جلد 21، شماره 4 - ( زمستان 1403 )
جلد 21 شماره 4 صفحات 280-274 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sharifi Z, Yadgari A, Paz Z. The Level of Expression of Programmed Death Type1 During the Natural Course of Hepatitis B Virus Infection in Asymptomatic Carriers of Hepatitis B. bloodj 2024; 21 (4) :274-280
URL: http://bloodjournal.ir/article-1-1559-fa.html
URL: http://bloodjournal.ir/article-1-1559-fa.html
شریفی زهره، یادگاری عباس، پاز زهرا. میزان بیان مرگ برنامهریزی شده نوع 1 طی سیر طبیعی عفونت ویروس هپاتیت B در ناقل فاقد علایم هپاتیت B. فصلنامه پژوهشی خون. 1403; 21 (4) :274-280
استاد مرکز تحقیقات فرآوردههای بیولوژیک و سلامت خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 680 kb]
(648 دریافت)
| چکیده (HTML) (1839 مشاهده)
مقدمه
هپاتیت B یک بیماری عفونی کبدی است که توسط ویروس هپاتیت B (HBV) ایجاد میشود، ویروس دارای پوشش و حاوی یک ژنوم DNA نسبتاً دو رشتهای حلقوی است (1). بیش از میلیونها نفر به ویروس HBV مبتلا شدهاند و تقریباً 350 میلیون نفر از آنها دارای عفونت HBV مزمن هستند و به ناقل ویروس تبدیل شدهاند (2). اکنون به طور گسترده پذیرفته شده است که پاسخهای ایمنی اکتسابی به ویژه پاسخ ایمنی سلولی، سبب پاکسازی HBV میشود (5-3). در بیشتر موارد، بیماران مبتلا به HBV مزمن، اختلال شدید عملکرد سلول T اختصاصی HBV را نشان میدهند که به دلیل سطح پایین سیتوکاینهای ضد ویروسی و اختلال در فعالیت لنفوسیتهای T سیتوتوکسیک (CTLs) همراه با ویرمی پایدار نشان داده میشود (2). در طول عفونت مزمن ویروس هپاتیت B (HBV)، تعادل پویایی بین تکثیر ویروس و پاسخ ایمنی میزبان برای بیماریزایی کبدی از اهمیت برخوردار است.
مطابق با ویژگیهای ایمنی، عفونت مزمن HBV را میتوان از نظر بالینی به چهار مرحله ایمنی یعنی مرحله تحمل ایمنی، مرحله فعال ایمنی، فاز پایدار ایمنی یا مرحله ناقل غیر فعال ویروس CHB (Chronic Hepatitis B) و مرحله فعالسازی مجدد ایمنی مشخص میشود. به طور گسترده پذیرفته شده است که پاسخهای ایمنی اکتسابی، به ویژه پاسخهای ایمنی سلولی، واسطه پاکسازی HBV است (6-3).
با توجه به اختلال در عملکرد سلولهای T اختصاصی HBV در بیماران مبتلا به عفونت مزمن HBV که با سطوح پایین سیتوکاینهای ضد ویروسی، اختلال در فعالیت لنفوسیتهای T سیتوتوکسیک و ویرمی پایدار مشخص میشود، هنوز مکانیسم زیربنایی این نقص سلول T در عفونـت مزمـن HBV به طور کامل شناخته نشده است (7).
پروتئین مرگ سلولی برنامهریزی شده (PD-1) یک پروتئین غشایی 55 کیلو دالتون است که از 288 اسید آمینه تشکیل شده و در انسان ژن کدکننده آن بر روی بازوی بلند کروموزوم شماره 2 و به عنوان یک گیرنده تحریککننده منفی است. PD-1 با لیگاندهای خود، PD-L1 و PD-L2 بـرای کاهـش پـاسخهای سلـول T تعامل میکند و به نظر میرسد برای تنظیم تحمل سلولهای T اهمیت ویژهای دارد. مسیر PD-1/PD-L1 به خوبی مطالعه شده است که نقش منفی در تنظیم فعالسازی و تکثیر سلولهای T و تولید سیتوکاینها دارد (11-8). شواهد نشان میدهد مسیر PD-1 نقش مهمی در مهار عملکرد سلولهای CD8+ T اختصاصی ویروس در عفونت مزمن ویروسی شامل ویروس نقص ایمنی انسانی (HIV)، ویروس هپاتیت C (HCV) و HBV دارد (15-12). اگر چه گزارشهایی در مورد تغییرات سطوح بیان PD-1 و پاسخهای سلول T در بیماران مبتلا به عفونت HBV موجود است، الگوی تغییر بیان PD-1 در سیر طبیعی عفونت مزمن HBV نیاز به بررسی بیشتر دارد (16).
درک چنین تغییراتی در بیان PD-1 و پاسخهای سلول T در دوره عفونت مزمن HBV در مدیریت ناقلین HBV بسیار مهم است. به دلیل تغییرات سطوح بیان PD-1 در تنظیم پاسخ سلول T ، در این مطالعه، بیان PD-1 در سیر طبیعی عفونت مزمن ویروس هپاتیتB در افراد فاقد علایم ناقل HBV بررسی شد.
مواد و روشها
در این مطالعه مورد- شاهدی، 120 اهداکننده خون به دو گروه کنترل (60 نفر سالم) که از نظر HBsAg و anti-HBc وآنتیبادی علیه HCV و HIV-1 منفی بودند و60 نفر گروه مورد شامل اهداکننده خون فاقد علایم که فقط از نظر HBsAg و anti-HBc مثبت و از نظر آنتیبادی علیه HCV و HIV-1 منفی بودند، به طور تصادفی در سال 1398 از پایگاه تهران وارد مطالعه شدند. نمونه خون در لوله حاوی EDTA گرفته شد و در g 3000 به مدت 15 دقیقه سانتریفیوژ شد. پلاسما و بافیکوت جمعآوری و در فریزر منفی 70 درجه سانتیگراد ذخیره شد. این مطالعه در کمیته اخلاق مؤسسه عالی طب انتقال خون مورد تایید قرار گرفت و همه شرکتکنندگان در مطالعه رضایت آگاهانه کتبی را امضا کردند.
آزمایشهای سرولوژیک:
بـر روی نمونههــای HBsAg مثبت، آزمایشهای Total anti-HBC ، HBe Ag و anti-HBc با استفاده از کیتهای الایزای شرکت دیاپرو، ایتالیا بر اساس دستور کار کیت انجام شد.
آزمایشهای عملکرد کبد:
آزمایشهای آلانین آمینوترانسفراز (ALT) با استفاده از کیت شرکت پارس آزمون (ایران) بر اساس دستور کار کیت بر روی نمونه ها انجام شد.
استخراج RNA : [FR1] [ZS2]
استخراج RNA با استفاده از کیت پارس توس از بافیکوت نمونهها بر اساس دستور کار کیت انجام شد. جهت بررسی غلظت و خلوص RNA از دستگاه اسپکتروفتومتر نانودرآپ (آمریکا) استفاده شد و جذب نوری نمونههای RNA در طول موجهای 260 و 280 نانومتر اندازهگیری شد.
ساخت cDNA :
ساخت cDNA با استفاده از کیت پارس توس بر روی RNA های استخراج شده از بافیکوتها و مطابق دستورالعمل کیت انجام شد.
آزمایش Real-Time PCR برای بررسی بیان ژن[FR3] :[ZS4]
بر روی نمونه60 اهداکننده فاقد علایم ناقل HBV و 60 نمونه اهداکننده سالم، بررسی بیان ژنPD-1 به عنوان ژن هدف و ژن β-actin به عنوان ژن رفرانس با استفاده از آغازگرهای اختصاصی PD-1(جلوبرنده: CCCTGGTGGTTGGTGTCGT و معکوس: GCCTGGCTCCTATTGTCCCTC) و ژن بتااکتین β-actin (جلوبرنده: TGGCACCCAGCACAATGAA و معکوس: CTAAGTCATAGTCCGCCTAGAAG) با روش سایبرگرین انجام شد. حجم نهایی هر واکنش 20 میکرولیتر شامل μL 10×2 مسترمیکس سایبرگرین (آمپلیکون، دانمارک)، μL 5/0 از آغازگرهای جلوبرنده و معکوس و مقدار μL 2 cDNA و μL7 آب مقطر با چرخه دمایی 95 درجه سانتیگراد به مدت 15 دقیقه و 35 چرخه شامل 95 درجه سانتیگراد 30 ثانیه، 59 درجه سانتیگراد 30 ثانیه، 72 درجه سانتیگراد 30 ثانیه و گرادیانت دمایی 70 تا 95 درجه سانتیگراد به مدت 60 ثانیه انجام شد.
تجزیه و تحلیل دادهها:
برای بررسی ریل تایم از نرمافزار LinRegPCC ، 2009 REST استفاده شد (11). تجزیه و تحلیل همبستگی اسپیرمن جهت بیان PD-1 و سطح ALT انجام شد[FR5] . 05/0 p< از نظر آماری معنادار در نظر گرفته شد[FR6] [ZS7] .
یافتهها
تمام نمونههای اهداکنندگان فاقد علایم مبتلا به هپاتیت B از نظر (Total) anti-HBc و anti-HBe 100% مثبت بودند و از نظر HBe Ag منفی بودند. میانگین و انحراف معیار حاصل از اندازهگیری ALT برحسب IU/L در گروه شاهد و مورد به ترتیب برابر 11/0 ± 29 و 21/0 ± 28 بود. تجزیه و تحلیل همبستگی اسپیرمن بین بیان PD-1 و سطح ALT انجام شد و بین دو گروه اختلاف معناداری وجود نداشت. از نظر جنس هر دو گروه شامل 95% مرد و 5% زن بودند. آزمون مجذور کا نشان داد که توزیع فراوانی جنس بین دو گروه اختلاف معنادار ندارد. میانگین سنی مورد و شاهد به ترتیب 8/5 ± 39 و 2/9 ± 37 سال بود که در آزمون t مستقل اختلاف معناداری بین میانگین سنها وجود نداشت.
نتایج بررسی کمی و خلوص RNA های استخراج شده دارای غلظت بالا و خلوص 260/280 برابر 2-85/1 بود. برای بررسی بیان ژن PD-1 ، ابتدا نمونههای منحنی ذوب برای ژن هدف PD-1 و ژن رفرانس β-actin مورد بررسی قرار گرفت و دمای ذوب ˚C1 ± 86 و ˚C1 ± 88 به ترتیب برای آنها ثبت شد (نمودارهای 1 و 2). پس از بررسی منحنی سیگمویید و منحنی ذوب و صحت واکنش، ct هر یک از نمونهها برای ژن هدف و کنترل ثبت شد. همچنین کارآیی آغازگرها و واکنش PCR با نرمافزار LinReg بررسی شد. با استفاده از نرمافزار REST نتایج تجزیه و تحلیل شد و افزایش 5/1 برابر بیان ژن PD-1 در اهداکنندگان مبتلا به هپاتیت B فاقد علایم نسبت به افراد سالم نشان داده شد که از نظر آماری معنادار نبود.
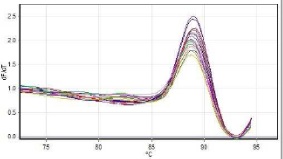
نمودار 1: منحنی ذوب برای ژن هدف PD-1 را نشان میدهد که دمای ذوب تمام نمونهها برابر 1 ± 86 میباشد و نشانه اختصاصی بودن واکنش Real-Time PCR میباشد.
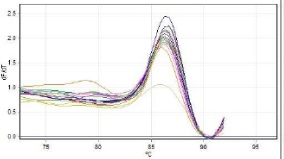
نمودار 2: منحنی ذوب برای ژن رفرانس را نشان میدهد که دمای ذوب تمام نمونهها برابر 1 ± 88 میباشد و نشانه اختصاصی بودن واکنشReal-Time PCR است.
بحث
مطالعهها نشان داده بسیاری از پاتوژنها (HIV, HCV وHBV) با تقویت مسیر سیگنالینگ (PD-1)/PD-L1 سبب فرار از سیستم ایمنی میزبان میشوند (15-12). در افراد آلوده به عفونت ویروس هپاتیت B ، بیان رسپتور PD-1 بر روی هپاتوسیتهای آلوده به ویروس و PBMCs و به طور خاص بر روی سلولهای CD8+ T اختصاصی ویروس افزایش مییابد و موجب خستگی سلول T و پاسخ ضعیف آنها به ویروس میشود. همچنین افزایش بیان PD-1بر روی PBMCsو هپاتوسیتهای آلوده به ویروس موجب تقویت مسیر مهاری و کاهش شدت پاسخ ایمنی میشود. موارد فوق نشاندهنده اهمیت مسیر سیگنالیگ PD-1/PD-L1 در اختـلال عملکـرد سلولهـای T در افـراد مبتـلا بـه
عفونت مزمن هپاتیت B میباشد[FR8] (13)[ZS9] .
در این مطالعه، افزایش بیان جزیی ژن PD-1 ، در اهداکنندگان خون مبتلا به هپاتیت B فاقد علایـم نسبت به افراد سالم که از نظر آماری معنادار نبود، نشان داد که افزایش بیان ژن تنها در مرحلهای از بیماری که فرد از نظر واکنش ایمنی به ویروس فعال باشد، افزایش مییابد و در وضعیت ناقل غیر فعال ویروسی، سطح بیان ژن PD-1 نزدیک به افراد سالم است که با مطالعههای قبلی نیز همخوانی دارد و[FR10] [ZS11] نشان میدهد سطح بیانPD-1 در تنظیم فعال شدن و تکثیر سلولهای T و تولید سیتوکاینها در اهداکنندگان مبتلا به هپاتیت B فاقد علایم، تغییری نمیکند(16). گزارشهایی در مورد تغییرات سطح بیانPD-1 و پاسخهای سلول T در بیماران مبتلا به عفونت HBV موجود است و این الگوی تغییر بیان PD-1 در سیر طبیعی عفونت مزمن HBV همراه با پاسخهای سلول T در دوره عفونت مزمن HBV در مدیریت ناقلین HBV بسیار مهم است (16). مطالعهها نشان داده که فعال شدن مسیر سیگنالیگ PD-1 ارتباط نزدیکی با عملکرد نادرست سلولهای T در مرحله کلیرانس ایمنی عفونت مزمن دارد، اما در دیگر مراحل عفونت مزمن HBV ، یعنی فاز تحمل ایمنی و فاز ناقل ویروس غیر فعال تغییری در الگوی بیان PD-1 مشاهده نمیشود (18، 17).
در یک مطالعه، برای تعیین بیان سطحی PD-1 در کل سلولهای CD8+ T محیطی در طول سیر طبیعی عفونت مزمن HBV ، تعداد کل سلولهای T محیطی 39 بیمار (9 نفر در فاز تحمل ایمنی، 10 نفر در فاز ناقل ویروس غیر فعال و 20 نفر در مرحله کلیرانس ایمنی) با روش فلوسیتومتری تجزیه و تحلیل شدند. سطح بیان PD-1 در سلولهای CD8+ T در مراحل تحمل ایمنی و حامل ویروس غیر فعال در بیماران مبتلا به عفونت مزمن HBV ، تفاوت معناداری با گروه کنترل عادی نداشت. با این حال، سطح بیان PD-1 در مرحله کلیرانس ایمنی بیماران مبتلا به عفونت مزمن HBV ، نسبت به افراد سالم و در مراحل تحمل ایمنی و ناقل ویروس غیر فعال بیماران مبتلا به عفونت مزمن HBV به طور قابل توجهی بالاتر بود (17). نتایج فوق با نتایج مطالعه انجام شده موافقت دارد و عدم تغییر الگوی بیان PD-1 در سیر طبیعی عفونت مزمن HBV در ناقل ویروس غیر فعال بدون علامت را نشان میدهد. همچنین ارتباط معناداری بین سطح بیان PD-1 با سطح سرمی ALT و AST در مرحله ناقل ویروس غیر فعال و افراد سالم وجود نداشت.
مسیر سیگنالینگ [FR12] [ZS13] (PD-1)/PD-L1 نقش منفی در تنظیم فعال شدن و تکثیر سلولهای T و تولید سیتوکاینها دارد. مطالعهها نشان میدهد مسیرPD-1 نقش مهمی در مهار عملکرد سلولهای CD8+ T اختصاصی ویروس در عفونتهای ویروسی مزمن شامل ویروس نقص ایمنی انسانی، ویروس هپاتیت C و HBV ایفا میکند (24-19). اما مسیر PD-l/PD-L1 در پاسخ سلولهای T در سیر طبیعی عفونت مزمن HBV نقش متفاوتی ایفا میکند و در مرحلهای که میزبان از نظر وضعیت ایمنی پایدار میباشد و یا ویروس در میزبان غیر فعال است، میزان بیان PD-1 تغییر نمیکند و الگوی مشابه افراد سالم را نشان میدهد. تعادل پویایی بین تکثیر ویروس و پاسخ ایمنی میزبان برای بیماریزایی عفونت مزمن HBV وجود دارد و مسیر PD-1/PD-L1 با تغییر ایمنی ضد ویروسی در مرحله طبیعی عفونت مزمن HBV به طور چشمگیری تغییر میکند (16)[FR14] [ZS15] .
در بررسی[FR16] [ZS17] بیان PD-1 در سلولهای CD8+ T ویژه آنتیژن اصلی هپاتیت B (HBcAg)، بیماران مبتلا به عفونت مزمن ویروس هپاتیت B در طی مرحله تحمل ایمنی و مرحله کلیرانس ایمنی، در مجموع 105 بیمار مبتلا به عفونت مزمن HBV و 15 فرد سالم هم سن وارد مطالعه شدند (28-17). بیماران با توجه به وضعیت آنها در فاز کلیرانس ایمنی (55=n) یا فاز تحمل ایمنی (50=n) که با بیوپسی کبد مشخص شد، به دو گروه تقسیم شدند. بـرای بیان PD-1 از فلوسیتومتری استفاده شد. سلولهای تک هستهای خون محیطی (PBMC) و سلولهای CD8+ T اختصاصی HBcAg جداسازی شدند (28-17). همچنین، سطوح mRNA PD-1 در PBMCها با استفاده از RT-PCR اندازهگیری شد. سلولهای CD8+ T در گروه کلیرانس ایمنی نسبت به گروه فاز تحمل ایمنی بیشتر بود، اما بیان PD-1 در سلولهای CD8+ T اختصاصی HBcAg در گروه فاز کلیرانس ایمنی به طور قابل توجهی کمتر از گروه فاز تحمل ایمنی بود و همبستگی منفی بین فراوانی سلولهای CD8+ T اختصاصی HBcAg و بیانPD-1 ، وجود داشت. نتیجه آن که بیانPD-1 با سلولهای CD8+ T اختصاصی HBV مرتبط بود و نقش مهمی در مهار عملکرد آنها در طول مرحله تحمل ایمنـی عفونت مزمن HBV داشت (25[FR18] [ZS19] [FR20] [ZS21] ).
در مطالعه سوی و همکاران که بر روی بیان مولکولهای چک پوینتهای ایمنی بر روی زیر مجموعههای سلول T CD4+ در حاملان ویروس هپاتیت B بدون علامت مزمن HBeAg منفی انجام شد، نتایج نشان داد که سطوح mRNA نسبی ژنهای TIM-3 و CTLA-4 به طور قابل توجهی در PBMC ها از ناقلین مزمن بدون علامت HBV ، HBeAg منفی (ASCs) در مقایسه با سطوح mRNAکنترلهای سالم (HC) افزایش یافته است، اما سطوح mRNA PD-1 و LAG-3 تفاوت قابل توجهی بین ASC و HC نداشتند. علاوه بر این، ارتباط معناداری بین این مولکولهای چک پوینتهای ایمنی بیان شده روی سلولهای CD4+ T و سطوح سرمی HBsAg از ASCهای مزمن با HBeAg منفی وجود نداشت که با نتایج عدم تفاوت معنادار بیان سطوح mRNA PD-1 در دو گروه مورد مطالعه پژوهش حاضر موافقت دارد (26). با توجه به محدودیت بودجه در این تحقیق بررسی بیان ژن PD-1 با استفاده از روش فلوسیتومتری انجام نشد و فقط در سطح mRNA در افراد ناقل غیر فعال فاقد علایم عفونت ویروس هپاتیت B انجام شــد کـه نشاندهنده عدم تغییر معنادار بیان PD-1 در مهار عملکـرد سلولهـای T در این افراد بود.
نتیجهگیری
سطـح بیـان ژن PD-1 در وضعیــت ناقـل غیــر فعال ویروسی مشابه افراد سالم میباشد و فعال شدن و تکثیر سلولهای T و تولید سیتوکاینها در اهداکنندگان مبتلا به هپاتیت B فاقد علایم، تغییری نمیکند و افزایش بیان ژن در مرحلهای از بیماری که فرد از نظر واکنش ایمنی به ویروس فعال باشد، ایجاد میشود.
حمایت مالی
این پروژه توسط مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین مالی شده است.
ملاحظات اخلاقی
این مطالعه به تایید کمیته اخلاق مؤسسه عالی آموزشی و پژوهشی طب انتقال خون رسیده است. (کد اخلاق IR.TMI.REC.1397.040).
عدم تعارض منافع
هیچگونه تعارض منافعی در مطالعه حاضر وجود نداشته
است.
نقش نویسندگان
دکتر زهره شریفی: طراحی مطالعه، نگارش و ویرایش مقاله، بررسی و تفسیر دادهها و نظارت بر انجام آزمایشها
عباس یادگاری: نوشتن پایاننامه، انجام آزمایشها، روششناسی و تحلیل و بررسی دادهها
زهرا پاز: فراهم آوردن مواد مورد نیاز، آموزش روشها و تجهیزات و بررسی و نظارت بر انجام آزمایشها
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد زیست فناوری مؤسسه عالی آموزشی و پژوهشی انتقال خون ایران است. بدیـن وسیلـه از ایـن مـؤسسه به خاطر حمایتهای
مالی آن تشکر میشود.
متن کامل: (590 مشاهده)
میزان بیان مرگ برنامهریزی شده نوع 1 طی سیر طبیعی عفونت ویروس
هپاتیت B در ناقل فاقد علایم هپاتیت B
زهره شریفی1، عباس یادگاری2، زهرا پاز3
چکیده
سابقه و هدف
در طول عفونت مزمن ویروس هپاتیت B ، تعادل پویا بین تکثیر ویروس و پاسخ ایمنی میزبان در ایجاد بیماری کبدی از اهمیت زیادی برخوردار است. در این مطالعه، میزان بیان مرگ برنامهریزی شده نوع 1 در اهداکنندگان فاقد علائم مبتلا به هپاتیت B طی سیر طبیعی عفونت ویروس هپاتیتB بررسی شد.
مواد و روشها
در این مطالعه مورد- شاهدی، 120 اهداکننده خون به دو گروه 60 نفره شامل کنترل یا سالم و اهداکننده فاقد علائم HBsAg و anti-HBC مثبت تقسیم و به طور تصادفی در سال 1398 از پایگاه تهران وارد مطالعه شدند. برای بررسی بیان ژن پس از استخراج RNA و ساخت cDNA ، آزمایشReal-Time PCR برای ژن PD-1 و ژن رفرانس β-actin انجام شد سپس با استفاده از نرمافزار REST و آنوا، تغییرات بیان ژن نسبت به گروه سالم بررسی شد (05/0 p<).
یافتهها
تمام نمونههای اهداکنندگان فاقد علایم مبتلا به هپاتیت B از نظر Total anti-HBc و anti-HBe ، 100% مثبت و از نظر HBe Ag منفی بودند. میزان بیان ژن با استفاده از نرم افزار REST وct های به دست آمده از آزمایشReal-Time PCR برای ژن PD-1 و ژن رفرانس تجزیه و تحلیل شد و افزایش 5/1 برابر بیان ژن PD-1 در اهداکنندگان فاقد علایم مبتلا به هپاتیت B نسبت به افراد سالم نشان داده شد که از نظر آماری معنادار نبود.
نتیجه گیری
بیان ژن PD-1 در طول سیر طبیعی عفونت مزمن HBV در افراد فاقد علایم مبتلا به هپاتیت B به طور معنادار تغییری نمیکند و مشابه افرد سالم است.
کلمات کلیدی: ویروس هپاتیت B ، Real-Time PCR ، عفونت بدون علامت
تاریخ دریافت: 17/07/1403
تاریخ پذیرش: 13/08/1403
1- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
2- کارشناس ارشد زیست فناوری ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- کارشناس میکروبشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
هپاتیت B در ناقل فاقد علایم هپاتیت B
زهره شریفی1، عباس یادگاری2، زهرا پاز3
چکیده
سابقه و هدف
در طول عفونت مزمن ویروس هپاتیت B ، تعادل پویا بین تکثیر ویروس و پاسخ ایمنی میزبان در ایجاد بیماری کبدی از اهمیت زیادی برخوردار است. در این مطالعه، میزان بیان مرگ برنامهریزی شده نوع 1 در اهداکنندگان فاقد علائم مبتلا به هپاتیت B طی سیر طبیعی عفونت ویروس هپاتیتB بررسی شد.
مواد و روشها
در این مطالعه مورد- شاهدی، 120 اهداکننده خون به دو گروه 60 نفره شامل کنترل یا سالم و اهداکننده فاقد علائم HBsAg و anti-HBC مثبت تقسیم و به طور تصادفی در سال 1398 از پایگاه تهران وارد مطالعه شدند. برای بررسی بیان ژن پس از استخراج RNA و ساخت cDNA ، آزمایشReal-Time PCR برای ژن PD-1 و ژن رفرانس β-actin انجام شد سپس با استفاده از نرمافزار REST و آنوا، تغییرات بیان ژن نسبت به گروه سالم بررسی شد (05/0 p<).
یافتهها
تمام نمونههای اهداکنندگان فاقد علایم مبتلا به هپاتیت B از نظر Total anti-HBc و anti-HBe ، 100% مثبت و از نظر HBe Ag منفی بودند. میزان بیان ژن با استفاده از نرم افزار REST وct های به دست آمده از آزمایشReal-Time PCR برای ژن PD-1 و ژن رفرانس تجزیه و تحلیل شد و افزایش 5/1 برابر بیان ژن PD-1 در اهداکنندگان فاقد علایم مبتلا به هپاتیت B نسبت به افراد سالم نشان داده شد که از نظر آماری معنادار نبود.
نتیجه گیری
بیان ژن PD-1 در طول سیر طبیعی عفونت مزمن HBV در افراد فاقد علایم مبتلا به هپاتیت B به طور معنادار تغییری نمیکند و مشابه افرد سالم است.
کلمات کلیدی: ویروس هپاتیت B ، Real-Time PCR ، عفونت بدون علامت
تاریخ دریافت: 17/07/1403
تاریخ پذیرش: 13/08/1403
1- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
2- کارشناس ارشد زیست فناوری ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- کارشناس میکروبشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
هپاتیت B یک بیماری عفونی کبدی است که توسط ویروس هپاتیت B (HBV) ایجاد میشود، ویروس دارای پوشش و حاوی یک ژنوم DNA نسبتاً دو رشتهای حلقوی است (1). بیش از میلیونها نفر به ویروس HBV مبتلا شدهاند و تقریباً 350 میلیون نفر از آنها دارای عفونت HBV مزمن هستند و به ناقل ویروس تبدیل شدهاند (2). اکنون به طور گسترده پذیرفته شده است که پاسخهای ایمنی اکتسابی به ویژه پاسخ ایمنی سلولی، سبب پاکسازی HBV میشود (5-3). در بیشتر موارد، بیماران مبتلا به HBV مزمن، اختلال شدید عملکرد سلول T اختصاصی HBV را نشان میدهند که به دلیل سطح پایین سیتوکاینهای ضد ویروسی و اختلال در فعالیت لنفوسیتهای T سیتوتوکسیک (CTLs) همراه با ویرمی پایدار نشان داده میشود (2). در طول عفونت مزمن ویروس هپاتیت B (HBV)، تعادل پویایی بین تکثیر ویروس و پاسخ ایمنی میزبان برای بیماریزایی کبدی از اهمیت برخوردار است.
مطابق با ویژگیهای ایمنی، عفونت مزمن HBV را میتوان از نظر بالینی به چهار مرحله ایمنی یعنی مرحله تحمل ایمنی، مرحله فعال ایمنی، فاز پایدار ایمنی یا مرحله ناقل غیر فعال ویروس CHB (Chronic Hepatitis B) و مرحله فعالسازی مجدد ایمنی مشخص میشود. به طور گسترده پذیرفته شده است که پاسخهای ایمنی اکتسابی، به ویژه پاسخهای ایمنی سلولی، واسطه پاکسازی HBV است (6-3).
با توجه به اختلال در عملکرد سلولهای T اختصاصی HBV در بیماران مبتلا به عفونت مزمن HBV که با سطوح پایین سیتوکاینهای ضد ویروسی، اختلال در فعالیت لنفوسیتهای T سیتوتوکسیک و ویرمی پایدار مشخص میشود، هنوز مکانیسم زیربنایی این نقص سلول T در عفونـت مزمـن HBV به طور کامل شناخته نشده است (7).
پروتئین مرگ سلولی برنامهریزی شده (PD-1) یک پروتئین غشایی 55 کیلو دالتون است که از 288 اسید آمینه تشکیل شده و در انسان ژن کدکننده آن بر روی بازوی بلند کروموزوم شماره 2 و به عنوان یک گیرنده تحریککننده منفی است. PD-1 با لیگاندهای خود، PD-L1 و PD-L2 بـرای کاهـش پـاسخهای سلـول T تعامل میکند و به نظر میرسد برای تنظیم تحمل سلولهای T اهمیت ویژهای دارد. مسیر PD-1/PD-L1 به خوبی مطالعه شده است که نقش منفی در تنظیم فعالسازی و تکثیر سلولهای T و تولید سیتوکاینها دارد (11-8). شواهد نشان میدهد مسیر PD-1 نقش مهمی در مهار عملکرد سلولهای CD8+ T اختصاصی ویروس در عفونت مزمن ویروسی شامل ویروس نقص ایمنی انسانی (HIV)، ویروس هپاتیت C (HCV) و HBV دارد (15-12). اگر چه گزارشهایی در مورد تغییرات سطوح بیان PD-1 و پاسخهای سلول T در بیماران مبتلا به عفونت HBV موجود است، الگوی تغییر بیان PD-1 در سیر طبیعی عفونت مزمن HBV نیاز به بررسی بیشتر دارد (16).
درک چنین تغییراتی در بیان PD-1 و پاسخهای سلول T در دوره عفونت مزمن HBV در مدیریت ناقلین HBV بسیار مهم است. به دلیل تغییرات سطوح بیان PD-1 در تنظیم پاسخ سلول T ، در این مطالعه، بیان PD-1 در سیر طبیعی عفونت مزمن ویروس هپاتیتB در افراد فاقد علایم ناقل HBV بررسی شد.
مواد و روشها
در این مطالعه مورد- شاهدی، 120 اهداکننده خون به دو گروه کنترل (60 نفر سالم) که از نظر HBsAg و anti-HBc وآنتیبادی علیه HCV و HIV-1 منفی بودند و60 نفر گروه مورد شامل اهداکننده خون فاقد علایم که فقط از نظر HBsAg و anti-HBc مثبت و از نظر آنتیبادی علیه HCV و HIV-1 منفی بودند، به طور تصادفی در سال 1398 از پایگاه تهران وارد مطالعه شدند. نمونه خون در لوله حاوی EDTA گرفته شد و در g 3000 به مدت 15 دقیقه سانتریفیوژ شد. پلاسما و بافیکوت جمعآوری و در فریزر منفی 70 درجه سانتیگراد ذخیره شد. این مطالعه در کمیته اخلاق مؤسسه عالی طب انتقال خون مورد تایید قرار گرفت و همه شرکتکنندگان در مطالعه رضایت آگاهانه کتبی را امضا کردند.
آزمایشهای سرولوژیک:
بـر روی نمونههــای HBsAg مثبت، آزمایشهای Total anti-HBC ، HBe Ag و anti-HBc با استفاده از کیتهای الایزای شرکت دیاپرو، ایتالیا بر اساس دستور کار کیت انجام شد.
آزمایشهای عملکرد کبد:
آزمایشهای آلانین آمینوترانسفراز (ALT) با استفاده از کیت شرکت پارس آزمون (ایران) بر اساس دستور کار کیت بر روی نمونه ها انجام شد.
استخراج RNA : [FR1] [ZS2]
استخراج RNA با استفاده از کیت پارس توس از بافیکوت نمونهها بر اساس دستور کار کیت انجام شد. جهت بررسی غلظت و خلوص RNA از دستگاه اسپکتروفتومتر نانودرآپ (آمریکا) استفاده شد و جذب نوری نمونههای RNA در طول موجهای 260 و 280 نانومتر اندازهگیری شد.
ساخت cDNA :
ساخت cDNA با استفاده از کیت پارس توس بر روی RNA های استخراج شده از بافیکوتها و مطابق دستورالعمل کیت انجام شد.
آزمایش Real-Time PCR برای بررسی بیان ژن[FR3] :[ZS4]
بر روی نمونه60 اهداکننده فاقد علایم ناقل HBV و 60 نمونه اهداکننده سالم، بررسی بیان ژنPD-1 به عنوان ژن هدف و ژن β-actin به عنوان ژن رفرانس با استفاده از آغازگرهای اختصاصی PD-1(جلوبرنده: CCCTGGTGGTTGGTGTCGT و معکوس: GCCTGGCTCCTATTGTCCCTC) و ژن بتااکتین β-actin (جلوبرنده: TGGCACCCAGCACAATGAA و معکوس: CTAAGTCATAGTCCGCCTAGAAG) با روش سایبرگرین انجام شد. حجم نهایی هر واکنش 20 میکرولیتر شامل μL 10×2 مسترمیکس سایبرگرین (آمپلیکون، دانمارک)، μL 5/0 از آغازگرهای جلوبرنده و معکوس و مقدار μL 2 cDNA و μL7 آب مقطر با چرخه دمایی 95 درجه سانتیگراد به مدت 15 دقیقه و 35 چرخه شامل 95 درجه سانتیگراد 30 ثانیه، 59 درجه سانتیگراد 30 ثانیه، 72 درجه سانتیگراد 30 ثانیه و گرادیانت دمایی 70 تا 95 درجه سانتیگراد به مدت 60 ثانیه انجام شد.
تجزیه و تحلیل دادهها:
برای بررسی ریل تایم از نرمافزار LinRegPCC ، 2009 REST استفاده شد (11). تجزیه و تحلیل همبستگی اسپیرمن جهت بیان PD-1 و سطح ALT انجام شد[FR5] . 05/0 p< از نظر آماری معنادار در نظر گرفته شد[FR6] [ZS7] .
یافتهها
تمام نمونههای اهداکنندگان فاقد علایم مبتلا به هپاتیت B از نظر (Total) anti-HBc و anti-HBe 100% مثبت بودند و از نظر HBe Ag منفی بودند. میانگین و انحراف معیار حاصل از اندازهگیری ALT برحسب IU/L در گروه شاهد و مورد به ترتیب برابر 11/0 ± 29 و 21/0 ± 28 بود. تجزیه و تحلیل همبستگی اسپیرمن بین بیان PD-1 و سطح ALT انجام شد و بین دو گروه اختلاف معناداری وجود نداشت. از نظر جنس هر دو گروه شامل 95% مرد و 5% زن بودند. آزمون مجذور کا نشان داد که توزیع فراوانی جنس بین دو گروه اختلاف معنادار ندارد. میانگین سنی مورد و شاهد به ترتیب 8/5 ± 39 و 2/9 ± 37 سال بود که در آزمون t مستقل اختلاف معناداری بین میانگین سنها وجود نداشت.
نتایج بررسی کمی و خلوص RNA های استخراج شده دارای غلظت بالا و خلوص 260/280 برابر 2-85/1 بود. برای بررسی بیان ژن PD-1 ، ابتدا نمونههای منحنی ذوب برای ژن هدف PD-1 و ژن رفرانس β-actin مورد بررسی قرار گرفت و دمای ذوب ˚C1 ± 86 و ˚C1 ± 88 به ترتیب برای آنها ثبت شد (نمودارهای 1 و 2). پس از بررسی منحنی سیگمویید و منحنی ذوب و صحت واکنش، ct هر یک از نمونهها برای ژن هدف و کنترل ثبت شد. همچنین کارآیی آغازگرها و واکنش PCR با نرمافزار LinReg بررسی شد. با استفاده از نرمافزار REST نتایج تجزیه و تحلیل شد و افزایش 5/1 برابر بیان ژن PD-1 در اهداکنندگان مبتلا به هپاتیت B فاقد علایم نسبت به افراد سالم نشان داده شد که از نظر آماری معنادار نبود.

نمودار 1: منحنی ذوب برای ژن هدف PD-1 را نشان میدهد که دمای ذوب تمام نمونهها برابر 1 ± 86 میباشد و نشانه اختصاصی بودن واکنش Real-Time PCR میباشد.

نمودار 2: منحنی ذوب برای ژن رفرانس را نشان میدهد که دمای ذوب تمام نمونهها برابر 1 ± 88 میباشد و نشانه اختصاصی بودن واکنشReal-Time PCR است.
بحث
مطالعهها نشان داده بسیاری از پاتوژنها (HIV, HCV وHBV) با تقویت مسیر سیگنالینگ (PD-1)/PD-L1 سبب فرار از سیستم ایمنی میزبان میشوند (15-12). در افراد آلوده به عفونت ویروس هپاتیت B ، بیان رسپتور PD-1 بر روی هپاتوسیتهای آلوده به ویروس و PBMCs و به طور خاص بر روی سلولهای CD8+ T اختصاصی ویروس افزایش مییابد و موجب خستگی سلول T و پاسخ ضعیف آنها به ویروس میشود. همچنین افزایش بیان PD-1بر روی PBMCsو هپاتوسیتهای آلوده به ویروس موجب تقویت مسیر مهاری و کاهش شدت پاسخ ایمنی میشود. موارد فوق نشاندهنده اهمیت مسیر سیگنالیگ PD-1/PD-L1 در اختـلال عملکـرد سلولهـای T در افـراد مبتـلا بـه
عفونت مزمن هپاتیت B میباشد[FR8] (13)[ZS9] .
در این مطالعه، افزایش بیان جزیی ژن PD-1 ، در اهداکنندگان خون مبتلا به هپاتیت B فاقد علایـم نسبت به افراد سالم که از نظر آماری معنادار نبود، نشان داد که افزایش بیان ژن تنها در مرحلهای از بیماری که فرد از نظر واکنش ایمنی به ویروس فعال باشد، افزایش مییابد و در وضعیت ناقل غیر فعال ویروسی، سطح بیان ژن PD-1 نزدیک به افراد سالم است که با مطالعههای قبلی نیز همخوانی دارد و[FR10] [ZS11] نشان میدهد سطح بیانPD-1 در تنظیم فعال شدن و تکثیر سلولهای T و تولید سیتوکاینها در اهداکنندگان مبتلا به هپاتیت B فاقد علایم، تغییری نمیکند(16). گزارشهایی در مورد تغییرات سطح بیانPD-1 و پاسخهای سلول T در بیماران مبتلا به عفونت HBV موجود است و این الگوی تغییر بیان PD-1 در سیر طبیعی عفونت مزمن HBV همراه با پاسخهای سلول T در دوره عفونت مزمن HBV در مدیریت ناقلین HBV بسیار مهم است (16). مطالعهها نشان داده که فعال شدن مسیر سیگنالیگ PD-1 ارتباط نزدیکی با عملکرد نادرست سلولهای T در مرحله کلیرانس ایمنی عفونت مزمن دارد، اما در دیگر مراحل عفونت مزمن HBV ، یعنی فاز تحمل ایمنی و فاز ناقل ویروس غیر فعال تغییری در الگوی بیان PD-1 مشاهده نمیشود (18، 17).
در یک مطالعه، برای تعیین بیان سطحی PD-1 در کل سلولهای CD8+ T محیطی در طول سیر طبیعی عفونت مزمن HBV ، تعداد کل سلولهای T محیطی 39 بیمار (9 نفر در فاز تحمل ایمنی، 10 نفر در فاز ناقل ویروس غیر فعال و 20 نفر در مرحله کلیرانس ایمنی) با روش فلوسیتومتری تجزیه و تحلیل شدند. سطح بیان PD-1 در سلولهای CD8+ T در مراحل تحمل ایمنی و حامل ویروس غیر فعال در بیماران مبتلا به عفونت مزمن HBV ، تفاوت معناداری با گروه کنترل عادی نداشت. با این حال، سطح بیان PD-1 در مرحله کلیرانس ایمنی بیماران مبتلا به عفونت مزمن HBV ، نسبت به افراد سالم و در مراحل تحمل ایمنی و ناقل ویروس غیر فعال بیماران مبتلا به عفونت مزمن HBV به طور قابل توجهی بالاتر بود (17). نتایج فوق با نتایج مطالعه انجام شده موافقت دارد و عدم تغییر الگوی بیان PD-1 در سیر طبیعی عفونت مزمن HBV در ناقل ویروس غیر فعال بدون علامت را نشان میدهد. همچنین ارتباط معناداری بین سطح بیان PD-1 با سطح سرمی ALT و AST در مرحله ناقل ویروس غیر فعال و افراد سالم وجود نداشت.
مسیر سیگنالینگ [FR12] [ZS13] (PD-1)/PD-L1 نقش منفی در تنظیم فعال شدن و تکثیر سلولهای T و تولید سیتوکاینها دارد. مطالعهها نشان میدهد مسیرPD-1 نقش مهمی در مهار عملکرد سلولهای CD8+ T اختصاصی ویروس در عفونتهای ویروسی مزمن شامل ویروس نقص ایمنی انسانی، ویروس هپاتیت C و HBV ایفا میکند (24-19). اما مسیر PD-l/PD-L1 در پاسخ سلولهای T در سیر طبیعی عفونت مزمن HBV نقش متفاوتی ایفا میکند و در مرحلهای که میزبان از نظر وضعیت ایمنی پایدار میباشد و یا ویروس در میزبان غیر فعال است، میزان بیان PD-1 تغییر نمیکند و الگوی مشابه افراد سالم را نشان میدهد. تعادل پویایی بین تکثیر ویروس و پاسخ ایمنی میزبان برای بیماریزایی عفونت مزمن HBV وجود دارد و مسیر PD-1/PD-L1 با تغییر ایمنی ضد ویروسی در مرحله طبیعی عفونت مزمن HBV به طور چشمگیری تغییر میکند (16)[FR14] [ZS15] .
در بررسی[FR16] [ZS17] بیان PD-1 در سلولهای CD8+ T ویژه آنتیژن اصلی هپاتیت B (HBcAg)، بیماران مبتلا به عفونت مزمن ویروس هپاتیت B در طی مرحله تحمل ایمنی و مرحله کلیرانس ایمنی، در مجموع 105 بیمار مبتلا به عفونت مزمن HBV و 15 فرد سالم هم سن وارد مطالعه شدند (28-17). بیماران با توجه به وضعیت آنها در فاز کلیرانس ایمنی (55=n) یا فاز تحمل ایمنی (50=n) که با بیوپسی کبد مشخص شد، به دو گروه تقسیم شدند. بـرای بیان PD-1 از فلوسیتومتری استفاده شد. سلولهای تک هستهای خون محیطی (PBMC) و سلولهای CD8+ T اختصاصی HBcAg جداسازی شدند (28-17). همچنین، سطوح mRNA PD-1 در PBMCها با استفاده از RT-PCR اندازهگیری شد. سلولهای CD8+ T در گروه کلیرانس ایمنی نسبت به گروه فاز تحمل ایمنی بیشتر بود، اما بیان PD-1 در سلولهای CD8+ T اختصاصی HBcAg در گروه فاز کلیرانس ایمنی به طور قابل توجهی کمتر از گروه فاز تحمل ایمنی بود و همبستگی منفی بین فراوانی سلولهای CD8+ T اختصاصی HBcAg و بیانPD-1 ، وجود داشت. نتیجه آن که بیانPD-1 با سلولهای CD8+ T اختصاصی HBV مرتبط بود و نقش مهمی در مهار عملکرد آنها در طول مرحله تحمل ایمنـی عفونت مزمن HBV داشت (25[FR18] [ZS19] [FR20] [ZS21] ).
در مطالعه سوی و همکاران که بر روی بیان مولکولهای چک پوینتهای ایمنی بر روی زیر مجموعههای سلول T CD4+ در حاملان ویروس هپاتیت B بدون علامت مزمن HBeAg منفی انجام شد، نتایج نشان داد که سطوح mRNA نسبی ژنهای TIM-3 و CTLA-4 به طور قابل توجهی در PBMC ها از ناقلین مزمن بدون علامت HBV ، HBeAg منفی (ASCs) در مقایسه با سطوح mRNAکنترلهای سالم (HC) افزایش یافته است، اما سطوح mRNA PD-1 و LAG-3 تفاوت قابل توجهی بین ASC و HC نداشتند. علاوه بر این، ارتباط معناداری بین این مولکولهای چک پوینتهای ایمنی بیان شده روی سلولهای CD4+ T و سطوح سرمی HBsAg از ASCهای مزمن با HBeAg منفی وجود نداشت که با نتایج عدم تفاوت معنادار بیان سطوح mRNA PD-1 در دو گروه مورد مطالعه پژوهش حاضر موافقت دارد (26). با توجه به محدودیت بودجه در این تحقیق بررسی بیان ژن PD-1 با استفاده از روش فلوسیتومتری انجام نشد و فقط در سطح mRNA در افراد ناقل غیر فعال فاقد علایم عفونت ویروس هپاتیت B انجام شــد کـه نشاندهنده عدم تغییر معنادار بیان PD-1 در مهار عملکـرد سلولهـای T در این افراد بود.
نتیجهگیری
سطـح بیـان ژن PD-1 در وضعیــت ناقـل غیــر فعال ویروسی مشابه افراد سالم میباشد و فعال شدن و تکثیر سلولهای T و تولید سیتوکاینها در اهداکنندگان مبتلا به هپاتیت B فاقد علایم، تغییری نمیکند و افزایش بیان ژن در مرحلهای از بیماری که فرد از نظر واکنش ایمنی به ویروس فعال باشد، ایجاد میشود.
حمایت مالی
این پروژه توسط مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین مالی شده است.
ملاحظات اخلاقی
این مطالعه به تایید کمیته اخلاق مؤسسه عالی آموزشی و پژوهشی طب انتقال خون رسیده است. (کد اخلاق IR.TMI.REC.1397.040).
عدم تعارض منافع
هیچگونه تعارض منافعی در مطالعه حاضر وجود نداشته
است.
نقش نویسندگان
دکتر زهره شریفی: طراحی مطالعه، نگارش و ویرایش مقاله، بررسی و تفسیر دادهها و نظارت بر انجام آزمایشها
عباس یادگاری: نوشتن پایاننامه، انجام آزمایشها، روششناسی و تحلیل و بررسی دادهها
زهرا پاز: فراهم آوردن مواد مورد نیاز، آموزش روشها و تجهیزات و بررسی و نظارت بر انجام آزمایشها
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد زیست فناوری مؤسسه عالی آموزشی و پژوهشی انتقال خون ایران است. بدیـن وسیلـه از ایـن مـؤسسه به خاطر حمایتهای
مالی آن تشکر میشود.
[FR1]استخراج چه چیزی؟
[ZS2]اصلاح شد
[FR3]کیت مورد استفاده؟
[ZS4]در متن امپلیکون آمده است
[FR5]نتایج؟
[FR6]آزمون آماری بررسی در مطالعه مورد شاهدی؟
[ZS7]اصلاح شد
[FR8]رفرنس؟
[ZS9]اصلاح شد
[FR10]رفرنس؟
[ZS11]اصلاح شد
[FR12]لغات انگلیس به صورت ترجمه فارسی با یا بدون اصل انگلیسی
[ZS13]متاسفان کلمه فارسی جایگزین وجود ندارد
[FR14]رفرنس؟
[ZS15]اصلاح شد
[FR16]در بحث نیاز به ارائه بررسی متون نیست مقایسه انجام شود.
[ZS17]این مورد بررسی متنو نمی باشد و مقایسه با پژوهش حاضر است که ضروری بود نمونه ها و روش بیان ژن با دو روش نوشته شود
[FR18]محدودیت ها؟
[ZS19]اصلاح شد
[FR20]مقایسه؟
[ZS21]اصلاح شد
نوع مطالعه: پژوهشي |
موضوع مقاله:
ويروس شناسي
فهرست منابع
1. Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med 2004 ; 350(11): 1118-29. [DOI:10.1056/NEJMra031087] [PMID]
2. Lai CL, Ratziu V, Yuen MF, Poynard T. Viral hepatitis B. Lancet 2003; 20; 362(9401): 2089-94. [DOI:10.1016/S0140-6736(03)15108-2] [PMID]
3. Bertoletti A, Maini M, Williams R. Role of hepatitis B virus-specific cytotoxic T cells in liver damage and viral control. Antiviral Res 2003; 60(2): 61-6. [DOI:10.1016/j.antiviral.2003.08.012] [PMID]
4. Chisari FV, Ferrari C. Hepatitis B Virus Immunopathogenesis. Annu Rev Immunol 1995 13: 29-60. [DOI:10.1146/annurev.iy.13.040195.000333] [PMID]
5. Maini MK, Boni C, Ogg GS, King AS, Reignat S, Lee CK, et al. Direct ex vivo analysis of hepatitis B virus-specific CD8(+) T cells associated with the control of infection. Gastroenterology 1999; 117(6): 1386-96. [DOI:10.1016/S0016-5085(99)70289-1] [PMID]
6. Yuen MF, Chen DS, Dusheiko GM, Janssen HLA, Lau DTY, Locarnini SA, et al. Hepatitis B virus infection. Nat Rev Dis Primers 2018; 4: 18035. [DOI:10.1038/nrdp.2018.35] [PMID]
7. Boni C, Fisicaro P, Valdatta C, Amadei B, Di Vincenzo P, Giuberti T, et al. Characterization of hepatitis B Virus (HBV)-Specific T-Cell Dysfunction in Chronic HBV Infection. J Virol 2007; 81(42): 15-25. [DOI:10.1128/JVI.02844-06] [PMID] []
8. Ai L, Chen J, Yan H, He Q, Luo P, Xu Z, et al. Research status and outlook of pd-1/pd-l1 inhibitors for cancer therapy. Drug Des Devel Ther 2020; 14: 3625-49. [DOI:10.2147/DDDT.S267433] [PMID] []
9. Chen Y, Pei Y, Luo J, Huang Z, Yu J, Meng X. Looking for the optimal PD-1/PD-L1 inhibitor in cancer treatment: A comparison in basic structure, function, and clinical practice. Front Immunol 2020; 11:1088. [DOI:10.3389/fimmu.2020.01088] [PMID] []
10. Bengsch B, Martin B, Thimme R. Restoration of HBV-specific CD8+ T cell function by PD-1 blockade in inactive carrier patients is linked to T cell differentiation. J Hepatol 2014; 61: 1212-9. [DOI:10.1016/j.jhep.2014.07.005] [PMID]
11. Singh V, Khurana A, Allawadhi P, Banothu AK, Bharani KK, Weiskirchen R. Emerging role of PD-1/PD-L1 inhibitors in chronic liver diseases. Front Pharmacol 2021; 12: 790963. [DOI:10.3389/fphar.2021.790963] [PMID] []
12. Wieland S, Thimme R, Purcell RH, Chisari FV. Genomic analysis of the host response to hepatitis B virus infection. Proc Natl Acad Sci U S A 2004; 101(17): 6669-74. [DOI:10.1073/pnas.0401771101] [PMID] []
13. Wykes MN, Lewin SR. Immune checkpoint blockade in infectious diseases. Nat Rev Immunol 2018; 18(2): 91-104. [DOI:10.1038/nri.2017.112] [PMID] []
14. Cox MA, Nechanitzky R, Mak TW. Check point inhibitors as therapies for infectious diseases. Curr Opin Immunol 2017; 48: 61-7. [DOI:10.1016/j.coi.2017.07.016] [PMID]
15. Schönrich G, Raftery MJ. The PD-1/PD-L 1axis and virus infections: a delicate balance. Front Cell Infect Microbiol 2019; 9: 207. [DOI:10.3389/fcimb.2019.00207] [PMID] []
16. Ortega-Prieto AM, Dorner M. Immune Evasion Strategies during Chronic Hepatitis B and C Virus Infection. Vaccines (Basel) 2017; 5(3): 24. [DOI:10.3390/vaccines5030024] [PMID] []
17. Ye P, Weng ZH, Zhang SL, Zhang JA, Zhao L, Dong JH, et al. Programmed death-1 expression is associated with the disease status in hepatitis B virus infection. World J Gastroenterol 2008; 14: 4551-7. [DOI:10.3748/wjg.14.4551] [PMID] []
18. Liang XS, Zhou Y, Li CZ, Wan MB. Natural course of chronic hepatitis B is characterized by changing patterns of programmed death type-1 of CD8-positive T cells. World J Gastroenterol 2010; 16(5): 618-24. [DOI:10.3748/wjg.v16.i5.618] [PMID] []
19. Day CL, Kaufmann DE, Kiepiela P, Brown JA, Moodley ES, Reddy S, et al. PD-1 expression on HIV-specific T cells is associated with T-cell exhaustion and disease progression. Nature 2006; 443: 350-4. [DOI:10.1038/nature05115] [PMID]
20. Petrovas C, Casazza JP, Brenchley JM, Price DA, Gostick E, Adams WC, et al. PD-1 is a regulator of virus-specific CD8+ T cell survival in HIV infection. J Exp Med 2006; 203: 2281-92. [DOI:10.1084/jem.20061496] [PMID] []
21. Zhang JY, Zhang Z, Wang X, Fu JL, Yao J, Jiao Y, et al. PD-1 up-regulation is correlated with HIV-specific memory CD8+ T-cell exhaustion in typical progressors but not in long-term nonprogressors. Blood 2007; 109: 4671-8. [DOI:10.1182/blood-2006-09-044826] [PMID]
22. Golden-Mason L, Palmer B, Klarquist J, Mengshol JA, Castelblanco N, Rosen HR. Upregulation of PD-1 expression on circulating and intrahepatic hepatitis C virus-specific CD8+ T cells associated with reversible immune dysfunction. J Virol 2007; 81: 9249-58. [DOI:10.1128/JVI.00409-07] [PMID] []
23. Urbani S, Amadei B, Tola D, Massari M, Schivazappa S, Missale G, et al. PD-1 expression in acute hepatitis C virus (HCV) infection is associated with HCV-specific CD8 exhaustion. J Virol 2006; 80: 11398-403. [DOI:10.1128/JVI.01177-06] [PMID] []
24. Boni C, Fisicaro P, Valdatta C, Amadei B, Di Vincenzo P, Giuberti T, et al. Characterization of hepatitis B virus (HBV)-specific T-cell dysfunction in chronic HBV infection. J Virol 2007; 81: 4215-25. [DOI:10.1128/JVI.02844-06] [PMID] []
25. Zhou JY, Zhou DF, Li JQ. PD-1 expression in HBcAg-specific CD8+ T cells of adolescents with chronic HBV infection. Zhonghua Gan Zang Bing Za Zhi 2013; 21(1): 27-32. [Article in Chinese]
26. Cui D , Jiang D , Yan C , Liu X , Lv Y , Xie J, Chen Y. Immune Checkpoint Molecules Expressed on CD4+ T Cell Subsets in Chronic Asymptomatic Hepatitis B Virus Carriers With Hepatitis B e Antigen-Negative. Front Microbiol 2022; 13: 887408. [DOI:10.3389/fmicb.2022.887408] [PMID] []
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







