جلد 22، شماره 4 - ( زمستان 1404 )
جلد 22 شماره 4 صفحات 296-285 |
برگشت به فهرست نسخه ها
Ethics code: IR.SBMU.REC.1401.005
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
hedayati S, Rahimi A R, Aghaei F, Mohsenzadeh M. Modulatory Effects of High-Intensity Interval Training on the Mobilization of Hematopoietic Stem Cell and Related Gene Expression (CXCL12 and SCF) in Autologous Transplant Patients. bloodj 2025; 22 (4) :285-296
URL: http://bloodjournal.ir/article-1-1592-fa.html
URL: http://bloodjournal.ir/article-1-1592-fa.html
هدایتی ثمینه، رحیمی علیرضا، آقایی فریبا، محسن زاده مهسا. تأثیر تمرین تناوبی با شدت بالا بر موبیلیزاسیون سلولهای بنیادی خونساز و بیان ژنهای مرتبط با آن (CXCL12 و SCF) در بیماران داوطلب پیوند اتولوگ. فصلنامه پژوهشی خون. 1404; 22 (4) :285-296
گروه فیزیولوژی ورزشی، واحد کرج، دانشگاه آزاد اسلامی
واژههای کلیدی: تمرین تناوبی با شدت بالا، موبیلیزاسیون سلولهای بنیادی خونساز، فاکتور محرک کلونی گرانولوسیت (G-CSF)، پیوند اتولوگ، لنفوم (هوچکین / غیر هوچکین)، آنتیژنهای CD34، کموکاین CXCL12، فاکتور سلولهای بنیادی (SCF)
متن کامل [PDF 873 kb]
(84 دریافت)
| چکیده (HTML) (176 مشاهده)
.jpg)
HIIT تأثیری بر محصول آفرزیس نداشت:
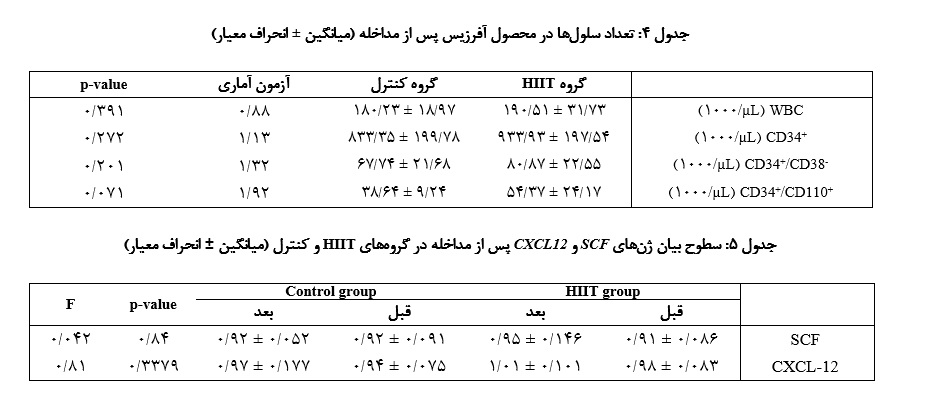
طبق نتـایج آزمون t مستقل، هیچ تفاوت معناداری در تعداد WBC، CD34+، CD34+/CD38- و CD34+/CD110+ در محصول آفرزیس بین گروههای HIIT و کنترل مشاهده نشد.
بیان ژنهای SCF و CXCL-12 تحت تأثیر تمرینات تناوبی با شدت بالا (HIIT) قرار نگرفت:
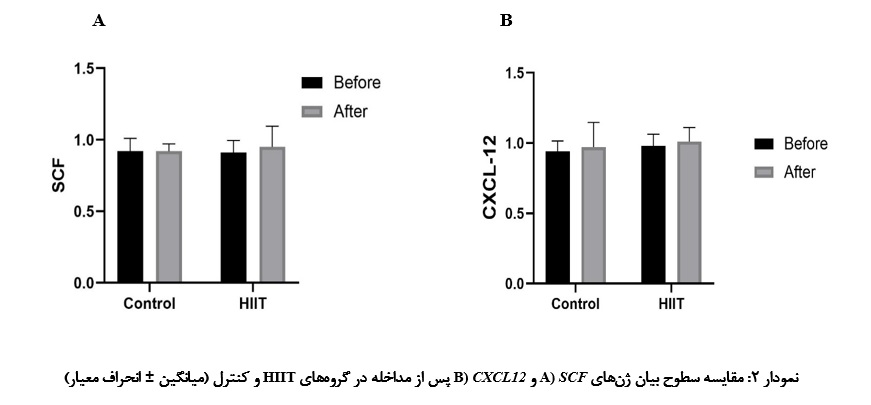
همانطـور کـه در جدول ۵ و شکـل ۲ نشـان داده شده است، نتایج آزمون تجزیـه و تحلیل واریانس(ANOVA) اختلاف معناداری در سطح بیان ژنهای SCF و CXCL-12 بین گروههای HIIT و کنترل نشان نداد.
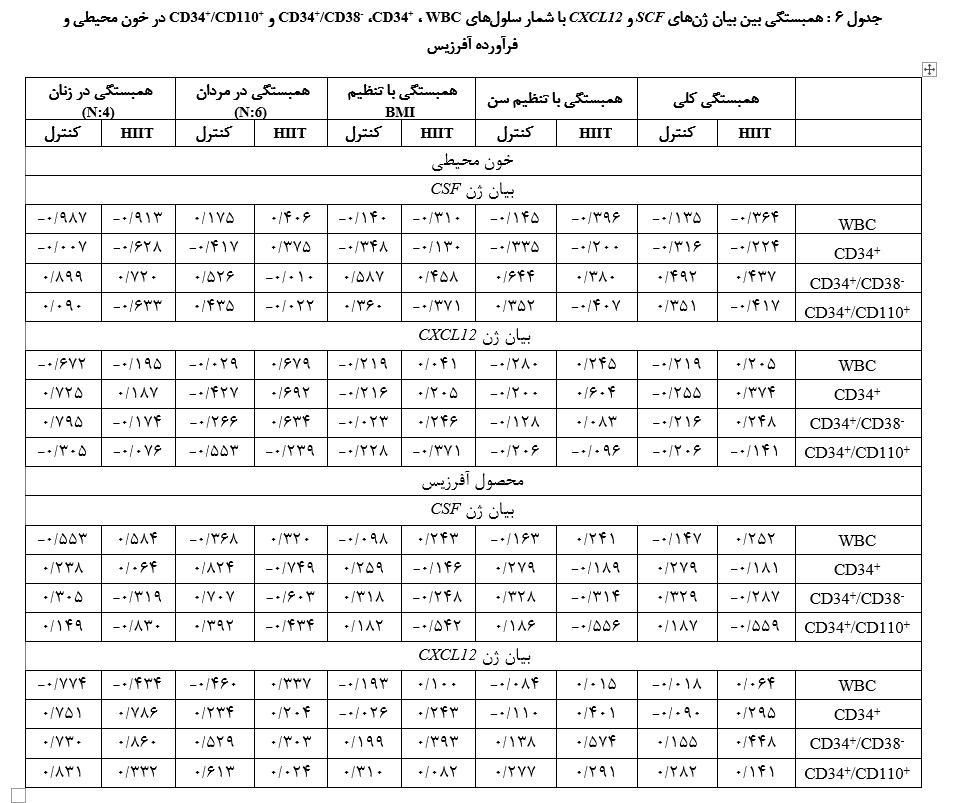
عدم وجود همبستگی میان بیان ژنهای SCF و CXCL12 با شمارش سلولهای WBC و CD34+:
هیچ همبستگی معناداری بین افزایش هر واحد در بیان
ژنهای SCF و CXCL12 با شمار سلولهای WBC، CD34+، CD34+/CD38- و CD34+/CD110+ در خون محیطی و فرآورده آفرزیس مشاهده نشد. همچنین پس از تعدیل بر اساس سن، شاخص توده بدنی (BMI) و جنسیت، همچنان همبستگی معناداری یافت نشد (جدول 6).
بحث
مطالعههای بـالینی تأیید کردهاند که انجام تمرینات ورزشی با شـدت کم تا زیاد در اهداکنندگان و بیماران تحت پیوند سلولهای بنیادی خونساز (HSCT) امکانپذیر و ایمن است (26-24). حتی تمرینات تناوبی با شدت بالا (HIIT) نیز در جمعیتهای بـالینی متعددی به خوبی تحمل شده است، بنـابراین این دستورالعملها میتوانند برای افراد غیرسالم نیز کاربردی باشند. افراد غیرسالم ممکن است بتوانند تمرینات با شدت بالا را همراه با استفاده از (G-CSF فاکتور محرک کلنی گرانولوسیتی (انجـام دهند که باعث آزادسازی سلولهای بنیادی خونساز (HSC) به میزان مشابه افراد سالم میشود (3). ورزش میتواند به طور حاد تعداد HSCها را در مغز استخوان و خون محیطی، حتی پس از یک جلسه تمرین در افراد جوان و مسن، مرد و زن، و ورزشکار و غیر ورزشکار افزایش دهد (27، 16، 14، 3).
یافتههای مطالعه حاضر نشان داد که HIIT به طور قابل توجهی سلولهای CD34+، CD34+/CD38- و CD34+/CD110+ در گردش خون را افزایش میدهـد که با نتایج مطالعههای قبلی همخوانی دارد. برای اولین بار در سال 1978، بارت و همکاران نشان دادند که یک تمرین حاد میتواند تعداد سلولهای بنیادی خونساز گردشکننده را افزایش دهد (28). همچنین بونسینیور (2002) افزایش 3 تا 4 برابری سلولهای CD34+ را در دوندهها نسبت به افـراد کم تحرک گزارش کرد (29). موریچی و همکاران (2005) نیز دو برابر شدن تعداد سلولهای CD34+ را پس از تمرینات فوق زیاد نشان دادند (2). کراننبروک و همکاران (2008) افزایش تعداد HSCهـا در گردش پس از تمرینات حاد را گزارش کردند و وینکلر و همکاران (2009) افزایش 1/3 برابری سلولهای CD34+ را مشاهده نمودند (31، 30). همچنین بونسینیور (2010) ادعا کرد که تعداد سلولهای CD34+ در دوندهها نسبت به افراد کمتحرک 4 برابر بیشتر است (32). شیدی و همکاران (2020) نیز افزایش قابل توجهی در HSCهای گردش کننده گزارش کردنـد و پرادانا و همکاران افزایش معنادار HSCها پس از HIIT را گزارش دادند (33، 1).
ورزش بـاعث افزایش تـرشح فاکتور محرک کلنی گرانولوسیتی (G-CSF)، کورتیزول، اینترلوکین-6 ، فاکتور نکروز تومور α، اینترلوکین-1 بتا و فـاکتور رشد اندوتلیال عروقی میشود کـه باعث افزایش تعداد HSCهای گردشکننده میگردد (5، 4، 2). همچنین افزایش تنش برشی همودینامیکی ناشی از افزایش برونده قلبی و فشار خون در اثر ورزش ممکن است باعث آزادسازی HSCها شود. اگر چه سطح پلاسمایی G-CSF در حین ورزش افزایش مییابد، اما مسئول مستقیم آزادسازی سریع HSC نیست زیرا G-CSF برای آزادسازی سلولهـا به چند روز زمان نیاز دارد. در عوض، احتمالاً این آزادسازی ناشی از مهاجرت سلولها از مخـازن حاشیهای تحت تـأثیر گیرندههای بتا-2 آدرنرژیک است (15). نتایج حاضر نشان داد که HIIT تأثیر قابل توجهی در افزایش تعداد سلولهـای CD34+، CD34+/CD38- و CD34+/CD110+ در محصول آفرزیس ندارد. این موضوع بـه دلیل موقتی بودن افزایش HSCهای گردشکننده است که بلافاصله پس از ورزش افزایش مییابد، تا 30-15 دقیقه اول بـالا باقی میماند و سپس به سرعت به مقدار پایه بـاز میگردد (34، 16، 14). این مـدت زمان کوتاه برای افزایش میزان برداشت آفرزیس از نظر بالینی کافی نیست (16). افزایش گذرا ممکن است به دلیل مصرف سریع HSCها برای ترمیم آسیبهای ناشی از ورزش باشد (16، 2). یافتن HSCها در عضلات اسکلتی پس از ورزش نشان میدهد که این سلولها باید از گردش خون خارج شده و در فرآیند بـازسازی بافت شرکت کنند (16، 14، 2، 1). بنابراین بهترین زمان برداشت HSC بلافاصله پس از ورزش است (3).
عامل سلول بنیادی (SCF) و لیگاند کموکاینCXC12 توسط سلولهای استرومایی ترشح شده و با CD117 و گیرنده آن که روی سطح HSCها بیان میشوند، تعامل دارنـد. این تعاملات به ماندگاری و لانهگزینی HSCها در niche مغز استخوان کمـک میکند. اختلال در محورهای SCF-CD117 و CXCR4-CXCL12 منجر به آزادسازی HSCها به جریان خون میشود (14). در شرایط پایدار، مولکولهای چسبندگی سلولی به CXCL12 متصل شده و HSCها را در مغز استخوان نگه میدارند.G-CSF مولکول چسبندگی سلولی عروقی (VCAM-1) را تخریب کرده و باعث آزادسازی HSC به خون محیطی میشود (12). نتایج مطالعه حاضر تفاوت معناداری در بیان ژنهای SCF و CXCL12 بیـن گروه HIIT و کنترل نشان نـداد. همچنین افزایش بیان این ژنهـا در گروه HIIT باعث تغییر قابل توجهی در تعداد سلولهای CD34+/CD38- و CD34+/CD110+ در خون محیطی یا محصول آفرزیس نشد.
اگرچه پژوهشهای قبلی نیز اثرات ورزش بر آزادسازی HSC را بررسی کردهاند، مطالعه ما یکی از نخستین مطالعاتی است که به طور خاص تأثیر HIIT را بر آزادسازی HSC در زمینه پیونـد خودی HSCT بررسی میکند (36، 35). ما زمانبندی و شدت تمرین را به همراه کاربرد آن در شرایط بالینی بلافاصله پس از تجویز G-CSF بررسی کردیم.
این مطالعه رویکردی منحصر به فرد و جامع ارائه میدهد و نه تنها مارکر CD34 بلکه بیان CD38 و CD110 را نیز روی HSC ها ارزیابی میکند. در حالی که تحقیقات قبلی عمدتاً روی سلولهای CD34+ به عنوان نشانگر HSC متمرکز بودند، مطالعه ما این تحلیل را با بررسی زیر جمعیتهای CD34+/CD38- و CD34+/CD110+ گسترش داده است. این مارکرهـای اضافی ارزیابی جامعتری از جمعیت سلولهای بنیادی که با ترکیب G-CSF و HIIT آزاد میشوند، فراهم میکنند و جامعیت پژوهش ما را تضمین میکنند.
اگر چه سلولهای CD34+ معمولاً برای HSCT استفاده میشوند، جمعیت CD34+ هتروژن است. بنابراینHSCT ممکن است به دلیل وجود HSC های کوتاه مدت(CD34+/CD38+) یـا تأخیر در بازسازی پلاکتها به دلیل فقدان HSC های مگاکاریوسیتی (CD34+/CD110+) با موفقیت نـاکافی همراه باشد.
سلولهایCD34+/CD38- طولانی مدت بوده، قابلیت خودنوسازی دارند و تا پایان عمر سیستم خونسازی را بازسازی میکنند؛ بنابراین استفاده از این زیرجمعیت در HSCT نتایج بهتری دارد. زیرجمعیت CD34+/CD110+ که گیرنده ترومبوپوئتین (MPL) را بیان میکند، با تمایل به لاین مگاکاریوسیتی مرتبطتر است و ممکن است بـه بازسازی سریعتر پلاکتها کمک کند. بنابراین مطالعه ما نه تنها کاربرد نوآورانه HIIT برای افزایش آزادسازی HSC را بررسی میکند، بلکـه بـا هدفگیری زیرجمعیتهای خاصتر HSC به بهبود نتایج پیوند میپردازد. این تمرکز دوگانه ممکن است فرآیندهای آزادسازی و بازیابی پس از پیوند را بهبود بخشد.
استفاده از ورزش به عنوان درمان کمکی همراه بـا G-CSF برای HSCT خودی محدودیتهایی دارد، از جمله شرایط بالینی متفاوت بیماران، عوامل محیطی، مالی و حمایت اجتماعی برای ورزش، خطر سقوط و نیاز به وسایل کمکی، بیماریهای همراه مانند بیماریهای قلبی-عروقی و ریوی، ناراحتیهای اسکلتی- عضلانی ناشی از آرتریت، مشکلات عضلانی، نوروپاتی محیطی و متاستاز استخوان، خطر شکنندگی استخوان در مواردی مانند مالتیپل میلومای متعدد، عوامل مزاحم در بیماران تحـت شیمیدرمانی مانند درد، خستگی، نـاراحتی روانی، عدم تعادل یا کمبود مواد مغذی و داروها. محدودیتهای مطالعه حاضر شامل اندازه نمونـه نسبتاً کوچک و احتمال وجود تفاوتهای فردی در پاسخ فیزیولوژیـک به تمرینات HIIT و تجویز G-CSF است که ممکن است بر آزادسازی سلولهای بنیادی تأثیر بگذارد. همچنین زمانبندی برداشت آفرزیس و محدودیـتهای بالینی مرتبط با بیماران تحت HSCT میتواند برتعمیم نتایج تـأثیر بگذارد. این عوامل باید در مطالعههای آینده مــــورد
توجه قرار گیرند.
نتیجهگیری
یافتههای مطالعه نشان داد ورزش باعث افزایش موقـت HSCها در خون محیطی میشود، اما تـأثیر معناداری بر محصول آفرزیس و بیان ژنهای کلیدی ندارد؛ این مسأله احتمالاً ناشی از فعال شدن مسیرهای کوتاه مدت مانند سیستم آدرنرژیـک، بدون ایجاد تغییر پایدار در تنظیم ژنهای نیچ میباشد. بدین ترتیبHIIT به عنوان یک روش تقویتکننده احتمالی برای آزادسازی سلولهای بنیادی خونساز همراه با درمان G-CSF مطرح است. با این حال، این تأثیر گذرا بوده و تعداد سلولهای CD34+ گردش کننده به سرعـت کاهـش مییابـد. پـژوهشهای آینده بـرای تعییـن امکانپـذیری ورزش دقیقاً قبل از انجام آفرزیس به منظور بیشینه کردن تاثیر بر افزایش برداشت مورد نیاز است.
ملاحظات اخلاقی
تمام شرکتکنندگان، پس از دریافت توضیحات کامل از سوی تیم تحقیق، فرم رضایتنامه آگاهانه و محرمانه را امضا کردند. این مطالعه مطابق اصول اخلاق در پژوهش بر انسان و با تأیید کمیته اخلاق دانشگاه علوم پزشکی شهید بهشتی به شماره (IR.SBMU.REC.1401.005) انجام شد.
عدم تعارض منافع
هیچگونه تعارض منافع مالی یا غیر مالی بین نویسندگان و همچنین نهادهای مرتبط بـا این پژوهش گزارش نشده است.
نقش نویسندگان
ثمینه هدایتی: انجام آزمایشها، گردآوری و تحلیل دادهها
دکتر علیرضا رحیمی: طراحی مطالعه، نظارت بر اجرا و ویرایش نهایی مقاله
دکتر فریبا آقایی: مشاوره روششناختی و بازبینی محتوا
دکتر مهسا محسنزاده: مشاوره روششناختی و بازبینی محتوای علمی
تمامی نویسندگان در تائید نسخه نهایی مقاله توافق داشته و مسئولیت تمامی جنبههای کار را بر عهده میگیرند.
تشکر و قدردانی
بدین وسیله از ریاست و پرسنل محترم مرکز تحقیقات سلولهای بنیادی خونساز و بخش پیوند مغز استخوان بیمارستان طالقانی و دانشگاه علوم پزشکی شهید بهشتی تهران که امکان انجام این پژوهش را فراهم آوردند، صمیمانه تشکر میشود. این مطالعه به عنوان بخشی از پایاننامه دکتری تخصصی با عنوان "تأثیر تمرین تناوبی با شدت بالا بر بیان ژنهای SCF و CXCL-12 دخیل در موبیلیزاسیون سلولهــای بنیــادی خونســاز و محتـــوای سلولهـــای
CD34+/CD110+ و CD34+/CD38- در بیماران کـاندید پیوند اتولوگ پیوند مغز استخوان" و نیز طرح پژوهشی مصوب شده توسط معاونت تحقیقات و فناوری دانشگاه با کد طرح 32316 به انجام رسید.
متن کامل: (4 مشاهده)
تأثیر تمرین تناوبی با شدت بالا بر موبیلیزاسیون سلولهای بنیادی خونساز و بیان ژنهای مرتبط با آن (CXCL12 و SCF) در بیماران داوطلب پیوند اتولوگ
ثمینه هدایتی1، علیرضا رحیمی1 ، فریبا آقایی1 ، مهسا محسنزاده1
1- گروه فیزیولوژی ورزشی، واحد کرج، دانشگاه آزاد اسلامی، کرج، ایران
1- گروه فیزیولوژی ورزشی، واحد کرج، دانشگاه آزاد اسلامی، کرج، ایران
 http://dx.doi.org/10.61186/bloodj.22.1.11 Citation: Hedayati S, Rahimi A.R, Aghaei F, Mohsenzadeh M. Modulatory Effects of High-Intensity Interval Training on the Mobilization of Hematopoietic Stem Cell and Related Gene Expression (CXCL12 and SCF) in Autologous Transplant Patients. J Iran Blood Transfus. 2025: 22 (4): 285-296 نویسنده مسئول: دکتر علیرضا رحیمی. دانشیار گروه فیزیولوژی ورزشی ـ واحد کرج ـ دانشگاه آزاد اسلامی ـ کرج ـ ایران صندوق پستی: 31485-313 E-mail: a_r_rahimi@hotmail.com کد اخلاق: IR.SBMU.REC.1401.005 |
 چکیده چکیدهسابقه و هدف این مطالعه با هدف بررسی تأثیر تمرین تناوبی با شدت بالا (HIIT) به عنوان روشی غیر تهاجمی برای تقویت فرآیند موبیلیزاسیون سلولهای بنیادی خونساز (HSC) در داوطلبان کاندید پیوند اتولوگ انجام شد. تمرکز اصلی بر بررسی تغییرات شمارش سلولهای بنیادی +CD34 و بیان ژنهای SCF و CXCL-12 بود. مواد و روشها این مطالعه یک پژوهش نیمه تجربی کاربردی بود که در آن۲۰ بیمار مبتلا به لنفوم هوچکین و غیر هوچکین به صورت همتاسازی بر اساس سن، جنس، شاخص توده بدنی و وضعیت آمادگی جسمانی به دو گروه کنترل (10 n=) و HIIT (10 n=) تقسیم شدند. گروه HIIT ، شش ساعت پس از دریافت آخرین دوز فاکتور محرک کلونی گرانولوسیتی (G-CSF) به مدت پنج روز، یک جلسه تمرین تناوبی با شدت بالا شامل ۱۲ دوره یک دقیقهای با شدت 100% VO₂peak انجام دادند. گروه کنترل بدون تمرین و در وضعیت نشسته بر روی تردمیل باقی ماند. نمونهگیری خون در هر دو گروه پیش و بلافاصله پس از مداخله و نمونه آفرزیس نیز بلافاصله پس از مداخله انجام و شمارش سلولهای WBC، +CD34 و زیرگروههای آن بدون تأخیر زمانی قابل توجه در کمتر از 24 ساعت با شرایط نگهداری مناسب در دمای 4 درجه، با فلوسیتومتری صورت گرفت. بیان ژنهای SCF و CXCL-12 با روش qRT-PCR ارزیابی شد. یافتهها پس از HIIT، میانگین تعداد سلولهای CD34+ از 89/12 ± 86/40 به 15/16 ± 21/58 و گلبولهای سفید از 87/3 ± 35/35 به 1/5 ± 61/41 افزایش یافت، در حالی که تغییرات گروه کنترل اندک بود. تمرین HIIT باعث افزایش معنادار تعداد WBC، سلولهای +CD34 و زیر گروه CD34+/CD110+ در خون محیطی با اندازه اثر قابل توجه شد (05/0 p<)(d~1-1.4). اما این افزایش در محصول(Yield) آفرزیس مشاهده نگردید. همچنین، هیچ تغییر معناداری در بیان ژنهای SCF و CXCL-12 پس از تمرین دیده نشد و همبستگی قابل توجهی بین بیان این ژنها و شمارش سلولهای بنیادی مشاهده نشد. نتیجه گیری تمرین تناوبی با شدت بالا میتواند به عنوان یک تقویتکننده موقت و غیر تهاجمی برای افزایش تعداد سلولهای بنیادی در خون محیطی پس از تجویز G-CSF مطرح باشد. با این حال، این اثر موقتی بوده، به محصول آفرزیس منتقل نمیشود و باید بلافاصله پیش از فرآیند آفرزیس انجام شود. کلمات کلیدی: تمرین تناوبی با شدت بالا، موبیلیزاسیون سلولهای بنیادی خونساز، فاکتور محرک کلونی گرانولوسیت (G-CSF)، پیوند اتولوگ، لنفوم (هوچکین / غیر هوچکین)، آنتیژنهای CD34، کموکاین CXCL12، فاکتور سلولهای بنیادی (SCF) |
مقدمه
سلولهای بنیادی خونساز (HSCs; Hematopoietic Stem Cells) مسئول تولید مداوم سلولهای خونی در گردش هستند و نقش اساسی در حفظ ذخایر خونی ایفا میکنند (1). سلولهای CD34 مثبت، پیشسازهای چند توانی محسوب میشوند که برای بازسازی و حفظ هموستازی سیستم خونساز ضروریاند (3، 2). منبع اصلی HSCها مغز استخوان است، اما مقدار اندکی از آنها در خون محیطی نیز وجود دارد (1). این سلولها بسیار نادرند و تنها 1% از سلولهای هستهدار مغز استخوان و 1/0% از سلولهای تکهستهای خون محیطی را تشکیل میدهند (4). با این حال، در شرایطی مانند التهاب، فعالیت بدنی و هیپوکسـی، میـزان آنهـا در گردش افزایش مییابد (6، 5).
پیوند سلولهای بنیادی خونساز، یا پیوند مغز استخوان، شامل جایگزینی HSCها و سلولهای ایمنی بیمار بـا سلولهای آلوژن یا اتولوگ است (7، 4). این روش برای بازسازی ذخایر خونی در بیماریهای بدخیم و غیر بدخیم مانند کمخونی آپلاستیک یـا برخی بیماریهای عصبی خود ایمنی به کار میرود (10-8، 4). فرآیند پیوند شامل سه مرحله است: ۱) موبیلیزاسیون و جمعآوری HSC ها، ۲) اعمال درمان تضعیفکننده سیستم ایمنی، و ۳) تزریق سلولها (11).
میزان سلولهای CD34+ نقش تعیینکنندهای در موفقیت پیوند دارد. هر چـه تعداد این سلولها بیشتر باشد، پیوند سریعتر و با احتمال موفقیت بـالاتری انجام میشود (13، 12، 4). خون محیطی به دلیل دسترسی آسان و کـاهش مدت نوتروپنی، منبع ترجیحی HSC برای پیونـد است (12).
با این حال، به دلیل اتصال HSC ها به نیچ مغز استخوان از طریق مولکولهای چسبنده، میزان آنها در خون محیطی محدود است (14، 3). بـرای جمعآوری مؤثر، از فرآیند «موبیلیزاسیون» استفاده میشود که طی آن HSCها از مغز استخوان به خون محیطی آزاد میشوند (12، 4). معمولاً برای موفقیت، شمار CD34+ باید بیش از ۱۰ سلول در میکرولیتر باشد تا 106×5/4-4 سلول به ازای هر کیلوگرم وزن بدن جمعآوری شود (15).
رایجترین عامل موبیلیزاسیون، G-CSF است که طی 5-4 روز پیش از آفرزیس تجویز میشود تـا سطح CD34+ در خون افزایش یـابد (15، 12، 3). اما رژیمهای مبتنی بر G-CSF گـاهی نـاکارآمدند و میتوانند منجر به جمعآوری نـاکافی، تکرار فرآیند و افزایش خطر شکست پیوند شوند (14، 12، 3). علاوه بر این، G-CSF بـا عوارضی مانند درد استخوان، تب و تهوع همراه است (12، 4). از این رو، یافتن روشهای مکمل یا جایگزین برای تسهیل موبیلیزاسیون اهمیت دارد (15).
ورزش یکی از روشهای غیرتهاجمی مطرح برای افزایش موبیلیزاسیون HSC است (17، 16، 12، 4). سطح G-CSF میتواند در پاسخ به هیپوکسی ناشی از ورزش افزایش یابد (18). شدت تمرین عامل کلیدی است؛ تمرینات شدید نسبت به تمرینات متوسط موجب افزایش بیشتر سلولهای CD34+ در گردش میشوند، در حالی که تمرینات سبک تأثیری ندارند (19، 3). تمرینات تناوبی با شدت بالا ( HIIT: High-Intensity Intevral Training) نیـز بـه عنوان جایگزینی مؤثر برای تمرینات هوازی سنتی پیشنهاد شدهاند (20).
در این مطالعه، به منظور ارزیابی جامع اثر HIIT بر موبیلیزاسیون HSC ، شاخصهای WBC (پاسخ ایمنی و التهابی)، CD34+ (نشانگر کلاسیک HSC)، −CD34+/CD38 (جمعیت اولیهتر با پتانسیل خودنوسازی بالا) و CD34+/CD110+ (زیر مجموعه متعهد به رده مگاکاریوسیتی مرتبط با بازسازی پلاکتها) اندازهگیری شد. همچنین بیان ژنهای SCF و CXCL-12 ، که به ترتیب در بقا/تکثیر و انسداد HSC ها در نیچ مغز استخوان نقش دارنـد، مورد بررسی قرار گرفت (22، 21، 14). CD34+/CD38 جمعیتی خالصتر از HSCها را نشان میدهد و CD34+/CD110+ با بـازیابی پلاکتی پس از پیوند ارتباط مستقیم دارد. ارزیابی SCF و CXCL-12 نیز به شناسایی مکانیسمهای مولکولی احتمالی در آزادسازی سلولها کمک میکند.
مواد و روشها
این مطالعه یـک پژوهش نیمه تجربی کاربردی بود که بر روی 20 بیمار کاندید پیوند سلولهای بنیادی خونساز اتولوگ مبتلا بـه لنفوم هوچکین و غیرهوچکین کـه در بیمارستان طالقانی تهران بستری بودند انجام شد و نمونهها به صورت در دسترس و با همتاسازی انتخاب شدند. بیماران با در نظر گرفتن سن، جنس، نوع بیماری خونی، شاخص توده بدنی یاBMI ، سطح آمادگی جسمانی و نتایج آزمایش ورزشی، به دو گروه همگن کنترل و HIIT تقسیم شدند. بدین ترتیب تخصیص به گروههای کنترلشده و بر اساس ویژگیهای پایـه انجام شد و تصادفیسازی کامل صورت نگرفت.
محاسبه حجم نمونه:
با توجه به طراحی مطالعه و مقایسه میانگینها بین دو گروه، حجم نمونـه با استفاده از فرمول عمومی مقایسه میانگین دو گروه مستقل و با در نظر گرفتن مقادیر استاندارد محاسبه شد (23). بر این اساس، با فرض اندازه اثر بزرگ (8/0 d=) بر پایه مطالعههای پیشین مشابه، سطح معناداری (05/0 a=) و توان آماری (80/0 b=)، حجم نمونه مورد نیـاز برای هر گروه ۱۰ نفر برآورد شد (15، 3). با در نظـر گرفتن احتمال ریزش نمونهها، تعداد نهایی شرکتکنندگان در هر گروه ۱۰ نفر در نظر گرفته شد که در مجموع حجم نمونه مطالعه را به ۲۰ نفر رساند. محاسبـات با نرمافزار G*Power (نسخه ۳.۱.۹.۷) انجام پذیرفت.
n=2(Z1−α/2+Z1−β)2⋅σ2d2n=d22(Z1−α/2+Z1−β)2⋅σ2
معیارهای ورود به مطالعه:
شرایط لازم برای مشارکت در این پژوهش به شرح زیر بود:
دلایل حذف شرکتکنندگان از روند مطالعه عبارت بودند از:
طراحی مطالعه و دستورالعمل آزمایشی:
افراد گروه HIIT، پیش از فرآیند آفرزیس، فقط یک جلسه تمرین تناوبی با شدت بالا انجام دادند. کل نمونهها به دو گروه ۱۰ نفره تقسیم شدند: گروه تمرین (HIIT) و گروه کنترل. هر دو گروه مطابق دستورالعملهای کالج پزشکی ورزشی آمریکا (ACSM) برای ارزیـابی خطرات احتمالی فعالیت ورزشی بررسی شدند.
در ابتدا، یک آزمون حداکثر ظرفیت قلبی-ریوی (MCT) به منظور تعیین VO₂peak هر فرد انجام شد. سپس، پس از گـذشت ده روز (برای حذف اثرات فیزیولوژیکی تست)، درمان موبیلیزاسیون با G-CSF به دوز ۵ میکروگرم به ازای هر کیلوگرم وزن بدن برای مدت پنج روز آغاز شد.
شش ساعت پس از آخرین دوز G-CSF، گروه HIIT تمرین تناوبی با شدت بالا را به شکل زیر اجرا کرد:
نمونهگیری خون:
در گروه HIIT، نمونهگیـری خـون دقیقـاً قبل و بلافاصله پس از اجرای دستورالعمل تمرینی انجام شد. در مقابل، گروه کنترل بدون انجام تمرین، فقط بر روی تردمیل نشسته و در همان وضعیت و بازه زمانی مشابه، نمونهگیری شدند. نمونههای خون از طریق کاتتر از ورید گردنی گرفته شده و در لولههای حاوی ماده ضد انعقاد EDTA جمعآوری شدنـد. همچنین بلافاصله پس از اجرای دستورالعمل تمرینی، بیماران برای جداسازی سلولهای بنیادی از خـون
سلولهای بنیادی خونساز (HSCs; Hematopoietic Stem Cells) مسئول تولید مداوم سلولهای خونی در گردش هستند و نقش اساسی در حفظ ذخایر خونی ایفا میکنند (1). سلولهای CD34 مثبت، پیشسازهای چند توانی محسوب میشوند که برای بازسازی و حفظ هموستازی سیستم خونساز ضروریاند (3، 2). منبع اصلی HSCها مغز استخوان است، اما مقدار اندکی از آنها در خون محیطی نیز وجود دارد (1). این سلولها بسیار نادرند و تنها 1% از سلولهای هستهدار مغز استخوان و 1/0% از سلولهای تکهستهای خون محیطی را تشکیل میدهند (4). با این حال، در شرایطی مانند التهاب، فعالیت بدنی و هیپوکسـی، میـزان آنهـا در گردش افزایش مییابد (6، 5).
پیوند سلولهای بنیادی خونساز، یا پیوند مغز استخوان، شامل جایگزینی HSCها و سلولهای ایمنی بیمار بـا سلولهای آلوژن یا اتولوگ است (7، 4). این روش برای بازسازی ذخایر خونی در بیماریهای بدخیم و غیر بدخیم مانند کمخونی آپلاستیک یـا برخی بیماریهای عصبی خود ایمنی به کار میرود (10-8، 4). فرآیند پیوند شامل سه مرحله است: ۱) موبیلیزاسیون و جمعآوری HSC ها، ۲) اعمال درمان تضعیفکننده سیستم ایمنی، و ۳) تزریق سلولها (11).
میزان سلولهای CD34+ نقش تعیینکنندهای در موفقیت پیوند دارد. هر چـه تعداد این سلولها بیشتر باشد، پیوند سریعتر و با احتمال موفقیت بـالاتری انجام میشود (13، 12، 4). خون محیطی به دلیل دسترسی آسان و کـاهش مدت نوتروپنی، منبع ترجیحی HSC برای پیونـد است (12).
با این حال، به دلیل اتصال HSC ها به نیچ مغز استخوان از طریق مولکولهای چسبنده، میزان آنها در خون محیطی محدود است (14، 3). بـرای جمعآوری مؤثر، از فرآیند «موبیلیزاسیون» استفاده میشود که طی آن HSCها از مغز استخوان به خون محیطی آزاد میشوند (12، 4). معمولاً برای موفقیت، شمار CD34+ باید بیش از ۱۰ سلول در میکرولیتر باشد تا 106×5/4-4 سلول به ازای هر کیلوگرم وزن بدن جمعآوری شود (15).
رایجترین عامل موبیلیزاسیون، G-CSF است که طی 5-4 روز پیش از آفرزیس تجویز میشود تـا سطح CD34+ در خون افزایش یـابد (15، 12، 3). اما رژیمهای مبتنی بر G-CSF گـاهی نـاکارآمدند و میتوانند منجر به جمعآوری نـاکافی، تکرار فرآیند و افزایش خطر شکست پیوند شوند (14، 12، 3). علاوه بر این، G-CSF بـا عوارضی مانند درد استخوان، تب و تهوع همراه است (12، 4). از این رو، یافتن روشهای مکمل یا جایگزین برای تسهیل موبیلیزاسیون اهمیت دارد (15).
ورزش یکی از روشهای غیرتهاجمی مطرح برای افزایش موبیلیزاسیون HSC است (17، 16، 12، 4). سطح G-CSF میتواند در پاسخ به هیپوکسی ناشی از ورزش افزایش یابد (18). شدت تمرین عامل کلیدی است؛ تمرینات شدید نسبت به تمرینات متوسط موجب افزایش بیشتر سلولهای CD34+ در گردش میشوند، در حالی که تمرینات سبک تأثیری ندارند (19، 3). تمرینات تناوبی با شدت بالا ( HIIT: High-Intensity Intevral Training) نیـز بـه عنوان جایگزینی مؤثر برای تمرینات هوازی سنتی پیشنهاد شدهاند (20).
در این مطالعه، به منظور ارزیابی جامع اثر HIIT بر موبیلیزاسیون HSC ، شاخصهای WBC (پاسخ ایمنی و التهابی)، CD34+ (نشانگر کلاسیک HSC)، −CD34+/CD38 (جمعیت اولیهتر با پتانسیل خودنوسازی بالا) و CD34+/CD110+ (زیر مجموعه متعهد به رده مگاکاریوسیتی مرتبط با بازسازی پلاکتها) اندازهگیری شد. همچنین بیان ژنهای SCF و CXCL-12 ، که به ترتیب در بقا/تکثیر و انسداد HSC ها در نیچ مغز استخوان نقش دارنـد، مورد بررسی قرار گرفت (22، 21، 14). CD34+/CD38 جمعیتی خالصتر از HSCها را نشان میدهد و CD34+/CD110+ با بـازیابی پلاکتی پس از پیوند ارتباط مستقیم دارد. ارزیابی SCF و CXCL-12 نیز به شناسایی مکانیسمهای مولکولی احتمالی در آزادسازی سلولها کمک میکند.
مواد و روشها
این مطالعه یـک پژوهش نیمه تجربی کاربردی بود که بر روی 20 بیمار کاندید پیوند سلولهای بنیادی خونساز اتولوگ مبتلا بـه لنفوم هوچکین و غیرهوچکین کـه در بیمارستان طالقانی تهران بستری بودند انجام شد و نمونهها به صورت در دسترس و با همتاسازی انتخاب شدند. بیماران با در نظر گرفتن سن، جنس، نوع بیماری خونی، شاخص توده بدنی یاBMI ، سطح آمادگی جسمانی و نتایج آزمایش ورزشی، به دو گروه همگن کنترل و HIIT تقسیم شدند. بدین ترتیب تخصیص به گروههای کنترلشده و بر اساس ویژگیهای پایـه انجام شد و تصادفیسازی کامل صورت نگرفت.
محاسبه حجم نمونه:
با توجه به طراحی مطالعه و مقایسه میانگینها بین دو گروه، حجم نمونـه با استفاده از فرمول عمومی مقایسه میانگین دو گروه مستقل و با در نظر گرفتن مقادیر استاندارد محاسبه شد (23). بر این اساس، با فرض اندازه اثر بزرگ (8/0 d=) بر پایه مطالعههای پیشین مشابه، سطح معناداری (05/0 a=) و توان آماری (80/0 b=)، حجم نمونه مورد نیـاز برای هر گروه ۱۰ نفر برآورد شد (15، 3). با در نظـر گرفتن احتمال ریزش نمونهها، تعداد نهایی شرکتکنندگان در هر گروه ۱۰ نفر در نظر گرفته شد که در مجموع حجم نمونه مطالعه را به ۲۰ نفر رساند. محاسبـات با نرمافزار G*Power (نسخه ۳.۱.۹.۷) انجام پذیرفت.
n=2(Z1−α/2+Z1−β)2⋅σ2d2n=d22(Z1−α/2+Z1−β)2⋅σ2
معیارهای ورود به مطالعه:
شرایط لازم برای مشارکت در این پژوهش به شرح زیر بود:
- سن بین ۱۸ تا ۵۵ سال
- وزن بین ۴۰ تا ۸۰ کیلوگرم
- داشتن شاخص توده بدنی (BMI) کمتر از ۳۰ kg/m²
- عدم مصرف سیگار و سایر فرآوردههای تنباکو
- عدم ابتلا بـه بیماریهای همزمان مؤثر بر انجام ورزش (از جمله بیماریهای قلبی-عروقی، ریوی، کلیوی، هپاتیت و دیابت)
- توانایی کامل برای انجام آزمایش ورزش و طی کردن حداقل چهار مرحله از دستورالعمل آن
- نداشتن هرگونه اختلال حرکتی یا مشکل بالینی که انجام دستورالعمل تمرینی را محدود کند
- اخذ تأییدیه پزشکی مبنی بر صلاحیت و ایمنی شرکت در فعالیت ورزشی مورد نظر
دلایل حذف شرکتکنندگان از روند مطالعه عبارت بودند از:
- ناتوانی در اجرای پروتکل تمرینی با شدت و مدت تعیینشده
- مشاهده هرگونـه علامت یا عارضه هشداردهنـــده
طراحی مطالعه و دستورالعمل آزمایشی:
افراد گروه HIIT، پیش از فرآیند آفرزیس، فقط یک جلسه تمرین تناوبی با شدت بالا انجام دادند. کل نمونهها به دو گروه ۱۰ نفره تقسیم شدند: گروه تمرین (HIIT) و گروه کنترل. هر دو گروه مطابق دستورالعملهای کالج پزشکی ورزشی آمریکا (ACSM) برای ارزیـابی خطرات احتمالی فعالیت ورزشی بررسی شدند.
در ابتدا، یک آزمون حداکثر ظرفیت قلبی-ریوی (MCT) به منظور تعیین VO₂peak هر فرد انجام شد. سپس، پس از گـذشت ده روز (برای حذف اثرات فیزیولوژیکی تست)، درمان موبیلیزاسیون با G-CSF به دوز ۵ میکروگرم به ازای هر کیلوگرم وزن بدن برای مدت پنج روز آغاز شد.
شش ساعت پس از آخرین دوز G-CSF، گروه HIIT تمرین تناوبی با شدت بالا را به شکل زیر اجرا کرد:
- ۵ دقیقه گرم کردن با شدت ۱۰ تا ۲۰ درصد VO₂peak
- سپس ۱۲ دوره یـک دقیقهای تمرین با شدت %100 VO₂peak
- و یـک دقیقه استراحت بین هر دوره با شدت %20 VO₂peak
نمونهگیری خون:
در گروه HIIT، نمونهگیـری خـون دقیقـاً قبل و بلافاصله پس از اجرای دستورالعمل تمرینی انجام شد. در مقابل، گروه کنترل بدون انجام تمرین، فقط بر روی تردمیل نشسته و در همان وضعیت و بازه زمانی مشابه، نمونهگیری شدند. نمونههای خون از طریق کاتتر از ورید گردنی گرفته شده و در لولههای حاوی ماده ضد انعقاد EDTA جمعآوری شدنـد. همچنین بلافاصله پس از اجرای دستورالعمل تمرینی، بیماران برای جداسازی سلولهای بنیادی از خـون
.jpg)
محیطی به اتاق آفرزیس هدایت شدند. نمونهها بدون تأخیر زمانی قابل توجه در کمتر از 24 ساعت با شرایط نگهداری مناسب در دمای 4 درجه شمارش شدند.
شمارش کامل سلولهای خونی و آنالیز فلوسیتومتری:
بــرای انجام شمارش کامل سلولهای خونی (CBC)، از دستگاه شمارشگر سلولی خودکار (Sysmex KX21 ، ژاپن) استفاده شد. برای تجزیه و تحلیل فلوسایتومتری، مقدار ۹۸ میکرولیتـر از نمونه خون وریدی به یک میکروتیوب 5/1 میلیلیتری منتقل شد، سپس ۲ میکرولیتر از آنتیبادیهای زیر اضافه گردید:
روش استخراج RNA:
نمونههای خون محیطی و آفرزیس ابتدا با PBS شسته شده و سپس به آنها ۵۰ میکرولیتر ترایزول افزوده شد. پس از ورتکس کردن و انکوباسیون در دمای اتاق به مدت ۵ دقیقه، مخلوط به میکروتیوب منتقل شده و ۳۰ میکرولیتر کلروفرم اضافه گردیـد. پس از مخلوط شدن دستی به مدت ۱۵ دقیقه و انکوباسیون در دمای اتاق برای ۵ دقیقه، سانتریفیوژ در دمای ۴ درجه سانتیگراد بـا سرعت ۸۰۰۰ دور در دقیقه بـه مدت ۵ دقیقه انجام شد و لایه رویی برداشته شد.
در مرحله بعد، فـاز رویی به میکروتیوب جدیدی منتقل و ۳۰ میکرولیتر ایزوپروپانول 100% افزوده شد و در دمای منفی ۲۰ درجـه سانتیگراد به مدت ۲۴ ساعت انکوبه گردید. پس از سانتریفیوژ، لایه فوقانی حذف و رسوب با اتانول 80% سرد شسته شد. پس از خشککردن، رسوب RNA در ۱۰ میکرولیتر آب استریل حل و در دمای منفـی
۸۰ درجه سانتیگراد نگهداری شد.
در نهایت، کمیت و کیفیت RNA استخراجشده بـا دستگاه نـانودراپ ( Nanodrop 2000 ساختThermo Scientific، آمریکا) و با اندازهگیری جذب در طول موجهای ۲۶۰ و ۲۸۰ نانومتر و محاسبه نسبت جذب ارزیابی شد.
qRT-PCR :
برای بررسی بیان ژنهای SCF و CXCL12، از روش واکنش زنجیرهای پلیمراز با رونویسی معکوس کمی (qRT-PCR) با رنگ SYBR Green در دو مرحله استفاده شد: ابتدا سنتز cDNA از RNA و سپس تکثیر DNA دو رشتهای.
ژن GAPDH بـه عنوان ژن مرجع (Housekeeping) در نظر گرفته شد. آغازگرهای مورد استفاده در جدول شماره 1 آورده شدهاند.
برای واکنش PCR، از مخلوط واکنش شامل 75/0 میکرولیتـر از هر آغازگر، ۱۰ میکرولیتر SYBR Green، 5/13 میکرولیتر آب دیونیزه و ۲ میکرولیتر cDNA استفاده شد. این واکنش در دستگاه ترمال سایکلر ABI (Applied Biosystems) انجام شد. دستورالعمل PCR شامل مراحل زیر بود:
دناتوراسیون اولیه: ۵ دقیقه در ۹۵ درجه سانتیگراد
۴۰ چرخه شامل:
۳۰ ثانیه در ۹۴ درجه (دناتوراسیون)
۳۰ ثانیه در ۵۸ درجه (اتصال)
۱۵ ثانیه در ۷۲ درجه (امتداد)
محصولات PCR بـر روی ژل آگـارز 4% الکتروفــــورز شدند.
روش تجزیه و تحلیل اطلاعات:
برای تجزیه و تحلیل داده ها از نرم افزار SPSS نسخـه 22 استفاده شد. برای تعیین توزیع طبیعی دادهها از آزمون کلموگروف-اسمیرنوف و برای بررسی همگنی دادهها از آزمون لون استفاده شد. برای محاسبه میانگین، دامنه تغییرات و انحراف استاندارد از آمار توصیفی استفاده شده است. در مطالعه برای مقایسه دو گروه، با کنترل قبل از فعالیت، از آزمون آنوا یک طرفه با اندازههای مکرر استفاده شد. برای مقایسه قبل و بعد از فعالیت در دو گروه از آزمون تی-زوجی استفاده شد. ارتباط بین سطح بیان ژن با تعداد سلولهای بنیادی موبیلیز شده در خون محیطی از نوع همبستگی پیرسون است، همچنین این ارتباط با کنترل عوامل مخدوش کننده نیز سنجیده شده است. تمامی آزمونها دو طرفه و سطح معناداری 05/0 p£ در نظر گرفته میشود.
یافتهها
ویژگیهای جمعیت مورد مطالعه:
میانگین سنی افراد گروه HIIT برابر با 3/51 سـال و در
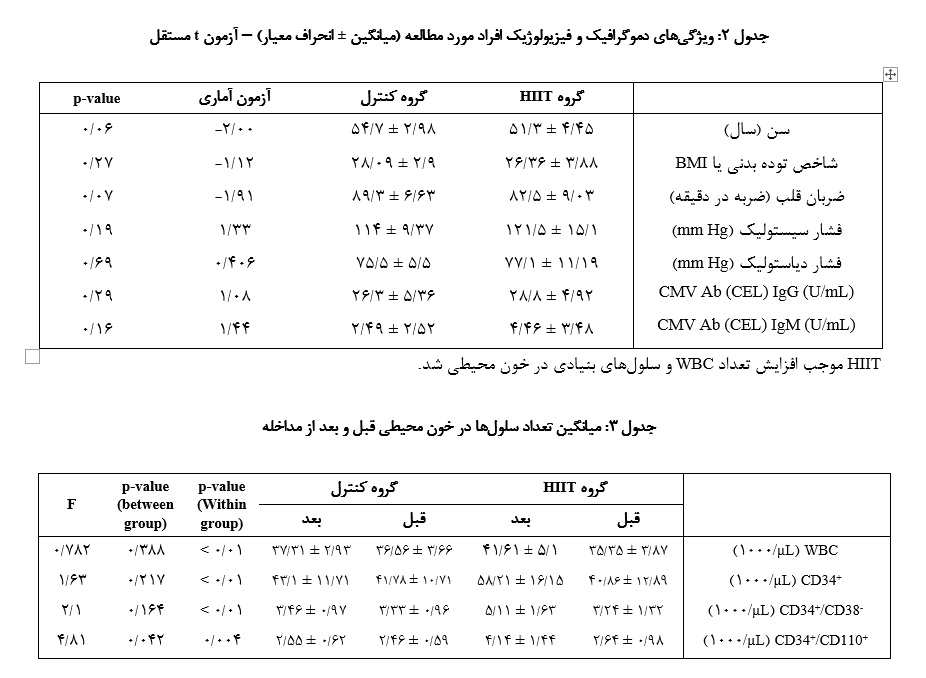
گروه کنترل برابر بـا 7/54 سال بود. در هر دو گروه، 60% شرکتکنندگان مرد و 40% زن بودنـد. سایر ویژگیهای فیزیولوژیک مانند شاخص توده بدنی (BMI)، ضربان قلب، فشار خون و آنتیبادیCMV (CMV Ab) (با توجه به این که سایتومگالوویروس میتواند بر پاسخ ایمنی و شاخصهای خونی مؤثر بـاشد) نیز بین دو گروه تفاوت آماری معناداری نداشتند.
آزمون ANOVA بـا اندازهگیریهای مکرر نشان داد که اگر چه تفاوت معناداری بین گروهها در تعداد WBC، CD34+ و CD34+/CD38- وجود نداشت، اما تعداد سلولهایCD34+/CD110+ در گروه HIIT به طور معناداری بیشتر از گروه کنترل بود (05/0 p<)(d~1-1.4). همچنین در گروه HIIT ، تفاوت معناداری در تمام شاخصهـا قبل و بعد از تمرین مشاهده شد (05/0 p<).
همچنین آزمون t زوجی درون گروهی نشان داد که در گروه HIIT، افزایش معناداری در تمام شاخصها نسبت به پیش از تمرین دیـده شد، در حالی که گروه کنترل هیچ تغییر معناداری نداشت (نمودار 1).
شمارش کامل سلولهای خونی و آنالیز فلوسیتومتری:
بــرای انجام شمارش کامل سلولهای خونی (CBC)، از دستگاه شمارشگر سلولی خودکار (Sysmex KX21 ، ژاپن) استفاده شد. برای تجزیه و تحلیل فلوسایتومتری، مقدار ۹۸ میکرولیتـر از نمونه خون وریدی به یک میکروتیوب 5/1 میلیلیتری منتقل شد، سپس ۲ میکرولیتر از آنتیبادیهای زیر اضافه گردید:
- CD34-PE (ضد CD34 انسانی)
- CD38-APC (ضد CD38 انسانی)
- CD110-viobright b515 (ضد CD110 انسانی)
روش استخراج RNA:
نمونههای خون محیطی و آفرزیس ابتدا با PBS شسته شده و سپس به آنها ۵۰ میکرولیتر ترایزول افزوده شد. پس از ورتکس کردن و انکوباسیون در دمای اتاق به مدت ۵ دقیقه، مخلوط به میکروتیوب منتقل شده و ۳۰ میکرولیتر کلروفرم اضافه گردیـد. پس از مخلوط شدن دستی به مدت ۱۵ دقیقه و انکوباسیون در دمای اتاق برای ۵ دقیقه، سانتریفیوژ در دمای ۴ درجه سانتیگراد بـا سرعت ۸۰۰۰ دور در دقیقه بـه مدت ۵ دقیقه انجام شد و لایه رویی برداشته شد.
در مرحله بعد، فـاز رویی به میکروتیوب جدیدی منتقل و ۳۰ میکرولیتر ایزوپروپانول 100% افزوده شد و در دمای منفی ۲۰ درجـه سانتیگراد به مدت ۲۴ ساعت انکوبه گردید. پس از سانتریفیوژ، لایه فوقانی حذف و رسوب با اتانول 80% سرد شسته شد. پس از خشککردن، رسوب RNA در ۱۰ میکرولیتر آب استریل حل و در دمای منفـی
۸۰ درجه سانتیگراد نگهداری شد.
در نهایت، کمیت و کیفیت RNA استخراجشده بـا دستگاه نـانودراپ ( Nanodrop 2000 ساختThermo Scientific، آمریکا) و با اندازهگیری جذب در طول موجهای ۲۶۰ و ۲۸۰ نانومتر و محاسبه نسبت جذب ارزیابی شد.
qRT-PCR :
برای بررسی بیان ژنهای SCF و CXCL12، از روش واکنش زنجیرهای پلیمراز با رونویسی معکوس کمی (qRT-PCR) با رنگ SYBR Green در دو مرحله استفاده شد: ابتدا سنتز cDNA از RNA و سپس تکثیر DNA دو رشتهای.
ژن GAPDH بـه عنوان ژن مرجع (Housekeeping) در نظر گرفته شد. آغازگرهای مورد استفاده در جدول شماره 1 آورده شدهاند.
برای واکنش PCR، از مخلوط واکنش شامل 75/0 میکرولیتـر از هر آغازگر، ۱۰ میکرولیتر SYBR Green، 5/13 میکرولیتر آب دیونیزه و ۲ میکرولیتر cDNA استفاده شد. این واکنش در دستگاه ترمال سایکلر ABI (Applied Biosystems) انجام شد. دستورالعمل PCR شامل مراحل زیر بود:
دناتوراسیون اولیه: ۵ دقیقه در ۹۵ درجه سانتیگراد
۴۰ چرخه شامل:
۳۰ ثانیه در ۹۴ درجه (دناتوراسیون)
۳۰ ثانیه در ۵۸ درجه (اتصال)
۱۵ ثانیه در ۷۲ درجه (امتداد)
محصولات PCR بـر روی ژل آگـارز 4% الکتروفــــورز شدند.
روش تجزیه و تحلیل اطلاعات:
برای تجزیه و تحلیل داده ها از نرم افزار SPSS نسخـه 22 استفاده شد. برای تعیین توزیع طبیعی دادهها از آزمون کلموگروف-اسمیرنوف و برای بررسی همگنی دادهها از آزمون لون استفاده شد. برای محاسبه میانگین، دامنه تغییرات و انحراف استاندارد از آمار توصیفی استفاده شده است. در مطالعه برای مقایسه دو گروه، با کنترل قبل از فعالیت، از آزمون آنوا یک طرفه با اندازههای مکرر استفاده شد. برای مقایسه قبل و بعد از فعالیت در دو گروه از آزمون تی-زوجی استفاده شد. ارتباط بین سطح بیان ژن با تعداد سلولهای بنیادی موبیلیز شده در خون محیطی از نوع همبستگی پیرسون است، همچنین این ارتباط با کنترل عوامل مخدوش کننده نیز سنجیده شده است. تمامی آزمونها دو طرفه و سطح معناداری 05/0 p£ در نظر گرفته میشود.
یافتهها
ویژگیهای جمعیت مورد مطالعه:
میانگین سنی افراد گروه HIIT برابر با 3/51 سـال و در
گروه کنترل برابر بـا 7/54 سال بود. در هر دو گروه، 60% شرکتکنندگان مرد و 40% زن بودنـد. سایر ویژگیهای فیزیولوژیک مانند شاخص توده بدنی (BMI)، ضربان قلب، فشار خون و آنتیبادیCMV (CMV Ab) (با توجه به این که سایتومگالوویروس میتواند بر پاسخ ایمنی و شاخصهای خونی مؤثر بـاشد) نیز بین دو گروه تفاوت آماری معناداری نداشتند.
آزمون ANOVA بـا اندازهگیریهای مکرر نشان داد که اگر چه تفاوت معناداری بین گروهها در تعداد WBC، CD34+ و CD34+/CD38- وجود نداشت، اما تعداد سلولهایCD34+/CD110+ در گروه HIIT به طور معناداری بیشتر از گروه کنترل بود (05/0 p<)(d~1-1.4). همچنین در گروه HIIT ، تفاوت معناداری در تمام شاخصهـا قبل و بعد از تمرین مشاهده شد (05/0 p<).
همچنین آزمون t زوجی درون گروهی نشان داد که در گروه HIIT، افزایش معناداری در تمام شاخصها نسبت به پیش از تمرین دیـده شد، در حالی که گروه کنترل هیچ تغییر معناداری نداشت (نمودار 1).





HIIT تأثیری بر محصول آفرزیس نداشت:
بیان ژنهای SCF و CXCL-12 تحت تأثیر تمرینات تناوبی با شدت بالا (HIIT) قرار نگرفت:
همانطـور کـه در جدول ۵ و شکـل ۲ نشـان داده شده است، نتایج آزمون تجزیـه و تحلیل واریانس(ANOVA) اختلاف معناداری در سطح بیان ژنهای SCF و CXCL-12 بین گروههای HIIT و کنترل نشان نداد.
عدم وجود همبستگی میان بیان ژنهای SCF و CXCL12 با شمارش سلولهای WBC و CD34+:
هیچ همبستگی معناداری بین افزایش هر واحد در بیان
ژنهای SCF و CXCL12 با شمار سلولهای WBC، CD34+، CD34+/CD38- و CD34+/CD110+ در خون محیطی و فرآورده آفرزیس مشاهده نشد. همچنین پس از تعدیل بر اساس سن، شاخص توده بدنی (BMI) و جنسیت، همچنان همبستگی معناداری یافت نشد (جدول 6).
بحث
مطالعههای بـالینی تأیید کردهاند که انجام تمرینات ورزشی با شـدت کم تا زیاد در اهداکنندگان و بیماران تحت پیوند سلولهای بنیادی خونساز (HSCT) امکانپذیر و ایمن است (26-24). حتی تمرینات تناوبی با شدت بالا (HIIT) نیز در جمعیتهای بـالینی متعددی به خوبی تحمل شده است، بنـابراین این دستورالعملها میتوانند برای افراد غیرسالم نیز کاربردی باشند. افراد غیرسالم ممکن است بتوانند تمرینات با شدت بالا را همراه با استفاده از (G-CSF فاکتور محرک کلنی گرانولوسیتی (انجـام دهند که باعث آزادسازی سلولهای بنیادی خونساز (HSC) به میزان مشابه افراد سالم میشود (3). ورزش میتواند به طور حاد تعداد HSCها را در مغز استخوان و خون محیطی، حتی پس از یک جلسه تمرین در افراد جوان و مسن، مرد و زن، و ورزشکار و غیر ورزشکار افزایش دهد (27، 16، 14، 3).
یافتههای مطالعه حاضر نشان داد که HIIT به طور قابل توجهی سلولهای CD34+، CD34+/CD38- و CD34+/CD110+ در گردش خون را افزایش میدهـد که با نتایج مطالعههای قبلی همخوانی دارد. برای اولین بار در سال 1978، بارت و همکاران نشان دادند که یک تمرین حاد میتواند تعداد سلولهای بنیادی خونساز گردشکننده را افزایش دهد (28). همچنین بونسینیور (2002) افزایش 3 تا 4 برابری سلولهای CD34+ را در دوندهها نسبت به افـراد کم تحرک گزارش کرد (29). موریچی و همکاران (2005) نیز دو برابر شدن تعداد سلولهای CD34+ را پس از تمرینات فوق زیاد نشان دادند (2). کراننبروک و همکاران (2008) افزایش تعداد HSCهـا در گردش پس از تمرینات حاد را گزارش کردند و وینکلر و همکاران (2009) افزایش 1/3 برابری سلولهای CD34+ را مشاهده نمودند (31، 30). همچنین بونسینیور (2010) ادعا کرد که تعداد سلولهای CD34+ در دوندهها نسبت به افراد کمتحرک 4 برابر بیشتر است (32). شیدی و همکاران (2020) نیز افزایش قابل توجهی در HSCهای گردش کننده گزارش کردنـد و پرادانا و همکاران افزایش معنادار HSCها پس از HIIT را گزارش دادند (33، 1).
ورزش بـاعث افزایش تـرشح فاکتور محرک کلنی گرانولوسیتی (G-CSF)، کورتیزول، اینترلوکین-6 ، فاکتور نکروز تومور α، اینترلوکین-1 بتا و فـاکتور رشد اندوتلیال عروقی میشود کـه باعث افزایش تعداد HSCهای گردشکننده میگردد (5، 4، 2). همچنین افزایش تنش برشی همودینامیکی ناشی از افزایش برونده قلبی و فشار خون در اثر ورزش ممکن است باعث آزادسازی HSCها شود. اگر چه سطح پلاسمایی G-CSF در حین ورزش افزایش مییابد، اما مسئول مستقیم آزادسازی سریع HSC نیست زیرا G-CSF برای آزادسازی سلولهـا به چند روز زمان نیاز دارد. در عوض، احتمالاً این آزادسازی ناشی از مهاجرت سلولها از مخـازن حاشیهای تحت تـأثیر گیرندههای بتا-2 آدرنرژیک است (15). نتایج حاضر نشان داد که HIIT تأثیر قابل توجهی در افزایش تعداد سلولهـای CD34+، CD34+/CD38- و CD34+/CD110+ در محصول آفرزیس ندارد. این موضوع بـه دلیل موقتی بودن افزایش HSCهای گردشکننده است که بلافاصله پس از ورزش افزایش مییابد، تا 30-15 دقیقه اول بـالا باقی میماند و سپس به سرعت به مقدار پایه بـاز میگردد (34، 16، 14). این مـدت زمان کوتاه برای افزایش میزان برداشت آفرزیس از نظر بالینی کافی نیست (16). افزایش گذرا ممکن است به دلیل مصرف سریع HSCها برای ترمیم آسیبهای ناشی از ورزش باشد (16، 2). یافتن HSCها در عضلات اسکلتی پس از ورزش نشان میدهد که این سلولها باید از گردش خون خارج شده و در فرآیند بـازسازی بافت شرکت کنند (16، 14، 2، 1). بنابراین بهترین زمان برداشت HSC بلافاصله پس از ورزش است (3).
عامل سلول بنیادی (SCF) و لیگاند کموکاینCXC12 توسط سلولهای استرومایی ترشح شده و با CD117 و گیرنده آن که روی سطح HSCها بیان میشوند، تعامل دارنـد. این تعاملات به ماندگاری و لانهگزینی HSCها در niche مغز استخوان کمـک میکند. اختلال در محورهای SCF-CD117 و CXCR4-CXCL12 منجر به آزادسازی HSCها به جریان خون میشود (14). در شرایط پایدار، مولکولهای چسبندگی سلولی به CXCL12 متصل شده و HSCها را در مغز استخوان نگه میدارند.G-CSF مولکول چسبندگی سلولی عروقی (VCAM-1) را تخریب کرده و باعث آزادسازی HSC به خون محیطی میشود (12). نتایج مطالعه حاضر تفاوت معناداری در بیان ژنهای SCF و CXCL12 بیـن گروه HIIT و کنترل نشان نـداد. همچنین افزایش بیان این ژنهـا در گروه HIIT باعث تغییر قابل توجهی در تعداد سلولهای CD34+/CD38- و CD34+/CD110+ در خون محیطی یا محصول آفرزیس نشد.
اگرچه پژوهشهای قبلی نیز اثرات ورزش بر آزادسازی HSC را بررسی کردهاند، مطالعه ما یکی از نخستین مطالعاتی است که به طور خاص تأثیر HIIT را بر آزادسازی HSC در زمینه پیونـد خودی HSCT بررسی میکند (36، 35). ما زمانبندی و شدت تمرین را به همراه کاربرد آن در شرایط بالینی بلافاصله پس از تجویز G-CSF بررسی کردیم.
این مطالعه رویکردی منحصر به فرد و جامع ارائه میدهد و نه تنها مارکر CD34 بلکه بیان CD38 و CD110 را نیز روی HSC ها ارزیابی میکند. در حالی که تحقیقات قبلی عمدتاً روی سلولهای CD34+ به عنوان نشانگر HSC متمرکز بودند، مطالعه ما این تحلیل را با بررسی زیر جمعیتهای CD34+/CD38- و CD34+/CD110+ گسترش داده است. این مارکرهـای اضافی ارزیابی جامعتری از جمعیت سلولهای بنیادی که با ترکیب G-CSF و HIIT آزاد میشوند، فراهم میکنند و جامعیت پژوهش ما را تضمین میکنند.
اگر چه سلولهای CD34+ معمولاً برای HSCT استفاده میشوند، جمعیت CD34+ هتروژن است. بنابراینHSCT ممکن است به دلیل وجود HSC های کوتاه مدت(CD34+/CD38+) یـا تأخیر در بازسازی پلاکتها به دلیل فقدان HSC های مگاکاریوسیتی (CD34+/CD110+) با موفقیت نـاکافی همراه باشد.
سلولهایCD34+/CD38- طولانی مدت بوده، قابلیت خودنوسازی دارند و تا پایان عمر سیستم خونسازی را بازسازی میکنند؛ بنابراین استفاده از این زیرجمعیت در HSCT نتایج بهتری دارد. زیرجمعیت CD34+/CD110+ که گیرنده ترومبوپوئتین (MPL) را بیان میکند، با تمایل به لاین مگاکاریوسیتی مرتبطتر است و ممکن است بـه بازسازی سریعتر پلاکتها کمک کند. بنابراین مطالعه ما نه تنها کاربرد نوآورانه HIIT برای افزایش آزادسازی HSC را بررسی میکند، بلکـه بـا هدفگیری زیرجمعیتهای خاصتر HSC به بهبود نتایج پیوند میپردازد. این تمرکز دوگانه ممکن است فرآیندهای آزادسازی و بازیابی پس از پیوند را بهبود بخشد.
استفاده از ورزش به عنوان درمان کمکی همراه بـا G-CSF برای HSCT خودی محدودیتهایی دارد، از جمله شرایط بالینی متفاوت بیماران، عوامل محیطی، مالی و حمایت اجتماعی برای ورزش، خطر سقوط و نیاز به وسایل کمکی، بیماریهای همراه مانند بیماریهای قلبی-عروقی و ریوی، ناراحتیهای اسکلتی- عضلانی ناشی از آرتریت، مشکلات عضلانی، نوروپاتی محیطی و متاستاز استخوان، خطر شکنندگی استخوان در مواردی مانند مالتیپل میلومای متعدد، عوامل مزاحم در بیماران تحـت شیمیدرمانی مانند درد، خستگی، نـاراحتی روانی، عدم تعادل یا کمبود مواد مغذی و داروها. محدودیتهای مطالعه حاضر شامل اندازه نمونـه نسبتاً کوچک و احتمال وجود تفاوتهای فردی در پاسخ فیزیولوژیـک به تمرینات HIIT و تجویز G-CSF است که ممکن است بر آزادسازی سلولهای بنیادی تأثیر بگذارد. همچنین زمانبندی برداشت آفرزیس و محدودیـتهای بالینی مرتبط با بیماران تحت HSCT میتواند برتعمیم نتایج تـأثیر بگذارد. این عوامل باید در مطالعههای آینده مــــورد
توجه قرار گیرند.
نتیجهگیری
یافتههای مطالعه نشان داد ورزش باعث افزایش موقـت HSCها در خون محیطی میشود، اما تـأثیر معناداری بر محصول آفرزیس و بیان ژنهای کلیدی ندارد؛ این مسأله احتمالاً ناشی از فعال شدن مسیرهای کوتاه مدت مانند سیستم آدرنرژیـک، بدون ایجاد تغییر پایدار در تنظیم ژنهای نیچ میباشد. بدین ترتیبHIIT به عنوان یک روش تقویتکننده احتمالی برای آزادسازی سلولهای بنیادی خونساز همراه با درمان G-CSF مطرح است. با این حال، این تأثیر گذرا بوده و تعداد سلولهای CD34+ گردش کننده به سرعـت کاهـش مییابـد. پـژوهشهای آینده بـرای تعییـن امکانپـذیری ورزش دقیقاً قبل از انجام آفرزیس به منظور بیشینه کردن تاثیر بر افزایش برداشت مورد نیاز است.
ملاحظات اخلاقی
تمام شرکتکنندگان، پس از دریافت توضیحات کامل از سوی تیم تحقیق، فرم رضایتنامه آگاهانه و محرمانه را امضا کردند. این مطالعه مطابق اصول اخلاق در پژوهش بر انسان و با تأیید کمیته اخلاق دانشگاه علوم پزشکی شهید بهشتی به شماره (IR.SBMU.REC.1401.005) انجام شد.
عدم تعارض منافع
هیچگونه تعارض منافع مالی یا غیر مالی بین نویسندگان و همچنین نهادهای مرتبط بـا این پژوهش گزارش نشده است.
نقش نویسندگان
ثمینه هدایتی: انجام آزمایشها، گردآوری و تحلیل دادهها
دکتر علیرضا رحیمی: طراحی مطالعه، نظارت بر اجرا و ویرایش نهایی مقاله
دکتر فریبا آقایی: مشاوره روششناختی و بازبینی محتوا
دکتر مهسا محسنزاده: مشاوره روششناختی و بازبینی محتوای علمی
تمامی نویسندگان در تائید نسخه نهایی مقاله توافق داشته و مسئولیت تمامی جنبههای کار را بر عهده میگیرند.
تشکر و قدردانی
بدین وسیله از ریاست و پرسنل محترم مرکز تحقیقات سلولهای بنیادی خونساز و بخش پیوند مغز استخوان بیمارستان طالقانی و دانشگاه علوم پزشکی شهید بهشتی تهران که امکان انجام این پژوهش را فراهم آوردند، صمیمانه تشکر میشود. این مطالعه به عنوان بخشی از پایاننامه دکتری تخصصی با عنوان "تأثیر تمرین تناوبی با شدت بالا بر بیان ژنهای SCF و CXCL-12 دخیل در موبیلیزاسیون سلولهــای بنیــادی خونســاز و محتـــوای سلولهـــای
CD34+/CD110+ و CD34+/CD38- در بیماران کـاندید پیوند اتولوگ پیوند مغز استخوان" و نیز طرح پژوهشی مصوب شده توسط معاونت تحقیقات و فناوری دانشگاه با کد طرح 32316 به انجام رسید.
فهرست منابع
1. Shady KA, Shehata AM, Ebrahim AS. Impact of Acute Exercise by Yo-Yo Intermittent Recovery Test on Hematopoietic Stem Cells, Muscle Damage and Inflammations Markers in Football Players. The Scientific Journal of Physical Education and Sports Sciences 2020; 39(1): 1-14.
2. Morici G, Zangla D, Santoro A, Pelosi E, Petrucci E, Gioia M, et al. Supramaximal exercise mobilizes hematopoietic progenitors and reticulocytes in athletes. Am J Physiol Regul Integr Comp Physiol 2005; 289(5): R1496-R503. [DOI:10.1152/ajpregu.00338.2005] [PMID]
3. Baker JM, Nederveen JP, Parise G. Aerobic exercise in humans mobilizes HSCs in an intensity-dependent manner. J Appl Physiol(1985) 2017; 122(1): 182-90. [DOI:10.1152/japplphysiol.00696.2016] [PMID] []
4. Kasravi K, Ghazalian F, Gaeini A, Hajifathali A, Gholami M. A Comparison of the Effect of Two Types of Continuous and Discontinuous Aerobic Exercise on Patients' Stem Cell Mobilization before Autologous Hematopoietic Stem Cell Transplantation. Int J Hematol Oncol Stem Cell Res 2021; 15(1): 61-71. [DOI:10.18502/ijhoscr.v15i1.5250] [PMID] []
5. Kröpfl JM, Stelzer I, Mangge H, Pekovits K, Fuchs R, Allard N, et al. Exercise-induced norepinephrine decreases circulating hematopoietic stem and progenitor cell colony-forming capacity. PLoS One 2014; 9(9): e106120. [DOI:10.1371/journal.pone.0106120] [PMID] []
6. Kroepfl JM, Pekovits K, Stelzer I, Fuchs R, Zelzer S, Hofmann P, et al. Exercise increases the frequency of circulating hematopoietic progenitor cells, but reduces hematopoietic colony-forming capacity. Stem Cells Dev 2012; 21(16): 2915-25. [DOI:10.1089/scd.2012.0017] [PMID]
7. Zarekar T, Hajifathali A, Ahmadizad S. The effect of High Intensity Interval Exercise on Platelet Engraftment in Autologous Bone Marrow Transplantation (BMT). Int J Hematol Oncol Stem Cell Res 2024; 18(3): 240-8. [DOI:10.18502/ijhoscr.v18i3.16104] [PMID] []
8. Dias ALM, Laterza MC, Mira PAdC, Freitas IMG, Trevizan PF, Martinez DG, et al. Exacerbated hemodynamic response during exercise in cancer patients prior to autologous hematopoietic stem cell transplantation. Support Care Cancer 2021; 29(7): 3831-8. [DOI:10.1007/s00520-020-05911-1] [PMID]
9. Ji C, Dai R, Wu H, Li Q, Liu S, He P, et al. Efficacy and safety of hematopoietic stem cell transplantation for hematologic malignancies: A protocol for an overview of systematic reviews and meta-analyses. Medicine: Case Reports and Study Protocols 2021; 2(12): e0174. [DOI:10.1097/MD9.0000000000000174]
10. de Vasconcelos P, Lacerda JF. Hematopoietic Stem Cell Transplantation for Neurological Disorders: A Focus on Inborn Errors of Metabolism. Front Cell Neurosci 2022; 16: 895511. [DOI:10.3389/fncel.2022.895511] [PMID] []
11. Carreras E, Dufour C, Mohty M, Kröger N. The EBMT Handbook: Hematopoietic Stem Cell Transplantation and Cellular Therapies [Internet]. 7th ed. Cham (CH): Springer; 2019. [DOI:10.1007/978-3-030-02278-5]
12. Zarekar T, Ahmadizad S, Hajifathali A. The effect of high intensity interval training on neutropenia in patients with lymphoma and multiple myeloma after hematopoietic stem cell transplantation. Sport Physiology 2023; 15(58): 101-24. [Article in Farsi]
13. Hedayati S, Rahimi A, Aghaei F, Mohsenzadeh M. Reviewing the effect of exercise on hematopoietic stem cell mobilization. J Iran Blood Transfus 2023; 20(2): 143-54. [Article in Farsi]
14. Niemiro GM, Parel J, Beals J, Van Vliet S, Paluska SA, Moore DR, et al. Kinetics of circulating progenitor cell mobilization during submaximal exercise. J Appl Physiol 2017; 122(3): 675-82. [DOI:10.1152/japplphysiol.00936.2016] [PMID]
15. Agha NH, Baker FL, Kunz HE, Graff R, Azadan R, Dolan C, et al. Vigorous exercise mobilizes CD34+ hematopoietic stem cells to peripheral blood via the β2-adrenergic receptor. Brain Behav Immun 2018; 68: 66-75. [DOI:10.1016/j.bbi.2017.10.001] [PMID] []
16. Boppart MD, De Lisio M, Witkowski S. Exercise and stem cells. Prog Mol Biol Transl Sci 2015; 135: 423-56. [DOI:10.1016/bs.pmbts.2015.07.005] [PMID]
17. Kröpfl JM, Beltrami FG, Gruber HJ, Stelzer I, Spengler CM. Exercise-induced circulating hematopoietic stem and progenitor cells in well-trained subjects. Front Physiol 2020; 11: 308. [DOI:10.3389/fphys.2020.00308] [PMID] []
18. Ghanimati R, Rajabi H, Ramezani F, Ramez M, Bapiran M, Nasirinezhad F. The effect of preconditioning with high-intensity training on tissue levels of G-CSF, its receptor and C-kit after an acute myocardial infarction in male rats. BMC Cardiovasc Disord 2020; 20(1): 75. [DOI:10.1186/s12872-020-01380-w] [PMID] []
19. Li W, Chen L, Sajadi SM, Baghaei S, Salahshour S. The impact of acute and chronic aerobic and resistance exercise on stem cell mobilization: A review of effects in healthy and diseased individuals across different age groups. Regen Ther 2024; 27: 464-81. [DOI:10.1016/j.reth.2024.04.013] [PMID] []
20. Heinemann NC, Tischer-Zimmermann S, Wittke TC, Eigendorf J, Kerling A, Framke T, et al. High-intensity interval training in allogeneic adoptive T-cell immunotherapy-a big HIT? J Transl Med 2020; 18(1): 148. [DOI:10.1186/s12967-020-02301-3] [PMID] []
21. Chang HH, Liou YS, Sun DS. Hematopoietic stem cell mobilization. Tzu Chi Med J 2022; 34(3): 270-5. [DOI:10.4103/tcmj.tcmj_98_21] [PMID] []
22. McKinnon KM. Flow cytometry: an overview. Curr Protoc Immunol 2018; 120: 5.1.1-5.1.11. [DOI:10.1002/cpim.40] [PMID] []
23. Grady DG, Cummings SR, Hulley SB. Alternative clinical trial designs and implementation issues. In: Grady DG, Cummings SR, Hulley SB, Browner WS, Newman ThB. Designing Clinical Research. 4th ed; 2013. p. 151-70.
24. do Lago ASD, Zaffarani C, Mendonça JFB, Moran CA, Costa D, Gomes ELdFD. Effects of physical exercise for children and adolescents undergoing hematopoietic stem cell transplantation: a systematic review and meta-analysis. Hematol Transfus Cell Ther 2021; 43(3): 313-23. [DOI:10.1016/j.htct.2020.07.013] [PMID] []
25. Chamorro-Viña C, Guilcher GM, Khan FM, Mazil K, Schulte F, Wurz A, et al. EXERCISE in pediatric autologous stem cell transplant patients: a randomized controlled trial protocol. BMC Cancer 2012; 12: 401. [DOI:10.1186/1471-2407-12-401] [PMID] []
26. Aziz JA, Smith C, Slobodian M, Du I, Shorr R, De Lisio M, et al. Impact of exercise training on hematological outcomes following hematopoietic cell transplantation: a scoping review. Clin Invest Med 2021; 44(2): E19-26. [DOI:10.25011/cim.v44i2.36369] [PMID]
27. Keser I, Suyani E, Aki SZ, Sucak AGT. The positive impact of regular exercise program on stem cell mobilization prior to autologous stem cell transplantation. Transfus Apher Sci 2013; 49(2): 302-6. [DOI:10.1016/j.transci.2013.06.007] [PMID]
28. Barrett A, Longhurst P, Sneath P, Watson J. Mobilization of CFU-C by exercise and ACTH induced stress in man. Exp Hematol 1978; 6(7): 590-4.
29. Bonsignore MR, Morici G, Santoro A, Pagano M, Cascio L, Bonanno A, et al. Circulating hematopoietic progenitor cells in runners. J Appl Physiol 2002; 93(5): 1691-7. [DOI:10.1152/japplphysiol.00376.2002] [PMID]
30. Van Craenenbroeck EM, Vrints CJ, Haine SE, Vermeulen K, Goovaerts I, Van Tendeloo VF, et al. A maximal exercise bout increases the number of circulating CD34+/KDR+ endothelial progenitor cells in healthy subjects. Relation with lipid profile. J Appl Physiol 2008; 104(4): 1006-13. [DOI:10.1152/japplphysiol.01210.2007] [PMID]
31. Möbius-Winkler S, Hilberg T, Menzel K, Golla E, Burman A, Schuler G, et al. Time-dependent mobilization of circulating progenitor cells during strenuous exercise in healthy individuals. J Appl Physiol 2009; 107(6): 1943-50. [DOI:10.1152/japplphysiol.00532.2009] [PMID]
32. Bonsignore MR, Morici G, Riccioni R, Huertas A, Petrucci E, Veca M, et al. Hemopoietic and angiogenetic progenitors in healthy athletes: different responses to endurance and maximal exercise. J Appl Physiol 2010; 109(1): 60-7. [DOI:10.1152/japplphysiol.01344.2009] [PMID]
33. Pradana F, Nijjar T, Cox PA, Morgan PT, Podlogar T, Lucas SJ, et al. Brief cycling intervals incrementally increase the number of hematopoietic stem and progenitor cells in human peripheral blood. Front Physiol 2024; 15: 1327269. [DOI:10.3389/fphys.2024.1327269] [PMID] []
34. Schmid M, Kroepfl JM, Spengler CM. Changes in circulating stem and progenitor cell numbers following acute exercise in healthy human subjects: a systematic review and meta-analysis. Stem Cell Rev Rep 2021; 17(4): 1091-1120. [DOI:10.1007/s12015-020-10105-7] [PMID] []
35. Emmons R, Niemiro GM, Owolabi O, De Lisio M. Acute exercise mobilizes hematopoietic stem and progenitor cells and alters the mesenchymal stromal cell secretome. J Appl Physiol 2016; 120(6): 624-32. [DOI:10.1152/japplphysiol.00925.2015] [PMID]
36. Nederveen JP, Baker J, Ibrahim G, Ivankovic V, Percival ME, Parise G. Hematopoietic stem and progenitor cell (HSPC) mobilization responses to different exercise intensities in young and older adults. Journal of Science in Sport and Exercise 2020; 2: 47-58. [DOI:10.1007/s42978-019-00050-4]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






