جلد 16، شماره 2 - ( تابستان 1398 )
جلد 16 شماره 2 صفحات 148-133 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shahbazi M, Ahmadinejad M. Heparin induced thrombocytopenia. Sci J Iran Blood Transfus Organ 2019; 16 (2) :133-148
URL: http://bloodjournal.ir/article-1-1240-fa.html
URL: http://bloodjournal.ir/article-1-1240-fa.html
شهبازی معصومه، احمدی نژاد مینو. ترومبوسیتوپنی ناشی از هپارین. فصلنامه پژوهشی خون. 1398; 16 (2) :133-148
استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 558 kb]
(9970 دریافت)
| چکیده (HTML) (4020 مشاهده)
مقدمه
هپارین با وزن مولکولی بالا (UFH: Unfractionated heparin) و سایر مشتقات آن مانند هپارین با وزن مولکولی پایین(LMWH: Low molecular weight heparin) در میان بیشترین داروهای تجویز شده در سراسر جهان قرار دارند. علیرغم این که در سالهای اخیر، داروهای ضد انعقادی جدیدی معرفی شدهاند اما هم چنان هپارین به عنوان داروی مورد علاقه پزشکان به دلیل ویژگیهای مطلوبی مانند شروع عملکرد سریع، توانایی مهار پروتئینهای انعقادی، متنوع، آسان بودن مانیتورینگ و برگشت، به عنوان پیشرو در پروفیلاکسی و درمان بسیاری از شرایط بالینی از جمله: جراحی قلب و عروق و روشهای تهاجمی (cardiovascular surgery and invasive procedures)، سندرومهای حاد کرونری(acute coronary syndromes)، ترومبوآمبولیسم وریدی(venous thromboembolism)، فیبریلاسیون دهلیزی(atrial fibrillation)، بیماری انسداد محیطی(peripheral occlusive disease)، در موارد گردش خون در خارج از بدن(extracorporeal circulation) و دیالیز(dialysis) استفاده شده و پیشبینی میشود استفاده از این دارو در آینده نیز ادامه پیدا کند(2، 1).
ترومبوسیتوپنی ناشی از هپارین(HIT ؛ Heparin Induced Thrombocytopenia)، یکی از عوارض خطرناک درمان با داروی هپارین بوده و از آن جا که میتواند منجر به فعالسازی پلاکتها شود، خطر ایجاد ترومبوز و مرگ و میر متعاقب آن وجود دارد. از آن جا که HIT یک سندروم بالینی- آزمایشگاهی میباشد، تشخیص آن باید بر اساس یافتههای بالینی و نتایج تستهای آزمایشگاهی صورت گیرد و استفاده تنها از هر کدام از آنها میتواند منجر به عدم تشخیص(miss diagnosis) و یا تشخیص بیش از حد واقعی(over-diagnosis) این پدیده گردد(4، 3). در این مقاله مروری، خوانندگان با پیشرفتهای اخیر در مورد پاتوفیزیولوژی، علائم بالینی، روشهای ارزیابی بالینی، تستهای آزمایشگاهی و دارودرمانی HIT آشنا خواهند شد.
چرا HIT مهم است؟
سالانـه حـدود 12 میلیون بیمار در آمریکا تحت درمـان
با هپارین قرار میگیرند و از آن جا که HIT میتواند به صورت رخدادهای ترومبوتیک بسیار مخرب بروز نماید، این رخدادها باعث شده HIT در میان واکنشهای نامطلوب دارو درمانی، جایگاه ویژهای داشته باشد. تخمین زده میشود سالانه حدود 600 هزار مورد جدید HIT در ایالت متحده امریکا رخ داده که تقریباً در حدود نیمی از آنها رخدادهای ترومبوتیک بروز مییابد و حدود 90 هزار بیمار دچار مرگ میشوند که این آمار قابل مقایسه با آمار سالانه 260 هزار مورد جدید سرطان تهاجمی پستان در ایالت متحده میباشد. از طرفی HIT عارضهای پر هزینه میباشد به طوری که در آمریکا میزان ضرر مالی بالقوه آن 33 تا 100 میلیون دلار تخمین زده میشود(6، 5). علیرغم اهمیت این بیماری، تاکنون کمتر از 10 مقاله در خصوص این بیماری یا گزارش موردی آن از ایران به چاپ رسیده است که در متن به نتایج برخی از آنها اشاره خواهد شد.
تعریف ترومبوسیتوپنی ناشی از هپارین:
دو نوع ترومبوسیتوپنی ناشی از هپارین تعریف شده است:
نوع 1 یا ترومبوسیتوپنی همراه با هپارین (HAT: heparin-associated thrombocytopenia):
در 30%-10% از بیمارانی که هپارین دریافت میکنند ، به شکل ترومبوسیتوپنی خفیف، طی دو یا سه روز بعد از دریافت هپارین، تظاهر پیدا میکند. مکانیسم آن هنوز کاملاً شناخته نشده است اما احتمالاً ناشی از اثر آگلوتینهکنندگی هپارین بر روی پلاکتها بوده و با مکانیسمهای غیر ایمیون ایجاد میشود. در این نوع، شمارش پلاکتها حتی با ادامه درمان هپارین به طور خود به خود طبیعی شده و مهمتر این که با خطر ترومبوز همراه نمیباشد(7).
نوع 2 یا ترومبوسیتوپنی ناشی از هپارین (HIT):
معمولاً در 5%-1% از بیماران تحت درمان با هپارین رخ داده و یک بیماری تهدیدکننده حیات با مکانیسم ایمیون میباشد و امروزه واژه ترومبوسیتوپنی ناشی از هپارین (HIT) برای این نوع به کار میرود. با توجه به خطر بالای ترومبـوز و مـرگ و میـر متعاقب آن، در صورت شک و یا
تشخیص این نوع ترومبوسیتوپنی، تزریق هپارین باید سریعاً متوقف گردیده و از ضد انعقادهای جایگزین برای جلوگیری از بروز رخ دادهای ترومبوتیک استفاده شود.
موارد معدود ولی بسیار خطرناکی از HIT وجود دارد که به نام HIT خودبهخودی یا اتوایمیون(spontaneous HIT syndrome) نامیده میشود. این نوع HIT در غیاب مواجهه با هپارین رخ میدهد و بیشتر بعد از اعمال جراحی بزرگ(به ویژه بعد از تعویض زانو) و در عفونتهای اخیر مشاهده شده و برخلاف HIT معمول که شمارش پلاکت معمولاً در حدود 2 تا 5 روز بعد از شروع درمان با ضد انعقاد جایگزین افزایش پیدا میکند، این نوع از HIT میتواند برای هفتهها علیرغم قطع هپارین ادامه یابد(10-7).
الگوهای شروع HIT :
سه نوع الگو برای شروع HIT وجود دارد:
1- الگوی معمول ترومبوسیتوپنی در HIT (Typical-onset HIT)؛ که تقریباً 60% موارد را به خود اختصاص میدهد و در روزهای 5 تا 10 بعد از شروع هپارین درمانی رخ میدهد.
2- الگوی سریع(Rapid-onset HIT)؛ در بیمارانی که در طی 90 روز گذشته(به ویژه 30 روز گذشته) هپارین دریافت نمودهاند، به دلیل حضور آنتیبادیهای در گردش بلافاصله در مواجهه مجدد با هپارین رخ داده و معمولاً 30% موارد را به خود اختصاص میدهد. در این الگو، HIT میتواند با رخداد آنافیلاکتوئیدی که متعاقب تزریق داخل وریدی هپارین رخ میدهد، پیچیده شود.
3- الگوی تاخیری HIT (Delayed onset HIT)؛ در بعضی از بیماران، HIT حتی با قطع مصرف هپارین توسعه پیدا کرده و یا بدتر شده و به طور میانگین 9 روز بعد از شروع هپارین درمانی رخ میدهد. این بیماران ممکن است ترومبوز را درطی 3 هفته بعد از شروع مواجهه با هپارین بروز دهند(9، 8، 1).
پاتوفیزیولوژی HIT :
HIT یک واکنش ایمنی میباشد که مشخصـه آن تولیـد
آنتیبادی علیه کمپلکس هپارین ـ فاکتور4 پلاکتی است. فاکتور 4 پلاکتی به دلیل دارا بودن بار مثبت تمایل زیادی برای اتصال به مولکولهایی با بار منفی مانند هپارین و دیگر گلیکوز آمینوگلیکانها دارد از این رو این مولکول با هپارین در گردش، تشکیل کمپلکس هپارین- فاکتور4 پلاکتی داده که منجر به تولید آنتیبادی علیه این کمپلکس میشود. با وجود این که هر سه آنتیبادی IgG ،IgM و IgA علیه این کمپلکس تولید میگردند اما تاکنون تنها مشخص گردیده است که اتصال آنتیبادی IgG به FcγRIIa سطح پلاکتی، باعث تغییر غشای آن و تولید میکروپارتیکلهای پیش انعقادی، تومبوسیتوپنی و تسریع تولید ترومبین میگردد. با وجود این که آنتیبادیهای IgM و IgA در پاتوفیزیولوژی HIT نقش دارند اما نقش آنها کاملاً مشخص نشده است و احتمال دارد در ارتباط با ایجاد علائم بالینی نباشند. هم چنین فاکتورهای 4 پلاکتی آزاد شده از پلاکتها میتوانند به گلیکوزآمینوگلیکانهای شبه هپارینی بر سطح سلولهای اندوتلیال متصل شوند و منجر به تولید آنتیبادی علیه این کمپلکسها و در نتیجه آسیب سلولهای اندوتلیال و تولید فاکتور بافتی(Tissue factor) گردند. هم چنین این آنتیبادیها میتوانند به رسپتورهای سطح منوسیتها نیز متصل شده و باعث آزادسازی فاکتور بافتی شوند. تمامی این رویدها منجر به ایجاد شرایط پیش انعقادی گردیده که حتی با قطع مصرف هپارین میتواند برای روزها ادامه پیدا کند(شکل 1)(13-11).
شیوع، اپیدمیولوژی و فاکتورهای خطر ابتلا به HIT :
مطالعههای مختلف میزان شیوع HIT را از 1/0% تا 5% گزارش نمودهاند(17-14). این میزان شیوع با توجه به نوع هپارین(UFH یا LMWH) دریافتی و مدت زمان دریافت هپارین متفاوت بوده به طوری که بروز آن در دریافتکنندگان LMWH در مقایسه با UFH پایینتر میباشد که علت آن را به توانایی کمتر LMWH (10 برابر کمتر از UFH) در تحریک سیستم ایمنی بیماران دریافتکننده این دارو نسبت میدهند(18). همچنین میزان بروز این بیماری در دریافتکنندگان هپارین UFH با منشاء خوکی نسبت بـه

شکل 1: پاتوفیزیولوژی HIT ؛ نقش پلاکتها، کمپلکس هپارین- فاکتور 4 پلاکتی و کمپلکس آنتیبادی- فاکتور 4 پلاکتی- هپارین(19)
جدول 1: مزایا و معایب روشهای تشخیصی HIT (45)
شکل 2: الگوریتم تشخیصی ترومبوسیتوپنی ناشی از هپارین(48)
سطح طبیعی برگشت، وارفارین باید به آهستگی در دوز 5 میلیگرم یا کمتر، روزانه و به تدریج تجویز شود تا به INR
2 تـا 3 برسـد. استفـاده هـم زمان از مهارکنندههای مستقیم ترومبین وآنتاگونیستهای ویتامین K به ویژه آرگاتروبان که باعث افزایش در INR میشود، میتواند چالشبرانگیز باشد (51، 50).
تزریق پلاکت:
برخلاف وجود ترومبوسیتوپنی شدید در HIT، خونریزی خود به خودی در این بیماران شایع نمیباشد. با این وجود بیماران HIT نیازمند روشهای تهاجمی، ممکن است به صورت پروفیلاکسی جهت کاهش خطر خونریزی نیازمند تزریق پلاکت باشند. گزارشهای متعددی در مورد تزریق پلاکت به بیماران HITوجود دارد که این تزریق را به اضافه کردن سوخت بر روی آتش که منجر به تشدید ترومبوز میگردد، تشبیه نمودهاند. با این وجود هنوز شواهد حمایتکننده مستقیمی در مورد افزایش خطر ترومبوز در بیماران با HIT که تحت تزریق پلاکت قرار گرفتهاند وجود ندارد اما از طرف دیگر شواهد برای حمایت از تزریق پلاکت در این گروه از بیماران بسیار محدود میباشد(52، 11).
تعویض پلاسما:
تا قبل از استفاده از مهارکنندههای مستقیم ترومبین، از تعویض پلاسما برای درمان HIT حاد استفاده میشد اما بعد از ظهور این داروها، این روش تنها در زمانهای کوتاهی برای کاهش میزان تیتر آنتیبادی علیه کمپلکس Heparin-PF4، در بیمارانی که در معرض دوباره هپارین
قرار میگرفتند و به منظور کاهش خطر بروز رخدادهای ترومبوتیک استفاده شد. اگر چه هنوز بهترین زمان استفاده از تعویض پلاسما تعیین نشده است، با این وجود در مواردی که دسترسی به گزینههای درمانی وجود نداشته و یا مقاومت به مهارکننده های مستقیم ترومبین وجود دارد و همچنین در زمان بروز عوارضی مانند خونریزی ناشی از مصرف این داروها میتوان از این روش بهره گرفت(52).
نتیجهگیری
بررسی مقالات منتشر شده در چند سال اخیر نشان میدهد ترومبوسیتوپنی ناشی از هپارین، همچنان یک عارضه جانبی خطرناک ناشی از درمان با هپارین بوده و نیازمند تشخیص صحیح و به موقع میباشد. از آنجا که این عارضه یک رخداد بالینی-آزمایشگاهی است، در این مطالعه در مرحله اول توجه دقیق به علائم بالینی بیماران با استفاده از سیستمهای ارزیابی بالینی شرح داده شد و سپس انجام تستهای آزمایشگاهی مناسب(آزمایشهای ایمونولوژیک و سپس در صورت لزوم انجام آزمایشهای عملکردی) برای جلوگیری از تشخیص بیش از حد و یا عدم تشخیص HIT که از اهمیت زیادی برخوردار میباشد، توضیح داده شد. با توجه به جمعیت 80 میلیونی کشور ایران و میزان شیوع 1تا 5 درصدی این بیماری بالاقوه خطرناک در میان جمعیتهای مختلف بیماران دریافتکننده داروی هپارین و همچنین عدم ارائه پنل کامل تشخیص آزمایشگاهی این بیماری در کشور ایران، راهاندازی یک آزمایشگاه مرجع ارائهدهنده آزمایشهای آزمایشگاهی(ایمنولوژیک و عملکردی) ضروری به نظر میرسد.
متن کامل: (26008 مشاهده)
ترومبوسیتوپنی ناشی از هپارین
معصومه شهبازی1، مینو احمدینژاد2
چکیده
سابقه و هدف
هپارین یکی از شایعترین داروهای ضد انعقاد مورد استفاده برای پیشگیری و درمان حوادث ترومبوآمبولیک است که توسط پزشکان تجویز میگردد. ترومبوسیتوپنی ناشی از هپارین یا HIT ، عارضهای نادر ولی تهدید کننده حیات، ناشی از مصرف هپارین میباشد. تشخیص HIT بر اساس دو پایه اصلی، ارزیابی بالینی و بررسیهای آزمایشگاهی بنا شده است. هدف از این مقاله مروری، بررسی فاکتورهای خطر، علائم بالینی، پاتوفیزیولوژی، روشهای تشخیصی و درمان HIT بود.
مواد و روشها
در این مطالعه به جستجوی مقالات مرتبط در پایگاههای اطلاعاتی مانند Pub Med با استفاده از کلید واژههای هپارین، ترومبوسیتوپنی ناشی از هپارین، پاتوفیزیولوژی، تشخیص و درمان در بازه زمانی 1997 تا 2018 پرداخته شد.
یافتهها
این بیماری همچنان یک رخداد تهدیدکننده حیات بوده که در اثر ایجاد آنتیبادی علیه کمپلکس هپارین-PF4 ایجاد میشود و در صورت فعالسازی پلاکتها میتواند منجر به رخدادهای ترومبوتیک خطرناکی در بیماران گردد. همچنین روشهای تشخیصی آزمایشگاهی اهمیت فراوانی در رد یا تایید تشخیص این بیماری کشنده داشته و لذا انجام آنها در بیمارانی که به لحاظ بالینی مشکوک به این عارضه هستند، ضروری است.
نتیجه گیری
امروزه با شناخت بهتر پاتوفیزیولوژی بیماری و هم چنین با پیشرفتهای حاصله در سرعت و دقت روشهای تشخیصی آزمایشگاهی، تحولی مهم در تشخیص سریعتر این بیماری به وجود آمده است.
کلمات کلیدی: هپارین، ترومبوسیتوپنی، تشخیص
تاریخ دریافت: 11/10/97
تاریخ پذیرش: 22/2 /98
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: متخصص آسیبشناسی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
معصومه شهبازی1، مینو احمدینژاد2
چکیده
سابقه و هدف
هپارین یکی از شایعترین داروهای ضد انعقاد مورد استفاده برای پیشگیری و درمان حوادث ترومبوآمبولیک است که توسط پزشکان تجویز میگردد. ترومبوسیتوپنی ناشی از هپارین یا HIT ، عارضهای نادر ولی تهدید کننده حیات، ناشی از مصرف هپارین میباشد. تشخیص HIT بر اساس دو پایه اصلی، ارزیابی بالینی و بررسیهای آزمایشگاهی بنا شده است. هدف از این مقاله مروری، بررسی فاکتورهای خطر، علائم بالینی، پاتوفیزیولوژی، روشهای تشخیصی و درمان HIT بود.
مواد و روشها
در این مطالعه به جستجوی مقالات مرتبط در پایگاههای اطلاعاتی مانند Pub Med با استفاده از کلید واژههای هپارین، ترومبوسیتوپنی ناشی از هپارین، پاتوفیزیولوژی، تشخیص و درمان در بازه زمانی 1997 تا 2018 پرداخته شد.
یافتهها
این بیماری همچنان یک رخداد تهدیدکننده حیات بوده که در اثر ایجاد آنتیبادی علیه کمپلکس هپارین-PF4 ایجاد میشود و در صورت فعالسازی پلاکتها میتواند منجر به رخدادهای ترومبوتیک خطرناکی در بیماران گردد. همچنین روشهای تشخیصی آزمایشگاهی اهمیت فراوانی در رد یا تایید تشخیص این بیماری کشنده داشته و لذا انجام آنها در بیمارانی که به لحاظ بالینی مشکوک به این عارضه هستند، ضروری است.
نتیجه گیری
امروزه با شناخت بهتر پاتوفیزیولوژی بیماری و هم چنین با پیشرفتهای حاصله در سرعت و دقت روشهای تشخیصی آزمایشگاهی، تحولی مهم در تشخیص سریعتر این بیماری به وجود آمده است.
کلمات کلیدی: هپارین، ترومبوسیتوپنی، تشخیص
تاریخ دریافت: 11/10/97
تاریخ پذیرش: 22/2 /98
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: متخصص آسیبشناسی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
هپارین با وزن مولکولی بالا (UFH: Unfractionated heparin) و سایر مشتقات آن مانند هپارین با وزن مولکولی پایین(LMWH: Low molecular weight heparin) در میان بیشترین داروهای تجویز شده در سراسر جهان قرار دارند. علیرغم این که در سالهای اخیر، داروهای ضد انعقادی جدیدی معرفی شدهاند اما هم چنان هپارین به عنوان داروی مورد علاقه پزشکان به دلیل ویژگیهای مطلوبی مانند شروع عملکرد سریع، توانایی مهار پروتئینهای انعقادی، متنوع، آسان بودن مانیتورینگ و برگشت، به عنوان پیشرو در پروفیلاکسی و درمان بسیاری از شرایط بالینی از جمله: جراحی قلب و عروق و روشهای تهاجمی (cardiovascular surgery and invasive procedures)، سندرومهای حاد کرونری(acute coronary syndromes)، ترومبوآمبولیسم وریدی(venous thromboembolism)، فیبریلاسیون دهلیزی(atrial fibrillation)، بیماری انسداد محیطی(peripheral occlusive disease)، در موارد گردش خون در خارج از بدن(extracorporeal circulation) و دیالیز(dialysis) استفاده شده و پیشبینی میشود استفاده از این دارو در آینده نیز ادامه پیدا کند(2، 1).
ترومبوسیتوپنی ناشی از هپارین(HIT ؛ Heparin Induced Thrombocytopenia)، یکی از عوارض خطرناک درمان با داروی هپارین بوده و از آن جا که میتواند منجر به فعالسازی پلاکتها شود، خطر ایجاد ترومبوز و مرگ و میر متعاقب آن وجود دارد. از آن جا که HIT یک سندروم بالینی- آزمایشگاهی میباشد، تشخیص آن باید بر اساس یافتههای بالینی و نتایج تستهای آزمایشگاهی صورت گیرد و استفاده تنها از هر کدام از آنها میتواند منجر به عدم تشخیص(miss diagnosis) و یا تشخیص بیش از حد واقعی(over-diagnosis) این پدیده گردد(4، 3). در این مقاله مروری، خوانندگان با پیشرفتهای اخیر در مورد پاتوفیزیولوژی، علائم بالینی، روشهای ارزیابی بالینی، تستهای آزمایشگاهی و دارودرمانی HIT آشنا خواهند شد.
چرا HIT مهم است؟
سالانـه حـدود 12 میلیون بیمار در آمریکا تحت درمـان
با هپارین قرار میگیرند و از آن جا که HIT میتواند به صورت رخدادهای ترومبوتیک بسیار مخرب بروز نماید، این رخدادها باعث شده HIT در میان واکنشهای نامطلوب دارو درمانی، جایگاه ویژهای داشته باشد. تخمین زده میشود سالانه حدود 600 هزار مورد جدید HIT در ایالت متحده امریکا رخ داده که تقریباً در حدود نیمی از آنها رخدادهای ترومبوتیک بروز مییابد و حدود 90 هزار بیمار دچار مرگ میشوند که این آمار قابل مقایسه با آمار سالانه 260 هزار مورد جدید سرطان تهاجمی پستان در ایالت متحده میباشد. از طرفی HIT عارضهای پر هزینه میباشد به طوری که در آمریکا میزان ضرر مالی بالقوه آن 33 تا 100 میلیون دلار تخمین زده میشود(6، 5). علیرغم اهمیت این بیماری، تاکنون کمتر از 10 مقاله در خصوص این بیماری یا گزارش موردی آن از ایران به چاپ رسیده است که در متن به نتایج برخی از آنها اشاره خواهد شد.
تعریف ترومبوسیتوپنی ناشی از هپارین:
دو نوع ترومبوسیتوپنی ناشی از هپارین تعریف شده است:
نوع 1 یا ترومبوسیتوپنی همراه با هپارین (HAT: heparin-associated thrombocytopenia):
در 30%-10% از بیمارانی که هپارین دریافت میکنند ، به شکل ترومبوسیتوپنی خفیف، طی دو یا سه روز بعد از دریافت هپارین، تظاهر پیدا میکند. مکانیسم آن هنوز کاملاً شناخته نشده است اما احتمالاً ناشی از اثر آگلوتینهکنندگی هپارین بر روی پلاکتها بوده و با مکانیسمهای غیر ایمیون ایجاد میشود. در این نوع، شمارش پلاکتها حتی با ادامه درمان هپارین به طور خود به خود طبیعی شده و مهمتر این که با خطر ترومبوز همراه نمیباشد(7).
نوع 2 یا ترومبوسیتوپنی ناشی از هپارین (HIT):
معمولاً در 5%-1% از بیماران تحت درمان با هپارین رخ داده و یک بیماری تهدیدکننده حیات با مکانیسم ایمیون میباشد و امروزه واژه ترومبوسیتوپنی ناشی از هپارین (HIT) برای این نوع به کار میرود. با توجه به خطر بالای ترومبـوز و مـرگ و میـر متعاقب آن، در صورت شک و یا
تشخیص این نوع ترومبوسیتوپنی، تزریق هپارین باید سریعاً متوقف گردیده و از ضد انعقادهای جایگزین برای جلوگیری از بروز رخ دادهای ترومبوتیک استفاده شود.
موارد معدود ولی بسیار خطرناکی از HIT وجود دارد که به نام HIT خودبهخودی یا اتوایمیون(spontaneous HIT syndrome) نامیده میشود. این نوع HIT در غیاب مواجهه با هپارین رخ میدهد و بیشتر بعد از اعمال جراحی بزرگ(به ویژه بعد از تعویض زانو) و در عفونتهای اخیر مشاهده شده و برخلاف HIT معمول که شمارش پلاکت معمولاً در حدود 2 تا 5 روز بعد از شروع درمان با ضد انعقاد جایگزین افزایش پیدا میکند، این نوع از HIT میتواند برای هفتهها علیرغم قطع هپارین ادامه یابد(10-7).
الگوهای شروع HIT :
سه نوع الگو برای شروع HIT وجود دارد:
1- الگوی معمول ترومبوسیتوپنی در HIT (Typical-onset HIT)؛ که تقریباً 60% موارد را به خود اختصاص میدهد و در روزهای 5 تا 10 بعد از شروع هپارین درمانی رخ میدهد.
2- الگوی سریع(Rapid-onset HIT)؛ در بیمارانی که در طی 90 روز گذشته(به ویژه 30 روز گذشته) هپارین دریافت نمودهاند، به دلیل حضور آنتیبادیهای در گردش بلافاصله در مواجهه مجدد با هپارین رخ داده و معمولاً 30% موارد را به خود اختصاص میدهد. در این الگو، HIT میتواند با رخداد آنافیلاکتوئیدی که متعاقب تزریق داخل وریدی هپارین رخ میدهد، پیچیده شود.
3- الگوی تاخیری HIT (Delayed onset HIT)؛ در بعضی از بیماران، HIT حتی با قطع مصرف هپارین توسعه پیدا کرده و یا بدتر شده و به طور میانگین 9 روز بعد از شروع هپارین درمانی رخ میدهد. این بیماران ممکن است ترومبوز را درطی 3 هفته بعد از شروع مواجهه با هپارین بروز دهند(9، 8، 1).
پاتوفیزیولوژی HIT :
HIT یک واکنش ایمنی میباشد که مشخصـه آن تولیـد
آنتیبادی علیه کمپلکس هپارین ـ فاکتور4 پلاکتی است. فاکتور 4 پلاکتی به دلیل دارا بودن بار مثبت تمایل زیادی برای اتصال به مولکولهایی با بار منفی مانند هپارین و دیگر گلیکوز آمینوگلیکانها دارد از این رو این مولکول با هپارین در گردش، تشکیل کمپلکس هپارین- فاکتور4 پلاکتی داده که منجر به تولید آنتیبادی علیه این کمپلکس میشود. با وجود این که هر سه آنتیبادی IgG ،IgM و IgA علیه این کمپلکس تولید میگردند اما تاکنون تنها مشخص گردیده است که اتصال آنتیبادی IgG به FcγRIIa سطح پلاکتی، باعث تغییر غشای آن و تولید میکروپارتیکلهای پیش انعقادی، تومبوسیتوپنی و تسریع تولید ترومبین میگردد. با وجود این که آنتیبادیهای IgM و IgA در پاتوفیزیولوژی HIT نقش دارند اما نقش آنها کاملاً مشخص نشده است و احتمال دارد در ارتباط با ایجاد علائم بالینی نباشند. هم چنین فاکتورهای 4 پلاکتی آزاد شده از پلاکتها میتوانند به گلیکوزآمینوگلیکانهای شبه هپارینی بر سطح سلولهای اندوتلیال متصل شوند و منجر به تولید آنتیبادی علیه این کمپلکسها و در نتیجه آسیب سلولهای اندوتلیال و تولید فاکتور بافتی(Tissue factor) گردند. هم چنین این آنتیبادیها میتوانند به رسپتورهای سطح منوسیتها نیز متصل شده و باعث آزادسازی فاکتور بافتی شوند. تمامی این رویدها منجر به ایجاد شرایط پیش انعقادی گردیده که حتی با قطع مصرف هپارین میتواند برای روزها ادامه پیدا کند(شکل 1)(13-11).
شیوع، اپیدمیولوژی و فاکتورهای خطر ابتلا به HIT :
مطالعههای مختلف میزان شیوع HIT را از 1/0% تا 5% گزارش نمودهاند(17-14). این میزان شیوع با توجه به نوع هپارین(UFH یا LMWH) دریافتی و مدت زمان دریافت هپارین متفاوت بوده به طوری که بروز آن در دریافتکنندگان LMWH در مقایسه با UFH پایینتر میباشد که علت آن را به توانایی کمتر LMWH (10 برابر کمتر از UFH) در تحریک سیستم ایمنی بیماران دریافتکننده این دارو نسبت میدهند(18). همچنین میزان بروز این بیماری در دریافتکنندگان هپارین UFH با منشاء خوکی نسبت بـه

شکل 1: پاتوفیزیولوژی HIT ؛ نقش پلاکتها، کمپلکس هپارین- فاکتور 4 پلاکتی و کمپلکس آنتیبادی- فاکتور 4 پلاکتی- هپارین(19)
هپارین با منشاء گاوی کمتر است. HIT در میان بیماران جراحی شایعتر از بیماران داخلی(Medical patients) میباشد و بالاترین بروز را در بیماران ارتوپدی(5%-3%) و سپس در بیماران جراحی قلب(3%-1%) و کمترین بروز را در گروه جراحیهای زنان و زایمان دارد(کمتر از 1%). هم چنین خطر بروز این عارضه در زنان تقریباً دو برابر مردان میباشد(17-14).
در حالی که میزان بروز سندرمHIT در بیماران دریافتکننده هپارین در بالا ذکر شده، لیکن باید مطلع باشیم که شیوع آنتیبادیهای ضد کمپلکس هپارین- فاکتور 4 پلاکتی بسیار بالاتر از درصدهای گزارش شده میباشد به طوری که در 50%-7% از کل بیماران تحت درمان با هپارین، میتوان آنتیبادی علیه کمپلکس هپارین-فاکتور 4 پلاکتی را یافت اما نهایتاً سندرم HIT فقط در تعداد کمی از این بیماران بروز پیدا میکند(11).
هم چنین در مطالعهای که توسط شهبازی و همکارانش بر روی بیماران جراحی قلب در ایران انجام شد، میزان فراوانی این پدیده را در این گروه 4/5% گزارش نمودند(20).
علائم بالینی:
1- ترومبوسیتوپنی:
ترومبوسیتوپنی حاد تقریباً یک هفته بعد از شروع هپارین درمانی، به عنوان مهمترین علامت بالینی HIT در نظر گرفته میشود و تقریباً در 95% از بیماران HIT ، در طول دوره بیماریشان اتفاق میافتد. افت 50% شمارش پلاکت بیمار از مقدار پایه به عنوان مهمترین یافته بیماری بوده که در 90% بیماران سطح پلاکت به زیر 109× 150 (یعنی به سطح مورد نظر در تعریف متداول ترومبوسیتوپنی) و در اغلب بیماران بالای 109 × 55 میرسد. در تعداد اندکی از بیماران، افت 50% شمارش پلاکت با توجه به تعداد پلاکت در ابتدای شروع درمان با هپارین(سطح پایه) در سطحی خواهد بود که در تعریف معمول ترومبوسیتوپنی قرار نمیگیرد. به همین دلیل اطلاع از سطح پلاکت پایه در تشخیص بیماری از اهمیت ویژهای برخوردار است(21، 8).
در کمتر از 5% از بیماران با HIT ، شمارش پلاکت کمتر از 109× 20 میباشد. ترومبوسیتوپنی شدیـد در HIT بـا خطـر بالایـی از همراهـی بـا رخـدادهـای تـرومبوتیک
است(22).
با توجه به شیوع بالای ترومبوسیتوپنی در بیماران بستری، زمانی که تنها علامت بالینی بیمار کاهش پلاکت میباشد، بایستی سایر تشخیصهای افتراقی در نظر گرفته شود که شامل؛ بیماران بستری در بخش مراقبتهای ویژه ICU (در46%-38% این بیماران، ترومبوسیتوپنی دیده میشود)، آمبولیسم حاد ریوی، مرحله آخر بیماری کلیوی، سپسیس، بیماران با عمل جراحی بایپس قلبی ـ ریوی اخیر و عوارض دارویی میباشد(16).
2- ترومبوز:
خطرناکترین یافته HIT ، ترومبوز است که در 57%-29% از بیماران با HIT میتواند رخ دهد. تا قبل از دسترسی به درمانهای رایج، حدود 9% از رخدادهای ترومبوتیک ناشی از HIT منجر به قطع عضو و 16% منجر به مرگ میگردید(22).
ترومبوز وریدهای عمقی با یا بدون آمبولیسم ریوی شایعترین ترومبوزهای ناشی از HIT میباشند(50% از بیماران). ترومبوزهای ورید اندام فوقانی معمولاً کمتر رخ داده و در ارتباط با استفاده همزمان یا مکرر از کاتترهای درون عروقی میباشد(22). ترومبوزهای وریدی نسبت به ترومبوزهای سرخرگی در بیماران داخلی(medical patients) و یا بعد از عمل جراحی ارتوپدی غالب بوده در حالی که به دنبال اعمال جراحی قلب و عروق در HIT این نسبت مشابه است(16).
ترومبوزهای کمتر معمول، شامل ترومبوز وریدهای مغزی(سینوس دورال) و احشایی(مزانتریک و آدرنال) میباشند. ترومبوز ورید آدرنال تقریباً در 2% از بیماران رخ داده و به شکل انفارکتوس خونریزیدهنده آدرنال خود را نشان میدهد. وقتی که نکروز آدرنال دو طرفه باشد، میتواند منجر به نارسایی حاد آدرنال گردد.
در 20%-10% بیماران، نکروز پوستی در محل تزریق هپارین رخ داده که به عنوان یکی از حوادث ترومبوتیک در نظر گرفته میشود.
ترومبوزهای سرخرگی در HIT شامل: مغزی، کرونری،
مزانتریک، سرخرگهای براکیال و اندام تحتانی هستند.
در 5% بیماران، نکروز ایسکمیک اندام، دیـده شـده کـه
این موضوع غالباً مرتبط با استفاده از وارفارین و نتیجتاً کاهش پروتئین C بوده و منجر به ایجاد میکروترمبوز میگردد(23-21، 15).
بررسی بالینی HIT ( قبل از انجام تستهای آزمایشگاهی)، ابزار ارزیابی بالینی:
به دلیل مصرف گسترده هپارین در بیماران بستری شـده
در بیمارستان و هم چنین فراوانی ترومبوسیتوپنی(50%-30%) در این گروه از بیماران به دلایل متعدد که موجب هم زمانی مصرف هپارین و ترومبوسیتوپنی میگردد، ضروری است روشهای تشخیصی مطمئنی برای تشخیص و یا رد HIT در بیماران در نظر گرفته شود. از آن جایی که روشهای آزمایشگاهی خود دارای محدودیتهای مهمی در تشخیص HIT بوده و استفاده از آنها در قدم اول تشخیص این بیماری منجر به تشخیص بیش از حد واقعی و در برخی موارد منجر به عدم تشخیص میگردد ضروری است بیماران در مرحله اول، به عنوان اولین و مهمترین گام تشخیصی، بر اساس یافتههای بالینی ارزیابی گردند(26-23، 17). به همین دلیل روشهای متعددی برای ارزیابی بیمار مظنون به HIT پیشنهاد گردیده است که شامل:
1-4Ts score :
رایجترین و مهمترین سیستم امتیازدهی بالینی مورد استفاده میباشد که اولین بار در سال 2003 توسط وارکنتین و همکارانش در دانشگاه مک مستر کانادا پیشنهاد گردید. اعتبار این سیستم بعدها در مطالعههای زیادی مورد ارزیابی قرار گرفت و مشاهده گردید این سیستم جهت تشخیص اولیه HIT از اعتبار بالایی برخوردار میباشد. این سیستم به بررسی 4 ویژگی مشخص HIT میپردازد. 1) ترومبوسیتوپنی 2) زمان شروع افت پلاکت 3) حضور ترومبوز(یا سایر عوارض بالینی) 4) عدم حضور سایر علل ترومبوسیتوپنی .
هر کدام از این پارامترها، امتیازی بین 2-0 را کسب کرده و جمع نهایی امتیازها از صفر تا 8 متفاوت است. امتیازها در سه گروه امتیاز پایین (3-1)، امتیاز متوسط (4-5) و امتیاز بالا(8-6) طبقهبندی میشود. مطالعههای مختلفی ارزش پیشآگهی دهنده منفی (Negative Predictive Value: NPV)4Ts score را بالا (8/99%) گزارش کردهاند به طوری که در اغلب مطالعهها این گونه نتیجهگیری شده که امتیاز کمتر از 3 با قاطعیت بالایی تشخیص HIT را رد میکند و این در حالی است که ارزش پیشآگهی دهنده مثبت(Positive Predictive Value PPV) برای امتیاز متوسط 20%-10% و برای امتیاز بالا، 80%-40% میباشد، بنابراین زمانی که بیمار دارای امتیاز بالینی متوسط و بالا میباشد، تایید تشخیص باید به روشهای آزمایشگاهی صورت گیرد تا تشخیص HIT از صحت بالایی برخوردار شود(29-27).
تاکنون در ایران مطالعههای معدودی در زمینه HIT صورت گرفته که در غالب آنها روش تشخیصی HIT به دلیل محدودیتهای دسترسی به تستهای آزمایشگاهی، صرفاً بر اساس ارزیابی بالینی بوده و در اکثریت آنها صرفاً از روش ارزیابی بالینی4Ts score استفاده شده است. این مطالعهها طراحیهای متفاوتی داشته و در جامعههای آماری متفاوتی بررسی شدهاند. نتایج آنها مؤید 85/0% تا 6/15% تواتر HIT بوده است(31، 30). در مطالعهای که شهبازی و همکاران در سال 95 بر روی 92 بیمار تحت عمل جراحی قلب در بیمارستان شهید مدرس تهران انجام دادند، برای ارزیابی HIT از روش 4Ts score و بررسی آزمایشگاهی ELISA استفاده نمودند. در این مطالعه یکی از یافتههای قابل تعمق، عدم ثبت نتایج4Ts score (البته در صورت محاسبه پزشک) در پروندههای بیماران بود.
محققین در این مطالعه بر اساس اطلاعات پرونده بیماران به محاسبه4Ts score پرداخته و بر اساس همین بررسی، احتمال تشخیص HIT در 14 بیمار(2/15%) مطرح گردید. پس از افزودن بررسی آزمایشگاهیAnti PF4/Heparin Ab به روش ایمونواسی برای ارزیابی احتمال HIT در این 14 بیمار، در 8 بیمار(6/8%) آزمایش مثبت بود و این موضوع اهمیت تشخیص بر اساس دو بازوی ارزیابی بالینی و ارزیابی آزمایشگاهی را نشان میدهد(25).
2) HEP score(HIT expert probability score):
در تلاش برای بهبود اختصاصیت و ارزش پیشآگهی دهنده مثبت 4Ts score ، روش HIT expert probability (HEP) با استفاده از نظر کارشناسان توسعه یافت. در این مدل از 26 کارشناس خواسته شد تا به 8 ویژگی بالینی HIT (1- شدت افت پلاکت،2- زمان افت پلاکت،3- مرز شمارش پلاکتی،4- ترومبوز، 5- نکروز پوستی، 6- واکنش حاد سیستمیک، 7- خونریزی و 8- سایر علل ترومبوسیتوپنی) امتیازی بین 3- (شدیداً به نفع رد تشخیص HIT) تا 3+ ( شدیداً به نفع تشخیص HIT) اختصاص دهند(20). در یک مطالعه گذشتهنگر امتیاز آستانه 5 (5 : (cut off در ارتباط با ارزش پیشآگهی دهنده مثبت 55% (%82-25%) و ارزش پیشآگهی دهنده منفی 97% (%100-85%) گزارش گردید که مشابه ارزش پیشآگهی دهنده 4Ts score است(31). با این وجود بر خلاف 4Ts score که برای انجام، تقریباً راحت میباشد این روش پیچیدهتر بوده و استفاده از آن پر زحمتتر است اما برای بیماران ICU و پزشکان با تجربه کمتر مناسب بوده و تایید صحت این روش نیازمند مطالعههای آیندهنگر زیادی میباشد(32، 20).
سیستم امتیازدهی بالینی در جراحی قلب(Lillo-Le Louet):
چالش برانگیزترین زمینه برای تشخیص HITاز سایر علل ترومبوسیتوپنی در جراحی قلب میباشد چرا که عوامل خطر متعددی برای کاهش پلاکت وجود دارد که باعث پیچده شدن تشخیص HIT میشود. از جمله این عوامل میتوان به اثر ترقیقی، عفونت/انعقاد داخل عروقی منتشر(DIC)، شوک کاردیوژنیک، وسیلههای مکانیکی و داروهای مختلف اشاره کرد. هم چنین افزایش خطر ترومبوز تا 20% و شیوع بالای آنتیبادی علیه کمپلکس هپارین- فاکتور 4 پلاکتی(70%-25%).در این گروه از بیماران مشاهده میشود(20). با وجود بالا بودن این عوامل، خطر بروز HIT بعد از عمل جراحی قلب پایین میباشد(2%-6/0%). به دلیل مشکل بودن تشخیص HIT بعد از عمل جراحی قلب، لیلولی لوئت و همکارانش سه متغیر غیر وابسته بالینی را در زمینه تشخیص HIT شناسایی کردند که شامل: 1) الگوی افت پلاکت، 2) مدت زمان عمل جراحی بایپس قلبی ـ ریوی تا زمان ظن به HIT و 3) طول مدت عمل بایپس قلبی ـ ریوی بود. آنها مشاهده کردند بیمارانی که HIT را بعد از عمل جراحی قلب بروز میدهند، دارای الگوی دو فازه مشخص در بازگشت شمارش پلاکت میباشند به طوری که در الگوی نوع یک، شمارش پلاکت در 2 تا 4 روز بعد از عمل جراحی کاهش یافته سپس به حد طبیعی و یا بالاتر از حد طبیعی بر میگردد که این پدیده به طور معمول بعد از عمل جراحی قلب اتفاق میافتد ولی در صورتی که دوباره افت پیدا کند، این موضوع به دلیل توسعه آنتیبادیهای HIT میباشد و در صورتی که این ترومبوسیتوپنی بیش از 5 روز ادامه پیدا کند، الگوی نوع 2 خوانده میشود. بر اساس این مشاهدات امتیازی به هر یک از الگوهای افت پلاکتی تعلق میگیرد(الگوی افت پلاکت نوع یک: 2 امتیاز و الگوی افت پلاکتی نوع دو: 1 امتیاز).
متغیرهای دیگر نیز امتیازاتی کسب کرده که شامل طول زمان، از هنگام عمل جراحی قلب تا ظن به HIT (≤ 5 روز: 2 امتیاز و > 5 روز: 0 امتیاز) و طول عمل جراحی(≥ 118 دقیقه: 1 امتیاز و < 118 دقیقه: 0 امتیاز) میباشند. مجموع امتیازاتی که بیمار از این سیستم میگیرد، از0 تا 5 است. آنها مشاهده کردند امتیاز ≤ 2 در ارتباط با احتمال بالایی از HIT بوده(ارزش پیشآگهیدهنده مثبت بالا (62%PPV: ) در حالی که امتیاز ≤5 در ارتباط با احتمال بسیار بالاتری میباشد(95% PPV:). در یک مطالعه به مقایسه این سیستم با 4Ts score پرداخته شد و مشاهده گردید هر دو سیستم PPV پایینی داشته اما این سیستم ارزش پیشآگهی دهنده منفی )78%(NPV= پایینتری از 4Ts score (91%) دارد. محققان نتیجه گرفتند با وجود این که عملکرد تشخیصی هر دو سیستم امتیازدهی، پایین است اما الگوی پلاکتی نوع 1 بعد از عمل جراحی قلب به عنوان قویترین پیشگویی کننده HIT در این شرایط می باشد(34، 32).
تستهای آزمایشگاهی:
انجـام تسـتهـای آزمـایشگاهـی جهـت تاییـد و یا رد
تشخیص HIT به ویژه در بیماران با امتیاز بالینی متوسط و بالا ضروری میباشد. به دلیل فراوانی بالای آنتیبادی علیه کمپلکس Heparin-PF4 در بعضی از جمعیتهای بیماران (مانند بعد ازعمل جراحی قلب)، از این تستها نباید جهت غربالگری بیماران استفاده کرد. تستهای آزمایشگاهی جهت تشخیص HIT به طور کلی شامل دو دسته تستهای ایمنولوژیک و عملکردی میباشند(16) (جدول 1).
1- آزمایشهای ایمنولوژیک:
این دسته از آزمایشها کلیه آنتیبادیهایی را که علیه کمپلکس Heparin-PF4ساخته شده شناسایی میکنند، اما قادر به افتراق آنتیبادیهایی که توانایی فعالسازی پلاکتها را دارند، از سایر موارد پاتولوژیک ندارند.
حساسیت بالا، سهولت و سرعت انجام، سبب گردیده است بیشتر آزمایشگاههای بالینی از این دسته از آزمایشها جهت تشخیص HIT استفاده کنند(34). انواع مختلفی از آزمایشهای ایمنولوژیک وجود دارد که خود به دو دسته (ELISA) Enzyme linked immunosorbant assay و آزمایشهای سریع از جمله Particle-based immunoassays (PaGIA) تقسیم میشوند(36).
آزمایش الایزا دارای حساسیت(99%) و NPV بالایی میباشد بنابراین در بیشتر مواقع نتیجه منفی این آزمایش بیانگر رد بودن تشخیص HIT است. دلیل این که ارزش پیشآگهی دهنده منفی ELISA نمیتواند 100% باشد(99%-98%) میتواند به علت شناسایی آنتیبادیهای کمتر پاتولوژیک(مانند IgM وIgA) در بعضی از کیتها بوده و از طرفـی آنتیبادیهـای HIT همواره علیه کمپلکس Heparin-PF4 نبوده و گاهی اوقات این آنتیبادیها علیه عوامل فعالکننده پلاکتی مانند اینترلوکین 8 (IL-8) و پپتید فعالکننده 2 نوترفیل(NAP-2) ایجاد میشوند که کیتهای ELISA در حال حاضر قادر به شناسایی این دسته از آنتیبادیها نمیباشند(16).
بـا ایـن وجــود اختصاصیت این آزمایشها تقریباً پایین
بوده(70%-30%) و بیانگر این است که بیماران با علائم بالینی HIT که نتیجه آزمایش ELISA آنها مثبت شده است، الزاماً دارای آنتیبادیهای پاتولوژیک مرتبط با HIT نبوده (موارد مثبت کاذب بالا) و نیاز به انجام آزمایشهای تکمیلی جهت تشخیص قطعی HIT میباشد. روشهای مختلفی برای افزایش اختصاصیت آزمایشهای ایمنولوژیک وجود دارد که از جمله آنها میتوان به محدود کردن این آزمایشها به شناسایی آنتیبادیهای IgG و استفاده از مرحله تاییدی هپارین با غلظت بالا اشاره کرد(37). در آزمایش ELISA ، آنتیژن هدف(کمپلکسهای پلیآنیون (PF4- به یک فاز جامد مانند پلیتهای میکروتیتر متصل میشود، با اضافه کردن سرم و یا پلاسمای بیمار، در صورت وجود آنتیبادی علیه این کمپلکس در نمونه بیمار، با افزودن آنتیبادی ثانویه نشاندار شده، میتوان این اتصال را شناسایی کرد. نتیجه آزمایش ELISA به صورت شدت نوری(OD) گزارش میشود که متناسب با مقدار آنتیبادیهای موجود در نمونه بیمار بوده و مقدار بالای OD (شدت جذب نوری بالاتر از 1) معمولاً در ارتباط با احتمال خطر بالاتری برای HIT و بروز ترومبوز در این بیماران میباشد(39، 38).
2- آزمایشهای عملکردی:
گروه دوم از آزمایشهای تشخیصی HIT جهت شناسایی گروهی از آنتیبادیهای علیه کمپلکس Heparin-PF4 بوده که توانایی فعالسازی پلاکتها را داشته و لذا به عنوان آنتیبادیهای پاتولوژیک شناخته میشوند. در این گروه از آزمایشها، سرم بیمار با پلاکتهای اهداکنندگان سالم در حضور هپارین(LMWH و UFH) مجاور و انکوبه میشود. نتیجه نهایی فعال شدن پلاکتی در این آزمایشها بسته به نوع آزمایش توسط پارامترهای مختلفی مانند بررسی آزادسازی مواد رادیواکتیو، تجمع پلاکتی و یا فلوسیتومتری ارزیابی شده و به تفصیل در ادامه بحث به نحوه انجام هر کدام از این روشها پرداخته میشود.
2-1- SRA(Serotonin releasing assay) :
ایـن روش در گـروه آزمایـشهای عملکردی بـه عنوان
آزمایش استاندارد طلایی بوده و در آن فعال شدن پلاکتها
توسـط ارزیابـی آزادسازی سروتونین نشاندار شده(میزان C-Serotonin 14) بررسی میشود. این آزمایش دارای حساسیت(100%-88%) و اختصاصیت(100%-89%) بالایی بوده و معمولاً در آزمایشگاههای مرجع قادر به انجام آن میباشند(38).
در این روش پلاکتهای شسته شده با C-serotonin 14 انکوبه شده سپس پلاکتها مواد رادیو اکتیو را جذب کرده و در گرانولهای متراکم خود ذخیره میکنند. در مرحله بعد پلاکتهای شسته شده همراه با سرم بیمار و هپارین در چاهکهای میکروتیتر با انتهای مسطح به صورت دوبل بر روی شیکر پلیت انکوبه میشود. بعد از 60 دقیقه انکوباسیون و سانتریفیوژ، مایع رویی (supernatants) ترکیب واکنشی را جمعآوری کرده و رادیواکتیویته آن اندازهگیری میشود. نتایج آزمایش به صورت درصد آزادسازی سروتونین در مقایسه با حداکثر لیز پلاکتی القا شده توسط دترجنت (100%) (detergent-induced platelet lysis) بیان میگردد. آزمایشی مثبت در نظر گرفته میشود که بیش از 20% آزادسازی سروتونین در غلظتهای درمانی هپارین و کمتر از 20% در غلظت فوق درمانی هپارین را نشان دهد(38-36).
(Heparin induced platelet aggregation) HIPA :
در این روش، از پلاکتهای چهار اهداکننده سالم استفاده میشود. پلاکتهای شسته شده در مجاورت سرم بیمار در حضور بافر(به عنوان کنترل منفی)، هپارین با وزن مولکولی پایین در محدوده دوز درمانی(reviparin ، anti-FXa/mL 2/0) و یا هپارین در محدوده دوز فوق درمانیIU/mL, UFH) 100) در چاهکهای میکروتیتر با انتهای مدور شفاف انکوبه میشود. از دستگاه مگنتیک استایرر به عنوان منبع shear force استفاده میشود و تشکیل تجمعهای پلاکتی را هر 5 دقیقه به صورت چشمی بررسی میکنند. آزمایشی مثبت در نظر گرفته میشود که تجمع پلاکتی در غلظتهای هپارین درمانی حداقل 2 اهداکننده از 4 نفر مشاهده شود اما این تجمـع در طـول 30 دقیقه در غلظتهای فوق درمانی هپارین مشاهده نشود.
اختصاصـیت تمامـی روشهای عملکردی را میتوان با
استفاده از مهار فعالسازی پلاکتها با هپارین در غلظت بالا و با انسداد FCYRIIA با استفاده از آنتیبادیهای مونوکلونال افزایش داد.
اگر چه هر دو این روشهای عملکردی به عنوان روشهای تائیدی برای تشخیص HIT در نظر گرفته میشوند اما دارای معایب و محدودیتهایی نیز میباشند از جمله: این آزمایشها وقتگیر بوده و در زمانی که نیاز به تصمیمگیری سریع برای بیمار میباشد، نتایج این آزمایشها در دسترس نبوده و همچنین این روشها نیازمند تکنسین بسیار ماهر آزمایشگاهی و پلاکتهای اهداکنندگان سالم میباشد. همچنین روش SRA نیازمند استفاده از مواد رادیواکتیو بوده که بسیاری از آزمایشگاهها برای رعایت مسائل ایمنی از این روش اجتناب میکنند(40).
2-3- فلوسیتومتری:
در ترومبوسیتوپنی ناشی از هپارین، آنتیبادیهای HIT میتوانند منجر به تولید میکروپارتیکلهای پلاکتی(PMP) شده که میتوان آنها را با روش فلوسیتومتری جهت تشخیص کمیسازی نمود. برای این منظور از مواد فلوئورسنت متصل به آنتیبادیهای مونوکلونالی مانند anti-CD41 یا anti-GPIba استفاده کرد. همچنین میتوان از آنکسینV (Anexin V)نیز برای اتصال به فسفولیپیدهای آنیونیک به عنوان مارکر فعالسازی پلاکت استفاده نمود. میکرو پارتیکلهای پلاکتی از روی اندازه و پارامترهای پراکندگی قابل افتراق از پلاکتها میباشند(41، 37).
کنترل کیفی در آزمایشهای عملکردی:
در تمامی روشهای عملکردی که از پلاکتهای اهداکنندگان سالم استفاده میشود، لازم است اهداکنندگان حداقل طی دو هفته قبل از اهدای پلاکت هیچگونه دارو یا ماده غذایی که بر روی عملکرد پلاکت تاثیرگذار است را مصرف نکرده باشند. همچنین جهت کنترل کیفی روشهای عملکردی میتوان از سرم یا پلاسمای بیماران HIT که قبلاً تشخیص قطعی داده شدند به عنوان کنترل مثبت و از سرم
یـا پلاسمـای افـراد سالـم فاقد HIT بـه عنوان کنترل منفی
استفاده نمود(42).
آزمایشهای ایمنی سریع (Rapid immunoassays):
امروزه دستهای از آزمایشهای ایمونولوژیک طراحی شدهاند که امکان غربالگری اولیه بیماران HITرا به شکل سریع(کمتر از 30 دقیقه) به پزشکان میدهد. این آزمایشها آنتیبادی علیه کمپلکس Heparin-PF4را شناسایی میکنند اما از نظر اساس تست و نوع کلاس آنتیبادی که شناسایی میکنند با یکدیگر تفاوت دارند(17). نتیجه منفی این آزمایشها به دلیل npv FHGH t در بیماران با امتیاز بالینی پایین و متوسط با ارزش بوده در حالی که در بیماران با احتمال بالینی قوی، باید با احتیاط بیشتری عمل نمود. از مشکلات دیگر این آزمایشها میتوان به عدم اشاره دقیق به جایگاه این آزمایشها در الگوریتم تشخیصی فعلی برای تفسیر نتایج آزمایشها اشاره نمود(43). از جمله این آزمایشها میتوان به موارد زیر اشاره کرد:
1- Particle-based immunoassays (PaGIA) :
روشهای «بررسی ایمنی بر پایه ذرات» به شناسایی آنتیبادیهایی میپردازند که علیه کمپلکس Heparin-PF4 ساخته شده و منجر به آگلوتیناسیون ذرات حاوی PF4 و یا Heparin-PF4 میگردند. یکی از این روشهاParticle gel immunoassay (PaGIA) میباشد. این روش از کمپلکسهای PF4/heparin متصل شده به دانههای پلیاسترن قرمز با تراکم بالا استفاده میکند که بعد از اضافه کردن سرم یا پلاسمای بیمار، آنتیبادی علیه کمپلکس Heparin-PF4 به دانههای پلیاسترن متصل شده که با سانتریفیوژ کردن، دانههای آگلوتینه شده(بیانگر حضور آنتیبادی علیه کمپلکس Heparin-PF4) در طول ژل سفاکریل مهاجرت نکرده در حالی که دانههای آگلوتینه نشده(بیانگر فقدان حضور آنتیبادیها) در طول ژل مهاجرت مینمایند. نتایج آزمایش سپس به صورت چشمی بررسی میگردد. برخلاف ELISA ، «روشهای بررسی بر پایه ذرات» تقریباً غیر کمی بوده و بین زیر گروههای مختلف آنتیبادیها تمایز قائل نمیشوند بنابراین اختصاصیـت و PPV پائینـی دارنـد. مهـمتریـن مـزیـــت
روشهـای بـررسی بـر پایـه ذرات، سریع بودن زمان انجام
آزمایشها(15 دقیقه) میباشد(44).
2- lateral flow immunoassay (LFI-HIT):
جهت تشخیص آنتیبادی علیه کمپلکس Heparin-PF4 که زیر گروه IgG میباشد به کار میرود و نتیجه آزمایش به شکل کیفی (مثبت یا منفی) گزارش میشود. اصول آزمایش بر پایه تشخیص اتصال آنتیبادی در سرم بیمار(در صورت وجود) با کمپلکس PF4/Polyanion نشاندار شده با لیگاند بوده که این مجموعه به نانوپارتیکلهای طلا که یک آنتیبادی ضد لیگاند را حمل مینمایند متصل خواهد شد و نهایتاً در مسیر مویرگی حرکت نمونه و بافر توسط آنتیبادی ضد IgG انسانی بیحرکت شده و قابل شناسایی میگردند. هر استریپ تست برای بررسی نمونه یک بیمار طراحی شده و در مدت 15 دقیقه بدون نیاز به تجهیزات خاص آزمایشگاهی قابل انجام میباشد. این آزمایش دارای NPV بالایی بوده و نتیجه منفی با احتمال بالا تشخیص HIT را رد میکند(45). با این وجود در مطالعهای که توسط لروکس و همکارانش انجام شد، مشاهده گردید این آزمایش دارایPPV مطلوبی نبوده و باید تنها به عنوان یک آزمایش غربالگری استفاده شود و در مواردی که نتیجه این آزمایش مثبت است باید آزمایش ELISA جهت تایید نتیجه حاصله انجام شود(46).
3-Health TEST Heparin/Platelet factor 4 Antibody Assay Q :
این روش از سیستمی به نام Assay Particle Immuno-Filtration استفاده میکند. در این روش سرم بیمار به چاهکهای واکنشی حاوی ذرات رنگی کووت شده با PF4 (و نه arin-PF4) اضافه میشود و در نهایت ذرات آگلوتینه نشده در طول فیلتر غشایی مهاجرت میکنند. از این رو آزمایش منفی را با رنگ آبی در چاهک، و نبود رنگ را به عنوان نتیجه مثبت در نظر میگیرند(47).
4- روشهای دستگاهی:
تعـدادی از روشهـای بـررسی ایمنی برای دستگاههای
اتوماتیک آزمایشگاهی در دسترس میباشند که تاکنـون سـه روش معرفی شدهاند: روش HemosIL- HIT-Ab (PF4-H) که بر پایه آگلوتیناسیون ذرات لاتکس میباشد و روشهای HemosIL Acustar HIT-IgG و HemsoIL Acustar HIT-Ab (IgG, A, M) بر پایه شناسایی کمیلومینسانس میباشند. در روش بررسی آگلوتیناسیون بر پایه ذرات لاتکس، آگلوتیناسیون ذرات کووت شده با PF4/polyvinyl sulfonate توسط آنتیبادی مونوکلونال، anti-PF4/heparin antibody در حضور anti-PF4/heparin antibodies انسانی مهار شده، این روش قادر به افتراق بین زیر کلاسهای مختلف آنتیبادی(IgG, IgM یا (IgA نمیباشد. روش بررسی کمی لومینسانس بر پایه اتصال anti-PF4/heparin antibodies به PF4/polyvinyl sulfonate میباشد. این روشها میتواند بر روی سرم یا پلاسمای بیمار انجام شده و قادر به افتراق زیر کلاسهای مختلف آنتیبادی هستند. اخیراً مطالعهها نشان دادهاند نتایج مثبت این آزمایشها با احتمال بیش از 85% بیانگر این است که نمونه، حاوی آنتیبادیهای فعالکننده پلاکتها میباشد(47، 45).
الگوریتم تشخیصی:
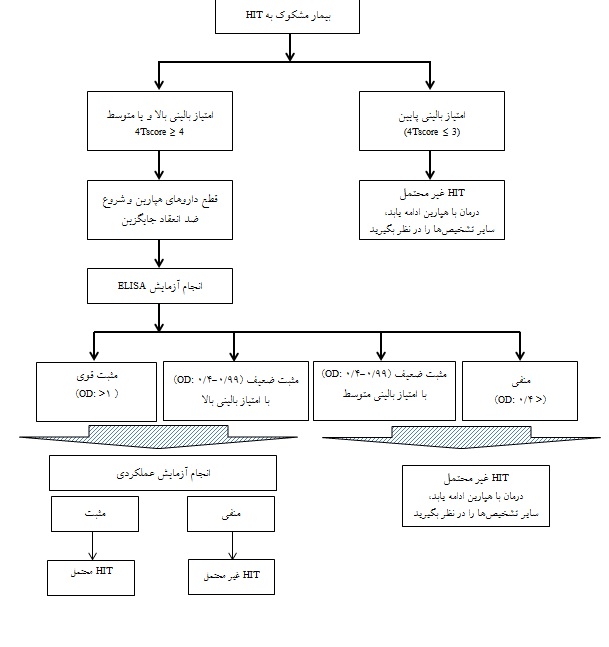
در صورتی که تشخیص ترومبوسیتوپنی ناشی از هپارین تنها بر پایه یافتههای بالینی و یا آزمایشگاهی باشد، میتواند منجر به عدم تشخیص و یا تشخیص بیش از اندازه HIT گردد چرا که هیچ کدام از روشهای ارزیابی بالینی و آزمایشگاهی دارای حساسیت و اختصاصیت 100% نمیباشند. از طرفی ممکن است بعضی از بیماران با امتیاز بالینی پایین دارای HIT بوده در حالی که بعضی دیگر از بیماران با امتیاز بالینی بالا HIT نداشته باشند. به همین دلیل تشخیص صحیحHIT نخست بر پایه علائم بالینی بیمار بوده و در صورت وجود علائم بالینی در گام بعدی، تستهای آزمایشگاهی درخواست میشود. این استراتژی برای تشخیص بیماران را میتوان در غالب یک الگوریتم نمایش داد(شکل2))48، 8). در مطالعهای که توسط فارم و همکارانـش در سـال 2017 جهـت ارزیـابی حســاسیت و
در حالی که میزان بروز سندرمHIT در بیماران دریافتکننده هپارین در بالا ذکر شده، لیکن باید مطلع باشیم که شیوع آنتیبادیهای ضد کمپلکس هپارین- فاکتور 4 پلاکتی بسیار بالاتر از درصدهای گزارش شده میباشد به طوری که در 50%-7% از کل بیماران تحت درمان با هپارین، میتوان آنتیبادی علیه کمپلکس هپارین-فاکتور 4 پلاکتی را یافت اما نهایتاً سندرم HIT فقط در تعداد کمی از این بیماران بروز پیدا میکند(11).
هم چنین در مطالعهای که توسط شهبازی و همکارانش بر روی بیماران جراحی قلب در ایران انجام شد، میزان فراوانی این پدیده را در این گروه 4/5% گزارش نمودند(20).
علائم بالینی:
1- ترومبوسیتوپنی:
ترومبوسیتوپنی حاد تقریباً یک هفته بعد از شروع هپارین درمانی، به عنوان مهمترین علامت بالینی HIT در نظر گرفته میشود و تقریباً در 95% از بیماران HIT ، در طول دوره بیماریشان اتفاق میافتد. افت 50% شمارش پلاکت بیمار از مقدار پایه به عنوان مهمترین یافته بیماری بوده که در 90% بیماران سطح پلاکت به زیر 109× 150 (یعنی به سطح مورد نظر در تعریف متداول ترومبوسیتوپنی) و در اغلب بیماران بالای 109 × 55 میرسد. در تعداد اندکی از بیماران، افت 50% شمارش پلاکت با توجه به تعداد پلاکت در ابتدای شروع درمان با هپارین(سطح پایه) در سطحی خواهد بود که در تعریف معمول ترومبوسیتوپنی قرار نمیگیرد. به همین دلیل اطلاع از سطح پلاکت پایه در تشخیص بیماری از اهمیت ویژهای برخوردار است(21، 8).
در کمتر از 5% از بیماران با HIT ، شمارش پلاکت کمتر از 109× 20 میباشد. ترومبوسیتوپنی شدیـد در HIT بـا خطـر بالایـی از همراهـی بـا رخـدادهـای تـرومبوتیک
است(22).
با توجه به شیوع بالای ترومبوسیتوپنی در بیماران بستری، زمانی که تنها علامت بالینی بیمار کاهش پلاکت میباشد، بایستی سایر تشخیصهای افتراقی در نظر گرفته شود که شامل؛ بیماران بستری در بخش مراقبتهای ویژه ICU (در46%-38% این بیماران، ترومبوسیتوپنی دیده میشود)، آمبولیسم حاد ریوی، مرحله آخر بیماری کلیوی، سپسیس، بیماران با عمل جراحی بایپس قلبی ـ ریوی اخیر و عوارض دارویی میباشد(16).
2- ترومبوز:
خطرناکترین یافته HIT ، ترومبوز است که در 57%-29% از بیماران با HIT میتواند رخ دهد. تا قبل از دسترسی به درمانهای رایج، حدود 9% از رخدادهای ترومبوتیک ناشی از HIT منجر به قطع عضو و 16% منجر به مرگ میگردید(22).
ترومبوز وریدهای عمقی با یا بدون آمبولیسم ریوی شایعترین ترومبوزهای ناشی از HIT میباشند(50% از بیماران). ترومبوزهای ورید اندام فوقانی معمولاً کمتر رخ داده و در ارتباط با استفاده همزمان یا مکرر از کاتترهای درون عروقی میباشد(22). ترومبوزهای وریدی نسبت به ترومبوزهای سرخرگی در بیماران داخلی(medical patients) و یا بعد از عمل جراحی ارتوپدی غالب بوده در حالی که به دنبال اعمال جراحی قلب و عروق در HIT این نسبت مشابه است(16).
ترومبوزهای کمتر معمول، شامل ترومبوز وریدهای مغزی(سینوس دورال) و احشایی(مزانتریک و آدرنال) میباشند. ترومبوز ورید آدرنال تقریباً در 2% از بیماران رخ داده و به شکل انفارکتوس خونریزیدهنده آدرنال خود را نشان میدهد. وقتی که نکروز آدرنال دو طرفه باشد، میتواند منجر به نارسایی حاد آدرنال گردد.
در 20%-10% بیماران، نکروز پوستی در محل تزریق هپارین رخ داده که به عنوان یکی از حوادث ترومبوتیک در نظر گرفته میشود.
ترومبوزهای سرخرگی در HIT شامل: مغزی، کرونری،
مزانتریک، سرخرگهای براکیال و اندام تحتانی هستند.
در 5% بیماران، نکروز ایسکمیک اندام، دیـده شـده کـه
این موضوع غالباً مرتبط با استفاده از وارفارین و نتیجتاً کاهش پروتئین C بوده و منجر به ایجاد میکروترمبوز میگردد(23-21، 15).
بررسی بالینی HIT ( قبل از انجام تستهای آزمایشگاهی)، ابزار ارزیابی بالینی:
به دلیل مصرف گسترده هپارین در بیماران بستری شـده
در بیمارستان و هم چنین فراوانی ترومبوسیتوپنی(50%-30%) در این گروه از بیماران به دلایل متعدد که موجب هم زمانی مصرف هپارین و ترومبوسیتوپنی میگردد، ضروری است روشهای تشخیصی مطمئنی برای تشخیص و یا رد HIT در بیماران در نظر گرفته شود. از آن جایی که روشهای آزمایشگاهی خود دارای محدودیتهای مهمی در تشخیص HIT بوده و استفاده از آنها در قدم اول تشخیص این بیماری منجر به تشخیص بیش از حد واقعی و در برخی موارد منجر به عدم تشخیص میگردد ضروری است بیماران در مرحله اول، به عنوان اولین و مهمترین گام تشخیصی، بر اساس یافتههای بالینی ارزیابی گردند(26-23، 17). به همین دلیل روشهای متعددی برای ارزیابی بیمار مظنون به HIT پیشنهاد گردیده است که شامل:
1-4Ts score :
رایجترین و مهمترین سیستم امتیازدهی بالینی مورد استفاده میباشد که اولین بار در سال 2003 توسط وارکنتین و همکارانش در دانشگاه مک مستر کانادا پیشنهاد گردید. اعتبار این سیستم بعدها در مطالعههای زیادی مورد ارزیابی قرار گرفت و مشاهده گردید این سیستم جهت تشخیص اولیه HIT از اعتبار بالایی برخوردار میباشد. این سیستم به بررسی 4 ویژگی مشخص HIT میپردازد. 1) ترومبوسیتوپنی 2) زمان شروع افت پلاکت 3) حضور ترومبوز(یا سایر عوارض بالینی) 4) عدم حضور سایر علل ترومبوسیتوپنی .
هر کدام از این پارامترها، امتیازی بین 2-0 را کسب کرده و جمع نهایی امتیازها از صفر تا 8 متفاوت است. امتیازها در سه گروه امتیاز پایین (3-1)، امتیاز متوسط (4-5) و امتیاز بالا(8-6) طبقهبندی میشود. مطالعههای مختلفی ارزش پیشآگهی دهنده منفی (Negative Predictive Value: NPV)4Ts score را بالا (8/99%) گزارش کردهاند به طوری که در اغلب مطالعهها این گونه نتیجهگیری شده که امتیاز کمتر از 3 با قاطعیت بالایی تشخیص HIT را رد میکند و این در حالی است که ارزش پیشآگهی دهنده مثبت(Positive Predictive Value PPV) برای امتیاز متوسط 20%-10% و برای امتیاز بالا، 80%-40% میباشد، بنابراین زمانی که بیمار دارای امتیاز بالینی متوسط و بالا میباشد، تایید تشخیص باید به روشهای آزمایشگاهی صورت گیرد تا تشخیص HIT از صحت بالایی برخوردار شود(29-27).
تاکنون در ایران مطالعههای معدودی در زمینه HIT صورت گرفته که در غالب آنها روش تشخیصی HIT به دلیل محدودیتهای دسترسی به تستهای آزمایشگاهی، صرفاً بر اساس ارزیابی بالینی بوده و در اکثریت آنها صرفاً از روش ارزیابی بالینی4Ts score استفاده شده است. این مطالعهها طراحیهای متفاوتی داشته و در جامعههای آماری متفاوتی بررسی شدهاند. نتایج آنها مؤید 85/0% تا 6/15% تواتر HIT بوده است(31، 30). در مطالعهای که شهبازی و همکاران در سال 95 بر روی 92 بیمار تحت عمل جراحی قلب در بیمارستان شهید مدرس تهران انجام دادند، برای ارزیابی HIT از روش 4Ts score و بررسی آزمایشگاهی ELISA استفاده نمودند. در این مطالعه یکی از یافتههای قابل تعمق، عدم ثبت نتایج4Ts score (البته در صورت محاسبه پزشک) در پروندههای بیماران بود.
محققین در این مطالعه بر اساس اطلاعات پرونده بیماران به محاسبه4Ts score پرداخته و بر اساس همین بررسی، احتمال تشخیص HIT در 14 بیمار(2/15%) مطرح گردید. پس از افزودن بررسی آزمایشگاهیAnti PF4/Heparin Ab به روش ایمونواسی برای ارزیابی احتمال HIT در این 14 بیمار، در 8 بیمار(6/8%) آزمایش مثبت بود و این موضوع اهمیت تشخیص بر اساس دو بازوی ارزیابی بالینی و ارزیابی آزمایشگاهی را نشان میدهد(25).
2) HEP score(HIT expert probability score):
در تلاش برای بهبود اختصاصیت و ارزش پیشآگهی دهنده مثبت 4Ts score ، روش HIT expert probability (HEP) با استفاده از نظر کارشناسان توسعه یافت. در این مدل از 26 کارشناس خواسته شد تا به 8 ویژگی بالینی HIT (1- شدت افت پلاکت،2- زمان افت پلاکت،3- مرز شمارش پلاکتی،4- ترومبوز، 5- نکروز پوستی، 6- واکنش حاد سیستمیک، 7- خونریزی و 8- سایر علل ترومبوسیتوپنی) امتیازی بین 3- (شدیداً به نفع رد تشخیص HIT) تا 3+ ( شدیداً به نفع تشخیص HIT) اختصاص دهند(20). در یک مطالعه گذشتهنگر امتیاز آستانه 5 (5 : (cut off در ارتباط با ارزش پیشآگهی دهنده مثبت 55% (%82-25%) و ارزش پیشآگهی دهنده منفی 97% (%100-85%) گزارش گردید که مشابه ارزش پیشآگهی دهنده 4Ts score است(31). با این وجود بر خلاف 4Ts score که برای انجام، تقریباً راحت میباشد این روش پیچیدهتر بوده و استفاده از آن پر زحمتتر است اما برای بیماران ICU و پزشکان با تجربه کمتر مناسب بوده و تایید صحت این روش نیازمند مطالعههای آیندهنگر زیادی میباشد(32، 20).
سیستم امتیازدهی بالینی در جراحی قلب(Lillo-Le Louet):
چالش برانگیزترین زمینه برای تشخیص HITاز سایر علل ترومبوسیتوپنی در جراحی قلب میباشد چرا که عوامل خطر متعددی برای کاهش پلاکت وجود دارد که باعث پیچده شدن تشخیص HIT میشود. از جمله این عوامل میتوان به اثر ترقیقی، عفونت/انعقاد داخل عروقی منتشر(DIC)، شوک کاردیوژنیک، وسیلههای مکانیکی و داروهای مختلف اشاره کرد. هم چنین افزایش خطر ترومبوز تا 20% و شیوع بالای آنتیبادی علیه کمپلکس هپارین- فاکتور 4 پلاکتی(70%-25%).در این گروه از بیماران مشاهده میشود(20). با وجود بالا بودن این عوامل، خطر بروز HIT بعد از عمل جراحی قلب پایین میباشد(2%-6/0%). به دلیل مشکل بودن تشخیص HIT بعد از عمل جراحی قلب، لیلولی لوئت و همکارانش سه متغیر غیر وابسته بالینی را در زمینه تشخیص HIT شناسایی کردند که شامل: 1) الگوی افت پلاکت، 2) مدت زمان عمل جراحی بایپس قلبی ـ ریوی تا زمان ظن به HIT و 3) طول مدت عمل بایپس قلبی ـ ریوی بود. آنها مشاهده کردند بیمارانی که HIT را بعد از عمل جراحی قلب بروز میدهند، دارای الگوی دو فازه مشخص در بازگشت شمارش پلاکت میباشند به طوری که در الگوی نوع یک، شمارش پلاکت در 2 تا 4 روز بعد از عمل جراحی کاهش یافته سپس به حد طبیعی و یا بالاتر از حد طبیعی بر میگردد که این پدیده به طور معمول بعد از عمل جراحی قلب اتفاق میافتد ولی در صورتی که دوباره افت پیدا کند، این موضوع به دلیل توسعه آنتیبادیهای HIT میباشد و در صورتی که این ترومبوسیتوپنی بیش از 5 روز ادامه پیدا کند، الگوی نوع 2 خوانده میشود. بر اساس این مشاهدات امتیازی به هر یک از الگوهای افت پلاکتی تعلق میگیرد(الگوی افت پلاکت نوع یک: 2 امتیاز و الگوی افت پلاکتی نوع دو: 1 امتیاز).
متغیرهای دیگر نیز امتیازاتی کسب کرده که شامل طول زمان، از هنگام عمل جراحی قلب تا ظن به HIT (≤ 5 روز: 2 امتیاز و > 5 روز: 0 امتیاز) و طول عمل جراحی(≥ 118 دقیقه: 1 امتیاز و < 118 دقیقه: 0 امتیاز) میباشند. مجموع امتیازاتی که بیمار از این سیستم میگیرد، از0 تا 5 است. آنها مشاهده کردند امتیاز ≤ 2 در ارتباط با احتمال بالایی از HIT بوده(ارزش پیشآگهیدهنده مثبت بالا (62%PPV: ) در حالی که امتیاز ≤5 در ارتباط با احتمال بسیار بالاتری میباشد(95% PPV:). در یک مطالعه به مقایسه این سیستم با 4Ts score پرداخته شد و مشاهده گردید هر دو سیستم PPV پایینی داشته اما این سیستم ارزش پیشآگهی دهنده منفی )78%(NPV= پایینتری از 4Ts score (91%) دارد. محققان نتیجه گرفتند با وجود این که عملکرد تشخیصی هر دو سیستم امتیازدهی، پایین است اما الگوی پلاکتی نوع 1 بعد از عمل جراحی قلب به عنوان قویترین پیشگویی کننده HIT در این شرایط می باشد(34، 32).
تستهای آزمایشگاهی:
انجـام تسـتهـای آزمـایشگاهـی جهـت تاییـد و یا رد
تشخیص HIT به ویژه در بیماران با امتیاز بالینی متوسط و بالا ضروری میباشد. به دلیل فراوانی بالای آنتیبادی علیه کمپلکس Heparin-PF4 در بعضی از جمعیتهای بیماران (مانند بعد ازعمل جراحی قلب)، از این تستها نباید جهت غربالگری بیماران استفاده کرد. تستهای آزمایشگاهی جهت تشخیص HIT به طور کلی شامل دو دسته تستهای ایمنولوژیک و عملکردی میباشند(16) (جدول 1).
1- آزمایشهای ایمنولوژیک:
این دسته از آزمایشها کلیه آنتیبادیهایی را که علیه کمپلکس Heparin-PF4ساخته شده شناسایی میکنند، اما قادر به افتراق آنتیبادیهایی که توانایی فعالسازی پلاکتها را دارند، از سایر موارد پاتولوژیک ندارند.
حساسیت بالا، سهولت و سرعت انجام، سبب گردیده است بیشتر آزمایشگاههای بالینی از این دسته از آزمایشها جهت تشخیص HIT استفاده کنند(34). انواع مختلفی از آزمایشهای ایمنولوژیک وجود دارد که خود به دو دسته (ELISA) Enzyme linked immunosorbant assay و آزمایشهای سریع از جمله Particle-based immunoassays (PaGIA) تقسیم میشوند(36).
آزمایش الایزا دارای حساسیت(99%) و NPV بالایی میباشد بنابراین در بیشتر مواقع نتیجه منفی این آزمایش بیانگر رد بودن تشخیص HIT است. دلیل این که ارزش پیشآگهی دهنده منفی ELISA نمیتواند 100% باشد(99%-98%) میتواند به علت شناسایی آنتیبادیهای کمتر پاتولوژیک(مانند IgM وIgA) در بعضی از کیتها بوده و از طرفـی آنتیبادیهـای HIT همواره علیه کمپلکس Heparin-PF4 نبوده و گاهی اوقات این آنتیبادیها علیه عوامل فعالکننده پلاکتی مانند اینترلوکین 8 (IL-8) و پپتید فعالکننده 2 نوترفیل(NAP-2) ایجاد میشوند که کیتهای ELISA در حال حاضر قادر به شناسایی این دسته از آنتیبادیها نمیباشند(16).
بـا ایـن وجــود اختصاصیت این آزمایشها تقریباً پایین
بوده(70%-30%) و بیانگر این است که بیماران با علائم بالینی HIT که نتیجه آزمایش ELISA آنها مثبت شده است، الزاماً دارای آنتیبادیهای پاتولوژیک مرتبط با HIT نبوده (موارد مثبت کاذب بالا) و نیاز به انجام آزمایشهای تکمیلی جهت تشخیص قطعی HIT میباشد. روشهای مختلفی برای افزایش اختصاصیت آزمایشهای ایمنولوژیک وجود دارد که از جمله آنها میتوان به محدود کردن این آزمایشها به شناسایی آنتیبادیهای IgG و استفاده از مرحله تاییدی هپارین با غلظت بالا اشاره کرد(37). در آزمایش ELISA ، آنتیژن هدف(کمپلکسهای پلیآنیون (PF4- به یک فاز جامد مانند پلیتهای میکروتیتر متصل میشود، با اضافه کردن سرم و یا پلاسمای بیمار، در صورت وجود آنتیبادی علیه این کمپلکس در نمونه بیمار، با افزودن آنتیبادی ثانویه نشاندار شده، میتوان این اتصال را شناسایی کرد. نتیجه آزمایش ELISA به صورت شدت نوری(OD) گزارش میشود که متناسب با مقدار آنتیبادیهای موجود در نمونه بیمار بوده و مقدار بالای OD (شدت جذب نوری بالاتر از 1) معمولاً در ارتباط با احتمال خطر بالاتری برای HIT و بروز ترومبوز در این بیماران میباشد(39، 38).
2- آزمایشهای عملکردی:
گروه دوم از آزمایشهای تشخیصی HIT جهت شناسایی گروهی از آنتیبادیهای علیه کمپلکس Heparin-PF4 بوده که توانایی فعالسازی پلاکتها را داشته و لذا به عنوان آنتیبادیهای پاتولوژیک شناخته میشوند. در این گروه از آزمایشها، سرم بیمار با پلاکتهای اهداکنندگان سالم در حضور هپارین(LMWH و UFH) مجاور و انکوبه میشود. نتیجه نهایی فعال شدن پلاکتی در این آزمایشها بسته به نوع آزمایش توسط پارامترهای مختلفی مانند بررسی آزادسازی مواد رادیواکتیو، تجمع پلاکتی و یا فلوسیتومتری ارزیابی شده و به تفصیل در ادامه بحث به نحوه انجام هر کدام از این روشها پرداخته میشود.
2-1- SRA(Serotonin releasing assay) :
ایـن روش در گـروه آزمایـشهای عملکردی بـه عنوان
آزمایش استاندارد طلایی بوده و در آن فعال شدن پلاکتها
توسـط ارزیابـی آزادسازی سروتونین نشاندار شده(میزان C-Serotonin 14) بررسی میشود. این آزمایش دارای حساسیت(100%-88%) و اختصاصیت(100%-89%) بالایی بوده و معمولاً در آزمایشگاههای مرجع قادر به انجام آن میباشند(38).
در این روش پلاکتهای شسته شده با C-serotonin 14 انکوبه شده سپس پلاکتها مواد رادیو اکتیو را جذب کرده و در گرانولهای متراکم خود ذخیره میکنند. در مرحله بعد پلاکتهای شسته شده همراه با سرم بیمار و هپارین در چاهکهای میکروتیتر با انتهای مسطح به صورت دوبل بر روی شیکر پلیت انکوبه میشود. بعد از 60 دقیقه انکوباسیون و سانتریفیوژ، مایع رویی (supernatants) ترکیب واکنشی را جمعآوری کرده و رادیواکتیویته آن اندازهگیری میشود. نتایج آزمایش به صورت درصد آزادسازی سروتونین در مقایسه با حداکثر لیز پلاکتی القا شده توسط دترجنت (100%) (detergent-induced platelet lysis) بیان میگردد. آزمایشی مثبت در نظر گرفته میشود که بیش از 20% آزادسازی سروتونین در غلظتهای درمانی هپارین و کمتر از 20% در غلظت فوق درمانی هپارین را نشان دهد(38-36).
(Heparin induced platelet aggregation) HIPA :
در این روش، از پلاکتهای چهار اهداکننده سالم استفاده میشود. پلاکتهای شسته شده در مجاورت سرم بیمار در حضور بافر(به عنوان کنترل منفی)، هپارین با وزن مولکولی پایین در محدوده دوز درمانی(reviparin ، anti-FXa/mL 2/0) و یا هپارین در محدوده دوز فوق درمانیIU/mL, UFH) 100) در چاهکهای میکروتیتر با انتهای مدور شفاف انکوبه میشود. از دستگاه مگنتیک استایرر به عنوان منبع shear force استفاده میشود و تشکیل تجمعهای پلاکتی را هر 5 دقیقه به صورت چشمی بررسی میکنند. آزمایشی مثبت در نظر گرفته میشود که تجمع پلاکتی در غلظتهای هپارین درمانی حداقل 2 اهداکننده از 4 نفر مشاهده شود اما این تجمـع در طـول 30 دقیقه در غلظتهای فوق درمانی هپارین مشاهده نشود.
اختصاصـیت تمامـی روشهای عملکردی را میتوان با
استفاده از مهار فعالسازی پلاکتها با هپارین در غلظت بالا و با انسداد FCYRIIA با استفاده از آنتیبادیهای مونوکلونال افزایش داد.
اگر چه هر دو این روشهای عملکردی به عنوان روشهای تائیدی برای تشخیص HIT در نظر گرفته میشوند اما دارای معایب و محدودیتهایی نیز میباشند از جمله: این آزمایشها وقتگیر بوده و در زمانی که نیاز به تصمیمگیری سریع برای بیمار میباشد، نتایج این آزمایشها در دسترس نبوده و همچنین این روشها نیازمند تکنسین بسیار ماهر آزمایشگاهی و پلاکتهای اهداکنندگان سالم میباشد. همچنین روش SRA نیازمند استفاده از مواد رادیواکتیو بوده که بسیاری از آزمایشگاهها برای رعایت مسائل ایمنی از این روش اجتناب میکنند(40).
2-3- فلوسیتومتری:
در ترومبوسیتوپنی ناشی از هپارین، آنتیبادیهای HIT میتوانند منجر به تولید میکروپارتیکلهای پلاکتی(PMP) شده که میتوان آنها را با روش فلوسیتومتری جهت تشخیص کمیسازی نمود. برای این منظور از مواد فلوئورسنت متصل به آنتیبادیهای مونوکلونالی مانند anti-CD41 یا anti-GPIba استفاده کرد. همچنین میتوان از آنکسینV (Anexin V)نیز برای اتصال به فسفولیپیدهای آنیونیک به عنوان مارکر فعالسازی پلاکت استفاده نمود. میکرو پارتیکلهای پلاکتی از روی اندازه و پارامترهای پراکندگی قابل افتراق از پلاکتها میباشند(41، 37).
کنترل کیفی در آزمایشهای عملکردی:
در تمامی روشهای عملکردی که از پلاکتهای اهداکنندگان سالم استفاده میشود، لازم است اهداکنندگان حداقل طی دو هفته قبل از اهدای پلاکت هیچگونه دارو یا ماده غذایی که بر روی عملکرد پلاکت تاثیرگذار است را مصرف نکرده باشند. همچنین جهت کنترل کیفی روشهای عملکردی میتوان از سرم یا پلاسمای بیماران HIT که قبلاً تشخیص قطعی داده شدند به عنوان کنترل مثبت و از سرم
یـا پلاسمـای افـراد سالـم فاقد HIT بـه عنوان کنترل منفی
استفاده نمود(42).
آزمایشهای ایمنی سریع (Rapid immunoassays):
امروزه دستهای از آزمایشهای ایمونولوژیک طراحی شدهاند که امکان غربالگری اولیه بیماران HITرا به شکل سریع(کمتر از 30 دقیقه) به پزشکان میدهد. این آزمایشها آنتیبادی علیه کمپلکس Heparin-PF4را شناسایی میکنند اما از نظر اساس تست و نوع کلاس آنتیبادی که شناسایی میکنند با یکدیگر تفاوت دارند(17). نتیجه منفی این آزمایشها به دلیل npv FHGH t در بیماران با امتیاز بالینی پایین و متوسط با ارزش بوده در حالی که در بیماران با احتمال بالینی قوی، باید با احتیاط بیشتری عمل نمود. از مشکلات دیگر این آزمایشها میتوان به عدم اشاره دقیق به جایگاه این آزمایشها در الگوریتم تشخیصی فعلی برای تفسیر نتایج آزمایشها اشاره نمود(43). از جمله این آزمایشها میتوان به موارد زیر اشاره کرد:
1- Particle-based immunoassays (PaGIA) :
روشهای «بررسی ایمنی بر پایه ذرات» به شناسایی آنتیبادیهایی میپردازند که علیه کمپلکس Heparin-PF4 ساخته شده و منجر به آگلوتیناسیون ذرات حاوی PF4 و یا Heparin-PF4 میگردند. یکی از این روشهاParticle gel immunoassay (PaGIA) میباشد. این روش از کمپلکسهای PF4/heparin متصل شده به دانههای پلیاسترن قرمز با تراکم بالا استفاده میکند که بعد از اضافه کردن سرم یا پلاسمای بیمار، آنتیبادی علیه کمپلکس Heparin-PF4 به دانههای پلیاسترن متصل شده که با سانتریفیوژ کردن، دانههای آگلوتینه شده(بیانگر حضور آنتیبادی علیه کمپلکس Heparin-PF4) در طول ژل سفاکریل مهاجرت نکرده در حالی که دانههای آگلوتینه نشده(بیانگر فقدان حضور آنتیبادیها) در طول ژل مهاجرت مینمایند. نتایج آزمایش سپس به صورت چشمی بررسی میگردد. برخلاف ELISA ، «روشهای بررسی بر پایه ذرات» تقریباً غیر کمی بوده و بین زیر گروههای مختلف آنتیبادیها تمایز قائل نمیشوند بنابراین اختصاصیـت و PPV پائینـی دارنـد. مهـمتریـن مـزیـــت
روشهـای بـررسی بـر پایـه ذرات، سریع بودن زمان انجام
آزمایشها(15 دقیقه) میباشد(44).
2- lateral flow immunoassay (LFI-HIT):
جهت تشخیص آنتیبادی علیه کمپلکس Heparin-PF4 که زیر گروه IgG میباشد به کار میرود و نتیجه آزمایش به شکل کیفی (مثبت یا منفی) گزارش میشود. اصول آزمایش بر پایه تشخیص اتصال آنتیبادی در سرم بیمار(در صورت وجود) با کمپلکس PF4/Polyanion نشاندار شده با لیگاند بوده که این مجموعه به نانوپارتیکلهای طلا که یک آنتیبادی ضد لیگاند را حمل مینمایند متصل خواهد شد و نهایتاً در مسیر مویرگی حرکت نمونه و بافر توسط آنتیبادی ضد IgG انسانی بیحرکت شده و قابل شناسایی میگردند. هر استریپ تست برای بررسی نمونه یک بیمار طراحی شده و در مدت 15 دقیقه بدون نیاز به تجهیزات خاص آزمایشگاهی قابل انجام میباشد. این آزمایش دارای NPV بالایی بوده و نتیجه منفی با احتمال بالا تشخیص HIT را رد میکند(45). با این وجود در مطالعهای که توسط لروکس و همکارانش انجام شد، مشاهده گردید این آزمایش دارایPPV مطلوبی نبوده و باید تنها به عنوان یک آزمایش غربالگری استفاده شود و در مواردی که نتیجه این آزمایش مثبت است باید آزمایش ELISA جهت تایید نتیجه حاصله انجام شود(46).
3-Health TEST Heparin/Platelet factor 4 Antibody Assay Q :
این روش از سیستمی به نام Assay Particle Immuno-Filtration استفاده میکند. در این روش سرم بیمار به چاهکهای واکنشی حاوی ذرات رنگی کووت شده با PF4 (و نه arin-PF4) اضافه میشود و در نهایت ذرات آگلوتینه نشده در طول فیلتر غشایی مهاجرت میکنند. از این رو آزمایش منفی را با رنگ آبی در چاهک، و نبود رنگ را به عنوان نتیجه مثبت در نظر میگیرند(47).
4- روشهای دستگاهی:
تعـدادی از روشهـای بـررسی ایمنی برای دستگاههای
اتوماتیک آزمایشگاهی در دسترس میباشند که تاکنـون سـه روش معرفی شدهاند: روش HemosIL- HIT-Ab (PF4-H) که بر پایه آگلوتیناسیون ذرات لاتکس میباشد و روشهای HemosIL Acustar HIT-IgG و HemsoIL Acustar HIT-Ab (IgG, A, M) بر پایه شناسایی کمیلومینسانس میباشند. در روش بررسی آگلوتیناسیون بر پایه ذرات لاتکس، آگلوتیناسیون ذرات کووت شده با PF4/polyvinyl sulfonate توسط آنتیبادی مونوکلونال، anti-PF4/heparin antibody در حضور anti-PF4/heparin antibodies انسانی مهار شده، این روش قادر به افتراق بین زیر کلاسهای مختلف آنتیبادی(IgG, IgM یا (IgA نمیباشد. روش بررسی کمی لومینسانس بر پایه اتصال anti-PF4/heparin antibodies به PF4/polyvinyl sulfonate میباشد. این روشها میتواند بر روی سرم یا پلاسمای بیمار انجام شده و قادر به افتراق زیر کلاسهای مختلف آنتیبادی هستند. اخیراً مطالعهها نشان دادهاند نتایج مثبت این آزمایشها با احتمال بیش از 85% بیانگر این است که نمونه، حاوی آنتیبادیهای فعالکننده پلاکتها میباشد(47، 45).
الگوریتم تشخیصی:
در صورتی که تشخیص ترومبوسیتوپنی ناشی از هپارین تنها بر پایه یافتههای بالینی و یا آزمایشگاهی باشد، میتواند منجر به عدم تشخیص و یا تشخیص بیش از اندازه HIT گردد چرا که هیچ کدام از روشهای ارزیابی بالینی و آزمایشگاهی دارای حساسیت و اختصاصیت 100% نمیباشند. از طرفی ممکن است بعضی از بیماران با امتیاز بالینی پایین دارای HIT بوده در حالی که بعضی دیگر از بیماران با امتیاز بالینی بالا HIT نداشته باشند. به همین دلیل تشخیص صحیحHIT نخست بر پایه علائم بالینی بیمار بوده و در صورت وجود علائم بالینی در گام بعدی، تستهای آزمایشگاهی درخواست میشود. این استراتژی برای تشخیص بیماران را میتوان در غالب یک الگوریتم نمایش داد(شکل2))48، 8). در مطالعهای که توسط فارم و همکارانـش در سـال 2017 جهـت ارزیـابی حســاسیت و
جدول 1: مزایا و معایب روشهای تشخیصی HIT (45)
| نوع/آزمایش | اساس آزمایش | مثال | مزایا | معایب |
| ایمونولوژیک | شناسایی آنتیبادیهای در گردش علیه کمپلکس هپارین ـ PF4 بدون توجه به توانایی آنها در فعالسازی پلاکتها | Poly specific ELISA IgG-specific ELISA |
حساسیت بالا، راحت بودن جهت انجام، در دسترس بودن |
اختصاصیت پایین |
| عملکردی | شناسایی آنتیبادیهای در گردش علیه کمپلکس هپارین - PF4 با توجه به توانایی آنها در فعالسازی پلاکتها | SRA HIPA |
حساسیت بالا اختصاصیت بالا |
از نظر تکنیکی انجام این آزمایشها مشکل بوده محدودیت در دسترسی دارد |
اختصاصیـت الگوریتـم تشخیصـی بــرای HIT انجام شد، حساسیـت و اختصاصیـت ایـن الگوریتـم را 94% گـزارش
نمودند(49).
دارو درمانی:
بیمارانی که ظن بالینی متوسط یا بالایی به HIT دارند، باید تمام مسیرهای تزریق هپارین در آنها قطع شده و ضد انعقادهای جایگزین به ویژه مهارکنندههای مستقیم ترومبین ( Direct Thrombin Inhibitor:DTI) برای آنها شروع شود. همچنین در بیمارانی که مشکوک به HIT هستند نباید LMWH با UFH جایگزین گردد زیرا هر چند LMWH با احتمال کمتری منجر به HIT میشود اما میتواند با آنتیبادیهای HIT واکنش متقاطع داده و منجر به بدتر شدن شرایط این سندروم شود.
مناسبترین ضد انعقاد برای استفاده در بیماران HIT دقیقاً مشخص نیست. داروهایی که در این زمینه استفاده میشوند باید دارای ویژگیهایی از جمله: سریعالاثر بودن، توانایی مختل کردن آبشار انعقادی فعال شده در سطح ترومبین و یا فاکتور Xa ، خطر خونریزی پایین، عدم نیاز به مانیتورینگ و یا مانیتورینگ راحت و شاید مهمترین عامل، آشنایی پزشک با نحوه استفاده از این داروها باشد.
مهارکنندههای مستقیم ترومبین داخل رگی(Parenteral Direct Thrombin Inhibitors):
ایـن دستـه از داروهـا بـه گستردگـی بـرای مدیریــت
HIT استفاده میشوند. Argatroban توسط FDA برای درمانHIT تایید شده است و bivalirudin در ایالت متحده برای تداخلات کرونری زیر پوستی در بیمارانی که HIT دارند و یا در خطر HIT هستند استفاده میشود. Desirudin برای HIT تایید نشده است اما برای جلوگیری از ترومبوز ورید عمقی بعد از جراحی شکستگی لگن استفاده میشود. Lepirudin برای استفاده در HIT تایید شده است اما تولید آن به دلیل مسائل تجاری در اروپا در سال 2011 و در آمریکای شمالی در سال 2012 متوقف شده است.
مهارکنندههای مستقیم ترومبین باعث افزایش وابسته به دوز aPTT میشوند که امکان مانیتورینگ راحت را میدهد(51، 50).
تغییر به آنتاگونیستهای ویتامین K :
HIT به عنوان یک فاکتور خطر برای ترومبوآمبولیسمهای بعدی در نظر گرفته میشود. از آن جا که این خطر برگشتپذیر و گذرا بوده از این رو پیشنهاد میشود ضد انعقاد درمانی برای 4 تا 6 هفته در بیماران با HIT ایزوله و 3 ماه در بیماران با ترومبوزادامه یابد. از شروع درمان سریع با آنتاگونیستهای ویتامین K (مثل وارفارین) باید اجتناب شود چرا که توانایی بالاقوه برای بدتر کردن شرایط پروترومبوتیک از طریق کاهش سریع پروتئیـن C کـه یک ضد انعقاد طبیعی است را دارا میباشد.
بـه محـض ایـن که شمارش پلاکت در فاز حاد HIT به
نمودند(49).
دارو درمانی:
بیمارانی که ظن بالینی متوسط یا بالایی به HIT دارند، باید تمام مسیرهای تزریق هپارین در آنها قطع شده و ضد انعقادهای جایگزین به ویژه مهارکنندههای مستقیم ترومبین ( Direct Thrombin Inhibitor:DTI) برای آنها شروع شود. همچنین در بیمارانی که مشکوک به HIT هستند نباید LMWH با UFH جایگزین گردد زیرا هر چند LMWH با احتمال کمتری منجر به HIT میشود اما میتواند با آنتیبادیهای HIT واکنش متقاطع داده و منجر به بدتر شدن شرایط این سندروم شود.
مناسبترین ضد انعقاد برای استفاده در بیماران HIT دقیقاً مشخص نیست. داروهایی که در این زمینه استفاده میشوند باید دارای ویژگیهایی از جمله: سریعالاثر بودن، توانایی مختل کردن آبشار انعقادی فعال شده در سطح ترومبین و یا فاکتور Xa ، خطر خونریزی پایین، عدم نیاز به مانیتورینگ و یا مانیتورینگ راحت و شاید مهمترین عامل، آشنایی پزشک با نحوه استفاده از این داروها باشد.
مهارکنندههای مستقیم ترومبین داخل رگی(Parenteral Direct Thrombin Inhibitors):
ایـن دستـه از داروهـا بـه گستردگـی بـرای مدیریــت
HIT استفاده میشوند. Argatroban توسط FDA برای درمانHIT تایید شده است و bivalirudin در ایالت متحده برای تداخلات کرونری زیر پوستی در بیمارانی که HIT دارند و یا در خطر HIT هستند استفاده میشود. Desirudin برای HIT تایید نشده است اما برای جلوگیری از ترومبوز ورید عمقی بعد از جراحی شکستگی لگن استفاده میشود. Lepirudin برای استفاده در HIT تایید شده است اما تولید آن به دلیل مسائل تجاری در اروپا در سال 2011 و در آمریکای شمالی در سال 2012 متوقف شده است.
مهارکنندههای مستقیم ترومبین باعث افزایش وابسته به دوز aPTT میشوند که امکان مانیتورینگ راحت را میدهد(51، 50).
تغییر به آنتاگونیستهای ویتامین K :
HIT به عنوان یک فاکتور خطر برای ترومبوآمبولیسمهای بعدی در نظر گرفته میشود. از آن جا که این خطر برگشتپذیر و گذرا بوده از این رو پیشنهاد میشود ضد انعقاد درمانی برای 4 تا 6 هفته در بیماران با HIT ایزوله و 3 ماه در بیماران با ترومبوزادامه یابد. از شروع درمان سریع با آنتاگونیستهای ویتامین K (مثل وارفارین) باید اجتناب شود چرا که توانایی بالاقوه برای بدتر کردن شرایط پروترومبوتیک از طریق کاهش سریع پروتئیـن C کـه یک ضد انعقاد طبیعی است را دارا میباشد.
بـه محـض ایـن که شمارش پلاکت در فاز حاد HIT به

شکل 2: الگوریتم تشخیصی ترومبوسیتوپنی ناشی از هپارین(48)
سطح طبیعی برگشت، وارفارین باید به آهستگی در دوز 5 میلیگرم یا کمتر، روزانه و به تدریج تجویز شود تا به INR
2 تـا 3 برسـد. استفـاده هـم زمان از مهارکنندههای مستقیم ترومبین وآنتاگونیستهای ویتامین K به ویژه آرگاتروبان که باعث افزایش در INR میشود، میتواند چالشبرانگیز باشد (51، 50).
تزریق پلاکت:
برخلاف وجود ترومبوسیتوپنی شدید در HIT، خونریزی خود به خودی در این بیماران شایع نمیباشد. با این وجود بیماران HIT نیازمند روشهای تهاجمی، ممکن است به صورت پروفیلاکسی جهت کاهش خطر خونریزی نیازمند تزریق پلاکت باشند. گزارشهای متعددی در مورد تزریق پلاکت به بیماران HITوجود دارد که این تزریق را به اضافه کردن سوخت بر روی آتش که منجر به تشدید ترومبوز میگردد، تشبیه نمودهاند. با این وجود هنوز شواهد حمایتکننده مستقیمی در مورد افزایش خطر ترومبوز در بیماران با HIT که تحت تزریق پلاکت قرار گرفتهاند وجود ندارد اما از طرف دیگر شواهد برای حمایت از تزریق پلاکت در این گروه از بیماران بسیار محدود میباشد(52، 11).
تعویض پلاسما:
تا قبل از استفاده از مهارکنندههای مستقیم ترومبین، از تعویض پلاسما برای درمان HIT حاد استفاده میشد اما بعد از ظهور این داروها، این روش تنها در زمانهای کوتاهی برای کاهش میزان تیتر آنتیبادی علیه کمپلکس Heparin-PF4، در بیمارانی که در معرض دوباره هپارین
قرار میگرفتند و به منظور کاهش خطر بروز رخدادهای ترومبوتیک استفاده شد. اگر چه هنوز بهترین زمان استفاده از تعویض پلاسما تعیین نشده است، با این وجود در مواردی که دسترسی به گزینههای درمانی وجود نداشته و یا مقاومت به مهارکننده های مستقیم ترومبین وجود دارد و همچنین در زمان بروز عوارضی مانند خونریزی ناشی از مصرف این داروها میتوان از این روش بهره گرفت(52).
نتیجهگیری
بررسی مقالات منتشر شده در چند سال اخیر نشان میدهد ترومبوسیتوپنی ناشی از هپارین، همچنان یک عارضه جانبی خطرناک ناشی از درمان با هپارین بوده و نیازمند تشخیص صحیح و به موقع میباشد. از آنجا که این عارضه یک رخداد بالینی-آزمایشگاهی است، در این مطالعه در مرحله اول توجه دقیق به علائم بالینی بیماران با استفاده از سیستمهای ارزیابی بالینی شرح داده شد و سپس انجام تستهای آزمایشگاهی مناسب(آزمایشهای ایمونولوژیک و سپس در صورت لزوم انجام آزمایشهای عملکردی) برای جلوگیری از تشخیص بیش از حد و یا عدم تشخیص HIT که از اهمیت زیادی برخوردار میباشد، توضیح داده شد. با توجه به جمعیت 80 میلیونی کشور ایران و میزان شیوع 1تا 5 درصدی این بیماری بالاقوه خطرناک در میان جمعیتهای مختلف بیماران دریافتکننده داروی هپارین و همچنین عدم ارائه پنل کامل تشخیص آزمایشگاهی این بیماری در کشور ایران، راهاندازی یک آزمایشگاه مرجع ارائهدهنده آزمایشهای آزمایشگاهی(ایمنولوژیک و عملکردی) ضروری به نظر میرسد.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






