جلد 13، شماره 2 - ( تابستان 1395 )
جلد 13 شماره 2 صفحات 137-130 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Razavi Babaheydari S, Mousavi Hosseini K, Atashi A, Esmaeeili S. Study of quantitative and qualitative gene expression of lipoprotein lipase before and after differentiation of human bone marrow mesenchymal stem cells into adipocytes. bloodj 2016; 13 (2) :130-137
URL: http://bloodjournal.ir/article-1-993-fa.html
URL: http://bloodjournal.ir/article-1-993-fa.html
رضوی بابا حیدری سید رسول، موسوی حسینی کامران، آتشی امیر، اسمعیلی شادی. مطالعه بیان کمی و کیفی ژن لیپوپروتئین لیپاز قبل و بعد از تمایز سلولهای بنیادی مزانشیمی مغز استخوان انسانی به سلول چربی. فصلنامه پژوهشی خون. 1395; 13 (2) :130-137
تهران ـ ایران ـ صندوق پستی: 1157-14665
متن کامل [PDF 468 kb]
(1539 دریافت)
| چکیده (HTML) (6420 مشاهده)
مقدمه
سلولهای بنیادی مزانشیمی، سلولهایی هستند که توانایی خود بازسازی و در نهایت تمایز به انواع متعدد سلول را دارند. این سلولهای بنیادی اساساً از مغز استخوان منشا میگیرند اما قابل برداشت از بافت چربی، تاندون، خون محیطی، ماهیچه اسکلتی و اخیراً استخوان ترابکولار نیز میباشند. سلولهای بنیادی مزانشیمی میتوانند به ردههای استخوانساز، چربیساز، غضروفساز و ماهیچهساز تمایز یابند(1).
سلولهای بنیادی مزانشیمی به تعداد وسیعی در انسان بالغ، در مغز استخوان و بافت چربی یافت میشوند و به طور گستردهای به علت داشتن توانایی درمان بیماریهای انسانی مورد بررسی قرار گرفته است(2).
در سالهای اخیر، چاقی به یک نگرانی که تهدیدکننده سلامتی میباشد تبدیل شده است. توده چربی سفید، بافتی اندوکرین است که نه تنها نقش فعال و مرکزی در تنظیم تعادل انرژی بازی میکند، بلکه نقش اساسی در تعدادی از فرآیندهای فیزیولوژیکی و پاتولوژیکی نیز دارد. از طرفی مطالعههای اپیدمیولوژیک نشان دادهاند که افزایش سطوح تریگلیسیرید سرم(TG) با احتمال پیشرفت سرطان همراه است. بنابراین TG سرم نقش مهمی در کارسینوژنزیس (سرطانزایی) بازی میکند و آنزیم کلیدی LPL که مسبب هیدرولیزTG پلاسما است نیز در این روند درگیر است(3). بنابراین درک چگونگی فرآیندهای تمایز آدیپوست میتواند به ما در تنظیم تعداد و عملکرد این سلولها در ارگانیسم بالغ کمک کرده و در نتیجه در درمان و تسکین بیماریهای متابولیک هم چون چاقی و دیابت و برخی سرطانها یاری رساند. اطلاعات کمی در مورد پتانسیل تمایزی سلولهای بنیادی مغز استخوان وجود دارد و بیان این ژن قبل و بعد از تمایز سلولهای بنیادی مزانشیمی به سلول چربی مشخص نشده است(5، 4). این مطالعه به بررسی بیان این ژن قبل و بعد از تمایز پرداخته است.
مواد و روشها
در این مطالعه که به روش کارآزمایی بالینی بود، اقداماتی
به ترتیب زیر انجام گرفت:
1- جداسازی و کشت MSCs از مغز استخوان:
آسپیره مغز استخوان بعد از گرفتن رضایتنامه کتبی از افراد سالم از بیمارستان طالقانی تهران تهیه شد. سلولهای تک هستهای از طریق شیب غلظتی با استفاده از محلول فایکول جدا شد.
بدین منظور بعد از رقیق کردن محلول آسپیره به نسبت یک به یک با PBS ، به مدت 20 دقیقه با دور G 450 سانتریفیوژ شد. سلولهای تک هستهای دارای چگالی کمتری نسبت به فایکول بودند لذا بر روی آن قرار گرفتند. گلبولهای قرمز باقیمانده دارای وزن مولکولی بیشتری نسبت به فایکول هستند و در ته لوله رسوب میکنند. سپس مایعرویی که حاوی سلولهای تک هستهای است را برداشته و با دور G 300 به مدت 10 دقیقه سانتریفیوژ انجام شد. در نهایت 106 * 1 از سلولهای تک هستهای بر سانتیمتر مکعب به فلاسکهای T75 انتقال داده شد. فلاسکها در شرایط دمایی 37 درجه سانتیگراد و 5% CO2 نگهداری شده و هفتهای سه بار تعویض محیط انجام شد. جهت تکثیر سلولها از محیطDMEM با 10% FBS استفاده شد.
2- بررسی هویت سلولهای بنیادی مزانشیمی جداسازی شده:
مارکرهای سطحی CD90 ، CD34 ، CD37 و CD105 با استفاده از فلوسیتومتری مورد بررسی قرار گرفت. سلولها در غلظت 103 * 3 بر سانتیمتر مربع در 3 فلاسک T25 کشت داده شد و بعد از رسیدن به جمعیت سلولی 80%-70%، محیط تکثیری DMEM با محیط تمایزی استئوبلاستی تعویض شد.
برای تهیه محیط تمایزی استئوبلاستی از محیط کشت عمومی DMEM ، L- گلوتامین و 10% FBS استفاده شد که به این محیط کشت فاکتورهای دگزامتازون با غلظت نهایی10 نانومولار، بتا ـ گلیسرول فسفات با غلظت نهایی 5 میلیمولار و آسکوربات -2- فسفات با غلظت نهایی 50 میکروگرم بر میلیلیتر اضافه گردید. بعد از 21 روز، تمایز به سمت استخوان با استفاده از رنگآمیزی آلیزارین قرمز مورد تایید قرار گرفت.
جدول 1: توالی و اندازه آغازگرهای ژن LPL و ژن بتااکتین طراحی شده
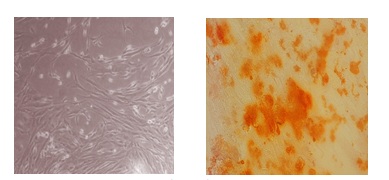
شکل 1: راست به چپ : رنگآمیزی آلیزارین رد سلولهای بنیادی مزانشیمال تمایز یافته به سلول استخوان در روز 21 تمایز و سلولهای بنیادی مزانشیمال در روز 21 (کنترل)
2- نتایج فلوسیتومتری:
جهت تایید مزانشیم بودن سلولها، فلوسیتومتری برای مارکرهای CD90 ، CD105 ، CD31 و CD34 انجام گرفت که نتایج آن در نمودار 1 قابل مشاهده میباشد. نتایج حاصل از فلوسیتومتری نشان داد که سلولهای جداسازی شده به لحاظ ماهیت، سلول بنیادی مزانشیمی هستند که با بیان بالای CD105 ، CD90 ، CD73 و نیز عدم بیان CD34 مشخص میشوند.
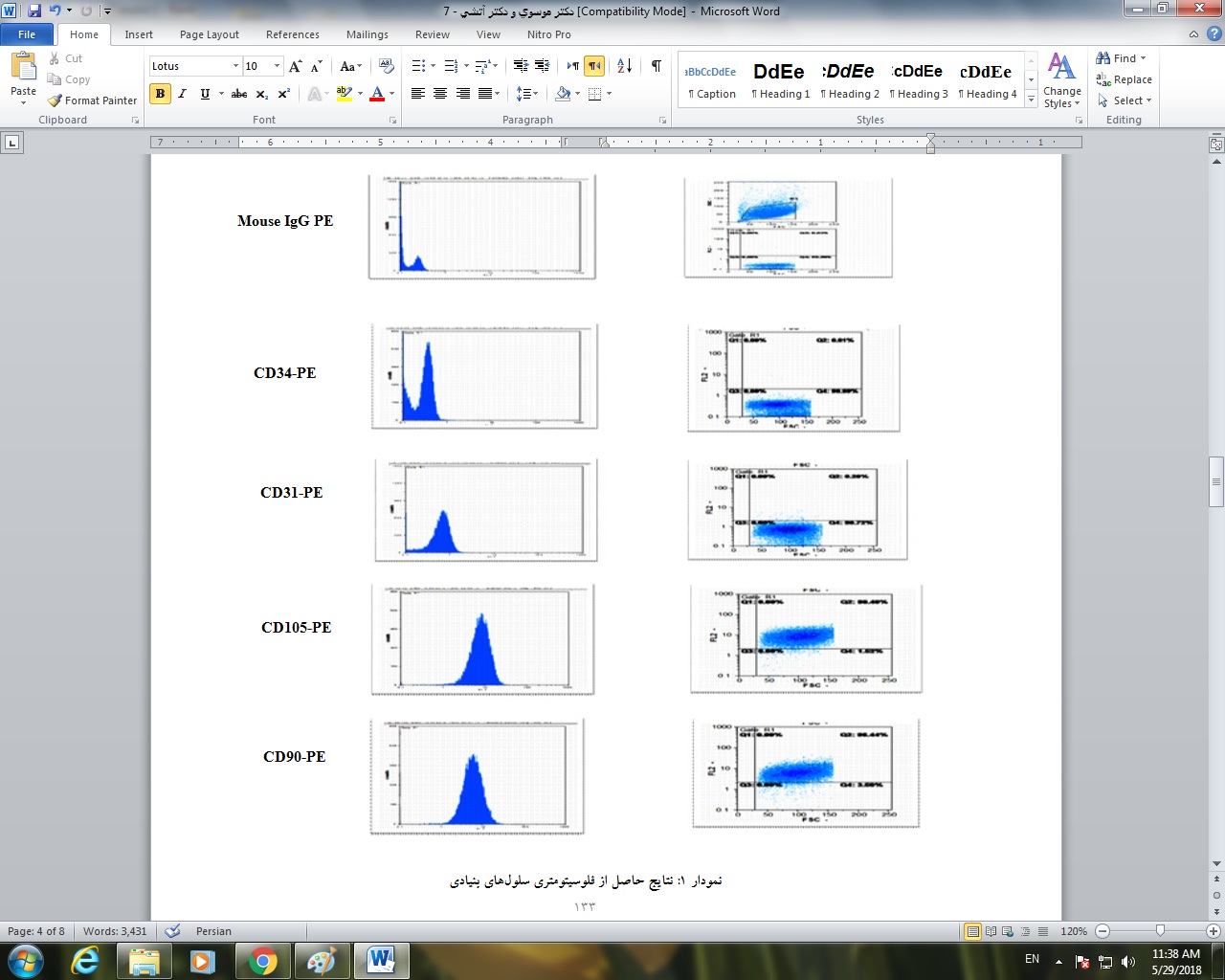
نمودار 1: نتایج حاصل از فلوسیتومتری سلولهای بنیادی
3- رنگآمیزی BM-MSCs ضمن تمایز به آدیپوسیتها:
MSCs بعد از تمایز، مورفولوژی سلولهای آدیپوسیت را به خود گرفته و رنگآمیزی Oil Red O دانههای قرمز حاوی تجمع لیپیدها را در داخل سلولهای آدیپوسیت نشان میدهد(شکل 2).
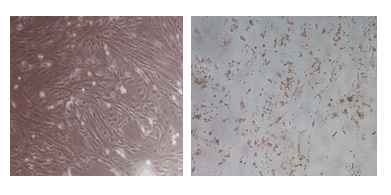
شکل 2: راست به چپ: رنگآمیزیOil- Red- O سلولهای بنیادی مزانشیمال تمایز یافته به چربی در روز 14 و سلولهای بنیادی مزانشیمال در روز 14 تمایز(کنترل)
4- نتایج حاصل از بیان کیفی ژن LPL :
در شکل 3 نمایی از بیان کیفی ژن LPL قبل و بعد از تمایز BM-MSCs آورده شده است. همان طور که مشاهده میشود، این ژن قبل از تمایز فاقد بیان بوده با این حال، بعد از تمایز، ژن LPL بیان شده و بیان آن کاملاً مشهود است.
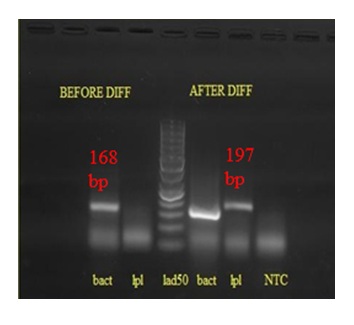
شکل 3 : نمای ژل الکترفورز بعد از الکتروفورز محصول PCR : 1) beta actin قبـل از تمایـز، 2) LPL قبل از تمایز 3) سایز مارکر bp 50 4) beta actin بعد از تمایز 5) LPL بعد از تمایز 6) NTC
5- پس از انجام آزمایش Real Time PCR میانگین حاصل از 3 نمونه به شرح زیر بود(جدول 2):
جدول 2: Ct های میانگین مربوط به ژن LPL و β-actin و انحراف معیار آنها(C = control ، UD = undifferentiated ، D = differentiated و T=test)
به علت عدم بیان ژن LPL قبل از تمایز و بیان آن بعد از تمایز، امکان مقایسه آن و بیان مقدار عددی این افزایش بیان امکانپذیر نمیباشد و تنها میتوان از نظر کیفی بیان این ژن را بررسی نمود.
بحث
در این مطالعه سلولهای بنیادی مزانشیمی مغز استخوان انسانی(H-MSCs) به وسیله شیب غلظتی فایکول جدا شد. مارکرهای سطحی این سلولها به وسیله فلوسیتومتری تایید شد و تمایز به سلول چربی و استخوان به وسیله دستورالعمل دگزامتازون انجام گرفت و به وسیله رنگآمیزی تایید شد. سپس بیان کمی و کیفی ژن LPL به عنوان یکی از مهمترین ژنهای دخیل در تمایز چربی، قبل و بعد از تمایز به آدیپوسیت به وسیله Real Time PCR بررسی شد. مطالعههای بسیاری در زمینه تمایز سلولها و هم چنین ردههای سلولی مختلف از جمله BMS2 ، UAMS33 ، 2T3 به سمت سلول چربی انجام شده است(9-6).
هم چنین مطالعههایی بر روی تمایز سلولهای بنیادی مزانشیمی مغز استخوان انسانی نیز انجام شده است. به عنوان مثال در مطالعهای در سال 2013 مشخص شد که هیپوکسی از تمایز سلولهای BM-MSCs بـه سمـت سلولهای آدیپوسیتی جلوگیری میکند و در مطالعـهای در
سال 2015 ، تمایـز MSC ها بـه ردههـای استئوژنیک، آدیپوژنیک، کندروژنیک و میوژنیک بررسی شد و توانایی MSC ها در تمایز به چربی با مشاهده وزیکولهای چربی پس از رنگآمیزی Oil-Red-O به اثبات رسیده ولی اشارهای بر روی بیان ژن LPL نشده است(11، 10). ساخت چربی فرآیندی پیچیده است که نیازمند همکاری بین فاکتورهای مختلف از جمله LPL ، PPARγ و C/EBPs میباشد (12).
تمایز BM-MSCs به سلولهای چربی دارای اهمیت زیادی است. استئوپورزیس و افزایش خطر شکستگی استخوان به علت افزایش سن، نه تنها به دنبال کاهش سلولهای استـخوانی است، بلکه جایـگزینی بافـت مغز استـخوان با چربـی نیـز میتواند در آن اثرگــذار باشد(15-13). در نتیجه علاوه بر تحریک استئوژنزیس، نیاز به مهار آدیپوژنزیس نیز هست(17، 16). از این رو مهار تمایز BM-MSCs به آدیپوسیت با واسطه سرکوب بیان LPL میتواند مفید باشد. امروزه چاقی به صورت یک نگرانی تهدید کننده حیات در آمده است(20-18). هم چنین یکی از عوارض کم خونی آپلاستیک، افزایش سلولهای چربی در مغز استخوان است که منجر به اختلال در حمایت داربست مغز استخوان از سلولهای بنیادی خونساز میشود. چنین نقصی میتواند به علت تمایز بیش از حد BM-MSCs به سلولهای چربی باشد. مطالعهها نشان دادهاند که مهار چربیسازی در مبتلایان به کم خونی آپلاستیک میتواند به طور چشمگیری نیاز به پیوند مغز استخوان را کاهش دهد(28-20). اخیراً مشخص شده که BM-MSCs جدا شده از بیماران لوسمی حاد میلوئیدی (AML)، دارای قدرت بیشتری در تمایز به سمت سلولهای چربی میباشند و تعداد این سلولها در مغز استخوان این مبتلایان که دارای نقص در تولید مناسب سلولهای خونیاند، نیز بیشتر است(29). همان طور که پیشتر نیز اشاره شد، LPL با در اختیار گذاشتن منبعی از اسیدهای چرب برای سلولهای سرطانی، در افزایش رشد و بقای این سلولها مؤثر بوده و به عنوان هدفی مناسب برای شیمی درمانی مد نظر قرار گرفته است.
نتیجهگیری
در این مطالعه ژن LPL بعد از تمایز، بیان بسیار بالایی در مقایسه با سلولهای بنیادی مزانشیمی مغز استخوان انسانی به عنوان کنترل داشت.
مشاهدات ما در این مطالعه میتواند به عنوان یکی از فرآیندهای درمانی برای بیماریهای اشاره شده به کار رود و با مهار تمایز MSCs به چربی، بهبودی شرایط بیماری را سبب شود. شاید بتوان با مهار بیان آن در درمان بیماریهای مختلف از جمله چاقی مفرط، آنمی آپلاستیک، پوکی استخوان، برخی سرطانها به خصوص سرطان پروستات، آلزایمر و دیابت از آن بهره برد.
تشکر و قدردانی
لازم است که از اساتید راهنما در سازمان انتقال خون ایران و گروه هماتولوژی دانشکده پزشکی دانشگاه تربیت مدرس و سایر افرادی که بنده را به نحوی در انجام این پژوهش یاری نمودند، تشکر نمایم. این مقاله از پایان نامه کارشناسی ارشد اینجانب که مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد منتج شده است.
متن کامل: (2008 مشاهده)
مطالعه بیان کمی و کیفی ژن لیپوپروتئین لیپاز قبل و بعد از تمایز سلولهای بنیادی
مزانشیمی مغز استخوان انسانی به سلول چربی
سید رسول رضوی باباحیدری1، کامران موسوی حسینی2، امیر آتشی3، شادی اسمعیلی4
چکیده
سابقه و هدف
تریگلیسرید سرم، نقش مهمی در سرطانزایی بازی میکند و آنزیم کلیدی LPL که مسبب هیدرولیز تریگلیسرید پلاسما است نیز، در این روند درگیر است. تنظیم نادرست LPL در بسیاری از بیماریهای انسانی مثل آترواسکلروزیس نقش دارد. سطوح تریگلیسیرید سرم با افزایش خطر شیلومیکرونمیا، چاقی و دیابت نوع 2 در ارتباط است. در این مطالعه بیان کمی و کیفی این ژن، قبل و بعد از تمایز سلولهای بنیادی مزانشیمی مغز استخوان انسانی به سلول چربی در محیط آزمایشگاه بررسی گردید.
مواد و روشها
در یک کارآزمایی بالینی، سلولهای بنیادی مزانشیمی جداسازی گردید و در محیط کشت حاوی القاگرهای مناسب به مدت 14 روز به آدیپوسیت تمایز داده شد. سپس RNA استخراج شد و ساخت cDNA انجام گرفت و در نهایت آنالیز RT-PCR برای ژن LPL صورت گرفت.
یافتهها
مشاهده زیر میکروسکوپ معکوس بعد از 14 روز نشان داد که قابلیت تمایز سلولهای مزانشیمی مغز استخوان به چربی وجود دارد. ژن LPL قبل از تمایز فاقد بیان بود در حالی که بعد از تمایز دارای بیان قابل توجهی بود.
نتیجه گیری
با توجه به یافتههای حاصل از این مطالعه، سلولهای بنیادی مزانشیمی مغز استخوان قادر به تمایز به رده استخوان و چربی میباشند که در تصمیمگیری برای تعهد به هر کدام از این ردهها، یک سری ژنهای چربیساز از جمله LPL ، نقش دارند. ممکن است بتوان با مهار و یا تحریک بیان آنها در درمان بیماریهای مختلف از جمله سرطان پروستات، آنمی آپلاستیک، دیابت و پوکی استخوان از آن بهره برد.
کلمات کلیدی: سلولهای بنیادی مزانشیمی، آدیپوسیتها، لیپوپروتئین لیپاز، تمایز سلولی
تاریخ دریافت : 2 /7 /94
تاریخ پذیرش : 10/11/94
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: PhD شیمی دارویی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- مؤلف مسئول: PhD هماتولوژی و بانک خون ـ استادیار دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 111-14115
4- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ گروه هماتولوژی ـ تهران ـ ایران
مزانشیمی مغز استخوان انسانی به سلول چربی
سید رسول رضوی باباحیدری1، کامران موسوی حسینی2، امیر آتشی3، شادی اسمعیلی4
چکیده
سابقه و هدف
تریگلیسرید سرم، نقش مهمی در سرطانزایی بازی میکند و آنزیم کلیدی LPL که مسبب هیدرولیز تریگلیسرید پلاسما است نیز، در این روند درگیر است. تنظیم نادرست LPL در بسیاری از بیماریهای انسانی مثل آترواسکلروزیس نقش دارد. سطوح تریگلیسیرید سرم با افزایش خطر شیلومیکرونمیا، چاقی و دیابت نوع 2 در ارتباط است. در این مطالعه بیان کمی و کیفی این ژن، قبل و بعد از تمایز سلولهای بنیادی مزانشیمی مغز استخوان انسانی به سلول چربی در محیط آزمایشگاه بررسی گردید.
مواد و روشها
در یک کارآزمایی بالینی، سلولهای بنیادی مزانشیمی جداسازی گردید و در محیط کشت حاوی القاگرهای مناسب به مدت 14 روز به آدیپوسیت تمایز داده شد. سپس RNA استخراج شد و ساخت cDNA انجام گرفت و در نهایت آنالیز RT-PCR برای ژن LPL صورت گرفت.
یافتهها
مشاهده زیر میکروسکوپ معکوس بعد از 14 روز نشان داد که قابلیت تمایز سلولهای مزانشیمی مغز استخوان به چربی وجود دارد. ژن LPL قبل از تمایز فاقد بیان بود در حالی که بعد از تمایز دارای بیان قابل توجهی بود.
نتیجه گیری
با توجه به یافتههای حاصل از این مطالعه، سلولهای بنیادی مزانشیمی مغز استخوان قادر به تمایز به رده استخوان و چربی میباشند که در تصمیمگیری برای تعهد به هر کدام از این ردهها، یک سری ژنهای چربیساز از جمله LPL ، نقش دارند. ممکن است بتوان با مهار و یا تحریک بیان آنها در درمان بیماریهای مختلف از جمله سرطان پروستات، آنمی آپلاستیک، دیابت و پوکی استخوان از آن بهره برد.
کلمات کلیدی: سلولهای بنیادی مزانشیمی، آدیپوسیتها، لیپوپروتئین لیپاز، تمایز سلولی
تاریخ دریافت : 2 /7 /94
تاریخ پذیرش : 10/11/94
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: PhD شیمی دارویی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- مؤلف مسئول: PhD هماتولوژی و بانک خون ـ استادیار دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 111-14115
4- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ گروه هماتولوژی ـ تهران ـ ایران
مقدمه
سلولهای بنیادی مزانشیمی، سلولهایی هستند که توانایی خود بازسازی و در نهایت تمایز به انواع متعدد سلول را دارند. این سلولهای بنیادی اساساً از مغز استخوان منشا میگیرند اما قابل برداشت از بافت چربی، تاندون، خون محیطی، ماهیچه اسکلتی و اخیراً استخوان ترابکولار نیز میباشند. سلولهای بنیادی مزانشیمی میتوانند به ردههای استخوانساز، چربیساز، غضروفساز و ماهیچهساز تمایز یابند(1).
سلولهای بنیادی مزانشیمی به تعداد وسیعی در انسان بالغ، در مغز استخوان و بافت چربی یافت میشوند و به طور گستردهای به علت داشتن توانایی درمان بیماریهای انسانی مورد بررسی قرار گرفته است(2).
در سالهای اخیر، چاقی به یک نگرانی که تهدیدکننده سلامتی میباشد تبدیل شده است. توده چربی سفید، بافتی اندوکرین است که نه تنها نقش فعال و مرکزی در تنظیم تعادل انرژی بازی میکند، بلکه نقش اساسی در تعدادی از فرآیندهای فیزیولوژیکی و پاتولوژیکی نیز دارد. از طرفی مطالعههای اپیدمیولوژیک نشان دادهاند که افزایش سطوح تریگلیسیرید سرم(TG) با احتمال پیشرفت سرطان همراه است. بنابراین TG سرم نقش مهمی در کارسینوژنزیس (سرطانزایی) بازی میکند و آنزیم کلیدی LPL که مسبب هیدرولیزTG پلاسما است نیز در این روند درگیر است(3). بنابراین درک چگونگی فرآیندهای تمایز آدیپوست میتواند به ما در تنظیم تعداد و عملکرد این سلولها در ارگانیسم بالغ کمک کرده و در نتیجه در درمان و تسکین بیماریهای متابولیک هم چون چاقی و دیابت و برخی سرطانها یاری رساند. اطلاعات کمی در مورد پتانسیل تمایزی سلولهای بنیادی مغز استخوان وجود دارد و بیان این ژن قبل و بعد از تمایز سلولهای بنیادی مزانشیمی به سلول چربی مشخص نشده است(5، 4). این مطالعه به بررسی بیان این ژن قبل و بعد از تمایز پرداخته است.
مواد و روشها
در این مطالعه که به روش کارآزمایی بالینی بود، اقداماتی
به ترتیب زیر انجام گرفت:
1- جداسازی و کشت MSCs از مغز استخوان:
آسپیره مغز استخوان بعد از گرفتن رضایتنامه کتبی از افراد سالم از بیمارستان طالقانی تهران تهیه شد. سلولهای تک هستهای از طریق شیب غلظتی با استفاده از محلول فایکول جدا شد.
بدین منظور بعد از رقیق کردن محلول آسپیره به نسبت یک به یک با PBS ، به مدت 20 دقیقه با دور G 450 سانتریفیوژ شد. سلولهای تک هستهای دارای چگالی کمتری نسبت به فایکول بودند لذا بر روی آن قرار گرفتند. گلبولهای قرمز باقیمانده دارای وزن مولکولی بیشتری نسبت به فایکول هستند و در ته لوله رسوب میکنند. سپس مایعرویی که حاوی سلولهای تک هستهای است را برداشته و با دور G 300 به مدت 10 دقیقه سانتریفیوژ انجام شد. در نهایت 106 * 1 از سلولهای تک هستهای بر سانتیمتر مکعب به فلاسکهای T75 انتقال داده شد. فلاسکها در شرایط دمایی 37 درجه سانتیگراد و 5% CO2 نگهداری شده و هفتهای سه بار تعویض محیط انجام شد. جهت تکثیر سلولها از محیطDMEM با 10% FBS استفاده شد.
2- بررسی هویت سلولهای بنیادی مزانشیمی جداسازی شده:
مارکرهای سطحی CD90 ، CD34 ، CD37 و CD105 با استفاده از فلوسیتومتری مورد بررسی قرار گرفت. سلولها در غلظت 103 * 3 بر سانتیمتر مربع در 3 فلاسک T25 کشت داده شد و بعد از رسیدن به جمعیت سلولی 80%-70%، محیط تکثیری DMEM با محیط تمایزی استئوبلاستی تعویض شد.
برای تهیه محیط تمایزی استئوبلاستی از محیط کشت عمومی DMEM ، L- گلوتامین و 10% FBS استفاده شد که به این محیط کشت فاکتورهای دگزامتازون با غلظت نهایی10 نانومولار، بتا ـ گلیسرول فسفات با غلظت نهایی 5 میلیمولار و آسکوربات -2- فسفات با غلظت نهایی 50 میکروگرم بر میلیلیتر اضافه گردید. بعد از 21 روز، تمایز به سمت استخوان با استفاده از رنگآمیزی آلیزارین قرمز مورد تایید قرار گرفت.
جدول 1: توالی و اندازه آغازگرهای ژن LPL و ژن بتااکتین طراحی شده
| ژنها | آغازگرها | دما درجه سانتیگراد |
Amplicon Size |
| LPL-F | CCCTACAAAGTCTTCCATTAC | 49 | bp 197 |
| LPL-R | AGTTCTCCAATATCTACCTCTG | ||
| β-Actin-F | TGAAGATCAAGATCATTGCTCCTC | 54 | bp 168 |
| β-Actin-R | AGTCATAGTCCGCCTAGAAGC |
3- تمایز سلولهای مزانشیمی به آدیپوسیت:
برای القای تمایز به آدیپوسیت، 103 * 3 بر سانتیمتر مربع سلول در فلاسکهای T25 برده شده و بعد از رسیدن به جمعیت سلولی 70% ، از محیط اختصاصی آدیپوسیت به جای DMEM استفاده شد. برای تهیه محیط تمایزی آدیپوسیتی از محیط کشت عمومی DMEM ، L- گلوتامین و 10% FBS استفاده شد که به این محیط کشت، فاکتورهای دگزامتازون با غلظت نهایی 12 نانومولار و آسکوربات -2-فسفات با غلظت نهایی 50 میکروگرم بر میلیلیتر اضافه گردید. فلاسکها به مدت 14 روز در انکوباتور 37 درجه سانتیگراد با 5% Co2 نگهداری شد. سلولهای کنترل منفی فاقد محیط تمایزی بوده و تنها از 10% FBS + DMEM تغذیه میکردند. جهت بررسی تمایز از رنگآمیزی Oil Red O استفاده شد. جهت رنگآمیزی، ابتدا سلولها با 10% فرمالین(سیگما)، فیکس شد و بعد از شستشو، با محلول Oil Red O به مدت 5 دقیقه رنگ شدند.
4- طراحی آغازگر:
طراحی توالی آغازگرهای مربوطه به صورتExon Junction توسط Primer Blast انجام گرفت(جدول 1).
5- جداسازی RNA و RT-PCR :
استخراج RNA با استفاده از روش دستی و بر پایه جداسازی با فنل و کلروفرم انجام شد. برای ساخت cDNA، 5 میکروگرم RNA استخراج شده به همراه آغازگرهای اولیگو T در حضور آنزیم ترانس کریپتاز معکـوس قرار گرفت و سپسRT-PCR با استفاده از مستـر
میکس شرکت سیناژن انجام شد.
6- انجام Real time PCR :
الگوی بیان کمی mRNA ژن LPL در طول تمایز آدیپوسیتی سلولهای بنیادی مزانشیمی با محیط تمایزی با استفاده از روش quantitative Real Time PCR مورد ارزیابی قرار گرفت. بر این اساس آزمون quantitative Real Time PCR بر روی cDNA سلولهای بنیادی مزانشیمی قبل از تمایز(روز صفر) و بعد از تمایز(روز 14 تمایز) با آغازگرهای اختصاصی صورت گرفت.
7- کنترل کیفی RNA استخراج شده:
مقدار RNA استخراج شده به واسطه جذب در طول موج 260 نانومتر اندازهگیری شد. هم چنین خلوص RNA استخراج شده از طریق نسبت جذب در طول موج 260 نانومتر به 280 نانومتر سنجیده شد.
8- آنالیز دادهها:
پس از انجام PCR و خارج کردن نمونهها از دستگاه ترمال سایکلر، آنالیز کیفی ژن LPL با استفاده از الکتروفورز روی ژل آگاروز 2% و با بتا اکتین به عنوان کنترل داخلی مورد ارزیابی قرار گرفت. تمامی مراحل آزمایش به صورت سه بار تکرار انجام شد.
یافتهها
1- یافتههای حاصل از تمایز سلولهای بنیادی مزانشیمی به سمت استئوبلاست:
نتایج نشان داد که سلولهای بنیادی مزانشیمی جدا شده قدرت تمایز به سمت سلولهای استخوانی را داشتهاند(شکل 1).
برای القای تمایز به آدیپوسیت، 103 * 3 بر سانتیمتر مربع سلول در فلاسکهای T25 برده شده و بعد از رسیدن به جمعیت سلولی 70% ، از محیط اختصاصی آدیپوسیت به جای DMEM استفاده شد. برای تهیه محیط تمایزی آدیپوسیتی از محیط کشت عمومی DMEM ، L- گلوتامین و 10% FBS استفاده شد که به این محیط کشت، فاکتورهای دگزامتازون با غلظت نهایی 12 نانومولار و آسکوربات -2-فسفات با غلظت نهایی 50 میکروگرم بر میلیلیتر اضافه گردید. فلاسکها به مدت 14 روز در انکوباتور 37 درجه سانتیگراد با 5% Co2 نگهداری شد. سلولهای کنترل منفی فاقد محیط تمایزی بوده و تنها از 10% FBS + DMEM تغذیه میکردند. جهت بررسی تمایز از رنگآمیزی Oil Red O استفاده شد. جهت رنگآمیزی، ابتدا سلولها با 10% فرمالین(سیگما)، فیکس شد و بعد از شستشو، با محلول Oil Red O به مدت 5 دقیقه رنگ شدند.
4- طراحی آغازگر:
طراحی توالی آغازگرهای مربوطه به صورتExon Junction توسط Primer Blast انجام گرفت(جدول 1).
5- جداسازی RNA و RT-PCR :
استخراج RNA با استفاده از روش دستی و بر پایه جداسازی با فنل و کلروفرم انجام شد. برای ساخت cDNA، 5 میکروگرم RNA استخراج شده به همراه آغازگرهای اولیگو T در حضور آنزیم ترانس کریپتاز معکـوس قرار گرفت و سپسRT-PCR با استفاده از مستـر
میکس شرکت سیناژن انجام شد.
6- انجام Real time PCR :
الگوی بیان کمی mRNA ژن LPL در طول تمایز آدیپوسیتی سلولهای بنیادی مزانشیمی با محیط تمایزی با استفاده از روش quantitative Real Time PCR مورد ارزیابی قرار گرفت. بر این اساس آزمون quantitative Real Time PCR بر روی cDNA سلولهای بنیادی مزانشیمی قبل از تمایز(روز صفر) و بعد از تمایز(روز 14 تمایز) با آغازگرهای اختصاصی صورت گرفت.
7- کنترل کیفی RNA استخراج شده:
مقدار RNA استخراج شده به واسطه جذب در طول موج 260 نانومتر اندازهگیری شد. هم چنین خلوص RNA استخراج شده از طریق نسبت جذب در طول موج 260 نانومتر به 280 نانومتر سنجیده شد.
8- آنالیز دادهها:
پس از انجام PCR و خارج کردن نمونهها از دستگاه ترمال سایکلر، آنالیز کیفی ژن LPL با استفاده از الکتروفورز روی ژل آگاروز 2% و با بتا اکتین به عنوان کنترل داخلی مورد ارزیابی قرار گرفت. تمامی مراحل آزمایش به صورت سه بار تکرار انجام شد.
یافتهها
1- یافتههای حاصل از تمایز سلولهای بنیادی مزانشیمی به سمت استئوبلاست:
نتایج نشان داد که سلولهای بنیادی مزانشیمی جدا شده قدرت تمایز به سمت سلولهای استخوانی را داشتهاند(شکل 1).

شکل 1: راست به چپ : رنگآمیزی آلیزارین رد سلولهای بنیادی مزانشیمال تمایز یافته به سلول استخوان در روز 21 تمایز و سلولهای بنیادی مزانشیمال در روز 21 (کنترل)
2- نتایج فلوسیتومتری:
جهت تایید مزانشیم بودن سلولها، فلوسیتومتری برای مارکرهای CD90 ، CD105 ، CD31 و CD34 انجام گرفت که نتایج آن در نمودار 1 قابل مشاهده میباشد. نتایج حاصل از فلوسیتومتری نشان داد که سلولهای جداسازی شده به لحاظ ماهیت، سلول بنیادی مزانشیمی هستند که با بیان بالای CD105 ، CD90 ، CD73 و نیز عدم بیان CD34 مشخص میشوند.

نمودار 1: نتایج حاصل از فلوسیتومتری سلولهای بنیادی
3- رنگآمیزی BM-MSCs ضمن تمایز به آدیپوسیتها:
MSCs بعد از تمایز، مورفولوژی سلولهای آدیپوسیت را به خود گرفته و رنگآمیزی Oil Red O دانههای قرمز حاوی تجمع لیپیدها را در داخل سلولهای آدیپوسیت نشان میدهد(شکل 2).

شکل 2: راست به چپ: رنگآمیزیOil- Red- O سلولهای بنیادی مزانشیمال تمایز یافته به چربی در روز 14 و سلولهای بنیادی مزانشیمال در روز 14 تمایز(کنترل)
4- نتایج حاصل از بیان کیفی ژن LPL :
در شکل 3 نمایی از بیان کیفی ژن LPL قبل و بعد از تمایز BM-MSCs آورده شده است. همان طور که مشاهده میشود، این ژن قبل از تمایز فاقد بیان بوده با این حال، بعد از تمایز، ژن LPL بیان شده و بیان آن کاملاً مشهود است.

شکل 3 : نمای ژل الکترفورز بعد از الکتروفورز محصول PCR : 1) beta actin قبـل از تمایـز، 2) LPL قبل از تمایز 3) سایز مارکر bp 50 4) beta actin بعد از تمایز 5) LPL بعد از تمایز 6) NTC
5- پس از انجام آزمایش Real Time PCR میانگین حاصل از 3 نمونه به شرح زیر بود(جدول 2):
جدول 2: Ct های میانگین مربوط به ژن LPL و β-actin و انحراف معیار آنها(C = control ، UD = undifferentiated ، D = differentiated و T=test)
| SD | T (D) Gene |
SD | C(UD) Gene |
SD | T(D) Housekeeping |
SD | C(UD) Housekeeping |
| 09/2 | 8/31 | - | - | 88/0 | 92/22 | 22/1 | 51/28 |
| 55/1 | 10/27 | - | - | 1/1 | 11/20 | 98/0 | 10/27 |
| 65/1 | 27 | - | - | 12/1 | 10/23 | 28/1 | 05/30 |
به علت عدم بیان ژن LPL قبل از تمایز و بیان آن بعد از تمایز، امکان مقایسه آن و بیان مقدار عددی این افزایش بیان امکانپذیر نمیباشد و تنها میتوان از نظر کیفی بیان این ژن را بررسی نمود.
بحث
در این مطالعه سلولهای بنیادی مزانشیمی مغز استخوان انسانی(H-MSCs) به وسیله شیب غلظتی فایکول جدا شد. مارکرهای سطحی این سلولها به وسیله فلوسیتومتری تایید شد و تمایز به سلول چربی و استخوان به وسیله دستورالعمل دگزامتازون انجام گرفت و به وسیله رنگآمیزی تایید شد. سپس بیان کمی و کیفی ژن LPL به عنوان یکی از مهمترین ژنهای دخیل در تمایز چربی، قبل و بعد از تمایز به آدیپوسیت به وسیله Real Time PCR بررسی شد. مطالعههای بسیاری در زمینه تمایز سلولها و هم چنین ردههای سلولی مختلف از جمله BMS2 ، UAMS33 ، 2T3 به سمت سلول چربی انجام شده است(9-6).
هم چنین مطالعههایی بر روی تمایز سلولهای بنیادی مزانشیمی مغز استخوان انسانی نیز انجام شده است. به عنوان مثال در مطالعهای در سال 2013 مشخص شد که هیپوکسی از تمایز سلولهای BM-MSCs بـه سمـت سلولهای آدیپوسیتی جلوگیری میکند و در مطالعـهای در
سال 2015 ، تمایـز MSC ها بـه ردههـای استئوژنیک، آدیپوژنیک، کندروژنیک و میوژنیک بررسی شد و توانایی MSC ها در تمایز به چربی با مشاهده وزیکولهای چربی پس از رنگآمیزی Oil-Red-O به اثبات رسیده ولی اشارهای بر روی بیان ژن LPL نشده است(11، 10). ساخت چربی فرآیندی پیچیده است که نیازمند همکاری بین فاکتورهای مختلف از جمله LPL ، PPARγ و C/EBPs میباشد (12).
تمایز BM-MSCs به سلولهای چربی دارای اهمیت زیادی است. استئوپورزیس و افزایش خطر شکستگی استخوان به علت افزایش سن، نه تنها به دنبال کاهش سلولهای استـخوانی است، بلکه جایـگزینی بافـت مغز استـخوان با چربـی نیـز میتواند در آن اثرگــذار باشد(15-13). در نتیجه علاوه بر تحریک استئوژنزیس، نیاز به مهار آدیپوژنزیس نیز هست(17، 16). از این رو مهار تمایز BM-MSCs به آدیپوسیت با واسطه سرکوب بیان LPL میتواند مفید باشد. امروزه چاقی به صورت یک نگرانی تهدید کننده حیات در آمده است(20-18). هم چنین یکی از عوارض کم خونی آپلاستیک، افزایش سلولهای چربی در مغز استخوان است که منجر به اختلال در حمایت داربست مغز استخوان از سلولهای بنیادی خونساز میشود. چنین نقصی میتواند به علت تمایز بیش از حد BM-MSCs به سلولهای چربی باشد. مطالعهها نشان دادهاند که مهار چربیسازی در مبتلایان به کم خونی آپلاستیک میتواند به طور چشمگیری نیاز به پیوند مغز استخوان را کاهش دهد(28-20). اخیراً مشخص شده که BM-MSCs جدا شده از بیماران لوسمی حاد میلوئیدی (AML)، دارای قدرت بیشتری در تمایز به سمت سلولهای چربی میباشند و تعداد این سلولها در مغز استخوان این مبتلایان که دارای نقص در تولید مناسب سلولهای خونیاند، نیز بیشتر است(29). همان طور که پیشتر نیز اشاره شد، LPL با در اختیار گذاشتن منبعی از اسیدهای چرب برای سلولهای سرطانی، در افزایش رشد و بقای این سلولها مؤثر بوده و به عنوان هدفی مناسب برای شیمی درمانی مد نظر قرار گرفته است.
نتیجهگیری
در این مطالعه ژن LPL بعد از تمایز، بیان بسیار بالایی در مقایسه با سلولهای بنیادی مزانشیمی مغز استخوان انسانی به عنوان کنترل داشت.
مشاهدات ما در این مطالعه میتواند به عنوان یکی از فرآیندهای درمانی برای بیماریهای اشاره شده به کار رود و با مهار تمایز MSCs به چربی، بهبودی شرایط بیماری را سبب شود. شاید بتوان با مهار بیان آن در درمان بیماریهای مختلف از جمله چاقی مفرط، آنمی آپلاستیک، پوکی استخوان، برخی سرطانها به خصوص سرطان پروستات، آلزایمر و دیابت از آن بهره برد.
تشکر و قدردانی
لازم است که از اساتید راهنما در سازمان انتقال خون ایران و گروه هماتولوژی دانشکده پزشکی دانشگاه تربیت مدرس و سایر افرادی که بنده را به نحوی در انجام این پژوهش یاری نمودند، تشکر نمایم. این مقاله از پایان نامه کارشناسی ارشد اینجانب که مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد منتج شده است.
نوع مطالعه: پژوهشي |
موضوع مقاله:
سلولهاي بنيادي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





