جلد 13، شماره 2 - ( تابستان 1395 )
جلد 13 شماره 2 صفحات 145-138 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Maziri P, Asaadi Tehrani G, Mirzaahmadi S. Relationship between GPIa(807C/T) and GPIIIa(PLA1/PLA2) gene plymorphisms and recurrent spontaneous abortion in women in Tehran Province. bloodj 2016; 13 (2) :138-145
URL: http://bloodjournal.ir/article-1-958-fa.html
URL: http://bloodjournal.ir/article-1-958-fa.html
مزیری پریسا، اسعدی تهرانی گلناز، میرزا احمدی سینا. ارتباط بین پلیمورفیسم های ژنی GPIa(807C/T) و GPIIIa(pLA1/pLA2) در زنان مبتلا به سقط مکرر خودبهخودی در استان تهران. فصلنامه پژوهشی خون. 1395; 13 (2) :138-145
زنجان، ایران
متن کامل [PDF 362 kb]
(2803 دریافت)
| چکیده (HTML) (7214 مشاهده)
مقدمه
سقط مکرر خودبهخودی اغلب به صورت دو یا بیش از دو سقط متوالی پیش از هفته 20 بارداری تعریف میشود که تقریباً در 1% کل بارداریها اتفاق میافتد(3-1). از مهمترین علل آن میتوان به فاکتورهای آناتومیک، ایمونولوژیک، ژنتیک، آندوکرین، ترومبوفیلیک،فاکتورهای محیطی و عوامل ناشناخته اشاره نمود(4). در 55% بیماران دچار سقط مکرر خودبهخودی، اختلال در فاکتورهای ترومبوفیلی گزارش شدهاست(5). وقوع ترومبوز در مویرگهای جفت باعث اختلال در روند گردش خون بین مادر و جنین شده و در نهایت با کاهش اکسیژنرسانی منجر به سقط جنین میگردد(6). گیرندههای پلاکتی، به دلیل اهمیتشان در برهمکنش با کلاژن موجود در سطوح اندوتلیال عروق، فاکتورهای مناسبی جهت مطالعه بیماریهای ناشی از ترومبوز نابهجا هستند. اینتگرین پلاکتی(GPIa/IIa) α2β1 ، گیرنده اصلی کلاژن میباشد و از طریق اتصال به کلاژن تحتانی سلولهای اندوتلیال با واسطه فاکتور ونویلبراند، به تشکیل لخته توسط پلاکتها کمک میکند(10-7). ژن GPIa بر روی کرموزوم 5 (در موقعیت q23.31) به طول Kb110 قرار دارد و شامل 30 اگزون است(11). پلیمورفیسم 807C/T در این ژن در انتهای '3 اگزون 7 (در نوکلئوتید 807) واقع شده و اسید آمینه فنیل آلانین را رمزگردانی مینماید. جهش تک نوکلئوتیدی در ناحیه مذکور باعث تبدیل نوکلئوتید سیتوزین به تیمین میگردد، که علیرغم عدم تغییر در بیان فنیلآلانین، در سطح بیان اینتگرین α2β1 بر روی پلاکت تاثیرگذار میباشد(12).
افراد واجد ژنوتیپ TT ، بیشترین تعداد گیرنده و افراد با ژنوتیپ CC کمترین تعداد گیرنده را دارا هستند، درحالی که فراوانی گیرنده در افراد هتروزیگوت(CT) حدواسط افـراد همـوزیگوت نـرمال و هموزیگـوت بیمار است(13).
اینتگرینαIIbβ3(GPIIb/IIIa) ، گیرنده اصلی گلیکوپروتئینی فیبرینوژن و فراوانترین اینتگرین پلاکت است. این گیرنده چسبندگی پلاکت و تشکیل لخته را وساطت میکند(15، 14). ژن GPIIIa با 9 اگزون و طول 60 کیلو باز بر روی کروموزوم 17 در ناحیه q21.32 قرار دارد(16، 11). پلیمورفیسم pLA1/pLA2یا پلیمورفیسم آنتیژن اختصاصی پلاکتی HPA-1a/1b (Human Platelet Antigen-1a/1b) در انتهای '3 اگزون 2 ژن GPIIIa بر روی میزان بیان گیرنده αIIbβ3 مؤثر میباشد. تبدیل تیمین به سیتوزین در نتیجه یک جهش نقطهای در نوکلئوتید 1565 در اگزون شماره 2 ژن GPIIIa ، منجر به جایگزینی لوسین به پرولین در اسید آمینه 33 زیر واحد β گیرنده پلاکتی αIIbβ3 میگردد(18، 17). آلل جهش یافتهPLA2 (HPA-1b)، با افزایش در تعداد گیرنده αIIbβ3 و افزایش تجمع پلاکتی همراه میباشد(20، 19). HPA-1a به عنوان ایمنیزاترین آلوآنتیژن شناخته شدهاست. اگر مادر فاقد HPA1a و جنین وی دارای این آنتیژن باشد، ممکن است پلاکتهای جنین وارد گردش خون مادر شده و علیه آنها آنتیبادی ضد HPA-1a ساخته شود. در این حالت احتمال ترومبوسیتوپنی آلوایمیون نوزادان(Neonatal Alloimmunized Thrombocytopenia) و سقط جنین وجود دارد(22، 21). مطالعههای بسیار محدودی به بررسی ارتباط پلیمورفیسمهای 807C/T و pLA1/pLA2 با سقط مکرر خودبهخودی پرداخته است، لذا در تحقیق حاضر ارتباط بین پلیمورفیسمهای مذکور با سقط مکرر خودبهخودی مورد ارزیابی قرار گرفت.
مواد و روشها
جمعیت مورد مطالعه:
در یک مطالعه مورد ـ شاهدی،50 خانم با سابقه حداقل دو سقط مکرر خودبهخودی به عنوان گروه بیماران و 50 خانم دارای حداقل دو بارداری موفق و بدون سابقه سقط به عنوان گروه شاهد از میان مراجعهکنندگان به بیمارستان فوق تخصصی زنان و زایمان صارم تهران با توجه به پرونده پزشکی بیماران و نظر متخصص زنان، انتخاب شدند. عوامل مؤثر در سقط مکرر خودبهخودی مانند کاریوتیپ، عوامل آناتومی، عوامل هورمونی، عوامل عفونی و عوامل ایمونولوژیک در بیماران مورد ارزیابی قرار گرفتند و در تمامی موارد طبیعی بودند. به منظور رعایت اخلاق پزشکی از بیماران رضایتنامه دریافت گردید(23).
جدول1: توالی آغازگرها و میزان محصول PCR پلیمورفیسم 807C/T در ژن GPIa
(آغازگرها با استفاده از نرمافزار 5 Oligo و Gene Runner طراحی شده و در سایت NCBI با توالی ژن هدف Blast گردیدند)
جدول2: توالی آغازگرها، آنزیم محدودالاثر، محصولPCR وRFLP پلیمورفیسم pLA1/pLA2 در ژن GPIIIa .
(آغازگرها با استفاده از نرمافزار Oligo 5 و Gene Runner طراحی شده و در سایت NCBI با توالی ژن هدف Blast گردیدند)
تعیین ژنوتیپ:
با استفاده از کیت استخراج DNA اختصاصی شرکت سیناکلون،DNA ژنومیک از خون محیطی استخراج شد. سپس واکنش زنجیره پلیمراز با استفاده از آغازگرهای اختصاصی ژن GPIa به روشTetra-PrimerARMS-PCR و آغازگرهای ژن GPIIIa به روش PCR-RFLP انجام گرفت(جداول 1 و 2).
واکنش Tetra-PrimerARMS-PCR در حجم 20 میکرولیتر حاوی 200 نانوگرم DNA ژنومیک، 10 میکرولیتر(Master Mix)X Taq Premix2 (پارس توس، ایران)، 10 پیکومول از هر آغازگر (ژن فناوران، ایران) و 6 میکرولیتر آب دیونیزه، صورت گرفت. واکنش PCR-RFLP در حجم50 میکرولیتر حاوی 200 نانوگرم DNA ژنومیک، 25 میکرولیتر(Master Mix) X Taq Premix 2 (پارس توس، ایران)، 20 پیکومول از هر آغازگر(ژن فناوران، ایران) و 21 میکرولیتر آب دیونیزه، انجام شد. در هر دو ژن، تکثیر در 32 چرخه، دمای 94 درجه سانتیگراد به مدت 45 ثانیه، دمای اتصال 8/55 درجه سانتیگراد به مدت 1 دقیقه در ژن GPIa، دمای اتصال 1/56 درجه سانتیگراد در ژن GPIIIa و 72 درجه سانتیگراد به مدت 45 ثانیه انجام شد. دناتوراسیون اولیه به مدت 5 دقیقه در 94 درجه سانتیگراد و طویلسازی نهایی به مدت 5 دقیقه در دمای 72 درجه سانتیگراد صورت گرفت. روش PCR - ARMS Primer-Tetra یک روش تکثیری قدرتمند برای مشخص کردن جهشهای نقطهای است. در این روش از دو آغازگر خارجی(Outer primer) به نامهای fop و rop که به نواحی اطراف نوکلئوتید 807 در اگزون 7 ژن GPIa متصل میشوند، استفاده گردید. اتصال آغازگرهای خارجی به نواحی اطراف جهش نقطهای موجب اطمینان از PCR صحیح در محل SNP مد نظر میگردد. وجود باند bp 350 بر روی ژل آگاروز حاکی از اتصال آغازگرهای خارجی میباشد. دو آغازگر داخلی (Inner primer) نیز در این روش استفاده شد. آغازگر داخلی IPT در حضور جهش تک نوکلئوتیدی سیتوزین به تیمین متصل میگردد. آغازگر داخلی IPC هنگامی که جهش مذکور در نوکلئوتید 807 صورت نگرفته باشد، به این ناحیه متصل میشود. محصول PCR با الکتروفورز در ژل آگاروز 2% تفکیک گردید، که در فرد هموزیگوت سالم با ژنوتیپ CC دو باند 174 و 350 جفت بازی، در فرد هموزیگوت بیمار با ژنوتیپ TT دو باند 234 و 350 جفت بازی و در فرد هتروزیگوت با ژنوتیپ CT هر سه باند 174، 234 و 350 جفت بازی رؤیت گردید(شکل1).
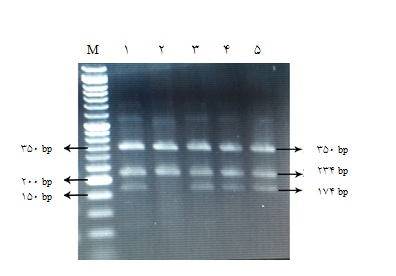
شکل1: محصول PCR پلیمورفیسم 807C/T ژنGPIa روی ژل آگاروز 2% . چاهک M: مارکر bp50 ؛ چاهکهای 1، 3، 4، 5: 807C/T ، هتروزیگوت(bp350، 234، 174)؛ چاهک2: 807T/T ، هموزیگوت بیمار(bp 350 ، bp 234).
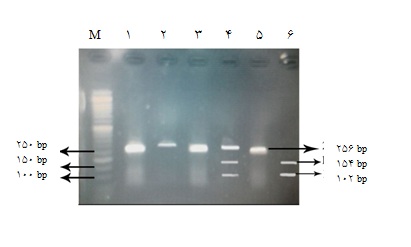
شکل2 : نتایج الکتروفورز محصول PCR پس از RFLP برای پلیمورفیسم pLA1/pLA2 روی ژل آگاروز 3%. چاهک M: مارکر bp 50 ؛ چاهکهای 1، 3، 5: محصول PCR قبل از RFLP ؛ چاهک 2 : pLA1/pLA1، هموزیگوت سالم(bp 256)؛ چاهک 4 : pLA1/pLA2 ، هتروزیگوت(bp 256، 154 ،102)؛ چاهک6 : pLA2/pLA2 ، هموزیگوت بیمار(bp 102، 154).
تحلیل آماری:
مشاهدهها، توسط نرمافزار SPSS (نگارش 16) مورد تحلیل قرار گرفت. توزیع ژنوتیپهای هر موتاسیون، فرکانس هموزیگوت و هتروزیگوت در دو گروه بیمار و شاهد با استفاده از مربع کای و پیرسون مورد سنجش قرار گرفت. p-value کمتر از 05/0 به عنوان سطح معنادار، در نظر گرفته شد.
یافتهها
در این تحقیق، پلیمورفیسمهای 807C/T و pLA1/pLA2 در50 خانم با سابقه سقط مکرر خودبهخودی که از نظر کاریوتیپ، عوامل آناتومی، عوامل هورمونی، عوامل عفونی و عوامل ایمونولوژیک طبیعی بودند، مورد بررسی قرار گرفتند(جدول 3).
فراوانی ژنوتیپی مشاهده شده در گروه بیمار و شاهد به ترتیب 24/0 در مقابل44/0 برای ژنوتیپCC ، 42/0 در مقابل 4/0 برای ژنوتیپ CT و 34/0 در مقابل 16/0 برای ژنوتیپ TT بود. فراوانی ژنوتیپی در گروه بیمار و شاهد، ارتباط معناداری را نشان داد(045/0p=). فراوانی آللT و C در خانمهای مبتلا به سقط مکرر به ترتیب عبارت بود از 55/0 و 45/0 و در گروه کنترل این فراوانی برابر با 36/0 و 64/0 بود. دو گروه از نظر فراوانی آللی اختلاف معناداری نشان دادند(007/0p=).
جدول 3: مقایسه فراوانی آللی و ژنوتیپی حاصل از پلیمورفیسم 807C/T ژن GPIa در خانمهای دچار سقط مکرر و نرمال
جدول 4: مقایسه فراوانی آللی و ژنوتیپی پلیمورفیسم pLA1/pLA2 ژن GPIIIa در خانمهای دچار سقط مکرر و نرمال
در مورد پلیمورفیسم pLA1/pLA2 ، فراوانی ژنوتیپی در زنان دارای سقط مکرر و زنان گروه شاهد، به ترتیب 8/0 در مقابل 88/0 برای ژنوتیپ PLA1/PLA1 ، 14/0 در مقابل 1/0 برای ژنوتیپ pLA1/pLA2 و 06/0 در مقابل02/0 برای ژنوتیپ PLA2/PLA2 بود(جدول4). به منظور محاسبه فراوانی آللی، همواره میتوان از فراوانی ژنوتیپی استفاده نمود، در صورتی که جهت محاسبه فراوانی ژنوتیپی از فراوانی آللی، میبایست شرایط تعادل هاردی- واینبرگ که بر مبنای آمیزش تصادفی است، برقرار گردد(24). بر این اساس، فراوانی آللهای PLA2 و PLA1 در خانمهای طبیعی به ترتیب 07/0 و 93/0 و در خانمهای واجد شرایط سقط مکرر، به ترتیب 13/0 و 87/0 محاسبه گردید (جدول 4).
نتایج نشـان داد فراوانی ژنوتیپ PLA2/PLA2 در افراد
بیمار بهطور معناداری بیشتر از افراد شاهد نمیباشد. هم چنین، فراوانی آلل PLA2 در جمعیت بیمار به طور معناداری بیشتر از افراد شاهد نبود.
بحث
آنالیز پلیمورفیسم ژنهای مؤثر در عملکرد گیرندههای پلاکتی، به دلیل نقش مهمی که تشکیل لختههای نابهجا دارند، میتواند در موارد مختلفی در زنان دچار سقط مکرر مورد مطالعه قرار گیرد. بر اساس نتایج حاصل از این تحقیق، پلیمورفیسم 807C/T در بیماران شیوع بیشتری را نشان داد. با این حال نقش پلیمورفیسم pLA1/pLA2 در سقط مکرر افراد مورد مطالعه تایید نشد و اختلاف معناداری بین گروه بیمار و شاهد مشاهده نگردید. پلیمورفیسم807C/T ، یکی از چند شکلیهای شایع در ژن GPIa است که ارتباط آن با برخی بیماریهای قلبی-عروقی، انسداد ورید شبکیه چشم و سکتههای مغزی بررسی شده است(27-25). نتایج مطالعه حاضر نشان داد که پلیمورفیسم 807C/T با سقط مکررخودبهخودی مرتبط است و فراوانی ژنوتیپ جهش یافته TT در جمعیت بیمار به طور معناداری بیشتر از گروه شاهد میباشد. در سال 2013، اولینبار توسط زنوزی در تبریز، ارتباط پلیمورفیسم 807C/T با سقط مکرر از طریق روش ARMS-PCR بررسی گردید و ارتباطی میان این چند شکلی و سقط مکرر خودبهخودی مشاهده نشد. فراوانی ژنوتیپ جهش یافته در مطالعه حاضر در تهران، 34/0 در جمعیت بیمار و در مطالعه زنوزی به میزان 12/0 گزارش شدهاست(28). تفاوت در نتایج فوق که میتواند به دلیل الگویهای ژنتیکی متفاوت در قومیتهای متنوع ایرانی باشد ، غیر قابل انتظار نبود با این وجود جهت دستیابی به یافتههای قطعی، تحقیقات بیشتر در سایر قومیتهای ایرانی و در جمعیت های مورد مطالعه بیشتر پیشنهاد میگردد. مطالعههای متعددی در مورد اثر پلیمورفیسم pLA1/pLA2 در شکلگیری ترومبوز نابهجا، بیماریهای قلبی- عروقی و سکتههای مغزی وجود دارد(31-29). اخیراً به نقش این پلیمورفیسم به عنوان یک عامل خطر در سقط مکرر توجه زیادی شده است. در مطالعه حاضر، فراوانی ژنوتیپی PLA2/PLA2 و pLA1/pLA2 در زنان دچار سقط مکرر به ترتیب 06/0 و 14/0 بود که نشان میدهد فراوانی پلیمورفیسم pLA1/pLA2 در جمعیت بیمار نسبت به گروه کنترل، افزایش معناداری ندارد و پلیمورفیسم مذکور در مستعد شدن افراد به سقط مکرر مؤثر نیست. هم چنین بر طبق مطالعههایی که توسط جدی-تهرانی و همکاران در سال 2011 در ایران انجام شده است، ارتباط معناداری بین پلیمورفیسم pLA1/pLA2 ژن GPIIIa و سقط مکرر مشاهده نشده است(6). این عدم ارتباط معنادار در مطالعه پیهوچ و همکاران (آلمان، 2001) نیز مشاهده شده است(32). در مقابل، مطالعههای دیگری از جمله مطالعههای انجام شده توسط روزی و همکاران(2005، ایتالیا)، لامبرینوداکی(2010، ایتالیا) و دو مطالعه انجام گرفته توسط ایوانو و همکاران در سالهای 2008 و 2010 در بلغارستان، ارتباط معناداری بین پلیمورفیسم pLA1/pLA2 با سقط مکرر خودبهخودی نشان میدهند(35-32). فراوانی ژنوتیپ جهش یافته در مطالعه روزی در ایتالیا، 44/0 برآورد شده که تقریباً 7 برابر فراوانی ژنوتیپ PLA2/PLA2 در مطالعه حاضر است(35). در مطالعههای ایوانو در بلغارستان و لامبرینوداکی در یونان، فراوانی افراد ناقل این پلیمورفیسم به ترتیب 29/0 و 56/0 گزارش شده است که در مقایسه با فراوانی افراد
هتروزیگوت در مطالعه حاضر، در ایران فراوانی بیشتری دیده میشود(36-34). این نتایج مختلف به دلیل تفاوت در الگوهای ژنتیکی و نژادی در جمعیتهای مورد مطالعه، تعداد افراد مورد مطالعه، رانش ژنتیکی، مهاجرت و انتخاب طبیعی است. به همین منظور، جهت بررسی ارتباط پلیمورفیسمهای 807C/T و pLA1/pLA2 با سقط مکرر خودبهخودی، باید مطالعههای بیشتری در آینده انجام گیرد. در صورت شیوع بالای هر کدام از پلیمورفیسمهای مذکور در زنان مبتلا به سقط مکرر، استفاده از داروهای ضد انعقاد و مهارکنندههای گیرنده پلاکتی در طی بارداری برای پیشگیری از سقط نتیجه بخش خواهد بود.
نتیجهگیری
با توجه به نتایج به دست آمده از این مطالعه، پلیمورفیسم pLA1/pLA2 در بروز سقط مکرر خود بهخودی نقشی ندارد. در مقابل، افراد حامل آلل موتانت 807T مستعد به سقط مکرر میباشند. جهت بررسی دقیقتر این فاکتورها، انجام تحقیقات بیشتر پیشنهاد میگردد.
تشکر و قدردانی
نویسندگان این مقاله از کارکنان مرکز تحقیقات بیولوژی دانشگاه آزاد اسلامی زنجان به دلیل همکاری صمیمانه در انجام این پروژه، کمال تشکر و امتنان را دارند.
متن کامل: (2393 مشاهده)
ارتباط بین پلیمورفیسم های ژنی GPIa(807C/T) و GPIIIa(pLA1/pLA2)
در زنان مبتلا به سقط مکرر خودبهخودی در استان تهران
پریسا مزیری1، گلناز اسعدی تهرانی2، سینا میرزا احمدی3
چکیده
سابقه و هدف
سقط مکرر خودبهخودی، به ختم بارداری قبل از هفته 20 حاملگی اطلاق میشود. در برخی از زنان با سابقه سقط مکرر، جهشهای ژن ترومبوفیلیک منجر به ایجاد لختههای خونی در عروق جفت، کاهش اکسیژنرسانی و مرگ جنین میشود. هدف از این مطالعه، بررسی ارتباط پلیمورفیسمهای 807C/T (ژن GPIa) و pLA1/pLA2 (ژن GPIIIa) با سقط مکرر خودبهخودی بود.
مواد و روشها
در این مطالعه مورد - شاهدی، 50 خانم با سابقه حداقل دو سقط مکرر با علت نامشخص و 50 خانم بدون سابقه سقط مکرر و دارای حداقل دو بارداری موفق در استان تهران انتخاب شدند و در مرکز تحقیقات بیولوژی دانشگاه آزاد اسلامی زنجان در سال 1393 مورد بررسی قرار گرفتند. پلیمورفیسمهای 807C/T وpLA1/pLA2 به ترتیب از طریق روشهای Tetra-Primer ARMS-PCR وPCR-RFLP ارزیابی شدند. نتایج به دست آمده از تعیین ژنوتیپ این پلیمورفیسمها توسط نرمافزار 16SPSS و آزمون کایدو تجزیه و تحلیل گردیدند.
یافتهها
افراد واجد ژنوتیپ 807TT در جمعیت بیمار بیشتر از افراد شاهد بود(045/0p=). در مقابل شیوع ژنوتیپ pLA2/pLA2 در جمعیت بیمار و شاهد بسیار کم بود. در این تحقیق فراوانی ژنوتیپهای 807TT و pLA2/pLA2 به ترتیب در گروه بیمار و شاهد(34/0 ، 16/0) و (06/0 ، 02/0) گزارش شد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد که پلیمورفیسم 807C/T با سقط مکرر خودبهخودی، رابطه معناداری دارد. در مقابل اختلاف معناداری بین افراد بیمار و شاهد در پلیمورفیسم pLA1/pLA2 وجود ندارد.
کلمات کلیدی: سقط خودبهخودی، GPIa ، GPIIIa
تاریخ دریافت : 3/3 /94
تاریخ پذیرش : 8/12/94
1- کارشناس ارشد زیستشناسی ژنتیک ـ گروه ژنتیک دانشکده علوم پایه، دانشگاه آزاد اسلامی واحد زنجان ـ زنجان ـ ایران
2- مؤلف مسئول: PhD ژنتیک مولکولی ـ استادیار گروه ژنتیک دانشکده علوم پایه، دانشگاه آزاد اسلامی واحد زنجان ـ زنجان ـ اعتمادیه ـ ایران ـ کدپستی: 451568145
3- PhD ژنتیک مولکولی ـ استادیار گروه ژنتیک دانشکده علوم پایه، دانشگاه آزاد اسلامی واحد زنجان ـ زنجان ـ ایران
در زنان مبتلا به سقط مکرر خودبهخودی در استان تهران
پریسا مزیری1، گلناز اسعدی تهرانی2، سینا میرزا احمدی3
چکیده
سابقه و هدف
سقط مکرر خودبهخودی، به ختم بارداری قبل از هفته 20 حاملگی اطلاق میشود. در برخی از زنان با سابقه سقط مکرر، جهشهای ژن ترومبوفیلیک منجر به ایجاد لختههای خونی در عروق جفت، کاهش اکسیژنرسانی و مرگ جنین میشود. هدف از این مطالعه، بررسی ارتباط پلیمورفیسمهای 807C/T (ژن GPIa) و pLA1/pLA2 (ژن GPIIIa) با سقط مکرر خودبهخودی بود.
مواد و روشها
در این مطالعه مورد - شاهدی، 50 خانم با سابقه حداقل دو سقط مکرر با علت نامشخص و 50 خانم بدون سابقه سقط مکرر و دارای حداقل دو بارداری موفق در استان تهران انتخاب شدند و در مرکز تحقیقات بیولوژی دانشگاه آزاد اسلامی زنجان در سال 1393 مورد بررسی قرار گرفتند. پلیمورفیسمهای 807C/T وpLA1/pLA2 به ترتیب از طریق روشهای Tetra-Primer ARMS-PCR وPCR-RFLP ارزیابی شدند. نتایج به دست آمده از تعیین ژنوتیپ این پلیمورفیسمها توسط نرمافزار 16SPSS و آزمون کایدو تجزیه و تحلیل گردیدند.
یافتهها
افراد واجد ژنوتیپ 807TT در جمعیت بیمار بیشتر از افراد شاهد بود(045/0p=). در مقابل شیوع ژنوتیپ pLA2/pLA2 در جمعیت بیمار و شاهد بسیار کم بود. در این تحقیق فراوانی ژنوتیپهای 807TT و pLA2/pLA2 به ترتیب در گروه بیمار و شاهد(34/0 ، 16/0) و (06/0 ، 02/0) گزارش شد.
نتیجهگیری
نتایج مطالعه حاضر نشان داد که پلیمورفیسم 807C/T با سقط مکرر خودبهخودی، رابطه معناداری دارد. در مقابل اختلاف معناداری بین افراد بیمار و شاهد در پلیمورفیسم pLA1/pLA2 وجود ندارد.
کلمات کلیدی: سقط خودبهخودی، GPIa ، GPIIIa
تاریخ دریافت : 3/3 /94
تاریخ پذیرش : 8/12/94
1- کارشناس ارشد زیستشناسی ژنتیک ـ گروه ژنتیک دانشکده علوم پایه، دانشگاه آزاد اسلامی واحد زنجان ـ زنجان ـ ایران
2- مؤلف مسئول: PhD ژنتیک مولکولی ـ استادیار گروه ژنتیک دانشکده علوم پایه، دانشگاه آزاد اسلامی واحد زنجان ـ زنجان ـ اعتمادیه ـ ایران ـ کدپستی: 451568145
3- PhD ژنتیک مولکولی ـ استادیار گروه ژنتیک دانشکده علوم پایه، دانشگاه آزاد اسلامی واحد زنجان ـ زنجان ـ ایران
مقدمه
سقط مکرر خودبهخودی اغلب به صورت دو یا بیش از دو سقط متوالی پیش از هفته 20 بارداری تعریف میشود که تقریباً در 1% کل بارداریها اتفاق میافتد(3-1). از مهمترین علل آن میتوان به فاکتورهای آناتومیک، ایمونولوژیک، ژنتیک، آندوکرین، ترومبوفیلیک،فاکتورهای محیطی و عوامل ناشناخته اشاره نمود(4). در 55% بیماران دچار سقط مکرر خودبهخودی، اختلال در فاکتورهای ترومبوفیلی گزارش شدهاست(5). وقوع ترومبوز در مویرگهای جفت باعث اختلال در روند گردش خون بین مادر و جنین شده و در نهایت با کاهش اکسیژنرسانی منجر به سقط جنین میگردد(6). گیرندههای پلاکتی، به دلیل اهمیتشان در برهمکنش با کلاژن موجود در سطوح اندوتلیال عروق، فاکتورهای مناسبی جهت مطالعه بیماریهای ناشی از ترومبوز نابهجا هستند. اینتگرین پلاکتی(GPIa/IIa) α2β1 ، گیرنده اصلی کلاژن میباشد و از طریق اتصال به کلاژن تحتانی سلولهای اندوتلیال با واسطه فاکتور ونویلبراند، به تشکیل لخته توسط پلاکتها کمک میکند(10-7). ژن GPIa بر روی کرموزوم 5 (در موقعیت q23.31) به طول Kb110 قرار دارد و شامل 30 اگزون است(11). پلیمورفیسم 807C/T در این ژن در انتهای '3 اگزون 7 (در نوکلئوتید 807) واقع شده و اسید آمینه فنیل آلانین را رمزگردانی مینماید. جهش تک نوکلئوتیدی در ناحیه مذکور باعث تبدیل نوکلئوتید سیتوزین به تیمین میگردد، که علیرغم عدم تغییر در بیان فنیلآلانین، در سطح بیان اینتگرین α2β1 بر روی پلاکت تاثیرگذار میباشد(12).
افراد واجد ژنوتیپ TT ، بیشترین تعداد گیرنده و افراد با ژنوتیپ CC کمترین تعداد گیرنده را دارا هستند، درحالی که فراوانی گیرنده در افراد هتروزیگوت(CT) حدواسط افـراد همـوزیگوت نـرمال و هموزیگـوت بیمار است(13).
اینتگرینαIIbβ3(GPIIb/IIIa) ، گیرنده اصلی گلیکوپروتئینی فیبرینوژن و فراوانترین اینتگرین پلاکت است. این گیرنده چسبندگی پلاکت و تشکیل لخته را وساطت میکند(15، 14). ژن GPIIIa با 9 اگزون و طول 60 کیلو باز بر روی کروموزوم 17 در ناحیه q21.32 قرار دارد(16، 11). پلیمورفیسم pLA1/pLA2یا پلیمورفیسم آنتیژن اختصاصی پلاکتی HPA-1a/1b (Human Platelet Antigen-1a/1b) در انتهای '3 اگزون 2 ژن GPIIIa بر روی میزان بیان گیرنده αIIbβ3 مؤثر میباشد. تبدیل تیمین به سیتوزین در نتیجه یک جهش نقطهای در نوکلئوتید 1565 در اگزون شماره 2 ژن GPIIIa ، منجر به جایگزینی لوسین به پرولین در اسید آمینه 33 زیر واحد β گیرنده پلاکتی αIIbβ3 میگردد(18، 17). آلل جهش یافتهPLA2 (HPA-1b)، با افزایش در تعداد گیرنده αIIbβ3 و افزایش تجمع پلاکتی همراه میباشد(20، 19). HPA-1a به عنوان ایمنیزاترین آلوآنتیژن شناخته شدهاست. اگر مادر فاقد HPA1a و جنین وی دارای این آنتیژن باشد، ممکن است پلاکتهای جنین وارد گردش خون مادر شده و علیه آنها آنتیبادی ضد HPA-1a ساخته شود. در این حالت احتمال ترومبوسیتوپنی آلوایمیون نوزادان(Neonatal Alloimmunized Thrombocytopenia) و سقط جنین وجود دارد(22، 21). مطالعههای بسیار محدودی به بررسی ارتباط پلیمورفیسمهای 807C/T و pLA1/pLA2 با سقط مکرر خودبهخودی پرداخته است، لذا در تحقیق حاضر ارتباط بین پلیمورفیسمهای مذکور با سقط مکرر خودبهخودی مورد ارزیابی قرار گرفت.
مواد و روشها
جمعیت مورد مطالعه:
در یک مطالعه مورد ـ شاهدی،50 خانم با سابقه حداقل دو سقط مکرر خودبهخودی به عنوان گروه بیماران و 50 خانم دارای حداقل دو بارداری موفق و بدون سابقه سقط به عنوان گروه شاهد از میان مراجعهکنندگان به بیمارستان فوق تخصصی زنان و زایمان صارم تهران با توجه به پرونده پزشکی بیماران و نظر متخصص زنان، انتخاب شدند. عوامل مؤثر در سقط مکرر خودبهخودی مانند کاریوتیپ، عوامل آناتومی، عوامل هورمونی، عوامل عفونی و عوامل ایمونولوژیک در بیماران مورد ارزیابی قرار گرفتند و در تمامی موارد طبیعی بودند. به منظور رعایت اخلاق پزشکی از بیماران رضایتنامه دریافت گردید(23).
جدول1: توالی آغازگرها و میزان محصول PCR پلیمورفیسم 807C/T در ژن GPIa
(آغازگرها با استفاده از نرمافزار 5 Oligo و Gene Runner طراحی شده و در سایت NCBI با توالی ژن هدف Blast گردیدند)
| پلیمورفیسم | توالی آغازگرها | نوع اولیگو آغازگر | محصول PCR (bp) |
| C/T 807 | Outer Reverse Primer (rop) | 5'-CCA GCT GCC TTCT CAA AGT ATT CAA GAC -3' | 350 |
| Outer Forward Primer (fop) | 5'-GTC TCC TCT GTTG AAG GTG GGG TTA ATT -3' | ||
| Inner Reverse Primer (IPC) | 5'-AAA ACT TAC CTT GCA TAT TGA ATT GCTACG -3' | 174 | |
| Inner Forward Primer (IPT) | 5'-ATA TGG TGG GGAC CTC ACA AAC ACA GTT -3' | 234 |
جدول2: توالی آغازگرها، آنزیم محدودالاثر، محصولPCR وRFLP پلیمورفیسم pLA1/pLA2 در ژن GPIIIa .
(آغازگرها با استفاده از نرمافزار Oligo 5 و Gene Runner طراحی شده و در سایت NCBI با توالی ژن هدف Blast گردیدند)
| پلیمورفیسم | توالی آغازگرها | محصول PCR (bp) | آنزیم محدودالاثر | محصول RFLP (bp) |
| pLA1/pLA2 | R:5'-ACT GAC TTG AGT GAC CTG GGA -3' F:5'-CTT AGC TAT TGG GAA GTG GTA -3' |
256 | MspI | 256 |
| 256، 154 102 | ||||
| 154، 102 |
تعیین ژنوتیپ:
با استفاده از کیت استخراج DNA اختصاصی شرکت سیناکلون،DNA ژنومیک از خون محیطی استخراج شد. سپس واکنش زنجیره پلیمراز با استفاده از آغازگرهای اختصاصی ژن GPIa به روشTetra-PrimerARMS-PCR و آغازگرهای ژن GPIIIa به روش PCR-RFLP انجام گرفت(جداول 1 و 2).
واکنش Tetra-PrimerARMS-PCR در حجم 20 میکرولیتر حاوی 200 نانوگرم DNA ژنومیک، 10 میکرولیتر(Master Mix)X Taq Premix2 (پارس توس، ایران)، 10 پیکومول از هر آغازگر (ژن فناوران، ایران) و 6 میکرولیتر آب دیونیزه، صورت گرفت. واکنش PCR-RFLP در حجم50 میکرولیتر حاوی 200 نانوگرم DNA ژنومیک، 25 میکرولیتر(Master Mix) X Taq Premix 2 (پارس توس، ایران)، 20 پیکومول از هر آغازگر(ژن فناوران، ایران) و 21 میکرولیتر آب دیونیزه، انجام شد. در هر دو ژن، تکثیر در 32 چرخه، دمای 94 درجه سانتیگراد به مدت 45 ثانیه، دمای اتصال 8/55 درجه سانتیگراد به مدت 1 دقیقه در ژن GPIa، دمای اتصال 1/56 درجه سانتیگراد در ژن GPIIIa و 72 درجه سانتیگراد به مدت 45 ثانیه انجام شد. دناتوراسیون اولیه به مدت 5 دقیقه در 94 درجه سانتیگراد و طویلسازی نهایی به مدت 5 دقیقه در دمای 72 درجه سانتیگراد صورت گرفت. روش PCR - ARMS Primer-Tetra یک روش تکثیری قدرتمند برای مشخص کردن جهشهای نقطهای است. در این روش از دو آغازگر خارجی(Outer primer) به نامهای fop و rop که به نواحی اطراف نوکلئوتید 807 در اگزون 7 ژن GPIa متصل میشوند، استفاده گردید. اتصال آغازگرهای خارجی به نواحی اطراف جهش نقطهای موجب اطمینان از PCR صحیح در محل SNP مد نظر میگردد. وجود باند bp 350 بر روی ژل آگاروز حاکی از اتصال آغازگرهای خارجی میباشد. دو آغازگر داخلی (Inner primer) نیز در این روش استفاده شد. آغازگر داخلی IPT در حضور جهش تک نوکلئوتیدی سیتوزین به تیمین متصل میگردد. آغازگر داخلی IPC هنگامی که جهش مذکور در نوکلئوتید 807 صورت نگرفته باشد، به این ناحیه متصل میشود. محصول PCR با الکتروفورز در ژل آگاروز 2% تفکیک گردید، که در فرد هموزیگوت سالم با ژنوتیپ CC دو باند 174 و 350 جفت بازی، در فرد هموزیگوت بیمار با ژنوتیپ TT دو باند 234 و 350 جفت بازی و در فرد هتروزیگوت با ژنوتیپ CT هر سه باند 174، 234 و 350 جفت بازی رؤیت گردید(شکل1).

شکل1: محصول PCR پلیمورفیسم 807C/T ژنGPIa روی ژل آگاروز 2% . چاهک M: مارکر bp50 ؛ چاهکهای 1، 3، 4، 5: 807C/T ، هتروزیگوت(bp350، 234، 174)؛ چاهک2: 807T/T ، هموزیگوت بیمار(bp 350 ، bp 234).

شکل2 : نتایج الکتروفورز محصول PCR پس از RFLP برای پلیمورفیسم pLA1/pLA2 روی ژل آگاروز 3%. چاهک M: مارکر bp 50 ؛ چاهکهای 1، 3، 5: محصول PCR قبل از RFLP ؛ چاهک 2 : pLA1/pLA1، هموزیگوت سالم(bp 256)؛ چاهک 4 : pLA1/pLA2 ، هتروزیگوت(bp 256، 154 ،102)؛ چاهک6 : pLA2/pLA2 ، هموزیگوت بیمار(bp 102، 154).
|
به منظور تایید نتایج PCR ، نمونهها در شرکت ژن فناوران در یک جهت مستقیم تعیین توالی شدند. جهت شناسایی پلیمورفیسم pLA1/pLA2 ، محصول PCR مربوطه با استفاده از آنزیم MspI مورد هضم آنزیمی قرار گرفت. طول محصول PCR معادل 256 جفت باز بود. در افراد دارای ژنوتیپ PLA2/PLA2 ، محصول PCR در مجاورت آنزیم MspI ، دو قطعه 154 و 102 جفت بازی ایجاد نمود، ولی در ژنوتیپ pLA1/pLA2 ، سه قطعه 256 ، 154 ، 102 جفت بازی حاصل گردید. محصولات PCR ، قبل و پس از هضم آنزیمی، با الکتروفورز روی ژل آگاروز 3% از هم تفکیک شده و طول دقیق آنها مورد بررسی قرار گرفت(شکل2).
|
تحلیل آماری:
مشاهدهها، توسط نرمافزار SPSS (نگارش 16) مورد تحلیل قرار گرفت. توزیع ژنوتیپهای هر موتاسیون، فرکانس هموزیگوت و هتروزیگوت در دو گروه بیمار و شاهد با استفاده از مربع کای و پیرسون مورد سنجش قرار گرفت. p-value کمتر از 05/0 به عنوان سطح معنادار، در نظر گرفته شد.
یافتهها
در این تحقیق، پلیمورفیسمهای 807C/T و pLA1/pLA2 در50 خانم با سابقه سقط مکرر خودبهخودی که از نظر کاریوتیپ، عوامل آناتومی، عوامل هورمونی، عوامل عفونی و عوامل ایمونولوژیک طبیعی بودند، مورد بررسی قرار گرفتند(جدول 3).
فراوانی ژنوتیپی مشاهده شده در گروه بیمار و شاهد به ترتیب 24/0 در مقابل44/0 برای ژنوتیپCC ، 42/0 در مقابل 4/0 برای ژنوتیپ CT و 34/0 در مقابل 16/0 برای ژنوتیپ TT بود. فراوانی ژنوتیپی در گروه بیمار و شاهد، ارتباط معناداری را نشان داد(045/0p=). فراوانی آللT و C در خانمهای مبتلا به سقط مکرر به ترتیب عبارت بود از 55/0 و 45/0 و در گروه کنترل این فراوانی برابر با 36/0 و 64/0 بود. دو گروه از نظر فراوانی آللی اختلاف معناداری نشان دادند(007/0p=).
جدول 3: مقایسه فراوانی آللی و ژنوتیپی حاصل از پلیمورفیسم 807C/T ژن GPIa در خانمهای دچار سقط مکرر و نرمال
| بیمار (50 n=) | نرمال(50 n=) | p-value | |
| ژنوتیپ | |||
| CC | 12 (24/0) | 22 (44/0) | 045/0 |
| CT | 21 (42/0) | 20 (4/0) | |
| TT | 17 (34/0) | 8 (16/0) | |
| آلل | |||
| C | 45 (45/0) | 64 (64/0) | 007/0 |
| T | 55 (55/0) | 36 (36/0) | |
جدول 4: مقایسه فراوانی آللی و ژنوتیپی پلیمورفیسم pLA1/pLA2 ژن GPIIIa در خانمهای دچار سقط مکرر و نرمال
| بیمار (50 n=) | نرمال(50 n=) | p-value | |
| ژنوتیپ | |||
| PLA2/PLA2 | 3 (06/0) | 1 (02/0) | 467/0 |
| pLA1/pLA2 | 7 (14/0) | 5 (1/0) | |
| PLA1/PLA1 | 40 (8/0) | 44 (88/0) | |
| آلل | |||
| PLA2 | 13 (13/0) | 7 (07/0) | 157/0 |
| PLA1 | 87 (87/0) | 93 (93/0) | |
در مورد پلیمورفیسم pLA1/pLA2 ، فراوانی ژنوتیپی در زنان دارای سقط مکرر و زنان گروه شاهد، به ترتیب 8/0 در مقابل 88/0 برای ژنوتیپ PLA1/PLA1 ، 14/0 در مقابل 1/0 برای ژنوتیپ pLA1/pLA2 و 06/0 در مقابل02/0 برای ژنوتیپ PLA2/PLA2 بود(جدول4). به منظور محاسبه فراوانی آللی، همواره میتوان از فراوانی ژنوتیپی استفاده نمود، در صورتی که جهت محاسبه فراوانی ژنوتیپی از فراوانی آللی، میبایست شرایط تعادل هاردی- واینبرگ که بر مبنای آمیزش تصادفی است، برقرار گردد(24). بر این اساس، فراوانی آللهای PLA2 و PLA1 در خانمهای طبیعی به ترتیب 07/0 و 93/0 و در خانمهای واجد شرایط سقط مکرر، به ترتیب 13/0 و 87/0 محاسبه گردید (جدول 4).
نتایج نشـان داد فراوانی ژنوتیپ PLA2/PLA2 در افراد
بیمار بهطور معناداری بیشتر از افراد شاهد نمیباشد. هم چنین، فراوانی آلل PLA2 در جمعیت بیمار به طور معناداری بیشتر از افراد شاهد نبود.
بحث
آنالیز پلیمورفیسم ژنهای مؤثر در عملکرد گیرندههای پلاکتی، به دلیل نقش مهمی که تشکیل لختههای نابهجا دارند، میتواند در موارد مختلفی در زنان دچار سقط مکرر مورد مطالعه قرار گیرد. بر اساس نتایج حاصل از این تحقیق، پلیمورفیسم 807C/T در بیماران شیوع بیشتری را نشان داد. با این حال نقش پلیمورفیسم pLA1/pLA2 در سقط مکرر افراد مورد مطالعه تایید نشد و اختلاف معناداری بین گروه بیمار و شاهد مشاهده نگردید. پلیمورفیسم807C/T ، یکی از چند شکلیهای شایع در ژن GPIa است که ارتباط آن با برخی بیماریهای قلبی-عروقی، انسداد ورید شبکیه چشم و سکتههای مغزی بررسی شده است(27-25). نتایج مطالعه حاضر نشان داد که پلیمورفیسم 807C/T با سقط مکررخودبهخودی مرتبط است و فراوانی ژنوتیپ جهش یافته TT در جمعیت بیمار به طور معناداری بیشتر از گروه شاهد میباشد. در سال 2013، اولینبار توسط زنوزی در تبریز، ارتباط پلیمورفیسم 807C/T با سقط مکرر از طریق روش ARMS-PCR بررسی گردید و ارتباطی میان این چند شکلی و سقط مکرر خودبهخودی مشاهده نشد. فراوانی ژنوتیپ جهش یافته در مطالعه حاضر در تهران، 34/0 در جمعیت بیمار و در مطالعه زنوزی به میزان 12/0 گزارش شدهاست(28). تفاوت در نتایج فوق که میتواند به دلیل الگویهای ژنتیکی متفاوت در قومیتهای متنوع ایرانی باشد ، غیر قابل انتظار نبود با این وجود جهت دستیابی به یافتههای قطعی، تحقیقات بیشتر در سایر قومیتهای ایرانی و در جمعیت های مورد مطالعه بیشتر پیشنهاد میگردد. مطالعههای متعددی در مورد اثر پلیمورفیسم pLA1/pLA2 در شکلگیری ترومبوز نابهجا، بیماریهای قلبی- عروقی و سکتههای مغزی وجود دارد(31-29). اخیراً به نقش این پلیمورفیسم به عنوان یک عامل خطر در سقط مکرر توجه زیادی شده است. در مطالعه حاضر، فراوانی ژنوتیپی PLA2/PLA2 و pLA1/pLA2 در زنان دچار سقط مکرر به ترتیب 06/0 و 14/0 بود که نشان میدهد فراوانی پلیمورفیسم pLA1/pLA2 در جمعیت بیمار نسبت به گروه کنترل، افزایش معناداری ندارد و پلیمورفیسم مذکور در مستعد شدن افراد به سقط مکرر مؤثر نیست. هم چنین بر طبق مطالعههایی که توسط جدی-تهرانی و همکاران در سال 2011 در ایران انجام شده است، ارتباط معناداری بین پلیمورفیسم pLA1/pLA2 ژن GPIIIa و سقط مکرر مشاهده نشده است(6). این عدم ارتباط معنادار در مطالعه پیهوچ و همکاران (آلمان، 2001) نیز مشاهده شده است(32). در مقابل، مطالعههای دیگری از جمله مطالعههای انجام شده توسط روزی و همکاران(2005، ایتالیا)، لامبرینوداکی(2010، ایتالیا) و دو مطالعه انجام گرفته توسط ایوانو و همکاران در سالهای 2008 و 2010 در بلغارستان، ارتباط معناداری بین پلیمورفیسم pLA1/pLA2 با سقط مکرر خودبهخودی نشان میدهند(35-32). فراوانی ژنوتیپ جهش یافته در مطالعه روزی در ایتالیا، 44/0 برآورد شده که تقریباً 7 برابر فراوانی ژنوتیپ PLA2/PLA2 در مطالعه حاضر است(35). در مطالعههای ایوانو در بلغارستان و لامبرینوداکی در یونان، فراوانی افراد ناقل این پلیمورفیسم به ترتیب 29/0 و 56/0 گزارش شده است که در مقایسه با فراوانی افراد
هتروزیگوت در مطالعه حاضر، در ایران فراوانی بیشتری دیده میشود(36-34). این نتایج مختلف به دلیل تفاوت در الگوهای ژنتیکی و نژادی در جمعیتهای مورد مطالعه، تعداد افراد مورد مطالعه، رانش ژنتیکی، مهاجرت و انتخاب طبیعی است. به همین منظور، جهت بررسی ارتباط پلیمورفیسمهای 807C/T و pLA1/pLA2 با سقط مکرر خودبهخودی، باید مطالعههای بیشتری در آینده انجام گیرد. در صورت شیوع بالای هر کدام از پلیمورفیسمهای مذکور در زنان مبتلا به سقط مکرر، استفاده از داروهای ضد انعقاد و مهارکنندههای گیرنده پلاکتی در طی بارداری برای پیشگیری از سقط نتیجه بخش خواهد بود.
نتیجهگیری
با توجه به نتایج به دست آمده از این مطالعه، پلیمورفیسم pLA1/pLA2 در بروز سقط مکرر خود بهخودی نقشی ندارد. در مقابل، افراد حامل آلل موتانت 807T مستعد به سقط مکرر میباشند. جهت بررسی دقیقتر این فاکتورها، انجام تحقیقات بیشتر پیشنهاد میگردد.
تشکر و قدردانی
نویسندگان این مقاله از کارکنان مرکز تحقیقات بیولوژی دانشگاه آزاد اسلامی زنجان به دلیل همکاری صمیمانه در انجام این پروژه، کمال تشکر و امتنان را دارند.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





