جلد 12، شماره 3 - ( پاييز 1394 )
جلد 12 شماره 3 صفحات 276-266 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rafieemehr H, Kheirandish M, Soleimani M. Isolation, expansion, and in vitro differentiation of human umbilical cord blood mesenchymal stromal cells into neural progenitor cells. bloodj 2015; 12 (3) :266-276
URL: http://bloodjournal.ir/article-1-937-fa.html
URL: http://bloodjournal.ir/article-1-937-fa.html
رفیعی مهر حسن، خیراندیش مریم، سلیمانی مسعود. جداسازی، تکثیر و تمایز سلولهای استرومال مزانشیمی خون بند ناف انسانی به سلولهای پروژنیتور عصبی در محیط آزمایشگاهی. فصلنامه پژوهشی خون. 1394; 12 (3) :266-276
تهران ـ ایران ت صندوق پستی: 1157-14665
متن کامل [PDF 394 kb]
(2829 دریافت)
| چکیده (HTML) (7028 مشاهده)
مقدمه
تولید سیگنالهای التهابی و تخریب اولیگودندروسیتها و آکسونها در بیمارهای نورودژنراتیو باعث میشوند که میلینسازی مجدد رخ ندهد. داروهای فعلی که در دو دهه اخیر برای بیمارهای نورودژنراتیو مانند مولتیپل اسکلروزیس مورد تایید قرار گرفته و استفاده میشود، عمدتاً نرخ عود بیماری را کاهش میدهند و تاثیر چندانی بر توقف پیشرفت بیماری و ترمیم بافت عصبی یا افزایش روند رمیلینه شدن ندارند(2، 1). امروزه سلول درمانی بر اساس سلولهای بنیادی در بیمارهای نورودژنراتیو مورد توجه زیادی قرار گرفته است. بدین منظور مطالعههای وسیعی در کلینیک و مدلهای حیوانی انجام شده و ادامه دارد(3).
ملاحظات اخلاقی، مشکلات تکنیکی و ایمونولوژیکی، استفاده از سلولهای بنیادی جنینی و عصبی را با چالش مواجه کرده است(4). سلولهای استرومال مزانشیمی (mesenchymal stromal cells: MSCs) به دلیل نداشتن مشکلات مربوط به سلولهای بنیادی عصبی(NSCs : neural stem cells) و سلولهای بنیادی جنینی(ESCs : embryonic stem cells)، امروزه طرفداران زیادی را پیدا کرده است. سلول MSC ، غیر هماتوپوئتیک با توانایی خودنوسازی و تمایز به سلولهای رده مزودرم، اکتودرم و آندودرم هستند و از بافتهای پیوندی مختلف بدن میتوان آنها را جدا کرد. MSC از نظر مورفولوژی فیبروبلاست مانند (دوکی شکل) بوده و با بیان مارکرهای آنتیژنی سطحی CD73 ، CD90 ، CD105 و CD29 و عدم بیان مارکرهای CD11bc ، CD45 و CD34 مشخص میشوند. سلولهای مزانشیمی، سلولهای NK و عملکرد سلولهای T سیتوتوکسیک را سرکوب میکنند. تولید سلولهای Th-1 و Th-17 را مهار کرده و باعث تحریک تولید سلولهای T تنظیمکننده(Treg) میشود. سلولهای استرومال مزانشیمی میتوانند به سیستم عصبی مرکزی مهاجرت نموده و جایگزین بافت آسیب دیده شوند و میتوانند با ترشح فاکتورهای پاراکرینی، از نورون در برابر استرسهای اکسیداتیو حمایت کنند(7-5). مغز استخوان در دستـرستریـن و متداولتریـن منبـع MSC میباشد امـا بـه
علت بیان بالای ویروس، میزان بیان HLA-ABC بیشتر، روشهای دردناک و تهاجمی جمعآوری نمونه و... لزوم شناسایی منابع دیگر MSCsرا اثبات میکنند. سلولهای استرومال مزانشیمی خون بند ناف در مقایسه با مغز استخوان به دلایلی مانند: پتانسیل ایمونوژنیک کمتر، نداشتن واکنش پیوند علیه میزبان، قابلیت بیشتر تمایز به سلول عصبی، دسترسی سریع و جمعآوری آسان آن، به عنوان یکی از منابع جایگزین سلولهای استرومال مزانشیمی مغز استخوان مورد مطالعه و استفاده قرار گرفته است. سلولهای استرومال مزانشیمی امروزه به عنوان یک ابزار نویدبخش در بیماریهای نورودژنراتیو مورد توجه قرار گرفته است(7-5). چالشهایی مانند، احتمال تشکیل تومور و بافتهای ناخواسته، موجب گرایش محققان به تمایزعصبی سلولهای استرومال مزانشیمی آن و استفاده از سلولهای پیشساز عصبی مشتق از سلولهای استرومال مزانشیمی گردیده است(10-8).
در سال 2000 میلادی، تمایز عصبی سلولهای استرومال مزانشیمی با انتشار چهار مقاله، دو تا مربوط به تمایز در محیط آزمایشگاهی و دو مقاله دیگر مربوط به تمایز عصبی در محیط بدن، توجه محققان را به خود جلب کرد(14-11). اگر چه تمایز عصبی سلولهای استرومال مزانشیمی توسط برخی از محققان به چالش کشیده شد، اما گروهی دیگر از محققان تمایز عصبی را تایید کردند(15). محققانی که منتقد تمایز عصبی در آزمایشگاه یا در محیط بدن بودند، ادعا میکردند سلولهای شبه عصبی ناشی از سلولهای استرومال مزانشیمی واقعیت ندارد و بیشتر آرتیفکت هستند و برخی از منتقدان تمایز عصبی هم ادعا کردند که کسب فنوتیپ عصبی توسط این سلولها در محیط بدن به علت تمایز عصبی نیست، بلکه ناشی از ادغام این سلولها با سلولهای میزبان میباشد(17، 16). به هر حال با این گزارشها، اولین نوید در زمینه کاربردی کردن این نوع از سلولهای بنیادی در درمان بیماریهای نورودژنراتیو داده شد. با توجه به تاریخچه موجود در زمینه تمایز سلولهای استرومال مزانشیمی به سلولهای عصبی میتوان به این نتیجه رسید که هنـوز دستورالعمل استانـداردی بـه منظـور تمایـز عصبـی و تولیـد سلولهای
عصبی در مقیاس بالا برای مصارف بالینی گزارش نشده است. در این مطالعه ضمن تنظیم دستورالعمل جدید برای تمایز عصبی سلولهای استرومال مزانشیمی، اثرات هم زمان و ترکیبی برخی از فاکتورهای رشد و مواد شیمیایی با روش Real Time-PCR بررسی گردید.
مواد و روشها
جداسازی سلولهای استرومال مزانشیمی از خون بند ناف:
در این مطالعه تجربی، سلولها از خون بند ناف پس از دریافت فرم رضایتنامه جدا شدند. ابتدا سلولهای تک هستهای خون بند ناف(MNCs = Mono nuclear cells) بر اساس دستورالعمل کوگلر و همکارانش استخراج و پاساژ داده شدند(19، 18). به طور خلاصه MNCs خون بند ناف با استفاده از فایکول(077/1، سیگما، آمریکا) با سانتریفوژ شیب غلظتی جداسازی و در فلاسک cm225 حاوی 6 میلیلیتر محیط کشت DMEM -LG با 10% FBS (اینویتروژن، آمریکا)، 1%پنیسیلین و 1% استرپتومایسین (سیناژن، ایران) در دمای 37 درجه سانتیگراد و 5% CO2 کشت داده شد. 48 ساعت پس از آغاز کشت، سلولهای غیر چسبنده به وسیله تعویض محیط کشت حذف شدند و سلولهای چسبنده باقی ماندند. تعویض محیط کشت سلولی با فاصله زمانی 3 روز موجب حذف سلولهای غیر چسبنده شد. در نهایـت سلولهای استرومال مزانشیمی حاصـل از پاساژ سوم برای آزمایشهای نهایی فراهم شدند.
تعیین درصد زندهبودن سلولها(Viability test):
حدود 50 میکرولیتر از سوسپانسیون سلولی را با 50 میکرولیتر از رنگ تریپانبلو 4/0% مخلوط کرده پس از 30 ثانیه، یک قطره از این مخلوط را برداشته و با استفاده از لام نئوبار در خانههای مربوط به شمارش گلبولهای سفید شمارش شدند. رنگ تریپانبلو در سلولهای مرده نفوذ کرده و آنها را آبی رنگ میکند اما وارد سلولهای زنده نمیشود. به این ترتیب درصد سلولهای زنده به دست میآید. در مطالعه حاضر، درصد زنده بودن(viability) سلولها با رنگآمیزی تریپانبلو بیش از 90% بود.
بررسی ایمونوفنوتایپ سلولی:
به منظور بررسی مارکرهای سطحی، سلولهای تریپسینه شده (از پاساژ سوم سلولهای استرومال مزانشیمی خون بند ناف) در 1 میلی لیتر محلول(Phosphate Buffered Saline) PBSسوسپانسیون شدند. 50 میکرولیتر از سلولها را با 5 میکرولیتر از آنتیبادیهای CD34 ، HLA-DR ، CD105 کنژوگـه با فیکواریترین(PE) و آنتیبادیهای CD90 ، CD73 و CD45 کنژوگه بافلورسئین ایزوتیوسیانات (FITC) و برای کنترل منفی با آنتیبادیهای PE-IgG1 و FITC-IgG1 مخلوط شدند(آنتیبادیها مربوط به شرکت بیوساینس ـ امریکا بود) و به مدت 20 تا 30 دقیقه در 4 درجه سانتیگراد و در تاریکی انکوبه شدند. در مرحله بعد سلولها با 2% PBS-BSA شستشو داده شدند و در 500 میلیلیتر PBS سوسپانسیون شدند و در انتها به منظور فیکس شدن سلولها، 50 میکرولیتر پارافرم آلدئید 1% به لولهها اضافه و با دستگاه فلوسیتومتری تجزیه و تحلیل شدند.
تمایز سلولهای استرومال مزانشیمی به رده چربی:
برای تمایز به رده چربی از سلولهای پاساژ 5-3 استفاده گردید. بعد از شمارش سلولی، تعداد 104´1سلول به همراه 1 میلیلیتر محیط کشت DMEM-LG حاوی سرم 10% به چاهکهای پلیت 24 خانهای افزوده شد و در انکوباتور با دمای 37 درجه سانتیگراد دارای رطوبت و 5% CO2 قرار داده شد. هنگامی که تراکم سلولها به 60% رسید، محیط کشت DMEM-LG خالی شد و 1 میلیلیتر از محیط تمایز به چربی شامل دگزامتازون، انسولین و ایندومتاسین و ایزوبوتیل متیل گزانتین به پلیت 24 خانهای افزوده شد. پلیت دوباره در انکوباتور قرار داده شد. به مدت 3هفته، محیط تمایزی هر 3 روز یک بار تعویض شد. بعد از 21 روز، تمایز سلولها با رنگآمیزی اویل رد مورد بررسی قرار گرفت.
تمایز سلولهای استرومال مزانشیمی به رده استخوانی:
برای تمایز به استئوبلاست از سلولهای پاساژ 5-3 استفاده گردید. به طورخلاصه بعد از شمارش سلولی، تعداد 104´1 سلول به همراه 1 میلیلیتر محیط کشت DMEM-LG حاوی سرم 10% به چاهکهای پلیت 24 خانهای افزوده شد و در انکوباتور با دمای 37 درجه سانتیگراد دارای رطوبت و 5% CO2 قرار داده شد. هنگامی که تراکم سلولها به 60% رسید، محیط کشت DMEM-LG خالی شد و 1 میلیلیتر از محیط تمایز به استخوان شامل دگزامتازون، گلیسرول دو فسفات و اسید آسکوربیک دو فسفات، به پلیت 24 خانهای افزوده شد. پلیت دوباره در انکوباتور قرار داده شد. به مدت 20 روز، محیط تمایزی هر 3 روز یک بار تعویض شد. بعد از 20روز، تمایز سلولها با رنگآمیزی آلیزارین رد مورد بررسی قرار گرفت.
تمایز سلولهای استرومال مزانشیمی به رده عصبی:
برای تمایز به رده عصبی از سلولهای پاساژ 5-3 و مطابق دستوالعمل با کمی تغییر استفاده گردید(21، 20). به طور خلاصه هنگامی که تراکم سلولی در فلاسک cm2 75 حاوی محیط کشتDMEM-HG به 70% رسید، تریپسینه گردید. بعد از شمارش سلولی، تعداد 104 ´ 2 سلول به همراه 1 میلیلیتر محیط کشت حاوی سرم10% به چاهکهای پلیت 24 خانهای افزوده شد و در انکوباتور با دمای 37 درجه سانتیگراد دارای رطوبت و 5% CO2 قرار داده شد. هنگامی که تراکم سلولها به 60% رسید، محیط کشت خالی شد و1 میلیلیتر ازمحیط تمایز عصبی: رتینوئیک اسید 5 میکرومولار، فاکتور رشد فیبروبلاستی 10 نانوگرم در میلیلیتر، فاکتور رشد اپیدرمال 10 نانوگرم در میلیلیتر، فاکتور رشد عصبی 10 نانوگرم در میلیلیتر، ایزوبوتیل متیل گزانتین 5/0 میلیمولار و آسکوربیک اسید 100 میکرومولار به پلیت 24 خانهای افزوده شد. پلیت دوباره در انکوباتور قرار داده شد. محیط تمایزی هر 3 روز یک بار تعویض شد. در زمانهای مختلف مورفولوژی سلولها و به منظور تایید تمایز سلولها، بیان ژنهای اختصاصی عصبی با روش Real Time-PCR بررسی گردید.
آنالیز RT-PCR:
سلولهای تمایز یافته(آزمایش) و سلولهای تمایز نیافته
(کنترل) از نظر بیان ژنهای اختصاصی عصبی مورد بررسی قرار گرفتند. RNA سلولهای آزمایش و کنترل با کیت RNX-Plus (سیناژن)، بر اساس دستورالعملهای کیت، جداسازی شده و جهت ادامه آزمونها در فریزر 70- درجه سانتیگراد نگهداری شد. برای رفع آلودگی احتمالی DNA نیز، نمونههای استخراج شده با آنزیم DNase1 (فرمنتاز) تیمار شدند. سپس میزان RNA به وسیله دستگاه اسپکتروفتومتر(نانودراپ) تعیین گردید. از روی RNA استخراج شده، cDNA در واکنش رونویسی معکوس (RT-PCR) با استفاده از آغازگر هگزامر رندوم و آنزیم ترانس کریپتاز مطابق با دستورالعمل ساخت cDNA (سیناژن) تهیه گردید. در ادامه با آغازگرهای اختصاصی ژنهای عصبی، واکنشهای زنجیرهای پلیمراز(PCR) مطابق با دستوالعمل کیت تاکارا و با دستگاه ترمال سایکلر انجام شد. محصول نهایی PCR در ژل آگاروز 2% الکتروفورز شده و با رنگ Sybersafe مورد ارزیابی قرار گرفت(جدول 1).
جدول 1: اجزای مورد نیاز جهت Real Time PCR
تایید تمایز سلولهای استرومال مزانشیمی به رده عصبی با روش Real-Time PCR :
بیان کمی mRNA ژنهای عصبی MBP ، nestin ، GFAP و MAP2 در نمونههای حاصل از cDNA به دست آمده از سلولهای کشت داده شده تحت شرایط تمایز عصبی پس از 6 روز بررسی گردید. مراحل انجام آزمایش و نحوه ساخت مستر میکس و برنامه دمایی واکنش طبق دستور عمل ذکر شده در کیت Syber-Detect MMX (کانادا، آلفابیو) میباشد. به طور خلاصه، ابتدا cDNA ساخته شده در مرحله قبل را با Water DEPC به نسبت 1 به 2 رقیق میکنیم. بعد از رقیق کردن، فلوسیتومتری مختصر میگردد. تمامی مراحل بر روی بلوک یخ انجام میشود. قبل از استفاده از آنزیم و مستر میکس، آنها را فلوسیتومتری کرده و بر روی بلوک یخ قرار میدهیم. در مرحله بعد به تعداد نمونهها در یک میکروتیوپ جداگانه محلول کاری درست میکنیم و در دستگاه ترمال سایکلر Corrbet Science Rotor-Gene 6000 قرار میدهیم(جدول 2).
جدول 2 : مراحل واکنش 2 Step-Real-Time PCRاجرا شده برای بررسی بیان مارکرهای عصبی
نتایج بیان نسبی ژنهای اختصاصی عصبی توسط نرمافزار دستگاه Real-Time PCRاستخراج و معناداری نتایج با نرمافزار REST 2009 و 5/11 SPSSمشخص گردید.
یافتهها
بـرای اطمینـان از میـزان خلـوص سلولهـای استرومال مزانشیمـی جـدا شـده از خـون بنـد ناف وتوان تمایزی به
سلولهای رده مزانشیمی و عصبی، به ترتیب فلوسیتومتری، رنگآمیزی اختصاصی و PCR انجام گرفت.
بررسی ایمونوفنوتایپ سلولی:
نتایج مربوط به بیان شاخصها یا مارکرهای سطحی سلولهای استرومال مزانشیمی در نمودار 1 نشان داده شده و یافتهها با استفاده از برنامه آماری 5/11 SPSS بررسی شدهاند.
بررسی پتانسیل تمایزی سلولی:
سلولهای استرومال مزانشیمی خون بند ناف (برگرفته از پاساژ 3) که تحت تاثیر تمایز آدیپوسیتی قرار گرفته بودند، به علت حضور واکوئلهـای چربـی بـا رنگآمیزی Oil-Red-O واکنش مثبت نشان دادند(شکل1). هم چنین سلولهای استرومال مزانشیمی خون بند ناف که به مدت دو هفته در محیط تمایز به استخوان قرار گرفته بودند، ابتدا تغییرات مورفولوژی را نشان داده سپس به علت رسوب کلسیم در سطح سلول(معدنی شدن)، با رنگآمیزی اختصاصی آلیزارین رد به رنگ قرمز درآمدند(شکل 1). سلولهای استرومال مزانشیمی خون بند ناف پس از تمایز عصبی، از شکل دوکی خارج شده دارای سیتوپلاسم کشیده با جسم سلولی کوچک و دارای یک یا چند زوائد سیتوپلاسمی گردیدند(شکل1).


نمودار 1: بررسی مارکرهای اختصاصی سلول استرومال مزانشیمی خون بند ناف. همان طوری که در شکل دیده میشود، این سلولها مارکرهای اختصاصی سلول استرومال مزانشیمی CD73 و CD105 را بیان میکنند ولی از نظر مارکرهایی مانند CD45 ، HLA-DR منفی میباشند. A : توزیع جمعیت سلول استرومال مزانشیمی(الف، ب، ج و د). B : نمودار کنترل ایزوتیپ آنتیژن CD73 (الف)، CD105 (ب)، CD45 (ج) و HLA-DR (د) . C : نمودار بیان آنتیژن CD73 (الف)، CD105 (ب)، CD45 (ج) و HLA-DR (د)
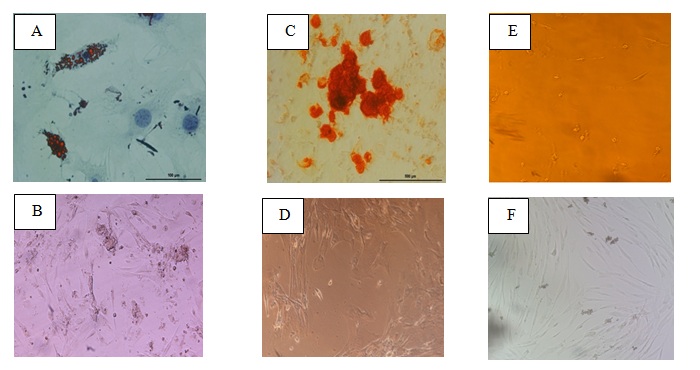
شکل 1: توانایی تمایز سلولهای استرومال مزانشیمی خون بند ناف در اثر اضافه کردن فاکتورهای القایی قابل مشاهده است. شکل A و B به ترتیب نشاندهنده سلولهای استرومال مزانشیمی خون بند ناف بعد از القای آدیپوژنیک و قبل از القا است. تمایز به رده چربی که از گرانولهای چربی رنگ شده با oil red مشخص شده است. شکل C و D به ترتیب نشاندهنده سلولهای استرومال مزانشیمی خون بند ناف بعد از القای استئوژنیک و قبل از القا است. تمایز به رده استخوانی که از طریق رسوب کلسیم رنگ شده با آلیزارین رد مشخص شده است. شکل E و F به ترتیب نشاندهنده سلولهای استرومال مزانشیمی خون بند ناف بعد از القای نوروژنیک و قبل از القا است. تمایز به رده عصبی که از طریق زوائد دندریتی شکل، سیتوپلاسم کشیده و جسم سلولی کوچک مشخص شده است(بزرگنمایی X100).
جدول 3: مشخصات آغازگرهای طراحی شده برای بررسی بیان ژنهای اختصاصی عصبی در سطح سلول استرومال مزانشیمی تمایز یافته
جدول 4 : میزان بیان ژنهای اختصاصی عصبی در سطح سلول استرومال مزانشیمی تمایز یافته با روش Real-Time PCR
(با استفاده از نرمافزار 13/0 V2 2009 REST)
P(H1) -Probability of alternate hypothesis that difference between sample and control groups is due only to chance.
بررسی کمی بیان ژنهای اختصاصی عصبی:
بیان کمی mRNA ژنهای عصبی(Nestin ، MBP ، MAP2 و GFAP) با استفاده از cDNA حاصل از سلولهای پروژنیتور عصبی با quantitative Real-Time PCR ، پس از نرمالسازی با ژن بتااکتین و آنالیز از طریق روش REST-2009 مورد ارزیابی قرار گرفت. ژنهای نامبرده در سلولهای گروه آزمایش به خوبی بیان شدهاند در حالی که در سلولهای کنترل(سلولهای غیر تمایز یافته)، بیان ژنهای عصبی دیده نشد. نتایج آنالیز از طریق نرمافزار REST-2009 نشان داد که میزان بیان MAP2 ، GFAP و MBP در سلولهای پروژنیتور عصبی نسبت به سلولهای استرومال مزانشیمی افزایش معناداری دارد اما ژن nestin تغییر معناداری نداشت. هم چنین آنالیز آماری نشان داد که بیشترین بیان ژنی مربوط به GFAP و کمترین بیان ژنی مربوط به nestin میباشد(جداول 3 و 4).
بحث
امروزه سلولهای بنیادی مزانشیمی(MSCs) به عنوان یک منبع سلولی ایدهآل در رابطه با سلول درمانی شناخته میشوند. مروری بر مطالعههای انجام شده نشان میدهد که تاکنون القای تمایز عصبی در ردههای مختلفی از سلولهای بنیادی از جمله سلولهای استرومال مزانشیمی، سلولهای بنیادی جنینی و سلولهای بنیادی عصبی انجام گرفته است(5). از سال 2000 وقتی وود بری و همکاران در in vitro و برازلتون و همکاران در in vivo تمایز سلولهای استرومال مزانشیمی به سلول عصبی را گزارش کردند، تحقیقات در زمینه سلول درمانی و ترمیم بافت عصبی در بیماریهای نورودژنراتیو توسعه وسیعی پیداکرد(14، 12، 11). با این وجود هنوز چالشها و نگرانیهای زیادی در مورد چگونگی تعامل، کارآیی و ایمن بودن سلولهای القا شده همانند خود سلولهای استرومال مزانشیمی وجود دارد.
در مطالعه حاضر به دلیل ویژگیهایی مانند ظرفیت تکثیر و تمایز نوروژنیک بیشتر و روند کند پیری نسبت به سلولهای استرومال مغز استخوان و دیگر منابع شناخته شده، از سلولهای استرومال مزانشیمی خون بند ناف برای القای عصبی استفاده گردید(6). در این پژوهش پس از 6 روز تیمار با رتینوئیک اسید، فاکتور رشد فیبروبلاستی، فاکتور رشد عصبی، فاکتور رشد اپیدرمال، اسید اسکوربیک و ایزوبوتیل متیل گزانتین، بیان برخی ژنهای اختصاصی عصبی با RT-PCR و Real-Time PCR، نشان داد که nestin در سلولهای مزانشیمی تیمار شده تفاوت معناداری با سلولهای مزانشیمی تیمار نشده(گروه کنترل) ندارد در حالی که میزان بیان مارکرهای MAP-2 ، GFAP و MBP تفاوت معناداری در مقایسه با گروه کنترل داشت. کمترین بیان ژنی مربوط به nestinو بیشترین بیان مربوط به GFAP بود(جدول 4). هم چنین نتایج این تحقیق نشان داد که رتینوئیک اسید در مقایسه با دیگر فاکتورها نقش مهمتری در تمایز و هویت سلولهای پروژنیتور به دست آمده دارد به طوری که در غلظت یک تا 5 میکرومولار باعث تولید سلول نورونی و در حضور غلظت پایین رتینوئیک اسید (2/0 میکرومولار)، عمدتاً باعث تولید سلولهای GFAP مثبت میگردد. در اکثر مطالعههای مشابه برای تایید تمایز عصبی از روشهایی مانند فلوسیتومتری، ایمنوسیتوشیمی و وسترن بلات برای تایید تمایز استفاده گردیده است اما در این مطالعه برای اولین بار برای تایید تمایز از روش Real-Time PCR استفاده گردید که تاکنون گزارش مشابهی منتشر نشده است.
دنگ و همکاران در سال 2001 و هو وهمکاران در سال
2003 گزارش کردند که سلولهای استرومال مزانشیمی خون بند ناف تحت تاثیر dbcAMPو ایزوبوتیل متیل گزانتین توانایی تمایز به سلولهای شبه عصبی را دارند(23، 22). اسکار و همکاران در سال 2004 نشان دادند که در حضور فاکتور رشد عصبی، رتینوئیک اسید، هیدروکورتیزون و مرکاپتواتانول، سلولهای استرومال مزانشیمی مشتق از خون بند ناف به سلولهای پروژنیتور عصبی تمایز مییابند(24). سال 2006 تروپل و همکاران عملکرد سلولهای عصبی تمایز یافته از سلولهای استرومایی مغز استخوان را نشان دادند(25). نعمتی و همکاران در سال 2009 جهت بررسی میزان بیان مارکرهای اختصاصی سلولهای بنیادی عصبی در سلولهای استرومال مزانشیمی مغز استخوان، پس از یک هفته تیمار با فاکتور رشد عصبی و فاکتور رشد اپیدرمال و رتینوئیک اسید، از فلوسیتومتری استفاده کردند. یافتههای فلوسیتومتری نشان داد که سلولها بعد از القا حدود 90% مارکر نستین، 41% مارکر توبولین و 67% مارکر GFAPرا بیان میکنند. تغییرات مورفولوژیکی نیز در راستای نتایج حاصل از آنالیزهای فلوسیتومتری بودند(26). کشافی و همکاران در سال 2013 برای بررسی تمایز سلولهای استرومال مزانشیمی بافت سینوویوم به سلولهای شبه عصبی در محیط آزمایشگاهی، از RT-PCR استفاده کردند. بدین منظور سلولهای استرومال مزانشیمی سه روز با مرکاپتواتانول و رتینوئیک اسید تیمار گردیدند(27).
در مطالعههای گذشته از مواد شیمیایی مانند بتامرکاپتواتانول و دیمتیل سولفوکساید برای تمایز عصبی استفاده گردیده است(14، 12، 11). اما مطالعههای اخیر نشان میدهد که القاکنندههای شیمیائی باعث بیان ناپایدار ژنهای عصبی و مرگ زودرس سلول در آزمایشگاه شده که این امر موجب کاهش کارآیی سلول درمانی خواهد شد. هم چنین نتایج ضد و نقیض در عملکردی بودن سلولهای القا شده با این روش گزارش گردیده است. با این وجود هنوز استراتژی و دستورالعمل استاندارد در خصوص جداسازی، کشت و تمایز عصبی ارایه نشده است. با توجه به تجربیات گذشته، در بررسی حاضر سعی شد با اصلاح دستورالعملهای رایج تمایز عصبی، تنظیم دستورالعمل جدید(حاوی رتینوئیک اسید، فاکتور رشد فیبروبلاستی، فاکتور رشد عصبی، فاکتور رشد اپیدرمال، اسید اسکوربیک و ایزوبوتیل متیل گزانتین) و استفاده از نوروبازال مدیوم و پرتکرارترین فاکتورهای رشد و مواد شیمیایی، روش کارآمدتری برای القای تمایز در سلولهای استرومال مزانشیمی انتخاب گردد. در این پژوهش با حذف بتامرکاپتواتانول(به علت القای مرگ سلولی) و استفاده از دستورالعمل تنظیم شده، بعد از 24 ساعت تغییر شکل سلولها به سمت عصبی دیده شد و از سلولهای روز ششم تمایز، جهت آنالیز دقیقتر مورفولوژی و بیان پایدارتر و مداومتر ژنهای عصبی استفاده گردید. احتمالاً عواملی مانند نوع سرم استفاده شده جهت تکثیر و تمایز سلولی، نوع و غلظت مواد القاگر، دستورالعمل تمایز، منبع سلول، نحوه جمعآوری و پردازش سلولی و روش تایید تمایـز عصبـی از علل تناقض در نتایج مطالعههای مختلف تمایـز
عصبی توسط محققان میباشد(28، 12، 11).
سلولهای پروژنیتور عصبی مشتق از سلول استرومال مزانشیمی در مقایسه با خود سلول مزانشیمی، علاوه بر حفظ خصوصیات تعدیل ایمنی و حفاظت عصبی، به علت متعهد شدن به رده عصبی در آزمایشگاه و احتمال بسیار کمتر در تشکیل رده مزانشیمی(بافت ناخواسته) پس از پیوند، میتواند به عنوان کاندید مناسبتری در سلول درمانی اماس باشد. هر چند انجام تحقیقات وسیعتر در شناسایی مناسبترین روش جداسازی و منبع سلول، تعیین غلظت بهینه فاکتورهای القاگر عصبی، ارزیابی هویت واقعی سلولهای القا شده در محیط آزمایشگاهی و بررسی ایمنی و کارآیی آنها در مدل حیوانی قبل از کاربرد بالینی ضروری میباشد.
نتیجهگیری
در مجموع یافتههای این مطالعه نشان داد سلولهای استرومال مزانشیمی جدا شده از خون بند ناف توانایی تمایز به سلولهای نورونی را دارند و هویت سلول به دست آمده به نوع روش القا بستگی دارد. به منظور به دست آوردن نتیجه مناسب تمایز عصبی، لازم است که از ترکیبی از فاکتورهای رشد و عوامل شیمیایی استفاده کرد. کاربرد ترکیبی مواد شیمیایی و فاکتورهای رشد و کنترل غلظت بهینه آنها میتواند راهکار جدیدی جهت القای تمایز عصبی و کنترل هویت سلولهای پروژنیتور عصبی مشتق از سلولهای استرومال مزانشیمی خون بند ناف در آزمایشگاه باشد. به نظر میرسد با توجه به قدرت تکثیر بالا، روند کند پیری و تمایز نوروژنیک، بیشتر سلولهای استرومال مزانشیمی خون بند ناف کاندید مناسبی جهت تمایز به سایر سلولها از جمله سلولهای نورونی و در نتیجه قابل استفاده در مطالعههای کلینیکی، دستورالعملهای سلول درمانی و مهندسی بافت باشد.
تشکر و قدردانی
این پژوهش در قالب پایاننامه، با مساعدت مالی مرکز تحقیقـات مؤسسـه عالـی آمـوزشی و پـژوهشی طب انتقال خون و حمایت مرکز تحقیقات و فناوری بنیاخته انجام گردید. نویسندگان، از پرسنل محترم بخش پاتولوژی مرکز تحقیقات سازمان انتقال خون و خانم توکلی(مرکز تحقیقات وفناوری بن یاخته)، به دلیل همکاری صمیمانه در انجام این تحقیق، تشکر و قدردانی مینمایند.
متن کامل: (3982 مشاهده)
جداسازی، تکثیر و تمایز سلولهای استرومال مزانشیمی خون بند ناف انسانی
به سلولهای پروژنیتور عصبی در محیط آزمایشگاهی
حسن رفیعیمهر1، مریم خیراندیش2، مسعود سلیمانی3
چکیده
سابقه و هدف
خون بند ناف دارای مزایای فراوانی نسبت به سایر منابع سلولهای استرومال مزانشیمی است. این مطالعه با هدف فراهم کردن یک دستورالعمل جدید جهت تمایز عصبی سلولهای استرومال مزانشیمی خون بند ناف انسانی در محیط آزمایشگاه انجام گرفت.
مواد و روشها
در این مطالعه تجربی، سلولهای بنیادی مزانشیمی خون بند ناف انسانی پس از جداسازی و تایید مورفولوژیکی، تمایز به رده چربی و استخوان و ایمنوفنوتایپ، با رتینوئیک اسید، فاکتور رشد فیبروبلاستی، فاکتور رشد عصبی، فاکتور رشد اپیدرمال، اسید اسکوربیک، ایزوبوتیل گزانتین و محیط کشت نوروبازال جهت القای تمایز عصبی تیمار گردید. بیان نسبی ژنهای اختصاصی عصبی با Real-Time PCR ، نرمافزار 2009 REST و 5/11 SPSS مورد بررسی قرارگرفت.
یافتهها
نتایج نشان داد که سلولهای استرومال مزانشیمی، دوکی بوده و پتانسیل تمایز به رده چربی و استخوان را دارند. فلوسیتومتری برای(78%) CD73، (78%) CD105 مثبت و برای CD45 (2%) و (5/2%) HLA-DR منفی بود. پس از تمایز عصبی و تغییر شکل قابل توجه سلولهای استرومال مزانشیمی به سلولهای عصبی، نتایج تجزیه و تحلیل Real-Time PCR نشان داد که بیان ژنهایی نظیر MBP ، nestin ، MAP-2 و GFAP به طور معناداری در مقایسه با سلولهای تمایز نیافته(کنترل) افزایش یافته است(05/0 p <).
نتیجهگیری
مطالعه حاضر نشان داد، تیمار سلولهای استرومال مزانشیمی با ترکیبی از فاکتورهای رشد و مواد شیمیایی باعث القای تمایز عصبی شده و میتواند باعث افزایش کارآیی سلول درمانی بیماریهای نورودژنراتیو براساس سلولهای بنیادی در آینده گردد. هر چند که عملکرد سلولهای پروژنیتور عصبی به دست آمده قبل از کاربرد بالینی باید در مدلهای حیوانی ارزیابی شود.
کلمات کلیدی: سلولهای استرومال مزانشیمی، سلول درمانی، تمایز سلولی
تاریخ دریافت : 18/11/93
تاریخ پذیرش : 8 /2 /94
1ـ دانشجوی PhD هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون - مؤسسه عالی آموزشی و پژوهشی طب انتقال خون - تهران و دانشکده پیراپزشکی دانشگاه علوم پزشکی همدان ـ همدان ـ ایران
2ـ مؤلف مسئول: PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خـون - مـؤسسه عالـی آمـوزشی و پژوهشی طب انتقال خون - تهران - ایران- صندوق پستی: 1157-14665
3- PhD هماتولوژی و بانک خون ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
به سلولهای پروژنیتور عصبی در محیط آزمایشگاهی
حسن رفیعیمهر1، مریم خیراندیش2، مسعود سلیمانی3
چکیده
سابقه و هدف
خون بند ناف دارای مزایای فراوانی نسبت به سایر منابع سلولهای استرومال مزانشیمی است. این مطالعه با هدف فراهم کردن یک دستورالعمل جدید جهت تمایز عصبی سلولهای استرومال مزانشیمی خون بند ناف انسانی در محیط آزمایشگاه انجام گرفت.
مواد و روشها
در این مطالعه تجربی، سلولهای بنیادی مزانشیمی خون بند ناف انسانی پس از جداسازی و تایید مورفولوژیکی، تمایز به رده چربی و استخوان و ایمنوفنوتایپ، با رتینوئیک اسید، فاکتور رشد فیبروبلاستی، فاکتور رشد عصبی، فاکتور رشد اپیدرمال، اسید اسکوربیک، ایزوبوتیل گزانتین و محیط کشت نوروبازال جهت القای تمایز عصبی تیمار گردید. بیان نسبی ژنهای اختصاصی عصبی با Real-Time PCR ، نرمافزار 2009 REST و 5/11 SPSS مورد بررسی قرارگرفت.
یافتهها
نتایج نشان داد که سلولهای استرومال مزانشیمی، دوکی بوده و پتانسیل تمایز به رده چربی و استخوان را دارند. فلوسیتومتری برای(78%) CD73، (78%) CD105 مثبت و برای CD45 (2%) و (5/2%) HLA-DR منفی بود. پس از تمایز عصبی و تغییر شکل قابل توجه سلولهای استرومال مزانشیمی به سلولهای عصبی، نتایج تجزیه و تحلیل Real-Time PCR نشان داد که بیان ژنهایی نظیر MBP ، nestin ، MAP-2 و GFAP به طور معناداری در مقایسه با سلولهای تمایز نیافته(کنترل) افزایش یافته است(05/0 p <).
نتیجهگیری
مطالعه حاضر نشان داد، تیمار سلولهای استرومال مزانشیمی با ترکیبی از فاکتورهای رشد و مواد شیمیایی باعث القای تمایز عصبی شده و میتواند باعث افزایش کارآیی سلول درمانی بیماریهای نورودژنراتیو براساس سلولهای بنیادی در آینده گردد. هر چند که عملکرد سلولهای پروژنیتور عصبی به دست آمده قبل از کاربرد بالینی باید در مدلهای حیوانی ارزیابی شود.
کلمات کلیدی: سلولهای استرومال مزانشیمی، سلول درمانی، تمایز سلولی
تاریخ دریافت : 18/11/93
تاریخ پذیرش : 8 /2 /94
1ـ دانشجوی PhD هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون - مؤسسه عالی آموزشی و پژوهشی طب انتقال خون - تهران و دانشکده پیراپزشکی دانشگاه علوم پزشکی همدان ـ همدان ـ ایران
2ـ مؤلف مسئول: PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خـون - مـؤسسه عالـی آمـوزشی و پژوهشی طب انتقال خون - تهران - ایران- صندوق پستی: 1157-14665
3- PhD هماتولوژی و بانک خون ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
مقدمه
تولید سیگنالهای التهابی و تخریب اولیگودندروسیتها و آکسونها در بیمارهای نورودژنراتیو باعث میشوند که میلینسازی مجدد رخ ندهد. داروهای فعلی که در دو دهه اخیر برای بیمارهای نورودژنراتیو مانند مولتیپل اسکلروزیس مورد تایید قرار گرفته و استفاده میشود، عمدتاً نرخ عود بیماری را کاهش میدهند و تاثیر چندانی بر توقف پیشرفت بیماری و ترمیم بافت عصبی یا افزایش روند رمیلینه شدن ندارند(2، 1). امروزه سلول درمانی بر اساس سلولهای بنیادی در بیمارهای نورودژنراتیو مورد توجه زیادی قرار گرفته است. بدین منظور مطالعههای وسیعی در کلینیک و مدلهای حیوانی انجام شده و ادامه دارد(3).
ملاحظات اخلاقی، مشکلات تکنیکی و ایمونولوژیکی، استفاده از سلولهای بنیادی جنینی و عصبی را با چالش مواجه کرده است(4). سلولهای استرومال مزانشیمی (mesenchymal stromal cells: MSCs) به دلیل نداشتن مشکلات مربوط به سلولهای بنیادی عصبی(NSCs : neural stem cells) و سلولهای بنیادی جنینی(ESCs : embryonic stem cells)، امروزه طرفداران زیادی را پیدا کرده است. سلول MSC ، غیر هماتوپوئتیک با توانایی خودنوسازی و تمایز به سلولهای رده مزودرم، اکتودرم و آندودرم هستند و از بافتهای پیوندی مختلف بدن میتوان آنها را جدا کرد. MSC از نظر مورفولوژی فیبروبلاست مانند (دوکی شکل) بوده و با بیان مارکرهای آنتیژنی سطحی CD73 ، CD90 ، CD105 و CD29 و عدم بیان مارکرهای CD11bc ، CD45 و CD34 مشخص میشوند. سلولهای مزانشیمی، سلولهای NK و عملکرد سلولهای T سیتوتوکسیک را سرکوب میکنند. تولید سلولهای Th-1 و Th-17 را مهار کرده و باعث تحریک تولید سلولهای T تنظیمکننده(Treg) میشود. سلولهای استرومال مزانشیمی میتوانند به سیستم عصبی مرکزی مهاجرت نموده و جایگزین بافت آسیب دیده شوند و میتوانند با ترشح فاکتورهای پاراکرینی، از نورون در برابر استرسهای اکسیداتیو حمایت کنند(7-5). مغز استخوان در دستـرستریـن و متداولتریـن منبـع MSC میباشد امـا بـه
علت بیان بالای ویروس، میزان بیان HLA-ABC بیشتر، روشهای دردناک و تهاجمی جمعآوری نمونه و... لزوم شناسایی منابع دیگر MSCsرا اثبات میکنند. سلولهای استرومال مزانشیمی خون بند ناف در مقایسه با مغز استخوان به دلایلی مانند: پتانسیل ایمونوژنیک کمتر، نداشتن واکنش پیوند علیه میزبان، قابلیت بیشتر تمایز به سلول عصبی، دسترسی سریع و جمعآوری آسان آن، به عنوان یکی از منابع جایگزین سلولهای استرومال مزانشیمی مغز استخوان مورد مطالعه و استفاده قرار گرفته است. سلولهای استرومال مزانشیمی امروزه به عنوان یک ابزار نویدبخش در بیماریهای نورودژنراتیو مورد توجه قرار گرفته است(7-5). چالشهایی مانند، احتمال تشکیل تومور و بافتهای ناخواسته، موجب گرایش محققان به تمایزعصبی سلولهای استرومال مزانشیمی آن و استفاده از سلولهای پیشساز عصبی مشتق از سلولهای استرومال مزانشیمی گردیده است(10-8).
در سال 2000 میلادی، تمایز عصبی سلولهای استرومال مزانشیمی با انتشار چهار مقاله، دو تا مربوط به تمایز در محیط آزمایشگاهی و دو مقاله دیگر مربوط به تمایز عصبی در محیط بدن، توجه محققان را به خود جلب کرد(14-11). اگر چه تمایز عصبی سلولهای استرومال مزانشیمی توسط برخی از محققان به چالش کشیده شد، اما گروهی دیگر از محققان تمایز عصبی را تایید کردند(15). محققانی که منتقد تمایز عصبی در آزمایشگاه یا در محیط بدن بودند، ادعا میکردند سلولهای شبه عصبی ناشی از سلولهای استرومال مزانشیمی واقعیت ندارد و بیشتر آرتیفکت هستند و برخی از منتقدان تمایز عصبی هم ادعا کردند که کسب فنوتیپ عصبی توسط این سلولها در محیط بدن به علت تمایز عصبی نیست، بلکه ناشی از ادغام این سلولها با سلولهای میزبان میباشد(17، 16). به هر حال با این گزارشها، اولین نوید در زمینه کاربردی کردن این نوع از سلولهای بنیادی در درمان بیماریهای نورودژنراتیو داده شد. با توجه به تاریخچه موجود در زمینه تمایز سلولهای استرومال مزانشیمی به سلولهای عصبی میتوان به این نتیجه رسید که هنـوز دستورالعمل استانـداردی بـه منظـور تمایـز عصبـی و تولیـد سلولهای
عصبی در مقیاس بالا برای مصارف بالینی گزارش نشده است. در این مطالعه ضمن تنظیم دستورالعمل جدید برای تمایز عصبی سلولهای استرومال مزانشیمی، اثرات هم زمان و ترکیبی برخی از فاکتورهای رشد و مواد شیمیایی با روش Real Time-PCR بررسی گردید.
مواد و روشها
جداسازی سلولهای استرومال مزانشیمی از خون بند ناف:
در این مطالعه تجربی، سلولها از خون بند ناف پس از دریافت فرم رضایتنامه جدا شدند. ابتدا سلولهای تک هستهای خون بند ناف(MNCs = Mono nuclear cells) بر اساس دستورالعمل کوگلر و همکارانش استخراج و پاساژ داده شدند(19، 18). به طور خلاصه MNCs خون بند ناف با استفاده از فایکول(077/1، سیگما، آمریکا) با سانتریفوژ شیب غلظتی جداسازی و در فلاسک cm225 حاوی 6 میلیلیتر محیط کشت DMEM -LG با 10% FBS (اینویتروژن، آمریکا)، 1%پنیسیلین و 1% استرپتومایسین (سیناژن، ایران) در دمای 37 درجه سانتیگراد و 5% CO2 کشت داده شد. 48 ساعت پس از آغاز کشت، سلولهای غیر چسبنده به وسیله تعویض محیط کشت حذف شدند و سلولهای چسبنده باقی ماندند. تعویض محیط کشت سلولی با فاصله زمانی 3 روز موجب حذف سلولهای غیر چسبنده شد. در نهایـت سلولهای استرومال مزانشیمی حاصـل از پاساژ سوم برای آزمایشهای نهایی فراهم شدند.
تعیین درصد زندهبودن سلولها(Viability test):
حدود 50 میکرولیتر از سوسپانسیون سلولی را با 50 میکرولیتر از رنگ تریپانبلو 4/0% مخلوط کرده پس از 30 ثانیه، یک قطره از این مخلوط را برداشته و با استفاده از لام نئوبار در خانههای مربوط به شمارش گلبولهای سفید شمارش شدند. رنگ تریپانبلو در سلولهای مرده نفوذ کرده و آنها را آبی رنگ میکند اما وارد سلولهای زنده نمیشود. به این ترتیب درصد سلولهای زنده به دست میآید. در مطالعه حاضر، درصد زنده بودن(viability) سلولها با رنگآمیزی تریپانبلو بیش از 90% بود.
بررسی ایمونوفنوتایپ سلولی:
به منظور بررسی مارکرهای سطحی، سلولهای تریپسینه شده (از پاساژ سوم سلولهای استرومال مزانشیمی خون بند ناف) در 1 میلی لیتر محلول(Phosphate Buffered Saline) PBSسوسپانسیون شدند. 50 میکرولیتر از سلولها را با 5 میکرولیتر از آنتیبادیهای CD34 ، HLA-DR ، CD105 کنژوگـه با فیکواریترین(PE) و آنتیبادیهای CD90 ، CD73 و CD45 کنژوگه بافلورسئین ایزوتیوسیانات (FITC) و برای کنترل منفی با آنتیبادیهای PE-IgG1 و FITC-IgG1 مخلوط شدند(آنتیبادیها مربوط به شرکت بیوساینس ـ امریکا بود) و به مدت 20 تا 30 دقیقه در 4 درجه سانتیگراد و در تاریکی انکوبه شدند. در مرحله بعد سلولها با 2% PBS-BSA شستشو داده شدند و در 500 میلیلیتر PBS سوسپانسیون شدند و در انتها به منظور فیکس شدن سلولها، 50 میکرولیتر پارافرم آلدئید 1% به لولهها اضافه و با دستگاه فلوسیتومتری تجزیه و تحلیل شدند.
تمایز سلولهای استرومال مزانشیمی به رده چربی:
برای تمایز به رده چربی از سلولهای پاساژ 5-3 استفاده گردید. بعد از شمارش سلولی، تعداد 104´1سلول به همراه 1 میلیلیتر محیط کشت DMEM-LG حاوی سرم 10% به چاهکهای پلیت 24 خانهای افزوده شد و در انکوباتور با دمای 37 درجه سانتیگراد دارای رطوبت و 5% CO2 قرار داده شد. هنگامی که تراکم سلولها به 60% رسید، محیط کشت DMEM-LG خالی شد و 1 میلیلیتر از محیط تمایز به چربی شامل دگزامتازون، انسولین و ایندومتاسین و ایزوبوتیل متیل گزانتین به پلیت 24 خانهای افزوده شد. پلیت دوباره در انکوباتور قرار داده شد. به مدت 3هفته، محیط تمایزی هر 3 روز یک بار تعویض شد. بعد از 21 روز، تمایز سلولها با رنگآمیزی اویل رد مورد بررسی قرار گرفت.
تمایز سلولهای استرومال مزانشیمی به رده استخوانی:
برای تمایز به استئوبلاست از سلولهای پاساژ 5-3 استفاده گردید. به طورخلاصه بعد از شمارش سلولی، تعداد 104´1 سلول به همراه 1 میلیلیتر محیط کشت DMEM-LG حاوی سرم 10% به چاهکهای پلیت 24 خانهای افزوده شد و در انکوباتور با دمای 37 درجه سانتیگراد دارای رطوبت و 5% CO2 قرار داده شد. هنگامی که تراکم سلولها به 60% رسید، محیط کشت DMEM-LG خالی شد و 1 میلیلیتر از محیط تمایز به استخوان شامل دگزامتازون، گلیسرول دو فسفات و اسید آسکوربیک دو فسفات، به پلیت 24 خانهای افزوده شد. پلیت دوباره در انکوباتور قرار داده شد. به مدت 20 روز، محیط تمایزی هر 3 روز یک بار تعویض شد. بعد از 20روز، تمایز سلولها با رنگآمیزی آلیزارین رد مورد بررسی قرار گرفت.
تمایز سلولهای استرومال مزانشیمی به رده عصبی:
برای تمایز به رده عصبی از سلولهای پاساژ 5-3 و مطابق دستوالعمل با کمی تغییر استفاده گردید(21، 20). به طور خلاصه هنگامی که تراکم سلولی در فلاسک cm2 75 حاوی محیط کشتDMEM-HG به 70% رسید، تریپسینه گردید. بعد از شمارش سلولی، تعداد 104 ´ 2 سلول به همراه 1 میلیلیتر محیط کشت حاوی سرم10% به چاهکهای پلیت 24 خانهای افزوده شد و در انکوباتور با دمای 37 درجه سانتیگراد دارای رطوبت و 5% CO2 قرار داده شد. هنگامی که تراکم سلولها به 60% رسید، محیط کشت خالی شد و1 میلیلیتر ازمحیط تمایز عصبی: رتینوئیک اسید 5 میکرومولار، فاکتور رشد فیبروبلاستی 10 نانوگرم در میلیلیتر، فاکتور رشد اپیدرمال 10 نانوگرم در میلیلیتر، فاکتور رشد عصبی 10 نانوگرم در میلیلیتر، ایزوبوتیل متیل گزانتین 5/0 میلیمولار و آسکوربیک اسید 100 میکرومولار به پلیت 24 خانهای افزوده شد. پلیت دوباره در انکوباتور قرار داده شد. محیط تمایزی هر 3 روز یک بار تعویض شد. در زمانهای مختلف مورفولوژی سلولها و به منظور تایید تمایز سلولها، بیان ژنهای اختصاصی عصبی با روش Real Time-PCR بررسی گردید.
آنالیز RT-PCR:
سلولهای تمایز یافته(آزمایش) و سلولهای تمایز نیافته
(کنترل) از نظر بیان ژنهای اختصاصی عصبی مورد بررسی قرار گرفتند. RNA سلولهای آزمایش و کنترل با کیت RNX-Plus (سیناژن)، بر اساس دستورالعملهای کیت، جداسازی شده و جهت ادامه آزمونها در فریزر 70- درجه سانتیگراد نگهداری شد. برای رفع آلودگی احتمالی DNA نیز، نمونههای استخراج شده با آنزیم DNase1 (فرمنتاز) تیمار شدند. سپس میزان RNA به وسیله دستگاه اسپکتروفتومتر(نانودراپ) تعیین گردید. از روی RNA استخراج شده، cDNA در واکنش رونویسی معکوس (RT-PCR) با استفاده از آغازگر هگزامر رندوم و آنزیم ترانس کریپتاز مطابق با دستورالعمل ساخت cDNA (سیناژن) تهیه گردید. در ادامه با آغازگرهای اختصاصی ژنهای عصبی، واکنشهای زنجیرهای پلیمراز(PCR) مطابق با دستوالعمل کیت تاکارا و با دستگاه ترمال سایکلر انجام شد. محصول نهایی PCR در ژل آگاروز 2% الکتروفورز شده و با رنگ Sybersafe مورد ارزیابی قرار گرفت(جدول 1).
جدول 1: اجزای مورد نیاز جهت Real Time PCR
| اجزا | غلظت |
| MasterMix syber green (amplicon) | µL 5/6 |
| Primer F+R | (µL 1) pmol 10 |
| (Template)1*103 ng (cDNA) | µL 1 |
| Distilled Water | (µL 5/4) µL 13 Up to |
تایید تمایز سلولهای استرومال مزانشیمی به رده عصبی با روش Real-Time PCR :
بیان کمی mRNA ژنهای عصبی MBP ، nestin ، GFAP و MAP2 در نمونههای حاصل از cDNA به دست آمده از سلولهای کشت داده شده تحت شرایط تمایز عصبی پس از 6 روز بررسی گردید. مراحل انجام آزمایش و نحوه ساخت مستر میکس و برنامه دمایی واکنش طبق دستور عمل ذکر شده در کیت Syber-Detect MMX (کانادا، آلفابیو) میباشد. به طور خلاصه، ابتدا cDNA ساخته شده در مرحله قبل را با Water DEPC به نسبت 1 به 2 رقیق میکنیم. بعد از رقیق کردن، فلوسیتومتری مختصر میگردد. تمامی مراحل بر روی بلوک یخ انجام میشود. قبل از استفاده از آنزیم و مستر میکس، آنها را فلوسیتومتری کرده و بر روی بلوک یخ قرار میدهیم. در مرحله بعد به تعداد نمونهها در یک میکروتیوپ جداگانه محلول کاری درست میکنیم و در دستگاه ترمال سایکلر Corrbet Science Rotor-Gene 6000 قرار میدهیم(جدول 2).
جدول 2 : مراحل واکنش 2 Step-Real-Time PCRاجرا شده برای بررسی بیان مارکرهای عصبی
| مرحله | دما | زمان | سیکل |
| دناتوره اولیه | 95 درجه سانتیگراد | 30 ثانیه | 1 |
| دناتوره | 95 درجه سانتیگراد | 5 ثانیه | 45-30 |
| اتصال آغازگرها و گسترش | 60 درجه سانتیگراد | 30 ثانیه |
نتایج بیان نسبی ژنهای اختصاصی عصبی توسط نرمافزار دستگاه Real-Time PCRاستخراج و معناداری نتایج با نرمافزار REST 2009 و 5/11 SPSSمشخص گردید.
یافتهها
بـرای اطمینـان از میـزان خلـوص سلولهـای استرومال مزانشیمـی جـدا شـده از خـون بنـد ناف وتوان تمایزی به
سلولهای رده مزانشیمی و عصبی، به ترتیب فلوسیتومتری، رنگآمیزی اختصاصی و PCR انجام گرفت.
بررسی ایمونوفنوتایپ سلولی:
نتایج مربوط به بیان شاخصها یا مارکرهای سطحی سلولهای استرومال مزانشیمی در نمودار 1 نشان داده شده و یافتهها با استفاده از برنامه آماری 5/11 SPSS بررسی شدهاند.
بررسی پتانسیل تمایزی سلولی:
|
A B C |


نمودار 1: بررسی مارکرهای اختصاصی سلول استرومال مزانشیمی خون بند ناف. همان طوری که در شکل دیده میشود، این سلولها مارکرهای اختصاصی سلول استرومال مزانشیمی CD73 و CD105 را بیان میکنند ولی از نظر مارکرهایی مانند CD45 ، HLA-DR منفی میباشند. A : توزیع جمعیت سلول استرومال مزانشیمی(الف، ب، ج و د). B : نمودار کنترل ایزوتیپ آنتیژن CD73 (الف)، CD105 (ب)، CD45 (ج) و HLA-DR (د) . C : نمودار بیان آنتیژن CD73 (الف)، CD105 (ب)، CD45 (ج) و HLA-DR (د)

شکل 1: توانایی تمایز سلولهای استرومال مزانشیمی خون بند ناف در اثر اضافه کردن فاکتورهای القایی قابل مشاهده است. شکل A و B به ترتیب نشاندهنده سلولهای استرومال مزانشیمی خون بند ناف بعد از القای آدیپوژنیک و قبل از القا است. تمایز به رده چربی که از گرانولهای چربی رنگ شده با oil red مشخص شده است. شکل C و D به ترتیب نشاندهنده سلولهای استرومال مزانشیمی خون بند ناف بعد از القای استئوژنیک و قبل از القا است. تمایز به رده استخوانی که از طریق رسوب کلسیم رنگ شده با آلیزارین رد مشخص شده است. شکل E و F به ترتیب نشاندهنده سلولهای استرومال مزانشیمی خون بند ناف بعد از القای نوروژنیک و قبل از القا است. تمایز به رده عصبی که از طریق زوائد دندریتی شکل، سیتوپلاسم کشیده و جسم سلولی کوچک مشخص شده است(بزرگنمایی X100).
جدول 3: مشخصات آغازگرهای طراحی شده برای بررسی بیان ژنهای اختصاصی عصبی در سطح سلول استرومال مزانشیمی تمایز یافته
| مارکرها | آغازگر جلوبرنده | آغازگر معکوس | Ampilicon size (bp) | چرخه |
| MAP2 | AGT TCC AGC AGC GTG ATG | CAT TCT CTC TTC AGC CTT CTC | 97 | 35 |
| GFAP | GCA GAC CTT CTC CAA CCT G | ACT CCT TAA TGA CCT CTC CAT C | 127 | 35 |
| MBP | ACC CCG TAG TCC ACT TCT TC | ACT CCC TTG AAT CCC TTG TG | 179 | 35 |
| Nestin | GAA GGT GAA GGG CAA ATC TG | CCT CTT CTT CCC ATA TTT CCT G | 96 | 35 |
جدول 4 : میزان بیان ژنهای اختصاصی عصبی در سطح سلول استرومال مزانشیمی تمایز یافته با روش Real-Time PCR
(با استفاده از نرمافزار 13/0 V2 2009 REST)
| ژنها | انواع | Reaction Efficiency | Expression | Std. Error | 95% CI | P(H1) | Result |
| (2= n) b-actin | REF | 0/1 | 000/1 | ||||
| (2= n) MAP-2 | TRG | 0/1 | 714/9 | 880/16-611/6 | 124/22-481/4 | 000/0 | Up |
| (2= n) GFAP | TRG | 0/1 | 569/54 | 713/84-909/39 | 883/107-641/28 | 000/0 | Up |
| (2= n) nestin | TRG | 0/1 | 850/0 | 718/3-332/0 | 589/5-155/0 | 680/0 | |
| (2= n) MBP | TRG | 0/1 | 063/3 | 649/6-692/1 | 790/8-127/1 | 000/0 | UP |
بررسی کمی بیان ژنهای اختصاصی عصبی:
بیان کمی mRNA ژنهای عصبی(Nestin ، MBP ، MAP2 و GFAP) با استفاده از cDNA حاصل از سلولهای پروژنیتور عصبی با quantitative Real-Time PCR ، پس از نرمالسازی با ژن بتااکتین و آنالیز از طریق روش REST-2009 مورد ارزیابی قرار گرفت. ژنهای نامبرده در سلولهای گروه آزمایش به خوبی بیان شدهاند در حالی که در سلولهای کنترل(سلولهای غیر تمایز یافته)، بیان ژنهای عصبی دیده نشد. نتایج آنالیز از طریق نرمافزار REST-2009 نشان داد که میزان بیان MAP2 ، GFAP و MBP در سلولهای پروژنیتور عصبی نسبت به سلولهای استرومال مزانشیمی افزایش معناداری دارد اما ژن nestin تغییر معناداری نداشت. هم چنین آنالیز آماری نشان داد که بیشترین بیان ژنی مربوط به GFAP و کمترین بیان ژنی مربوط به nestin میباشد(جداول 3 و 4).
بحث
امروزه سلولهای بنیادی مزانشیمی(MSCs) به عنوان یک منبع سلولی ایدهآل در رابطه با سلول درمانی شناخته میشوند. مروری بر مطالعههای انجام شده نشان میدهد که تاکنون القای تمایز عصبی در ردههای مختلفی از سلولهای بنیادی از جمله سلولهای استرومال مزانشیمی، سلولهای بنیادی جنینی و سلولهای بنیادی عصبی انجام گرفته است(5). از سال 2000 وقتی وود بری و همکاران در in vitro و برازلتون و همکاران در in vivo تمایز سلولهای استرومال مزانشیمی به سلول عصبی را گزارش کردند، تحقیقات در زمینه سلول درمانی و ترمیم بافت عصبی در بیماریهای نورودژنراتیو توسعه وسیعی پیداکرد(14، 12، 11). با این وجود هنوز چالشها و نگرانیهای زیادی در مورد چگونگی تعامل، کارآیی و ایمن بودن سلولهای القا شده همانند خود سلولهای استرومال مزانشیمی وجود دارد.
در مطالعه حاضر به دلیل ویژگیهایی مانند ظرفیت تکثیر و تمایز نوروژنیک بیشتر و روند کند پیری نسبت به سلولهای استرومال مغز استخوان و دیگر منابع شناخته شده، از سلولهای استرومال مزانشیمی خون بند ناف برای القای عصبی استفاده گردید(6). در این پژوهش پس از 6 روز تیمار با رتینوئیک اسید، فاکتور رشد فیبروبلاستی، فاکتور رشد عصبی، فاکتور رشد اپیدرمال، اسید اسکوربیک و ایزوبوتیل متیل گزانتین، بیان برخی ژنهای اختصاصی عصبی با RT-PCR و Real-Time PCR، نشان داد که nestin در سلولهای مزانشیمی تیمار شده تفاوت معناداری با سلولهای مزانشیمی تیمار نشده(گروه کنترل) ندارد در حالی که میزان بیان مارکرهای MAP-2 ، GFAP و MBP تفاوت معناداری در مقایسه با گروه کنترل داشت. کمترین بیان ژنی مربوط به nestinو بیشترین بیان مربوط به GFAP بود(جدول 4). هم چنین نتایج این تحقیق نشان داد که رتینوئیک اسید در مقایسه با دیگر فاکتورها نقش مهمتری در تمایز و هویت سلولهای پروژنیتور به دست آمده دارد به طوری که در غلظت یک تا 5 میکرومولار باعث تولید سلول نورونی و در حضور غلظت پایین رتینوئیک اسید (2/0 میکرومولار)، عمدتاً باعث تولید سلولهای GFAP مثبت میگردد. در اکثر مطالعههای مشابه برای تایید تمایز عصبی از روشهایی مانند فلوسیتومتری، ایمنوسیتوشیمی و وسترن بلات برای تایید تمایز استفاده گردیده است اما در این مطالعه برای اولین بار برای تایید تمایز از روش Real-Time PCR استفاده گردید که تاکنون گزارش مشابهی منتشر نشده است.
دنگ و همکاران در سال 2001 و هو وهمکاران در سال
2003 گزارش کردند که سلولهای استرومال مزانشیمی خون بند ناف تحت تاثیر dbcAMPو ایزوبوتیل متیل گزانتین توانایی تمایز به سلولهای شبه عصبی را دارند(23، 22). اسکار و همکاران در سال 2004 نشان دادند که در حضور فاکتور رشد عصبی، رتینوئیک اسید، هیدروکورتیزون و مرکاپتواتانول، سلولهای استرومال مزانشیمی مشتق از خون بند ناف به سلولهای پروژنیتور عصبی تمایز مییابند(24). سال 2006 تروپل و همکاران عملکرد سلولهای عصبی تمایز یافته از سلولهای استرومایی مغز استخوان را نشان دادند(25). نعمتی و همکاران در سال 2009 جهت بررسی میزان بیان مارکرهای اختصاصی سلولهای بنیادی عصبی در سلولهای استرومال مزانشیمی مغز استخوان، پس از یک هفته تیمار با فاکتور رشد عصبی و فاکتور رشد اپیدرمال و رتینوئیک اسید، از فلوسیتومتری استفاده کردند. یافتههای فلوسیتومتری نشان داد که سلولها بعد از القا حدود 90% مارکر نستین، 41% مارکر توبولین و 67% مارکر GFAPرا بیان میکنند. تغییرات مورفولوژیکی نیز در راستای نتایج حاصل از آنالیزهای فلوسیتومتری بودند(26). کشافی و همکاران در سال 2013 برای بررسی تمایز سلولهای استرومال مزانشیمی بافت سینوویوم به سلولهای شبه عصبی در محیط آزمایشگاهی، از RT-PCR استفاده کردند. بدین منظور سلولهای استرومال مزانشیمی سه روز با مرکاپتواتانول و رتینوئیک اسید تیمار گردیدند(27).
در مطالعههای گذشته از مواد شیمیایی مانند بتامرکاپتواتانول و دیمتیل سولفوکساید برای تمایز عصبی استفاده گردیده است(14، 12، 11). اما مطالعههای اخیر نشان میدهد که القاکنندههای شیمیائی باعث بیان ناپایدار ژنهای عصبی و مرگ زودرس سلول در آزمایشگاه شده که این امر موجب کاهش کارآیی سلول درمانی خواهد شد. هم چنین نتایج ضد و نقیض در عملکردی بودن سلولهای القا شده با این روش گزارش گردیده است. با این وجود هنوز استراتژی و دستورالعمل استاندارد در خصوص جداسازی، کشت و تمایز عصبی ارایه نشده است. با توجه به تجربیات گذشته، در بررسی حاضر سعی شد با اصلاح دستورالعملهای رایج تمایز عصبی، تنظیم دستورالعمل جدید(حاوی رتینوئیک اسید، فاکتور رشد فیبروبلاستی، فاکتور رشد عصبی، فاکتور رشد اپیدرمال، اسید اسکوربیک و ایزوبوتیل متیل گزانتین) و استفاده از نوروبازال مدیوم و پرتکرارترین فاکتورهای رشد و مواد شیمیایی، روش کارآمدتری برای القای تمایز در سلولهای استرومال مزانشیمی انتخاب گردد. در این پژوهش با حذف بتامرکاپتواتانول(به علت القای مرگ سلولی) و استفاده از دستورالعمل تنظیم شده، بعد از 24 ساعت تغییر شکل سلولها به سمت عصبی دیده شد و از سلولهای روز ششم تمایز، جهت آنالیز دقیقتر مورفولوژی و بیان پایدارتر و مداومتر ژنهای عصبی استفاده گردید. احتمالاً عواملی مانند نوع سرم استفاده شده جهت تکثیر و تمایز سلولی، نوع و غلظت مواد القاگر، دستورالعمل تمایز، منبع سلول، نحوه جمعآوری و پردازش سلولی و روش تایید تمایـز عصبـی از علل تناقض در نتایج مطالعههای مختلف تمایـز
عصبی توسط محققان میباشد(28، 12، 11).
سلولهای پروژنیتور عصبی مشتق از سلول استرومال مزانشیمی در مقایسه با خود سلول مزانشیمی، علاوه بر حفظ خصوصیات تعدیل ایمنی و حفاظت عصبی، به علت متعهد شدن به رده عصبی در آزمایشگاه و احتمال بسیار کمتر در تشکیل رده مزانشیمی(بافت ناخواسته) پس از پیوند، میتواند به عنوان کاندید مناسبتری در سلول درمانی اماس باشد. هر چند انجام تحقیقات وسیعتر در شناسایی مناسبترین روش جداسازی و منبع سلول، تعیین غلظت بهینه فاکتورهای القاگر عصبی، ارزیابی هویت واقعی سلولهای القا شده در محیط آزمایشگاهی و بررسی ایمنی و کارآیی آنها در مدل حیوانی قبل از کاربرد بالینی ضروری میباشد.
نتیجهگیری
در مجموع یافتههای این مطالعه نشان داد سلولهای استرومال مزانشیمی جدا شده از خون بند ناف توانایی تمایز به سلولهای نورونی را دارند و هویت سلول به دست آمده به نوع روش القا بستگی دارد. به منظور به دست آوردن نتیجه مناسب تمایز عصبی، لازم است که از ترکیبی از فاکتورهای رشد و عوامل شیمیایی استفاده کرد. کاربرد ترکیبی مواد شیمیایی و فاکتورهای رشد و کنترل غلظت بهینه آنها میتواند راهکار جدیدی جهت القای تمایز عصبی و کنترل هویت سلولهای پروژنیتور عصبی مشتق از سلولهای استرومال مزانشیمی خون بند ناف در آزمایشگاه باشد. به نظر میرسد با توجه به قدرت تکثیر بالا، روند کند پیری و تمایز نوروژنیک، بیشتر سلولهای استرومال مزانشیمی خون بند ناف کاندید مناسبی جهت تمایز به سایر سلولها از جمله سلولهای نورونی و در نتیجه قابل استفاده در مطالعههای کلینیکی، دستورالعملهای سلول درمانی و مهندسی بافت باشد.
تشکر و قدردانی
این پژوهش در قالب پایاننامه، با مساعدت مالی مرکز تحقیقـات مؤسسـه عالـی آمـوزشی و پـژوهشی طب انتقال خون و حمایت مرکز تحقیقات و فناوری بنیاخته انجام گردید. نویسندگان، از پرسنل محترم بخش پاتولوژی مرکز تحقیقات سازمان انتقال خون و خانم توکلی(مرکز تحقیقات وفناوری بن یاخته)، به دلیل همکاری صمیمانه در انجام این تحقیق، تشکر و قدردانی مینمایند.
نوع مطالعه: پژوهشي |
موضوع مقاله:
سلولهاي بنيادي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





