جلد 12، شماره 4 - ( زمستان 1394 )
جلد 12 شماره 4 صفحات 330-318 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Soltani F, Amiri F, Mohammadipour M, Jalili M, Habibi Roudkenar M, Jalili M. Cell survival evaluation of mesenchaymal stem cells cultivated in the presense of secretome of HIF-1α/Nrf2-engineered-MSC. bloodj 2016; 12 (4) :318-330
URL: http://bloodjournal.ir/article-1-902-fa.html
URL: http://bloodjournal.ir/article-1-902-fa.html
سلطانی فاطمه، امیری فاطمه، محمدیپور مهشید، جلیلی محسن، حبیبی رودکنار مهریار، جلیلی محمدعلی. ارزیابی میزان بقای سلولهای بنیادی مزانشیمی پس از مجاورت با سکرتوم حاصل از سلولهای بنیادی مزانشیمی دستورزی شده با ژنهای Nrf2 و HIF-1α. فصلنامه پژوهشی خون. 1394; 12 (4) :318-330
متن کامل [PDF 524 kb]
(1917 دریافت)
| چکیده (HTML) (6907 مشاهده)
مقدمه
امروزه انواع مختلف سلولهای بنیادی در درمان بسیاری از بیماریهای ارثی و اکتسابی کاربرد دارند. پس از شناسایی گروه دیگری از سلولهای بنیادی غیر خونساز یا همان سلولهای بنیادی مزانشیمی، امید به استفاده از این سلولها در پیوند و ترمیم بافتهای آسیب دیده افزایش پیدا کرد و گروههای مختلفی بر روی کاربرد بالینی این سلولها کار کردهاند(1).
سلولهای بنیادی مزانشیمی(MSCs) Mesenchymal Stem Cells ، توانایی تمایز به ردههای مختلف سلولی را داشته، در آزمایشگاه به آسانی از بافتهای مختلف جدا و تکثیر داده میشوند(5-2). این سلولها دارای ویژگیهای خاص مانند خصوصیت تعدیل ایمنی و توانایی مهاجرت و جایگزینی در محل آسیب دیده هستند(9-6). امروزه از این سلولها به عنوان یک منبع سلولی ایده آل در زمینه سلول درمانی، ژن درمانی و نیز مهندسی بافت استفاده میشود.
با این وجود، آسیبهای وارده به آنها قبل و بعد از پیوند که در نتیجه عوامل آسیبرسان ریز محیطها ایجاد میشوند، در مجموع باعث مرگ زودرس سلولهای بنیادی مزانشیمی در همان روزهای ابتدایی پس از پیوند شده و موجب کاهش کارآیی سلول درمانی به پایینتر از حد انتظار میگردند(10). از مهمترین این عوامل آسیبرسان؛ کمبود اکسیژن، فقر غذایی و وجود رادیکالهای آزاد اکسیژن ناشی از واکنشهای اکسیداسیون و احیا یا همان استرس اکسیداتیو میباشند(11).
با توجه به مطالب ذکر شده، افزایش مقاومت سلولهای بنیادی مزانشیمی در برابر شرایط استرسزا جهت افزایش کارآیی پیوند این سلولها، بسیار حیاتی است(12). بدین منظور در مطالعههای مختلف، راهکارهای گوناگونی همانند پیش شرطی کردن و بهبود شرایط کشت سلولهای بنیادی مزانشیمی به کار گرفته شدهاند(14، 13).
مطالعههای متعددی در زمینه افزایش بقای سلولهای بنیادی مزانشیمی با استفاده از روش دستورزی ژنتیکی سلولها با ژنهای محافظت کننده سلولی مختلف انجام شـده اسـت(18-15). از جملـه ژنهـای محافظـت کننـده سلولی، دو ژن Nrf2 (NF-E2 یا Nuclear Factor-Erythorid - Related Factor 2) و HIF-1α (Hypoxia Inducible Factor-1α) میباشند که به عنوان دو فاکتور رونویسی منجر به بیان مجموعه ژنهایی میگردند که افزایش مقاومت این سلولها را مقابل شرایط استرس اکسیداتیو و کمبود اکسیژن به دنبال خواهد داشت(20، 19).
اما متأسفانه با وجود مؤثر بودن روش دستورزی ژنتیکی در افزایش کارآمدی سلولها در پیوند، استفاده از سلول دستورزی شده در بالین، مورد تأیید سازمان بهداشت جهانی (WHO) نیست. از طرفی سلولهای بنیادی مزانشیمی توانایی ترشح سیتوکینها و مولکولهای فعال زیستی زیادی را دارا میباشند(21). سکرتوم (Secretome) مجموعهای از سیتوکینهای تعدیلکننده ایمنی و درمانی مترشحه از سلولهای بنیادی مزانشیمی است(22). به نظر میرسد سکرتوم حاصل از سلولهای دستورزی شده با ژن Nrf2 و HIF-1α ، حاوی مجموعهای از پروتئینهایی باشد که میتوانند در افزایش مقاومت سلولها در برابر استرس اکسیداتیو و شرایط کمبود اکسیژن مؤثر باشند، بدون دستورزی مستقیم سلولهای بنیادی مزانشیمی، نتایج قابل قبولی در افزایش بقای این سلولها به دنبال داشته و گامی مؤثر جهت افزایش کارآیی استفاده از این سلولها در بالین محسوب شود.
از آن جا که سلولهای بنیادی مزانشیمی کاربردهای فراوانی در سلول درمانی دارند، بهبود درصد بقای آنها با روشهای مناسب مانند استفاده از مواد ترشحی خود این سلولها میتواند نگرانیها در زمینه استفاده از سایر روشهای موجود در افزایش بقای آنها مانند عدم ایمنی و سلامت و یا احتمال بر انگیختن پاسخ ایمنی را کاهش دهد.
با توجه به مطالعهها و مطالب ذکر شده و با این فرضیه که استفاده از سکرتوم سلولهای دستورزی شده با ژنهای Nrf2 وHIF-1α میتواند مشکل عدم امکان استفاده از سلولهای دستورزی شده در بالین را مرتفع سازد و از طرفی فقدان مطالعه مشابه در زمینه بررسی اثرات پاراکرین سلولهای بنیادی مزانشیمی بر بقای این سلولها، این مطالعه با هدف بررسی اثر سکرتوم ترشحی سلولهای بنیـادی مـزانشیمی دستورزی شده با ژنهای Nrf2 و HIF-1α بر میزان بقای این سلولها پس از القای استرسهای سلولی مختلف(کمبود اکسیژن، فقر غذایی و استرس اکسیداتیو) طراحی و انجام شد.
بدین ترتیب پس از کشت سلولهای بنیادی مزانشیمی بندناف در شرایط مناسب، محیط کشت رویی(سکرتوم) آنها جمعآوری شده و با این سلولها مجاور گردید. در نهایت میزان بقای سلولهای کشت داده در مجاورت سکرتوم پس از مواجهه با شرایط استرس اکسیداتیو، کمبود اکسیـژن و فقـر سرمـی نسبـت بـه گروه کنترل ارزیابی شد.
مواد و روشها
در این مطالعه تجربی از سلولهای بنیادی مزانشیمی بند ناف موجود در ذخیره سلولی مرکز تحقیقات مؤسسه عالی آموزشی- پژوهشی طب انتقال خون، که قبلاً مارکرهای سطحی و توانایی تمایز آنها به سه رده چربی، استخوان و غضروف بررسی و تأیید شده بود، استفاده شد(23). پلاسمید نوترکیب حاوی ژن Nrf2 pcDNA3.1-Nrf2)) و پلاسمید نوترکیب حاوی ژن HIF-1α pcDNA3.1-HIF-1α)) نیز قبلاً با روش برش و اتصال آنزیمی تولید و با روشهای PCR ، هضم آنزیمی و توالییابی DNA تأیید شده بودند و باکتری اشرشیاکولـی نـوعDH5α دارای ایـن پلاسمیدهای نوترکیب به صورت ذخیره (استوک) در مرکز تحقیقات موجود بود(18، 17).
آمادهسازی و استخراج پلاسمیدهای نوترکیب:
باکتریهای حاوی pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α از استوک خارج شده و در محیط LB مایع حاوی آنتیبیوتیک اختصاصی کانامایسین یا آمپیسیلین(شرکت اینویتروژن آمریکا) به صورت جداگانه به مدت یک شب در انکوباتور 37 درجه سانتیگراد شیکردار(شرکت ایوی من استرالیا) کشت داده شدند. پلاسمیدهای نوترکیب با استفاده از کیت استخراج پلاسمید(شرکت رُوش آلمان) و بر طبق روش کار کیت استخراج و کمیت آنها با استفاده از اسپکتروفتومتر نانودراپ (شرکتهای تک آمریکا) اندازهگیری شد.
آمادهسازی سلولهای بنیادی مزانشیمی بند ناف:
سلولهای بنیادی مزانشیمی بند ناف از دمای 80- یا تانک ازت خارج شده، پس از یخزدایی با محیط DMEM-Low glucose حاوی 10% سرم جنین گاوی (FBS) و آنتیبیوتیک استرپتومایسین و آمپیسیلین(هر سه ماده از شرکت اینویتروژن آمریکا) مخلوط شده و به ظروف کشت مناسب و استریل منتقل و در انکوباتور استاندارد کشت سلولی، کشت داده شدند. خصوصیات ریختشناسی آنها با استفاده از میکروسکوپ نوری معکوس(شرکت نیکون ژاپن) بررسی شد. سپس تعداد 300 هزار عدد از این سلولها در چاهکهای پلیتهای 6 خانهای کشت داده شدند و پس از چسبیدن سلولها به کف پلیت، از آنها جهت انجام مراحل ترانسفکشن(ورود DNA پلاسمیدی به داخل سلول) استفاده شد.
ترانسفکشن پلاسمیدهای نوترکیب به داخل سلولهای بنیادی مزانشیمی:
در این مطالعه از ماده لیپوزومی فیوژن اچ دی (شرکت رُوش آلمان) جهت وارد کردن pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α به درون سلولهای بنیادی مزانشیمی بند ناف استفاده شد. نسبتهای مناسب از فیوژن اچ دی با pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α به طور جداگانه و هم زمان با هر دوی آنها مخلوط شده و به محیط کشت سلولهای بنیادی مزانشیمی کشت داده شده در چاهکهای مختلف پلیتهای 6 خانهای اضافه شد. پس از گذشت 5-4 ساعت، محیط کشت سلولها تعویض شد.
تأیید بیان ژنهای Nrf2 و HIF-1α به روش PCR ترانس کریپتاز معکوس(RT-PCR):
72 ساعت پس از ترانسفکشن، بیان Nrf2 در سلولهای ترانسفکت شده با pcDNA3.1-Nrf2 (که MSC-Nrf2 نامیده شدند)، بیان HIF-1α در سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α (یا MSC-HIF-1α) و بیان هم زمان هر دو ژن در سلولهای هم زمان ترانسفکت شده (یا MSC-Nrf2-HIF) به روش PCR ترانس کریپتاز معکوس بررسی شد. RNA گروههای سلولی مختلف با استفاده از ماده ترایزول(شرکت اینویتروژن آمریکا) استخراج شد. cDNA آنها با استفاده از کیت ساخت cDNA (شرکت بیونیر آمریکا) و بر اساس روش کار توصیفی کیت ساخته شد. آغازگرهای اختصاصی دو ژن مورد نظر با استفاده از سایت NCBI طراحی شده، واکنشهای PCR با استفاده از دورههای دمایی و زمانی مناسب ایجاد شده توسط دستگاه PCR (شرکت تاکارای ژاپن) انجام شد. محصولات به دست آمده بر روی ژل آگارز 2% الکتروفورز شده با رنگ اتیدیوم بروماید رنگآمیزی شد. باندهای ایجاد شده با دستگاه ترانس لومیناتور( شرکت تتروی انگلیس) مشاهـده و تفسیر گردید.
جمعآوری و تغلیظ سکرتوم سلولهای بنیادی مزانشیمی:
سلولهای بنیادی مزانشیمی بند ناف با هر دو پلاسمید نوترکیب ذکر شده و به روش توصیف شده ترانسفکت شدند. 48 ساعت بعد محیط کشت آنها با محیط کشت فاقد سرم تعویض شد و 24 ساعت بعد محیط کشت رویی سلولها جمعآوری و با استفاده از لولههای دارای فیلتر 5 کیلو دالتون(شرکت سارتوریوس آلمان) و سانتریفوژ با سرعت 10000 دور در دقیقه به مدت 90 دقیقه تغلیظ شـد.
کشت سلولهای بنیادی مزانشیمی بند ناف در مجاورت سکرتوم سلولهای دستورزی شده:
10000 سلول بنیادی مزانشیمی بندناف به طور سه تایی در چاهکهای پلیت 96 خانهای و در محیط DMEM-LG دارای 10% FBSو آنتیبیوتیک کشت داده شدند. بعد از چسبیدن سلولها، محیط کشت چاهکها تخلیه شده و درصدهای مختلف از سکرتوم سلولهای هم زمان ترانسفکت شده با Nrf2 وHIF-1α (MSC-HIF-Nrf2) به آنها اضافه شد و به مدت یک شب در انکوباتور استاندارد کشت سلولی نگهداری شدند.
این گروه S- HIF-Nrf2 نامیده شدند. هم زمان گروه کنترلS-MSC)) نیز با سکرتوم به دست آمده از سلولهای بنیـادی مزانشیمــی بدون دستورزی ژنتیکی به مدت یک
شب مجاور شدند.
ایجاد شرایط گوناگون استرس سلولی بر گروههای سلولی مختلف:
به منظور بررسی تأثیر افزایش بیان HIF-1α و Nrf2 به طور جداگانه و هم زمان و هم چنین سکرتوم به دست آمده از آنها بر میزان بقای سلولها، گروههای سلولی مختلف ترانسفکت شده و یا کشت داده شده، در مجاورت سکرتوم با شرایط استرس کمبود اکسیژن، فقر سرمی و استرس اکسیداتیو ناشی از اثر پراکسیدهیدروژن(H2O2) مواجه شدند.
10000 سلول بنیادی مزانشیمی در چاهکهای پلیتهای 96 خانهای به طور جداگانه و سه تایی کشت داده شدند.
جهت اعمال استرس کمبود اکسیژن، سلولها به مدت زمانهای مختلف 0، 5/1، 3، 6 و 24 ساعت در انکوباتور مخصوص با اکسیژن پایین(هیپوکسی) و در غلظت 1% اکسیژن و 5% دیاکسیدکربن کشت داده شدند. جهت ایجاد استرس فقر سرمی، محیط کشت سلولها خارج و به آنها محیط کشت فاقد FBS اضافه و پلیتها به مدت زمانهای 0، 5/1، 3، 6، 24 و 48 ساعت در انکوباتور کشت سلولی نگهداری شدند. بـه منظـور ایجـاد شرایط استرس اکسیداتیو و رادیکالهای آزاد اکسیژن، سلولها با غلظتهای 5-0 میلیمولار H2O2 به مدت یک ساعت مواجه شدند.
تعیین درصد سلولهای زنده و میزان بقای سلولها پس از اعمال استرسهای سلولی مختلف:
پس از ایجاد شرایط استرس، درصد سلولهای زنده گروههای سلولی مختلف با روش تریپانبلو تخمین زده شد. به منظور تایید بیشتر و کمی سازی نتایج، میزان بقای سلولها با روش WST-1 (Water Soluble Tetrazoliume Salt ، شرکت سیگمای آمریکا) نیز بررسی شد. WST-1 به نسبت 1:10 به محیط کشت سلولها اضافه شد و پس از گذشت 4-3 ساعت، میزان جذب نوری نمونهها در طول موج 450 نانومتر با دستگاه الایزا خوان (شرکت مولتی اسکن بلژیک) خوانش و میزان بقای سلولی محاسبه گردید.
بررسیهای آماری:
کلیه آزمایشها به صورت سه تا پنجتایی ارزیابی شدند و نتایج به دست آمده و میزان بقای سلولی به صورت میانگین ± انحراف معیار(mean ± SD) مورد استفاده قرار گرفت. دادههای کمی با استفاده از برنامه نرمافزاری 19SPSS version و روش آماری آنالیز واریانس یک طرفه (One-Way ANOVA) تجزیه و تحلیل شدند و دامنه طبیعی سازی و اختلافهای معنادار با ارزش p کمتر از 05/0 گزارش شد.
یافتهها
سلولهای بنیادی مزانشیمی بند ناف ظاهری دوکی شکل دارند:
پس از یخزدایی و کشت سلولها در محیط کشت اختصاصی، سلولهای رشد کرده از نظر ریختشناسی با استفاده از میکروسکوپ معکوس بررسی شدند. مشاهدات میکروسکوپی نشان داد که سلولهای کشت داده شده از این نظر کاملاً مشابه سلولهای بنیادی مزانشیمی بوده، ظاهری شبه فیبروبلاستی دارند و دوکی شکل هستند (شکل1).

شکل1: خصوصیات ریختشناسی سلولهای بنیادی مزانشیمی بندناف. سلولها ظاهری دوکی و کشیده داشتند(بزرگنمایی 200×).
سلولهای ترانسفکت شده، ژنهای Nrf2 و HIF-1α را بیان میکنند:
72 ساعت پس از ترانسفکشن سلولها با pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α به طور جداگانه و هم زمان، بیان این ژنها به روش PCR ترانس کریپتاز معکوس در سلولها بررسی شد. همان طور که در شکل 2 مشاهده میشود، سلولهای ترانسفکت شده با pcDNA3.1-Nrf2که MSC-Nrf2 نامیده شدند، ژن Nrf2 را بیان کردند. با توجه به شکل 2 ، بیان HIF-1αدر سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α نیز تایید شد.
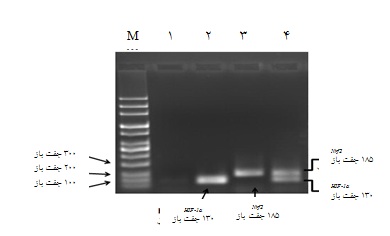
شکل2: بررسی بیان ژن HIF-1α و Nrf2در گروههای سلولی مختلف با روش PCR ترانس کریپتاز معکوس. M مارکر DNA ، ردیف 1: سلولهای ترانسفکت شده با پلاسمید خالی، ردیف 2: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- HIF-1α ، ردیف3: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- Nrf2 و ردیف4: سلولهای هم زمان ترانسفکت شده با پلاسمیدهای pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α. سلولهای بنیادی مزانشیمی هم زمان ترانسفکت شده،HIF-1α وNrf2 را بیان کردند.
شکل3: بررسی بیان بتااکتین در گروههای سلولی مختلف با روش PCR ترانس کریپتاز معکوس(کنترل داخلی). M مارکر DNA ، ردیف 1: سلولهای ترانسفکت شده با پلاسمید خالی، ردیف 2: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- HIF-1α ، ردیف3: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- Nrf2 و ردیف 4: سلولهای هم زمان ترانسفکت شده با پلاسمیدهای pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α. تمامی گروهها ژن بتااکتین را بیان کردند.
وجود دو باند با اندازههای مورد انتظار مؤید بیان هم زمان هر دو ژن در سلولهای هم زمان ترانسفکت شده(یا سلولهای MSC-Nrf2-HIF) بود(شکل 2). جهت کنترل مراحل آزمایش، بیان ژن بتااکتین نیز مورد بررسی قرار گرفت و همه گروههای مورد بررسی این ژن را به میزان مناسب بیان کردند (شکل3).
سلولهای هم زمان ترانسفکت شده در برابر استرس کمبود اکسیژن مقاومتر هستند:
گروههای سلولی مختلف ترانسفکت شده در غلظت اکسیژن 1% تنظیم شده با انکوباتور مخصوص هیپوکسی در مدت زمانهای مختلف کشت داده شدند و میزان بقای آنها با روشWST-1 ارزیابی شد(نمودار 1). طبق نمودار ارائه شده، میزان بقای سلولی گروههای ترانسفکت شده با ژنهای ذکر شده بیش از گروه کنترل(سلولهای بنیادی مزانشیمی و سلولهای ترانسفکت شده با پلاسمید خالی) بود. و در بین گروههای ترانسفکت شده نیز، میزان بقای سلولهای هم زمان ترانسفکت شده بیش از سلولهایی بود که فقط یکی از ژنهای Nrf2 یا HIF-1α در آنها افزایش بیان داده شده بود. به طوری که این اختلاف در زمان 24 ساعت مواجهه با کمبود اکسیژن معنادار بود(05/0 p<) (نمودار1).
میزان بقای سلولهای هم زمان ترانسفکت شده پس از استرس فقر سرمی بیش از سایر گروهها است:
پس از کشت سلولها در محیط فاقد سرم در زمانهای مختلف، میزان بقای آنها با روش WST-1 سنجیده شد (نمودار2). همان طور که در نمودار 2 مشاهده میشود، سلولهای هم زمان ترانسفکت شده در برابر استرس فقر سرمی مقاومت بیشتری داشته و میزان بقای آنها با میزان بقای سلولهایی که فقط با یکی از پلاسمیدها ترانسفکت شده بودند در زمان 48 ساعت، اختلاف معنادار داشت (01/0 p<)(نمودار 2).
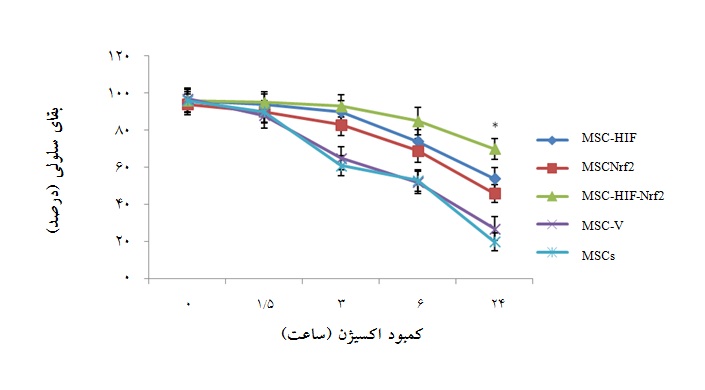
نمودار1: میزان بقای سلولی در گروههای سلولی مختلف پس از مواجهه با استرس کمبود اکسیژن در زمانهای متفاوت(0، 5/1، 3 ، 6 و 24 ساعت)، با روش .WST-1:MSC-Nrf2 سلولهای ترانسفکت شده با pcDNA3.1-Nrf2 ،:MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α ، MSC-HIF-Nrf2: سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 ، MSC-V : سلولهای ترانسفکت شده با پلاسمید خالی و : MSCs سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکی(05/0 p<). گروه هم زمان ترانسفکت شده با دو ژن دارای بیشترین بقای سلولی بود.
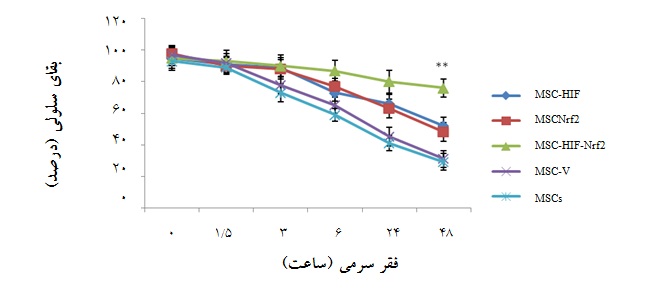
نمودار2: میزان بقای سلولی در گروههای سلولی مختلف پس از مواجهه با استرس فقر سرمی در زمانهای متفاوت( 0، 5/1، 3، 6، 24 و 48 ساعت)، با روش WST-1.: MSC-Nrf2 سلولهای ترانسفکت شده با pcDNA3.1-Nrf2،: MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1- HIF-1α ، MSC-HIF-Nrf2 : سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 ، MSC-V : سلولهای ترانسفکت شده با پلاسمید خالی و : MSCs سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکی(01/0 p<). گروه هم زمان ترانسفکت شده با دو ژن دارای بیشترین بقای سلولی بود.
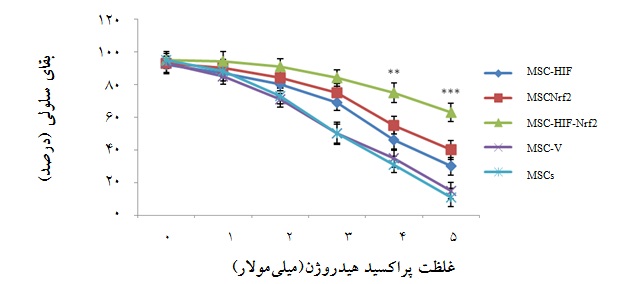
نمودار3: میزان بقای سلولی گروههای سلولی مختلف پس از مواجهه یک ساعته با غلظتهای 5-0 میلی مولار H2O2 با روش WST-1 . MSC-Nrf2 : سلولهای ترانسفکت شده با pcDNA3.1-Nrf2،:MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α ، MSC-HIF-Nrf2: سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2، MSC-V : سلولهای ترانسفکت شده با پلاسمید خالی و :MSCs سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکی(01/0 p< و 001/0 p<). گروه هم زمان ترانسفکت شده با دو ژن دارای بیشترین بقای سلولی بود.
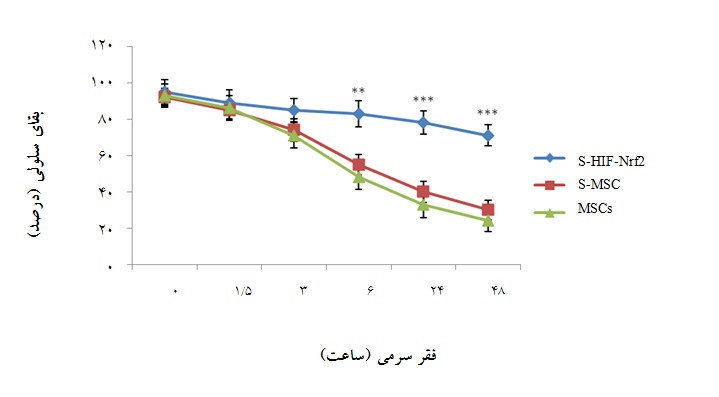
نمودار4: میزان بقای سلولی در گروههای سلولی مختلف مجاور شده با سکرتوم پس از مواجهه با استرس کمبود اکسیژن در زمانهای مختلف (0، 5/1، 3، 6، 24 و 48 ساعت) با روش WST-1. S-HIF-Nrf2 : سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2، S-MSC : سلولهای مجاور شده با سکرتوم سلولی بدون دست ورزی ژنتیکی و MSCs: سلولهای بدون مجاورت با سکرتوم(001/0 p<). سلولهای مجاور شده با سکرتوم دستورزی شده با دو ژن دارای بیشترین بقای سلولی بودند.
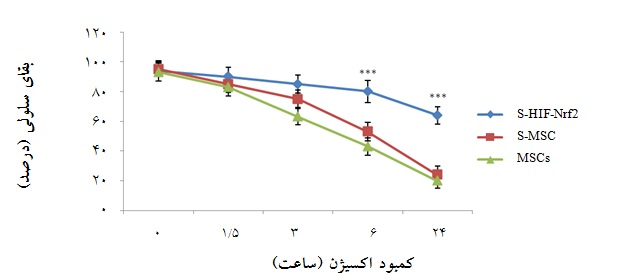
نمودار5: میزان بقای سلولی در گروههای سلولی مختلف مجاور شده با سکرتوم پس از مواجهه با استرس فقر سرمی در زمانهای مختلف(0 ، 5/1، 3، 6، 24 و 48 ساعت)، با روش WST-1. S-HIF-Nrf2: سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2، S-MSC: سلولهای مجاور شده با سکرتوم سلولی بدون دست ورزی ژنتیکی و MSCs: سلولها بدون مجاورت با سکرتوم (01/0 p< و 001/0 p<). سلولهای مجاور شده با سکرتوم دست ورزی شده با دو ژن دارای بیشترین بقای سلولی بودند.
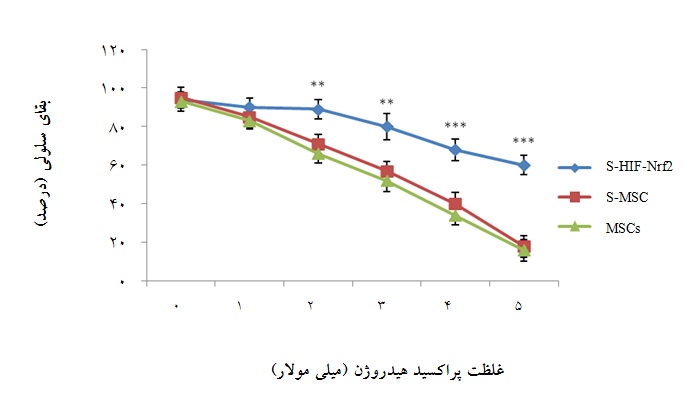
نمودار6: میزان بقای سلولی در گروههای سلولی مختلف مجاور شده با سکرتوم پس از مواجهه یک ساعته با غلظتهای 5-0 میلی مولار H2O2 ، با روش WST-1 . S-HIF-Nrf2 : سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2، S-MSC : سلولهای مجاور شده با سکرتوم سلولی بدون دست ورزی ژنتیکی و MSCs: سلولها بدون مجاورت با سکرتوم. (01/0 p< و 001/0 p<). سلولهای مجاور شده با سکرتوم دست ورزی شده با دو ژن دارای بیشترین بقای سلولی بودند.
جدول 1: میانگین و انحراف معیار درصد بقای سلولی در گروههای مختلف پس از مواجهه با استرس اکسیداتیو، کمبود اکسیژن و فقر سرمی با روش WST-1. :MSC-Nrf2سلولهای ترانسفکت شده با pcDNA3.1-Nrf2،:MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α ، MSC-HIF-Nrf2: سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 ، S-HIF-Nrf2 : سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2 و :MSCسلولهای بنیادی مزانشیمی کنترل.
بحث
به دلیل خصوصیات منحصر به فرد سلولهای بنیادی مزانشیمی، استفاده از آنها در مطالعههای بالینی و به خصوص پزشکی ترمیمی، مورد توجه قرار گرفته است(5-2). اما مهمترین چالش بر سر راه استفاده از آنها، بقای کم این سلولها پس از تزریق است(10). بنابراین مجهز کردن آنها به ابزارهایی که باعث افزایش مقاومت سلولی میشوند، کمک کننده است. به نظر میرسد استفاده از اثرات ترشحی و محافظتی خود سلولهای بنیادی مزانشیمی، راهکار مناسبی جهت رسیدن به این هدف باشد. در مطالعه اخیر جهت افزایش بیان دو ژن Nrf2 و HIF-1α در سلولهای بنیادی مزانشیمی بند ناف، از حامل پلاسمیدی و ماده فیوژن اچدی استفاده شد. استفاده از حامل پلاسمیدی (به جای حامل ویروسی) نگرانی از واکنشهای ایمنی غیر اختصاصی و یا جهشزایی را به همراه ندارد(24). ماده لیپوزومی فیوژن اچ دی باعث افزایش درصد انتقال DNA به داخل سلول شده و بر روی تکثیر و تمایز سلولی اثر منفی ندارد(25).
Nrf2 و HIF-1α از عوامل بسیار مهم در فرآیندهای حفاظت سلولی هستند که افزایش بیان آنها اثر مضاعفی بر مقاومت سلولی سلولهای بنیادی مزانشیمی بند ناف دارد (20، 19). سلولهای بنیادی مزانشیمی بند ناف با نمونهگیری آسان جداسازی میشوند و دارای قدرت تکثیر و خاصیت تعدیل ایمنی بیشتری هستند(26). در این مطالعه میزان بقـای سلولی پس از اعمال سه استرس کمبود اکسیژن، فقر سرمی و استرس اکسیداتیو که باعث بیشترین مرگ سلولها در شرایط آزمایشگاه و بالین میشوند، با روش WST-1 بررسی و افزایش داده شد(11). WST-1 روشی آسان و دقیق با سمیت سلولی کمتر است(27). نتایج WST-1 مبین افزایش میزان بقای سلولی در سلولهای دستورزی شده پس از اعمال شرایط استرس بود.
کیانی و همکاران در سال 2013 بیان HIF-1α را در سلولهای بنیادی مزانشیمی با استفاده از حامل پلاسمیدی افزایش دادند و سپس سلولها را با استرسهای اکسیداتیو، فقر سرمی و کمبود اکسیژن مواجه کردند و این طور نتیجه گرفتند که با افزایش بیان این ژن، میزان بقای سلولها در مواجهه با استرسهای سلولی افزایش مییابد (17). محمدزاده (2012) طی مطالعهای نشان داد که افزایش بیان Nrf2 در سلولهای بنیادی مزانشیمی باعث اثر حفاظتی قابل قبولی در برابر استرسهای سلولی مشابه میشود. وی از حامل ویروسی در مطالعه خود استفاده کرده بود(18). نتایج آنها با مطالعه اخیر هم خوانی داشت. از طرفی در مطالعه اخیر افزایش بیان هم زمان HIF-1α و Nrf2 باعث همافزایی اثرات محافظتی دو ژن شده و منجر به افزایش مقاومت سلولی در شرایط استرسی سختتر شد.
در قسمتی از این مطالعه مجاور کردن سلولهای بنیادی مزانشیمی با سکرتوم سلولهای دستورزی شده نیز باعث افزایش مقاومت آنها شد. استفاده از سکرتوم و اثرات ترشحـی سلولها، نگرانیهای ناشی از دستورزی ژنتیکی
سلولهـا و عدم امکان استفاده از آن در بالین را به همراه ندارد.
لی و همکارانش در سال 2012 با جمعآوری سکرتوم سلولهای بنیادی دست ورزی شده با ژن GATA-4 و اعمال استرس کمبود اکسیژن نشان دادند که سلولهای سیاهرگی مجاور شده با این سکرتوم، پس از پیوند دارای توان تمایزی و بقای بیشتری هستند(28).
جنسکی و گروه وی (2006) چنین گزارش کردند که جمعآوری سکرتوم سلولهای بنیادی مزانشیمی که ژن Akt در آنها افزایش بیان یافته، کشت سلولهای قلبی در مجاورت این سکرتوم و اعمال شرایط کمبود اکسیژن باعث تسریع در فرآیند ترمیم عضله قلبی آسیب دیده میشود (29). در این دو مطالعه از حاملهای ویروسی جهت دستورزی سلولها استفاده شده بود. از طرفی میزان بقای سلولها تنها پس از شرایط کمبود اکسیژن مورد بررسی قرار گرفته بود.
زانگ و همکارانش در سال 2009 با مجاورت محیط کشت حاصل از سلولهای بنیادی مزانشیمی با سلولهای عضلانی قلب که در شرایط کمبود اکسیژن تیمار شده بودند، نشان دادند که اثر ترشحی سلولهای بنیادی مزانشیمی منجر به محافظت از سلولهای عضله قلبی در برابر آپوپتوز ناشی از استرس اکسیداتیو نیز میگردد (30). در این مطالعه نیز همانند مطالعهی اخیر، سکرتوم سلولهای بنیادی مزانشیمی باعث افزایش بقای سلولی پس از مواجهه سلولها با H2O2 شد.
به طور خلاصه در این تحقیق میزان بقا و مقاومت سلولهای بنیادی مزانشیمی در برابر استرسهای سلولی مختلف پس از افزایش بیان دو ژن مهم در فرآیندهای محافظت سلولی(Nrf2 وHIF-1α ) و هم چنین کشت این سلولها در مجاورت سکرتوم به دست آمده از سلولهای دستورزی شده، افزایش داده شد.
نتیجهگیری
افزایش بیان دو ژن Nrf2 و HIF-1α در سلولهای بنیادی مزانشیمی، اثر مضاعفی بر میزان بقای آنها دارد. سکرتوم سلولهای دستورزی شده با این دو ژن، سلولهای بنیادی مزانشیمی را در برابر استرسهای کمبود اکسیژن، فقر سرمی و استرس اکسیداتیو محافظت کرده و نگرانیهای ناشی از دستورزی ژنتیکی سلولها و عدم امکان استفاده از آن در بالین را نیز از بین میبرد. به نظر میرسد استفاده از سکرتوم، راهکاری مناسب و عملی در افزایش بقای سلولها و امکان کاربرد بیشتر و مفیدتر آنها در کارآزماییهای بالینی باشد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه دانشجویی خانم فاطمه سلطانی در مقطع کارشناسی ارشد و مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال ایران میباشد که از محل بودجههای پژوهشی این مرکز تامین اعتبار گردیده است.
متن کامل: (1966 مشاهده)
ارزیابی میزان بقای سلولهای بنیادی مزانشیمی پس از مجاورت با سکرتوم حاصل
از سلولهای بنیادی مزانشیمی دستورزی شده با ژنهای Nrf2 و HIF-1α
فاطمه سلطانی1، فاطمه امیری2، مریم خیراندیش3، مهشید محمدیپور4، محسن جلیلی5،
مهریار حبیبی رودکنار6، محمد علی جلیلی7
چکیده
سابقه و هدف
سلولهای بنیادی مزانشیمی، یک منبع سلولی ایدهآل برای پیوند میباشند. اما استرسهای مختلف در طول تکثیر آزمایشگاهی منجر به کاهش بقای سلولی آنها پس از پیوند میشود. بنابراین به کارگیری راهکارهای عملی جهت افزایش میزان بقای آنها در ریز محیط سرشار از استرس بسیار ضروری است. هدف این مطالعه، بررسی اثر سکرتوم ترشحی سلولهای بنیادی مزانشیمی دستورزی شده با دو ژن Nrf2 و HIF-1α بر بقای این سلولها، تحت استرسهای سلولی مختلف بود.
مواد و روشها
در یک مطالعه تجربی، پلاسمیدهای نوترکیب pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 به طور جداگانه و هم زمان به درون سلولهای بنیادی مزانشیمی بند ناف ترانسفکت شدند. 72 ساعت بعد، بیان HIF-1α و Nrf2 در سلولهای دستورزی شده به روش RT-PCR بررسی شد. گروههای سلولی مختلف با استرس اکسیداتیو، فقر سرمی و کمبود اکسیژن مواجه شدند. سکرتوم سلولهای ترانسفکت شده جمعآوری و تغلیظ شده و با سلولهای بنیادی مزانشیمی بند ناف مجاور شد. بقای سلولها پس از اعمال شرایط استرس مشابه با روش WST-1 بررسی شد.
یافتهها
سلولهای هم زمان ترانسفکت شده، ژنهای HIF-1α و Nrf2 را بیان کردند. این سلولها میزان بقای (5/5% ± 5/84%) بیشتری را در مقایسه با گروه کنترل(4% ± 3/55%) نشان دادند. هم چنین بقای سلولهای کشت داده شده با سکرتوم پس از مواجهه با استرسهای مختلف، 6% ± 3/81% و بقای گروه کنترل 3/4% ± 9/57% بود.
نتیجه گیری
سکرتوم سلولهای دستورزی شده، سلولهای بنیادی مزانشیمی را در برابر استرس اکسیداتیو، فقر سرمی و کمبود اکسیژن محافظت میکند.
کلمات کلیدی: محیط رویی، سلولهای بنیادی مزانشیمی، بقای سلولی
تاریخ دریافت : 6/7/93
تاریخ پذیرش : 2/4/94
1- کارشناس ارشد زیست فنآوری پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خـون - مـؤسسه عالـی آمـوزشی و پژوهشی طب انتقال خون - تهران - ایران
4- دانشجوی PhD ژنتیک ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- دانشجوی دامپزشکی ـ دانشگاه آزاد اسلامی کرج ـ کرج ـ ایران
6- PhD زیست فنآوری پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
7- مؤلف مسئول: PhD شیمی دارویی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
از سلولهای بنیادی مزانشیمی دستورزی شده با ژنهای Nrf2 و HIF-1α
فاطمه سلطانی1، فاطمه امیری2، مریم خیراندیش3، مهشید محمدیپور4، محسن جلیلی5،
مهریار حبیبی رودکنار6، محمد علی جلیلی7
چکیده
سابقه و هدف
سلولهای بنیادی مزانشیمی، یک منبع سلولی ایدهآل برای پیوند میباشند. اما استرسهای مختلف در طول تکثیر آزمایشگاهی منجر به کاهش بقای سلولی آنها پس از پیوند میشود. بنابراین به کارگیری راهکارهای عملی جهت افزایش میزان بقای آنها در ریز محیط سرشار از استرس بسیار ضروری است. هدف این مطالعه، بررسی اثر سکرتوم ترشحی سلولهای بنیادی مزانشیمی دستورزی شده با دو ژن Nrf2 و HIF-1α بر بقای این سلولها، تحت استرسهای سلولی مختلف بود.
مواد و روشها
در یک مطالعه تجربی، پلاسمیدهای نوترکیب pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 به طور جداگانه و هم زمان به درون سلولهای بنیادی مزانشیمی بند ناف ترانسفکت شدند. 72 ساعت بعد، بیان HIF-1α و Nrf2 در سلولهای دستورزی شده به روش RT-PCR بررسی شد. گروههای سلولی مختلف با استرس اکسیداتیو، فقر سرمی و کمبود اکسیژن مواجه شدند. سکرتوم سلولهای ترانسفکت شده جمعآوری و تغلیظ شده و با سلولهای بنیادی مزانشیمی بند ناف مجاور شد. بقای سلولها پس از اعمال شرایط استرس مشابه با روش WST-1 بررسی شد.
یافتهها
سلولهای هم زمان ترانسفکت شده، ژنهای HIF-1α و Nrf2 را بیان کردند. این سلولها میزان بقای (5/5% ± 5/84%) بیشتری را در مقایسه با گروه کنترل(4% ± 3/55%) نشان دادند. هم چنین بقای سلولهای کشت داده شده با سکرتوم پس از مواجهه با استرسهای مختلف، 6% ± 3/81% و بقای گروه کنترل 3/4% ± 9/57% بود.
نتیجه گیری
سکرتوم سلولهای دستورزی شده، سلولهای بنیادی مزانشیمی را در برابر استرس اکسیداتیو، فقر سرمی و کمبود اکسیژن محافظت میکند.
کلمات کلیدی: محیط رویی، سلولهای بنیادی مزانشیمی، بقای سلولی
تاریخ دریافت : 6/7/93
تاریخ پذیرش : 2/4/94
1- کارشناس ارشد زیست فنآوری پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خـون - مـؤسسه عالـی آمـوزشی و پژوهشی طب انتقال خون - تهران - ایران
4- دانشجوی PhD ژنتیک ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- دانشجوی دامپزشکی ـ دانشگاه آزاد اسلامی کرج ـ کرج ـ ایران
6- PhD زیست فنآوری پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
7- مؤلف مسئول: PhD شیمی دارویی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
امروزه انواع مختلف سلولهای بنیادی در درمان بسیاری از بیماریهای ارثی و اکتسابی کاربرد دارند. پس از شناسایی گروه دیگری از سلولهای بنیادی غیر خونساز یا همان سلولهای بنیادی مزانشیمی، امید به استفاده از این سلولها در پیوند و ترمیم بافتهای آسیب دیده افزایش پیدا کرد و گروههای مختلفی بر روی کاربرد بالینی این سلولها کار کردهاند(1).
سلولهای بنیادی مزانشیمی(MSCs) Mesenchymal Stem Cells ، توانایی تمایز به ردههای مختلف سلولی را داشته، در آزمایشگاه به آسانی از بافتهای مختلف جدا و تکثیر داده میشوند(5-2). این سلولها دارای ویژگیهای خاص مانند خصوصیت تعدیل ایمنی و توانایی مهاجرت و جایگزینی در محل آسیب دیده هستند(9-6). امروزه از این سلولها به عنوان یک منبع سلولی ایده آل در زمینه سلول درمانی، ژن درمانی و نیز مهندسی بافت استفاده میشود.
با این وجود، آسیبهای وارده به آنها قبل و بعد از پیوند که در نتیجه عوامل آسیبرسان ریز محیطها ایجاد میشوند، در مجموع باعث مرگ زودرس سلولهای بنیادی مزانشیمی در همان روزهای ابتدایی پس از پیوند شده و موجب کاهش کارآیی سلول درمانی به پایینتر از حد انتظار میگردند(10). از مهمترین این عوامل آسیبرسان؛ کمبود اکسیژن، فقر غذایی و وجود رادیکالهای آزاد اکسیژن ناشی از واکنشهای اکسیداسیون و احیا یا همان استرس اکسیداتیو میباشند(11).
با توجه به مطالب ذکر شده، افزایش مقاومت سلولهای بنیادی مزانشیمی در برابر شرایط استرسزا جهت افزایش کارآیی پیوند این سلولها، بسیار حیاتی است(12). بدین منظور در مطالعههای مختلف، راهکارهای گوناگونی همانند پیش شرطی کردن و بهبود شرایط کشت سلولهای بنیادی مزانشیمی به کار گرفته شدهاند(14، 13).
مطالعههای متعددی در زمینه افزایش بقای سلولهای بنیادی مزانشیمی با استفاده از روش دستورزی ژنتیکی سلولها با ژنهای محافظت کننده سلولی مختلف انجام شـده اسـت(18-15). از جملـه ژنهـای محافظـت کننـده سلولی، دو ژن Nrf2 (NF-E2 یا Nuclear Factor-Erythorid - Related Factor 2) و HIF-1α (Hypoxia Inducible Factor-1α) میباشند که به عنوان دو فاکتور رونویسی منجر به بیان مجموعه ژنهایی میگردند که افزایش مقاومت این سلولها را مقابل شرایط استرس اکسیداتیو و کمبود اکسیژن به دنبال خواهد داشت(20، 19).
اما متأسفانه با وجود مؤثر بودن روش دستورزی ژنتیکی در افزایش کارآمدی سلولها در پیوند، استفاده از سلول دستورزی شده در بالین، مورد تأیید سازمان بهداشت جهانی (WHO) نیست. از طرفی سلولهای بنیادی مزانشیمی توانایی ترشح سیتوکینها و مولکولهای فعال زیستی زیادی را دارا میباشند(21). سکرتوم (Secretome) مجموعهای از سیتوکینهای تعدیلکننده ایمنی و درمانی مترشحه از سلولهای بنیادی مزانشیمی است(22). به نظر میرسد سکرتوم حاصل از سلولهای دستورزی شده با ژن Nrf2 و HIF-1α ، حاوی مجموعهای از پروتئینهایی باشد که میتوانند در افزایش مقاومت سلولها در برابر استرس اکسیداتیو و شرایط کمبود اکسیژن مؤثر باشند، بدون دستورزی مستقیم سلولهای بنیادی مزانشیمی، نتایج قابل قبولی در افزایش بقای این سلولها به دنبال داشته و گامی مؤثر جهت افزایش کارآیی استفاده از این سلولها در بالین محسوب شود.
از آن جا که سلولهای بنیادی مزانشیمی کاربردهای فراوانی در سلول درمانی دارند، بهبود درصد بقای آنها با روشهای مناسب مانند استفاده از مواد ترشحی خود این سلولها میتواند نگرانیها در زمینه استفاده از سایر روشهای موجود در افزایش بقای آنها مانند عدم ایمنی و سلامت و یا احتمال بر انگیختن پاسخ ایمنی را کاهش دهد.
با توجه به مطالعهها و مطالب ذکر شده و با این فرضیه که استفاده از سکرتوم سلولهای دستورزی شده با ژنهای Nrf2 وHIF-1α میتواند مشکل عدم امکان استفاده از سلولهای دستورزی شده در بالین را مرتفع سازد و از طرفی فقدان مطالعه مشابه در زمینه بررسی اثرات پاراکرین سلولهای بنیادی مزانشیمی بر بقای این سلولها، این مطالعه با هدف بررسی اثر سکرتوم ترشحی سلولهای بنیـادی مـزانشیمی دستورزی شده با ژنهای Nrf2 و HIF-1α بر میزان بقای این سلولها پس از القای استرسهای سلولی مختلف(کمبود اکسیژن، فقر غذایی و استرس اکسیداتیو) طراحی و انجام شد.
بدین ترتیب پس از کشت سلولهای بنیادی مزانشیمی بندناف در شرایط مناسب، محیط کشت رویی(سکرتوم) آنها جمعآوری شده و با این سلولها مجاور گردید. در نهایت میزان بقای سلولهای کشت داده در مجاورت سکرتوم پس از مواجهه با شرایط استرس اکسیداتیو، کمبود اکسیـژن و فقـر سرمـی نسبـت بـه گروه کنترل ارزیابی شد.
مواد و روشها
در این مطالعه تجربی از سلولهای بنیادی مزانشیمی بند ناف موجود در ذخیره سلولی مرکز تحقیقات مؤسسه عالی آموزشی- پژوهشی طب انتقال خون، که قبلاً مارکرهای سطحی و توانایی تمایز آنها به سه رده چربی، استخوان و غضروف بررسی و تأیید شده بود، استفاده شد(23). پلاسمید نوترکیب حاوی ژن Nrf2 pcDNA3.1-Nrf2)) و پلاسمید نوترکیب حاوی ژن HIF-1α pcDNA3.1-HIF-1α)) نیز قبلاً با روش برش و اتصال آنزیمی تولید و با روشهای PCR ، هضم آنزیمی و توالییابی DNA تأیید شده بودند و باکتری اشرشیاکولـی نـوعDH5α دارای ایـن پلاسمیدهای نوترکیب به صورت ذخیره (استوک) در مرکز تحقیقات موجود بود(18، 17).
آمادهسازی و استخراج پلاسمیدهای نوترکیب:
باکتریهای حاوی pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α از استوک خارج شده و در محیط LB مایع حاوی آنتیبیوتیک اختصاصی کانامایسین یا آمپیسیلین(شرکت اینویتروژن آمریکا) به صورت جداگانه به مدت یک شب در انکوباتور 37 درجه سانتیگراد شیکردار(شرکت ایوی من استرالیا) کشت داده شدند. پلاسمیدهای نوترکیب با استفاده از کیت استخراج پلاسمید(شرکت رُوش آلمان) و بر طبق روش کار کیت استخراج و کمیت آنها با استفاده از اسپکتروفتومتر نانودراپ (شرکتهای تک آمریکا) اندازهگیری شد.
آمادهسازی سلولهای بنیادی مزانشیمی بند ناف:
سلولهای بنیادی مزانشیمی بند ناف از دمای 80- یا تانک ازت خارج شده، پس از یخزدایی با محیط DMEM-Low glucose حاوی 10% سرم جنین گاوی (FBS) و آنتیبیوتیک استرپتومایسین و آمپیسیلین(هر سه ماده از شرکت اینویتروژن آمریکا) مخلوط شده و به ظروف کشت مناسب و استریل منتقل و در انکوباتور استاندارد کشت سلولی، کشت داده شدند. خصوصیات ریختشناسی آنها با استفاده از میکروسکوپ نوری معکوس(شرکت نیکون ژاپن) بررسی شد. سپس تعداد 300 هزار عدد از این سلولها در چاهکهای پلیتهای 6 خانهای کشت داده شدند و پس از چسبیدن سلولها به کف پلیت، از آنها جهت انجام مراحل ترانسفکشن(ورود DNA پلاسمیدی به داخل سلول) استفاده شد.
ترانسفکشن پلاسمیدهای نوترکیب به داخل سلولهای بنیادی مزانشیمی:
در این مطالعه از ماده لیپوزومی فیوژن اچ دی (شرکت رُوش آلمان) جهت وارد کردن pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α به درون سلولهای بنیادی مزانشیمی بند ناف استفاده شد. نسبتهای مناسب از فیوژن اچ دی با pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α به طور جداگانه و هم زمان با هر دوی آنها مخلوط شده و به محیط کشت سلولهای بنیادی مزانشیمی کشت داده شده در چاهکهای مختلف پلیتهای 6 خانهای اضافه شد. پس از گذشت 5-4 ساعت، محیط کشت سلولها تعویض شد.
تأیید بیان ژنهای Nrf2 و HIF-1α به روش PCR ترانس کریپتاز معکوس(RT-PCR):
72 ساعت پس از ترانسفکشن، بیان Nrf2 در سلولهای ترانسفکت شده با pcDNA3.1-Nrf2 (که MSC-Nrf2 نامیده شدند)، بیان HIF-1α در سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α (یا MSC-HIF-1α) و بیان هم زمان هر دو ژن در سلولهای هم زمان ترانسفکت شده (یا MSC-Nrf2-HIF) به روش PCR ترانس کریپتاز معکوس بررسی شد. RNA گروههای سلولی مختلف با استفاده از ماده ترایزول(شرکت اینویتروژن آمریکا) استخراج شد. cDNA آنها با استفاده از کیت ساخت cDNA (شرکت بیونیر آمریکا) و بر اساس روش کار توصیفی کیت ساخته شد. آغازگرهای اختصاصی دو ژن مورد نظر با استفاده از سایت NCBI طراحی شده، واکنشهای PCR با استفاده از دورههای دمایی و زمانی مناسب ایجاد شده توسط دستگاه PCR (شرکت تاکارای ژاپن) انجام شد. محصولات به دست آمده بر روی ژل آگارز 2% الکتروفورز شده با رنگ اتیدیوم بروماید رنگآمیزی شد. باندهای ایجاد شده با دستگاه ترانس لومیناتور( شرکت تتروی انگلیس) مشاهـده و تفسیر گردید.
جمعآوری و تغلیظ سکرتوم سلولهای بنیادی مزانشیمی:
سلولهای بنیادی مزانشیمی بند ناف با هر دو پلاسمید نوترکیب ذکر شده و به روش توصیف شده ترانسفکت شدند. 48 ساعت بعد محیط کشت آنها با محیط کشت فاقد سرم تعویض شد و 24 ساعت بعد محیط کشت رویی سلولها جمعآوری و با استفاده از لولههای دارای فیلتر 5 کیلو دالتون(شرکت سارتوریوس آلمان) و سانتریفوژ با سرعت 10000 دور در دقیقه به مدت 90 دقیقه تغلیظ شـد.
کشت سلولهای بنیادی مزانشیمی بند ناف در مجاورت سکرتوم سلولهای دستورزی شده:
10000 سلول بنیادی مزانشیمی بندناف به طور سه تایی در چاهکهای پلیت 96 خانهای و در محیط DMEM-LG دارای 10% FBSو آنتیبیوتیک کشت داده شدند. بعد از چسبیدن سلولها، محیط کشت چاهکها تخلیه شده و درصدهای مختلف از سکرتوم سلولهای هم زمان ترانسفکت شده با Nrf2 وHIF-1α (MSC-HIF-Nrf2) به آنها اضافه شد و به مدت یک شب در انکوباتور استاندارد کشت سلولی نگهداری شدند.
این گروه S- HIF-Nrf2 نامیده شدند. هم زمان گروه کنترلS-MSC)) نیز با سکرتوم به دست آمده از سلولهای بنیـادی مزانشیمــی بدون دستورزی ژنتیکی به مدت یک
شب مجاور شدند.
ایجاد شرایط گوناگون استرس سلولی بر گروههای سلولی مختلف:
به منظور بررسی تأثیر افزایش بیان HIF-1α و Nrf2 به طور جداگانه و هم زمان و هم چنین سکرتوم به دست آمده از آنها بر میزان بقای سلولها، گروههای سلولی مختلف ترانسفکت شده و یا کشت داده شده، در مجاورت سکرتوم با شرایط استرس کمبود اکسیژن، فقر سرمی و استرس اکسیداتیو ناشی از اثر پراکسیدهیدروژن(H2O2) مواجه شدند.
10000 سلول بنیادی مزانشیمی در چاهکهای پلیتهای 96 خانهای به طور جداگانه و سه تایی کشت داده شدند.
جهت اعمال استرس کمبود اکسیژن، سلولها به مدت زمانهای مختلف 0، 5/1، 3، 6 و 24 ساعت در انکوباتور مخصوص با اکسیژن پایین(هیپوکسی) و در غلظت 1% اکسیژن و 5% دیاکسیدکربن کشت داده شدند. جهت ایجاد استرس فقر سرمی، محیط کشت سلولها خارج و به آنها محیط کشت فاقد FBS اضافه و پلیتها به مدت زمانهای 0، 5/1، 3، 6، 24 و 48 ساعت در انکوباتور کشت سلولی نگهداری شدند. بـه منظـور ایجـاد شرایط استرس اکسیداتیو و رادیکالهای آزاد اکسیژن، سلولها با غلظتهای 5-0 میلیمولار H2O2 به مدت یک ساعت مواجه شدند.
تعیین درصد سلولهای زنده و میزان بقای سلولها پس از اعمال استرسهای سلولی مختلف:
پس از ایجاد شرایط استرس، درصد سلولهای زنده گروههای سلولی مختلف با روش تریپانبلو تخمین زده شد. به منظور تایید بیشتر و کمی سازی نتایج، میزان بقای سلولها با روش WST-1 (Water Soluble Tetrazoliume Salt ، شرکت سیگمای آمریکا) نیز بررسی شد. WST-1 به نسبت 1:10 به محیط کشت سلولها اضافه شد و پس از گذشت 4-3 ساعت، میزان جذب نوری نمونهها در طول موج 450 نانومتر با دستگاه الایزا خوان (شرکت مولتی اسکن بلژیک) خوانش و میزان بقای سلولی محاسبه گردید.
بررسیهای آماری:
کلیه آزمایشها به صورت سه تا پنجتایی ارزیابی شدند و نتایج به دست آمده و میزان بقای سلولی به صورت میانگین ± انحراف معیار(mean ± SD) مورد استفاده قرار گرفت. دادههای کمی با استفاده از برنامه نرمافزاری 19SPSS version و روش آماری آنالیز واریانس یک طرفه (One-Way ANOVA) تجزیه و تحلیل شدند و دامنه طبیعی سازی و اختلافهای معنادار با ارزش p کمتر از 05/0 گزارش شد.
یافتهها
سلولهای بنیادی مزانشیمی بند ناف ظاهری دوکی شکل دارند:
پس از یخزدایی و کشت سلولها در محیط کشت اختصاصی، سلولهای رشد کرده از نظر ریختشناسی با استفاده از میکروسکوپ معکوس بررسی شدند. مشاهدات میکروسکوپی نشان داد که سلولهای کشت داده شده از این نظر کاملاً مشابه سلولهای بنیادی مزانشیمی بوده، ظاهری شبه فیبروبلاستی دارند و دوکی شکل هستند (شکل1).

شکل1: خصوصیات ریختشناسی سلولهای بنیادی مزانشیمی بندناف. سلولها ظاهری دوکی و کشیده داشتند(بزرگنمایی 200×).
سلولهای ترانسفکت شده، ژنهای Nrf2 و HIF-1α را بیان میکنند:
72 ساعت پس از ترانسفکشن سلولها با pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α به طور جداگانه و هم زمان، بیان این ژنها به روش PCR ترانس کریپتاز معکوس در سلولها بررسی شد. همان طور که در شکل 2 مشاهده میشود، سلولهای ترانسفکت شده با pcDNA3.1-Nrf2که MSC-Nrf2 نامیده شدند، ژن Nrf2 را بیان کردند. با توجه به شکل 2 ، بیان HIF-1αدر سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α نیز تایید شد.

شکل2: بررسی بیان ژن HIF-1α و Nrf2در گروههای سلولی مختلف با روش PCR ترانس کریپتاز معکوس. M مارکر DNA ، ردیف 1: سلولهای ترانسفکت شده با پلاسمید خالی، ردیف 2: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- HIF-1α ، ردیف3: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- Nrf2 و ردیف4: سلولهای هم زمان ترانسفکت شده با پلاسمیدهای pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α. سلولهای بنیادی مزانشیمی هم زمان ترانسفکت شده،HIF-1α وNrf2 را بیان کردند.

شکل3: بررسی بیان بتااکتین در گروههای سلولی مختلف با روش PCR ترانس کریپتاز معکوس(کنترل داخلی). M مارکر DNA ، ردیف 1: سلولهای ترانسفکت شده با پلاسمید خالی، ردیف 2: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- HIF-1α ، ردیف3: سلولهای ترانسفکت شده با پلاسمید pcDNA3.1- Nrf2 و ردیف 4: سلولهای هم زمان ترانسفکت شده با پلاسمیدهای pcDNA3.1-Nrf2 و pcDNA3.1-HIF-1α. تمامی گروهها ژن بتااکتین را بیان کردند.
وجود دو باند با اندازههای مورد انتظار مؤید بیان هم زمان هر دو ژن در سلولهای هم زمان ترانسفکت شده(یا سلولهای MSC-Nrf2-HIF) بود(شکل 2). جهت کنترل مراحل آزمایش، بیان ژن بتااکتین نیز مورد بررسی قرار گرفت و همه گروههای مورد بررسی این ژن را به میزان مناسب بیان کردند (شکل3).
سلولهای هم زمان ترانسفکت شده در برابر استرس کمبود اکسیژن مقاومتر هستند:
گروههای سلولی مختلف ترانسفکت شده در غلظت اکسیژن 1% تنظیم شده با انکوباتور مخصوص هیپوکسی در مدت زمانهای مختلف کشت داده شدند و میزان بقای آنها با روشWST-1 ارزیابی شد(نمودار 1). طبق نمودار ارائه شده، میزان بقای سلولی گروههای ترانسفکت شده با ژنهای ذکر شده بیش از گروه کنترل(سلولهای بنیادی مزانشیمی و سلولهای ترانسفکت شده با پلاسمید خالی) بود. و در بین گروههای ترانسفکت شده نیز، میزان بقای سلولهای هم زمان ترانسفکت شده بیش از سلولهایی بود که فقط یکی از ژنهای Nrf2 یا HIF-1α در آنها افزایش بیان داده شده بود. به طوری که این اختلاف در زمان 24 ساعت مواجهه با کمبود اکسیژن معنادار بود(05/0 p<) (نمودار1).
میزان بقای سلولهای هم زمان ترانسفکت شده پس از استرس فقر سرمی بیش از سایر گروهها است:
پس از کشت سلولها در محیط فاقد سرم در زمانهای مختلف، میزان بقای آنها با روش WST-1 سنجیده شد (نمودار2). همان طور که در نمودار 2 مشاهده میشود، سلولهای هم زمان ترانسفکت شده در برابر استرس فقر سرمی مقاومت بیشتری داشته و میزان بقای آنها با میزان بقای سلولهایی که فقط با یکی از پلاسمیدها ترانسفکت شده بودند در زمان 48 ساعت، اختلاف معنادار داشت (01/0 p<)(نمودار 2).

نمودار1: میزان بقای سلولی در گروههای سلولی مختلف پس از مواجهه با استرس کمبود اکسیژن در زمانهای متفاوت(0، 5/1، 3 ، 6 و 24 ساعت)، با روش .WST-1:MSC-Nrf2 سلولهای ترانسفکت شده با pcDNA3.1-Nrf2 ،:MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α ، MSC-HIF-Nrf2: سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 ، MSC-V : سلولهای ترانسفکت شده با پلاسمید خالی و : MSCs سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکی(05/0 p<). گروه هم زمان ترانسفکت شده با دو ژن دارای بیشترین بقای سلولی بود.

نمودار2: میزان بقای سلولی در گروههای سلولی مختلف پس از مواجهه با استرس فقر سرمی در زمانهای متفاوت( 0، 5/1، 3، 6، 24 و 48 ساعت)، با روش WST-1.: MSC-Nrf2 سلولهای ترانسفکت شده با pcDNA3.1-Nrf2،: MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1- HIF-1α ، MSC-HIF-Nrf2 : سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 ، MSC-V : سلولهای ترانسفکت شده با پلاسمید خالی و : MSCs سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکی(01/0 p<). گروه هم زمان ترانسفکت شده با دو ژن دارای بیشترین بقای سلولی بود.

نمودار3: میزان بقای سلولی گروههای سلولی مختلف پس از مواجهه یک ساعته با غلظتهای 5-0 میلی مولار H2O2 با روش WST-1 . MSC-Nrf2 : سلولهای ترانسفکت شده با pcDNA3.1-Nrf2،:MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α ، MSC-HIF-Nrf2: سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2، MSC-V : سلولهای ترانسفکت شده با پلاسمید خالی و :MSCs سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکی(01/0 p< و 001/0 p<). گروه هم زمان ترانسفکت شده با دو ژن دارای بیشترین بقای سلولی بود.
افزایش بیان هم زمان Nrf2 و HIF-1α اثر حفاظتی بیشتری بر سلولها در شرایط استرس اکسیداتیو دارد:
میزان بقای سلولی در گروههای سلولی مختلف تحت مطالعه پس از یک ساعت مواجهه با غلظت 5-0 میلیمولار پراکسیدهیدروژن بررسی شد(نمودار3). نتایج WST-1 که در نمودار 3 ارایه شده است، نشان داد که افزایش بیان هم زمان این دو ژن در سلولهای بنیادی مزانشیمی، این سلولها را در برابر استرس ناشی از H2O2 محافظت کرده به طوری که اختلاف میزان بقای گروه سلولی هم زمان ترانسفکت شده با دیگر گروهها در غلظتهای 4 و 5 میلیمولار H2O2 با ارزش p کمتر از 01/0 و 001/0 معنادار بود(نمودار3).
سکرتوم سلولهای هم زمان ترانسفکت شده، اثرات محافظت سلولی مناسبی در شرایط استرس سلولی مختلف دارد:
پس از جمعآوری و تغلیظ سکرتوم سلولهای دستورزی شده با دو ژن و سکرتوم سلولهای بدون دستورزی، سلولهای بنیادی مزانشیمی به روش ذکر شده با این سکرتومها مواجه شده و سپس تحت شرایط استرس سلولی مشابه، کشت داده شدند. در نهایت میزان بقای سلولی آنها با روش WST-1 سنجیده شد (نمودارهای 4 تا 6). با توجه به نمودار 4 ، سلولهای مجاور شده با سکرتوم سلولهای همزمان ترانسفکت شده با Nrf2 وHIF-1α که S-HIF-Nrf2 نامیده شده بودند، نسبت به گروه کنترل خود یا سلولهای مجاور شده با سکرتوم به دست آمده از سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکیS-MSC)) مقاومت بیشتری در برابر استرس کمبود اکسیژن از خود نشان دادند. اختلاف میزان بقای آنها پس از 6 و 24 ساعت مواجهه با کمبود اکسیژن با میزان بقای
گروه کنترل با ارزش p کمتر از 001/0 معنادار بود (نمودار4).
بر طبق اطلاعات ارائه شده در نمودار 5، گروه سلولی S- HIF-Nrf2 که با سکرتوم سلولهایی که بیان هر دو ژن در آنها افزایش بیان یافته بود مجاور شدهاند، بیشترین مقاومت را در برابر استرس فقر سرمی داشته و میزان بقای آنها نسبت به میزان بقای گروه سلولی S-MSC (سلولهای مواجه شده با سکرتوم سلولی بدون دستورزی ژنتیکی) در زمانهای 24 و 48 ساعته، اختلاف معناداری را نشان داد (نمودار5). ارزشP محاسبه شده کمتر از 01/0 و 001/0 بود. با توجه به نمودار6 ، میزان بقای سلولهای مواجه شده با سکرتوم سلولهای هم زمان ترانسفکت شده پس از اعمال استرس اکسیداتیو ناشی از پراکسیدهیدروژن در غلظتهای 2 تا 5 میلی مولار با گروه کنترل اختلاف معنادار داشت(001/0 p< و 01/0 p<).
جدول 1 میانگین و انحراف معیار درصد بقای سلولی پنج گروه اصلی تحت مطالعه را پس از مواجهه با استرس اکسیداتیو، کمبود اکسیژن و فقر سرمی ارایه میکند.
با نگاهی به نتایج بدست آمده میتوان این طور نتیجه گرفت که کشت سلولهای بنیادی مزانشیمی در مجاورت سکرتوم ترشحی آنها نیز باعث افزایش مقاومت این سلولها در مقایسه با کنترل مناسب میشود.
میزان بقای سلولی در گروههای سلولی مختلف تحت مطالعه پس از یک ساعت مواجهه با غلظت 5-0 میلیمولار پراکسیدهیدروژن بررسی شد(نمودار3). نتایج WST-1 که در نمودار 3 ارایه شده است، نشان داد که افزایش بیان هم زمان این دو ژن در سلولهای بنیادی مزانشیمی، این سلولها را در برابر استرس ناشی از H2O2 محافظت کرده به طوری که اختلاف میزان بقای گروه سلولی هم زمان ترانسفکت شده با دیگر گروهها در غلظتهای 4 و 5 میلیمولار H2O2 با ارزش p کمتر از 01/0 و 001/0 معنادار بود(نمودار3).
سکرتوم سلولهای هم زمان ترانسفکت شده، اثرات محافظت سلولی مناسبی در شرایط استرس سلولی مختلف دارد:
پس از جمعآوری و تغلیظ سکرتوم سلولهای دستورزی شده با دو ژن و سکرتوم سلولهای بدون دستورزی، سلولهای بنیادی مزانشیمی به روش ذکر شده با این سکرتومها مواجه شده و سپس تحت شرایط استرس سلولی مشابه، کشت داده شدند. در نهایت میزان بقای سلولی آنها با روش WST-1 سنجیده شد (نمودارهای 4 تا 6). با توجه به نمودار 4 ، سلولهای مجاور شده با سکرتوم سلولهای همزمان ترانسفکت شده با Nrf2 وHIF-1α که S-HIF-Nrf2 نامیده شده بودند، نسبت به گروه کنترل خود یا سلولهای مجاور شده با سکرتوم به دست آمده از سلولهای بنیادی مزانشیمی بدون دستورزی ژنتیکیS-MSC)) مقاومت بیشتری در برابر استرس کمبود اکسیژن از خود نشان دادند. اختلاف میزان بقای آنها پس از 6 و 24 ساعت مواجهه با کمبود اکسیژن با میزان بقای
گروه کنترل با ارزش p کمتر از 001/0 معنادار بود (نمودار4).
بر طبق اطلاعات ارائه شده در نمودار 5، گروه سلولی S- HIF-Nrf2 که با سکرتوم سلولهایی که بیان هر دو ژن در آنها افزایش بیان یافته بود مجاور شدهاند، بیشترین مقاومت را در برابر استرس فقر سرمی داشته و میزان بقای آنها نسبت به میزان بقای گروه سلولی S-MSC (سلولهای مواجه شده با سکرتوم سلولی بدون دستورزی ژنتیکی) در زمانهای 24 و 48 ساعته، اختلاف معناداری را نشان داد (نمودار5). ارزشP محاسبه شده کمتر از 01/0 و 001/0 بود. با توجه به نمودار6 ، میزان بقای سلولهای مواجه شده با سکرتوم سلولهای هم زمان ترانسفکت شده پس از اعمال استرس اکسیداتیو ناشی از پراکسیدهیدروژن در غلظتهای 2 تا 5 میلی مولار با گروه کنترل اختلاف معنادار داشت(001/0 p< و 01/0 p<).
جدول 1 میانگین و انحراف معیار درصد بقای سلولی پنج گروه اصلی تحت مطالعه را پس از مواجهه با استرس اکسیداتیو، کمبود اکسیژن و فقر سرمی ارایه میکند.
با نگاهی به نتایج بدست آمده میتوان این طور نتیجه گرفت که کشت سلولهای بنیادی مزانشیمی در مجاورت سکرتوم ترشحی آنها نیز باعث افزایش مقاومت این سلولها در مقایسه با کنترل مناسب میشود.

نمودار4: میزان بقای سلولی در گروههای سلولی مختلف مجاور شده با سکرتوم پس از مواجهه با استرس کمبود اکسیژن در زمانهای مختلف (0، 5/1، 3، 6، 24 و 48 ساعت) با روش WST-1. S-HIF-Nrf2 : سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2، S-MSC : سلولهای مجاور شده با سکرتوم سلولی بدون دست ورزی ژنتیکی و MSCs: سلولهای بدون مجاورت با سکرتوم(001/0 p<). سلولهای مجاور شده با سکرتوم دستورزی شده با دو ژن دارای بیشترین بقای سلولی بودند.

نمودار5: میزان بقای سلولی در گروههای سلولی مختلف مجاور شده با سکرتوم پس از مواجهه با استرس فقر سرمی در زمانهای مختلف(0 ، 5/1، 3، 6، 24 و 48 ساعت)، با روش WST-1. S-HIF-Nrf2: سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2، S-MSC: سلولهای مجاور شده با سکرتوم سلولی بدون دست ورزی ژنتیکی و MSCs: سلولها بدون مجاورت با سکرتوم (01/0 p< و 001/0 p<). سلولهای مجاور شده با سکرتوم دست ورزی شده با دو ژن دارای بیشترین بقای سلولی بودند.

نمودار6: میزان بقای سلولی در گروههای سلولی مختلف مجاور شده با سکرتوم پس از مواجهه یک ساعته با غلظتهای 5-0 میلی مولار H2O2 ، با روش WST-1 . S-HIF-Nrf2 : سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2، S-MSC : سلولهای مجاور شده با سکرتوم سلولی بدون دست ورزی ژنتیکی و MSCs: سلولها بدون مجاورت با سکرتوم. (01/0 p< و 001/0 p<). سلولهای مجاور شده با سکرتوم دست ورزی شده با دو ژن دارای بیشترین بقای سلولی بودند.
جدول 1: میانگین و انحراف معیار درصد بقای سلولی در گروههای مختلف پس از مواجهه با استرس اکسیداتیو، کمبود اکسیژن و فقر سرمی با روش WST-1. :MSC-Nrf2سلولهای ترانسفکت شده با pcDNA3.1-Nrf2،:MSC-HIF سلولهای ترانسفکت شده با pcDNA3.1-HIF-1α ، MSC-HIF-Nrf2: سلولهای هم زمان ترانسفکت شده با pcDNA3.1-HIF-1α و pcDNA3.1-Nrf2 ، S-HIF-Nrf2 : سلولهای مجاور شده با سکرتوم MSC-HIF-Nrf2 و :MSCسلولهای بنیادی مزانشیمی کنترل.
| گروه سلولی | استرس اکسیداتیو | کمبود اکسیژن | فقر سرمی |
| MSC-Nrf2 | 8/5% ± 8/72% | 3/4% ± 8/76% | 1/5% ± 3/77% |
| MSC-HIF | 6% ± 3/67% | 1/6% ± 6/81% | 5/4% ± 4/76% |
| MSC-HIF-Nrf2 | 2/5% ± 6/83% | 5/4% ± 8/87% | 2/6% ± 3/85% |
| S-HIF-Nrf2 | 4/4% ± 80% | 8/5% ± 6/82% | 5% ± 8/72% |
| MSC | 5/4% ± 2/58% | 4% ± 64% | 8/5% ± 8/72% |
بحث
به دلیل خصوصیات منحصر به فرد سلولهای بنیادی مزانشیمی، استفاده از آنها در مطالعههای بالینی و به خصوص پزشکی ترمیمی، مورد توجه قرار گرفته است(5-2). اما مهمترین چالش بر سر راه استفاده از آنها، بقای کم این سلولها پس از تزریق است(10). بنابراین مجهز کردن آنها به ابزارهایی که باعث افزایش مقاومت سلولی میشوند، کمک کننده است. به نظر میرسد استفاده از اثرات ترشحی و محافظتی خود سلولهای بنیادی مزانشیمی، راهکار مناسبی جهت رسیدن به این هدف باشد. در مطالعه اخیر جهت افزایش بیان دو ژن Nrf2 و HIF-1α در سلولهای بنیادی مزانشیمی بند ناف، از حامل پلاسمیدی و ماده فیوژن اچدی استفاده شد. استفاده از حامل پلاسمیدی (به جای حامل ویروسی) نگرانی از واکنشهای ایمنی غیر اختصاصی و یا جهشزایی را به همراه ندارد(24). ماده لیپوزومی فیوژن اچ دی باعث افزایش درصد انتقال DNA به داخل سلول شده و بر روی تکثیر و تمایز سلولی اثر منفی ندارد(25).
Nrf2 و HIF-1α از عوامل بسیار مهم در فرآیندهای حفاظت سلولی هستند که افزایش بیان آنها اثر مضاعفی بر مقاومت سلولی سلولهای بنیادی مزانشیمی بند ناف دارد (20، 19). سلولهای بنیادی مزانشیمی بند ناف با نمونهگیری آسان جداسازی میشوند و دارای قدرت تکثیر و خاصیت تعدیل ایمنی بیشتری هستند(26). در این مطالعه میزان بقـای سلولی پس از اعمال سه استرس کمبود اکسیژن، فقر سرمی و استرس اکسیداتیو که باعث بیشترین مرگ سلولها در شرایط آزمایشگاه و بالین میشوند، با روش WST-1 بررسی و افزایش داده شد(11). WST-1 روشی آسان و دقیق با سمیت سلولی کمتر است(27). نتایج WST-1 مبین افزایش میزان بقای سلولی در سلولهای دستورزی شده پس از اعمال شرایط استرس بود.
کیانی و همکاران در سال 2013 بیان HIF-1α را در سلولهای بنیادی مزانشیمی با استفاده از حامل پلاسمیدی افزایش دادند و سپس سلولها را با استرسهای اکسیداتیو، فقر سرمی و کمبود اکسیژن مواجه کردند و این طور نتیجه گرفتند که با افزایش بیان این ژن، میزان بقای سلولها در مواجهه با استرسهای سلولی افزایش مییابد (17). محمدزاده (2012) طی مطالعهای نشان داد که افزایش بیان Nrf2 در سلولهای بنیادی مزانشیمی باعث اثر حفاظتی قابل قبولی در برابر استرسهای سلولی مشابه میشود. وی از حامل ویروسی در مطالعه خود استفاده کرده بود(18). نتایج آنها با مطالعه اخیر هم خوانی داشت. از طرفی در مطالعه اخیر افزایش بیان هم زمان HIF-1α و Nrf2 باعث همافزایی اثرات محافظتی دو ژن شده و منجر به افزایش مقاومت سلولی در شرایط استرسی سختتر شد.
در قسمتی از این مطالعه مجاور کردن سلولهای بنیادی مزانشیمی با سکرتوم سلولهای دستورزی شده نیز باعث افزایش مقاومت آنها شد. استفاده از سکرتوم و اثرات ترشحـی سلولها، نگرانیهای ناشی از دستورزی ژنتیکی
سلولهـا و عدم امکان استفاده از آن در بالین را به همراه ندارد.
لی و همکارانش در سال 2012 با جمعآوری سکرتوم سلولهای بنیادی دست ورزی شده با ژن GATA-4 و اعمال استرس کمبود اکسیژن نشان دادند که سلولهای سیاهرگی مجاور شده با این سکرتوم، پس از پیوند دارای توان تمایزی و بقای بیشتری هستند(28).
جنسکی و گروه وی (2006) چنین گزارش کردند که جمعآوری سکرتوم سلولهای بنیادی مزانشیمی که ژن Akt در آنها افزایش بیان یافته، کشت سلولهای قلبی در مجاورت این سکرتوم و اعمال شرایط کمبود اکسیژن باعث تسریع در فرآیند ترمیم عضله قلبی آسیب دیده میشود (29). در این دو مطالعه از حاملهای ویروسی جهت دستورزی سلولها استفاده شده بود. از طرفی میزان بقای سلولها تنها پس از شرایط کمبود اکسیژن مورد بررسی قرار گرفته بود.
زانگ و همکارانش در سال 2009 با مجاورت محیط کشت حاصل از سلولهای بنیادی مزانشیمی با سلولهای عضلانی قلب که در شرایط کمبود اکسیژن تیمار شده بودند، نشان دادند که اثر ترشحی سلولهای بنیادی مزانشیمی منجر به محافظت از سلولهای عضله قلبی در برابر آپوپتوز ناشی از استرس اکسیداتیو نیز میگردد (30). در این مطالعه نیز همانند مطالعهی اخیر، سکرتوم سلولهای بنیادی مزانشیمی باعث افزایش بقای سلولی پس از مواجهه سلولها با H2O2 شد.
به طور خلاصه در این تحقیق میزان بقا و مقاومت سلولهای بنیادی مزانشیمی در برابر استرسهای سلولی مختلف پس از افزایش بیان دو ژن مهم در فرآیندهای محافظت سلولی(Nrf2 وHIF-1α ) و هم چنین کشت این سلولها در مجاورت سکرتوم به دست آمده از سلولهای دستورزی شده، افزایش داده شد.
نتیجهگیری
افزایش بیان دو ژن Nrf2 و HIF-1α در سلولهای بنیادی مزانشیمی، اثر مضاعفی بر میزان بقای آنها دارد. سکرتوم سلولهای دستورزی شده با این دو ژن، سلولهای بنیادی مزانشیمی را در برابر استرسهای کمبود اکسیژن، فقر سرمی و استرس اکسیداتیو محافظت کرده و نگرانیهای ناشی از دستورزی ژنتیکی سلولها و عدم امکان استفاده از آن در بالین را نیز از بین میبرد. به نظر میرسد استفاده از سکرتوم، راهکاری مناسب و عملی در افزایش بقای سلولها و امکان کاربرد بیشتر و مفیدتر آنها در کارآزماییهای بالینی باشد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه دانشجویی خانم فاطمه سلطانی در مقطع کارشناسی ارشد و مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال ایران میباشد که از محل بودجههای پژوهشی این مرکز تامین اعتبار گردیده است.
نوع مطالعه: پژوهشي |
موضوع مقاله:
سلولهاي بنيادي
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





