جلد 12، شماره 1 - ( بهار 1394 )
جلد 12 شماره 1 صفحات 13-23 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nikbakht Dastjerdi M. Investigation of p53 codon 72 polymorphism in patients with acute myeloid leukemia in Iran. bloodj 2015; 12 (1) :23-13
URL: http://bloodjournal.ir/article-1-860-fa.html
URL: http://bloodjournal.ir/article-1-860-fa.html
نیکبخت دستجردی مهدی. پلیمورفیسم کدون 72 ژن P53 در بیماران مبتلا به لوسمی میلوئید حاد در ایران. فصلنامه پژوهشی خون. 1394; 12 (1) :23-13
خیابان هزار جریب ـ اصفهان ـ ایران ـ کدپستی: 81744176
متن کامل [PDF 320 kb]
(2382 دریافت)
| چکیده (HTML) (7587 مشاهده)
مقدمه
سرطان بعد از بیماریهای قلبی ـ عروقی، دومین علت اصلی مرگ و میر در جهان میباشد(1). سرطانهای هماتولوژیک از دو رده اصلی سلولهای خونی منشاء میگیرند که شامل رده سلولی میلوئید و لنفوئید میباشد. بر اساس طبقهبندی WHO ، اصطلاح میلوئید شامل تمامی سلولهای متعلق به ردههای گرانولوسیتی(شامل نوتروفیل، ائوزینوفیل و بازوفیل) منوسیت، ماکروفاژ، اریتروئید، مگاکاریوسیت و ماست سل میباشد. طبقهبندی WHO برای سرطانهای میلوئید، به منظور تشخیص اولیه نمونههای خون محیطی یا مغز استخوان که مشکوک به سرطانهای میلوئید هستند، پیش از شروع درمان ،کاربرد دارد. درصد سلولی با فنوتیپ بلاست، معیاری برای طبقهبندی سرطانهای میلوئید و قضاوت در مورد سرعت رشد آنها محسوب میشود. از نطر WHO وجود حداقل 20% سلولهای بلاست در خون محیطی یا مغز استخوان به عنوان لوسمی میلوئید حاد(AML) در نظر گرفته میشود. با این وجود در برخی از ناهنجاریهای ژنتیکی، تشخیص AML ممکن است بدون توجه به شمارش بلاستهای خون محیطی یا مغز استخوان انجام پذیرد(2).
شیوع سرطانهای هماتولوژیک در کشورهای غربی رو به فزونی است. این نوع بدخیمیها با توجه به ویژگیهای بالینی و تغییرات ژنتیکی اکتسابی در آنها، بیماریهای ناهمگونی محسوب میشوند. به نظر میرسد عوامل متعددی از قبیل جهشهای ژنی، تابش اشعه یونیزان و عوامل شیمیائی مثل بنزن در بروز این سرطانها نقش ایفا مینمایند. این عوامل تاثیر کارسینوژنیک خود را با آسیب رساندن به DNA پروژنیتورهای خونی اعمال نموده و در نهایت منجر به بدخیمی میگردند. با این وجود در اغلب موارد وجود تفاوتهای ژنتیکی میتواند عاملی برای خطر بالای ابتلا به سرطان باشد(3).
ژن P53 به عنوان مهمترین ژن مهارکننده تومور، بر روی بازوی کوتاه کروموزوم 17 قرار دارد(13P17) و از 11 اگزون و10 اینترون تشکیل شده است که حاوی 20 کیلو باز میباشد. این ژن پروتئین P53 را کد میکند که یک فسفوپروتئین هستهای است و از 393 اسید آمینــه تشکیـل
تشکیل شده است(5، 4). ژن P53 یکی از مهمترین تنظیمکنندههای مهاری در رشد سلولهای طبیعی و تقسیم سلولی میباشد. زمانی که DNA آسیب میبیند ، ژن P53 از طریق اتصال به DNA ، تحریک و بیان ژنهای زیر دست (down stream) که نقش مهاری بر رشد و یا تهاجم سلولی دارند را باعث میشود(6). یکی دیگر از اعمال ژن P53 در پاسخ به استرسهایی که وارد سلول میشود، تنظیم چرخه سلولی و القاء آپوپتوزیس است که با فعال کردن مکانیسمهای بیوشیمیایی، نهایتاً مرگ فیزیولوژیک سلول را به دنبال دارد. اثرات سودمند شیمی درمانی در درمان سرطانها غالباً از طریق القاء آپوپتوزیس و یا اختلال در روند متابولیک چرخه سلولی میباشد. بنابراین تومورهایی که آپوپتوزیس را نشان میدهند، نسبت به شیمی درمانی حساسترند و پیشآگهی بهتری دارند(7).
اخیراً مطالب زیادی در مورد ارتباط بیماریهای خاص از جمله سرطان با پلیمورفیسم تک نوکلئوتیدی( SNP = Single Nucleotid Polymorphism) بیان شده است و وجود تفاوتهای فردی برای مستعد شدن در برابر نئوپلاسمهای خاص را توضیح میدهد. اهمیت ارتباط SNPs با خطر افزایش ابتلا به سرطانهای مختلف در گروههای نژادی متفاوت گزارش شده است(8). مشخص شده که کدون 72 اگزون شماره 4 ژن P53 دارای پلیمورفیسم تک نوکلئوتیدی شایعی است که در نتیجه آن ممکن است دو آلل ایجاد شود، یکی آرژانتین با توالی CGC و دیگری پرولین با توالی CCC . با توجه به امکان وجود این دو آلل، سه ژنوتیپ مختلف ممکن است ایجاد شود که عبارتند از آرژنین/آرژنین، پرولین/آرژنین و پرولین/ پرولین(6). این دو آلل از لحاظ ساختمانی و عملکرد با هم متفاوت هستند و قابلیتهای متفاوتی برای ظهور سرطان دارند(9). گزارشهای متعددی نشان میدهد که میزان بروز سرطانهای مختلف از جمله سرطانهای سینه، ریه، پروستات، کولورکتال، پوست، لوسمی و سایر بیماریها مثل اندومتریوز با درصد فراوانی این سه ژنوتیپ ارتباط دارد(23-8). تنوع در آللهای کدکننده اسیدهای آمینه آرژنین و پرولین باعث ایجاد تغییر در ساختمان پروتئین P53 و به دنبال آن تغییر در عملکرد این پروتئین میگردد(17). تحقیقات اخیر بیان میکنند که پلیمورفیسم کدون 72 روی فانکشن ژن P53تاثیر دارد و نشان میدهد که پروتئین دارای پرولین، توانایی بیشتری در القاء توقف چرخه سلولی و بر عکس قدرت کمتری برای القای آپوپتوز نسبت به پروتئین دارای آرژنین دارد. بر همین اساس پاسخدهی این ژنوتیپها به داروهای شیمی درمانی متفاوت گزارش شده است(7).
با توجه به این که این پلیمورفیسم وابسته به موقعیت جغرافیایی و نژادی است و فراوانی برخی از سرطانهای انسانی از جمله سرطان خون با آن مرتبط است، پاسخدهی این ژنوتیپ به داروهای شیمی درمانی متفاوت گزارش شده است. هدف از این مطالعه بررسی این پلیمورفیسم در نمونههای لوسمی میلوئید حاد و مقایسه آن با نمونههای سالم در شهر اصفهان بود.
مواد و روشها
جمعآوری نمونهها:
در یک مطالعه مورد ـ شاهدی، نمونههای سرطانی بالغ بر100 نمونه بلوک پارافینی به عنوان مورد و نمونههای خونی از خون افراد فاقد سرطان از بیمارستان الزهرا به عنوان گروه شاهد جمعآوری شد. قبل از نمونهگیری، از کلیه افراد فاقد سرطان جهت گرفتن خون رضایتنامه کتبی اخذ شد. نمونههای خونی از افرادی گرفته شد که از نظر سن و جنس با نمونههای سرطانی match شده بودند.
از بین نمونههای سرطانی مربوط به سالهای قبل که به صورت بلوکهای پارافینی در آرشیو پاتولوژی بیمارستان موجود بودند، پس از ثبت اطلاعات دموگرافیک و تایید تشخیص پاتولوژی، 59 نمونه که از کیفیت بهتری برخوردار بودند، برای انجام مراحل بعدی مورد استفاده قرار گرفتند.
استخراج DNA :
الف- بلوکهای پارافینی:
بعد از تایید تشخیص پاتولوژی، سه تا پنج قطعه از برشهای بلوک پارافینی مربوط به هریک از نمونههای AML به ضخامت 10 تا 15 میکرومتر در میکروتیوپ 5/1 میلیلیتری جمعآوری شدند. به منظور پارافینزدایی، به هر یک از تیوبها 500 میکرولیتر گزیلن اضافه شد و در بن ماری به مدت 2 ساعت در درجه حرارت 55 درجه سانتیگراد قرار داده شد.
سپس سانتریفوژ در Xg 18000 به مدت 5 دقیقه انجام شده و مجدداً با اضافه نمودن 500 میکرولیتر گزیلن، مرحله پارافینزدایی تکرار گردید. پس از پارافینزدایی، آبدهی نمونهها توسط الکلهای نزولی انجام گرفت. در مرحله بعد با استفاده از(رُوش ـ آلمان) high pure PCR template preparation kit ، DNA از بافتها استخراج گردید. DNA استخراج شده در تیوبهای 5/1 میلیلیتری جمعآوری شد و به یخچال در دمای 20- درجه سانتیگراد منتقل گردید.
ب- نمونههای خونی:
بعد از matching افراد سالم از نظر سن و جنس با نمونههای سرطانی، حدود 1 میلیلیتر از خون محیطی آنها جمع آوری شد و 200 میکرولیتر از آن جهت استخراج DNA با استفاده از high pure PCR template preparation kit (رُوش، آلمان)، به کار رفت.
تعیین غلظت DNA :
در این مرحله غلظت DNAاستخراج شده توسط دستگاه اسپکتروفتومتر یا از طریق load 5 میکرولیتر از محلول DNA استخراج شده بر روی ژل آگاروز 5% تعیین گردید.
تکثیر توالی پلیمورفیک کدون 72 ژن P53 توسط PCR :
PCR از طریق استفاده از 300-100 نانوگرم DNA ، 1 واحد تک پلیمراز ، 5/1 میلیمول MgCl2 و 200 میکرومول از هر یک از dATP ، dCTP ، dTTP، dGTP و 2 میکرومول از هر یک از زوج آغازگرهای اختصاصی برای تکثیر پرولین و آرژنین در حجم نهایی 25 میکرولیتر انجام گرفت(24).
توالی آغازگرهای اختصاصی برای تکثیر پرولین عبارتند از:
F: GCCAGAGGCTGCTCCCCC
R: CGTGCAAGTCACAGACTT
توالی آغازگرهای اختصاصی برای تکثیر آرژنین عبارتند از:
F: TCCCCCTTGCCGTCCCAA
R: CTGGTGCAGGGGCCACGC
تنظیم دستگاه ترموسایکلر برای تکثیر توالی پلیمورفیک کدون 72 ژن P53 به ترتیب زیر انجام گرفت:
مرحله اول: دناتوراسیون ابتدایی با دمای 94 درجه سانتیگراد به مدت 3 دقیقه
مرحله دوم: که 35 سیکل و شامل سه بخش زیر بود:
الف- دناتوراسیون با دمای 94 درجه سانتیگراد به مدت 30 ثانیه
ب- آنیلینگ با دمای 54 درجه سانتیگراد به مدت 30 ثانیه برای تکثیر پرولین و با دمای 60 درجه سانتیگراد برای تکثیر آرژنین
ج- اکستنشن با دمای 72 درجه سانتیگراد به مدت 30 ثانیه
مرحله سوم: اکستنشن نهایی با دمای 72 درجه سانتیگراد به مدت 5 دقیقه
بعد از اتمام کار محصول PCR تا زمان الکتروفورز در یخچال نگهداری شد.
ژل الکتروفورز :
حدود 5 میکرولیتر از محصول واکنش همراه با 1 میکرولیتر loading dye در ژل آگاروز 2% در بافر TBE * 5/0 الکتروفورز شده و روی یک UV Transluminator مشاهده شد.
تجزیه و تحلیل دادهها:
اطلاعات به دست آمده از طریق نرمافزار 11 SPSS ، مورد تجزیه و تحلیل آماری قرار گرفت. برای مقایسه توزیع فراوانی سه ژنوتیپ مختلف کدون 72 در نمونههای سرطانی با توزیع فراوانی این سه ژنوتیپ در نمونههای شاهد از کایدو استفاده شد. p-value کوچکتر از 05/0 معنادار تلقی گردید.
یافتهها
نتایج دموگرافیک:
برای انجام این مطالعه 59 نمونه سرطانی و 59 نمونه خونی افراد سالم جمعآوری شد(جدول 1).
جدول 1: نتایج دموگرافیک 59 نمونه AML
نتایج استخراج DNA از نمونهها:
DNA استخراج شده از نمونههای سرطانی و نمونه خونی افراد سالم دارای غلظت و کیفیت مناسب بوده و به طور موفقیتآمیزی توسطPCR تکثیر یافتند. 59 نمونه DNA استخراج شده از خون افراد سالم نیز همگی دارای غلظت و کیفیت مناسب بوده و به طور موفقیتآمیزی توسط PCR تکثیر یافتند.
نتایج Allele specific PCR :
محصول PCR برای آلل پرولین bp177 و برای آلل آرژنین bp 141بود(شکلهای 1 و 2). در نمونههای با ژنوتیپ آرژنین/آرژنین فقط با آغازگرهای اختصاصی برای تکثیر آرژنین، باندی با اندازه bp141 و در نمونههای با ژنوتیپ پرولین/پرولین فقط با آغازگرهای اختصاصی برای تکثیر پرولین، باندی با اندازه bp 177 ایجاد شد. در حالی که در نمونههای با ژنوتیپ آرژنین/پرولین با هر دو دسته این آغازگرها باند تشکیل گردید. توزیع فراوانی سه ژنوتیپ مختلف کدون 72 ژن P53 در 59 نمونه سرطانی و 59 نمونه خونی افراد فاقد سرطان در جدول 2 ارایه شده است. اختلاف بین توزیع فراوانی ژنوتیپ آرژنین/آرژنین کدون 72 ژن P53 در نمونههای سرطانی با نمونههای خونی افراد فاقد سرطان معنادار بــود به طوری که احتمال ابتلای افراد دارای ژنوتیپ آرژنین/ آرژنین، به AML ، بیش از سه برابر سایر افراد بود(04/0 p=).
جدول 2: توزیع فراوانی سه ژنوتیپ مختلف کدون 72 در 49 نمونه سرطانی و 49 نمونه خونی افراد فاقد سرطان به عنوان گروه شاهد. اختلاف بین توزیع فراوانی ژنوتیپ آرژنین/آرژنین کدون 72 ژن P53 در نمونههای سرطانی با نمونههای خونی افراد فاقد سرطان معنادار میباشد(04/0 p=). احتمال ابتلای افراد دارای ژنوتیپ آرژنین/آرژنین، با فاصله اطمینان 95% به AML ، بیش از سه برابر سایر افراد بود(81/3 OR=).
OR: Odds Ratio
CI: Confidence Interval
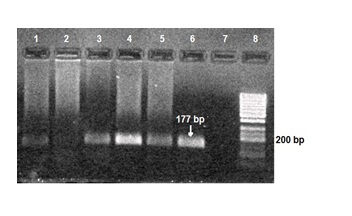
شکل 1: نمونههای با ژنوتیپ پرولین/پرولین فقط با آغازگرهای اختصاصی برای تکثیر پرولین، باندی با اندازه bp 177 ایجاد نمودهاند. نمونههای شماره 1 و 6-3 دارای باند؛ نمونه شماره 2 فاقد باند؛ شماره: 7 کنترل منفی؛ شماره 8 : مارکر 50 تایی
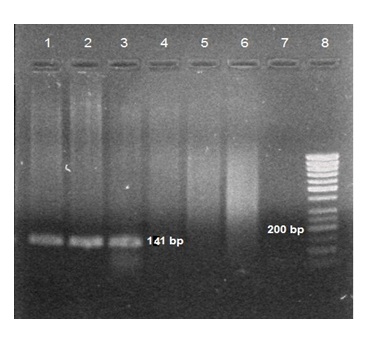
شکل 2: نمونههای با ژنوتیپ آرژنین/آرژنین فقط با آغازگرهای اختصاصی برای تکثیر آرژنین باندی با اندازه bp 141 تشکیل دادهاند. نمونههای شماره 3-1 دارای باند؛ نمونه های شماره 6- 4 فاقد باند; شماره: 7 کنترل منفی و شماره 8: مارکر 50 تایی.
بحث
مشخص شده است که پلیمورفیسم کدون 72 ژن P53 به عنوان یک فاکتور خطر در برخی از انواع سرطانهای انسانی نقش ایفا میکند. استوری و همکارانش نشان دادند که در سرطان گردن رحم مرتبط با HPV (Human papilloma-virus)، بیان بیش از اندازه پروتئین هموزیگوت آرژنین P53 وجود دارد و مشخص نمودند که افراد هموزیگوت آرژنین P53 ، هفت برابر از سایر ژنوتیپها، برای ابتلا به سرطان گردن رحم مرتبط با HPV، مستعدتر میباشند(25). این یافته توسط دو مطالعه دیگر نیز تایید شده است، هر چند که توسط برخی از محققین رد شده است(30-26). تنوع بین آزمایشگاهها در تعیین توالی P53 ممکن است مسؤول اختلاف در یافتهها باشد(31). در مطالعههای دیگر احتمال ابتلا به سرطانهای مثانه و کاردیا در ژنوتیپ هموزیگوت آرژنینP53 بیش از سایر ژنوتیپها گزارش شده است(33، 32).
از طرف دیگر نشان داده شده است افرادی که دارای ژنوتیپ هموزیگوت پرولین P53هستند، احتمال بیشتری برای ابتلا به سرطان پستان، ریه و پروستات دارند(34، 14، 12).
گزارش شده است که فراوانی موتاسیون در ژن P53 دارای آلل آرژنین بیش از ژن P53 دارای آلل پرولین است. از طرف دیگر نوع پرولیندار باعث القاء توقف چرخه سلولی در مرحله G1 میشود(35). مطالعههای دیگر نشان داده است پلیمورفیسم کدون 72 ژن P53بر روی ظرفیت ترمیم DNA این پروتئین مؤثر است به طوری که سلولهای بیانکننده نوع پرولیندار پروتئین P53 در مقایسه
با نوع آرژنیندار این پروتئین، به طور مؤثرتری چندین ژن هدف وابسته به P53 را که در امر ترمیم DNA نقش دارند، فعال مینمایند(36). هم چنین گزارش شده است که پلیمورفیسم کدون 72 ژن P53 میتواند بر روی بیان این ژن تاثیرگذار باشد زیرا جابهجایی نوکلئوتید در ناحیه transactivation ژن اتفاق میافتد(37). هم چنین کدون 72 ژن P53 در ناحیه هیدروفوبیک پروتئین واقع و دارای فعالیتهایی است که در امر مهار رشد سلولی ضروری میباشد(38).
در این مطالعه از طریق تجزیه و تحلیل 59 نمونه سرطانی AML و مقایسه آن با 59 نمونه خونی افراد سالم در شهر اصفهان، ارتباط معناداری بین پلیمورفیسم کدون 72 ژن P53 و AML مشاهده شد به طوری که افراد دارای ژنوتیپ آرژنین/آرژنین احتمال ابتلای آنها به AML بیش از سه برابر سایر افراد بود. این نتایج ممکن است مبین این مطلب باشد که موتاسیون بالای گزارش شده برای نوع آرژنیندار پروتئین ممکن است باعث ناپایداری پروتئین و فقدان فعالین مهارکنندگی آن شده و منجر به ایجاد بدخیمی میلوئید گردد. البته در این مطالعه موتاسیونهای ژن P53 بررسی نشده که لازم است در مطالعههای آتی مورد توجه قرار گیرد. به علاوه نوع آرژنیندار پروتئین نقش کمتری در فعالسازی ژنهای ترمیمکننده DNA نسبت به نوع پرولیندار، ایفاء مینماید(36). در مطالعههای مورد - شاهدی انجام گرفته در ایتالیا و چین نیز ارتباط معناداری بین پلیمورفیسم کدون 72 ژن P53 و خطر ابتلا به لوسمی مشاهده شده در حالی که چنین ارتباطی در کشور برزیل مشاهده نشد(22، 21، 19). در مطالعه انجام شده در هند نیز ارتباط معناداری بین ژنوتیپ آرژنین با ایجاد AML به دست آمد. به علاوه، نشان داده شد که پیشآگهی بیماران با ژنوتیپ پرولین ضعیفتر است(39).
به نظر میرسد که نوع آرژنیندار پروتئین، تمایل بیشتری برای داشتن موتاسیون داراست و بنابراین در شروع بیماری AML نقش دارد در حالی که نوع پرولیندار آن کارائی کمتری در القاء آپوپتوز داشته و بنابراین باعث پیشرفت بیماری و عدم پاسخدهی به داروهای شیمی درمانی میگردد.
فراوانیهای آللی در جمعیتهای گوناگون متفاوت گزارش شده است. بر طبق گزارشهای ارایه شده، جمعیت آمریکای لاتین، ایالات متحده و اروپا میزان بالایی از آلل آرژنین را نسبت به آلل پرولین بروز میدهند که در مقایسه با آن در جمعیتهای آفریقایی و آسیایی فراوانی آلل آرژنین کمتر است(43-40). بنابراین با وجود این یافتههای متفاوت، بررسی نقش پلیمورفیسم ژن P53 در ایجاد AML نیاز به مطالعههای گستردهتری دارد. در مطالعه حاضر عوامل زمینهساز بالقوه از قبیل کشیدن سیگار، عادات زندگی و ابتلا به ویروس HPVکنترل نشد. اینها موارد مهمی هستند که در مطالعههای آینده برای ارزیابی پلیمورفیسم P53 بایستی مورد بررسی قرار گیرند.
نتیجهگیری
یافتههای مطالعه حاضر مشخص میکند که پلیمورفیسم کدون 72 ژن P53 میتواند به عنوان یک فاکتور زمینهساز ژنتیکی برای ایجاد سرطان لوسمی میلوئید حاد در ایران محسوب شود. با این وجود مطالعههای بیشتر جهت روشن شدن نقش این پلیمورفیسم در ایجاد این سرطان لازم است.
تشکر و قدردانی
از معاونت پژوهشی دانشکده پزشکی به جهت تصویب این طرح پژوهشی و کلیه پرسنل محترم آزمایشگاه مرکزی دانشکده پزشکی تشکر و قدردانی به عمل میآید.
متن کامل: (3054 مشاهده)
پلیمورفیسم کدون 72 ژن P53 در بیماران مبتلا به لوسمی میلوئید حاد در ایران
مهدی نیکبخت دستجردی1
چکیده
سابقه و هدف
وجود یک پلیمورفیسم شایع در کدون شماره 72 ژن P53 ، با افزایش خطر ابتلا به سرطانهای ریه، پروستات، سینه و کولورکتال همراه است. در این مطالعه این پلیمورفیسم را در نمونههای لوسمی میلوئید حاد از بیمارستان الزهرای شهر اصفهان بررسی نمودیم.
مواد و روشها
در یک مطالعه مورد شاهدی، 59 نمونه خون مبتلایان به لوسمی میلوئید حاد و 59 نمونه سالم بررسی شدند. ژنوتیپهای کدون 73 ژن P53 توسط روش Allel specific PCR تعیین شد. برای مقایسه توزیع فراوانی سه ژنوتیپ مختلف کدون 72 در نمونههای سرطانی با توزیع فراوانی این سه ژنوتیپ در نمونههای شاهد از آزمون کایدو و نرمافزار 11SPSS استفاده شد.
یافتهها
محصول PCR برای آلل پرولین bp 177 و برای آلل آرژنین bp141 بود. توزیع ژنوتیپ پلیمورفیسمP53 برای ژنوتیپهای آرژنین/آرژنین، آرژنین/پرولین و پرولین/پرولین در گروه شاهد به ترتیب 9/11% ، 4/81% و 8/6% و در گروه نمونههای لوسمی میلوئید حاد به ترتیب 9/33%، 61% و 1/5% بود. اختلاف معناداری بین توزیع فراوانی ژنوتیپها در دو گروه مشاهده شد(04/0 p=).
نتیجه گیری
پلیمورفیسم کدون 72 ژن P53 ممکن است یک فاکتور زمینهساز ژنتیکی برای سرطان لوسمی میلوئید حاد در ایران محسوب شود.
کلمات کلیدی: ژنهای TP53 ، لوسمی حاد میلوئید، پلیمورفیسم(ژنتیک)، ایران
تاریخ دریافت : 2/2/93
تاریخ پذیرش : 2/7/93
1- مؤلف مسؤول: PhD آناتومی ـ دانشیار دانشکده پزشکی دانشگاه علوم پزشکی اصفهان ـ خیابان هزار جریب ـ اصفهان ـ ایران ـ کدپستی: 81744176
مهدی نیکبخت دستجردی1
چکیده
سابقه و هدف
وجود یک پلیمورفیسم شایع در کدون شماره 72 ژن P53 ، با افزایش خطر ابتلا به سرطانهای ریه، پروستات، سینه و کولورکتال همراه است. در این مطالعه این پلیمورفیسم را در نمونههای لوسمی میلوئید حاد از بیمارستان الزهرای شهر اصفهان بررسی نمودیم.
مواد و روشها
در یک مطالعه مورد شاهدی، 59 نمونه خون مبتلایان به لوسمی میلوئید حاد و 59 نمونه سالم بررسی شدند. ژنوتیپهای کدون 73 ژن P53 توسط روش Allel specific PCR تعیین شد. برای مقایسه توزیع فراوانی سه ژنوتیپ مختلف کدون 72 در نمونههای سرطانی با توزیع فراوانی این سه ژنوتیپ در نمونههای شاهد از آزمون کایدو و نرمافزار 11SPSS استفاده شد.
یافتهها
محصول PCR برای آلل پرولین bp 177 و برای آلل آرژنین bp141 بود. توزیع ژنوتیپ پلیمورفیسمP53 برای ژنوتیپهای آرژنین/آرژنین، آرژنین/پرولین و پرولین/پرولین در گروه شاهد به ترتیب 9/11% ، 4/81% و 8/6% و در گروه نمونههای لوسمی میلوئید حاد به ترتیب 9/33%، 61% و 1/5% بود. اختلاف معناداری بین توزیع فراوانی ژنوتیپها در دو گروه مشاهده شد(04/0 p=).
نتیجه گیری
پلیمورفیسم کدون 72 ژن P53 ممکن است یک فاکتور زمینهساز ژنتیکی برای سرطان لوسمی میلوئید حاد در ایران محسوب شود.
کلمات کلیدی: ژنهای TP53 ، لوسمی حاد میلوئید، پلیمورفیسم(ژنتیک)، ایران
تاریخ دریافت : 2/2/93
تاریخ پذیرش : 2/7/93
1- مؤلف مسؤول: PhD آناتومی ـ دانشیار دانشکده پزشکی دانشگاه علوم پزشکی اصفهان ـ خیابان هزار جریب ـ اصفهان ـ ایران ـ کدپستی: 81744176
مقدمه
سرطان بعد از بیماریهای قلبی ـ عروقی، دومین علت اصلی مرگ و میر در جهان میباشد(1). سرطانهای هماتولوژیک از دو رده اصلی سلولهای خونی منشاء میگیرند که شامل رده سلولی میلوئید و لنفوئید میباشد. بر اساس طبقهبندی WHO ، اصطلاح میلوئید شامل تمامی سلولهای متعلق به ردههای گرانولوسیتی(شامل نوتروفیل، ائوزینوفیل و بازوفیل) منوسیت، ماکروفاژ، اریتروئید، مگاکاریوسیت و ماست سل میباشد. طبقهبندی WHO برای سرطانهای میلوئید، به منظور تشخیص اولیه نمونههای خون محیطی یا مغز استخوان که مشکوک به سرطانهای میلوئید هستند، پیش از شروع درمان ،کاربرد دارد. درصد سلولی با فنوتیپ بلاست، معیاری برای طبقهبندی سرطانهای میلوئید و قضاوت در مورد سرعت رشد آنها محسوب میشود. از نطر WHO وجود حداقل 20% سلولهای بلاست در خون محیطی یا مغز استخوان به عنوان لوسمی میلوئید حاد(AML) در نظر گرفته میشود. با این وجود در برخی از ناهنجاریهای ژنتیکی، تشخیص AML ممکن است بدون توجه به شمارش بلاستهای خون محیطی یا مغز استخوان انجام پذیرد(2).
شیوع سرطانهای هماتولوژیک در کشورهای غربی رو به فزونی است. این نوع بدخیمیها با توجه به ویژگیهای بالینی و تغییرات ژنتیکی اکتسابی در آنها، بیماریهای ناهمگونی محسوب میشوند. به نظر میرسد عوامل متعددی از قبیل جهشهای ژنی، تابش اشعه یونیزان و عوامل شیمیائی مثل بنزن در بروز این سرطانها نقش ایفا مینمایند. این عوامل تاثیر کارسینوژنیک خود را با آسیب رساندن به DNA پروژنیتورهای خونی اعمال نموده و در نهایت منجر به بدخیمی میگردند. با این وجود در اغلب موارد وجود تفاوتهای ژنتیکی میتواند عاملی برای خطر بالای ابتلا به سرطان باشد(3).
ژن P53 به عنوان مهمترین ژن مهارکننده تومور، بر روی بازوی کوتاه کروموزوم 17 قرار دارد(13P17) و از 11 اگزون و10 اینترون تشکیل شده است که حاوی 20 کیلو باز میباشد. این ژن پروتئین P53 را کد میکند که یک فسفوپروتئین هستهای است و از 393 اسید آمینــه تشکیـل
تشکیل شده است(5، 4). ژن P53 یکی از مهمترین تنظیمکنندههای مهاری در رشد سلولهای طبیعی و تقسیم سلولی میباشد. زمانی که DNA آسیب میبیند ، ژن P53 از طریق اتصال به DNA ، تحریک و بیان ژنهای زیر دست (down stream) که نقش مهاری بر رشد و یا تهاجم سلولی دارند را باعث میشود(6). یکی دیگر از اعمال ژن P53 در پاسخ به استرسهایی که وارد سلول میشود، تنظیم چرخه سلولی و القاء آپوپتوزیس است که با فعال کردن مکانیسمهای بیوشیمیایی، نهایتاً مرگ فیزیولوژیک سلول را به دنبال دارد. اثرات سودمند شیمی درمانی در درمان سرطانها غالباً از طریق القاء آپوپتوزیس و یا اختلال در روند متابولیک چرخه سلولی میباشد. بنابراین تومورهایی که آپوپتوزیس را نشان میدهند، نسبت به شیمی درمانی حساسترند و پیشآگهی بهتری دارند(7).
اخیراً مطالب زیادی در مورد ارتباط بیماریهای خاص از جمله سرطان با پلیمورفیسم تک نوکلئوتیدی( SNP = Single Nucleotid Polymorphism) بیان شده است و وجود تفاوتهای فردی برای مستعد شدن در برابر نئوپلاسمهای خاص را توضیح میدهد. اهمیت ارتباط SNPs با خطر افزایش ابتلا به سرطانهای مختلف در گروههای نژادی متفاوت گزارش شده است(8). مشخص شده که کدون 72 اگزون شماره 4 ژن P53 دارای پلیمورفیسم تک نوکلئوتیدی شایعی است که در نتیجه آن ممکن است دو آلل ایجاد شود، یکی آرژانتین با توالی CGC و دیگری پرولین با توالی CCC . با توجه به امکان وجود این دو آلل، سه ژنوتیپ مختلف ممکن است ایجاد شود که عبارتند از آرژنین/آرژنین، پرولین/آرژنین و پرولین/ پرولین(6). این دو آلل از لحاظ ساختمانی و عملکرد با هم متفاوت هستند و قابلیتهای متفاوتی برای ظهور سرطان دارند(9). گزارشهای متعددی نشان میدهد که میزان بروز سرطانهای مختلف از جمله سرطانهای سینه، ریه، پروستات، کولورکتال، پوست، لوسمی و سایر بیماریها مثل اندومتریوز با درصد فراوانی این سه ژنوتیپ ارتباط دارد(23-8). تنوع در آللهای کدکننده اسیدهای آمینه آرژنین و پرولین باعث ایجاد تغییر در ساختمان پروتئین P53 و به دنبال آن تغییر در عملکرد این پروتئین میگردد(17). تحقیقات اخیر بیان میکنند که پلیمورفیسم کدون 72 روی فانکشن ژن P53تاثیر دارد و نشان میدهد که پروتئین دارای پرولین، توانایی بیشتری در القاء توقف چرخه سلولی و بر عکس قدرت کمتری برای القای آپوپتوز نسبت به پروتئین دارای آرژنین دارد. بر همین اساس پاسخدهی این ژنوتیپها به داروهای شیمی درمانی متفاوت گزارش شده است(7).
با توجه به این که این پلیمورفیسم وابسته به موقعیت جغرافیایی و نژادی است و فراوانی برخی از سرطانهای انسانی از جمله سرطان خون با آن مرتبط است، پاسخدهی این ژنوتیپ به داروهای شیمی درمانی متفاوت گزارش شده است. هدف از این مطالعه بررسی این پلیمورفیسم در نمونههای لوسمی میلوئید حاد و مقایسه آن با نمونههای سالم در شهر اصفهان بود.
مواد و روشها
جمعآوری نمونهها:
در یک مطالعه مورد ـ شاهدی، نمونههای سرطانی بالغ بر100 نمونه بلوک پارافینی به عنوان مورد و نمونههای خونی از خون افراد فاقد سرطان از بیمارستان الزهرا به عنوان گروه شاهد جمعآوری شد. قبل از نمونهگیری، از کلیه افراد فاقد سرطان جهت گرفتن خون رضایتنامه کتبی اخذ شد. نمونههای خونی از افرادی گرفته شد که از نظر سن و جنس با نمونههای سرطانی match شده بودند.
از بین نمونههای سرطانی مربوط به سالهای قبل که به صورت بلوکهای پارافینی در آرشیو پاتولوژی بیمارستان موجود بودند، پس از ثبت اطلاعات دموگرافیک و تایید تشخیص پاتولوژی، 59 نمونه که از کیفیت بهتری برخوردار بودند، برای انجام مراحل بعدی مورد استفاده قرار گرفتند.
استخراج DNA :
الف- بلوکهای پارافینی:
بعد از تایید تشخیص پاتولوژی، سه تا پنج قطعه از برشهای بلوک پارافینی مربوط به هریک از نمونههای AML به ضخامت 10 تا 15 میکرومتر در میکروتیوپ 5/1 میلیلیتری جمعآوری شدند. به منظور پارافینزدایی، به هر یک از تیوبها 500 میکرولیتر گزیلن اضافه شد و در بن ماری به مدت 2 ساعت در درجه حرارت 55 درجه سانتیگراد قرار داده شد.
سپس سانتریفوژ در Xg 18000 به مدت 5 دقیقه انجام شده و مجدداً با اضافه نمودن 500 میکرولیتر گزیلن، مرحله پارافینزدایی تکرار گردید. پس از پارافینزدایی، آبدهی نمونهها توسط الکلهای نزولی انجام گرفت. در مرحله بعد با استفاده از(رُوش ـ آلمان) high pure PCR template preparation kit ، DNA از بافتها استخراج گردید. DNA استخراج شده در تیوبهای 5/1 میلیلیتری جمعآوری شد و به یخچال در دمای 20- درجه سانتیگراد منتقل گردید.
ب- نمونههای خونی:
بعد از matching افراد سالم از نظر سن و جنس با نمونههای سرطانی، حدود 1 میلیلیتر از خون محیطی آنها جمع آوری شد و 200 میکرولیتر از آن جهت استخراج DNA با استفاده از high pure PCR template preparation kit (رُوش، آلمان)، به کار رفت.
تعیین غلظت DNA :
در این مرحله غلظت DNAاستخراج شده توسط دستگاه اسپکتروفتومتر یا از طریق load 5 میکرولیتر از محلول DNA استخراج شده بر روی ژل آگاروز 5% تعیین گردید.
تکثیر توالی پلیمورفیک کدون 72 ژن P53 توسط PCR :
PCR از طریق استفاده از 300-100 نانوگرم DNA ، 1 واحد تک پلیمراز ، 5/1 میلیمول MgCl2 و 200 میکرومول از هر یک از dATP ، dCTP ، dTTP، dGTP و 2 میکرومول از هر یک از زوج آغازگرهای اختصاصی برای تکثیر پرولین و آرژنین در حجم نهایی 25 میکرولیتر انجام گرفت(24).
توالی آغازگرهای اختصاصی برای تکثیر پرولین عبارتند از:
F: GCCAGAGGCTGCTCCCCC
R: CGTGCAAGTCACAGACTT
توالی آغازگرهای اختصاصی برای تکثیر آرژنین عبارتند از:
F: TCCCCCTTGCCGTCCCAA
R: CTGGTGCAGGGGCCACGC
تنظیم دستگاه ترموسایکلر برای تکثیر توالی پلیمورفیک کدون 72 ژن P53 به ترتیب زیر انجام گرفت:
مرحله اول: دناتوراسیون ابتدایی با دمای 94 درجه سانتیگراد به مدت 3 دقیقه
مرحله دوم: که 35 سیکل و شامل سه بخش زیر بود:
الف- دناتوراسیون با دمای 94 درجه سانتیگراد به مدت 30 ثانیه
ب- آنیلینگ با دمای 54 درجه سانتیگراد به مدت 30 ثانیه برای تکثیر پرولین و با دمای 60 درجه سانتیگراد برای تکثیر آرژنین
ج- اکستنشن با دمای 72 درجه سانتیگراد به مدت 30 ثانیه
مرحله سوم: اکستنشن نهایی با دمای 72 درجه سانتیگراد به مدت 5 دقیقه
بعد از اتمام کار محصول PCR تا زمان الکتروفورز در یخچال نگهداری شد.
ژل الکتروفورز :
حدود 5 میکرولیتر از محصول واکنش همراه با 1 میکرولیتر loading dye در ژل آگاروز 2% در بافر TBE * 5/0 الکتروفورز شده و روی یک UV Transluminator مشاهده شد.
تجزیه و تحلیل دادهها:
اطلاعات به دست آمده از طریق نرمافزار 11 SPSS ، مورد تجزیه و تحلیل آماری قرار گرفت. برای مقایسه توزیع فراوانی سه ژنوتیپ مختلف کدون 72 در نمونههای سرطانی با توزیع فراوانی این سه ژنوتیپ در نمونههای شاهد از کایدو استفاده شد. p-value کوچکتر از 05/0 معنادار تلقی گردید.
یافتهها
نتایج دموگرافیک:
برای انجام این مطالعه 59 نمونه سرطانی و 59 نمونه خونی افراد سالم جمعآوری شد(جدول 1).
جدول 1: نتایج دموگرافیک 59 نمونه AML
| نمونههای AML | |
| جنس | تعداد (درصد) |
| مرد | 38 (64) |
| زن | 21 (36) |
| میانگین سنی(دامنه) | 37 (75-3) |
نتایج استخراج DNA از نمونهها:
DNA استخراج شده از نمونههای سرطانی و نمونه خونی افراد سالم دارای غلظت و کیفیت مناسب بوده و به طور موفقیتآمیزی توسط
نتایج Allele specific PCR :
محصول PCR برای آلل پرولین bp177 و برای آلل آرژنین bp 141بود(شکلهای 1 و 2). در نمونههای با ژنوتیپ آرژنین/آرژنین فقط با آغازگرهای اختصاصی برای تکثیر آرژنین، باندی با اندازه bp141 و در نمونههای با ژنوتیپ پرولین/پرولین فقط با آغازگرهای اختصاصی برای تکثیر پرولین، باندی با اندازه bp 177 ایجاد شد. در حالی که در نمونههای با ژنوتیپ آرژنین/پرولین با هر دو دسته این آغازگرها باند تشکیل گردید. توزیع فراوانی سه ژنوتیپ مختلف کدون 72 ژن P53 در 59 نمونه سرطانی و 59 نمونه خونی افراد فاقد سرطان در جدول 2 ارایه شده است. اختلاف بین توزیع فراوانی ژنوتیپ آرژنین/آرژنین کدون 72 ژن P53 در نمونههای سرطانی با نمونههای خونی افراد فاقد سرطان معنادار بــود به طوری که احتمال ابتلای افراد دارای ژنوتیپ آرژنین/ آرژنین، به AML ، بیش از سه برابر سایر افراد بود(04/0 p=).
جدول 2: توزیع فراوانی سه ژنوتیپ مختلف کدون 72 در 49 نمونه سرطانی و 49 نمونه خونی افراد فاقد سرطان به عنوان گروه شاهد. اختلاف بین توزیع فراوانی ژنوتیپ آرژنین/آرژنین کدون 72 ژن P53 در نمونههای سرطانی با نمونههای خونی افراد فاقد سرطان معنادار میباشد(04/0 p=). احتمال ابتلای افراد دارای ژنوتیپ آرژنین/آرژنین، با فاصله اطمینان 95% به AML ، بیش از سه برابر سایر افراد بود(81/3 OR=).
| ژنوتیپ | گروه بیماران سرطانی | گروه شاهد | OR (95% CI) |
p-value |
| تعداد(درصد) | تعداد(درصد) | |||
| آرژنین/آرژنین | 20 (9/33) | 7 (9/11) | 81/3 (90/9-64/1) |
04/0 |
| آرژنین/پرولین | 36 (61) | 48 (4/81) | ||
| پرولین/پرولین | 9 (1/5) | 4 (8/6) |
CI: Confidence Interval

شکل 1: نمونههای با ژنوتیپ پرولین/پرولین فقط با آغازگرهای اختصاصی برای تکثیر پرولین، باندی با اندازه bp 177 ایجاد نمودهاند. نمونههای شماره 1 و 6-3 دارای باند؛ نمونه شماره 2 فاقد باند؛ شماره: 7 کنترل منفی؛ شماره 8 : مارکر 50 تایی

شکل 2: نمونههای با ژنوتیپ آرژنین/آرژنین فقط با آغازگرهای اختصاصی برای تکثیر آرژنین باندی با اندازه bp 141 تشکیل دادهاند. نمونههای شماره 3-1 دارای باند؛ نمونه های شماره 6- 4 فاقد باند; شماره: 7 کنترل منفی و شماره 8: مارکر 50 تایی.
بحث
مشخص شده است که پلیمورفیسم کدون 72 ژن P53 به عنوان یک فاکتور خطر در برخی از انواع سرطانهای انسانی نقش ایفا میکند. استوری و همکارانش نشان دادند که در سرطان گردن رحم مرتبط با HPV (Human papilloma-virus)، بیان بیش از اندازه پروتئین هموزیگوت آرژنین P53 وجود دارد و مشخص نمودند که افراد هموزیگوت آرژنین P53 ، هفت برابر از سایر ژنوتیپها، برای ابتلا به سرطان گردن رحم مرتبط با HPV، مستعدتر میباشند(25). این یافته توسط دو مطالعه دیگر نیز تایید شده است، هر چند که توسط برخی از محققین رد شده است(30-26). تنوع بین آزمایشگاهها در تعیین توالی P53 ممکن است مسؤول اختلاف در یافتهها باشد(31). در مطالعههای دیگر احتمال ابتلا به سرطانهای مثانه و کاردیا در ژنوتیپ هموزیگوت آرژنینP53 بیش از سایر ژنوتیپها گزارش شده است(33، 32).
از طرف دیگر نشان داده شده است افرادی که دارای ژنوتیپ هموزیگوت پرولین P53هستند، احتمال بیشتری برای ابتلا به سرطان پستان، ریه و پروستات دارند(34، 14، 12).
گزارش شده است که فراوانی موتاسیون در ژن P53 دارای آلل آرژنین بیش از ژن P53 دارای آلل پرولین است. از طرف دیگر نوع پرولیندار باعث القاء توقف چرخه سلولی در مرحله G1 میشود(35). مطالعههای دیگر نشان داده است پلیمورفیسم کدون 72 ژن P53بر روی ظرفیت ترمیم DNA این پروتئین مؤثر است به طوری که سلولهای بیانکننده نوع پرولیندار پروتئین P53 در مقایسه
با نوع آرژنیندار این پروتئین، به طور مؤثرتری چندین ژن هدف وابسته به P53 را که در امر ترمیم DNA نقش دارند، فعال مینمایند(36). هم چنین گزارش شده است که پلیمورفیسم کدون 72 ژن P53 میتواند بر روی بیان این ژن تاثیرگذار باشد زیرا جابهجایی نوکلئوتید در ناحیه transactivation ژن اتفاق میافتد(37). هم چنین کدون 72 ژن P53 در ناحیه هیدروفوبیک پروتئین واقع و دارای فعالیتهایی است که در امر مهار رشد سلولی ضروری میباشد(38).
در این مطالعه از طریق تجزیه و تحلیل 59 نمونه سرطانی AML و مقایسه آن با 59 نمونه خونی افراد سالم در شهر اصفهان، ارتباط معناداری بین پلیمورفیسم کدون 72 ژن P53 و AML مشاهده شد به طوری که افراد دارای ژنوتیپ آرژنین/آرژنین احتمال ابتلای آنها به AML بیش از سه برابر سایر افراد بود. این نتایج ممکن است مبین این مطلب باشد که موتاسیون بالای گزارش شده برای نوع آرژنیندار پروتئین ممکن است باعث ناپایداری پروتئین و فقدان فعالین مهارکنندگی آن شده و منجر به ایجاد بدخیمی میلوئید گردد. البته در این مطالعه موتاسیونهای ژن P53 بررسی نشده که لازم است در مطالعههای آتی مورد توجه قرار گیرد. به علاوه نوع آرژنیندار پروتئین نقش کمتری در فعالسازی ژنهای ترمیمکننده DNA نسبت به نوع پرولیندار، ایفاء مینماید(36). در مطالعههای مورد - شاهدی انجام گرفته در ایتالیا و چین نیز ارتباط معناداری بین پلیمورفیسم کدون 72 ژن P53 و خطر ابتلا به لوسمی مشاهده شده در حالی که چنین ارتباطی در کشور برزیل مشاهده نشد(22، 21، 19). در مطالعه انجام شده در هند نیز ارتباط معناداری بین ژنوتیپ آرژنین با ایجاد AML به دست آمد. به علاوه، نشان داده شد که پیشآگهی بیماران با ژنوتیپ پرولین ضعیفتر است(39).
به نظر میرسد که نوع آرژنیندار پروتئین، تمایل بیشتری برای داشتن موتاسیون داراست و بنابراین در شروع بیماری AML نقش دارد در حالی که نوع پرولیندار آن کارائی کمتری در القاء آپوپتوز داشته و بنابراین باعث پیشرفت بیماری و عدم پاسخدهی به داروهای شیمی درمانی میگردد.
فراوانیهای آللی در جمعیتهای گوناگون متفاوت گزارش شده است. بر طبق گزارشهای ارایه شده، جمعیت آمریکای لاتین، ایالات متحده و اروپا میزان بالایی از آلل آرژنین را نسبت به آلل پرولین بروز میدهند که در مقایسه با آن در جمعیتهای آفریقایی و آسیایی فراوانی آلل آرژنین کمتر است(43-40). بنابراین با وجود این یافتههای متفاوت، بررسی نقش پلیمورفیسم ژن P53 در ایجاد AML نیاز به مطالعههای گستردهتری دارد. در مطالعه حاضر عوامل زمینهساز بالقوه از قبیل کشیدن سیگار، عادات زندگی و ابتلا به ویروس HPVکنترل نشد. اینها موارد مهمی هستند که در مطالعههای آینده برای ارزیابی پلیمورفیسم P53 بایستی مورد بررسی قرار گیرند.
نتیجهگیری
یافتههای مطالعه حاضر مشخص میکند که پلیمورفیسم کدون 72 ژن P53 میتواند به عنوان یک فاکتور زمینهساز ژنتیکی برای ایجاد سرطان لوسمی میلوئید حاد در ایران محسوب شود. با این وجود مطالعههای بیشتر جهت روشن شدن نقش این پلیمورفیسم در ایجاد این سرطان لازم است.
تشکر و قدردانی
از معاونت پژوهشی دانشکده پزشکی به جهت تصویب این طرح پژوهشی و کلیه پرسنل محترم آزمایشگاه مرکزی دانشکده پزشکی تشکر و قدردانی به عمل میآید.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و انكولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





