جلد 10، شماره 4 - ( زمستان 1392 )
جلد 10 شماره 4 صفحات 346-335 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Bashash D, Ghaffari S, Kazerani M, Hazaveh K, Alimoghaddam K, Ghavamzadeh A. Time-Dependent Inhibitory Effect of Non-Nucleosidic Telomerase Inhibitor on NB4 Cell Proliferation through Transcriptional Suppression of Catalytic Subunit . bloodj 2014; 10 (4) :335-346
URL: http://bloodjournal.ir/article-1-825-fa.html
URL: http://bloodjournal.ir/article-1-825-fa.html
بشاش داود، غفاری سید حمیداله، کازرانی مریم، هزاوه کبریا، علی مقدم کامران، قوام زاده اردشیر. مهار تکثیر سلولهای NB4 به طور وابسته به زمان تحت تاثیر مهارکننده غیر نوکلئوتیدی تلومراز از طریق کاهش رونویسی زیر واحد کاتالیتیک. فصلنامه پژوهشی خون. 1392; 10 (4) :335-346
دانشیار مرکز تحقیقات خـون، انکولوژی و پیونـد سلولهای بنیادی بیمارستان شریعتی و دانشکده پزشکی دانشگاه علوم پزشکی تهران
متن کامل [PDF 680 kb]
(2304 دریافت)
| چکیده (HTML) (11183 مشاهده)
مقدمه
لوسمی پرومیلوسیتیک حاد(APL)، یکی از زیر گروههایAML (AML-M3) میباشد. APL معمولاً در سنین 50-40 سالگی رخ داده و حدود 15%-10% انواع AML را به خود اختصاص میدهد(1). این بیماری در اثر نقص در بلوغ گلبولهای سفید در رده میلوئیدی به وجود میآید که طی آن روند بلوغ در سلولهای رده گرانولوسیتی در مرحله پرومیلوسیت متوقف میشود. تقریباً ۹5% از بیماران مبتلا به APL دارای جابهجایی بین کروموزوم ۱۵ و۱۷ هستند](22 : 12)q(15:17) [tکه منجر به الحاق ژن RARα (ژن کدکننده گیرنده رتینوئیک اسید) با ژن PML میگردد(2). به دلیل انعقاد داخل عروقی منتشر (DIC) که ظاهراً ناشی از آزاد شدن مواد پیش انعقادی از گرانولهای سلولهای لوسمیک است، مشکلات خونریزی در این بیماری شایع بوده و از جمله علل اصلی مرگ و میر این بیماران محسوب میشود(3). در سال 1985 معرفی ATRA که مشتقی از ویتامین A است، افقی جدید در تاریخچه درمان APL گشود و از میزان مرگ و میر بیماری به طور قابل توجهی کاست. با این حال و علیرغم اثر بخشی این دارو در درمان APL، درصدی از بیماران دچار عود شده و در نهایت به مرگ بیمار منجر میشود(4).
علیرغم این حقیقت که ماهیت بالینی سرطان بسیار متنوع است، اما اکثر تومورها در تعداد محدودی از ویژگیها هم چون توانایی تکثیر نامحدود، رشد غیر قابل کنترل، تهاجم به بافتها و انتشار متاستاتیک مشترک میباشند(5). مطالعههای انجام شده طی دو دهه گذشته نشان داده است که کسب توانایی تکثیر نامحدود که با حفظ طول تلومر مرتبط است، مهمترین مرحله در ایجاد سرطان میباشد(6). هم چنین مشخص شده است که مهمترین مکانیسم برای غلبه بر محدودیت تکثیر ناشی از کوتاه شدن طول تلومر، فعال شدن آنزیمی به نام تلومراز است که افزایش فعالیت آن در بیش از 85% بدخیمیهای انسان گزارش شده است(7). تلومراز آنزیمی است که از یک جزء RNA به نام hTERCو یک جزء کاتالیتیک تحت عنوان hTERT تشکیل شده است(8). مشخص شده است که فعالیت تلومراز طی روند بلوغ و تکامل عمدتاً از طریـق
رونویسی ژن hTERT تنظیم میشود(9). از آنجایی که اکثر سلولهای سوماتیک hTERT را بیان نمیکنند، فاقد فعالیت تلومراز میباشند؛ از سوی دیگر، اکثریت سلولهای سرطانی hTERT را بیان کرده و تلومراز مثبت میباشند(9). با توجه به این امر، تلومراز و به ویژه hTERT ، به عنوان اهداف درمانی بسیار امیدوارکننده جهت درمان سرطانها معرفی شده و اخیراً مهارکنندگان تلومراز به عنوان راهکارهای درمانـی جدیـد، مورد توجه شایان قرار گرفتهاند. در میان این دسته از داروها، BIBR1532 که یک مهارکننده غیرنوکلئوزیدی - غیرپپتیدی است، افق بسیار روشنی در درمان سرطانها گشوده است(10).
این دارو به طور اختصاصی موجب مهار آنزیم تلومراز میشود و بر روی آنزیمهای DNA پلیمراز، RNA پلیمراز و هم چنین سایر اعضـای آنزیمهـای تـرانس کریپتاز معکوس بیتاثیر است. این ترکیب، یک مهارکننده غیر رقابتی آنزیم تلومراز محسوب میشود؛ به این ترتیب که محل اتصال دارو متمایز از محل داکسی ریبو نوکلئوتیدها و آغازگر است(11). در واقع BIBR1532 به محل کاتالیتیک آنزیم متصل نمیشود و همین امر آن را از سایر مهارکنندهها از جمله ترکیبات نوکلئوزیدیک و یا الیگونوکلئوتیدی متمایز میسازد(12).
تاکنون بررسیهای گوناگونی در مورد تاثیر این ترکیب بر روی سلولهای سرطانی مختلف صورت گرفته و نشان داده شده است که BIBR1532 موجب مهار تکثیر سلولهای سرطانی ریه، سینه، فیبروسارکوما و پروستات میشود(10).
این دارو دارای اثرات وابسته به دوز بوده و سرعت و اثر آن به طول اولیه تلومر در سلول سرطانی بستگی دارد. با توجه به آن که تقریباً 90% بیماران مبتلا بهAPL دارای تلومرهایی با طول کوتاه و فعالیت تلومراز بالا می باشند، لذا به نظر میرسد این بیماران کاندید مناسب برای درمان با مهارکنندگان تلومراز باشند(13). به این منظور و برای بررسی کارآیی استفاده از استراتژی آنتیتلومراز در بیماری APL، سلولهای رده NB4 با غلظتهای متفاوت از داروی BIBR1532 تیمار شدند و نتایـج آن مورد بررسی قرار گرفت.
مواد و روشها
کشت سلولی:
در یک مطالعه تجربی، سلولهای NB4 (رده سلولی انسانی APL) به صورت سوسپانسیون در محیط کشت RPMI 1640 حاوی mM 2 از L -گلوتامین ، 10% FBS ، پنیسیلین به میزان unit/mL 100 و استرپتومایسین به میزان µg/mL 100 در دمای 37 درجه سانتیگراد و فشار 5% از CO2 کشت داده شدند. سلولهای NB4 از بانک سلولی انستیتو پاستور تهیه شد و برای بررسی حضور (17; 15)t با روش استاندارد کاریوتایپینگ انجام شد. هم چنین این رده سلولی برای حضور mRNA ژن ترکیبی αPML/RAR نیز مورد مطالعه قرار گرفت.
تیمار دارویی با BIBR1532 :
برای تیمار دارویی سلولها، از داروی BIBR1532 (آمریکا، بیوساینس) که به صورت پودر میباشد، استفاده شد. محلول ذخیره BIBR1532 در غلظت mM 1 و به واسطه حل کردن این دارو در DMSO استریل 1/0% تهیه شد. محلول ذخیره BIBR1532 را در میکروتیوبها تقسیم کرده و آنها را در دمای 20- درجه سانتیگراد تا زمان مصرف نگهداری کردیم. به منظور تعیین اثرات بهینه دارو، ٢ متغیر دوز و زمان در این تحقیق در نظر گرفته شد. سلولهای سرطانی، با غلظتهای 10، 30، 60 و 90 میکرومولار از داروی BIBR1532 تیمار شدند و به ترتیب پس از زمانهای ٢4، 4٨ و٧٢ ساعت مورد مطالعه قرار گرفتند. در ضمن به منظور افزایش بهرهوری کار و بررسی مقایسهای، تمامی آزمایشها برای هر دوز و زمان به صورت داپلیکیت انجام شد.
تعیین درصد زنده بودن و بررسی منحنی رشد لگاریتمی سلولها:

برای بررسی اثر مهاری داروی BIBR1532 بر روی شاخص زنده مانی و منحنی رشد لگاریتمی سلولها، سلولهای NB4 به تعداد 105 * 1 سلول در هر mL در حضور یا عدم حضور داروی BIBR1532 انکوبه شده و به مدت 10روز نگهداری شدند. سلولها هر سه روز یک بار پاساژ داده شده و مجدداً تیمار میشدند. به طور پیوسته، هر 24 ساعت شاخص زندهمانی سلولها با استفاده از رنگآمیزی تریپانبلو بررسی شد. برای انجام آزمایش، در شرایط استریل میزان 30 میکرولیتر از سوسپانسیون سلولی را برداشته و داخل یک میکروتیوب ریختیم. سپس هم حجم آن تریپانبلو اضافه کرده و پس از گذشت چند دقیقه یک قطره از آن را برداشته و با استفاده از لام نئوبار و در خانههای مربوط به شمارش گلبول سفید شمارش انجام شد(ضریب رقت 2 میباشد). در ادامه، با شمارش سلولهای مرده و با استفاده از فرمول زیر درصد زنده بودن سلولها تعیین گردید.

بررسی میزان ساخت DNA و درصد تکثیر سلولی:
اثر مهاری BIBR1532 بر روی تکثیر سلولهای NB4 از طریق تعیین میزان مشارکت برمو داکسی یوریدین در DNA سلولهای NB4 با استفاده از BrdU-based cell proliferation ELISA kit طبق دستورالعمل کیت اندازهگیری شد. به طور خلاصه، سلولها به تعداد 5000 در هر چاهک درون پلیت 96 تایی در حضور یا عدم حضور داروی BIBR1532 کشت داده شدند. 12 ساعت مانده به انتهای زمان انکوباسیون، 10 میکرولیتر محلول BrdU که در کیت موجود میباشد، به سلولها افزوده شد. در ادامه و با استفاده از محلول FixDenat ، سلولها فیکس شده و DNA آنها دناتوره گردید. سلولها با آنتیبادی علیه BrdU که با آنزیم پراکسیداز کنژوگه میباشد، به مدت 1 ساعت در دمای اتاق انکوبه شده و در انتهای این زمان، 100 میکرولیتر سوبسترای TMB افزوده گردید. پس از گذشت 30 دقیقه در دمای اتاق و آن هم به منظور پایان دادن به عملکرد آنزیم پراکسیداز، از محلول اسید سولفوریک 1 مولار استفاده شد. در انتها، میزان رنگ ایجاد شده در هر چاهک با استفاده از دستگاه الایزا ریدر در طول موج nm450 خوانده شد. برای محاسبه اثر مهاری داروی BIBR1532 بر روی تکثیر سلولهای NB4 و بررسی میزان کاهش ساخت DNA سلولهای تیمار شده، از فـرمول زیـر استفاده شد:

در این فرمول، OD exp و OD cont به ترتیب بیانگر جذب نوری سلولهای تیمار شده و سلولهای تیمار نشده (کنترل) میباشد.
اندازهگیری فعالیت متابولیک سلولی:
در این مطالعه به منظور بررسی تاثیر سایتوتوکسیک دارو بر توان متابولیک سلول، از روش MTT استفاده شد. پس از تیمار سلولی، 100 میکرولیتر سوسپانسیون حاوی 103 * 5 سلول به چاهکهای پلیت 96 خانهای اضافه گشت(هر سری به صورت سه تایی انجام شد). چاهکی که فقط حاوی محیط کشت فاقد سلول بود، به عنوان بلانک دستگاه الایزا ریدر و چاهکهای شامل محیط کشت و سلول(بدون افزودن دارو) به عنوان کنترل زنده سلول به کار رفت. پلیت مورد آزمایش در دمای 37 درجه سانتیگراد و فشار 5% از CO2 قرار گرفت. بعد از اتمام زمان انکوباسیون، به هر چاهک 100 میکرولیتر محلول MTT افزوده شده و پس از شیک به مدت 5 دقیقه، پلیت به مدت 3 ساعت دیگر انکوبه شد.
سپس پلیت را با دورg 350 به مدت 10 دقیقه سانتریفوژ نمودیم، پس از سانتریفوژ مایع رویی را دور ریخته و به رسوب ته پلیت 100 میکرولیتر DMSO اضافه کردیم. پس از مخلوط نمودن به مدت 5 دقیقه، پلیت را در دمای 37 درجه سانتیگراد به مدت 5 دقیقه انکوبه نمودیم. سپس پلیت را جهت قرائت در دستگاه الایزا ریدر قرار داده و جذب نوری چاهکها را در طول موج 570 نانومتر خواندیم.
استخراج RNA و ساخت cDNA :
برای استخراج RNA از سلولهای مورد مطالعه، از کیت High Pure RNA Isolation(رُوش) طبق دستورالعمل استفاده شد. پس از تیمار سلولهای NB4 با داروی BIBR1532 و متعاقب گذشت زمانهای 24، 48 و 72 ساعت، RNA سلولها استخراج شده و کمیت آنها با روش اسپکتروفتومتری با استفاده از دستگاه نانو دراپ ND-1000 اندازهگیری شد. برای انجام واکنش رونویسی معکوس از (Takara BIO) Revert Aid First Strand cDNA Synthesis Kit استفاده شد.
حجم مورد نظر برای انجام این واکنش 20 میکرولیتر بود و محتویات آن شامل µL4 بافر PCR 5X ، µL2 از DNTP ، µL1 راندم هگزامر، µL1 آب تیمار شـده با DEPC ، µL1 مهار کننده RNase (U/µL 20)، µL 1 ترانس کریپتاز معکوس M-MULV ( U/µL200) وµg 1 از RNA مورد آزمایش به ازاء هر واکنش میباشد. محتوی مذکور به مدت 5 دقیقه در دمای 65 درجه سانتیگراد، 5 دقیقه در دمای 25 درجه سانتیگراد و 1 ساعت در دمای 42 درجه سانتیگراد انکوبه شدند و در نهایت، واکنش ساخت cDNA به واسطه انکوباسیون 5 دقیقهای در دمای 70 درجه پایان پذیرفت. cDNA ساخته شده در دمای 20- درجه سانتیگراد نگهداری شد.
انجام آزمون Real-time PCR :
آزمون Real-time PCR در دستگاه light cycler (رُوش) و در حجم 20 میکرولیتر انجام شد. به ازاء هر واکنش، µL10 از SYBR Premix Ex Taq (تاکارا بیو)، µL2 از محصول cDNA، µL5/0 از هر یک از آغازگرها( pmol10) و µL7 آب عاری از نوکلئاز استفاده شد. شرایط دمایی مورد استفاده شامل یک مرحله فعالسازی اولیه در دمای 95 درجه سانتیگراد به مدت 30 ثانیه و در ادامه، 45 سیکل برای دناتوراسیون(5 ثانیه در 95 درجه سانتیگراد) و مرحله آنیلینگ/اکستنشن توام (20 ثانیه در60 درجه سانتیگراد) میباشد. برای بررسی اختصاصیت محصول تکثیر شده، منحنی ذوب مورد بررسی قرار گرفت. در انتها برای محاسبه نسبی تعداد نسخه mRNA تکثیر شده از فرمول –êêct 2 استفاده شد(جدول 1).
آنالیز آماری:
برای انجام مطالعههای آماری از 18 SPSS استفاده شد. اختلاف معنادار بین متغیرهای آزمایش با استفاده از آزمون two tailed student تعیین شد. مقادیـر به دست آمده با 05/0 p< از نظر آماری معنادار در نظر گرفته شده است.
جدول 1: توالی آغازگرهای مورد استفاده جهت انجام آزمون Real-time PCR
جدول 2: نتایج درصد زنده مانی سلولها بر حسب روز


نمودار 1: تاثیر دارویBIBR1532 بر روی درصد زندهمانی سلولهای NB4 طی 5 روز ابتدایی تیمار. کاهش درصد زندهمانی سلولها 24 ساعت پس از تیمار با دوز 90 میکرومولار آغاز شده و تمامی سلولهای تیمار شده با این غلظت دارویی در روز هفتم مرده بودند. با افزایش غلظت دارو شاهد افزایش تاثیر آنتی پرولیفراتیو BIBR1532 علیه رده سلولی NB4 میباشیم؛ در این خصوص دوزهای 60 و 90 میکرومولار در روز پنجم به ترتیب 73% و 91% زندهمانی سلولها را کاهش دادند، این در حالی است که تاثیر دوز 30 میکرومولار کمتر بوده و با کاهش 18 درصدی در این روز همراه بود. بررسی سلولها نشان میدهد که تیمار با دوز 10 میکرومولار بر روی زندهمانی سلولهای NB4 تاثیر نداشته است.

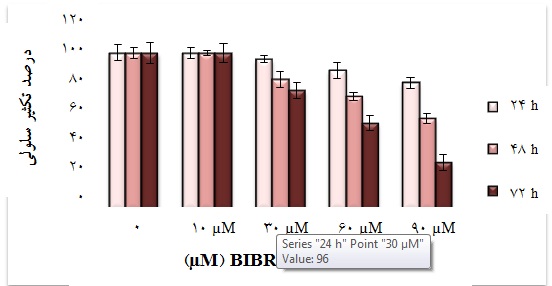
نمودار 2: اثر داروی BIBR1532 بر میزان تکثیر سلولهای NB4 به طور وابسته به دوز و زمان. غلظت µM 10 دارو هیچگونه اثری در مهار میزان ساخت DNA سلولها ندارد، در حالی که در غلظت µM30 ، فعالیت تکثیر سلولها در زمانهای 24، 48 و 72 ساعت به ترتیب به 96%، 83% و 76% کاهش یافت. با افزایش غلظت دارو و مطالعه نتایج به دست آمده مشخص شد که کاهش تکثیر و مهار ساخت DNA در غلظتهای 60 و 90 میکرومولار بیشتر از غلظت 30 میکرومولار بوده است؛ به گونهای که میزان تکثیر سلولهای NB4 تیمار شده به مدت 72 ساعت با دوزهای 60 و 90 میکرومولار به ترتیب به 55% و 30% کاهش پیدا کرد.

شکل 1: منحنی ذوب ژن hTERT و HPRT . همین طور که مشاهده میشود در نمودارها پس از مشتقگیری منحنی درجه دومی به دست میآید که وجود پیکهای ذوب با نقاط ماکزیمم واحد بر این موضوع دلالت دارد که رشته DNA تکثیر شده، به طور اختصاصی رشتهDNA ژن هدف hTERT و ژن مرجع HPRT میباشد.
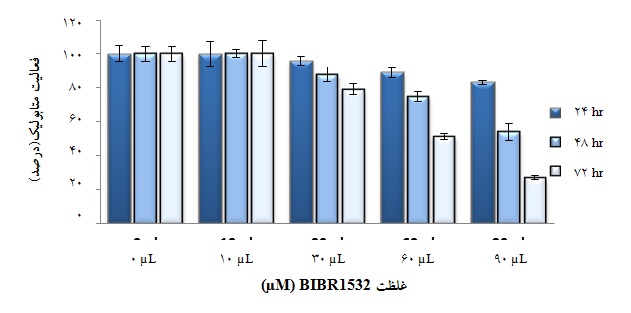
نمودار 4: اثر داروی BIBR1532 بر میزان فعالیت متابولیک سلولهای NB4 به طور وابسته به دوز و زمان. غلظت µM 10 دارو هیچگونه اثری در مهار فعالیت متابولیک سلولها ندارد؛ در حالی که در غلظت µM 30 دارو، فعالیت متابولیک سلولها در زمانهای 24، 48 و 72 ساعت به ترتیب به 6/95%، 88% و 79% رسید. هم چنین تیمار سلولها با غلظتهای µM 60 و µM 90 دارو طی زمانهای 24، 48 و 72 ساعت به ترتیب سبب کسب فعالیت متابولیک 89%، 75%، 51% و 83%، 54% و 27% گشت.
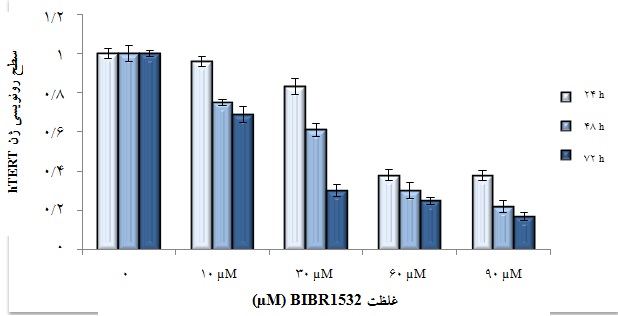
نمودار 4: اثر داروی BIBR1532 بر سطح رونویسی ژن hTERT به طور وابسته به دوز و زمان. نتایج به دست آمده از بررسی بیان ژن hTERT مبین این موضوع است که داروی BIBR1532 به طور وابسته به دوز در غلظتهای 10، 30، 60 و 90 میکرومولار موجب کاهش رونویسی ژن hTERT شده است؛ همان طور که در این شکل آورده شده است، بیشترین کاهش در میان غلظتهای متفاوت مربوط به تیمار سلولی با دوز 90 میکرومولار میباشد. هم چنین، نتایج به دست آمده از آزمایشهای وابسته به زمان بیانگر تاثیر گذشت زمان در تشدید کاهش میزان نسخهبرداری از ژن hTERT میباشد؛ بدین ترتیب که حداکثر میزان کاهش در رونویسی زیر واحد کاتالیتیک تلومراز طی تیمار 72 ساعته با دوز 90 میکرومولار به دست آمد که با کاهش 83 درصدی بیان ژن hTERT همراه بود.
میشود(14). در این راستا و جهت بررسی اثرBIBR1532 بر رونویسی ژن hTERT (که مهمترین عامل تنظیمکننده فعالیت تلومراز میباشد)، میزان بیان mRNA ژن hTERT در سلولهای NB4 تیمار شده در مقایسه با سلولهای کنترل به روش Real-Time RT-PCR ارزیابی گردید. بدین منظور، RNA مربوط به سلولهای تحت تیمار با BIBR5132 و سلولهای کنترل استخراج شد، cDNA های مربوطه ساخته و سپس تغییر در بیان ژن hTERT بررسی شد(از ژن HPRT به عنوان ژن مرجع استفاده گردید). از آن جایی که سایبرگرین نمیتواند بین محصولات مختلف تفاوتی قائل باشد، با استفاده از منحنی ذوب اختصاصیت محصولات در فرآیند PCR مشخص گشت. آنالیز منحنی ذوب نشان میدهد که هیچگونه آغازگر ـ دایمر و یا تکثیر DNA های اضافی وجود نداشته و رشته DNA تکثیر شده، به طور اختصاصی رشته DNA ژن هدف (hTERT) میباشد(شکل 1). نتایج به دست آمده از بررسی بیان ژن hTERT مبین این موضوع است که داروی BIBR1532 به طور وابسته به دوز در غلظتهای 10، 30، 60 و 90 میکرومولار به ترتیب موجب کاهش رونویسی ژن hTERT شده است(نمودار 4). همانطور که در این شکل آورده شده است، بیشترین کاهش در میان غلظتهای متفاوت مربوط به تیمار سلولی با دوز 90 میکرومولار میباشد. هم چنین، نتایج به دست آمده از آزمایشهای وابسته به زمان بیانگر تاثیر گذشت زمان در تشدید کاهش میزان نسخهبرداری از ژن hTERT میباشد؛ بدین ترتیب حداکثر میزان کاهش در رونویسی زیر واحد کاتالیتیک تلومراز طی تیمار 72 ساعته با دوز 90 میکرومولار به دست آمد که با کاهش 83 درصدی بیان ژن hTERT همراه بود.
بحث
سلولهای توموری جهت حفظ طول تلومر و به دنبال آن حفظ توانایی تکثیر نامحدود خود، مکانیزمهای مختلفی را در پیش میگیرند. یکی از مهمترین مکانیزمها در این رابطه و به منظور غلبه بر ساعت تلومریک، فعال شدن مجدد و افزایش بیان آنزیم تلومراز است(16، 15). آنزیم تلومراز در اصل یک آنزیم ریبونوکلئوپروتئینی است که در انسان از یک زیر واحد RNA به نام hTERC و یک زیر واحد پروتئینی تحت عنوان hTERT تشکیل شده است(17). در بسیاری از سلولهای سوماتیک فعالیت تلومرازی وجود ندارد و توالیهای تلومری طی تقسیمات سلولی از بین میروند؛ این در حالی است که در حدود 90% از سلولهای سرطانی، فعالیت بالای تلومراز قابل شناسایی است و همین فعالیت بالا خود منجر به پایداری تلومرها و به دنبال آن توانایی تکثیر نامحدود و نامیرایی سلولهای سرطانی میگردد(18). با توجه به این که سلولهای سرطانی جهت بقای خود وابسته به آنزیم تلومراز بوده و از سوی دیگر، hTERT به عنوان یک بخش کاتالیتیک کلیدی در تنظیم فعالیت تلومراز محسوب میشود، به همین دلیل در بسیاری از روشهای درمانی ضد سرطان مبتنی بر تلومراز، زیر واحد hTERT مورد هدف قرار میگیرد(19). در سال 2001 یک کلاس جدید از مهارکنندههای غیرپپتیدیک - غیرنوکلئوزیدیک تلومراز توسط کمپانیBoehring Ingelheim معرفی شد که مهمترین عضو این خانواده، داروی BIBR1532 میباشد(10).
امروزه برای درمان APL از ATRA و به تازگی از آرسنیک استفاده میشود، اما با توجه به عود بیماران درمان شده با این راهکار درمانی، سعی بر آن است تا روشهای درمانی جدیدی در مورد این بیماری مورد بررسی قرار گیرد(20). همان گونه که پیشتر بیان شد، یکی از روشهای درمانی مفید، هدف قرار دادن آنزیم تلومراز با استفاده از داروهای آنتیتلومراز است. اکثر داروهای آنتیتلومراز از جمله BIBR1532 دارای فاز تاخیری هستند. این خاصیت در مورد BIBR1532 زمانی مشخص شد که برای اولین بار سلولهای تومورال رده سلولی زایا (GCT) تحت تاثیر BIBR1532 به همراه داروی ضد سرطان سیس پلاتین قرار گرفتند؛ نتایج این آزمایشها نشان دادند که برای کوتاه شدن طول تلومر به 300 روز زمان نیاز میباشد(21). به همین دلیل به نظر میرسد که داروهای آنتیتلومرازی به دلیل دارا بودن فاز تاخیری و رابطه این فاز با طول اولیه تلومر و کوتاه شدن تدریجی آن در هر تقسیم سلولی (حدود bp200-50 در هر تقسیم سلولی)، بر روی سلولهایی که طول تلومر کوتاهتری دارند میتوانند مؤثرتر عمل کنند. طی مطالعهای که اخیراً در آزمایشگاه ما انجام شد، مشخص گشت که کوتاهی طول تلومر و بالا بودن فعالیت تلومراز، دو مشخصه مهم سلولهای سرطانی APL میباشد(13). هم چنین نتایج حاصل از این تحقیق بیانگر ارتباط بین این دو ویژگی با میزان پیشرفت و عود بیماری نیز بود. در این راستا و با توجه به نقش مهم آنزیم تلومراز در پیشرفت و عود این بیماری و هم چنین کوتاهی طول تلومر این بیماران، هدف قرار دادن آنزیم تلومراز با داروهای آنتی تلومراز هم چون BIBR1532 میتواند روشی مفید و مؤثر در درمان این بیماران باشد.
برای بررسی اثر بخشی درمان آنتی تلومراز در APL، سلولهای NB4در مجاورت دوزهای مختلف BIBR1532 تیمار شدند. پس از انجام آزمایشها، مشخص گردید که دوزهای بالای دارو(≤30 میکرومولار) طی مدت کوتاه قادرند بر روی درصد زندهمانی و هم چنین قدرت تکثیر سلولها تاثیر مهاری قابل ملاحظهای بگذارند؛ این در حالی است که دوز پایین دارو(µM10) طی گذشت مدت زمان کوتاه قادر به مهار رشد و کاهش درصد زندهمانی سلولهای NB4 نمیباشد. در مطالعه ال- دالی و همکارانش نیز نتایج به همین ترتیب بود، به طوری که آنها به بررسی اثر BIBR1532 بر روی ردههای AML و CLL پرداختند و نشان دادند که BIBR1532 در غلظتهای µM80-30 دارای اثر سایتوتوکسیک مستقیم و کوتاه مدت میباشد(22). هم چنین مشخص شده است که بیماران مبتلا به AML با سطح بالای بیان hTERT در زمان تشخیص، دوره بهبودی پایینتر، دوره بقای کوتاهتر و هم چنین افزایش احتمال عود بیماری داشتهاند(23). با در نظر گرفتن این مطلب به نظر میرسد که بررسی کمی mRNA ژن hTERT میتواند در بررسی پیش آگهی و کنترل
بیماری مؤثر باشد. هم چنین هدف قرار دادن بیان hTERT میتواند راهی مؤثر در زمینه درمان بیماران مبتلا باشد. نتایج حاصل از این مطالعه نشان میدهد که BIBR1532 به طور وابسته به دوز و زمان قادر به کاهش رونویسی ژن hTERT است.
در نتیجه، با مطالعه انجام شده مشخص شد که تیمار سلولهای NB4 با داروی BIBR1523 به طور وابسته به دوز و زمان با سرکوب رونویسی از ژن hTERT ، مهار تکثیر و ساخت DNA و هم چنین کاهش درصد زندهمانی سلولها همراه است. با توجه به طول تلومر کوتاه و فعالیت بالای آنزیم تلومراز در بیماران APL و هم چنین اثربخشی دارویBIBR1532 در القای اثر آنتی پرولیفراتیو در رده سلولی NB4 ، میتوان درمانهای مبتنی بر استراتژی آنتیتلومرازی را به عنوان راهکار درمانی مناسب در بیماران APL مد نظر قرار داد.
نتیجهگیری
با توجه به طول تلومر کوتاه و فعالیت بالای آنزیم تلومراز در بیماران APL و هم چنین اثر بخشی داروی BIBR1532 در القای اثر آنتی پرولیفراتیو در رده سلولی NB4 ، میتوان درمانهای مبتنی بر استراتژی آنتیتلومرازی را به عنوان راهکار درمانی مناسب در بیماران APL ، مد نظر قرار داد.
متن کامل: (2617 مشاهده)
مهار تکثیر سلولهای NB4 به طور وابسته به زمان تحت تاثیر مهارکننده
غیر نوکلئوتیدی تلومراز از طریق کاهش رونویسی زیر واحد کاتالیتیک
داود بشاش1، سید حمیداله غفاری2، مریم کازرانی3، کبریا هزاوه4، کامران علی مقدم4، اردشیر قوامزاده4
چکیده
سابقه و هدف
به دلیل فعالیت تلومراز در تکثیر نامحدود اکثر سلولهای سرطانی از جمله بدخیمیهای خونی مانند لوسمی پرومیلوسیتیکی حاد(APL)، مهار تلومراز روش مناسبی جهت درمان میباشد. در این مطالعه به بررسی اثر BIBR1532 ، مهارکننده غیرنوکلئوزیدیکی، بر روی مهار تکثیر سلولی و بیان ژن hTERT که به عنوان جزء اصلی در فعالیت تلومراز نقش دارد، پرداختیم.
مواد و روشها
در یک مطالعه تجربی، به منظور بررسی اثر BIBR1532 ، سلولها در حضور غلظتهای مختلفی از دارو کشت داده شدند و آزمونهایTrypan blue exclusion assay ، BrdU cell proliferation assayو Quantitative real-time PCR جهت بررسی اثر دارو بر درصد زندهمانی، تکثیر سلولی و بیان mRNA ژن hTERT در زمانهای متفاوت صورت گرفت.
یافتهها
BIBR1532 قادر به کاهش درصد زندهمانی و مهار تکثیر سلولها میباشد. تیمار سلولها با BIBR1532 در غلظتهای 10، 30، 60 و 90 میکرومولار پس از طی 24، 48 و 72 ساعت به صورت وابسته به دوز و زمان منجر به کاهش میزان ساخت DNA سلولها گردید. علاوه بر این، نتایج نشان میدهد که داروی BIBR1532 همراه با افزایش غلظت دارو و زمان تیمار سلولها به طور قابل توجهی منجر به کاهش میزان mRNA ژن hTERT میگردد.
نتیجه گیری
با توجه به طول تلومر کوتاه و فعالیت بالای آنزیم تلومراز در بیماران APL و همچنین اثر بخشی دارویBIBR1532 در القای اثر آنتی پرولیفراتیو در رده سلولی NB4 ، میتوان درمانهای مبتنی بر استراتژی آنتیتلومرازی را به عنوان راهکار درمانی مناسب در بیماران APL مد نظر قرار داد.
کلمات کلیدی: لوسمی پرومیلوسیتی حاد، BIBR1532 ، تلومراز
تاریخ دریافت : 4 /6/91
تاریخ پذیرش : 30/8/91
1- PhD خونشناسی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسؤول: PhD ژنتیـک مولکولی ـ دانشیار مرکز تحقیقات خـون، انکولوژی و پیونـد سلولهای بنیادی بیمارستان شریعتی و دانشکده پزشکی دانشگاه علوم پزشکی تهران ـ کارگر شمالی ـ تهران ـ ایران ـ کدپستی: 14111
3- کارشناس ارشد خونشناسی ـ دانشگاه علوم پزشکی تهران ـ بیمارستان شریعتی ـ تهران ـ ایران
4- فوق تخصص خون و انکولوژی ـ استاد مرکز تحقیقات خون، انکولوژی و پیوند سلولهای بنیادی بیمارستان شریعتی و دانشکده پزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
غیر نوکلئوتیدی تلومراز از طریق کاهش رونویسی زیر واحد کاتالیتیک
داود بشاش1، سید حمیداله غفاری2، مریم کازرانی3، کبریا هزاوه4، کامران علی مقدم4، اردشیر قوامزاده4
چکیده
سابقه و هدف
به دلیل فعالیت تلومراز در تکثیر نامحدود اکثر سلولهای سرطانی از جمله بدخیمیهای خونی مانند لوسمی پرومیلوسیتیکی حاد(APL)، مهار تلومراز روش مناسبی جهت درمان میباشد. در این مطالعه به بررسی اثر BIBR1532 ، مهارکننده غیرنوکلئوزیدیکی، بر روی مهار تکثیر سلولی و بیان ژن hTERT که به عنوان جزء اصلی در فعالیت تلومراز نقش دارد، پرداختیم.
مواد و روشها
در یک مطالعه تجربی، به منظور بررسی اثر BIBR1532 ، سلولها در حضور غلظتهای مختلفی از دارو کشت داده شدند و آزمونهایTrypan blue exclusion assay ، BrdU cell proliferation assayو Quantitative real-time PCR جهت بررسی اثر دارو بر درصد زندهمانی، تکثیر سلولی و بیان mRNA ژن hTERT در زمانهای متفاوت صورت گرفت.
یافتهها
BIBR1532 قادر به کاهش درصد زندهمانی و مهار تکثیر سلولها میباشد. تیمار سلولها با BIBR1532 در غلظتهای 10، 30، 60 و 90 میکرومولار پس از طی 24، 48 و 72 ساعت به صورت وابسته به دوز و زمان منجر به کاهش میزان ساخت DNA سلولها گردید. علاوه بر این، نتایج نشان میدهد که داروی BIBR1532 همراه با افزایش غلظت دارو و زمان تیمار سلولها به طور قابل توجهی منجر به کاهش میزان mRNA ژن hTERT میگردد.
نتیجه گیری
با توجه به طول تلومر کوتاه و فعالیت بالای آنزیم تلومراز در بیماران APL و همچنین اثر بخشی دارویBIBR1532 در القای اثر آنتی پرولیفراتیو در رده سلولی NB4 ، میتوان درمانهای مبتنی بر استراتژی آنتیتلومرازی را به عنوان راهکار درمانی مناسب در بیماران APL مد نظر قرار داد.
کلمات کلیدی: لوسمی پرومیلوسیتی حاد، BIBR1532 ، تلومراز
تاریخ دریافت : 4 /6/91
تاریخ پذیرش : 30/8/91
1- PhD خونشناسی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسؤول: PhD ژنتیـک مولکولی ـ دانشیار مرکز تحقیقات خـون، انکولوژی و پیونـد سلولهای بنیادی بیمارستان شریعتی و دانشکده پزشکی دانشگاه علوم پزشکی تهران ـ کارگر شمالی ـ تهران ـ ایران ـ کدپستی: 14111
3- کارشناس ارشد خونشناسی ـ دانشگاه علوم پزشکی تهران ـ بیمارستان شریعتی ـ تهران ـ ایران
4- فوق تخصص خون و انکولوژی ـ استاد مرکز تحقیقات خون، انکولوژی و پیوند سلولهای بنیادی بیمارستان شریعتی و دانشکده پزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
مقدمه
لوسمی پرومیلوسیتیک حاد(APL)، یکی از زیر گروههایAML (AML-M3) میباشد. APL معمولاً در سنین 50-40 سالگی رخ داده و حدود 15%-10% انواع AML را به خود اختصاص میدهد(1). این بیماری در اثر نقص در بلوغ گلبولهای سفید در رده میلوئیدی به وجود میآید که طی آن روند بلوغ در سلولهای رده گرانولوسیتی در مرحله پرومیلوسیت متوقف میشود. تقریباً ۹5% از بیماران مبتلا به APL دارای جابهجایی بین کروموزوم ۱۵ و۱۷ هستند](22 : 12)q(15:17) [tکه منجر به الحاق ژن RARα (ژن کدکننده گیرنده رتینوئیک اسید) با ژن PML میگردد(2). به دلیل انعقاد داخل عروقی منتشر (DIC) که ظاهراً ناشی از آزاد شدن مواد پیش انعقادی از گرانولهای سلولهای لوسمیک است، مشکلات خونریزی در این بیماری شایع بوده و از جمله علل اصلی مرگ و میر این بیماران محسوب میشود(3). در سال 1985 معرفی ATRA که مشتقی از ویتامین A است، افقی جدید در تاریخچه درمان APL گشود و از میزان مرگ و میر بیماری به طور قابل توجهی کاست. با این حال و علیرغم اثر بخشی این دارو در درمان APL، درصدی از بیماران دچار عود شده و در نهایت به مرگ بیمار منجر میشود(4).
علیرغم این حقیقت که ماهیت بالینی سرطان بسیار متنوع است، اما اکثر تومورها در تعداد محدودی از ویژگیها هم چون توانایی تکثیر نامحدود، رشد غیر قابل کنترل، تهاجم به بافتها و انتشار متاستاتیک مشترک میباشند(5). مطالعههای انجام شده طی دو دهه گذشته نشان داده است که کسب توانایی تکثیر نامحدود که با حفظ طول تلومر مرتبط است، مهمترین مرحله در ایجاد سرطان میباشد(6). هم چنین مشخص شده است که مهمترین مکانیسم برای غلبه بر محدودیت تکثیر ناشی از کوتاه شدن طول تلومر، فعال شدن آنزیمی به نام تلومراز است که افزایش فعالیت آن در بیش از 85% بدخیمیهای انسان گزارش شده است(7). تلومراز آنزیمی است که از یک جزء RNA به نام hTERCو یک جزء کاتالیتیک تحت عنوان hTERT تشکیل شده است(8). مشخص شده است که فعالیت تلومراز طی روند بلوغ و تکامل عمدتاً از طریـق
رونویسی ژن hTERT تنظیم میشود(9). از آنجایی که اکثر سلولهای سوماتیک hTERT را بیان نمیکنند، فاقد فعالیت تلومراز میباشند؛ از سوی دیگر، اکثریت سلولهای سرطانی hTERT را بیان کرده و تلومراز مثبت میباشند(9). با توجه به این امر، تلومراز و به ویژه hTERT ، به عنوان اهداف درمانی بسیار امیدوارکننده جهت درمان سرطانها معرفی شده و اخیراً مهارکنندگان تلومراز به عنوان راهکارهای درمانـی جدیـد، مورد توجه شایان قرار گرفتهاند. در میان این دسته از داروها، BIBR1532 که یک مهارکننده غیرنوکلئوزیدی - غیرپپتیدی است، افق بسیار روشنی در درمان سرطانها گشوده است(10).
این دارو به طور اختصاصی موجب مهار آنزیم تلومراز میشود و بر روی آنزیمهای DNA پلیمراز، RNA پلیمراز و هم چنین سایر اعضـای آنزیمهـای تـرانس کریپتاز معکوس بیتاثیر است. این ترکیب، یک مهارکننده غیر رقابتی آنزیم تلومراز محسوب میشود؛ به این ترتیب که محل اتصال دارو متمایز از محل داکسی ریبو نوکلئوتیدها و آغازگر است(11). در واقع BIBR1532 به محل کاتالیتیک آنزیم متصل نمیشود و همین امر آن را از سایر مهارکنندهها از جمله ترکیبات نوکلئوزیدیک و یا الیگونوکلئوتیدی متمایز میسازد(12).
تاکنون بررسیهای گوناگونی در مورد تاثیر این ترکیب بر روی سلولهای سرطانی مختلف صورت گرفته و نشان داده شده است که BIBR1532 موجب مهار تکثیر سلولهای سرطانی ریه، سینه، فیبروسارکوما و پروستات میشود(10).
این دارو دارای اثرات وابسته به دوز بوده و سرعت و اثر آن به طول اولیه تلومر در سلول سرطانی بستگی دارد. با توجه به آن که تقریباً 90% بیماران مبتلا بهAPL دارای تلومرهایی با طول کوتاه و فعالیت تلومراز بالا می باشند، لذا به نظر میرسد این بیماران کاندید مناسب برای درمان با مهارکنندگان تلومراز باشند(13). به این منظور و برای بررسی کارآیی استفاده از استراتژی آنتیتلومراز در بیماری APL، سلولهای رده NB4 با غلظتهای متفاوت از داروی BIBR1532 تیمار شدند و نتایـج آن مورد بررسی قرار گرفت.
مواد و روشها
کشت سلولی:
در یک مطالعه تجربی، سلولهای NB4 (رده سلولی انسانی APL) به صورت سوسپانسیون در محیط کشت RPMI 1640 حاوی mM 2 از L -گلوتامین ، 10% FBS ، پنیسیلین به میزان unit/mL 100 و استرپتومایسین به میزان µg/mL 100 در دمای 37 درجه سانتیگراد و فشار 5% از CO2 کشت داده شدند. سلولهای NB4 از بانک سلولی انستیتو پاستور تهیه شد و برای بررسی حضور (17; 15)t با روش استاندارد کاریوتایپینگ انجام شد. هم چنین این رده سلولی برای حضور mRNA ژن ترکیبی αPML/RAR نیز مورد مطالعه قرار گرفت.
تیمار دارویی با BIBR1532 :
برای تیمار دارویی سلولها، از داروی BIBR1532 (آمریکا، بیوساینس) که به صورت پودر میباشد، استفاده شد. محلول ذخیره BIBR1532 در غلظت mM 1 و به واسطه حل کردن این دارو در DMSO استریل 1/0% تهیه شد. محلول ذخیره BIBR1532 را در میکروتیوبها تقسیم کرده و آنها را در دمای 20- درجه سانتیگراد تا زمان مصرف نگهداری کردیم. به منظور تعیین اثرات بهینه دارو، ٢ متغیر دوز و زمان در این تحقیق در نظر گرفته شد. سلولهای سرطانی، با غلظتهای 10، 30، 60 و 90 میکرومولار از داروی BIBR1532 تیمار شدند و به ترتیب پس از زمانهای ٢4، 4٨ و٧٢ ساعت مورد مطالعه قرار گرفتند. در ضمن به منظور افزایش بهرهوری کار و بررسی مقایسهای، تمامی آزمایشها برای هر دوز و زمان به صورت داپلیکیت انجام شد.
تعیین درصد زنده بودن و بررسی منحنی رشد لگاریتمی سلولها:

برای بررسی اثر مهاری داروی BIBR1532 بر روی شاخص زنده مانی و منحنی رشد لگاریتمی سلولها، سلولهای NB4 به تعداد 105 * 1 سلول در هر mL در حضور یا عدم حضور داروی BIBR1532 انکوبه شده و به مدت 10روز نگهداری شدند. سلولها هر سه روز یک بار پاساژ داده شده و مجدداً تیمار میشدند. به طور پیوسته، هر 24 ساعت شاخص زندهمانی سلولها با استفاده از رنگآمیزی تریپانبلو بررسی شد. برای انجام آزمایش، در شرایط استریل میزان 30 میکرولیتر از سوسپانسیون سلولی را برداشته و داخل یک میکروتیوب ریختیم. سپس هم حجم آن تریپانبلو اضافه کرده و پس از گذشت چند دقیقه یک قطره از آن را برداشته و با استفاده از لام نئوبار و در خانههای مربوط به شمارش گلبول سفید شمارش انجام شد(ضریب رقت 2 میباشد). در ادامه، با شمارش سلولهای مرده و با استفاده از فرمول زیر درصد زنده بودن سلولها تعیین گردید.

بررسی میزان ساخت DNA و درصد تکثیر سلولی:
اثر مهاری BIBR1532 بر روی تکثیر سلولهای NB4 از طریق تعیین میزان مشارکت برمو داکسی یوریدین در DNA سلولهای NB4 با استفاده از BrdU-based cell proliferation ELISA kit طبق دستورالعمل کیت اندازهگیری شد. به طور خلاصه، سلولها به تعداد 5000 در هر چاهک درون پلیت 96 تایی در حضور یا عدم حضور داروی BIBR1532 کشت داده شدند. 12 ساعت مانده به انتهای زمان انکوباسیون، 10 میکرولیتر محلول BrdU که در کیت موجود میباشد، به سلولها افزوده شد. در ادامه و با استفاده از محلول FixDenat ، سلولها فیکس شده و DNA آنها دناتوره گردید. سلولها با آنتیبادی علیه BrdU که با آنزیم پراکسیداز کنژوگه میباشد، به مدت 1 ساعت در دمای اتاق انکوبه شده و در انتهای این زمان، 100 میکرولیتر سوبسترای TMB افزوده گردید. پس از گذشت 30 دقیقه در دمای اتاق و آن هم به منظور پایان دادن به عملکرد آنزیم پراکسیداز، از محلول اسید سولفوریک 1 مولار استفاده شد. در انتها، میزان رنگ ایجاد شده در هر چاهک با استفاده از دستگاه الایزا ریدر در طول موج nm450 خوانده شد. برای محاسبه اثر مهاری داروی BIBR1532 بر روی تکثیر سلولهای NB4 و بررسی میزان کاهش ساخت DNA سلولهای تیمار شده، از فـرمول زیـر استفاده شد:

در این فرمول، OD exp و OD cont به ترتیب بیانگر جذب نوری سلولهای تیمار شده و سلولهای تیمار نشده (کنترل) میباشد.
اندازهگیری فعالیت متابولیک سلولی:
در این مطالعه به منظور بررسی تاثیر سایتوتوکسیک دارو بر توان متابولیک سلول، از روش MTT استفاده شد. پس از تیمار سلولی، 100 میکرولیتر سوسپانسیون حاوی 103 * 5 سلول به چاهکهای پلیت 96 خانهای اضافه گشت(هر سری به صورت سه تایی انجام شد). چاهکی که فقط حاوی محیط کشت فاقد سلول بود، به عنوان بلانک دستگاه الایزا ریدر و چاهکهای شامل محیط کشت و سلول(بدون افزودن دارو) به عنوان کنترل زنده سلول به کار رفت. پلیت مورد آزمایش در دمای 37 درجه سانتیگراد و فشار 5% از CO2 قرار گرفت. بعد از اتمام زمان انکوباسیون، به هر چاهک 100 میکرولیتر محلول MTT افزوده شده و پس از شیک به مدت 5 دقیقه، پلیت به مدت 3 ساعت دیگر انکوبه شد.
سپس پلیت را با دورg 350 به مدت 10 دقیقه سانتریفوژ نمودیم، پس از سانتریفوژ مایع رویی را دور ریخته و به رسوب ته پلیت 100 میکرولیتر DMSO اضافه کردیم. پس از مخلوط نمودن به مدت 5 دقیقه، پلیت را در دمای 37 درجه سانتیگراد به مدت 5 دقیقه انکوبه نمودیم. سپس پلیت را جهت قرائت در دستگاه الایزا ریدر قرار داده و جذب نوری چاهکها را در طول موج 570 نانومتر خواندیم.
استخراج RNA و ساخت cDNA :
برای استخراج RNA از سلولهای مورد مطالعه، از کیت High Pure RNA Isolation(رُوش) طبق دستورالعمل استفاده شد. پس از تیمار سلولهای NB4 با داروی BIBR1532 و متعاقب گذشت زمانهای 24، 48 و 72 ساعت، RNA سلولها استخراج شده و کمیت آنها با روش اسپکتروفتومتری با استفاده از دستگاه نانو دراپ ND-1000 اندازهگیری شد. برای انجام واکنش رونویسی معکوس از (Takara BIO) Revert Aid First Strand cDNA Synthesis Kit استفاده شد.
حجم مورد نظر برای انجام این واکنش 20 میکرولیتر بود و محتویات آن شامل µL4 بافر PCR 5X ، µL2 از DNTP ، µL1 راندم هگزامر، µL1 آب تیمار شـده با DEPC ، µL1 مهار کننده RNase (U/µL 20)، µL 1 ترانس کریپتاز معکوس M-MULV ( U/µL200) وµg 1 از RNA مورد آزمایش به ازاء هر واکنش میباشد. محتوی مذکور به مدت 5 دقیقه در دمای 65 درجه سانتیگراد، 5 دقیقه در دمای 25 درجه سانتیگراد و 1 ساعت در دمای 42 درجه سانتیگراد انکوبه شدند و در نهایت، واکنش ساخت cDNA به واسطه انکوباسیون 5 دقیقهای در دمای 70 درجه پایان پذیرفت. cDNA ساخته شده در دمای 20- درجه سانتیگراد نگهداری شد.
انجام آزمون Real-time PCR :
آزمون Real-time PCR در دستگاه light cycler (رُوش) و در حجم 20 میکرولیتر انجام شد. به ازاء هر واکنش، µL10 از SYBR Premix Ex Taq (تاکارا بیو)، µL2 از محصول cDNA، µL5/0 از هر یک از آغازگرها( pmol10) و µL7 آب عاری از نوکلئاز استفاده شد. شرایط دمایی مورد استفاده شامل یک مرحله فعالسازی اولیه در دمای 95 درجه سانتیگراد به مدت 30 ثانیه و در ادامه، 45 سیکل برای دناتوراسیون(5 ثانیه در 95 درجه سانتیگراد) و مرحله آنیلینگ/اکستنشن توام (20 ثانیه در60 درجه سانتیگراد) میباشد. برای بررسی اختصاصیت محصول تکثیر شده، منحنی ذوب مورد بررسی قرار گرفت. در انتها برای محاسبه نسبی تعداد نسخه mRNA تکثیر شده از فرمول –êêct 2 استفاده شد(جدول 1).
آنالیز آماری:
برای انجام مطالعههای آماری از 18 SPSS استفاده شد. اختلاف معنادار بین متغیرهای آزمایش با استفاده از آزمون two tailed student تعیین شد. مقادیـر به دست آمده با 05/0 p< از نظر آماری معنادار در نظر گرفته شده است.
جدول 1: توالی آغازگرهای مورد استفاده جهت انجام آزمون Real-time PCR
| ژن | Accession number | آغازگر جلوبرنده ('3-'5) | آغازگر معکوس ('3-'5) | سایز(bp) |
| HPRT | 000194-NM | TGGACAGGACTGAACGTCTTG | CCAGCAGGTCAGCAAAGAATTTA | 111 |
| hTERT | 198253-NM | TGACACCTCACCTCACCCAC | CACTGTCTTCCGCAAGTTCAC | 95 |
یافتهها
BIBR1532 به طور وابسته به دوز و زمان باعث کاهش زندهمانی سلولهای NB4 میشود:
پس از کشت رده سلولی NB4 در حضور غلظتهای مختلف دارو، درصد زندهمانی سلولها جهت بررسی تاثیر دارو به صورت روزانه مورد بررسی قرار گرفت. نتایج نشان میدهد که داروی BIBR1532 بر روی سلولهای NB4 دارای اثر مستقیم آنتیپرولیفراتیو وابسته به دوز و زمان میباشد؛ به طوری که درصد زندهمانی سلولهای تیمار شده در محیط کشت با افزایش غلظت دارو و در طول زمان در مقایسه با سلولهای تیمار نشده(کنترل) به طور قابل توجه کاهش یافت(نمودار 1). تیمار سلولها در حضور تمام غلظتهای دارویی به غیر از غلظت 10 میکرومولار در اثر گذشت زمان با کاهش زندهمانی سلولها همراه بوده است(جدول 2). کاهش درصد زندهمانی سلولها 24 ساعت پس از تیمار با دوز 90 میکرومولار آغاز شده و تمامی سلولهای تیمار شده با این غلظت دارویـی در روز هفتـم مرده بودند. همان گونه که در نمودار 1 ارایه شده است، با افزایش غلظت دارو شاهد افزایش تاثیر آنتیپرولیفراتیو BIBR1532 علیه رده سلولی NB4 میباشیم؛ در این خصوص دوزهای 60 و 90 میکرومولار در روز ششم به ترتیب 83% و 95% زندهمانی سلولها را کاهش دادند، این در حالی است که تاثیر دوز 30 میکرومولار کمتر بوده و با کاهش 26 درصدی در این روز همراه بوده است. بررسی سلولها تا روز دهم نشان میدهد که تیمار با دوز 10 میکرومولار بر روی زندهمانی سلولهای NB4 تاثیر نداشته است.
مهار تکثیر سلولی و کاهش میزان ساخت DNA :
به منظور بررسی اثر آنتی پرولیفراتیو داروی BIBR1532
و تعیین اثربخشی آن بر روی تکثیر و ساخت DNA در رده سلولی NB4 ، آزمون BrdU انجام شد؛ در این آزمون، میزان مشارکت برمو داکسی یوریدین در DNA سلولهای تیمار شده بیانگر میزان ساخت DNA در این سلولها میباشد. طی بررسیهای وابسته به دوز در زمانهای 24، 48 و 72 ساعت، مشخص گردید که داروی BIBR1532 هم به طور وابسته به دوز و هم وابسته به زمان قادر به مهار تکثیر سلولهایNB4 است. غلظت µM 10 دارو هیچگونه اثری در مهار میزان ساخت DNA سلولها نداشت، در حالی که در غلظت µM30، فعالیت تکثیر سلولها در زمانهای ذکر شده به ترتیب به 96%، 83% و 76% کاهش یافت(نمودار 2). با افزایش غلظت دارو و مطالعه نتایج به دست آمده، مشخص شد که کاهش تکثیر و مهار ساخت DNA در غلظتهای 60 و 90 میکرومولار بیشتر از غلظت 30 میکرومولار بوده است؛ به گونهای که میزان تکثیر سلولهای NB4 تیمار شده به مدت 72 ساعت با دوزهای 60 و 90 میکرومولار به ترتیب به 55 و 30 درصد کاهش پیدا کرد. نتایج به دست آمده نمایانگر مؤثر بودن داروی BIBR1532 در مهار رشد سلولهای سرطانی APL بوده و با توجه به این نتایج میتوان به این نکته پی برد که هر چه سلولها زمان طولانیتری تحت تیمار با داروی BIBR1532 قرار گرفته باشند، میزان رشدشان کمتر میشود. هم چنین در دوزهای بالاتر ممانعت از رشد سلولی سریعتر و به میزان بیشتری صورت میگیرد.
BIBR1532 به طور وابسته به دوز و زمان باعث کاهش فعالیت متابولیک سلولهای NB4 میشود:
در این مطالعه و به منظور بررسی اثر داروی BIBR1532 در مهـار فعالیـت متابولیـک رده سلولی NB4 ، آزمایش MTT انجام شد. در طی بررسیهای وابسته به دوز
در زمانهای 24، 48 و 72 ساعت مشخص گردید که داروی BIBR1532 قادر به مهار فعالیت متابولیک سلولهایNB4 میباشد. همان گونه که در نمودار 3 مشاهده میشود، غلظت µM 10 دارو هیچ گونه اثری در مهار فعالیت متابولیک سلولها ندارد؛ در حالی که در غلظت µM 30 دارو، فعالیت متابولیک سلولها در زمانهای ذکر شده به ترتیب به 6/95%، 88% و 79% رسید. هم چنین تیمار سلولها با غلظتهای µM 60 و µM 90 دارو طی زمانهای 24، 48 و 72 ساعت به ترتیب سبب کسب فعالیت متابولیک 89%، 75%، 51% و 83%، 54% و 27% گشت. نتایج حاصل از آزمایش MTT مؤید آن است که داروی BIBR1532 به طور وابسته به دوز و زمان باعث کاهش فعالیت متابولیک سلولهای NB4 میشود.
کاهش رونویسی ژن hTERT به طور وابسته به دوز و زمان طی تیمار سلولهای NB4 با داروی BIBR1532 :
مشخص شده است که فعالیت تلومراز طی روند بلوغ و تکامل عمدتاً از طریق رونویسی ژن hTERT تنظیم
BIBR1532 به طور وابسته به دوز و زمان باعث کاهش زندهمانی سلولهای NB4 میشود:
پس از کشت رده سلولی NB4 در حضور غلظتهای مختلف دارو، درصد زندهمانی سلولها جهت بررسی تاثیر دارو به صورت روزانه مورد بررسی قرار گرفت. نتایج نشان میدهد که داروی BIBR1532 بر روی سلولهای NB4 دارای اثر مستقیم آنتیپرولیفراتیو وابسته به دوز و زمان میباشد؛ به طوری که درصد زندهمانی سلولهای تیمار شده در محیط کشت با افزایش غلظت دارو و در طول زمان در مقایسه با سلولهای تیمار نشده(کنترل) به طور قابل توجه کاهش یافت(نمودار 1). تیمار سلولها در حضور تمام غلظتهای دارویی به غیر از غلظت 10 میکرومولار در اثر گذشت زمان با کاهش زندهمانی سلولها همراه بوده است(جدول 2). کاهش درصد زندهمانی سلولها 24 ساعت پس از تیمار با دوز 90 میکرومولار آغاز شده و تمامی سلولهای تیمار شده با این غلظت دارویـی در روز هفتـم مرده بودند. همان گونه که در نمودار 1 ارایه شده است، با افزایش غلظت دارو شاهد افزایش تاثیر آنتیپرولیفراتیو BIBR1532 علیه رده سلولی NB4 میباشیم؛ در این خصوص دوزهای 60 و 90 میکرومولار در روز ششم به ترتیب 83% و 95% زندهمانی سلولها را کاهش دادند، این در حالی است که تاثیر دوز 30 میکرومولار کمتر بوده و با کاهش 26 درصدی در این روز همراه بوده است. بررسی سلولها تا روز دهم نشان میدهد که تیمار با دوز 10 میکرومولار بر روی زندهمانی سلولهای NB4 تاثیر نداشته است.
مهار تکثیر سلولی و کاهش میزان ساخت DNA :
به منظور بررسی اثر آنتی پرولیفراتیو داروی BIBR1532
و تعیین اثربخشی آن بر روی تکثیر و ساخت DNA در رده سلولی NB4 ، آزمون BrdU انجام شد؛ در این آزمون، میزان مشارکت برمو داکسی یوریدین در DNA سلولهای تیمار شده بیانگر میزان ساخت DNA در این سلولها میباشد. طی بررسیهای وابسته به دوز در زمانهای 24، 48 و 72 ساعت، مشخص گردید که داروی BIBR1532 هم به طور وابسته به دوز و هم وابسته به زمان قادر به مهار تکثیر سلولهایNB4 است. غلظت µM 10 دارو هیچگونه اثری در مهار میزان ساخت DNA سلولها نداشت، در حالی که در غلظت µM30، فعالیت تکثیر سلولها در زمانهای ذکر شده به ترتیب به 96%، 83% و 76% کاهش یافت(نمودار 2). با افزایش غلظت دارو و مطالعه نتایج به دست آمده، مشخص شد که کاهش تکثیر و مهار ساخت DNA در غلظتهای 60 و 90 میکرومولار بیشتر از غلظت 30 میکرومولار بوده است؛ به گونهای که میزان تکثیر سلولهای NB4 تیمار شده به مدت 72 ساعت با دوزهای 60 و 90 میکرومولار به ترتیب به 55 و 30 درصد کاهش پیدا کرد. نتایج به دست آمده نمایانگر مؤثر بودن داروی BIBR1532 در مهار رشد سلولهای سرطانی APL بوده و با توجه به این نتایج میتوان به این نکته پی برد که هر چه سلولها زمان طولانیتری تحت تیمار با داروی BIBR1532 قرار گرفته باشند، میزان رشدشان کمتر میشود. هم چنین در دوزهای بالاتر ممانعت از رشد سلولی سریعتر و به میزان بیشتری صورت میگیرد.
BIBR1532 به طور وابسته به دوز و زمان باعث کاهش فعالیت متابولیک سلولهای NB4 میشود:
در این مطالعه و به منظور بررسی اثر داروی BIBR1532 در مهـار فعالیـت متابولیـک رده سلولی NB4 ، آزمایش MTT انجام شد. در طی بررسیهای وابسته به دوز
در زمانهای 24، 48 و 72 ساعت مشخص گردید که داروی BIBR1532 قادر به مهار فعالیت متابولیک سلولهایNB4 میباشد. همان گونه که در نمودار 3 مشاهده میشود، غلظت µM 10 دارو هیچ گونه اثری در مهار فعالیت متابولیک سلولها ندارد؛ در حالی که در غلظت µM 30 دارو، فعالیت متابولیک سلولها در زمانهای ذکر شده به ترتیب به 6/95%، 88% و 79% رسید. هم چنین تیمار سلولها با غلظتهای µM 60 و µM 90 دارو طی زمانهای 24، 48 و 72 ساعت به ترتیب سبب کسب فعالیت متابولیک 89%، 75%، 51% و 83%، 54% و 27% گشت. نتایج حاصل از آزمایش MTT مؤید آن است که داروی BIBR1532 به طور وابسته به دوز و زمان باعث کاهش فعالیت متابولیک سلولهای NB4 میشود.
کاهش رونویسی ژن hTERT به طور وابسته به دوز و زمان طی تیمار سلولهای NB4 با داروی BIBR1532 :
مشخص شده است که فعالیت تلومراز طی روند بلوغ و تکامل عمدتاً از طریق رونویسی ژن hTERT تنظیم
جدول 2: نتایج درصد زنده مانی سلولها بر حسب روز
| دوز(µM) زمان(روزها) |
0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 0 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 |
| µM 10 1532 BIBR | 100 | 100 | 100 | 100 | 98 | 99 | 98 | 99 | 97 | 99 | 97 |
| µM 30 1532 BIBR | 100 | 100 | 100 | 93 | 85 | 82 | 74 | 71 | 65 | 55 | 43 |
| µM 60 1532 BIBR | 100 | 100 | 90 | 57 | 38 | 27 | 17 | 10 | 0 | ||
| µM 90 1532 BIBR | 100 | 90 | 65 | 36 | 20 | 9 | 5 | 0 |


نمودار 1: تاثیر دارویBIBR1532 بر روی درصد زندهمانی سلولهای NB4 طی 5 روز ابتدایی تیمار. کاهش درصد زندهمانی سلولها 24 ساعت پس از تیمار با دوز 90 میکرومولار آغاز شده و تمامی سلولهای تیمار شده با این غلظت دارویی در روز هفتم مرده بودند. با افزایش غلظت دارو شاهد افزایش تاثیر آنتی پرولیفراتیو BIBR1532 علیه رده سلولی NB4 میباشیم؛ در این خصوص دوزهای 60 و 90 میکرومولار در روز پنجم به ترتیب 73% و 91% زندهمانی سلولها را کاهش دادند، این در حالی است که تاثیر دوز 30 میکرومولار کمتر بوده و با کاهش 18 درصدی در این روز همراه بود. بررسی سلولها نشان میدهد که تیمار با دوز 10 میکرومولار بر روی زندهمانی سلولهای NB4 تاثیر نداشته است.


نمودار 2: اثر داروی BIBR1532 بر میزان تکثیر سلولهای NB4 به طور وابسته به دوز و زمان. غلظت µM 10 دارو هیچگونه اثری در مهار میزان ساخت DNA سلولها ندارد، در حالی که در غلظت µM30 ، فعالیت تکثیر سلولها در زمانهای 24، 48 و 72 ساعت به ترتیب به 96%، 83% و 76% کاهش یافت. با افزایش غلظت دارو و مطالعه نتایج به دست آمده مشخص شد که کاهش تکثیر و مهار ساخت DNA در غلظتهای 60 و 90 میکرومولار بیشتر از غلظت 30 میکرومولار بوده است؛ به گونهای که میزان تکثیر سلولهای NB4 تیمار شده به مدت 72 ساعت با دوزهای 60 و 90 میکرومولار به ترتیب به 55% و 30% کاهش پیدا کرد.

شکل 1: منحنی ذوب ژن hTERT و HPRT . همین طور که مشاهده میشود در نمودارها پس از مشتقگیری منحنی درجه دومی به دست میآید که وجود پیکهای ذوب با نقاط ماکزیمم واحد بر این موضوع دلالت دارد که رشته DNA تکثیر شده، به طور اختصاصی رشتهDNA ژن هدف hTERT و ژن مرجع HPRT میباشد.

نمودار 4: اثر داروی BIBR1532 بر میزان فعالیت متابولیک سلولهای NB4 به طور وابسته به دوز و زمان. غلظت µM 10 دارو هیچگونه اثری در مهار فعالیت متابولیک سلولها ندارد؛ در حالی که در غلظت µM 30 دارو، فعالیت متابولیک سلولها در زمانهای 24، 48 و 72 ساعت به ترتیب به 6/95%، 88% و 79% رسید. هم چنین تیمار سلولها با غلظتهای µM 60 و µM 90 دارو طی زمانهای 24، 48 و 72 ساعت به ترتیب سبب کسب فعالیت متابولیک 89%، 75%، 51% و 83%، 54% و 27% گشت.

نمودار 4: اثر داروی BIBR1532 بر سطح رونویسی ژن hTERT به طور وابسته به دوز و زمان. نتایج به دست آمده از بررسی بیان ژن hTERT مبین این موضوع است که داروی BIBR1532 به طور وابسته به دوز در غلظتهای 10، 30، 60 و 90 میکرومولار موجب کاهش رونویسی ژن hTERT شده است؛ همان طور که در این شکل آورده شده است، بیشترین کاهش در میان غلظتهای متفاوت مربوط به تیمار سلولی با دوز 90 میکرومولار میباشد. هم چنین، نتایج به دست آمده از آزمایشهای وابسته به زمان بیانگر تاثیر گذشت زمان در تشدید کاهش میزان نسخهبرداری از ژن hTERT میباشد؛ بدین ترتیب که حداکثر میزان کاهش در رونویسی زیر واحد کاتالیتیک تلومراز طی تیمار 72 ساعته با دوز 90 میکرومولار به دست آمد که با کاهش 83 درصدی بیان ژن hTERT همراه بود.
میشود(14). در این راستا و جهت بررسی اثرBIBR1532 بر رونویسی ژن hTERT (که مهمترین عامل تنظیمکننده فعالیت تلومراز میباشد)، میزان بیان mRNA ژن hTERT در سلولهای NB4 تیمار شده در مقایسه با سلولهای کنترل به روش Real-Time RT-PCR ارزیابی گردید. بدین منظور، RNA مربوط به سلولهای تحت تیمار با BIBR5132 و سلولهای کنترل استخراج شد، cDNA های مربوطه ساخته و سپس تغییر در بیان ژن hTERT بررسی شد(از ژن HPRT به عنوان ژن مرجع استفاده گردید). از آن جایی که سایبرگرین نمیتواند بین محصولات مختلف تفاوتی قائل باشد، با استفاده از منحنی ذوب اختصاصیت محصولات در فرآیند PCR مشخص گشت. آنالیز منحنی ذوب نشان میدهد که هیچگونه آغازگر ـ دایمر و یا تکثیر DNA های اضافی وجود نداشته و رشته DNA تکثیر شده، به طور اختصاصی رشته DNA ژن هدف (hTERT) میباشد(شکل 1). نتایج به دست آمده از بررسی بیان ژن hTERT مبین این موضوع است که داروی BIBR1532 به طور وابسته به دوز در غلظتهای 10، 30، 60 و 90 میکرومولار به ترتیب موجب کاهش رونویسی ژن hTERT شده است(نمودار 4). همانطور که در این شکل آورده شده است، بیشترین کاهش در میان غلظتهای متفاوت مربوط به تیمار سلولی با دوز 90 میکرومولار میباشد. هم چنین، نتایج به دست آمده از آزمایشهای وابسته به زمان بیانگر تاثیر گذشت زمان در تشدید کاهش میزان نسخهبرداری از ژن hTERT میباشد؛ بدین ترتیب حداکثر میزان کاهش در رونویسی زیر واحد کاتالیتیک تلومراز طی تیمار 72 ساعته با دوز 90 میکرومولار به دست آمد که با کاهش 83 درصدی بیان ژن hTERT همراه بود.
بحث
سلولهای توموری جهت حفظ طول تلومر و به دنبال آن حفظ توانایی تکثیر نامحدود خود، مکانیزمهای مختلفی را در پیش میگیرند. یکی از مهمترین مکانیزمها در این رابطه و به منظور غلبه بر ساعت تلومریک، فعال شدن مجدد و افزایش بیان آنزیم تلومراز است(16، 15). آنزیم تلومراز در اصل یک آنزیم ریبونوکلئوپروتئینی است که در انسان از یک زیر واحد RNA به نام hTERC و یک زیر واحد پروتئینی تحت عنوان hTERT تشکیل شده است(17). در بسیاری از سلولهای سوماتیک فعالیت تلومرازی وجود ندارد و توالیهای تلومری طی تقسیمات سلولی از بین میروند؛ این در حالی است که در حدود 90% از سلولهای سرطانی، فعالیت بالای تلومراز قابل شناسایی است و همین فعالیت بالا خود منجر به پایداری تلومرها و به دنبال آن توانایی تکثیر نامحدود و نامیرایی سلولهای سرطانی میگردد(18). با توجه به این که سلولهای سرطانی جهت بقای خود وابسته به آنزیم تلومراز بوده و از سوی دیگر، hTERT به عنوان یک بخش کاتالیتیک کلیدی در تنظیم فعالیت تلومراز محسوب میشود، به همین دلیل در بسیاری از روشهای درمانی ضد سرطان مبتنی بر تلومراز، زیر واحد hTERT مورد هدف قرار میگیرد(19). در سال 2001 یک کلاس جدید از مهارکنندههای غیرپپتیدیک - غیرنوکلئوزیدیک تلومراز توسط کمپانیBoehring Ingelheim معرفی شد که مهمترین عضو این خانواده، داروی BIBR1532 میباشد(10).
امروزه برای درمان APL از ATRA و به تازگی از آرسنیک استفاده میشود، اما با توجه به عود بیماران درمان شده با این راهکار درمانی، سعی بر آن است تا روشهای درمانی جدیدی در مورد این بیماری مورد بررسی قرار گیرد(20). همان گونه که پیشتر بیان شد، یکی از روشهای درمانی مفید، هدف قرار دادن آنزیم تلومراز با استفاده از داروهای آنتیتلومراز است. اکثر داروهای آنتیتلومراز از جمله BIBR1532 دارای فاز تاخیری هستند. این خاصیت در مورد BIBR1532 زمانی مشخص شد که برای اولین بار سلولهای تومورال رده سلولی زایا (GCT) تحت تاثیر BIBR1532 به همراه داروی ضد سرطان سیس پلاتین قرار گرفتند؛ نتایج این آزمایشها نشان دادند که برای کوتاه شدن طول تلومر به 300 روز زمان نیاز میباشد(21). به همین دلیل به نظر میرسد که داروهای آنتیتلومرازی به دلیل دارا بودن فاز تاخیری و رابطه این فاز با طول اولیه تلومر و کوتاه شدن تدریجی آن در هر تقسیم سلولی (حدود bp200-50 در هر تقسیم سلولی)، بر روی سلولهایی که طول تلومر کوتاهتری دارند میتوانند مؤثرتر عمل کنند. طی مطالعهای که اخیراً در آزمایشگاه ما انجام شد، مشخص گشت که کوتاهی طول تلومر و بالا بودن فعالیت تلومراز، دو مشخصه مهم سلولهای سرطانی APL میباشد(13). هم چنین نتایج حاصل از این تحقیق بیانگر ارتباط بین این دو ویژگی با میزان پیشرفت و عود بیماری نیز بود. در این راستا و با توجه به نقش مهم آنزیم تلومراز در پیشرفت و عود این بیماری و هم چنین کوتاهی طول تلومر این بیماران، هدف قرار دادن آنزیم تلومراز با داروهای آنتی تلومراز هم چون BIBR1532 میتواند روشی مفید و مؤثر در درمان این بیماران باشد.
برای بررسی اثر بخشی درمان آنتی تلومراز در APL، سلولهای NB4در مجاورت دوزهای مختلف BIBR1532 تیمار شدند. پس از انجام آزمایشها، مشخص گردید که دوزهای بالای دارو(≤30 میکرومولار) طی مدت کوتاه قادرند بر روی درصد زندهمانی و هم چنین قدرت تکثیر سلولها تاثیر مهاری قابل ملاحظهای بگذارند؛ این در حالی است که دوز پایین دارو(µM10) طی گذشت مدت زمان کوتاه قادر به مهار رشد و کاهش درصد زندهمانی سلولهای NB4 نمیباشد. در مطالعه ال- دالی و همکارانش نیز نتایج به همین ترتیب بود، به طوری که آنها به بررسی اثر BIBR1532 بر روی ردههای AML و CLL پرداختند و نشان دادند که BIBR1532 در غلظتهای µM80-30 دارای اثر سایتوتوکسیک مستقیم و کوتاه مدت میباشد(22). هم چنین مشخص شده است که بیماران مبتلا به AML با سطح بالای بیان hTERT در زمان تشخیص، دوره بهبودی پایینتر، دوره بقای کوتاهتر و هم چنین افزایش احتمال عود بیماری داشتهاند(23). با در نظر گرفتن این مطلب به نظر میرسد که بررسی کمی mRNA ژن hTERT میتواند در بررسی پیش آگهی و کنترل
بیماری مؤثر باشد. هم چنین هدف قرار دادن بیان hTERT میتواند راهی مؤثر در زمینه درمان بیماران مبتلا باشد. نتایج حاصل از این مطالعه نشان میدهد که BIBR1532 به طور وابسته به دوز و زمان قادر به کاهش رونویسی ژن hTERT است.
در نتیجه، با مطالعه انجام شده مشخص شد که تیمار سلولهای NB4 با داروی BIBR1523 به طور وابسته به دوز و زمان با سرکوب رونویسی از ژن hTERT ، مهار تکثیر و ساخت DNA و هم چنین کاهش درصد زندهمانی سلولها همراه است. با توجه به طول تلومر کوتاه و فعالیت بالای آنزیم تلومراز در بیماران APL و هم چنین اثربخشی دارویBIBR1532 در القای اثر آنتی پرولیفراتیو در رده سلولی NB4 ، میتوان درمانهای مبتنی بر استراتژی آنتیتلومرازی را به عنوان راهکار درمانی مناسب در بیماران APL مد نظر قرار داد.
نتیجهگیری
با توجه به طول تلومر کوتاه و فعالیت بالای آنزیم تلومراز در بیماران APL و هم چنین اثر بخشی داروی BIBR1532 در القای اثر آنتی پرولیفراتیو در رده سلولی NB4 ، میتوان درمانهای مبتنی بر استراتژی آنتیتلومرازی را به عنوان راهکار درمانی مناسب در بیماران APL ، مد نظر قرار داد.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





