جلد 10، شماره 3 - ( پاييز 1392 )
جلد 10 شماره 3 صفحات 230-222 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Oubari F, Nikougoftar Zarif M, Amirizadeh N, Shaiegan M, Atarodi K, Nakhlestani M, et al . Isolation and expansion of Mesenchymal Stem Cells from placenta. bloodj 2013; 10 (3) :222-230
URL: http://bloodjournal.ir/article-1-791-fa.html
URL: http://bloodjournal.ir/article-1-791-fa.html
عوبری فرهاد، نیکوگفتار ظریف مهین، امیریزاده ناصر، شایگان مژگان، عطاردی کامران، نخلستانی مژده، و همکاران.. جداسازی و تکثیر سلولهای بنیادی مزانشیمی از جفت. فصلنامه پژوهشی خون. 1392; 10 (3) :222-230
فرهاد عوبری 
 ، مهین نیکوگفتار ظریف*
، مهین نیکوگفتار ظریف* 
 ، ناصر امیریزاده
، ناصر امیریزاده 
 ، مژگان شایگان
، مژگان شایگان 
 ، کامران عطاردی
، کامران عطاردی 
 ، مژده نخلستانی
، مژده نخلستانی 
 ، معصومه میرزا مرادی
، معصومه میرزا مرادی 
 ، راضیه فدایی
، راضیه فدایی 
 ، خدیجه گلزاده
، خدیجه گلزاده 


 ، مهین نیکوگفتار ظریف*
، مهین نیکوگفتار ظریف* 
 ، ناصر امیریزاده
، ناصر امیریزاده 
 ، مژگان شایگان
، مژگان شایگان 
 ، کامران عطاردی
، کامران عطاردی 
 ، مژده نخلستانی
، مژده نخلستانی 
 ، معصومه میرزا مرادی
، معصومه میرزا مرادی 
 ، راضیه فدایی
، راضیه فدایی 
 ، خدیجه گلزاده
، خدیجه گلزاده 

استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
متن کامل [PDF 579 kb]
(4268 دریافت)
| چکیده (HTML) (13267 مشاهده)
مقدمه
در حدود 130 سال پیش، پاتولوژیستی آلمانی به نام کوهنیم گزارش داد که در مغز استخوان، سلولهایی وجود دارند که نقش بسیار مهمی در فرآیند ترمیم بافتهای محیطی بازی میکنند. متعاقب آن در سال 1976، فرایداستین و همکارانش سلولهایی شبه فیبروبلاستی را از مغز استخوان جدا کردند که در شرایط in vitro توان کلنیزایی و تبدیل به سلولهای آدیپوسیتی، کندروسیتی، میوسیتی و هم چنین استئوسیتی را داشتند و به همین دلیل نام سلولهای بنیادی مزانشیمی (MSCs) را به آنها دادند. سلولهای بنیادی مزانشیمی در حدود 4-10 تا 5-10 از سلولهای مغز استخوان را تشکیل میدهند. در مدلهای تجربی دیده شده است که این سلولها با تولید انواع فاکتورهای بیولوژیک، توان اصلاح بافتی، رگزایی، تکامل ساختار مغز استخوان و تاثیر بر خونسازی را دارند(1). سلولهای بنیادی مزانشیمی علاوه بر ترشح فاکتورهای محلول، از طریق اتصالات سلولی و همچنین تولید لیپیدهای تنظیمکننده عصبی نیز ایفای نقش میکنند(2). چنانچه چامبیلن نشان داد، بیان سطحی مولکول SDF1 بر روی غشای این سلولها، موجب اتصال آنها به سلولهای حامل CXCR4 که لیگاند SDF1 است، مثل سلولهای بنیادی خونساز شده و لذا نقش بسیار مهمی نیز در پایداری و نگهداری سلولهای بنیادی خونساز به عهده دارند. این اتصالات موجب ابقای سلولهای MSC در محل آسیب به واسطه حضور سلولهای حاوی لیگاند آن نیز میشوند(3).
در سال 1980، سیمونز و همکارانش با استفاده از آنتیبادیهای STOR1 ، سلولهای MSC را از مغز استخوان جدا کردند. سلولهای جدا شده به این روش، توانایی ساخت کلنی و همچنین تمایز به سلولهای مزودرمی را داشتند، مطالعههای متعدد بر روی جداسازی این سلولها موجب شناسایی فنوتیپ آنها شد. سلولهای MSC شاخصهای سطحی CD24 ، CD44 ، CD73 ، CD105 ، CD166 ، CD90 ، MHC-I را بیان کرده و از نظر بیان CD34 ، CD45 ، CD14 ، MHC-II منفی هستند. از آن جا که استفاده از مغز استخوان به عنوان منبع MSC ها بسیار مشکل و در بسیاری موارد غیر اخلاقی است، توجه محققین به استفاده از منابع جایگزین جلب شده و گزارشهای بسیاری در مورد حضور این سلولها در بافتهای مختلف ارایه شده است؛ از قبیل بافتهای عضلانی، پوست، ترابکولار استخوان، بافتهای چربی، پری استیوم، خون بند ناف و غشای سینوویال و هم چنین در بافتهای جنینی شامل آمنیون، ژل وارتون، بند ناف و جفت(5، 4، 1). به دلیل این که این بافتها پس از زایمان نوزاد دور ریخته میشوند و استفاده از آنها برای مادر و نوزاد هیچ گونه خطری به همراه ندارد، به علاوه ظرفیت تکثیر و تمایز این سلولها به دلیل منشا جنینی آنها، بیشتر است، لذا اخیراً توجه به این منابع بسیار زیاد شده است. از طرف دیگر نقش بسیار ارزنده MSC ها به عنوان یک بستر تغذیهکننده(Feeder) مناسب جهت تکثیر سلولهای بنیادی خونساز به منظور پیوند، توجه بیشتر محققین را جلب کرده است (8-6). سلولهای MSC با برقراری ارتباطات سلولی پایدار با سلولهای بنیادی خونساز، زمینه تکثیر با حداقل تمایز این سلولها را فراهم آورده و در مواردی که بیمار کاندید پیوند، به تعداد بیشتری سلول بنیادی خونساز نیاز دارد، با تکثیر آنها بر روی بستر MSC ، مشکل کمبود تعداد سلول را رفع میکنند(10، 9). به این ترتیب با توجه به مطالب ارایه شده و اهمیت و نقش بسیار مهم این سلولها در طب ترمیمی و پیوند، در این تحقیق اقدام به جداسازی سلولهای بنیادی مزانشیمی از بافت جفت نمودیم، با این هدف که به اثبات روش جداسازی این سلولها پرداخته و هویت سلولهای مزانشیمی جدا شده از جفت را از طریق بررسی توانایی تمایز این سلولها و ایمونوفنوتایپ آنها مشخص نماییم(11). ضمناً زمینه استفاده از این سلولها را در سلول درمانی و همچنین به عنوان مهمترین مساله، امکان تکثیر سلولهای HSC جدا شده از خون بند ناف را بر روی بستر مزانشیمی جدا شده از جفت مربوط به همان اهدا کننده با MHC سازگار فراهم نماییم.
مواد و روشها
جداسازی سلولهای بنیادی مزانشیمی از بافت جفت:
مطالعـه انجام شده از نوع تجربی بود. بافـت جفـت در
شرایـط کامـلاً استریـل در اطاق عمل و پس از زایمان به روش سزارین انتخابی، از 3 مادر که فرم رضایتنامه کتبی را امضا کرده بودند، جمعآوری شد. سپس بافت دسیژوا از آن جدا شده و پس از شستشوی مکرر در بافر نمکی فسفات(PBS)، به محیط انتقالی که شامل PBS به همراه 50 واحد در میلیلیتر پنیسیلین و 50 میلیگرم در میلیلیتر استرپتومایسین بود، منتقل و به آزمایشگاه تحقیقات بانک خون بند ناف سازمان انتقال خون ارسال شد.
در زیر هود لامینار و در یک پلیت 10 میلیمتری، کلیه عروق و لختههای خون از بافت جفت جدا شده و سپس به روش مکانیکی به قطعات کوچک تقسیم و در PBS در دور RPM 1250 به مدت 5 دقیقه شستشو شد، به رسوب حاصله 30 میلیلیتر از محلول کلاژناز(آمریکا، سیگما) با غلظت 1 میلیگرم در میلیلیتر اضافه شده و در انکوباتور 37 درجه سانتیگراد و 5% CO2 به مدت 1 ساعت انکوبه شد.
سوسپانسیون حاصله سپس در همان شرایط قبل سانتریفوژ شده، به رسوب سلولی، محلول تریپسین 25/0% که حاوی 1 میلیمولار EDTA بود(آمریکا، سیگما) اضافه شد و در انکوباتور با شرایط قبلی به مدت 30 دقیقه انکوبه شد. سپس رسوب سلول دو بار شستشو و سانتریفوژ شده و از فیلتر با منافذ 70 میکرون عبور داده شد. به منظور لیز RBCهای باقیمانده در نمونه، 2 میلیلیتر از محلول هایپوتون کلرید آمونیوم(آمریکا، فارمین ژن) به نمونه افزوده و پس از 10 دقیقه مجدداً شستشو شد. رسوب سلولی حاصله که شامل سلولهای جدا شده از بافت جفت بود، به فلاسک 75T منتقل و در محیط DMEM (Dulbecco's Modified Eagle Medium-LG ، آمریکا، گیبکو، Low Glucose) همراه با 10% FBS (آمریکا، گیبکو) کشت داده شدند. سلولهای مزانشیمی در مخلوط سلولی به کف فلاسک متصل شده و دوکی شکل میشوند. پس از 24 ساعت با تعویض محیط کشت، سلولهای معلق(غیر مزانشیمی) از محیط دور شده و سلولهای مزانشیمال با اتصال به کف فلاسک، پس از چند روز تشکیل کلنی داده و تکثیر میشوند. هنگامی که بیش از 90% از سطح فلاسک توسط سلولها پوشیده شد، با استفاده از محلول تریپسین 25/0% که حاوی 1 میلیمولار EDTA بود، سلولها از فلاسک جدا شده و تعداد 105 * 5 سلول مجدداً در فلاسک T75 جدیدی کشت شدند و محیط کشت آنها نیز 4 روز یک بار تعویض شد. به این ترتیب پاساژهای متوالی از این سلولها تهیه شد و نمونهای از هر پاساژ، پس از افزودن محلول DMSO به همراه دکستران DEX40 (آلمان، کرایو شور) به نسبت 4 به 1 ، در ازت مایع فریز شد تا در شرایطی که نیاز به بررسی مجدد بر روی یک نمونه باشد، منبع سلولی در دسترس باشد.
بررسی میزان تکثیر سلولی:
جهت ارزیابی توان تکثیر سلولهای جدا شده، تعداد 104 سلول بنیادی مزانشیمی جدا شده از بافت جفت در هر بار پاساژ سلولی، در چاهکهای پلیت 6 خانه به صورت 3 بار تکرار کشت شد و در هر بار پاساژ پس از جداسازی سلولی، ضمن برآورد درصد سلولهای زنده، تعداد آنها نیز با استفاده از لام نئوبار و شمارشگر الکترونیک(ژاپن، سیسمکس) در موقعیت کاپیلاری شمارش شد. درصد سلولهای زنده، با تهیه سوسپانسیون سلولی به صورت ترکیب هم حجم از محلول تریپان بلو 4/0% (کانادا، استم سل تکنولوژی) و سوسپانسیون سلول با شمارش 100 سلول در میکرولیتر، محاسبه شد.
بررسی میزان توان کلنیزایی سلولی:
تعداد 1500 سلول بنیادی مزانشیمی جدا شده از بافت جفت مربوط به پاساژ 3 و7 با 3 میلیلیتر از محیط کشت نیمه جامد حاوی FGF-β (کانادا، استم سل تکنولوژی) مخلوط و مقدار 1 میلیلیتر از مخلوط حاصل به هر یک از دو پلیت 35 میلیمتری، منتقل شد. به این ترتیب در هر پلیت 500 سلول وجود داشت. پلیتها در انکوباتور 37 درجه سانتیگراد و 5% CO2 به مدت 2 هفته کشت شدند. پس از زمان قید شده، تعداد کلنیها شمارش و ثبت شد.
تایید هویت سلولی سلولهای بنیادی مزانشیمی جدا شده از بافت جفت:
الف: ایمونوفنوتایپ سلولی:
به منظور تعیین هویت فنوتیپی سلولهـای جـدا شده از
بافت جفت، سلولها از پاساژ 3 و 7 تریپسینه و از فلاسک
جدا شده و در بافر فسفات شستشو شدند. سوسپانسیون سلولی با شمارش 1000 سلول در هر میکرولیتر تهیه شد. از سوسپانسیون مذکور، مقدار 50 میکرولیتر و از هر یک از آنتیبادیهای مونوکلونال کنژوگه به رنگهای فلورسنت نیز مقدار 5 میکرولیتر به هر لوله افزوده شد. به موازات، سلولها با آنتیبادی ایزوتایپ کنترل نیز مجاور شدند. سپس لولهها 30 دقیقه در حرارت یخچال انکوبه شده و با افزودن 50 میکرولیتر از فیکساتیو پارافرمالدئید 1% (آمریکا، سیگما) با دستگاه فلوسایتومتری Patrec CY-Flow Space (آلمان، پارتک) آنالیز شدند. لیست آنتیبادیها شامل : CD44-FITC ، CD29-PE ، CD90-FITC ، CD73-PE ، CD105-FITC ، CD166-PE ، CD45-FITC ، IgG1-FITC/IgG1-PE (آمریکا، فارمین ژن) و CD34-PE (از کمپانی داکو، دانمارک) بودند و در هر آنالیز 5000 سلول بررسی شدند.
ب: بررسی توانایی تمایز استئوسیتی و آدیپوسیتی سلولی:
به منظور بررسی توان تمایز سلولهای بنیادی مزانشیمی جدا شده از بافت جفت، ابتدا سطح چاهکهای پلیت 6 خانه با محلول کلاژن 4% (کانادا، استم سل تکنولوژی) آغشته شده و پس از دو بار شستشو با بافر فسفات، در هر چاهک 105 * 4 سلول از پاساژ 3 و 7 در محیط DMED-LG همراه با FBS 10% کشت شدند. هنگامی که 80% از سطح چاهکها از سلول پوشیده شد، محیط کشت با محیط تمایزی استئوسیتی و آدیپوسیتی تعویض شد. به موازات نمونهای نیز در محیط DMEM-LG جهت کنترل کشت شد.
محیط تمایز استئوسیتی(ایران، ایده زیست نوترکیب) شامل محیط DMEM-HG(Dulbecco's Modified Eagle Medium- ، گیبکو، High Glucose) همراه با 10%FBS و 10 میلیمولار در لیتر دگزامتازون، 10 نانو مولار در لیتر ویتامین D3 و 50 میلیگرم در میلیلیتر اسید آسکوربیک بود. محیط تمایز آدیپوسیتی(ایران، ایده زیست نوترکیب) شامل DMED-HG به همراه 10% FBS و1 میکرومــولار در لیتـر دگزامتازون، 10 میکرومولار در لیتر انسولین و 200 میکرومولار در لیتر ایندومتاسین بود. محیط کشت تمایزی هر 3 روز یک بار تعویض شد. پس از 3 هفته، مورفولوژی سلولی مورد بررسی قرار گرفت. به این ترتیب جهت ارزیابی تمایز القا شده، سلولها به منظور رنگآمیزی اختصاصی آماده شدند.
رنگآمیزی Oil Red-O به منظور ارزیابی تمایز آدیپوسیتی:
پس از حذف محیط کشت تمایزی از چاهکها، سلولها در بافر نمکی فسفات شسته شده و به منظور تثبیت سلولی، از محلول پارافرمالدئید 10% در بافر فسفات به مدت 20 دقیقه در حرارت اطاق استفاده شد. سپس سلولها در محلول 60% ایزوپروپانول شستشو و سپس به مدت 10 دقیقه در محلول رنگ که از ترکیب 6 حجم محلول رنگی 5/0% Oil Red-O (آمریکا، سیگما) در ایزوپروپانول و 4 حجم آب مقطر به دست آمده بود، قرار گرفت. واکنش رنگ توسط میکروسکوپ اینورت بررسی شد.
رنگآمیزی آلیزارین رد به منظور ارزیابی تمایز استئوسیتی:
به منظور تثبیت سلولی از محلول اتانول 70% به مدت 10 دقیقه، پس از حذف محیط کشت تمایزی از چاهکها، استفاده شد. سلولها در بافر نمکی فسفات شسته شده و به مدت 20 دقیقه در حرارت اتاق قرار گرفتند. سپس سلولها در محلول 60% ایزوپروپانول شستشو و در مرحله بعد به مدت 10 دقیقه در محلول رنگی آلیزارین رد 2% (آمریکا، سیگما) در بافر فسفات قرار گرفتند. واکنش رنگ توسط میکروسکوپ اینورت بررسی شد.
یافتهها
بررسی میزان رشد سلولی:
سلولهای جدا شده از جفت پس از کشت در پاساژهای ابتدایی با سرعت کمتر و سپس با سرعت زیاد تکثیر شدند و پس از نزدیـک به 20 روز به مرحله تکثیر تصاعدی رسیدند(نمودار 1). روند تکثیر در این سلولها تا حدود روز 90 تصاعدی بــوده و سپـس کندتـر و در یـک نمونه رو به کاهش رفت.

نمودار 1: میزان تکثیر سلولهای استرومایی مزانشیمال جدا شده از بافت جفت در in vitro

نمودار 2: توان کلنیزایی سلولهای بنیادی مزانشیمی جدا شده از بافت جفت در In vitro پس از 10 روز کشت در محیط نیمه جامد
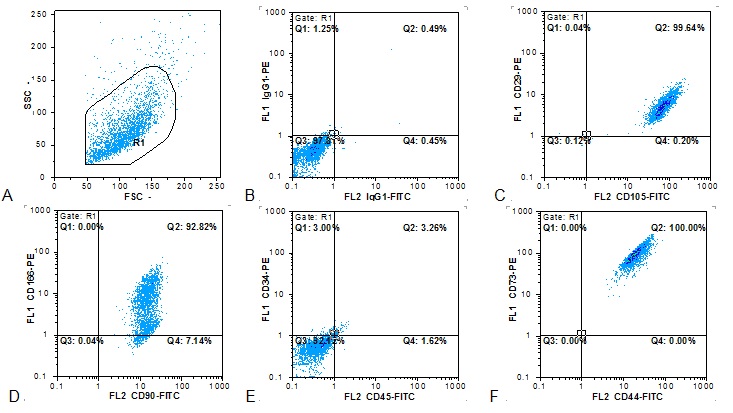
شکل 2: بررسی خصوصیات ایمونوفنوتایپی سلولهای بنیادی مزانشیمی جدا شده از بافت جفت، A : پراکندگی سایز و گرانولیتی سلولی، B: ایزوتایپ کنترل، C, D, E, F : واکنش آنتیبادیهای اختصاصی
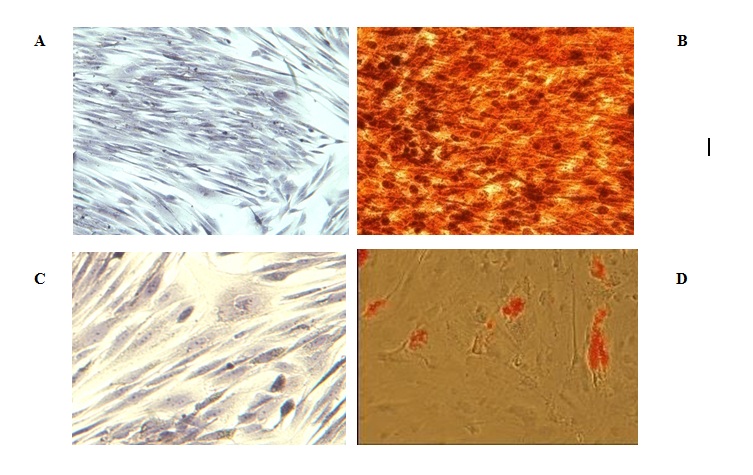
شکل 3: رنگآمیزی اختصاصی بر روی سلولهای تحت کشت با محیطهای تمایزی و کنترل، A,B : رنگآمیزی Alizarian Red بر روی سلولها A : در محیط کنترل و B: در محیط تمایز استئوسیتی، C,D: رنگآمیزی Oil Red-Oبر روی سلولها C : در محیط کنترل و D : در محیط تمایز آدیپوسیتی(بزرگنمایی 200 x ).
بررسی توان تمایز سلولی:
سلولهای جدا شده از پاساژ 3 و 7 که در محیط تمایز استئوسیتی قرار گرفته بودند، پس از 10 روز تغییرات مورفولوژی را نشان داده و رسوب کلسیم در سطح سلول که حاکی از مینرالیزه شدن بود، باعث ایجاد واکنش رنگی قرمز در رنگآمیزی آلیزارین رد شد.
سلولهایی که تحت تاثیر تمایز آدیپوسیتی قرار گرفته بودند، از شکل دوکی خارج و به شکل کروی در آمده و حاوی واکوئولهای چربی بودند، که در رنگآمیزی Oil Red-O واکنش مثبت نشان دادند(شکل 3).
بحث
امروزه سلولهای بنیادی مزانشیمی به عنوان منبع سلولی با ارزشی در سلولدرمانی شناخته شدهاند. کاربرد گسترده این سلولها به دلیل ظرفیت بالای تکثیر و خود نوسازی، تمایز به سایر ردههای مزانشیمی و مهار واکنشهای ایمنی میباشد(5). هم چنین عدم تشکیل تراتوما پس از پیوند در مدلهای حیوانی، علت دیگری است که این سلولها را مورد توجه قرار داده است. رایجترین منبع دسترسی به سلولهای بنیادی مزانشیمال تا مدتها مغز استخوان بود. در سالهای اخیر مقالات متعددی چاپ شده و حضور این سلولها را در بسیاری از بافتهای بالغ و جنینی اثبات کردهاند. از آن جا که سلولهای بنیادی مزانشیمی جدا شده از بافتهای جنینی که بعد از زایمان به عنوان زباله بیولوژیک حذف میشوند، فنوتیپی شبیه به سلولهای مزانشیمی مغز استخوان دارند، تلاشهای بسیاری در جایگزینی آنها آغاز شده است(12). در این مطالعه نیز ما موفق شدیم با استفاده از روش هضم آنزیمی، سلولهای بنیادی مزانشیمی را از بافت جفتی که بخش دسیژوآی آن حذف شده، جدا کرده و تکثیر دهیم. با توجه به این که در گزارشهای قبلی جداسازی سلولهای بنیادی مزانشیمی از بافت جفت، متعاقب به کارگیری آنزیمهای متعدد انجام شده و هم چنین مراحل جداسازی نیـز طولانـی بـوده اسـت، ایـن گـزارش روشی سریعتر و
مقرون به صرفهتر را در دسترس قرار میدهد(15-12).
سلـولهـای مزانشیمـی جـدا شـده از بافـت پلاسنتـا،
مورفولوژی شبه فیبروبلاستی داشته و تا قبل از پاساژ دوم سرعت رشد کمتری داشتند. پس از پاساژ دوم، سلولها وارد فاز رشد تصاعدی شده و در نهایت در پاساژهای 13 تا 15 نیز مجدداً سرعت تکثیر کمتری پیدا کردند، میانگین روند تکثیر سلولها در این مطالعه با نتیجه تحقیق کانماتسو و همکارانش تطابق داشته، در حالی که در گزارش دیگری میزان تکثیر سلولی در پاساژ 1 ، 10 و 20 یکسان گزارش شده است(14، 13). به هر حال این مطلب که قدرت تکثیر سلولهای مزانشیمی جدا شده از جفت به مراتب بیشتر از سلولهای جدا شده از مغز استخوان است، در گزارشهای متعدد آمده است(15). توان کلنیزایی سلولها در این مطالعه مشابه با مطالعه گروه کانماتسو و همکارانش بود. توجه به سیر تکثیر و کلنیزایی سلولهای مزانشیمی از آن جهت حایز اهمیت است که در کاربردهای مختلف بالینی، استفاده از این سلولها میبایست با نگرش به تعداد آنها در زمان پیوند انجام شود. سلولهای بنیادی مزانشیمی توسط پروفایلی از آنتیبادیها شناسایی میشوند، که در این مطالعه نیز بیان بالای این شاخصها نشان داده شده است، در حالی که از جهت بیان مارکرهای سلولهای خونساز(CD34 ، CD45) کاملاً منفی بودند که این مساله حکایت از خلوص سلولهای جدا شده دارد.
سنجشهای In vitro ثابت کرد که سلولهای جدا شده خاصیت چند ظرفیتی سلولهای بنیادی مزانشیمی را داشته و پتانسیل تمایز استئوسیتی در آنها به مراتب بالاست و به همین جهت در مواردی که هدف از کشت آنها تمایز به ردههای دیگر است، توصیه میشود که تا قبل از این که تمام سطح ظرف کشت توسط سلولها اشغال شود، القای تمایز انجام شود، چرا که تراکم سلولی، سلولها را به طرف تمایز استئوسیتی هدایت میکند. چنانچه در نتایج اشاره شد، پتانسیل تمایز آدیپوسیتی سلولهای بنیادی مزانشیمی جفت کمتر بود، این مساله در توافق با نتیجه گزارشهای بارلو است که اظهار کرده است این سلولها نسبت به سلولهای مزانشیمی جدا شده از مغز استخوان و بافت چربی، ظرفیت کمتری در تبدیل به سلولهای آدیپوسیتی دارند(15). در هر حال با توجه به روند تکثیر سلولها، بررسی توان تمایز آنها در این تحقیق بر روی سلولهای حاصل از پاساژ 3 و 7 انجام و حفظ خاصیت تکثیر بالا و تمایز آنها در این محدوده از منحنی رشد کاملاً تایید شد. به هر حال با وجود مطالعههای بسیار گسترده، به دلیل استفاده متنوع از سلولهای مزانشیمی در سلول درمانی، مطالعه و بررسیهای بیشتر بر روی بیولوژی سلولهای مذکور توصیه میشود.
نتیجهگیری
در مجموع این مطالعه نشان داد که سلولهای بنیادی مزانشیمی را میتوان از بافت جفت تنها با استفاده از یک آنزیم، در مدت زمان کوتاهی جدا کرده و در محیط کشتی که تنها با FBS حمایت میشود تکثیر کرد، بدون این که
تغییری در خصوصیات کلنیزایی و تمایزی آنها رخ دهد. هم چنین در دسترس بودن این منبع، عدم آسیب برای اهداکننده بافت و تعداد زیاد سلول، زمینه استفاده درمانی از آن را گسترش خواهد داد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد هماتولوژی مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدینوسیله نویسندگان مقاله مراتب تشکر و قدردانی خود را از زحمات کارکنان بیمارستان میلاد به دلیل همکاری در انجام تحقیق، ابراز میدارند.
متن کامل: (4522 مشاهده)
جداسازی و تکثیر سلولهای بنیادی مزانشیمی از جفت
فرهاد عوبری1، مهین نیکوگفتار ظریف2، ناصر امیریزاده3، مژگان شایگان4، کامران عطاردی5، مژده نخلستانی6،
معصومه میرزا مرادی7، راضیه فدایی8، خدیجه گلزاده9
چکیده
سابقه و هدف
سلولهای بنیادی مزانشیمی، سلولهای شبه فیبروبلاستی با توان تکثیر، کلنیزایی و تبدیل به سلولهای ردههای مزانشیمی هستند، که در سلول درمانی کاربرد گستردهای پیدا کردهاند. این سلولها در بعضی بافتهای بالغ و جنینی حضور داشته و منبع اصلی دسترسی به آنها مغز استخوان است. در این مطالعه جهت دسترسی آسانتر و کم خطرتر به سلولهای مذکور، به بررسی و تثبیت روش جداسازی این سلولها از بافت جفت پرداخته و سپس خصوصیات آنها را مورد بررسی قرار دادیم.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود و بر روی سه نمونه جفت پس از زایمان، از مادرانی که رضایتنامه کتبی دادند، انجام شد. سلولها پس از جداسازی از بافت جفت، کشت داده شدند و در پاساژهای 3 و7 خصوصیات آنها از نظر میزان تکثیر، توان کلنیزایی، ایمونوفنوتایپ و تمایز سلولی بررسی شد.
یافتهها
نتایج به دست آمده حکایت از توان بالای تکثیر و کلنیزایی سلولهای مزانشیمی جدا شده از جفت داشت. بررسی ایمونوفنوتایپ سلولی، علاوه بر تایید خلوص بیش از 95% ، نشان داد که سلولهای مذکور با بیان شاخصهای سطحی اختصاصی، شبیه به سلولهای بنیادی مزانشیمی مغز استخوان هستند. همچنین پتانسیل تمایز به سلولهای استئوسیتی و آدیپوسیتی را نیز دارند.
نتیجه گیری
در این مطالعه سلولهای بنیادی مزانشیمی از بافت جفت جدا شده و در محیط کشت اختصاصی تکثیر شدند، بدون این که تغییری در خصوصیات کلنیزایی و تمایزی آنها رخ دهد. به این ترتیب میتوان از این منبع سلولی در مصارف مختلف سلول درمانی استفاده کرد.
کلمات کلیدی: سلولهای بنیادی مزانشیمی، جفت، سلول درمانی
تاریخ دریافت : 9 /3 /91
تاریخ پذیرش : 10/10/91
1- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسؤول: PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- PhD خونشناسی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- پزشک عمومی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
7- متخصص زنان و زایمان ـ استادیار دانشگاه علوم پزشکی شهید بهشتی ـ بیمارستان مهدیه ـ تهران ـ ایران
8- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
9- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
فرهاد عوبری1، مهین نیکوگفتار ظریف2، ناصر امیریزاده3، مژگان شایگان4، کامران عطاردی5، مژده نخلستانی6،
معصومه میرزا مرادی7، راضیه فدایی8، خدیجه گلزاده9
چکیده
سابقه و هدف
سلولهای بنیادی مزانشیمی، سلولهای شبه فیبروبلاستی با توان تکثیر، کلنیزایی و تبدیل به سلولهای ردههای مزانشیمی هستند، که در سلول درمانی کاربرد گستردهای پیدا کردهاند. این سلولها در بعضی بافتهای بالغ و جنینی حضور داشته و منبع اصلی دسترسی به آنها مغز استخوان است. در این مطالعه جهت دسترسی آسانتر و کم خطرتر به سلولهای مذکور، به بررسی و تثبیت روش جداسازی این سلولها از بافت جفت پرداخته و سپس خصوصیات آنها را مورد بررسی قرار دادیم.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود و بر روی سه نمونه جفت پس از زایمان، از مادرانی که رضایتنامه کتبی دادند، انجام شد. سلولها پس از جداسازی از بافت جفت، کشت داده شدند و در پاساژهای 3 و7 خصوصیات آنها از نظر میزان تکثیر، توان کلنیزایی، ایمونوفنوتایپ و تمایز سلولی بررسی شد.
یافتهها
نتایج به دست آمده حکایت از توان بالای تکثیر و کلنیزایی سلولهای مزانشیمی جدا شده از جفت داشت. بررسی ایمونوفنوتایپ سلولی، علاوه بر تایید خلوص بیش از 95% ، نشان داد که سلولهای مذکور با بیان شاخصهای سطحی اختصاصی، شبیه به سلولهای بنیادی مزانشیمی مغز استخوان هستند. همچنین پتانسیل تمایز به سلولهای استئوسیتی و آدیپوسیتی را نیز دارند.
نتیجه گیری
در این مطالعه سلولهای بنیادی مزانشیمی از بافت جفت جدا شده و در محیط کشت اختصاصی تکثیر شدند، بدون این که تغییری در خصوصیات کلنیزایی و تمایزی آنها رخ دهد. به این ترتیب میتوان از این منبع سلولی در مصارف مختلف سلول درمانی استفاده کرد.
کلمات کلیدی: سلولهای بنیادی مزانشیمی، جفت، سلول درمانی
تاریخ دریافت : 9 /3 /91
تاریخ پذیرش : 10/10/91
1- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسؤول: PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- PhD خونشناسی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- پزشک عمومی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
7- متخصص زنان و زایمان ـ استادیار دانشگاه علوم پزشکی شهید بهشتی ـ بیمارستان مهدیه ـ تهران ـ ایران
8- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
9- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
در حدود 130 سال پیش، پاتولوژیستی آلمانی به نام کوهنیم گزارش داد که در مغز استخوان، سلولهایی وجود دارند که نقش بسیار مهمی در فرآیند ترمیم بافتهای محیطی بازی میکنند. متعاقب آن در سال 1976، فرایداستین و همکارانش سلولهایی شبه فیبروبلاستی را از مغز استخوان جدا کردند که در شرایط in vitro توان کلنیزایی و تبدیل به سلولهای آدیپوسیتی، کندروسیتی، میوسیتی و هم چنین استئوسیتی را داشتند و به همین دلیل نام سلولهای بنیادی مزانشیمی (MSCs) را به آنها دادند. سلولهای بنیادی مزانشیمی در حدود 4-10 تا 5-10 از سلولهای مغز استخوان را تشکیل میدهند. در مدلهای تجربی دیده شده است که این سلولها با تولید انواع فاکتورهای بیولوژیک، توان اصلاح بافتی، رگزایی، تکامل ساختار مغز استخوان و تاثیر بر خونسازی را دارند(1). سلولهای بنیادی مزانشیمی علاوه بر ترشح فاکتورهای محلول، از طریق اتصالات سلولی و همچنین تولید لیپیدهای تنظیمکننده عصبی نیز ایفای نقش میکنند(2). چنانچه چامبیلن نشان داد، بیان سطحی مولکول SDF1 بر روی غشای این سلولها، موجب اتصال آنها به سلولهای حامل CXCR4 که لیگاند SDF1 است، مثل سلولهای بنیادی خونساز شده و لذا نقش بسیار مهمی نیز در پایداری و نگهداری سلولهای بنیادی خونساز به عهده دارند. این اتصالات موجب ابقای سلولهای MSC در محل آسیب به واسطه حضور سلولهای حاوی لیگاند آن نیز میشوند(3).
در سال 1980، سیمونز و همکارانش با استفاده از آنتیبادیهای STOR1 ، سلولهای MSC را از مغز استخوان جدا کردند. سلولهای جدا شده به این روش، توانایی ساخت کلنی و همچنین تمایز به سلولهای مزودرمی را داشتند، مطالعههای متعدد بر روی جداسازی این سلولها موجب شناسایی فنوتیپ آنها شد. سلولهای MSC شاخصهای سطحی CD24 ، CD44 ، CD73 ، CD105 ، CD166 ، CD90 ، MHC-I را بیان کرده و از نظر بیان CD34 ، CD45 ، CD14 ، MHC-II منفی هستند. از آن جا که استفاده از مغز استخوان به عنوان منبع MSC ها بسیار مشکل و در بسیاری موارد غیر اخلاقی است، توجه محققین به استفاده از منابع جایگزین جلب شده و گزارشهای بسیاری در مورد حضور این سلولها در بافتهای مختلف ارایه شده است؛ از قبیل بافتهای عضلانی، پوست، ترابکولار استخوان، بافتهای چربی، پری استیوم، خون بند ناف و غشای سینوویال و هم چنین در بافتهای جنینی شامل آمنیون، ژل وارتون، بند ناف و جفت(5، 4، 1). به دلیل این که این بافتها پس از زایمان نوزاد دور ریخته میشوند و استفاده از آنها برای مادر و نوزاد هیچ گونه خطری به همراه ندارد، به علاوه ظرفیت تکثیر و تمایز این سلولها به دلیل منشا جنینی آنها، بیشتر است، لذا اخیراً توجه به این منابع بسیار زیاد شده است. از طرف دیگر نقش بسیار ارزنده MSC ها به عنوان یک بستر تغذیهکننده(Feeder) مناسب جهت تکثیر سلولهای بنیادی خونساز به منظور پیوند، توجه بیشتر محققین را جلب کرده است (8-6). سلولهای MSC با برقراری ارتباطات سلولی پایدار با سلولهای بنیادی خونساز، زمینه تکثیر با حداقل تمایز این سلولها را فراهم آورده و در مواردی که بیمار کاندید پیوند، به تعداد بیشتری سلول بنیادی خونساز نیاز دارد، با تکثیر آنها بر روی بستر MSC ، مشکل کمبود تعداد سلول را رفع میکنند(10، 9). به این ترتیب با توجه به مطالب ارایه شده و اهمیت و نقش بسیار مهم این سلولها در طب ترمیمی و پیوند، در این تحقیق اقدام به جداسازی سلولهای بنیادی مزانشیمی از بافت جفت نمودیم، با این هدف که به اثبات روش جداسازی این سلولها پرداخته و هویت سلولهای مزانشیمی جدا شده از جفت را از طریق بررسی توانایی تمایز این سلولها و ایمونوفنوتایپ آنها مشخص نماییم(11). ضمناً زمینه استفاده از این سلولها را در سلول درمانی و همچنین به عنوان مهمترین مساله، امکان تکثیر سلولهای HSC جدا شده از خون بند ناف را بر روی بستر مزانشیمی جدا شده از جفت مربوط به همان اهدا کننده با MHC سازگار فراهم نماییم.
مواد و روشها
جداسازی سلولهای بنیادی مزانشیمی از بافت جفت:
مطالعـه انجام شده از نوع تجربی بود. بافـت جفـت در
شرایـط کامـلاً استریـل در اطاق عمل و پس از زایمان به روش سزارین انتخابی، از 3 مادر که فرم رضایتنامه کتبی را امضا کرده بودند، جمعآوری شد. سپس بافت دسیژوا از آن جدا شده و پس از شستشوی مکرر در بافر نمکی فسفات(PBS)، به محیط انتقالی که شامل PBS به همراه 50 واحد در میلیلیتر پنیسیلین و 50 میلیگرم در میلیلیتر استرپتومایسین بود، منتقل و به آزمایشگاه تحقیقات بانک خون بند ناف سازمان انتقال خون ارسال شد.
در زیر هود لامینار و در یک پلیت 10 میلیمتری، کلیه عروق و لختههای خون از بافت جفت جدا شده و سپس به روش مکانیکی به قطعات کوچک تقسیم و در PBS در دور RPM 1250 به مدت 5 دقیقه شستشو شد، به رسوب حاصله 30 میلیلیتر از محلول کلاژناز(آمریکا، سیگما) با غلظت 1 میلیگرم در میلیلیتر اضافه شده و در انکوباتور 37 درجه سانتیگراد و 5% CO2 به مدت 1 ساعت انکوبه شد.
سوسپانسیون حاصله سپس در همان شرایط قبل سانتریفوژ شده، به رسوب سلولی، محلول تریپسین 25/0% که حاوی 1 میلیمولار EDTA بود(آمریکا، سیگما) اضافه شد و در انکوباتور با شرایط قبلی به مدت 30 دقیقه انکوبه شد. سپس رسوب سلول دو بار شستشو و سانتریفوژ شده و از فیلتر با منافذ 70 میکرون عبور داده شد. به منظور لیز RBCهای باقیمانده در نمونه، 2 میلیلیتر از محلول هایپوتون کلرید آمونیوم(آمریکا، فارمین ژن) به نمونه افزوده و پس از 10 دقیقه مجدداً شستشو شد. رسوب سلولی حاصله که شامل سلولهای جدا شده از بافت جفت بود، به فلاسک 75T منتقل و در محیط DMEM (Dulbecco's Modified Eagle Medium-LG ، آمریکا، گیبکو، Low Glucose) همراه با 10% FBS (آمریکا، گیبکو) کشت داده شدند. سلولهای مزانشیمی در مخلوط سلولی به کف فلاسک متصل شده و دوکی شکل میشوند. پس از 24 ساعت با تعویض محیط کشت، سلولهای معلق(غیر مزانشیمی) از محیط دور شده و سلولهای مزانشیمال با اتصال به کف فلاسک، پس از چند روز تشکیل کلنی داده و تکثیر میشوند. هنگامی که بیش از 90% از سطح فلاسک توسط سلولها پوشیده شد، با استفاده از محلول تریپسین 25/0% که حاوی 1 میلیمولار EDTA بود، سلولها از فلاسک جدا شده و تعداد 105 * 5 سلول مجدداً در فلاسک T75 جدیدی کشت شدند و محیط کشت آنها نیز 4 روز یک بار تعویض شد. به این ترتیب پاساژهای متوالی از این سلولها تهیه شد و نمونهای از هر پاساژ، پس از افزودن محلول DMSO به همراه دکستران DEX40 (آلمان، کرایو شور) به نسبت 4 به 1 ، در ازت مایع فریز شد تا در شرایطی که نیاز به بررسی مجدد بر روی یک نمونه باشد، منبع سلولی در دسترس باشد.
بررسی میزان تکثیر سلولی:
جهت ارزیابی توان تکثیر سلولهای جدا شده، تعداد 104 سلول بنیادی مزانشیمی جدا شده از بافت جفت در هر بار پاساژ سلولی، در چاهکهای پلیت 6 خانه به صورت 3 بار تکرار کشت شد و در هر بار پاساژ پس از جداسازی سلولی، ضمن برآورد درصد سلولهای زنده، تعداد آنها نیز با استفاده از لام نئوبار و شمارشگر الکترونیک(ژاپن، سیسمکس) در موقعیت کاپیلاری شمارش شد. درصد سلولهای زنده، با تهیه سوسپانسیون سلولی به صورت ترکیب هم حجم از محلول تریپان بلو 4/0% (کانادا، استم سل تکنولوژی) و سوسپانسیون سلول با شمارش 100 سلول در میکرولیتر، محاسبه شد.
بررسی میزان توان کلنیزایی سلولی:
تعداد 1500 سلول بنیادی مزانشیمی جدا شده از بافت جفت مربوط به پاساژ 3 و7 با 3 میلیلیتر از محیط کشت نیمه جامد حاوی FGF-β (کانادا، استم سل تکنولوژی) مخلوط و مقدار 1 میلیلیتر از مخلوط حاصل به هر یک از دو پلیت 35 میلیمتری، منتقل شد. به این ترتیب در هر پلیت 500 سلول وجود داشت. پلیتها در انکوباتور 37 درجه سانتیگراد و 5% CO2 به مدت 2 هفته کشت شدند. پس از زمان قید شده، تعداد کلنیها شمارش و ثبت شد.
تایید هویت سلولی سلولهای بنیادی مزانشیمی جدا شده از بافت جفت:
الف: ایمونوفنوتایپ سلولی:
به منظور تعیین هویت فنوتیپی سلولهـای جـدا شده از
بافت جفت، سلولها از پاساژ 3 و 7 تریپسینه و از فلاسک
جدا شده و در بافر فسفات شستشو شدند. سوسپانسیون سلولی با شمارش 1000 سلول در هر میکرولیتر تهیه شد. از سوسپانسیون مذکور، مقدار 50 میکرولیتر و از هر یک از آنتیبادیهای مونوکلونال کنژوگه به رنگهای فلورسنت نیز مقدار 5 میکرولیتر به هر لوله افزوده شد. به موازات، سلولها با آنتیبادی ایزوتایپ کنترل نیز مجاور شدند. سپس لولهها 30 دقیقه در حرارت یخچال انکوبه شده و با افزودن 50 میکرولیتر از فیکساتیو پارافرمالدئید 1% (آمریکا، سیگما) با دستگاه فلوسایتومتری Patrec CY-Flow Space (آلمان، پارتک) آنالیز شدند. لیست آنتیبادیها شامل : CD44-FITC ، CD29-PE ، CD90-FITC ، CD73-PE ، CD105-FITC ، CD166-PE ، CD45-FITC ، IgG1-FITC/IgG1-PE (آمریکا، فارمین ژن) و CD34-PE (از کمپانی داکو، دانمارک) بودند و در هر آنالیز 5000 سلول بررسی شدند.
ب: بررسی توانایی تمایز استئوسیتی و آدیپوسیتی سلولی:
به منظور بررسی توان تمایز سلولهای بنیادی مزانشیمی جدا شده از بافت جفت، ابتدا سطح چاهکهای پلیت 6 خانه با محلول کلاژن 4% (کانادا، استم سل تکنولوژی) آغشته شده و پس از دو بار شستشو با بافر فسفات، در هر چاهک 105 * 4 سلول از پاساژ 3 و 7 در محیط DMED-LG همراه با FBS 10% کشت شدند. هنگامی که 80% از سطح چاهکها از سلول پوشیده شد، محیط کشت با محیط تمایزی استئوسیتی و آدیپوسیتی تعویض شد. به موازات نمونهای نیز در محیط DMEM-LG جهت کنترل کشت شد.
محیط تمایز استئوسیتی(ایران، ایده زیست نوترکیب) شامل محیط DMEM-HG(Dulbecco's Modified Eagle Medium- ، گیبکو، High Glucose) همراه با 10%FBS و 10 میلیمولار در لیتر دگزامتازون، 10 نانو مولار در لیتر ویتامین D3 و 50 میلیگرم در میلیلیتر اسید آسکوربیک بود. محیط تمایز آدیپوسیتی(ایران، ایده زیست نوترکیب) شامل DMED-HG به همراه 10% FBS و1 میکرومــولار در لیتـر دگزامتازون، 10 میکرومولار در لیتر انسولین و 200 میکرومولار در لیتر ایندومتاسین بود. محیط کشت تمایزی هر 3 روز یک بار تعویض شد. پس از 3 هفته، مورفولوژی سلولی مورد بررسی قرار گرفت. به این ترتیب جهت ارزیابی تمایز القا شده، سلولها به منظور رنگآمیزی اختصاصی آماده شدند.
رنگآمیزی Oil Red-O به منظور ارزیابی تمایز آدیپوسیتی:
پس از حذف محیط کشت تمایزی از چاهکها، سلولها در بافر نمکی فسفات شسته شده و به منظور تثبیت سلولی، از محلول پارافرمالدئید 10% در بافر فسفات به مدت 20 دقیقه در حرارت اطاق استفاده شد. سپس سلولها در محلول 60% ایزوپروپانول شستشو و سپس به مدت 10 دقیقه در محلول رنگ که از ترکیب 6 حجم محلول رنگی 5/0% Oil Red-O (آمریکا، سیگما) در ایزوپروپانول و 4 حجم آب مقطر به دست آمده بود، قرار گرفت. واکنش رنگ توسط میکروسکوپ اینورت بررسی شد.
رنگآمیزی آلیزارین رد به منظور ارزیابی تمایز استئوسیتی:
به منظور تثبیت سلولی از محلول اتانول 70% به مدت 10 دقیقه، پس از حذف محیط کشت تمایزی از چاهکها، استفاده شد. سلولها در بافر نمکی فسفات شسته شده و به مدت 20 دقیقه در حرارت اتاق قرار گرفتند. سپس سلولها در محلول 60% ایزوپروپانول شستشو و در مرحله بعد به مدت 10 دقیقه در محلول رنگی آلیزارین رد 2% (آمریکا، سیگما) در بافر فسفات قرار گرفتند. واکنش رنگ توسط میکروسکوپ اینورت بررسی شد.
یافتهها
بررسی میزان رشد سلولی:
سلولهای جدا شده از جفت پس از کشت در پاساژهای ابتدایی با سرعت کمتر و سپس با سرعت زیاد تکثیر شدند و پس از نزدیـک به 20 روز به مرحله تکثیر تصاعدی رسیدند(نمودار 1). روند تکثیر در این سلولها تا حدود روز 90 تصاعدی بــوده و سپـس کندتـر و در یـک نمونه رو به کاهش رفت.

نمودار 1: میزان تکثیر سلولهای استرومایی مزانشیمال جدا شده از بافت جفت در in vitro

نمودار 2: توان کلنیزایی سلولهای بنیادی مزانشیمی جدا شده از بافت جفت در In vitro پس از 10 روز کشت در محیط نیمه جامد
بررسی میزان توان کلنیزایی سلولی:
توان کلنیزایی سلولهای مذکور پس از 10 روز کشـت
در محیـط نیمـه جامـد از طریـق شمـارش تعداد کلنیهای ایجاد شـده بـــررسی شد(نمودار 2).
بررسی ایمونوفنوتایپ سلولی:
سلولهـای بنیـادی مزانشیمـی جـدا شـده از جفــــت،
شاخصهای سطحی CD73 ، CD44 ، CD90 ، CD166 ، D29 ، CD105 را بـه میـزان بالایـی در سطح بیان کردند. مـیزان بیان CD166 در زیر گروهی از سلولها قدری کمتر بود.
از طرف دیگر در بررسی مارکرهای سلولهای خونساز، دیـده شـد کـه سلولهـای مزانشیمی از نظر بیان CD34 و CD45 منفی بودند(شکل 2).
توان کلنیزایی سلولهای مذکور پس از 10 روز کشـت
در محیـط نیمـه جامـد از طریـق شمـارش تعداد کلنیهای ایجاد شـده بـــررسی شد(نمودار 2).
بررسی ایمونوفنوتایپ سلولی:
سلولهـای بنیـادی مزانشیمـی جـدا شـده از جفــــت،
شاخصهای سطحی CD73 ، CD44 ، CD90 ، CD166 ، D29 ، CD105 را بـه میـزان بالایـی در سطح بیان کردند. مـیزان بیان CD166 در زیر گروهی از سلولها قدری کمتر بود.
از طرف دیگر در بررسی مارکرهای سلولهای خونساز، دیـده شـد کـه سلولهـای مزانشیمی از نظر بیان CD34 و CD45 منفی بودند(شکل 2).

شکل 2: بررسی خصوصیات ایمونوفنوتایپی سلولهای بنیادی مزانشیمی جدا شده از بافت جفت، A : پراکندگی سایز و گرانولیتی سلولی، B: ایزوتایپ کنترل، C, D, E, F : واکنش آنتیبادیهای اختصاصی

شکل 3: رنگآمیزی اختصاصی بر روی سلولهای تحت کشت با محیطهای تمایزی و کنترل، A,B : رنگآمیزی Alizarian Red بر روی سلولها A : در محیط کنترل و B: در محیط تمایز استئوسیتی، C,D: رنگآمیزی Oil Red-Oبر روی سلولها C : در محیط کنترل و D : در محیط تمایز آدیپوسیتی(بزرگنمایی 200 x ).
بررسی توان تمایز سلولی:
سلولهای جدا شده از پاساژ 3 و 7 که در محیط تمایز استئوسیتی قرار گرفته بودند، پس از 10 روز تغییرات مورفولوژی را نشان داده و رسوب کلسیم در سطح سلول که حاکی از مینرالیزه شدن بود، باعث ایجاد واکنش رنگی قرمز در رنگآمیزی آلیزارین رد شد.
سلولهایی که تحت تاثیر تمایز آدیپوسیتی قرار گرفته بودند، از شکل دوکی خارج و به شکل کروی در آمده و حاوی واکوئولهای چربی بودند، که در رنگآمیزی Oil Red-O واکنش مثبت نشان دادند(شکل 3).
بحث
امروزه سلولهای بنیادی مزانشیمی به عنوان منبع سلولی با ارزشی در سلولدرمانی شناخته شدهاند. کاربرد گسترده این سلولها به دلیل ظرفیت بالای تکثیر و خود نوسازی، تمایز به سایر ردههای مزانشیمی و مهار واکنشهای ایمنی میباشد(5). هم چنین عدم تشکیل تراتوما پس از پیوند در مدلهای حیوانی، علت دیگری است که این سلولها را مورد توجه قرار داده است. رایجترین منبع دسترسی به سلولهای بنیادی مزانشیمال تا مدتها مغز استخوان بود. در سالهای اخیر مقالات متعددی چاپ شده و حضور این سلولها را در بسیاری از بافتهای بالغ و جنینی اثبات کردهاند. از آن جا که سلولهای بنیادی مزانشیمی جدا شده از بافتهای جنینی که بعد از زایمان به عنوان زباله بیولوژیک حذف میشوند، فنوتیپی شبیه به سلولهای مزانشیمی مغز استخوان دارند، تلاشهای بسیاری در جایگزینی آنها آغاز شده است(12). در این مطالعه نیز ما موفق شدیم با استفاده از روش هضم آنزیمی، سلولهای بنیادی مزانشیمی را از بافت جفتی که بخش دسیژوآی آن حذف شده، جدا کرده و تکثیر دهیم. با توجه به این که در گزارشهای قبلی جداسازی سلولهای بنیادی مزانشیمی از بافت جفت، متعاقب به کارگیری آنزیمهای متعدد انجام شده و هم چنین مراحل جداسازی نیـز طولانـی بـوده اسـت، ایـن گـزارش روشی سریعتر و
مقرون به صرفهتر را در دسترس قرار میدهد(15-12).
سلـولهـای مزانشیمـی جـدا شـده از بافـت پلاسنتـا،
مورفولوژی شبه فیبروبلاستی داشته و تا قبل از پاساژ دوم سرعت رشد کمتری داشتند. پس از پاساژ دوم، سلولها وارد فاز رشد تصاعدی شده و در نهایت در پاساژهای 13 تا 15 نیز مجدداً سرعت تکثیر کمتری پیدا کردند، میانگین روند تکثیر سلولها در این مطالعه با نتیجه تحقیق کانماتسو و همکارانش تطابق داشته، در حالی که در گزارش دیگری میزان تکثیر سلولی در پاساژ 1 ، 10 و 20 یکسان گزارش شده است(14، 13). به هر حال این مطلب که قدرت تکثیر سلولهای مزانشیمی جدا شده از جفت به مراتب بیشتر از سلولهای جدا شده از مغز استخوان است، در گزارشهای متعدد آمده است(15). توان کلنیزایی سلولها در این مطالعه مشابه با مطالعه گروه کانماتسو و همکارانش بود. توجه به سیر تکثیر و کلنیزایی سلولهای مزانشیمی از آن جهت حایز اهمیت است که در کاربردهای مختلف بالینی، استفاده از این سلولها میبایست با نگرش به تعداد آنها در زمان پیوند انجام شود. سلولهای بنیادی مزانشیمی توسط پروفایلی از آنتیبادیها شناسایی میشوند، که در این مطالعه نیز بیان بالای این شاخصها نشان داده شده است، در حالی که از جهت بیان مارکرهای سلولهای خونساز(CD34 ، CD45) کاملاً منفی بودند که این مساله حکایت از خلوص سلولهای جدا شده دارد.
سنجشهای In vitro ثابت کرد که سلولهای جدا شده خاصیت چند ظرفیتی سلولهای بنیادی مزانشیمی را داشته و پتانسیل تمایز استئوسیتی در آنها به مراتب بالاست و به همین جهت در مواردی که هدف از کشت آنها تمایز به ردههای دیگر است، توصیه میشود که تا قبل از این که تمام سطح ظرف کشت توسط سلولها اشغال شود، القای تمایز انجام شود، چرا که تراکم سلولی، سلولها را به طرف تمایز استئوسیتی هدایت میکند. چنانچه در نتایج اشاره شد، پتانسیل تمایز آدیپوسیتی سلولهای بنیادی مزانشیمی جفت کمتر بود، این مساله در توافق با نتیجه گزارشهای بارلو است که اظهار کرده است این سلولها نسبت به سلولهای مزانشیمی جدا شده از مغز استخوان و بافت چربی، ظرفیت کمتری در تبدیل به سلولهای آدیپوسیتی دارند(15). در هر حال با توجه به روند تکثیر سلولها، بررسی توان تمایز آنها در این تحقیق بر روی سلولهای حاصل از پاساژ 3 و 7 انجام و حفظ خاصیت تکثیر بالا و تمایز آنها در این محدوده از منحنی رشد کاملاً تایید شد. به هر حال با وجود مطالعههای بسیار گسترده، به دلیل استفاده متنوع از سلولهای مزانشیمی در سلول درمانی، مطالعه و بررسیهای بیشتر بر روی بیولوژی سلولهای مذکور توصیه میشود.
نتیجهگیری
در مجموع این مطالعه نشان داد که سلولهای بنیادی مزانشیمی را میتوان از بافت جفت تنها با استفاده از یک آنزیم، در مدت زمان کوتاهی جدا کرده و در محیط کشتی که تنها با FBS حمایت میشود تکثیر کرد، بدون این که
تغییری در خصوصیات کلنیزایی و تمایزی آنها رخ دهد. هم چنین در دسترس بودن این منبع، عدم آسیب برای اهداکننده بافت و تعداد زیاد سلول، زمینه استفاده درمانی از آن را گسترش خواهد داد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد هماتولوژی مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدینوسیله نویسندگان مقاله مراتب تشکر و قدردانی خود را از زحمات کارکنان بیمارستان میلاد به دلیل همکاری در انجام تحقیق، ابراز میدارند.
نوع مطالعه: پژوهشي |
موضوع مقاله:
سلولهاي بنيادي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



