جلد 11، شماره 2 - ( تابستان 1393 )
جلد 11 شماره 2 صفحات 146-137 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Kamali Dolatabadi E, Ostadali Dehaghi M, Amirizadeh N, Parivar K, Mahdian R. Frequency of P15 /INK4B CpG island methylation in AML patients. bloodj 2014; 11 (2) :137-146
URL: http://bloodjournal.ir/article-1-762-fa.html
URL: http://bloodjournal.ir/article-1-762-fa.html
کمالی دولت آبادی عصمت، استاد علی دهقی محمدرضا، امیری زاده ناصر، پریور کاظم، مهدیان رضا. فرکانس متیلاسیون ژن P15 و بیان آن در بیماران مبتلا به لوسمی میلوئید حاد. فصلنامه پژوهشی خون. 1393; 11 (2) :137-146
دانشگاه آزاد اسلامی واحد علوم تحقیقات
متن کامل [PDF 401 kb]
(2379 دریافت)
| چکیده (HTML) (9630 مشاهده)
مقدمه
لوسمی میلوئید حاد(Acute myeloid lukemia)، یک اختلال کلونال خونساز بوده که ممکن است از سلولهای بنیادی خونساز(hematopoietic stem cell) و یا از یک سلول نیای رده خاص(lineage-specific progenitor cell) مشتق شود. ناهنجاریهای کروموزومی غیر تصادفی مانند حذف، وارونگی و جابهجایی، و هم چنین تغییرات اپیژنتیکی بدون اینکه تغییری در توالی ژن ایجاد کنند، نقش مهمی در پاتوژنز بیماری لوسمی میلوئیدی حاد دارند(3-1). تغییر الگوی متیلاسیون ژنها مانند افزایش متیلاسیون در پروموتر ژنهای سرکوبگر تومور و یا کاهش متیلاسیون در سرتاسر ژن از مهمترین مکانیسمهای اپیژنتیکی میباشد(8-4). اگر چه تغییرات هیستونی نیز از مکانیسمهای دیگر اپیژنتیک بوده که مطالعه کمتری بر روی آن صورت گرفتهاست(9). در واقع متیلاسیون نابهجا (aberrant) در ناحیه '5 پروموتر ژنهای سرکوبگر تومور، در بسیاری از سرطانها به عنوان مهمترین مکانیسم اپیژنتیک یاد شده است(12-10). بر خلاف تغییرات ژنتیکی که غیرقابل برگشت میباشد، این تغییرات اپیژنتیکی قابل بازگشت هستند(13).
متیلاسیون سیتوزین در نواحی پالیندرومیک CpG پروموتر ژنها، نقش مهمی را در خاموشی اپیژنتیک ژنهایی مانند IGSF4 ، ESR1 و CDKN2 در طی توسعه، پیشرفت و عود لوسمی بازی میکند(17-13، 3). پروتئین CDKN4B که به عنوان یک سرکوبگر تومور چندگانه (multi tumor suppressor 2 (MTS2)) شناخته شده است توسط ژن CDKN2B رمزگذاری میشود. این ژن در کنار ژن سرکوبگر تومور CDKN2A بر روی کروموزم 9 قرار گرفته و میزان بسامد موتاسیون در این ژن زیاد میباشد(22-18). ژن CDKN2B مهار کننده کیناز وابسته به سیکلین P15InK4B را رمزگذاری کرده که با CDK4 و CDK6 تشکیل کمپلکسی داده و از طریق مهار سایکلین D سبب جلوگیری از فعال شدن کینازهای وابسته به سیکلین شده و در نهایت عملکرد خود را از طریق مهار گذر سلول از فاز G1 انجام میدهند. بیان این ژن به طور چشمگیری توسط ژن TGF بتا القا شده و از سویی دیگرنقش و عملکرد این ژن(P15) به عنوان ژن سرکوبگر تومور در غیاب ژن P16 بسیار مهمتر و بارزتر است(25-23). اگر چه متیلاسیون پروموتر ژن P15 که منجر به خاموشی نسخهبرداری شده، یکی از مکانیسمهای مهم غیر فعال شدن ژن در لوسمی میلوئید حاد میباشد، ولی حذف هموزیگوتی و یا مکانیسمهای موتاسیون داخل ژنی نیز در لوسمی میلوئید حاد به طور نادر گزارش شده است(26, 22).
در این مطالعه متیلاسیون پروموتر P15 CDKN2B در بین بیماران لوسمی میلوئید حاد مراجعهکننده به مرکز تحقیقات خون و انکولوژی و پیوند سلولهای بنیادی بیمارستان دکتر شریعتی تهران در یک بازه زمانی 5 ماهه، به منظور بررسی بسامد متیلاسیون در این ژن و نیز بررسی رابطه متیلاسیون و میزان بیان این ژن مورد بررسی قرار گرفت.
مواد و روشها
در یک مطالعه مقطعی، نمونه خون محیطی و یا نمونه مغز استخوان 59 بیمار مبتلا به لوسمی میلوئید حاد مراجعهکننده به مرکز تحقیقات خون، انکولوژی و پیوند سلولهای بنیادی بیمارستان دکتر علی شریعتی تهران در یک بازه زمانی 5 ماهه جمعآوری گردید. قبل از نمونهگیری، رضایتنامه مطابق با قوانین بیمارستان و مرکز تحقیقات از بیماران گرفته شد. آزمایش CBC با دستگاه sysmex k502 و بررسی لام خون محیطی و مغز استخوان بیماران به منظور اندازهگیری WBC ، PLT، HCT ، Hb و تعیین درصد بلاست بیماران به طور جداگانه انجام شده و ثبت گردید. بعد از تشخیص احتمالی نوع سرطان خون بر اساس طبقهبندی FAB با رنگآمیزی رومانوسکی لام خون محیطی و یا لام مغزاستخوان بیمار، تشخیص با بررسی مارکرهای سطحی به روش فلوسیتومتری تایید شد.
استخراج DNA و بیسولفیته کردن آنها:
سلولهای تک هستهای از نمونه خون و یا مغز استخوان بیماران با استفاده از فایکول(bio West) جدا شده و سپس DNA با استفاده از مینیکیت استخراج DNA (CA، Valencia و کیاژن) استخراج شد. کیفیت DNA با استفاده از نانودراپ مورد بررسی قرار گرفت و بعد از حصول اطمینان از کیفیت آن، در 20- درجه سانتیگراد ذخیره شد.
1000 نانوگرم از DNA ی هر بیمار با استفاده از کیت بیسولفیت سدیم(کیاژن) EpiTect Bisulfite Kit با توجه به دستوالعمل کارخانه سازنده، بیسولفیته شده و در نهایت DNA در 20 میکرولیتر از بافر الوشن کیت حل شد. نمونهها در 20- درجه سانتیگراد دخیره شدند. با انجام این مرحله، سیتوزینهای غیر متیله تبدیل به تیمین شده و سیتوزینهای متیله دستنخورده باقی میماند.
طراحی آغازگر، واکنش زنجیرهای پلیمراز جهت بررسی منحنی ذوب:
با استفاده از نرمافزار(Molecular Biology Insights، آمریکا، CO و Cascade) software 0/1 Oligo آغازگر برای نواحی دو طرف پروموتر ژن طراحی شده و سپس با نرمافزارهای MethBlast و GeneRunner مورد بررسی قرار گرفت. ساختار ثانویه آغازگر با نرمافزار GeneRunner چک شده و و دمای ذوب(Melt temprature) آغازگر و منحنی ذوب با نرمافزار DNA melting simulation software و Oligocalculate مورد بررسی قرار گرفت. بعد از حصول اطمینان از طراحی آغازگرها، توالی آغازگر جهت ساخت به شرکت MWG آلمان ارسال شد(جدول 1).
جدول 1: توالی آغازگرها
بعد از بهینهسازی PCR ، PCR از منطقه مورد نظر با استفاده از مستر میکس تاکارا حاوی سایبرگرین SYBR Premix EX Taq TM II(Cat.# RR820L) با 50 نانوگرم از DNA بیسولفیـت شـده در دستگـاه ABI StepOnePlus در
دمای آنیلینگ 57 درجه سانتیگراد انجام شد.
کنترلهای به کار رفته در بررسی منحنی ذوب:
کنترلهای به کار رفته در بررسی منحنی ذوب شامل کیت کنترل متیلاسیون(کیاژن) و DNA بیسولفیت شده 10 فرد نرمال بود. کیت کنترل متیلاسیون حاوی کنترل غیر متیله بیسولفیت شده(به عنوان کنترل 0% متیله)، کنترل متیله بیسولفیت شده(به عنوان کنترل 100% متیله) و DNA انسانی بیسولفیت نشده(جهت بررسی موفقیتآمیز بیسولفیته کردن نمونهها) میباشد. منحنی ذوب هر بیمار با منحنیهای ذوب 10 کنترل نرمال، کنترلهای غیر متیله تجاری و کنترلهای متیله تجاری مقایسه گردید. بیمارانی که منحنی ذوب آنان انحراف به راست داشته و حد فاصل بین منحنیهای ذوب کنترلهای متیله تجاری و غیر متیله تجاری قرار میگرفت به عنوان جزیی متیله در نظر گرفته شدند. قابل ذکر است که منحنی ذوب کنترلهای نرمال منطبق بر منحنی ذوب کنترلهای غیر متیله تجاری است.
بررسی بیان با روش Real Time PCR
استخراج RNA و ساخت cDNA :
106 * 2 سلول از هر بیمار در 1 سیسی ترایزول حل شده و RNA توتالآن بر اساس دستورالعملهای استاندارد به روش اتانول سرد و کلروفرم جدا شد(28، 27). بعد از حصول اطمینان از کیفیت RNA , RNA به 80- انتقال داده شد. با استفاده از کیت فرمنتاز(#K1622 ، #K1621 و فرمنتاز) و با توجه به دستورالعمل کیت، cDNA با 3000 نانوگرم RNA ساخته شد. cDNA با آغازگرهای HPRT چک شد. آغازگرهای بیان ژن با دو نرمافزار Primer Express و AlleleID به صورت exon-exon junction طراحی شد. ساختار ثانویه آغازگر، دمای ذوب و منحنی ذوب آن با نرمافزارهای Generunner ، Oligocalculate و DNA melting simulation software چک شد. بعد از حصول اطمینان از طراحی آغازگرها، توالی آغازگر جهت ساخت به شرکت MWG آلمان ارسال گردید(جدول 1).
بعد از بهینهسازی روش، جهت بررسی بیان ژن P15 ، Real Time با نمونه cDNA در دستگاه ABI StepOnePlus در دمای آنلینگ 60 درجه سانتیگراد انجام شد. نتیجه نهایی میزان بیان ژن به روش ∆∆CT محاسبه گردید. از ژن GAPDH به عنوان ژن رفرانس استفاده شد.
آزمایشهای آماری:
در این تحقیق با استفاده از نرمافزار 18 SPSS و آزمایشهای Fishers Exact Test و pearson chi sqaure محاسبات آماری انجام گرفت. 05/0 p< در نظر گرفته شد.
یافتهها
متیلاسیون پروموتر ژن P15 و بیان آن در 59 بیمار مبتلا به لوسمی میلوئید حاد اولیه و ثانویه مورد بررسی قرار گرفت. خصوصیات سیتوژنتیکی، خونشناسی, نوع لوسمی میلوئید حاد، سن و جنس بیماران وارد مطالعه شده در جدول 2 آورده شده است. در گروه مورد مطالعه، 2/71% از بیماران مراجعهکننده به مرکز تحقیقات در بازه زمانی مشخص شده مرد بودند. 1/83% بیماران مراجعهکننده به مرکز تحقیقات در بازه زمانی مشخص شده جوانتر از 56 سال با متوسط سنی 36 سال(86-8) بودند. در بررسی سیتوژنتیک، 8/67% (40 از 59) بیماران طبیعی و 2/32%(19 از 59) بیماران دارای سیتوژنتیک غیر طبیعی بودند. در هنگام تشخیص، 2/32% (19 از 59) بیماران مورد مطالعه در نمونه مغز استخوان خود بلاست کمتر از 50% و 8/67% (40 از 59) بیماران بلاست بیش از 50% داشتند.
در بررسی متیلاسیون پروموتر ژن P15 در بیماران وارد مطالعه شده، 7/40% بیماران در ناحیه پروموتری این ژن متیله بوده ولی میزان متیلاسیون آنها متفاوت بود. منحنی ذوب در بیمارانی که کاملاً مطابق با نمونه کنترل متیله بود به عنوان متیله و در بیمارانی که منحنی ذوب آنها بین منحنیهای ذوب متیله و غیر متیله قرار گرفتند و متمایل به راست بودند، به عنوان جزیی متیله در نظر گرفته شد(شکلهای 5-1).
به منظور بررسی پیامدهای عملکرد متیلاسیون در ناحیه پروموتری ژن P15 ، بیان ژن با استفاده از Real Time به روش محاسباتی ∆∆CT مورد بررسی قرار گرفت که در مقایسـه بـا افراد نرمال، بیان ژن P15 در گروه مورد مطالعه
97/2-012/0 با میانگین 664/0بود.
جدول 2: مشخصات خونشناسی و سیتوژنتیک بیماران
بدون در نظر گرفتن متیلاسیون و عدم متیلاسیون در ژن P15 ، 9/92% بیماران وارد مطالعه شده کاهش بیان ژن P15 را نشان دادند(971/0- 012/0). 22 از 24 بیماری که پروموتر ژن آنها متیله بود(9/90%) و 31 از 35(5/88%) بیماری که در ژن P15 آنها متیلاسیون شناسایی نشده بود، کاهش بیان در این ژن را نشان دادند.
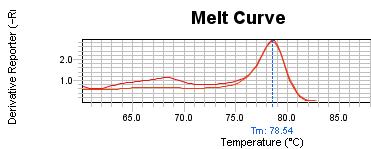
شکل1: منحنی کنترل غیر متیله و منحنی کنترل نرمال که دقیقاً بر روی منحنی کنترل غیر متیله قرار گرفته است. Tm منحنیهای کنترل نرمال و کنترل غیرمتیله °C54/78 میباشد.
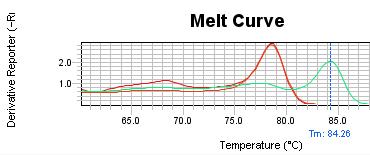
شکل2: منحنی کنترل متیله(منحنی سمت راست) در مقایسه با کنترلهای غیر متیله و نرمال(دو منحنی بر هم افتاده در سمت چپ). Tm کنترل متیله(سمت راست) °C 26/84 میباشد.
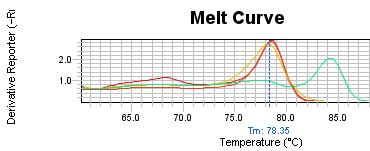
شکل3: منحنی دمای ذوب بیمار در مقایسه با منحنیهای متیله (منحنی سمت راست)، غیر متیله و کنترل نرمال(دو منحنی بر روی هم افتاده در سمت چپ). Tm منحنی ذوب بیمار(منحنی سمت چپ مشخص شده با پیکان) مشابه منحنی کنترل نرمال و کنترل غیرمتیله است.
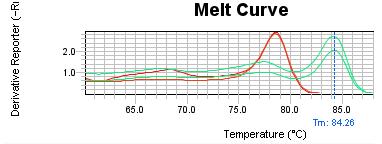
شکل4: منحنی ذوب بیمار(منحنی سمت راست مشخص شده با پیکان) دقیقاً منطبق بر روی منحنی کنترل متیله(منحنی سمت راست زیر آن) میباشد. کنترلهای نرمال و غیر متیله در سمت چپ و دقیقاً بر روی هم قرار گرفتهاند.
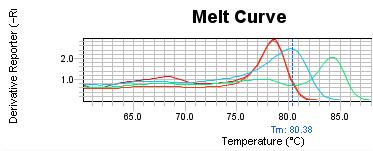
شکل5: منحنی ذوب بیمار با دمای ذوب 38/80 (منحنی بین دو منحنی سمت راست و چپ). منحنی ذوب در این نمونه در مقایسه با نمودارهای کنترل نرمال و کنترل غیرمتیله (دو منحنی منطبق بر هم سمت چپ) به سمت راست شیفت نموده و در بررسی جزئی متیله در نظر گرفته میشود.
بدون در نظر گرفتن متیلاسیون و عدم متیلاسیون در ژن P15 ، 9/92% بیماران وارد مطالعه شده کاهش بیان ژن P15 را نشان دادند(971/0- 012/0). 22 از 24 بیماری که پروموتر ژن آنها متیله بود(9/90%) و 31 از 35(5/88%) بیماری که در ژن P15 آنها متیلاسیون شناسایی نشده بود، کاهش بیان در این ژن را نشان دادند.
در محاسبات آماری بیمارانی که بیان ژن P15 در آنها کاهش یافته بود هیچ ارتباط معناداری بین متیلاسیون/ عدم متیلاسیون و کاهش بیان ژن به دست نیامد. در بیماران که ژن P15 آنها متیله و یا جزیی متیله بود، بین میزان متیلاسیون و میزان بیان ارتباط معناداری به دست نیامد.
بحث
یکی از مکانیسمهای اپیژنتیک در غیرفعال کردن ژنهـای سرکوبـگر تـومور ماننـد P15 ARF ، CDKN2A ،
CDKN2B متیلاسیون نواحی CPG در پروموتر ژن و توالیهای تنظیمی این ژنها میباشد(29). CDKN2B(P15) یک ژن سرکوبگر تومور شناخته شده است که بر روی کروموزم 9 قرار گرفته و غیرفعال شدن آن در بسیاری از تومورها و لوسمی میلوئید حاد گزارش شده است(32-30). در این مطالعه متیلاسیون ژن CDKN2Bو میزان بیان این ژن در گروه 59 نفری بیماران مبتلا به لوسمی میلوئید حاد مورد بررسی قرار گرفت. 7/40% از بیماران بدون در نظر گرفتن میزان متیلاسیون، در ناحیه پروموتری ژن افزایش متیلاسیون نسبت به افراد نرمال نشان دادند که این نتایج با نتایج به دست آمده از مطالعههای شیماموتو (61/31) 51% ، گوا (29/15) 52% و شاکانکری(59/29) 49% تا حدودی همخوانی داشت(35-33). میزان متیلاسیون در ژن CDKN2B از 31% تا 93% در مطالعههای مختلف گزارش شده است(41-36، 31، 10). این اختلافات گزارش شده در میزان متیلاسیون این ژن ممکن است به دلیل تنوع در تعداد بیماران مورد بررسی قرار گرفته و یا حساسیت روشهای به کار رفته در روش تشخیص باشد(42، 40، 32).
در بررسی ناحیه پروموتری ژن P15 در بیماران وارد مطالعه شده در تمام زیر گروههای FAB به غیر از M6 ، تغییرات الگوی متیلاسیون دیده شد. بیشترین فرکانس موتاسیون به ترتیب در M2 2/64%، M5 9/42%، M1 40% بوده در حالی که فرکانس متیلاسیون در M3 5/28% و در M4 2/22% بود. نتایج حاصله از این تحقیق مشابه نتایج به دست آمده در مطالعه شاکانکری بود ولی با نتایج تحقیقات دیگر کمی متفاوت بود. تفاوت در نتایج به دست آمده از مطالعههای مختلف در جمعیتهای گوناگون ممکن است به دلیل تعداد کم بیماران در هر زیر گروه FAB و روشهای به کار رفته در مطالعهها باشد(41، 40، 38، 32). تغییر الگوی متیلاسیون در پروموتر ژن P15 در بیش از 50% افراد مبتلا به بیماری لوسمی میلوئید حاد گزارش شده است. هم چنین در بررسیهای صورت گرفته ارتباط معناداری بین درصد بلاست و میزان متیلاسیون P15 گزارش شده است(43). 8/67% بیماران وارد مطالعه شده دارای بلاست بیش از 50% در مغز استخوان خود بوده و نتایج حاصل از بررسی این مطالعه رابطه معناداری بین درصد بلاست و متیلاسیون نشان داد(007/0 p=).
در مقایسه با افراد نرمال، بیان ژن P15 در گروه مورد مطالعه در گسترهی 97/2-012/0 با میانگین 664/0بود. (54 از 59) 9/92% بیماران وارد مطالعه شده کاهش بیان ژن P15 را نشان دادند(971/0-012/0). این گروه شامل 22 بیمار از 24 بیماری که پروموتر ژن آنها متیله و 31 از 35 بیماری که پروموتر ژن P15 آنها غیرمتیله بود، بودند. در جمعیت 9/92% که کاهش بیان داشتند، هیچ ارتباط معناداری بین متیلاسیون/ عدم متیلاسیون و کاهش بیان ژن به دست نیامد(062/0 p=) به علاوه ارتباط معناداری بین میزان بیان ژن و میزان متیلاسیون(متیلاسیون و پارشیال متیلاسیون) وجود نداشت(602/0 p=). پریسلر و همکاران در مطالعههایی که بر روی متیلاسیون و بیان ژن P15 در بیماران مبتلا به AML انجام دادند، به نتایج مشابه رسیدند(08/0 p=)، اما به دلیل این که 1/0 p< را نتایج قابل قبول میدانستند، رابطه معنادار بین متیلاسیون و بیان ژن P15 را گزارش کردند(44).
این یافته که تقریباً همه بیمارانی که در ژن P15 خود متیلاسیون نشان دادند کاهش بیان داشتند، این نکته را تایید میکند که متیلاسیون در پروموتر ژنها به عنوان یکی از مکانیسمهای کاهش بیان ژن میباشد که مشابه با یافتههای حاصل از مطالعههای گذشته است(45، 37، 35-32، 26-23). 31 نفر از 35 بیمار کاهش بیان ژن P15 بدون افزایش متیلاسیون در این ژن را نشان دادند که میتواند بیانگر این باشد که مکانیسمهای دیگر اپیژنتیک مانند تغییرات هیستونی و RNA غیر کدکننده در بیان ژن P15 نقش داشته و از سویی دیگر باید نقش سایر ژنها اعم از ژنهای القاکننده مانند TGF بتا و ژنهای تنظیمگر در بیان ژن P15 را نیز در نظر گرفت(50-46). حساسیت روشهای به کار رفته در تشخیص متیلاسیون ژن و گسترش گروه مورد مطالعه نیز در تائید یافتهها تاثیرگذار است(52، 51).
در 2 بیمار از 24 بیمار با وجود تغییرات متیلاسیون در ژن P15 ، افزایش بیان این ژن دیده شد. هاپفرو همکاران در مطالعهای که بر روی بیماران مبتلا به سندروم دیسپلازی میلوئیدی بر روی ژن P16 ، P73 ، DAPK و P15 انجام دادند در تعدادی از بیماران با وجود متیلاسیون در پروموتر ژن P16 افزایش بیان را مشاهده نمودند. و دلایل افزایش بیان با وجود متیلاسیون را اینگونه ذکر کردند: 1- ممکن است متیلاسیون در پروموتر ژن در سلولهای مختلف ناهمگن باشد و سلولهایی که P16 آنها بهگونهای متیله است که با اکثریت سلولهای غالب متفاوت است در این بیماران وجود داشته باشد. 2- هایپر متیلاسیون تنها یکی از روشهای کنترل بیان است(53).
نتیجهگیری
بیان ژن P15 بیماران مبتلا به لوسمی میلوئید حاد وارد مطالعه شده در مقایسه با افراد نرمال کاهش یافته بود اما بین میزان بیان ژن در این بیماران با متیلاسیون یا عدم متیلاسیون این ژن ارتباط معنیداری یافت نشد. این نتیجه بیانگر این امر است که متیلاسیون با کاهش بیان همراه است ولی تنها دلیل کاهش بیان نبوده و دیگر مکانیسمهای اپیژنتیک مانند تغییرات هیستونی نیز در تنظیم بیان ژن P15 ممکن است نقش داشته باشد. مقایسه ناحیه پروموتری این ژن در افراد نرمال و افراد مبتلا به لوسمی میلوئید حاد نشان داد که در افراد سالم، ناحیه پروموتری این ژن هیستون H3 که لیزین شماره 9 و 14 آن استیله
است (H3/ k9/k14) احاطه شده است، در حالی که در بیماران مبتلا به لوسمی میلوئید حاد، این ناحیه با هیستون H3 که لیزین شماره 9 و 14 آن استیله و لیزین 9 آن علاوه بر استیله بودن دیمتیله و تریمتیله نیز میباشد احاطه شده است. از سویی دیگر تفاوت در تغییرات هیستونی در بیماران مبتلا به لوسمی میلوئید حاد با الگوی ناحیه پروموتری متیله ژن P15 و غیر متیله این ژن نیز وجود دارد. تحقیقات نشان میدهد که میزان و محتوای متیلاسیون لیزین شماره 27 و لیزین 4 هیستون 3 در فعالسازی این ژن و یا کاهش بیان آن نقش داشته، هم چنین کاهش بیان این ژن با دی و تریمتیلاسیون لیزین 9 هیستون 3 همراه است(53). از سویی دیگر نقش سایر ژنها اعم از ژنهای القا کننده بیان مانند TGF بتا، ژنهای تنطیمگر بیان و وجود پلیموررفیسمهایی تاثیرگذار بر بیان این ژن را باید در نظر گرفت.
تشکر و قدردانی
بدینوسیله نویسندگان مقاله از همکاری محسن کریمی ارزنانی، شهربانو رستمی، حبیه قدیمی، بهرام چاردولی، نوشین نعیمی، آرزو اودی، مینا نوسعید تشکر و قدردانی مینمایند.
متن کامل: (1739 مشاهده)
فرکانس متیلاسیون ژن P15 و بیان آن در بیماران مبتلا به لوسمی میلوئید حاد
عصمت کمالی دولتآبادی1، محمدرضا استاد علی دهقی2، ناصر امیریزاده3، کاظم پریور4، رضا مهدیان5
چکیده
سابقه و هدف
در بدخیمیهای خونی، افزایش متیلاسیون در پروموتر ژنهای سرکوبگر تومور به عنوان یکی از رخدادهای شایع در مسیر اپیژنتیک گزارش شده است که قابل بازگشت میباشد. هدف از این مطالعه ارزیابی، میزان بسامد متیلاسیون پروموتر ژن P15 در بیماران مبتلا به لوسمی میلوئید حاد و بررسی ارتباط متیلاسیون پروموتر ژن P15 با بیان آن بود.
مواد و روشها
در یک مطالعه مقطعی، بیماران مراجعهکننده به مرکز خون و انکولوژی بیمارستان شریعتی، در دو بازده زمانی چهار ماهه، بعد از تایید بیماری لوسمی میلوئیدی حاد وارد مطالعه شدند. متیلاسیون پروموتر ژن P15 در 59 بیمار مبتلا به لوسمی میلوئیدی حاد با روش بررسی منحنی ذوب مورد مطالعه قرار گرفت و میزان بیان این ژن با روش Real Time PCR و به روش محاسباتی ∆∆CT انجام شد. یافتهها توسط آزمونهای کایدو و دقیق فیشر و نرمافزار 18 SPSS تجزیه و تحلیل شدند.
یافتهها
7/40% (24 از 59) بیماران وارد مطالعه شده افزایش متیلاسیون پروموتر ژن P15 را نشان دادند. بدون در نظر گرفتن الگوی متیلاسیون، 9/92% از کل جمعیت بیماران کاهش بیان این ژن را نشان دادند. 9/90% از بیمارانی که متیلاسیون در ژن P15 خود داشتند(22 از 24) و 5/88% (31 از 35) از بیمارانی که متیلاسیون در ژن P15 نداشتند، کاهش بیان در ژن P15 را نشان دادند.
نتیجه گیری
تغییرات اپیژنتیک رخ داده در ژنهای تنظیمگر و یا ژنهای القا کننده بیان در تنظیم بیان ژن P15 نقش داشته و علاوه بر آن دیگر مکانیسمهای اپیژنتیک مانند تغییرات هیستونی در تنظیم بیان نیز دخالت دارند.
کلمات کلیدی: اپیژنتیک، لوسمی میلوئید حاد(AML) ، متیلاسیون
تاریخ دریافت : 22/4/92
تاریخ پذیرش : 17/9/92
1- مؤلف مسؤول: دانشجوی دکترای تخصصی زیستشناسی با گرایش سلولی و مولکولی ـ دانشگاه آزاد اسلامی واحد علوم تحقیقات ـ تهران ـ ایران ـ صندوق پستی: 14114
2- دکترای تخصصی ایمونولوژی ـ استادیار مرکز تحقیقات خون، انکولوژی و پیوند سلولهای بنیادی ـ بیمارستان دکتر شریعتی ـ تهران ـ ایران
3- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- دکترای تخصصی زیستشناسی سلولی و تکوین ـ استاد دانشگاه آزاد اسلامی واحد علوم تحقیقات ـ تهران ـ ایران
5- دکترای تخصصی بیوتکنولوژی ـ استادیار مرکز تحقیقات بیوتکنولوژی انستیتو پاستور ایران ـ تهران ـ ایران
عصمت کمالی دولتآبادی1، محمدرضا استاد علی دهقی2، ناصر امیریزاده3، کاظم پریور4، رضا مهدیان5
چکیده
سابقه و هدف
در بدخیمیهای خونی، افزایش متیلاسیون در پروموتر ژنهای سرکوبگر تومور به عنوان یکی از رخدادهای شایع در مسیر اپیژنتیک گزارش شده است که قابل بازگشت میباشد. هدف از این مطالعه ارزیابی، میزان بسامد متیلاسیون پروموتر ژن P15 در بیماران مبتلا به لوسمی میلوئید حاد و بررسی ارتباط متیلاسیون پروموتر ژن P15 با بیان آن بود.
مواد و روشها
در یک مطالعه مقطعی، بیماران مراجعهکننده به مرکز خون و انکولوژی بیمارستان شریعتی، در دو بازده زمانی چهار ماهه، بعد از تایید بیماری لوسمی میلوئیدی حاد وارد مطالعه شدند. متیلاسیون پروموتر ژن P15 در 59 بیمار مبتلا به لوسمی میلوئیدی حاد با روش بررسی منحنی ذوب مورد مطالعه قرار گرفت و میزان بیان این ژن با روش Real Time PCR و به روش محاسباتی ∆∆CT انجام شد. یافتهها توسط آزمونهای کایدو و دقیق فیشر و نرمافزار 18 SPSS تجزیه و تحلیل شدند.
یافتهها
7/40% (24 از 59) بیماران وارد مطالعه شده افزایش متیلاسیون پروموتر ژن P15 را نشان دادند. بدون در نظر گرفتن الگوی متیلاسیون، 9/92% از کل جمعیت بیماران کاهش بیان این ژن را نشان دادند. 9/90% از بیمارانی که متیلاسیون در ژن P15 خود داشتند(22 از 24) و 5/88% (31 از 35) از بیمارانی که متیلاسیون در ژن P15 نداشتند، کاهش بیان در ژن P15 را نشان دادند.
نتیجه گیری
تغییرات اپیژنتیک رخ داده در ژنهای تنظیمگر و یا ژنهای القا کننده بیان در تنظیم بیان ژن P15 نقش داشته و علاوه بر آن دیگر مکانیسمهای اپیژنتیک مانند تغییرات هیستونی در تنظیم بیان نیز دخالت دارند.
کلمات کلیدی: اپیژنتیک، لوسمی میلوئید حاد(AML) ، متیلاسیون
تاریخ دریافت : 22/4/92
تاریخ پذیرش : 17/9/92
1- مؤلف مسؤول: دانشجوی دکترای تخصصی زیستشناسی با گرایش سلولی و مولکولی ـ دانشگاه آزاد اسلامی واحد علوم تحقیقات ـ تهران ـ ایران ـ صندوق پستی: 14114
2- دکترای تخصصی ایمونولوژی ـ استادیار مرکز تحقیقات خون، انکولوژی و پیوند سلولهای بنیادی ـ بیمارستان دکتر شریعتی ـ تهران ـ ایران
3- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- دکترای تخصصی زیستشناسی سلولی و تکوین ـ استاد دانشگاه آزاد اسلامی واحد علوم تحقیقات ـ تهران ـ ایران
5- دکترای تخصصی بیوتکنولوژی ـ استادیار مرکز تحقیقات بیوتکنولوژی انستیتو پاستور ایران ـ تهران ـ ایران
مقدمه
لوسمی میلوئید حاد(Acute myeloid lukemia)، یک اختلال کلونال خونساز بوده که ممکن است از سلولهای بنیادی خونساز(hematopoietic stem cell) و یا از یک سلول نیای رده خاص(lineage-specific progenitor cell) مشتق شود. ناهنجاریهای کروموزومی غیر تصادفی مانند حذف، وارونگی و جابهجایی، و هم چنین تغییرات اپیژنتیکی بدون اینکه تغییری در توالی ژن ایجاد کنند، نقش مهمی در پاتوژنز بیماری لوسمی میلوئیدی حاد دارند(3-1). تغییر الگوی متیلاسیون ژنها مانند افزایش متیلاسیون در پروموتر ژنهای سرکوبگر تومور و یا کاهش متیلاسیون در سرتاسر ژن از مهمترین مکانیسمهای اپیژنتیکی میباشد(8-4). اگر چه تغییرات هیستونی نیز از مکانیسمهای دیگر اپیژنتیک بوده که مطالعه کمتری بر روی آن صورت گرفتهاست(9). در واقع متیلاسیون نابهجا (aberrant) در ناحیه '5 پروموتر ژنهای سرکوبگر تومور، در بسیاری از سرطانها به عنوان مهمترین مکانیسم اپیژنتیک یاد شده است(12-10). بر خلاف تغییرات ژنتیکی که غیرقابل برگشت میباشد، این تغییرات اپیژنتیکی قابل بازگشت هستند(13).
متیلاسیون سیتوزین در نواحی پالیندرومیک CpG پروموتر ژنها، نقش مهمی را در خاموشی اپیژنتیک ژنهایی مانند IGSF4 ، ESR1 و CDKN2 در طی توسعه، پیشرفت و عود لوسمی بازی میکند(17-13، 3). پروتئین CDKN4B که به عنوان یک سرکوبگر تومور چندگانه (multi tumor suppressor 2 (MTS2)) شناخته شده است توسط ژن CDKN2B رمزگذاری میشود. این ژن در کنار ژن سرکوبگر تومور CDKN2A بر روی کروموزم 9 قرار گرفته و میزان بسامد موتاسیون در این ژن زیاد میباشد(22-18). ژن CDKN2B مهار کننده کیناز وابسته به سیکلین P15InK4B را رمزگذاری کرده که با CDK4 و CDK6 تشکیل کمپلکسی داده و از طریق مهار سایکلین D سبب جلوگیری از فعال شدن کینازهای وابسته به سیکلین شده و در نهایت عملکرد خود را از طریق مهار گذر سلول از فاز G1 انجام میدهند. بیان این ژن به طور چشمگیری توسط ژن TGF بتا القا شده و از سویی دیگرنقش و عملکرد این ژن(P15) به عنوان ژن سرکوبگر تومور در غیاب ژن P16 بسیار مهمتر و بارزتر است(25-23). اگر چه متیلاسیون پروموتر ژن P15 که منجر به خاموشی نسخهبرداری شده، یکی از مکانیسمهای مهم غیر فعال شدن ژن در لوسمی میلوئید حاد میباشد، ولی حذف هموزیگوتی و یا مکانیسمهای موتاسیون داخل ژنی نیز در لوسمی میلوئید حاد به طور نادر گزارش شده است(26, 22).
در این مطالعه متیلاسیون پروموتر P15 CDKN2B در بین بیماران لوسمی میلوئید حاد مراجعهکننده به مرکز تحقیقات خون و انکولوژی و پیوند سلولهای بنیادی بیمارستان دکتر شریعتی تهران در یک بازه زمانی 5 ماهه، به منظور بررسی بسامد متیلاسیون در این ژن و نیز بررسی رابطه متیلاسیون و میزان بیان این ژن مورد بررسی قرار گرفت.
مواد و روشها
در یک مطالعه مقطعی، نمونه خون محیطی و یا نمونه مغز استخوان 59 بیمار مبتلا به لوسمی میلوئید حاد مراجعهکننده به مرکز تحقیقات خون، انکولوژی و پیوند سلولهای بنیادی بیمارستان دکتر علی شریعتی تهران در یک بازه زمانی 5 ماهه جمعآوری گردید. قبل از نمونهگیری، رضایتنامه مطابق با قوانین بیمارستان و مرکز تحقیقات از بیماران گرفته شد. آزمایش CBC با دستگاه sysmex k502 و بررسی لام خون محیطی و مغز استخوان بیماران به منظور اندازهگیری WBC ، PLT، HCT ، Hb و تعیین درصد بلاست بیماران به طور جداگانه انجام شده و ثبت گردید. بعد از تشخیص احتمالی نوع سرطان خون بر اساس طبقهبندی FAB با رنگآمیزی رومانوسکی لام خون محیطی و یا لام مغزاستخوان بیمار، تشخیص با بررسی مارکرهای سطحی به روش فلوسیتومتری تایید شد.
استخراج DNA و بیسولفیته کردن آنها:
سلولهای تک هستهای از نمونه خون و یا مغز استخوان بیماران با استفاده از فایکول(bio West) جدا شده و سپس DNA با استفاده از مینیکیت استخراج DNA (CA، Valencia و کیاژن) استخراج شد. کیفیت DNA با استفاده از نانودراپ مورد بررسی قرار گرفت و بعد از حصول اطمینان از کیفیت آن، در 20- درجه سانتیگراد ذخیره شد.
1000 نانوگرم از DNA ی هر بیمار با استفاده از کیت بیسولفیت سدیم(کیاژن) EpiTect Bisulfite Kit با توجه به دستوالعمل کارخانه سازنده، بیسولفیته شده و در نهایت DNA در 20 میکرولیتر از بافر الوشن کیت حل شد. نمونهها در 20- درجه سانتیگراد دخیره شدند. با انجام این مرحله، سیتوزینهای غیر متیله تبدیل به تیمین شده و سیتوزینهای متیله دستنخورده باقی میماند.
طراحی آغازگر، واکنش زنجیرهای پلیمراز جهت بررسی منحنی ذوب:
با استفاده از نرمافزار(Molecular Biology Insights، آمریکا، CO و Cascade) software 0/1 Oligo آغازگر برای نواحی دو طرف پروموتر ژن طراحی شده و سپس با نرمافزارهای MethBlast و GeneRunner مورد بررسی قرار گرفت. ساختار ثانویه آغازگر با نرمافزار GeneRunner چک شده و و دمای ذوب(Melt temprature) آغازگر و منحنی ذوب با نرمافزار DNA melting simulation software و Oligocalculate مورد بررسی قرار گرفت. بعد از حصول اطمینان از طراحی آغازگرها، توالی آغازگر جهت ساخت به شرکت MWG آلمان ارسال شد(جدول 1).
جدول 1: توالی آغازگرها
| P15 primers (MCA) | F: GGT TGG TTT TTT ATT TTG TTA GAG |
| R: CCT AAA TTA CTT CTA AAA AAA AAC | |
| P15 primers (real-time) | F: TGG CCG GAG GTC ATG ATG |
| R: GGG CAG CAT CAT GCA CCG | |
| GAPDH primers | F: GAA GGT GAA GGT CGG AGT C |
| R: GAA GAT GGT GAT GGG ATT TC |
بعد از بهینهسازی PCR ، PCR از منطقه مورد نظر با استفاده از مستر میکس تاکارا حاوی سایبرگرین SYBR Premix EX Taq TM II(Cat.# RR820L) با 50 نانوگرم از DNA بیسولفیـت شـده در دستگـاه ABI StepOnePlus در
دمای آنیلینگ 57 درجه سانتیگراد انجام شد.
کنترلهای به کار رفته در بررسی منحنی ذوب:
کنترلهای به کار رفته در بررسی منحنی ذوب شامل کیت کنترل متیلاسیون(کیاژن) و DNA بیسولفیت شده 10 فرد نرمال بود. کیت کنترل متیلاسیون حاوی کنترل غیر متیله بیسولفیت شده(به عنوان کنترل 0% متیله)، کنترل متیله بیسولفیت شده(به عنوان کنترل 100% متیله) و DNA انسانی بیسولفیت نشده(جهت بررسی موفقیتآمیز بیسولفیته کردن نمونهها) میباشد. منحنی ذوب هر بیمار با منحنیهای ذوب 10 کنترل نرمال، کنترلهای غیر متیله تجاری و کنترلهای متیله تجاری مقایسه گردید. بیمارانی که منحنی ذوب آنان انحراف به راست داشته و حد فاصل بین منحنیهای ذوب کنترلهای متیله تجاری و غیر متیله تجاری قرار میگرفت به عنوان جزیی متیله در نظر گرفته شدند. قابل ذکر است که منحنی ذوب کنترلهای نرمال منطبق بر منحنی ذوب کنترلهای غیر متیله تجاری است.
بررسی بیان با روش Real Time PCR
استخراج RNA و ساخت cDNA :
106 * 2 سلول از هر بیمار در 1 سیسی ترایزول حل شده و RNA توتالآن بر اساس دستورالعملهای استاندارد به روش اتانول سرد و کلروفرم جدا شد(28، 27). بعد از حصول اطمینان از کیفیت RNA , RNA به 80- انتقال داده شد. با استفاده از کیت فرمنتاز(#K1622 ، #K1621 و فرمنتاز) و با توجه به دستورالعمل کیت، cDNA با 3000 نانوگرم RNA ساخته شد. cDNA با آغازگرهای HPRT چک شد. آغازگرهای بیان ژن با دو نرمافزار Primer Express و AlleleID به صورت exon-exon junction طراحی شد. ساختار ثانویه آغازگر، دمای ذوب و منحنی ذوب آن با نرمافزارهای Generunner ، Oligocalculate و DNA melting simulation software چک شد. بعد از حصول اطمینان از طراحی آغازگرها، توالی آغازگر جهت ساخت به شرکت MWG آلمان ارسال گردید(جدول 1).
بعد از بهینهسازی روش، جهت بررسی بیان ژن P15 ، Real Time با نمونه cDNA در دستگاه ABI StepOnePlus در دمای آنلینگ 60 درجه سانتیگراد انجام شد. نتیجه نهایی میزان بیان ژن به روش ∆∆CT محاسبه گردید. از ژن GAPDH به عنوان ژن رفرانس استفاده شد.
آزمایشهای آماری:
در این تحقیق با استفاده از نرمافزار 18 SPSS و آزمایشهای Fishers Exact Test و pearson chi sqaure محاسبات آماری انجام گرفت. 05/0 p< در نظر گرفته شد.
یافتهها
متیلاسیون پروموتر ژن P15 و بیان آن در 59 بیمار مبتلا به لوسمی میلوئید حاد اولیه و ثانویه مورد بررسی قرار گرفت. خصوصیات سیتوژنتیکی، خونشناسی, نوع لوسمی میلوئید حاد، سن و جنس بیماران وارد مطالعه شده در جدول 2 آورده شده است. در گروه مورد مطالعه، 2/71% از بیماران مراجعهکننده به مرکز تحقیقات در بازه زمانی مشخص شده مرد بودند. 1/83% بیماران مراجعهکننده به مرکز تحقیقات در بازه زمانی مشخص شده جوانتر از 56 سال با متوسط سنی 36 سال(86-8) بودند. در بررسی سیتوژنتیک، 8/67% (40 از 59) بیماران طبیعی و 2/32%(19 از 59) بیماران دارای سیتوژنتیک غیر طبیعی بودند. در هنگام تشخیص، 2/32% (19 از 59) بیماران مورد مطالعه در نمونه مغز استخوان خود بلاست کمتر از 50% و 8/67% (40 از 59) بیماران بلاست بیش از 50% داشتند.
در بررسی متیلاسیون پروموتر ژن P15 در بیماران وارد مطالعه شده، 7/40% بیماران در ناحیه پروموتری این ژن متیله بوده ولی میزان متیلاسیون آنها متفاوت بود. منحنی ذوب در بیمارانی که کاملاً مطابق با نمونه کنترل متیله بود به عنوان متیله و در بیمارانی که منحنی ذوب آنها بین منحنیهای ذوب متیله و غیر متیله قرار گرفتند و متمایل به راست بودند، به عنوان جزیی متیله در نظر گرفته شد(شکلهای 5-1).
به منظور بررسی پیامدهای عملکرد متیلاسیون در ناحیه پروموتری ژن P15 ، بیان ژن با استفاده از Real Time به روش محاسباتی ∆∆CT مورد بررسی قرار گرفت که در مقایسـه بـا افراد نرمال، بیان ژن P15 در گروه مورد مطالعه
97/2-012/0 با میانگین 664/0بود.
جدول 2: مشخصات خونشناسی و سیتوژنتیک بیماران
| شاخص | اطلاعات |
| سن، تعداد بیماران(%) | |
| زیر 56 سال | 49 (1/83) |
| بالای 56 سال | 10 (9/16) |
| جنس، تعداد بیماران(%) | |
| زن | 17 (8/28) |
| مرد | 42 (2/71) |
| دستهبندی بر اساس FAB ، تعداد بیماران(%) | |
| M1 | 6 (2/10) |
| M2 | 18 (5/30) |
| M3 | 7 (9/11) |
| M4 | 9 (3/15) |
| M4E | 1 (7/1) |
| M5 | 8 (6/13) |
| M6 | 3 (1/5) |
| موارد دیگر | 7 (9/11) |
| سایتوژنتیک، تعداد بیماران(%) | |
| طبیعی | 40 (8/67) |
| غیر طبیعی | 19 (2/32) |
| طبقهبندی سایتوژنتیک، تعداد بیماران(%) | |
| مساعد | 9 (3/15) |
| متوسط | 40 (7/67) |
| نامساعد | 8 (6/13) |
| نامشخص | 2 (4/3) |
| میانگین سن بر اساس سال | 36 (86-8) |
| میانگین شمارش سلولهای سفید (L/109 *) |
87/12 (6/245-2/1) |
| میانگین درصد بلاست مغز استخوان | 67 (100-5) |
| میانگین شمارش پلاکتی (L/109 *) | 40 (371-4) |
| میانگین هموگلوبین(g/dL) | 5/8 (1/17-3) |

شکل1: منحنی کنترل غیر متیله و منحنی کنترل نرمال که دقیقاً بر روی منحنی کنترل غیر متیله قرار گرفته است. Tm منحنیهای کنترل نرمال و کنترل غیرمتیله °C54/78 میباشد.

شکل2: منحنی کنترل متیله(منحنی سمت راست) در مقایسه با کنترلهای غیر متیله و نرمال(دو منحنی بر هم افتاده در سمت چپ). Tm کنترل متیله(سمت راست) °C 26/84 میباشد.

شکل3: منحنی دمای ذوب بیمار در مقایسه با منحنیهای متیله (منحنی سمت راست)، غیر متیله و کنترل نرمال(دو منحنی بر روی هم افتاده در سمت چپ). Tm منحنی ذوب بیمار(منحنی سمت چپ مشخص شده با پیکان) مشابه منحنی کنترل نرمال و کنترل غیرمتیله است.

شکل4: منحنی ذوب بیمار(منحنی سمت راست مشخص شده با پیکان) دقیقاً منطبق بر روی منحنی کنترل متیله(منحنی سمت راست زیر آن) میباشد. کنترلهای نرمال و غیر متیله در سمت چپ و دقیقاً بر روی هم قرار گرفتهاند.

شکل5: منحنی ذوب بیمار با دمای ذوب 38/80 (منحنی بین دو منحنی سمت راست و چپ). منحنی ذوب در این نمونه در مقایسه با نمودارهای کنترل نرمال و کنترل غیرمتیله (دو منحنی منطبق بر هم سمت چپ) به سمت راست شیفت نموده و در بررسی جزئی متیله در نظر گرفته میشود.
بدون در نظر گرفتن متیلاسیون و عدم متیلاسیون در ژن P15 ، 9/92% بیماران وارد مطالعه شده کاهش بیان ژن P15 را نشان دادند(971/0- 012/0). 22 از 24 بیماری که پروموتر ژن آنها متیله بود(9/90%) و 31 از 35(5/88%) بیماری که در ژن P15 آنها متیلاسیون شناسایی نشده بود، کاهش بیان در این ژن را نشان دادند.
در محاسبات آماری بیمارانی که بیان ژن P15 در آنها کاهش یافته بود هیچ ارتباط معناداری بین متیلاسیون/ عدم متیلاسیون و کاهش بیان ژن به دست نیامد. در بیماران که ژن P15 آنها متیله و یا جزیی متیله بود، بین میزان متیلاسیون و میزان بیان ارتباط معناداری به دست نیامد.
بحث
یکی از مکانیسمهای اپیژنتیک در غیرفعال کردن ژنهـای سرکوبـگر تـومور ماننـد P15 ARF ، CDKN2A ،
CDKN2B متیلاسیون نواحی CPG در پروموتر ژن و توالیهای تنظیمی این ژنها میباشد(29). CDKN2B(P15) یک ژن سرکوبگر تومور شناخته شده است که بر روی کروموزم 9 قرار گرفته و غیرفعال شدن آن در بسیاری از تومورها و لوسمی میلوئید حاد گزارش شده است(32-30). در این مطالعه متیلاسیون ژن CDKN2Bو میزان بیان این ژن در گروه 59 نفری بیماران مبتلا به لوسمی میلوئید حاد مورد بررسی قرار گرفت. 7/40% از بیماران بدون در نظر گرفتن میزان متیلاسیون، در ناحیه پروموتری ژن افزایش متیلاسیون نسبت به افراد نرمال نشان دادند که این نتایج با نتایج به دست آمده از مطالعههای شیماموتو (61/31) 51% ، گوا (29/15) 52% و شاکانکری(59/29) 49% تا حدودی همخوانی داشت(35-33). میزان متیلاسیون در ژن CDKN2B از 31% تا 93% در مطالعههای مختلف گزارش شده است(41-36، 31، 10). این اختلافات گزارش شده در میزان متیلاسیون این ژن ممکن است به دلیل تنوع در تعداد بیماران مورد بررسی قرار گرفته و یا حساسیت روشهای به کار رفته در روش تشخیص باشد(42، 40، 32).
در بررسی ناحیه پروموتری ژن P15 در بیماران وارد مطالعه شده در تمام زیر گروههای FAB به غیر از M6 ، تغییرات الگوی متیلاسیون دیده شد. بیشترین فرکانس موتاسیون به ترتیب در M2 2/64%، M5 9/42%، M1 40% بوده در حالی که فرکانس متیلاسیون در M3 5/28% و در M4 2/22% بود. نتایج حاصله از این تحقیق مشابه نتایج به دست آمده در مطالعه شاکانکری بود ولی با نتایج تحقیقات دیگر کمی متفاوت بود. تفاوت در نتایج به دست آمده از مطالعههای مختلف در جمعیتهای گوناگون ممکن است به دلیل تعداد کم بیماران در هر زیر گروه FAB و روشهای به کار رفته در مطالعهها باشد(41، 40، 38، 32). تغییر الگوی متیلاسیون در پروموتر ژن P15 در بیش از 50% افراد مبتلا به بیماری لوسمی میلوئید حاد گزارش شده است. هم چنین در بررسیهای صورت گرفته ارتباط معناداری بین درصد بلاست و میزان متیلاسیون P15 گزارش شده است(43). 8/67% بیماران وارد مطالعه شده دارای بلاست بیش از 50% در مغز استخوان خود بوده و نتایج حاصل از بررسی این مطالعه رابطه معناداری بین درصد بلاست و متیلاسیون نشان داد(007/0 p=).
در مقایسه با افراد نرمال، بیان ژن P15 در گروه مورد مطالعه در گسترهی 97/2-012/0 با میانگین 664/0بود. (54 از 59) 9/92% بیماران وارد مطالعه شده کاهش بیان ژن P15 را نشان دادند(971/0-012/0). این گروه شامل 22 بیمار از 24 بیماری که پروموتر ژن آنها متیله و 31 از 35 بیماری که پروموتر ژن P15 آنها غیرمتیله بود، بودند. در جمعیت 9/92% که کاهش بیان داشتند، هیچ ارتباط معناداری بین متیلاسیون/ عدم متیلاسیون و کاهش بیان ژن به دست نیامد(062/0 p=) به علاوه ارتباط معناداری بین میزان بیان ژن و میزان متیلاسیون(متیلاسیون و پارشیال متیلاسیون) وجود نداشت(602/0 p=). پریسلر و همکاران در مطالعههایی که بر روی متیلاسیون و بیان ژن P15 در بیماران مبتلا به AML انجام دادند، به نتایج مشابه رسیدند(08/0 p=)، اما به دلیل این که 1/0 p< را نتایج قابل قبول میدانستند، رابطه معنادار بین متیلاسیون و بیان ژن P15 را گزارش کردند(44).
این یافته که تقریباً همه بیمارانی که در ژن P15 خود متیلاسیون نشان دادند کاهش بیان داشتند، این نکته را تایید میکند که متیلاسیون در پروموتر ژنها به عنوان یکی از مکانیسمهای کاهش بیان ژن میباشد که مشابه با یافتههای حاصل از مطالعههای گذشته است(45، 37، 35-32، 26-23). 31 نفر از 35 بیمار کاهش بیان ژن P15 بدون افزایش متیلاسیون در این ژن را نشان دادند که میتواند بیانگر این باشد که مکانیسمهای دیگر اپیژنتیک مانند تغییرات هیستونی و RNA غیر کدکننده در بیان ژن P15 نقش داشته و از سویی دیگر باید نقش سایر ژنها اعم از ژنهای القاکننده مانند TGF بتا و ژنهای تنظیمگر در بیان ژن P15 را نیز در نظر گرفت(50-46). حساسیت روشهای به کار رفته در تشخیص متیلاسیون ژن و گسترش گروه مورد مطالعه نیز در تائید یافتهها تاثیرگذار است(52، 51).
در 2 بیمار از 24 بیمار با وجود تغییرات متیلاسیون در ژن P15 ، افزایش بیان این ژن دیده شد. هاپفرو همکاران در مطالعهای که بر روی بیماران مبتلا به سندروم دیسپلازی میلوئیدی بر روی ژن P16 ، P73 ، DAPK و P15 انجام دادند در تعدادی از بیماران با وجود متیلاسیون در پروموتر ژن P16 افزایش بیان را مشاهده نمودند. و دلایل افزایش بیان با وجود متیلاسیون را اینگونه ذکر کردند: 1- ممکن است متیلاسیون در پروموتر ژن در سلولهای مختلف ناهمگن باشد و سلولهایی که P16 آنها بهگونهای متیله است که با اکثریت سلولهای غالب متفاوت است در این بیماران وجود داشته باشد. 2- هایپر متیلاسیون تنها یکی از روشهای کنترل بیان است(53).
نتیجهگیری
بیان ژن P15 بیماران مبتلا به لوسمی میلوئید حاد وارد مطالعه شده در مقایسه با افراد نرمال کاهش یافته بود اما بین میزان بیان ژن در این بیماران با متیلاسیون یا عدم متیلاسیون این ژن ارتباط معنیداری یافت نشد. این نتیجه بیانگر این امر است که متیلاسیون با کاهش بیان همراه است ولی تنها دلیل کاهش بیان نبوده و دیگر مکانیسمهای اپیژنتیک مانند تغییرات هیستونی نیز در تنظیم بیان ژن P15 ممکن است نقش داشته باشد. مقایسه ناحیه پروموتری این ژن در افراد نرمال و افراد مبتلا به لوسمی میلوئید حاد نشان داد که در افراد سالم، ناحیه پروموتری این ژن هیستون H3 که لیزین شماره 9 و 14 آن استیله
است (H3/ k9/k14) احاطه شده است، در حالی که در بیماران مبتلا به لوسمی میلوئید حاد، این ناحیه با هیستون H3 که لیزین شماره 9 و 14 آن استیله و لیزین 9 آن علاوه بر استیله بودن دیمتیله و تریمتیله نیز میباشد احاطه شده است. از سویی دیگر تفاوت در تغییرات هیستونی در بیماران مبتلا به لوسمی میلوئید حاد با الگوی ناحیه پروموتری متیله ژن P15 و غیر متیله این ژن نیز وجود دارد. تحقیقات نشان میدهد که میزان و محتوای متیلاسیون لیزین شماره 27 و لیزین 4 هیستون 3 در فعالسازی این ژن و یا کاهش بیان آن نقش داشته، هم چنین کاهش بیان این ژن با دی و تریمتیلاسیون لیزین 9 هیستون 3 همراه است(53). از سویی دیگر نقش سایر ژنها اعم از ژنهای القا کننده بیان مانند TGF بتا، ژنهای تنطیمگر بیان و وجود پلیموررفیسمهایی تاثیرگذار بر بیان این ژن را باید در نظر گرفت.
تشکر و قدردانی
بدینوسیله نویسندگان مقاله از همکاری محسن کریمی ارزنانی، شهربانو رستمی، حبیه قدیمی، بهرام چاردولی، نوشین نعیمی، آرزو اودی، مینا نوسعید تشکر و قدردانی مینمایند.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





