جلد 10، شماره 1 - ( بهار 1392 )
جلد 10 شماره 1 صفحات 52-40 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hosseini A, Halabian R, Hamedi Asl P, Bashiri Nahanji H, Jalili M, Heydari M, et al . Role of autophagy as a survival factor in MSCs following exposure to oxidative stress . bloodj 2013; 10 (1) :40-52
URL: http://bloodjournal.ir/article-1-738-fa.html
URL: http://bloodjournal.ir/article-1-738-fa.html
حسینی علی، حلبیان راحله، حامدی اصل پژمان، بشیری نهنجی حامد، جلیلی محمد علی، حیدری مجید، و همکاران.. تاثیر اتوفاژی بر بقای سلولهای بنیادی مزانشیمال پس از مواجهه با استرسهای اکسیداتیو. فصلنامه پژوهشی خون. 1392; 10 (1) :40-52
علی حسینی 
 ، راحله حلبیان
، راحله حلبیان 
 ، پژمان حامدی اصل
، پژمان حامدی اصل 
 ، حامد بشیری نهنجی
، حامد بشیری نهنجی 
 ، محمد علی جلیلی
، محمد علی جلیلی 
 ، مجید حیدری
، مجید حیدری 
 ، ناصر امیریزاده
، ناصر امیریزاده 
 ، مهریار حبیبی رودکنار*
، مهریار حبیبی رودکنار* 


 ، راحله حلبیان
، راحله حلبیان 
 ، پژمان حامدی اصل
، پژمان حامدی اصل 
 ، حامد بشیری نهنجی
، حامد بشیری نهنجی 
 ، محمد علی جلیلی
، محمد علی جلیلی 
 ، مجید حیدری
، مجید حیدری 
 ، ناصر امیریزاده
، ناصر امیریزاده 
 ، مهریار حبیبی رودکنار*
، مهریار حبیبی رودکنار* 

دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
واژههای کلیدی: کلمات کلیدی : سلولهای بنیادی مزانشیمال، اتوفاژی، استرسهای اکسیداتیو، هایپوکسی سلولی، راپامایسین
متن کامل [PDF 645 kb]
(5026 دریافت)
| چکیده (HTML) (16914 مشاهده)
مقدمه
MSCs ، گروهی از سلولهای استرومایی غیرخونساز مغز استخوان هستند که در شرایط مناسب کشت سلولی و محیط بدن، توانایی تمایز به ردههای مختلف سلولی از قبیل سلولهای استخوانی، چربی، غضروف و سلولهای عضلانی را دارا میباشند(1). امروزه MSCs به عنوان یک منبع سلولی امید بخش در زمینه سلول درمانی و ژن درمانی جهت درمان بسیاری از بیماریهای کشنده و ژنتیکی مطرح گردیدهاند. با این وجود مشکلات فراوانی از جنبههای گوناگون موجب محدودیتهایی در کاربرد بالینی MSCs شده است. در این خصوص نتایج بسیاری از تحقیقات دلالت بر این دارد که در همان روزهای ابتدایی پس از پیوند به دلیل آسیبهای ناشی از استرسهای اکسیداتیو، فقر غذایی، هایپوکسی و دیگر موارد، تعداد ناچیزی از MSCs زنده میمانند و تنها بهبود عملکرد نواحی حاشیهای بافت آسیب دیده را به همراه دارند(2). در این راستا، ارایه راهکارهای درمانی مؤثر با هدف افزایش کارآیی و ایمنی درمانهای سلولی مبتنی بر MSCs، از موضوعات بسیار مهم تحقیقات جدید به شمار میرود که از آن جمله میتوان به درمان ریز محیط پیوندی جهت کاهش عوامل آسیبرسان مانند رادیکالهای آزاد اکسیژن(OFRs)، بیان یا القای ژنهای بقای سلولی به ترتیب از طریق روشهای مهندسی ژنتیک یا روشهای پیششرطی کردن(preconditioning) را نام برد.
با وجود نتایج رضایتبخش در خصوص هر یک از این روشها، تاکنون جواب قطعی و قابل قبولی به دست نیامده است و هریک در زمینه خاصی با مشکلاتی همراه بوده است. به عنوان مثال در روشهای دستورزی ژنتیکی سلولهای بنیادی با ژنهای بقای سلولی از قبیل AKT ، به دلیل افزایش بقای سلولی به طور دایم و کاهش قابل توجه در میزان آپوپتوز سلولها، خطر وقوع تومورزایی در سلولها مشاهده شده است(3). از طرف دیگر در بررسی نتایج درمان در ژن درمانی، به دلیل طولانی بودن فرآیند پایش و مشخص نبودن محدوده زمانی، از نظر اقتصادی اجرایی نمیباشد.
امنیـت زیستـی درمـان(درمـان بـا کمترین عوارض) از
معیارهای اصلی در استانداردهای کنترل کیفی درمان های سلولی میباشد و در این راستا به منظور استفاده بالینی از MSCs در درمان، علاوه بر دستیابی به تعداد مورد نیاز از سلولهایی با صلاحیت عملکردی مطلوب، بایستی سلولها از نظر ویژگی فنوتیپ و ژنوتیپ سلولی نیز بدون نقص و پایدار باشند، تا افزایش کارآیی و امنیت زیستی پیوند منجر به درمانی استاندارد و موفقیتآمیز گردد.
اتوفاژی یک مسیر کاتابولیک است که به وسیله تشکیل وزیکول با غشای دو لایه به نام اتوفاگوزوم مشخص میگردد. اتوفاگوزوم اجزای درون سیتوپلاسمی را در بر گرفته و به لیزوزومها جهت تجزیه تحویل میدهد. اتوفاژی پس از مواجهه سلول با استرسهای محیطی همانند فقر غذایی، هایپوکسی و رادیکالهای آزاد اکسیژن، القا شده و با فرآیندی تطابقی یا سازگار پذیر(آداپتیو)، از طریق مهیا کردن متابولیتهای انرژیزا، بقای سلول را تداوم میبخشد. به طوری که در مطالعههای اخیر با حذف ژنهای کلیدی فرآیند اتوفاژی، افزایش مرگ سلولی مشاهده شده است. در مطالعههای مشابهی گزارش شده که به واسطه مهار اتوفاژی در سلولها، آپوپتوز افزایش مییابد.
اتوفاژی به عنوان یک فرآیند حیاتی در سلول شناخته میشود که در تکامل زیستی، سیستم ایمنی و مرگ سلولی نقش ایفا میکند و در خصوص اختلالات کشندهای از قبیل تحلیل سیستم عصبی، بیماریهای خود ایمنی و انواع سرطانها تاثیرگذار میباشد. اتوفاژی دارای عملکردی دوگانه میباشد، از یک طرف باعث افزایش مدت و میزان بقای سلول و از طرف دیگر در مراحل پیشرفته باعث مرگ سلول میشود(4). لیکن تاکنون درخصوص نقش اتوفاژی در فرآیند مرگ سلولی توافقی حاصل نشده است و ناهمگونی در نتایج بسیاری از مطالعهها بحثبرانگیز بوده است. با توجه به بررسیهای صورت گرفته، در این مطالعه از اتوفاژی به عنوان یک راهکار درمانی جدید و ایمن با هدف افزایش بقای MSCs پس از مواجهه با استرسهای اکسیداتیو(2O2H) استفاده گردید.
به طور کلی هدف پاسخ به دو سؤال بود: 1- آیا القای
اتوفـاژی با راپامایسین، منجر به افزایش بقای MSCs پس از مواجهه با 2O2H میگردد یا بر عکس؟ 2- آیا مهار اتوفاژی با MA3 منجر به افزایش بقای MSCs پس از مواجهه با 2O2H میگردد یا بر عکس؟
مواد و روشها
پلاسمید و سویه باکتری:
در یک مطالعه تجربی، پلاسمید pEGFP-LC3m (اهدایی از آزمایشگاه پروفسور فوکوموتا در ژاپن) به عنوان وکتور کلونینگ و بیانی و سویه باکتریE.coli (اینویتروژن ـ آمریکا) TOP10 به عنوان میزبان پروکاریوتی جهت ازدیاد وکتور مورد نظر انتخاب شد. وکتور pEGFP-LC3m دارای ژن مقاومت به کانامایسین جهت غربالگری کلونهای ترانسفرم شده در میزبان پروکاریوتی و جنتیسین برای غربالگری کلونهای پایدار ترانسفکت شده در رده سلولی یوکاریوتی میباشد. به منظور بررسی اتوفاژی، وکتور پلاسمیدی pEGFP-LC3m حاوی ژن LC3 و جهت ردیابی سلولهای مورد نظر به وسیله میکروسکوپ فلورسانت، ژن گزارشگر پروتئین فلورسانت سبز(GFP) در ساختار وکتور قرار داده شده بود.
LC3 (ژن مخصوص بررسی اتوفاژی) به صورت tag به پروتئین GFP متصـل اسـت و در متـن ارایه گردید. پروتئین LC3 تعبیه شده در وکتور، یکی از اجزای کلیدی اتوفاژی بوده که به دو صورت LC3 نوع I و II بروز میکند. این پروتئین به طور طبیعی در سیتوپلاسم واقع شده است و در هنگام تشکیل اتوفاگوزوم LC3 نوع I ، به LC3 نوع II تبدیل شده و به غشای دو لایهای اتوفاگوزوم الحاق میگردند، که در نتیجه آن میتوان به طور مستقیم با شناسایی LC3 ، القا شدن اتوفاژی را در سلول شناسایی نمود(5). در این حالت به دلیل این که LC3 به صورت فیوژن به GFP متصل میباشد، نقاط سبز رنگ GFP به صورت نقطه نقطه متراکم در غشای اتوفاگوزومها قابل مشاهده هستند. در غیر این صورت (عدم اتوفازی) GFP به صورت معمول و یکنواخت در کل سیتوپلاسم پراکنده است.
کشت سلولی:
میزان 10 میلیلیتر نمونه آسپیراسیون مغز استخوان یک
داوطلب سالم(با کسب رضایت) در مرکز پیوند مغز استخوان بیمارستان شریعتی جهت جداسازی سلولهای بنیادی مزانشیمال(MSCs) در ضد انعقاد هپارین گرفته شد و در شرایط استریل به مرکز تحقیقات سازمان انتقال خون ایران انتقال یافت.
به طور خلاصه سلولهای تک هستهای مغز استخوان(MNC) با استفاده از فایکول(g/mL 077/1 ؛ آمریکا، آمستردام) با سانتریفوژ شیب غلظتی جداسازی و در محیط کشت سلولی اختصاصی DMEM-Low Glucose (آمریکا ، اینویتروژن) با 10% FBS (آمریکا، اینویتروژن)، 1% پنیسیلین و 1% استرپتومایسین(ایران، سیناژن) در دمای 37 درجه سانتیگراد و 5% CO2 کشت داده شدند.
48 ساعت پس از آغاز کشت، سلولهای غیر چسبنده به وسیله تعویض محیط کشت حذف شدند و سلولهای چسبنده باقی ماندند. تعویض محیط کشت سلولی با فاصله زمانی 3 روز، موجب حذف سلولهای غیر چسبنده شد و در نهایت MSCs حاصل از پاساژ چهارم برای آزمایشهای نهایی فراهم شدند. جهت تایید هویت سلولی، MSCs تکثیر یافته در in vitro از نظر مورفولوژی مورد بررسی قرار گرفتند.
تعیین شاخصهای سطحی MSCs به وسیله فلوسایتومتری:
ابتدا MSCs را باPBS (آمریکا، اینویتروژن) شستشو داده و پس از تریپسینه کردن به فالکن منتقل شدند و به مدت 5 دقیقه سانتریفوژ انجام شد. پس از سانتریفوژ نمودن، مایعرویی را دور ریخته و به ازای هر 104-103 سلول در هر میکرولیتر محیط، 5 میکرولیتر از آنتیبادیهای مونوکلونال مربوطه افزوده شده و به مدت 30 دقیقه در دمای 4 درجه سانتیگراد در تاریکی انکوبه شدند. در انتها 100 میکرولیتر محلول پارافرمالدئید به محلول حاوی سلول و آنتیبادی اضافه گردید و توسط دستگاه فلوسایتومتری، نتایج تجزیه و تحلیل گردید.
ارزیابی توانایی تمایز سلولهای MSC ، به رده سلولی استخوانی:
بـررسی میـزان تمایـز سلولهـای MSC بـا استفـاده از
کیتهای تمایزی اختصاصی به رده سلولی استخوانی حاوی Ascorbate ، L-Glutamin ،β-Glycerophosphate Dexamethasone و رنگآمیزیهای اختصاصی بر روی سلولهای MSC انجام شد. در یک پلیت 24 خانهای به صورت سه تایی، 10000 سلول MSC جداسازی شده (پاساژ 2) ریخته شد و به آنها 5/0 میلیلیتر محیط کشت DMEM-LG حاوی سرم افزوده و پلیت در انکوباتور با دمای 37 درجه سانتیگراد و فشار CO2 5% قرار داده شد. پس از 3 روز، محیط کشت خالی شد و 5/0 میلیلیتر محیط تمایز به سه چاهک افزوده شد. در سه چاهک دیگر که به عنوان کنترل استفاده شدند، تنها محیط کشت اضافه شد(در این چاهکها فقط 10000 سلول MSC معمولی بدون فاکتور تمایزدهنده وجود دارد). به مدت 21 روز، محیط تمایز هر 4-3 روز یک بار تعویض شد. بعد از این مدت در نهایت رنگآمیزی سلولهای تمایزی 2% آلیزارین رد جهت تعیین هویت رده سلولی استخوانی (اوستئوبلاست) مورد استفاده قرار گرفت.
ارزیابی توانایی تمایز سلولهای MSC به رده چربی (آدیپوسیت):
بررسی میزان تمایز سلولهای MSC با استفاده از کیتهای تمایزی اختصاصی به رده سلولی آدیپوسیت حاوی L-Glutamin ، H-Insulin (recombinant) ، IBMX، Indomethacin ، Dexamethasone ، (3-isobutyl-methyl-xanthine) و رنگآمیزیهای اختصاصی بر روی سلولهای MSC انجام شد. ابتدا در یک پلیت 24 خانهای، به صورت سهتایی 15000 سلول MSC به همراه 5/0 میلیلیتر محیط کشت DMEM-LG حاوی سرم ریخته و پلیت در انکوباتور با دمای 37 درجه سانتیگراد و فشار CO2 5% قرار داده شد. پس از 3 روز محیط کشت خالی شد و 5/0 میلیلیتر محیط تمایز به سه چاهک افزوده شد. در سه چاهک دیگر که به عنوان کنترل استفاده شدند، تنها محیط کشت اضافه شد(در این چاهکها فقط 15000 سلول MSC معمولی بدون فاکتور تمایزدهنده وجود دارد). به مدت 7 روز، محیط تمایز هر 4-3 روز یک بار تعویض شد. بعد از این مدت به منظور بررسی تمایز سلولها، رنگآمیزی اختصاصیHCS LipidTOXTM Green Neutral Lipid انجام گرفت.
ترانسفورماسیون وکتور pEGFP-LC3m به میزبان پروکاریوتی:
جهت بررسی میزان اتوفاژی در سلول بنیادی، میبایست سازه حاوی ژن بیانگر اتوفاژی در این سلولها به صورت اکتوپیک بیان شود. بدین منظور از وکتور pEGFP-LC3m استفاده گردید. برای تکثیر این سازه، ابتدا وکتور مذکور به داخل باکتری E.coli سوش TOP10 که با روش CaCl2 سرد آماده شده بود ترانسفورم شد. در پایان مرحله ترانسفورم، باکتری ترانسفورم شده در پلیت LB آگار حاوی آنتیبیوتیک اختصاصی کانامایسین، به مدت یک شب در 37 درجه سانتیگراد انکوبه شد. به دلیل وجود ژن مقاومت به کانامایسین در وکتور، تنها کلونهای حاوی وکتور زنده مانده و بدین صورت کلونهای حاوی وکتور نوترکیب غربالگری شدند. از کلونیهای رشد کرده در محیط انتخابی با استفاده از کیت High Pure Plasmid Isolation (رُوش - آلمان) و طبق دستورالعمل، استخراج پلاسمید نوترکیب صورت گرفت. سپس غلظت(کمیت) پلاسمید استخراج شده با دستگاه نانودراپ اندازهگیری و هم چنین با الکتروفورز بر روی ژل 1% آگارز پلاسمید تعیین کیفیت شد.
ترانسفکشن وکتور pEGFP-LC3m به MSCs جهت القای اتوفاژی:
2 میکروگرم از وکتور pEGFP-LC3m به همراه 5 میکرولیتر از معرف فیوژن 6 (Fugene 6 Transfection Reagent ، آلمان، رُوش) به داخل هر چاهک 6 خانه حاوی سلولهای بنیادی مزانشیمال ترانسفکت گردید. لازم به ذکر است یک روز قبل از ترانسفکت، حدود 500 هزار سلول در هر چاهک 6 خانهای ریخته شد. به منظور به دست آوردن سلولهای بنیادی مزانشیمال GFP-LC3 پایدار، به محیطهای کشت آنتیبیوتیک جنتیسین اضافه گردید. از آن جا که سلولهای حاوی وکتور، دارای ژن مقاوم به جنتیسین بودند، در مقابل این آنتیبیوتیک مقاومت کرده و بقیه سلولها مردند. از زمانی که سلولهای ترانسفکت شده با جنتیسین تیمار شدند، از روز 3 به بعد مرگ سلولی آغاز و بعد از گذشت 16 روز سلولهای پایدار مقاوم به جنتیسین به دست آمد. سپس تعداد 150000- 200000 سلول به هر خانه پلیت کشت سلولی شش خانهای حاوی 2 میلیلیتر محیط کشت اختصاصی DMEM Low Glucose ، FBS دار منتقل گردید. به یک سری از سلولها راپامایسین با غلظت ng/mL 10 (به عنوان القاکننده اتوفاژی) و به سری دیگر MA 3 با غلظت mM/mL 1 (به عنوان مهارکننده اتوفاژی) افزوده و سری سوم به عنوان کنترل درنظر گرفته شد. سپس پلیت در دمای 37 درجه سانتیگراد و 5% CO2 به مدت 24 ساعت انکوبه شد. در نهایت جهت بررسی اتوفاژی در MSCs پلیتهای حاوی سلول، برای مشاهده نقاط سبزرنگ با میکروسکوپ فلورسنت مورد بررسی قرار گرفتند.
به دلیل این که پایه و مبنای این مطالعه بررسی تاثیر اتوفاژی بر بقای سلولهای مزانشیمال بوده و برای این ارزیابی در درجه اول حضوریک ژن بیانگر(مارکر) اتوفاژی از ملزومات مطالعه بود، بنابراین در آزمایشها، گروه کنترل همان سلول ترانسفکت شده با مارکر اتوفاژی LC3 است که با سلولهای ترانسفکت شده و تیمار شده با القاکننده و مهارکننده اتوفاژی مقایسه میشود. در واقع مقایسه بین سلول ترانسفکت شده با LC3 بدون تیمار با القاکننده و مهارکننده اتوفاژی(کنترل) و سلولهای ترانسفکت شده باLC3 و تیمار شده با القاکننده و مهارکننده اتوفاژی است. چون اصل مطالعه بررسی شکست LC3 و ایجاد و مشاهده اتوفاگوزوم در سلولها است در صورت عدم حضور عامل اصلی(LC3 متصل به GFP) این مطالعه معنادار نمیباشد(16، 2).
مواجهه سلولهای MSC با غلظتهای مختلف 2O2H :
ابتدا 12000 سلول در هر خانه پلیت 96 خانهای ریخته
و به محیط کشت DMEM Low Glucose حاوی 10%FBS و آنتیبیوتیک اضافه شد. سپس پلیت به داخل انکوباتور 37 درجه سانتیگرادCO2 دار منتقل و به مدت 24 ساعت انکوبه گردید. پس از این مدت به تعدادی از سلولها راپامایسین(عامل القای اتوفاژی) با غلظتهای 16، 14، 12، 10، 8 نانوگرم، بـه تعـداد دیگـری از سلولهـا MA 3 (عامل مهار اتوفاژی) با غلظتهای mM 3، 2، 1 اضافه شد و مابقی سلولها به عنوان کنترل باقی ماندند. سپس پلیت برای بار دیگر به داخل انکوباتور منتقل و 24 ساعت انکوبه شد. پس از این مدت تمام سلولها به جز کنترل، با غلظتهای 2O2H µm/mL 25، 20، 15، 10 مجاور شدند و به مدت 4 ساعت(در تاریکی) در داخل انکوباتور، انکوبه شدند.
سنجش درصد بقای سلولی با استفاده از آزمون MTT :
پس ازانجام مراحل فوق، ابتدا مایع چاهکها خارج شدند سپس سلولها به مدت 4 ساعت با 10 میکرولیتر از محلول MTT (آمریکا، سیگما) به علاوه 90 میکرولیتر از محیط DMEM Low Glucose داخل انکوباتور 37 درجه سانتیگراد CO2 دار انکوبه شدند. سپس 100 میکرولیتر از محلول DMSO (آلمان، مرک) به علاوه 25 میکرولیتر از بافر سورنسن به چاهکها اضافه و میزان جذب نوری در طول موج 570 نانومتر اندازهگیری شد.
تحلیل آماری و مقایسه میانگینها با استفاده از نرمافزار SPSS در 001/0 p< ، 01/0 p< و 05/0 p< و با در نظر گرفتن خطای معیار(SEM) انجام گردید. تمام مراحل آزمایشهای فوق به صورت سه تایی(تریپلیکیت) انجام شد.
یافتهها
تایید حضور مارکرهای سطحی اختصاصی سلولهای بنیادی مزانشیمال با استفاده از آنتیبادیهای اختصاصی و دستگاه فلوسیتومتری:
پس از کشت سلولهای بنیادی مزانشیمال(MSC) جدا شده از نمونه مغز استخوان و گذشت زمان لازم برای رشد در محیط کشت اختصاصی، مورفولوژی آنها مورد بررسی قرار گرفت. مشاهدات میکروسکوپی نشان داد که سلولهای جدا شده از لحاظ مورفولوژی مشابه سلولهای MSC بودند(شکل 1).

شکل 1: سلولهای بنیادی مزانشیمال جدا شده از مغز استخوان، 7 روز پس از زمان جداسازی پاساژ اول
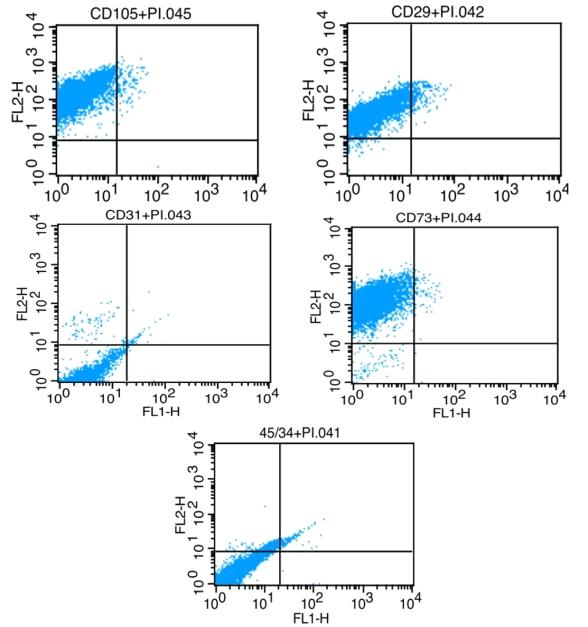
پس از مشاهدات میکروسکوپی، حضور مارکرهای موجود در سطح سلولها مورد بررسی قرار گرفت. وجود مارکرهای سطحی CD73 , CD29 , CD105 و عدم حضور مارکرهای CD31 , CD45 ، CD34 تاییدکننده سلولهای مزانشیمال بود(شکل 2).
تمایز سلول های MSC به رده سلولی استخوانی (اوستئوبلاست)
شکل2: بررسی مارکرهای اختصاصی سلولهای بنیادی مزانشیمال. وجود مارکرهای سطحی CD37 ، CD29 ، CD105 و عدم حضور مارکرهای CD31، CD45، CD34 تایید کننده سلولهای مزانشیمال بود.
سلولهای MSC با استفاده از مراحل ذکر شده در بخش مواد و روشها، به رده سلولـی استخوانی تمایز داده شد، پـس از 21 روز، رنـگآمیـزی آلیزارین رد 2% صورت گرفت. نتایج بیانگر آن بود که سلولهای MSC توانایی تمایز به رده سلولی استخوانی را داشتند(شکل B3).

شکل 3: توانایی تمایز سلولی سلولهای MSC. A: سلولهای MSC کنترل بدون تیمار با فاکتورهای تمایزی. B : سلولهای MSC تمایز یافته به استخوانی در حضور فاکتورها و محیط اختصاصی سلولهای استخوانساز. C : سلولهای MSC تمایز یافته به سلولهای چربی در حضور فاکتورها و محیط اختصاصی سلولهای چربیساز.
تمایز سلولهای MSC به رده سلولی چربی(آدیپوسیت):
سلول های MSC با استفاده از مراحل ذکر شده در بخش موادو روشها ، به رده سلولی استخوانی تمایز داده شد، پس از 7 روز رنگآمیزی HCS LipidTOXTM Green Neutral Lipid 1% صورت گرفت. نتایج بیانگر آن است که سلولهای MSC دارای خاصیت چند ظرفیتی بوده و به رده چربی تمایز یافتند(شکل C3).
تکثیر وکتور بیانی حاوی ژن LC3 (pEGFP-LC3) :
وکتور نوترکیب با روش شیمیایی به باکتری مستعد انتقال داده شد. از آن جا که ناقل کلونینگ حاوی ژن مقاومت به کانامایسین بود، تنها باکتریهای نوترکیب در محیط کشت LB آگارحاوی آنتیبیوتیک کانامایسین رشد کردند.

شکل 4: اندازهگیری کمیت DNA با استفاده از دستگاه نانودراپ. همان گونه که در نمودار مشخص است، عدد 4/281، نمایانگر غلظت DNA میباشد.
تعیین کمیت و کیفیت DNA پلاسمیدی استخراج شده:
DNA پلاسمیدی از تک کلونهای رشد کرده بر روی پلیت حاوی آنتیبیوتیک در محیط کشت LB و غلظت (کمیت) پلاسمید استخراج شده با دستگاه نانودراپ که یک اسپکتروفتومتر میباشد، اندازهگیری شد(شکل 4). کمیت DNA ng/uL 4/281 بود. جذب نوری نمونهها در طول موج λ 280/260 ، 91/1 بود که نشاندهنده عدم وجود ناخالصی میباشد. پس از این که غلظت DNA پلاسمیدی استخراج شده به کمک نانودراپ تعیین گردید برای آنالیزکیفیت نمونه، از نمونه استخراج شده آزمایش الکتروفورز در کنار ناقل pUC19 به عمل آمد که حضور سه باند بیانگر کویل، سوپرکویل و خطی بودن DNA و نشاندهنده خلوص و عدم شکست در پلاسمید و هم چنین تاییدکننده صحت مراحل استخراج پلاسمید بود، از آن جا که ناقل کنترل دارای طول bp2680 و معادل ناقل خالی است، بنابراین میبایست محل قرار گرفتن باند حاصل از پلاسمید نوترکیب بالاتر از پلاسمید کنترل باشد (شکل 5). سپس وکتور تکثیر و خالصسازی شده به MSCs انتقال یافت و پس از ترانسفکت سازه GFP-LC3 به داخل سلولها، به منظور بیان پایدار GFP-LC3 در سلولهای ترانسفکت شده از جنتیسین استفاده شد. ابتدا سلولها با غلظتهای مختلف جنتیسین تیمار شدند و در نهایت غلظت بهینه به دست آمد. سپس سلولهای ترانسفکت شده با غلظت بهینه جنتیسین(ng 120) کشت داده شدند و در نهایت سلولهای پایدار حاوی GFP-LC3
به دست آمد.

شکل 5: ستون 1؛ پلاسمید pUC19 به عنوان کنترل. ستون 2؛ پلاسمید حاوی ژن LC3 . پلاسمید حاوی ژن LC3 نسبت به کنترل سنگینتر بوده و بالاتر قرار میگیرد.
القا و مهار اتوفاژی در سلولهای MSC در حضور راپامایسین و MA3:
از آن جایی که راپامایسین به عنوان عامل القاکننده اتوفاژی و MA3 از عوامل مهار کننده اتوفاژی است، در ابتدای امر برای به دست آوردن میزان بهینه شرایط القا و مهار اتوفاژی، سلولهای بنیادی مزانشیمی در مجاورت غلظتهای مختلف عوامل فوق قرار گرفتند کـه نتایـج بـه
شرح زیر می باشد:

شکل 6 : نقاط سبز رنگ در سلولهای MSC پس از الحاق GFP با LC3 .
در حالت اول در سلولهای بنیادی مزانشیمـال کنتـرل

شکل7: القای اتوفاژی با راپامایسین. A: سلولهای MSC-GFP-LC3 در مواجهه با ng 8 راپامایسین. B: سلولهای MSC-GFP-LC3 در مواجهه با ng 10 راپامایسین. C : سلولهای MSC-GFP-LC3 در مواجهه با ng 14 راپامایسین. فلش قرمز نشاندهنده سلولهای دارای اتوفاژی است. با افزایش غلظت راپامایسین، اتوفاژی هم افزایش مییابد.

نمودار 1: میزان بقای سلولهای MSC در غلظتهای ng/mL 18، 16، 14، 12، 10 و 8 راپامایسین نسبت به حالت کنترل. غلظتهای
ng/mL 14-8 تاثیری در مرگ سلول نداشته و از غلظتهای ng/mL 16 به بالا، مرگ سلولی آغاز شد.
(SD ± Mean ، * : 05/0 p< ، *** : 01/0 p<).

نمودار 2: میزان بقای سلولهای MSC در غلظتهای 14، 12، 10 و 8 ng/mL راپامایسین پس از مواجهه با غلظتهای متفاوت 2O2H
(SD ± Mean ، *** : 001/0 p< ، ** : 01/0 p<).

نمودار 3: بقای سلولهای MSC در غلظت MA 3 ، mM/mL 3-1 پس از مواجهه با غلظتهای متفاوت 2O2H . بقای سلولی در غلظتهای
µM 25-15 2O2H در سلولهای حاوی MA 3 نسبت به کنترل بیشتر است.
(SD ± Mean ، *** : 001/0 p< ، ** : 01/0 p<).
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد هماتولوژی مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدین وسیله از مرکز
تحقیقات انتقال خون و مؤسسه عالی آموزشی و پژوهشی طب انتقال خون که در انجام این پروژه ما را یاری نمودند کمال تشکر را داریم.
متن کامل: (4634 مشاهده)
تاثیر اتوفاژی بر بقای سلولهای بنیادی مزانشیمال پس از مواجهه
با استرسهای اکسیداتیو
علی حسینی1، راحله حلبیان2، پژمان حامدی اصل1، حامد بشیری نهنجی1، محمد علی جلیلی3، مجید حیدری4،
ناصر امیریزاده5، مهریار حبیبی رودکنار6
چکیده
سابقه و هدف
بررسیها نشان داده که سلولهای بنیادی مزانشیمال(MSC) در مدت زمان کوتاهی پس از پیوند میمیرند، که به دلیل شرایط نامطلوب ریز محیط پیوندی در اثر افزایش عوامل استرسی، به ویژه استرسهای اکسیداتیو، هایپوکسی و فقر غذایی میباشد. به دلیل اهمیت موضوع، در این مطالعه اثر اتوفاژی بر بقای سلولهای بنیادی مزانشیمال پس از مواجهه با استرس اکسیداتیو(2O2H) بررسی شد.
مواد و روشها
در یک مطالعه تجربی، سلولهای بنیادی مزانشیمی مغز استخوانMSCs)) با استفاده از فایکول جداسازی و پاساژ سلولی چهارم انتخاب شد. وجود اتوفاژی از طریق شناسایی LC3 (از اجزای اصلی اتوفاگوزوم) با ترانسفکشن وکتور حاوی GFP-LC3 به MSCs بررسی گردید. راپامایسین جهت القای اتوفاژی و تری متیل آدنین(MA3) جهت مهار اتوفاژی به محیط کشت MSCs افزوده شدند. پس از طی دوره انکوباسیون، MSCs با غلظتهای کشنده از 2O2H مواجه و میزان بقای این سلولها با روش MTT Assay ارزیابی شد.
یافتهها
نتایج نشان داد که القای اتوفاژی در MSCs موجب افزایش حساسیت در برابر استرسهای اکسیداتیو و مهار اتوفاژی باعث افزایش مقاومت MSCs نسبت به استرسهای اکسیداتیو و افزایش میزان بقای MSCs در مقایسه با سلولهای کنترل شد.
نتیجه گیری
در این مطالعه نشان داده شد که مهار اتوفاژی در MSCs میتواند به میزان قابل توجهی بقای سلولی را در برابر استرسهای اکسیداتیو بهبود بخشد. در نتیجه استفاده از مهارکنندههای اتوفاژی از قبیل MA3 در پیوند MSCs ممکن است در آیندهای نزدیک، یک راهکار برای افزایش کارآمدی سلول درمانی را فراهم کند.
کلمات کلیدی: سلولهای بنیادی مزانشیمال، اتوفاژی، استرسهای اکسیداتیو، هایپوکسی سلولی، راپامایسین
تاریخ دریافت : 18/2/91
تاریخ پذیرش : 2 /7 /91
1- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- دانشجوی دکترای بیوتکنولوژی ـ مربی مرکز تحقیقات میکروبیوتکنولوژی کاربردی دانشگاه علوم پزشکی بقیهاله(عج) ـ تهران ـ ایران
3- PhD شیمی دارویی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- کارشناس ارشد پاتوبیولوژی ـ مربی مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- مؤلف مسؤول: PhD بیوتکنولوژی پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
با استرسهای اکسیداتیو
علی حسینی1، راحله حلبیان2، پژمان حامدی اصل1، حامد بشیری نهنجی1، محمد علی جلیلی3، مجید حیدری4،
ناصر امیریزاده5، مهریار حبیبی رودکنار6
چکیده
سابقه و هدف
بررسیها نشان داده که سلولهای بنیادی مزانشیمال(MSC) در مدت زمان کوتاهی پس از پیوند میمیرند، که به دلیل شرایط نامطلوب ریز محیط پیوندی در اثر افزایش عوامل استرسی، به ویژه استرسهای اکسیداتیو، هایپوکسی و فقر غذایی میباشد. به دلیل اهمیت موضوع، در این مطالعه اثر اتوفاژی بر بقای سلولهای بنیادی مزانشیمال پس از مواجهه با استرس اکسیداتیو(2O2H) بررسی شد.
مواد و روشها
در یک مطالعه تجربی، سلولهای بنیادی مزانشیمی مغز استخوانMSCs)) با استفاده از فایکول جداسازی و پاساژ سلولی چهارم انتخاب شد. وجود اتوفاژی از طریق شناسایی LC3 (از اجزای اصلی اتوفاگوزوم) با ترانسفکشن وکتور حاوی GFP-LC3 به MSCs بررسی گردید. راپامایسین جهت القای اتوفاژی و تری متیل آدنین(MA3) جهت مهار اتوفاژی به محیط کشت MSCs افزوده شدند. پس از طی دوره انکوباسیون، MSCs با غلظتهای کشنده از 2O2H مواجه و میزان بقای این سلولها با روش MTT Assay ارزیابی شد.
یافتهها
نتایج نشان داد که القای اتوفاژی در MSCs موجب افزایش حساسیت در برابر استرسهای اکسیداتیو و مهار اتوفاژی باعث افزایش مقاومت MSCs نسبت به استرسهای اکسیداتیو و افزایش میزان بقای MSCs در مقایسه با سلولهای کنترل شد.
نتیجه گیری
در این مطالعه نشان داده شد که مهار اتوفاژی در MSCs میتواند به میزان قابل توجهی بقای سلولی را در برابر استرسهای اکسیداتیو بهبود بخشد. در نتیجه استفاده از مهارکنندههای اتوفاژی از قبیل MA3 در پیوند MSCs ممکن است در آیندهای نزدیک، یک راهکار برای افزایش کارآمدی سلول درمانی را فراهم کند.
کلمات کلیدی: سلولهای بنیادی مزانشیمال، اتوفاژی، استرسهای اکسیداتیو، هایپوکسی سلولی، راپامایسین
تاریخ دریافت : 18/2/91
تاریخ پذیرش : 2 /7 /91
1- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- دانشجوی دکترای بیوتکنولوژی ـ مربی مرکز تحقیقات میکروبیوتکنولوژی کاربردی دانشگاه علوم پزشکی بقیهاله(عج) ـ تهران ـ ایران
3- PhD شیمی دارویی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- کارشناس ارشد پاتوبیولوژی ـ مربی مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- مؤلف مسؤول: PhD بیوتکنولوژی پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
MSCs ، گروهی از سلولهای استرومایی غیرخونساز مغز استخوان هستند که در شرایط مناسب کشت سلولی و محیط بدن، توانایی تمایز به ردههای مختلف سلولی از قبیل سلولهای استخوانی، چربی، غضروف و سلولهای عضلانی را دارا میباشند(1). امروزه MSCs به عنوان یک منبع سلولی امید بخش در زمینه سلول درمانی و ژن درمانی جهت درمان بسیاری از بیماریهای کشنده و ژنتیکی مطرح گردیدهاند. با این وجود مشکلات فراوانی از جنبههای گوناگون موجب محدودیتهایی در کاربرد بالینی MSCs شده است. در این خصوص نتایج بسیاری از تحقیقات دلالت بر این دارد که در همان روزهای ابتدایی پس از پیوند به دلیل آسیبهای ناشی از استرسهای اکسیداتیو، فقر غذایی، هایپوکسی و دیگر موارد، تعداد ناچیزی از MSCs زنده میمانند و تنها بهبود عملکرد نواحی حاشیهای بافت آسیب دیده را به همراه دارند(2). در این راستا، ارایه راهکارهای درمانی مؤثر با هدف افزایش کارآیی و ایمنی درمانهای سلولی مبتنی بر MSCs، از موضوعات بسیار مهم تحقیقات جدید به شمار میرود که از آن جمله میتوان به درمان ریز محیط پیوندی جهت کاهش عوامل آسیبرسان مانند رادیکالهای آزاد اکسیژن(OFRs)، بیان یا القای ژنهای بقای سلولی به ترتیب از طریق روشهای مهندسی ژنتیک یا روشهای پیششرطی کردن(preconditioning) را نام برد.
با وجود نتایج رضایتبخش در خصوص هر یک از این روشها، تاکنون جواب قطعی و قابل قبولی به دست نیامده است و هریک در زمینه خاصی با مشکلاتی همراه بوده است. به عنوان مثال در روشهای دستورزی ژنتیکی سلولهای بنیادی با ژنهای بقای سلولی از قبیل AKT ، به دلیل افزایش بقای سلولی به طور دایم و کاهش قابل توجه در میزان آپوپتوز سلولها، خطر وقوع تومورزایی در سلولها مشاهده شده است(3). از طرف دیگر در بررسی نتایج درمان در ژن درمانی، به دلیل طولانی بودن فرآیند پایش و مشخص نبودن محدوده زمانی، از نظر اقتصادی اجرایی نمیباشد.
امنیـت زیستـی درمـان(درمـان بـا کمترین عوارض) از
معیارهای اصلی در استانداردهای کنترل کیفی درمان های سلولی میباشد و در این راستا به منظور استفاده بالینی از MSCs در درمان، علاوه بر دستیابی به تعداد مورد نیاز از سلولهایی با صلاحیت عملکردی مطلوب، بایستی سلولها از نظر ویژگی فنوتیپ و ژنوتیپ سلولی نیز بدون نقص و پایدار باشند، تا افزایش کارآیی و امنیت زیستی پیوند منجر به درمانی استاندارد و موفقیتآمیز گردد.
اتوفاژی یک مسیر کاتابولیک است که به وسیله تشکیل وزیکول با غشای دو لایه به نام اتوفاگوزوم مشخص میگردد. اتوفاگوزوم اجزای درون سیتوپلاسمی را در بر گرفته و به لیزوزومها جهت تجزیه تحویل میدهد. اتوفاژی پس از مواجهه سلول با استرسهای محیطی همانند فقر غذایی، هایپوکسی و رادیکالهای آزاد اکسیژن، القا شده و با فرآیندی تطابقی یا سازگار پذیر(آداپتیو)، از طریق مهیا کردن متابولیتهای انرژیزا، بقای سلول را تداوم میبخشد. به طوری که در مطالعههای اخیر با حذف ژنهای کلیدی فرآیند اتوفاژی، افزایش مرگ سلولی مشاهده شده است. در مطالعههای مشابهی گزارش شده که به واسطه مهار اتوفاژی در سلولها، آپوپتوز افزایش مییابد.
اتوفاژی به عنوان یک فرآیند حیاتی در سلول شناخته میشود که در تکامل زیستی، سیستم ایمنی و مرگ سلولی نقش ایفا میکند و در خصوص اختلالات کشندهای از قبیل تحلیل سیستم عصبی، بیماریهای خود ایمنی و انواع سرطانها تاثیرگذار میباشد. اتوفاژی دارای عملکردی دوگانه میباشد، از یک طرف باعث افزایش مدت و میزان بقای سلول و از طرف دیگر در مراحل پیشرفته باعث مرگ سلول میشود(4). لیکن تاکنون درخصوص نقش اتوفاژی در فرآیند مرگ سلولی توافقی حاصل نشده است و ناهمگونی در نتایج بسیاری از مطالعهها بحثبرانگیز بوده است. با توجه به بررسیهای صورت گرفته، در این مطالعه از اتوفاژی به عنوان یک راهکار درمانی جدید و ایمن با هدف افزایش بقای MSCs پس از مواجهه با استرسهای اکسیداتیو(2O2H) استفاده گردید.
به طور کلی هدف پاسخ به دو سؤال بود: 1- آیا القای
اتوفـاژی با راپامایسین، منجر به افزایش بقای MSCs پس از مواجهه با 2O2H میگردد یا بر عکس؟ 2- آیا مهار اتوفاژی با MA3 منجر به افزایش بقای MSCs پس از مواجهه با 2O2H میگردد یا بر عکس؟
مواد و روشها
پلاسمید و سویه باکتری:
در یک مطالعه تجربی، پلاسمید pEGFP-LC3m (اهدایی از آزمایشگاه پروفسور فوکوموتا در ژاپن) به عنوان وکتور کلونینگ و بیانی و سویه باکتریE.coli (اینویتروژن ـ آمریکا) TOP10 به عنوان میزبان پروکاریوتی جهت ازدیاد وکتور مورد نظر انتخاب شد. وکتور pEGFP-LC3m دارای ژن مقاومت به کانامایسین جهت غربالگری کلونهای ترانسفرم شده در میزبان پروکاریوتی و جنتیسین برای غربالگری کلونهای پایدار ترانسفکت شده در رده سلولی یوکاریوتی میباشد. به منظور بررسی اتوفاژی، وکتور پلاسمیدی pEGFP-LC3m حاوی ژن LC3 و جهت ردیابی سلولهای مورد نظر به وسیله میکروسکوپ فلورسانت، ژن گزارشگر پروتئین فلورسانت سبز(GFP) در ساختار وکتور قرار داده شده بود.
LC3 (ژن مخصوص بررسی اتوفاژی) به صورت tag به پروتئین GFP متصـل اسـت و در متـن ارایه گردید. پروتئین LC3 تعبیه شده در وکتور، یکی از اجزای کلیدی اتوفاژی بوده که به دو صورت LC3 نوع I و II بروز میکند. این پروتئین به طور طبیعی در سیتوپلاسم واقع شده است و در هنگام تشکیل اتوفاگوزوم LC3 نوع I ، به LC3 نوع II تبدیل شده و به غشای دو لایهای اتوفاگوزوم الحاق میگردند، که در نتیجه آن میتوان به طور مستقیم با شناسایی LC3 ، القا شدن اتوفاژی را در سلول شناسایی نمود(5). در این حالت به دلیل این که LC3 به صورت فیوژن به GFP متصل میباشد، نقاط سبز رنگ GFP به صورت نقطه نقطه متراکم در غشای اتوفاگوزومها قابل مشاهده هستند. در غیر این صورت (عدم اتوفازی) GFP به صورت معمول و یکنواخت در کل سیتوپلاسم پراکنده است.
کشت سلولی:
میزان 10 میلیلیتر نمونه آسپیراسیون مغز استخوان یک
داوطلب سالم(با کسب رضایت) در مرکز پیوند مغز استخوان بیمارستان شریعتی جهت جداسازی سلولهای بنیادی مزانشیمال(MSCs) در ضد انعقاد هپارین گرفته شد و در شرایط استریل به مرکز تحقیقات سازمان انتقال خون ایران انتقال یافت.
به طور خلاصه سلولهای تک هستهای مغز استخوان(MNC) با استفاده از فایکول(g/mL 077/1 ؛ آمریکا، آمستردام) با سانتریفوژ شیب غلظتی جداسازی و در محیط کشت سلولی اختصاصی DMEM-Low Glucose (آمریکا ، اینویتروژن) با 10% FBS (آمریکا، اینویتروژن)، 1% پنیسیلین و 1% استرپتومایسین(ایران، سیناژن) در دمای 37 درجه سانتیگراد و 5% CO2 کشت داده شدند.
48 ساعت پس از آغاز کشت، سلولهای غیر چسبنده به وسیله تعویض محیط کشت حذف شدند و سلولهای چسبنده باقی ماندند. تعویض محیط کشت سلولی با فاصله زمانی 3 روز، موجب حذف سلولهای غیر چسبنده شد و در نهایت MSCs حاصل از پاساژ چهارم برای آزمایشهای نهایی فراهم شدند. جهت تایید هویت سلولی، MSCs تکثیر یافته در in vitro از نظر مورفولوژی مورد بررسی قرار گرفتند.
تعیین شاخصهای سطحی MSCs به وسیله فلوسایتومتری:
ابتدا MSCs را باPBS (آمریکا، اینویتروژن) شستشو داده و پس از تریپسینه کردن به فالکن منتقل شدند و به مدت 5 دقیقه سانتریفوژ انجام شد. پس از سانتریفوژ نمودن، مایعرویی را دور ریخته و به ازای هر 104-103 سلول در هر میکرولیتر محیط، 5 میکرولیتر از آنتیبادیهای مونوکلونال مربوطه افزوده شده و به مدت 30 دقیقه در دمای 4 درجه سانتیگراد در تاریکی انکوبه شدند. در انتها 100 میکرولیتر محلول پارافرمالدئید به محلول حاوی سلول و آنتیبادی اضافه گردید و توسط دستگاه فلوسایتومتری، نتایج تجزیه و تحلیل گردید.
ارزیابی توانایی تمایز سلولهای MSC ، به رده سلولی استخوانی:
بـررسی میـزان تمایـز سلولهـای MSC بـا استفـاده از
کیتهای تمایزی اختصاصی به رده سلولی استخوانی حاوی Ascorbate ، L-Glutamin ،β-Glycerophosphate Dexamethasone و رنگآمیزیهای اختصاصی بر روی سلولهای MSC انجام شد. در یک پلیت 24 خانهای به صورت سه تایی، 10000 سلول MSC جداسازی شده (پاساژ 2) ریخته شد و به آنها 5/0 میلیلیتر محیط کشت DMEM-LG حاوی سرم افزوده و پلیت در انکوباتور با دمای 37 درجه سانتیگراد و فشار CO2 5% قرار داده شد. پس از 3 روز، محیط کشت خالی شد و 5/0 میلیلیتر محیط تمایز به سه چاهک افزوده شد. در سه چاهک دیگر که به عنوان کنترل استفاده شدند، تنها محیط کشت اضافه شد(در این چاهکها فقط 10000 سلول MSC معمولی بدون فاکتور تمایزدهنده وجود دارد). به مدت 21 روز، محیط تمایز هر 4-3 روز یک بار تعویض شد. بعد از این مدت در نهایت رنگآمیزی سلولهای تمایزی 2% آلیزارین رد جهت تعیین هویت رده سلولی استخوانی (اوستئوبلاست) مورد استفاده قرار گرفت.
ارزیابی توانایی تمایز سلولهای MSC به رده چربی (آدیپوسیت):
بررسی میزان تمایز سلولهای MSC با استفاده از کیتهای تمایزی اختصاصی به رده سلولی آدیپوسیت حاوی L-Glutamin ، H-Insulin (recombinant) ، IBMX، Indomethacin ، Dexamethasone ، (3-isobutyl-methyl-xanthine) و رنگآمیزیهای اختصاصی بر روی سلولهای MSC انجام شد. ابتدا در یک پلیت 24 خانهای، به صورت سهتایی 15000 سلول MSC به همراه 5/0 میلیلیتر محیط کشت DMEM-LG حاوی سرم ریخته و پلیت در انکوباتور با دمای 37 درجه سانتیگراد و فشار CO2 5% قرار داده شد. پس از 3 روز محیط کشت خالی شد و 5/0 میلیلیتر محیط تمایز به سه چاهک افزوده شد. در سه چاهک دیگر که به عنوان کنترل استفاده شدند، تنها محیط کشت اضافه شد(در این چاهکها فقط 15000 سلول MSC معمولی بدون فاکتور تمایزدهنده وجود دارد). به مدت 7 روز، محیط تمایز هر 4-3 روز یک بار تعویض شد. بعد از این مدت به منظور بررسی تمایز سلولها، رنگآمیزی اختصاصیHCS LipidTOXTM Green Neutral Lipid انجام گرفت.
ترانسفورماسیون وکتور pEGFP-LC3m به میزبان پروکاریوتی:
جهت بررسی میزان اتوفاژی در سلول بنیادی، میبایست سازه حاوی ژن بیانگر اتوفاژی در این سلولها به صورت اکتوپیک بیان شود. بدین منظور از وکتور pEGFP-LC3m استفاده گردید. برای تکثیر این سازه، ابتدا وکتور مذکور به داخل باکتری E.coli سوش TOP10 که با روش CaCl2 سرد آماده شده بود ترانسفورم شد. در پایان مرحله ترانسفورم، باکتری ترانسفورم شده در پلیت LB آگار حاوی آنتیبیوتیک اختصاصی کانامایسین، به مدت یک شب در 37 درجه سانتیگراد انکوبه شد. به دلیل وجود ژن مقاومت به کانامایسین در وکتور، تنها کلونهای حاوی وکتور زنده مانده و بدین صورت کلونهای حاوی وکتور نوترکیب غربالگری شدند. از کلونیهای رشد کرده در محیط انتخابی با استفاده از کیت High Pure Plasmid Isolation (رُوش - آلمان) و طبق دستورالعمل، استخراج پلاسمید نوترکیب صورت گرفت. سپس غلظت(کمیت) پلاسمید استخراج شده با دستگاه نانودراپ اندازهگیری و هم چنین با الکتروفورز بر روی ژل 1% آگارز پلاسمید تعیین کیفیت شد.
ترانسفکشن وکتور pEGFP-LC3m به MSCs جهت القای اتوفاژی:
2 میکروگرم از وکتور pEGFP-LC3m به همراه 5 میکرولیتر از معرف فیوژن 6 (Fugene 6 Transfection Reagent ، آلمان، رُوش) به داخل هر چاهک 6 خانه حاوی سلولهای بنیادی مزانشیمال ترانسفکت گردید. لازم به ذکر است یک روز قبل از ترانسفکت، حدود 500 هزار سلول در هر چاهک 6 خانهای ریخته شد. به منظور به دست آوردن سلولهای بنیادی مزانشیمال GFP-LC3 پایدار، به محیطهای کشت آنتیبیوتیک جنتیسین اضافه گردید. از آن جا که سلولهای حاوی وکتور، دارای ژن مقاوم به جنتیسین بودند، در مقابل این آنتیبیوتیک مقاومت کرده و بقیه سلولها مردند. از زمانی که سلولهای ترانسفکت شده با جنتیسین تیمار شدند، از روز 3 به بعد مرگ سلولی آغاز و بعد از گذشت 16 روز سلولهای پایدار مقاوم به جنتیسین به دست آمد. سپس تعداد 150000- 200000 سلول به هر خانه پلیت کشت سلولی شش خانهای حاوی 2 میلیلیتر محیط کشت اختصاصی DMEM Low Glucose ، FBS دار منتقل گردید. به یک سری از سلولها راپامایسین با غلظت ng/mL 10 (به عنوان القاکننده اتوفاژی) و به سری دیگر MA 3 با غلظت mM/mL 1 (به عنوان مهارکننده اتوفاژی) افزوده و سری سوم به عنوان کنترل درنظر گرفته شد. سپس پلیت در دمای 37 درجه سانتیگراد و 5% CO2 به مدت 24 ساعت انکوبه شد. در نهایت جهت بررسی اتوفاژی در MSCs پلیتهای حاوی سلول، برای مشاهده نقاط سبزرنگ با میکروسکوپ فلورسنت مورد بررسی قرار گرفتند.
به دلیل این که پایه و مبنای این مطالعه بررسی تاثیر اتوفاژی بر بقای سلولهای مزانشیمال بوده و برای این ارزیابی در درجه اول حضوریک ژن بیانگر(مارکر) اتوفاژی از ملزومات مطالعه بود، بنابراین در آزمایشها، گروه کنترل همان سلول ترانسفکت شده با مارکر اتوفاژی LC3 است که با سلولهای ترانسفکت شده و تیمار شده با القاکننده و مهارکننده اتوفاژی مقایسه میشود. در واقع مقایسه بین سلول ترانسفکت شده با LC3 بدون تیمار با القاکننده و مهارکننده اتوفاژی(کنترل) و سلولهای ترانسفکت شده باLC3 و تیمار شده با القاکننده و مهارکننده اتوفاژی است. چون اصل مطالعه بررسی شکست LC3 و ایجاد و مشاهده اتوفاگوزوم در سلولها است در صورت عدم حضور عامل اصلی(LC3 متصل به GFP) این مطالعه معنادار نمیباشد(16، 2).
مواجهه سلولهای MSC با غلظتهای مختلف 2O2H :
ابتدا 12000 سلول در هر خانه پلیت 96 خانهای ریخته
و به محیط کشت DMEM Low Glucose حاوی 10%FBS و آنتیبیوتیک اضافه شد. سپس پلیت به داخل انکوباتور 37 درجه سانتیگرادCO2 دار منتقل و به مدت 24 ساعت انکوبه گردید. پس از این مدت به تعدادی از سلولها راپامایسین(عامل القای اتوفاژی) با غلظتهای 16، 14، 12، 10، 8 نانوگرم، بـه تعـداد دیگـری از سلولهـا MA 3 (عامل مهار اتوفاژی) با غلظتهای mM 3، 2، 1 اضافه شد و مابقی سلولها به عنوان کنترل باقی ماندند. سپس پلیت برای بار دیگر به داخل انکوباتور منتقل و 24 ساعت انکوبه شد. پس از این مدت تمام سلولها به جز کنترل، با غلظتهای 2O2H µm/mL 25، 20، 15، 10 مجاور شدند و به مدت 4 ساعت(در تاریکی) در داخل انکوباتور، انکوبه شدند.
سنجش درصد بقای سلولی با استفاده از آزمون MTT :
پس ازانجام مراحل فوق، ابتدا مایع چاهکها خارج شدند سپس سلولها به مدت 4 ساعت با 10 میکرولیتر از محلول MTT (آمریکا، سیگما) به علاوه 90 میکرولیتر از محیط DMEM Low Glucose داخل انکوباتور 37 درجه سانتیگراد CO2 دار انکوبه شدند. سپس 100 میکرولیتر از محلول DMSO (آلمان، مرک) به علاوه 25 میکرولیتر از بافر سورنسن به چاهکها اضافه و میزان جذب نوری در طول موج 570 نانومتر اندازهگیری شد.
تحلیل آماری و مقایسه میانگینها با استفاده از نرمافزار SPSS در 001/0 p< ، 01/0 p< و 05/0 p< و با در نظر گرفتن خطای معیار(SEM) انجام گردید. تمام مراحل آزمایشهای فوق به صورت سه تایی(تریپلیکیت) انجام شد.
یافتهها
تایید حضور مارکرهای سطحی اختصاصی سلولهای بنیادی مزانشیمال با استفاده از آنتیبادیهای اختصاصی و دستگاه فلوسیتومتری:
پس از کشت سلولهای بنیادی مزانشیمال(MSC) جدا شده از نمونه مغز استخوان و گذشت زمان لازم برای رشد در محیط کشت اختصاصی، مورفولوژی آنها مورد بررسی قرار گرفت. مشاهدات میکروسکوپی نشان داد که سلولهای جدا شده از لحاظ مورفولوژی مشابه سلولهای MSC بودند(شکل 1).

شکل 1: سلولهای بنیادی مزانشیمال جدا شده از مغز استخوان، 7 روز پس از زمان جداسازی پاساژ اول
پس از مشاهدات میکروسکوپی، حضور مارکرهای موجود در سطح سلولها مورد بررسی قرار گرفت. وجود مارکرهای سطحی CD73 , CD29 , CD105 و عدم حضور مارکرهای CD31 , CD45 ، CD34 تاییدکننده سلولهای مزانشیمال بود(شکل 2).

تمایز سلول های MSC به رده سلولی استخوانی (اوستئوبلاست)
شکل2: بررسی مارکرهای اختصاصی سلولهای بنیادی مزانشیمال. وجود مارکرهای سطحی CD37 ، CD29 ، CD105 و عدم حضور مارکرهای CD31، CD45، CD34 تایید کننده سلولهای مزانشیمال بود.
سلولهای MSC با استفاده از مراحل ذکر شده در بخش مواد و روشها، به رده سلولـی استخوانی تمایز داده شد، پـس از 21 روز، رنـگآمیـزی آلیزارین رد 2% صورت گرفت. نتایج بیانگر آن بود که سلولهای MSC توانایی تمایز به رده سلولی استخوانی را داشتند(شکل B3).

شکل 3: توانایی تمایز سلولی سلولهای MSC. A: سلولهای MSC کنترل بدون تیمار با فاکتورهای تمایزی. B : سلولهای MSC تمایز یافته به استخوانی در حضور فاکتورها و محیط اختصاصی سلولهای استخوانساز. C : سلولهای MSC تمایز یافته به سلولهای چربی در حضور فاکتورها و محیط اختصاصی سلولهای چربیساز.
تمایز سلولهای MSC به رده سلولی چربی(آدیپوسیت):
سلول های MSC با استفاده از مراحل ذکر شده در بخش موادو روشها ، به رده سلولی استخوانی تمایز داده شد، پس از 7 روز رنگآمیزی HCS LipidTOXTM Green Neutral Lipid 1% صورت گرفت. نتایج بیانگر آن است که سلولهای MSC دارای خاصیت چند ظرفیتی بوده و به رده چربی تمایز یافتند(شکل C3).
تکثیر وکتور بیانی حاوی ژن LC3 (pEGFP-LC3) :
وکتور نوترکیب با روش شیمیایی به باکتری مستعد انتقال داده شد. از آن جا که ناقل کلونینگ حاوی ژن مقاومت به کانامایسین بود، تنها باکتریهای نوترکیب در محیط کشت LB آگارحاوی آنتیبیوتیک کانامایسین رشد کردند.

شکل 4: اندازهگیری کمیت DNA با استفاده از دستگاه نانودراپ. همان گونه که در نمودار مشخص است، عدد 4/281، نمایانگر غلظت DNA میباشد.
تعیین کمیت و کیفیت DNA پلاسمیدی استخراج شده:
DNA پلاسمیدی از تک کلونهای رشد کرده بر روی پلیت حاوی آنتیبیوتیک در محیط کشت LB و غلظت (کمیت) پلاسمید استخراج شده با دستگاه نانودراپ که یک اسپکتروفتومتر میباشد، اندازهگیری شد(شکل 4). کمیت DNA ng/uL 4/281 بود. جذب نوری نمونهها در طول موج λ 280/260 ، 91/1 بود که نشاندهنده عدم وجود ناخالصی میباشد. پس از این که غلظت DNA پلاسمیدی استخراج شده به کمک نانودراپ تعیین گردید برای آنالیزکیفیت نمونه، از نمونه استخراج شده آزمایش الکتروفورز در کنار ناقل pUC19 به عمل آمد که حضور سه باند بیانگر کویل، سوپرکویل و خطی بودن DNA و نشاندهنده خلوص و عدم شکست در پلاسمید و هم چنین تاییدکننده صحت مراحل استخراج پلاسمید بود، از آن جا که ناقل کنترل دارای طول bp2680 و معادل ناقل خالی است، بنابراین میبایست محل قرار گرفتن باند حاصل از پلاسمید نوترکیب بالاتر از پلاسمید کنترل باشد (شکل 5). سپس وکتور تکثیر و خالصسازی شده به MSCs انتقال یافت و پس از ترانسفکت سازه GFP-LC3 به داخل سلولها، به منظور بیان پایدار GFP-LC3 در سلولهای ترانسفکت شده از جنتیسین استفاده شد. ابتدا سلولها با غلظتهای مختلف جنتیسین تیمار شدند و در نهایت غلظت بهینه به دست آمد. سپس سلولهای ترانسفکت شده با غلظت بهینه جنتیسین(ng 120) کشت داده شدند و در نهایت سلولهای پایدار حاوی GFP-LC3
به دست آمد.

شکل 5: ستون 1؛ پلاسمید pUC19 به عنوان کنترل. ستون 2؛ پلاسمید حاوی ژن LC3 . پلاسمید حاوی ژن LC3 نسبت به کنترل سنگینتر بوده و بالاتر قرار میگیرد.
القا و مهار اتوفاژی در سلولهای MSC در حضور راپامایسین و MA3:
از آن جایی که راپامایسین به عنوان عامل القاکننده اتوفاژی و MA3 از عوامل مهار کننده اتوفاژی است، در ابتدای امر برای به دست آوردن میزان بهینه شرایط القا و مهار اتوفاژی، سلولهای بنیادی مزانشیمی در مجاورت غلظتهای مختلف عوامل فوق قرار گرفتند کـه نتایـج بـه
شرح زیر می باشد:

شکل 6 : نقاط سبز رنگ در سلولهای MSC پس از الحاق GFP با LC3 .
در حالت اول در سلولهای بنیادی مزانشیمـال کنتـرل

شکل7: القای اتوفاژی با راپامایسین. A: سلولهای MSC-GFP-LC3 در مواجهه با ng 8 راپامایسین. B: سلولهای MSC-GFP-LC3 در مواجهه با ng 10 راپامایسین. C : سلولهای MSC-GFP-LC3 در مواجهه با ng 14 راپامایسین. فلش قرمز نشاندهنده سلولهای دارای اتوفاژی است. با افزایش غلظت راپامایسین، اتوفاژی هم افزایش مییابد.
حاوی GFP-LC3 (بدون مهار یا القای اتوفاژی)، نقاط سبز رنگ کمی حدود 1% (مشخص شده با فلش) مشاهده شد که مبین حضور اتوفاژی در سلولهای بنیادی مزانشیمال میباشد. لازم به ذکر است در صورت عدم رخداد اتوفاژی، سلولها به صورت یکنواخت سبز رنگ دیده میشوند و عدم وجود نقاط سبز رنگ(اتوفاگوزومهای حاوی LC3 نوع II) نشاندهنده عدم اتوفاژی است(شکل 6).
در حالت دوم سلولهای بنیادی مزانشیمال حاوی GFP-LC3 با غلظتهای مختلف راپامایسین تیمار شدند. با القای اتوفاژی، درون سلول مناطقی به صورت نقاط سبز رنگ(نقطه نقطه) ایجاد میشود. مشاهده شد هر چه میزان (غلظت) ماده القاکننده بیشتر میشود، حضور و تعداد نقاط سبز رنگ(مشخص شده با فلش) در درون سلول هم فزونی مییابد که این امر مبین اتوفاژی بیشتر میباشد. لازم به ذکر است در سلولهای کنترل(عدم حضور راپامایسین)، میزان نقاط سبز رنگ مشابه حالت اول بود (شکل 7).
در حالت سوم سلولهای بنیادی مزانشیمال حاوی GFP-LC3 که با مهارکننده اتوفاژی(MA3) تیمار شده بودند، مورد بررسی قرار گرفتند و مشاهده شد که تعداد نقاط سبز رنگ به شدت کاهش یافته و در حقیقت نقاط سبز وجود ندارد که مبین کاهش اتوفاژی در این سلولها میباشد. نتایج نشان داد که استفاده از غلظتهای مختلف MA3 ، تاثیری در میزان مهار اتوفاژی نداشته و در واقع در غلظتهای مختلف MA3 ، اتوفاژی به میزان یکسان مهار میگردد. در سلولهای کنترل میزان نقاط سبز رنگ بیشتر میباشد(شکل8).

شکل 8: مهار اتوفاژی با MA3 . مواجهه سلولهای MSC-GFP-LC3 با MA3 منجر به کاهش اتوفاژی گردید.
نتایج بالا نشان داد که میتوان از راپامایسین برای القا و MA3 برای مهار اتوفاژی در سلولهای بنیادی و بررسی اثر آن بر روی سلولهای بنیادی مزانشیمال استفاده کرد.
القای اتوفاژی و کاهش بقای سلولی در سلولهای بنیادی مزانشیمی پس از مواجهه با استرس اکسیداتیو(2O2H):
بـا افـزودن راپامایسیـن(بـه عنوان القاکننده اتوفاژی) با
غلظتهای مختلف به سلولهای MSC ، مشاهده شد که غلظتهای مختلف اتوفاژی به تنهایی، اثر چندانی بر مرگ و یا زنده ماندن سلولها نداشت، البته غلظت بالای راپامایسین باعث مقدار مختصری مرگ در این سلولها شد(منظور از غلظت بالای راپامایسین، غلظت ng/mL 16 میباشد). میانگین و انحراف معیار سلولهای کنترل و MSC تیمار شده با راپامایسین(غلظتng/m 8) حدود 984/0 ± 98 و MSC تیمار شده با راپامایسین (غلظت ng/m 18) حدود 65/1 ± 9/61 بود. میانگین و انحراف معیار سلولهای کنترل در تمامی غلظتها تقریباً یکسان
بود(نمودار 1).
میزان مرگ سلولی با افزایش غلظت 2O2H به سلولهای MSC که اتوفاژی در آنها القا شده بود و کنترل(سلولهایی که هیچ القایی صورت نگرفته بود)، به طور چشمگیری افزایش پیدا کرد، البته میزان مرگ در سلولهای MSC که در آنها اتوفاژی القا شده بود، نمود بیشتری داشت(نمودار2). همان طور که در نمودار مشاهده میشود، درصد مرگ سلولی در مواجهه با 2O2H برای محدوده غلظت ng/mL14-8 راپامایسین مشابه بود و در واقع کاهش بقای سلولی از غلظت 2O2 H µM 15بـه بـالا
در حالت دوم سلولهای بنیادی مزانشیمال حاوی GFP-LC3 با غلظتهای مختلف راپامایسین تیمار شدند. با القای اتوفاژی، درون سلول مناطقی به صورت نقاط سبز رنگ(نقطه نقطه) ایجاد میشود. مشاهده شد هر چه میزان (غلظت) ماده القاکننده بیشتر میشود، حضور و تعداد نقاط سبز رنگ(مشخص شده با فلش) در درون سلول هم فزونی مییابد که این امر مبین اتوفاژی بیشتر میباشد. لازم به ذکر است در سلولهای کنترل(عدم حضور راپامایسین)، میزان نقاط سبز رنگ مشابه حالت اول بود (شکل 7).
در حالت سوم سلولهای بنیادی مزانشیمال حاوی GFP-LC3 که با مهارکننده اتوفاژی(MA3) تیمار شده بودند، مورد بررسی قرار گرفتند و مشاهده شد که تعداد نقاط سبز رنگ به شدت کاهش یافته و در حقیقت نقاط سبز وجود ندارد که مبین کاهش اتوفاژی در این سلولها میباشد. نتایج نشان داد که استفاده از غلظتهای مختلف MA3 ، تاثیری در میزان مهار اتوفاژی نداشته و در واقع در غلظتهای مختلف MA3 ، اتوفاژی به میزان یکسان مهار میگردد. در سلولهای کنترل میزان نقاط سبز رنگ بیشتر میباشد(شکل8).

شکل 8: مهار اتوفاژی با MA3 . مواجهه سلولهای MSC-GFP-LC3 با MA3 منجر به کاهش اتوفاژی گردید.
نتایج بالا نشان داد که میتوان از راپامایسین برای القا و MA3 برای مهار اتوفاژی در سلولهای بنیادی و بررسی اثر آن بر روی سلولهای بنیادی مزانشیمال استفاده کرد.
القای اتوفاژی و کاهش بقای سلولی در سلولهای بنیادی مزانشیمی پس از مواجهه با استرس اکسیداتیو(2O2H):
بـا افـزودن راپامایسیـن(بـه عنوان القاکننده اتوفاژی) با
غلظتهای مختلف به سلولهای MSC ، مشاهده شد که غلظتهای مختلف اتوفاژی به تنهایی، اثر چندانی بر مرگ و یا زنده ماندن سلولها نداشت، البته غلظت بالای راپامایسین باعث مقدار مختصری مرگ در این سلولها شد(منظور از غلظت بالای راپامایسین، غلظت ng/mL 16 میباشد). میانگین و انحراف معیار سلولهای کنترل و MSC تیمار شده با راپامایسین(غلظتng/m 8) حدود 984/0 ± 98 و MSC تیمار شده با راپامایسین (غلظت ng/m 18) حدود 65/1 ± 9/61 بود. میانگین و انحراف معیار سلولهای کنترل در تمامی غلظتها تقریباً یکسان
بود(نمودار 1).
میزان مرگ سلولی با افزایش غلظت 2O2H به سلولهای MSC که اتوفاژی در آنها القا شده بود و کنترل(سلولهایی که هیچ القایی صورت نگرفته بود)، به طور چشمگیری افزایش پیدا کرد، البته میزان مرگ در سلولهای MSC که در آنها اتوفاژی القا شده بود، نمود بیشتری داشت(نمودار2). همان طور که در نمودار مشاهده میشود، درصد مرگ سلولی در مواجهه با 2O2H برای محدوده غلظت ng/mL14-8 راپامایسین مشابه بود و در واقع کاهش بقای سلولی از غلظت 2O2 H µM 15بـه بـالا

نمودار 1: میزان بقای سلولهای MSC در غلظتهای ng/mL 18، 16، 14، 12، 10 و 8 راپامایسین نسبت به حالت کنترل. غلظتهای
ng/mL 14-8 تاثیری در مرگ سلول نداشته و از غلظتهای ng/mL 16 به بالا، مرگ سلولی آغاز شد.
(SD ± Mean ، * : 05/0 p< ، *** : 01/0 p<).

نمودار 2: میزان بقای سلولهای MSC در غلظتهای 14، 12، 10 و 8 ng/mL راپامایسین پس از مواجهه با غلظتهای متفاوت 2O2H
(SD ± Mean ، *** : 001/0 p< ، ** : 01/0 p<).

نمودار 3: بقای سلولهای MSC در غلظت MA 3 ، mM/mL 3-1 پس از مواجهه با غلظتهای متفاوت 2O2H . بقای سلولی در غلظتهای
µM 25-15 2O2H در سلولهای حاوی MA 3 نسبت به کنترل بیشتر است.
(SD ± Mean ، *** : 001/0 p< ، ** : 01/0 p<).
در سلولهای تیمار شده با راپامایسین در مقایسه با کنترل به طور آشکاری نمایان گردید.
مهار اتوفاژی و افزایش بقای سلولی در سلولهای بنیادی مزانشیمی پس از مواجهه با استرس اکسیداتیو(2O2H):
نتایج استفاده از محدوده غلظت mM/mL 3-1 MA3 (به عنوان مهارکننده اتوفاژی) به سلولهای MSC ، نشان داد که مهار اتوفاژی در سلولها هیچ گونه تاثیری بر روند طبیعی مرگ سلولی نداشت. علاوه برآن، کاهش قابل ملاحظه روند مرگ سلولی در سلولهای MSC تیمار شده با MA3 در مواجهه با غلظتهای مختلف 2O2H ، از جمله نکات حایز اهمیت بود. در واقع مهار اتوفاژی با MA3 در سلولهای بنیادی، منجر به مقاومسازی سلولها به شرایط اکسیداتیو- استرس گردید(نمودار3).
بحث
امروزه سلولهای بنیادی مزانشیمال(MSCs) به عنوان یک منبع سلولی بسیار مهم و ایدهآل در رابطه با پیوند شناخته میشوند، از سال 1999 وقتی برای اولین بار ماکینو و همکارانش در آزمایشهای in vitro ، ظرفیت تمایزی MSCs به سلولهای عضله قلبی (کاردیومیوسیتها) را گزارش کردند، تحقیقات در زمینه سلول درمانی و مهندسی بافت به طرز شگفتانگیزی توسعه پیدا کرده است(6). مهمترین مسالهای که در درمان با این سلولها وجود دارد، مرگ اغلب این سلولها در مدت کوتاهی پس از پیوند میباشد که موجب شده کارآیی پیوند بسیار پایینتر از حد انتظار باشد(7). در این رابطه، توما و همکارانش گزارش کردند، کمتر از 44/0% از MSCs در طی 4 روز بعد از پیوند به قلب موشهای SCID ، بقای مطلوبی داشتند(8). عوامل گوناگونی در مرگ زودرس سلولهای MSC در ریز محیط پیوندی نقش دارند. در همین رابطه ژو و همکارانش در طی مطالعاتشان نشان دادند که استرسهای اکسیداتیو و آسیب ایسکمی(فقر غذایی به همراه هایپوکسی)، از دلایل اصلی مرگ زودرس سلولهای MSC در روزهای ابتدایی پس از پیوند میباشند(9).
در این پژوهش برای اولین بار اثر اتوفاژی بر روی بقای سلولهای بنیادی مزانشیمال در شرایط نامطلوب ریز محیط پیوندی، بررسی گردید. اتوفاژی به عنوان یک فرآیند حیاتی در سلول شناخته میشود که در تکامل زیستی، سیستم ایمنی و مرگ سلولی نقش ایفا میکند و نیز در خصوص اختلالات کشندهای از قبیل تحلیل سیستم عصبی، بیماریهای خود ایمنی و انواع سرطانها تاثیرگذار میباشد. اتوفاژی دارای عملکردی دوگانه است، از یک طرف باعث افزایش مدت و میزان بقای سلول و از طــرف
دیگر در مراحل پیشرفته باعث مرگ سلول میشود (10).
بـه طـور کلـی تاکنــون در خصوص نقش اتوفاژی در
فرآیند مرگ سلولی توافقی حاصل نشده است و ناهمگونی در نتایج بسیاری از مطالعهها، بحثبرانگیز بوده است.
استرسهای اکسیداتیو و همچنین فقر سرمی و هایپوکسی که از عوامل اصلی در مرگ زودرس سلولهای MSC در ریز محیط پیوندی میباشند، اتوفاژی را القا میکنند. در تایید این موضوع ماتسو و شرز شوال نشان دادند که استرسهای اکسیداتیو، فقر غذایی، میتوکندری با عملکرد ناقص و همچنین استرسهای رتیکولوم اندوپلاستیک، میتوانند باعث القای اتوفاژی شوند(12، 11).
پلیکانو و همکارانش نشان دادن که تحت شرایط اکسیداتیو، ROS ها که شامل رادیکالهای آزاد سوپر اکسید(O2-)، رادیکالهای هیدروکسیل(OH-) و پر اکسید هیدروژن(2O2H) میباشند، به مقدار زیادی تولید شده و آسیبهای جدی به سلول زده و اغلب باعث مرگ سلول میشوند(13).
یو و همکارانش در طی تحقیقات خود به این نتیجه رسیدند که مرگ سلولی در اثر استرسهای اکسیداتیو، توسط آپوپتوز و به واسطه کاسپازها صورت میگرفت. با مهار کاسپاز همچنان تجزیه کاتالاز و افزایش ROS ها ادامه داشت و باعث مرگ سلولی میشد و نشان دادند این مرگ سلولی توسط اتوفاژی صورت میگرفت(14).
در این مطالعه اتوفاژی به منظور افزایش مقاومت و بقای سلولهای MSC در جهت افزایش کارآیی و بهبود عملکرد این سلولها بعد از پیوند، مورد بررسی قرار گرفت در نتیجه مطابق اهداف یاد شده، اتوفاژی در سلولهای MSC در in vitro پس از مواجهه با غلظتهای کشنده 2O2H ، القا و مهار شد و در ادامه میزان بقای سلولی به طور کمی با آزمایش MTT assay مورد ارزیابی قرار گرفت.
در آزمایشهایی که انجام شد، نتایج حاکی از این بود که مهار اتوفاژی در سلولهای MSC میتواند موجب افزایش مقاومت این سلولها در پاسخ به استرسهای اکسیداتیو(2O2H) شده و بقای سلولی را به میزان قابل توجهی، در مقایسه با حالت کنترل(سلولهای MSC در حالت معمولی) و در حالتی که اتوفاژی در سلولهای MSC القا میشود، بهبود بخشد. در ارتباط با مهار اتوفاژی و اثر آن، چن و همکارانش برای اولین بار نشان دادند که سل لاینهای Hek 293 ، U87 و Hela زمانی که تحت مقادیر مختلف 2O2H قرار گرفتند، مرگ سلولی ایجاد شد و با مهار اتوفاژی نشان دادند که میزان کشندگی 2O2H بدون مهار آپوپتوز بسیار کاهش یافت. اما این میزان کشندگی با مهار آپوپتوز بدون مهار اتوفاژی تغییری نکرد(15).
همچنین در ارتباط با اثر مهار و القای اتوفاژی بر سلولهای مختلف، کواهارا و همکارانش در طی مطالعههایی نشان دادند که با القای اتوفاژی به وسیله راپامایسین، سلولهای سرطانی که به اشعه مقاوم بودند، حساس شده و زودتر میمردند و به درمان با اشعه پاسخ بهتری میدادند و نیز نشان دادند که با مهار اتوفاژی به وسیله MA3 ، سلولهای توموری نسبت به اشعه در رادیوتراپی مقاومت بیشتری نشان میدهند(16).
آزاد و همکارانش هم ثابت کردند که در سلولهای سرطانی سینه وگلیوما(glioma)، هایپوکسی با واسطه اتوفاژی باعث مرگ سلولها میشود. همچنین نشان دادند که اتوفاژی در پیشرفت سرطان پروستات هم نقش دارد(17). کازاوا و همکارانش نشان دادند داروهای شیمیایی مانند آرسنیک تریاکسید یا داروهای سرکوبکننده تومور، با القای مسیر اتوفاژی منجر به مرگ سلولهای سرطانی میشوند و بدین صورت درمان صورت میگیرد(18). لین و همکارانش نشان دادند که مهار اتوفاژی باعث مقاومت بیشتر سلولهای سرطانی پاپیلاری تیروئید به رادیوتراپی میشود، در حالی که القای اتوفاژی ممکن است در درمان این نوع سرطان و کشتن سلولهای سرطانی مقاوم به درمانهای متداول مفید باشد(19).
نتیجهگیری
نتایج آزمایشهای ما نشان میدهد که مهار اتوفاژی در سلولهای بنیادی مزانشیمال ممکن است بتواند یک سیستم دفاعی قوی برای این سلولها در برابر آسیبهای وارده در شرایط in vivo و in vitro فراهم کند.
مهار اتوفاژی و افزایش بقای سلولی در سلولهای بنیادی مزانشیمی پس از مواجهه با استرس اکسیداتیو(2O2H):
نتایج استفاده از محدوده غلظت mM/mL 3-1 MA3 (به عنوان مهارکننده اتوفاژی) به سلولهای MSC ، نشان داد که مهار اتوفاژی در سلولها هیچ گونه تاثیری بر روند طبیعی مرگ سلولی نداشت. علاوه برآن، کاهش قابل ملاحظه روند مرگ سلولی در سلولهای MSC تیمار شده با MA3 در مواجهه با غلظتهای مختلف 2O2H ، از جمله نکات حایز اهمیت بود. در واقع مهار اتوفاژی با MA3 در سلولهای بنیادی، منجر به مقاومسازی سلولها به شرایط اکسیداتیو- استرس گردید(نمودار3).
بحث
امروزه سلولهای بنیادی مزانشیمال(MSCs) به عنوان یک منبع سلولی بسیار مهم و ایدهآل در رابطه با پیوند شناخته میشوند، از سال 1999 وقتی برای اولین بار ماکینو و همکارانش در آزمایشهای in vitro ، ظرفیت تمایزی MSCs به سلولهای عضله قلبی (کاردیومیوسیتها) را گزارش کردند، تحقیقات در زمینه سلول درمانی و مهندسی بافت به طرز شگفتانگیزی توسعه پیدا کرده است(6). مهمترین مسالهای که در درمان با این سلولها وجود دارد، مرگ اغلب این سلولها در مدت کوتاهی پس از پیوند میباشد که موجب شده کارآیی پیوند بسیار پایینتر از حد انتظار باشد(7). در این رابطه، توما و همکارانش گزارش کردند، کمتر از 44/0% از MSCs در طی 4 روز بعد از پیوند به قلب موشهای SCID ، بقای مطلوبی داشتند(8). عوامل گوناگونی در مرگ زودرس سلولهای MSC در ریز محیط پیوندی نقش دارند. در همین رابطه ژو و همکارانش در طی مطالعاتشان نشان دادند که استرسهای اکسیداتیو و آسیب ایسکمی(فقر غذایی به همراه هایپوکسی)، از دلایل اصلی مرگ زودرس سلولهای MSC در روزهای ابتدایی پس از پیوند میباشند(9).
در این پژوهش برای اولین بار اثر اتوفاژی بر روی بقای سلولهای بنیادی مزانشیمال در شرایط نامطلوب ریز محیط پیوندی، بررسی گردید. اتوفاژی به عنوان یک فرآیند حیاتی در سلول شناخته میشود که در تکامل زیستی، سیستم ایمنی و مرگ سلولی نقش ایفا میکند و نیز در خصوص اختلالات کشندهای از قبیل تحلیل سیستم عصبی، بیماریهای خود ایمنی و انواع سرطانها تاثیرگذار میباشد. اتوفاژی دارای عملکردی دوگانه است، از یک طرف باعث افزایش مدت و میزان بقای سلول و از طــرف
دیگر در مراحل پیشرفته باعث مرگ سلول میشود (10).
بـه طـور کلـی تاکنــون در خصوص نقش اتوفاژی در
فرآیند مرگ سلولی توافقی حاصل نشده است و ناهمگونی در نتایج بسیاری از مطالعهها، بحثبرانگیز بوده است.
استرسهای اکسیداتیو و همچنین فقر سرمی و هایپوکسی که از عوامل اصلی در مرگ زودرس سلولهای MSC در ریز محیط پیوندی میباشند، اتوفاژی را القا میکنند. در تایید این موضوع ماتسو و شرز شوال نشان دادند که استرسهای اکسیداتیو، فقر غذایی، میتوکندری با عملکرد ناقص و همچنین استرسهای رتیکولوم اندوپلاستیک، میتوانند باعث القای اتوفاژی شوند(12، 11).
پلیکانو و همکارانش نشان دادن که تحت شرایط اکسیداتیو، ROS ها که شامل رادیکالهای آزاد سوپر اکسید(O2-)، رادیکالهای هیدروکسیل(OH-) و پر اکسید هیدروژن(2O2H) میباشند، به مقدار زیادی تولید شده و آسیبهای جدی به سلول زده و اغلب باعث مرگ سلول میشوند(13).
یو و همکارانش در طی تحقیقات خود به این نتیجه رسیدند که مرگ سلولی در اثر استرسهای اکسیداتیو، توسط آپوپتوز و به واسطه کاسپازها صورت میگرفت. با مهار کاسپاز همچنان تجزیه کاتالاز و افزایش ROS ها ادامه داشت و باعث مرگ سلولی میشد و نشان دادند این مرگ سلولی توسط اتوفاژی صورت میگرفت(14).
در این مطالعه اتوفاژی به منظور افزایش مقاومت و بقای سلولهای MSC در جهت افزایش کارآیی و بهبود عملکرد این سلولها بعد از پیوند، مورد بررسی قرار گرفت در نتیجه مطابق اهداف یاد شده، اتوفاژی در سلولهای MSC در in vitro پس از مواجهه با غلظتهای کشنده 2O2H ، القا و مهار شد و در ادامه میزان بقای سلولی به طور کمی با آزمایش MTT assay مورد ارزیابی قرار گرفت.
در آزمایشهایی که انجام شد، نتایج حاکی از این بود که مهار اتوفاژی در سلولهای MSC میتواند موجب افزایش مقاومت این سلولها در پاسخ به استرسهای اکسیداتیو(2O2H) شده و بقای سلولی را به میزان قابل توجهی، در مقایسه با حالت کنترل(سلولهای MSC در حالت معمولی) و در حالتی که اتوفاژی در سلولهای MSC القا میشود، بهبود بخشد. در ارتباط با مهار اتوفاژی و اثر آن، چن و همکارانش برای اولین بار نشان دادند که سل لاینهای Hek 293 ، U87 و Hela زمانی که تحت مقادیر مختلف 2O2H قرار گرفتند، مرگ سلولی ایجاد شد و با مهار اتوفاژی نشان دادند که میزان کشندگی 2O2H بدون مهار آپوپتوز بسیار کاهش یافت. اما این میزان کشندگی با مهار آپوپتوز بدون مهار اتوفاژی تغییری نکرد(15).
همچنین در ارتباط با اثر مهار و القای اتوفاژی بر سلولهای مختلف، کواهارا و همکارانش در طی مطالعههایی نشان دادند که با القای اتوفاژی به وسیله راپامایسین، سلولهای سرطانی که به اشعه مقاوم بودند، حساس شده و زودتر میمردند و به درمان با اشعه پاسخ بهتری میدادند و نیز نشان دادند که با مهار اتوفاژی به وسیله MA3 ، سلولهای توموری نسبت به اشعه در رادیوتراپی مقاومت بیشتری نشان میدهند(16).
آزاد و همکارانش هم ثابت کردند که در سلولهای سرطانی سینه وگلیوما(glioma)، هایپوکسی با واسطه اتوفاژی باعث مرگ سلولها میشود. همچنین نشان دادند که اتوفاژی در پیشرفت سرطان پروستات هم نقش دارد(17). کازاوا و همکارانش نشان دادند داروهای شیمیایی مانند آرسنیک تریاکسید یا داروهای سرکوبکننده تومور، با القای مسیر اتوفاژی منجر به مرگ سلولهای سرطانی میشوند و بدین صورت درمان صورت میگیرد(18). لین و همکارانش نشان دادند که مهار اتوفاژی باعث مقاومت بیشتر سلولهای سرطانی پاپیلاری تیروئید به رادیوتراپی میشود، در حالی که القای اتوفاژی ممکن است در درمان این نوع سرطان و کشتن سلولهای سرطانی مقاوم به درمانهای متداول مفید باشد(19).
نتیجهگیری
نتایج آزمایشهای ما نشان میدهد که مهار اتوفاژی در سلولهای بنیادی مزانشیمال ممکن است بتواند یک سیستم دفاعی قوی برای این سلولها در برابر آسیبهای وارده در شرایط in vivo و in vitro فراهم کند.
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد هماتولوژی مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدین وسیله از مرکز
تحقیقات انتقال خون و مؤسسه عالی آموزشی و پژوهشی طب انتقال خون که در انجام این پروژه ما را یاری نمودند کمال تشکر را داریم.
نوع مطالعه: پژوهشي |
موضوع مقاله:
سلولهاي بنيادي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



