جلد 22، شماره 4 - ( زمستان 1404 )
جلد 22 شماره 4 صفحات 304-297 |
برگشت به فهرست نسخه ها
Ethics code: IR.TMI.REC.1403.004
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Kheiri Ardahaei F, Yari F, Amo Hossein B. Compairing the Immune Response Induced in Peripheral Blood Mononuclear Cells by RhD+ Red Blood Cells and their Membrane Extract in Culture Medium. bloodj 2025; 22 (4) :297-304
URL: http://bloodjournal.ir/article-1-1604-fa.html
URL: http://bloodjournal.ir/article-1-1604-fa.html
خیری اردهایی فائزه، یاری فاطمه، عموحسین بهناز. مقایسه القای پاسخ ایمنی در سلولهای تک هستهای خون محیطی توسط گلبولهای قرمز واجد آنتیژن RhD و عصاره غشایی حاصل از آن سلولها در محیط کشت سلولی. فصلنامه پژوهشی خون. 1404; 22 (4) :297-304
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 571 kb]
(164 دریافت)
| چکیده (HTML) (164 مشاهده)
روشهای متعددی برای تولید آنتیبـادی وجود دارد، اما موفقیت تمامی آنها وابسته به القای یک ایمنیزایی مؤثر و اختصاصی است (18). بر این اساس، توسعه رویکردهای جایگزین مبتنی بر ایمنیزایی آزمایشگاهی (in vitro immunization) میتواند راهکاری کارآمد و کنترلپذیر برای تولید آنتیبادیهای تشخیصی و درمانی علیه آنتیژنهای خونی به شمار آید (19). در این راستا، انتخاب فرم مناسب آنتیژن برای تحریـک سلولهای ایمنی نقش کلیدی ایفا میکند، زیرا ویژگیهای ساختاری و اپیتوپی آنتیژن، تعیین کننده شدت و اختصاصیت پاسخ هومورال است (12). در مطالعه حاضر، دو فرم آنتیژنی شامل گلبول قرمز O مثبت و عصاره غشایی گلبول قرمز واجد آنتیژن D برای ارزیابی کارآیی ایمنیزایی مورد استفاده قرار گرفتند. نتایج نشان داد که عصاره غشایی گلبول قرمز واجد آنتیژن RhD، توانایی ایمنیزایی بالاتری نسبت به گلبول قرمز کامل دارد. این یافتهها با مشاهدات مطالعههای پیشین همخوانی دارد، به طوری که در مطالعه هندریکسون و همکاران نیز ایمنیزایی نسبتاً پایین گلبول قرمز گزارش شده است (20). با این حال باید توجه داشت که تفاوت در شدت پاسخ ایمنی گزارش شده میان مطالعهها میتواند ناشی از تفاوت در طراحی آزمایش، شرایط کشت سلولی، نحوه ارائه آنتیژن و روشهای سنجش پاسخ ایمنی باشد. در گلبول قرمز، پروتئین RhD به صورت طبیعی در کمپلکس غشایی و در میان سایر پروتئینهای ساختاری قرار دارد و بسیاری از اپیتوپهای آن در دسترس مستقیم سلولهای ایمنی نیستند (20). با این وجود، گلبول قرمز مزیت مهمی همچون ارائه آنتیژن RhD در ساختار طبیعی غشایی خود را دارد و از این نظر نزدیکترین حالت به شرایط فیزیولوژیک in vivo محسوب میشود، اما به علت وجود محدودیتهایی نظیر تراکم نسبتاً کم آنتیژن، دسترسپذیری پائین برخی از اپیتوپها و فقدان پردازش مؤثر آنتیژن در شرایط کشت سلولی میتواند موجب کاهش توان ایمنیزایی آن در محیط in vitro شود (21). در مقابل، فرآیند استخراج غشایی در تهیه عصاره، منجر به آزادسازی آنتیژن و افزایش دسترسپذیری اپیتوپهای سطحی میشود. عصاره غشایی واجد آنتیژن D به دلیل حضور آنتیژنهای سطحی در حالت محلول، افزایش غلظت مؤثر آنتیژن و تسهیل تعامل با سلولهای ارائه دهنده آنتیژن، قادر به القای پاسخ ایمنی قویتری است (22).
این مشاهدات با نتایج استیگس و همکاران همخوانی دارد که نشان میدهند انتخاب فرم آنتیژن و شیوه آمادهسازی آن، نقش کلیدی در شدت و اختصاصیت پاسخ هومورال دارد. علاوه بر این، وجود سایر اجزای غشایی مانند گلیکوپروتئینها و فسفولیپیدها در عصاره غشایی میتواند به عنوان ادجوانتهای طبیعی عمل کرده و به تحریک قویتر پاسخ ایمنی کمک کنند، هر چند امکان القای پاسخهای غیر اختصاصی ناشی از حضور این اجزا نیز باید مد نظر قرار گیرد (23). نتایج این مطالعه نشان میدهد که اگر چه گلبول قرمز کامل از نظر فیزیولوژیـک نزدیکترین فرم به آنتیژن طبیعی است، اما عصاره غشایی از نظر شدت تحریک ایمنی و کارآمدی در ایمنیزایی آزمایشگاهی عملکرد بهتری دارد. در ارزیـابی پاسخ اختصاصی علیه آنتیژن RhD، علیرغم آن که پلیت ELISA با یـک پپتید که نماینده یک اپیتوپ خاص از پروتئین RhD پوشش داده شده بود، هر دو فرم آنتیژنی توانستند پاسخ آنتیبادی اختصاصی قابل شناسایی ایجاد کنند. این موضوع نشان میدهد که در شرایط ایمنیزایی آزمـایشگاهی، اپیتوپهای ایمنیزای کلیدی RhD به میزان کافی در دسترس سلولهای ایمنی قرار گرفته و حتی در حضور طیف وسیع اپیتوپها، پاسخ اختصاصی علیه اپیتوپ پپتیدی هدف نیز القا میشود.
استفاده از ELISA پپتیدی در این مطالعه در مقایسه با روش های مبتنی بر آگلوتیناسیون یـا فلوسیتومتری در سایر مطالعهها، نیز میتواند در تبیین تفاوت نتایج گزارش شده نقش داشته باشد. علاوه بر این، تحقیقات در زمینه ارائه آنتیژن و بهینه سازی ادجوانتها نشان میدهد کـه فرم و نحوه تحویل آنتیژن میتواند پاسخ همورال را تقویـت کند، که مرتبط بـا یافتههای مطالعه حاضر میباشد (24).
نتیجهگیری
بـر اسـاس نتایـج حاصـل از ایــن مطالعـه آزمایشگاهی،
مواجهه سلولهای تکهستهای خون محیطی با عصاره غشایی گلبول قرمز که واجد آنتیژنD بود، در شرایط کشت سلولی، منجر به القای پاسخ هومورال قابل تشخیص با آزمون الایزا شد که از نظر شدت، نسبت به پاسخ ایجاد شده توسط گلبولهای قرمز کامل O⁺ تا حدودی قویتر بود، هر چند تفاوتها معنادار نبودند. با توجه به محدودیت تعداد تکرارهای آزمایش، انجام مطالعههای تکمیلی بـا حجم نمونه بیشتر به منظور تائید آماری این یافتهها ضروری است.
حمایت مالی
این پروژه با حمایت مالی مؤسسه عالی آموزشی و پژوهش طب انتقال خون انجام شده است.
ملاحظات اخلاقی
این مطالعه بـا کد اخلاق IR.TMI.REC.1403.004 انجام شـد و مصـوب کمیتـه اخـلاق مـؤسسه عالـی آمــوزشی و پژوهشی طب انتقال خون ایران میباشد.
عدم تعارض منافع
نویسندگان اظهار میدارند که هیچ گونه تعارض منافعی در مطالعه حاضر وجود ندارد.
نقش نویسندگان
فائزه خیری: انجام کار پژوهش، نوشتن مقاله
دکتر فـاطمه یاری: طراحی مطالعه، نظارت بر انجام مطالعه، همکاری در نگارش مقاله
بهناز عموحسین: همکاری در انجام کار پژوهش
تشکر و قدردانی
این مقاله حاصل بخشی از پایاننامه کارشناسی ارشد مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدینوسیله از معاونت آموزشی و پژوهشی مؤسسه، به جهت حمایت مالی و معنوی تشکر و قدردانی میگردد.
متن کامل: (5 مشاهده)
مقایسه القای پاسخ ایمنی در سلولهای تک هستهای خون محیطی توسط گلبولهای قرمز
واجد آنتیژن RhD و عصاره غشایی حاصل از آن سلولها در محیط کشت سلولی
فائزه خیری اردهایی1، فاطمه یاری2 ، بهناز عموحسین3
1- کارشناس ارشد هماتولوژی آزمایشگاهی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ایمونولوژی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
واجد آنتیژن RhD و عصاره غشایی حاصل از آن سلولها در محیط کشت سلولی
1- کارشناس ارشد هماتولوژی آزمایشگاهی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ایمونولوژی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
  http://dx.doi.org/10.61186/bloodj.21.4.333 Citation: Kheiri Ardahaei F, Yari F, Amo Hossein B. Compairing the Immune Response Induced in Peripheral Blood Mononuclear Cells by RhD+ Red Blood Cells and their Membrane Extract in Culture Medium. J Iran Blood Transfus. 2025: 22 (4): 297-304 نویسنده مسئول: دکتر فاطمه یاری. استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران صندوق پستی: 1157-14665 E-mail:
کد اخلاق: IR.TMI.REC.1403.004 |
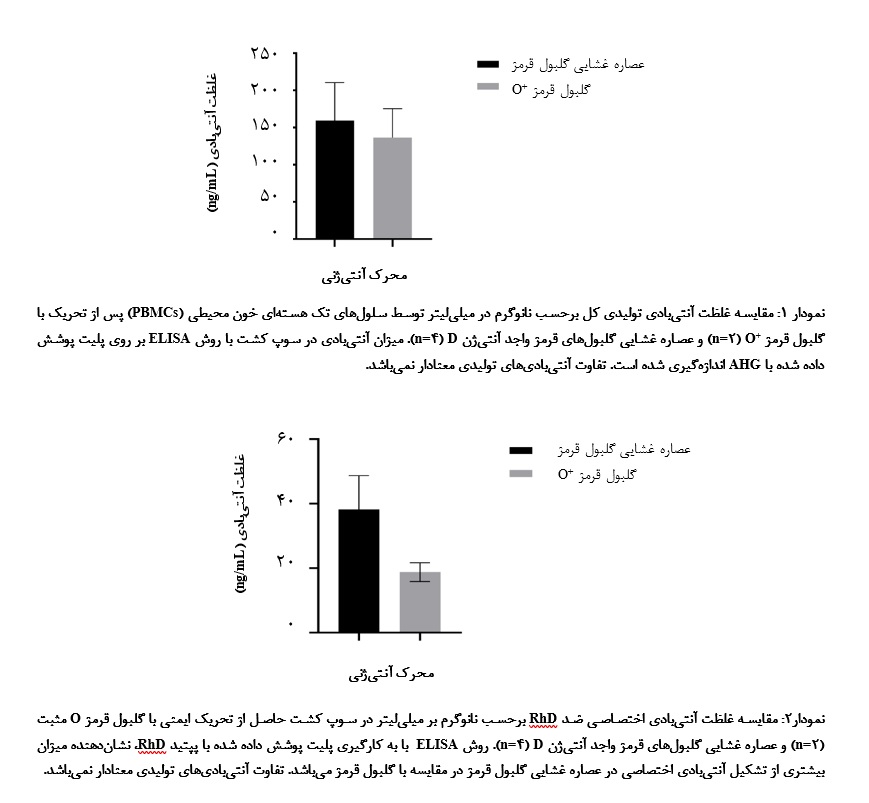
چکیده سابقه و هدف سیستم گروه خونی Rh یکی از مهمترین و پیچیدهترین سیستمهای آنتیژنی پس از ABO است. تولید آنتیبادیهای اختصاصی ضد RhD برای کاربردهای تشخیصی و درمانی اهمیت بالایی دارد. هدف از این مطالعه، ارزیابی پاسخ ایمنی ایجاد شده در سلولهای تک هستهای خون محیطی به وسیله گلبولهای قرمز واجد آنتیژن RhD و عصاره غشایی آنها در محیط کشت سلولی بود. مواد و روشها در این مطالعه تجربی، سلولهای تک هستهای خون محیطی (PBMCs) از 2 کیسه خون کامل با گروه خونی O منفی به روش گرادیان چگالی و با استفاده از معرف فایکول جداسازی شدند. سپس به منظورحذف سلولهای مهارکننده ایمنی، سوسپانسیون سلولی حاصله به مدت 40 دقیقه با لوسین متیل استر (5/2 میلیمولار) مواجه شده و پس از شستشو، در معرض گلبولهای قرمز واجد آنتیژن RhD و عصاره غشایی آنها در محیط کشت قرار گرفته و توانایی آنها در القای تولید آنتیبادی توتال و اختصاصی با استفاده از آزمون ELISA ارزیابی شد. با توجه به محدود بودن تعداد تکرارهای آزمایش، از روش ویلکاکسون به عنوان روش آماری غیر پارامتریک استفاده شد. یافتهها پس از ایمنسازی سلولهای PBMCs با گلبول قرمز O+ و عصاره غشایی آنها، میزان تولید آنتیبادی با روش کمـی ELISA تعیین شد. میانگیـن غلظـت تـوتال آنتیبـادی در مواجهـه بـا عصـاره غشایـی 19/51 ± 3/159 نانوگرم در میلیلیتر (4n=) و در مواجهه با گلبول قرمز کامل 9/38 ± 5/136 نانوگرم در میلیلیتر (2n=) ارزیابی شد. همچنین، غلظت آنتیبادی اختصاصی علیه RhD در حضور عصاره غشایی 58/10 ± 17/38 و در حضور گلبول قرمز کامل 95/2 ± 75/18 نانوگرم در میلیلیتر اندازهگیری شد. بر اساس دادهها، هر دو فرم آنتیژن قادر به القای پاسخ ایمنی هستند. آزمون ویلکاکسون نشان داد که تفاوت بین دو گروه از آنتیژنها در هر دو نوع ارزیابی آنتیبادی کل و آنتیبادیهای اختصاصی RhD معنادار نمیباشد. نتیجه گیری بر اساس یافتههای مطالعه، به نظر میرسد که آنتیژن غشایی گلبول قرمز نسبت به سلول کامل بهتر بتواند در القای پاسخ ایمنی علیه آنتیژن RhD در محیط کشت مؤثر باشد، ولی تفاوت آماری این دو معنادار نبوده و بر این اساس، استفاده از عصاره غشایی گلبول قرمز و سلول کامل هر دو میتوانند در تولید آنتیبادیهای اختصاصی علیه آنتیژن RhD در شرایط کشت سلولی مد نظر قرار گیرند. کلمات کلیدی: محیط کشت، ایمنیزایی، پاسخ آنتیبادی، سلولهای قرمز خون |
مقدمه
سیستم گروه خونی Rh یکی از مهمترین و پیچیدهترین سیستمهای آنتیژنی در طب انتقال خون است که پس از سیستم ABO بیشترین اهمیت بالینی را دارد (1). در میان آنـتیژنهای این سیستم، آنتیژن RhD بـه دلیل ایمونوژنیسیته بالا دارای اهمیت ویژهای میباشد (2). این آنتیژن یک پروتئین غشایی با لوپهای خارج سلولی قابل دسترس برای سیستم ایمنی است (3). حتی مقادیر اندک گلبول قرمز RhD مثبت میتوانند پاسخ ایمنی شدیدی در افراد RhD منفی ایجاد کنند، کـه در شرایط تزریق خون ناسازگار یا بارداری منجر به تولید آنتیبادیهای آلوایمیون علیه RhD میشود (4). تولید آنتیبادیهای اختصاصی ضد RhD در تشخیص و انتقال خون اهمیت دارد و همچنین در تولید فرآوردههای درمانی مانند ایمونوگلوبولین ضد D نقش حیاتی ایفا میکند (6-4). جهت تولید آنتیبادیهای اختصاصی، معمولاً دو رویکرد اصلی وجود دارد: ایمنیزایی در حیوانات (in-vivo immunization) و ایمنیزایی آزمایشگاهی (in-vitro immunization) (7). ایمنیزایی در حیوانات میتواند پاسخ طبیعی با میل ترکیبی بالا و کلاسهای متنوع آنتیبـادی ایجاد کند، اما معایبی مانند هزینه بالا، زمانبر بودن و مسائل اخلاقی دارد (8). در روش ایمنیزایـی in vitro ، سلولهای تک هستـهای یا لنفوسیتهای B و T، در حضور آنتیژن در شرایط کنترل شده، کشت داده میشوند (9). کنترل دقیق شرایط آزمایش، کوتاهتر بودن و عدم وجود سختی کار با حیوانات از مزایـای این نوع ایمنیزایی میباشد (10)، اما برای تولید آنتیبادیهای اختصاصی IgG نیازمند بهینهسازی شرایط کشت است (11). در تولید آنتیبادیهای اختصاصی، نوع آنتیژن، نقش تعیین کنندهای در شدت و اختصاصیت پاسخ ایمنی ایفا میکند (12). گلبولهای قرمز کامل RhD مثبت، که آنتیژن RhD را به صورت طبیعی ارائه میکنند، میتوانند پاسخ ایمنی قوی و پایدار مشابه شرایط in vivo ایجاد کنند، اما دسترسی اپیتوپها و کنترل دقیق دوز در شرایط in vitro محدود است، در حالی که عصاره غشایی آسانتر قابل استفاده است و توانایی القای پاسخ چند اپیتوپی دارد (14، 13)، هر چند احتمال القای پاسخهای غیر اختصاصی وجود دارد (15). با توجه به اهمیت بالینی آنتیژن RhD و نقش کلیدی آنتیبادیهای اختصاصی علیه آن، شناسایی شکل آنتیژنی مؤثر برای القای پاسخ ایمنی در شرایط آزمایشگاهی اهمیت فراوانی دارد. در این مطالعـه،
سلولهای تک هستهای خون محیطی (PBMC) در شرایط کشت آزمایشگاهی با عصاره غشایی دارای آنتیژن D و گلبول قرمز O مثبت در چاهـکهای جداگانـه، تحریک شدند. سپس به منظور سنجش توانایی این اشکال آنتیژنی در القای تولید آنتیبادی اختصاصی، سوپرناتانت حاصل از کشت سلولها، با روش الایزا مورد سنجش قرار گرفتند. هدف نهایی پژوهش، ارزیابی پتانسیل ایمنیزایی عصاره غشایی دارای آنتیژن D و گلبول قرمز O+ در القای پاسخ ایمنی اختصاصی و شناسایی رویکرد بهینه برای ایمنیزایی in vitro علیه این آنتیژن بود.
مواد و روشها
جداسازی سلولهای تک هستهای از خون کامل:
سلولهای تک هستهای خون محیطی (PBMC) از 2 کیسه خون کامل O منفی با استفاده از روش استاندارد گرادیان چگالی فایکول (بهار افشان، ایران) جدا شدند (17، 16). سلولها پس از شستشو با بافر فسفات (PBS) برای کشت سلولی آماده شدند. به منظور حـذف سلولهای سرکوبگر ایمنی، سوسپانسیون سلولی با ال لوسین متیل استر (مرک، آلمان) بـا غلظت 5/2 میلیمولار تیمار گردیده و به مدت 40 دقیقه در شرایط انکوباسیون نگهداری شد. در پایان سلولها سه بار با PBS شستشـو داده شدند (هر 5 دقیقه با دور g400). در نهایـت، رسوب سلولی هموژن گردید و حجم آن با محیط کشت RPMI (بایوسرا، فرانسه) حـاوی 10 % FBS (گرینر، آلمان) به 4 میلیلیتر رسانده شد.
آمادهسازی آنتیژنها:
عصاره آنتیژن D بـا لیز سلولهای RhD مثبت و استخراج پروتئینهای غشایی با استفاده از روشهای استاندارد تهیه شد. برای دستیابی به عصاره غشایی محلول واجد RhD جهت ایمونیزاسیون در محیط کشت، 3 کیسه گلبول قرمز متراکم از پـایگاه انتقال خون تهران تهیه شد. گلبولهای قرمز با انجام سانتریفوژ از سایر سلولهای خونی جدا شده و با بافر محلولسازی یا solubilize واجد تریس، Nonidet P-40 و EDTA مواجه شدنـد. در ضمن از مهار کننده پروتئازی PMSF نیز در بـافر مورد نظر استفاده شد:
25 mM Tris-HCL, 150 mM NaCL, 10 mM EDTA, 1.0% NP-40, pH 7.5 and 2 mM phenylmethylsulfonyl fluoride
پروتئینهای غشایی محلولسازی شده و بـا انجام سانتریفوژ از سایر اجزا سلولی جدا شدند. سوپرناتانت پس از جمعآوری، دیالیز شد تـا بافر محلولسازی از پیرامون پروتئینها خـارج شده و با PBS جایگزین گردد. به این منظور، از کیسه دیالیز استفاده شد. گلبولهای قرمز RhD مثبت از خون اهدایی RhD مثبت تهیه و پس از شستشو با PBS در شرایط استریل، مورد استفاده قرار گرفت.
ایمونیزاسیون سلولی در محیط کشت:
سلولهای تک هستهای خون محیطی، پس از شمارش در هر چاهک به تعداد 105×3 سلول توزیع شدند و به طور جداگانه با گلبولهای قرمز و عصاره غشایی آنها تحریک شدنـد: 10 میکرولیتر عصاره آنتیژن RhDحاوی μg1 پروتئین و 3 میکرولیتر گلبول قرمز O+ استفاده شد. برای تقویـت پاسخ ایمنی، 15 میکرولیتر اینترلوکین-4 (ابکم، انگلستان) بـا غلظت pg/mL 19 و 30 میکرولیتر اینترفرون گاما (ابکم، انگلستان) با غلظت pg/mL 9/6 به محیط کشت اضافه گردیـدند. پس از پایان مواجهه سلولی، پلیتهای کشت سلولی به درون انکوباتور CO2 دار منتقل شدند.
سنجش تولید آنتیبادی با روش ELISA :
پس از یک هفته انکوباسیون، سوپرناتانت کشت سلولی جمعآوری و برای سنجش تولید آنتیبادی مورد استفاده قرار گرفت. از پلیتهای پوشش داده شده با آنتیهیومن گلوبولین (AHG) (ابکم، انگلستان) جهت سنجش توتال آنتیبادی و از پلیت پوشش داده شده با پپتید ویژه RhD (کپنهاک، دانمارک) برای سنجش آنتیبادیهای اختصاصی استفاده شد. مقادیر آنتیبادی ایجاد شده، با به کارگیری استانداردهای IgG انسانی بر حسب ng/mL تعیین گردید. برای آمادهسازی پلیت الایزای AHG، محلول AHG با غلظت نهایی 5 میکروگرم در میلیلیتر تهیه شد. سپس، به هر چاهـک از پلیت 96 خانهای الایزا، به جز چاهکهای انتهایـی هر ردیف، مقدار 50 میکرولیتر از این محلول افزوده شد. چاهک انتهایی هر ستون پلیت الایزا، تنها 50 میکرولیتر بافر PBS اضافه شد تا به عنوان کنترل منفی مورد استفاده قرار گیرد. سپس، پلیتهای پوشش داده شده در دمای 4 درجه سانتیگراد به مدت 24 ساعت انکوبـه شدند. برای آمادهسازی پلیت پوشش داده شده با پپتید RhD، به منظور سنجش آنتیبادیهای اختصاصی، ابتدا پپتید با غلظت اولیه 100 میکروگرم بر میلیلیتر بـه میزان 40 بار رقیق شده تا به پپتید بـا غلظت 5/2 میکروگرم بر میلیلیتر دست یافته شود. سپس بـه چاهـکهای پلیت 96 خـانهای الایزا به استثناء چاهکهای انتهایی هر ردیف به میزان 50 میکرولیتر اضافه شد و به چاهکهای انتهایی هر ردیف هم بـه عنوان چاهک کنترل منفی، 50 میکرولیتر PBS اضافه شد. سپس پلیت در دمای 4 درجه سانتیگراد به مدت 24 ساعت انکوبه شد. پس از اتمام مرحله پوششدهی، به منظور بلوکـه کردن مناطق خالی هر چاهک و جلوگیری از نتایج کـاذب از سرم آلبومین گاوی 2% (مدیتال، ایران) استفاده شد. بدین منظور، به هر چاهک 100 میکرولیتر محلول بلوکه کننده افزوده شد.
شیوه اجرای ELISA :
به منظور اجرای آزمون الایزا، 50 میکرولیتراز سوپ رویی هر چاهک کشت به چاهکهای پلیت 96 خانـهای الایزا افزوده شد و پلیتها به مدت 40 دقیقه در انکوباتور 37 درجه سانتیگراد انکوبـه گردیدند. در هنگام اجرای آزمون الایزای کمی، علاوه بر سوپرناتانت کشت سلولی، 50 میکرولیتر از نمونههای استاندارد تهیه شده نیز استفاده شد. لازم به ذکر است که سوپ رویی چاهکهای پلیت کشت سلولی و استانداردهای تهیه شده به صورت دوتایی (duplicate) مورد آزمایـش قرار گرفتند. پس از پایان انکوباسیون، محلول هر چاهک تخلیه شد و پلیتها به طور متوالی سه بـار با محلول شستشو دهنده (washing buffer) (آدالتیس، ایتالیا) شستشو داده شدند. سپس 50 میکرولیتر محلول کونژوگه آنتیهیومـن گلوبولین-HRP (سیناژن، ایران) در رقت بهینه به چاهکها افزوده شد و پلیتها بـه مدت 40 دقیقه در انکوبـاتور 37 درجه سانتیگراد انکوبه گردید. پس از اتمام انکوباسیون و تکرار شست و شو، 50 میکرولیتر محلول سوبسترای TMB (زیمنس، آلمان) به چاهک ها اضافه شد و انکوباسیون به مدت 10 دقیقه در تاریکی صورت پـذیرفت. در نهایت 25 میکرولیتر محلول متوقفکننده (stop solution) (اینویتروژن، آمریـکا) بـه چاهکها اضافه گردید و قرائت جذب نوری (OD) چاهکها بـا دستگاه الایزا ریدر TECAN در طول موج 450 نانومتر انجام گرفت.
نرمافزارهای آماری و آزمونهای آماری:
برای تعیین غلظت آنتیبادیهای تولید شده از الایزا کمی استفاده شد. دادههای حاصل بـا نرمافزار 2016 Microsoft Excel تجزیه و تحلیل گردید و میانگین ± انحراف معیار (Mean ± SD) مقادیر مربوط بـه هر گروه تیماری براساس نتایج تکرار آزمایش محاسبه شد. بـا توجه به محدود بـودن تعداد تکرارهای آزمایش، روش ویلکاکسون به عنوان روش آماری غیر پارامتریک استفاده شد.
یافتهها
بررسی سطح پاسخ ایمنی تولید شده بر علیه آنتیژن RhD در محیط کشت:
پس از ایمنسازی سلولهای تک هستهای خون محیطی بـا گلبولهای قرمز واجد آنتیژن RhD و عصاره غشایی آنها، غلظت آنتیبادی تولید شده در سوپرناتانت کشت سلولی با روش الایزا به صورت کمی تعیین گردید. غلظت آنتیبادی تولید شده برای توتال آنتیبادی (پلیت پوشش داده شده با AHG) و آنتیبادی اختصاصی علیه RhD (پلیت پوشش داده شـده بـا پپتید) بـه شـرح زیــر میباشد: برای
سلولهای تحریک شده با عصاره غشایـی، توتـال آنتیبـادی 19/51 ±3/159 نانوگرم در میلیلیتر و آنتیبادی اختصاصی 58/10 ± 17/38 نانوگرم در میلیلیتر (4(n= اندازهگیری شد و برای تحریک با گلبول قرمز کـامل، توتال آنتیبادی 9/38 ± 5/136 نانوگرم در میلیلیتر و آنتیبادی اختصاصی 95/2 ± 75/18 نانوگرم در میلیلیتر (2(n= میباشد. مقادیر به صورت میانگین ± انحراف معیار، حاصل از تکرار آزمایش برای هر گروه تیمارشده محاسبه شد. نتایج نشان داد که بین گروههای مختلف تیماری در سطح تولید آنتیبـادی تفاوت وجود دارد هر چند تفاوتها معنادار نمیباشند. روش ویلکاکسون نشان داد که تفاوت بین دو گروه از آنتیژنها در هر دو نوع ارزیابی آنتیبادی کل و آنتیبادیهای اختصاصی RhD معنادار نمیباشد. نمایش گرافیکی دادهها به صورت نمودار میلهای آمده است (نمودارهای 1 و 2).
سیستم گروه خونی Rh یکی از مهمترین و پیچیدهترین سیستمهای آنتیژنی در طب انتقال خون است که پس از سیستم ABO بیشترین اهمیت بالینی را دارد (1). در میان آنـتیژنهای این سیستم، آنتیژن RhD بـه دلیل ایمونوژنیسیته بالا دارای اهمیت ویژهای میباشد (2). این آنتیژن یک پروتئین غشایی با لوپهای خارج سلولی قابل دسترس برای سیستم ایمنی است (3). حتی مقادیر اندک گلبول قرمز RhD مثبت میتوانند پاسخ ایمنی شدیدی در افراد RhD منفی ایجاد کنند، کـه در شرایط تزریق خون ناسازگار یا بارداری منجر به تولید آنتیبادیهای آلوایمیون علیه RhD میشود (4). تولید آنتیبادیهای اختصاصی ضد RhD در تشخیص و انتقال خون اهمیت دارد و همچنین در تولید فرآوردههای درمانی مانند ایمونوگلوبولین ضد D نقش حیاتی ایفا میکند (6-4). جهت تولید آنتیبادیهای اختصاصی، معمولاً دو رویکرد اصلی وجود دارد: ایمنیزایی در حیوانات (in-vivo immunization) و ایمنیزایی آزمایشگاهی (in-vitro immunization) (7). ایمنیزایی در حیوانات میتواند پاسخ طبیعی با میل ترکیبی بالا و کلاسهای متنوع آنتیبـادی ایجاد کند، اما معایبی مانند هزینه بالا، زمانبر بودن و مسائل اخلاقی دارد (8). در روش ایمنیزایـی in vitro ، سلولهای تک هستـهای یا لنفوسیتهای B و T، در حضور آنتیژن در شرایط کنترل شده، کشت داده میشوند (9). کنترل دقیق شرایط آزمایش، کوتاهتر بودن و عدم وجود سختی کار با حیوانات از مزایـای این نوع ایمنیزایی میباشد (10)، اما برای تولید آنتیبادیهای اختصاصی IgG نیازمند بهینهسازی شرایط کشت است (11). در تولید آنتیبادیهای اختصاصی، نوع آنتیژن، نقش تعیین کنندهای در شدت و اختصاصیت پاسخ ایمنی ایفا میکند (12). گلبولهای قرمز کامل RhD مثبت، که آنتیژن RhD را به صورت طبیعی ارائه میکنند، میتوانند پاسخ ایمنی قوی و پایدار مشابه شرایط in vivo ایجاد کنند، اما دسترسی اپیتوپها و کنترل دقیق دوز در شرایط in vitro محدود است، در حالی که عصاره غشایی آسانتر قابل استفاده است و توانایی القای پاسخ چند اپیتوپی دارد (14، 13)، هر چند احتمال القای پاسخهای غیر اختصاصی وجود دارد (15). با توجه به اهمیت بالینی آنتیژن RhD و نقش کلیدی آنتیبادیهای اختصاصی علیه آن، شناسایی شکل آنتیژنی مؤثر برای القای پاسخ ایمنی در شرایط آزمایشگاهی اهمیت فراوانی دارد. در این مطالعـه،
سلولهای تک هستهای خون محیطی (PBMC) در شرایط کشت آزمایشگاهی با عصاره غشایی دارای آنتیژن D و گلبول قرمز O مثبت در چاهـکهای جداگانـه، تحریک شدند. سپس به منظور سنجش توانایی این اشکال آنتیژنی در القای تولید آنتیبادی اختصاصی، سوپرناتانت حاصل از کشت سلولها، با روش الایزا مورد سنجش قرار گرفتند. هدف نهایی پژوهش، ارزیابی پتانسیل ایمنیزایی عصاره غشایی دارای آنتیژن D و گلبول قرمز O+ در القای پاسخ ایمنی اختصاصی و شناسایی رویکرد بهینه برای ایمنیزایی in vitro علیه این آنتیژن بود.
مواد و روشها
جداسازی سلولهای تک هستهای از خون کامل:
سلولهای تک هستهای خون محیطی (PBMC) از 2 کیسه خون کامل O منفی با استفاده از روش استاندارد گرادیان چگالی فایکول (بهار افشان، ایران) جدا شدند (17، 16). سلولها پس از شستشو با بافر فسفات (PBS) برای کشت سلولی آماده شدند. به منظور حـذف سلولهای سرکوبگر ایمنی، سوسپانسیون سلولی با ال لوسین متیل استر (مرک، آلمان) بـا غلظت 5/2 میلیمولار تیمار گردیده و به مدت 40 دقیقه در شرایط انکوباسیون نگهداری شد. در پایان سلولها سه بار با PBS شستشـو داده شدند (هر 5 دقیقه با دور g400). در نهایـت، رسوب سلولی هموژن گردید و حجم آن با محیط کشت RPMI (بایوسرا، فرانسه) حـاوی 10 % FBS (گرینر، آلمان) به 4 میلیلیتر رسانده شد.
آمادهسازی آنتیژنها:
عصاره آنتیژن D بـا لیز سلولهای RhD مثبت و استخراج پروتئینهای غشایی با استفاده از روشهای استاندارد تهیه شد. برای دستیابی به عصاره غشایی محلول واجد RhD جهت ایمونیزاسیون در محیط کشت، 3 کیسه گلبول قرمز متراکم از پـایگاه انتقال خون تهران تهیه شد. گلبولهای قرمز با انجام سانتریفوژ از سایر سلولهای خونی جدا شده و با بافر محلولسازی یا solubilize واجد تریس، Nonidet P-40 و EDTA مواجه شدنـد. در ضمن از مهار کننده پروتئازی PMSF نیز در بـافر مورد نظر استفاده شد:
25 mM Tris-HCL, 150 mM NaCL, 10 mM EDTA, 1.0% NP-40, pH 7.5 and 2 mM phenylmethylsulfonyl fluoride
پروتئینهای غشایی محلولسازی شده و بـا انجام سانتریفوژ از سایر اجزا سلولی جدا شدند. سوپرناتانت پس از جمعآوری، دیالیز شد تـا بافر محلولسازی از پیرامون پروتئینها خـارج شده و با PBS جایگزین گردد. به این منظور، از کیسه دیالیز استفاده شد. گلبولهای قرمز RhD مثبت از خون اهدایی RhD مثبت تهیه و پس از شستشو با PBS در شرایط استریل، مورد استفاده قرار گرفت.
ایمونیزاسیون سلولی در محیط کشت:
سلولهای تک هستهای خون محیطی، پس از شمارش در هر چاهک به تعداد 105×3 سلول توزیع شدند و به طور جداگانه با گلبولهای قرمز و عصاره غشایی آنها تحریک شدنـد: 10 میکرولیتر عصاره آنتیژن RhDحاوی μg1 پروتئین و 3 میکرولیتر گلبول قرمز O+ استفاده شد. برای تقویـت پاسخ ایمنی، 15 میکرولیتر اینترلوکین-4 (ابکم، انگلستان) بـا غلظت pg/mL 19 و 30 میکرولیتر اینترفرون گاما (ابکم، انگلستان) با غلظت pg/mL 9/6 به محیط کشت اضافه گردیـدند. پس از پایان مواجهه سلولی، پلیتهای کشت سلولی به درون انکوباتور CO2 دار منتقل شدند.
سنجش تولید آنتیبادی با روش ELISA :
پس از یک هفته انکوباسیون، سوپرناتانت کشت سلولی جمعآوری و برای سنجش تولید آنتیبادی مورد استفاده قرار گرفت. از پلیتهای پوشش داده شده با آنتیهیومن گلوبولین (AHG) (ابکم، انگلستان) جهت سنجش توتال آنتیبادی و از پلیت پوشش داده شده با پپتید ویژه RhD (کپنهاک، دانمارک) برای سنجش آنتیبادیهای اختصاصی استفاده شد. مقادیر آنتیبادی ایجاد شده، با به کارگیری استانداردهای IgG انسانی بر حسب ng/mL تعیین گردید. برای آمادهسازی پلیت الایزای AHG، محلول AHG با غلظت نهایی 5 میکروگرم در میلیلیتر تهیه شد. سپس، به هر چاهـک از پلیت 96 خانهای الایزا، به جز چاهکهای انتهایـی هر ردیف، مقدار 50 میکرولیتر از این محلول افزوده شد. چاهک انتهایی هر ستون پلیت الایزا، تنها 50 میکرولیتر بافر PBS اضافه شد تا به عنوان کنترل منفی مورد استفاده قرار گیرد. سپس، پلیتهای پوشش داده شده در دمای 4 درجه سانتیگراد به مدت 24 ساعت انکوبـه شدند. برای آمادهسازی پلیت پوشش داده شده با پپتید RhD، به منظور سنجش آنتیبادیهای اختصاصی، ابتدا پپتید با غلظت اولیه 100 میکروگرم بر میلیلیتر بـه میزان 40 بار رقیق شده تا به پپتید بـا غلظت 5/2 میکروگرم بر میلیلیتر دست یافته شود. سپس بـه چاهـکهای پلیت 96 خـانهای الایزا به استثناء چاهکهای انتهایی هر ردیف به میزان 50 میکرولیتر اضافه شد و به چاهکهای انتهایی هر ردیف هم بـه عنوان چاهک کنترل منفی، 50 میکرولیتر PBS اضافه شد. سپس پلیت در دمای 4 درجه سانتیگراد به مدت 24 ساعت انکوبه شد. پس از اتمام مرحله پوششدهی، به منظور بلوکـه کردن مناطق خالی هر چاهک و جلوگیری از نتایج کـاذب از سرم آلبومین گاوی 2% (مدیتال، ایران) استفاده شد. بدین منظور، به هر چاهک 100 میکرولیتر محلول بلوکه کننده افزوده شد.
شیوه اجرای ELISA :
به منظور اجرای آزمون الایزا، 50 میکرولیتراز سوپ رویی هر چاهک کشت به چاهکهای پلیت 96 خانـهای الایزا افزوده شد و پلیتها به مدت 40 دقیقه در انکوباتور 37 درجه سانتیگراد انکوبـه گردیدند. در هنگام اجرای آزمون الایزای کمی، علاوه بر سوپرناتانت کشت سلولی، 50 میکرولیتر از نمونههای استاندارد تهیه شده نیز استفاده شد. لازم به ذکر است که سوپ رویی چاهکهای پلیت کشت سلولی و استانداردهای تهیه شده به صورت دوتایی (duplicate) مورد آزمایـش قرار گرفتند. پس از پایان انکوباسیون، محلول هر چاهک تخلیه شد و پلیتها به طور متوالی سه بـار با محلول شستشو دهنده (washing buffer) (آدالتیس، ایتالیا) شستشو داده شدند. سپس 50 میکرولیتر محلول کونژوگه آنتیهیومـن گلوبولین-HRP (سیناژن، ایران) در رقت بهینه به چاهکها افزوده شد و پلیتها بـه مدت 40 دقیقه در انکوبـاتور 37 درجه سانتیگراد انکوبه گردید. پس از اتمام انکوباسیون و تکرار شست و شو، 50 میکرولیتر محلول سوبسترای TMB (زیمنس، آلمان) به چاهک ها اضافه شد و انکوباسیون به مدت 10 دقیقه در تاریکی صورت پـذیرفت. در نهایت 25 میکرولیتر محلول متوقفکننده (stop solution) (اینویتروژن، آمریـکا) بـه چاهکها اضافه گردید و قرائت جذب نوری (OD) چاهکها بـا دستگاه الایزا ریدر TECAN در طول موج 450 نانومتر انجام گرفت.
نرمافزارهای آماری و آزمونهای آماری:
برای تعیین غلظت آنتیبادیهای تولید شده از الایزا کمی استفاده شد. دادههای حاصل بـا نرمافزار 2016 Microsoft Excel تجزیه و تحلیل گردید و میانگین ± انحراف معیار (Mean ± SD) مقادیر مربوط بـه هر گروه تیماری براساس نتایج تکرار آزمایش محاسبه شد. بـا توجه به محدود بـودن تعداد تکرارهای آزمایش، روش ویلکاکسون به عنوان روش آماری غیر پارامتریک استفاده شد.
یافتهها
بررسی سطح پاسخ ایمنی تولید شده بر علیه آنتیژن RhD در محیط کشت:
پس از ایمنسازی سلولهای تک هستهای خون محیطی بـا گلبولهای قرمز واجد آنتیژن RhD و عصاره غشایی آنها، غلظت آنتیبادی تولید شده در سوپرناتانت کشت سلولی با روش الایزا به صورت کمی تعیین گردید. غلظت آنتیبادی تولید شده برای توتال آنتیبادی (پلیت پوشش داده شده با AHG) و آنتیبادی اختصاصی علیه RhD (پلیت پوشش داده شـده بـا پپتید) بـه شـرح زیــر میباشد: برای
سلولهای تحریک شده با عصاره غشایـی، توتـال آنتیبـادی 19/51 ±3/159 نانوگرم در میلیلیتر و آنتیبادی اختصاصی 58/10 ± 17/38 نانوگرم در میلیلیتر (4(n= اندازهگیری شد و برای تحریک با گلبول قرمز کـامل، توتال آنتیبادی 9/38 ± 5/136 نانوگرم در میلیلیتر و آنتیبادی اختصاصی 95/2 ± 75/18 نانوگرم در میلیلیتر (2(n= میباشد. مقادیر به صورت میانگین ± انحراف معیار، حاصل از تکرار آزمایش برای هر گروه تیمارشده محاسبه شد. نتایج نشان داد که بین گروههای مختلف تیماری در سطح تولید آنتیبـادی تفاوت وجود دارد هر چند تفاوتها معنادار نمیباشند. روش ویلکاکسون نشان داد که تفاوت بین دو گروه از آنتیژنها در هر دو نوع ارزیابی آنتیبادی کل و آنتیبادیهای اختصاصی RhD معنادار نمیباشد. نمایش گرافیکی دادهها به صورت نمودار میلهای آمده است (نمودارهای 1 و 2).
|
عصاره غشایی گلبول قرمز
گلبول قرمز O+ |
|
محرک آنتیژنی
|
|
غلظت آنتیبادی (ng/mL)
|
|
250
200 150 100 50 0 |

بحث
روشهای متعددی برای تولید آنتیبـادی وجود دارد، اما موفقیت تمامی آنها وابسته به القای یک ایمنیزایی مؤثر و اختصاصی است (18). بر این اساس، توسعه رویکردهای جایگزین مبتنی بر ایمنیزایی آزمایشگاهی (in vitro immunization) میتواند راهکاری کارآمد و کنترلپذیر برای تولید آنتیبادیهای تشخیصی و درمانی علیه آنتیژنهای خونی به شمار آید (19). در این راستا، انتخاب فرم مناسب آنتیژن برای تحریـک سلولهای ایمنی نقش کلیدی ایفا میکند، زیرا ویژگیهای ساختاری و اپیتوپی آنتیژن، تعیین کننده شدت و اختصاصیت پاسخ هومورال است (12). در مطالعه حاضر، دو فرم آنتیژنی شامل گلبول قرمز O مثبت و عصاره غشایی گلبول قرمز واجد آنتیژن D برای ارزیابی کارآیی ایمنیزایی مورد استفاده قرار گرفتند. نتایج نشان داد که عصاره غشایی گلبول قرمز واجد آنتیژن RhD، توانایی ایمنیزایی بالاتری نسبت به گلبول قرمز کامل دارد. این یافتهها با مشاهدات مطالعههای پیشین همخوانی دارد، به طوری که در مطالعه هندریکسون و همکاران نیز ایمنیزایی نسبتاً پایین گلبول قرمز گزارش شده است (20). با این حال باید توجه داشت که تفاوت در شدت پاسخ ایمنی گزارش شده میان مطالعهها میتواند ناشی از تفاوت در طراحی آزمایش، شرایط کشت سلولی، نحوه ارائه آنتیژن و روشهای سنجش پاسخ ایمنی باشد. در گلبول قرمز، پروتئین RhD به صورت طبیعی در کمپلکس غشایی و در میان سایر پروتئینهای ساختاری قرار دارد و بسیاری از اپیتوپهای آن در دسترس مستقیم سلولهای ایمنی نیستند (20). با این وجود، گلبول قرمز مزیت مهمی همچون ارائه آنتیژن RhD در ساختار طبیعی غشایی خود را دارد و از این نظر نزدیکترین حالت به شرایط فیزیولوژیک in vivo محسوب میشود، اما به علت وجود محدودیتهایی نظیر تراکم نسبتاً کم آنتیژن، دسترسپذیری پائین برخی از اپیتوپها و فقدان پردازش مؤثر آنتیژن در شرایط کشت سلولی میتواند موجب کاهش توان ایمنیزایی آن در محیط in vitro شود (21). در مقابل، فرآیند استخراج غشایی در تهیه عصاره، منجر به آزادسازی آنتیژن و افزایش دسترسپذیری اپیتوپهای سطحی میشود. عصاره غشایی واجد آنتیژن D به دلیل حضور آنتیژنهای سطحی در حالت محلول، افزایش غلظت مؤثر آنتیژن و تسهیل تعامل با سلولهای ارائه دهنده آنتیژن، قادر به القای پاسخ ایمنی قویتری است (22).
این مشاهدات با نتایج استیگس و همکاران همخوانی دارد که نشان میدهند انتخاب فرم آنتیژن و شیوه آمادهسازی آن، نقش کلیدی در شدت و اختصاصیت پاسخ هومورال دارد. علاوه بر این، وجود سایر اجزای غشایی مانند گلیکوپروتئینها و فسفولیپیدها در عصاره غشایی میتواند به عنوان ادجوانتهای طبیعی عمل کرده و به تحریک قویتر پاسخ ایمنی کمک کنند، هر چند امکان القای پاسخهای غیر اختصاصی ناشی از حضور این اجزا نیز باید مد نظر قرار گیرد (23). نتایج این مطالعه نشان میدهد که اگر چه گلبول قرمز کامل از نظر فیزیولوژیـک نزدیکترین فرم به آنتیژن طبیعی است، اما عصاره غشایی از نظر شدت تحریک ایمنی و کارآمدی در ایمنیزایی آزمایشگاهی عملکرد بهتری دارد. در ارزیـابی پاسخ اختصاصی علیه آنتیژن RhD، علیرغم آن که پلیت ELISA با یـک پپتید که نماینده یک اپیتوپ خاص از پروتئین RhD پوشش داده شده بود، هر دو فرم آنتیژنی توانستند پاسخ آنتیبادی اختصاصی قابل شناسایی ایجاد کنند. این موضوع نشان میدهد که در شرایط ایمنیزایی آزمـایشگاهی، اپیتوپهای ایمنیزای کلیدی RhD به میزان کافی در دسترس سلولهای ایمنی قرار گرفته و حتی در حضور طیف وسیع اپیتوپها، پاسخ اختصاصی علیه اپیتوپ پپتیدی هدف نیز القا میشود.
استفاده از ELISA پپتیدی در این مطالعه در مقایسه با روش های مبتنی بر آگلوتیناسیون یـا فلوسیتومتری در سایر مطالعهها، نیز میتواند در تبیین تفاوت نتایج گزارش شده نقش داشته باشد. علاوه بر این، تحقیقات در زمینه ارائه آنتیژن و بهینه سازی ادجوانتها نشان میدهد کـه فرم و نحوه تحویل آنتیژن میتواند پاسخ همورال را تقویـت کند، که مرتبط بـا یافتههای مطالعه حاضر میباشد (24).
نتیجهگیری
بـر اسـاس نتایـج حاصـل از ایــن مطالعـه آزمایشگاهی،
مواجهه سلولهای تکهستهای خون محیطی با عصاره غشایی گلبول قرمز که واجد آنتیژنD بود، در شرایط کشت سلولی، منجر به القای پاسخ هومورال قابل تشخیص با آزمون الایزا شد که از نظر شدت، نسبت به پاسخ ایجاد شده توسط گلبولهای قرمز کامل O⁺ تا حدودی قویتر بود، هر چند تفاوتها معنادار نبودند. با توجه به محدودیت تعداد تکرارهای آزمایش، انجام مطالعههای تکمیلی بـا حجم نمونه بیشتر به منظور تائید آماری این یافتهها ضروری است.
حمایت مالی
این پروژه با حمایت مالی مؤسسه عالی آموزشی و پژوهش طب انتقال خون انجام شده است.
ملاحظات اخلاقی
این مطالعه بـا کد اخلاق IR.TMI.REC.1403.004 انجام شـد و مصـوب کمیتـه اخـلاق مـؤسسه عالـی آمــوزشی و پژوهشی طب انتقال خون ایران میباشد.
عدم تعارض منافع
نویسندگان اظهار میدارند که هیچ گونه تعارض منافعی در مطالعه حاضر وجود ندارد.
نقش نویسندگان
فائزه خیری: انجام کار پژوهش، نوشتن مقاله
دکتر فـاطمه یاری: طراحی مطالعه، نظارت بر انجام مطالعه، همکاری در نگارش مقاله
بهناز عموحسین: همکاری در انجام کار پژوهش
تشکر و قدردانی
این مقاله حاصل بخشی از پایاننامه کارشناسی ارشد مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدینوسیله از معاونت آموزشی و پژوهشی مؤسسه، به جهت حمایت مالی و معنوی تشکر و قدردانی میگردد.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونولوژي
فهرست منابع
1. Avent ND, Reid ME. The Rh blood group system: a review. Blood 2000; 95(2): 375-87. [DOI:10.1182/blood.V95.2.375] [PMID]
2. Huang CH, Liu PZ, Cheng JG. Molecular biology and genetics of the Rh blood group system. Semin Hematol 2000; 37(2): 150-65. [DOI:10.1016/S0037-1963(00)90040-4] [PMID]
3. Flegel WA. The genetics of the Rhesus blood group system. Blood Transfus 2007; 5(2): 50-7.
4. Wagner FF, Flegel WA. Review: the molecular basis of the Rh blood group phenotypes. Immunohematology 2004; 20(1): 23-36. [DOI:10.21307/immunohematology-2019-419] []
5. Xie X, Fu Q, Bao Z, Zhang Y, Zhou D. Clinical value of different anti-D immunoglobulin strategies for preventing Rh hemolytic disease of the fetus and newborn: A network meta-analysis. PLoS One 2020; 15(3): e0230073. [DOI:10.1371/journal.pone.0230073] [PMID] []
6. Nadarajan VS. Serological analysis of Rh antigens: how far can we go? Annals of Blood 2023; 8. [DOI:10.21037/aob-23-30]
7. Kim HY, Stojadinovic A, Izadjoo MJ. Immunization, hybridoma generation, and selection for monoclonal antibody production. Methods Mol Biol 2014; 1131: 33-45. [DOI:10.1007/978-1-62703-992-5_3] [PMID]
8. Leenaars M, Hendriksen CF. Critical steps in the production of polyclonal and monoclonal antibodies: evaluation and recommendations. ILAR J 2005; 46(3): 269-79. [DOI:10.1093/ilar.46.3.269] [PMID]
9. Tomimatsu K, Shirahata S. Antigen-specific in vitro immunization: a source for human monoclonal antibodies. Methods Mol Biol 2014; 1060: 297-307. [DOI:10.1007/978-1-62703-586-6_15] [PMID]
10. Kato M, Yan H, Tsuji NM, Chiba T, Hanyu Y. A method for inducing antigen-specific IgG production by in vitro immunization. J Immunol Methods 2012; 386(1-2): 60-9. [DOI:10.1016/j.jim.2012.08.019] [PMID]
11. Wijkhuisen A, Savatier A, Cordeiro N, Léonetti M. Production of antigen-specific human IgGs by in vitro immunization. BMC Biotechnol 2016; 16: 22. [DOI:10.1186/s12896-016-0253-1] [PMID] []
12. Kheiri Ardahaei F, Yari F. Effective Factors in Creating Immunization Against a Desired Antigen in the Culture Medium. J Iran Blood Transfus 2024; 21(4): 330-41. [Article in Farsi] [DOI:10.61186/bloodj.21.4.333]
13. Howe JG, Stack G. Relationship between immunogenicity and protein structure at amino acid substitution sites of blood group antigens. Blood 2025; 146(4): 504-17. [DOI:10.1182/blood.2024025071] [PMID]
14. Hendrickson JE, Tormey CA, Shaz BH. Red blood cell alloimmunization mitigation strategies. Transfus Med Rev 2014; 28(3): 137-44. [DOI:10.1016/j.tmrv.2014.04.008] [PMID]
15. de Almeida R, Nakamura CN, de Lima Fontes M, Deffune E, Felisbino SL, Kaneno R, et al. Enhanced immunization techniques to obtain highly specific monoclonal antibodies. MAbs 2018; 10(1): 46-54. [DOI:10.1080/19420862.2017.1331804] [PMID] []
16. Kanof ME, Smith PD, Zola H. Isolation of whole mononuclear cells from peripheral blood and cord blood. Curr Protoc Immunol 2001; Chapter 7: 7.1.1-7.1.8.
17. Dargahi T, Yari F, Rezaei N. The source of HLA molecules on platelets: Does platelets adsorb soluble HLA molecules from their environment? Iran J Ped Hematol Oncol 2019; 9(4): 236-43. [DOI:10.18502/ijpho.v9i4.1572]
18. KÖHler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256(5517): 495-7. [DOI:10.1038/256495a0] [PMID] []
19. Borrebaeck CA. Development of in vitro immunization in murine and human hybridoma technology. J Pharm Biomed Anal 1987; 5(8): 783-92. [DOI:10.1016/0731-7085(87)80096-1] [PMID]
20. Steeghs L, Kuipers B, Hamstra HJ, Kersten G, van Alphen L, van der Ley P. Immunogenicity of outer membrane proteins in a lipopolysaccharide-deficient mutant of Neisseria meningitidis: influence of adjuvants on the immune response. Infect Immun 1999; 67(10): 4988-93. [DOI:10.1128/IAI.67.10.4988-4993.1999] [PMID] []
21. Stack G, Tormey CA. Estimating the immunogenicity of blood group antigens: a modified calculation that corrects for transfusion xposures. Br J Haematol 2016; 175(1): 154-60. [DOI:10.1111/bjh.14175] [PMID]
22. Zimmermann M, Rose N, Lindner JM, Kim H, Gonçalves AR, Callegari I, et al. Antigen Extraction and B Cell Activation Enable Identification of Rare Membrane Antigen Specific Human B Cells. Front Immunol 2019; 10: 829. [DOI:10.3389/fimmu.2019.00829] [PMID] []
23. Hendrickson JE, Tormey CA. Understanding red blood cell alloimmunization triggers. Hematology Am Soc Hematol Educ Program 2016; 2016(1): 446-51. [DOI:10.1182/asheducation-2016.1.446] [PMID] []
24. Burnet Institute. Methods of Delivery to Antigen-Presenting Cells: Development of New and Improved Vaccines. Molecular Pharmaceutics 2007; 4(1): 1-3. [DOI:10.1021/mp060102h] [PMID]
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






