جلد 21، شماره 4 - ( زمستان 1403 )
جلد 21 شماره 4 صفحات 341-330 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Kheiri Ardahaei F, Yari F. Effective Factors in Creating Immunization Against a Desired Antigen in the Culture Medium. bloodj 2024; 21 (4) :330-341
URL: http://bloodjournal.ir/article-1-1562-fa.html
URL: http://bloodjournal.ir/article-1-1562-fa.html
خیری اردهایی فائزه، یاری فاطمه. عوامل موثر در ایجاد ایمنی بر علیه یک آنتی ژن دلخواه در محیط کشت. فصلنامه پژوهشی خون. 1403; 21 (4) :330-341
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 689 kb]
(638 دریافت)
| چکیده (HTML) (1556 مشاهده)
مقدمه
آنتیبادیها، مولکولهای گلیکوپروتئینی هستند که در بدن توسط پلاسماسلها در پاسخ به آنتیژن تولید میشوند. آنتیبادیهای پلیکلونال و مونوکلونال در زمینههای مختلف همچون تحقیقات، تشخیص و درمان کاربرد دارند. آنتیبادیهای مونوکلونال گروهی از آنتیبادیها با ویژگی یکسان هستند که توسط کلون یکسان از سلول B برعلیه یک آنتیژن خاص تولید میشوند و به اپیتوپهای مشابه اتصال مییابند (1). یکی از کاربردهای مهم آنتیبادیهای مونوکلونال، در بخش تشخیص میباشد و از جمله آنها، تعیین نوع گروه خونی است. یکی از روشهای استاندارد تعیین فنوتیپ گروههای خونی، روشهای ایمونوهماتولوژیک مبتنی بر هماگلوتیناسیون میباشد (2). امروزه به منظور تعیین گروههای خونی مختلف از آنتیبادیهای اختصاصی در بانک خون استفاده میشود. آنتیبادیهای مونوکلونال به لحاظ داشتن اختصاصیت بیشتر و وقوع واکنشهای متقاطع کمتر، از مزیت بیشتری جهت استفاده در شناسایی و تعیین آنتیژنهای گلبول قرمز برخوردار میباشند (3). بنابراین برای رسیدن به این اهداف، دستیابی به کلونهای سلولی تولید کننده آنتیبادی اختصاصی برای آنتیژن مورد نظر با افینیتی بالا ضروری است. روشهای مختلفی برای تولید آنتیبادیها استفاده میشوند که در مرحله اول آنها ایمنیزایی قرار میگیرد (5، 4، 2).
ایمنیزایی مقدمه تولید آنتیبادی میباشد که به روشهای مختلفی انجام میشود. یکی از این روشها ایمنیزایی آزمایشگاهی(in vitro immunization) است که در این روش سلولهای ایمنی در آزمایشگاه توسط آنتیژن مورد نظر تحریک شده و از سلولهای خون محیطی جداسازی میشوند و در نتیجه لنفوسیتهای B تولیدکننده آنتیبادی اختصاصی علیه آنتیژن القا میگردند. سپس میتوان سلولهای تولیدکننده آنتیبادی را با سلولهای میلومایی فیوژ کرد تا سلولهای هیبریدوما شکل بگیرد .طی این روند سلولهای تولیدکننده آنتیبادی نامیرا شده و به صورت مداوم آنتیبادی تولید میکنند. روش دیگر ایمونیزاسیون در حیوانات آزمایشگاهی(in vivo immunization) میباشد که نیاز به تزریق آنتیژن به حیوان آزمایشگاهی دارد. لذا نیازمند طراحی یک حیوان خانه مجهز است. علاوه بر تهیه یک حیوان خانه، یکی از مشکلات و دشواریهای این روش رعایت اصول کار و ضوابط اخلاقی کار با حیوانات میباشد. روش تولید آنتیبادی مبتنی بر ایمنیزایی آزمایشگاهی برای تولید انواع زیادی از آنتیبادیها از جمله آنتیبادیهایی که برای ایمنیزایی درin vivo دچار مشکل هستند، پتانسیل زیادی را نشان میدهد. عدم نیاز به تزریق آنتیژن به حیوان و بینیاز شدن به ایجاد حیوان خانه همچنین حذف فرآیندهای پیچیده شامل انسانی کردن آنتیبادیها (humanize) یا کایمریزاسیون از مزایای این روش میباشند (6).
مواد و روشها
در این مقاله مروری با استفاده از پژوهشهای منتشر شده و پایگاههای اطلاعاتی PubMed و Google scholar و با استفاده از کلمات کلیدی in vitro technique ، immunization، antibodies ، مقالات از سال 1985 تا 2023 مورد ارزیابی قرار گرفته و یافتههای مهم و اساسی آن به صورت جامع و کامل و به صورت یک مقاله مروری ارائه گردیده است.
یافتهها
ایمنیزایی آزمایشگاهی (In vitro immunization):
به فرآیند تحریک سلولهای ایمنی خارج از بدن و در یک شرایط آزمایشگاهی کنترل شده، ایمنیزایی آزمایشگاهی گویند. چندین روش برای ایمونیزاسیون در محیط آزمایشگاهی برای تولید آنتیبادی وجود دارد، شامل:
آنتیبادی جهت تحریک و فعالسازی در محیط کشت استفاده میشود. برای ایمنیزایی آزمایشگاهی میتوان از سلولهای تک هستهای خون محیطی استفاده کرد و یا میتوان سلولهای B را جداسازی نموده و برای تحریک در محیط کشت استفاده نمود و یا حتی میتوان از سل لاینهای سلول B نامیرا جهت ایمنیزایی استفاده کرد. استفاده از سل لاینهای نامیرای سلول B ، تنوع مرتبط با سلولهای اولیه را حذف میکند و تأمین پایدار و ثابت آنتیبادیها را تضمین مینماید (7).
روش ایمنیزایی آزمایشگاهی به طور معمول مدت کوتاهی (حدود 5 روز) در مقایسه با چندین هفته فرآیند ایمنیزایی در موش زمان میبرد. این روش به مقادیر کمتری آنتیژن برای ایمنیزایی نیاز دارد. روش ایمنیزایی in vitro در مقایسه با ایمنیزایی in vivo تکرارپذیری بالاتری دارد و همچنین دستیابی به آنتیبادی از کلاس IgM به واسطه ایمنیزایی آزمایشگاهی آسانتر میباشد. اما از طرفی روش ایمنیزایی in vitro برای تولید آنتیبادی علیه تمامی آنتیژنها قابل استفاده نمیباشد و غالباً برای آنتیژنهایی کاربرد دارد که قبلاً در فرد ایجاد ایمنیزایی کرده و لنفوسیتهای B او در پاسخ به آن آنتیژن تحریک شده باشد (9، 8).
ایمنیزایی آزمایشگاهی با توجه به همه مزیتهایی که نسبت به ایمنیزاییهای سنتی دارد دارای محدودیتهایی نیز میباشد که منجر به چالشهایی در به دست آوردن تعداد کافی سلولهای تولیدکننده آنتیبادی با میل ترکیبی (affinity) بالا میشود. روش ایمنیزایی آزمایشگاهی تولید آنتیبادی با میل ترکیبی پایین و تولید آنتیبادی بیشتر از کلاس IgM را به دنبال دارد. لذا یک دستورالعمل ایمنیزایی پیشرفته با استفاده از سلولهای ایمنی طحال موش صورت گرفت که شامل یک دستورالعمل تحریک سه مرحلهای میباشد. روش تحریک سه مرحلهای ذکر شده در این قسمت شامل چرخههای متعدد تحریک مکرر آنتیژن و به دنبال آن گسترش سلولی است. این فرآیند فرکانس سلولهای پلاسماسل را افزایش میدهد که آنتیبادیهای IgG اختصاصی آنتیژن تولید کنند. این مــراحل احتمالاً شامل قرار گرفتن در معرض آنتیژن اولیه، دورههای بعدی تحریک مجدد برای افزایش تولید آنتیبادی و عوامل اضافی برای حمایت از فعالسازی سلول B و تعویض کلاس برای تولید بهینه IgG است. روش تحریک 3 مرحلهای توصیف شده، تولید آنتیبادیهای IgG اختصاصی آنتیژن را با افزایش تعداد سلولهای تولیدکننده این آنتیبادیها افزایش میدهد.
این روش باعث فعالشدن فعالکنندههای سلول B و سلولهای کمکی CD4+ تولیدکننده سیتوکین میشود و با تقلید از فرآیندهای ایمنی حیاتی که به طور طبیعی رخ میدهند، تغییر کلاس آنتیبادی را تحریک میکند. این رویکرد احتمال دستیابی به آنتیبادیهای مورد نظر در برابر آنتیژنهای چالش برانگیز را بهبود میبخشد و به طور بالقوه میتواند برای تولید آنتیبادیهای مونوکلونال انسانی با کارآیی افزایش یافته سازگار شود. محرکهای ایمنی نقش مهمی در افزایش ایمنسازی آزمایشگاهی با ترویج فعالسازی و تکثیر سلولهای ایمنی دارند. در روش توصیف شده، از CpG-ODN (CPG Oligodeoxyuncleotides) به عنوان یک محرک ایمنی در طول تحریک اولیه آنتیژن برای فعال کردن مؤثر سلولهای B به ویژه آنهایی که آنتیبادی تولید میکنند استفاده میشود. این تحریک مجموعهای از رویدادها را به وجود میآورد که منجر به افزایش تولید سلولهای تولیدکننده IgG اختصاصی آنتیژن میشود. علاوه بر این، سیتوکاینهای موجود در مرحله گسترش سلولی به طور مستقیم سلولهای T و B را تحریک میکنند که منجر به تکثیر سلولی و افزایش تراکم سلولی شده و تعامل بین سلولهای ایمنی را تقویت میکنند. این فعل و انفعالات برای تولید تعداد بیشتری از سلولهای پلاسمایی تولیدکننده IgG اختصاصی آنتیژن در پایان کشت ضروری هستند(10).
عوامل مؤثر در ایجاد ایمنیزایی آزمایشگاهی:
حذف سلولهای مهارکننده ایمنی:
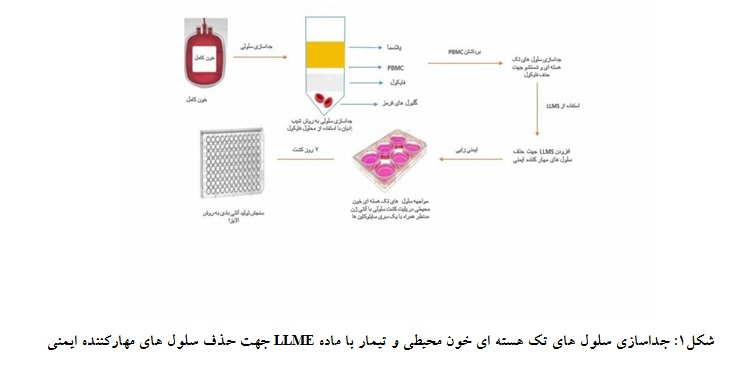
محققان دریافتند که وقتی لنفوسیتهای خون محیطی در حضور سایر زیر جمعیتهای سلولهای T تحریک شوند، به طور خاص به آنتیژن پاسخ نمیدهند. با حذف زیر جمعیتهای خاص سلولی حاوی لیزوزوم از لنفوسیتهای خون محیطی، سلولهای باقیمانده پاسخهای خاص آنتیژن را در طول ایمنیزایی آزمایشگاهی نشان میدهند. عوامل لیزوزوموتروپیک به ترکیباتی اطلاق میشود که میتوانند وارد لیزوزومها شوند. استرهای اسید آمینه L ، نوعی عوامل لیزوزوموتروپیک هستند که میتوانند آزادانه به لیزوزومها در انواع متفاوت از سلولها همچون مونوسیتها، ماکروفاژهای بافتی و سلولهای در گردش وارد شوند. در داخل لیزوزومها، L آمینو اسید سریعاً به اسید آمینه آزاد متابولیزه میشود. این اسید آمینه آزاد قطبی است لذا انتشار آن به خارج از لیزوزوم دشوار است. تجمع اسید آمینه آزاد در لیزوزوم در نهایت سبب تورم و پارگی این اندامک میشود. اللوسین متیلاستر (LLME) یک عامل لیزوزوموتروپیک است که با حذف سلولهای حاوی لیزوزوم، سبب افزایش پاسخ ایمنی در ایمنیزایی آزمایشگاهی میشود. LLME سلولهای جانبی تنظیمی برای تکثیر سلولهای Bو T را حذف میکند و فعالیت سلولهای کشنده طبیعی (NK Cell) را به طور غیر قابل برگشت در سلولهای خون محیطی مختل میکند. LLME باعث ایجاد سمیت سلولی برگشتپذیر در سلولهای غنی از لیزوزوم با تولید اسید آمینه آزاد میشود و سلولهای سیتولیتیک مانند سلول کشنده طبیعی (NK) و T سیتوتوکسیک (TC) را تحت تاثیر قرار میدهد (شکل1).
لذا تیمار لنفوسیتهای خون محیطی با LLME میتواند آنان را برای تولید آنتیبادی اختصاصی علیه یک آنتیژن خاص تحریک کند(11). سلولهای T سیتوتوکسیک (TC) و زیرگروههای سلولهای TCD8+ بر روی سلولهای B ترشحکننده آنتیبادی تحریک شده با میتوژن اختصاصی، اثر مهاری دارند. استفاده از ماده اللوسین متیلاستر سبب حذف این سلولهای مهار کننده ایمنی بدون هیچ اثر منفی بر روی سلولهای B و سلولهای T کمکی (Th) میشود. زمان استفاده از ماده LLME بعد از جداسازی سلولهای تک هستهای از خون کامل میباشد و جهت حذف سلولهای مهارکننده ایمنی به مدت حدوداً 40 دقیقه سلولها با این ماده انکوبه میشوند (شکل1) (12).
مجاور کردن سلولهای تک هستهای خون محیطی با ماده LLME منجر به حذف کامل سلولهای مهار کننده ایمنی میگردد. بعد استفاده از LLME ، درصد سلولهای بیانکننده مارکرهای Lue7 و Lue11 (مارکر اختصاصی بیانکننده سلولهای کشنده طبیعی) و مارکر سطحی Mo2 (مارکر اختصاصی مونوسیت) به ترتیب به 1/0% ، 2/0% و 5/0% کاهش مییابد (9).
مهم میباشد (3).
آنتیبادیها در بخش تشخیص و درمان بسیار کاربرد دارند. تاکنون روشهای مختلفی برای تولید این آنتیبادیها استفاده شده است. ایمنیزایی مرحله مقدماتی در تمامی این روشها میباشد که به شیوههای مختلفی صورت میگیرد. یکی از مهمتریـن شیـوههای ایمنیزایی، in vitro immunization میباشد. در این روش سلولهای ایمنی از سلولهای خون محیطی جدا شده و در آزمایشگاه به وسیله آنتیژن مد نظر تحریک میشوند و در نتیجه کلونهای لنفوسیتی تولیدکننده آنتیبادی اختصاصی علیه آنتیژن هدف القا میشود. جهت دستیابی به بهترین دستورالعمل ایمنیزایی آزمایشگاهی باید یک سری نکات را مد نظر داشت که عبارتند از:
نوع و غلظت آنتیژن که آنتیژنهایی با جنس پروتئینی و غلظت ng/mL 10-1 بهینه میباشد. نوع و غلظت لنفوسیت نیز حائز اهمیت میباشد که لنفوسیتهای خون محیطی به علت این که در دسترس میباشند و اثر بخشی بیشتری دارند، ترجیح داده میشوند. غلظت لنفوسیتها در محیط کشت نیز در ایمنیزایی جهت تولید آنتیبادی مؤثـر
میباشد که غلظت 106×2 سلول بهینه است. جهت ایمنیزایی مؤثر باید شرایط فیزیولوژیک محیط کشت را نیز تأمین کرد. وجود اجزای سرم در محیط کشت برای تأمین مواد مغذی لازم، فاکتورهای رشد، تکثیر و تمایز لنفوسیتها ضروری میباشد. علاوه بر اینها استفاده از آنتیبیوتیکها در محیط کشت جهت جلوگیری از رشد باکتری و الگلوتامین برای حمایت از زندهمانی و رشد سلول مؤثر میباشد. استفاده از ادجوانتها و سیتوکاینها در محیط کشت سبب افزایش تحریک ایمنی لنفوسیتهای B و تولید آنتیبادی خواهد شد. یکی از عوامل دیگر در بهینهسازی ایمونیزاسیون آزمایشگاهی، استفاده از اللوسین متیلاستر میباشد که سبب از بین بردن و حذف جمعیت سلولی غنی از لیزوزوم میشود. این سلولها شامل: مونوسیت، سلولهای T سیتوتوکسیک، سلولهای T تنظیمی و سلولهای کشنده طبیعی (NK) هستند. با حذف این سلولها که عمدتاً سبب مهار پاسخ ایمنی میشوند، تنها لنفوسیتهای B و T باقی میمانند که میانکنش آنها در محیط کشت منجر به افزایش ایمنیزایی و تکثیر لنفوسیتهای B و تولید آنتیبادی خواهد شد. مدت زمان انکوباسیون نیز بر روی ایمنیزایی جهت تولید آنتیبادی مؤثر میباشد. انکوباسیون به مدت 7 روز جهت ایمنیزایی لنفوسیتها مناسب است. این نکته را نیز باید توجه داشت که لنفوسیتهای خون اهداکنندگان مختلف شرایط بهینه متفاوتی برای ایمنیزایی به منظور دستیابی به آنتیبادی نیاز دارند. این تنوع پیچیدگی پاسخ ایمنی نشاندهنده این است که مقادیر بهینه برای ایمنیزایی از فردی به فرد دیگر متفاوت است و نیاز است در مطالعههای ایمنی، رویکردهای شخصی را نیز مد نظر گرفت.
نتیجهگیری
جهت دستیابی به کلون تولیدکننده آنتیبادی علیه یــک
آنتیژن دلخواه در شرایط آزمایشگاهی باید به عوامل مؤثر در ایجاد ایمنیزایی که در این مقاله مروری به آنها اشاره شده است، توجه نمود.
نقش نویسندگان
فائزه خیری اردهایی: ایده مقاله و نگارش نسخه اولیه مقاله
دکتر فاطمه یاری: نظارت بر تحقیق و نگارش مقاله و اصلاح و تهیه نسخه نهایی مقاله
متن کامل: (505 مشاهده)
عوامل موثر در ایجاد ایمنی بر علیه یک آنتی ژن دلخواه در محیط کشت
فائزه خیری اردهایی1، فاطمه یاری2
چکیده
سابقه و هدف
آنتیبادیها، مولکولهای گلیکوپروتئینی هستند که در تشخیص و درمان، بسیار مورد استفاده میباشند. روشهای گوناگونی برای تولید آنها وجود دارد که ایمنیزایی آزمایشگاهی یکی از آنان میباشد. لذا در این مطالعه، به بررسی روش ایمنیزایی آزمایشگاهی و عوامل مؤثر در بهینگی ایمونیزاسیون جهت دستیابی به لنفوسیت ایمونیزه شده تولیدکننده آنتیبادی در محیط آزمایشگاه پرداخته شده است.
مواد و روشها
برای انجام این مقاله مروری در پایگاههای اطلاعاتی PubMed وGoogle scholar با استفاده از کلمات کلیدی in vitro technique ، immunization و antibodies از سال 1985 تا 2023 جستجو انجام شد. حدود 50 مقاله با این کلمات کلیدی یافت شد که 34 مورد آن در این مقاله استفاده شده است.
یافتهها
مطالعههای پیش رو نشان داد که ایمنیزایی in vitro مزیتهایی را نسبت به ایمنیزاییin vivo دارد که از جمله آنها؛ مدت زمان کوتاهتر ایمنیزایی، تکرارپذیری بالا و دستیابی به کلونهای تولیدکننده IgM میباشد. از طرفی این روش برای تولید آنتیبادی علیه همه آنتیژنها کاربرد ندارد. عوامل زیادی در ایجاد ایمنیزایی آزمایشگاهی مؤثر میباشند که شامل نوع و غلظت آنتیژن، نوع و غلظت لنفوسیت، حذف سلولهای مهارکننده ایمنی، ادجوانتها و سیتوکاینها، شرایط فیزیولوژیک محیط کشت، مدت زمان انکوباسیون و تفاوت پاسخ ایمنی اهداکنندگان است.
نتیجه گیری
جهت تولید آنتیبادی میتوان از روش ایمنیزایی آزمایشگاهی استفاده کرد که مزیتهایی را نسبت به روشهای in vivoدارد ولی جهت دستیابی به سلولهای تولیدکننده آنتیبادی در شرایط آزمایشگاهی باید به عوامل مؤثر در ایجاد ایمنیزایی در مقدار مناسب آنها توجه کرد.
کلمات کلیدی: ایمنیزایی، روشهای درون آزمایشگاهی، آنتیبادیها
تاریخ دریافت: 13/08/1403
تاریخ پذیرش : 03/10/1403
1- کارشناسی ارشد هماتولوژی آزمایشگاهی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- نویسنده مسئول: PhD ایمونولوژی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
فائزه خیری اردهایی1، فاطمه یاری2
چکیده
سابقه و هدف
آنتیبادیها، مولکولهای گلیکوپروتئینی هستند که در تشخیص و درمان، بسیار مورد استفاده میباشند. روشهای گوناگونی برای تولید آنها وجود دارد که ایمنیزایی آزمایشگاهی یکی از آنان میباشد. لذا در این مطالعه، به بررسی روش ایمنیزایی آزمایشگاهی و عوامل مؤثر در بهینگی ایمونیزاسیون جهت دستیابی به لنفوسیت ایمونیزه شده تولیدکننده آنتیبادی در محیط آزمایشگاه پرداخته شده است.
مواد و روشها
برای انجام این مقاله مروری در پایگاههای اطلاعاتی PubMed وGoogle scholar با استفاده از کلمات کلیدی in vitro technique ، immunization و antibodies از سال 1985 تا 2023 جستجو انجام شد. حدود 50 مقاله با این کلمات کلیدی یافت شد که 34 مورد آن در این مقاله استفاده شده است.
یافتهها
مطالعههای پیش رو نشان داد که ایمنیزایی in vitro مزیتهایی را نسبت به ایمنیزاییin vivo دارد که از جمله آنها؛ مدت زمان کوتاهتر ایمنیزایی، تکرارپذیری بالا و دستیابی به کلونهای تولیدکننده IgM میباشد. از طرفی این روش برای تولید آنتیبادی علیه همه آنتیژنها کاربرد ندارد. عوامل زیادی در ایجاد ایمنیزایی آزمایشگاهی مؤثر میباشند که شامل نوع و غلظت آنتیژن، نوع و غلظت لنفوسیت، حذف سلولهای مهارکننده ایمنی، ادجوانتها و سیتوکاینها، شرایط فیزیولوژیک محیط کشت، مدت زمان انکوباسیون و تفاوت پاسخ ایمنی اهداکنندگان است.
نتیجه گیری
جهت تولید آنتیبادی میتوان از روش ایمنیزایی آزمایشگاهی استفاده کرد که مزیتهایی را نسبت به روشهای in vivoدارد ولی جهت دستیابی به سلولهای تولیدکننده آنتیبادی در شرایط آزمایشگاهی باید به عوامل مؤثر در ایجاد ایمنیزایی در مقدار مناسب آنها توجه کرد.
کلمات کلیدی: ایمنیزایی، روشهای درون آزمایشگاهی، آنتیبادیها
تاریخ دریافت: 13/08/1403
تاریخ پذیرش : 03/10/1403
1- کارشناسی ارشد هماتولوژی آزمایشگاهی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- نویسنده مسئول: PhD ایمونولوژی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
آنتیبادیها، مولکولهای گلیکوپروتئینی هستند که در بدن توسط پلاسماسلها در پاسخ به آنتیژن تولید میشوند. آنتیبادیهای پلیکلونال و مونوکلونال در زمینههای مختلف همچون تحقیقات، تشخیص و درمان کاربرد دارند. آنتیبادیهای مونوکلونال گروهی از آنتیبادیها با ویژگی یکسان هستند که توسط کلون یکسان از سلول B برعلیه یک آنتیژن خاص تولید میشوند و به اپیتوپهای مشابه اتصال مییابند (1). یکی از کاربردهای مهم آنتیبادیهای مونوکلونال، در بخش تشخیص میباشد و از جمله آنها، تعیین نوع گروه خونی است. یکی از روشهای استاندارد تعیین فنوتیپ گروههای خونی، روشهای ایمونوهماتولوژیک مبتنی بر هماگلوتیناسیون میباشد (2). امروزه به منظور تعیین گروههای خونی مختلف از آنتیبادیهای اختصاصی در بانک خون استفاده میشود. آنتیبادیهای مونوکلونال به لحاظ داشتن اختصاصیت بیشتر و وقوع واکنشهای متقاطع کمتر، از مزیت بیشتری جهت استفاده در شناسایی و تعیین آنتیژنهای گلبول قرمز برخوردار میباشند (3). بنابراین برای رسیدن به این اهداف، دستیابی به کلونهای سلولی تولید کننده آنتیبادی اختصاصی برای آنتیژن مورد نظر با افینیتی بالا ضروری است. روشهای مختلفی برای تولید آنتیبادیها استفاده میشوند که در مرحله اول آنها ایمنیزایی قرار میگیرد (5، 4، 2).
ایمنیزایی مقدمه تولید آنتیبادی میباشد که به روشهای مختلفی انجام میشود. یکی از این روشها ایمنیزایی آزمایشگاهی(in vitro immunization) است که در این روش سلولهای ایمنی در آزمایشگاه توسط آنتیژن مورد نظر تحریک شده و از سلولهای خون محیطی جداسازی میشوند و در نتیجه لنفوسیتهای B تولیدکننده آنتیبادی اختصاصی علیه آنتیژن القا میگردند. سپس میتوان سلولهای تولیدکننده آنتیبادی را با سلولهای میلومایی فیوژ کرد تا سلولهای هیبریدوما شکل بگیرد .طی این روند سلولهای تولیدکننده آنتیبادی نامیرا شده و به صورت مداوم آنتیبادی تولید میکنند. روش دیگر ایمونیزاسیون در حیوانات آزمایشگاهی(in vivo immunization) میباشد که نیاز به تزریق آنتیژن به حیوان آزمایشگاهی دارد. لذا نیازمند طراحی یک حیوان خانه مجهز است. علاوه بر تهیه یک حیوان خانه، یکی از مشکلات و دشواریهای این روش رعایت اصول کار و ضوابط اخلاقی کار با حیوانات میباشد. روش تولید آنتیبادی مبتنی بر ایمنیزایی آزمایشگاهی برای تولید انواع زیادی از آنتیبادیها از جمله آنتیبادیهایی که برای ایمنیزایی درin vivo دچار مشکل هستند، پتانسیل زیادی را نشان میدهد. عدم نیاز به تزریق آنتیژن به حیوان و بینیاز شدن به ایجاد حیوان خانه همچنین حذف فرآیندهای پیچیده شامل انسانی کردن آنتیبادیها (humanize) یا کایمریزاسیون از مزایای این روش میباشند (6).
مواد و روشها
در این مقاله مروری با استفاده از پژوهشهای منتشر شده و پایگاههای اطلاعاتی PubMed و Google scholar و با استفاده از کلمات کلیدی in vitro technique ، immunization، antibodies ، مقالات از سال 1985 تا 2023 مورد ارزیابی قرار گرفته و یافتههای مهم و اساسی آن به صورت جامع و کامل و به صورت یک مقاله مروری ارائه گردیده است.
یافتهها
ایمنیزایی آزمایشگاهی (In vitro immunization):
به فرآیند تحریک سلولهای ایمنی خارج از بدن و در یک شرایط آزمایشگاهی کنترل شده، ایمنیزایی آزمایشگاهی گویند. چندین روش برای ایمونیزاسیون در محیط آزمایشگاهی برای تولید آنتیبادی وجود دارد، شامل:
- سل لاینهای B نامیرا شده (immortalized B cell lines)
- تحریک سلولهای تک هستهای خون محیطی (stimulation of perpheral blood mononuclear cell)
- تحریک سلولهای B اولیه (stimulation of primary B cells)
آنتیبادی جهت تحریک و فعالسازی در محیط کشت استفاده میشود. برای ایمنیزایی آزمایشگاهی میتوان از سلولهای تک هستهای خون محیطی استفاده کرد و یا میتوان سلولهای B را جداسازی نموده و برای تحریک در محیط کشت استفاده نمود و یا حتی میتوان از سل لاینهای سلول B نامیرا جهت ایمنیزایی استفاده کرد. استفاده از سل لاینهای نامیرای سلول B ، تنوع مرتبط با سلولهای اولیه را حذف میکند و تأمین پایدار و ثابت آنتیبادیها را تضمین مینماید (7).
روش ایمنیزایی آزمایشگاهی به طور معمول مدت کوتاهی (حدود 5 روز) در مقایسه با چندین هفته فرآیند ایمنیزایی در موش زمان میبرد. این روش به مقادیر کمتری آنتیژن برای ایمنیزایی نیاز دارد. روش ایمنیزایی in vitro در مقایسه با ایمنیزایی in vivo تکرارپذیری بالاتری دارد و همچنین دستیابی به آنتیبادی از کلاس IgM به واسطه ایمنیزایی آزمایشگاهی آسانتر میباشد. اما از طرفی روش ایمنیزایی in vitro برای تولید آنتیبادی علیه تمامی آنتیژنها قابل استفاده نمیباشد و غالباً برای آنتیژنهایی کاربرد دارد که قبلاً در فرد ایجاد ایمنیزایی کرده و لنفوسیتهای B او در پاسخ به آن آنتیژن تحریک شده باشد (9، 8).
ایمنیزایی آزمایشگاهی با توجه به همه مزیتهایی که نسبت به ایمنیزاییهای سنتی دارد دارای محدودیتهایی نیز میباشد که منجر به چالشهایی در به دست آوردن تعداد کافی سلولهای تولیدکننده آنتیبادی با میل ترکیبی (affinity) بالا میشود. روش ایمنیزایی آزمایشگاهی تولید آنتیبادی با میل ترکیبی پایین و تولید آنتیبادی بیشتر از کلاس IgM را به دنبال دارد. لذا یک دستورالعمل ایمنیزایی پیشرفته با استفاده از سلولهای ایمنی طحال موش صورت گرفت که شامل یک دستورالعمل تحریک سه مرحلهای میباشد. روش تحریک سه مرحلهای ذکر شده در این قسمت شامل چرخههای متعدد تحریک مکرر آنتیژن و به دنبال آن گسترش سلولی است. این فرآیند فرکانس سلولهای پلاسماسل را افزایش میدهد که آنتیبادیهای IgG اختصاصی آنتیژن تولید کنند. این مــراحل احتمالاً شامل قرار گرفتن در معرض آنتیژن اولیه، دورههای بعدی تحریک مجدد برای افزایش تولید آنتیبادی و عوامل اضافی برای حمایت از فعالسازی سلول B و تعویض کلاس برای تولید بهینه IgG است. روش تحریک 3 مرحلهای توصیف شده، تولید آنتیبادیهای IgG اختصاصی آنتیژن را با افزایش تعداد سلولهای تولیدکننده این آنتیبادیها افزایش میدهد.
این روش باعث فعالشدن فعالکنندههای سلول B و سلولهای کمکی CD4+ تولیدکننده سیتوکین میشود و با تقلید از فرآیندهای ایمنی حیاتی که به طور طبیعی رخ میدهند، تغییر کلاس آنتیبادی را تحریک میکند. این رویکرد احتمال دستیابی به آنتیبادیهای مورد نظر در برابر آنتیژنهای چالش برانگیز را بهبود میبخشد و به طور بالقوه میتواند برای تولید آنتیبادیهای مونوکلونال انسانی با کارآیی افزایش یافته سازگار شود. محرکهای ایمنی نقش مهمی در افزایش ایمنسازی آزمایشگاهی با ترویج فعالسازی و تکثیر سلولهای ایمنی دارند. در روش توصیف شده، از CpG-ODN (CPG Oligodeoxyuncleotides) به عنوان یک محرک ایمنی در طول تحریک اولیه آنتیژن برای فعال کردن مؤثر سلولهای B به ویژه آنهایی که آنتیبادی تولید میکنند استفاده میشود. این تحریک مجموعهای از رویدادها را به وجود میآورد که منجر به افزایش تولید سلولهای تولیدکننده IgG اختصاصی آنتیژن میشود. علاوه بر این، سیتوکاینهای موجود در مرحله گسترش سلولی به طور مستقیم سلولهای T و B را تحریک میکنند که منجر به تکثیر سلولی و افزایش تراکم سلولی شده و تعامل بین سلولهای ایمنی را تقویت میکنند. این فعل و انفعالات برای تولید تعداد بیشتری از سلولهای پلاسمایی تولیدکننده IgG اختصاصی آنتیژن در پایان کشت ضروری هستند(10).
عوامل مؤثر در ایجاد ایمنیزایی آزمایشگاهی:
حذف سلولهای مهارکننده ایمنی:
محققان دریافتند که وقتی لنفوسیتهای خون محیطی در حضور سایر زیر جمعیتهای سلولهای T تحریک شوند، به طور خاص به آنتیژن پاسخ نمیدهند. با حذف زیر جمعیتهای خاص سلولی حاوی لیزوزوم از لنفوسیتهای خون محیطی، سلولهای باقیمانده پاسخهای خاص آنتیژن را در طول ایمنیزایی آزمایشگاهی نشان میدهند. عوامل لیزوزوموتروپیک به ترکیباتی اطلاق میشود که میتوانند وارد لیزوزومها شوند. استرهای اسید آمینه L ، نوعی عوامل لیزوزوموتروپیک هستند که میتوانند آزادانه به لیزوزومها در انواع متفاوت از سلولها همچون مونوسیتها، ماکروفاژهای بافتی و سلولهای در گردش وارد شوند. در داخل لیزوزومها، L آمینو اسید سریعاً به اسید آمینه آزاد متابولیزه میشود. این اسید آمینه آزاد قطبی است لذا انتشار آن به خارج از لیزوزوم دشوار است. تجمع اسید آمینه آزاد در لیزوزوم در نهایت سبب تورم و پارگی این اندامک میشود. اللوسین متیلاستر (LLME) یک عامل لیزوزوموتروپیک است که با حذف سلولهای حاوی لیزوزوم، سبب افزایش پاسخ ایمنی در ایمنیزایی آزمایشگاهی میشود. LLME سلولهای جانبی تنظیمی برای تکثیر سلولهای Bو T را حذف میکند و فعالیت سلولهای کشنده طبیعی (NK Cell) را به طور غیر قابل برگشت در سلولهای خون محیطی مختل میکند. LLME باعث ایجاد سمیت سلولی برگشتپذیر در سلولهای غنی از لیزوزوم با تولید اسید آمینه آزاد میشود و سلولهای سیتولیتیک مانند سلول کشنده طبیعی (NK) و T سیتوتوکسیک (TC) را تحت تاثیر قرار میدهد (شکل1).
لذا تیمار لنفوسیتهای خون محیطی با LLME میتواند آنان را برای تولید آنتیبادی اختصاصی علیه یک آنتیژن خاص تحریک کند(11). سلولهای T سیتوتوکسیک (TC) و زیرگروههای سلولهای TCD8+ بر روی سلولهای B ترشحکننده آنتیبادی تحریک شده با میتوژن اختصاصی، اثر مهاری دارند. استفاده از ماده اللوسین متیلاستر سبب حذف این سلولهای مهار کننده ایمنی بدون هیچ اثر منفی بر روی سلولهای B و سلولهای T کمکی (Th) میشود. زمان استفاده از ماده LLME بعد از جداسازی سلولهای تک هستهای از خون کامل میباشد و جهت حذف سلولهای مهارکننده ایمنی به مدت حدوداً 40 دقیقه سلولها با این ماده انکوبه میشوند (شکل1) (12).
مجاور کردن سلولهای تک هستهای خون محیطی با ماده LLME منجر به حذف کامل سلولهای مهار کننده ایمنی میگردد. بعد استفاده از LLME ، درصد سلولهای بیانکننده مارکرهای Lue7 و Lue11 (مارکر اختصاصی بیانکننده سلولهای کشنده طبیعی) و مارکر سطحی Mo2 (مارکر اختصاصی مونوسیت) به ترتیب به 1/0% ، 2/0% و 5/0% کاهش مییابد (9).

دادههای حاصل از بررسی تأثیر LLME بر ایمنیزایی آزمایشگاهی و تعیین غلظت مناسب این ماده در تولید آنتیبادی با روش ایمنیزایی آزمایشگاهی نشان داد که استفاده نکردن از این ماده به دلیل عدم حذف سلولهای مهارکننده ایمنی باعث کاهش ایمنیزایی و جذب نوری شده است. نتایج همچنین نشان داد که استفاده از غلظتهای بسیار بالای LLME ، باعث ایجاد سمیت و از بین بردن سلولهای تک هستهای خون محیطی میشود (13).
سلولهای T مهاری OKT8+ میتوانند پاسخ ایمنی را مهار کنند، لذا با حذف این سلولها در ایمنیزایی آزمایشگاهی، تولید آنتیبادی قویتر میشود. برای حذف این سلولها، آنها را به سوسپانسیون سلولی آنتی OKT8+ افزوده و بعد کمپلمان خرگوش اضافه گردید، که در نهایت لیز سلولهایOKT8+ را به همراه داشت(14).
2) استفاده از ادجوانت:
ادجوانتها مولکولها و ترکیباتی هستند که قدرت و طول عمر پاسخ ایمنی خاص به آنتیژنها را افزایش میدهند. ادجوانتها عمدتاً از پاتوژنها مشتق میشوند و اغلب بیانکننده الگوهای مولکولی مرتبط با پاتوژنها میباشند. انواع آنها شامل موادی مانند پلیساکارید باکتریاییCPG ODN و مورامیل دیپپتید (MDP) هستند. استفاده از ادجوانتها در ایمنیزایی آزمایشگاهی سبب افزایش تحریک ایمنی لنفوسیتهای B به آنتیژن میشود (15).
در شرایط فیزیولوژیک، سلولهای B بکر یا B پاسخ ایمونولوژیک ضعیفی دارند. در حالی که وجود ادجوانت CPG ODN ، مارکرهای CD8، CD40 و HLA-DRبر سطح سلولهای B Native را افزایش میدهد که متعاقباً باعث فعالسازی هر چه بیشتر سلولهای T میشود. این اثر در نهایت منجر به پاسخ ایمنی به مراتب قویتری خواهد شد (16).
در مطالعه ماتسودا و همکاران ابتدا از MDP به عنوان ادجوانت استفاده شد و نتایج نشان داد که MDP منجر به تکثیر غیر اختصاصی سلولهای B برای تولید آنتیبادی میشود. در ادامه از CPG ODN استفاده شد که منجر به تکثیر اختصاصی سلولهای B و تولید آنتیبادی اختصاصی گردید (17).
در ایجاد ایمنیزایی علیه آنتیژن Kell به منظور فعالسازی قویتر و مؤثرتر سلولهای B و تولید آنتیبادی، استفاده از ادجوانت CPG ODN مثمرثمر واقع شد. نتایج مطالعه نشان داد که با ایجاد شرایط کشت یکسان در چاهکهایی که از CPG ODN به عنوان ادجوانت استفاده شده است نسبت به چاهکهایی که فاقد CPG ODN بودند، جذب نوری بالاتری در طول موج 450 نانومتر دیده شد که به معنی تولید بیشتر آنتیبادی اختصاصی در این چاهکها میباشد (13).
3) استفاده از سیتوکاینها:
در ایمنیزایی in vitro جهت ایجاد ایمنیزایی، در ابتدا لنفوسیتها به روش سانتریفیوژ با شیب گرادیان از کیسههای خون کامل جدا میگردند. این لنفوسیتها، لنفوسیتهای بکری (native) هستند که تاکنون با آنتیژن برخورد نداشتهاند. جهت تحریک و فعالسازی لنفوسیتهای بکر نیاز به دو سیگنال میباشد. سیگنال اول توسط آنتیژن و رسپتور سلول B BCR)) القا میشود و سیگنال دوم نیز توسط مواد کمک تحریکی (co-factor) القا میگردد. پیشرفت سلولهای B در حال استراحت به سمت تبدیل شدن به پلاسما سل تولیدکننده آنتیبادی توسط سیتوکاینها تنظیم میشود. حضور این سیتوکاینها نقش مهمی در هدایت سلول B در چرخه سلولی به سمت تولید آنتیبادی ایفا میکند (18). اینترلوکین 2 (IL-2) و اینترفرون گاما (INF-γ) نقش مؤثری در تحریک تکثیر لنفوسیتهای B و القای تولید آنتیبادی به عنوان سیگنال دوم فعالسازی لنفوسیتهای B دارند. بدین ترتیب میتوان از این سیتوکاینها جهت بهبود ایمنیزایی آزمایشگاهی بهره برد (20، 19). جهت بهبود ایمنیزایی لنفوسیتهای بکر، آنتیژن و مواد کمک تحریکی نقش به سزایی ایفا میکنند. از جمله مهمترین مواد کمک تحریکی میتوان به سیتوکاینهایی همچون، اینترلوکین4 (IL-4) و اینترفرون گاما (INF-γ) اشاره کرد. این دو سیتوکاین میتوانند در بهبود ایمونیزاسیون آزمایشگاهی مؤثر باشند (21). افزودن اینترلوکین4 (IL4) به محیط کشت موجب افزایش ایمنیزایی بر علیه آنتیژن Kell در ایمنیزایی آزمایشگاهی بر علیه آنتیژنKell میشود (13).
کشت لنفوسیتی مخلوط (MLC)، روشی است که جهت مطالعه میانکنشهای سلول ـ سلول بین زیر گروههای لنفوسیتی و تولید ترکیبات ناشی از این میانکنشها به کار میرود (22). تکثیر لنفوسیتها در محیط MLC به علت ترشح سیتوکاینها در این محیط افزایش مییابد. سیتوکاینها با افزایش تکثیر لنفوسیت B به نامیراسازی سلولهای B کمک میکنند. سیکلوسپورین A به عنوان مهارکننده سیستم ایمنی به کار میرود. ولی در مطالعهای حضور سیکلوسپورین موجب افزایش تکثیر و زنده ماندن لنفوسیتهای خون محیطی گردید. از دلایل آن میتوان به تداخل سیکلوسپورین با لنفوسیتهای T سیتوتوکسیک (TC) اشاره کرد که طی فرآیند آلوایمونیزاسیون و تحریک لنفوسیتهای ضد آنتیژن بیگانه ایجاد میگردند. در نهایت این امر منجر به فعالسازی و تکثیر سلول های T کمکی (T helper) که در نهایت تکثیر لنفوسیتهای B و تمایز آنان به پلاسماسل را به همراه دارد، میشود. یک دلیل دیگر هم میتواند اثر مهارکنندگی سیکلوسپورین بر روی فرآیند آپوپتوز باشد که منجر به افزایش تکثیر لنفوسیتی میشود (23). اینترلوکین 4 که به عنوان فاکتور رشد سلول B (BCGF) شناخته میشود، نقش مهمی در فعالسازی سلولهای B در مراحل اولیه پاسخ ایمنی ایفا میکند. IL-4 کمک میکند تا سلولهای B آماده پاسخ به IL-2 و سایر اینترلوکینها شوند. این سیتوکاین برای فعالسازی اولیه سلول B ضروری است و آنان را برای پاسخهای ایمنی بیشتر آماده میکند. اینترلوکین2 یک فاکتور رشد سلول T میباشد که برای گسترش مجموعه سلولهای T کمکی که به آنتیژنها پاسخ میدهند حیاتی است. بر اساس نتایج به دست آمده، ترکیب IL-4 و IL-2 نقش به سزایی برای ایمنیزایی آزمایشگاهی علیه آنتیژنهای محلول دارد. این ترکیب در تقویت رشد و تمایز سلول های B مؤثر است. هیچ مشاهدهای یافت نشده است که افزودن IL-6 برای پاسخ ایمنی اولیه به آنتیژنهای محلول ضروری باشد (24). اینترلوکین 10 (IL-10) یا عامل مهار تولید سیتوکاین انسانی (CSIF : Cy tokine synthesis in hibitory factor) توسط انواع مختلفی از سلولها تولید میشود و به عنوان یک سرکوبکننده کلی تکثیر سلولهای ایمنی و پاسخهای سیتوکاینی عمل میکند. در ایمنیزایی آزمایشگاهی حضور IL-10 قبل از ایمنسازی با آنتیژن باعث مهار تولید آنتیبادی توسط سلولهای خون محیطی میشود. با تجزیه و تحلیل الگوهای بیان ژنهای مختلف سیتوکاینی، نشان داده شد که بیان IL-10 قبل از قرار گرفتن سلولها در معرض آنتیژن میتواند با سرکوب تولید آنتیبادی بر پاسخ ایمنی تاثیر بگذارد. در صورتی که این اینترلوکین در صورت اضافه شدن به سلولهای تک هستهای ایمن شده با آنتیژن میتواند موجب افزایش تکثیر و بقای لنفوسیتهای B و تولید آنتیبادی نیز شود. زمانی که IL-10 به عنوان سیتوکاین در طول ایمنسازی آزمایشگاهی به سلول های تک هسته ای خون محیطی تیمار شده با LLME اضافه میشود، تولید آنتیبادی را به طور چشمگیری تقویت میکند. نتایج نشان داد که بیان ژن IL-10 همراه با تولید آنتیبادی افزایش یافته است. هنگامی که IL-10 در محیط آزمایشگاه، به سلولهای ایمنی مواجه شده با آنتیژن اضافه میشود، پاسخ ایمنی را به سمت Th2، هدایت میکند. در واقع IL-10 بر الگوهای بیان سیتوکاینی در سلولهای B و T تاثیر میگذارد و با کاهش سیتوکاینهای نوع Th1 و تنظیم مثبت سیتوکاینهای Th2 پاسخ ایمنی را به سمت تولید آنتیبادی تقویت میکند. با تجزیه و تحلیل بیان آنتیژن سطحی خاص بر سطح سلولهای B با استفاده از روشهای فلوسیتومتری، مشاهده شد که IL-10 با افزایش بیان مارکر CD38 در تمایز و بلوغ سلولهای B به پلاسما سلهای تولیدکننده آنتیبادی نیز نقش دارد. در مقابل در صورتی که IL-10 به سلولهای ایمنی قبل از ایمنیزایی با آنتیژن اضافه شود، تولید آنتیبادی را با مکانیسمهای مستقیم و غیر مستقیم سرکوب میکند. IL-10 مستقیماً از تکثیر سلولهای T و تولید سیتوکاین جلوگیری میکند در حالی که به طور غیر مستقیم بر بلوغ سلولهای دندرتیک تأثیر میگذارد و آنان را به سلولهای ارائهدهنده آنتیژنی تلوروژنیک (Tolerogenic) تبدیل میکند.
سلولهای T مهاری OKT8+ میتوانند پاسخ ایمنی را مهار کنند، لذا با حذف این سلولها در ایمنیزایی آزمایشگاهی، تولید آنتیبادی قویتر میشود. برای حذف این سلولها، آنها را به سوسپانسیون سلولی آنتی OKT8+ افزوده و بعد کمپلمان خرگوش اضافه گردید، که در نهایت لیز سلولهایOKT8+ را به همراه داشت(14).
2) استفاده از ادجوانت:
ادجوانتها مولکولها و ترکیباتی هستند که قدرت و طول عمر پاسخ ایمنی خاص به آنتیژنها را افزایش میدهند. ادجوانتها عمدتاً از پاتوژنها مشتق میشوند و اغلب بیانکننده الگوهای مولکولی مرتبط با پاتوژنها میباشند. انواع آنها شامل موادی مانند پلیساکارید باکتریاییCPG ODN و مورامیل دیپپتید (MDP) هستند. استفاده از ادجوانتها در ایمنیزایی آزمایشگاهی سبب افزایش تحریک ایمنی لنفوسیتهای B به آنتیژن میشود (15).
در شرایط فیزیولوژیک، سلولهای B بکر یا B پاسخ ایمونولوژیک ضعیفی دارند. در حالی که وجود ادجوانت CPG ODN ، مارکرهای CD8، CD40 و HLA-DRبر سطح سلولهای B Native را افزایش میدهد که متعاقباً باعث فعالسازی هر چه بیشتر سلولهای T میشود. این اثر در نهایت منجر به پاسخ ایمنی به مراتب قویتری خواهد شد (16).
در مطالعه ماتسودا و همکاران ابتدا از MDP به عنوان ادجوانت استفاده شد و نتایج نشان داد که MDP منجر به تکثیر غیر اختصاصی سلولهای B برای تولید آنتیبادی میشود. در ادامه از CPG ODN استفاده شد که منجر به تکثیر اختصاصی سلولهای B و تولید آنتیبادی اختصاصی گردید (17).
در ایجاد ایمنیزایی علیه آنتیژن Kell به منظور فعالسازی قویتر و مؤثرتر سلولهای B و تولید آنتیبادی، استفاده از ادجوانت CPG ODN مثمرثمر واقع شد. نتایج مطالعه نشان داد که با ایجاد شرایط کشت یکسان در چاهکهایی که از CPG ODN به عنوان ادجوانت استفاده شده است نسبت به چاهکهایی که فاقد CPG ODN بودند، جذب نوری بالاتری در طول موج 450 نانومتر دیده شد که به معنی تولید بیشتر آنتیبادی اختصاصی در این چاهکها میباشد (13).
3) استفاده از سیتوکاینها:
در ایمنیزایی in vitro جهت ایجاد ایمنیزایی، در ابتدا لنفوسیتها به روش سانتریفیوژ با شیب گرادیان از کیسههای خون کامل جدا میگردند. این لنفوسیتها، لنفوسیتهای بکری (native) هستند که تاکنون با آنتیژن برخورد نداشتهاند. جهت تحریک و فعالسازی لنفوسیتهای بکر نیاز به دو سیگنال میباشد. سیگنال اول توسط آنتیژن و رسپتور سلول B BCR)) القا میشود و سیگنال دوم نیز توسط مواد کمک تحریکی (co-factor) القا میگردد. پیشرفت سلولهای B در حال استراحت به سمت تبدیل شدن به پلاسما سل تولیدکننده آنتیبادی توسط سیتوکاینها تنظیم میشود. حضور این سیتوکاینها نقش مهمی در هدایت سلول B در چرخه سلولی به سمت تولید آنتیبادی ایفا میکند (18). اینترلوکین 2 (IL-2) و اینترفرون گاما (INF-γ) نقش مؤثری در تحریک تکثیر لنفوسیتهای B و القای تولید آنتیبادی به عنوان سیگنال دوم فعالسازی لنفوسیتهای B دارند. بدین ترتیب میتوان از این سیتوکاینها جهت بهبود ایمنیزایی آزمایشگاهی بهره برد (20، 19). جهت بهبود ایمنیزایی لنفوسیتهای بکر، آنتیژن و مواد کمک تحریکی نقش به سزایی ایفا میکنند. از جمله مهمترین مواد کمک تحریکی میتوان به سیتوکاینهایی همچون، اینترلوکین4 (IL-4) و اینترفرون گاما (INF-γ) اشاره کرد. این دو سیتوکاین میتوانند در بهبود ایمونیزاسیون آزمایشگاهی مؤثر باشند (21). افزودن اینترلوکین4 (IL4) به محیط کشت موجب افزایش ایمنیزایی بر علیه آنتیژن Kell در ایمنیزایی آزمایشگاهی بر علیه آنتیژنKell میشود (13).
کشت لنفوسیتی مخلوط (MLC)، روشی است که جهت مطالعه میانکنشهای سلول ـ سلول بین زیر گروههای لنفوسیتی و تولید ترکیبات ناشی از این میانکنشها به کار میرود (22). تکثیر لنفوسیتها در محیط MLC به علت ترشح سیتوکاینها در این محیط افزایش مییابد. سیتوکاینها با افزایش تکثیر لنفوسیت B به نامیراسازی سلولهای B کمک میکنند. سیکلوسپورین A به عنوان مهارکننده سیستم ایمنی به کار میرود. ولی در مطالعهای حضور سیکلوسپورین موجب افزایش تکثیر و زنده ماندن لنفوسیتهای خون محیطی گردید. از دلایل آن میتوان به تداخل سیکلوسپورین با لنفوسیتهای T سیتوتوکسیک (TC) اشاره کرد که طی فرآیند آلوایمونیزاسیون و تحریک لنفوسیتهای ضد آنتیژن بیگانه ایجاد میگردند. در نهایت این امر منجر به فعالسازی و تکثیر سلول های T کمکی (T helper) که در نهایت تکثیر لنفوسیتهای B و تمایز آنان به پلاسماسل را به همراه دارد، میشود. یک دلیل دیگر هم میتواند اثر مهارکنندگی سیکلوسپورین بر روی فرآیند آپوپتوز باشد که منجر به افزایش تکثیر لنفوسیتی میشود (23). اینترلوکین 4 که به عنوان فاکتور رشد سلول B (BCGF) شناخته میشود، نقش مهمی در فعالسازی سلولهای B در مراحل اولیه پاسخ ایمنی ایفا میکند. IL-4 کمک میکند تا سلولهای B آماده پاسخ به IL-2 و سایر اینترلوکینها شوند. این سیتوکاین برای فعالسازی اولیه سلول B ضروری است و آنان را برای پاسخهای ایمنی بیشتر آماده میکند. اینترلوکین2 یک فاکتور رشد سلول T میباشد که برای گسترش مجموعه سلولهای T کمکی که به آنتیژنها پاسخ میدهند حیاتی است. بر اساس نتایج به دست آمده، ترکیب IL-4 و IL-2 نقش به سزایی برای ایمنیزایی آزمایشگاهی علیه آنتیژنهای محلول دارد. این ترکیب در تقویت رشد و تمایز سلول های B مؤثر است. هیچ مشاهدهای یافت نشده است که افزودن IL-6 برای پاسخ ایمنی اولیه به آنتیژنهای محلول ضروری باشد (24). اینترلوکین 10 (IL-10) یا عامل مهار تولید سیتوکاین انسانی (CSIF : Cy tokine synthesis in hibitory factor) توسط انواع مختلفی از سلولها تولید میشود و به عنوان یک سرکوبکننده کلی تکثیر سلولهای ایمنی و پاسخهای سیتوکاینی عمل میکند. در ایمنیزایی آزمایشگاهی حضور IL-10 قبل از ایمنسازی با آنتیژن باعث مهار تولید آنتیبادی توسط سلولهای خون محیطی میشود. با تجزیه و تحلیل الگوهای بیان ژنهای مختلف سیتوکاینی، نشان داده شد که بیان IL-10 قبل از قرار گرفتن سلولها در معرض آنتیژن میتواند با سرکوب تولید آنتیبادی بر پاسخ ایمنی تاثیر بگذارد. در صورتی که این اینترلوکین در صورت اضافه شدن به سلولهای تک هستهای ایمن شده با آنتیژن میتواند موجب افزایش تکثیر و بقای لنفوسیتهای B و تولید آنتیبادی نیز شود. زمانی که IL-10 به عنوان سیتوکاین در طول ایمنسازی آزمایشگاهی به سلول های تک هسته ای خون محیطی تیمار شده با LLME اضافه میشود، تولید آنتیبادی را به طور چشمگیری تقویت میکند. نتایج نشان داد که بیان ژن IL-10 همراه با تولید آنتیبادی افزایش یافته است. هنگامی که IL-10 در محیط آزمایشگاه، به سلولهای ایمنی مواجه شده با آنتیژن اضافه میشود، پاسخ ایمنی را به سمت Th2، هدایت میکند. در واقع IL-10 بر الگوهای بیان سیتوکاینی در سلولهای B و T تاثیر میگذارد و با کاهش سیتوکاینهای نوع Th1 و تنظیم مثبت سیتوکاینهای Th2 پاسخ ایمنی را به سمت تولید آنتیبادی تقویت میکند. با تجزیه و تحلیل بیان آنتیژن سطحی خاص بر سطح سلولهای B با استفاده از روشهای فلوسیتومتری، مشاهده شد که IL-10 با افزایش بیان مارکر CD38 در تمایز و بلوغ سلولهای B به پلاسما سلهای تولیدکننده آنتیبادی نیز نقش دارد. در مقابل در صورتی که IL-10 به سلولهای ایمنی قبل از ایمنیزایی با آنتیژن اضافه شود، تولید آنتیبادی را با مکانیسمهای مستقیم و غیر مستقیم سرکوب میکند. IL-10 مستقیماً از تکثیر سلولهای T و تولید سیتوکاین جلوگیری میکند در حالی که به طور غیر مستقیم بر بلوغ سلولهای دندرتیک تأثیر میگذارد و آنان را به سلولهای ارائهدهنده آنتیژنی تلوروژنیک (Tolerogenic) تبدیل میکند.

مهم میباشد (3).
به علاوه ترشح IL-10 و TGF-B از سلولهای دندرتیک موجب فعالسازی سلولهای T تنظیمی و در نهایت سرکوب پاسخ ایمنی میگردد. با درک نقش IL-10 در پاسخ ایمنی و تأثیر آن بر سلولهای ارائهدهنده آنتیژن (APC) مانند سلولهای دندرتیک و ماکروفاژها، دستورالعمل ایمنسازی آزمایشگاهی میتواند برای تولید آنتیبادیهای خاص انسانی بهینه شود (26، 25). اهمیت فاکتورهایی مانند سلولهای T کمکی محدود شده با MHC ، فاکتورهای تمایز سلول B و سیتوکاینهایی مانند IL-2 در افزایش پاسخ ایمنی به آنتیژن در ایمنیزایی آزمایشگاهی نشان داده شده است (27).
مقایسهای بین مونوکلونال آنتیبادیهای تولید شده از طریق ایمنیزایی in vitro و in vivo انجام گرفته است که نتایج نشان داده ایمنیزایی in vitro به طیف وسیعتری از ایزوتیپهای آنتیبادی در مقایسه با ایمنیزایی in vivo منجر میشود که احتمالاً به دلیل وجود لنفوکاینهای مشتق شده از سلول T در طول فرآیند ایمنیزایی آزمایشگاهی است (9).
4) نوع و غلظت آنتیژن:
علاوه بر مواد کمک محرک، خود آنتیژن نیز در ایمنیزایی آزمایشگاهی دخیل است. از جمله مهمترین پارامترهای مرتبط با آنتیژن که در بهبود ایمونیزاسیون آزمایشگاهی دخیل میباشد میتوان به غلظت و اشکال آنتیژن اشاره کرد. افزایش غلظت آنتیژن از آن جایی که با افزایش سیگنال اول فعالسازی لنفوسیتها همراه است، موجب بهبود ایمونیزاسیون میگردد. مطالعهها نشان دادهاند که با افزایش غلظت آنتیژن، تولید آنتیبادی افزایش مییابد (29، 28).
آنتیژنها موادی هستند که میتوانند پاسخ ایمنی را القا کنند. آنتیژنهایی که برای ایمنیزایی به جهت تولید آنتیبادی استفاده میشوند، آنتیژنهای وابسته به T میباشند. یعنی آنتیژنهایی که برای تحریک سلول B و تولید آنتیبادی نیاز به سلولهای T کمکی (T helper) و تعامل آن با سلولهای B دارند. آنتیژنهایی با جنس پروتئینی تنها آنتیژنهایی هستند که وابسته به سلولهای T helper میباشنـد لـذا بهتریـن آنتیژن جهت ایمنیزایی بـه
منظور تولید آنتیبادی، آنتیژنهای پروتئینی هستند (11).
برای ایمنیزایی هم میتوان از آنتیژن پروتئینی کامل و هم از توالی پپتیدی خاصی از پروتئین (native) استفاده کرد. ساختار بزرگتر و پیچیدهتر پروتئین کامل سبب ایجاد پاسخ قویتری نسبت به پپتیدها میشود. اما پپتیدها از آن جایی که توانایی هدف قرار دادن نواحی خاصی از پروتئین هدف را دارند و از طرفی نیاز به آنتیژنهای مشتق شده از حیوان و انسان را از بین میبرند، نسبت به آنتیژن پروتئینی کامل، مزیت دارند. اما با همه این مزایا پپتیدها برای ایمونیزاسیون نیاز به کونژوگه شدن با پروتئین بزرگتری به نام حامل (carrier) را دارند.
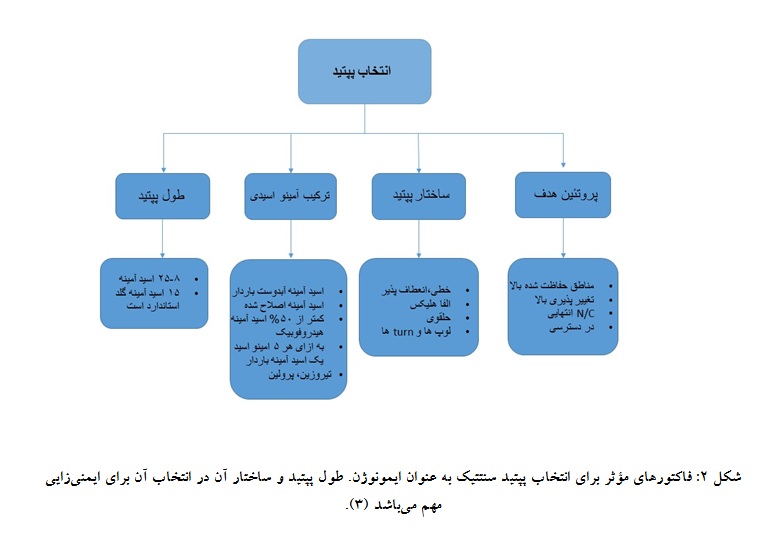
همچنین در ایمنیزایی با آنتیژن پروتئینی کامل تولید آنتیبادی از کلونهای مختلفی را به همراه دارد ولی در استفاده از پپتیدهای سنتتیک، اپیتوپها محدود میباشند لذا کلونهای تولیدکننده آنتیبادی نیز محدود بوده و نیازمند انتخاب بهترین کلون تولیدکننده آنتیبادی نمیباشد. به همین جهات استفاده از پپتیدهای سنتتیک جهت ایمنیزایی در مطالعههای اخیر گسترش یافته است (30). در استفاده از پپتید سنتتیک به منظور ایمنیزایی جهت تولید آنتیبادی، باید یک سری ویژگیها و فاکتورهایی را مد نظر گرفت که در شکل به آنان اشاره شده است (شکل 2).
در مطالعه مبارک و همکاران از پروتئین Tat (transcriptunal transactivator) از ویروس نقص ایمنی انسانی (HIV) در القای پاسخ ایمنی به روش آزمایشگاهی استفاده شد. هنگامی که Tat به شکل آزاد استفاده شد، هیچ اثر قابل توجهی در تحریک ترشح آنتیبادی در سلولهای تک هستهای خون محیطی انسان نشان داده نشد. این مطالعه نشان داد که پروتئین Tat به تنهایی برای تحریک پاسخ ایمنی کافی نیست. هنگامی کهTat با یک domain به نام ZZ مشتق شده از پروتئین A استافیلوکوکوس اورئوس فیوژ شد، افزایش قابل توجهی در تولید آنتیبادیهای IgM مشاهده شد. این مطالعه نشاندهنده این است که بعضی پروتئینها به تنهایی قادر به ایجاد پاسخ ایمنی نیستند و زمانی که با یک پروتئین دیگری به نام حامل کونژوگه میشوند، پاسخ ایمنی را ایجاد میکنند (31).
از طرفـی، غلظـتهای مختلـف آنتـیژن بـر تــولیــد آنتیبادیهای خاص در ایمنیزایی آزمایشگاهی تأثیر میگذارد. معمولاً غلظتهای پائین آنتیژن (ng/mL 10-1) برای تحریک تولید آنتیبادی خاص بهینه است (14).
5) نوع و غلظت لنفوسیت:
لنفوسیتهای B گروهی از گلبولهای سفید (WBC) میباشند، که نقش مهمی در پاسخ ایمنی و تولید آنتیبادی ایفا میکنند. ایمنیزایی آزمایشگاهی (in vitro immunization) به فرآیند تحریک سیستم ایمنی در خارج از بدن و در یک محیط آزمایشگاهی کنترل شده میگویند یعنی زمانی که لنفوسیتهای B در یک محیط کشت با آنتیژن مواجه شده و به دنبال آن فعال میشوند و تولید آنتیبادی اختصاصی علیه آنتیژن مینمایند. بدین منظور میتوان لنفوسیتها را از کیسه خون اهداکنندگان سالم، با استفاده از معرف فایکول (نوعی محیط گرادیان چگالی) سانتریفیوژ جداسازی کرد. به جای لنفوسیتهای خون محیطی از لنفوسیتهای لوزهها که بخشی از سیستم لنفاوی میباشند و حاوی غلظت بالایی از سلولهای ایمنی هستند نیز میتوان استفاده کرد. لنفوسیتهای لوزه در برابر سمیت سلولی ناشی از سرم مورد استفاده در محیط کشت انعطاف پذیرتر هستند (14).
استفاده از لنفوسیتهای خون محیطی انسان در ایمنیزایی آزمایشگاهی به دلیل در دسترس بودن و اثربخشی بیشتر در تولید آنتیبادی به لنفوسیتهای لوزه و سلولهای مغز استخوان ترجیح داده میشود (27).
غلظت بهینه سلول جهت کشت نیز در ایمنیزایی مؤثر میباشد. هنگامی که لنفوسیتها در غلظت سلولی کمتر از 106×1 کشت داده شدند، سطح آنتیبادیهای خاص تولید شده در مقایسه با غلظت بهینه 106×2 به طور قابل توجهی کمتر بود و در آزمایشهایی که از غلظت سلولی بالاتر از 106×4 استفاده شده است، سطح تولید آنتیبادی کمتر از آزمایش با میزان سلول 106×2 بود که این نشاندهنده اهمیت غلظت لنفوسیتها در محیط کشت میباشد (14). مطالعههای دیگری نیز اهمیت تعداد سلولهای لنفوسیت موجود در کشت، ایمنیزایی و تولید آنتیبادی را اثبات کردهاند (32).
6) شرایط فیزیولوژیک محیط کشت:
جهت ایمونیزاسیون آزمایشگاهی، سلولهای لنفوسیت کف پلیتهای کشت به صورت یکنواخت توزیع میگردند. جهت تأمین مواد مغذی که رشد یکنواخت سلولها را به همراه داشته باشد، باید محیط کشت مناسب همراه با سرم مانند سرم جنین گاوی (FBS) و یا سرم گوساله گاوی (FCS) استفاده کرد. وجود سرم در محیط کشت برای تأمین مواد مغذی لازم، فاکتورهای رشد و حمایت از لنفوسیتها برای تکثیر و تمایز به سلولهای ترشحکننده آنتیبادی ضروری است.
نتایج مطالعه لاگاک و همکاران، نشان داده است که لنفوسیتهای خون محیطی نسبت به وجود سرم جنین گاوی در محیط کشت حساس میباشند. هنگامی که لنفوسیتها در محیط بدون سرم و یا غلظت پائین سرم کشت داده شدند، تولید آنتیبادی اختصاصی مشاهده نشد که نشاندهنده لزوم وجود اجزای سرم برای ایمنسازی in vitro میباشد. علاوه بر اینها، استفاده از آنتیبیوتیکها در محیط کشت مانند جنتامایسین جهت جلوگیری از رشد باکتری و ال-گلوتامین به عنوان اسید آمینه برای حمایت از زندهماندن سلول و رشد سلولی در محیط کشت پیشنهاد میشود (14). محیط کشت شامل ERDF (Enhanced RDF) و یا RPMI ، 10% سرم جنین گاوی، مواد مغذی و فاکتورهای رشد ضروری برای رشد سلولها جهت ایمنیزایی در محیط کشت پیشنهاد شده است (23).
7) مدت زمان انکوباسیون:
تولید آنتیبادی در یک دوره 11 روزه زیر نظر گرفته شد، تا چارچوب زمانی بهینه برای حداکثر ترشح آنتیبادی تعیین شود. دادههای ارائه شده نشان داد که سطح آنتیبادی اختصاصی تولید شده پس از 7 روز انکوباسیون به اوج خود میرسـد و در روز پنجـم هنـوز سطـح آنتیبادی پائین است. در روز نهم نیز هم زندهمانی (viability) و هـم سنتز آنتیبادی کـاهش مییابد. 7 روز انکـوباسیون جهـت
ایمنیزایی لنفوسیتها مناسب میباشد(33).
8) تفاوت پاسخ ایمنی اهداکنندگان:
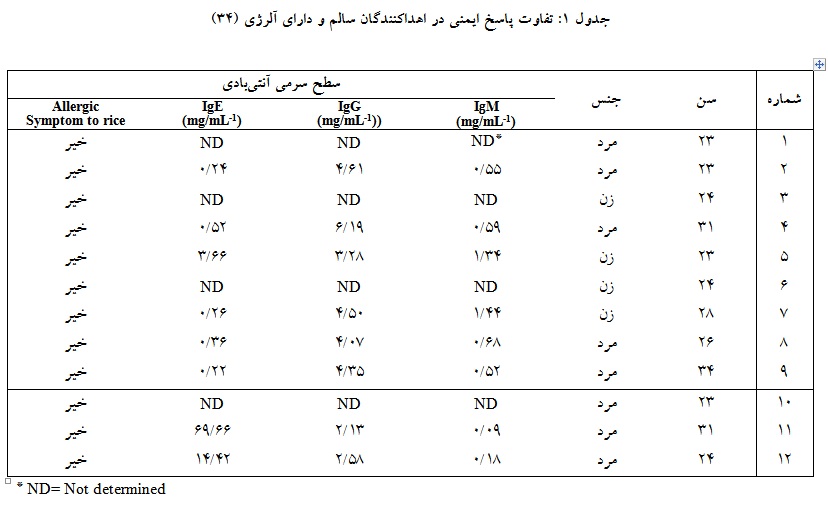
محققان مشاهده کردند که لنفوسیتهای خون محیطی اهداکنندگان مختلف شرایط بهینه متفاوتی جهت ایمنیزایی به منظور تولید آنتیبادی نشان میدهند. تفاوت نیازهای بهینه شرایط ایمنیسازی برای هر فرد نشاندهنده پاسخهای ایمنی منحصر به فرد هر شخص در برابر یک آنتیژن محلول خاص میباشد. برای بررسی بیشتر محققان نیاز ویژه به اینترلوکین 2 (IL-2) و اینترلوکین4 (IL-4) برای القای تولید آنتیبادی را در لنفوسیتهای خون محیطی (PBLS) از 12 داوطلب اهدای خون که 9 نفر آنان اهدکنندگان سالم و 3 نفر آنان دچار آلرژی بودند، بررسی کردند و پاسخهای ایمنی آنها را مقایسه نمودند. نتایج نشان داده که نیاز برای این سیتوکاینها در ایمنیزایی در بین این اهداکنندگان متفاوت میباشد (جدول1). PBLS از افراد متفاوت پاسخهای متفاوتی به IL-2 نشان میدهند. برخی افراد هیچ وابستگی به IL-2 نشان ندادند در حالی که برخی افزایش یا کاهش تولید آنتیبادی را در پاسخ به IL-2 داشتند. پاسخهای متنوع به IL-2 در بین اهداکنندگان سالم نشان میدهد که سیستم ایمنی فردی ممکن است نیازهای منحصر به فردی به سیتوکاینها برای تولید مؤثر آنتیبادی داشته باشند. این مطلب بیان میکند که مقادیر بهینه سیتوکاینهای مورد نیاز برای ایمنیزایی از فردی به فرد دیگر متفاوت است. این تنوع، پیچیدگی پاسخ ایمنی و نیاز به رویکردهای شخصی در مطالعههای ایمنی را برجسته میکند (34). در مطالعه مبارک و همکاران که از پروتئین فیوژن Ztat101 جهت ایمنیزایی استفاده شده، برای بررسی این که آیا پروتئین فیوژن تنوع در تحریک ایمنی نشان میدهد یا نه، این پروتئین را با 8 جمعیت مختلف سلولهای تک هستهای خون محیطی (PBMC) به دست آمده از 8 نمونه خون اهداکنندگان مجزا ایمن کردند. نتایج نشان داد که این پروتئین قادر به تحریک پاسخ ایمنی در همه نمونههای خون بود البته با شدت متفاوت. مطلب فوق همچنان میتواند نشاندهنده پاسخ ایمنی متفاوت اهداکنندگان در ایمنیزایی آزمایشگاهی باشد (31).
مقایسهای بین مونوکلونال آنتیبادیهای تولید شده از طریق ایمنیزایی in vitro و in vivo انجام گرفته است که نتایج نشان داده ایمنیزایی in vitro به طیف وسیعتری از ایزوتیپهای آنتیبادی در مقایسه با ایمنیزایی in vivo منجر میشود که احتمالاً به دلیل وجود لنفوکاینهای مشتق شده از سلول T در طول فرآیند ایمنیزایی آزمایشگاهی است (9).
4) نوع و غلظت آنتیژن:
علاوه بر مواد کمک محرک، خود آنتیژن نیز در ایمنیزایی آزمایشگاهی دخیل است. از جمله مهمترین پارامترهای مرتبط با آنتیژن که در بهبود ایمونیزاسیون آزمایشگاهی دخیل میباشد میتوان به غلظت و اشکال آنتیژن اشاره کرد. افزایش غلظت آنتیژن از آن جایی که با افزایش سیگنال اول فعالسازی لنفوسیتها همراه است، موجب بهبود ایمونیزاسیون میگردد. مطالعهها نشان دادهاند که با افزایش غلظت آنتیژن، تولید آنتیبادی افزایش مییابد (29، 28).
آنتیژنها موادی هستند که میتوانند پاسخ ایمنی را القا کنند. آنتیژنهایی که برای ایمنیزایی به جهت تولید آنتیبادی استفاده میشوند، آنتیژنهای وابسته به T میباشند. یعنی آنتیژنهایی که برای تحریک سلول B و تولید آنتیبادی نیاز به سلولهای T کمکی (T helper) و تعامل آن با سلولهای B دارند. آنتیژنهایی با جنس پروتئینی تنها آنتیژنهایی هستند که وابسته به سلولهای T helper میباشنـد لـذا بهتریـن آنتیژن جهت ایمنیزایی بـه
منظور تولید آنتیبادی، آنتیژنهای پروتئینی هستند (11).
برای ایمنیزایی هم میتوان از آنتیژن پروتئینی کامل و هم از توالی پپتیدی خاصی از پروتئین (native) استفاده کرد. ساختار بزرگتر و پیچیدهتر پروتئین کامل سبب ایجاد پاسخ قویتری نسبت به پپتیدها میشود. اما پپتیدها از آن جایی که توانایی هدف قرار دادن نواحی خاصی از پروتئین هدف را دارند و از طرفی نیاز به آنتیژنهای مشتق شده از حیوان و انسان را از بین میبرند، نسبت به آنتیژن پروتئینی کامل، مزیت دارند. اما با همه این مزایا پپتیدها برای ایمونیزاسیون نیاز به کونژوگه شدن با پروتئین بزرگتری به نام حامل (carrier) را دارند.
همچنین در ایمنیزایی با آنتیژن پروتئینی کامل تولید آنتیبادی از کلونهای مختلفی را به همراه دارد ولی در استفاده از پپتیدهای سنتتیک، اپیتوپها محدود میباشند لذا کلونهای تولیدکننده آنتیبادی نیز محدود بوده و نیازمند انتخاب بهترین کلون تولیدکننده آنتیبادی نمیباشد. به همین جهات استفاده از پپتیدهای سنتتیک جهت ایمنیزایی در مطالعههای اخیر گسترش یافته است (30). در استفاده از پپتید سنتتیک به منظور ایمنیزایی جهت تولید آنتیبادی، باید یک سری ویژگیها و فاکتورهایی را مد نظر گرفت که در شکل به آنان اشاره شده است (شکل 2).
در مطالعه مبارک و همکاران از پروتئین Tat (transcriptunal transactivator) از ویروس نقص ایمنی انسانی (HIV) در القای پاسخ ایمنی به روش آزمایشگاهی استفاده شد. هنگامی که Tat به شکل آزاد استفاده شد، هیچ اثر قابل توجهی در تحریک ترشح آنتیبادی در سلولهای تک هستهای خون محیطی انسان نشان داده نشد. این مطالعه نشان داد که پروتئین Tat به تنهایی برای تحریک پاسخ ایمنی کافی نیست. هنگامی کهTat با یک domain به نام ZZ مشتق شده از پروتئین A استافیلوکوکوس اورئوس فیوژ شد، افزایش قابل توجهی در تولید آنتیبادیهای IgM مشاهده شد. این مطالعه نشاندهنده این است که بعضی پروتئینها به تنهایی قادر به ایجاد پاسخ ایمنی نیستند و زمانی که با یک پروتئین دیگری به نام حامل کونژوگه میشوند، پاسخ ایمنی را ایجاد میکنند (31).
از طرفـی، غلظـتهای مختلـف آنتـیژن بـر تــولیــد آنتیبادیهای خاص در ایمنیزایی آزمایشگاهی تأثیر میگذارد. معمولاً غلظتهای پائین آنتیژن (ng/mL 10-1) برای تحریک تولید آنتیبادی خاص بهینه است (14).
5) نوع و غلظت لنفوسیت:
لنفوسیتهای B گروهی از گلبولهای سفید (WBC) میباشند، که نقش مهمی در پاسخ ایمنی و تولید آنتیبادی ایفا میکنند. ایمنیزایی آزمایشگاهی (in vitro immunization) به فرآیند تحریک سیستم ایمنی در خارج از بدن و در یک محیط آزمایشگاهی کنترل شده میگویند یعنی زمانی که لنفوسیتهای B در یک محیط کشت با آنتیژن مواجه شده و به دنبال آن فعال میشوند و تولید آنتیبادی اختصاصی علیه آنتیژن مینمایند. بدین منظور میتوان لنفوسیتها را از کیسه خون اهداکنندگان سالم، با استفاده از معرف فایکول (نوعی محیط گرادیان چگالی) سانتریفیوژ جداسازی کرد. به جای لنفوسیتهای خون محیطی از لنفوسیتهای لوزهها که بخشی از سیستم لنفاوی میباشند و حاوی غلظت بالایی از سلولهای ایمنی هستند نیز میتوان استفاده کرد. لنفوسیتهای لوزه در برابر سمیت سلولی ناشی از سرم مورد استفاده در محیط کشت انعطاف پذیرتر هستند (14).
استفاده از لنفوسیتهای خون محیطی انسان در ایمنیزایی آزمایشگاهی به دلیل در دسترس بودن و اثربخشی بیشتر در تولید آنتیبادی به لنفوسیتهای لوزه و سلولهای مغز استخوان ترجیح داده میشود (27).
غلظت بهینه سلول جهت کشت نیز در ایمنیزایی مؤثر میباشد. هنگامی که لنفوسیتها در غلظت سلولی کمتر از 106×1 کشت داده شدند، سطح آنتیبادیهای خاص تولید شده در مقایسه با غلظت بهینه 106×2 به طور قابل توجهی کمتر بود و در آزمایشهایی که از غلظت سلولی بالاتر از 106×4 استفاده شده است، سطح تولید آنتیبادی کمتر از آزمایش با میزان سلول 106×2 بود که این نشاندهنده اهمیت غلظت لنفوسیتها در محیط کشت میباشد (14). مطالعههای دیگری نیز اهمیت تعداد سلولهای لنفوسیت موجود در کشت، ایمنیزایی و تولید آنتیبادی را اثبات کردهاند (32).
6) شرایط فیزیولوژیک محیط کشت:
جهت ایمونیزاسیون آزمایشگاهی، سلولهای لنفوسیت کف پلیتهای کشت به صورت یکنواخت توزیع میگردند. جهت تأمین مواد مغذی که رشد یکنواخت سلولها را به همراه داشته باشد، باید محیط کشت مناسب همراه با سرم مانند سرم جنین گاوی (FBS) و یا سرم گوساله گاوی (FCS) استفاده کرد. وجود سرم در محیط کشت برای تأمین مواد مغذی لازم، فاکتورهای رشد و حمایت از لنفوسیتها برای تکثیر و تمایز به سلولهای ترشحکننده آنتیبادی ضروری است.
نتایج مطالعه لاگاک و همکاران، نشان داده است که لنفوسیتهای خون محیطی نسبت به وجود سرم جنین گاوی در محیط کشت حساس میباشند. هنگامی که لنفوسیتها در محیط بدون سرم و یا غلظت پائین سرم کشت داده شدند، تولید آنتیبادی اختصاصی مشاهده نشد که نشاندهنده لزوم وجود اجزای سرم برای ایمنسازی in vitro میباشد. علاوه بر اینها، استفاده از آنتیبیوتیکها در محیط کشت مانند جنتامایسین جهت جلوگیری از رشد باکتری و ال-گلوتامین به عنوان اسید آمینه برای حمایت از زندهماندن سلول و رشد سلولی در محیط کشت پیشنهاد میشود (14). محیط کشت شامل ERDF (Enhanced RDF) و یا RPMI ، 10% سرم جنین گاوی، مواد مغذی و فاکتورهای رشد ضروری برای رشد سلولها جهت ایمنیزایی در محیط کشت پیشنهاد شده است (23).
7) مدت زمان انکوباسیون:
تولید آنتیبادی در یک دوره 11 روزه زیر نظر گرفته شد، تا چارچوب زمانی بهینه برای حداکثر ترشح آنتیبادی تعیین شود. دادههای ارائه شده نشان داد که سطح آنتیبادی اختصاصی تولید شده پس از 7 روز انکوباسیون به اوج خود میرسـد و در روز پنجـم هنـوز سطـح آنتیبادی پائین است. در روز نهم نیز هم زندهمانی (viability) و هـم سنتز آنتیبادی کـاهش مییابد. 7 روز انکـوباسیون جهـت
ایمنیزایی لنفوسیتها مناسب میباشد(33).
8) تفاوت پاسخ ایمنی اهداکنندگان:
محققان مشاهده کردند که لنفوسیتهای خون محیطی اهداکنندگان مختلف شرایط بهینه متفاوتی جهت ایمنیزایی به منظور تولید آنتیبادی نشان میدهند. تفاوت نیازهای بهینه شرایط ایمنیسازی برای هر فرد نشاندهنده پاسخهای ایمنی منحصر به فرد هر شخص در برابر یک آنتیژن محلول خاص میباشد. برای بررسی بیشتر محققان نیاز ویژه به اینترلوکین 2 (IL-2) و اینترلوکین4 (IL-4) برای القای تولید آنتیبادی را در لنفوسیتهای خون محیطی (PBLS) از 12 داوطلب اهدای خون که 9 نفر آنان اهدکنندگان سالم و 3 نفر آنان دچار آلرژی بودند، بررسی کردند و پاسخهای ایمنی آنها را مقایسه نمودند. نتایج نشان داده که نیاز برای این سیتوکاینها در ایمنیزایی در بین این اهداکنندگان متفاوت میباشد (جدول1). PBLS از افراد متفاوت پاسخهای متفاوتی به IL-2 نشان میدهند. برخی افراد هیچ وابستگی به IL-2 نشان ندادند در حالی که برخی افزایش یا کاهش تولید آنتیبادی را در پاسخ به IL-2 داشتند. پاسخهای متنوع به IL-2 در بین اهداکنندگان سالم نشان میدهد که سیستم ایمنی فردی ممکن است نیازهای منحصر به فردی به سیتوکاینها برای تولید مؤثر آنتیبادی داشته باشند. این مطلب بیان میکند که مقادیر بهینه سیتوکاینهای مورد نیاز برای ایمنیزایی از فردی به فرد دیگر متفاوت است. این تنوع، پیچیدگی پاسخ ایمنی و نیاز به رویکردهای شخصی در مطالعههای ایمنی را برجسته میکند (34). در مطالعه مبارک و همکاران که از پروتئین فیوژن Ztat101 جهت ایمنیزایی استفاده شده، برای بررسی این که آیا پروتئین فیوژن تنوع در تحریک ایمنی نشان میدهد یا نه، این پروتئین را با 8 جمعیت مختلف سلولهای تک هستهای خون محیطی (PBMC) به دست آمده از 8 نمونه خون اهداکنندگان مجزا ایمن کردند. نتایج نشان داد که این پروتئین قادر به تحریک پاسخ ایمنی در همه نمونههای خون بود البته با شدت متفاوت. مطلب فوق همچنان میتواند نشاندهنده پاسخ ایمنی متفاوت اهداکنندگان در ایمنیزایی آزمایشگاهی باشد (31).

بحث
آنتیبادیها در بخش تشخیص و درمان بسیار کاربرد دارند. تاکنون روشهای مختلفی برای تولید این آنتیبادیها استفاده شده است. ایمنیزایی مرحله مقدماتی در تمامی این روشها میباشد که به شیوههای مختلفی صورت میگیرد. یکی از مهمتریـن شیـوههای ایمنیزایی، in vitro immunization میباشد. در این روش سلولهای ایمنی از سلولهای خون محیطی جدا شده و در آزمایشگاه به وسیله آنتیژن مد نظر تحریک میشوند و در نتیجه کلونهای لنفوسیتی تولیدکننده آنتیبادی اختصاصی علیه آنتیژن هدف القا میشود. جهت دستیابی به بهترین دستورالعمل ایمنیزایی آزمایشگاهی باید یک سری نکات را مد نظر داشت که عبارتند از:
نوع و غلظت آنتیژن که آنتیژنهایی با جنس پروتئینی و غلظت ng/mL 10-1 بهینه میباشد. نوع و غلظت لنفوسیت نیز حائز اهمیت میباشد که لنفوسیتهای خون محیطی به علت این که در دسترس میباشند و اثر بخشی بیشتری دارند، ترجیح داده میشوند. غلظت لنفوسیتها در محیط کشت نیز در ایمنیزایی جهت تولید آنتیبادی مؤثـر
میباشد که غلظت 106×2 سلول بهینه است. جهت ایمنیزایی مؤثر باید شرایط فیزیولوژیک محیط کشت را نیز تأمین کرد. وجود اجزای سرم در محیط کشت برای تأمین مواد مغذی لازم، فاکتورهای رشد، تکثیر و تمایز لنفوسیتها ضروری میباشد. علاوه بر اینها استفاده از آنتیبیوتیکها در محیط کشت جهت جلوگیری از رشد باکتری و الگلوتامین برای حمایت از زندهمانی و رشد سلول مؤثر میباشد. استفاده از ادجوانتها و سیتوکاینها در محیط کشت سبب افزایش تحریک ایمنی لنفوسیتهای B و تولید آنتیبادی خواهد شد. یکی از عوامل دیگر در بهینهسازی ایمونیزاسیون آزمایشگاهی، استفاده از اللوسین متیلاستر میباشد که سبب از بین بردن و حذف جمعیت سلولی غنی از لیزوزوم میشود. این سلولها شامل: مونوسیت، سلولهای T سیتوتوکسیک، سلولهای T تنظیمی و سلولهای کشنده طبیعی (NK) هستند. با حذف این سلولها که عمدتاً سبب مهار پاسخ ایمنی میشوند، تنها لنفوسیتهای B و T باقی میمانند که میانکنش آنها در محیط کشت منجر به افزایش ایمنیزایی و تکثیر لنفوسیتهای B و تولید آنتیبادی خواهد شد. مدت زمان انکوباسیون نیز بر روی ایمنیزایی جهت تولید آنتیبادی مؤثر میباشد. انکوباسیون به مدت 7 روز جهت ایمنیزایی لنفوسیتها مناسب است. این نکته را نیز باید توجه داشت که لنفوسیتهای خون اهداکنندگان مختلف شرایط بهینه متفاوتی برای ایمنیزایی به منظور دستیابی به آنتیبادی نیاز دارند. این تنوع پیچیدگی پاسخ ایمنی نشاندهنده این است که مقادیر بهینه برای ایمنیزایی از فردی به فرد دیگر متفاوت است و نیاز است در مطالعههای ایمنی، رویکردهای شخصی را نیز مد نظر گرفت.
نتیجهگیری
جهت دستیابی به کلون تولیدکننده آنتیبادی علیه یــک
آنتیژن دلخواه در شرایط آزمایشگاهی باید به عوامل مؤثر در ایجاد ایمنیزایی که در این مقاله مروری به آنها اشاره شده است، توجه نمود.
نقش نویسندگان
فائزه خیری اردهایی: ایده مقاله و نگارش نسخه اولیه مقاله
دکتر فاطمه یاری: نظارت بر تحقیق و نگارش مقاله و اصلاح و تهیه نسخه نهایی مقاله
نوع مطالعه: مروري |
موضوع مقاله:
ايمونولوژي
فهرست منابع
1. Liu JK. The history of monoclonal antibody development - Progress, remaining challenges and future innovations. Ann Med Surg (Lond) 2014; 3(4): 113-6. [DOI:10.1016/j.amsu.2014.09.001] [PMID] []
2. Voak D. Monoclonal antibodies as blood grouping reagents. Baillieres Clin Haematol 1990; 3(2): 219-42. [DOI:10.1016/S0950-3536(05)80048-4] [PMID]
3. Trier NH, Houen G. Peptide Antibodies in Clinical Laboratory Diagnostics. Adv Clin Chem 2017; 81: 43-96. [DOI:10.1016/bs.acc.2017.01.002] [PMID]
4. Nelson AL, Dhimolea E, Reichert JM. Development trends for human monoclonal antibody therapeutics. Nat Rev Drug Discov 2010; 9(10): 767-74. [DOI:10.1038/nrd3229] [PMID]
5. Panch SR, Montemayor-Garcia C, Klein HG. Hemolytic Transfusion Reactions. N Engl J Med 2019; 381(2): 150-62. [DOI:10.1056/NEJMra1802338] [PMID]
6. Matsumoto SE, Yamashita M, Katakura Y, Aiba Y, Tomimatsu K, Kabayama S, et al. A rapid and efficient strategy to generate antigen-specific human monoclonal antibody by in vitro immunization and the phage display method. J Immunol Methods 2008; 332(1-2): 2-9. [DOI:10.1016/j.jim.2007.12.005] [PMID]
7. Xu H, Xiang X, Ding W, Dong W, Hu Y. The Research Progress on Immortalization of Human B Cells. Microorganisms 2023; 11(12): 2936. [DOI:10.3390/microorganisms11122936] [PMID] []
8. Borrebaeck CA, Danielsson L, Möller SA. Human monoclonal antibodies produced from L-leucine methyl ester-treated and in vitro immunized peripheral blood lymphocytes. Biochem Biophys Res Commun 1987; 148(3): 941-6. [DOI:10.1016/S0006-291X(87)80223-1] [PMID]
9. Borrebaeck CA. Development of in vitro immunization in murine and human hybridoma technology. J Pharm Biomed Anal 1987; 5(8): 783-92. [DOI:10.1016/0731-7085(87)80096-1] [PMID]
10. Kato M, Yan H, Tsuji NM, Chiba T, Hanyu Y. A method for inducing antigen-specific IgG production by in vitro immunization. J Immunol Methods 2012; 386(1-2): 60-9. [DOI:10.1016/j.jim.2012.08.019] [PMID]
11. Borrebaeck CA, Danielsson L, Möller SA. Human monoclonal antibodies produced by primary in vitro immunization of peripheral blood lymphocytes. Proc Natl Acad Sci U S A 1988; 85(11): 3995-9. [DOI:10.1073/pnas.85.11.3995] [PMID] []
12. Thiele DL, Lipsky PE. Mechanism of L-leucyl-L-leucine methyl ester-mediated killing of cytotoxic lymphocytes: dependence on a lysosomal thiol protease, dipeptidyl peptidase I, that is enriched in these cells. Proc Natl Acad Sci U S A 1990; 87(1): 83-7. [DOI:10.1073/pnas.87.1.83] [PMID] []
13. Tobeyani F, Milani S, Yari F. Evaluation of effective factors during an in Vitro immunization against Kell blood group antigen. Sci J Iran Blood Transfus Organ 2022; 19(2):108-21. [Article in Farsi]
14. Lagacé J, Brodeur BR. Parameters affecting in vitro immunization of human lymphocytes. J Immunol Methods 1985; 85(1): 127-36. [DOI:10.1016/0022-1759(85)90281-9] [PMID]
15. Awate S, Babiuk LA, Mutwiri G. Mechanisms of action of adjuvants. Front Immunol 2013; 4: 114. [DOI:10.3389/fimmu.2013.00114] [PMID] []
16. Jiang W, Lederman MM, Harding CV, Rodriguez B, Mohner RJ, Sieg SF. TLR9 stimulation drives naïve B cells to proliferate and to attain enhanced antigen presenting function. Eur J Immunol 2007; 37(8): 2205-13. [DOI:10.1002/eji.200636984] [PMID]
17. Matsuda Y, Imamura R, Takahara S. Evaluation of Antigen-Specific IgM and IgG Production during an In Vitro Peripheral Blood Mononuclear Cell Culture Assay. Front Immunol 2017; 8: 794. [DOI:10.3389/fimmu.2017.00794] [PMID] []
18. Liu W, Tolar P, Song W, Kim TJ. Editorial: BCR Signaling and B Cell Activation. Front Immunol 2020; 11: 45. [DOI:10.3389/fimmu.2020.00045] [PMID] []
19. Xu TT, Qi Y, Pan Y, Li SQ, Chen HX, Li JM, et al. Screening of immune adjuvant and optimization of immunization protocol of glycoprotein D2 subunit vaccine against herpes simplex virus type 2. Chinese Journal of Biologicals 2018; 31: 689-94.
20. Zhang B, Yuan C, Song X, Xu L, Yan R, Shah MAA, et al. Optimization of Immunization Procedure for Eimeria tenella DNA Vaccine pVAX1-pEtK2-IL-2 and Its Stability. Acta Parasitol 2019; 64(4): 745-52. [DOI:10.2478/s11686-019-00090-4] [PMID]
21. Amrovani M, Yari F, Milani S, Amoohossein B. Evaluation of effective factors in the optimization of immunization to achieve antibodies against RhD antigen in culture medium. Sci J Iran Blood Transfus Organ 2022; 19(4): 257-69.
22. Pissas G, Eleftheriadis T. Assessment of Humoral Alloimmunity in Mixed Lymphocyte Reaction. Bio Protoc 2019; 9(2): e3139. [DOI:10.21769/BioProtoc.3139] [PMID] []
23. Milani S, Yari F. Alloimmune lymphocytes proliferation in presence of Mixed Lymphocyte Culture and cyclosporine. Sci J Iran Blood Transfus Organ 2021; 18(2): 97-104. [Article in Farsi]
24. Ichikawa A, Katakura Y, Teruya K, Hashizume S, Shirahata S. In vitro immunization of human peripheral blood lymphocytes: establishment of B cell lines secreting IgM specific for cholera toxin B subunit from lymphocytes stimulated with IL-2 and IL-4. Cytotechnology 1999; 31(1-2): 133-41.
25. Xu Q, Katakura Y, Yamashita M, Fang S, Tamura T, Matsumoto SE, et al. IL-10 augments antibody production in in vitro immunized lymphocytes by inducing a Th2-type response and B cell maturation. Biosci Biotechnol Biochem 2004; 68(11): 2279-84. [DOI:10.1271/bbb.68.2279] [PMID]
26. Yamashita M, Katakura Y, Aiba Y, Matsumoto SE, Morihara K, Teruya K, et al. Involvement of IL-10 in the suppression of antibody production by in vitro immunized peripheral blood mononuclear cells. Cytotechnology 2007; 55(2-3): 71-7. [DOI:10.1007/s10616-007-9088-x] [PMID] []
27. Danielsson L, Möller SA, Borrebaeck CA. Effect of cytokines on specific in vitro immunization of human peripheral B lymphocytes against T-cell dependent antigens. Immunology 1987; 61(1): 51-5.
28. Sprenger KG, Louveau JE, Murugan PM, Chakraborty AK. Optimizing immunization protocols to elicit broadly neutralizing antibodies. Proc Natl Acad Sci U S A 2020; 117(33): 20077-87. [DOI:10.1073/pnas.1919329117] [PMID] []
29. Bonenfant C, Dimier-Poisson I, Velge-Roussel F, Buzoni-Gatel D, Del Giudice G, Rappuoli R, Bout D. Intranasal immunization with SAG1 and nontoxic mutant heat-labile enterotoxins protects mice against Toxoplasma gondii. Infect Immun 2001; 69(3): 1605-12. [DOI:10.1128/IAI.69.3.1605-1612.2001] [PMID] []
30. Lee BS, Huang JS, Jayathilaka LP, Lee J, Gupta S. Antibody Production with Synthetic Peptides. Methods Mol Biol 2016; 1474: 25-47. [DOI:10.1007/978-1-4939-6352-2_2] [PMID]
31. Ait Mebarek M, Wijkhuisen A, Adel-Patient K, Lamourette P, Léonetti M, Volland H. Production of human antibodies by in vitro immunization using a fusion protein containing the transcriptional transactivator of HIV-1. J Immunol Methods 2013; 396(1-2): 96-106. [DOI:10.1016/j.jim.2013.07.015] [PMID]
32. Tamura T, Tomimatsu K, Katakura Y, Yamashita M, Matsumoto SE, Aiba Y, et al. Anti-peptide antibody production elicited by in vitro immunization of human peripheral blood mononuclear cells. Biosci Biotechnol Biochem 2007; 71(12): 2871-5. [DOI:10.1271/bbb.60460] [PMID]
33. Ho MK, Rand N, Murray J, Kato K, Rabin H. In vitro immunization of human lymphocytes. I. Production of human monoclonal antibodies against bombesin and tetanus toxoid. J Immunol 1985; 135(6): 3831-8. [DOI:10.4049/jimmunol.135.6.3831]
34. Yamashita M, Katakura Y, Shim SY, Matsumoto SE, Tamura T, Morihara K, et al. Different individual immune responses elicited by in vitro immunization. Cytotechnology 2002; 40(1-3): 161-5.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







