جلد 21، شماره 3 - ( پاییز 1403 )
جلد 21 شماره 3 صفحات 267-254 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Eslahi kalurazi A, Shahrousvand M, Davachi S, Mohammadi-Rovshandeh J, Mobayen M. Hemostatic materials based on natural polymers. bloodj 2024; 21 (3) :254-267
URL: http://bloodjournal.ir/article-1-1536-fa.html
URL: http://bloodjournal.ir/article-1-1536-fa.html
اصلاحی کلورزی امیر، شهروسوند محسن، دواچی سید محمد، محمدی روشنده جمشید، مبین محمدرضا. مواد بندآورنده خونی بر پایه پلیمرهای طبیعی. فصلنامه پژوهشی خون. 1403; 21 (3) :254-267
استادیار دانشکده فنی کاسپین ـ دانشکدگان فنی ـ دانشگاه تهران
واژههای کلیدی: کلمات کلیدی: لخته خون، زخمها، پلیمرها، منعقدکننده، خونریزی، کیتوسان، نشاسته، آلژینات
متن کامل [PDF 954 kb]
(656 دریافت)
| چکیده (HTML) (1647 مشاهده)
مقدمه
خونریزی یکی از عواملی است که در صورت عدم کنترل منجر به آسیبهای جبرانناپذیری از قبیل افت فشار خون، اختلال عملکرد اندامها و حتی مرگ میشود (1). بنابراین بندآورندگی به موقع و سریع در عملهای جراحی، حوادث رانندگی و جنگها نقش ضروری دارد، زیرا اولین عامل مرگ در جنگها و در غیر نظامیان دومین عامل پس از آسیبهای مغزی است. با توجه به کاربردهای مختلف مواد بندآورنده خونی در موقعیتهای مختلف، نیاز مبرم به این مواد برای زخمهایی با خونریزی احشایی با شکل نامنظم، غیرقابل تراکم و خونریزی با شدت جریان بالا وجود دارد (3، 2).
یک عامل بندآورنده خونی مناسب باید دارای ویژگیهایی مانند زیست سازگاری خوب، غیر سمی بودن، هزینه کم، استفاده آسان، کمترین مقدار اتلاف خون، سرعت بندآورندگی بالا و عدم حساسیت باشد، که با توجه به برآیند این ویژگیها، از پلیمرهای طبیعی از قبیل سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات برای ترمیم زخم و جلوگیری از خونریزی استفاده شده است (5، 4).
ترمیم زخم یک روند بسیار دقیق و هماهنگ است که از رویدادهای سلولی و مولکولی تشکیل شده و شامل چهار مرحله قطع خونریزی، التهاب، تکثیر و بازسازی میشود.
ایجاد زخم با شکست بافت همراه است. اولین مرحله در راستای بهبود، قطع خونریزی میباشد که این مرحله بلافاصله پس از آسیب با آزادسازی عوامل انعقادی همراه رخ میدهد. در این مرحله پلاکتهای موجود در خون فعال میشوند که موجب انقباض عروق میگردند و با جمع شدن پلاکتها در محل آسیب یک مانع فیزیکی ایجاد میشود، در نهایت این عملکرد موجب کاهش جریان خون میشود (6). مرحله التهاب به مدت 1 تا 4 روز طول میکشد که با علائمی مانند درد و تورم همراه است. این مرحله مانع آلودگیها شده و با پاکسازی محل زخم از باکتریها، بر بستر زخم برای رشد بافت جدید تمرکز دارد. در اوایل روز چهارم فیبروبلاستها جذب شده است و ماکروفاژهای بافت آزاد شدهاند تا رگزایی بافت جدید را مهیا کنند. مرحله سوم مکانیسم التیام، تکثیر است که با بسته شدن تدریجی زخم، تشکیل کلاژن، رگزایی و بازسازی بافت شناخته میشود. این مرحله 3 تا 21 روز بعد از آسیب ادامه مییابد. بازسازی محل آسیب دیده که 2 تا 3 هفته یا بیش از یک سال طول میکشد، به عنوان آخرین مرحله التیام شناخته میشود و وظیفه افزایش قدرت کششی و انقباض زخم را بر عهده دارد. با اتمام همه مراحل ترمیم زخم حتی پس از گذشت یک سال، باز هم مقدار کلاژن کمتری در محل زخم وجود دارد و استحکام کششی بافت ترمیم شده حدود 80 درصد میباشد و هرگز به 100 درصد نمیرسد(7، 5).
در این کار تلاش ما بر این بوده است تا به معرفی پلیمرهای طبیعی که سهم زیادی از بازار و کاربرد گستردهای در شرایط اورژانسی را به خود اختصاص دادهاند بپردازیم. یکی از عواملی که میتواند در نقش بندآورنده تاثیرگذار باشد، منشاء طبیعی پلیمر است زیرا مواد طبیعی به خودی خود زیست سازگاری و زیست تخریبپذیری مناسبی دارند. عامل مؤثر دیگری که در میزان بندآورندگی مهم است، نوع ساختار فیزیکی از قبیل هیدروژل، پودر، اسفنج و گاز است. در ادامه بندآورندههای تجاری معرفی و بررسی شدند. در این بررسی بر روی مواد بندآورنده خونی بر پایه پلیمرهای طبیعی و مواد بندآورنده خونی در بازار جهانی که در مقالات علمی سالهای اخیر گزارش شدهاند، تمرکز شده است.
مواد و روشها
در این پژوهش به صورت مروری، نقش بندآورندگی در ترمیم زخم، بندآورندههای مختلف بر پایه پلیمرهای طبیعی و بازار جهانی این مواد در 55 کار پژوهشی بررسی شد. در این راستا از 11 مقاله معتبر با هدف بررسی انعقاد پلیمرهای طبیعی استفاده شد. از انتشارات معتبر بینالملی و فارسی مانند Elsevier ، Springer ، Wiley Online Library، ScienceDirect و SID استفاده شد. برای جستجو از کلمات کلیدی و کاربردی مانند بندآورندههای خون، sodium alginate ، chitosan ، hemostatic ، oxidized cellulose ، collagen و starch استفاده شد.
یافتهها
اولین مرحله از مراحل برای ترمیم زخم، بندآورندگی است. مراحل بعدی که به بازسازی بافت کمک میکنند شامل التهاب، تکثیر و بازسازی است. مواد بندآورنده در عملهای جراحی و اورژانسی بسیار حیاتیاند. این مواد در بازار جهانی و کارهای تحقیقاتی به دو دسته ساختنی و طبیعی تقسیم میشوند، این در حالی است که مواد با منشاء طبیعی به خاطر ذاتی که دارند، عملکرد بهینه و حداقل سمیت را از خود نشان دادهاند. پلیمرهای طبیعی منعقدکننده شامل سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات میشوند. در ادامه به تشریح پلیمرهای طبیعی، معرفی مختصر پلیمرهای سنتزی، ساختار فیزیکی بندآورندهها و نمونههای تجاری پرداخته میشود.
مروری بر مواد بندآورنده خونی بر پایه پلیمرهای طبیعی:
در سالیان قبل از روشهایی متفاوت برای کنترل خونریزی استفاده شده است که مشکلات و عوارض زیادی را به وجود میآوردند. در تمدنهای باستانی از موم، ریشه گونه خاصی از ارکیده و جو برای جلوگیری از خونریزی استفاده میکردند (9، 8). عوامل زیادی از جمله منشاء پلیمر بر بندآورندگی خونریزی مؤثر است که در ادامه بررسی شده است.
منشاء پلیمری مواد بندآورنده خونی
سلولز اکسید شده
سلولز یک هموپلی ساکارید خنثی است که از
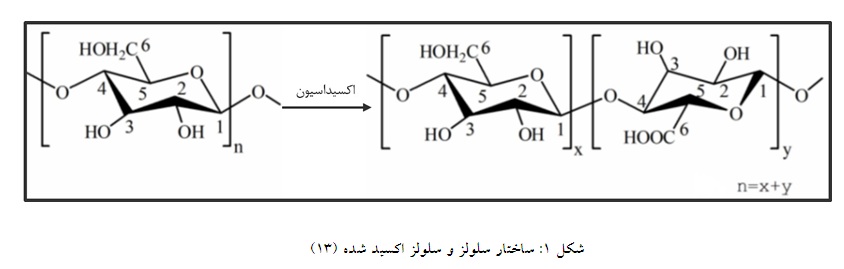
فراوانترین مواد زیست تخریبپذیر به شمار میرود (10). سلولز به طور کلی به دو دسته گیاهی و باکتریایی که از نظر شیمیایی یکسان و قابل استفاده برای بندآورندگیاند تقسیم میشود، این در حالی است که سلولز باکتریایی خلوص بالاتری دارد، البته سلولزهای گیاهی را هم با فرآیندهای خالصسازی میتوان به درصد خلوص بالایی رساند (11). با استفاده از سلولز، سلولز احیا شده اکسید شده به دست میآید که ساختار این ماده در شکل آورده شده است و حاوی 3 تا 25 درصد گروه کربوکسیل است که نشاندهنده پلیمری سازگار و قابل جذب میباشد (شکل 1). سلولز احیا شده اکسید شده به دلیل زیست سازگاری، زیست تخریبپذیری، سمیت کم و هزینه پایین به طور گسترده مورد تحقیق قرار گرفته و برای کاربردهای پزشکی زیادی به کار گرفته شده است. یکی دیگر از مزایای مهم سلولز اکسید شده این است که از گیاه گرفته میشود در نتیجه خطر بیماری ویروسی وجود ندارد (12).
یوگنیا کیروش و همکارانش در سال 2021 یک غشاء بر پایه سلولز باکتریایی اکسید شده برای کاربرد بندآورندگی طراحی کردند. تجزیه زیستی این ماده در مقایسه با نمونه اکسید نشده و تجاری در محیط آب خالص انجام شد. نمونه اکسید شده تجزیه بهتری در مدت 63 روز نشان داد، اما هیچ یک از نمونهها به طور کامل تخریب نشدند. با افزودن مایع خونی، سلولز اکسید نشده سرعت انعقاد کمتری نسبت به نمونه تجاری داشته، این در حالی است که اکسیداسیون موجب افزایش سرعت انعقاد در حد نمونه تجاری شده است.
سلولی و رشد سلولها در سطح و منافذ این داربست تایید زیست سازگاری این محصول است. این ماده برای تخمین مقدار زیست تخریبپذیری با کلاژن گاوی که یک محصول تجاری است مقایسه شد. پس از کاشت زیر پوستی هیچگونه التهابی مشاهده نشد. در روزهای متوالی اندازه اسفنج کاشته شده گرفته شد، اندازهها روند کاهشی تا روز 28 ام را نشان دادند و میزان تخریب به بالای 90% رسید. این اسفنج با جذب 20 برابری خون نسبت به وزن خود برتری چشمگیری نسبت به نمونه کلاژن گاوی تجاری نشان داد. برای بررسی توانایی انعقاد، این ماده با کلاژن گاوی و سلولز اکسید شده مقایسه شد. ماده سلولز به سرعت باعث ایجاد لخته شد، این در حالی است که اسفنجهای کلاژنی جذب خون و فعالسازی پلاکتهای بیشتری داشتند (37).
با گسترش فناوری زیستی، نوعی کلاژن توسط بیوتکنولوژی با ترکیب جدیدی به نام (rCOL) ساخته شده است. این ماده یک ترکیب ایدهآل است زیرا معایب کلاژن معمولی را رفع کرده است. یو هی و همکاران در سال 2021 روی یک اسفنج بندآورنده بر پایه کلاژن نوترکیب 1- اتیل- 3- [3- دیمتیل آمین پروپیل] کربودی ایمید هیدروکلراید (EDC) بررسی نمودند. مشاهدات مورفولوژیکی نشان داد که اسفنج کلاژن نوترکیب مقدار بیشتری از خون را به خاطر منافذ مواد نسبت به کلاژن معمولی جذب کرده و غلظت انعقاد را افزایش میدهد (38).
سدیم آلژینات:
جهان اقیانوسهای وسیع فراوانی دارد. با توسعه و اکتشاف اقیانوس، تحقیقات و استفاده از منابع اقیانوس در سالهای اخیر بیشتر و بیشتر مورد توجه قرار گرفته است (39). پلیساکاریدهای دریایی مانند آلژینات که یک پلیساکارید آنیونی است، از جلبک به دست میآید و به صورت نمکهای سدیم، کلسیم و منیزیم وجود دارد (40) (شکل 7). آلژینات به دلیل مزایای منحصر به فرد آن در هموستاز به محبوبیت تبدیل شده است. آلژینات دارای ایمنی، زیست سازگاری، عدم ایمنی زایی، جذب آب بالا و
خاصیت تشکیل آسان هیدروژل است (41).

ترکیبات آلژیناتی به عنوان مکمل منعقدکننده با سلولز استفاده میشوند، به طوری که شیائو کان اویانگ و همکارانش در سال 2022 یک میکروسفر متخلخل بر پایه آلژینات و نانو سلولز با هدف یک محصول منعقدکننده سریع خونریزی تولید کردند. اجزای این محصول از خود همولیز بسیار کمتری از سطح استاندارد نشان دادند، به همین علت خون سازگاری بالایی از خود نشان داده است. این ترکیب به خاطر دارا بودن از گروههای آمونیومی، خاصیت ضد باکتریایی قویتری نسبت به سلولز و آلژینات خالص نشان داد. برای ارزیابی عملکرد انعقادی این ترکیب را بر 12 دم و 12 نمونه کبد موش استفاده کردند. نتایج زمانی و وزنی مربوط به دم موش نشان دادند که در صورت استفاده از ترکیب آلژینات و نانوسلولز، زمان انعقاد به 40 درصد (حدود 80 ثانیه) و مقدار خون از دست رفته به 46 درصد (حدود 43 گرم) کاهش یافته است، همچنین در مدل خونریزی کبد روند کاهشی مقدار خون از دست رفته در حدود 23 درصد (3/13 گرم) و زمان انعقاد 49 درصد (36 ثانیه) ثبت کرد (42). ژانگ و همکارانش در سال 2019 یک هیدروژل بندآورنده خونی مبتنی بر سدیم آلژینات تهیه کردند. برای ارزیابی عملکرد بندآورندگی از روش سوراخ کردن کبد موش استفاده شد. استفاده از هیدروژل آلژیناتی در طول دوره منجر به خونریزی خیلی
متن کامل: (1430 مشاهده)
مواد بندآورنده خونی بر پایه پلیمرهای طبیعی
امیر اصلاحی کلورزی1، محسن شهروسوند2، سید محمد دواچی3، جمشید محمدی روشنده4،
محمدرضا مبین5
چکیده
سابقه و هدف
مواد منعقدکننده خون در جلوگیری از عوارض ناشی از خونریزی کنترل نشده، مانند مرگ و آسیب به اندامها، نقش حیاتی دارند. این ترکیبات باید علاوه بر حداکثر سرعت انعقاد و حداقل اتلاف خون، ویژگیهایی نظیر زیستسازگاری، تجزیهپذیری، خونسازگاری، خواص مکانیکی مناسب، قیمت مناسب و سهولت کاربرد را داشته باشند. پژوهشهای اخیر نشان میدهد که برخی پلیمرهای طبیعی مانند سلولز اکسید شده، کیتوسان، نشاسته، کلاژن و آلژینات دارای خواص بندآورندگی خون هستند. این مطالعه به بررسی عملکرد بندآورندگی، منبع پلیمری این مواد و محصولات موجود در بازار پرداخته است.
مواد و روشها
در این پژوهش به صورت مروری، نقش انعقاد خون توسط پلیمرهای طبیعی در 55 مقاله انگلیسی و فارسی معتبر بررسی شد. از منابع معتبر بینالمللی و فارسی مانند Elsevier ، Springer ، Wiley Online Library، ScienceDirect و SID استفاده شد. برای جستجو از کلمات کلیدی و کاربردی مانند بندآورندههای خون، sodium alginate ، chitosan ، hemostatic ، oxidized cellulose ، collagen و starch استفاده شد.
یافتهها
اولین مرحله از مراحل برای ترمیم زخم، بندآورندگی است. مراحل بعدی که به بازسازی بافت کمک میکنند شامل التهاب، تکیثر و بازسازی است. این مواد در بازار جهانی و کارهای تحقیفاتی به دو دسته ستنزی و طبیعی تقسیم میشوند. پلیمرهای طبیعی منعقدکننده شامل سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات میباشند.
نتیجه گیری
استفاده از پلیمرهای طبیعی به عنوان بندآورندههای خون نشاندهنده پتانسیل بالای این مواد در بهبود فرآیندهای درمانی و کاهش عوارض جانبی ناشی از مواد مصنوعی است، که میتواند به توسعه راهکارهای نوین و مؤثر در مدیریت خونریزیهای حاد منجر شود.
کلمات کلیدی: لخته خون، زخمها، پلیمرها، منعقدکننده، خونریزی، کیتوسان، نشاسته، آلژینات
تاریخ دریافت: 07/03/1403
تاریخ پذیرش : 31/05/1403
1- دانشجوی کارشناسی ارشد مهندسی پلیمر ـ دانشکده فنی کاسپین ـ دانشکدگان فنی ـ دانشگاه تهران ـ رضوانشهر ـ گیلان ـ ایران
2- مؤلف مسئول: دکترای تخصصی مهندسی پلیمر ـ استادیار دانشکده فنی کاسپین ـ دانشکدگان فنی ـ دانشگاه تهران ـ رضوانشهر ـ گیلان ـ ایران ـ صندوق پستی: 43841-119
3- دکترای تخصصی مهندسی پلیمر - استادیار دانشکده زیستشناسی و شیمی - دانشگاه بینالمللی تگزاس A&M ـ لاردو ـ ایالات متحده آمریکا
4- دکترای تخصصی مهندسی پلیمرـ دانشیار دانشکده فنی کاسپین ـ دانشکدگان فنی ـ دانشگاه تهران ـ رضوانشهرـ گیلان ـ ایران
5- متخصص جراحی عمومی ـ فلوشیپ سوختگی ـ مرکز تحقیقات سوختگی و ترمیمی ـ دانشگاه علوم پزشکی گیلان ـ رشت ـ ایران
امیر اصلاحی کلورزی1، محسن شهروسوند2، سید محمد دواچی3، جمشید محمدی روشنده4،
محمدرضا مبین5
چکیده
سابقه و هدف
مواد منعقدکننده خون در جلوگیری از عوارض ناشی از خونریزی کنترل نشده، مانند مرگ و آسیب به اندامها، نقش حیاتی دارند. این ترکیبات باید علاوه بر حداکثر سرعت انعقاد و حداقل اتلاف خون، ویژگیهایی نظیر زیستسازگاری، تجزیهپذیری، خونسازگاری، خواص مکانیکی مناسب، قیمت مناسب و سهولت کاربرد را داشته باشند. پژوهشهای اخیر نشان میدهد که برخی پلیمرهای طبیعی مانند سلولز اکسید شده، کیتوسان، نشاسته، کلاژن و آلژینات دارای خواص بندآورندگی خون هستند. این مطالعه به بررسی عملکرد بندآورندگی، منبع پلیمری این مواد و محصولات موجود در بازار پرداخته است.
مواد و روشها
در این پژوهش به صورت مروری، نقش انعقاد خون توسط پلیمرهای طبیعی در 55 مقاله انگلیسی و فارسی معتبر بررسی شد. از منابع معتبر بینالمللی و فارسی مانند Elsevier ، Springer ، Wiley Online Library، ScienceDirect و SID استفاده شد. برای جستجو از کلمات کلیدی و کاربردی مانند بندآورندههای خون، sodium alginate ، chitosan ، hemostatic ، oxidized cellulose ، collagen و starch استفاده شد.
یافتهها
اولین مرحله از مراحل برای ترمیم زخم، بندآورندگی است. مراحل بعدی که به بازسازی بافت کمک میکنند شامل التهاب، تکیثر و بازسازی است. این مواد در بازار جهانی و کارهای تحقیفاتی به دو دسته ستنزی و طبیعی تقسیم میشوند. پلیمرهای طبیعی منعقدکننده شامل سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات میباشند.
نتیجه گیری
استفاده از پلیمرهای طبیعی به عنوان بندآورندههای خون نشاندهنده پتانسیل بالای این مواد در بهبود فرآیندهای درمانی و کاهش عوارض جانبی ناشی از مواد مصنوعی است، که میتواند به توسعه راهکارهای نوین و مؤثر در مدیریت خونریزیهای حاد منجر شود.
کلمات کلیدی: لخته خون، زخمها، پلیمرها، منعقدکننده، خونریزی، کیتوسان، نشاسته، آلژینات
تاریخ دریافت: 07/03/1403
تاریخ پذیرش : 31/05/1403
1- دانشجوی کارشناسی ارشد مهندسی پلیمر ـ دانشکده فنی کاسپین ـ دانشکدگان فنی ـ دانشگاه تهران ـ رضوانشهر ـ گیلان ـ ایران
2- مؤلف مسئول: دکترای تخصصی مهندسی پلیمر ـ استادیار دانشکده فنی کاسپین ـ دانشکدگان فنی ـ دانشگاه تهران ـ رضوانشهر ـ گیلان ـ ایران ـ صندوق پستی: 43841-119
3- دکترای تخصصی مهندسی پلیمر - استادیار دانشکده زیستشناسی و شیمی - دانشگاه بینالمللی تگزاس A&M ـ لاردو ـ ایالات متحده آمریکا
4- دکترای تخصصی مهندسی پلیمرـ دانشیار دانشکده فنی کاسپین ـ دانشکدگان فنی ـ دانشگاه تهران ـ رضوانشهرـ گیلان ـ ایران
5- متخصص جراحی عمومی ـ فلوشیپ سوختگی ـ مرکز تحقیقات سوختگی و ترمیمی ـ دانشگاه علوم پزشکی گیلان ـ رشت ـ ایران
مقدمه
خونریزی یکی از عواملی است که در صورت عدم کنترل منجر به آسیبهای جبرانناپذیری از قبیل افت فشار خون، اختلال عملکرد اندامها و حتی مرگ میشود (1). بنابراین بندآورندگی به موقع و سریع در عملهای جراحی، حوادث رانندگی و جنگها نقش ضروری دارد، زیرا اولین عامل مرگ در جنگها و در غیر نظامیان دومین عامل پس از آسیبهای مغزی است. با توجه به کاربردهای مختلف مواد بندآورنده خونی در موقعیتهای مختلف، نیاز مبرم به این مواد برای زخمهایی با خونریزی احشایی با شکل نامنظم، غیرقابل تراکم و خونریزی با شدت جریان بالا وجود دارد (3، 2).
یک عامل بندآورنده خونی مناسب باید دارای ویژگیهایی مانند زیست سازگاری خوب، غیر سمی بودن، هزینه کم، استفاده آسان، کمترین مقدار اتلاف خون، سرعت بندآورندگی بالا و عدم حساسیت باشد، که با توجه به برآیند این ویژگیها، از پلیمرهای طبیعی از قبیل سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات برای ترمیم زخم و جلوگیری از خونریزی استفاده شده است (5، 4).
ترمیم زخم یک روند بسیار دقیق و هماهنگ است که از رویدادهای سلولی و مولکولی تشکیل شده و شامل چهار مرحله قطع خونریزی، التهاب، تکثیر و بازسازی میشود.
ایجاد زخم با شکست بافت همراه است. اولین مرحله در راستای بهبود، قطع خونریزی میباشد که این مرحله بلافاصله پس از آسیب با آزادسازی عوامل انعقادی همراه رخ میدهد. در این مرحله پلاکتهای موجود در خون فعال میشوند که موجب انقباض عروق میگردند و با جمع شدن پلاکتها در محل آسیب یک مانع فیزیکی ایجاد میشود، در نهایت این عملکرد موجب کاهش جریان خون میشود (6). مرحله التهاب به مدت 1 تا 4 روز طول میکشد که با علائمی مانند درد و تورم همراه است. این مرحله مانع آلودگیها شده و با پاکسازی محل زخم از باکتریها، بر بستر زخم برای رشد بافت جدید تمرکز دارد. در اوایل روز چهارم فیبروبلاستها جذب شده است و ماکروفاژهای بافت آزاد شدهاند تا رگزایی بافت جدید را مهیا کنند. مرحله سوم مکانیسم التیام، تکثیر است که با بسته شدن تدریجی زخم، تشکیل کلاژن، رگزایی و بازسازی بافت شناخته میشود. این مرحله 3 تا 21 روز بعد از آسیب ادامه مییابد. بازسازی محل آسیب دیده که 2 تا 3 هفته یا بیش از یک سال طول میکشد، به عنوان آخرین مرحله التیام شناخته میشود و وظیفه افزایش قدرت کششی و انقباض زخم را بر عهده دارد. با اتمام همه مراحل ترمیم زخم حتی پس از گذشت یک سال، باز هم مقدار کلاژن کمتری در محل زخم وجود دارد و استحکام کششی بافت ترمیم شده حدود 80 درصد میباشد و هرگز به 100 درصد نمیرسد(7، 5).
در این کار تلاش ما بر این بوده است تا به معرفی پلیمرهای طبیعی که سهم زیادی از بازار و کاربرد گستردهای در شرایط اورژانسی را به خود اختصاص دادهاند بپردازیم. یکی از عواملی که میتواند در نقش بندآورنده تاثیرگذار باشد، منشاء طبیعی پلیمر است زیرا مواد طبیعی به خودی خود زیست سازگاری و زیست تخریبپذیری مناسبی دارند. عامل مؤثر دیگری که در میزان بندآورندگی مهم است، نوع ساختار فیزیکی از قبیل هیدروژل، پودر، اسفنج و گاز است. در ادامه بندآورندههای تجاری معرفی و بررسی شدند. در این بررسی بر روی مواد بندآورنده خونی بر پایه پلیمرهای طبیعی و مواد بندآورنده خونی در بازار جهانی که در مقالات علمی سالهای اخیر گزارش شدهاند، تمرکز شده است.
مواد و روشها
در این پژوهش به صورت مروری، نقش بندآورندگی در ترمیم زخم، بندآورندههای مختلف بر پایه پلیمرهای طبیعی و بازار جهانی این مواد در 55 کار پژوهشی بررسی شد. در این راستا از 11 مقاله معتبر با هدف بررسی انعقاد پلیمرهای طبیعی استفاده شد. از انتشارات معتبر بینالملی و فارسی مانند Elsevier ، Springer ، Wiley Online Library، ScienceDirect و SID استفاده شد. برای جستجو از کلمات کلیدی و کاربردی مانند بندآورندههای خون، sodium alginate ، chitosan ، hemostatic ، oxidized cellulose ، collagen و starch استفاده شد.
یافتهها
اولین مرحله از مراحل برای ترمیم زخم، بندآورندگی است. مراحل بعدی که به بازسازی بافت کمک میکنند شامل التهاب، تکثیر و بازسازی است. مواد بندآورنده در عملهای جراحی و اورژانسی بسیار حیاتیاند. این مواد در بازار جهانی و کارهای تحقیقاتی به دو دسته ساختنی و طبیعی تقسیم میشوند، این در حالی است که مواد با منشاء طبیعی به خاطر ذاتی که دارند، عملکرد بهینه و حداقل سمیت را از خود نشان دادهاند. پلیمرهای طبیعی منعقدکننده شامل سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات میشوند. در ادامه به تشریح پلیمرهای طبیعی، معرفی مختصر پلیمرهای سنتزی، ساختار فیزیکی بندآورندهها و نمونههای تجاری پرداخته میشود.
مروری بر مواد بندآورنده خونی بر پایه پلیمرهای طبیعی:
در سالیان قبل از روشهایی متفاوت برای کنترل خونریزی استفاده شده است که مشکلات و عوارض زیادی را به وجود میآوردند. در تمدنهای باستانی از موم، ریشه گونه خاصی از ارکیده و جو برای جلوگیری از خونریزی استفاده میکردند (9، 8). عوامل زیادی از جمله منشاء پلیمر بر بندآورندگی خونریزی مؤثر است که در ادامه بررسی شده است.
منشاء پلیمری مواد بندآورنده خونی
سلولز اکسید شده
سلولز یک هموپلی ساکارید خنثی است که از
فراوانترین مواد زیست تخریبپذیر به شمار میرود (10). سلولز به طور کلی به دو دسته گیاهی و باکتریایی که از نظر شیمیایی یکسان و قابل استفاده برای بندآورندگیاند تقسیم میشود، این در حالی است که سلولز باکتریایی خلوص بالاتری دارد، البته سلولزهای گیاهی را هم با فرآیندهای خالصسازی میتوان به درصد خلوص بالایی رساند (11). با استفاده از سلولز، سلولز احیا شده اکسید شده به دست میآید که ساختار این ماده در شکل آورده شده است و حاوی 3 تا 25 درصد گروه کربوکسیل است که نشاندهنده پلیمری سازگار و قابل جذب میباشد (شکل 1). سلولز احیا شده اکسید شده به دلیل زیست سازگاری، زیست تخریبپذیری، سمیت کم و هزینه پایین به طور گسترده مورد تحقیق قرار گرفته و برای کاربردهای پزشکی زیادی به کار گرفته شده است. یکی دیگر از مزایای مهم سلولز اکسید شده این است که از گیاه گرفته میشود در نتیجه خطر بیماری ویروسی وجود ندارد (12).
یوگنیا کیروش و همکارانش در سال 2021 یک غشاء بر پایه سلولز باکتریایی اکسید شده برای کاربرد بندآورندگی طراحی کردند. تجزیه زیستی این ماده در مقایسه با نمونه اکسید نشده و تجاری در محیط آب خالص انجام شد. نمونه اکسید شده تجزیه بهتری در مدت 63 روز نشان داد، اما هیچ یک از نمونهها به طور کامل تخریب نشدند. با افزودن مایع خونی، سلولز اکسید نشده سرعت انعقاد کمتری نسبت به نمونه تجاری داشته، این در حالی است که اکسیداسیون موجب افزایش سرعت انعقاد در حد نمونه تجاری شده است.

برای بررسی زیست سازگاری و عدم پاسخهای عفونی، سلولز اکسید شده زیر پوست موش صحرایی کاشته شد. این غشا بعد از 3 ، 14 و 56 روز هیچ نشانه التهابی و نکروزی از خود نشان نداده و به راحتی قابل شناسایی و حذف است زیرا در آزمایش تجزیه زیستی در بدن به طور کامل تجزیه نشد (14). سان و همکاران در سال 2018 یک نانوالیاف سلولزی اکسید شده که قابلیت زیست سازگاری، جذب زیستی و آبدوستی دارد را به عنوان یک ماده بندآورنده خونی بررسی کردند. با تبدیل گروههای هیدروکسیل به گروههای کربوکسیل، نانوالیاف سلولزی اکسید شده را میتوان به دست آورد (15). این ماده در محیط آبی قابلیت تبدیل به هیدروژل را داشت، بنابراین به سدی برای تجمع گلبولهای قرمز و فعال شدن پلاکتها تبدیل میشد (16). با وجود تمام خواص کارآمد نانوالیاف سلولزی اکسید شده، خاصیت بندآورندگی نسبتا ضعیف بود. برای ساخت بندآورنده مؤثرتر میبایست با مواد زیست سازگار ترکیب میشد. به عنوان مثال ترومبین، اکسید روی، ژلاتین، نانوذرات نقره و پلیاتیلن گلیکول با نانو الیاف سلولز اکسید شده/فیبروئین ابریشم ترکیب شدند (18، 17). نتایج نشان داد که تمام ترکیبات بندآورندگی، اثر ضد باکتریایی و مکانیکی عالی داشتند. این نتایج حاکی از آن است که ترکیبات مبتنی بر نانوالیاف سلولزی اکسید شده در بندآورندگی پتانسیل بالایی دارند.
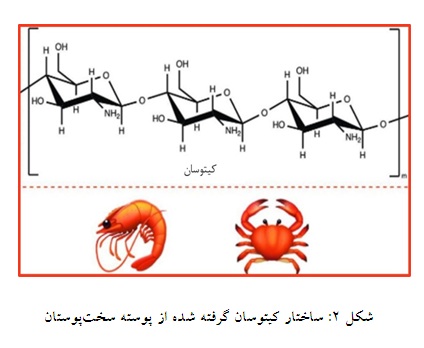
کیتوسان:
کیتوسان یک پلیساکارید خطی و نیمه کریستالی است، که در شکل نشان داده شده است و میتوان با یک واکنش از کیتین که از پوسته خرچنگ، میگو و صدف به دست میآید آن را ساخت (شکل 2). این ماده دارای خواص عالی مانند زیست سازگاری، ضد تومور، آنتیاکسیدانی، ضد باکتریایی، زیست تخریبپذیری و چسبندگی مخاطی است (20، 19، 5). از طرفی مواد بندآورنده خونی بر پایه ژل کیتوسان به علت انعطافپذیری ضعیف، حجم زیاد و زمان تجزیه طولانی برای زخمهای عمیق مناسب نیستند. با وجود فواید زیاد، این ماده در برابر خونریزی شدید محدود و ناپایدار است (21).
بنابراین برای کاربرد بندآورنـدگی خواص این ماده باید با اصلاحات شیمیایی بهبود یابد.
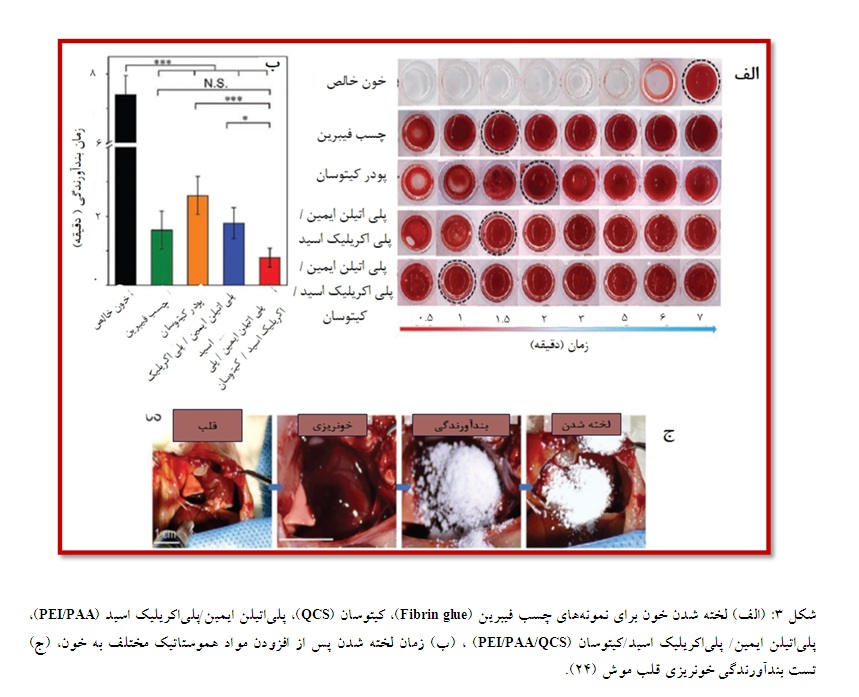
پودرهای بندآورنده رایج نمیتوانند لخته خونی پایدار تشکیل دهند و ممکن است در خون حل شوند و خونریزی را متوقف نکنند. سونگ و همکارانش در سال 2021 یک هیدروژل بندآورنده خونریزی بر پایه کیتوسان و پلیاتیلن گلیکول طراحی کردند. این هیدروژل به عنوان یک پانسمان منعقدکننده خونریزی حالت کششی مطلوبی در حدود 800% از خود نشان داد، همچنین این محصول سازگاری خوبی با سلولها از خود نشان داد. این هیدروژل چسبندگی بالایی به پوست خوک و انسان دارد که میتوان آن را، مزیتی به خاطر عدم نیاز به نیروی نگهدارنده خارجی تلقی کرد. در آزمایشهای هموستاتیک، موشهای صحرایی حدود 90% خون کمتری نسبت به نمونه گروه کنترل از دست دادند و با زمان 50 ثانیه سریعتر از نمونههای تجاری لخته انعقادی را تشکیل دادند (22). در مطالعه دیگری در سال 2021 ، کوو و همکاران پودر خود ژل شونده مانند پلیآکریل آمیدآلژینیک اسید را نشان دادهاند که میتواند در تماس با خون یک حالت ژلی و چسبنده تشکیل دهد، اما نکته حائز اهمیت مدت زمان تکمیل ژل شدن است که اغلب ممکن است چندین ساعت طول بکشد (23). در سال 2021 شین پنگ و همکاران یک پودر فوق سریع خود ژل شونده بر پایه پلیاتیلن ایمین، پلیاکریلیک اسید و کیتوسان گزارش کردهاند که پس از اعمال روی زخم، به سرعت در عرض 4 ثانیه خون را جذب کند و هیدروژل چسبندهای را تشکیل دهد که نه تنها میتواند مثل یک سد پایدار جلوی خونریزی را بگیرد، بلکه فاکتورهای انعقادی را متمرکز کند. توانایی لخته شدن خون در شرایط آزمایشگاهی برای 3 نمونه پودر پلیاتیلن ایمین/ پلیاکریلیک اسید/ کیتوسان، چسب فیبرین، پودر کیتوسان خالص و پودر پلیاتیلن ایمین/پلیاکریلیک اسید مورد ارزیابی قرار گرفت. زمان انعقاد خون بدون مواد بندآورنده خونی در حدود 7 دقیقه بود، مطابق شکل (3 - الف، ب) نتایج نشان دادند که ترکیب پلیاتیلن ایمین/ پلیاکریلیک اسید/کیتوسان سریعترین جذب خون و تجمع سلولهای خونی را دارند که زمان انعقاد را به 8/0 دقیقه رساند. سایر نمونهها به ترتیب زمانهای 6/0 ± 6/1، 5/0 ±
3/2 و 6/0 ± 6/1را نشان دادند. در مرحله بعد داخل بدن موجود زنده پودر پلیاتیلن ایمین، پلیاکریلیک اسید و کیتوسان را استفاده کردند، با سوراخ کردن قلب موش که با خونریزی شدیدی همراه بود، مشاهده شد که با مصرف 100 میلیگرم از این پودر، خونریزی در مدت زمان 10 ثانیه متوقف شد، اما در آزمایشهای حیوانی این پودر هیچ گزارشی مبنی بر این که آن جانور بعد مدت زمان مشخص زنده میماند یا خیر ارائه نشده است (24). به طور کلی ترکیبات بر پایه کیتوسان به طور چشمگیری باعث بهبود زخم در زخمهای پوستی میشوند، پس با توجه به خواص زیستی عالی، بند آورندگی مناسب و هزینه کم این مواد میتوانند زمینهساز پیشرفتهای خوبی در بندآورندگی باشند.
کیتوسان:
کیتوسان یک پلیساکارید خطی و نیمه کریستالی است، که در شکل نشان داده شده است و میتوان با یک واکنش از کیتین که از پوسته خرچنگ، میگو و صدف به دست میآید آن را ساخت (شکل 2). این ماده دارای خواص عالی مانند زیست سازگاری، ضد تومور، آنتیاکسیدانی، ضد باکتریایی، زیست تخریبپذیری و چسبندگی مخاطی است (20، 19، 5). از طرفی مواد بندآورنده خونی بر پایه ژل کیتوسان به علت انعطافپذیری ضعیف، حجم زیاد و زمان تجزیه طولانی برای زخمهای عمیق مناسب نیستند. با وجود فواید زیاد، این ماده در برابر خونریزی شدید محدود و ناپایدار است (21).
بنابراین برای کاربرد بندآورنـدگی خواص این ماده باید با اصلاحات شیمیایی بهبود یابد.

پودرهای بندآورنده رایج نمیتوانند لخته خونی پایدار تشکیل دهند و ممکن است در خون حل شوند و خونریزی را متوقف نکنند. سونگ و همکارانش در سال 2021 یک هیدروژل بندآورنده خونریزی بر پایه کیتوسان و پلیاتیلن گلیکول طراحی کردند. این هیدروژل به عنوان یک پانسمان منعقدکننده خونریزی حالت کششی مطلوبی در حدود 800% از خود نشان داد، همچنین این محصول سازگاری خوبی با سلولها از خود نشان داد. این هیدروژل چسبندگی بالایی به پوست خوک و انسان دارد که میتوان آن را، مزیتی به خاطر عدم نیاز به نیروی نگهدارنده خارجی تلقی کرد. در آزمایشهای هموستاتیک، موشهای صحرایی حدود 90% خون کمتری نسبت به نمونه گروه کنترل از دست دادند و با زمان 50 ثانیه سریعتر از نمونههای تجاری لخته انعقادی را تشکیل دادند (22). در مطالعه دیگری در سال 2021 ، کوو و همکاران پودر خود ژل شونده مانند پلیآکریل آمیدآلژینیک اسید را نشان دادهاند که میتواند در تماس با خون یک حالت ژلی و چسبنده تشکیل دهد، اما نکته حائز اهمیت مدت زمان تکمیل ژل شدن است که اغلب ممکن است چندین ساعت طول بکشد (23). در سال 2021 شین پنگ و همکاران یک پودر فوق سریع خود ژل شونده بر پایه پلیاتیلن ایمین، پلیاکریلیک اسید و کیتوسان گزارش کردهاند که پس از اعمال روی زخم، به سرعت در عرض 4 ثانیه خون را جذب کند و هیدروژل چسبندهای را تشکیل دهد که نه تنها میتواند مثل یک سد پایدار جلوی خونریزی را بگیرد، بلکه فاکتورهای انعقادی را متمرکز کند. توانایی لخته شدن خون در شرایط آزمایشگاهی برای 3 نمونه پودر پلیاتیلن ایمین/ پلیاکریلیک اسید/ کیتوسان، چسب فیبرین، پودر کیتوسان خالص و پودر پلیاتیلن ایمین/پلیاکریلیک اسید مورد ارزیابی قرار گرفت. زمان انعقاد خون بدون مواد بندآورنده خونی در حدود 7 دقیقه بود، مطابق شکل (3 - الف، ب) نتایج نشان دادند که ترکیب پلیاتیلن ایمین/ پلیاکریلیک اسید/کیتوسان سریعترین جذب خون و تجمع سلولهای خونی را دارند که زمان انعقاد را به 8/0 دقیقه رساند. سایر نمونهها به ترتیب زمانهای 6/0 ± 6/1، 5/0 ±
3/2 و 6/0 ± 6/1را نشان دادند. در مرحله بعد داخل بدن موجود زنده پودر پلیاتیلن ایمین، پلیاکریلیک اسید و کیتوسان را استفاده کردند، با سوراخ کردن قلب موش که با خونریزی شدیدی همراه بود، مشاهده شد که با مصرف 100 میلیگرم از این پودر، خونریزی در مدت زمان 10 ثانیه متوقف شد، اما در آزمایشهای حیوانی این پودر هیچ گزارشی مبنی بر این که آن جانور بعد مدت زمان مشخص زنده میماند یا خیر ارائه نشده است (24). به طور کلی ترکیبات بر پایه کیتوسان به طور چشمگیری باعث بهبود زخم در زخمهای پوستی میشوند، پس با توجه به خواص زیستی عالی، بند آورندگی مناسب و هزینه کم این مواد میتوانند زمینهساز پیشرفتهای خوبی در بندآورندگی باشند.


نشاسته:
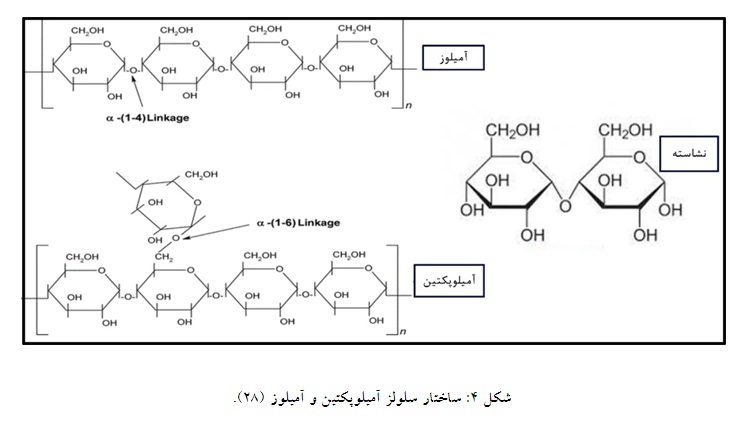
نشاسته از دو پلیمر گلوکز مطابق شکل تشکیل شده است: آمیلوپکتین و آمیلوز (شکل 4). آمیلوپکتین یک مولکول بسیار شاخهدار با واحدهای آلفا- گلوکوزیل (1 تا 4) مرتبط در زنجیرهای است. آمیلوز عمدتاً با واحدهای گلوکوزیل مرتبط است. آمیلوز ممکن است 10 شاخه یا بیشتر داشته باشد (25). نشاسته منبع اولیه انرژی ذخیره شده در گیاهان است که میتوان از گیاهانی مانند ذرت، سیب زمینی شیرین و گندم به دست آورد. نشاسته به عنوان مواد ژلکننده، غلیظ کننده، حافظ رطوبت و تشکیل فیلم استفاده شده است (27، 26).
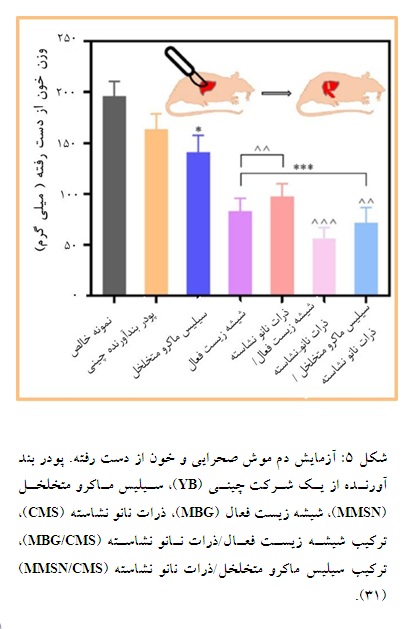
نشاسته به خاطر زیست سازگاری خوب و زیست تخریبپذیری بالا در زمینه بندآورندگی خون استفاده شده است. ویسکوزیته ذرات نشاسته پس از جذب خون افزایش یافته و با تجمع فاکتورهای انعقادی بندآورندگی خوبی را ایجاد کرده است (30، 29). لامیا حسن تیثی و همکارانش در سال 2024 نشان دادند برای استفاده از نشاسته به عنوان بندآورنده خونی میبایست همانند قبل اصلاحاتی صورت بگیرد، برای مثال میتوان از نانومواد معدنی استفاده کرد. کایون ژنگ و همکاران از سیلیس متخلخل و شیشه زیست فعال استفاده کردند. این پژوهش نشان داد ترکیب شیشه زیست فعال، ذرات نانو نشاسته، زیست تخریبپذیری و سازگاری سلولی بالایی داشته است که از طریق آزادسازی کلسیم به انعقاد کمک نموده است. به منظور آزمایش اثر بندآورندگی در داخل بدن، آزمایش دم موش صحرایی انجام گرفت و برای مقایسه بهتر، نمونه برای کنترل یک پودر بندآورنده از یک شرکت چینی به نام (YB) تهیه شده بود. نتایج مطابق شکل نشاندهنده این بود که ترکیب شیشه زیست فعال/ذرات نانو نشاسته بهترین عملکرد بندآورندگی را داشت زیرا کمترین مقدار اتلاف خون را داشت (شکل 5). برای نشان دادن ایمنی بیشتر ذرات، ذرات در محیط سلولی کشت داده شدند تا سازگاری سلولی آزمایش شود. نتایج این آزمایش نشان داد که در همه نمونهها به جز YB ، فعالیت سلولی بالاتر از 90 درصد بود. این در حالی است که نمونه کنترل کاهش فعالیت سلولی را نشان داد که گویای سمیت این ماده بود (31). نتایج این پژوهش نشان دادند که مواد بر پایه نشاسته و شیشه زیست فعال، بندآورندگی خوبی داشته و به خاطر آزادسازی کلسیم انعقاد بهتری صورت گرفته و میتوانستند انعقاد درونی و بیرونی را فعال کنند. یکی از کاربردهای گسترده پانسمانهای نشاستهای، اسفنج نشاسته است که ونجی هوانگ و همکارانش در سال 2022 یک اسفنج خود ژل شونده بر پایه نشاسته و اسید بورونیک ساختند. این اسفنج میتواند آب را به مقدار زیاد جذب کند و همزمان به خاطر تشکیل پیوندهای کوالانسی دچار ژل شدن موضعی شود. قابلیت ژل شوندگی این اجازه را به پانسمانها میدهد تا برای زخمهای نامنظم استفاده شوند. این اسفنج زمان انعقاد را برای ترکیب درصدهای مختلف به طور میانگین 37 درصد نسبت به گروه کنترل کاهش داد. اسفنج نشاستهای به خاطر منافذ منظم و انفعالات پیوندی، چسبندگی گلبول قرمز بالایی نشان داده است. این محصول زیست سازگاری بالای 85 درصد را در روز اول ثبت کرد. در آزمایش حیوانی اسفنج نشاستهای نه تنها آبشار انعقادی را تسهیل کرد، بلکه باعث افزایش چسبندگی و تجمع گلبولهای قرمز و پلاکتها شد، بنابراین تشکیل لخته را تسریع کرد. از طرفی به خاطر خاصیت ژل شوندگی پس از جذب خون شکل خود را حفظ کرده و از پخش شدن خون جلوگیری کرد. این عملکرد انعقادی درحالی است که نمونه تجاری PerClot با خون آغشته شده بود و باعث پخش شدن خون و منجر به افزایش خونریزی شد (32).
کلاژن:
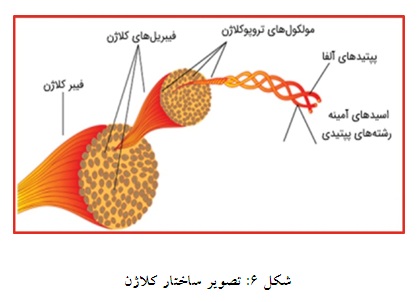
کلاژن یکی از فراوانترین و پیچیدهترین ماکرومولکولهای ماتریکس خارج سلولی مهرهداران است. حدود 30 نوع کلاژن در بدن انسان وجود دارد که مطابق شکل متشکل از مارپیچهای سهگانه، ترکیبات پروتئینی سفت و طناب مانندی هستند (33) (شکل 6). کلاژن به عنوان یک ماده جدید در زمینه پزشکی دارای خواصی مانند ترویج سلولهای خونی، جذب سلولهای خونی و تقویت رشد سلولی است. کلاژن میتواند روند بهبود زخم را تسریع ببخشد (34).
یشتر مواد متشکل از کلاژن ساختاری با تخلخل بالا، خواص رطوبت سنجی عالی و عملکرد انعقادی قابل قبولی دارند (35). با این حال، محصولات کلاژنی مشکلاتی از قبیل خطر همراه داشتن ویروس، زیست سازگاری ضعیف و خلوص پایین را به همراه دارند (36). لی وانگ و همکارانش در سال 2022 یک اسفنج با تخلخل بالا، جذب آب بالا، ایمن که در عین حال خاصیت منعقدکنندگی دارد را بر پایه کلاژن ماهی ساختند. کشت سلولی بر روی این اسفنج، سمیت سلولی سطح 1 که طبق استاندارد نشـاندهنـده عـدم سمیـت اســت را نشان داد. چسبندگی
نشاسته از دو پلیمر گلوکز مطابق شکل تشکیل شده است: آمیلوپکتین و آمیلوز (شکل 4). آمیلوپکتین یک مولکول بسیار شاخهدار با واحدهای آلفا- گلوکوزیل (1 تا 4) مرتبط در زنجیرهای است. آمیلوز عمدتاً با واحدهای گلوکوزیل مرتبط است. آمیلوز ممکن است 10 شاخه یا بیشتر داشته باشد (25). نشاسته منبع اولیه انرژی ذخیره شده در گیاهان است که میتوان از گیاهانی مانند ذرت، سیب زمینی شیرین و گندم به دست آورد. نشاسته به عنوان مواد ژلکننده، غلیظ کننده، حافظ رطوبت و تشکیل فیلم استفاده شده است (27، 26).
نشاسته به خاطر زیست سازگاری خوب و زیست تخریبپذیری بالا در زمینه بندآورندگی خون استفاده شده است. ویسکوزیته ذرات نشاسته پس از جذب خون افزایش یافته و با تجمع فاکتورهای انعقادی بندآورندگی خوبی را ایجاد کرده است (30، 29). لامیا حسن تیثی و همکارانش در سال 2024 نشان دادند برای استفاده از نشاسته به عنوان بندآورنده خونی میبایست همانند قبل اصلاحاتی صورت بگیرد، برای مثال میتوان از نانومواد معدنی استفاده کرد. کایون ژنگ و همکاران از سیلیس متخلخل و شیشه زیست فعال استفاده کردند. این پژوهش نشان داد ترکیب شیشه زیست فعال، ذرات نانو نشاسته، زیست تخریبپذیری و سازگاری سلولی بالایی داشته است که از طریق آزادسازی کلسیم به انعقاد کمک نموده است. به منظور آزمایش اثر بندآورندگی در داخل بدن، آزمایش دم موش صحرایی انجام گرفت و برای مقایسه بهتر، نمونه برای کنترل یک پودر بندآورنده از یک شرکت چینی به نام (YB) تهیه شده بود. نتایج مطابق شکل نشاندهنده این بود که ترکیب شیشه زیست فعال/ذرات نانو نشاسته بهترین عملکرد بندآورندگی را داشت زیرا کمترین مقدار اتلاف خون را داشت (شکل 5). برای نشان دادن ایمنی بیشتر ذرات، ذرات در محیط سلولی کشت داده شدند تا سازگاری سلولی آزمایش شود. نتایج این آزمایش نشان داد که در همه نمونهها به جز YB ، فعالیت سلولی بالاتر از 90 درصد بود. این در حالی است که نمونه کنترل کاهش فعالیت سلولی را نشان داد که گویای سمیت این ماده بود (31). نتایج این پژوهش نشان دادند که مواد بر پایه نشاسته و شیشه زیست فعال، بندآورندگی خوبی داشته و به خاطر آزادسازی کلسیم انعقاد بهتری صورت گرفته و میتوانستند انعقاد درونی و بیرونی را فعال کنند. یکی از کاربردهای گسترده پانسمانهای نشاستهای، اسفنج نشاسته است که ونجی هوانگ و همکارانش در سال 2022 یک اسفنج خود ژل شونده بر پایه نشاسته و اسید بورونیک ساختند. این اسفنج میتواند آب را به مقدار زیاد جذب کند و همزمان به خاطر تشکیل پیوندهای کوالانسی دچار ژل شدن موضعی شود. قابلیت ژل شوندگی این اجازه را به پانسمانها میدهد تا برای زخمهای نامنظم استفاده شوند. این اسفنج زمان انعقاد را برای ترکیب درصدهای مختلف به طور میانگین 37 درصد نسبت به گروه کنترل کاهش داد. اسفنج نشاستهای به خاطر منافذ منظم و انفعالات پیوندی، چسبندگی گلبول قرمز بالایی نشان داده است. این محصول زیست سازگاری بالای 85 درصد را در روز اول ثبت کرد. در آزمایش حیوانی اسفنج نشاستهای نه تنها آبشار انعقادی را تسهیل کرد، بلکه باعث افزایش چسبندگی و تجمع گلبولهای قرمز و پلاکتها شد، بنابراین تشکیل لخته را تسریع کرد. از طرفی به خاطر خاصیت ژل شوندگی پس از جذب خون شکل خود را حفظ کرده و از پخش شدن خون جلوگیری کرد. این عملکرد انعقادی درحالی است که نمونه تجاری PerClot با خون آغشته شده بود و باعث پخش شدن خون و منجر به افزایش خونریزی شد (32).

کلاژن:
کلاژن یکی از فراوانترین و پیچیدهترین ماکرومولکولهای ماتریکس خارج سلولی مهرهداران است. حدود 30 نوع کلاژن در بدن انسان وجود دارد که مطابق شکل متشکل از مارپیچهای سهگانه، ترکیبات پروتئینی سفت و طناب مانندی هستند (33) (شکل 6). کلاژن به عنوان یک ماده جدید در زمینه پزشکی دارای خواصی مانند ترویج سلولهای خونی، جذب سلولهای خونی و تقویت رشد سلولی است. کلاژن میتواند روند بهبود زخم را تسریع ببخشد (34).

یشتر مواد متشکل از کلاژن ساختاری با تخلخل بالا، خواص رطوبت سنجی عالی و عملکرد انعقادی قابل قبولی دارند (35). با این حال، محصولات کلاژنی مشکلاتی از قبیل خطر همراه داشتن ویروس، زیست سازگاری ضعیف و خلوص پایین را به همراه دارند (36). لی وانگ و همکارانش در سال 2022 یک اسفنج با تخلخل بالا، جذب آب بالا، ایمن که در عین حال خاصیت منعقدکنندگی دارد را بر پایه کلاژن ماهی ساختند. کشت سلولی بر روی این اسفنج، سمیت سلولی سطح 1 که طبق استاندارد نشـاندهنـده عـدم سمیـت اســت را نشان داد. چسبندگی
سلولی و رشد سلولها در سطح و منافذ این داربست تایید زیست سازگاری این محصول است. این ماده برای تخمین مقدار زیست تخریبپذیری با کلاژن گاوی که یک محصول تجاری است مقایسه شد. پس از کاشت زیر پوستی هیچگونه التهابی مشاهده نشد. در روزهای متوالی اندازه اسفنج کاشته شده گرفته شد، اندازهها روند کاهشی تا روز 28 ام را نشان دادند و میزان تخریب به بالای 90% رسید. این اسفنج با جذب 20 برابری خون نسبت به وزن خود برتری چشمگیری نسبت به نمونه کلاژن گاوی تجاری نشان داد. برای بررسی توانایی انعقاد، این ماده با کلاژن گاوی و سلولز اکسید شده مقایسه شد. ماده سلولز به سرعت باعث ایجاد لخته شد، این در حالی است که اسفنجهای کلاژنی جذب خون و فعالسازی پلاکتهای بیشتری داشتند (37).
با گسترش فناوری زیستی، نوعی کلاژن توسط بیوتکنولوژی با ترکیب جدیدی به نام (rCOL) ساخته شده است. این ماده یک ترکیب ایدهآل است زیرا معایب کلاژن معمولی را رفع کرده است. یو هی و همکاران در سال 2021 روی یک اسفنج بندآورنده بر پایه کلاژن نوترکیب 1- اتیل- 3- [3- دیمتیل آمین پروپیل] کربودی ایمید هیدروکلراید (EDC) بررسی نمودند. مشاهدات مورفولوژیکی نشان داد که اسفنج کلاژن نوترکیب مقدار بیشتری از خون را به خاطر منافذ مواد نسبت به کلاژن معمولی جذب کرده و غلظت انعقاد را افزایش میدهد (38).
سدیم آلژینات:
جهان اقیانوسهای وسیع فراوانی دارد. با توسعه و اکتشاف اقیانوس، تحقیقات و استفاده از منابع اقیانوس در سالهای اخیر بیشتر و بیشتر مورد توجه قرار گرفته است (39). پلیساکاریدهای دریایی مانند آلژینات که یک پلیساکارید آنیونی است، از جلبک به دست میآید و به صورت نمکهای سدیم، کلسیم و منیزیم وجود دارد (40) (شکل 7). آلژینات به دلیل مزایای منحصر به فرد آن در هموستاز به محبوبیت تبدیل شده است. آلژینات دارای ایمنی، زیست سازگاری، عدم ایمنی زایی، جذب آب بالا و
خاصیت تشکیل آسان هیدروژل است (41).

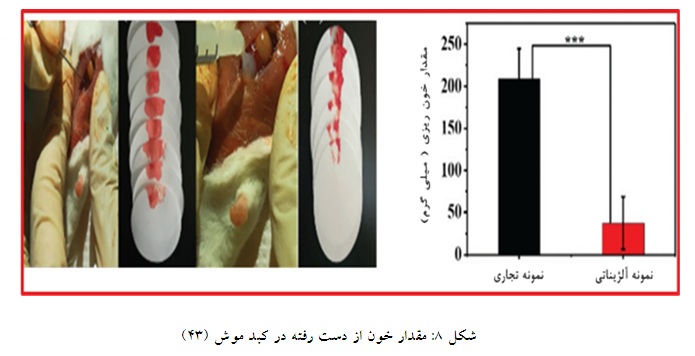
ترکیبات آلژیناتی به عنوان مکمل منعقدکننده با سلولز استفاده میشوند، به طوری که شیائو کان اویانگ و همکارانش در سال 2022 یک میکروسفر متخلخل بر پایه آلژینات و نانو سلولز با هدف یک محصول منعقدکننده سریع خونریزی تولید کردند. اجزای این محصول از خود همولیز بسیار کمتری از سطح استاندارد نشان دادند، به همین علت خون سازگاری بالایی از خود نشان داده است. این ترکیب به خاطر دارا بودن از گروههای آمونیومی، خاصیت ضد باکتریایی قویتری نسبت به سلولز و آلژینات خالص نشان داد. برای ارزیابی عملکرد انعقادی این ترکیب را بر 12 دم و 12 نمونه کبد موش استفاده کردند. نتایج زمانی و وزنی مربوط به دم موش نشان دادند که در صورت استفاده از ترکیب آلژینات و نانوسلولز، زمان انعقاد به 40 درصد (حدود 80 ثانیه) و مقدار خون از دست رفته به 46 درصد (حدود 43 گرم) کاهش یافته است، همچنین در مدل خونریزی کبد روند کاهشی مقدار خون از دست رفته در حدود 23 درصد (3/13 گرم) و زمان انعقاد 49 درصد (36 ثانیه) ثبت کرد (42). ژانگ و همکارانش در سال 2019 یک هیدروژل بندآورنده خونی مبتنی بر سدیم آلژینات تهیه کردند. برای ارزیابی عملکرد بندآورندگی از روش سوراخ کردن کبد موش استفاده شد. استفاده از هیدروژل آلژیناتی در طول دوره منجر به خونریزی خیلی

کمتری نسبت به نمونه تجاری شد به طوری که در نمونه تجاری 208 میلیگرم خون از دست رفته ولی در نمونه آلژیناتی به 40 میلیگرم کاهش یافته است (شکل 8). نتایج نشان داد که محلول آلژیناتی بندآورندگی بالایی دارد و زمان لخته شدن را به 834 ثانیه کاهش داده است. این کاهش 80 درصدی بندآورندگی و سرعت مناسب، عملکرد بندآورندگی این کامپوزیت را در داخل بدن تایید کرد. بررسی بافتشناسی نشان داد که این هیدروژلها ساختار پوستی عالی دارند، در همین حال هیچ نفوذ غیرطبیعی در بافت مشاهده نشد که این امر نشاندهنده بودن زیست سازگاری عالی این هیدروژل است (43).
پلیمرهای سنتزی با کاربرد بندآورندگی خون:
علاوه بر پلیمرهای طبیعی فوق، پلیمرهای سنتزی و مصنوعی مانند پلیاستر، پلیاتیلن گلیکول، پلیسیانواکریلات، پلییورتان، پلیاستات، پلیاتیلن اکسید، پلیآکریل آمید و پلیاتیلن ترفتالات هم توانایی بندآورندگی مناسب دارند (45، 44). این پلیمرها به تنهایی کاربرد بندآورندگی دارند ولی هرکدام دارای نقاط ضعفی هستند که میتوانند در ترکیب با پلیمرهای طبیعی نتایج بهتری نشان دهند. مواد هموستاتیک طبیعی به تنهایی استحکام مناسب در برابر جریان خون را ندارند مگر این که با یکدیگر ترتیب شوند یا میتوان با ایجاد یک ماده مستحکم و چسبنده با کمترین خطر نیاز دنیای بندآورندهها را رفع کرد. مواد هموستاتیک مبتنی بر پلیمر مصنوعی موفقیت قابل توجهی در نشان دادن انسداد عالی، استحکام مکانیکی و خواص چسبندگی بافت پیدا کردهاند (46).
طبقهبندی مواد بندآورنده خونی بر اساس ساختار فیزیکی:
به طور کلی مواد بندآورنده خونی بر اساس ساختار به چهار دسته ژل، پودری، اسفنج و گاز تقسیم میشوند (48، 47). هیدروژلها به خاطر پتانسیل جذب خون و تجمع سلولی که دارند پتانسیل بالایی برای بندآورندگی دارند (50، 49)، اگرچه هیدروژل ها چسبندگی زیستی بالایی دارند ولی جریان خون این چسبندگی را کم و استفاده هیدروژلها را محدود میکند. پودرهای بندآورنده را میتوان برای زخمهایی با شکلهای مختلف استفاده کرد، اما این پودرها نمیتوانند لخته پایدار ایجاد کنند و اغلب در برابر جریان خون شسته میشوند (52، 51). از بین این ساختارها، گاز و اسفنجها به خاطر ظرفیت جذب بالایی که دارند بندآورندگی را افزایش میدهند، ولی این مواد به خاطر عدم چسبندگی زیستی میبایست با نیروی خارجی نگه داشته شوند. بنابراین این مواد قابلیت استفاده برای زخمهایی با اشکال ناهموار، نامنظم و غیر قابل تراکم را ندارند. محصول بندآورنده ایدهآل ترکیبی است که ظرفیت جذب بالا و پوشش کامل سطح را داشته باشد، همچنین بتواند به سطح آسیب بچسبد.
محصولات تجاری بندآورنده خونی موجود در بازار جهانی:
مواد بندآورنده زیادی در بازار جهانی با کاربردها و شیوههای مصرف متفاوتی در بازار جهانی وجود دارند (53) (جدول 1). برای مثال یک شرکت بینالملی با نام تجاری کوئیکلات، یک پودر بندآورنده بر مبنای زئولیت تولید کرده است که کاربرد آسانی دارد، ولی به خاطر گرمازا بودن باعث از بین بردن بافت میشود (55، 54). شرکت معروف آمریکایی در زمینه بندآورندهها، پودرهایی بر پایه مواد مختلف تولید میکند، با این حال این مواد پس از استفاده میبایست از بدن خارج شوند. فروش مواد منعقدکننده خون در بازار جهانی در سال 2023 به 2/31 میلیارد دلار تخمین زده شد. با توجه به گزارشهای اقتصادی انتظار میرود که صنعت منعقدکنندههای خون از 9/33 میلیارد دلار در سال 2024 به 6/61 میلیارد دلار تا سال 2032 رشد کند. علیرغم مواجهه با چالشهای نظارتی، ایالات متحده همچنان با نوآوری مستمر و تقاضای قوی در خط مقدم بازار ضد انعقادها باقی مانده است.
بحث
در این تحقیق مواد بندآورنده خونریزی بر پایه پلیمرهای طبیعی مانند سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات مورد بررسی قرار گرفتند. این مواد در شرایط آزمایشگاهی از نظر زیست سازگاری، زیست تخریبپذیری، چسبندگی زیستی، سمی نبودن، انعقاد سریع، عدم واکنش آلرژیک و حفظ ساختار در برابر جریان خون مورد سنجش قرار میگیرند. از بین مواد فوق سلولز اکسید شده سرعت و عملکرد انعقادی بهتری داشته و در صورت بازسازی شدن ساختار سلولز، این ماده میتواند درون بدن تجریه شود و دیگر نیازمند خارج کردن نباشد. ماده کیتوسان به عنوان یک منعقد کننده شکلپذیر در تحقیقات شناخته میشود زیرا میتوان آن را به صورت اسفنج، فیلم، پودر و هیدروژل استفاده کرد، این درحالی است که برای این ماده واکنشهای آلرژیک و حذف توسط خون با سرعت بالا در شریان فمورال مشاهده شده است. خارج کردن مواد بندآورنده یک محدودیت برای استفاده است، ولی نشاسته در مقایسه با سلولز بازسازی نشده و کیتوسان تجزیه زیستی بالایی دارد. اما محدوده کاربردی نشاسته به خاطر حساسیت به رطوبتش و خطر واکنشهای عفونی کاهش مییابد. در بین مواد پلیمری، 2 ماده کلاژن و آلژینات قابلیت ژل شدن بالایی دارند و برخلاف پودر کیتوسان و سلولز به راحتی توسط خون با سرعت بالا در شریان فمورال حذف نمیشوند. اگرچه کلاژن حیوانی میتواند خطر انتقال بیماری را داشته باشد ولی آلژینات در پژوهشهای انجام شده هیچ گزارشی مبنی بر انتقال بیماری، واکنش آلرژیک و خطر عفونت نداشته است، اما ترکیبات آلژیناتی به کمبود یون کلسیم درون بدن حساساند و عملکردشان را کاهش میدهند. در کنار پلیمرهای طبیعی میتوان از پلیمرهای سنتزی به عنوان بندآورنده استفاده کرد، زیرا خواص این مواد قابل کنترل است و در شرایط فیزیولوژیکی بدن خوب عمل میکنند. پلیمرهای سنتزی لخته پایدارتری نسبت به پلیمرهای طبیعی ایجاد می کنند. این در حالی است که برای پلیمرهای سنتزی امکان سمیت بالا و تاثیر منفی بر فرآیند ترمیم زخم وجود دارد، همچنین اکثر این مواد قابلیت تجزیه زیستی و جذب بدن را ندارند. چالش اصلی تحقیقات، ساخت نسل جدید بندآورندههای خونی است که در کنار خواص زیستی مناسب بتواند انعقاد سریع و پوشش کاملی در برابر جریان خون باشد، حتی برای استفاده بیماران خاص که مشکل انعقاد خونی دارند مانند بیماران هموفیلی، مناسب باشد. در این پژوهش سعی شده است نقاط قوت و ضعف مواد پلیمری به منظور شناخت بهتر در راستای تولید محصول ایدهآل بررسی شوند.
نتیجهگیری
مواد بندآورنده خونی میتوانند نقش مهمی در کاهش چشمگیر مرگ و میر داشته باشند، زیرا این مواد در بسیاری از عملهای جراحی، تصادفات و میدانهای جنگ کاربرد مهمی دارند. مواد بندآورنده مورد نیاز عموم برای کاربرد قبل بیمارستان است. مواد پلیمری با بهرهمندی از ویژگیهای فیزیکی، هموستاتیک، باکتریکشی و زیست تخریبپذیر، سابقه طولانی استفاده ایمن و مؤثر برای هموستاتیک معمولی و کنترل خونریزی مویرگی، وریدی و شریان کوچک دارد. این مواد به اشکال مختلف مانند پارچه بافته شده، فیلم، پودر، اسفنج و هیدروژل در دسترس هستند. مواد بندآورنده با ایجاد یک ماتریکس قوی برای چسبندگی و تجمع پلاکتها، موجب انعقاد میشوند. به طور کلی، هر یک از پلیمرها به تنهایی نمیتوانند تمام الزامات را در استفاده بالینی برآورده کنند. بنابراین، رویکردهای جدیدی برای اصلاح مواد بندآورنده مانند معرفی گروههای عاملی یا پوششها بر روی سطح آنها و ترکیب با مواد دیگر که میتوانند انعقاد را بهبود ببخشند، در حال توسعه هستند. این استراتژی ها مواد منعقد کننده مبتنی بر پلیمرهای طبیعی جدید با پتانسیل انعقاد بهبود یافته را توسعه دادند. با این حال، تعداد بالایی از کاربردهای بالینی این مواد هنوز به دست نیامده است. در حال حاضر، هنوز چالشهای زیادی برای کاربردهای بالینی مواد منعقدکننده پلیمری وجود دارد، مانند نداشتن آزمایشهای متعدد بالینی که برای نشان دادن کارآیی و ایمنی آنها مورد نیاز است و همچنین خلوص پایین محصول که باید برای کاربردهای زیست پزشکی کاملاً تضمین شود.
علاوه بر این، استفاده از انواع جدیدی از مواد منعقدکننده ممکن است قبل از استفاده در داخل بدن به شرایط نگهداری یا آمادهسازی خاصی نیاز داشته باشد. نهایتاً این مواد در حالت ایدهآل نباید نیازی به خروج از بدن داشته باشند و به طور کامل تجزیه شده و عفونتی رخ ندهد. این مشکلات به عنوان کلید تحقیقات آینده برای اصلاح و ارتقاء بالینی انواع جدیدی از بندآورندههای پلیمری تبدیل خواهند شد.
نقش نویسندگان
امیر اصلاحی کلورزی: طراحی و ایده تحقیق، نگارش و ویرایش متن
دکتر محسن شهروسوند: طراحی و ایده تحقیق، نگارش، ویرایش متن و راستیآزمایی اطلاعات
دکتر سید محمد دواچی: مطالعه و ویرایش متن
دکتر جمشید محمدی روشنده: مطالعه و ویرایش متن
دکتر محمدرضا مبین: مطالعه و ویرایش متن
پلیمرهای سنتزی با کاربرد بندآورندگی خون:
علاوه بر پلیمرهای طبیعی فوق، پلیمرهای سنتزی و مصنوعی مانند پلیاستر، پلیاتیلن گلیکول، پلیسیانواکریلات، پلییورتان، پلیاستات، پلیاتیلن اکسید، پلیآکریل آمید و پلیاتیلن ترفتالات هم توانایی بندآورندگی مناسب دارند (45، 44). این پلیمرها به تنهایی کاربرد بندآورندگی دارند ولی هرکدام دارای نقاط ضعفی هستند که میتوانند در ترکیب با پلیمرهای طبیعی نتایج بهتری نشان دهند. مواد هموستاتیک طبیعی به تنهایی استحکام مناسب در برابر جریان خون را ندارند مگر این که با یکدیگر ترتیب شوند یا میتوان با ایجاد یک ماده مستحکم و چسبنده با کمترین خطر نیاز دنیای بندآورندهها را رفع کرد. مواد هموستاتیک مبتنی بر پلیمر مصنوعی موفقیت قابل توجهی در نشان دادن انسداد عالی، استحکام مکانیکی و خواص چسبندگی بافت پیدا کردهاند (46).
طبقهبندی مواد بندآورنده خونی بر اساس ساختار فیزیکی:
به طور کلی مواد بندآورنده خونی بر اساس ساختار به چهار دسته ژل، پودری، اسفنج و گاز تقسیم میشوند (48، 47). هیدروژلها به خاطر پتانسیل جذب خون و تجمع سلولی که دارند پتانسیل بالایی برای بندآورندگی دارند (50، 49)، اگرچه هیدروژل ها چسبندگی زیستی بالایی دارند ولی جریان خون این چسبندگی را کم و استفاده هیدروژلها را محدود میکند. پودرهای بندآورنده را میتوان برای زخمهایی با شکلهای مختلف استفاده کرد، اما این پودرها نمیتوانند لخته پایدار ایجاد کنند و اغلب در برابر جریان خون شسته میشوند (52، 51). از بین این ساختارها، گاز و اسفنجها به خاطر ظرفیت جذب بالایی که دارند بندآورندگی را افزایش میدهند، ولی این مواد به خاطر عدم چسبندگی زیستی میبایست با نیروی خارجی نگه داشته شوند. بنابراین این مواد قابلیت استفاده برای زخمهایی با اشکال ناهموار، نامنظم و غیر قابل تراکم را ندارند. محصول بندآورنده ایدهآل ترکیبی است که ظرفیت جذب بالا و پوشش کامل سطح را داشته باشد، همچنین بتواند به سطح آسیب بچسبد.
محصولات تجاری بندآورنده خونی موجود در بازار جهانی:
مواد بندآورنده زیادی در بازار جهانی با کاربردها و شیوههای مصرف متفاوتی در بازار جهانی وجود دارند (53) (جدول 1). برای مثال یک شرکت بینالملی با نام تجاری کوئیکلات، یک پودر بندآورنده بر مبنای زئولیت تولید کرده است که کاربرد آسانی دارد، ولی به خاطر گرمازا بودن باعث از بین بردن بافت میشود (55، 54). شرکت معروف آمریکایی در زمینه بندآورندهها، پودرهایی بر پایه مواد مختلف تولید میکند، با این حال این مواد پس از استفاده میبایست از بدن خارج شوند. فروش مواد منعقدکننده خون در بازار جهانی در سال 2023 به 2/31 میلیارد دلار تخمین زده شد. با توجه به گزارشهای اقتصادی انتظار میرود که صنعت منعقدکنندههای خون از 9/33 میلیارد دلار در سال 2024 به 6/61 میلیارد دلار تا سال 2032 رشد کند. علیرغم مواجهه با چالشهای نظارتی، ایالات متحده همچنان با نوآوری مستمر و تقاضای قوی در خط مقدم بازار ضد انعقادها باقی مانده است.

بحث
در این تحقیق مواد بندآورنده خونریزی بر پایه پلیمرهای طبیعی مانند سلولز اکسید شده، کیتوسان، کلاژن، نشاسته و آلژینات مورد بررسی قرار گرفتند. این مواد در شرایط آزمایشگاهی از نظر زیست سازگاری، زیست تخریبپذیری، چسبندگی زیستی، سمی نبودن، انعقاد سریع، عدم واکنش آلرژیک و حفظ ساختار در برابر جریان خون مورد سنجش قرار میگیرند. از بین مواد فوق سلولز اکسید شده سرعت و عملکرد انعقادی بهتری داشته و در صورت بازسازی شدن ساختار سلولز، این ماده میتواند درون بدن تجریه شود و دیگر نیازمند خارج کردن نباشد. ماده کیتوسان به عنوان یک منعقد کننده شکلپذیر در تحقیقات شناخته میشود زیرا میتوان آن را به صورت اسفنج، فیلم، پودر و هیدروژل استفاده کرد، این درحالی است که برای این ماده واکنشهای آلرژیک و حذف توسط خون با سرعت بالا در شریان فمورال مشاهده شده است. خارج کردن مواد بندآورنده یک محدودیت برای استفاده است، ولی نشاسته در مقایسه با سلولز بازسازی نشده و کیتوسان تجزیه زیستی بالایی دارد. اما محدوده کاربردی نشاسته به خاطر حساسیت به رطوبتش و خطر واکنشهای عفونی کاهش مییابد. در بین مواد پلیمری، 2 ماده کلاژن و آلژینات قابلیت ژل شدن بالایی دارند و برخلاف پودر کیتوسان و سلولز به راحتی توسط خون با سرعت بالا در شریان فمورال حذف نمیشوند. اگرچه کلاژن حیوانی میتواند خطر انتقال بیماری را داشته باشد ولی آلژینات در پژوهشهای انجام شده هیچ گزارشی مبنی بر انتقال بیماری، واکنش آلرژیک و خطر عفونت نداشته است، اما ترکیبات آلژیناتی به کمبود یون کلسیم درون بدن حساساند و عملکردشان را کاهش میدهند. در کنار پلیمرهای طبیعی میتوان از پلیمرهای سنتزی به عنوان بندآورنده استفاده کرد، زیرا خواص این مواد قابل کنترل است و در شرایط فیزیولوژیکی بدن خوب عمل میکنند. پلیمرهای سنتزی لخته پایدارتری نسبت به پلیمرهای طبیعی ایجاد می کنند. این در حالی است که برای پلیمرهای سنتزی امکان سمیت بالا و تاثیر منفی بر فرآیند ترمیم زخم وجود دارد، همچنین اکثر این مواد قابلیت تجزیه زیستی و جذب بدن را ندارند. چالش اصلی تحقیقات، ساخت نسل جدید بندآورندههای خونی است که در کنار خواص زیستی مناسب بتواند انعقاد سریع و پوشش کاملی در برابر جریان خون باشد، حتی برای استفاده بیماران خاص که مشکل انعقاد خونی دارند مانند بیماران هموفیلی، مناسب باشد. در این پژوهش سعی شده است نقاط قوت و ضعف مواد پلیمری به منظور شناخت بهتر در راستای تولید محصول ایدهآل بررسی شوند.
نتیجهگیری
مواد بندآورنده خونی میتوانند نقش مهمی در کاهش چشمگیر مرگ و میر داشته باشند، زیرا این مواد در بسیاری از عملهای جراحی، تصادفات و میدانهای جنگ کاربرد مهمی دارند. مواد بندآورنده مورد نیاز عموم برای کاربرد قبل بیمارستان است. مواد پلیمری با بهرهمندی از ویژگیهای فیزیکی، هموستاتیک، باکتریکشی و زیست تخریبپذیر، سابقه طولانی استفاده ایمن و مؤثر برای هموستاتیک معمولی و کنترل خونریزی مویرگی، وریدی و شریان کوچک دارد. این مواد به اشکال مختلف مانند پارچه بافته شده، فیلم، پودر، اسفنج و هیدروژل در دسترس هستند. مواد بندآورنده با ایجاد یک ماتریکس قوی برای چسبندگی و تجمع پلاکتها، موجب انعقاد میشوند. به طور کلی، هر یک از پلیمرها به تنهایی نمیتوانند تمام الزامات را در استفاده بالینی برآورده کنند. بنابراین، رویکردهای جدیدی برای اصلاح مواد بندآورنده مانند معرفی گروههای عاملی یا پوششها بر روی سطح آنها و ترکیب با مواد دیگر که میتوانند انعقاد را بهبود ببخشند، در حال توسعه هستند. این استراتژی ها مواد منعقد کننده مبتنی بر پلیمرهای طبیعی جدید با پتانسیل انعقاد بهبود یافته را توسعه دادند. با این حال، تعداد بالایی از کاربردهای بالینی این مواد هنوز به دست نیامده است. در حال حاضر، هنوز چالشهای زیادی برای کاربردهای بالینی مواد منعقدکننده پلیمری وجود دارد، مانند نداشتن آزمایشهای متعدد بالینی که برای نشان دادن کارآیی و ایمنی آنها مورد نیاز است و همچنین خلوص پایین محصول که باید برای کاربردهای زیست پزشکی کاملاً تضمین شود.
علاوه بر این، استفاده از انواع جدیدی از مواد منعقدکننده ممکن است قبل از استفاده در داخل بدن به شرایط نگهداری یا آمادهسازی خاصی نیاز داشته باشد. نهایتاً این مواد در حالت ایدهآل نباید نیازی به خروج از بدن داشته باشند و به طور کامل تجزیه شده و عفونتی رخ ندهد. این مشکلات به عنوان کلید تحقیقات آینده برای اصلاح و ارتقاء بالینی انواع جدیدی از بندآورندههای پلیمری تبدیل خواهند شد.
نقش نویسندگان
امیر اصلاحی کلورزی: طراحی و ایده تحقیق، نگارش و ویرایش متن
دکتر محسن شهروسوند: طراحی و ایده تحقیق، نگارش، ویرایش متن و راستیآزمایی اطلاعات
دکتر سید محمد دواچی: مطالعه و ویرایش متن
دکتر جمشید محمدی روشنده: مطالعه و ویرایش متن
دکتر محمدرضا مبین: مطالعه و ویرایش متن
نوع مطالعه: مروري |
موضوع مقاله:
مهندسی پزشکی
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






