جلد 21، شماره 2 - ( تابستان 1403 )
جلد 21 شماره 2 صفحات 184-169 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sadeghi Neysiyani S, Amini Kafi-Abad S. The effect of different types of plateletpheresis devices on the quality parameters of the produced platelet units. bloodj 2024; 21 (2) :169-184
URL: http://bloodjournal.ir/article-1-1525-fa.html
URL: http://bloodjournal.ir/article-1-1525-fa.html
صادقی نیسیانی سمانه، امینی کافی آباد صدیقه. تاثیر انواع مختلف دستگاههای پلاکت فرزیس بر پارامترهای کیفی واحدهای پلاکت تولیدی. فصلنامه پژوهشی خون. 1403; 21 (2) :169-184
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 665 kb]
(441 دریافت)
| چکیده (HTML) (1931 مشاهده)
مقدمه
پلاکتها سلولهای 2 تا 4 میکرونی، فاقد هسته و بسیار پیچیدهای هستند که در مغز استخوان و طی قطعه قطعه شدن سیتوپلاسم مگاکاریوسیتها تولید شده و به تعداد 450000-150000 در هر میکرولیتر از خون یافت میشوند(3-1). این سلولها در بسیاری از فرآیندهای پاتوفیزیولوژیک از جمله هموستاز، ترومبوز، جمع شدن لخته و ترمیم عروق نقش دارند(4). ساختار آنها را میتوان به چهار ناحیه محیطی، سل- ژل، اندامک و سیستم غشایی طبقهبندی کرد. ناحیه اندامک حاوی گرانولهای α، گرانولهای متراکم و لیزوزوم است(1). محتویات این گرانولها از جمله P-selectin ، CD63 و همچنین CD40L موجود در سیتوپلاسم در هنگام فعال شدن پلاکتها آزاد شده و از این رو جهت ارزیابی آسیبهای دوران ذخیرهسازی استفاده میگردند(5).
فرآوردههای پلاکتی به روشهای مختلفی از جمله آفرزیس و یا از خون کامل به روش پلاسمای غنی از پلاکت(Platelet Rich Plasma; PRP) و یا بافیکوت(Buffy coat; BC) تهیه میشوند(6). فرآورده پلاکتی باید به مدت 1 تا 2ساعت بلافاصله پس از تولید در دمای ˚C2± 22 بدون حرکت استراحت داده شود، در غیر این صورت ممکن است پلاکتها به صورت برگشتناپذیر فعال شده و تجمع کنند. پس از زمان استراحت، فرآوردههای پلاکتی در دمای ˚C2± 22 در شیکر انکوباتور نگهداری میشوند (7).
آفرزیس (واژه یونانی باستان aphaeresis به معنی برداشتن) روشی است که شامل برداشتن یک جزء از خون و بازگرداندن سایر اجزای خون به اهداکننده با استفاده از دستگاههای آفرزیس است. در روش پلاکت فرزیس، پلاکتها جمعآوری شده و سایر اجزا به اهداکننده باز میگردند(8، 7). پلاکت فرزیس دریافت پلاکتهای کافی از یک اهداکننده را بدون به خطر انداختن توده گلبولهای قرمز آنها تسهیل و توانایی اهداکننده را برای اهدای مکرر تضمین میکند بنابراین اهداکنندگان پلاکت فرزیس میتوانند در مقایسه با اهداکنندگان خون کامل به دفعات بیشتری پلاکت اهدا کنند(9). مطالعه یانکی و همکاران نیاز
به پلاکت فرزیس جهت انتخاب اهداکنندگان همسان از لحاظ HLA در درمان بیماران مبتلا به مقاومت پلاکتی را نشان داد (10). این مطالعه حرکت به سمت پلاکت فرزیس را تسریع کرد. دستگاههای آفرزیس با استفاده از فیلتراسیون، سانتریفیوژ و یا ترکیبی از این دو، قادر به جداسازی اجزای خون هستند. در روش فیلتراسیون اجزای سلولی خون بر اساس اندازه جدا میشوند، در حالی که در روش سانتریفیوژ جداسازی اجزای سلولی بر اساس وزن مخصوص آنها انجام میگیرد. دو تکنیک مختلف در روش سانتریفیوژ وجود دارد؛ سانتریفیوژ جریان متناوب (Intermittent Flow Centrifugation; IFC) و سانتریفیوژ جریان پیوسته(Continuous Flow Centrifugation; CFC) . در روش IFC خون به صورت چرخهای پردازش میشود. هر چرخه شامل خونگیری، جداسازی اجزای خون، برداشت جزء مورد نظر و انتقال سایر اجزا به اهداکننده است. در روش IFC پس از اتمام یک چرخه، چرخه دیگر آغاز میشود. از این رو این روش به یک محل رگگیری نیاز دارد و به شکل تک سوزنی انجام میشود.Trima Accel و Haemonetics MCS از جمله دستگاههایی هستند که به این روش کار میکنند. در روش سانتریفیوژ CFC خون به طور همزمان گرفته، پردازش و بازگشت داده میشود و به دو محل رگگیری نیاز است و به شکل دو سوزنی انجام میگیرد. دستگاههای Fenwal Amicus ، Cobe Spectra و Fresenius از این روش استفاده میکنند (8).
دستگاههای مختلف آفرزیس میتوانند بر کیفیت فرآورده پلاکتی تأثیر بگذارند. پلاکتها باید زنده، عملکردی و فاقد هر گونه آلودگی باشند. از جمله فاکتورهای مؤثر بر کیفیت فرآورده پلاکتی میتوان به تعداد و بازده پلاکت (Platelet yield یا بازده پلاکت به تعداد پلاکتی که در طول مدت زمان پلاکتفرزیس از یک اهداکننده جمعآوری میشود، گفته میشود)، تعداد گلبول سفید و قرمز، فعالیت پلاکت و میزان میکروپارتیکل اشاره کرد. به علاوه میزان pH و شاخصهای بیوشیمیایی مانند میزان گلوکز، لاکتات، بیکربنات، pCO2 و pO2 و همچنین توانایی تجمع پلاکتها نیز در کیفیت فرآورده پلاکتی مؤثر است. پلاکت فرزیس میتواند بر تمامی عوامل ذکر شده تاثیرگذار باشد. البته باید در نظر داشت علاوه بر دستگاه آفرزیس عوامل دیگری همچون سلامت اهداکننده، شرایط نگهداری و حمل و نقل نیز میتوانند بر کیفیت فرآورده پلاکتی تأثیرگذار باشند(12، 11).
هدف از این مطالعه مروری، ارزیابی تأثیر دستگاههای مختلف آفرزیس بر جنبههای مختلف کیفیت فرآورده پلاکتی از جمله شمارش سلولی، فعالیت متابولیکی، تجمع پلاکتی، فعال شدن پلاکتها و تعداد میکروپارتیکل در فرآورده به دست آمده بود. با در نظر گرفتن موارد مورد مطالعه میتوان جهت تهیه دستگاهی با امکان تولید فرآورده باکیفیت در مراکز انتقال خون اقدام نمود.
مواد و روشها
این مقاله به مرور تاثیرات دستگاههای مختلف آفرزیس بر کیفیت فرآوردههای پلاکتی حاصله از لحاظ بازده پلاکت (Platelet yield)، تعداد گلبولهای سفید و گلبولهای قرمز، تجمع پلاکتی(Platelet Aggregation)، فعالیت متابولیک (Metabolic activity)، فعال شدن پلاکتها (Platelet activation) و تعداد میکروپارتیکلهای پلاکتی (Platelet Microparticles) به جستجوی واژگان کلیدی در پایگاههای PubMed ، Google Scholar ، Science Direct و Scopus پرداخته و از بین 130 مقاله، 83 مقاله مرتبط استفاده شده است. مقالاتی که در آنها تنها به بررسی شاخصهای کیفی یک دستگاه پرداخته شده بود و مقایسهای بین حداقل دو دستگاه صورت نگرفته بود در این مطالعه مورد استفاده قرار نگرفت. همچنین مقالاتی که متن کامل آنها به زبان دیگری به جز فارسی یا انگلیسی نوشته شده بود نیز استفاده نگردید.
یافتهها
1- دستگاههای پلاکت فرزیس
اولین دستگاه آفرزیس توسط هرب کولیس در سال 1972 اختراع شد. در حال حاضر انواع مختلفی از دستگاههای پلاکتفرزیس در بازار موجود است. برخی از
متداولترین آنها عبارتند از:
Trima Accel (Terumo BCT ، Lakewood ، آمریکا) دستگاه آفرزیس است که توسط شرکت Terumo BCT جهت جمعآوری پلاکت، پلاسما، لکوسیت و گلبول قرمز تولید شده است. این دستگاه از سانتریفیوژ IFC استفاده میکند. قابلیت جمعآوری یک یا دو واحد پلاکت را داشته و قادر است فرآورده کم لکوسیت تهیه نماید. آخرین نسخه این دستگاه Trima Accel 7 است که نسبت به نسخه قبلی از لحاظ اساس کار و تکنولوژی تفاوتی نداشته بلکه صرفا در برخی برنامههای نرمافزاری متفاوت است(15-13).
Haemonetics MCS LN9000 (Haemonetics Corp ، Stoughton ، آمریکا):
یک نسخه اصلاح شده از MCS است. این دستگاه دارای یک پمپ پلاسمای اضافی است که سبب جداسازی بهتر اجزای خون و کاهش مدت زمان چرخه بازگشت خون به اهداکننده میشود. نوع سانتریفیوژ آن IFC است. اگر چه فرآیند تولید پلاکت توسط این دستگاه منجر به تولید فرآورده کم لکوسیت میشود، با این حال برای اطمینان از این امر فیلترهای کاهنده لکوسیت به صورت In-line در ستهای این دستگاه تعبیه شده است (16، 13).
Fenwal CS3000 and Fenwa1 CS3000+ (Baxter Healthcare Corp ، Round Lake ، آمریکا):
این دستگاهها نیز جهت تهیه پلاکت مورد استفاده قرار میگیرند و میتوانند فرآورده پلاکت کم لکوسیت تولید کنند.
Fenwa1 Amicus (Fenwal ، Inc. ، Lake Zurich ، آمریکا):
از سانتریفیوژ CFC استفاده میکند. به شکل تک سوزنی و دو سوزنی موجود است و قادر است فرآورده کم لکوسیت تولید نماید(17، 16، 13).
Cobe Spectra (Terumo BCT ، Lakewood ،آمریکا):
دارای سیستـم کاهـش لکوسیـت (LRS : Leukocyte
Reduction System) اســت. از سانتــریفیوژ CFC استفاده
میکند و به شکل تک سوزنی و دو سوزنی موجود است (17، 16).
Fresenius AS104 and Fresenius COM. TEC (Fresenius Bad Homburg ، آلمان):
این دستگاهها نیز از سانتریفیوژ CFC استفاده میکنند. COM.TEC قابلیتهای پلاکت فرزیس بهتری نسبت به AS 104 دارد. Fresenius AS104در حال حاضر برای جمعآوری پلاکت استفاده نمیشود بلکه AS204 جایگزین آن شده است (17، 14، 13).
مطالعههای مختلف بیان میکنند ویژگیهای دستگاههای مختلف آفرزیس از جمله فناوری جداسازی سلولهای خونی، نوع سانتریفیوژ (IFC یا CFC)، تفاوت در جنس کیسهها و ضد انعقاد موجود در ست دستگاههای مختلف میتوانند بر پارامترهای مختلف کیفی از جمله شمارش سلولی، فعالیت متابولیک، تجمع سلولی، فعال شدن پلاکتها و تعداد میکروپارتیکل تاثیرگذار باشند (20-18).
2- شاخصهای کیفی در فرآورده پلاکتی:
شاخصهای مختلفی جهت ارزیابی کیفیت فرآوردههای پلاکتی مورد استفاده قرار میگیرند از جمله شمارش سلولی (پلاکت، گلبول سفید و قرمز)، فعالیت متابولیک، تجمع پلاکتی، فعال شدن پلاکتها و تعداد میکروپارتیکل پلاکتی که در ادامه به توضیح هر کدام میپردازیم.
شمارش سلولی فرآوردههای پلاکت فرزیس (تعداد پلاکت، گلبول سفید و گلبول قرمز):
یکی از پارامترهای مهم جهت ارزیابی کیفیت فرآوردههای حاصل از پلاکتفرزیس، شمارش پلاکت، گلبول سفید و گلبول قرمز میباشد. استاندارهای انجمن بانکهای خون آمریکا (AABB) و کمیته اروپا از لحاظ تعداد پلاکت و گلبول سفید در فرآورده پلاکت فرزیس در جدول ذکر شده است (جدول 1). حداقل 90 درصد واحدهای کنترل کیفی شده باید الزامات ذکر شده را داشته باشند (21، 9). در بررسیهای ظاهری واحدهای پلاکتی پس از تولید، عدم مشاهده گلبولهای قرمز، دلالت بر وجود کمتر از 109× 4/0 گلبول قرمز در هر کیسه دارد. معمولاً شمارش گلبول قرمز در یک واحد پلاکت بیش از 109×1 در هر کیسه نیست که بروز پاسخ ایمنی و واکنشهای ناشی از انتقال خون در گیرندگان فرآورده را کاهش میدهد (9). به علاوه ارزیابی گلبولهای قرمز به عنوان یک شاخص مدیریت کیفیت (QM : Quality Management) در فرآوردههای پلاکتی در نظر گرفته میشود(22).
جدول 1: الزامات استاندارد AABB و اروپا برای فرآورده پلاکت فرزیس
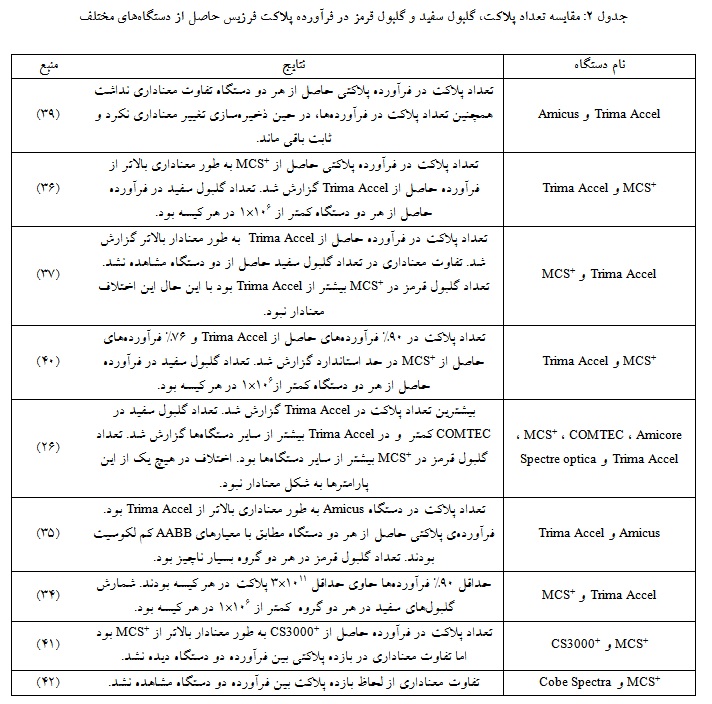
در مطالعههایی که در سالهای 1999-1998 انجام گرفته، بیشتر محققان بالاترین تعداد پلاکت را در دستگاه آمیکوس در شرایط یکسان گزارش کردهاند (25-23). برخی مطالعههای دیگر که دستگاه تریما اکسل با سایر دستگاهها مقایسه شده بود، نشان داد این دستگاه نسبت به سایر دستگاهها قادر است پلاکت بیشتری جمعآوری کند (29-26). با این حال اکثر مطالعههای انجام شده نشان دادند که تفاوت معناداری از لحاظ شمارش پلاکت در واحدهای پلاکت حاصل از دستگاههای مختلف آفرزیس وجود ندارد و این دستگاهها قادر هستند 1011×3 پلاکت در هر واحد پلاکت را فراهم کنند. همچنین دستگاههای آفرزیس موجود میتوانند فرآورده پلاکت کم لکوسیت تولید کنند (37-30، 20). دستگاههای جدید به دلیل رعایت برخی اصول در طراحی، به درجه بالایی از جدایی بین پلاکتها و گلبولهای سفید دست یافتهاند که منجر به تولید فرآوردههای پلاکت با کمترین میزان گلبول سفید و قرمز میشود (38، 32، 24).
در یک مطالعه که بازده پلاکت در دستگاههای دارای سانتریفیـوژ CFC مقایسـه شـده بود، بازده پلاکـت در همه

بنابراین تزریق پلاکتهای فعال شده ممکن است بهطور غیر مستقیم به واکنشهای نامطلوب کمک کند (73). همچنین پلاکتهایی با محتوای فسفاتیدیل سرین (PS) بالا در غشای خارجی، میتوانند پس از انتقال خون توسط فاگوسیتهای حرفهای مجهز به گیرندههای خاص برای PS، مانند گیرندههای رفتگر کلاس B (SR-B) و CD36 و یا توسط سیستم رتیکولواندوتلیال حذف شوند (75، 74).
5-2- میکروپارتیکل پلاکتی
میکروپارتیکلها وزیکولهای کوچکی به قطر 1/0 تا 1 میکرومتر هستند که از غشای پلاسمایی سلولهای مختلف از جمله پلاکتها آزاد شده و دارای نقشهای پاتوفیزیولوژی مختلفی از جمله فعال کردن پلاکت، انعقاد، التهاب و آنژیوژنز هستند. همچنین با حمل پروتئینها، لیپیدها و اسیدهای نوکلئیک در ارتباط بین سلولی نیز دخیل هستند (76). تعداد میکروپارتیکلهای پلاکتی مرتبط با عوامل متعدد مانند گروه خون، نحوه و مدت زمان جمعآوری خون، نحوه فیلتراسیون جهت کاهش لکوسیت، دمای ذخیرهسازی و سایر عوامل است (77). حضور میکروپارتیکلها در فرآوردههای پلاکتفرزیس میتواند باعث ایجاد عارضه پس از تزریق از جمله ترومبوز، التهاب و TRALI (Transfusion Related Acute Lung Injury) گیرندگان فرآورده گردد(78).
لکوسیتها دارای آنتیژنهای HLA هستند که منجر به برانگیختن پاسخ ایمنی شده و کارآیی فرآورده تزریق شده در گیرندگان فرآورده را کاهش میدهند. هدف پلاکت فرزیس، کاهش پاسخ به HLA از طریق کاهش لکوسیت است با این حال، پلاکتهایی که عمدتاً از پلاکت فرزیس جمعآوری میشوند حاوی میکروپارتیکلهای مشتق از پلاکت و سلولهای اندوتلیالاند که دارای تراکم بالایی از آنتیژن HLA هستند. بنابراین، کاهش این میکروپارتیکلها جهت افزایش کیفیت فرآوردههای حاصل از پلاکتفرزیس در آفرزیس ضروری است (79). میکروپارتیکلها به عنوان یک شاخص کیفیت فرآوردههای حاصل از پلاکت فرزیس میتوانند برای تخمین آسیبهایی در طی آمادهسازی و ذخیرهسازی ایجاد شده، استفاده شوند (80).
دو عامل مؤثر بر میکروپارتیکل پلاکتی در فرآوردههای حاصل از پلاکتفرزیس مشخص شده است: متغیرهای مربـوط به اهدا کننده (تعداد پلاکت، Mean Platelet) (MPV Volume، میزان کلسترول خون) و متغیرهای مربوط
به آفرزیس (82، 81).
خلاصهای از مطالعههای انجام شده در خصوص مقایسه
مقادیر میکروپارتیکل در فرآورده پلاکتفرزیس حاصل از دستگاههای مختلف در جدول قابل مشاهده است (جدول 6).
مطابق با آن چه در جدول 6 قابل مشاهده است در اکثر مطالعهها فرآوردههای پلاکت فرزیس حاصل از دستگاه Amicus بیشترین میزان میکروپارتیکل و فرآوردههای پلاکت فرزیس حاصل از Trima Accel کمترین میزان میکروپارتیکل را دارا بودند.
بحث
در این مطالعه شاخصهای کیفی و عملکردی فرآوردههای پلاکتی از جمله شمارش سلولی، تغییرات متابولیک، تجمع پلاکتی، فعال شدن پلاکتها و تعداد میکروپارتیکل پلاکتی در فرآوردههای حاصل از دستگاههای مختلف آفرزیس مورد ارزیابی قرار گرفت. مطابق با اکثر مطالعههای انجام شده، شمارش سلولی در دستگاههای مختلف تفاوت معناداری با یکدیگر نداشت و در حال حاضر دستگاههای موجود در بازار قادر هستند فرآورده پلاکتی مطابق با استاندارهای بینالمللی را فراهم کنند. اگر چه فرآوردههای حاصل از پلاکت فرزیس تعداد گلبولهای سفید کمتری نسبت به فرآوردههای حاصل از خون کامل دارند، اما تنها دستگاههایی که دارای برنامه کاهش لکوسیت هستند میتوانند فرآورده کم لکوسیت تولید کنند (37-33).
فعالیت متابولیک پلاکتهای آفرزیس عمدتاً با استفاده از pH ، pCO2 ، pO2 ، گلوکز و لاکتات تعیین میشود. در اکثر مطالعهها گلوکز و pO2 کاهش، لاکتات و pCO2 افزایش یافت و pH در محدوده قابلقبول قرار داشت با این حال این تغییرات به گونهای نبود که آسیبی به پلاکتها وارد نماید. میزان گلوکز موجود در ماده نگهدارنده فرآورده
پلاکتی دستگاههای مختلف میتواند یکی از علل تفاوت در میزان گلوکز و لاکتات فرآورده دستگاههای مختلف باشد. همچنین عوامل موثر در تسهیل تبادل گاز در فرآوردهها از جمله جنس کیسه میتواند بر تغییرات متابولیک تاثیرگذار باشد. در این خصوص برخی مطالعهها تفاوت معناداری در بین فرآوردههای دستگاههای مختلف نشان دادند و برخی تفاوت معناداری گزارش نکردند (32، 28، 20، 19).
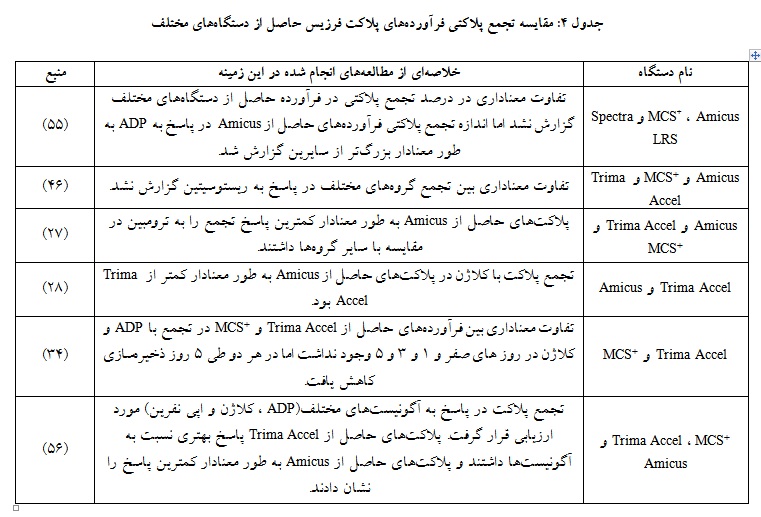
بررسی تجمع پلاکتی یکی از آزمایشهای رایج جهت سنجش عملکرد پلاکتها است که به وسیله آگونیستهای مختلف انجام میگیرد. مطابق مطالعههای مختلف در جدول 4 در پاسخ تجمع پلاکتی با آگونیستهای مختلف، فرآورده حاصل از دستگاه Amicus کمترین و Trima بیشترین پاسخ را دارا بودند (56، 55، 34، 27).
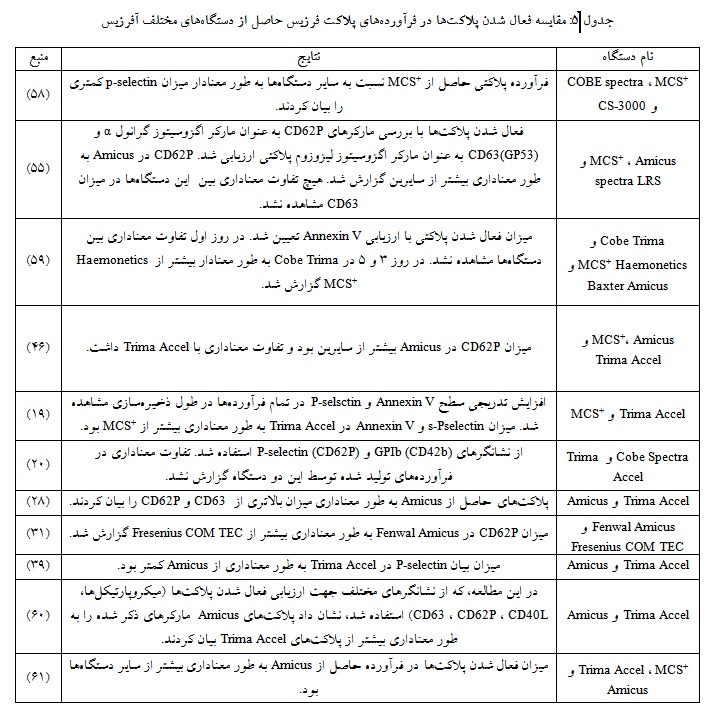
طبق مقالههای بررسی شده تهیه فرآورده پلاکتی با دستگاههای مختلف میتواند بر فعال شدن پلاکتها تأثیرگذار باشد به این طریق که میزان فعال شدن پلاکت و تولید میکروپارتیکل پلاکتی در فرآورده پلاکتی Amicus بالاتر از سایر دستگاهها گزارش شد و کمترین میزان متعلق به فرآورده پلاکتی حاصل از Trima بود (61، 60، 55، 46، 39، 28).
نتیجهگیری
طبق مقالههای ارزیابی شده در این مطالعه، بیشترین میزان تأثیر دستگاه بر فعال شدن پلاکتها متعلق به Amicus و کمترین میزان متعلق به دستگاه Trima است. بنابراین دستگاه Trima قادر است فرآوردهی پلاکت با کیفیت بالاتری نسبت به سایر دستگاهها تهیه نماید.
نقش نویسندگان
سمانه صادقی نیسیانی: نگارش مقاله
دکتر صدیقه امینی کافیآباد: ایده مقاله و نظارت بر نگارش مقاله
متن کامل: (832 مشاهده)
تاثیر انواع مختلف دستگاههای پلاکت فرزیس بر پارامترهای کیفی
واحدهای پلاکت تولیدی
سمانه صادقی نیسیانی1، صدیقه امینی کافیآباد2
چکیده
سابقه و هدف
پلاکت فرزیس به جمعآوری پلاکت از یک اهداکننده با استفاده از دستگاه آفرزیس گفته میشود. دستگاههای مختلفی جهت پلاکتفرزیس موجود هستند که هر کدام میتوانند به گونهای بر کیفیت فرآورده پلاکتی تاثیرگذار باشند. هدف از این مقاله مروری، بررسی تاثیر دستگاههای پلاکتفرزیس بر پارامترهای کیفی واحدهای پلاکت تولیدی بود.
مواد و روشها
این مقاله به مرور تاثیرات دستگاههای مختلف آفرزیس بر کیفیت واحدهای پلاکتی با جستجوی واژگان کلیدی در پایگاههای PubMed، Google Scholar، Science Direct و Scopus پرداخته و 83 مقاله استفاده شده است.
یافتهها
جهت ارزیابی کیفیت فرآورده پلاکت فرزیس، پارامترهای مختلفی از جمله شمارش و بازده پلاکتی، شمارش گلبول سفید و قرمز، تجمع پلاکت، فعالیت متابولیک، فعالیت پلاکتها و تعداد میکروپارتیکل پلاکتی مورد ارزیابی قرار میگیرد. تعداد پلاکت در فرآوردههای پلاکت حاصل از دستگاههای آفرزیس موجود مطابق با استانداردهای AABB و اروپا است. در بررسی فعالیت متابولیک پلاکتهای آفرزیس در اکثر مطالعهها میزان گلوکز و pO2 کاهش، لاکتات و pCO2 افزایش یافته بود و pH در محدوده قابل قبول قرار داشت. در پاسخ تجمع پلاکتی با آگونیستهای مختلف، فرآورده حاصل از دستگاه آمیکوس کمترین و تریما اکسل بیشترین پاسخ را داشتند. میزان فعال شدن پلاکت و تولید میکروپارتیکل نیز در فرآورده پلاکتی آمیکوس بیشتر و در تریما اکسل کمتر از سایرین گزارش شد.
نتیجه گیری
کیفیت واحدهای پلاکتی میتواند تحت تاثیر دستگاه آفرزیس قرار بگیرد. اکثر دستگاههای موجود میتوانند فرآورده پلاکت مطابق با استانداردهای موجود را فراهم کنند. طبق مطالعههای انجام شده، دستگاه Trima Accel نسبت به سایر دستگاهها(Haemonetics MCS+, Amicus, Cobe Spectra, Fresenius) فرآورده پلاکت با کیفیتتری را تهیه میکند.
کلمات کلیدی: پلاکتفرزیس، کنترل کیفی، تجمع پلاکتی، فعال شدن پلاکتها
تاریخ دریافت: 09/11/1402
تاریخ پذیرش : 18/01/1403
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: متخصص آسیبشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
واحدهای پلاکت تولیدی
سمانه صادقی نیسیانی1، صدیقه امینی کافیآباد2
چکیده
سابقه و هدف
پلاکت فرزیس به جمعآوری پلاکت از یک اهداکننده با استفاده از دستگاه آفرزیس گفته میشود. دستگاههای مختلفی جهت پلاکتفرزیس موجود هستند که هر کدام میتوانند به گونهای بر کیفیت فرآورده پلاکتی تاثیرگذار باشند. هدف از این مقاله مروری، بررسی تاثیر دستگاههای پلاکتفرزیس بر پارامترهای کیفی واحدهای پلاکت تولیدی بود.
مواد و روشها
این مقاله به مرور تاثیرات دستگاههای مختلف آفرزیس بر کیفیت واحدهای پلاکتی با جستجوی واژگان کلیدی در پایگاههای PubMed، Google Scholar، Science Direct و Scopus پرداخته و 83 مقاله استفاده شده است.
یافتهها
جهت ارزیابی کیفیت فرآورده پلاکت فرزیس، پارامترهای مختلفی از جمله شمارش و بازده پلاکتی، شمارش گلبول سفید و قرمز، تجمع پلاکت، فعالیت متابولیک، فعالیت پلاکتها و تعداد میکروپارتیکل پلاکتی مورد ارزیابی قرار میگیرد. تعداد پلاکت در فرآوردههای پلاکت حاصل از دستگاههای آفرزیس موجود مطابق با استانداردهای AABB و اروپا است. در بررسی فعالیت متابولیک پلاکتهای آفرزیس در اکثر مطالعهها میزان گلوکز و pO2 کاهش، لاکتات و pCO2 افزایش یافته بود و pH در محدوده قابل قبول قرار داشت. در پاسخ تجمع پلاکتی با آگونیستهای مختلف، فرآورده حاصل از دستگاه آمیکوس کمترین و تریما اکسل بیشترین پاسخ را داشتند. میزان فعال شدن پلاکت و تولید میکروپارتیکل نیز در فرآورده پلاکتی آمیکوس بیشتر و در تریما اکسل کمتر از سایرین گزارش شد.
نتیجه گیری
کیفیت واحدهای پلاکتی میتواند تحت تاثیر دستگاه آفرزیس قرار بگیرد. اکثر دستگاههای موجود میتوانند فرآورده پلاکت مطابق با استانداردهای موجود را فراهم کنند. طبق مطالعههای انجام شده، دستگاه Trima Accel نسبت به سایر دستگاهها(Haemonetics MCS+, Amicus, Cobe Spectra, Fresenius) فرآورده پلاکت با کیفیتتری را تهیه میکند.
کلمات کلیدی: پلاکتفرزیس، کنترل کیفی، تجمع پلاکتی، فعال شدن پلاکتها
تاریخ دریافت: 09/11/1402
تاریخ پذیرش : 18/01/1403
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: متخصص آسیبشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
پلاکتها سلولهای 2 تا 4 میکرونی، فاقد هسته و بسیار پیچیدهای هستند که در مغز استخوان و طی قطعه قطعه شدن سیتوپلاسم مگاکاریوسیتها تولید شده و به تعداد 450000-150000 در هر میکرولیتر از خون یافت میشوند(3-1). این سلولها در بسیاری از فرآیندهای پاتوفیزیولوژیک از جمله هموستاز، ترومبوز، جمع شدن لخته و ترمیم عروق نقش دارند(4). ساختار آنها را میتوان به چهار ناحیه محیطی، سل- ژل، اندامک و سیستم غشایی طبقهبندی کرد. ناحیه اندامک حاوی گرانولهای α، گرانولهای متراکم و لیزوزوم است(1). محتویات این گرانولها از جمله P-selectin ، CD63 و همچنین CD40L موجود در سیتوپلاسم در هنگام فعال شدن پلاکتها آزاد شده و از این رو جهت ارزیابی آسیبهای دوران ذخیرهسازی استفاده میگردند(5).
فرآوردههای پلاکتی به روشهای مختلفی از جمله آفرزیس و یا از خون کامل به روش پلاسمای غنی از پلاکت(Platelet Rich Plasma; PRP) و یا بافیکوت(Buffy coat; BC) تهیه میشوند(6). فرآورده پلاکتی باید به مدت 1 تا 2ساعت بلافاصله پس از تولید در دمای ˚C2± 22 بدون حرکت استراحت داده شود، در غیر این صورت ممکن است پلاکتها به صورت برگشتناپذیر فعال شده و تجمع کنند. پس از زمان استراحت، فرآوردههای پلاکتی در دمای ˚C2± 22 در شیکر انکوباتور نگهداری میشوند (7).
آفرزیس (واژه یونانی باستان aphaeresis به معنی برداشتن) روشی است که شامل برداشتن یک جزء از خون و بازگرداندن سایر اجزای خون به اهداکننده با استفاده از دستگاههای آفرزیس است. در روش پلاکت فرزیس، پلاکتها جمعآوری شده و سایر اجزا به اهداکننده باز میگردند(8، 7). پلاکت فرزیس دریافت پلاکتهای کافی از یک اهداکننده را بدون به خطر انداختن توده گلبولهای قرمز آنها تسهیل و توانایی اهداکننده را برای اهدای مکرر تضمین میکند بنابراین اهداکنندگان پلاکت فرزیس میتوانند در مقایسه با اهداکنندگان خون کامل به دفعات بیشتری پلاکت اهدا کنند(9). مطالعه یانکی و همکاران نیاز
به پلاکت فرزیس جهت انتخاب اهداکنندگان همسان از لحاظ HLA در درمان بیماران مبتلا به مقاومت پلاکتی را نشان داد (10). این مطالعه حرکت به سمت پلاکت فرزیس را تسریع کرد. دستگاههای آفرزیس با استفاده از فیلتراسیون، سانتریفیوژ و یا ترکیبی از این دو، قادر به جداسازی اجزای خون هستند. در روش فیلتراسیون اجزای سلولی خون بر اساس اندازه جدا میشوند، در حالی که در روش سانتریفیوژ جداسازی اجزای سلولی بر اساس وزن مخصوص آنها انجام میگیرد. دو تکنیک مختلف در روش سانتریفیوژ وجود دارد؛ سانتریفیوژ جریان متناوب (Intermittent Flow Centrifugation; IFC) و سانتریفیوژ جریان پیوسته(Continuous Flow Centrifugation; CFC) . در روش IFC خون به صورت چرخهای پردازش میشود. هر چرخه شامل خونگیری، جداسازی اجزای خون، برداشت جزء مورد نظر و انتقال سایر اجزا به اهداکننده است. در روش IFC پس از اتمام یک چرخه، چرخه دیگر آغاز میشود. از این رو این روش به یک محل رگگیری نیاز دارد و به شکل تک سوزنی انجام میشود.Trima Accel و Haemonetics MCS از جمله دستگاههایی هستند که به این روش کار میکنند. در روش سانتریفیوژ CFC خون به طور همزمان گرفته، پردازش و بازگشت داده میشود و به دو محل رگگیری نیاز است و به شکل دو سوزنی انجام میگیرد. دستگاههای Fenwal Amicus ، Cobe Spectra و Fresenius از این روش استفاده میکنند (8).
دستگاههای مختلف آفرزیس میتوانند بر کیفیت فرآورده پلاکتی تأثیر بگذارند. پلاکتها باید زنده، عملکردی و فاقد هر گونه آلودگی باشند. از جمله فاکتورهای مؤثر بر کیفیت فرآورده پلاکتی میتوان به تعداد و بازده پلاکت (Platelet yield یا بازده پلاکت به تعداد پلاکتی که در طول مدت زمان پلاکتفرزیس از یک اهداکننده جمعآوری میشود، گفته میشود)، تعداد گلبول سفید و قرمز، فعالیت پلاکت و میزان میکروپارتیکل اشاره کرد. به علاوه میزان pH و شاخصهای بیوشیمیایی مانند میزان گلوکز، لاکتات، بیکربنات، pCO2 و pO2 و همچنین توانایی تجمع پلاکتها نیز در کیفیت فرآورده پلاکتی مؤثر است. پلاکت فرزیس میتواند بر تمامی عوامل ذکر شده تاثیرگذار باشد. البته باید در نظر داشت علاوه بر دستگاه آفرزیس عوامل دیگری همچون سلامت اهداکننده، شرایط نگهداری و حمل و نقل نیز میتوانند بر کیفیت فرآورده پلاکتی تأثیرگذار باشند(12، 11).
هدف از این مطالعه مروری، ارزیابی تأثیر دستگاههای مختلف آفرزیس بر جنبههای مختلف کیفیت فرآورده پلاکتی از جمله شمارش سلولی، فعالیت متابولیکی، تجمع پلاکتی، فعال شدن پلاکتها و تعداد میکروپارتیکل در فرآورده به دست آمده بود. با در نظر گرفتن موارد مورد مطالعه میتوان جهت تهیه دستگاهی با امکان تولید فرآورده باکیفیت در مراکز انتقال خون اقدام نمود.
مواد و روشها
این مقاله به مرور تاثیرات دستگاههای مختلف آفرزیس بر کیفیت فرآوردههای پلاکتی حاصله از لحاظ بازده پلاکت (Platelet yield)، تعداد گلبولهای سفید و گلبولهای قرمز، تجمع پلاکتی(Platelet Aggregation)، فعالیت متابولیک (Metabolic activity)، فعال شدن پلاکتها (Platelet activation) و تعداد میکروپارتیکلهای پلاکتی (Platelet Microparticles) به جستجوی واژگان کلیدی در پایگاههای PubMed ، Google Scholar ، Science Direct و Scopus پرداخته و از بین 130 مقاله، 83 مقاله مرتبط استفاده شده است. مقالاتی که در آنها تنها به بررسی شاخصهای کیفی یک دستگاه پرداخته شده بود و مقایسهای بین حداقل دو دستگاه صورت نگرفته بود در این مطالعه مورد استفاده قرار نگرفت. همچنین مقالاتی که متن کامل آنها به زبان دیگری به جز فارسی یا انگلیسی نوشته شده بود نیز استفاده نگردید.
یافتهها
1- دستگاههای پلاکت فرزیس
اولین دستگاه آفرزیس توسط هرب کولیس در سال 1972 اختراع شد. در حال حاضر انواع مختلفی از دستگاههای پلاکتفرزیس در بازار موجود است. برخی از
متداولترین آنها عبارتند از:
Trima Accel (Terumo BCT ، Lakewood ، آمریکا) دستگاه آفرزیس است که توسط شرکت Terumo BCT جهت جمعآوری پلاکت، پلاسما، لکوسیت و گلبول قرمز تولید شده است. این دستگاه از سانتریفیوژ IFC استفاده میکند. قابلیت جمعآوری یک یا دو واحد پلاکت را داشته و قادر است فرآورده کم لکوسیت تهیه نماید. آخرین نسخه این دستگاه Trima Accel 7 است که نسبت به نسخه قبلی از لحاظ اساس کار و تکنولوژی تفاوتی نداشته بلکه صرفا در برخی برنامههای نرمافزاری متفاوت است(15-13).
Haemonetics MCS LN9000 (Haemonetics Corp ، Stoughton ، آمریکا):
یک نسخه اصلاح شده از MCS است. این دستگاه دارای یک پمپ پلاسمای اضافی است که سبب جداسازی بهتر اجزای خون و کاهش مدت زمان چرخه بازگشت خون به اهداکننده میشود. نوع سانتریفیوژ آن IFC است. اگر چه فرآیند تولید پلاکت توسط این دستگاه منجر به تولید فرآورده کم لکوسیت میشود، با این حال برای اطمینان از این امر فیلترهای کاهنده لکوسیت به صورت In-line در ستهای این دستگاه تعبیه شده است (16، 13).
Fenwal CS3000 and Fenwa1 CS3000+ (Baxter Healthcare Corp ، Round Lake ، آمریکا):
این دستگاهها نیز جهت تهیه پلاکت مورد استفاده قرار میگیرند و میتوانند فرآورده پلاکت کم لکوسیت تولید کنند.
Fenwa1 Amicus (Fenwal ، Inc. ، Lake Zurich ، آمریکا):
از سانتریفیوژ CFC استفاده میکند. به شکل تک سوزنی و دو سوزنی موجود است و قادر است فرآورده کم لکوسیت تولید نماید(17، 16، 13).
Cobe Spectra (Terumo BCT ، Lakewood ،آمریکا):
دارای سیستـم کاهـش لکوسیـت (LRS : Leukocyte
Reduction System) اســت. از سانتــریفیوژ CFC استفاده
میکند و به شکل تک سوزنی و دو سوزنی موجود است (17، 16).
Fresenius AS104 and Fresenius COM. TEC (Fresenius Bad Homburg ، آلمان):
این دستگاهها نیز از سانتریفیوژ CFC استفاده میکنند. COM.TEC قابلیتهای پلاکت فرزیس بهتری نسبت به AS 104 دارد. Fresenius AS104در حال حاضر برای جمعآوری پلاکت استفاده نمیشود بلکه AS204 جایگزین آن شده است (17، 14، 13).
مطالعههای مختلف بیان میکنند ویژگیهای دستگاههای مختلف آفرزیس از جمله فناوری جداسازی سلولهای خونی، نوع سانتریفیوژ (IFC یا CFC)، تفاوت در جنس کیسهها و ضد انعقاد موجود در ست دستگاههای مختلف میتوانند بر پارامترهای مختلف کیفی از جمله شمارش سلولی، فعالیت متابولیک، تجمع سلولی، فعال شدن پلاکتها و تعداد میکروپارتیکل تاثیرگذار باشند (20-18).
2- شاخصهای کیفی در فرآورده پلاکتی:
شاخصهای مختلفی جهت ارزیابی کیفیت فرآوردههای پلاکتی مورد استفاده قرار میگیرند از جمله شمارش سلولی (پلاکت، گلبول سفید و قرمز)، فعالیت متابولیک، تجمع پلاکتی، فعال شدن پلاکتها و تعداد میکروپارتیکل پلاکتی که در ادامه به توضیح هر کدام میپردازیم.
شمارش سلولی فرآوردههای پلاکت فرزیس (تعداد پلاکت، گلبول سفید و گلبول قرمز):
یکی از پارامترهای مهم جهت ارزیابی کیفیت فرآوردههای حاصل از پلاکتفرزیس، شمارش پلاکت، گلبول سفید و گلبول قرمز میباشد. استاندارهای انجمن بانکهای خون آمریکا (AABB) و کمیته اروپا از لحاظ تعداد پلاکت و گلبول سفید در فرآورده پلاکت فرزیس در جدول ذکر شده است (جدول 1). حداقل 90 درصد واحدهای کنترل کیفی شده باید الزامات ذکر شده را داشته باشند (21، 9). در بررسیهای ظاهری واحدهای پلاکتی پس از تولید، عدم مشاهده گلبولهای قرمز، دلالت بر وجود کمتر از 109× 4/0 گلبول قرمز در هر کیسه دارد. معمولاً شمارش گلبول قرمز در یک واحد پلاکت بیش از 109×1 در هر کیسه نیست که بروز پاسخ ایمنی و واکنشهای ناشی از انتقال خون در گیرندگان فرآورده را کاهش میدهد (9). به علاوه ارزیابی گلبولهای قرمز به عنوان یک شاخص مدیریت کیفیت (QM : Quality Management) در فرآوردههای پلاکتی در نظر گرفته میشود(22).
جدول 1: الزامات استاندارد AABB و اروپا برای فرآورده پلاکت فرزیس
پلاکت 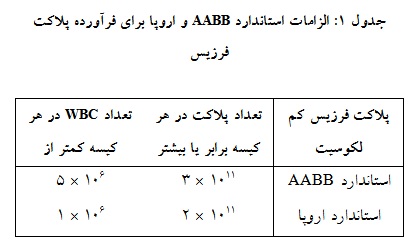 فرزیس کم لکوسیت فرزیس کم لکوسیت |
تعداد پلاکت در هر کیسه برابر یا بیشتر | تعداد WBC در هر کیسه کمتر از |
| استاندارد AABB | 1011 × 3 | 106 × 5 |
| استاندارد اروپا | 1011 × 2 | 106 × 1 |
در مطالعههایی که در سالهای 1999-1998 انجام گرفته، بیشتر محققان بالاترین تعداد پلاکت را در دستگاه آمیکوس در شرایط یکسان گزارش کردهاند (25-23). برخی مطالعههای دیگر که دستگاه تریما اکسل با سایر دستگاهها مقایسه شده بود، نشان داد این دستگاه نسبت به سایر دستگاهها قادر است پلاکت بیشتری جمعآوری کند (29-26). با این حال اکثر مطالعههای انجام شده نشان دادند که تفاوت معناداری از لحاظ شمارش پلاکت در واحدهای پلاکت حاصل از دستگاههای مختلف آفرزیس وجود ندارد و این دستگاهها قادر هستند 1011×3 پلاکت در هر واحد پلاکت را فراهم کنند. همچنین دستگاههای آفرزیس موجود میتوانند فرآورده پلاکت کم لکوسیت تولید کنند (37-30، 20). دستگاههای جدید به دلیل رعایت برخی اصول در طراحی، به درجه بالایی از جدایی بین پلاکتها و گلبولهای سفید دست یافتهاند که منجر به تولید فرآوردههای پلاکت با کمترین میزان گلبول سفید و قرمز میشود (38، 32، 24).
در یک مطالعه که بازده پلاکت در دستگاههای دارای سانتریفیـوژ CFC مقایسـه شـده بود، بازده پلاکـت در همه

دستگاهها تقریباً در یک محدوده گزارش شد و تفاوت معناداری بین آنها مشاهده نشده بود (32). مطالعه ککلیک و همکاران نشان داد بازده پلاکت در فرآوردههای حاصل از دستگاههای دارای سانتریفیوژ IFC بالاتر از دستگاههای دارای سانتریفیوژ CFC است (18).
خلاصهای از مطالعههای مختلف در خصوص مقایسه تعداد پلاکت، گلبول سفید و گلبول قرمز در سالهای اخیر در جدول آورده شده است (جدول 2). مطابق با این جدول، اکثر دستگاهها قادر هستند فرآورده پلاکتی مطابق با
استاندارد AABB و اروپا را فراهم کنند.
همچنین مطالعههای سالهای 2021-2019 نشان دادند دستگاههای پلاکت فرزیس جدید فرآورده پلاکت با کمترین میزان گلبول سفید و قرمز را فراهم میکنند (37، 33، 26).
فعالیت متابولیک:
فعالیت متابولیک پلاکتهای آفرزیس عمدتاً با استفاده
از pH ، pCO2 ، pO2 ، بــیکربنـات، گلـوکـز و لاکتـات
اندازهگیری میشود.
pH :
متابولیسم پلاکتها طی نگهداری در ˚C2± 22 منجر به تغییر pH میشود. مورفی و همکاران نشان دادند کاهش pH به زیر 6 منجر به آسیب غیرقابل برگشت پلاکتها میشود (43). تغییرات مشابهی در pH بالای 5/7 نیز مشاهده شده است. بر این اساس، استانداردهای فعلی آستانههایی را برای پذیرش pH فرآوردههای پلاکتی، تعریف کردهاند. برای مثال، AABB مقرر میکند که حداقل 90 درصد پلاکتهای آفرزیس باید در پایان ذخیرهسازی 2/6 pH ≥ داشته باشند(9). استانداردهای دیگر ممکن است آستانههایی با اندکی تفاوت تعیین کرده باشند، اما همه آنها تعیین pH را به عنوان یک شاخص کنترل کیفیت در نظر گرفتهاند. استاندارد اروپا مشخص میکند pH در ˚C2± 22 در پایان عمر مفید توصیه شده، باید مساوی یا بالاتر از 4/6 اندازهگیری شود (21). از منظر کنترل کیفیت، هدف اصلی نظارت بر pH پلاکت، شناسایی مشکلات بالقوه از جمله آلودگی باکتریال، میزان پایین پلاسما نسبت به پلاکت و عدم تبادل گاز است که ممکن است در طول تولید و ذخیرهسازی فرآورده رخ دهد. انحراف از نتیجه مورد انتظار میتواند به شناسایی چنین مشکلاتی کمک کند و منجر به اقدام اصلاحی شود. با این حال، سودمندی pH پلاکت در فرآوردههای آفرزیس برای این منظور مورد تردید قرار گرفته است. تودیسکو و همکاران در مطالعه خود عنوان کردند که اندازهگیری pH جهت نظارت بر پلاکت حاصل از خون کامل کاربردی است و در مورد پلاکت حاصل از آفرزیس ارزش چندانی ندارد. پلاکت حاصل از خون کامل پس از جداسازی از خون با یک روش دستی که میتواند بسیار وابسته به کاربر باشد در مقداری از پلاسما جهت حفظ pH شناور میشوند در حالی که در پلاکت فرزیس دستگاه با در نظر گرفتن شمارش پلاکت اهداکننده و سایر پارامترها به عنوان مثال وزن، جنسیت و میزان هماتوکریت، حجم خون پردازش شده را محاسبه و حجم پلاسمای مورد نیاز برای آن میزان پلاکت را تعیین میکند. بنابراین حجم پلاسما و تعداد پلاکت که از عوامل مهم در تغییر pH هستند، حذف میشود (44).
با این حال باید در نظر داشت علاوه بر حجم پلاسما و تعداد پلاکت، عوامل دیگری نیز pH را در فرآوردههای پلاکتی تحت تاثیر قرار میدهند. برای مثال شرایط نمونهگیری، نوع آژیتاسیون، ابعاد و جنس کیسه پلاکتی، دمای نگهداری، گلبولهای سفید موجود در فرآورده و آلودگی باکتریایی از عوامل مؤثر بر pH شناخته میشوند. به علاوه استفاده از محلولهای ضد انعقاد و نگهدارنده بر روی pH، متابولیسم گلوکز، لاکتات و تولید اسید کربنیک تأثیرگذار هستند(45).
تودیسکو و همکاران در سال 2005 دستگاههای MCS+ LN9000 ، Amicus و CS3000 را مورد مطالعه قرار دادند. کمترین میزان pH متعلق به CS3000 بود و تفاوت معناداری در این زمینه در دو دستگاه MCS و Amicus دیده نشد. این احتمال وجود دارد که فرآوردههای جمعآوری شده با CS3000 مقدار pH کمتری داشته باشند، زیرا میانگین غلظت پلاکت در فرآورده حاصل از CS3000 بیشتر از فرآورده جمعآوری شده با Amicus یا +MCS بود (44).
پایکر و همکاران در سال 2006 دستگاههای Amicus ، MCS+ و Trima را مورد مطالعه قرار دادند. pH در فرآوردههای Amicus از همه کمتر گزارش شد(46). مطالعه مشابهی در سال 2010 در خصوص دستگاههای Trima و Amicus انجام شد. pH فرآوردههای حاصل از دستگاه Amicus کمتر از Trima گزارش شد اما همچنان در محدوده 4/7-4/6 قرار داشت. یکی از دلایل pH بالاتر در فرآوردههای حاصل از Trima ، نفوذپذیری بهتر گاز در کیسهها عنوان شده است که با کاهش تغییر از متابولیسم هوازی به گلیکولیز در فرآوردههای حاصل از Trima accel همراه است (28).
تینگارد و همکاران در سال 2008 بر روی دستگاههایTrima Accel و COBE Spectra (both Gambro BCT) مطالعه کردند. pH در حین روز صفر و 1 افزایش پیدا کرده و سپس کاهش یافت. pH در حین نگهداری در بازه قابل قبول بود و تفاوتی بین دو دستگاه نداشت (20). مطالعههای دیگری هم افزایش pH در طی روزهای اول ذخیرهسازی در فرآوردههای پلاکت فرزیس را نشان دادند (49-47).
مطالعه وانگ و همکارانش در سال 2020 بر روی فرآورده کم لکوسیت حاصل از دستگاه Trima Accel و فرآورده غیر کم لکوسیتHaemonetics MCS+ انجام شد. حداقل90% فرآوردهها طی 5 روز ذخیرهسازی pH بیشتر یا مساوی 2/6 داشتند. pH در فرآورده کم لکوسیت حاصل از Trima Accel به طور معناداری بیشتر از فرآورده غیر کم لکوسیت حاصل از MCS بود که این مطالعه میتواند نشاندهنده نقش لکوسیت در pH فرآوردههای پلاکتی باشد (34). مطالعههای مختلف نشان میدهند در اکثر فرآوردههای پلاکتی حاصل از آفرزیس، pH در محدوده قابل قبول قرار دارد و تفاوت چندانی میان pH حاصل از دستگاههای مختلف گزارش نشده است (51، 50، 39، 35).
گلوکز، لاکتات، بیکربنات، pCO2 و pO2 :
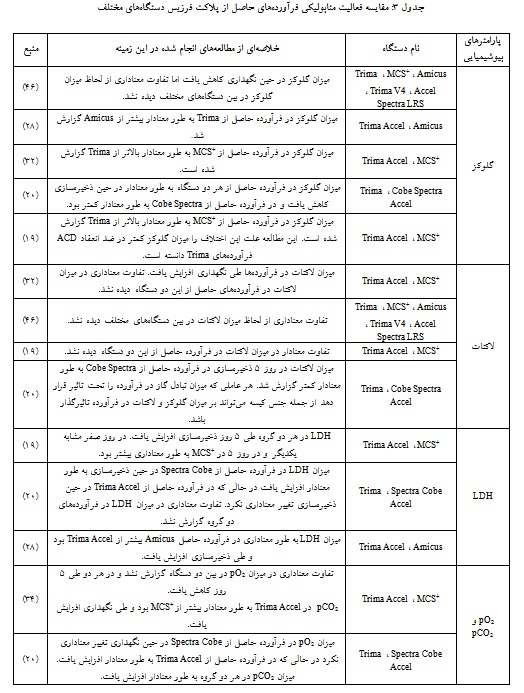
طی متابولیسم پلاکتها، گلوکز از محیط اطراف وارد پلاکتها شده، میتواند تحت گلیکولیز (مسیر غیر اکسیداتیو) در سیتوپلاسم قرار گیرد تا پیرووات و مقدار کمی ATP تولید کند. پیرووات در فسفوریلاسیون اکسیداتیو در ماتریکس میتوکندری از طریق چرخه تریکربوکسیلیک اسید شرکت میکند. چرخه اسید سیتریک، NADH+و FADH2تولید میکند که برای تولید ATP انبوه در زنجیره انتقال الکترون مصرف میشوند. طی این چرخه O2 مصرف و CO2 تولید میشود. CO2 تولید شده نیز از طریق آنزیم کربنیک انیدراز به بیکربنات تبدیل میشود. در طول ذخیرهسازی فرآوردههای پلاکتی، گلیکولیز افزایش مییابد در حالی که چرخه تریکربوکسیلیک اسید در میتوکندری سرکوب میشود. این فرآیند منجر به افزایش مصرف گلوکز و ترشح اسید لاکتیک و کاهش تولید ATP میشود. در نهایت، این تغییرات با اسیدی شدن محیط ذخیرهسازی، کاهش بقا و عملکرد پلاکتها مرتبط است (53، 52). خلاصهای از مطالعههای انجام شده در خصوص مقایسه فعالیت متابولیک در فرآوردههای پلاکت فرزیس حاصل از دستگاههای مختلف آفرزیس در جدول آورده شده است (جدول 3).
2-3- تجمع پلاکتی
پلاکتها میتوانند توسط آگونیستهای متعدد مانند کلاژن، ترومبین، اپینفرین، ریستوسیتین و ADP از طریق مسیرهای مختلف فعال شوند. آزمایش اگریگومتری نوعی آزمایش عملکرد پلاکتی است که توانایی پلاکتها را برای جمع شدن و تشکیل لختههای خونی، اندازهگیری میکند (54). خلاصهای از مطالعههای انجام شده در خصوص تفاوت تجمع پلاکت در دستگاههای مختلف آفرزیس در جدول آورده شده است (جدول 4). مطابق با این جدول، پلاکتهای حاصل از Trima Accel پاسخ بهتری به آگونیستهای پلاکتی دادند و کمترین میزان پاسخ به آگونیستها در پلاکتهای حاصل از Amicus گزارش شده است.
4-2- فعال شدن پلاکتها
مارکرهای مختلفی طی فعال شدن پلاکتها در سطح آنها ظاهر میشوند از جمله این مارکرها میتوان به P-selectin اشاره کرد. P-selectin پروتئینی است که در گرانولهای آلفا ذخیره شده است و طی فعال شدن پلاکتها به سطح آنها منتقل میشود. بیان P-selectin بر روی سطح پلاکتها یا وجود شکل محلول آن در پلاسما به عنوان نشانگر فعال شدن پلاکتها در نظر گرفته میشود. این پروتئین در اتصال پلاکت به سطوح و سلولهای دیگر نقش دارد. مارکرهای دیگری نیز جهت شناسایی فعالیت پلاکتی مورد استفاده قرار میگیرند از جمله CD63 ، CD40L ، CD69 ، Annexin V با این حال از آن جایی که P-selectin در مراحل ابتدایی فعال شدن پلاکتها بر سطح آنها به صورت پایدار ظاهر میشود، بیشتر از سایر مارکرها مورد استفاده قرار میگیرد (57). شماری از مطالعههای انجام شده در خصوص مقایسه فعال شدن پلاکتها در فرآوردههای پلاکتفرزیس حاصل از دستگاههای مختلف آفرزیس در جدول آورده شده است (جدول 5).
خلاصهای از مطالعههای مختلف در خصوص مقایسه تعداد پلاکت، گلبول سفید و گلبول قرمز در سالهای اخیر در جدول آورده شده است (جدول 2). مطابق با این جدول، اکثر دستگاهها قادر هستند فرآورده پلاکتی مطابق با
استاندارد AABB و اروپا را فراهم کنند.
همچنین مطالعههای سالهای 2021-2019 نشان دادند دستگاههای پلاکت فرزیس جدید فرآورده پلاکت با کمترین میزان گلبول سفید و قرمز را فراهم میکنند (37، 33، 26).
فعالیت متابولیک:
فعالیت متابولیک پلاکتهای آفرزیس عمدتاً با استفاده
از pH ، pCO2 ، pO2 ، بــیکربنـات، گلـوکـز و لاکتـات
اندازهگیری میشود.
pH :
متابولیسم پلاکتها طی نگهداری در ˚C2± 22 منجر به تغییر pH میشود. مورفی و همکاران نشان دادند کاهش pH به زیر 6 منجر به آسیب غیرقابل برگشت پلاکتها میشود (43). تغییرات مشابهی در pH بالای 5/7 نیز مشاهده شده است. بر این اساس، استانداردهای فعلی آستانههایی را برای پذیرش pH فرآوردههای پلاکتی، تعریف کردهاند. برای مثال، AABB مقرر میکند که حداقل 90 درصد پلاکتهای آفرزیس باید در پایان ذخیرهسازی 2/6 pH ≥ داشته باشند(9). استانداردهای دیگر ممکن است آستانههایی با اندکی تفاوت تعیین کرده باشند، اما همه آنها تعیین pH را به عنوان یک شاخص کنترل کیفیت در نظر گرفتهاند. استاندارد اروپا مشخص میکند pH در ˚C2± 22 در پایان عمر مفید توصیه شده، باید مساوی یا بالاتر از 4/6 اندازهگیری شود (21). از منظر کنترل کیفیت، هدف اصلی نظارت بر pH پلاکت، شناسایی مشکلات بالقوه از جمله آلودگی باکتریال، میزان پایین پلاسما نسبت به پلاکت و عدم تبادل گاز است که ممکن است در طول تولید و ذخیرهسازی فرآورده رخ دهد. انحراف از نتیجه مورد انتظار میتواند به شناسایی چنین مشکلاتی کمک کند و منجر به اقدام اصلاحی شود. با این حال، سودمندی pH پلاکت در فرآوردههای آفرزیس برای این منظور مورد تردید قرار گرفته است. تودیسکو و همکاران در مطالعه خود عنوان کردند که اندازهگیری pH جهت نظارت بر پلاکت حاصل از خون کامل کاربردی است و در مورد پلاکت حاصل از آفرزیس ارزش چندانی ندارد. پلاکت حاصل از خون کامل پس از جداسازی از خون با یک روش دستی که میتواند بسیار وابسته به کاربر باشد در مقداری از پلاسما جهت حفظ pH شناور میشوند در حالی که در پلاکت فرزیس دستگاه با در نظر گرفتن شمارش پلاکت اهداکننده و سایر پارامترها به عنوان مثال وزن، جنسیت و میزان هماتوکریت، حجم خون پردازش شده را محاسبه و حجم پلاسمای مورد نیاز برای آن میزان پلاکت را تعیین میکند. بنابراین حجم پلاسما و تعداد پلاکت که از عوامل مهم در تغییر pH هستند، حذف میشود (44).
با این حال باید در نظر داشت علاوه بر حجم پلاسما و تعداد پلاکت، عوامل دیگری نیز pH را در فرآوردههای پلاکتی تحت تاثیر قرار میدهند. برای مثال شرایط نمونهگیری، نوع آژیتاسیون، ابعاد و جنس کیسه پلاکتی، دمای نگهداری، گلبولهای سفید موجود در فرآورده و آلودگی باکتریایی از عوامل مؤثر بر pH شناخته میشوند. به علاوه استفاده از محلولهای ضد انعقاد و نگهدارنده بر روی pH، متابولیسم گلوکز، لاکتات و تولید اسید کربنیک تأثیرگذار هستند(45).
تودیسکو و همکاران در سال 2005 دستگاههای MCS+ LN9000 ، Amicus و CS3000 را مورد مطالعه قرار دادند. کمترین میزان pH متعلق به CS3000 بود و تفاوت معناداری در این زمینه در دو دستگاه MCS و Amicus دیده نشد. این احتمال وجود دارد که فرآوردههای جمعآوری شده با CS3000 مقدار pH کمتری داشته باشند، زیرا میانگین غلظت پلاکت در فرآورده حاصل از CS3000 بیشتر از فرآورده جمعآوری شده با Amicus یا +MCS بود (44).
پایکر و همکاران در سال 2006 دستگاههای Amicus ، MCS+ و Trima را مورد مطالعه قرار دادند. pH در فرآوردههای Amicus از همه کمتر گزارش شد(46). مطالعه مشابهی در سال 2010 در خصوص دستگاههای Trima و Amicus انجام شد. pH فرآوردههای حاصل از دستگاه Amicus کمتر از Trima گزارش شد اما همچنان در محدوده 4/7-4/6 قرار داشت. یکی از دلایل pH بالاتر در فرآوردههای حاصل از Trima ، نفوذپذیری بهتر گاز در کیسهها عنوان شده است که با کاهش تغییر از متابولیسم هوازی به گلیکولیز در فرآوردههای حاصل از Trima accel همراه است (28).
تینگارد و همکاران در سال 2008 بر روی دستگاههایTrima Accel و COBE Spectra (both Gambro BCT) مطالعه کردند. pH در حین روز صفر و 1 افزایش پیدا کرده و سپس کاهش یافت. pH در حین نگهداری در بازه قابل قبول بود و تفاوتی بین دو دستگاه نداشت (20). مطالعههای دیگری هم افزایش pH در طی روزهای اول ذخیرهسازی در فرآوردههای پلاکت فرزیس را نشان دادند (49-47).
مطالعه وانگ و همکارانش در سال 2020 بر روی فرآورده کم لکوسیت حاصل از دستگاه Trima Accel و فرآورده غیر کم لکوسیتHaemonetics MCS+ انجام شد. حداقل90% فرآوردهها طی 5 روز ذخیرهسازی pH بیشتر یا مساوی 2/6 داشتند. pH در فرآورده کم لکوسیت حاصل از Trima Accel به طور معناداری بیشتر از فرآورده غیر کم لکوسیت حاصل از MCS بود که این مطالعه میتواند نشاندهنده نقش لکوسیت در pH فرآوردههای پلاکتی باشد (34). مطالعههای مختلف نشان میدهند در اکثر فرآوردههای پلاکتی حاصل از آفرزیس، pH در محدوده قابل قبول قرار دارد و تفاوت چندانی میان pH حاصل از دستگاههای مختلف گزارش نشده است (51، 50، 39، 35).
گلوکز، لاکتات، بیکربنات، pCO2 و pO2 :
طی متابولیسم پلاکتها، گلوکز از محیط اطراف وارد پلاکتها شده، میتواند تحت گلیکولیز (مسیر غیر اکسیداتیو) در سیتوپلاسم قرار گیرد تا پیرووات و مقدار کمی ATP تولید کند. پیرووات در فسفوریلاسیون اکسیداتیو در ماتریکس میتوکندری از طریق چرخه تریکربوکسیلیک اسید شرکت میکند. چرخه اسید سیتریک، NADH+و FADH2تولید میکند که برای تولید ATP انبوه در زنجیره انتقال الکترون مصرف میشوند. طی این چرخه O2 مصرف و CO2 تولید میشود. CO2 تولید شده نیز از طریق آنزیم کربنیک انیدراز به بیکربنات تبدیل میشود. در طول ذخیرهسازی فرآوردههای پلاکتی، گلیکولیز افزایش مییابد در حالی که چرخه تریکربوکسیلیک اسید در میتوکندری سرکوب میشود. این فرآیند منجر به افزایش مصرف گلوکز و ترشح اسید لاکتیک و کاهش تولید ATP میشود. در نهایت، این تغییرات با اسیدی شدن محیط ذخیرهسازی، کاهش بقا و عملکرد پلاکتها مرتبط است (53، 52). خلاصهای از مطالعههای انجام شده در خصوص مقایسه فعالیت متابولیک در فرآوردههای پلاکت فرزیس حاصل از دستگاههای مختلف آفرزیس در جدول آورده شده است (جدول 3).
2-3- تجمع پلاکتی
پلاکتها میتوانند توسط آگونیستهای متعدد مانند کلاژن، ترومبین، اپینفرین، ریستوسیتین و ADP از طریق مسیرهای مختلف فعال شوند. آزمایش اگریگومتری نوعی آزمایش عملکرد پلاکتی است که توانایی پلاکتها را برای جمع شدن و تشکیل لختههای خونی، اندازهگیری میکند (54). خلاصهای از مطالعههای انجام شده در خصوص تفاوت تجمع پلاکت در دستگاههای مختلف آفرزیس در جدول آورده شده است (جدول 4). مطابق با این جدول، پلاکتهای حاصل از Trima Accel پاسخ بهتری به آگونیستهای پلاکتی دادند و کمترین میزان پاسخ به آگونیستها در پلاکتهای حاصل از Amicus گزارش شده است.
4-2- فعال شدن پلاکتها
مارکرهای مختلفی طی فعال شدن پلاکتها در سطح آنها ظاهر میشوند از جمله این مارکرها میتوان به P-selectin اشاره کرد. P-selectin پروتئینی است که در گرانولهای آلفا ذخیره شده است و طی فعال شدن پلاکتها به سطح آنها منتقل میشود. بیان P-selectin بر روی سطح پلاکتها یا وجود شکل محلول آن در پلاسما به عنوان نشانگر فعال شدن پلاکتها در نظر گرفته میشود. این پروتئین در اتصال پلاکت به سطوح و سلولهای دیگر نقش دارد. مارکرهای دیگری نیز جهت شناسایی فعالیت پلاکتی مورد استفاده قرار میگیرند از جمله CD63 ، CD40L ، CD69 ، Annexin V با این حال از آن جایی که P-selectin در مراحل ابتدایی فعال شدن پلاکتها بر سطح آنها به صورت پایدار ظاهر میشود، بیشتر از سایر مارکرها مورد استفاده قرار میگیرد (57). شماری از مطالعههای انجام شده در خصوص مقایسه فعال شدن پلاکتها در فرآوردههای پلاکتفرزیس حاصل از دستگاههای مختلف آفرزیس در جدول آورده شده است (جدول 5).


فرآوردههای پلاکتفرزیس در زمان آمادهسازی تحت تأثیر فرآیند تهیه آنها توسط دستگاه قرار میگیرند. طبق مطالعههایی که در جدول 5 آمده است، بیشترین میزان بیان مارکرهای فعال شدن پلاکت در فرآوردههای حاصل از آمیکوس و کمترین میزان در فرآوردههای حاصل از تریما اکسل گزارش شده است. در دستگاه آمیکوس، پلاکتهای بسیار فشرده در کیسههای کوچک در داخل سانتریفیوژ ذخیره میشوند و در طول فرآیند جداسازی در معرض نیروهای گریز از مرکز و تنش تماسی قرار میگیرند. این شرایط به علاوه تماس نزدیک با سطح پلاستیک، منجر به فعال شدن پلاکتها میشود. در مقابل، دستگاه تریما اکسل، پلاکتهای سانتریفیوژ شده بین گلبولهای قرمز و پلاسما لایهبندی میشوند و پلاسمای غنی از پلاکت جمعآوری شده به طور مداوم به کیسه ذخیرهسازی خارجی منتقل میشود. این روش ممکن است منجر به دستکاری ملایمتر و کاهش فعال شدن پلاکتها شود(62).
مطالعههای مختلف، افزایش بیان P-selectin و حضور
sP-selectin در فرآوردههای به دست آمده توسط دستگاههای پلاکت فرزیس با سانتریفیوژ جریان پیوسته (Amicus, Cobe spectra) در مقایسه با فرآوردههای حاصل از پلاکت فرزیس با سانتریفیوژ جریان متناوب(Haemonetics, Trima accel) را نشان دادهاند (64، 63). پلاکتها در دستگاههای پلاکت فرزیس با سانتریفیوژ جریان پیوسته به میزان بیشتری در معرض نیروهای فیزیکی و سطوح مصنوعی قرار میگیرند (65، 63، 19). بیان P-selectin وابسته به دستگاه، اصطلاحی است که در خصوص این فرآیند به کار برده میشود (66). همین توضیح را میتوان برای منعکس کردن تغییرات در میزان Annexin V نیز تعمیم داد.
CD40L ، عضوی از خانواده تومور نکروز فاکتور است که در مراحل انتهایی فعال شدن پلاکتها به سطح آنها منتقل میشود و متعاقباً از سطح پلاکت جدا شده و CD40L محلول (sCD40L) ایجاد میشود (67). بنابراین، افزایش سطح sCD40L نشانگر فعال شدن پلاکتها است و میتوانـد جهـت ارزیابـی فعـال شـدن پلاکــتها در
مطالعههای مختلف، افزایش بیان P-selectin و حضور
sP-selectin در فرآوردههای به دست آمده توسط دستگاههای پلاکت فرزیس با سانتریفیوژ جریان پیوسته (Amicus, Cobe spectra) در مقایسه با فرآوردههای حاصل از پلاکت فرزیس با سانتریفیوژ جریان متناوب(Haemonetics, Trima accel) را نشان دادهاند (64، 63). پلاکتها در دستگاههای پلاکت فرزیس با سانتریفیوژ جریان پیوسته به میزان بیشتری در معرض نیروهای فیزیکی و سطوح مصنوعی قرار میگیرند (65، 63، 19). بیان P-selectin وابسته به دستگاه، اصطلاحی است که در خصوص این فرآیند به کار برده میشود (66). همین توضیح را میتوان برای منعکس کردن تغییرات در میزان Annexin V نیز تعمیم داد.
CD40L ، عضوی از خانواده تومور نکروز فاکتور است که در مراحل انتهایی فعال شدن پلاکتها به سطح آنها منتقل میشود و متعاقباً از سطح پلاکت جدا شده و CD40L محلول (sCD40L) ایجاد میشود (67). بنابراین، افزایش سطح sCD40L نشانگر فعال شدن پلاکتها است و میتوانـد جهـت ارزیابـی فعـال شـدن پلاکــتها در

فرآوردههای پلاکتی مورد استفاده قرار بگیرد (69، 68). در فرآوردههای پلاکتی که با دستگاههای MCS+ ، Trima Accel و Amicus جمعآوری میشوند، میزان sCD40L را در طول ذخیرهسازی افزایش مییابد (70). مطالعه دیگری سطوح بالاتری از CD40L را در فرآوردههای حاصل از Amicus نشان داد (71). فعالشدن پلاکت ناشی از آفرزیس ممکن است برگشتپذیر باشد. لذا جهت بازگشت پلاکتها به حالت غیرفعال، پلاکتها بلافاصله پس از تهیه به مدت 1 تا 2 ساعت قبل از انتقال به آژیتاتور استراحت داده میشوند. با این حال برخی مطالعهها نشان دادند دوره استراحت بر روی بازگشت پلاکتها به حالت غیرفعال تأثیری نداشته است (72، 55).
بیان بالای CD62P در سطح پلاکتها منجر به پاکسازی سریع پلاکتها پس از تزریق به واسطه گیرنده PSGL-1 موجود بر سطح WBC از گردش خون میشود. به علاوه اتصـال بیـن پـلاکتهای فعـال شــده و WBC منجـر بـه فعالسازی WBC و ترشح سایتوکاینهای پیش التهابی مانند اینترلوکین1 و تقویت واکنشهای التهابی میشود
بیان بالای CD62P در سطح پلاکتها منجر به پاکسازی سریع پلاکتها پس از تزریق به واسطه گیرنده PSGL-1 موجود بر سطح WBC از گردش خون میشود. به علاوه اتصـال بیـن پـلاکتهای فعـال شــده و WBC منجـر بـه فعالسازی WBC و ترشح سایتوکاینهای پیش التهابی مانند اینترلوکین1 و تقویت واکنشهای التهابی میشود

بنابراین تزریق پلاکتهای فعال شده ممکن است بهطور غیر مستقیم به واکنشهای نامطلوب کمک کند (73). همچنین پلاکتهایی با محتوای فسفاتیدیل سرین (PS) بالا در غشای خارجی، میتوانند پس از انتقال خون توسط فاگوسیتهای حرفهای مجهز به گیرندههای خاص برای PS، مانند گیرندههای رفتگر کلاس B (SR-B) و CD36 و یا توسط سیستم رتیکولواندوتلیال حذف شوند (75، 74).
5-2- میکروپارتیکل پلاکتی
میکروپارتیکلها وزیکولهای کوچکی به قطر 1/0 تا 1 میکرومتر هستند که از غشای پلاسمایی سلولهای مختلف از جمله پلاکتها آزاد شده و دارای نقشهای پاتوفیزیولوژی مختلفی از جمله فعال کردن پلاکت، انعقاد، التهاب و آنژیوژنز هستند. همچنین با حمل پروتئینها، لیپیدها و اسیدهای نوکلئیک در ارتباط بین سلولی نیز دخیل هستند (76). تعداد میکروپارتیکلهای پلاکتی مرتبط با عوامل متعدد مانند گروه خون، نحوه و مدت زمان جمعآوری خون، نحوه فیلتراسیون جهت کاهش لکوسیت، دمای ذخیرهسازی و سایر عوامل است (77). حضور میکروپارتیکلها در فرآوردههای پلاکتفرزیس میتواند باعث ایجاد عارضه پس از تزریق از جمله ترومبوز، التهاب و TRALI (Transfusion Related Acute Lung Injury) گیرندگان فرآورده گردد(78).
لکوسیتها دارای آنتیژنهای HLA هستند که منجر به برانگیختن پاسخ ایمنی شده و کارآیی فرآورده تزریق شده در گیرندگان فرآورده را کاهش میدهند. هدف پلاکت فرزیس، کاهش پاسخ به HLA از طریق کاهش لکوسیت است با این حال، پلاکتهایی که عمدتاً از پلاکت فرزیس جمعآوری میشوند حاوی میکروپارتیکلهای مشتق از پلاکت و سلولهای اندوتلیالاند که دارای تراکم بالایی از آنتیژن HLA هستند. بنابراین، کاهش این میکروپارتیکلها جهت افزایش کیفیت فرآوردههای حاصل از پلاکتفرزیس در آفرزیس ضروری است (79). میکروپارتیکلها به عنوان یک شاخص کیفیت فرآوردههای حاصل از پلاکت فرزیس میتوانند برای تخمین آسیبهایی در طی آمادهسازی و ذخیرهسازی ایجاد شده، استفاده شوند (80).
دو عامل مؤثر بر میکروپارتیکل پلاکتی در فرآوردههای حاصل از پلاکتفرزیس مشخص شده است: متغیرهای مربـوط به اهدا کننده (تعداد پلاکت، Mean Platelet) (MPV Volume، میزان کلسترول خون) و متغیرهای مربوط
به آفرزیس (82، 81).
خلاصهای از مطالعههای انجام شده در خصوص مقایسه
مقادیر میکروپارتیکل در فرآورده پلاکتفرزیس حاصل از دستگاههای مختلف در جدول قابل مشاهده است (جدول 6).
مطابق با آن چه در جدول 6 قابل مشاهده است در اکثر مطالعهها فرآوردههای پلاکت فرزیس حاصل از دستگاه Amicus بیشترین میزان میکروپارتیکل و فرآوردههای پلاکت فرزیس حاصل از Trima Accel کمترین میزان میکروپارتیکل را دارا بودند.
بحث
در این مطالعه شاخصهای کیفی و عملکردی فرآوردههای پلاکتی از جمله شمارش سلولی، تغییرات متابولیک، تجمع پلاکتی، فعال شدن پلاکتها و تعداد میکروپارتیکل پلاکتی در فرآوردههای حاصل از دستگاههای مختلف آفرزیس مورد ارزیابی قرار گرفت. مطابق با اکثر مطالعههای انجام شده، شمارش سلولی در دستگاههای مختلف تفاوت معناداری با یکدیگر نداشت و در حال حاضر دستگاههای موجود در بازار قادر هستند فرآورده پلاکتی مطابق با استاندارهای بینالمللی را فراهم کنند. اگر چه فرآوردههای حاصل از پلاکت فرزیس تعداد گلبولهای سفید کمتری نسبت به فرآوردههای حاصل از خون کامل دارند، اما تنها دستگاههایی که دارای برنامه کاهش لکوسیت هستند میتوانند فرآورده کم لکوسیت تولید کنند (37-33).
فعالیت متابولیک پلاکتهای آفرزیس عمدتاً با استفاده از pH ، pCO2 ، pO2 ، گلوکز و لاکتات تعیین میشود. در اکثر مطالعهها گلوکز و pO2 کاهش، لاکتات و pCO2 افزایش یافت و pH در محدوده قابلقبول قرار داشت با این حال این تغییرات به گونهای نبود که آسیبی به پلاکتها وارد نماید. میزان گلوکز موجود در ماده نگهدارنده فرآورده
پلاکتی دستگاههای مختلف میتواند یکی از علل تفاوت در میزان گلوکز و لاکتات فرآورده دستگاههای مختلف باشد. همچنین عوامل موثر در تسهیل تبادل گاز در فرآوردهها از جمله جنس کیسه میتواند بر تغییرات متابولیک تاثیرگذار باشد. در این خصوص برخی مطالعهها تفاوت معناداری در بین فرآوردههای دستگاههای مختلف نشان دادند و برخی تفاوت معناداری گزارش نکردند (32، 28، 20، 19).
بررسی تجمع پلاکتی یکی از آزمایشهای رایج جهت سنجش عملکرد پلاکتها است که به وسیله آگونیستهای مختلف انجام میگیرد. مطابق مطالعههای مختلف در جدول 4 در پاسخ تجمع پلاکتی با آگونیستهای مختلف، فرآورده حاصل از دستگاه Amicus کمترین و Trima بیشترین پاسخ را دارا بودند (56، 55، 34، 27).
طبق مقالههای بررسی شده تهیه فرآورده پلاکتی با دستگاههای مختلف میتواند بر فعال شدن پلاکتها تأثیرگذار باشد به این طریق که میزان فعال شدن پلاکت و تولید میکروپارتیکل پلاکتی در فرآورده پلاکتی Amicus بالاتر از سایر دستگاهها گزارش شد و کمترین میزان متعلق به فرآورده پلاکتی حاصل از Trima بود (61، 60، 55، 46، 39، 28).
نتیجهگیری
طبق مقالههای ارزیابی شده در این مطالعه، بیشترین میزان تأثیر دستگاه بر فعال شدن پلاکتها متعلق به Amicus و کمترین میزان متعلق به دستگاه Trima است. بنابراین دستگاه Trima قادر است فرآوردهی پلاکت با کیفیت بالاتری نسبت به سایر دستگاهها تهیه نماید.
نقش نویسندگان
سمانه صادقی نیسیانی: نگارش مقاله
دکتر صدیقه امینی کافیآباد: ایده مقاله و نظارت بر نگارش مقاله
نوع مطالعه: مروري |
موضوع مقاله:
طب انتقال خون
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






