جلد 20، شماره 4 - ( زمستان 1402 )
جلد 20 شماره 4 صفحات 275-267 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Tasbiti Z, Dadashi M, Chegini A, Zadsar M. Association of HLA-DR polymorphisms and Febrile Non-Hemolytic Transfusion Reaction in multi-transfused thalassemia patients. bloodj 2023; 20 (4) :267-275
URL: http://bloodjournal.ir/article-1-1512-fa.html
URL: http://bloodjournal.ir/article-1-1512-fa.html
تثبیتی زینب، داداشی مریم سادات، چگینی آزیتا، زادسر مریم. ارتباط پلی مورفیسم درآلل های HLA-DR و بروز عارضه تب زای غیرهمولیتیک در بیماران تالاسمی دارای تزریق خون مکرر. فصلنامه پژوهشی خون. 1402; 20 (4) :267-275
دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
واژههای کلیدی: کلمات کلیدی: واکنش تبزای غیر همولیتیک، تزریق خون، پلیمورفیسم (ژنتیک)، HLA-DR، تالاسمی
متن کامل [PDF 426 kb]
(685 دریافت)
| چکیده (HTML) (2074 مشاهده)
مقدمه
تزریق خون و فرآوردههای خونی باید عاقلانه و با تشخیص صحیح تجویز شود زیرا علاوه بر این که نجاتدهنده زندگی است، میتواند به علت بروز واکنشهای ناشی از تزریق خون کشنده هم باشد (1). واکنشهای تبزای غیر همولیتیک (FNHTR) و واکنشهای آلرژیک از جمله واکنشهای حاد ناشی از انتقال خون بوده و از بالاترین شیوع برخوردار هستند و میتوانند برای بیمار بسیار آزاردهنده باشند (2). FNHTR معمولاً به صورت افزایش دمای بدن به بیش از 1 درجه سانتیگراد و یا 2 درجه فارنهایت نسبت به حالت پایه با یا بدون لرز (chills)، سرگیجه (rigors)، سردرد (headache)، افزایش تعداد تنفس (تاکیپنه)، تغییر در فشار خون و اضطراب مشاهده میشود. در بعضی موارد ممکن است بیمار تب نداشته باشد، اما یک یا چند علامت دیگر مشاهده گردد.
ناسازگاری HLA میتواند منجر به ایجاد آنتیبادی ضد لکوسیت انسانی در گیرنده فرآورده خونی شود که مسئول طیف وسیعی از واکنشهای ایمونولوژیک مانند مقاومت به تزریق پلاکت (PTR)، آسیب حاد ریوی مرتبط با تزریق خون (TRALI)، بیماری پیوند علیه میزبان مرتبط با تزریق خون (TA-GVHD) و هم چنین FNHTR میباشد. آنتیبادی ضد HLA پس از تزریق خونهای مکرر در بیماران و یا پس از چندین بارداری در زنان تولید میشود و زمانی که تزریق خون مجدد صورت پذیرد، آنتیبادیهای ضد HLA با لکوسیتها و پلاکتهای تزریقشده واکنش داده و منجر به تجزیه و آزادسازی مدیاتورهای تبزا از لکوسیتها و پلاکتها شده و FNHTR بروز پیدا میکند (3).
سیستم HLA مجموعهای از ژنهایی واقع بر کروموزوم 6 بوده که پروتئینهای اصلی کمپلکس سازگار بافتی اصلی (MHC) را کد میکند. مولکولهای MHC شامل دو کلاس اصلی میباشد. MHC کلاس یک که تقریباً بر روی همه سلولهای سروماتیک بدن و MHC کلاس دو که بر سطح گروهی از سلولهای ایمنی از جمله B سل، T سل فعال شده، ماکروفاژها و دندریتیک سل ها بیان میشوند (4). ناحیه MHC Class II شامل سه لوکوس DP ، DQ و DR بوده و هر کدام از این لوکوسها سری A و B داشته و زنجیرههای آلفا و بتا را کد میکنند. 5 هاپلوتایپ برای لوکوس HLA-DR وجود دارد و HLA-DRB1 پلیمورفیکترین لوکوس میباشد (5). سیستم HLA-DRB1 نقش حیاتی در سیستم ایمنی در رابطه با عرضه آنتیژنها به سلولهای T و تولید آنتیبادی از طریق پلاسما سلها ایفا میکند (6). آللهای خاص HLA-DR با افزایش خطر ابتلا به برخی بیماریها مرتبط است (4). برای مثال، آللهای HLA-DRB1 با بیماریهای خود ایمنی مانند آرتریت روماتوئید و لوپوس اریتماتوز سیستمیک مرتبط هستند (7). مطالعههای متعددی حاکی از ارتباط پلیمورفیسمهای HLA و آلوایمونیزاسیون به دنبال تزریق خون مکرر در بیماران تالاسمی و آنمی داسی شکل بوده است (8).
میزان بروز و شدت عوارض تزریق خون در همه بیماران یکسان نبوده و متفاوت است. یکی از دلایل مهم این تفاوت، بروز تفاوت در ویژگیهای ژنتیکی بیماران است. بررسی مطالعههای قبلی که درخصوص میزان شیوع آللهای HLA-DR در جامعه طبیعی ایرانی بوده است نشان داد که آلل HLA-DRB1*11 شایعترین آلل در جامعه ایرانی میباشد (10، 9). با توجه به عدم وجود گزارش منتشر شده از فراوانی آللهای HLA-DR در بیماران تالاسمی مولتی ترنسفیوز ایرانی که مبتلا به عارضه FNHTR بودهاند، لذا فراوانی آللهای این سیستم به روش PCR-SSP در 88 نفر بیمار تالاسمی مولتیترنسفیوز مورد بررسی قرار گرفت و با مطالعههای انجام شده در جامعه طبیعی ایرانی مقایسه شد.
مواد و روشها
مطالعه حاضر یک مطالعه مقطعی- تحلیلی در سال 1402 بوده و از 88 بیمار تالاسمی با تزریق خون مکرر مراجعهکننده به درمانگاه تالاسمی بزرگسالان ظفر تهران، مقدار 6 میلیلیتر خون در لوله حاوی ضد انعقاد EDTA گرفته شد. قبل از نمونهگیری از بیماران خواسته شد تا فرم رضایتنامه را پر کنند. به منظور ارزیابی بهتر، بیماران در دو گروه بررسی شدند. گروه اول شامل 70 بیمار تالاسمی که سابقه بروز عارضه FNHTR داشتند و گروه دوم 18 بیمار تالاسمی که سابقه بروز هیچگونه واکنش ناشی از تزریق خون را نداشتند. اطلاعات موردنیاز از قبیل سن، جنس، سن شروع تزریق خون و تعداد دفعات تزریق خون در طول یک سال ثبت گردید. این مطالعه مورد تائید کمیته اخلاق مؤسسه طب انتقال خون با کد اخلاق IR.TMI.REC.1402.002 میباشد.
روش مولکولی:
استخراج DNA: بعد از نمونهگیری و انتقال نمونهها به آزمایشگاه، استخراج DNA با استفاده از کیت تجاری FAVORGEN طبق بروشور کیت صورت پذیرفت. به طور خلاصه داخل یک میکروتیوب 200 میکرولیتر از نمونه خون با 20 میکرولیتر پروتئیناز K و 200 میکرولیتر بافر FABG با استفاده از ورتکس کاملاً مخلوط گشت. میکروتیوب به منظور لیز شدن نمونه خون به مدت 15 دقیقه در 60 درجه سانتیگراد انکوبه شده و پس از سانتریفیوژ مختصر، 200 میکرولیتر اتانول (100% - 96%) به نمونه اضافه شد. یک مینیستون FABG درون یک لوله جمعآوری قرار داده شده و مخلوط نمونه به درون مینیستون انتقال داده شد. پس از سانتریفیوژ سریع، مینیستون درون یک لوله جمعآوری جدید گذاشته شد. مینیستون با استفاده از 400 میکرولیتر از بافر W1 و سپس 750 میکرولیتر بافر شستشو شسته شده و مایع دور ریخته شد. با اضافه کردن بین 50 تا 200 میکرولیتر بافر شستشـوی گـرم شده و یا (0/9-5/7 pH=) ddH2O به مرکز غشای مینیستون و سپس سانتریفیوژ با بالاترین دور، تمام DNA از مینیستون خارج شد. سپس بهمنظور ارزیابی کیفیت DNA استخراجشده، جذب نوری DNA در طول موجهای 260 و 280 نانومتر خوانش شد.
روش PCR-SSP :
حجم کلی محتوای واکنش 30 میکرولیتـر (شامـل 8/16 میکرولیتر آب مقطـر، 4/8 میکرولیتر مخلوط Ready PCR ،
2/2 میکرولیتر آنزیمTaq Polymerase و 6/2 میکرولیتر نمونه DNA) بوده که پس از آمادهسازی به میزان 10 میکرولیتر در چاهکهای بلوک PCR ریخته شد. سپس با استفاده از کاور روی استریپها پوشانده شده و داخل دستگاه ترموسایکلر قرار گرفته و طبق برنامه زیر دستگاه ران شده است: یک چرخه در 96 درجه سانتیگراد به مدت دو دقیقه، 10 چرخه (15 ثانیه در 96 درجه سانتیگراد و 60 ثانیه در 65 درجه سانتیگراد) و 20 چرخه (15 ثانیه در 96 درجه سانتیگراد و 50 ثانیه در 61 درجه سانتیگراد و 30 ثانیه در 72 درجه سانتیگراد) و درنهایت چرخه در 4 درجه سانتیگراد پایان یافت.
الکتروفورز:
درنهایت محصولات حاصل از PCR ، بر روی ژل آگارز 2 درصد حاوی رنگ DNA Safe Stain با ولتاژ 120 تا 150 ولت به مدت 30 دقیقه ران شده و سپس باندها زیر دستگاه UV-Trans laminator و در طول موج 312 نانومتر مشاهده گشت.
تجزیه و تحلیل دادهها:
تمام محاسبات و تجزیهو تحلیلهای آماری توسط نرمافزار 24 IBM SPSS Statistics انجام شده و به منظور بررسی رابطه بین دو متغیر کیفی، آزمون کایدو مورد استفاده قرار گرفت.
یافتهها
مجموع 88 بیمار تالاسمی بهطور تصادفی انتخاب و وارد مطالعه شدند که شامل 35 مرد (8/39%) و 53 زن (2/60%) با میانگین سنی 28/11 ± 63/38 سال و در محـدوده 75-22 سال بودند. در بیماران این مطالعه میانگیـن سـن شروع تزریق 13/12 ± 94/5 سال بود. هم چنین تعداد تزریق در سال به طور میانگین در بیماران 74/13 ± 25/22 واحد در سال بود. 88 بیمار تالاسمی بر اساس بروز واکنش FNHTR ، در دو گـروه با و بدون FNHTR وارد مطالعه شدنـد.70 بیمار FNHTR بـا 18 بیمـار کـه هیـچ گونـه عارضـهای نداشتند مقایسه شدند.
میانگین سنی تقریباً 62/11 ± 41/38 سال در گروه FNHTR و 10/10 ± 44/39 سال در گروه بدون FNHTR بود. همچنین نسبت جنسیتی در گروه FNHTR به صورت 7/35% مرد و 3/64% زن و در گروه بدون FNHTR 6/55% مرد و 4/44% زن، میانگین سن شروع تزریق در گروه FNHTR 66/12 ± 1/6 سال و در گروه بدون FNHTR 08/10 ± 31/5 سال، میانگین تعداد تزریق در هر سال 65/14 ± 23/22 واحد در گروه FNHTR و 76/9 ± 33/22 واحد در گروه بدون FNHTR بود. از نظر
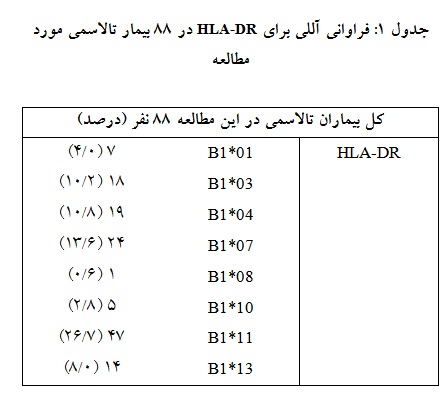
نوع تالاسمی نیز 3/83% در گروه بدون FNHTR و 6/88% در گروه FNHTR ، تالاسمی ماژور و 7/16% در گروه بدون FNHTR و 42/11% در گروه FNHTR تالاسمی اینترمدیا بودند. مقایسهها نشان داد دو گروه از نظر عوامل دموگرافیک و موقعیتهای بالینی یکسان بوده و تفاوت معناداری بین دو گروه دیده نشده است. با مقایسه نتایج به دست آمده مشخص شد که آلل HLA-DRB1*11 با درصد فراوانی 7/26% بیشترین فراوانی را در جمعیت تالاسمی مورد مطالعه دارد (جدول 1). فراوانی سایر آللها HLA-DRB1*07 (6/13%)، HLA-DRB1*04 (8/10%)، HLA-DRB1*3 (2/10%) به ترتیب در رتبههای دوم تا چهارم قرار دارد. از طرفی مشخص شد که آلل HLA-DRB1*08 با درصد فراوانی 6/0% دارای کمترین شیوع در جمعیت تالاسمی مورد مطالعه میباشد.
همچنین با مقایسه نتایج به دست آمده مشخص شد که توزیع فراوانی آلل HLA-DRB1*10 (992/0-026/0 CI 95% ، 159/0 OR=) ارتباط منفی با بروز FNHTR در جمعیت تالاسمی ایرانی دارد (049/0 p=). در گروه بدون FNHTR ، 10 آلل HLA-DR و در گروه FNHTR ، 11 آلل شناسایی شد.
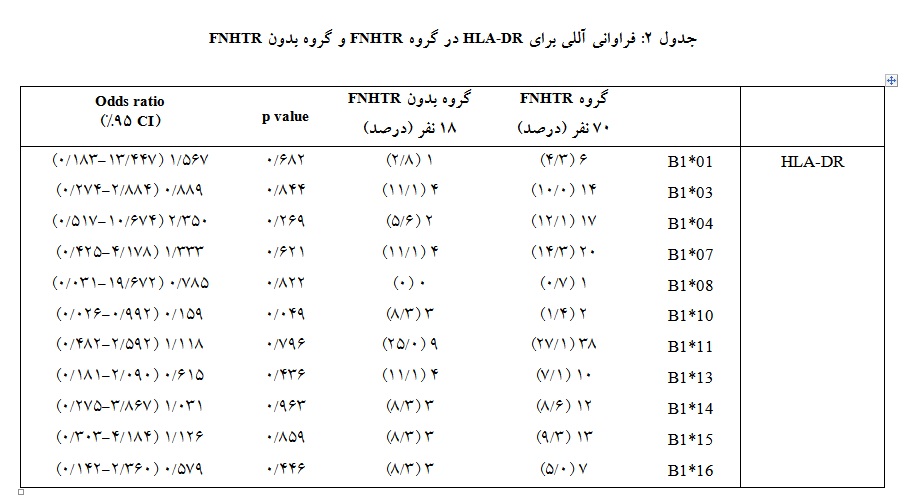
اطلاعات نشان میدهد که بیشترین و کمترین فراوانی HLA-DR در گروه بدون FNHTR مربوط به HLA-DRB1*11 و HLA-DRB1*01 بوده که به ترتیب 25% و 8/2% میباشـــد. در گروه FNHTR نیز HLA-DRB1*11 و HLA-DRB1*08 با درصدهای 1/27% و 7/0% به ترتیب بیشترین و کمترین شیوع را داشتهاند (جدول 2).
در گروه FNHTR فراوانی بالاتری از آللهای HLA-DRB1*01 (3/4% در مقابل 8/2%)، HLA-DRB1*04 (1/12% در مقابل 6/5%)، HLA-DRB1*07 (3/14% در مقابل 1/11%)، HLA-DRB1*08 (7/0% در مقابل 0%)، HLA-DRB1*11 (1/27% در مقابل 0/25%)، HLA-DRB1*14 (6/8% در مقابل 3/8%)، HLA-DRB1*15 (3/9% در مقابل 3/8%) نسبت به گروه بدون FNHTR مشاهده شده است. علاوه بر این، فراوانی HLA-DRB1*03 (0/10% در مقابل 1/11%)، HLA-DRB1*10 (4/1% در مقابل 3/8%)، HLA-DRB1*13 (1/7% در مقابل 1/11%)، HLA-DRB1*16 (0/5% در مقابل 3/8%)، در گروه FNHTR نسبت به گروه بدون FNHTR کاهش یافت.
بحث
مطالعه حاضر که در مورد پلیمورفیسم در آللهای HLA-DR و ارتباط آن با واکنش تبزای غیرهمولیتیک (FNHTR) در بیماران تالاسمی بود، نشان داد که هیچ رابطه مثبتی در ارتباط پلیمورفیسم در آللهای HLA-DR و بروز FNHTR در بیماران تالاسمی ایرانی وجود نداشته ولیکن احتمال نقش محافظتی آلل HLA-DRB1*10 در بروز FNHTR در این بیماران وجود دارد (049/0 p=). بیشترین فراوانی آلل HLA-DR در این مطالعه HLA-DRB1*11 با درصد فراوانی 7/26% در 88 نفر جمعیت مورد مطالعه و همچنین 1/27% در جمعیت گروه FNHTR و 25% در جمعیت بدون FNHTR بوده است. با توجه به نتایج مطالعه حاضر، درصد فراوانی آللهای HLA-DR در جمعیت مورد مطالعه به ترتیب فراوانی بدین صورت بود:
(7/26%) HLA-DRB1*11 ، (6/13%) HLA-DRB1*07 ، (8/10%) HLA-DRB1*04 ، (2/10%) HLA-DRB1*03 ، (1/9%) HLA-DRB1*15 ، (5/8%) HLA-DRB1*14 ، (8/0%) HLA-DRB1*13 ، (7/5%) HLA-DRB1*16 ، (4%) HLA-DRB1*01 ، (8/2%) HLA-DRB1*10 و (6/0%) HLA-DRB1*08 .
بر اساس مطالعههای گذشته در جمعیتهای ایرانی فراوانترین آلل HLA-DRB1*11 بوده است (11). الگوی فراوانی HLA-DRB1*11 در بیماران تالاسمی ایرانــی مورد مطالعه بسیار شبیه به جمعیت طبیعی و اهداکنندگان ایرانی بوده و تفاوت معناداری در فراوانی HLA-DRB1*11 بین جامعه طبیعی و بیماران تالاسمی وجود ندارد، بهجز مطالعهای بر روی قوم بلوچ که نشان داد شایعترین آلل در آنها HLA-DRB1*03 میباشد (12).
ژن HLA بسیار پلیمورفیک بوده و همین امر باعث تنوع ژنتیکی سیستم ایمنی میزبان و به دنبال آن پاسخهای متفاوت به عفونت یکسان میگردد (14، 13). در همین راستا محققان در بیرمنگهام به نقش HLA-DR3 در افزایش خطر ابتلا به بیماری گریوز و تیروئیدیت هاشیموتو دست یافتند درحالیکه HLA-DR7 دارای نقش محافظتی در ابتلا به این بیماریها بود (15). مطالعهای در چین توسط ونگ و همکارانش نشاندهنده ارتباط HLA-DRB1*14:04 و HLA-DQA1*01:01 با شدت بیماری کووید-19 و در مقابل نقش محافظتی HLA-DPB1*03:01 و HLA-DRB1*12:01 در برابر ابتلا به فرم شدید بیماری بود (16). در حالیکه در ژاپن محققان به ارتباط مثبت HLA-DRB1*09:01 با شدت بیماری اشاره کردهاند (17). مطالعه دیگری در ایتالیا بیان کننده ارتباط HLA-DRB1*08:01 با شدت بیماری و نقش محافظی HLA-B*58:01، HLA-DRB1*03:01 و HLA-A*02:05 در برابر شدت علائم بالینی بیماری کووید-19 بود. بر اساس مطالعه داداشی و همکاران و هم چنین سایر مطالعهها در جمعیت ایرانی، HLA-A*24 و HLA-B*55 ممکن است نقش محافظتی در بروز FNHTR در بیماران بتاتالاسمی ایرانی داشته باشند (19، 18).
بهطور کلی، توزیع پلیمورفیسمهای HLA-DR در بیماران تالاسمی با آن چه در مطالعههای قبلی در جمعیتهای مختلف ایرانی پیدا شده بــود، مطابقت داشت.
در مطالعهای که نیکبین و همکارانش در سال 2017 بر روی جمعیت اهداکننده استان یزد داشتند، فراوانی آللها بدین شرح بوده است: HLA-DRB1*11 (4/24%)، HLA-DRB1*15 (3/13%)، HLA-DRB1*07 (3/13%)، HLA-DRB1*13 (0/10%)، HLA-DRB1*01 (8/8%)، HLA-DRB1*03 (8/8%)، HLA-DRB1*04 (22/7%)، HLA-DRB1*14 (4/4%)، HLA-DRB1*08 (8/3%)، HLA-DRB1*10 (7/2%)،HLA-DRB1*16 (2/2%)، HLA-DRB1*09 (05/0%)(20).
عرب و همکارانش در سال 2018 با مطالعه جمعیت اهداکننده گیلک، فراوانی آللهای HLA-DR را بدین شرح گزارش کردند: HLA-DRB1*11 (1/14%)، HLA-DRB1*01 (5/13%)، HLA-DRB1*04. (8/11%)، HLA-DRB1*14 (2/11%)، HLA-DRB1*15 (0/10%)، HLA-DRB1*03 (4/9%)، HLA-DRB1*16 (6/7%)، HLA-DRB1*07. (5/6%)، HLA-DRB*10 (5/6%)، HLA-DRB1*13 (3/5%)،HLA-DRB1*13 (5/3%) و کمترین فراوانی نیز متعلق به HLA-DRB1*08 (06/0%) بوده است که در مطالعه حاضر نیز HLA-DRB1*08 کمترین شیوع را داشته است (21). اسماعیلی و همکـاران نیز در سال 2017 فراوانی آللهای HLADRB1 را در جمعیت طبیعی مشهد به شرح زیر گـزارش کردهاند: HLA-DRB1*16 (0/20%)، HLA-DRB1*13 (2/16%)، HLA-DRB1*11 (15/0%)، HLA-DRB1*07 (15/0%) (22).
ایران ازنظر نژادی کشوری متنوع بوده و شامل نژادهای مختلفی ازجمله فارس، ترک، کرد، عرب، ترکمن، لر و بلوچ میباشد. بر خلاف این که شایعترین آلل رایج در جمعیت ایران HLA-DRB1*11 میباشد، مطالعه بر روی قوم بلوچ حاکی از شیوع بیشتر آلل HLA-DRB1*03 (29%) بود که بیانکننده قرابت ژنتیکی بین جمعیت بلوچ در ایران و بلوچها و براهوییهای پاکستان است (12). با توجه به این که فراوانی آللهای HLA-DR بیماران تالاسمی در مطالعه حاضر مشابه جمعیت طبیعی و اهداکنندگان ایرانی است، لذا میتوانیم میزان شیوع آللها را با مطالعههای صـورت گـرفته در کشـورهـای دیگر نیز مقایسه کنیم.
مطالعههای متعددی در زمینه شیوع آللهای مختلف HLA-DR در کشورهای دیگر صورت گرفته است. محققان در دانمارک با مطالعه ارتباط پلیمورفیسمهای HLA-DRB1 با سقط مکرر بارداری، فراوانی آللهای HLA-DRB1 در جمعیت طبیعی را به ترتیب زیر گزارش کردهاند: HLA-DRB1*15 با درصد فراوانی 52/17%، HLA-DRB1*04 با 36/16%، HLA-DRB1*13 با 75/13% در رتبههای اول تا سوم قرار داشتند(22). فراوانی آللهای HLA-DRB1 سال 2016 در سوریه به ترتیب HLA-DRB1*11 (4/26%)، HLA-DRB1*04 (14%) و HLA-DRB1*04 (12%) بوده است (23). در فرانسه نیز فراوانترین آللها در جمعیت طبیعی اهداکنندگان سلولهای بنیادی به صورت HLA-DRB1*13 (1/14%)، B1*07 (5/13%)، B1*11 (2/13%) و B1*15 (0/13%) گزارش شده است (24).
نتیجهگیری
در مطالعه حاضر در خصوص فراوانی آللهای HLA-DR نهتنها تفاوت آماری معناداری در بیماران تالاسمی مبتلا به FNHTR و گروه بدون FNHTR نشان نداد، بلکه مشابه با اهداکنندگان ایرانی بود. بیشترین فراوانی آللی مربوط به HLA-DRB1*11 و کمترین نیز مربوط به HLA-DRB1*08 بوده است. همچنین در این مطالعه، ارتباط منفی بین آلل HLA-DRB1*10 و وقوع FNHTR یافت شده است. بهعبارتدیگر، فراوانی آلل HLA-DRB1*10 گروه FNHTR پایینتر بوده است، اگرچه تائید این ارتباط احتمالی نیازمند بررسیهای دقیقتر با گروه کنترل بزرگتر میباشد تا بتوان بهصورت دقیقتر اعلام کرد که آلل مذکور سیستم HLA به عنوان یک فاکتور محافظتی بالقوه در برابر FNHTR در جمعیت تالاسمی ایران ایفای نقش میکنند.
حمایت مالی
این مطالعه با حمایت مالی مؤسسه عالی آموزشی و پژوهشی طب انتقال خون انجام شده است.
ملاحظات اخلاقی
این مطالعه دارای کد اخلاق IR.TMI.REC.1402.002 از مـؤسسـه عـالی آمـوزشی و پـژوهشی طـب انتقــال خون
میباشد.
عدم تعارض منافع
نویسندگان اظهار کردند در انتشار این اثر منافع تجاری نداشتند و در مقابل ارائه اثر وجهی دریافت نکردهاند.
نقش نویسندگان
زینب تثبیتی: انجام آزمایشها و تحلیل آنها و هم چنین تجزیه و تحلیلهای آماری و نگارش اولیه مقاله
دکتر مریم سادات داداشی: ناظر انجام آزمایشها و صحت خوانش نتایج تستها و تحلیل آنها، تحلیلهای آماری و نگارش بخش یافتهها
دکتر آزیتا چگینی: همکاری در نوشتن پروپوزال، پژوهش و نگارش آن و همکاری در نگارش پیشنویس مقاله
دکتر مریم زادسر: نویسنده مسئول و محقق اصلی پژوهش، ارائه دهنده طرح اولیه پژوهش، ناظر انجام
تحقیق و ادیت نهایی مقاله
تشکر و قدردانی
این مطالعه قسمتی از پایاننامه دانشجویی دوره کارشناسی ارشد رشته خونشناسی و بانک خون مؤسسه عالی آموزشی و پژوهشی طب انتقال خون بوده و همه مراحل عملی پروژه در آزمایشگاه مرکز تحقیقات سازمان انتقال خون انجام شده است. از همکاران مرکز تحقیقات سازمان انتقال خون و بخش تالاسمی مرکز تالاسمی بزرگسالان ظفر که همکاری صمیمانه در این تحقیق داشتند و هم چنین خانم دکتر آزیتا آذرکیوان برای انتخاب بیماران FNHTR سپاسگزاریم. هم چنین از زحمات دکتر مریم سادات داداشی و بنیامین رحمتی در کمک به جمعآوری نمونه بیماران کمال تشکر را داریم.
متن کامل: (681 مشاهده)
ارتباط پلیمورفیسم درآللهای HLA-DR و بروز عارضه تبزای غیرهمولیتیک
در بیماران تالاسمی دارای تزریق خون مکرر
زینب تثبیتی1، مریم سادات داداشی2، آزیتا چگینی3، مریم زادسر4
چکیده
سابقه و هدف
بیماران بتاتالاسمی نیازمند تزریق خون منظم هستند. واکنش تبزای غیرهمولیتیک یا FNHTR شایعترین واکنش ناشی از تزریق خون میباشد. یکی از دلایل بروز FNHTR ، آنتیبادی ضد آنتیژنهای لکوسیتی کلاس دو است. پلیمورفیسمهای HLA در جوامع مختلف متفاوت بوده و میتواند در بروز و یا مقاومت به FNHTR نقش داشته باشد. در مطالعه حاضر، به بررسی ارتباط پلیمورفیسم در آللهای HLA-DR با بروز FNHTR در بیماران بتاتالاسمی با تزریق خون مکرر استان تهران پرداختیم.
مواد و روشها
در مطالعه مقطعی- تحلیلی حاضر، 88 بیمار بتا تالاسمی ماژور و اینترمدیا با میانگین سنی 28/11 ± 63/38 سال و نسبت 35 مرد (8/39%) و 53 زن (2/60%) وارد مطالعه شده و جهت نتیجه بهتر، 70 بیمار تالاسمی با بروز FNHTR با 18 بیمار تالاسمی که بروز FNHTR نداشتند، مقایسه شدند. ژنوتیپ HLA-DR بیماران با روش PCR-SSP بررسی شد. مقایسهها با آزمون کایدو و پیرسون انجام شد.
یافتهها
بررسی آللهای HLA-DRB1 نشان داد که آلل HLA-DRB1*11 بیشترین شیوع (7/26%) را دارد. ارتباط آماری معناداری بین آللهای HLA-DR با بروز FNHTR مشاهده نشد. اگر چه ممکن است HLA-DRB1*10 به عنوان یک مارکر ژنتیکی احتمالی در محافظت از بروز FNHTR نقش داشته باشد (049/0 p=).
نتیجه گیری
در این مطالعه، ارتباطی بین فراوانی آللهای HLA-DR با بروز واکنش FNHTR در بیماران بتاتالاسمی با تزریق خون مکرر مشاهده نشد، درخصوص HLA-DRB1*10 این ارتباط معنادار بوده و میتواند آلل محافظتکننده باشد. بررسی سطح آللی HLA کلاس II در جمعیتهای بزرگتر میتواند دادههای عمیقتری را در مورد این ارتباط نشان دهند.
کلمات کلیدی: واکنش تبزای غیر همولیتیک، تزریق خون، پلیمورفیسم (ژنتیک)، HLA-DR ، تالاسمی
تاریخ دریافت: 17/07/1402
تاریخ پذیرش : 13/08/1402
1- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- دکترای خونشناسی آزمایشگاهی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- متخصص بیهوشی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- مؤلف مسئول: متخصص بیماریهای عفونی و گرمسیری ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
در بیماران تالاسمی دارای تزریق خون مکرر
زینب تثبیتی1، مریم سادات داداشی2، آزیتا چگینی3، مریم زادسر4
چکیده
سابقه و هدف
بیماران بتاتالاسمی نیازمند تزریق خون منظم هستند. واکنش تبزای غیرهمولیتیک یا FNHTR شایعترین واکنش ناشی از تزریق خون میباشد. یکی از دلایل بروز FNHTR ، آنتیبادی ضد آنتیژنهای لکوسیتی کلاس دو است. پلیمورفیسمهای HLA در جوامع مختلف متفاوت بوده و میتواند در بروز و یا مقاومت به FNHTR نقش داشته باشد. در مطالعه حاضر، به بررسی ارتباط پلیمورفیسم در آللهای HLA-DR با بروز FNHTR در بیماران بتاتالاسمی با تزریق خون مکرر استان تهران پرداختیم.
مواد و روشها
در مطالعه مقطعی- تحلیلی حاضر، 88 بیمار بتا تالاسمی ماژور و اینترمدیا با میانگین سنی 28/11 ± 63/38 سال و نسبت 35 مرد (8/39%) و 53 زن (2/60%) وارد مطالعه شده و جهت نتیجه بهتر، 70 بیمار تالاسمی با بروز FNHTR با 18 بیمار تالاسمی که بروز FNHTR نداشتند، مقایسه شدند. ژنوتیپ HLA-DR بیماران با روش PCR-SSP بررسی شد. مقایسهها با آزمون کایدو و پیرسون انجام شد.
یافتهها
بررسی آللهای HLA-DRB1 نشان داد که آلل HLA-DRB1*11 بیشترین شیوع (7/26%) را دارد. ارتباط آماری معناداری بین آللهای HLA-DR با بروز FNHTR مشاهده نشد. اگر چه ممکن است HLA-DRB1*10 به عنوان یک مارکر ژنتیکی احتمالی در محافظت از بروز FNHTR نقش داشته باشد (049/0 p=).
نتیجه گیری
در این مطالعه، ارتباطی بین فراوانی آللهای HLA-DR با بروز واکنش FNHTR در بیماران بتاتالاسمی با تزریق خون مکرر مشاهده نشد، درخصوص HLA-DRB1*10 این ارتباط معنادار بوده و میتواند آلل محافظتکننده باشد. بررسی سطح آللی HLA کلاس II در جمعیتهای بزرگتر میتواند دادههای عمیقتری را در مورد این ارتباط نشان دهند.
کلمات کلیدی: واکنش تبزای غیر همولیتیک، تزریق خون، پلیمورفیسم (ژنتیک)، HLA-DR ، تالاسمی
تاریخ دریافت: 17/07/1402
تاریخ پذیرش : 13/08/1402
1- کارشناس ارشد خونشناسی آزمایشگاهی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- دکترای خونشناسی آزمایشگاهی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- متخصص بیهوشی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- مؤلف مسئول: متخصص بیماریهای عفونی و گرمسیری ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
تزریق خون و فرآوردههای خونی باید عاقلانه و با تشخیص صحیح تجویز شود زیرا علاوه بر این که نجاتدهنده زندگی است، میتواند به علت بروز واکنشهای ناشی از تزریق خون کشنده هم باشد (1). واکنشهای تبزای غیر همولیتیک (FNHTR) و واکنشهای آلرژیک از جمله واکنشهای حاد ناشی از انتقال خون بوده و از بالاترین شیوع برخوردار هستند و میتوانند برای بیمار بسیار آزاردهنده باشند (2). FNHTR معمولاً به صورت افزایش دمای بدن به بیش از 1 درجه سانتیگراد و یا 2 درجه فارنهایت نسبت به حالت پایه با یا بدون لرز (chills)، سرگیجه (rigors)، سردرد (headache)، افزایش تعداد تنفس (تاکیپنه)، تغییر در فشار خون و اضطراب مشاهده میشود. در بعضی موارد ممکن است بیمار تب نداشته باشد، اما یک یا چند علامت دیگر مشاهده گردد.
ناسازگاری HLA میتواند منجر به ایجاد آنتیبادی ضد لکوسیت انسانی در گیرنده فرآورده خونی شود که مسئول طیف وسیعی از واکنشهای ایمونولوژیک مانند مقاومت به تزریق پلاکت (PTR)، آسیب حاد ریوی مرتبط با تزریق خون (TRALI)، بیماری پیوند علیه میزبان مرتبط با تزریق خون (TA-GVHD) و هم چنین FNHTR میباشد. آنتیبادی ضد HLA پس از تزریق خونهای مکرر در بیماران و یا پس از چندین بارداری در زنان تولید میشود و زمانی که تزریق خون مجدد صورت پذیرد، آنتیبادیهای ضد HLA با لکوسیتها و پلاکتهای تزریقشده واکنش داده و منجر به تجزیه و آزادسازی مدیاتورهای تبزا از لکوسیتها و پلاکتها شده و FNHTR بروز پیدا میکند (3).
سیستم HLA مجموعهای از ژنهایی واقع بر کروموزوم 6 بوده که پروتئینهای اصلی کمپلکس سازگار بافتی اصلی (MHC) را کد میکند. مولکولهای MHC شامل دو کلاس اصلی میباشد. MHC کلاس یک که تقریباً بر روی همه سلولهای سروماتیک بدن و MHC کلاس دو که بر سطح گروهی از سلولهای ایمنی از جمله B سل، T سل فعال شده، ماکروفاژها و دندریتیک سل ها بیان میشوند (4). ناحیه MHC Class II شامل سه لوکوس DP ، DQ و DR بوده و هر کدام از این لوکوسها سری A و B داشته و زنجیرههای آلفا و بتا را کد میکنند. 5 هاپلوتایپ برای لوکوس HLA-DR وجود دارد و HLA-DRB1 پلیمورفیکترین لوکوس میباشد (5). سیستم HLA-DRB1 نقش حیاتی در سیستم ایمنی در رابطه با عرضه آنتیژنها به سلولهای T و تولید آنتیبادی از طریق پلاسما سلها ایفا میکند (6). آللهای خاص HLA-DR با افزایش خطر ابتلا به برخی بیماریها مرتبط است (4). برای مثال، آللهای HLA-DRB1 با بیماریهای خود ایمنی مانند آرتریت روماتوئید و لوپوس اریتماتوز سیستمیک مرتبط هستند (7). مطالعههای متعددی حاکی از ارتباط پلیمورفیسمهای HLA و آلوایمونیزاسیون به دنبال تزریق خون مکرر در بیماران تالاسمی و آنمی داسی شکل بوده است (8).
میزان بروز و شدت عوارض تزریق خون در همه بیماران یکسان نبوده و متفاوت است. یکی از دلایل مهم این تفاوت، بروز تفاوت در ویژگیهای ژنتیکی بیماران است. بررسی مطالعههای قبلی که درخصوص میزان شیوع آللهای HLA-DR در جامعه طبیعی ایرانی بوده است نشان داد که آلل HLA-DRB1*11 شایعترین آلل در جامعه ایرانی میباشد (10، 9). با توجه به عدم وجود گزارش منتشر شده از فراوانی آللهای HLA-DR در بیماران تالاسمی مولتی ترنسفیوز ایرانی که مبتلا به عارضه FNHTR بودهاند، لذا فراوانی آللهای این سیستم به روش PCR-SSP در 88 نفر بیمار تالاسمی مولتیترنسفیوز مورد بررسی قرار گرفت و با مطالعههای انجام شده در جامعه طبیعی ایرانی مقایسه شد.
مواد و روشها
مطالعه حاضر یک مطالعه مقطعی- تحلیلی در سال 1402 بوده و از 88 بیمار تالاسمی با تزریق خون مکرر مراجعهکننده به درمانگاه تالاسمی بزرگسالان ظفر تهران، مقدار 6 میلیلیتر خون در لوله حاوی ضد انعقاد EDTA گرفته شد. قبل از نمونهگیری از بیماران خواسته شد تا فرم رضایتنامه را پر کنند. به منظور ارزیابی بهتر، بیماران در دو گروه بررسی شدند. گروه اول شامل 70 بیمار تالاسمی که سابقه بروز عارضه FNHTR داشتند و گروه دوم 18 بیمار تالاسمی که سابقه بروز هیچگونه واکنش ناشی از تزریق خون را نداشتند. اطلاعات موردنیاز از قبیل سن، جنس، سن شروع تزریق خون و تعداد دفعات تزریق خون در طول یک سال ثبت گردید. این مطالعه مورد تائید کمیته اخلاق مؤسسه طب انتقال خون با کد اخلاق IR.TMI.REC.1402.002 میباشد.
روش مولکولی:
استخراج DNA: بعد از نمونهگیری و انتقال نمونهها به آزمایشگاه، استخراج DNA با استفاده از کیت تجاری FAVORGEN طبق بروشور کیت صورت پذیرفت. به طور خلاصه داخل یک میکروتیوب 200 میکرولیتر از نمونه خون با 20 میکرولیتر پروتئیناز K و 200 میکرولیتر بافر FABG با استفاده از ورتکس کاملاً مخلوط گشت. میکروتیوب به منظور لیز شدن نمونه خون به مدت 15 دقیقه در 60 درجه سانتیگراد انکوبه شده و پس از سانتریفیوژ مختصر، 200 میکرولیتر اتانول (100% - 96%) به نمونه اضافه شد. یک مینیستون FABG درون یک لوله جمعآوری قرار داده شده و مخلوط نمونه به درون مینیستون انتقال داده شد. پس از سانتریفیوژ سریع، مینیستون درون یک لوله جمعآوری جدید گذاشته شد. مینیستون با استفاده از 400 میکرولیتر از بافر W1 و سپس 750 میکرولیتر بافر شستشو شسته شده و مایع دور ریخته شد. با اضافه کردن بین 50 تا 200 میکرولیتر بافر شستشـوی گـرم شده و یا (0/9-5/7 pH=) ddH2O به مرکز غشای مینیستون و سپس سانتریفیوژ با بالاترین دور، تمام DNA از مینیستون خارج شد. سپس بهمنظور ارزیابی کیفیت DNA استخراجشده، جذب نوری DNA در طول موجهای 260 و 280 نانومتر خوانش شد.
روش PCR-SSP :
حجم کلی محتوای واکنش 30 میکرولیتـر (شامـل 8/16 میکرولیتر آب مقطـر، 4/8 میکرولیتر مخلوط Ready PCR ،
2/2 میکرولیتر آنزیمTaq Polymerase و 6/2 میکرولیتر نمونه DNA) بوده که پس از آمادهسازی به میزان 10 میکرولیتر در چاهکهای بلوک PCR ریخته شد. سپس با استفاده از کاور روی استریپها پوشانده شده و داخل دستگاه ترموسایکلر قرار گرفته و طبق برنامه زیر دستگاه ران شده است: یک چرخه در 96 درجه سانتیگراد به مدت دو دقیقه، 10 چرخه (15 ثانیه در 96 درجه سانتیگراد و 60 ثانیه در 65 درجه سانتیگراد) و 20 چرخه (15 ثانیه در 96 درجه سانتیگراد و 50 ثانیه در 61 درجه سانتیگراد و 30 ثانیه در 72 درجه سانتیگراد) و درنهایت چرخه در 4 درجه سانتیگراد پایان یافت.
الکتروفورز:
درنهایت محصولات حاصل از PCR ، بر روی ژل آگارز 2 درصد حاوی رنگ DNA Safe Stain با ولتاژ 120 تا 150 ولت به مدت 30 دقیقه ران شده و سپس باندها زیر دستگاه UV-Trans laminator و در طول موج 312 نانومتر مشاهده گشت.
تجزیه و تحلیل دادهها:
تمام محاسبات و تجزیهو تحلیلهای آماری توسط نرمافزار 24 IBM SPSS Statistics انجام شده و به منظور بررسی رابطه بین دو متغیر کیفی، آزمون کایدو مورد استفاده قرار گرفت.
یافتهها
مجموع 88 بیمار تالاسمی بهطور تصادفی انتخاب و وارد مطالعه شدند که شامل 35 مرد (8/39%) و 53 زن (2/60%) با میانگین سنی 28/11 ± 63/38 سال و در محـدوده 75-22 سال بودند. در بیماران این مطالعه میانگیـن سـن شروع تزریق 13/12 ± 94/5 سال بود. هم چنین تعداد تزریق در سال به طور میانگین در بیماران 74/13 ± 25/22 واحد در سال بود. 88 بیمار تالاسمی بر اساس بروز واکنش FNHTR ، در دو گـروه با و بدون FNHTR وارد مطالعه شدنـد.70 بیمار FNHTR بـا 18 بیمـار کـه هیـچ گونـه عارضـهای نداشتند مقایسه شدند.

میانگین سنی تقریباً 62/11 ± 41/38 سال در گروه FNHTR و 10/10 ± 44/39 سال در گروه بدون FNHTR بود. همچنین نسبت جنسیتی در گروه FNHTR به صورت 7/35% مرد و 3/64% زن و در گروه بدون FNHTR 6/55% مرد و 4/44% زن، میانگین سن شروع تزریق در گروه FNHTR 66/12 ± 1/6 سال و در گروه بدون FNHTR 08/10 ± 31/5 سال، میانگین تعداد تزریق در هر سال 65/14 ± 23/22 واحد در گروه FNHTR و 76/9 ± 33/22 واحد در گروه بدون FNHTR بود. از نظر
نوع تالاسمی نیز 3/83% در گروه بدون FNHTR و 6/88% در گروه FNHTR ، تالاسمی ماژور و 7/16% در گروه بدون FNHTR و 42/11% در گروه FNHTR تالاسمی اینترمدیا بودند. مقایسهها نشان داد دو گروه از نظر عوامل دموگرافیک و موقعیتهای بالینی یکسان بوده و تفاوت معناداری بین دو گروه دیده نشده است. با مقایسه نتایج به دست آمده مشخص شد که آلل HLA-DRB1*11 با درصد فراوانی 7/26% بیشترین فراوانی را در جمعیت تالاسمی مورد مطالعه دارد (جدول 1). فراوانی سایر آللها HLA-DRB1*07 (6/13%)، HLA-DRB1*04 (8/10%)، HLA-DRB1*3 (2/10%) به ترتیب در رتبههای دوم تا چهارم قرار دارد. از طرفی مشخص شد که آلل HLA-DRB1*08 با درصد فراوانی 6/0% دارای کمترین شیوع در جمعیت تالاسمی مورد مطالعه میباشد.
همچنین با مقایسه نتایج به دست آمده مشخص شد که توزیع فراوانی آلل HLA-DRB1*10 (992/0-026/0 CI 95% ، 159/0 OR=) ارتباط منفی با بروز FNHTR در جمعیت تالاسمی ایرانی دارد (049/0 p=). در گروه بدون FNHTR ، 10 آلل HLA-DR و در گروه FNHTR ، 11 آلل شناسایی شد.

اطلاعات نشان میدهد که بیشترین و کمترین فراوانی HLA-DR در گروه بدون FNHTR مربوط به HLA-DRB1*11 و HLA-DRB1*01 بوده که به ترتیب 25% و 8/2% میباشـــد. در گروه FNHTR نیز HLA-DRB1*11 و HLA-DRB1*08 با درصدهای 1/27% و 7/0% به ترتیب بیشترین و کمترین شیوع را داشتهاند (جدول 2).
در گروه FNHTR فراوانی بالاتری از آللهای HLA-DRB1*01 (3/4% در مقابل 8/2%)، HLA-DRB1*04 (1/12% در مقابل 6/5%)، HLA-DRB1*07 (3/14% در مقابل 1/11%)، HLA-DRB1*08 (7/0% در مقابل 0%)، HLA-DRB1*11 (1/27% در مقابل 0/25%)، HLA-DRB1*14 (6/8% در مقابل 3/8%)، HLA-DRB1*15 (3/9% در مقابل 3/8%) نسبت به گروه بدون FNHTR مشاهده شده است. علاوه بر این، فراوانی HLA-DRB1*03 (0/10% در مقابل 1/11%)، HLA-DRB1*10 (4/1% در مقابل 3/8%)، HLA-DRB1*13 (1/7% در مقابل 1/11%)، HLA-DRB1*16 (0/5% در مقابل 3/8%)، در گروه FNHTR نسبت به گروه بدون FNHTR کاهش یافت.
بحث
مطالعه حاضر که در مورد پلیمورفیسم در آللهای HLA-DR و ارتباط آن با واکنش تبزای غیرهمولیتیک (FNHTR) در بیماران تالاسمی بود، نشان داد که هیچ رابطه مثبتی در ارتباط پلیمورفیسم در آللهای HLA-DR و بروز FNHTR در بیماران تالاسمی ایرانی وجود نداشته ولیکن احتمال نقش محافظتی آلل HLA-DRB1*10 در بروز FNHTR در این بیماران وجود دارد (049/0 p=). بیشترین فراوانی آلل HLA-DR در این مطالعه HLA-DRB1*11 با درصد فراوانی 7/26% در 88 نفر جمعیت مورد مطالعه و همچنین 1/27% در جمعیت گروه FNHTR و 25% در جمعیت بدون FNHTR بوده است. با توجه به نتایج مطالعه حاضر، درصد فراوانی آللهای HLA-DR در جمعیت مورد مطالعه به ترتیب فراوانی بدین صورت بود:
(7/26%) HLA-DRB1*11 ، (6/13%) HLA-DRB1*07 ، (8/10%) HLA-DRB1*04 ، (2/10%) HLA-DRB1*03 ، (1/9%) HLA-DRB1*15 ، (5/8%) HLA-DRB1*14 ، (8/0%) HLA-DRB1*13 ، (7/5%) HLA-DRB1*16 ، (4%) HLA-DRB1*01 ، (8/2%) HLA-DRB1*10 و (6/0%) HLA-DRB1*08 .
بر اساس مطالعههای گذشته در جمعیتهای ایرانی فراوانترین آلل HLA-DRB1*11 بوده است (11). الگوی فراوانی HLA-DRB1*11 در بیماران تالاسمی ایرانــی مورد مطالعه بسیار شبیه به جمعیت طبیعی و اهداکنندگان ایرانی بوده و تفاوت معناداری در فراوانی HLA-DRB1*11 بین جامعه طبیعی و بیماران تالاسمی وجود ندارد، بهجز مطالعهای بر روی قوم بلوچ که نشان داد شایعترین آلل در آنها HLA-DRB1*03 میباشد (12).
ژن HLA بسیار پلیمورفیک بوده و همین امر باعث تنوع ژنتیکی سیستم ایمنی میزبان و به دنبال آن پاسخهای متفاوت به عفونت یکسان میگردد (14، 13). در همین راستا محققان در بیرمنگهام به نقش HLA-DR3 در افزایش خطر ابتلا به بیماری گریوز و تیروئیدیت هاشیموتو دست یافتند درحالیکه HLA-DR7 دارای نقش محافظتی در ابتلا به این بیماریها بود (15). مطالعهای در چین توسط ونگ و همکارانش نشاندهنده ارتباط HLA-DRB1*14:04 و HLA-DQA1*01:01 با شدت بیماری کووید-19 و در مقابل نقش محافظتی HLA-DPB1*03:01 و HLA-DRB1*12:01 در برابر ابتلا به فرم شدید بیماری بود (16). در حالیکه در ژاپن محققان به ارتباط مثبت HLA-DRB1*09:01 با شدت بیماری اشاره کردهاند (17). مطالعه دیگری در ایتالیا بیان کننده ارتباط HLA-DRB1*08:01 با شدت بیماری و نقش محافظی HLA-B*58:01، HLA-DRB1*03:01 و HLA-A*02:05 در برابر شدت علائم بالینی بیماری کووید-19 بود. بر اساس مطالعه داداشی و همکاران و هم چنین سایر مطالعهها در جمعیت ایرانی، HLA-A*24 و HLA-B*55 ممکن است نقش محافظتی در بروز FNHTR در بیماران بتاتالاسمی ایرانی داشته باشند (19، 18).
بهطور کلی، توزیع پلیمورفیسمهای HLA-DR در بیماران تالاسمی با آن چه در مطالعههای قبلی در جمعیتهای مختلف ایرانی پیدا شده بــود، مطابقت داشت.
در مطالعهای که نیکبین و همکارانش در سال 2017 بر روی جمعیت اهداکننده استان یزد داشتند، فراوانی آللها بدین شرح بوده است: HLA-DRB1*11 (4/24%)، HLA-DRB1*15 (3/13%)، HLA-DRB1*07 (3/13%)، HLA-DRB1*13 (0/10%)، HLA-DRB1*01 (8/8%)، HLA-DRB1*03 (8/8%)، HLA-DRB1*04 (22/7%)، HLA-DRB1*14 (4/4%)، HLA-DRB1*08 (8/3%)، HLA-DRB1*10 (7/2%)،HLA-DRB1*16 (2/2%)، HLA-DRB1*09 (05/0%)(20).
عرب و همکارانش در سال 2018 با مطالعه جمعیت اهداکننده گیلک، فراوانی آللهای HLA-DR را بدین شرح گزارش کردند: HLA-DRB1*11 (1/14%)، HLA-DRB1*01 (5/13%)، HLA-DRB1*04. (8/11%)، HLA-DRB1*14 (2/11%)، HLA-DRB1*15 (0/10%)، HLA-DRB1*03 (4/9%)، HLA-DRB1*16 (6/7%)، HLA-DRB1*07. (5/6%)، HLA-DRB*10 (5/6%)، HLA-DRB1*13 (3/5%)،HLA-DRB1*13 (5/3%) و کمترین فراوانی نیز متعلق به HLA-DRB1*08 (06/0%) بوده است که در مطالعه حاضر نیز HLA-DRB1*08 کمترین شیوع را داشته است (21). اسماعیلی و همکـاران نیز در سال 2017 فراوانی آللهای HLADRB1 را در جمعیت طبیعی مشهد به شرح زیر گـزارش کردهاند: HLA-DRB1*16 (0/20%)، HLA-DRB1*13 (2/16%)، HLA-DRB1*11 (15/0%)، HLA-DRB1*07 (15/0%) (22).
ایران ازنظر نژادی کشوری متنوع بوده و شامل نژادهای مختلفی ازجمله فارس، ترک، کرد، عرب، ترکمن، لر و بلوچ میباشد. بر خلاف این که شایعترین آلل رایج در جمعیت ایران HLA-DRB1*11 میباشد، مطالعه بر روی قوم بلوچ حاکی از شیوع بیشتر آلل HLA-DRB1*03 (29%) بود که بیانکننده قرابت ژنتیکی بین جمعیت بلوچ در ایران و بلوچها و براهوییهای پاکستان است (12). با توجه به این که فراوانی آللهای HLA-DR بیماران تالاسمی در مطالعه حاضر مشابه جمعیت طبیعی و اهداکنندگان ایرانی است، لذا میتوانیم میزان شیوع آللها را با مطالعههای صـورت گـرفته در کشـورهـای دیگر نیز مقایسه کنیم.
مطالعههای متعددی در زمینه شیوع آللهای مختلف HLA-DR در کشورهای دیگر صورت گرفته است. محققان در دانمارک با مطالعه ارتباط پلیمورفیسمهای HLA-DRB1 با سقط مکرر بارداری، فراوانی آللهای HLA-DRB1 در جمعیت طبیعی را به ترتیب زیر گزارش کردهاند: HLA-DRB1*15 با درصد فراوانی 52/17%، HLA-DRB1*04 با 36/16%، HLA-DRB1*13 با 75/13% در رتبههای اول تا سوم قرار داشتند(22). فراوانی آللهای HLA-DRB1 سال 2016 در سوریه به ترتیب HLA-DRB1*11 (4/26%)، HLA-DRB1*04 (14%) و HLA-DRB1*04 (12%) بوده است (23). در فرانسه نیز فراوانترین آللها در جمعیت طبیعی اهداکنندگان سلولهای بنیادی به صورت HLA-DRB1*13 (1/14%)، B1*07 (5/13%)، B1*11 (2/13%) و B1*15 (0/13%) گزارش شده است (24).
نتیجهگیری
در مطالعه حاضر در خصوص فراوانی آللهای HLA-DR نهتنها تفاوت آماری معناداری در بیماران تالاسمی مبتلا به FNHTR و گروه بدون FNHTR نشان نداد، بلکه مشابه با اهداکنندگان ایرانی بود. بیشترین فراوانی آللی مربوط به HLA-DRB1*11 و کمترین نیز مربوط به HLA-DRB1*08 بوده است. همچنین در این مطالعه، ارتباط منفی بین آلل HLA-DRB1*10 و وقوع FNHTR یافت شده است. بهعبارتدیگر، فراوانی آلل HLA-DRB1*10 گروه FNHTR پایینتر بوده است، اگرچه تائید این ارتباط احتمالی نیازمند بررسیهای دقیقتر با گروه کنترل بزرگتر میباشد تا بتوان بهصورت دقیقتر اعلام کرد که آلل مذکور سیستم HLA به عنوان یک فاکتور محافظتی بالقوه در برابر FNHTR در جمعیت تالاسمی ایران ایفای نقش میکنند.
حمایت مالی
این مطالعه با حمایت مالی مؤسسه عالی آموزشی و پژوهشی طب انتقال خون انجام شده است.
ملاحظات اخلاقی
این مطالعه دارای کد اخلاق IR.TMI.REC.1402.002 از مـؤسسـه عـالی آمـوزشی و پـژوهشی طـب انتقــال خون
میباشد.
عدم تعارض منافع
نویسندگان اظهار کردند در انتشار این اثر منافع تجاری نداشتند و در مقابل ارائه اثر وجهی دریافت نکردهاند.
نقش نویسندگان
زینب تثبیتی: انجام آزمایشها و تحلیل آنها و هم چنین تجزیه و تحلیلهای آماری و نگارش اولیه مقاله
دکتر مریم سادات داداشی: ناظر انجام آزمایشها و صحت خوانش نتایج تستها و تحلیل آنها، تحلیلهای آماری و نگارش بخش یافتهها
دکتر آزیتا چگینی: همکاری در نوشتن پروپوزال، پژوهش و نگارش آن و همکاری در نگارش پیشنویس مقاله
دکتر مریم زادسر: نویسنده مسئول و محقق اصلی پژوهش، ارائه دهنده طرح اولیه پژوهش، ناظر انجام
تحقیق و ادیت نهایی مقاله
تشکر و قدردانی
این مطالعه قسمتی از پایاننامه دانشجویی دوره کارشناسی ارشد رشته خونشناسی و بانک خون مؤسسه عالی آموزشی و پژوهشی طب انتقال خون بوده و همه مراحل عملی پروژه در آزمایشگاه مرکز تحقیقات سازمان انتقال خون انجام شده است. از همکاران مرکز تحقیقات سازمان انتقال خون و بخش تالاسمی مرکز تالاسمی بزرگسالان ظفر که همکاری صمیمانه در این تحقیق داشتند و هم چنین خانم دکتر آزیتا آذرکیوان برای انتخاب بیماران FNHTR سپاسگزاریم. هم چنین از زحمات دکتر مریم سادات داداشی و بنیامین رحمتی در کمک به جمعآوری نمونه بیماران کمال تشکر را داریم.
نوع مطالعه: پژوهشي |
موضوع مقاله:
طب انتقال خون
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






