جلد 20، شماره 4 - ( زمستان 1402 )
جلد 20 شماره 4 صفحات 311-298 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Moradi V, Ranjbar A, Omidkhoda A, Ahmadbeigi N. In vitro comparison of cytotoxicity of CD19 CAR-CIK and CD19 CAR-T cells. bloodj 2023; 20 (4) :298-311
URL: http://bloodjournal.ir/article-1-1510-fa.html
URL: http://bloodjournal.ir/article-1-1510-fa.html
مرادی وحید، رنجبر اعظم، امیدخدا آزاده، احمدبیگی ناصر. مقایسه میزان کشندگی سلولهای CD19 CAR-CIK و CD19 CAR-T در محیط in vitro. فصلنامه پژوهشی خون. 1402; 20 (4) :298-311
دانشکده علوم پیراپزشکی دانشگاه علوم پزشکی تهران
واژههای کلیدی: کلمات کلیدی: Chimeric Antigen Receptors، سلولهای T، سلولهای کشنده القا شده با سیتوکین، بیماری پیوند علیه میزبان
متن کامل [PDF 896 kb]
(734 دریافت)
| چکیده (HTML) (1871 مشاهده)
مقدمه
لنفوسیتهای T بیانکننده گیرنده آنتیژنی دوگانه [Chimeric antigen receptor T cells (CAR-T cells)] در سالهای اخیر به عنوان یکی از شاخههای ایمنی درمانی سرطان، موفقیتهای چشمگیری را به خصوص در زمینه درمان بدبخیمیهای خونی لنفوسیتهای B کسب کردهاند؛ به گونهای که از سال 2017 تاکنون، هشت محصول مجوز عرضه بالینی را اخذ نمودهاند (2، 1). CAR یک گیرنده صناعی میباشد که در آن دامین خارج سلولی از ناحیه متغیر زنجیره یک آنتیبادی ] single-chain variable fragment (scFv) [ تشکیل شده است که توسط یک دامین غشاگذر به دامینهای پیامرسان داخل سلول متصل میشود. دامینهای پیامرسان داخل سلولی از نواحی پیامرسان زنجیره CD3 zeta و دامین کمک محرک (مانند CD28) تشکیل شده است (3). بدین ترتیب این گیرنده اختصاصیتی مطابق با اختصاصیت ناحیه scFv به کار رفته خواهد داشت و برخلاف گیرنده سلولی درونزای لنفوسیتهای T ، قادر به شناسایی آنتیژنهای توموری بدون نیاز به عرضه آنها توسط مولکولهای سازگاری بافتی نسجی [major histocompatibility complex (MHC)] خواهد بود. این ویژگی سلولهای CAR-T را قادر میسازد تا سلولهای سرطانی را که با کاهش بیان سطحی مولکولهای MHC خود را از دسترس لنفوسیتهای T پنهان کردهاند، شناسایی کرده و از بین ببرند (4).
تمامی CAR-T cell هایی که مجوز عرضه بالینی را دریافت کردهاند، از منبع اتولوگ تهیه میشوند. در این روش سلولهای تک هستهای خون محیطی بیمار که حاوی لنفوسیتهای T هستند از طریق لوکوفرزیس جداسازی میشوند. پس از کشت و فعالسازی این سلولها در محیط کشت حاوی IL-2 و آنتیبادیهای anti-CD3 ، anti-CD28 و anti-CD2، ژن بیان کننده CAR از طریق وکتورهای ویروسی/غیر ویروسی به سلولها منتقل میشود. سپس سلولها به مدت دو تا سه هفته در محیط کشت تکثیر میشوند تا به مقدار مناسب برای تزریق به بیمار برسند (5). علیرغم تحولی که سلولهای CAR-T اتولوگ در درمـان بدخیمیهــای لنفوسـیتهای B کسـب کردهانــد،
این روش با چالشهای اساسی روبرو میباشد. این نوع از درمان به صورت یک روند شخصیسازی شده برای هر بیمار طی میشود که منجر به افزایش هزینه تولید محصول میشود، به طوری که هزینه هر بار تزریق این محصولات در آمریکا بین 375000 تا 450000 دلار میباشد (6). از سوی دیگر این روش فرآیندی زمانبر است به طوری که سریعترین فرآیند تولید مربوط به فرآورده Kymriah میباشد که تولید آن به 19 تا 20 روز زمان نیاز دازد. با توجه به این که این درمان عمدتاً برای بیمارانی که در مراحل نهایی بیماری قرار داشته و نسبت به سایر درمانها مقاومت نشان دادهاند استفاده میشود، این مسأله تأخیری بسیار بزرگ محسوب میشود، چرا که در طی فرآیند تولید ممکن است به علت پیشرفت بیماری بیمار فوت کرده و یا صلاحیت درمان را از دست بدهد (7). امکان شکست فرآیند تولید و هم چنین امکان آلودگی محصول نهایی با سلولهای بدخیم در طی انجام لوکوفرزیس از دیگر مشکلات این روش درمانی محسوب میشود (10-8).
با توجه به مشکلات مذکور استفاده از منابع آلوژنیک لنفوسیتهای T برای تولید سلولهای CAR-T در سالهای اخیر توجه زیادی را به خود معطوف کرده است. لنفوسیتهای T آلوژنیک را میتوان از خون محیطی اهداکنندگان سالم، سلولهای بنیادی پر توان و خون بند ناف تهیه کرد (12، 11). با این حال استفاده از تمامی این منابع آلوژنیک با دو مشکل اساسی روبرو میباشد: خطر ایجاد بیماری پیوند علیه میزبان ](GvHD)[Graft versus host disease و پایداری پایین این سلولها در محیط بدن به علت پاسخ های ایمنی میزبان (13).
سلولهای کشنده القاشده با سیتوکین (CIK cells : Cytokine induced killer cells) سلولهایـی بـا فنـوتیــپ
مخلوط لنفوسیتهای T و سلولهای کشنده طبیعی [Natural killer cells (NK cells)] هستند که در محیط آزمایشگاه با افزودن ترتیبی Interferon (IFN)-γ ، Interleukin (IL)-2 و آنتیبادی anti-CD3 در طی زمانهای مشخص از سلولهای تک هستهای خون محیطی [Peripheral blood mononuclear cells (PBMCs)] تکثیر میشوند (14). سلولهای CIK جمعیت هتروژنی از سلولهایی با چهار نوع فنوتیپ متفاوت میباشند که شامل جمعیت غالبی از سلولها با فنوتیپ CD3+ CD56+ ، سلولهای CD3+ CD56- و درصد کمی از سلولهای CD3-CD56+ و سلولهای CD3-CD56- میباشد (15). مطالعهها نشان دادهاند که استفاده از سلولهای CIK آلوژنیک در مقایسه با لنفوسیتهای αβ-T با خطر پایینتری از ایجاد GvHD همراه است (17، 16). همچنین مطالعههای قبلی نشان دادهاند که با انتقال ژن CAR به سلولهای CIK ، این سلولها قادر خواهند بود تا هم از طریق مکانیسمهای وابسته به CAR و هم از طریق مکانیسمهای مستقل از CAR (از طریق گیرندههای فعالکننده سلول NK مانند گیرنده NKG2D) به مقابله با سلولهای بدخیم بپردازند (18).
با توجه به این که یک جایگزین مناسب برای سلولهای CAR-T لازم است تا در عین خطر پایین GvHD از کشندگی قابل مقایسهای با این سلولها نیز برخوردار باشد، در این مطالعه یک بررسی in vitro اولیه جهت مقایسه قدرت کشندگی سلولهای CD19 CAR-T و CD19 CAR-CIK در برابر سلولهای K562 بیان کننده مولکول سطحی CD19 صورت گرفت.
مواد و روشها
جداسازی سلولهای تک هستهای خون محیطی و کشت سلولهای T و CIK :
پس از اخذ فرم رضایت از دو اهداکننده سالم 28 و 38 ساله که دارای شمارش طبیعی گلبولهای سفید خون بودند، به میزان 20 میلیلیتر خون وریدی در ضد انعقاد K2EDTA گرفته شد. برای جداسازی سلولهای تک هستهای خون محیطی [Peripheral blood mononuclear cells(PBMC)] از نمونه خون اهداکنندگان سالم از روش سانتریفیوژ گرادیان شیب غلظت با فایکول 077/1 (inno-train ، آلمان) استفاده شد. برای کشت سلولهای CIK ابتدا PBMC ها جهت حذف سلولهای چسبنده به مدت سه ساعت در محیط Roswell Park Memorial Institute (RPMI) 1640 (ایده زیست، ایران) فاقد سرم جنین گاوی [Fetal bovine serum (FBS)] کشت داده شدند. پس از گذشت مدت زمان مذکور، سلولهای غیرچسبنده جدا شده و به تعداد یک میلیون سلول در هر چاهک از پلیت 24 خانه کشت داده شدند. به هر چاهک یک میلیلیتر محیط RPMI دارای FBS 10% (دنازیست، ایران) و IFN-γ (Miltenyi Biotech ، آلمان) با غلظت U/mL 1000 افزوده شد. در روز بعد IL-2 (Miltenyi Biotech ، آلمان) با غلظت IU/mL 300 و آنتیبادی anti-CD3 OKT3 (Miltenyi Biotech ، آلمان) با غلظت ng/mL100 به هر کدام از چاهکها افزوده شد. چاهکها هر روز بررسی شده و محیط هر چاهک هر دو تا سه روز با محیط تازه دارای FBS 10% و (U/mL 300) IL-2 تعویض شد. برای کشت لنفوسیتهای T ابتدا PBMC های جدا شده از اهداکنندگان سالم به تعداد یک میلیون سلول در هر چاهک از پلیت 24 خانه کشت داده شدند. به هر چاهک میزان یک میلیلیتر محیط TexMACS (Miltenyi Biotech ، آلمان) حاوی FBS 10% ، IL-2 با غلظت U/mL100 و بیدهای معناطیسی Coat شده با آنتیبادیهای anti-CD3 ، anti-CD2 و anti-CD28 (Miltenyi Biotech ، آلمان) به تعداد نصف سلولهای موجود در هر چاهک افزوده شد. سلولها هر روز از نظر مورفولوژیک بررسی شده و محیط هر چاهک هر سه روز یک بار با محیط تازه حاوی FBS 10% و (U/mL 100) IL-2 تعویض شد.
تولید وکتور لنتی ویروسی:
برای تولید وکتور لنتی ویروسی از پلاسمیدهای psPAX2 ، pMD2G و پلاسمیدهای Transfer که در مطالعه پیشین گروه طراحی و به کار برده شده بودند استفاده شد (19). لازم به ذکر است که در این مرحله از دو نوع پلاسمید transfer جهت تولید دو وکتور ویروسی متفاوت استفاده شد. پلاسمید Transfer اول که به صورت bicistronic دارای ژنهای CAR و GFP بود و پلاسمید transfer دوم برای تولید وکتور ویروسی Mock که کاملاً مشابه پلاسمید Transfer اول بود به استثنای این که فاقد توالی کد کننده CAR بود. پلاسمیدهای مورد نظر با استفاده از حامل پلیاتیلنایمین [polyethylenimine (PEI)] به درون سلولهای LentiX 293T ترانسفکت شدند. در فواصل زمانی 24 ساعت، 36 ساعت، 48 ساعت و 60 ساعت پس از ترانسفکشن، سوپ حاوی پارتیکلهای ویروسی جمعآوری شده و پس از سانتریفیوژ با دور g 10000 و دمای 4 درجه سانتیگراد با فیلتر پلیاترسولفون Um 45/0 فیلتر شد. در مرحله بعد جهت تغلیظ ویروس، از روش گرادیان سوکروز 20% استفاده شد. به طور خلاصه در هرکدام از لولههای اولتراسانتریفیوژ به میزان یک دهم حجم سوپ ویروسی سوکروز 20% ریخته شد و سپس سوپ ویروسی به آرامی به هر لوله افزوده شد، به طوری که یک محلول دو فازی در هر لوله ایجاد شد. در ادامه لولهها با دور g 50000 و در دمای چهار درجه سانتیگراد به مدت سه ساعت سانتریفیوژ شدند. پس از حذف مایع رویی رسوب ویروسی حاصل در 100 میکرولیتر محیط TexMACS حل شده و تا زمان استفاده در دمای 80- درجه سانتیگراد ذخیره شد. در نهایت برای تعیین تیتر ویروس تغلیظ شده سلولهای LentiX 293T پس از شمارش، با رقتهای مختلف ویروس تغلیظ شده ترانسداکت شدند و با تعیین درصد سلولهای آلوده شده (سلولهای GFP+)، تیتر ویروس تعیین شد.
ترانسداکشن سلولها:
جمعیت سلولهای T و CIK در روز سوم کشت هر کدام به سه گروه تقسیم شدند: گروه اول شامل سلولهای ترانسداکت نشده (T و CIK)، گروه دوم شامل سلولهای ترانسداکت شده با وکتور ویروسی حاوی CAR (CAR-T و CAR-CIK) و گروه سوم شامل سلولهای ترانسداکت شده با ویروس Mock (Mock T و Mock CIK). جهت ترانسداکشن سلولها از ضریب آلوده سازی [multiplicity of infection (MOI)] 5 استفاده شد. برای انجام ترانسداکشن پس از کشت سلولهای T و CIK در یک پلیت 24 خانه، حجم هر خانه به گونهای تنظیم شد که پس از افزودن میزان مورد نیاز از سوپ ویروسی و محیط کشت، حجم نهایی به 300 میکرولیتر برسد. به خانههای حاوی سلولهای T و CIK ترانسداکت نشده نیز به ترتیب 300 میکرولیتر محیط TexMacs و RPMI افزوده شد. سلولها به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد و CO2 5% انکوبه شدند و پس از طی زمان مذکور، محیط حاوی سوپ ویروسی با محیط تازه دارای FBS 10% و IL-2 تعویض شد.
ایمونوفنوتایپینگ سلولها:
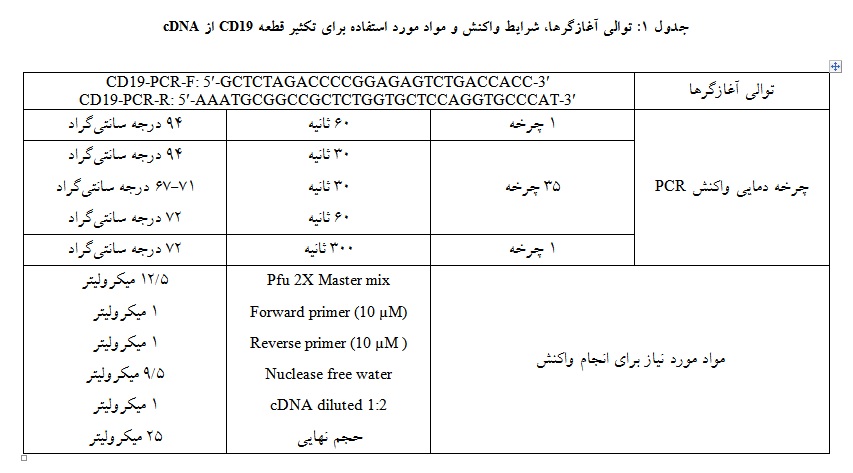
سلولهای T و CIK در روز چهاردهم پس از کشت جهت بررسی بیان مولکولهای سطحی سلولهای T و CIK مورد ارزیابی قرار گرفتند. به این منظور هر کدام از جمعیتهای سلولی به تعداد 105 × 1 عدد سلول در صد میکرولیتر PBS حاوی BSA 3% حل شدند. سپس جمعیتهای سلولهای T با پنج میکرولیتر از آنتیبادیهای anti-CD3-perCP (BD Bioscience ، آمریکا)، anti-CD4-APC (BD Bioscience ، آمریکا) و anti-CD8-PE (BD Bioscience ، آمریکا) و جمعیتهای سلولهای CIK با پنج میکرولیتر از آنتیبادیهای anti-CD3-perCP (BD Bioscience ، آمریکا) و anti-CD56-PE (BD Bioscience ، آمریکا) رنگآمیزی شدند و با دستگاه فلوسیتومتریBD FACSCalibur مورد ارزیابی قرار گرفتند. همچنین برای بررسی میزان ترانسداکشن سلولها از سنجش میزان بیان پروتئین GFP در سلولهای ترانسداکت شده با روش فلوسیتومتری استفاده شد. برای بررسی دادههای فلوسیتومتری از نرمافزار Flow Jo استفاده شد.
تولید رده سلولی CD19+ K562 :
رده سلولی RAJI به عنوان منبعی با میزان بالای بیان CD19 محسوب میشود بنابراین در مطالعه حاضر از سلولهای RAJI (مرکز ملی ذخایر ژنتیک، ایران) به عنوان منبع RNA ژن CD19 استفاده شد. برای این منظور در ابتدا RNA تام سلولهای RAJI با روش Trizol/choloroform استخراج شد. در ادامه با استفاده از کیت سنتز DNA مکمل (cDNA)(پیشگام، ایران) از RNA استخراج شده برای سنتز cDNA استفاده شد. برای تکثیر قطعه CD19 از cDNA سنتز شده آغازگرهای جلوبرنده و معکوس برای ایزوفرم سوم ژن CD19 طراحی شدند. همچنین برای تعیین دمای بهینه واکنش از گرادیان دمایی بین 67 تا 71 درجه سانتیگراد برای مرحله آنیلینگ استفاده شد. توالی آغازگرها، شرایط واکنش PCR و مواد مورد استفاده در واکنش PCR در جدول قابل مشاهده میباشد (جدول 1). در مرحله بعد از پلاسمید pCDH-EF1a-eFFly-eGFP (Addgene ، آمریکا) دارای ژن مقاومت به آنتی بیوتیک آمپیسیلین به عنوان پلاسمید پذیرنده برای کلون کردن
قطعه CD19 تکثیر شده استفاده شد. بدین منظور قطعه CD19 تکثیر شده و پلاسمید pCDH-EF1a-eFFly-eGFP هر دو توسط آنزیمهای محدودکننده Not1 و Xba1 (NEB ، آمریکا) برش داده شده و سپس توسط آنزیم T4 DNA Ligase (Thermo Fisher، آمریکا) به هم متصل شدند.
پلاسمید نوترکیب حاصل با استفاده از شوک دمایی به داخل E.coli Stbl4 competent cell ها ترانسفرم شده و باکتریهای ترانسفرم شده در محیط LB Agar (Thermo fisher، انگلیس) دارای آنتیبیوتیک آمپیسیلین کشت داده شده و به مدت 24 ساعت در دمای 37 درجه سانتیگراد انکوبه شدند.
پس از 24 ساعت شش عدد از کلنیهای رشد کرده بر روی پلیت (کلنیهایی که با موفقیت ترانسفرم شده و دارای ژن مقاومت به آمپیسیلین بودند) انتخاب شده و برای Colony PCR مورد استفاده قرار گرفتند (جدول 2). کلنیهای به کار رفته برای Colony PCR به طور همزمان در محیط LB broth (Thermo fisher، انگلیس) کشت داده شدند. پس از 16 ساعت انکوباسیون در دمای 37 درجه سانتیگراد از کیت استخراج پلاسمید (پیشگام، ایران) برای استخراج پلاسمید نوترکیب از باکتریهای رشد کرده استفاده شد.
برای تولید وکتور لنتی ویروسی حاوی ژن CD19 ، پلاسمیدهای psPAX2 ، pMD2G و پلاسمید Transfer نوترکیب با استفاده از PEI به درون سلولهای LentiX 293T ترانسفکت شدند و مطابق مراحل ذکر شده در قسمتهای پیشین سوپ ویروسی در فواصل معین جمعآوری شده و پس از تغلیظ تعیین تیتر شد. سلولهای K562 در محیط FBS 10% + RPMI کشت داده شده و دو مرتبه با فاصله زمانی 72 ساعت با ضریب آلودهسازی (MOI) 3 ترانسداکت شدند. 72 ساعت پس از دومین ترانسداکشن، سلولهای K562 برای بررسی بیان CD19 و GFP مورد ارزیابی قرار گرفتند. به این منظور در هر نوبت 105 × 1 سلول در بافر فسفات (کالا زیست، ایران) حاوی 3% آلبومین سرم گاوی (Sigma-Aldrich ، آمریکا) حل شده و با پنج میکرولیتر آنتیبادی anti-CD19 متصل به فلوروکروم APC (BD Bioscience ، آمریکا) رنگآمیزی شدند و با دستگاه فلوسیتومتری BD FACSCalibur برای بررسی میزان بیان GFP و CD19 مورد ارزیابی قرار گرفتند.
بررسی میزان کشندگی سلولها:
در روز شانـزدهم کشـت سلولهــای CAR-T ، CAR-
CIK، Mock T ، Mock CIK و سلولهای T و CIK ترانسداکت نشده جمعآوری شدند تا میزان کشندگی آنها در برابر سلولهای CD19+K562 مورد ارزیابی قرار گیرد. به این منظور از کیت ارزیابی کشندگی بر اساس سنجش میزان رهایش لاکتات دهیدروژناز (LDH release cytotoxicity assay) شرکت Abcam استفاده شد. طبق دستورالعمل شرکت سازنده کیت هر کدام از سلولها در نسبت effector: target (E:T ratio) 1:1 ، 1:5 و 1:10 با سلولهای هدف (CD19+K562) در پلیت 96 خانه کشت داده شدند.
هر نسبت E:T به صورت تکرار سه تایی کشت داده شد تا میانگین حاصل از سه چاهک به عنوان عدد نهایی گزارش گردد. جهت حذف تداخل رهایش LDH از سلولهای در حال آپوپتوز و LDH موجود در محیط کشت، سلولهای effector (در هر سه نسبت ×1، ×2 و ×10)، سلولهای هدف و محیط کشت فاقد سلول نیز به صورت تکرار سهتایی در پلیت کشت داده شدند تا میزان LDH آنها اندازهگیری شده و از میزان LDH چاهکهای تست کاسته شود تا تخمین صحیحی از میزان کشندگی سلولها حاصل گردد.
سلولها یک شب در انکوباتور با دمای 37 درجه سانتیگراد و CO2 5% انکوبه شده و روز بعد بر اساس دستورالعمل کیت میزان مرگ در بین سلولهای هدف در هر چاهک بر اساس میزان رهایش LDH از سلولها اندازهگیری شد. به طور خلاصه پلیتها با دور g 200 سانتریفیوژ شدند و 50 میکرولیتر از مایع رویی هر چاهک برداشته شد و پس از افزودن معرفهای موجود در کیت جذب نوری هر نمونه در طول موج 500 نانومتر اندازهگیری شد.
آنالیز آماری:
جهت تجزیه و تحلیل آماری از نرمافزار Graph Pad prism ورژن 8 استفاده شد و 05/0 p< معنادار در نظر گرفته شد. برای مقایسه بین دو گروه از آزمایش student T-test و جهت مقایسه بین چند گروه از آزمایش ANOVA و پست هاک Tukey استفاده شد.
یافتهها
تولید وکتور لنتیویروسی:
پس از ترانسفکت سلولهای LentiX 293T با پلاسمیدهای Transfer، psPAX2 و pMD2G به واسطه PEI ، سوپ ویروسی در فواصل مشخص جمعآوری شده و تغلیظ شد. جهت تعیین تعداد پارتیکلهای ویروسی در هر میکرولیتر از سوپ ویروس تغلیظ شده، سه غلظت از سوپ ویروس تغلیظ شده تهیه شده و به سلولهای LentiX 293T دارای شمارش مشخص افزوده شد. 72 ساعت پس از عمل ترانسداکشن، سلولهای LentiX 293T با آنزیم تریپسین از کف پلیت کنده شده و جهت تعیین تیتر ویروس مورد بررسی قرار گرفتند. جهت تعیین تیتر از بررسی بیان GFP در سلولها استفاده شد. به این ترتیب ویروسهای تغلیظ شده در سریهای مختلف کاری تعیین تیتر شدند که تیتر ویروس حاوی CAR به طور میانگین برابر با 2250 ± 15500 پارتیکل در هر میکرولیتر و تیتر ویروس Mock برابر با 4200 ± 22500 پارتیکل در هر میکرولیتر بود.
ایمونوفنوتایپینگ ُسلولهای T و CIK :
به طور میانگین در بین تمامی گروههای لنفوسیتهای T میزان خلوص سلولهای CD3+ برابر با 1 ± 6/91% بود. از این میان 1 ± 12/33% سلولها شامل سلولهای CD4+ ، 1 ± 5/60% سلولها شامل سلولهای CD8+ و به ترتیب 9/0 ± 72/3% و 1 ± 82/3% سلولها شامل سلولهای CD4+ CD8+ و CD4- CD8- بود. همچنین در بین تمامی جمعیتهای سلولهای CIK به طور میانگین جمعیت CD3+ CD56+ برابر با 1/3 ± 72/59%، جمعیت CD3+CD56- برابر با 8/3 ± 88/32%، جمعیت CD3-CD56+ برابر با 9/1 ± 89/5% و جمعیت CD3- CD56- برابر با 5/2 ± 52/1% بود (شکل 1).
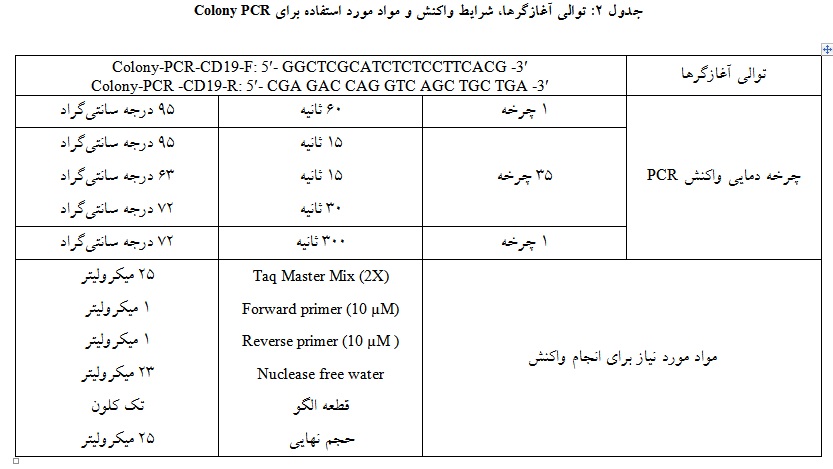
میزان بیان GFP در هر دو گروه سلولهای CAR-CIK و CAR-T به ترتیب برابر با 9/0 ± 3/36% و 8/1 ± 7/34% بود (شکل 2). همچنین میزان بیان GFP در سلولهای Mock CIK و Mock T به ترتیب برابر با 2/1 ± 3/44% و 5/2 ± 4/45% بود.
تولید رده سلولی K562 CD19+ :
با توجه به آغازگرهای طراحی شده برای تکثیر قطعه CD19 از cDNA سنتز شده، در این مرحله تشکیل
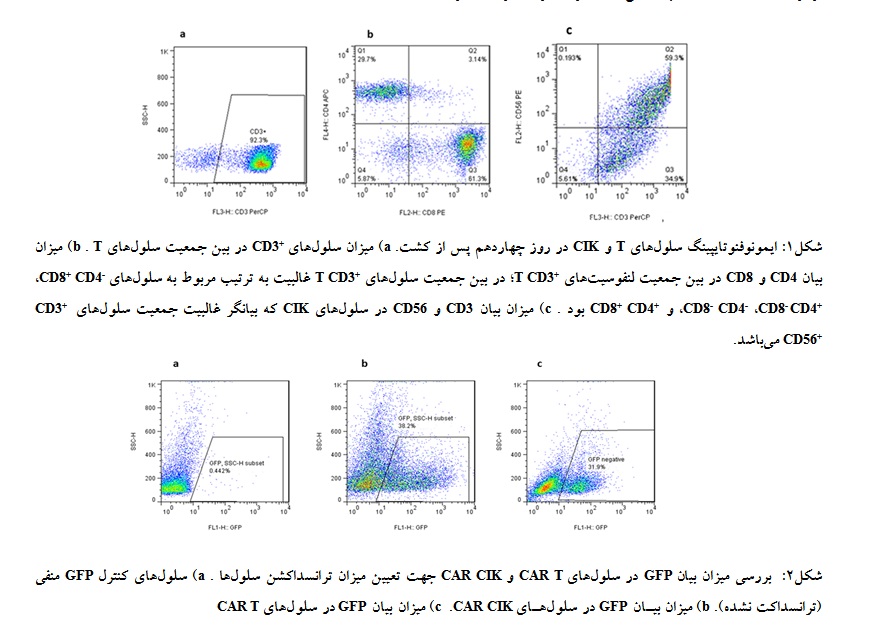
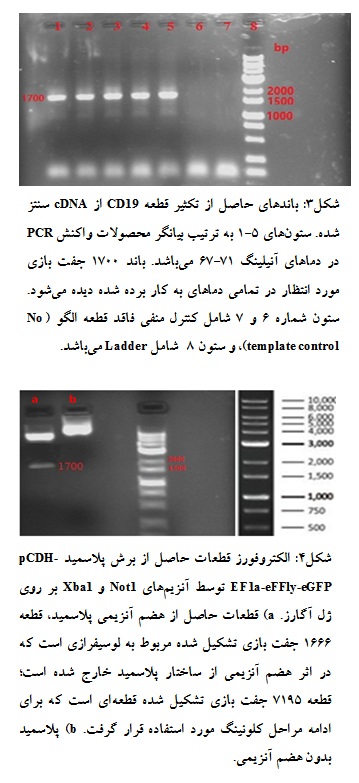
باندهایی به اندازه 1700 جفت باز مورد انتظار بود که چنین باندی در تمامی دماهای به کار رفته برای آنیلینگ ایجاد شده بود (شکل 3). دمای 67 درجه سانتیگراد به عنوان دمای بهینه آنیلینگ انتخاب و برای ادامه به کار گرفته شد. برای کلون کردن قطعه CD19 به داخل پلاسمید pCDH-EF1a-eFFly-eGFP هر دو قطعه با آنزیمهای NOT1 وXba1 برش داده شدند که باندهای حاصل از برش پلاسمید pCDH-EF1a-eFFly-eGFP در نمودار قابل مشاهده میباشد (شکل 4).
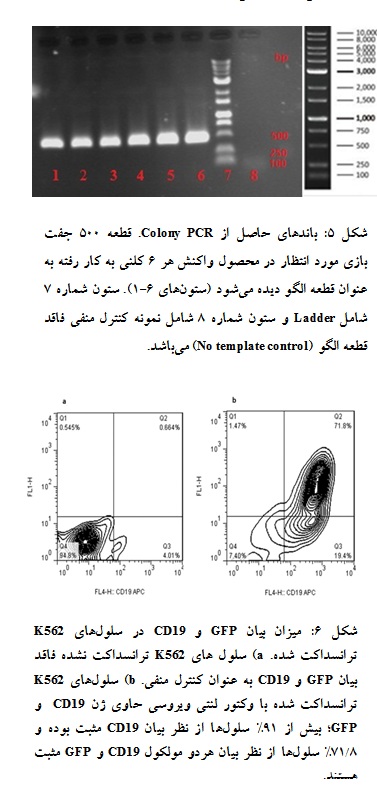
با توجه به آغازگرهای طراحی شده برای Colony PCR تشکیل باندی با طول 500 جفت باز مورد انتظار بود که چنین باندی در هر شش کلون مورد استفاده مشاهده شد (شکل 5). پس از تولید و تغلیظ وکتور لنتی ویروسی حاوی ژن CD19 سوپ ویروس تغلیظ شده با انجام فلوسیتومتری تعیین تیتر شد که تیتر آن برابر با 1438 ± 15938 پارتیکل در هر میکرولیتر بود. 72 ساعت پس از دومین ترانسداکشن، میزان بیان CD19 و GFP در سلولهای K562 به ترتیب برابر با 2/91% و 8/71% بود (شکل 6).
بررسی میزان کشندگی سلولها:
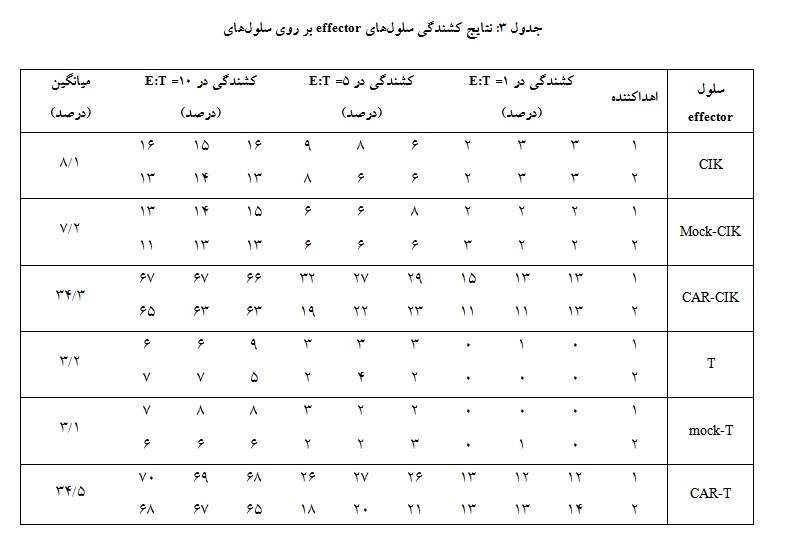
برای بررسی میزان کشندگی، هر یک از سلولهای effector در سه نسبت 1:1، 1:5 و1:10 با سلولهای target (سلولهای CD19+ K562) به صورت شبانه کشت داده شدند و صبح روز بعد میزان مرگ در بین سلولهای target بر اساس میزان رهایش LDH اندازهگیری شد (جدول 3 و
نمودار 1).
سلولهای CIK فاقد CAR در تمامی نسبتهای E: T کشندگی بیشتری را در مقایسه با سلولهای T فاقد CAR از خود بروز دادند با این حال این تفاوت به لحاظ آماری معنادار نبود. بین سلولهای Mock CIK و CIK و سلولهای Mock T و T نیز تفاوت معناداری مشاهده نشد. انتقال گیرنده CAR به هر دو سلول CIK و T موجب افزایش معنادار کشندگی این سلولها در مقایسه با سلولهای CIK و T فاقد CAR شد (001/0 p<). سلولهای CAR-CIK و CAR-T هر دو یک کشندگی وابسته به دوز را از خود نشان دادند به طوری که با افزایش دوز میزان مرگ در بین سلولهای هدف به طور معناداری نسبت به دوزهای پیشین افزایش یافت (نمودار 2). سلولهای CAR-CIK کشندگی قابل مقایسهای را با سلولهای CAR-T از خود نشان دادند به طوری که تفاوت معناداری بین قدرت کشندگی این دو جمعیت سلولی مشاهده نشد (نمودار 2).
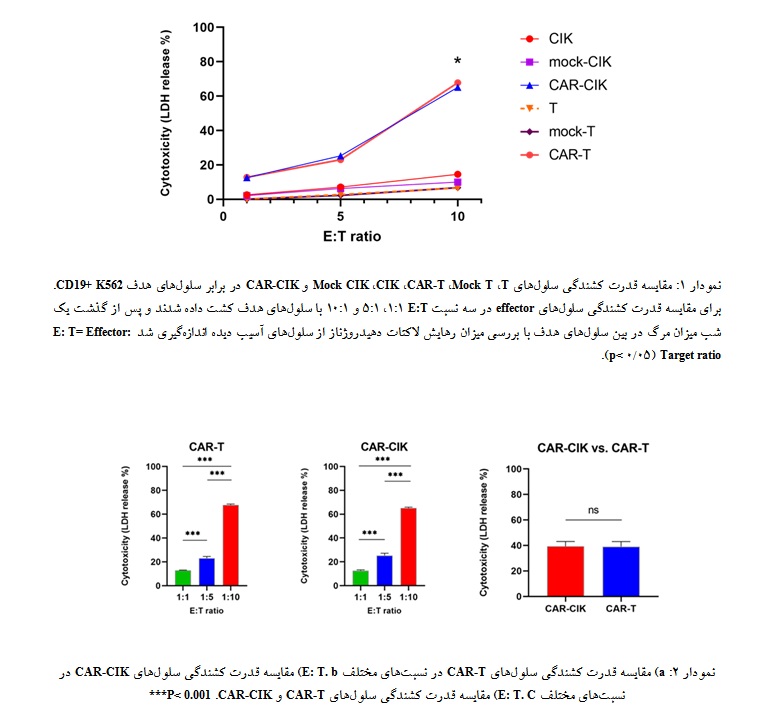
کشندگی سلولهای CAR CIK با سلولهای CAR-T مشاهده نشد.
درمانهای رایج سرطان از قبیل شیمیدرمانی و پرتو درمانی همیشه قادر به ریشهکن سازی کامل بیماری نبوده و به علاوه اثرات مخربی را برروی بافتهای سالم بدن برجای میگذارند. در سالهای اخیر ظهور سلولهای CAR-T تحولی عظیم در درمان سرطان ایجاد کرده است به طوری که این روش درمانی امروزه جزو روشهای درمانی استاندارد برای بسیاری از بدخیمیهای لنفوسیتهای B به حسـاب مـیآید. ایـن درمان به صورت
استاندارد از طریق جداسازی لنفوسیتهای T اتولوگ از بیمار و آمادهسازی آنها در محیط ex vivo برای تزریق مجدد به بیمار انجام میشود که با مشکلاتی اساسی از قبیل هزینه بسیار بالا و زمان آمادهسازی طولانی مواجه میباشد. از طرفی استفاده از منابع آلوژنیک سلولهای T نیز با خطر ایجاد GvHD و ایمنیزایی در بدن میزبان روبرو میباشد (13، 10-6).
سلولهای CIK به عنوان یک سلول قابل تهیه از منابع آلوژنیک و با خطر پایین ایجاد GvHD میتوانند جایگزینی بالقوه برای لنفوسیتهای T در ایمنی درمانی با سلولهای بیان کننده CAR باشند. مطالعههای متعددی نشان دادهاند که انتقال گیرنده CAR به سلولهای CIK موجب افزایش قدرت کشندگی این سلولها در برابر سلولهای سرطانی میشود (22-20). همچنین نشان داده شده که این سلولها میتوانند هم از طریق سیگنالینگ وابسته به CAR و هم از طریق مکانیسمهای مستقل از CAR قدرت کشندگی خود را بر سلول هدف اعمال کنند. از طرفی نشان داده شده که سیگنالینگ CAR در سلولهای CIK علاوه بر ایجاد سیتوتوکسیسیتی وابسته به CAR میتواند موجب تقویت پاسخهای مستقل از CAR نیز بشود (23). به علاوه الگوی بیان گیرندههای کموکاینی در سلولهای CIK به گونهای است که در عین کاهش ترافیک آنها به ارگانهای هدف GvHD موجب افزایش ترافیک آنها به ارگانهای توموری میشود (24). تمامی این موارد این سلولها را به عنوان جایگزینی بالقوه و با خطر پایین GvHD برای سلولهای CAR-T مطرح میکند.
در این مطالعه نیز همراستا با مطالعههای پیشین نشان داده شد که انتقال گیرنده CAR به سلولهای CIK موجب افزایش قدرت کشندگی این سلولها میشود (25، 22-20، 18). طبق نتایج مطالعه حاضر با این که سلولهای CIK فاقد CAR حدی پایه از کشندگی را بر روی سلولهای هدف اعمال میکنند، با این حال انتقال گیرنده CAR موجب افزایش معنادار قدرت کشندگی این سلولها میگردد. به طوری که در هر سه نسبت E: T به کار رفته سلولهای CAR-CIK تفاوت معناداری را در قدرت کشندگی در مقایسه با سلولهای CIK فاقد CAR از خود نشان دادند. سلولهای CAR-CIK همانند سلولهای CAR-T یک کشندگی وابسته به دوز را از خود نشان دادند به طوری که با افزایش نسبت E:T میزان کشندگی این سلولها نیز به طور معناداری افزایش یافت.
مطالعهها نشان دادهاند که استفاده از سازه CAR نسل سوم که دارای دو دامین کمک محرک میباشد، موجب آپوپتوز ناشی از فعال شدن شدید (Activation induced cell death) در سلولهای CAR-T می شود (3). با این حال این نتایج در مورد سلولهای CIK متغیر میباشد. در حالی که مطالعهای در سال 2013 نشان داد که استفاده از CAR نسل سوم بر علیه آنتیژن کارسینوامبریونیک (CEA) موجب آپوپتوز ناشی از فعالسازی شدید میشود (23)، مطالعهای دیگر در سال 2016 نشان داد که استفاده از نسل سوم CAR بر علیه آنتیژن گیرنده فولات (FRα) در مقایسه با نسل دوم این گیرنده موجب پاسخ بهتر سلولهای CAR-CIK در برابر سلول های بیانکننده FRα میشود(25). این تفاوت ممکن است به تفاوت قدرت اتصال CAR با دو آنتیژن متفاوت مربوط باشد به طوری که در موارد اتصال با avidity پایین استفاده از نسل سوم CAR میتواند کمککننده باشد در حالی که در مواقع اتصال با تمایل (avidity) بالا استفاده از CAR نسل سوم با ارسال سیگنالهای فعالسازی قوی میتواند موجب مرگ ناشی از فعال شدن شدید سلول گردد. از طرفی به این دلیل که استفاده از دامینهای پیامرسانی DAP10 و DAP12 به عنوان جایگزین دامین CD3 Zeta و دامین کمک محرک 2B4 به جای CD28 و 4-1BB در ساختمان CAR در سلولهای CAR-NK نتایج مثبتی را نشان داده است، لازم است تا تاثیر این ساختارها در عملکرد سلولهای CAR-CIK نیز مورد بررسی قرار گیرد (26).
علاوه بر موارد ذکر شده چند مورد دیگر نیز میتواند در مقایسه سلولهای CAR-T و CAR-CIK در نظر گرفته شود. برای مثال میزان نیاز به IL-2 جزو مواردی میباشد که میتواند در مقایسه این دو نوع سلول حائز اهمیت باشد، چرا که استفاده از IL-2 به علت ایجاد سمیت در بدن با محدودیت دوز روبرو میباشد (27). همان طور که در قسمت مواد و روشها ذکر شد کشت سلولهای CIK در محیط کشت به میزان بیشتری از IL-2 در مقایسه با سلولهای T نیاز دارد. همچنین در مطالعهای نشان داده شد که سلولهای CIK فعال شده در مقایسه با سلولهای T فعال شده میزان IL-2 کمتری از خود آزاد میکنند (23). این موارد یعنی کم بودن میزان IL-2 مترشحه از سلولهای فعال شده و نیاز به منابع خارجی سیتوکین میتواند در عملکرد in vivo سلولها اثرگذار باشد. بنابراین لازم است تا در مطالعههای in vitro میزان سیتوتوکسیسیتی بلند مدت این سلولها در عدم حضور IL-2 مورد مقایسه قرار گیرد و مطالعههای in vivo تکمیلی نیز برای پایش بلند مدت این سلولها در درون بدن انجام شود. همچنین لازم است تا میزان بیان سطحی نشانگرهای فرسودگی (exhaustion) سلولی از قبیل PD-1 و LAG-3 نیز در بلند مدت در این سلولها مورد مقایسه قرار گیرد تا از بعد کاملتری بتوان این دو سلول را مورد مقایسه قرار داد.
نتیجهگیری
در مطالعه حاضر نشان داده شد که سلولهای CAR-CIK از قدرت کشندگی قابل مقایسهای با سلولهای CAR-T برخوردار هستند. طبق نتایج مطالعه حاضر و مطالعههای پیشین میتوان گفت که سلولهای CAR-CIK آلوژنیک دو شرط لازم برای استفاده به عنوان جایگزین سلولهای CAR-T آلوژنیک، یعنی قدرت کشندگی کافی و خطر پایین GvHD را دارا میباشند. با این حال لازم است تا مطالعههای بیشتری برای ارزیابی و مقایسه سایر ابعاد مؤثر در عملکرد این سلولها در دست انجام قرار گیرد تا بتوان با دید دقیق تری به مقایسه این دو جمعیت سلولی
پرداخت.
حمایت مالی
هزینههای این مطالعه توسط دانشگاه علوم پزشکی تهران تأمین شده است.
ملاحظات اخلاقی
در پایان لازم به ذکر میباشد که این مطالعه به تایید کمیته اخلاق دانشگاه علوم پزشکی تهران رسیده است (کد اخلاق: IR.TUMS.SPH.REC.1400.171).
عدم تعارض منافع
هیچگونه تعارض منافعی در مطالعه حاضر وجود نداشته است.
نقش نویسندگان
وحید مرادی: انجام مراحل عملی، تجزیه و تحلیل و تفسیر نتایج، تهیه پیشنویس مقاله
اعظم رنجبر: انجام مراحل عملی، تجزیه و تحلیل و تفسیر نتایج
دکتر آزاده امیدخدا: طراحی مطالعه، بازبینی و اصلاح پیشنویس مقاله
دکتر ناصر احمدبیگی: مدیریت و طراحی مطالعه، بازبینی و اصلاح پیشنویس مقاله
تشکر و قدردانی
بدینوسیله از اساتید، کارکنان و دانشجویان پژوهشکده گوارش و کبد دانشگاه علوم پزشکی تهران، تشکر و قدردانی میگردد.
متن کامل: (858 مشاهده)
مقایسه میزان کشندگی سلولهای CD19 CAR-CIK و CD19 CAR-T
در محیط in vitro
وحید مرادی1، اعظم رنجبر2، آزاده امیدخدا3، ناصر احمدبیگی4
چکیده
سابقه و هدف
علیرغم موفقیتهای سلولهای CAR-T در درمان بدخیمیهای خونی، استفاده از منابع آلوژنیک لنفوسیتهای T برای تولید این سلولها با خطر ایجاد GvHD همراه است. سلولهای CIK سلولهایی با خطر پایین GvHD میباشند؛ بنابراین سلولهای CAR-CIK میتوانند به عنوان جایگزینی بالقوه برای سلولهای CAR-T مورد ارزیابی قرار گیرند.
مواد و روشها
در این مطالعه تجربی، پس از جداسازی و کشت سلولهای تک هستهای خون محیطی دو اهداکننده سالم، سلولهای T و CIK با استفاده از وکتور لنتی ویروسی حاوی ژن CD19 CAR ترانسداکت شدند. در روز شانزدهم کشت برای مقایسه کشندگی سلولهای CAR-T و CAR-CIK از همکشتی این سلولها با سلولهای هدف CD19+ K562 استفاده شد و میزان مرگ در بین سلولهای هدف با استفاده از کیت سنجش لاکتات دهیدروژناز اندازهگیری شد. جهت تجزیه و تحلیل آماری از نرمافزار Graph Pad Prism ورژن 8 و تجزیه و تحلیل Student T-test و Anova و پست هاک Tukey استفاده شد و 05/0 p< معنادار در نظر گرفته شد.
یافتهها
در هر دو گروه سلول های CAR-T و CAR-CIK گیرنده CAR موجب افزایش معنادار کشندگی سلولها شد؛
به طوری که تفاوت معناداری بین قدرت کشندگی سلولهای CAR-T (7/1 ± 8/67%) و CAR-CIK (8/1 ± 1/65%) مشاهده نشد.
نتیجه گیری
سلولهای CAR-CIK در محیط in vitro کشندگی مناسبی را از خود بروز میدهند لذا میتوانند به عنوان جایگزینی برای سلولهای CAR-T مطرح باشند. با این حال مطالعههای بیشتری جهت مقایسه سایر ابعاد مؤثر در عملکرد این دو سلول مورد نیاز میباشد.
کلمات کلیدی: Chimeric Antigen Receptors، سلولهای T، سلولهای کشنده القا شده با سیتوکین، بیماری پیوند علیه میزبان
تاریخ دریافت: 14/06/1402
تاریخ پذیرش : 23/08/1402
1- کارشناس ارشد هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشکده علوم پیراپزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
2- کارشناس ارشد میکروبیولوژی ـ مرکز تحقیقات ژن درمانی ـ پژوهشکده گوارش و کبد دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
3- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشیار گروه هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشکده علوم پیراپزشکی ـ دانشگاه علوم پزشکی تهران ـ تهران ـ ایران ـ صندوق پستی: 44361-14177
4- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشیار مرکز تحقیقات ژن درمانی پژوهشکده گوارش و کبد دانشگاه علوم پزشکی تهران ـ تهران ـ ایران ـ صندوق پستی: 14117-13135
در محیط in vitro
وحید مرادی1، اعظم رنجبر2، آزاده امیدخدا3، ناصر احمدبیگی4
چکیده
سابقه و هدف
علیرغم موفقیتهای سلولهای CAR-T در درمان بدخیمیهای خونی، استفاده از منابع آلوژنیک لنفوسیتهای T برای تولید این سلولها با خطر ایجاد GvHD همراه است. سلولهای CIK سلولهایی با خطر پایین GvHD میباشند؛ بنابراین سلولهای CAR-CIK میتوانند به عنوان جایگزینی بالقوه برای سلولهای CAR-T مورد ارزیابی قرار گیرند.
مواد و روشها
در این مطالعه تجربی، پس از جداسازی و کشت سلولهای تک هستهای خون محیطی دو اهداکننده سالم، سلولهای T و CIK با استفاده از وکتور لنتی ویروسی حاوی ژن CD19 CAR ترانسداکت شدند. در روز شانزدهم کشت برای مقایسه کشندگی سلولهای CAR-T و CAR-CIK از همکشتی این سلولها با سلولهای هدف CD19+ K562 استفاده شد و میزان مرگ در بین سلولهای هدف با استفاده از کیت سنجش لاکتات دهیدروژناز اندازهگیری شد. جهت تجزیه و تحلیل آماری از نرمافزار Graph Pad Prism ورژن 8 و تجزیه و تحلیل Student T-test و Anova و پست هاک Tukey استفاده شد و 05/0 p< معنادار در نظر گرفته شد.
یافتهها
در هر دو گروه سلول های CAR-T و CAR-CIK گیرنده CAR موجب افزایش معنادار کشندگی سلولها شد؛
به طوری که تفاوت معناداری بین قدرت کشندگی سلولهای CAR-T (7/1 ± 8/67%) و CAR-CIK (8/1 ± 1/65%) مشاهده نشد.
نتیجه گیری
سلولهای CAR-CIK در محیط in vitro کشندگی مناسبی را از خود بروز میدهند لذا میتوانند به عنوان جایگزینی برای سلولهای CAR-T مطرح باشند. با این حال مطالعههای بیشتری جهت مقایسه سایر ابعاد مؤثر در عملکرد این دو سلول مورد نیاز میباشد.
کلمات کلیدی: Chimeric Antigen Receptors، سلولهای T، سلولهای کشنده القا شده با سیتوکین، بیماری پیوند علیه میزبان
تاریخ دریافت: 14/06/1402
تاریخ پذیرش : 23/08/1402
1- کارشناس ارشد هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشکده علوم پیراپزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
2- کارشناس ارشد میکروبیولوژی ـ مرکز تحقیقات ژن درمانی ـ پژوهشکده گوارش و کبد دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
3- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشیار گروه هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشکده علوم پیراپزشکی ـ دانشگاه علوم پزشکی تهران ـ تهران ـ ایران ـ صندوق پستی: 44361-14177
4- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و علوم انتقال خون ـ دانشیار مرکز تحقیقات ژن درمانی پژوهشکده گوارش و کبد دانشگاه علوم پزشکی تهران ـ تهران ـ ایران ـ صندوق پستی: 14117-13135
مقدمه
لنفوسیتهای T بیانکننده گیرنده آنتیژنی دوگانه [Chimeric antigen receptor T cells (CAR-T cells)] در سالهای اخیر به عنوان یکی از شاخههای ایمنی درمانی سرطان، موفقیتهای چشمگیری را به خصوص در زمینه درمان بدبخیمیهای خونی لنفوسیتهای B کسب کردهاند؛ به گونهای که از سال 2017 تاکنون، هشت محصول مجوز عرضه بالینی را اخذ نمودهاند (2، 1). CAR یک گیرنده صناعی میباشد که در آن دامین خارج سلولی از ناحیه متغیر زنجیره یک آنتیبادی ] single-chain variable fragment (scFv) [ تشکیل شده است که توسط یک دامین غشاگذر به دامینهای پیامرسان داخل سلول متصل میشود. دامینهای پیامرسان داخل سلولی از نواحی پیامرسان زنجیره CD3 zeta و دامین کمک محرک (مانند CD28) تشکیل شده است (3). بدین ترتیب این گیرنده اختصاصیتی مطابق با اختصاصیت ناحیه scFv به کار رفته خواهد داشت و برخلاف گیرنده سلولی درونزای لنفوسیتهای T ، قادر به شناسایی آنتیژنهای توموری بدون نیاز به عرضه آنها توسط مولکولهای سازگاری بافتی نسجی [major histocompatibility complex (MHC)] خواهد بود. این ویژگی سلولهای CAR-T را قادر میسازد تا سلولهای سرطانی را که با کاهش بیان سطحی مولکولهای MHC خود را از دسترس لنفوسیتهای T پنهان کردهاند، شناسایی کرده و از بین ببرند (4).
تمامی CAR-T cell هایی که مجوز عرضه بالینی را دریافت کردهاند، از منبع اتولوگ تهیه میشوند. در این روش سلولهای تک هستهای خون محیطی بیمار که حاوی لنفوسیتهای T هستند از طریق لوکوفرزیس جداسازی میشوند. پس از کشت و فعالسازی این سلولها در محیط کشت حاوی IL-2 و آنتیبادیهای anti-CD3 ، anti-CD28 و anti-CD2، ژن بیان کننده CAR از طریق وکتورهای ویروسی/غیر ویروسی به سلولها منتقل میشود. سپس سلولها به مدت دو تا سه هفته در محیط کشت تکثیر میشوند تا به مقدار مناسب برای تزریق به بیمار برسند (5). علیرغم تحولی که سلولهای CAR-T اتولوگ در درمـان بدخیمیهــای لنفوسـیتهای B کسـب کردهانــد،
این روش با چالشهای اساسی روبرو میباشد. این نوع از درمان به صورت یک روند شخصیسازی شده برای هر بیمار طی میشود که منجر به افزایش هزینه تولید محصول میشود، به طوری که هزینه هر بار تزریق این محصولات در آمریکا بین 375000 تا 450000 دلار میباشد (6). از سوی دیگر این روش فرآیندی زمانبر است به طوری که سریعترین فرآیند تولید مربوط به فرآورده Kymriah میباشد که تولید آن به 19 تا 20 روز زمان نیاز دازد. با توجه به این که این درمان عمدتاً برای بیمارانی که در مراحل نهایی بیماری قرار داشته و نسبت به سایر درمانها مقاومت نشان دادهاند استفاده میشود، این مسأله تأخیری بسیار بزرگ محسوب میشود، چرا که در طی فرآیند تولید ممکن است به علت پیشرفت بیماری بیمار فوت کرده و یا صلاحیت درمان را از دست بدهد (7). امکان شکست فرآیند تولید و هم چنین امکان آلودگی محصول نهایی با سلولهای بدخیم در طی انجام لوکوفرزیس از دیگر مشکلات این روش درمانی محسوب میشود (10-8).
با توجه به مشکلات مذکور استفاده از منابع آلوژنیک لنفوسیتهای T برای تولید سلولهای CAR-T در سالهای اخیر توجه زیادی را به خود معطوف کرده است. لنفوسیتهای T آلوژنیک را میتوان از خون محیطی اهداکنندگان سالم، سلولهای بنیادی پر توان و خون بند ناف تهیه کرد (12، 11). با این حال استفاده از تمامی این منابع آلوژنیک با دو مشکل اساسی روبرو میباشد: خطر ایجاد بیماری پیوند علیه میزبان ](GvHD)[Graft versus host disease و پایداری پایین این سلولها در محیط بدن به علت پاسخ های ایمنی میزبان (13).
سلولهای کشنده القاشده با سیتوکین (CIK cells : Cytokine induced killer cells) سلولهایـی بـا فنـوتیــپ
مخلوط لنفوسیتهای T و سلولهای کشنده طبیعی [Natural killer cells (NK cells)] هستند که در محیط آزمایشگاه با افزودن ترتیبی Interferon (IFN)-γ ، Interleukin (IL)-2 و آنتیبادی anti-CD3 در طی زمانهای مشخص از سلولهای تک هستهای خون محیطی [Peripheral blood mononuclear cells (PBMCs)] تکثیر میشوند (14). سلولهای CIK جمعیت هتروژنی از سلولهایی با چهار نوع فنوتیپ متفاوت میباشند که شامل جمعیت غالبی از سلولها با فنوتیپ CD3+ CD56+ ، سلولهای CD3+ CD56- و درصد کمی از سلولهای CD3-CD56+ و سلولهای CD3-CD56- میباشد (15). مطالعهها نشان دادهاند که استفاده از سلولهای CIK آلوژنیک در مقایسه با لنفوسیتهای αβ-T با خطر پایینتری از ایجاد GvHD همراه است (17، 16). همچنین مطالعههای قبلی نشان دادهاند که با انتقال ژن CAR به سلولهای CIK ، این سلولها قادر خواهند بود تا هم از طریق مکانیسمهای وابسته به CAR و هم از طریق مکانیسمهای مستقل از CAR (از طریق گیرندههای فعالکننده سلول NK مانند گیرنده NKG2D) به مقابله با سلولهای بدخیم بپردازند (18).
با توجه به این که یک جایگزین مناسب برای سلولهای CAR-T لازم است تا در عین خطر پایین GvHD از کشندگی قابل مقایسهای با این سلولها نیز برخوردار باشد، در این مطالعه یک بررسی in vitro اولیه جهت مقایسه قدرت کشندگی سلولهای CD19 CAR-T و CD19 CAR-CIK در برابر سلولهای K562 بیان کننده مولکول سطحی CD19 صورت گرفت.
مواد و روشها
جداسازی سلولهای تک هستهای خون محیطی و کشت سلولهای T و CIK :
پس از اخذ فرم رضایت از دو اهداکننده سالم 28 و 38 ساله که دارای شمارش طبیعی گلبولهای سفید خون بودند، به میزان 20 میلیلیتر خون وریدی در ضد انعقاد K2EDTA گرفته شد. برای جداسازی سلولهای تک هستهای خون محیطی [Peripheral blood mononuclear cells(PBMC)] از نمونه خون اهداکنندگان سالم از روش سانتریفیوژ گرادیان شیب غلظت با فایکول 077/1 (inno-train ، آلمان) استفاده شد. برای کشت سلولهای CIK ابتدا PBMC ها جهت حذف سلولهای چسبنده به مدت سه ساعت در محیط Roswell Park Memorial Institute (RPMI) 1640 (ایده زیست، ایران) فاقد سرم جنین گاوی [Fetal bovine serum (FBS)] کشت داده شدند. پس از گذشت مدت زمان مذکور، سلولهای غیرچسبنده جدا شده و به تعداد یک میلیون سلول در هر چاهک از پلیت 24 خانه کشت داده شدند. به هر چاهک یک میلیلیتر محیط RPMI دارای FBS 10% (دنازیست، ایران) و IFN-γ (Miltenyi Biotech ، آلمان) با غلظت U/mL 1000 افزوده شد. در روز بعد IL-2 (Miltenyi Biotech ، آلمان) با غلظت IU/mL 300 و آنتیبادی anti-CD3 OKT3 (Miltenyi Biotech ، آلمان) با غلظت ng/mL100 به هر کدام از چاهکها افزوده شد. چاهکها هر روز بررسی شده و محیط هر چاهک هر دو تا سه روز با محیط تازه دارای FBS 10% و (U/mL 300) IL-2 تعویض شد. برای کشت لنفوسیتهای T ابتدا PBMC های جدا شده از اهداکنندگان سالم به تعداد یک میلیون سلول در هر چاهک از پلیت 24 خانه کشت داده شدند. به هر چاهک میزان یک میلیلیتر محیط TexMACS (Miltenyi Biotech ، آلمان) حاوی FBS 10% ، IL-2 با غلظت U/mL100 و بیدهای معناطیسی Coat شده با آنتیبادیهای anti-CD3 ، anti-CD2 و anti-CD28 (Miltenyi Biotech ، آلمان) به تعداد نصف سلولهای موجود در هر چاهک افزوده شد. سلولها هر روز از نظر مورفولوژیک بررسی شده و محیط هر چاهک هر سه روز یک بار با محیط تازه حاوی FBS 10% و (U/mL 100) IL-2 تعویض شد.
تولید وکتور لنتی ویروسی:
برای تولید وکتور لنتی ویروسی از پلاسمیدهای psPAX2 ، pMD2G و پلاسمیدهای Transfer که در مطالعه پیشین گروه طراحی و به کار برده شده بودند استفاده شد (19). لازم به ذکر است که در این مرحله از دو نوع پلاسمید transfer جهت تولید دو وکتور ویروسی متفاوت استفاده شد. پلاسمید Transfer اول که به صورت bicistronic دارای ژنهای CAR و GFP بود و پلاسمید transfer دوم برای تولید وکتور ویروسی Mock که کاملاً مشابه پلاسمید Transfer اول بود به استثنای این که فاقد توالی کد کننده CAR بود. پلاسمیدهای مورد نظر با استفاده از حامل پلیاتیلنایمین [polyethylenimine (PEI)] به درون سلولهای LentiX 293T ترانسفکت شدند. در فواصل زمانی 24 ساعت، 36 ساعت، 48 ساعت و 60 ساعت پس از ترانسفکشن، سوپ حاوی پارتیکلهای ویروسی جمعآوری شده و پس از سانتریفیوژ با دور g 10000 و دمای 4 درجه سانتیگراد با فیلتر پلیاترسولفون Um 45/0 فیلتر شد. در مرحله بعد جهت تغلیظ ویروس، از روش گرادیان سوکروز 20% استفاده شد. به طور خلاصه در هرکدام از لولههای اولتراسانتریفیوژ به میزان یک دهم حجم سوپ ویروسی سوکروز 20% ریخته شد و سپس سوپ ویروسی به آرامی به هر لوله افزوده شد، به طوری که یک محلول دو فازی در هر لوله ایجاد شد. در ادامه لولهها با دور g 50000 و در دمای چهار درجه سانتیگراد به مدت سه ساعت سانتریفیوژ شدند. پس از حذف مایع رویی رسوب ویروسی حاصل در 100 میکرولیتر محیط TexMACS حل شده و تا زمان استفاده در دمای 80- درجه سانتیگراد ذخیره شد. در نهایت برای تعیین تیتر ویروس تغلیظ شده سلولهای LentiX 293T پس از شمارش، با رقتهای مختلف ویروس تغلیظ شده ترانسداکت شدند و با تعیین درصد سلولهای آلوده شده (سلولهای GFP+)، تیتر ویروس تعیین شد.
ترانسداکشن سلولها:
جمعیت سلولهای T و CIK در روز سوم کشت هر کدام به سه گروه تقسیم شدند: گروه اول شامل سلولهای ترانسداکت نشده (T و CIK)، گروه دوم شامل سلولهای ترانسداکت شده با وکتور ویروسی حاوی CAR (CAR-T و CAR-CIK) و گروه سوم شامل سلولهای ترانسداکت شده با ویروس Mock (Mock T و Mock CIK). جهت ترانسداکشن سلولها از ضریب آلوده سازی [multiplicity of infection (MOI)] 5 استفاده شد. برای انجام ترانسداکشن پس از کشت سلولهای T و CIK در یک پلیت 24 خانه، حجم هر خانه به گونهای تنظیم شد که پس از افزودن میزان مورد نیاز از سوپ ویروسی و محیط کشت، حجم نهایی به 300 میکرولیتر برسد. به خانههای حاوی سلولهای T و CIK ترانسداکت نشده نیز به ترتیب 300 میکرولیتر محیط TexMacs و RPMI افزوده شد. سلولها به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد و CO2 5% انکوبه شدند و پس از طی زمان مذکور، محیط حاوی سوپ ویروسی با محیط تازه دارای FBS 10% و IL-2 تعویض شد.
ایمونوفنوتایپینگ سلولها:
سلولهای T و CIK در روز چهاردهم پس از کشت جهت بررسی بیان مولکولهای سطحی سلولهای T و CIK مورد ارزیابی قرار گرفتند. به این منظور هر کدام از جمعیتهای سلولی به تعداد 105 × 1 عدد سلول در صد میکرولیتر PBS حاوی BSA 3% حل شدند. سپس جمعیتهای سلولهای T با پنج میکرولیتر از آنتیبادیهای anti-CD3-perCP (BD Bioscience ، آمریکا)، anti-CD4-APC (BD Bioscience ، آمریکا) و anti-CD8-PE (BD Bioscience ، آمریکا) و جمعیتهای سلولهای CIK با پنج میکرولیتر از آنتیبادیهای anti-CD3-perCP (BD Bioscience ، آمریکا) و anti-CD56-PE (BD Bioscience ، آمریکا) رنگآمیزی شدند و با دستگاه فلوسیتومتریBD FACSCalibur مورد ارزیابی قرار گرفتند. همچنین برای بررسی میزان ترانسداکشن سلولها از سنجش میزان بیان پروتئین GFP در سلولهای ترانسداکت شده با روش فلوسیتومتری استفاده شد. برای بررسی دادههای فلوسیتومتری از نرمافزار Flow Jo استفاده شد.
تولید رده سلولی CD19+ K562 :
رده سلولی RAJI به عنوان منبعی با میزان بالای بیان CD19 محسوب میشود بنابراین در مطالعه حاضر از سلولهای RAJI (مرکز ملی ذخایر ژنتیک، ایران) به عنوان منبع RNA ژن CD19 استفاده شد. برای این منظور در ابتدا RNA تام سلولهای RAJI با روش Trizol/choloroform استخراج شد. در ادامه با استفاده از کیت سنتز DNA مکمل (cDNA)(پیشگام، ایران) از RNA استخراج شده برای سنتز cDNA استفاده شد. برای تکثیر قطعه CD19 از cDNA سنتز شده آغازگرهای جلوبرنده و معکوس برای ایزوفرم سوم ژن CD19 طراحی شدند. همچنین برای تعیین دمای بهینه واکنش از گرادیان دمایی بین 67 تا 71 درجه سانتیگراد برای مرحله آنیلینگ استفاده شد. توالی آغازگرها، شرایط واکنش PCR و مواد مورد استفاده در واکنش PCR در جدول قابل مشاهده میباشد (جدول 1). در مرحله بعد از پلاسمید pCDH-EF1a-eFFly-eGFP (Addgene ، آمریکا) دارای ژن مقاومت به آنتی بیوتیک آمپیسیلین به عنوان پلاسمید پذیرنده برای کلون کردن
قطعه CD19 تکثیر شده استفاده شد. بدین منظور قطعه CD19 تکثیر شده و پلاسمید pCDH-EF1a-eFFly-eGFP هر دو توسط آنزیمهای محدودکننده Not1 و Xba1 (NEB ، آمریکا) برش داده شده و سپس توسط آنزیم T4 DNA Ligase (Thermo Fisher، آمریکا) به هم متصل شدند.


پلاسمید نوترکیب حاصل با استفاده از شوک دمایی به داخل E.coli Stbl4 competent cell ها ترانسفرم شده و باکتریهای ترانسفرم شده در محیط LB Agar (Thermo fisher، انگلیس) دارای آنتیبیوتیک آمپیسیلین کشت داده شده و به مدت 24 ساعت در دمای 37 درجه سانتیگراد انکوبه شدند.
پس از 24 ساعت شش عدد از کلنیهای رشد کرده بر روی پلیت (کلنیهایی که با موفقیت ترانسفرم شده و دارای ژن مقاومت به آمپیسیلین بودند) انتخاب شده و برای Colony PCR مورد استفاده قرار گرفتند (جدول 2). کلنیهای به کار رفته برای Colony PCR به طور همزمان در محیط LB broth (Thermo fisher، انگلیس) کشت داده شدند. پس از 16 ساعت انکوباسیون در دمای 37 درجه سانتیگراد از کیت استخراج پلاسمید (پیشگام، ایران) برای استخراج پلاسمید نوترکیب از باکتریهای رشد کرده استفاده شد.
برای تولید وکتور لنتی ویروسی حاوی ژن CD19 ، پلاسمیدهای psPAX2 ، pMD2G و پلاسمید Transfer نوترکیب با استفاده از PEI به درون سلولهای LentiX 293T ترانسفکت شدند و مطابق مراحل ذکر شده در قسمتهای پیشین سوپ ویروسی در فواصل معین جمعآوری شده و پس از تغلیظ تعیین تیتر شد. سلولهای K562 در محیط FBS 10% + RPMI کشت داده شده و دو مرتبه با فاصله زمانی 72 ساعت با ضریب آلودهسازی (MOI) 3 ترانسداکت شدند. 72 ساعت پس از دومین ترانسداکشن، سلولهای K562 برای بررسی بیان CD19 و GFP مورد ارزیابی قرار گرفتند. به این منظور در هر نوبت 105 × 1 سلول در بافر فسفات (کالا زیست، ایران) حاوی 3% آلبومین سرم گاوی (Sigma-Aldrich ، آمریکا) حل شده و با پنج میکرولیتر آنتیبادی anti-CD19 متصل به فلوروکروم APC (BD Bioscience ، آمریکا) رنگآمیزی شدند و با دستگاه فلوسیتومتری BD FACSCalibur برای بررسی میزان بیان GFP و CD19 مورد ارزیابی قرار گرفتند.
بررسی میزان کشندگی سلولها:
در روز شانـزدهم کشـت سلولهــای CAR-T ، CAR-
CIK، Mock T ، Mock CIK و سلولهای T و CIK ترانسداکت نشده جمعآوری شدند تا میزان کشندگی آنها در برابر سلولهای CD19+K562 مورد ارزیابی قرار گیرد. به این منظور از کیت ارزیابی کشندگی بر اساس سنجش میزان رهایش لاکتات دهیدروژناز (LDH release cytotoxicity assay) شرکت Abcam استفاده شد. طبق دستورالعمل شرکت سازنده کیت هر کدام از سلولها در نسبت effector: target (E:T ratio) 1:1 ، 1:5 و 1:10 با سلولهای هدف (CD19+K562) در پلیت 96 خانه کشت داده شدند.
هر نسبت E:T به صورت تکرار سه تایی کشت داده شد تا میانگین حاصل از سه چاهک به عنوان عدد نهایی گزارش گردد. جهت حذف تداخل رهایش LDH از سلولهای در حال آپوپتوز و LDH موجود در محیط کشت، سلولهای effector (در هر سه نسبت ×1، ×2 و ×10)، سلولهای هدف و محیط کشت فاقد سلول نیز به صورت تکرار سهتایی در پلیت کشت داده شدند تا میزان LDH آنها اندازهگیری شده و از میزان LDH چاهکهای تست کاسته شود تا تخمین صحیحی از میزان کشندگی سلولها حاصل گردد.
سلولها یک شب در انکوباتور با دمای 37 درجه سانتیگراد و CO2 5% انکوبه شده و روز بعد بر اساس دستورالعمل کیت میزان مرگ در بین سلولهای هدف در هر چاهک بر اساس میزان رهایش LDH از سلولها اندازهگیری شد. به طور خلاصه پلیتها با دور g 200 سانتریفیوژ شدند و 50 میکرولیتر از مایع رویی هر چاهک برداشته شد و پس از افزودن معرفهای موجود در کیت جذب نوری هر نمونه در طول موج 500 نانومتر اندازهگیری شد.
آنالیز آماری:
جهت تجزیه و تحلیل آماری از نرمافزار Graph Pad prism ورژن 8 استفاده شد و 05/0 p< معنادار در نظر گرفته شد. برای مقایسه بین دو گروه از آزمایش student T-test و جهت مقایسه بین چند گروه از آزمایش ANOVA و پست هاک Tukey استفاده شد.
یافتهها
تولید وکتور لنتیویروسی:
پس از ترانسفکت سلولهای LentiX 293T با پلاسمیدهای Transfer، psPAX2 و pMD2G به واسطه PEI ، سوپ ویروسی در فواصل مشخص جمعآوری شده و تغلیظ شد. جهت تعیین تعداد پارتیکلهای ویروسی در هر میکرولیتر از سوپ ویروس تغلیظ شده، سه غلظت از سوپ ویروس تغلیظ شده تهیه شده و به سلولهای LentiX 293T دارای شمارش مشخص افزوده شد. 72 ساعت پس از عمل ترانسداکشن، سلولهای LentiX 293T با آنزیم تریپسین از کف پلیت کنده شده و جهت تعیین تیتر ویروس مورد بررسی قرار گرفتند. جهت تعیین تیتر از بررسی بیان GFP در سلولها استفاده شد. به این ترتیب ویروسهای تغلیظ شده در سریهای مختلف کاری تعیین تیتر شدند که تیتر ویروس حاوی CAR به طور میانگین برابر با 2250 ± 15500 پارتیکل در هر میکرولیتر و تیتر ویروس Mock برابر با 4200 ± 22500 پارتیکل در هر میکرولیتر بود.
ایمونوفنوتایپینگ ُسلولهای T و CIK :
به طور میانگین در بین تمامی گروههای لنفوسیتهای T میزان خلوص سلولهای CD3+ برابر با 1 ± 6/91% بود. از این میان 1 ± 12/33% سلولها شامل سلولهای CD4+ ، 1 ± 5/60% سلولها شامل سلولهای CD8+ و به ترتیب 9/0 ± 72/3% و 1 ± 82/3% سلولها شامل سلولهای CD4+ CD8+ و CD4- CD8- بود. همچنین در بین تمامی جمعیتهای سلولهای CIK به طور میانگین جمعیت CD3+ CD56+ برابر با 1/3 ± 72/59%، جمعیت CD3+CD56- برابر با 8/3 ± 88/32%، جمعیت CD3-CD56+ برابر با 9/1 ± 89/5% و جمعیت CD3- CD56- برابر با 5/2 ± 52/1% بود (شکل 1).

میزان بیان GFP در هر دو گروه سلولهای CAR-CIK و CAR-T به ترتیب برابر با 9/0 ± 3/36% و 8/1 ± 7/34% بود (شکل 2). همچنین میزان بیان GFP در سلولهای Mock CIK و Mock T به ترتیب برابر با 2/1 ± 3/44% و 5/2 ± 4/45% بود.
تولید رده سلولی K562 CD19+ :
|
شکل3: باندهای حاصل از تکثیر قطعه CD19 از cDNA سنتز شده. ستونهای 5-1 به ترتیب بیانگر محصولات واکنش PCR در دماهای آنیلینگ 71-67 میباشد. باند 1700 جفت بازی مورد انتظار در تمامی دماهای به کار برده شده دیده میشود. ستون شماره 6 و 7 شامل کنترل منفی فاقد قطعه الگو (No template control)، و ستون 8 شامل Ladder میباشد.
|
باندهایی به اندازه 1700 جفت باز مورد انتظار بود که چنین باندی در تمامی دماهای به کار رفته برای آنیلینگ ایجاد شده بود (شکل 3). دمای 67 درجه سانتیگراد به عنوان دمای بهینه آنیلینگ انتخاب و برای ادامه به کار گرفته شد. برای کلون کردن قطعه CD19 به داخل پلاسمید pCDH-EF1a-eFFly-eGFP هر دو قطعه با آنزیمهای NOT1 وXba1 برش داده شدند که باندهای حاصل از برش پلاسمید pCDH-EF1a-eFFly-eGFP در نمودار قابل مشاهده میباشد (شکل 4).
|
شکل 5: باندهای حاصل از Colony PCR. قطعه 500 جفت بازی مورد انتظار در محصول واکنش هر 6 کلنی به کار رفته به عنوان قطعه الگو دیده میشود (ستونهای 6-1). ستون شماره 7 شامل Ladder و ستون شماره 8 شامل نمونه کنترل منفی فاقد قطعه الگو (No template control) میباشد.
|


با توجه به آغازگرهای طراحی شده برای Colony PCR تشکیل باندی با طول 500 جفت باز مورد انتظار بود که چنین باندی در هر شش کلون مورد استفاده مشاهده شد (شکل 5). پس از تولید و تغلیظ وکتور لنتی ویروسی حاوی ژن CD19 سوپ ویروس تغلیظ شده با انجام فلوسیتومتری تعیین تیتر شد که تیتر آن برابر با 1438 ± 15938 پارتیکل در هر میکرولیتر بود. 72 ساعت پس از دومین ترانسداکشن، میزان بیان CD19 و GFP در سلولهای K562 به ترتیب برابر با 2/91% و 8/71% بود (شکل 6).
بررسی میزان کشندگی سلولها:
برای بررسی میزان کشندگی، هر یک از سلولهای effector در سه نسبت 1:1، 1:5 و1:10 با سلولهای target (سلولهای CD19+ K562) به صورت شبانه کشت داده شدند و صبح روز بعد میزان مرگ در بین سلولهای target بر اساس میزان رهایش LDH اندازهگیری شد (جدول 3 و
نمودار 1).
سلولهای CIK فاقد CAR در تمامی نسبتهای E: T کشندگی بیشتری را در مقایسه با سلولهای T فاقد CAR از خود بروز دادند با این حال این تفاوت به لحاظ آماری معنادار نبود. بین سلولهای Mock CIK و CIK و سلولهای Mock T و T نیز تفاوت معناداری مشاهده نشد. انتقال گیرنده CAR به هر دو سلول CIK و T موجب افزایش معنادار کشندگی این سلولها در مقایسه با سلولهای CIK و T فاقد CAR شد (001/0 p<). سلولهای CAR-CIK و CAR-T هر دو یک کشندگی وابسته به دوز را از خود نشان دادند به طوری که با افزایش دوز میزان مرگ در بین سلولهای هدف به طور معناداری نسبت به دوزهای پیشین افزایش یافت (نمودار 2). سلولهای CAR-CIK کشندگی قابل مقایسهای را با سلولهای CAR-T از خود نشان دادند به طوری که تفاوت معناداری بین قدرت کشندگی این دو جمعیت سلولی مشاهده نشد (نمودار 2).


در این مطالعه نشان داده شد که همانند لنفوسیتهای T، انتقال گیرنده CD19 CAR به سلولهای CIK نیز موجب افزایش معنادار قدرت کشندگی این سلولها در برابر سلولهای هدف CD19+ میشود. همچنین نشان داده شد که سلولهای CD19 CAR-CIK در محیط in vitro کشندگی قابل مقایسهای را با سلولهای CD19 CAR-T نشان میدهند، به طوری کـه تفـاوت معنـاداری در قـدرت
کشندگی سلولهای CAR CIK با سلولهای CAR-T مشاهده نشد.
درمانهای رایج سرطان از قبیل شیمیدرمانی و پرتو درمانی همیشه قادر به ریشهکن سازی کامل بیماری نبوده و به علاوه اثرات مخربی را برروی بافتهای سالم بدن برجای میگذارند. در سالهای اخیر ظهور سلولهای CAR-T تحولی عظیم در درمان سرطان ایجاد کرده است به طوری که این روش درمانی امروزه جزو روشهای درمانی استاندارد برای بسیاری از بدخیمیهای لنفوسیتهای B به حسـاب مـیآید. ایـن درمان به صورت
استاندارد از طریق جداسازی لنفوسیتهای T اتولوگ از بیمار و آمادهسازی آنها در محیط ex vivo برای تزریق مجدد به بیمار انجام میشود که با مشکلاتی اساسی از قبیل هزینه بسیار بالا و زمان آمادهسازی طولانی مواجه میباشد. از طرفی استفاده از منابع آلوژنیک سلولهای T نیز با خطر ایجاد GvHD و ایمنیزایی در بدن میزبان روبرو میباشد (13، 10-6).
سلولهای CIK به عنوان یک سلول قابل تهیه از منابع آلوژنیک و با خطر پایین ایجاد GvHD میتوانند جایگزینی بالقوه برای لنفوسیتهای T در ایمنی درمانی با سلولهای بیان کننده CAR باشند. مطالعههای متعددی نشان دادهاند که انتقال گیرنده CAR به سلولهای CIK موجب افزایش قدرت کشندگی این سلولها در برابر سلولهای سرطانی میشود (22-20). همچنین نشان داده شده که این سلولها میتوانند هم از طریق سیگنالینگ وابسته به CAR و هم از طریق مکانیسمهای مستقل از CAR قدرت کشندگی خود را بر سلول هدف اعمال کنند. از طرفی نشان داده شده که سیگنالینگ CAR در سلولهای CIK علاوه بر ایجاد سیتوتوکسیسیتی وابسته به CAR میتواند موجب تقویت پاسخهای مستقل از CAR نیز بشود (23). به علاوه الگوی بیان گیرندههای کموکاینی در سلولهای CIK به گونهای است که در عین کاهش ترافیک آنها به ارگانهای هدف GvHD موجب افزایش ترافیک آنها به ارگانهای توموری میشود (24). تمامی این موارد این سلولها را به عنوان جایگزینی بالقوه و با خطر پایین GvHD برای سلولهای CAR-T مطرح میکند.
در این مطالعه نیز همراستا با مطالعههای پیشین نشان داده شد که انتقال گیرنده CAR به سلولهای CIK موجب افزایش قدرت کشندگی این سلولها میشود (25، 22-20، 18). طبق نتایج مطالعه حاضر با این که سلولهای CIK فاقد CAR حدی پایه از کشندگی را بر روی سلولهای هدف اعمال میکنند، با این حال انتقال گیرنده CAR موجب افزایش معنادار قدرت کشندگی این سلولها میگردد. به طوری که در هر سه نسبت E: T به کار رفته سلولهای CAR-CIK تفاوت معناداری را در قدرت کشندگی در مقایسه با سلولهای CIK فاقد CAR از خود نشان دادند. سلولهای CAR-CIK همانند سلولهای CAR-T یک کشندگی وابسته به دوز را از خود نشان دادند به طوری که با افزایش نسبت E:T میزان کشندگی این سلولها نیز به طور معناداری افزایش یافت.
مطالعهها نشان دادهاند که استفاده از سازه CAR نسل سوم که دارای دو دامین کمک محرک میباشد، موجب آپوپتوز ناشی از فعال شدن شدید (Activation induced cell death) در سلولهای CAR-T می شود (3). با این حال این نتایج در مورد سلولهای CIK متغیر میباشد. در حالی که مطالعهای در سال 2013 نشان داد که استفاده از CAR نسل سوم بر علیه آنتیژن کارسینوامبریونیک (CEA) موجب آپوپتوز ناشی از فعالسازی شدید میشود (23)، مطالعهای دیگر در سال 2016 نشان داد که استفاده از نسل سوم CAR بر علیه آنتیژن گیرنده فولات (FRα) در مقایسه با نسل دوم این گیرنده موجب پاسخ بهتر سلولهای CAR-CIK در برابر سلول های بیانکننده FRα میشود(25). این تفاوت ممکن است به تفاوت قدرت اتصال CAR با دو آنتیژن متفاوت مربوط باشد به طوری که در موارد اتصال با avidity پایین استفاده از نسل سوم CAR میتواند کمککننده باشد در حالی که در مواقع اتصال با تمایل (avidity) بالا استفاده از CAR نسل سوم با ارسال سیگنالهای فعالسازی قوی میتواند موجب مرگ ناشی از فعال شدن شدید سلول گردد. از طرفی به این دلیل که استفاده از دامینهای پیامرسانی DAP10 و DAP12 به عنوان جایگزین دامین CD3 Zeta و دامین کمک محرک 2B4 به جای CD28 و 4-1BB در ساختمان CAR در سلولهای CAR-NK نتایج مثبتی را نشان داده است، لازم است تا تاثیر این ساختارها در عملکرد سلولهای CAR-CIK نیز مورد بررسی قرار گیرد (26).
علاوه بر موارد ذکر شده چند مورد دیگر نیز میتواند در مقایسه سلولهای CAR-T و CAR-CIK در نظر گرفته شود. برای مثال میزان نیاز به IL-2 جزو مواردی میباشد که میتواند در مقایسه این دو نوع سلول حائز اهمیت باشد، چرا که استفاده از IL-2 به علت ایجاد سمیت در بدن با محدودیت دوز روبرو میباشد (27). همان طور که در قسمت مواد و روشها ذکر شد کشت سلولهای CIK در محیط کشت به میزان بیشتری از IL-2 در مقایسه با سلولهای T نیاز دارد. همچنین در مطالعهای نشان داده شد که سلولهای CIK فعال شده در مقایسه با سلولهای T فعال شده میزان IL-2 کمتری از خود آزاد میکنند (23). این موارد یعنی کم بودن میزان IL-2 مترشحه از سلولهای فعال شده و نیاز به منابع خارجی سیتوکین میتواند در عملکرد in vivo سلولها اثرگذار باشد. بنابراین لازم است تا در مطالعههای in vitro میزان سیتوتوکسیسیتی بلند مدت این سلولها در عدم حضور IL-2 مورد مقایسه قرار گیرد و مطالعههای in vivo تکمیلی نیز برای پایش بلند مدت این سلولها در درون بدن انجام شود. همچنین لازم است تا میزان بیان سطحی نشانگرهای فرسودگی (exhaustion) سلولی از قبیل PD-1 و LAG-3 نیز در بلند مدت در این سلولها مورد مقایسه قرار گیرد تا از بعد کاملتری بتوان این دو سلول را مورد مقایسه قرار داد.
نتیجهگیری
در مطالعه حاضر نشان داده شد که سلولهای CAR-CIK از قدرت کشندگی قابل مقایسهای با سلولهای CAR-T برخوردار هستند. طبق نتایج مطالعه حاضر و مطالعههای پیشین میتوان گفت که سلولهای CAR-CIK آلوژنیک دو شرط لازم برای استفاده به عنوان جایگزین سلولهای CAR-T آلوژنیک، یعنی قدرت کشندگی کافی و خطر پایین GvHD را دارا میباشند. با این حال لازم است تا مطالعههای بیشتری برای ارزیابی و مقایسه سایر ابعاد مؤثر در عملکرد این سلولها در دست انجام قرار گیرد تا بتوان با دید دقیق تری به مقایسه این دو جمعیت سلولی
پرداخت.
حمایت مالی
هزینههای این مطالعه توسط دانشگاه علوم پزشکی تهران تأمین شده است.
ملاحظات اخلاقی
در پایان لازم به ذکر میباشد که این مطالعه به تایید کمیته اخلاق دانشگاه علوم پزشکی تهران رسیده است (کد اخلاق: IR.TUMS.SPH.REC.1400.171).
عدم تعارض منافع
هیچگونه تعارض منافعی در مطالعه حاضر وجود نداشته است.
نقش نویسندگان
وحید مرادی: انجام مراحل عملی، تجزیه و تحلیل و تفسیر نتایج، تهیه پیشنویس مقاله
اعظم رنجبر: انجام مراحل عملی، تجزیه و تحلیل و تفسیر نتایج
دکتر آزاده امیدخدا: طراحی مطالعه، بازبینی و اصلاح پیشنویس مقاله
دکتر ناصر احمدبیگی: مدیریت و طراحی مطالعه، بازبینی و اصلاح پیشنویس مقاله
تشکر و قدردانی
بدینوسیله از اساتید، کارکنان و دانشجویان پژوهشکده گوارش و کبد دانشگاه علوم پزشکی تهران، تشکر و قدردانی میگردد.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونولوژي
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






