جلد 20، شماره 3 - ( پاییز 1402 )
جلد 20 شماره 3 صفحات 254-236 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Javadzadeh Shahshahani H, Akhavan Tafti F, Amini Kafi‐abad S. An overview of three methods used to prepare the platelet components from whole blood and apheresis method. bloodj 2023; 20 (3) :236-254
URL: http://bloodjournal.ir/article-1-1494-fa.html
URL: http://bloodjournal.ir/article-1-1494-fa.html
جوادزاده شهشهانی هایده، اخوان تفتی فاطمه، امینی کافی آباد صدیقه. مروری بر سه روش مورد استفاده برای تهیه فرآورده پلاکتی از خون کامل و روش آفرزیس. فصلنامه پژوهشی خون. 1402; 20 (3) :236-254
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 938 kb]
(1268 دریافت)
| چکیده (HTML) (2041 مشاهده)
An overview of three methods used to prepare the platelet components from whole blood and apheresis method
Javadzadeh Shahshahani H.1,2, Akhavan Tafti F.1,2, Amini Kafi-abad S.1
1Blood Transfusion Research Center, High Institute for Research and Education in Transfusion Medicine, Tehran, Iran
2Yazd Blood Transfusion Center, Yazd, Iran
Abstract
Background and Objectives
There are different ways to prepare platelets. Every one of these methods can have advantages and limitations for blood transfusion centers, donors, and patients. Knowledge of them is necessary for choosing the proper technique in blood transfusion centers. This article reviewed the methods of preparing platelets and compared them.
Materials and Methods
Studies related to the preparation of platelet components, the texts of articles, and review references were extracted. PubMed, Web of Science, Scopus, Magiran, SID, Google, and Google Scholar search engines were used for keywords such as blood component, platelet-rich plasma, platelet concentrate, buffy-coat method, platelet storage, buffy-coat pooled platelet, plateletpheresis, pathogen inactivation, Overnight storage, preparation concentrate, Leukofiltered platelets from May to June 2022.
Results
Studies comparing platelet preparation methods have had different results. One of the advantages of Buffy–coat method may be less activation, as platelets are centrifuged against a cushion of RBCs rather than the plastic container during PRP-PC production. Some recent findings have shown that the quality and clinical effectiveness of the buffy-Coat technique is better than Platelets Rich plasma (PRP) and is equivalent to the apheresis method. However, sufficient evidence is not yet available. The limitations of platelet preparation by the apheresis method, including the cost, declining apheresis donor base, and the time-consuming process, have led to the tendency towards other techniques. However, in cases such as platelet refractoriness, it is necessary to prepare matched platelets using the apheresis method.
Conclusions
To improve the quality of platelets and optimize the treatment of thrombocytopenic patients, it seems that the preparation of leuko-reduced pooled platelets is a suitable option considering the challenges of the apheresis method. With the advancement of techniques such as pathogen reduction and platelete additive solutions it is attempted for longer life span and safety.
Key words: Platelets, Platelet-Rich Plasma, Plateletpheresis
Received: 9 Apr 2023
Accepted: 21 Jun 2023
Correspondence: Amini Kafi-Abad S., MD. Pathologist. Professor of Blood Transfusion Research Center, High Institute for Research and Education in Transfusion Medicine.
P.O.Box: 14665-1157, Tehran, Iran. Tel: (+9821) 88601573; Fax: (+9821) 88601555
E-mail: s.amini@ibto.ir
مقدمه
بر اساس تاریخچه، در ابتدا خونهای اهدایی در بطریهای شیشهای جمعآوری و به صورت خون کامل به بیماران تزریق میشد. تا سال 1974، خون کامل محصول غالب انتقال خون بود (2، 1). معایب خون کامل شامل از بین رفتن فاکتورهای انعقادی و کاهش بقای گلبولهای قرمز بود و پس از مدتی استفاده از آن محدود شد. اواسط دهه 1970، خون در کیسههای پلاستیکی متصل به کیسههای جانبی با کورد پلاستیکی جمعآوری میشد که امکان جداسازی خون کامل را به اجزای تشکیلدهنده میداد (2، 1).
در برخی کشورها از سال 1975، به دلیل وجود تعداد زیادی لکوسیت و پلاکت، جداسازی لایه بافیکوت به عنوان یک روش استاندارد برای جلوگیری از تشکیل میکرواگریگیت (ریزدانهها) در طول ذخیرهسازی آغاز شد. از این رو از سال 1978 به بعد، کنسانترههای گلبول قرمز فاقد بافیکوت به محصول اصلی انتقال خون تبدیل شدند (2).
بیش از 60 سال پیش، تولید پلاکت از خون کامل آغاز شد و درمان بیماران ترومبوسایتوپنیک را متحول ساخت. در ابتدا پلاسمای غنی از پلاکت (PRP) مستقیماً بعد از جداسازی از RBC به وسیله دور سبک سانتریفیوژ به بیمار تزریق میشد اما به تدریج فرآورده پلاکت کنسانتره (PC) که از سانتریفیوژ PRP با دور سنگین به دست آمد، برای تزریق به بیماران استفاده شد. پیشرفت در روشهای تهیه و نگهداری پلاکت، استفاده از روشهای درمانی تهاجمیتر را ترغیب کرد (4، 3)، به طوری که در سالهای اخیر نیاز به پلاکت به دلیل روشهای درمانی بهتر برای بیماریهای هماتولوژیک، به شدت افزایش یافته است. فرآورده پلاکت ممکن است از خون کامل یا با پلاکت فرزیس تهیه شود (6، 5، 2). روش بافیکوت (BC) برای تهیه کنسانتره پلاکتی در دهه 1970 توسعه یافت و هنوز در بسیاری از مراکز خون در سراسر جهان استفاده میشود. توسعه این روش جرقه پیشرفتهای تکنولوژیکی مختلف در جمعآوری خون، پردازش و ذخیرهسازی در آن زمان ایجاد کرد. تا قبل از آن تولید پلاکت به روش PRP بود (3، 2). برخی از دادهها نشان میدهد که روشهای مختلف تولید پلاکتهای مشتق از خون کامل (پلاسمای غنی از پلاکت یا بافیکوت) منجر به درجات متفاوتی از فعال شدن پلاکت میشود، که ممکن است بر کیفیت پلاکت تأثیر بگذارد (9-7، 3). از اواخر قرن 19 و ابتدای قرن 20 میلادی روشهای آفرزیس به تدریج توسعه یافتند. به طوری که خون کامل طی جمعآوری به اجزای مختلف تقسیم شده و سپس جزء مورد نظر برداشته شده و سایر اجزا به اهداکننده برگشت داده میشود. با جدا کردن پلاکت، فرآورده پلاکت فرزیس با محتوای بیشتر پلاکتی تولید گردید (10).
با این حال طبق دانستههای ما مطالعه جامعی که بر پایه شواهد علمی مشخصاً از یک روش تهیه فرآورده پلاکت به عنوان روش ارجح حمایت کند، یافت نشد. مطالعههای جدیدی در مورد برخی مقایسه روشها از منظر کیفیت، هزینه، اهداکنندگان و بیماران انجام شده است (3). هدف از مطالعه حاضر مروری بر سابقه و روشهای مورد استفاده برای تهیه پلاکت و مقایسه آنها بود.
مواد و روشها
این پژوهش به روش مروری انجام شد. بدین ترتیب که سؤالات پژوهش شناسایی، مطالعههای مرتبط با تهیه پلاکت جستجو، متون مقالات و مراجع بررسی و مطالعههای مرتبط شناسایی و استخراج شد. نتایج و روشهای مورد استفاده در این مطالعهها مورد بررسی و تحلیل قرار گرفت و در نهایت خلاصهسازی و در این مطالعه ثبت شد.
سؤالات پژوهشی این مطالعه شامل موارد زیر بود: 1- روشهای رایج تولید پلاکت و مزایا و معایب و محدودیت هر روش کدام است؟ 2- مقرون به صرفهترین روش کدام است؟ 3- با کیفیتترین محصول از کدام روش به دست میآید؟ 4- جهتگیری کشورهای توسعه یافته به سمت کدام روش است؟ 5- علل تغییر سوگیری کشورها به سمت روشهای دیگر چه بوده است؟ 6- برای کدام روش با توجه به تجهیزات، اقلام مصرفی، تغییرات جمعیتی و... راه پیشرفت به سمت روشهای کاملتر وجود دارد؟
کلید واژههای فارسی و انگلیسی مرتبط با موضوع شامل:
فرآوردههای خونی، پلاکت، پلاسمای غنی از پلاکت، روش بافیکوت، پولد پلاکت، پلاکت فرزیس، غیر فعالسازی پاتوژن، ماده افزودنی، کنسانتره پلاکتی، ماده افزودنی پلاکت، پلاکت کم لکوسیت و buffy coat method، platelet storage ، platelet concentrate ، platelet-rich plasma ، blood component preparation ، platelet apheresis ، pathogen inactivation ، Overnight storage ، Buffy coat pooled platelet concentrate ، Leukofiltered platelets ، Platelet additive solution از داده پایگاههای PubMd, Web Of Science, Scopus, Magiran, SID و موتور جستجوی Google و Google Scholar در بازه زمانی اردیبهشت تا خرداد سال 1401 برای یافتن پاسخ سؤالات جستجو شد. معیار ورود به مطالعه شامل مطالعهها و پژوهشهای انجام شده در زمینه تهیه پلاکت از ابتدای سال 1980 تا انتهای سال 2022 بود. معیار خروج شامل مطالعههای صورت گرفته قبل و بعد از این بازه به زبانهای غیر از فارسی و انگلیسی، کنفرانسها، پایاننامهها و منابع فاقد متن کامل بود. دو نفر از نویسندگان وظیفه غربالگری مقالات را بر عهده داشتند و سپس توسط نفر سوم نتایج غربالگری نهایی شد. در جستجوی اولیه، 400 مقاله با کلید واژههای فوق به زبان فارسیـ انگلیسی یافت شد. تعداد 92 مورد به دلیل عدم دسترسی به متن کامل حذف شد. بررسی عنوان و چکیده 308 مطالعه منجر به حذف 255 مقاله شد و53 مطالعه وارد مرحله نهایی شدند.
نتایج بررسی مطالعههای منتخب در حیطههای روشهای رایج تولیـد پلاکت، تاریخچه روشهای مختلف برای تولید پلاکت به روش بافیکوت، تولید و استفاده از ماده افزودنی، تهیه پولد پلاکتی و فیلترهای کاهنده پلاکت، مزایا و معایب روش بافیکوت و PRP ، مزایا و معایب آفرزیس، فرآوری خون با روش انکوباسیون یک شبه (Overnight storage) و تولید PF24 (Plasma frozen within 24 hours) بـه جــای FFP (Fresh frozen plasma) شرح داده شد.
یافتهها
روشهای رایج تولید پلاکت:
سه روش رایج برای تهیه پلاکت در دنیا وجود دارد:
روشPRP (platelet-rich plasma):
از خون کامل طی یک مرحله سانتریفیوژ با دور سبک، PRP تهیـه کرده (امکان کاهش لکوسیت به صورت in-line
در حین جداسازی PRP وجود دارد) و سپس در مرحله دوم، سانتریفیوژ با دور سنگین منجر به ایجاد تجمع پلاکتی در ته کیسه میشود که از پلاسما جدا میشود و پس از گذشت یک ساعت بیحرکت ماندن در دمای 24-20 درجه سانتیگراد، پلاکتها از هم جدا شده و به عنوان فرآورده متراکم پلاکتی (PRP-PC) در آژیتاتور نگهداری میشود (8). 4 تا 6 PRP-PC را میتوان 4 ساعت قبل از تزریق ادغام کرد و انقضای آن 6 ساعت در دمای محیط خواهد بود (2).
مدت زمان نگهداری کیسههای پلاکتی 5 روز است و در صورت استفاده از روشهای تشخیص و کاهش آلودگی باکتریال تا 7 روز میتواند افزایش داده شود (6). حجم فرآورده به ازای هر 109×6 پلاکت باید بیش از 40 میلیلیتر باشد (6).
در استانداردAABB اشاره شده است پلاکت حاصل از خون کامل معمولاً در 40 تا 70 میلیلیتر پلاسما تهیه میشود (11). اگر از سیستم بسته و استریل برای ادغام استفاده شود، میتوان ادغام را 24 ساعت پس از تهیه PRP-PC انجام داد و تا 5 روز از زمان خونگیری نگهداری کرد (6).
روش بافیکوت(Buffy Coat یا BC):
ابتدا خون کامل در معرض یک مرحله سانتریفیوژ با دور سنگین قرار گرفته، گلبولهای قرمز و پلاسمای کم پلاکت (PPP:Plasma Poor Platelet) به روش دستی یا اتوماتیک جدا میشوند (در زمان حاضر تنها روش اتوماتیک استفاده میشود). غالباً از کیسههای bottom and top استفاده میشود. از قسمت بالای کیسه پلاسما خارج و از قسمت پاییـن گلبولهـای قـرمز خـارج شده و بافیکوت در کیسه
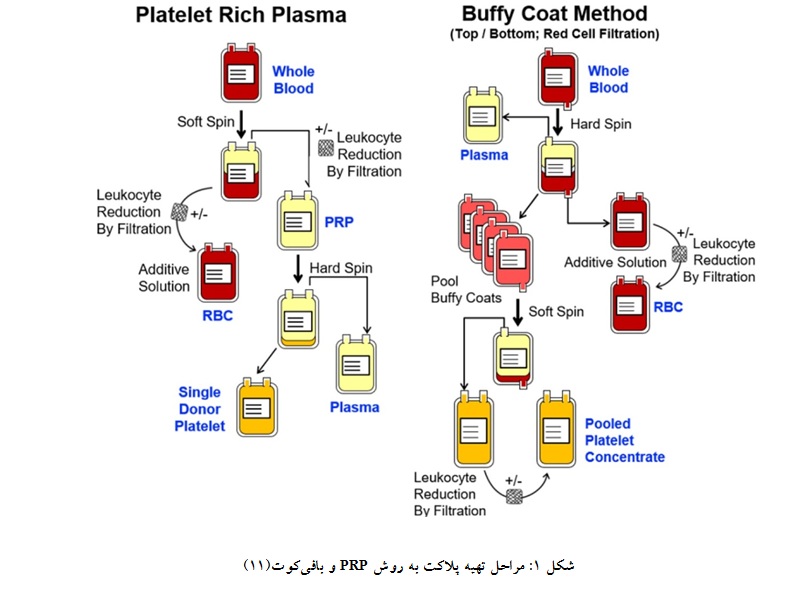

انجام چرخه در یک شیفت کاری، امکان متمرکزسازی مراکز فرآوری، اتواستریلیزاسیون و کاهش آلودگی باکتریال فرآورده، کاهش هزینههای حمل ونقل از مراکز اقماری و تیم سیار را میتوان به عنوان مزایا نام برد. عدم امکان تهیه FFP و کرایوپرسیپیتیت از محدودیتهای آن اسـت. کاهش
حجم فرآورده RBC به میزان تقریبی mL20 در روش بافیکوت نسبت به PRP نشان داده شده است. بعد از حدود 40 سال از گسترش روش بافیکوت برای تهیه پلاکت، این روش در بسیاری مراکز انتقال خون دنیا از جمله اروپا، نیوزیلند، استرالیا و کانادا استفاده شده است(3، 2).
2- مزایا و محدودیتهای روش آفرزیس:
در اکثر کشورهای توسعهیافته، نسبت جمعیت در گروه سنی بالاتر به سرعت در حال افزایش است و بنابراین، نیاز به فرآوردههای خونی نیز ممکن است به سرعت افزایش یابد. در مطالعهای در یزد بیش از 25 درصد فرآوردههای خونی برای گروه سنی بیش از 65 سال مصرف شد (52). با کاهش نرخ زاد و ولد در بسیاری از کشورهای توسعهیافته، این گروههای سنی جوانتر به عنوان درصدی از کل جمعیت در حال حاضر که به یکی از سه روش رایج برای تهیه پلاکت از آنها استفاده میشود، در حال کاهش هستند. همچنین علاقه کمتری در افرادی که بین سالهای 1981 تا 2000 متولد شدهاند، برای پیوستن به سازمانهای مدنی یا اهدای خون، بهویژه از طریق فرزیس، وجود دارد(16).
در بررسی تغییرات سنی اهداکنندگان در استان یزد نیز جمعیت اهداکننده 30-18 سال در طی سالهای مورد بررسی کاهش داشت(53). فرآیند آفرزیس زمانبر است و اهداکنندگان جدید و جوان بیشتر تمایل به اهدای خون کامل دارند تا اهدای آفرزیس. در اهدای خون کامل نسبت به اهدای آفرزیس امکان تهیه فرآوردههای دیگر بیشتر است.
به طور کلی استدلال میشود با توجه به محدودیتهای روش آفرزیس و این که با پیشرفت روشهای کم هزینهتر که از نظر کیفی قابل قیاس هستند و از طرفی با توجه به درخواستهای روز افزون تهیه پلاکت فرزیس از طرف پزشکان، عمدتاً اهدای خـون کامـل روش مناسـبتری اسـت، زیـرا در مکانهای مختلف ثابت و سیار امکانپذیر بوده و به طور کلی به صرفهتر است. البته تولید پلاکت به روش آفرزیس را نمیتوان حذف نمود و باید بخشی از پلاکت تولیدی باقی بماند تا بتواند تقاضا برای فرآوردههای خاص مثلاً همسـان با HLA یا آنتیژن پلاکتی گیرنده را برآورده نماید. تولید پلاکتهای چند دوزی از چرخه آفرزیس باید به حداکثر مقدار ممکن برسد تا هزینه این فرآورده خونی تعدیل شود (45). برخی مطالعهها نشان دادهاند در روز پایانی نگهداری پلاکت آفرزیس پایدارترین pH و کمترین تجمعات پلاکتی را دارند (45، 44). با این حال در بسیاری از بیماران اثربخشی محصول بافیکوت در گیرنده مشابه آفرزیس بوده است (41، 40، 14). محاسبه شده که تولید دوز درمانی پلاکت بافیکوت تقریباً 5/2 برابر ارزانتر از دوز آفرزیس است (54، 16، 14).
نیازمندیهای تغییر روش تهیه پلاکت:
مراکز انتقال خون برای تغییر روش از PRP به بافیکوت با چالشها و نیازمندیهایی مواجه هستند که شامل موارد زیر است: کیسههای مصرفی باید به Bottom & Top تغییر یابد. در صورت استفاده از روش انکوباسیون یکشبه برای استراحت 16تا 24 ساعته خون کامل قبل از فرآوری در محیط فرآورده به انکوباتور 48 تایی دو طبقه نیاز است.
اکستراکتورهای اتوماتیک Opti pressesبا دیواره پشتی مسطح قابل جابهجایی، با احتساب زمان جداسازی برای هر کیسه 5/3 دقیقه و هر ران کاری سانتریفیوژ که 12 کیسه است و همچنین متوسط ارسال کیسه به واحد فرآورده 25 واحد و با در نظر گرفتن کیسههای فیلتر دار و زمان استراحت آنها میتوان پیشبینی کرد که در هر ران کاری حداقل دو دستگاه سانتریفیوژ همزمان در حال استفاده است و برای جداسازی اجزای خون بعد از سانتریفیوژ، 10 دستگاه اکستراکتور برای 100 تا 120 واحد خون مورد نیاز است. علاوه بر هزینههای خرید دستگاه، هزینه نقل و انتقال به مرکز، سرویس دورهای و نگهداری پیشگیرانه، هزینه تعمیرات این تجهیزات نیز باید مد نظر قرار داده شود.
دستگاه ولدر برای تهیه پولد پلاکتی که یک روش رایج در تهیه پلاکت به روش بافیکوت است، مورد نیاز میباشد. در برخی مدلها هر 14 تا 15 ثانیه یک کورد جوش داده میشود. به عبارتی برای متوسط 60 واحد پلاکت در روز با احتساب زمان قرار دادن کورد و خروج آن از بازوهای دستگاه، حداقل30 دقیقه زمان صرف خواهد شد. در صورتی که در نوع دستگاهی که خریداری می شود با همین بازده و زمان کورد جوش داده شود، حداکثر دو دستگاه در مرکز مورد نیاز خواهد بود. هزینه خرید، سرویس دورهای و نگهداری پیشگیرانه، انتقال دستگاه به مرکز باید در نظر گرفته شود. ست برای انتقال پلاکت ادغام شده و کاهش لکوسیت از سایر اقلام مصرفی مورد نیاز است. برای جانمایی دستگاه اکستراکتور اتوماتیک، دستگاه ولدر و آژیتاتور ممکن است نیاز به تغییرات فضا در واحدهای فنی باشد که هزینههای آن باید محاسبه شود. بررسی از نظر کفایت لاینر و باگت سانتریفیوژها برای تهیه پلاکت بافیکوت بایستی انجام شود و با توجه به نوع تغییرات، تجهیزات و فرآیند و این که در مرحله جوش کورد باید کنترل محل جوش برای کیسهها برای تعیین تاریخ انقضا و اطمینان از باز نشدن مسیر انجام شود، حداقل یک نفر باید به پرسنل فنی واحد اضافه گردد. تغییرات نرمافزارهای مورد استفاده و آموزش کارشناسان درگیر در فرآیند نیز باید مد نظر قرار گیرد.
نتیجهگیری
به منظور ارزیابی اثربخشی بالینی و زندهمانی پلاکتهای ذخیره شده در داخل بدن بیمار، مطالعههای بیشتری مورد نیاز است. مطالعههای in vivo به دلیل اثر فاکتورهای مربوط به بیمار روی افزایش شمارش و
عملکرد پلاکت خیلی محدود هستند. با این حال برخی مطالعهها نشان دادهاند که کیفیت و اثربخشی فرآورده پولد بافیکوت کم لکوسیت معادل آفرزیس و بهتر از PRP است و محتوای لکوسیت در فرآوردههای گلبول قرمز و پلاکت کمتر هست. همچنین احتمال عدم فیلتراسیون و گیر افتادن و از دست رفتن پلاکتها در فیلتر کاهنده لکوسیت و فرآورده گلبول قرمز کمتر میشود. بیشتر کشورهای دنیا به سمت استفاده از روش بافیکوت رفتهاند که هم کم هزینهتر است و هم امکان پیشرفت بیشتر در بهبود کیفیت دارد(14). پیشنهاد میشود هدف را بهبود کیفیت پلاکتها و بهینهسازی درمان بیماران ترومبوسایتوپنیک قرار داد تا این که صرفاً تمرکز بر روی روش تهیه باشد. برای بهبود کیفیت استفاده از پلاکتهای ادغام شده کم لکوسیت با توجه به چالشهای روش آفرزیس(هزینهبر بودن، مشکل جذب اهداکننده) گزینه مناسبی میباشد و پیشرفت روشهایی مانند کاهش پاتوژن و استفاده از مواد افزودنی پلاکت، ایمنی و عمر نگهداری این فرآورده را بیشتر میکند. در روشPRP تهیه پلاکت ادغام شده کم لکوسیت امکانپذیر است. با این حال به دلیل محتوای بالای لکوسیت در واحدهای پلاکت، احتمال میکرواگریگیشن و عدم فیلتراسیون یا گیر افتادن پلاکتها در فیلتر هست. از طرفی برای استفاده از این لاین (in line) فیلتر کاهنده لکوسیت برای تهیه هر واحد منفرد پلاکت کم لکوسیت هزینهها بیشتر میشود. برای تهیه پلاکت ادغام شده کم لکوسیت به روش بافیکوت امکان تهیه و استقرار اکستراکتورهای اتوماتیک، سیستمهای ادغام فرآورده و تأمین کیسههای خون جدید و افزایش خونگیری برای جبران کاهش حجم گلبول قرمز و در صورت تهیه PF24 تهیه انکوباتور نگهداری خون کامل و تأمین فاکتور 8 تجاری درنظر گرفته شود.
متن کامل: (3574 مشاهده)
|
Sci J Iran Blood Transfus Organ 2023;20 (3): 236-254 |
|
Review Article
|
An overview of three methods used to prepare the platelet components from whole blood and apheresis method
Javadzadeh Shahshahani H.1,2, Akhavan Tafti F.1,2, Amini Kafi-abad S.1
1Blood Transfusion Research Center, High Institute for Research and Education in Transfusion Medicine, Tehran, Iran
2Yazd Blood Transfusion Center, Yazd, Iran
Abstract
Background and Objectives
There are different ways to prepare platelets. Every one of these methods can have advantages and limitations for blood transfusion centers, donors, and patients. Knowledge of them is necessary for choosing the proper technique in blood transfusion centers. This article reviewed the methods of preparing platelets and compared them.
Materials and Methods
Studies related to the preparation of platelet components, the texts of articles, and review references were extracted. PubMed, Web of Science, Scopus, Magiran, SID, Google, and Google Scholar search engines were used for keywords such as blood component, platelet-rich plasma, platelet concentrate, buffy-coat method, platelet storage, buffy-coat pooled platelet, plateletpheresis, pathogen inactivation, Overnight storage, preparation concentrate, Leukofiltered platelets from May to June 2022.
Results
Studies comparing platelet preparation methods have had different results. One of the advantages of Buffy–coat method may be less activation, as platelets are centrifuged against a cushion of RBCs rather than the plastic container during PRP-PC production. Some recent findings have shown that the quality and clinical effectiveness of the buffy-Coat technique is better than Platelets Rich plasma (PRP) and is equivalent to the apheresis method. However, sufficient evidence is not yet available. The limitations of platelet preparation by the apheresis method, including the cost, declining apheresis donor base, and the time-consuming process, have led to the tendency towards other techniques. However, in cases such as platelet refractoriness, it is necessary to prepare matched platelets using the apheresis method.
Conclusions
To improve the quality of platelets and optimize the treatment of thrombocytopenic patients, it seems that the preparation of leuko-reduced pooled platelets is a suitable option considering the challenges of the apheresis method. With the advancement of techniques such as pathogen reduction and platelete additive solutions it is attempted for longer life span and safety.
Key words: Platelets, Platelet-Rich Plasma, Plateletpheresis
Received: 9 Apr 2023
Accepted: 21 Jun 2023
Correspondence: Amini Kafi-Abad S., MD. Pathologist. Professor of Blood Transfusion Research Center, High Institute for Research and Education in Transfusion Medicine.
P.O.Box: 14665-1157, Tehran, Iran. Tel: (+9821) 88601573; Fax: (+9821) 88601555
E-mail: s.amini@ibto.ir
مروری بر سه روش مورد استفاده برای تهیه فرآورده پلاکتی از خون کامل
و روش آفرزیس
هایده جوادزاده شهشهانی1، فاطمه اخوان تفتی2، صدیقه امینی کافیآباد3
چکیده
سابقه و هدف
روشهای متفاوتی برای تهیه پلاکت وجود دارد. هر یک از این روشها برای مراکز انتقال خون، اهداکنندگان و بیماران میتوانند مزایا و محدودیتهایی داشته باشند. آگاهی از آنها برای تصمیمگیری در مورد انتخاب روش مناسب در مراکز انتقال خون لازم است. این مقاله به مرور روشهای تهیه پلاکت و مقایسه آنها میپردازد.
مواد و روشها
در یک مطالعه مروری، مقالههای مرتبط با تهیه پلاکت جستجو شد و متون مقالهها و مراجع شناسایی و استخراج گردید. کلید واژههای blood component ، platelet-rich plasma ، platelet concentrate ، buffy-coat method ، platelet storage ، buffy-coat pooled platelet ، plateletpheresis ، pathogen inactivation ، Overnight storage ، preparation concentrate ، Leukofiltered platelets در پایگاههای داده PubMed, Web Of Science, Scopus, Magiran, SID و موتور جستجوی Google و Google Scholar در بازه اردیبهشت تا خرداد 1401 جستجو شد.
یافتهها
مطالعهها در مورد مقایسه روشهای تهیه پلاکت نتایج مختلفی داشتهاند. در روش بافیکوت در هنگام سانتریفیوژ، گلبولهای قرمز به عنوان تکیهگاهی برای پلاکتها عمل میکنند، در حالی که در روش پلاسمای غنی از پلاکت، پلاکتها در معرض دیواره پلاستیکی کیسه قرار میگیرند و منجر به فعال شدن پلاکتها میشود. برخی یافتههای جدیدتر نشان دادهاند کیفیت و اثر بخشی بالینی روش بافیکوت بهتر از روش پلاسمای غنی از پلاکت و معادل روش آفرزیس است. با این حال هنوز شواهد کافی در دسترس نیست. محدودیتهای تهیه پلاکت به روش آفرزیس شامل هزینه، محدودیت جذب اهداکنندگان و زمانبر بودن فرآیند باعث تمایل به سمت سایر روشها شده است. به هر حال در مواردی مانند مقاومت پلاکتی، تهیه پلاکت همسان به روش آفرزیس ضروری است.
نتیجه گیری
برای بهبود کیفیت پلاکتها و بهینهسازی درمان بیماران ترومبوسایتوپنیک تهیه پلاکتهای ادغام شده کم لکوسیت با توجه به چالشهای روش آفرزیس گزینه مناسبی است. با پیشرفت روشهایی مانند کاهش پاتوژن و مواد افزودنی پلاکتی سعی میشود ایمنی و عمر نگهداری این فرآورده بیشتر گردد.
کلمات کلیدی: پلاکتها، پلاسمای غنی از پلاکت، پلاکت فرزیس
تاریخ دریافت: 20/01/1402
تاریخ پذیرش : 31/03/1402
1- متخصص آسیبشناسی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و اداره کل انتقال خون یزد ـ یزد ـ ایران
2- کارشناس ارشد میکروبشناسی پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و اداره کل انتقال خون یزد ـ یزد - ایران
3- مؤلف مسئول: متخصص آسیبشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
و روش آفرزیس
هایده جوادزاده شهشهانی1، فاطمه اخوان تفتی2، صدیقه امینی کافیآباد3
چکیده
سابقه و هدف
روشهای متفاوتی برای تهیه پلاکت وجود دارد. هر یک از این روشها برای مراکز انتقال خون، اهداکنندگان و بیماران میتوانند مزایا و محدودیتهایی داشته باشند. آگاهی از آنها برای تصمیمگیری در مورد انتخاب روش مناسب در مراکز انتقال خون لازم است. این مقاله به مرور روشهای تهیه پلاکت و مقایسه آنها میپردازد.
مواد و روشها
در یک مطالعه مروری، مقالههای مرتبط با تهیه پلاکت جستجو شد و متون مقالهها و مراجع شناسایی و استخراج گردید. کلید واژههای blood component ، platelet-rich plasma ، platelet concentrate ، buffy-coat method ، platelet storage ، buffy-coat pooled platelet ، plateletpheresis ، pathogen inactivation ، Overnight storage ، preparation concentrate ، Leukofiltered platelets در پایگاههای داده PubMed, Web Of Science, Scopus, Magiran, SID و موتور جستجوی Google و Google Scholar در بازه اردیبهشت تا خرداد 1401 جستجو شد.
یافتهها
مطالعهها در مورد مقایسه روشهای تهیه پلاکت نتایج مختلفی داشتهاند. در روش بافیکوت در هنگام سانتریفیوژ، گلبولهای قرمز به عنوان تکیهگاهی برای پلاکتها عمل میکنند، در حالی که در روش پلاسمای غنی از پلاکت، پلاکتها در معرض دیواره پلاستیکی کیسه قرار میگیرند و منجر به فعال شدن پلاکتها میشود. برخی یافتههای جدیدتر نشان دادهاند کیفیت و اثر بخشی بالینی روش بافیکوت بهتر از روش پلاسمای غنی از پلاکت و معادل روش آفرزیس است. با این حال هنوز شواهد کافی در دسترس نیست. محدودیتهای تهیه پلاکت به روش آفرزیس شامل هزینه، محدودیت جذب اهداکنندگان و زمانبر بودن فرآیند باعث تمایل به سمت سایر روشها شده است. به هر حال در مواردی مانند مقاومت پلاکتی، تهیه پلاکت همسان به روش آفرزیس ضروری است.
نتیجه گیری
برای بهبود کیفیت پلاکتها و بهینهسازی درمان بیماران ترومبوسایتوپنیک تهیه پلاکتهای ادغام شده کم لکوسیت با توجه به چالشهای روش آفرزیس گزینه مناسبی است. با پیشرفت روشهایی مانند کاهش پاتوژن و مواد افزودنی پلاکتی سعی میشود ایمنی و عمر نگهداری این فرآورده بیشتر گردد.
کلمات کلیدی: پلاکتها، پلاسمای غنی از پلاکت، پلاکت فرزیس
تاریخ دریافت: 20/01/1402
تاریخ پذیرش : 31/03/1402
1- متخصص آسیبشناسی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و اداره کل انتقال خون یزد ـ یزد ـ ایران
2- کارشناس ارشد میکروبشناسی پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و اداره کل انتقال خون یزد ـ یزد - ایران
3- مؤلف مسئول: متخصص آسیبشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
بر اساس تاریخچه، در ابتدا خونهای اهدایی در بطریهای شیشهای جمعآوری و به صورت خون کامل به بیماران تزریق میشد. تا سال 1974، خون کامل محصول غالب انتقال خون بود (2، 1). معایب خون کامل شامل از بین رفتن فاکتورهای انعقادی و کاهش بقای گلبولهای قرمز بود و پس از مدتی استفاده از آن محدود شد. اواسط دهه 1970، خون در کیسههای پلاستیکی متصل به کیسههای جانبی با کورد پلاستیکی جمعآوری میشد که امکان جداسازی خون کامل را به اجزای تشکیلدهنده میداد (2، 1).
در برخی کشورها از سال 1975، به دلیل وجود تعداد زیادی لکوسیت و پلاکت، جداسازی لایه بافیکوت به عنوان یک روش استاندارد برای جلوگیری از تشکیل میکرواگریگیت (ریزدانهها) در طول ذخیرهسازی آغاز شد. از این رو از سال 1978 به بعد، کنسانترههای گلبول قرمز فاقد بافیکوت به محصول اصلی انتقال خون تبدیل شدند (2).
بیش از 60 سال پیش، تولید پلاکت از خون کامل آغاز شد و درمان بیماران ترومبوسایتوپنیک را متحول ساخت. در ابتدا پلاسمای غنی از پلاکت (PRP) مستقیماً بعد از جداسازی از RBC به وسیله دور سبک سانتریفیوژ به بیمار تزریق میشد اما به تدریج فرآورده پلاکت کنسانتره (PC) که از سانتریفیوژ PRP با دور سنگین به دست آمد، برای تزریق به بیماران استفاده شد. پیشرفت در روشهای تهیه و نگهداری پلاکت، استفاده از روشهای درمانی تهاجمیتر را ترغیب کرد (4، 3)، به طوری که در سالهای اخیر نیاز به پلاکت به دلیل روشهای درمانی بهتر برای بیماریهای هماتولوژیک، به شدت افزایش یافته است. فرآورده پلاکت ممکن است از خون کامل یا با پلاکت فرزیس تهیه شود (6، 5، 2). روش بافیکوت (BC) برای تهیه کنسانتره پلاکتی در دهه 1970 توسعه یافت و هنوز در بسیاری از مراکز خون در سراسر جهان استفاده میشود. توسعه این روش جرقه پیشرفتهای تکنولوژیکی مختلف در جمعآوری خون، پردازش و ذخیرهسازی در آن زمان ایجاد کرد. تا قبل از آن تولید پلاکت به روش PRP بود (3، 2). برخی از دادهها نشان میدهد که روشهای مختلف تولید پلاکتهای مشتق از خون کامل (پلاسمای غنی از پلاکت یا بافیکوت) منجر به درجات متفاوتی از فعال شدن پلاکت میشود، که ممکن است بر کیفیت پلاکت تأثیر بگذارد (9-7، 3). از اواخر قرن 19 و ابتدای قرن 20 میلادی روشهای آفرزیس به تدریج توسعه یافتند. به طوری که خون کامل طی جمعآوری به اجزای مختلف تقسیم شده و سپس جزء مورد نظر برداشته شده و سایر اجزا به اهداکننده برگشت داده میشود. با جدا کردن پلاکت، فرآورده پلاکت فرزیس با محتوای بیشتر پلاکتی تولید گردید (10).
با این حال طبق دانستههای ما مطالعه جامعی که بر پایه شواهد علمی مشخصاً از یک روش تهیه فرآورده پلاکت به عنوان روش ارجح حمایت کند، یافت نشد. مطالعههای جدیدی در مورد برخی مقایسه روشها از منظر کیفیت، هزینه، اهداکنندگان و بیماران انجام شده است (3). هدف از مطالعه حاضر مروری بر سابقه و روشهای مورد استفاده برای تهیه پلاکت و مقایسه آنها بود.
مواد و روشها
این پژوهش به روش مروری انجام شد. بدین ترتیب که سؤالات پژوهش شناسایی، مطالعههای مرتبط با تهیه پلاکت جستجو، متون مقالات و مراجع بررسی و مطالعههای مرتبط شناسایی و استخراج شد. نتایج و روشهای مورد استفاده در این مطالعهها مورد بررسی و تحلیل قرار گرفت و در نهایت خلاصهسازی و در این مطالعه ثبت شد.
سؤالات پژوهشی این مطالعه شامل موارد زیر بود: 1- روشهای رایج تولید پلاکت و مزایا و معایب و محدودیت هر روش کدام است؟ 2- مقرون به صرفهترین روش کدام است؟ 3- با کیفیتترین محصول از کدام روش به دست میآید؟ 4- جهتگیری کشورهای توسعه یافته به سمت کدام روش است؟ 5- علل تغییر سوگیری کشورها به سمت روشهای دیگر چه بوده است؟ 6- برای کدام روش با توجه به تجهیزات، اقلام مصرفی، تغییرات جمعیتی و... راه پیشرفت به سمت روشهای کاملتر وجود دارد؟
کلید واژههای فارسی و انگلیسی مرتبط با موضوع شامل:
فرآوردههای خونی، پلاکت، پلاسمای غنی از پلاکت، روش بافیکوت، پولد پلاکت، پلاکت فرزیس، غیر فعالسازی پاتوژن، ماده افزودنی، کنسانتره پلاکتی، ماده افزودنی پلاکت، پلاکت کم لکوسیت و buffy coat method، platelet storage ، platelet concentrate ، platelet-rich plasma ، blood component preparation ، platelet apheresis ، pathogen inactivation ، Overnight storage ، Buffy coat pooled platelet concentrate ، Leukofiltered platelets ، Platelet additive solution از داده پایگاههای PubMd, Web Of Science, Scopus, Magiran, SID و موتور جستجوی Google و Google Scholar در بازه زمانی اردیبهشت تا خرداد سال 1401 برای یافتن پاسخ سؤالات جستجو شد. معیار ورود به مطالعه شامل مطالعهها و پژوهشهای انجام شده در زمینه تهیه پلاکت از ابتدای سال 1980 تا انتهای سال 2022 بود. معیار خروج شامل مطالعههای صورت گرفته قبل و بعد از این بازه به زبانهای غیر از فارسی و انگلیسی، کنفرانسها، پایاننامهها و منابع فاقد متن کامل بود. دو نفر از نویسندگان وظیفه غربالگری مقالات را بر عهده داشتند و سپس توسط نفر سوم نتایج غربالگری نهایی شد. در جستجوی اولیه، 400 مقاله با کلید واژههای فوق به زبان فارسیـ انگلیسی یافت شد. تعداد 92 مورد به دلیل عدم دسترسی به متن کامل حذف شد. بررسی عنوان و چکیده 308 مطالعه منجر به حذف 255 مقاله شد و53 مطالعه وارد مرحله نهایی شدند.
نتایج بررسی مطالعههای منتخب در حیطههای روشهای رایج تولیـد پلاکت، تاریخچه روشهای مختلف برای تولید پلاکت به روش بافیکوت، تولید و استفاده از ماده افزودنی، تهیه پولد پلاکتی و فیلترهای کاهنده پلاکت، مزایا و معایب روش بافیکوت و PRP ، مزایا و معایب آفرزیس، فرآوری خون با روش انکوباسیون یک شبه (Overnight storage) و تولید PF24 (Plasma frozen within 24 hours) بـه جــای FFP (Fresh frozen plasma) شرح داده شد.
یافتهها
روشهای رایج تولید پلاکت:
سه روش رایج برای تهیه پلاکت در دنیا وجود دارد:
روشPRP (platelet-rich plasma):
از خون کامل طی یک مرحله سانتریفیوژ با دور سبک، PRP تهیـه کرده (امکان کاهش لکوسیت به صورت in-line
در حین جداسازی PRP وجود دارد) و سپس در مرحله دوم، سانتریفیوژ با دور سنگین منجر به ایجاد تجمع پلاکتی در ته کیسه میشود که از پلاسما جدا میشود و پس از گذشت یک ساعت بیحرکت ماندن در دمای 24-20 درجه سانتیگراد، پلاکتها از هم جدا شده و به عنوان فرآورده متراکم پلاکتی (PRP-PC) در آژیتاتور نگهداری میشود (8). 4 تا 6 PRP-PC را میتوان 4 ساعت قبل از تزریق ادغام کرد و انقضای آن 6 ساعت در دمای محیط خواهد بود (2).
مدت زمان نگهداری کیسههای پلاکتی 5 روز است و در صورت استفاده از روشهای تشخیص و کاهش آلودگی باکتریال تا 7 روز میتواند افزایش داده شود (6). حجم فرآورده به ازای هر 109×6 پلاکت باید بیش از 40 میلیلیتر باشد (6).
در استانداردAABB اشاره شده است پلاکت حاصل از خون کامل معمولاً در 40 تا 70 میلیلیتر پلاسما تهیه میشود (11). اگر از سیستم بسته و استریل برای ادغام استفاده شود، میتوان ادغام را 24 ساعت پس از تهیه PRP-PC انجام داد و تا 5 روز از زمان خونگیری نگهداری کرد (6).
روش بافیکوت(Buffy Coat یا BC):
ابتدا خون کامل در معرض یک مرحله سانتریفیوژ با دور سنگین قرار گرفته، گلبولهای قرمز و پلاسمای کم پلاکت (PPP:Plasma Poor Platelet) به روش دستی یا اتوماتیک جدا میشوند (در زمان حاضر تنها روش اتوماتیک استفاده میشود). غالباً از کیسههای bottom and top استفاده میشود. از قسمت بالای کیسه پلاسما خارج و از قسمت پاییـن گلبولهـای قـرمز خـارج شده و بافیکوت در کیسه

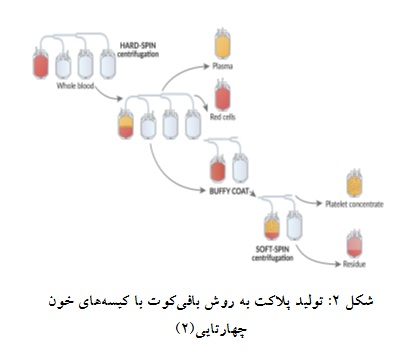
اصلی باقی میماند. برای تهیه فرآورده پلاکتی ادغام شده، 6-4 بافیکوت با یک واحد پلاسما یا ماده افزودنی پلاکت (PAS) ادغام شده پس از سوسپانسیون مجدد با دور سبک سانتریفیوژ میشود که گلبولهای سفید و قرمز باقیمانده در ته کیسه ته نشین شده و مایع فوقانی آن به عنوان فرآورده پلاکتی ادغام شده به کیسه دیگر منتقل میشود. میتوان پلاکتها را در حین انتقال از فیلتر کاهنده لکوسیت عبور داد (شکل 1)(8). حجم فرآورده به ازای هر109×60 پلاکت باید بیش از 40 میلیلیتر باشد (6).
روش آفرزیس:
روشی مناسب برای جمعآوری فـرآوردههـای خونی مانند گلبولهای قرمز و سـفید، پلاکتها و پلاسمای اهداکننده است .پلاکت فـرزیس فرآینـد اسـتانداردی است که طی آن پلاکتها از خون کامل جدا و جمعآوری میشوند .خون اهداکننده جمعآوری میشود و پس از جدا کردن پلاکت و مقداری پلاسما، سایر اجزای خون به اهداکننده برگردانده میشود(10).
به این پلاکتهای جمعآوری شـده از یک اهداکننده واحد، پلاکت تک واحدی میگویند. پلاکتها در فرآیند پلاکت فرزیس در مدت 2-1 ساعت جمعآوری شده و یک واحد پلاکت فرزیس معمولاً شـامل 1011 × 3 پلاکت بوده که این تعداد برابر 6-5 واحد پلاکـت رندوم حاصل از خون کامل اهداکننده تصادفی است(12). حجم فرآورده به ازای هر 109 × 60 پلاکت باید بیش از 40 میلی لیتر باشد(6).
مدت زمان نگهداری پلاکت در دمای 20 تا 24 درجه در کشورهای مختلف بر اساس ارزیابی خطرهای مختلف از جمله واکنشهای پس از تزریق، آلودگی باکتریال، روش تولید پلاکت و.... متفاوت است مثلاً در آمریکا نهایتاً 5 روز، ژاپن 3 روز، کشورهـای اتحادیـه اروپـا اکثراً بالای 7 روز و آلمان 4 روز (13).
سیر تکامل روش بافی کوت در تهیه پلاکت کنسانتره:
در مراکز انتقال خون ایران از روش PRP و آفرزیس برای تهیه پلاکت استفاده میشود. روش بافیکوت اولین بار در هلند و با استفاده از محلول افزودنی به عنوان جزء اصلی ذخیره پلاکتی توسط راک و همکاران شرح داده شد(14). این روش از دهه 1960 شناخته شده بود و استفاده از آن در دهه 1970 توسعه یافت، اما تا اواسط دهه 1980 بود که روش بافیکوت به طور قابل اعتمادی برای تولید معمول کنسانتره پلاکتی مورد استفاده قرار گرفت. در سال 1987 این روش در بانک خون آمستردام مورد استفاده قرار گرفت و تا سال 1993، 100% پلاکت حاصل از خون کامل به این روش تهیه شد(2).
در سوئد نیز از اواسط 1970 استفاده از این روش آغاز شد که یکی از دلایل آن حجم بالاتر پلاسمای حاصل از این روش است(15). در دهه ۹۰ میلادی در اروپا و از سال 2005، سرویس انتقال خون کانادا (CBS) تغییر ازروش PRP به روش بافیکوت را آغاز کرد. در حال حاضر، در کانادا تقریباً 70 درصد دوزهای فرآورده پلاکت از خون کامل و بقیه به روش آفرزیس تهیه میشود(17، 16). در اروپا، 50 درصد یا بیشتر از تزریقها، پلاکت کنسانتره مشتق از بافیکوت هستند. دانمارک، اسپانیا و هلند بیش از 85 درصد پلاکت کنسانتره خود را از خون کامل تهیه میکنند. در فرانسه و بریتانیا که درصد بالایی از پلاکت به روش آفرزیس تهیه میشد نیز در حال دور شدن از روش آفرزیس به سمت تهیه پلاکت از بافی کوت خون کامل هستند(14). روش دستی با استفاده از کیسههای سه تایی که در ابتدا برای تهیه پلاکت به روش بافیکوت مورد استفاده قرار گرفت، پر زحمت و مشکل بود و ضریب اطمینان پایینی داشت(2). به تدریج کیسههای چهارتایی برای تهیه بافیکوت مورد استفاده قرار گرفت(2). این روش نیز نیاز به تبحر بالای پرسنل در زمان جداسازی فرآوردهها داشت. روشهای متفاوتی برای تهیه پلاکت از بافیکوت وجود دارد. در سال 1976، پیتر پرینس و هانس لوس با استفاده از روش بافیکوت جداسازی پلاکتها را آزمایش کردند(18، 2). در این مطالعه برای تهیه کنسانتره پلاکتـی از خون CPD (Citrate-phosphate-dextrose Solution) در یک سیستم چهار کیسهای بسته و ذخیره پلاکـتها در پلاسمای اتولوگ تحت شرایط استریـل استفاده شد. پس از جداسازی خون به اجزا، پلاسما، بافی کوت و کنسانتره گلبول قرمز فاقد لکوسیت و ترومبوسیت، ماده افزودنی SAGM (Saline, Adenine, Glucose and Manitol) به RBC اضافه شد. سپس پلاکتهای موجود در بافیکوت با سانتریفیوژ دوم با دور سبک جدا شده و به کیسه SAGM منتقل شدند. پلاکتها به مدت 72 ساعت در دمای 22 درجه سانتیگراد در انکوباتور نگهداری شدند. میانگین حجم پلاکتهای کنسانتره mL61 با میانگین محتوای پلاکتی 106 × 72 بود (19).
در مطالعه مشابه دیگری در سال 1985 (با کیسههای 4تایی) اجزای خون 4 ساعت پس از جمعآوری، جداسازی شدند (1). پس از جداسازی بافی کوت به آرامی با حدود mL 35 پلاسما مخلوط شده و سپس کیسه حاوی پلاسما و کیسه حاوی RBC جدا شدند. میانگین حجم در این روش به ترتیب برای خون کامل mL 580 ، کنسانتره گلبول قرمز پس از افزودن SAGM (mL 23 ± 280) و پلاسما mL274 و بافیکوت mL70 بود. PC با این روش به مدت 72 ساعت در دمای 22 درجه سانتیگراد قابل نگهداری بود (19). محدودیت مشاهده شده در این مطالعه این بود که به دلیل حجم بافی کوت، کیسه ها در هنگام سانتریفیوژ دچار تاشدگی (فولدینگ) شده و کیفیت جداسازی را تحت تاثیر قرار میدادند.
روش آفرزیس:
روشی مناسب برای جمعآوری فـرآوردههـای خونی مانند گلبولهای قرمز و سـفید، پلاکتها و پلاسمای اهداکننده است .پلاکت فـرزیس فرآینـد اسـتانداردی است که طی آن پلاکتها از خون کامل جدا و جمعآوری میشوند .خون اهداکننده جمعآوری میشود و پس از جدا کردن پلاکت و مقداری پلاسما، سایر اجزای خون به اهداکننده برگردانده میشود(10).
به این پلاکتهای جمعآوری شـده از یک اهداکننده واحد، پلاکت تک واحدی میگویند. پلاکتها در فرآیند پلاکت فرزیس در مدت 2-1 ساعت جمعآوری شده و یک واحد پلاکت فرزیس معمولاً شـامل 1011 × 3 پلاکت بوده که این تعداد برابر 6-5 واحد پلاکـت رندوم حاصل از خون کامل اهداکننده تصادفی است(12). حجم فرآورده به ازای هر 109 × 60 پلاکت باید بیش از 40 میلی لیتر باشد(6).
مدت زمان نگهداری پلاکت در دمای 20 تا 24 درجه در کشورهای مختلف بر اساس ارزیابی خطرهای مختلف از جمله واکنشهای پس از تزریق، آلودگی باکتریال، روش تولید پلاکت و.... متفاوت است مثلاً در آمریکا نهایتاً 5 روز، ژاپن 3 روز، کشورهـای اتحادیـه اروپـا اکثراً بالای 7 روز و آلمان 4 روز (13).
سیر تکامل روش بافی کوت در تهیه پلاکت کنسانتره:
در مراکز انتقال خون ایران از روش PRP و آفرزیس برای تهیه پلاکت استفاده میشود. روش بافیکوت اولین بار در هلند و با استفاده از محلول افزودنی به عنوان جزء اصلی ذخیره پلاکتی توسط راک و همکاران شرح داده شد(14). این روش از دهه 1960 شناخته شده بود و استفاده از آن در دهه 1970 توسعه یافت، اما تا اواسط دهه 1980 بود که روش بافیکوت به طور قابل اعتمادی برای تولید معمول کنسانتره پلاکتی مورد استفاده قرار گرفت. در سال 1987 این روش در بانک خون آمستردام مورد استفاده قرار گرفت و تا سال 1993، 100% پلاکت حاصل از خون کامل به این روش تهیه شد(2).
در سوئد نیز از اواسط 1970 استفاده از این روش آغاز شد که یکی از دلایل آن حجم بالاتر پلاسمای حاصل از این روش است(15). در دهه ۹۰ میلادی در اروپا و از سال 2005، سرویس انتقال خون کانادا (CBS) تغییر ازروش PRP به روش بافیکوت را آغاز کرد. در حال حاضر، در کانادا تقریباً 70 درصد دوزهای فرآورده پلاکت از خون کامل و بقیه به روش آفرزیس تهیه میشود(17، 16). در اروپا، 50 درصد یا بیشتر از تزریقها، پلاکت کنسانتره مشتق از بافیکوت هستند. دانمارک، اسپانیا و هلند بیش از 85 درصد پلاکت کنسانتره خود را از خون کامل تهیه میکنند. در فرانسه و بریتانیا که درصد بالایی از پلاکت به روش آفرزیس تهیه میشد نیز در حال دور شدن از روش آفرزیس به سمت تهیه پلاکت از بافی کوت خون کامل هستند(14). روش دستی با استفاده از کیسههای سه تایی که در ابتدا برای تهیه پلاکت به روش بافیکوت مورد استفاده قرار گرفت، پر زحمت و مشکل بود و ضریب اطمینان پایینی داشت(2). به تدریج کیسههای چهارتایی برای تهیه بافیکوت مورد استفاده قرار گرفت(2). این روش نیز نیاز به تبحر بالای پرسنل در زمان جداسازی فرآوردهها داشت. روشهای متفاوتی برای تهیه پلاکت از بافیکوت وجود دارد. در سال 1976، پیتر پرینس و هانس لوس با استفاده از روش بافیکوت جداسازی پلاکتها را آزمایش کردند(18، 2). در این مطالعه برای تهیه کنسانتره پلاکتـی از خون CPD (Citrate-phosphate-dextrose Solution) در یک سیستم چهار کیسهای بسته و ذخیره پلاکـتها در پلاسمای اتولوگ تحت شرایط استریـل استفاده شد. پس از جداسازی خون به اجزا، پلاسما، بافی کوت و کنسانتره گلبول قرمز فاقد لکوسیت و ترومبوسیت، ماده افزودنی SAGM (Saline, Adenine, Glucose and Manitol) به RBC اضافه شد. سپس پلاکتهای موجود در بافیکوت با سانتریفیوژ دوم با دور سبک جدا شده و به کیسه SAGM منتقل شدند. پلاکتها به مدت 72 ساعت در دمای 22 درجه سانتیگراد در انکوباتور نگهداری شدند. میانگین حجم پلاکتهای کنسانتره mL61 با میانگین محتوای پلاکتی 106 × 72 بود (19).

در مطالعه مشابه دیگری در سال 1985 (با کیسههای 4تایی) اجزای خون 4 ساعت پس از جمعآوری، جداسازی شدند (1). پس از جداسازی بافی کوت به آرامی با حدود mL 35 پلاسما مخلوط شده و سپس کیسه حاوی پلاسما و کیسه حاوی RBC جدا شدند. میانگین حجم در این روش به ترتیب برای خون کامل mL 580 ، کنسانتره گلبول قرمز پس از افزودن SAGM (mL 23 ± 280) و پلاسما mL274 و بافیکوت mL70 بود. PC با این روش به مدت 72 ساعت در دمای 22 درجه سانتیگراد قابل نگهداری بود (19). محدودیت مشاهده شده در این مطالعه این بود که به دلیل حجم بافی کوت، کیسه ها در هنگام سانتریفیوژ دچار تاشدگی (فولدینگ) شده و کیفیت جداسازی را تحت تاثیر قرار میدادند.

در مطالعه دیگری در سال 1987 لاینرهای شیلددار مخصوص و دو گیره ایمنی بزرگ با نوکهای صاف از طریق بست بالای هر کیسه استفاده شد تا فولدینگ کیسه به حداقل برسد(20). در این روش یک نفر میتواند جداسازی 24 کیسه خون کامل را در مدت یک ساعت انجـام دهـد. هنگامـــی که بافیکوت آماده شد، یـک نفـر
میتواند 18 کنستانتره پلاکت را در مدت یک ساعت از بافیکوت تهیه و فرآوری نماید(21، 19).
کیسههای چهارتایی حاوی SAGM در مطالعههای مختلف دیگری نیز استفاده شده است. محدودیت این روشها، تکرارپذیری و اعتبار آزمون مجدد کم و وابسته بودن به تبحر فردی کاربران بود (20، 17).
در سالهای بعد استفاده از کیسههای Top & Bottom (دارای دو خروجی در بالا و پایین کیسه جمعآوری خون هستند که امکان جداسازی همزمان RBC و پلاسما را از بالا و پایین کیسه فراهم میکند، در حالی که لایه بافیکوت در کیسه جمع آوری باقی می ماند) رواج یافت و سیستمهای اکستراکتور اتوماتیک برای جداسازی لایهها مورد استفاده قرار گرفت(22). در روشهای قبلی هر چند بسته به نوع کیسه انتخابی امکان استفاده از اکستراکتورهای دستی و یا اکستراکتورهای اتوماتیک (Opti presses) با دیواره پشتی مسطح قابل جابهجایی وجود داشت ولی در روش استفاده از کیسههای Top & Bottom امکان اتوماسیون فرآیند و بالا بردن ضریـب اطمینـان جـداسازی فراهم و وابستگی به تبحر کاربر نیز در این روش کمتر شد. همچنین فرآورده RBC محتوای گلبول سفید کمتری داشت (16، 14). این روشها به علت دقت و تکرارپذیری بالا و امکان استانداردسـازی بـالا مـورد تاییـد اتحادیه اروپا قرار
گرفت (23).
میتوان بافیکوتهای به دست آمده را ادغام نمود و پس از مخلوط کردن با یک واحد پلاسما یا PAS (Platelet additive solutions) سانتریفیوژ نمود. در هنگام ادغام فرآوردهها میتوان از پلاسما یا PAS استفاده کرد. این ماده یک محلول الکترولیت متعادل است که پلاکت را حفظ میکند، ظرفیت بافری مثل پلاسما دارد و باعث حفظ pH بیش از 6 میگردد. سایر مزایای استفاده از ماده افزودنی شامل افزایش حجم پلاسما برای تولید داروهای مشتق از پلاسما، ترکیب استاندارد شده استریل، محلول فاقد پاتوژن، قابلیت کنترل pH محیط ذخیرهسازی، پروتئین کمتر در نتیجه واکنشهای آلرژیک کمتر، تیتر آنتیبادیهای سیستم ABO پایینتر و کاهش بروز واکنش آسیب حاد ریه ناشی از انتقال خون با واسطه آنتیبادی است (24). PAS باید حاوی موادی باشد که به راحتی محیط با pH مناسب برای تأمین کیفیت و سلامت پلاکتها را فراهم نماید. استات یکی از اجزای آن است. فعالیت متابولیک را میتوان با تعیین سطح لاکتات در طول ذخیرهسازی و در پایان ذخیرهسازی ارزیابی کرد. تولید زیاد لاکتات با خطر زنده مانـدن کـم پـلاکتها در داخـل بدن مرتبط است و ممکن
است منعکسکننده شرایط هیپوکسیک در طول ذخیرهسازی باشد (25). استات یکی از اجزای رایج محلول PAS است، ایـن مـولکول در طـول ذخیـرهسازی بـه بیکربنات تبدیل میشود که به نوبه خود از پلاکتها در برابر ضایعات ثانویه به کاهش pH محیط ذخیرهسازی محافظت میکند(7). مطالعهها نشان داده که بدون استات تولید لاکتات بیشتر است همین امر باعث تغییرات pH و کاهش طول عمر پلاکتها میگردد (26، 7). وجود پتاسیم با حفظ
تغییر سیالیت غشا، تجمع PLT ناشی از آگونیست را مهار میکند (24). علی رغم همه مزایای مواد افزودنی، حداقل 30 درصد پلاسما برای حفظ یکپارچگی ساختاری پلاکتها مورد نیاز است (27). در طی چند سال اخیر این روش تکامل یافته است. برای استاندارد کردن فرآیندها از سال 2018 به بعد در هلند به تمام پلاکتها ماده افزودنی (acetate, potassium, magnesium, phosphate) PAS-E (platelet additive solutions) اضافه میشود (1).
شرایـط جمعآوری، پردازش و نگهداری به طور قابل توجهی بر کیفیت، سلامت و اثربخشی اجزای خون تأثیر میگذارد. فرآوری خون با روش انکوباسیون یک شبه و تولید PF24 به جای پلاسمای تازه منجمد یکی از روشهایی است که امروزه برای تولید پلاکت به روش بافیکوت مورد بهرهبرداری قرار میگیرد. البته راهنماهای FDA از 1980 اجازه تولید محصول از خون کامل نگهداری شده در دمای 20 تا 24 درجه به مدت حداکثر 8 ساعت را دادند (28). در کشورهایی مثل دانمارک، اسپانیا و هلند که 85% از پلاکت خود را با روش بافیکوت تهیه میکنند، نشان داده شد که میتوان ذخایر PLT را به جای روش آفرزیس از خون کامل (Whole Blood) تهیه کرد مشروط به اینکه نگهداری خون کامل در دمای اتاق قبل از جداسازی از حداکثر ۲۴ ساعت بیشتر نشود (16). مطالعهها نشان داده که استفاده از فرآوری خون پس از انکوباسیون یک شبه و تولید PF24 به جای FFP مزایای لجستیکی اقتصادی برای مراکز دارد. هم چنین دارای محدودیتهایی است که میتواند بر سطح فاکتورهای انعقادی پلاسما مؤثر باشد. نتایج مطالعههـا روی بازیابـی و
بقای گلبولهای قرمز حاصل از این روش متغیر بوده است (29، 28، 14). در یک مطالعه در چین دو سری پلاکت تهیه شد. در سری اول از خون کامل تازه قبل از 8 ساعت بافیکوت استخراج شد و سپس در 18 تا 24 ساعت بعد پلاکتها از بافیکوت جداسازی شد (PC1). در گروه دوم خون کامل 24 ساعـت در دمـای20 تا 24 درجه سانتیگراد نگهداری شد و سپس بافیکوت و پلاکتها استخراج شدند (PC2) و پلاسما هم از خون کامل نگهداری شده در دمای 2۴-2۰ درجه به مدت حداکثر ۱۸ تا ۲۴ ساعت بعد تهیه شد. در این مطالعه نشان داده شد محتوای فاکتور FVII و FVIII پلاسمای ۲۴ ساعته پایینتر از FFP بود و هم چنین در PC2 محتوای پلاکت نسبت به PC1 بالاتر بود. اما از نظر فاکتورهای عملکردی پلاکت تفاوتی نداشتند. برخی شاخصهای بیوشیمی مانند Na+ ، pH پایینتر و Lac ، K+ و بروز CD62P (p-selectin : یکی از شاخصهای نشاندهنده فعال شدن پلاکتها که معمولاً در گرانولهای پلاکتی و سلولهای اندوتلیال ذخیره میشود) نسبت به PC1 بالاتر بود (28). در برخی مطالعهها ذکر شده که هیچ تغییر قابل توجهی در فاکتورهای V، VII و X و فیبرینوژن؛ آنتیترومبین III ، پروتئین C ؛ و پروتئین S در دوره نگهداری 24 ساعته بین FFP و PF24 مشاهده نشده و فاکتور VIII بعد از مدت نگهداری 24 ساعته 15 تا 20 درصد کاهش یافت (30). حفظ فعالیت فاکتورهای انعقادی
در مطالعه دیگری نیز نشان داده شده است (31).
در مطالعه اسلیچر، فیلیپ و دیکسترا نشان داده شد این روش (انکوباسیون یک شبه و تولید PF24 به جای FFP) باعث افزایش بازده (yield) پلاکتی میشود، چون فرصت برای جدا شدن گلبولهای سفید و پلاکتها از هم (PLT-WBC disintegration) در طول زمان نگهداری وجود دارد لذا ذخیره بافی کوت حاوی تعداد پلاکـت بالاتـر، محتــوای WBC کمتـر و فعال شدن کمتر پلاکت است (33، 32، 29). همچنین برخی مطالعهها نشان داده که بهترین حالت نگهداری خون کامل دردمای 20 تا 24 درجه سانتیگراد به مدت 20 تا 24 ساعت قبل از فرآوری است (34). استفاده از این روش امکان تجمیع مراکـز فـرآوری و
کاهش هزینههای حمل و نقل خون به مراکز فرآوری را فراهم میسازد(28، 16). فرآوری خون در 8-6 ساعت پس از جمعآوری به دلیل وجود میکرو اگریگیشنها و تجمعات پلاکتی احتمال عدم فیلتراسیونin line را بالا میبرد (20). یکی از روشهای رایج در تهیه پلاکت به
روش بافیکوت، تهیه پولد پلاکتی است. برای تهیه بافی کوت ادغام شده در ابتدا یک ترانسفر پک mL600 با هشت جفت کننده یا اتصال دهنده (couplers) برای مخلوط کردن بافیکوت محتوا و PAS-1 استفاده شد (14، 6).
میتواند 18 کنستانتره پلاکت را در مدت یک ساعت از بافیکوت تهیه و فرآوری نماید(21، 19).
کیسههای چهارتایی حاوی SAGM در مطالعههای مختلف دیگری نیز استفاده شده است. محدودیت این روشها، تکرارپذیری و اعتبار آزمون مجدد کم و وابسته بودن به تبحر فردی کاربران بود (20، 17).
در سالهای بعد استفاده از کیسههای Top & Bottom (دارای دو خروجی در بالا و پایین کیسه جمعآوری خون هستند که امکان جداسازی همزمان RBC و پلاسما را از بالا و پایین کیسه فراهم میکند، در حالی که لایه بافیکوت در کیسه جمع آوری باقی می ماند) رواج یافت و سیستمهای اکستراکتور اتوماتیک برای جداسازی لایهها مورد استفاده قرار گرفت(22). در روشهای قبلی هر چند بسته به نوع کیسه انتخابی امکان استفاده از اکستراکتورهای دستی و یا اکستراکتورهای اتوماتیک (Opti presses) با دیواره پشتی مسطح قابل جابهجایی وجود داشت ولی در روش استفاده از کیسههای Top & Bottom امکان اتوماسیون فرآیند و بالا بردن ضریـب اطمینـان جـداسازی فراهم و وابستگی به تبحر کاربر نیز در این روش کمتر شد. همچنین فرآورده RBC محتوای گلبول سفید کمتری داشت (16، 14). این روشها به علت دقت و تکرارپذیری بالا و امکان استانداردسـازی بـالا مـورد تاییـد اتحادیه اروپا قرار
گرفت (23).
میتوان بافیکوتهای به دست آمده را ادغام نمود و پس از مخلوط کردن با یک واحد پلاسما یا PAS (Platelet additive solutions) سانتریفیوژ نمود. در هنگام ادغام فرآوردهها میتوان از پلاسما یا PAS استفاده کرد. این ماده یک محلول الکترولیت متعادل است که پلاکت را حفظ میکند، ظرفیت بافری مثل پلاسما دارد و باعث حفظ pH بیش از 6 میگردد. سایر مزایای استفاده از ماده افزودنی شامل افزایش حجم پلاسما برای تولید داروهای مشتق از پلاسما، ترکیب استاندارد شده استریل، محلول فاقد پاتوژن، قابلیت کنترل pH محیط ذخیرهسازی، پروتئین کمتر در نتیجه واکنشهای آلرژیک کمتر، تیتر آنتیبادیهای سیستم ABO پایینتر و کاهش بروز واکنش آسیب حاد ریه ناشی از انتقال خون با واسطه آنتیبادی است (24). PAS باید حاوی موادی باشد که به راحتی محیط با pH مناسب برای تأمین کیفیت و سلامت پلاکتها را فراهم نماید. استات یکی از اجزای آن است. فعالیت متابولیک را میتوان با تعیین سطح لاکتات در طول ذخیرهسازی و در پایان ذخیرهسازی ارزیابی کرد. تولید زیاد لاکتات با خطر زنده مانـدن کـم پـلاکتها در داخـل بدن مرتبط است و ممکن
است منعکسکننده شرایط هیپوکسیک در طول ذخیرهسازی باشد (25). استات یکی از اجزای رایج محلول PAS است، ایـن مـولکول در طـول ذخیـرهسازی بـه بیکربنات تبدیل میشود که به نوبه خود از پلاکتها در برابر ضایعات ثانویه به کاهش pH محیط ذخیرهسازی محافظت میکند(7). مطالعهها نشان داده که بدون استات تولید لاکتات بیشتر است همین امر باعث تغییرات pH و کاهش طول عمر پلاکتها میگردد (26، 7). وجود پتاسیم با حفظ
تغییر سیالیت غشا، تجمع PLT ناشی از آگونیست را مهار میکند (24). علی رغم همه مزایای مواد افزودنی، حداقل 30 درصد پلاسما برای حفظ یکپارچگی ساختاری پلاکتها مورد نیاز است (27). در طی چند سال اخیر این روش تکامل یافته است. برای استاندارد کردن فرآیندها از سال 2018 به بعد در هلند به تمام پلاکتها ماده افزودنی (acetate, potassium, magnesium, phosphate) PAS-E (platelet additive solutions) اضافه میشود (1).
شرایـط جمعآوری، پردازش و نگهداری به طور قابل توجهی بر کیفیت، سلامت و اثربخشی اجزای خون تأثیر میگذارد. فرآوری خون با روش انکوباسیون یک شبه و تولید PF24 به جای پلاسمای تازه منجمد یکی از روشهایی است که امروزه برای تولید پلاکت به روش بافیکوت مورد بهرهبرداری قرار میگیرد. البته راهنماهای FDA از 1980 اجازه تولید محصول از خون کامل نگهداری شده در دمای 20 تا 24 درجه به مدت حداکثر 8 ساعت را دادند (28). در کشورهایی مثل دانمارک، اسپانیا و هلند که 85% از پلاکت خود را با روش بافیکوت تهیه میکنند، نشان داده شد که میتوان ذخایر PLT را به جای روش آفرزیس از خون کامل (Whole Blood) تهیه کرد مشروط به اینکه نگهداری خون کامل در دمای اتاق قبل از جداسازی از حداکثر ۲۴ ساعت بیشتر نشود (16). مطالعهها نشان داده که استفاده از فرآوری خون پس از انکوباسیون یک شبه و تولید PF24 به جای FFP مزایای لجستیکی اقتصادی برای مراکز دارد. هم چنین دارای محدودیتهایی است که میتواند بر سطح فاکتورهای انعقادی پلاسما مؤثر باشد. نتایج مطالعههـا روی بازیابـی و
بقای گلبولهای قرمز حاصل از این روش متغیر بوده است (29، 28، 14). در یک مطالعه در چین دو سری پلاکت تهیه شد. در سری اول از خون کامل تازه قبل از 8 ساعت بافیکوت استخراج شد و سپس در 18 تا 24 ساعت بعد پلاکتها از بافیکوت جداسازی شد (PC1). در گروه دوم خون کامل 24 ساعـت در دمـای20 تا 24 درجه سانتیگراد نگهداری شد و سپس بافیکوت و پلاکتها استخراج شدند (PC2) و پلاسما هم از خون کامل نگهداری شده در دمای 2۴-2۰ درجه به مدت حداکثر ۱۸ تا ۲۴ ساعت بعد تهیه شد. در این مطالعه نشان داده شد محتوای فاکتور FVII و FVIII پلاسمای ۲۴ ساعته پایینتر از FFP بود و هم چنین در PC2 محتوای پلاکت نسبت به PC1 بالاتر بود. اما از نظر فاکتورهای عملکردی پلاکت تفاوتی نداشتند. برخی شاخصهای بیوشیمی مانند Na+ ، pH پایینتر و Lac ، K+ و بروز CD62P (p-selectin : یکی از شاخصهای نشاندهنده فعال شدن پلاکتها که معمولاً در گرانولهای پلاکتی و سلولهای اندوتلیال ذخیره میشود) نسبت به PC1 بالاتر بود (28). در برخی مطالعهها ذکر شده که هیچ تغییر قابل توجهی در فاکتورهای V، VII و X و فیبرینوژن؛ آنتیترومبین III ، پروتئین C ؛ و پروتئین S در دوره نگهداری 24 ساعته بین FFP و PF24 مشاهده نشده و فاکتور VIII بعد از مدت نگهداری 24 ساعته 15 تا 20 درصد کاهش یافت (30). حفظ فعالیت فاکتورهای انعقادی
در مطالعه دیگری نیز نشان داده شده است (31).
در مطالعه اسلیچر، فیلیپ و دیکسترا نشان داده شد این روش (انکوباسیون یک شبه و تولید PF24 به جای FFP) باعث افزایش بازده (yield) پلاکتی میشود، چون فرصت برای جدا شدن گلبولهای سفید و پلاکتها از هم (PLT-WBC disintegration) در طول زمان نگهداری وجود دارد لذا ذخیره بافی کوت حاوی تعداد پلاکـت بالاتـر، محتــوای WBC کمتـر و فعال شدن کمتر پلاکت است (33، 32، 29). همچنین برخی مطالعهها نشان داده که بهترین حالت نگهداری خون کامل دردمای 20 تا 24 درجه سانتیگراد به مدت 20 تا 24 ساعت قبل از فرآوری است (34). استفاده از این روش امکان تجمیع مراکـز فـرآوری و
کاهش هزینههای حمل و نقل خون به مراکز فرآوری را فراهم میسازد(28، 16). فرآوری خون در 8-6 ساعت پس از جمعآوری به دلیل وجود میکرو اگریگیشنها و تجمعات پلاکتی احتمال عدم فیلتراسیونin line را بالا میبرد (20). یکی از روشهای رایج در تهیه پلاکت به
روش بافیکوت، تهیه پولد پلاکتی است. برای تهیه بافی کوت ادغام شده در ابتدا یک ترانسفر پک mL600 با هشت جفت کننده یا اتصال دهنده (couplers) برای مخلوط کردن بافیکوت محتوا و PAS-1 استفاده شد (14، 6).

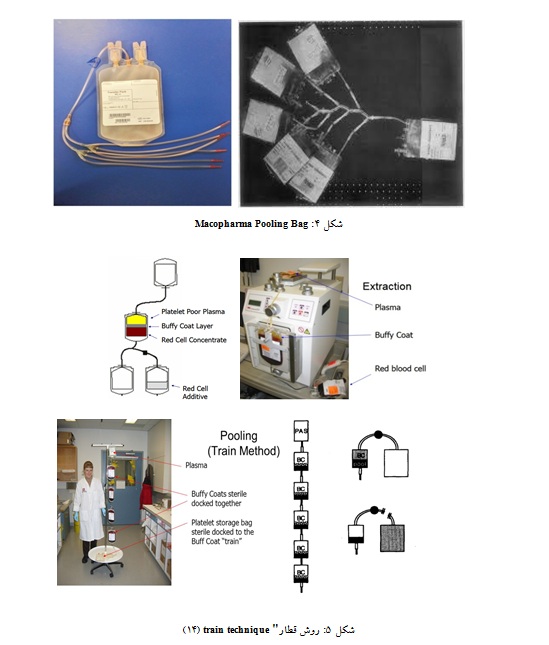
استفاده از کیسههای Top & bottom مانند (Optipac ®, Baxter Healthcare, La Chatre, France) برای تهیه بافیکوت به دلیل قابلیت مجزاسازی بهتر گلبولهای سفید در هنگام جداسازی بهتر از روشهای قدیمی استفاده از کیسههای top-only است. در استکهلم از هر دو روش قدیمی و جدید top system (BB* AGQ456p ، Terumo ، ژاپن، توکیو) و Opti system (optipac KGR1693B ، Baxter) استفاده میشود. در اوپسالا و بسیاری از مکانهای دیگر که از سیستم Opti System (Optipac KGR 1693B, Baxter) برای خونگیری و فرآوری استفاده میکردند، این روش متعاقباً با "روش قطار (train technique) جایگزین شد(شکل 5)، به این معنا که هم اتصالات لوله پایین و هم بالای کیسههای بافیکوت را به صورت قطاری به هم متصل میکند و تمام محتویات را در آخرین کیسه بافیکوت جمع میکند. کیسه PAS برای شستن تمام محتویات پولد بافیکوت استفاده میشود. پس از جدا کردن کیسههای خالی، پولد بافیکوت به طور استریل به یک یا دو کیسه متصل میشود و با یا بدون فیلتر حذف لکوسیت به کیسه جدید منتقل میگردد(14).
در این روش خون کامل در کیسههای top& bottom جمعآوری شده و پس از طی مراحل جداسازی، کورد کیسههای حاوی بافیکوت به صورت قطاری به هم متصل میگردد و در ابتدای زنجیره یک کیسه پلاسما یا PAS قرار دارد. در روش فوق تمام محصول در یک کیسه جمعآوری شده و پلاسما یا PAS مسیر کورد و کیسهها را شستشو میدهد و در کیسه نهایی جمعآوری میگردد. دستگاه جوش استریل (welder) برای اتصال کورد کیسهها مورد نیاز است. اولین دستگاه SCD 812 در سال 1988 مورد استفاده قرار گرفت (30، 12). از آن زمان تاکنون انواع مختلف این دستگاهها تولید و در حال استفاده است. به مرور و با پیشرفت تکنولوژی کیفیت محل جوش و درجه اطمینان آن بالاتر رفته و سرعت دستگاه نیز افزایش داشته است. تهیه فرآورده از خون کامل میتواند به روشهای مختلفی انجام شود، از یک فرآیند با چندین مرحله دستی پس از سانتریفیوژ تا فرآیندهای تمام اتوماتیک. ستهای دستی برای تهیه پولد پلاکتی از شرکتهای مختلف Fresenius Kabi (FRE) ،Macopharma (MAC) و Terumo BCT (TER) موجود هستند(35). در استکهلم، یک کیسه 600 میلیلیتری با ورودیهای متعدد] Singapore ، JMS ، 5370146) multiple entries [ برای جمعآوری محصول بافیکوت استفاده میشود(14). اولین دستگاههای نیمه خودکار مانند Compomat G4 و Optipress II در دهه هشتاد مورد استفاده قرار گرفت(36). سیستمهای تمام اتوماتیک Compomat G5 و MacoPress Smart ، عملکرد کاملاً الکترونیکی داشته و قابلیت باز کردن خودکار کیسههای خون را دارند و میتوان با این دستگاهها به طور همزمان سانتریفیوژ و جداسازی اجزا در کیسههای جانبی را در فرآیندهای یک مرحلهای با استفاده از نرم افزار انجام داد (36).
در شورای اروپا (European Committee) و راهنمای فنی انتقال خون (Technical manual 19th ed) استفاده از کیسه Top & Bottom به همراه مواد افزودنی و به روش انکوباسیون یک شبه و تولید PF24 به جای FFP شرح داده شده است(6).
روشهای رایج سنجش کیفیت پلاکت:
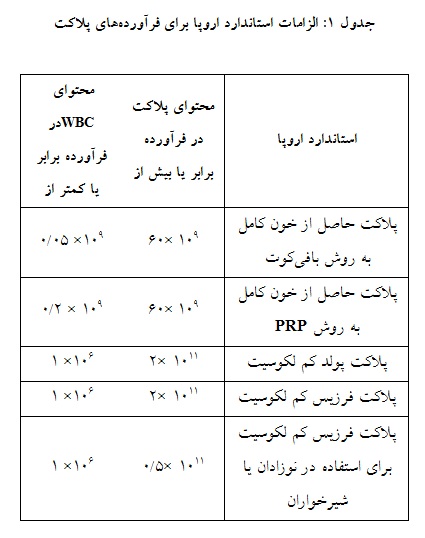
تضمین کیفیت و سلامت خون و فرآوردههای خونی که برای تزریق به بیمار استفاده میشود، در طب انتقال خون ضروری است (37). یکی از مسائل اصلی در کنترل کیفیت به نگهداری و استفاده صحیح از دستگاه مربوط میشود تا از تولید محصول ثابت و ایمنی اهداکننده اطمینان حاصل شود (38). کیفیت پلاکت در شرایط In vitro را میتوان با استفاده از پارامترهای خاصی مانند حرکت گردبادی (swirling)، حجم، شمارش پلاکت و گلبول سفید در هر کیسه و تغییرات pH و درشرایط in vivo با استفاده از افزایش شمارش تصحیح شده (CCI :Corrected Count Increment) و درصد بازیابی (پلاکتهای عملکردی در گردش خون) در 1 و 20 ساعت پس از تزریق ارزیابی کرد (39، 35). مقادیر قابل قبول بر اساس استاندارد اروپا برای کلیه روشهای تولید پلاکت در جدول قابل مشاهده است (جدول 1). حداقل 90 درصد واحدهای کنترل کیفی شده باید الزامات ذکر شده را داشته باشند. pH فرآوردهها در طول مدت مجاز نگهداری در 20 تا 24 درجه سانتیگراد بیش از 4/6 و حجم فرآورده به ازای هر 109× 60 پلاکت بیش از 40 میلیلیتر است(6). طبق استاندارد آمریکا، محتوای پلاکت فرآوری شده از خون کامل در هر واحد معمولاً 1010×5/5 در70-40 میلیلیتر پلاسما میباشد. هم چنین حداقل محتوای پلاکت در محصول آفرزیس 1011×3 تعیین شده است(11). حجم فرآورده به ازای هر 109×60 پلاکت بیش از 40 میلیلیتر است(6).
بحث
فاکتورهای مؤثر بر پلاکت در تولید و نگهداری شامل مـوارد زیـر است که در ادامه به مقایسه آنها در روشهای مختلف تولید پلاکت خواهیم پرداخت: 1- روشهای جمعآوری به ویژه سانتریفیوژ دوم و تعلیق مجدد 2- دما 3- غلظت پلاکت وحجم پلاسما 4- آژیتاسیون 5- نوع و اندازه کیسه مخصوص نگهداری محصول6- حمل و نقل 7- درجه آلودگی با گلبولهای سفید (34). زیر ساختهای مورد نیاز در بخش نیازمندیها مورد بحث قرار گرفته است.
1- مزایا و محدودیتهای روشهای تهیه پلاکت از خون کامل:
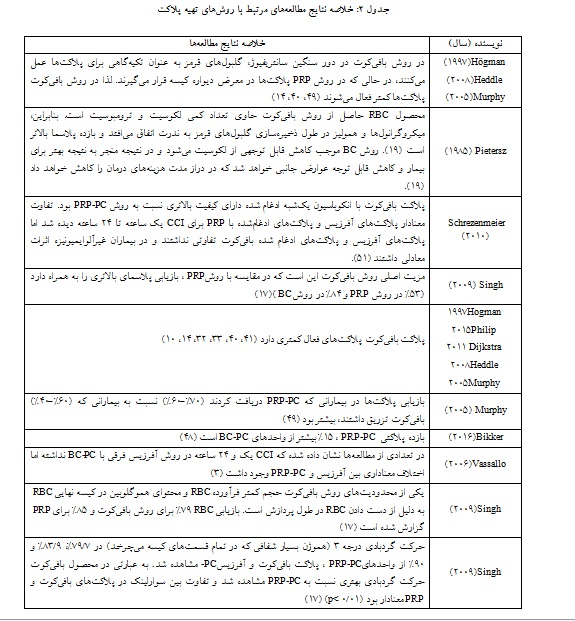
همان طور که در مقاله حاضر اشاره شد برای تهیه پلاکت کنستانتره از خون کامل از روش PRP و بافیکوت استفاده میشود. بر اساس مطالعه هاگمن ـ مورفی و هدل در مقایسه پلاکت تهیه شده به روش بافیکوت با PRP ، بیشتر این مطالعهها تغییرات in-vitro را بررسی کرده و نتایج مختلفی نشان دادهاند( جدول 2).
فعال شدن کمتر پلاکتها به عنوان مزیت روش بافیکوت نسبت به روش PRP ذکر شده است. در روش بافیکوت در دور سنگین سانتریفیوژ، گلبولهای قرمز به عنوان بالشتکی برای پلاکتها عمل میکنند، در حالی که در روش PRP پلاکتها در معرض دیواره کیسه قرار میگیرند. فعال شدن پلاکتها منجر به از دست رفتن پلاکتی و از دست دادن پلاکتهای ذخیره شده میشود (41، 40، 33، 14). مطالعه لوین نشان داد که فعال شدن مارکرهای P-selectin (CD62P) و Annexin V یک ساعت بعد از تولید در روش PRP به صورت معناداری بیشتر است (001/0 p<). Annexin V عضوی از خانواده پروتئینهای اتصالدهنده کلسیم و فسفولیپید با فعالیت ضد انعقادی عروقی است. این مولکول که عمدتاً در سطح سیتوزولی غشا یافت میشود، در حضور غلظتهای فیزیولوژیکی کلسیم میل ترکیبی بالایی برای فسفولیپیدها دارد. با استفاده از فلوسیتومتری برای تشخیص و تعیین فراوانی سلولهای آپوپتوز به عنوان یک شاخص استفاده میگردد. P-selectin (CD62P) یک نشانگر فعالسازی پلاکتی است که واسطه تجمع پلاکتهای ناشی از کلستاز است (15). در مطالعه واشیتانی ذکر شده بلافاصله پس از آمادهسازی، پلاکتهای تهیه شده بـا روشPRP در حالت فعالتری نسبت به پلاکتهای تهیه شده با روش بافیکوت هستند.
علاوه بر این نشان داده شد، تولید لاکتـات، نشت LDH (Lactate dehydrogenase) و P-TG (p-thromboglobulin) در پلاکتهای مشتق شده از یک ساعت بعد از تولید، در روش PRP بیشتر است ولی افزایش نشـت LDH بیـن دو روش تـولید پـلاکت تفاوت معناداری نداشت.
در این روش خون کامل در کیسههای top& bottom جمعآوری شده و پس از طی مراحل جداسازی، کورد کیسههای حاوی بافیکوت به صورت قطاری به هم متصل میگردد و در ابتدای زنجیره یک کیسه پلاسما یا PAS قرار دارد. در روش فوق تمام محصول در یک کیسه جمعآوری شده و پلاسما یا PAS مسیر کورد و کیسهها را شستشو میدهد و در کیسه نهایی جمعآوری میگردد. دستگاه جوش استریل (welder) برای اتصال کورد کیسهها مورد نیاز است. اولین دستگاه SCD 812 در سال 1988 مورد استفاده قرار گرفت (30، 12). از آن زمان تاکنون انواع مختلف این دستگاهها تولید و در حال استفاده است. به مرور و با پیشرفت تکنولوژی کیفیت محل جوش و درجه اطمینان آن بالاتر رفته و سرعت دستگاه نیز افزایش داشته است. تهیه فرآورده از خون کامل میتواند به روشهای مختلفی انجام شود، از یک فرآیند با چندین مرحله دستی پس از سانتریفیوژ تا فرآیندهای تمام اتوماتیک. ستهای دستی برای تهیه پولد پلاکتی از شرکتهای مختلف Fresenius Kabi (FRE) ،Macopharma (MAC) و Terumo BCT (TER) موجود هستند(35). در استکهلم، یک کیسه 600 میلیلیتری با ورودیهای متعدد] Singapore ، JMS ، 5370146) multiple entries [ برای جمعآوری محصول بافیکوت استفاده میشود(14). اولین دستگاههای نیمه خودکار مانند Compomat G4 و Optipress II در دهه هشتاد مورد استفاده قرار گرفت(36). سیستمهای تمام اتوماتیک Compomat G5 و MacoPress Smart ، عملکرد کاملاً الکترونیکی داشته و قابلیت باز کردن خودکار کیسههای خون را دارند و میتوان با این دستگاهها به طور همزمان سانتریفیوژ و جداسازی اجزا در کیسههای جانبی را در فرآیندهای یک مرحلهای با استفاده از نرم افزار انجام داد (36).
در شورای اروپا (European Committee) و راهنمای فنی انتقال خون (Technical manual 19th ed) استفاده از کیسه Top & Bottom به همراه مواد افزودنی و به روش انکوباسیون یک شبه و تولید PF24 به جای FFP شرح داده شده است(6).
روشهای رایج سنجش کیفیت پلاکت:
تضمین کیفیت و سلامت خون و فرآوردههای خونی که برای تزریق به بیمار استفاده میشود، در طب انتقال خون ضروری است (37). یکی از مسائل اصلی در کنترل کیفیت به نگهداری و استفاده صحیح از دستگاه مربوط میشود تا از تولید محصول ثابت و ایمنی اهداکننده اطمینان حاصل شود (38). کیفیت پلاکت در شرایط In vitro را میتوان با استفاده از پارامترهای خاصی مانند حرکت گردبادی (swirling)، حجم، شمارش پلاکت و گلبول سفید در هر کیسه و تغییرات pH و درشرایط in vivo با استفاده از افزایش شمارش تصحیح شده (CCI :Corrected Count Increment) و درصد بازیابی (پلاکتهای عملکردی در گردش خون) در 1 و 20 ساعت پس از تزریق ارزیابی کرد (39، 35). مقادیر قابل قبول بر اساس استاندارد اروپا برای کلیه روشهای تولید پلاکت در جدول قابل مشاهده است (جدول 1). حداقل 90 درصد واحدهای کنترل کیفی شده باید الزامات ذکر شده را داشته باشند. pH فرآوردهها در طول مدت مجاز نگهداری در 20 تا 24 درجه سانتیگراد بیش از 4/6 و حجم فرآورده به ازای هر 109× 60 پلاکت بیش از 40 میلیلیتر است(6). طبق استاندارد آمریکا، محتوای پلاکت فرآوری شده از خون کامل در هر واحد معمولاً 1010×5/5 در70-40 میلیلیتر پلاسما میباشد. هم چنین حداقل محتوای پلاکت در محصول آفرزیس 1011×3 تعیین شده است(11). حجم فرآورده به ازای هر 109×60 پلاکت بیش از 40 میلیلیتر است(6).

بحث
فاکتورهای مؤثر بر پلاکت در تولید و نگهداری شامل مـوارد زیـر است که در ادامه به مقایسه آنها در روشهای مختلف تولید پلاکت خواهیم پرداخت: 1- روشهای جمعآوری به ویژه سانتریفیوژ دوم و تعلیق مجدد 2- دما 3- غلظت پلاکت وحجم پلاسما 4- آژیتاسیون 5- نوع و اندازه کیسه مخصوص نگهداری محصول6- حمل و نقل 7- درجه آلودگی با گلبولهای سفید (34). زیر ساختهای مورد نیاز در بخش نیازمندیها مورد بحث قرار گرفته است.
1- مزایا و محدودیتهای روشهای تهیه پلاکت از خون کامل:
همان طور که در مقاله حاضر اشاره شد برای تهیه پلاکت کنستانتره از خون کامل از روش PRP و بافیکوت استفاده میشود. بر اساس مطالعه هاگمن ـ مورفی و هدل در مقایسه پلاکت تهیه شده به روش بافیکوت با PRP ، بیشتر این مطالعهها تغییرات in-vitro را بررسی کرده و نتایج مختلفی نشان دادهاند( جدول 2).
فعال شدن کمتر پلاکتها به عنوان مزیت روش بافیکوت نسبت به روش PRP ذکر شده است. در روش بافیکوت در دور سنگین سانتریفیوژ، گلبولهای قرمز به عنوان بالشتکی برای پلاکتها عمل میکنند، در حالی که در روش PRP پلاکتها در معرض دیواره کیسه قرار میگیرند. فعال شدن پلاکتها منجر به از دست رفتن پلاکتی و از دست دادن پلاکتهای ذخیره شده میشود (41، 40، 33، 14). مطالعه لوین نشان داد که فعال شدن مارکرهای P-selectin (CD62P) و Annexin V یک ساعت بعد از تولید در روش PRP به صورت معناداری بیشتر است (001/0 p<). Annexin V عضوی از خانواده پروتئینهای اتصالدهنده کلسیم و فسفولیپید با فعالیت ضد انعقادی عروقی است. این مولکول که عمدتاً در سطح سیتوزولی غشا یافت میشود، در حضور غلظتهای فیزیولوژیکی کلسیم میل ترکیبی بالایی برای فسفولیپیدها دارد. با استفاده از فلوسیتومتری برای تشخیص و تعیین فراوانی سلولهای آپوپتوز به عنوان یک شاخص استفاده میگردد. P-selectin (CD62P) یک نشانگر فعالسازی پلاکتی است که واسطه تجمع پلاکتهای ناشی از کلستاز است (15). در مطالعه واشیتانی ذکر شده بلافاصله پس از آمادهسازی، پلاکتهای تهیه شده بـا روشPRP در حالت فعالتری نسبت به پلاکتهای تهیه شده با روش بافیکوت هستند.
علاوه بر این نشان داده شد، تولید لاکتـات، نشت LDH (Lactate dehydrogenase) و P-TG (p-thromboglobulin) در پلاکتهای مشتق شده از یک ساعت بعد از تولید، در روش PRP بیشتر است ولی افزایش نشـت LDH بیـن دو روش تـولید پـلاکت تفاوت معناداری نداشت.

تفاوت در فعالسازی پلاکتهای مشتق از PRP و بافیکوت پس از 2 روز ناپدید شد که نشاندهنده بهبود پلاکتهای PRP پس از فعالسازی اولیه بود(42). با این حال بر اساس مطالعه فیجن هیر، افزایش اتصال هر سه MoAbs (Monoclonal antibody) علیه آنتیژنهای وابسته به فعالسازی از روزهای 5 تا 9 در هر دو نوع PC نشاندهنده ادامه فعالسازی و در نهایت، وخامت وضعیت پلاکتها است (01/0 p<) (9). بر اساس مطالعه مورفی و هاگمن یکی دیگر از مزایای روش بافیکوت، کاهش احتمال آلودگی باکتریال پلاکتها به علت امکان استفاده از انواع ماده افزودنی PAS-III (حاوی غیر فعالکننده پاتوژن) میباشد (41، 40، 14). در یک مطالعه واسکون سلوز در هند عنوان شده که بین سانتریفیوژ دور سنگین و سبک باید فاصله وجود داشته باشد. به همین دلیل روش بافیکوت از روش PRP زمانبرتر است (43).
بر اساس مطالعه مورفی و هاگمن بهبود کیفیت RBC از طریق کاهش تشکیل ریزدانهها و همولیز در روش بافیکوت مشاهده شده است (41، 40، 20، 14). در مطالعه ساین، گلبولهای قرمز (RBC) حاصل از روش بافیکوت حاوی تعداد کمی لکوسیت و ترومبوسیت هستند. بنابراین، میکروگرانولها و همولیز در طول ذخیرهسازی گلبولهای قرمز به ندرت اتفاق میافتد و بازده پلاسما بالاتر است(17). در روش PRP به دلیل بیشتر بودن محتوای لکوسیت در فرآورده RBC ، احتمال حضور میکرواگریگیت و عدم فیلتراسیون و از دست رفتن پلاکتها بیشتر است. روش بافیکوت با همولیز کمتر پس از ذخیرهسازی و 2,3 DPG (2,3 Diphosphoglycerate) بالاتر در محصولات نهایی RBC همراه است. با این حال، همولیز به شرایط نگهداری و ترکیب محلول ذخیرهسازیRBC بستگی دارد(17).
استفاده از PAS باعث افزایش mL 75-30 حجم پلاسما خواهد شد. بر اساس مطالعه هاگمـــن، مورفـی و پیتـرز، حجم پلاسما به طور متوسطmL 280 است و لایه بافیکوت جدا شده حاوی 10 درصد گلبولهای قرمز، 70 درصد لکوسیتهـا و 90 درصد پلاکتها است (41، 40، 20، 19، 14).
در مطالعه واسکونسلوز ذکر شده که در مورد آلودگی باکتریایی، بروز مثبت کم بود و نمیتوان نتیجهگیری کرد که کدام روش ایمنتر است، اگر چه میزان آلودگی در (32/0%) بافی کوت در مقایسه با (18/0%)PRP دو برابر بیشتر بود. این یافتهها از این ایده حمایت میکنند که تغییرات مشاهده شده عمدتاً به خود روشها مربوط میشوند و وابسته به کیسه نیستند، زیرا الگوهای مشابهی با سیستمهای Grifols (یک تولیدکننده داروسازی و شیمیایی چند ملیتی اسپانیایی تولیدکننده محصولات مبتنی بر پلاسمای خون، دستگاهها، ابزارها و معرفهای آزمایشگاهی آزمایشهای بالینی) و Pall bag (کمپانی Pall's FSI Filter Bags & Vessels ارائه دهنده طیف وسیعی از خدمات فیلتراسیون و جداسازی) به دست آمده است. به منظور ارزیابی اهمیت بالینی این آزمایشها و نتایج in vivo از نظر اثربخشی بالینی و زنده ماندن پلاکتهای ذخیره شده برای بیمار، مطالعههای بیشتری مورد نیاز است(44). هر چند مطالعه دوین کاهش میزان آلودگی باکتریایی در مقایسه با روش PRP را ذکر کرده است(45). در مطالعه ساینت ذکر شده که مزیت اصلی روش بافی کوت این است که در مقایسه با روشPRP ، بازیابی پلاسمای بالاتری را به همراه دارد (53% در روش PRP و 84% در روش بافیکوت) همچنین در این مطالعه ذکر شده مشاهده سوارلینک و شمارش پلاکتی به شکل معناداری در پلاکت فرزیس بیش از دو روش دیگر است ولی بین روش بافیکوت و PRP تفاوت معناداری مشاهده نشد. شمارش گلبول سفید به شکل معناداری در محصول پلاکتی PRP بیش از روش بافیکوت بود(17). نتایج مطالعه بشکار و همکاران نیز از نظر شمارش پلاکت و گلبول سفید با این مطالعه همخوانی دارد(8).
در مطالعه مورفی در سال 1994 و 2005 ذکر شده، روش بافی کوت موجب کاهش قابل توجهی از لکوسیت میشود و در نتیجه منجر به نتیجه بهتر برای بیمار و کاهش قابل توجه عوارض جانبی خواهد شد که در دراز مدت هزینههای درمان را کاهش خواهد داد. در یک مطالعه نشان داده شد وقتی میزان لکوسیتها 106× 5 کاهش داده شود واکنشهای آلوایمیونیزاسیون HLA 93% کاهش خواهد یافت (46). مطالعه مورفی نشان داد این واکنشها در تزریق پلاکت کم لکوسیت به بیمار نسبت به پلاکت معمولی 48-16 درصد کمتر است (41، 25). در مطالعه دیکسترا در سـال 2004، تعـداد بسیـار کمتـری از قطعـات WBC در PC های تهیه شده با روش PRP نسبت به روش بافیکوت در پلاسما یا Composol مشاهده شد، سانتریفیوژ با دور سنگین خون کامل ممکن است منجر به تعداد بیشتری از قطعات WBC نسبت به سانتریفیوژ PRP با دور سنگین شود که حاوی WBC کمتر قبل از سانتریفیوژ بوده است. چیزی که برای مراکز انتقال خون مهمتر است این است که کدام محصول برای بیمار بهتر است؟ فرآورده پلاکت بافیکوت پلاکتهای فعال کمتری دارد و بنابراین ممکن است موثرتر باشد(33). همچنین در مطالعه دیکسترا در سـال 2004 و 2005 ذکـر شـده PRP-PC تعداد قطعات WBC کمتری دارد و بنابراین ممکن است واکنشهای ایمنی کمتری داشته باشد. برای هر دو محصول توصیه شد که ظرف 24 ساعت پس از جمعآوری خون فیلتر شود زیرا در طول نگهداری، WBCها تکه تکه میشوند و این قطعات با فیلتراسیون حذف نمیشوند(47، 33).
در مطالعه پیترز عنوان شد که لکوسیتها باعث کاهش قابل توجه pH، افزایش مصرف گلوکز، تولید اسید لاکتیک و آزادسازی LDH در طول ذخیرهسازی میشوند (21). مطالعههای ساینت و ارنیس پیشنهاد دادند که تعداد کم لکوسیتهای باقیمانده در محصول پلاکتی ممکن است در جلوگیری از کاهش pH در طول ذخیرهسازی پلاکت مهم باشد (45، 17).
بیکر و همکاران گزارش دادند بازده پلاکتی PRP-PC ، 15% بیشتر از واحدهای پلاکت بافیکوت است(48). مورفی و همکاران دریافتند که بازیابی پلاکتها در بیمارانی که PRP-PC دریافت کردند (بازیابی70%-60%) نسبت به بیمارانی که پلاکت بافیکوت تزریق داشتند (بازیابی60%-40%)، بیشتر بود (49). برتولینی و همکاران همچنین تولید بازدهی کمتری را در واحدهای پلاکت بافیکوت در مقایسه با واحدهای PRP-PC گزارش کردند، اما افزایش تعداد پلاکتها پس از تزریق پلاکت بافیکوت و واحدهای PRP-PC تفاوت معناداری نداشت (50). مطالعه لوین نشان داد کیفیت پلاکت بافیکوت نسبت به روش PRP بهتر بوده است و در تعدادی از مطالعهها نشان داده شده که CCI یک و 24 ساعته در روش آفرزیس فرقی با پلاکت بافیکوت نداشته اما اختلاف معناداری بین آفرزیس و PRP-PC وجود داشت (3). یکی از محدودیتهای روش بافیکوت، حجم کمتر فرآورده RBC و محتوای همـوگلوبین در کیسه نهاییRBC به دلیل از دست دادن RBC در طول پردازش است. بازیابی RBC 79% برای روش BC و 85% برای PRP گزارش شده است (17، 15).
در مطالعه ساینت، حرکت گردبادی درجه 3 (هموژن بسیار شفافی که در تمام قسمتهای کیسه میچرخد) در 7/79% ، 9/83% و 90% از واحدهای PRP-PC، پلاکت بافیکوت و آفرزیس PC مشاهده شد. به عبارتی در محصول بافیکوت حرکت گردبادی بهتری نسبت به PRP-PC مشاهده شد و تفاوت بین سوارلینگ در پلاکتهای بافیکوت وPRP معنادار بود (01/0 p<)(17).
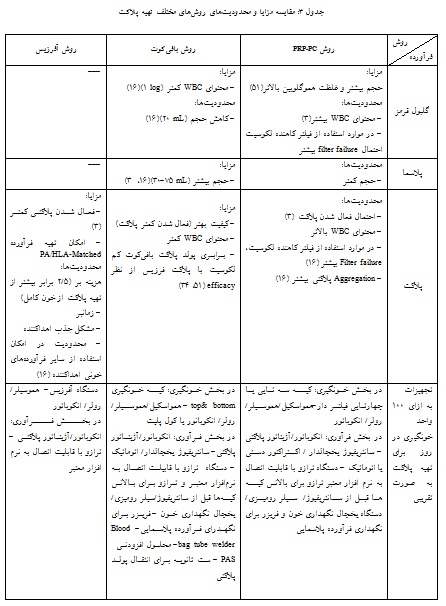
بر اساس یافتههای مطالعههای مختلف (جدول ۳) از مزایای روش PRP میتوان به حجم بیشتر و هموگلوبین بالاتر درمحصول RBC، سهولت روش انجام کار و انجام فرآیند در یک شیفت کاری، امکان تهیه FFP و Cryoprecipitate اشاره کرد. محدودیت این روش شامل احتمال بیشتر تولید پلاسمای با حجم کم، محتوای بیشتر WBC در فرآورده پلاکت و RBCs ، آلودگی RBC در فرآورده پلاکت، عدم فیلتراسیون (filter failure) بیشتر (هنگام استفاده از فیلتر کاهنده لکوسیت)، احتمال فعالشدن پلاکت در حین سانتریفیوژ با دور سنگین hard spin و امکان استفاده محدود از PAS میباشد.
مزایای روش بافیکوت شامل حجم بیشتر پلاسما، شمارش کمترWBC در فرآوردههای پلاکت و RBC ، احتمال عدم فیلتراسیون و فعال شدن پلاکتها و بهبود کیفیت پلاکت، امکان استفاده از PAS و فناوری کاهش پاتوژن (Pathogen reduction technology) PRT و نگهداری پلاکت تا 7 روز، با استفاده از automatic pooling system ، امکان استانداردسازی فرآیندها از طریق سیستمهای اتوماسیون و معایب محدودیت آن در صورت تهیه پلاکت بافیکوت تازه (Fresh-BC) شامل نیاز به استراحت 3-2 ساعت قبل از جداسازی و فرآیند پیچیدهتر، انتقال کار به شیفتهای بعدی، در صورت عدم استفاده از اکستراکتور اتوماتیک و این که جداسازی دستی لایهها نیاز به تبحر بالا و پرسنل با تجربه و با دقت بالا دارد. در روش تهیه پلاکت به روش بافیکـوت بـا انکوباسیـون یـک شبـه
بر اساس مطالعه مورفی و هاگمن بهبود کیفیت RBC از طریق کاهش تشکیل ریزدانهها و همولیز در روش بافیکوت مشاهده شده است (41، 40، 20، 14). در مطالعه ساین، گلبولهای قرمز (RBC) حاصل از روش بافیکوت حاوی تعداد کمی لکوسیت و ترومبوسیت هستند. بنابراین، میکروگرانولها و همولیز در طول ذخیرهسازی گلبولهای قرمز به ندرت اتفاق میافتد و بازده پلاسما بالاتر است(17). در روش PRP به دلیل بیشتر بودن محتوای لکوسیت در فرآورده RBC ، احتمال حضور میکرواگریگیت و عدم فیلتراسیون و از دست رفتن پلاکتها بیشتر است. روش بافیکوت با همولیز کمتر پس از ذخیرهسازی و 2,3 DPG (2,3 Diphosphoglycerate) بالاتر در محصولات نهایی RBC همراه است. با این حال، همولیز به شرایط نگهداری و ترکیب محلول ذخیرهسازیRBC بستگی دارد(17).
استفاده از PAS باعث افزایش mL 75-30 حجم پلاسما خواهد شد. بر اساس مطالعه هاگمـــن، مورفـی و پیتـرز، حجم پلاسما به طور متوسطmL 280 است و لایه بافیکوت جدا شده حاوی 10 درصد گلبولهای قرمز، 70 درصد لکوسیتهـا و 90 درصد پلاکتها است (41، 40، 20، 19، 14).
در مطالعه واسکونسلوز ذکر شده که در مورد آلودگی باکتریایی، بروز مثبت کم بود و نمیتوان نتیجهگیری کرد که کدام روش ایمنتر است، اگر چه میزان آلودگی در (32/0%) بافی کوت در مقایسه با (18/0%)PRP دو برابر بیشتر بود. این یافتهها از این ایده حمایت میکنند که تغییرات مشاهده شده عمدتاً به خود روشها مربوط میشوند و وابسته به کیسه نیستند، زیرا الگوهای مشابهی با سیستمهای Grifols (یک تولیدکننده داروسازی و شیمیایی چند ملیتی اسپانیایی تولیدکننده محصولات مبتنی بر پلاسمای خون، دستگاهها، ابزارها و معرفهای آزمایشگاهی آزمایشهای بالینی) و Pall bag (کمپانی Pall's FSI Filter Bags & Vessels ارائه دهنده طیف وسیعی از خدمات فیلتراسیون و جداسازی) به دست آمده است. به منظور ارزیابی اهمیت بالینی این آزمایشها و نتایج in vivo از نظر اثربخشی بالینی و زنده ماندن پلاکتهای ذخیره شده برای بیمار، مطالعههای بیشتری مورد نیاز است(44). هر چند مطالعه دوین کاهش میزان آلودگی باکتریایی در مقایسه با روش PRP را ذکر کرده است(45). در مطالعه ساینت ذکر شده که مزیت اصلی روش بافی کوت این است که در مقایسه با روشPRP ، بازیابی پلاسمای بالاتری را به همراه دارد (53% در روش PRP و 84% در روش بافیکوت) همچنین در این مطالعه ذکر شده مشاهده سوارلینک و شمارش پلاکتی به شکل معناداری در پلاکت فرزیس بیش از دو روش دیگر است ولی بین روش بافیکوت و PRP تفاوت معناداری مشاهده نشد. شمارش گلبول سفید به شکل معناداری در محصول پلاکتی PRP بیش از روش بافیکوت بود(17). نتایج مطالعه بشکار و همکاران نیز از نظر شمارش پلاکت و گلبول سفید با این مطالعه همخوانی دارد(8).
در مطالعه مورفی در سال 1994 و 2005 ذکر شده، روش بافی کوت موجب کاهش قابل توجهی از لکوسیت میشود و در نتیجه منجر به نتیجه بهتر برای بیمار و کاهش قابل توجه عوارض جانبی خواهد شد که در دراز مدت هزینههای درمان را کاهش خواهد داد. در یک مطالعه نشان داده شد وقتی میزان لکوسیتها 106× 5 کاهش داده شود واکنشهای آلوایمیونیزاسیون HLA 93% کاهش خواهد یافت (46). مطالعه مورفی نشان داد این واکنشها در تزریق پلاکت کم لکوسیت به بیمار نسبت به پلاکت معمولی 48-16 درصد کمتر است (41، 25). در مطالعه دیکسترا در سـال 2004، تعـداد بسیـار کمتـری از قطعـات WBC در PC های تهیه شده با روش PRP نسبت به روش بافیکوت در پلاسما یا Composol مشاهده شد، سانتریفیوژ با دور سنگین خون کامل ممکن است منجر به تعداد بیشتری از قطعات WBC نسبت به سانتریفیوژ PRP با دور سنگین شود که حاوی WBC کمتر قبل از سانتریفیوژ بوده است. چیزی که برای مراکز انتقال خون مهمتر است این است که کدام محصول برای بیمار بهتر است؟ فرآورده پلاکت بافیکوت پلاکتهای فعال کمتری دارد و بنابراین ممکن است موثرتر باشد(33). همچنین در مطالعه دیکسترا در سـال 2004 و 2005 ذکـر شـده PRP-PC تعداد قطعات WBC کمتری دارد و بنابراین ممکن است واکنشهای ایمنی کمتری داشته باشد. برای هر دو محصول توصیه شد که ظرف 24 ساعت پس از جمعآوری خون فیلتر شود زیرا در طول نگهداری، WBCها تکه تکه میشوند و این قطعات با فیلتراسیون حذف نمیشوند(47، 33).
در مطالعه پیترز عنوان شد که لکوسیتها باعث کاهش قابل توجه pH، افزایش مصرف گلوکز، تولید اسید لاکتیک و آزادسازی LDH در طول ذخیرهسازی میشوند (21). مطالعههای ساینت و ارنیس پیشنهاد دادند که تعداد کم لکوسیتهای باقیمانده در محصول پلاکتی ممکن است در جلوگیری از کاهش pH در طول ذخیرهسازی پلاکت مهم باشد (45، 17).
بیکر و همکاران گزارش دادند بازده پلاکتی PRP-PC ، 15% بیشتر از واحدهای پلاکت بافیکوت است(48). مورفی و همکاران دریافتند که بازیابی پلاکتها در بیمارانی که PRP-PC دریافت کردند (بازیابی70%-60%) نسبت به بیمارانی که پلاکت بافیکوت تزریق داشتند (بازیابی60%-40%)، بیشتر بود (49). برتولینی و همکاران همچنین تولید بازدهی کمتری را در واحدهای پلاکت بافیکوت در مقایسه با واحدهای PRP-PC گزارش کردند، اما افزایش تعداد پلاکتها پس از تزریق پلاکت بافیکوت و واحدهای PRP-PC تفاوت معناداری نداشت (50). مطالعه لوین نشان داد کیفیت پلاکت بافیکوت نسبت به روش PRP بهتر بوده است و در تعدادی از مطالعهها نشان داده شده که CCI یک و 24 ساعته در روش آفرزیس فرقی با پلاکت بافیکوت نداشته اما اختلاف معناداری بین آفرزیس و PRP-PC وجود داشت (3). یکی از محدودیتهای روش بافیکوت، حجم کمتر فرآورده RBC و محتوای همـوگلوبین در کیسه نهاییRBC به دلیل از دست دادن RBC در طول پردازش است. بازیابی RBC 79% برای روش BC و 85% برای PRP گزارش شده است (17، 15).
در مطالعه ساینت، حرکت گردبادی درجه 3 (هموژن بسیار شفافی که در تمام قسمتهای کیسه میچرخد) در 7/79% ، 9/83% و 90% از واحدهای PRP-PC، پلاکت بافیکوت و آفرزیس PC مشاهده شد. به عبارتی در محصول بافیکوت حرکت گردبادی بهتری نسبت به PRP-PC مشاهده شد و تفاوت بین سوارلینگ در پلاکتهای بافیکوت وPRP معنادار بود (01/0 p<)(17).
بر اساس یافتههای مطالعههای مختلف (جدول ۳) از مزایای روش PRP میتوان به حجم بیشتر و هموگلوبین بالاتر درمحصول RBC، سهولت روش انجام کار و انجام فرآیند در یک شیفت کاری، امکان تهیه FFP و Cryoprecipitate اشاره کرد. محدودیت این روش شامل احتمال بیشتر تولید پلاسمای با حجم کم، محتوای بیشتر WBC در فرآورده پلاکت و RBCs ، آلودگی RBC در فرآورده پلاکت، عدم فیلتراسیون (filter failure) بیشتر (هنگام استفاده از فیلتر کاهنده لکوسیت)، احتمال فعالشدن پلاکت در حین سانتریفیوژ با دور سنگین hard spin و امکان استفاده محدود از PAS میباشد.
مزایای روش بافیکوت شامل حجم بیشتر پلاسما، شمارش کمترWBC در فرآوردههای پلاکت و RBC ، احتمال عدم فیلتراسیون و فعال شدن پلاکتها و بهبود کیفیت پلاکت، امکان استفاده از PAS و فناوری کاهش پاتوژن (Pathogen reduction technology) PRT و نگهداری پلاکت تا 7 روز، با استفاده از automatic pooling system ، امکان استانداردسازی فرآیندها از طریق سیستمهای اتوماسیون و معایب محدودیت آن در صورت تهیه پلاکت بافیکوت تازه (Fresh-BC) شامل نیاز به استراحت 3-2 ساعت قبل از جداسازی و فرآیند پیچیدهتر، انتقال کار به شیفتهای بعدی، در صورت عدم استفاده از اکستراکتور اتوماتیک و این که جداسازی دستی لایهها نیاز به تبحر بالا و پرسنل با تجربه و با دقت بالا دارد. در روش تهیه پلاکت به روش بافیکـوت بـا انکوباسیـون یـک شبـه

انجام چرخه در یک شیفت کاری، امکان متمرکزسازی مراکز فرآوری، اتواستریلیزاسیون و کاهش آلودگی باکتریال فرآورده، کاهش هزینههای حمل ونقل از مراکز اقماری و تیم سیار را میتوان به عنوان مزایا نام برد. عدم امکان تهیه FFP و کرایوپرسیپیتیت از محدودیتهای آن اسـت. کاهش
حجم فرآورده RBC به میزان تقریبی mL20 در روش بافیکوت نسبت به PRP نشان داده شده است. بعد از حدود 40 سال از گسترش روش بافیکوت برای تهیه پلاکت، این روش در بسیاری مراکز انتقال خون دنیا از جمله اروپا، نیوزیلند، استرالیا و کانادا استفاده شده است(3، 2).
2- مزایا و محدودیتهای روش آفرزیس:
در اکثر کشورهای توسعهیافته، نسبت جمعیت در گروه سنی بالاتر به سرعت در حال افزایش است و بنابراین، نیاز به فرآوردههای خونی نیز ممکن است به سرعت افزایش یابد. در مطالعهای در یزد بیش از 25 درصد فرآوردههای خونی برای گروه سنی بیش از 65 سال مصرف شد (52). با کاهش نرخ زاد و ولد در بسیاری از کشورهای توسعهیافته، این گروههای سنی جوانتر به عنوان درصدی از کل جمعیت در حال حاضر که به یکی از سه روش رایج برای تهیه پلاکت از آنها استفاده میشود، در حال کاهش هستند. همچنین علاقه کمتری در افرادی که بین سالهای 1981 تا 2000 متولد شدهاند، برای پیوستن به سازمانهای مدنی یا اهدای خون، بهویژه از طریق فرزیس، وجود دارد(16).
در بررسی تغییرات سنی اهداکنندگان در استان یزد نیز جمعیت اهداکننده 30-18 سال در طی سالهای مورد بررسی کاهش داشت(53). فرآیند آفرزیس زمانبر است و اهداکنندگان جدید و جوان بیشتر تمایل به اهدای خون کامل دارند تا اهدای آفرزیس. در اهدای خون کامل نسبت به اهدای آفرزیس امکان تهیه فرآوردههای دیگر بیشتر است.
به طور کلی استدلال میشود با توجه به محدودیتهای روش آفرزیس و این که با پیشرفت روشهای کم هزینهتر که از نظر کیفی قابل قیاس هستند و از طرفی با توجه به درخواستهای روز افزون تهیه پلاکت فرزیس از طرف پزشکان، عمدتاً اهدای خـون کامـل روش مناسـبتری اسـت، زیـرا در مکانهای مختلف ثابت و سیار امکانپذیر بوده و به طور کلی به صرفهتر است. البته تولید پلاکت به روش آفرزیس را نمیتوان حذف نمود و باید بخشی از پلاکت تولیدی باقی بماند تا بتواند تقاضا برای فرآوردههای خاص مثلاً همسـان با HLA یا آنتیژن پلاکتی گیرنده را برآورده نماید. تولید پلاکتهای چند دوزی از چرخه آفرزیس باید به حداکثر مقدار ممکن برسد تا هزینه این فرآورده خونی تعدیل شود (45). برخی مطالعهها نشان دادهاند در روز پایانی نگهداری پلاکت آفرزیس پایدارترین pH و کمترین تجمعات پلاکتی را دارند (45، 44). با این حال در بسیاری از بیماران اثربخشی محصول بافیکوت در گیرنده مشابه آفرزیس بوده است (41، 40، 14). محاسبه شده که تولید دوز درمانی پلاکت بافیکوت تقریباً 5/2 برابر ارزانتر از دوز آفرزیس است (54، 16، 14).
نیازمندیهای تغییر روش تهیه پلاکت:
مراکز انتقال خون برای تغییر روش از PRP به بافیکوت با چالشها و نیازمندیهایی مواجه هستند که شامل موارد زیر است: کیسههای مصرفی باید به Bottom & Top تغییر یابد. در صورت استفاده از روش انکوباسیون یکشبه برای استراحت 16تا 24 ساعته خون کامل قبل از فرآوری در محیط فرآورده به انکوباتور 48 تایی دو طبقه نیاز است.
اکستراکتورهای اتوماتیک Opti pressesبا دیواره پشتی مسطح قابل جابهجایی، با احتساب زمان جداسازی برای هر کیسه 5/3 دقیقه و هر ران کاری سانتریفیوژ که 12 کیسه است و همچنین متوسط ارسال کیسه به واحد فرآورده 25 واحد و با در نظر گرفتن کیسههای فیلتر دار و زمان استراحت آنها میتوان پیشبینی کرد که در هر ران کاری حداقل دو دستگاه سانتریفیوژ همزمان در حال استفاده است و برای جداسازی اجزای خون بعد از سانتریفیوژ، 10 دستگاه اکستراکتور برای 100 تا 120 واحد خون مورد نیاز است. علاوه بر هزینههای خرید دستگاه، هزینه نقل و انتقال به مرکز، سرویس دورهای و نگهداری پیشگیرانه، هزینه تعمیرات این تجهیزات نیز باید مد نظر قرار داده شود.
دستگاه ولدر برای تهیه پولد پلاکتی که یک روش رایج در تهیه پلاکت به روش بافیکوت است، مورد نیاز میباشد. در برخی مدلها هر 14 تا 15 ثانیه یک کورد جوش داده میشود. به عبارتی برای متوسط 60 واحد پلاکت در روز با احتساب زمان قرار دادن کورد و خروج آن از بازوهای دستگاه، حداقل30 دقیقه زمان صرف خواهد شد. در صورتی که در نوع دستگاهی که خریداری می شود با همین بازده و زمان کورد جوش داده شود، حداکثر دو دستگاه در مرکز مورد نیاز خواهد بود. هزینه خرید، سرویس دورهای و نگهداری پیشگیرانه، انتقال دستگاه به مرکز باید در نظر گرفته شود. ست برای انتقال پلاکت ادغام شده و کاهش لکوسیت از سایر اقلام مصرفی مورد نیاز است. برای جانمایی دستگاه اکستراکتور اتوماتیک، دستگاه ولدر و آژیتاتور ممکن است نیاز به تغییرات فضا در واحدهای فنی باشد که هزینههای آن باید محاسبه شود. بررسی از نظر کفایت لاینر و باگت سانتریفیوژها برای تهیه پلاکت بافیکوت بایستی انجام شود و با توجه به نوع تغییرات، تجهیزات و فرآیند و این که در مرحله جوش کورد باید کنترل محل جوش برای کیسهها برای تعیین تاریخ انقضا و اطمینان از باز نشدن مسیر انجام شود، حداقل یک نفر باید به پرسنل فنی واحد اضافه گردد. تغییرات نرمافزارهای مورد استفاده و آموزش کارشناسان درگیر در فرآیند نیز باید مد نظر قرار گیرد.
نتیجهگیری
به منظور ارزیابی اثربخشی بالینی و زندهمانی پلاکتهای ذخیره شده در داخل بدن بیمار، مطالعههای بیشتری مورد نیاز است. مطالعههای in vivo به دلیل اثر فاکتورهای مربوط به بیمار روی افزایش شمارش و
عملکرد پلاکت خیلی محدود هستند. با این حال برخی مطالعهها نشان دادهاند که کیفیت و اثربخشی فرآورده پولد بافیکوت کم لکوسیت معادل آفرزیس و بهتر از PRP است و محتوای لکوسیت در فرآوردههای گلبول قرمز و پلاکت کمتر هست. همچنین احتمال عدم فیلتراسیون و گیر افتادن و از دست رفتن پلاکتها در فیلتر کاهنده لکوسیت و فرآورده گلبول قرمز کمتر میشود. بیشتر کشورهای دنیا به سمت استفاده از روش بافیکوت رفتهاند که هم کم هزینهتر است و هم امکان پیشرفت بیشتر در بهبود کیفیت دارد(14). پیشنهاد میشود هدف را بهبود کیفیت پلاکتها و بهینهسازی درمان بیماران ترومبوسایتوپنیک قرار داد تا این که صرفاً تمرکز بر روی روش تهیه باشد. برای بهبود کیفیت استفاده از پلاکتهای ادغام شده کم لکوسیت با توجه به چالشهای روش آفرزیس(هزینهبر بودن، مشکل جذب اهداکننده) گزینه مناسبی میباشد و پیشرفت روشهایی مانند کاهش پاتوژن و استفاده از مواد افزودنی پلاکت، ایمنی و عمر نگهداری این فرآورده را بیشتر میکند. در روشPRP تهیه پلاکت ادغام شده کم لکوسیت امکانپذیر است. با این حال به دلیل محتوای بالای لکوسیت در واحدهای پلاکت، احتمال میکرواگریگیشن و عدم فیلتراسیون یا گیر افتادن پلاکتها در فیلتر هست. از طرفی برای استفاده از این لاین (in line) فیلتر کاهنده لکوسیت برای تهیه هر واحد منفرد پلاکت کم لکوسیت هزینهها بیشتر میشود. برای تهیه پلاکت ادغام شده کم لکوسیت به روش بافیکوت امکان تهیه و استقرار اکستراکتورهای اتوماتیک، سیستمهای ادغام فرآورده و تأمین کیسههای خون جدید و افزایش خونگیری برای جبران کاهش حجم گلبول قرمز و در صورت تهیه PF24 تهیه انکوباتور نگهداری خون کامل و تأمین فاکتور 8 تجاری درنظر گرفته شود.
نوع مطالعه: مروري |
موضوع مقاله:
انتقال خون
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






