جلد 20، شماره 3 - ( پاییز 1402 )
جلد 20 شماره 3 صفحات 188-179 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sasani N, Roghanian R, Emtiazi G, Jalali S, Aghaie A. Defensin peptide extraction from leukoreduction filters and determination of minimum inhibitory concentration on Staphylococcus aureus growth. bloodj 2023; 20 (3) :179-188
URL: http://bloodjournal.ir/article-1-1488-fa.html
URL: http://bloodjournal.ir/article-1-1488-fa.html
ساسانی نیلوفر، روغنیان رسول، امتیازی گیتی، جلالی سید مهرداد، آقایی افسانه. استخراج پپتید دیفنسین از فیلترهای لکوسیتی و تعیین میزان حداقل غلظت بازدارندگی رشد بر استافیلوکوکوس اورئوس. فصلنامه پژوهشی خون. 1402; 20 (3) :179-188
دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 465 kb]
(774 دریافت)
| چکیده (HTML) (1847 مشاهده)
مقدمه
در آغاز قرن بیستم، مرگ و میر ناشی از بیماریهای عفونی با کشف عوامل ضد میکروبی و ساخت آنتیبیوتیکها و واکسنها، به عنوان مهمترین دستاوردهای بشر در زمینه پزشکی کاهش یافت (1). اولین آنتیبیوتیک توسط فلمینگ در سال 1928 و در پلیت حاوی استافیلوکوکوس اورئوس شناسایی و سرآغاز کشف پنیسیلین شد که همراه با سایر آنتیبیوتیکها منجر به نجات جان میلیونها انسان و حیوان گردید. اما پس از مدت زمان کوتاهی، مقاومتهای آنتیبیوتیکی به دلایل استفاده نامناسب از آنتیبیوتیکها در پزشکی و دامپزشکی پدیدار گشت (2). بر این اساس، در معرض قرار گرفتن طولانی مدت و مداوم میکروارگانیسمها در برابر آنتیبیوتیکها، خطر مقاومت آنها را به آنتی بیوتیکها افزایش داده است (3).
امروزه در کنترل عفونتهای میکروبی نیاز به نوآوریهایی نظیر استفاده از پپتیدهای ضد میکروبی (AMPs, Anti Microbial Peptides) میباشد. پپتیدهای ضد میکروبی؛ بیومولکولهای حفاظت شده در تمام پروکاریوتها و یوکاریوتها هستند و اولین خط دفاع ایمنی ذاتی در برابر ویروسها، باکتریها، قارچها و انگلها میباشند (6-4). کشف AMPs یا دفاع کاتیونی به سال 1939 باز میگردد (7). این AMPs از اجزای مهم دفاع طبیعی بدن علیه عوامل بیماریزا هستند و توسط گرانولوسیتها، ماکروفاژها و سلولهای اپیتلیال در انسان تولید میشوند. پپتیدهای ضد میکروبی، به عنوان آنتیبیوتیکهای جدید در مقابله با باکتریهای مقاوم به آنتیبیوتیک در درمانهای بالینی به صورت آزمایشی استفاده شده است (4). نوتروفیلها، گرانولوسیتهای با توانایی تولید AMPs میباشند و از آن جایی که بیش از 60 درصد گلبولهای سفید خون را نوتروفیلها تشکیل میدهند، میتوانند به عنوان منبع غنی از این پپتیدها مورد استفاده قرار گیرند (8).
از طرف دیگر واکنشهای ناخواسته انتقال خون به واسطه حضور گلبولهای سفید بروز مینماید و جداسازی لکوسیتها، با هدف کم نمودن عوارض انتقال خون ضروری میباشد (9). یکی از عملکردهای معمول در مراحل فرآوری خون، کاهش لکوسیتها است که قبل از ذخیرهسازی در سازمانهای انتقال خون در بسیاری از کشورها انجام میشود (10). بر اساس آمار سازمان انتقال خون ایران، سالیانه تعداد زیادی کیسههای خون فیلتردار مصرف میشود و این فیلترها پس از استفاده به عنوان ضایعات دور ریخته میشوند، در حالی که منبع بسیار غنی از سلولهای خون محیطی و هم چنین آنزیمها میباشند و میتواند در مطالعههای پایه و سپس بالینی مورد استفاده قرار گیرد (11).
هدف اصلی این مطالعه، استخراج پپتید ضد میکروبی دیفنسین از فیلترهای کاهنده لکوسیتی و تعیین میزان حداقل غلظت بازدارندگی MIC (Minimum Inhibitory Concentration) پپتید دیفنسین استخراج شده از نوتروفیلهای به دام افتاده در فیلترهای کاهنده لکوسیتی برای مقابله با میکروبهای مقاوم به آنتیبیوتیکهای رایج و بر روی باکتری استافیلوکوکوس اورئوس بوده است.
مواد و روشها
فیلترهای کاهنده لکوسیتی:
در این مطالعه تجربی از فیلترهای کاهنده لکوسیتی به عنوان جامعه مورد مطالعه و با روش نمونهگیری غیر احتمالی آسان و با ابزار چک لیست و مقایسه استفاده شد. بدین منظور فیلترهای Leucoflex LCR5 متصل به کیسههای چهارتایی شرکت ماکوفارمای فرانسه، برای جداسازی ابتدایی لکوسیتها و سپس جداسازی اختصاصی نوتروفیلها و سپس استخراج دیفنسین مورد استفاده قرار گرفت (شکل 1). در فرآیند موجود در پایگاههای انتقال خون، در حدود 450 میلیلیتر از خون کامل اهداکنندگان از این فیلترها عبور داده و خون بدون گلبولهای سفید در کیسههای جمعکننده خون که متصل به سمت دیگر این فیلترها هستند جمعآوری میشود.
سیستم بافری شستشوی فیلتر:
فیلترها روزانه از پایگاه انتقال خون تهران تهیه و شستشوی فیلتر به روش شستشوی معکوس یعنی در خلاف جهت ورودی فیلتر (Back Flush) به روش دستی صورت گرفت. برای شستشوی دستی، میزان 150 میلیلیتر بافر توسط سرنگ 60 میلیلیتری با فشار پیستون و از جهت مخالف ورودی وارد فیلتر شد و باقیمانده بافر در فیلتر با استفاده از سرنگ پر شده از هوا تخلیه گردید. سپس برای انجام سریعتر شستشوی فیلترها از یک سیستم مکانیکی طراحی و ست آپ شده استفاده شد (شکل 2).
بدین ترتیب فیلترها در دمای اتاق با بافر PBS در 2/7 pH حاوی 2 میلیمولار EDTA و 4% دکستران 40 شستشو داده شد. شمارش سلولی با دستگاه اتوهموآنالیزور سیسمکس انجام گرفت و درصد و تعداد سلولهای لکوسیتی (نوتروفیل، لنفوسیت، مونوسیت، بازوفیل و ائوزینوفیل) اندازهگیری و سپس زندهمانی لکوسیتهای بازیابی شده 5/85% گزارش شد (12).

جداسازی نوتروفیلها از سایر سلولها:
از سانتریفیوژ شیب چگالی و دکستران برای جداسازی گرانولوسیتها استفاده گردید (13). به طور خلاصه 150 میلیلیتر از محلول به دست آمده از شستشوی فیلتر برای جداسازی نوتروفیلها استفاده شد. برای حذف سلولهای دیگر شامل منوسیتها و لنفوسیتها از هیستوپک (آلمان، سیگما 1077 Histopaque®) و سانتریفیوژ گرادیانت به نسبت 5 میلیلیتر خون و 2 میلیلیتر هسیتوپک استفاده شد. به آرامی به صورتی که خون با هیستوپک مخلوط نشود، توسط پیپت پاستور خون روی هیستوپک ریخته و در دور g × 800 مدت 20 دقیقه سانتریفیوژ گردید، 4 لایه شامل پلاسما، سلولهای تک هسته، لایه محتوی هیستوپک و در نهایت لایه گرانولوسیتها به همراه سلولهای قرمز خون ایجاد گردید. در ادامه سه لایه فوق دور ریخته شد و لایه گرانولوسیتی به همراه لایه گلبولهای قرمز توسط محلول هنکس (HBSSHanks' Balanced Salt Solution) شرکت گیبکو به نسبت 1 به 1 رقیق شد. برای حذف گلبولهای قرمز از روش رسوبدهی با دکستران High Fractionation استفاده شد، برای این کار خون به نسبت 1 به 1 در فالکونهای mL 50 با دکستران 6% (45000-35000 ، سیگما)، دارای 9/0% NaCl مخلوط و به مدت 1 ســاعت در دمای آزمایشــگاه قرار داده شد تا گلبولهای قرمز کاملاً تهنشین شود. فاز شفاف بالایی شامل نوتروفیلها، با پیپت پاستور جمعآوری گردید. رســوبدهی با دکســتران همــه گلبولهای قرمز را حــذف نمیکند، بنابراین به منظور حذف باقیمانده از محلول لیز گلبولهای قرمز استفاده گردید. بعد از جداسازی نوتروفیلها، زندهمانی آنها با استفاده از تریپان بلو 4/0% در زیر میکروسکوپ نوری بررسی شد.
استخراج پپتید دیفنسین از نوتروفیلها:
بعد از جداسازی نوتروفیلها و شستشوی آنها با PBS ، لیز سلولی با محلول 34/0 مولار سوکروز در 4/7 pH ، انجام گرفت. در مرحله بعد خرد کردن نوتروفیلها به کمک ســونیکاتور در حضور یخ، ســه بار و هر بار به مدت 30 ثانیه انجام شد. بعد از اتمام سونیکاسیون به منظور حذف قطعات یاختهای به مدت 15 دقیقه در 4 درجه با دور g ×200 سانتریفیوژ و عصاره سیتوزولی برداشته و رسوبات قطعات یاختهای دور ریخته شد. مایع رویی دوبار به مدت 30 دقیقه در دور g ×500 در دمای 4 درجه سانتریفیوژ گردید، پلت حاوی گرانولهای نوتروفیلی در سوکروز 34/0 مولار حل گردید و برای ادامه مراحل مورد استفاده قرار گرفت (14).
خالصسازی پپتید دیفنسین با دستگاه HPLC :
برای خالصسازی پپتید دیفنسین از دستگاه HPLC مدل شیماتزو با ستون TSK G3000PW به اندازه 5/7 میلیمتر در 60 سانتیمتر متصل به گارد ستون (TSKgel guardcolumn PWH) 5/7 میلیمتر در 5/7 سانتیمتر استفاده گردید. برای آمادهسازی و متعادلسازی دستگاه، سرعت جریان دستگاه روی mL/min 5/0 تنظیم و دستگاه به مدت 30 دقیقه با متانل 70 درصد و سپس نیم ساعت با آب مقطر شستشو داده شد. پمپها به مدت 3 دقیقه تخلیه (Purge) شدند. برنامه ران کاری بر اساس استفاده از یک پمپ با سرعت 7/0 میلیلیتر در دقیقه با حلال اصلی استونیتریل 34/0 درصد دارای TFA 1/0 درصد بدون شیب غلظت تنظیم و خوانش در طول موج 220 نانومتر انجام شد. پس از رسیدن به خط زمینه (Baseline)، محلول استاندارد پپتید دیفنسین بارگیری شد و در نهایت محل پیک نمونه مورد آزمایش تعیین گردید. سپس نمونه مورد نظر فیلتر شد و مجددا مراحل تکرار گردید و پیک مربوط به دیفنسین جمعآوری شد (15).
تهیه و کشت باکتری:
باکتری استافیلوکوکوس اورئوس ATCC 33591 از مرکز ذخایر ملی ژنتیک خریداری گردید. سوسپانسیون میکروبی در محیط کشت مایع مولر هینتون براث (مرک، آلمان) تهیه شد. برای این کار یک لوپ از میکروب در 5 میلیلیتر محلول محیط کشت فوق تلقیح و به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت. پس ازکشت اول، کشـت مجـدد تهیـه و در همـان شرایط نگهداری شد.
تهیه میزان تلقیح باکتری:
از سوسپانسیون میکروبی تهیه شده مقادیر مختلفی برداشته و در طول موج 600 نانومتر خوانده شد تا جذب نوری 05/0 تا 1/0 به دست آید و سپس از آن رقت سریال تهیه گردید. از هر رقت به پلیتهای حاوی BHIآگار اضافه و کشت داده شد. پلیتها به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت و سپس تعداد باکتریها شمارش شد و از این طریق تعداد باکتریها در کووت حاوی سوسپانسیون باکتری با جذب نوری معادل 1/0 محاسبه شد. میانگین تعداد باکتریها در کووت با جذب نوری 1/0 معادل با محلول 5/0 مک فارلند برابر با CFU/mL 108 × 5/1محاسبه شد. با مشخص شدن این عدد هرگاه که سوسپانسیون باکتریایی با جذب نوری 1/0 تهیه شود، تعداد باکتری در آن معادل عدد محاسبه شده و میتوان از این سوسپانسیون غلظتهای دلخواه را تهیه نمود.
بررسی خاصیت ضد باکتری پپتید دیفنسین:
تعیین حداقل غلظت بازدارندگی(MIC) رشد:
حداقل غلظت مهارکنندگی پپتید تخلیص شده به روش ماکرودایلوشن سنجیده شد (16). به طور خلاصه، ابتدا رقت سریال پپتید در مبنای 2 به صورت، رقتهای 1 به 1 تا 1 به 32 پپتید دیفنسین محلول در محیط کشت آبگوشت مولر هینتون و پلیت 96 خانهای تهیه گردید. در واقع برای پپتید مورد نظر، غلظتهای 20 تا 625/0 میکروگرم در میلیلیتر در نظر گرفته شد. در مرحله بعد، تراکم ثابتی از باکتری معادل نیم مک فارلند یا CFU/mL 108×5/1 به همه چاهکهای میکروپلیت افزوده شد. سپس پلیت به مدت 2، 4، 8 و 24 ساعت در دمای 37 درجه سانتیگراد و شرایط هوازی انکوبه گردید.
بررسی قطر هاله عدم رشد:
به کمک این آزمون، قطر هاله عدم رشد پپتید تخلیص شده برای باکتری مورد نظر تعیین گردید. برای این کار ابتدا 10 میلیلیتر محیط کشت مولر هینتون آگار (مرک، آلمان) با کشت 24 ساعته باکتری استافیلوکوکوس اورئوس با تراکم نیم مک فارلند مخلوط و در یک پلیت استریل10 سانتیمتری ریخته شد. سپس با یک سواپ استریل به صورت چمنی باکتری مذکور کشت داده شد. در ادامه یک دیسک استریل آغشته به پپتید تخلیص شده در مرکز محیط کشت قرار داده شد و سپس پلیت با همان شرایط ذکر شده انکوبه گردید.
یافتهها
نتایج خالصسازی پپتید دیفنسین به روش HPLC :
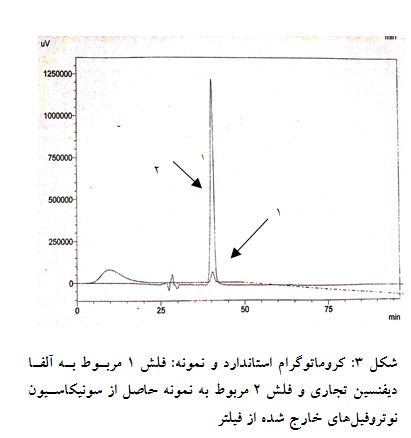
فرکشن شماره 2 در شکل 3 حاوی پیک به دست آمده از تزریق پپتید و فراکشن شماره 1 حاوی پیک استاندارد دیفنسین میباشد. در مقایسه با کروماتوگرام استاندارد، دیفنسین تخلیص شده غلظت 250 برابر غلظت استاندارد را نشان میدهد (غلظت نمونه استاندارد ppm 200 میباشد) و همپوشانی دقیقی با نمونه استاندارد دارد
و با سرعت ورودی فاز متحرک به میزان 7/0 میلیلیتر در دقیقه، و بعد از 40 دقیقه از دستگاه خارج شد.
نتایج بررسی خاصیت ضد باکتری پپتید دیفنسین:
حداقـل غلظت بازدارندگی رشد پپتید دیفنسین به میزان
5/2 میکروگرم بر میلیلیتر برای باکتری اســتافیلوکوکوس اورئـوس بـه روش مـاکرودایلوشن تعیین شد . بررسیهای
باکتریکشــی نشان داد که این پپتید ســبب مهار رشد باکتری مذکور میشود.
نتایج بررسی قطر هاله عدم رشد:
پس از گذشت 24 ساعت، پلیت زیر نور چراغ بررسی گردید و قطر منطقه مهار رشد برای باکتری استافیلوکوکوس اورئوس برابر با 9 میلیمتر با استفاده از خطکش اندازهگیری گردید.
بحث
در این مطالعه از فیلترهای کاهنده لکوسیتی Leucoflex LCR5 استفاده شد، سپس لکوسیتها از فیلترهای کاهنده لکوسیتی توسط جریان معکوس بازیافت شد و جداسازی گرانولوسیتها از سایر سلولها بر مبنای سانتریفیوژ شیب چگالی و رسوب دکستران صورت گرفت. از روش سونیکاسیون برای شکستن گرانولهای نوتروفیلی و آزادسازی دیفنسین و از روش کروماتوگرافی طرد مولکولی برای تخلیص دیفنسین استفاده شد. بررسی فعالیت ضد میکروبی دیفنسین بر روی گونه مقاوم استافیلوکوکوس اورئوس نشاندهنده اثربخشی بر روی گونه مقاوم به آنتیبیوتیکهای رایج بود.
اگر چه در طول قرن گذشته، کشف طیف گستردهای از آنتیبیوتیکها و واکسنها، عوارض مرگ و میر ناشی از عفونتهای میکروبی را کاهش داد، اما امروزه مقاومتهای آنتی بیوتیکی ناشی از استفاده بیش از حد و نامناسب آنتیبیوتیکها، دنیا را با چالشهای جدیدی مواجه کرده است. به همین دلیل نیاز به دستیابی به نوآوریهایی در کنترل عفونتهای میکروبی وجود دارد و استفاده از پپتیدهای ضد میکروبی به عنوان جایگزینی بالقوه و با ارزش اهمیت ویژهای پیدا کرده است (18، 17).
این پپتیدهای ضد میکروبی که از اجزای مهم دفاع طبیعی بدن علیه عوامل بیماریزا هستند، توسط گرانولوسیتها، ماکروفاژها و سلولهای اپیتلیال در انسان تولید میشوند و از آن جایی که بیش از 60 درصد گلبولهای سفید خون را نوتروفیلها تشکیل میدهند، میتوانند به عنوان منبع غنی از این پپتیدها مورد استفاده قرار گیرند (8، 6).
از طرف دیگر برخی عوارض جانبی بالقوه در انتقال خون ناشی از اجزای لکوسیتی اهداکننده میباشد و به همین دلیل کاهش لکوسیتها به عنوان یکی از عملکردهای بهینه در مراحل فرآیندهای خون در انتقال خونهای سراسر دنیا قرار گرفته است (19). فیلترهای کاهنده لکوسیتی متعددی در سازمان انتقال خون ایران برای کاهش لکوسیت در فرآوردههای خونی استفاده میشود که از دسته فیلترهای پیشذخیره هستند. در این مطالعه فیلترهای Leucoflex LCR5 متصل به کیسههای چهارتایی شرکت ماکوفارمای فرانسه، برای جداسازی ابتدایی لکوسیتها و سپس جداسازی اختصاصی نوتروفیلها و استخراج دیفنسین مورد استفاده قرار گرفت. فیلترهای LCR5 دارای 27 لایه مشتمل بر 5 لایه 30 میکرومتری و 22 لایه 9 میکرومتری میباشد. 5 لایه ابتدایی جهت جداسازی لختهها بوده و از جنس پلی اتیلن ترفتالات میباشند. لایههای 9 میکرومتری از جنس پلیپروپیلن بوده و در سه سطح مکانیسمی به ترتیب به روشهای جداسازی براساس اندازه، جداسازی تمایلی و جداسازی سلولی (به دام انداختن سلولها) عمل میکنند (20). این فیلترهای کاهنده لکوسیتی پس از استفاده به عنوان ضایعات تلقی شده و دور ریخته میشوند. در حالی که این فیلترها منبع بسیار غنی از سلولهای خون محیطی میباشند که به راحتی میتوان از این منبع ارزشمند در مطالعات پایه و یا بالینی استفاده نمود و راهی برای استفاده از این سرمایه ملی ارزشمند در درمان گشود(11).
روش رایج کنونی برای بازیابی لکوسیتها از فیلترهای کاهنده لکوسیتی، جریان معکوس است که شامل عبور جریان مایع در جهت معکوس جریان اصلی فیلترها میباشد. لانگلی و همکاران، بافر سالین فسفات (PBS) را از جریان معکوس عبور دادند (21). در سالهای بعد کولیگان و همکاران، پس از جریان معکوس و برای تخلیص بیشتر از سانتریفیوژ شیب فایکول هایپک استفاده کردند و سلولهای لکوسیتی حاصل را با PBS شستشو دادند (11). در سال 2017 وگهاوپت و همکاران نیز از جریان معکوس شستشو برای استحصال لکوسیتهای به دام افتاده در فیلتر استفاده کردند (22). در مطالعه حاضر از سیستم جریان معکوس و از بافر شستشوی PBSدر pH برابر با 2/7 ، حاوی 2 میلی مولار EDTA و 4 درصد دکستران40% استفاده گردید. همچنین برای جلوگیری از دستکاری کمتر در شستشوی فیلتر، یک سیستم مکانیکی با حجم و فشار تعیین شده شامل یک اتصال سه طرفه قابل تنظیم، یک پمپ پریستالتیک و یک دمنده هوا، با سرعت و تکرارپذیری بالا طراحی و استفاده شد. همچنین برای جداسازی گرانولوسیتها از سایر سلولها، از روش مقبل و همکاران بر مبنای سانتریفیوژ شیب چگالی و رسوب دکستران تحت شرایط دمایی و pH تعریف شده و با انجام تغییراتی در روش استفاده شد (13).
در یک مطالعه در سال 2014، برای تحریک ترشح دیفنسین از سیتوکالازین b (Cytochalasin B) و N- formylmethionyl-leucyl-phenylalanine استفاده شد (23). در مطالعه حاضر به دلیل استفاده از فیلترهای کاهنده لکوسیتی که گرانولوسیتهای حاصل از حدود 450 میلیلیتر خون میباشد و به دلیل میزان فراوان لکوسیت در دسترس، نیاز به این غنی سازی نبود. برای شکستن گرانولهای نوتروفیلی و آزادسازی دیفنسین از روش سونیکاسیون استفاده شد و برای تخلیص دیفنسین از کروماتوگرافی طرد مولکولی (Size Exclusion Chromatography) استفاده شد، همچنان که در مطالعههای بسیاری از روشهای متفاوتی نظیر کروماتوگرافی تعویض یونی و کروماتوگرافی فاز معکوس و کروماتوگرافی طرد مولکولـی بـرای تخلیـص پپتیدهای ضد میکروبی استفـاده
شده است (26-24).
دیفنسینها به طور همزمان دارای فعالیت ضد میکروبی و ضد سرطانی هستند و در حال حاضر تحقیقات بسیاری بر روی این اثرات متمرکز شده است (27). اغلب پپتیدهای ضد میکروبی ضد باکتری، کاتیونیک هستند که غشا سلول باکتری را هدف قرار داده و موجب تجزیه ساختار لیپید دولایه میگردد. در حالی که برخی از پپتیدهای ضد میکروبی قادر به مهار واکنشهای درون سلولی نیز میباشند (7). در این مطالعه اثر پپتید دیفنسین استخراج شده از نوتروفیلهای حاصل از فیلترهای کاهنده لکوسیتی،
بر روی گونه مقاوم استافیلوکوکوس اورئوس، نشاندهنده اثربخشی بر روی گونه مقاوم به آنتیبیوتیکهای رایج بود و این پپتید در غلظت 5/2 میکروگرم بر میلیلیتر،که غلظت مناسبی برای خاصیت باکتریکشی محسوب میشود، قادر به مهار رشد باکتری شد. در این مطالعه حداقل غلظت مهاری (MIC) پپتید دیفنسین با مطالعه وُسیر و همکاران در سال 2014 مطابقت نشان داد (23).
نتیجهگیری
در این مطالعه از دیفنسین به عنوان پپتید ضدمیکروبی و برای بررسی تعیین حداقل غلظت مهار رشد باکتری استافیلوکوک اورئوس استفاده گردید و نشان داده شد که با توجه به ظهور گسترده مقاومتهای دارویی میتواند به عنوان یک گزینه مناسب و در دسترس و با پتانسیل جایگزینی برای آنتیبیوتیکها مد نظر قرار گیرد. با وجود مطالعههای بسیاری که بر روی فعالیت ضد باکتریایی دیفنسین انجام گرفته است، تاکنون خاصیت باکتریکشی پپتید دیفنسین بازیابی شده از فیلترهای کاهنده لکوسیتی گزارش نگردیده بود. از طرفی یکی از منابع در دسترس سلولهای خونی، فیلترهای کاهنده لکوسیتی میباشد که به دلیل سهلالوصول بودن، مورد توجه بسیاری از مراکز تحقیقاتی انتقال خون قرار گرفته است. قابلیتهای فوقالعاده گلبولهای سفید از جمله تولید پپتیدهای ضد میکروبی و کموکاینهای مختلف، سبب شده است مطالعهها در زمینه بازیابی حداکثری گلبولهای سفید به دام افتاده در این فیلترها در مراکز تحقیقاتی انتقال خون صورت پذیرد. مطالعهها در مورد بازیابی سلولهای حاصل از فیلترهای کاهنده لکوسیتی و نقش پپتیدهای ضد میکروبی و سایر مدیاتورهای حاصل از این سلولها میتواند ابزار قدرتمندی در تحقیقات سلول درمانی و مطالعههای برهمکنش سلولی باشد و در پیشرفتهای مولکولی جدید در کشف دارو اهمیت داشته باشد.
حمایت مالی
این پروژه تحقیقاتی توسط مؤسسه ملی توسعه تحقیقـات علـوم پـزشکی ایران و مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین مالی شده است.
ملاحظات اخلاقی
این پروژه از مؤسسه ملی توسعه تحقیقات علوم پزشکی ایران دارای کد اخلاق IR.NIMAD.REC.1396.294 و از مؤسسه عالی آموزشی و پژوهشی طب انتقال خون دارای کد اخلاق IR.TMI.REC.1396.019 میباشد.
عدم تعارض منافع
نویسندگان اظهار کردند در انتشار این اثر منافع تجاری نداشتند و در مقابل ارائه اثر وجهی دریافت نکردهاند.
تشکر و قدردانی
بدینوسیله از مؤسسه ملی توسعه تحقیقات علوم پزشکی ایران و مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تشکر میشود.
متن کامل: (723 مشاهده)
استخراج پپتید دیفنسین از فیلترهای لکوسیتی و تعیین میزان حداقل غلظت
بازدارندگی رشد بر استافیلوکوکوس اورئوس
نیلوفر ساسانی1، رسول روغنیان2، گیتی امتیازی2، سید مهرداد جلالی3، افسانه آقایی4
چکیده
سابقه و هدف
شناسایی و کشف آنتیبیوتیکها از دستاوردهای مهم بشر در زمینه بیماریهای عفونی بوده است، اگر چه پس از زمان کوتاهی، پدیده مقاومت آنتیبیوتیکی ایجاد شد. امروزه نیاز به نوآوری در کنترل عفونتهای میکروبی نظیر استفاده از پپتیدهای ضد میکروبی وجود دارد. این پپتیدها در نوتروفیلها به وفور یافت میشوند و از آن جایی که فیلترهای کاهنده لکوسیتی منبع ارزشمندی از این سلولها میباشد، به عنوان یک گزینه در دسترس مورد مطالعه قرار گرفته است.
مواد و روشها
در یک مطالعه تجربی جامعه مورد مطالعه فیلترهای کاهنده لکوسیتی بودند که با روش نمونهگیری غیر احتمالی آسان انتخاب شدند. ابتدا لکوسیتها استخراج و سپس نوتروفیلها جداسازی شد. پپتید دیفنسین پس از سونیکاسیون نوتروفیلها استخراج شد و خالصسازی پپتید با دستگاه HPLC صورت گرفت. باکتری استافیلوکوکوس اورئوس کشت و میزان تلقیح باکتری تعیین و حداقل غلظت بازدارندگی رشد به روش ماکرودایلوشن سنجیده شد. سپس قطر هاله عدم رشد پپتید دیفنسین برای باکتری مورد نظر تعیین گردید.
یافتهها
با استفاده از استاندارد دیفنسین، پیک دیفنسین خالص جمعآوری گردید و حداقل غلظت بازدارندگی رشد به میزان 5/2 میکروگرم بر میلیلیتر برای باکتری استافیلوکوکوس اورئوس به روش ماکرودایلوشن تعیین شد. منطقه مهار رشد در بررسی قطر هاله عدم رشد برابر با 9 میلیمتر محاسبه گردید.
نتیجه گیری
درمان بیماریهای عفونی با ظهور گسترده مقاومتهای دارویی با چالش مواجه و استفاده از نوآوریهای جدید اجتنابناپذیر شده است. دیفنسین به عنوان پپتید ضدمیکروبی گزینه مناسبی است که در نوتروفیلهای حاصل از فیلترهای کاهنده لکوسیتی به وفور یافت میشود و برای تحقیقات در خصوص داروهای جدید ضدمیکروبی پیشنهاد میگردد.
کلمات کلیدی: دیفنسین، حداقل غلظت بازدارندگی، استافیلوکوک اورئوس
تاریخ دریافت: 24/11/1401
تاریخ پذیرش : 10/12/1401
1- دانشجوی دکترای میکروبیولوژِی ـ دانشکده علوم دانشگاه اصفهان ـ اصفهان ـ ایران
2- دکترای میکروبیولوژی ـ استاد دانشکده علوم دانشگاه اصفهان ـ اصفهان ـ ایران
3- دکترای داروسازی ـ شرکت پالایش و پژوهش خون ـ تهران ـ ایران
4- مؤلف مسئول: PhD ایمنیشناسی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
بازدارندگی رشد بر استافیلوکوکوس اورئوس
نیلوفر ساسانی1، رسول روغنیان2، گیتی امتیازی2، سید مهرداد جلالی3، افسانه آقایی4
چکیده
سابقه و هدف
شناسایی و کشف آنتیبیوتیکها از دستاوردهای مهم بشر در زمینه بیماریهای عفونی بوده است، اگر چه پس از زمان کوتاهی، پدیده مقاومت آنتیبیوتیکی ایجاد شد. امروزه نیاز به نوآوری در کنترل عفونتهای میکروبی نظیر استفاده از پپتیدهای ضد میکروبی وجود دارد. این پپتیدها در نوتروفیلها به وفور یافت میشوند و از آن جایی که فیلترهای کاهنده لکوسیتی منبع ارزشمندی از این سلولها میباشد، به عنوان یک گزینه در دسترس مورد مطالعه قرار گرفته است.
مواد و روشها
در یک مطالعه تجربی جامعه مورد مطالعه فیلترهای کاهنده لکوسیتی بودند که با روش نمونهگیری غیر احتمالی آسان انتخاب شدند. ابتدا لکوسیتها استخراج و سپس نوتروفیلها جداسازی شد. پپتید دیفنسین پس از سونیکاسیون نوتروفیلها استخراج شد و خالصسازی پپتید با دستگاه HPLC صورت گرفت. باکتری استافیلوکوکوس اورئوس کشت و میزان تلقیح باکتری تعیین و حداقل غلظت بازدارندگی رشد به روش ماکرودایلوشن سنجیده شد. سپس قطر هاله عدم رشد پپتید دیفنسین برای باکتری مورد نظر تعیین گردید.
یافتهها
با استفاده از استاندارد دیفنسین، پیک دیفنسین خالص جمعآوری گردید و حداقل غلظت بازدارندگی رشد به میزان 5/2 میکروگرم بر میلیلیتر برای باکتری استافیلوکوکوس اورئوس به روش ماکرودایلوشن تعیین شد. منطقه مهار رشد در بررسی قطر هاله عدم رشد برابر با 9 میلیمتر محاسبه گردید.
نتیجه گیری
درمان بیماریهای عفونی با ظهور گسترده مقاومتهای دارویی با چالش مواجه و استفاده از نوآوریهای جدید اجتنابناپذیر شده است. دیفنسین به عنوان پپتید ضدمیکروبی گزینه مناسبی است که در نوتروفیلهای حاصل از فیلترهای کاهنده لکوسیتی به وفور یافت میشود و برای تحقیقات در خصوص داروهای جدید ضدمیکروبی پیشنهاد میگردد.
کلمات کلیدی: دیفنسین، حداقل غلظت بازدارندگی، استافیلوکوک اورئوس
تاریخ دریافت: 24/11/1401
تاریخ پذیرش : 10/12/1401
1- دانشجوی دکترای میکروبیولوژِی ـ دانشکده علوم دانشگاه اصفهان ـ اصفهان ـ ایران
2- دکترای میکروبیولوژی ـ استاد دانشکده علوم دانشگاه اصفهان ـ اصفهان ـ ایران
3- دکترای داروسازی ـ شرکت پالایش و پژوهش خون ـ تهران ـ ایران
4- مؤلف مسئول: PhD ایمنیشناسی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
در آغاز قرن بیستم، مرگ و میر ناشی از بیماریهای عفونی با کشف عوامل ضد میکروبی و ساخت آنتیبیوتیکها و واکسنها، به عنوان مهمترین دستاوردهای بشر در زمینه پزشکی کاهش یافت (1). اولین آنتیبیوتیک توسط فلمینگ در سال 1928 و در پلیت حاوی استافیلوکوکوس اورئوس شناسایی و سرآغاز کشف پنیسیلین شد که همراه با سایر آنتیبیوتیکها منجر به نجات جان میلیونها انسان و حیوان گردید. اما پس از مدت زمان کوتاهی، مقاومتهای آنتیبیوتیکی به دلایل استفاده نامناسب از آنتیبیوتیکها در پزشکی و دامپزشکی پدیدار گشت (2). بر این اساس، در معرض قرار گرفتن طولانی مدت و مداوم میکروارگانیسمها در برابر آنتیبیوتیکها، خطر مقاومت آنها را به آنتی بیوتیکها افزایش داده است (3).
امروزه در کنترل عفونتهای میکروبی نیاز به نوآوریهایی نظیر استفاده از پپتیدهای ضد میکروبی (AMPs, Anti Microbial Peptides) میباشد. پپتیدهای ضد میکروبی؛ بیومولکولهای حفاظت شده در تمام پروکاریوتها و یوکاریوتها هستند و اولین خط دفاع ایمنی ذاتی در برابر ویروسها، باکتریها، قارچها و انگلها میباشند (6-4). کشف AMPs یا دفاع کاتیونی به سال 1939 باز میگردد (7). این AMPs از اجزای مهم دفاع طبیعی بدن علیه عوامل بیماریزا هستند و توسط گرانولوسیتها، ماکروفاژها و سلولهای اپیتلیال در انسان تولید میشوند. پپتیدهای ضد میکروبی، به عنوان آنتیبیوتیکهای جدید در مقابله با باکتریهای مقاوم به آنتیبیوتیک در درمانهای بالینی به صورت آزمایشی استفاده شده است (4). نوتروفیلها، گرانولوسیتهای با توانایی تولید AMPs میباشند و از آن جایی که بیش از 60 درصد گلبولهای سفید خون را نوتروفیلها تشکیل میدهند، میتوانند به عنوان منبع غنی از این پپتیدها مورد استفاده قرار گیرند (8).
از طرف دیگر واکنشهای ناخواسته انتقال خون به واسطه حضور گلبولهای سفید بروز مینماید و جداسازی لکوسیتها، با هدف کم نمودن عوارض انتقال خون ضروری میباشد (9). یکی از عملکردهای معمول در مراحل فرآوری خون، کاهش لکوسیتها است که قبل از ذخیرهسازی در سازمانهای انتقال خون در بسیاری از کشورها انجام میشود (10). بر اساس آمار سازمان انتقال خون ایران، سالیانه تعداد زیادی کیسههای خون فیلتردار مصرف میشود و این فیلترها پس از استفاده به عنوان ضایعات دور ریخته میشوند، در حالی که منبع بسیار غنی از سلولهای خون محیطی و هم چنین آنزیمها میباشند و میتواند در مطالعههای پایه و سپس بالینی مورد استفاده قرار گیرد (11).
هدف اصلی این مطالعه، استخراج پپتید ضد میکروبی دیفنسین از فیلترهای کاهنده لکوسیتی و تعیین میزان حداقل غلظت بازدارندگی MIC (Minimum Inhibitory Concentration) پپتید دیفنسین استخراج شده از نوتروفیلهای به دام افتاده در فیلترهای کاهنده لکوسیتی برای مقابله با میکروبهای مقاوم به آنتیبیوتیکهای رایج و بر روی باکتری استافیلوکوکوس اورئوس بوده است.
مواد و روشها
فیلترهای کاهنده لکوسیتی:
در این مطالعه تجربی از فیلترهای کاهنده لکوسیتی به عنوان جامعه مورد مطالعه و با روش نمونهگیری غیر احتمالی آسان و با ابزار چک لیست و مقایسه استفاده شد. بدین منظور فیلترهای Leucoflex LCR5 متصل به کیسههای چهارتایی شرکت ماکوفارمای فرانسه، برای جداسازی ابتدایی لکوسیتها و سپس جداسازی اختصاصی نوتروفیلها و سپس استخراج دیفنسین مورد استفاده قرار گرفت (شکل 1). در فرآیند موجود در پایگاههای انتقال خون، در حدود 450 میلیلیتر از خون کامل اهداکنندگان از این فیلترها عبور داده و خون بدون گلبولهای سفید در کیسههای جمعکننده خون که متصل به سمت دیگر این فیلترها هستند جمعآوری میشود.
سیستم بافری شستشوی فیلتر:
فیلترها روزانه از پایگاه انتقال خون تهران تهیه و شستشوی فیلتر به روش شستشوی معکوس یعنی در خلاف جهت ورودی فیلتر (Back Flush) به روش دستی صورت گرفت. برای شستشوی دستی، میزان 150 میلیلیتر بافر توسط سرنگ 60 میلیلیتری با فشار پیستون و از جهت مخالف ورودی وارد فیلتر شد و باقیمانده بافر در فیلتر با استفاده از سرنگ پر شده از هوا تخلیه گردید. سپس برای انجام سریعتر شستشوی فیلترها از یک سیستم مکانیکی طراحی و ست آپ شده استفاده شد (شکل 2).
بدین ترتیب فیلترها در دمای اتاق با بافر PBS در 2/7 pH حاوی 2 میلیمولار EDTA و 4% دکستران 40 شستشو داده شد. شمارش سلولی با دستگاه اتوهموآنالیزور سیسمکس انجام گرفت و درصد و تعداد سلولهای لکوسیتی (نوتروفیل، لنفوسیت، مونوسیت، بازوفیل و ائوزینوفیل) اندازهگیری و سپس زندهمانی لکوسیتهای بازیابی شده 5/85% گزارش شد (12).

جداسازی نوتروفیلها از سایر سلولها:
از سانتریفیوژ شیب چگالی و دکستران برای جداسازی گرانولوسیتها استفاده گردید (13). به طور خلاصه 150 میلیلیتر از محلول به دست آمده از شستشوی فیلتر برای جداسازی نوتروفیلها استفاده شد. برای حذف سلولهای دیگر شامل منوسیتها و لنفوسیتها از هیستوپک (آلمان، سیگما 1077 Histopaque®) و سانتریفیوژ گرادیانت به نسبت 5 میلیلیتر خون و 2 میلیلیتر هسیتوپک استفاده شد. به آرامی به صورتی که خون با هیستوپک مخلوط نشود، توسط پیپت پاستور خون روی هیستوپک ریخته و در دور g × 800 مدت 20 دقیقه سانتریفیوژ گردید، 4 لایه شامل پلاسما، سلولهای تک هسته، لایه محتوی هیستوپک و در نهایت لایه گرانولوسیتها به همراه سلولهای قرمز خون ایجاد گردید. در ادامه سه لایه فوق دور ریخته شد و لایه گرانولوسیتی به همراه لایه گلبولهای قرمز توسط محلول هنکس (HBSSHanks' Balanced Salt Solution) شرکت گیبکو به نسبت 1 به 1 رقیق شد. برای حذف گلبولهای قرمز از روش رسوبدهی با دکستران High Fractionation استفاده شد، برای این کار خون به نسبت 1 به 1 در فالکونهای mL 50 با دکستران 6% (45000-35000 ، سیگما)، دارای 9/0% NaCl مخلوط و به مدت 1 ســاعت در دمای آزمایشــگاه قرار داده شد تا گلبولهای قرمز کاملاً تهنشین شود. فاز شفاف بالایی شامل نوتروفیلها، با پیپت پاستور جمعآوری گردید. رســوبدهی با دکســتران همــه گلبولهای قرمز را حــذف نمیکند، بنابراین به منظور حذف باقیمانده از محلول لیز گلبولهای قرمز استفاده گردید. بعد از جداسازی نوتروفیلها، زندهمانی آنها با استفاده از تریپان بلو 4/0% در زیر میکروسکوپ نوری بررسی شد.
استخراج پپتید دیفنسین از نوتروفیلها:
بعد از جداسازی نوتروفیلها و شستشوی آنها با PBS ، لیز سلولی با محلول 34/0 مولار سوکروز در 4/7 pH ، انجام گرفت. در مرحله بعد خرد کردن نوتروفیلها به کمک ســونیکاتور در حضور یخ، ســه بار و هر بار به مدت 30 ثانیه انجام شد. بعد از اتمام سونیکاسیون به منظور حذف قطعات یاختهای به مدت 15 دقیقه در 4 درجه با دور g ×200 سانتریفیوژ و عصاره سیتوزولی برداشته و رسوبات قطعات یاختهای دور ریخته شد. مایع رویی دوبار به مدت 30 دقیقه در دور g ×500 در دمای 4 درجه سانتریفیوژ گردید، پلت حاوی گرانولهای نوتروفیلی در سوکروز 34/0 مولار حل گردید و برای ادامه مراحل مورد استفاده قرار گرفت (14).
خالصسازی پپتید دیفنسین با دستگاه HPLC :
برای خالصسازی پپتید دیفنسین از دستگاه HPLC مدل شیماتزو با ستون TSK G3000PW به اندازه 5/7 میلیمتر در 60 سانتیمتر متصل به گارد ستون (TSKgel guardcolumn PWH) 5/7 میلیمتر در 5/7 سانتیمتر استفاده گردید. برای آمادهسازی و متعادلسازی دستگاه، سرعت جریان دستگاه روی mL/min 5/0 تنظیم و دستگاه به مدت 30 دقیقه با متانل 70 درصد و سپس نیم ساعت با آب مقطر شستشو داده شد. پمپها به مدت 3 دقیقه تخلیه (Purge) شدند. برنامه ران کاری بر اساس استفاده از یک پمپ با سرعت 7/0 میلیلیتر در دقیقه با حلال اصلی استونیتریل 34/0 درصد دارای TFA 1/0 درصد بدون شیب غلظت تنظیم و خوانش در طول موج 220 نانومتر انجام شد. پس از رسیدن به خط زمینه (Baseline)، محلول استاندارد پپتید دیفنسین بارگیری شد و در نهایت محل پیک نمونه مورد آزمایش تعیین گردید. سپس نمونه مورد نظر فیلتر شد و مجددا مراحل تکرار گردید و پیک مربوط به دیفنسین جمعآوری شد (15).
تهیه و کشت باکتری:
باکتری استافیلوکوکوس اورئوس ATCC 33591 از مرکز ذخایر ملی ژنتیک خریداری گردید. سوسپانسیون میکروبی در محیط کشت مایع مولر هینتون براث (مرک، آلمان) تهیه شد. برای این کار یک لوپ از میکروب در 5 میلیلیتر محلول محیط کشت فوق تلقیح و به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت. پس ازکشت اول، کشـت مجـدد تهیـه و در همـان شرایط نگهداری شد.
تهیه میزان تلقیح باکتری:
از سوسپانسیون میکروبی تهیه شده مقادیر مختلفی برداشته و در طول موج 600 نانومتر خوانده شد تا جذب نوری 05/0 تا 1/0 به دست آید و سپس از آن رقت سریال تهیه گردید. از هر رقت به پلیتهای حاوی BHIآگار اضافه و کشت داده شد. پلیتها به مدت 24 ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت و سپس تعداد باکتریها شمارش شد و از این طریق تعداد باکتریها در کووت حاوی سوسپانسیون باکتری با جذب نوری معادل 1/0 محاسبه شد. میانگین تعداد باکتریها در کووت با جذب نوری 1/0 معادل با محلول 5/0 مک فارلند برابر با CFU/mL 108 × 5/1محاسبه شد. با مشخص شدن این عدد هرگاه که سوسپانسیون باکتریایی با جذب نوری 1/0 تهیه شود، تعداد باکتری در آن معادل عدد محاسبه شده و میتوان از این سوسپانسیون غلظتهای دلخواه را تهیه نمود.
بررسی خاصیت ضد باکتری پپتید دیفنسین:
تعیین حداقل غلظت بازدارندگی(MIC) رشد:
حداقل غلظت مهارکنندگی پپتید تخلیص شده به روش ماکرودایلوشن سنجیده شد (16). به طور خلاصه، ابتدا رقت سریال پپتید در مبنای 2 به صورت، رقتهای 1 به 1 تا 1 به 32 پپتید دیفنسین محلول در محیط کشت آبگوشت مولر هینتون و پلیت 96 خانهای تهیه گردید. در واقع برای پپتید مورد نظر، غلظتهای 20 تا 625/0 میکروگرم در میلیلیتر در نظر گرفته شد. در مرحله بعد، تراکم ثابتی از باکتری معادل نیم مک فارلند یا CFU/mL 108×5/1 به همه چاهکهای میکروپلیت افزوده شد. سپس پلیت به مدت 2، 4، 8 و 24 ساعت در دمای 37 درجه سانتیگراد و شرایط هوازی انکوبه گردید.
بررسی قطر هاله عدم رشد:
به کمک این آزمون، قطر هاله عدم رشد پپتید تخلیص شده برای باکتری مورد نظر تعیین گردید. برای این کار ابتدا 10 میلیلیتر محیط کشت مولر هینتون آگار (مرک، آلمان) با کشت 24 ساعته باکتری استافیلوکوکوس اورئوس با تراکم نیم مک فارلند مخلوط و در یک پلیت استریل10 سانتیمتری ریخته شد. سپس با یک سواپ استریل به صورت چمنی باکتری مذکور کشت داده شد. در ادامه یک دیسک استریل آغشته به پپتید تخلیص شده در مرکز محیط کشت قرار داده شد و سپس پلیت با همان شرایط ذکر شده انکوبه گردید.
یافتهها
نتایج خالصسازی پپتید دیفنسین به روش HPLC :
فرکشن شماره 2 در شکل 3 حاوی پیک به دست آمده از تزریق پپتید و فراکشن شماره 1 حاوی پیک استاندارد دیفنسین میباشد. در مقایسه با کروماتوگرام استاندارد، دیفنسین تخلیص شده غلظت 250 برابر غلظت استاندارد را نشان میدهد (غلظت نمونه استاندارد ppm 200 میباشد) و همپوشانی دقیقی با نمونه استاندارد دارد
|
2
|

نتایج بررسی خاصیت ضد باکتری پپتید دیفنسین:
حداقـل غلظت بازدارندگی رشد پپتید دیفنسین به میزان
5/2 میکروگرم بر میلیلیتر برای باکتری اســتافیلوکوکوس اورئـوس بـه روش مـاکرودایلوشن تعیین شد . بررسیهای
باکتریکشــی نشان داد که این پپتید ســبب مهار رشد باکتری مذکور میشود.
نتایج بررسی قطر هاله عدم رشد:
پس از گذشت 24 ساعت، پلیت زیر نور چراغ بررسی گردید و قطر منطقه مهار رشد برای باکتری استافیلوکوکوس اورئوس برابر با 9 میلیمتر با استفاده از خطکش اندازهگیری گردید.
بحث
در این مطالعه از فیلترهای کاهنده لکوسیتی Leucoflex LCR5 استفاده شد، سپس لکوسیتها از فیلترهای کاهنده لکوسیتی توسط جریان معکوس بازیافت شد و جداسازی گرانولوسیتها از سایر سلولها بر مبنای سانتریفیوژ شیب چگالی و رسوب دکستران صورت گرفت. از روش سونیکاسیون برای شکستن گرانولهای نوتروفیلی و آزادسازی دیفنسین و از روش کروماتوگرافی طرد مولکولی برای تخلیص دیفنسین استفاده شد. بررسی فعالیت ضد میکروبی دیفنسین بر روی گونه مقاوم استافیلوکوکوس اورئوس نشاندهنده اثربخشی بر روی گونه مقاوم به آنتیبیوتیکهای رایج بود.
اگر چه در طول قرن گذشته، کشف طیف گستردهای از آنتیبیوتیکها و واکسنها، عوارض مرگ و میر ناشی از عفونتهای میکروبی را کاهش داد، اما امروزه مقاومتهای آنتی بیوتیکی ناشی از استفاده بیش از حد و نامناسب آنتیبیوتیکها، دنیا را با چالشهای جدیدی مواجه کرده است. به همین دلیل نیاز به دستیابی به نوآوریهایی در کنترل عفونتهای میکروبی وجود دارد و استفاده از پپتیدهای ضد میکروبی به عنوان جایگزینی بالقوه و با ارزش اهمیت ویژهای پیدا کرده است (18، 17).
این پپتیدهای ضد میکروبی که از اجزای مهم دفاع طبیعی بدن علیه عوامل بیماریزا هستند، توسط گرانولوسیتها، ماکروفاژها و سلولهای اپیتلیال در انسان تولید میشوند و از آن جایی که بیش از 60 درصد گلبولهای سفید خون را نوتروفیلها تشکیل میدهند، میتوانند به عنوان منبع غنی از این پپتیدها مورد استفاده قرار گیرند (8، 6).
از طرف دیگر برخی عوارض جانبی بالقوه در انتقال خون ناشی از اجزای لکوسیتی اهداکننده میباشد و به همین دلیل کاهش لکوسیتها به عنوان یکی از عملکردهای بهینه در مراحل فرآیندهای خون در انتقال خونهای سراسر دنیا قرار گرفته است (19). فیلترهای کاهنده لکوسیتی متعددی در سازمان انتقال خون ایران برای کاهش لکوسیت در فرآوردههای خونی استفاده میشود که از دسته فیلترهای پیشذخیره هستند. در این مطالعه فیلترهای Leucoflex LCR5 متصل به کیسههای چهارتایی شرکت ماکوفارمای فرانسه، برای جداسازی ابتدایی لکوسیتها و سپس جداسازی اختصاصی نوتروفیلها و استخراج دیفنسین مورد استفاده قرار گرفت. فیلترهای LCR5 دارای 27 لایه مشتمل بر 5 لایه 30 میکرومتری و 22 لایه 9 میکرومتری میباشد. 5 لایه ابتدایی جهت جداسازی لختهها بوده و از جنس پلی اتیلن ترفتالات میباشند. لایههای 9 میکرومتری از جنس پلیپروپیلن بوده و در سه سطح مکانیسمی به ترتیب به روشهای جداسازی براساس اندازه، جداسازی تمایلی و جداسازی سلولی (به دام انداختن سلولها) عمل میکنند (20). این فیلترهای کاهنده لکوسیتی پس از استفاده به عنوان ضایعات تلقی شده و دور ریخته میشوند. در حالی که این فیلترها منبع بسیار غنی از سلولهای خون محیطی میباشند که به راحتی میتوان از این منبع ارزشمند در مطالعات پایه و یا بالینی استفاده نمود و راهی برای استفاده از این سرمایه ملی ارزشمند در درمان گشود(11).
روش رایج کنونی برای بازیابی لکوسیتها از فیلترهای کاهنده لکوسیتی، جریان معکوس است که شامل عبور جریان مایع در جهت معکوس جریان اصلی فیلترها میباشد. لانگلی و همکاران، بافر سالین فسفات (PBS) را از جریان معکوس عبور دادند (21). در سالهای بعد کولیگان و همکاران، پس از جریان معکوس و برای تخلیص بیشتر از سانتریفیوژ شیب فایکول هایپک استفاده کردند و سلولهای لکوسیتی حاصل را با PBS شستشو دادند (11). در سال 2017 وگهاوپت و همکاران نیز از جریان معکوس شستشو برای استحصال لکوسیتهای به دام افتاده در فیلتر استفاده کردند (22). در مطالعه حاضر از سیستم جریان معکوس و از بافر شستشوی PBSدر pH برابر با 2/7 ، حاوی 2 میلی مولار EDTA و 4 درصد دکستران40% استفاده گردید. همچنین برای جلوگیری از دستکاری کمتر در شستشوی فیلتر، یک سیستم مکانیکی با حجم و فشار تعیین شده شامل یک اتصال سه طرفه قابل تنظیم، یک پمپ پریستالتیک و یک دمنده هوا، با سرعت و تکرارپذیری بالا طراحی و استفاده شد. همچنین برای جداسازی گرانولوسیتها از سایر سلولها، از روش مقبل و همکاران بر مبنای سانتریفیوژ شیب چگالی و رسوب دکستران تحت شرایط دمایی و pH تعریف شده و با انجام تغییراتی در روش استفاده شد (13).
در یک مطالعه در سال 2014، برای تحریک ترشح دیفنسین از سیتوکالازین b (Cytochalasin B) و N- formylmethionyl-leucyl-phenylalanine استفاده شد (23). در مطالعه حاضر به دلیل استفاده از فیلترهای کاهنده لکوسیتی که گرانولوسیتهای حاصل از حدود 450 میلیلیتر خون میباشد و به دلیل میزان فراوان لکوسیت در دسترس، نیاز به این غنی سازی نبود. برای شکستن گرانولهای نوتروفیلی و آزادسازی دیفنسین از روش سونیکاسیون استفاده شد و برای تخلیص دیفنسین از کروماتوگرافی طرد مولکولی (Size Exclusion Chromatography) استفاده شد، همچنان که در مطالعههای بسیاری از روشهای متفاوتی نظیر کروماتوگرافی تعویض یونی و کروماتوگرافی فاز معکوس و کروماتوگرافی طرد مولکولـی بـرای تخلیـص پپتیدهای ضد میکروبی استفـاده
شده است (26-24).
دیفنسینها به طور همزمان دارای فعالیت ضد میکروبی و ضد سرطانی هستند و در حال حاضر تحقیقات بسیاری بر روی این اثرات متمرکز شده است (27). اغلب پپتیدهای ضد میکروبی ضد باکتری، کاتیونیک هستند که غشا سلول باکتری را هدف قرار داده و موجب تجزیه ساختار لیپید دولایه میگردد. در حالی که برخی از پپتیدهای ضد میکروبی قادر به مهار واکنشهای درون سلولی نیز میباشند (7). در این مطالعه اثر پپتید دیفنسین استخراج شده از نوتروفیلهای حاصل از فیلترهای کاهنده لکوسیتی،
بر روی گونه مقاوم استافیلوکوکوس اورئوس، نشاندهنده اثربخشی بر روی گونه مقاوم به آنتیبیوتیکهای رایج بود و این پپتید در غلظت 5/2 میکروگرم بر میلیلیتر،که غلظت مناسبی برای خاصیت باکتریکشی محسوب میشود، قادر به مهار رشد باکتری شد. در این مطالعه حداقل غلظت مهاری (MIC) پپتید دیفنسین با مطالعه وُسیر و همکاران در سال 2014 مطابقت نشان داد (23).
نتیجهگیری
در این مطالعه از دیفنسین به عنوان پپتید ضدمیکروبی و برای بررسی تعیین حداقل غلظت مهار رشد باکتری استافیلوکوک اورئوس استفاده گردید و نشان داده شد که با توجه به ظهور گسترده مقاومتهای دارویی میتواند به عنوان یک گزینه مناسب و در دسترس و با پتانسیل جایگزینی برای آنتیبیوتیکها مد نظر قرار گیرد. با وجود مطالعههای بسیاری که بر روی فعالیت ضد باکتریایی دیفنسین انجام گرفته است، تاکنون خاصیت باکتریکشی پپتید دیفنسین بازیابی شده از فیلترهای کاهنده لکوسیتی گزارش نگردیده بود. از طرفی یکی از منابع در دسترس سلولهای خونی، فیلترهای کاهنده لکوسیتی میباشد که به دلیل سهلالوصول بودن، مورد توجه بسیاری از مراکز تحقیقاتی انتقال خون قرار گرفته است. قابلیتهای فوقالعاده گلبولهای سفید از جمله تولید پپتیدهای ضد میکروبی و کموکاینهای مختلف، سبب شده است مطالعهها در زمینه بازیابی حداکثری گلبولهای سفید به دام افتاده در این فیلترها در مراکز تحقیقاتی انتقال خون صورت پذیرد. مطالعهها در مورد بازیابی سلولهای حاصل از فیلترهای کاهنده لکوسیتی و نقش پپتیدهای ضد میکروبی و سایر مدیاتورهای حاصل از این سلولها میتواند ابزار قدرتمندی در تحقیقات سلول درمانی و مطالعههای برهمکنش سلولی باشد و در پیشرفتهای مولکولی جدید در کشف دارو اهمیت داشته باشد.
حمایت مالی
این پروژه تحقیقاتی توسط مؤسسه ملی توسعه تحقیقـات علـوم پـزشکی ایران و مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین مالی شده است.
ملاحظات اخلاقی
این پروژه از مؤسسه ملی توسعه تحقیقات علوم پزشکی ایران دارای کد اخلاق IR.NIMAD.REC.1396.294 و از مؤسسه عالی آموزشی و پژوهشی طب انتقال خون دارای کد اخلاق IR.TMI.REC.1396.019 میباشد.
عدم تعارض منافع
نویسندگان اظهار کردند در انتشار این اثر منافع تجاری نداشتند و در مقابل ارائه اثر وجهی دریافت نکردهاند.
تشکر و قدردانی
بدینوسیله از مؤسسه ملی توسعه تحقیقات علوم پزشکی ایران و مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تشکر میشود.
نوع مطالعه: پژوهشي |
موضوع مقاله:
طب انتقال خون
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






