جلد 17، شماره 4 - ( زمستان 1399 )
جلد 17 شماره 4 صفحات 286-276 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Noorazar L, Esmaeili S, Mashati P, Gharebaghian A, Salari S. Investigating the apoptotic and anti-proliferative effects of Juniperus excelsa fractions on Acute Lymphoblastic leukemia cell line (Nalm-6). bloodj 2020; 17 (4) :276-286
URL: http://bloodjournal.ir/article-1-1362-fa.html
URL: http://bloodjournal.ir/article-1-1362-fa.html
نورآذر لیلا، اسماعیلی سمیه، مشاتی پرگل، قره باغیان احمد، سالاری سینا. اثر آپوپتوتیک و آنتیپرولیفراتیو فرکشن های گیاه Juniperus excelsa بر روی رده سلولی لوسمی لنفوبلاستیک حاد(Nalm-6). فصلنامه پژوهشی خون. 1399; 17 (4) :276-286
دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی
متن کامل [PDF 788 kb]
(1251 دریافت)
| چکیده (HTML) (3371 مشاهده)
مقدمه
لوسمی لنفوبلاستی حاد(ALL)، یکی از انواع بدخیمیهای خونی است که با تکثیر پیشسازهای لنفوئیدی در مغز استخوان همراه میباشد که تواماً کودکان و بزرگسالان را درگیر میکند. سالانه به طور تقریبی، 6000 مورد ابتلا به این سرطان در ایالت متحده امریکا گزارش میشود که بیشترین رنج سنی بیماران بین کودکان و نوجوانان است(1). دو گروه سنی کودکان زیر 15 سال و افراد بالای 50 سال در این لوسمی بیشترین ابتلا را دارند و شایعترین پیک سنی درگیر در ALL کودکان، بین 2 تا 5 سال میباشد(2). این بدخیمی در کودکان با پیشآگهی مطلوب همراه است اما در بزرگسالان به صورت یک بیماری کشنده بروز مییابد(3). از شایعترین علائم ALL میتوان به کبودی یا خونریزی ناشی از ترومبوسیتوپنی، خستگی و رنگ پریدگی ناشی از کم خونی و عفونت ناشی از نوتروپنی اشاره کرد. در تشخیص ALL ، ارتشاح سلولهای لوسمی به کبد، طحال، غدد لنفاوی و مدیاستن و ایجاد لنفادنوپاتی کمک کننده است (1). پیشرفت مداوم در توسعه درمانهای مؤثر باعث شده است که میزان بهبودی در کودکان به بیش از 80% افزایش یابد و رویکردهای نوینی در جهت افزایش بقای عاری از سرطان ایجاد شود که به موجب آن شاهد کاهش عواض داروهای شیمی درمانی خواهیم بود(4). همانطور که میدانیم عوارض جانبی داروهای شیمی درمانی سرکوب شدید سیستم ایمنی، پوکی استخوان، نوروتوکسیسیتی و غیره، از محدودیتهای این درمان است. از آنجا که داروهای گیاهی به علت داشتن منشأ طبیعی در مقایسه با داروهای شیمیایی دارای عوارض جانبی کمتری بوده و به دلیل این که با ارگانیسم زنده از جمله بدن انسان سازگاری بیشتری دارند، تمایل به مصرف آنها رو به افزایش است و اکنون نیز به عنوان منبع مکملی برای داروهای شیمی درمانی مورد توجه هستند(5). اخیراً به کارگیری داروهای گیاهی در زمینه بهبود سرطان مورد توجه محققان قـرار گرفتهاند. شناخت ترکیبات مؤثره در این گیاهان و جداسازی، تخلیص و به کارگیری آنها در زمینه تحقیقات سرطان نشان داده است که این ترکیبات قادرند باعـث مهار رشد و
القای آپوپتوز شده در نهایت منجر به مرگ سلول سرطانی شوند. با نظر به این که داروهایی با پایه گیاهی تاثیرگذاری و پایداری بیشتر و عوارض جانبی کمتر و همچنین از لحاظ چرخه تولید، صرفه اقتصادی بالاتری نسبت به داروهای سنتتیک دارند، تمایل بیشتری در مصرف داروهای گیاهی به عنوان مکمل یا جایگزین داروهای سنتتیک در بین جوامع مختلف مشاهده میشود(6). امروزه، حدوداً 55% از داروهایی که به عنوان ضد سرطان در بالین بیمار مورد استفاده قرار میگیرد، از منابع گیاهی به دست آمده است(7). گیاه جونیپروس اکسلسا(Juniperus excelsa ; J.excelsa)، یک درخت یا درختچهای همیشه سبز از خانواده کوپرساسیا(Cupressaceae) است که در کشورهای ناحیه بالکان، ترکیه، سوریه، لبنان، گرجستان، دامنه قفقاز و قسمت شرقی ایران وجود دارد و فرمهای اصلاح شده متعددی از آن در ایران کاشته میشود که مردم محلی، آن را با نام ارس یا اردوج میشناسند(8). جونیپروس یک گیاه دارویی است که در گذشته برای درمان قاعدگی دردناک، سرفه و برونشیت مورد استفاده قرار میگرفت. همچنین فعالیت ضد میکروبی متعددی در میوه و برگهای این گیاه علیه برخی پاتوژنها مورد بررسی قرار گرفته است(9، 8). مطالعههای اخیر در مورد ترکیبات با منبع پودوفیلوتوکسین و دئوکسی پودوفیلوتوکسین موجود در عصاره برگ این گیاه نشان داد که این ترکیبات، خاصیت سیتوتوکسیک بر علیه سلولهای سرطانی از خود نشان میدهند(10). اثرات سیتوتوکسیک این عصاره بر روی ردههای سلولی مربوط به تومورهای جامد مانند رده سلولی Hela نیز در مقالهای مشابه به اثبات رسیده است(11). در مطالعه مشابه، عصاره تام جونیپروس اکسلسا، آپوپتوز را در سلولهای سرطانی رده لنفوبلاستی Reh و Nalm-6 القا کرد و همچنین توانست با اثر سینرژی، دوز داروی شیمیدرمانی وین کریستین را در این دو رده سلولی کاهش دهد(5). از طرف دیگر برخی از مطالعهها تایید کردهاند که میتوان از این عصاره به عنوان یک ماده نگهدارنده مواد غذایی استفاده کرد، چرا که خاصیت ضد میکروبی داشته و بر روی بدن انسان تاثیر سوء نخواهد گذاشت(12). در این مطالعه رده سلولی Nalm-6 که الگویی از لوسمی ALL است، به دلیل شیوع بیشتر در بین کودکان و پیش آگهی ضعیف آن در بزرگسالان، به عنوان رده سلولی مورد مطالعه برگزیده شد و برای اولین بار اثرات کشندگی سه فرکشن نامبرده گیاه فوق به طور خاص برروی رده سلولی Nalm-6 و سلولهای طبیعی تک هستهای خون فرد سالم(PBMC) مورد بررسی قرار گرفت.
مواد و روشها
1- آمادهسازی عصاره:
در یک مطالعه تجربی، 30 گرم از پودر گیاه خشک به نسبت 1 به 10 با حلال غیر قطبی پترولیوم اتر مخلوط شد. مخلوط ایجاد شده پس از 24 ساعت قرارگیری بر روی شیکر، صاف و فرکشن به دست آمده با روتاری تغلیظ یافت. پس از خشک شدن کامل نمونه تغلیظ شده در زیر هود شیمیایی، فرکشن خشک اتردوپترولی حاصل شد. در ادامه با افزودن حلال کلروفرم با نسبت 1 به 10 به باقیمانده خشک شده گیاه از مرحله قبل و تکرار فرآیند شرح داده شده، فرکشن کلروفرمی به دست آمد. از افزودن حلال متانولی به باقیمانده خشک، فرکشن متانولی استخراج گردید. در انتها با افزودن آب به عنوان حلال قطبی، عصاره آبی حاصل شد که با استفاده از دستگاه فریزدرایر، فرکشن خشک آبی استخراج شد. فرکشنهای به دست آمده تا زمان استفاده در دمای 4 درجه سانتیگراد نگهداری شد. تمامی مراحل استخراج فرکشنها در مرکز تحقیقات طب سنتی و مفردات پزشکی دانشگاه علوم پزشکی شهید بهشتی و زیر نظر متخصص فارماکوگنوزی انجام گرفت. به منظور تهیه ذخیره اولیه از فرکشنها، 20 میلیگرم از هر یک از فرکشنهای خشک درون ویال، با استفاده از ترازوی دیجیتال وزن شد و به استثنای فرکشن آبی، 1 میلیلیتر از DMSO به عنوان حلال استفاده گردید. از محیط کشت RPMI به عنوان حلال برای فرکشن آبی استفاده شد. غلظت نهایی استوک فرکشنها 20 میلیگرم در میلیلیتر بود و تا زمان تیمار سلولها با غلظتهای مورد نظر، در فریزر 20- درجه سانتیگراد نگهداری گردید. محیط کشت RPMI برای رقیقسازی فرکشنها از استوک اولیه استفاده شد و غلظت نهایی DMSO در غلظتهای مورد مطالعه به زیر 01/0 رسید و نیازی به کنترل DMSO نبود. مخلوط حاضر را به مدت 24 ساعت روی شیکر قرار داده و پس از طی این مدت، نمونه را با کاغذ صافی و قیف صاف کرده و حجم مایع به دست آمده را با روتاری کم نمودیم. پس از آن نمونه تغلیظ شده را درون ویال وزن شده ریخته و منتظر خشک شدن کامل آن شدیم که فرکشن حاصل از آن، فرکشن اتردوپترولی است. سپس ویال محتوی تفاله گیاه را وزن کرده و از اختلاف وزن نمونه خشک شده و ویال وزن شده، وزن تفاله خشک به دست میآمد. آن را زیر هود به نسبت 1 به 10 با حلال کلروفرم مخلوط نمودیم. 24 ساعت روی شیکر قرار داده و سپس مانند مرحله قبل آن را صاف کردیم. مایع صاف شده را تغلیظ کرده و زیر هود خشک نمودیم که فرکشن کلروفرمی از آن به دست آمد. در مرحله بعد، تفاله را با حلال متانول به طریق گفته شده 24 ساعت خیسانده و صاف کردیم. نمونه صاف شده را تغلیظ کرده و به عنوان فرکشن متانولی استفاده نمودیم. روی تفاله باقیمانده به نسبت 1 به 10 آب ریخته و با قیف بوخنر صاف نمودیم و مایع زیرین آن که فرکشن آبی است، درون ظرف فریزدرایر ریخته و داخل فریزر گذاشتیم.
2- کشت سلولی و تیمار سلولها:
مطالعه انجام شده از نوع تجربی بود و بدین منظور از رده سلولی Nalm-6 مربوط به لوسمی لنفوبلاستیک حاد استفاده شد. همچنین سلولهایPBMC به عنوان سلولهای تک هستهای خونی طبیعی و کنترل، برای ارزیابی عدم تاثیر دارو بر سلولهای خونی مورد استفاده قرار داده شد. رده سلولی Nalm-6از بانک سلولی انستیتو پاستور ایران (تهران، ایران) تهیه شد. به منظور کشت سلولی، ابتدا مراحل یخزدایی سلولها از تانک ازت انجام شد. سپس سلولها در محیط RPMI 1640 (آمریکا، جیبکو) حاوی10% FBS و 1% پنیسیلین - استرپتومایسین کشت داده شدند. فلاسکهای کشت سلولی در انکوباتور 37 درجه سانتیگراد با 5% CO2 انکوبه شدند. برای جداسازی سلولهای PBMC ، مقدار 20 میلیلیتر از خون فرد طبیعی در ضد انعقاد هپارین گرفته شد و به نسبت 1 به 1 با PBS فیلتر شده رقیق گردید. یک سوم حجم نهایی هر فالکون، فایکول ریخته شد و خون رقیق شده به آرامی با سمپلر از کنار دیواره فالکون بر روی فایکول ریخته شد. به دلیل سمی بودن فایکول، باید این مرحله به سرعت انجام گردد. سلولها به همراه فایکول در سانتریفوژ بدون ترمز با دور g 600 به مدت 25 دقیقه سانتریفوژ شدند.
پس از پایان سانتریفوژ، از پایین به بالا شاهد 4 لایه سلولی شامل گلبولهای قرمز، گرانولوسیتها، فایکول، سلولهای PBMC و در نهایت پلاسما هستیم. لایه پلاسما با سمپلر به آرامی دور ریخته شد. سلولهای PBMC که لایه ابر مانندی را تشکیل داده بودند، توسط پیپت پاستور استریل به یک فالکون تمیز منتقل و جهت شست و شو و خروج فایکول به آن PBS فیلتر شده اضافه شد. سلولها با دور g350 به مدت 5 دقیقه سانتریفوژ شدند. این کار سه مرتبه تکرار گردید. در مرحله آخر پس از خروج مایع رویی، محیط کشت RPMI به همراه FBS و آنتیبیوتیک اضافه شد و در پلیت 6 خانه کشت در انکوباتور 37 درجه سانتیگراد با 5% CO2 انکوبه گردید. بعد از این که سلولها به قدر کافی رشد کردند، سلولهای Nalm-6 و PBMC با غلظتهای مختلف از فرکشن کلروفرمی، اتردوپترولی و آبی به مدت 24 و 48 ساعت تیمار شدند. غلظتهای مختلف عصاره ها با استفاده از محیط کشت استریل رقیق سازی و تهیه شد و تمامـی آزمایـشها بـرای افـزایش دقـت کار سه بار تکرار گردید.
3- رنگآمیزی تریپانبلو:
برای شمارش سلولهای زنده جهت بررسی میزان بقا و
تکثیر سلولهای تیمار شده نسبت به کنترل، از رنگآمیزی تریپان بلو و لام هموسیتومتر(نئوبار) استفاده شد. پس از 24 و 48 ساعت از کشت سلولها با غلظتهای ذکر شده از فرکشنهای کلروفرمی، اتردوپترولی و آبی گیاه جونیپروس اکسلسا در چاهکهای پلیت 24 خانه، رنگ تریپانبلو به نسبت 1 به 1 به محیط موجود در چاهکها اضافه شد و پس از 5-3 دقیقه زیر میکروسکوپ بررسی گردید. اساس این آزمایش بدین ترتیب است که سلولهای زنده نسبت به ورود رنگ تریپانبلو نفوذ ناپذیر میباشند، در حالی که سلولهای مرده رنگ را جذب مینمایند. میزان زندهمانی سلولهای زنده با فرمول زیر محاسبه شد.
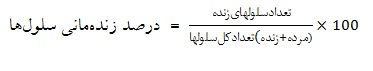
4- آزمون MTT به منظور سنجش فعالیت متابولیک :
برای سنجش تاثیر عصارههای کلروفرمی، اتردوپترولی و آبی گیاه جونیپروس اکسلسا بر میزان فعالیـت متابولیک، سلولهای لوسمیک Nalm-6 و طبیعی PBMC با دوزهای مختلف از فرکشنها در چاهکهای پلیت 96 خانه تیمار شدند. پس از 24 و 48 ساعت انکوباسیون در انکوباتور 37 درجه سانتیگراد و 5% CO2 ، به سلولهای داخل هر چاهک 10میکرولیتر محلول MTT (4,5 dimethyl diphenyl tetrazolium bromide) با غلظت mg/mL 5 اضافه شد و پلیت مجدداً به مدت 3 ساعت در انکوباتور قرار گرفت. در طی زمان انکوباسیون، رنگ تترازولیوم موجود در محلول MTT به وسیله آنزیم سوکسینات دهیدروژناز احیا میشود. احیا و شکسته شدن این رنگ موجب تولید کریستالهای آبی رنگ فورمازان میشود. میزان رنگ تولید شده با تعداد سلولهایی که از نظر فعالیت متابولیک فعال هستند (سلولهای زنده) رابطه مستقیم دارد.
در ادامه پلیت با دور g 2000 به مدت 15 دقیقه سانتریفوژ شده و پس از خالی کردن محلول رویی، 100 میکرولیتـر حـلال DMSO بـرای حــل رسوب رنگی فورمازان ایجاد شده که نامحلول در آب هستند به هر چاهک اضافه شد و جذب نوری چاهکها با استفاده از دستگاه رنگ سنجی EISA-reader در طول موج 570 نانومتر قرائت گردید.

درصد فعالیت متابولیک سلولها طبق فرمول بالا محاسبه گردید.
5- آزمـون فلـوسیتومتری بـه منظور سنجش میزان آپوپتوز:
به منظور تایید آپوپتوز در سلولهای لوسمیک تحت تاثیر فرکشنهای جونیپروس اکسلسا، از آزمون فلوسیتومتری انکسین PI/V استفاده شد. ابتدا سلولها در محیط RPMI حاوی FBS 10% در انکوباتور 37 درجه سانتیگراد حاوی 5% CO2 به منظور دسترسی به تعداد مورد نظر از سلولها، کشت شدند. طبق دستورالعمل کیت (Annexin V Apoptosis Detection Kit FITC ، بیوساینس) برای هر آزمون به 105×3 سلول در هر میلیلیتر نیاز است. سلولها در پلیت 6 خانه با غلظتهای 5/1 تا 5/2 میکروگرم در میلیلیتر عصاره کلروفرمی جونیپروس اکسلسا به مدت 48 ساعت تیمار شدند. و همچنین2 نانوگرم در میلیلیتر داروی وین کریستین تیمار و به مدت 48 ساعت انکوبه شدند.
بعد از انکوباسیون، سلولها به فالکون منتقل شده و سانتریفوژ شدند و مایع رویی آن دور ریخته شد. رسوب سلولی پس از یک بار شستشو با PBS ، با 500 میکرولیتر از بافر باند کننده X 1 مواجه شد. در ادامه 5 میکرولیتر انکسین V به نمونه ها اضافه شد و پس از 10 دقیقه انکوباسیون در تاریکی، این بار 5 میکرولیتر رنگ PI (Propidium Iodide) اضافه و مجدداً 10 دقیقه انکوبه شد. سپس نمونهها به ویالهای مربوط به فلوسیتومتری منتقل شدند و میزان خروج فسفاتیدیل سرین در سطح سلولها توسط دستگاه فلوسیتومتری مورد سنجش قرار گرفت و نتایج توسط نرمافزار FlowJo 7.6.1 آنالیز شد.
یافتهها
اثر فرکشنهای کلروفرمی، اتردوپترولی و آبی گیاه J.excelsa بر روی شاخص زندهمانی سلولهای Nalm-6 و PBMC :
نتایـج آزمایـش زندهمانی سلولی پس از24 و 48 ساعت
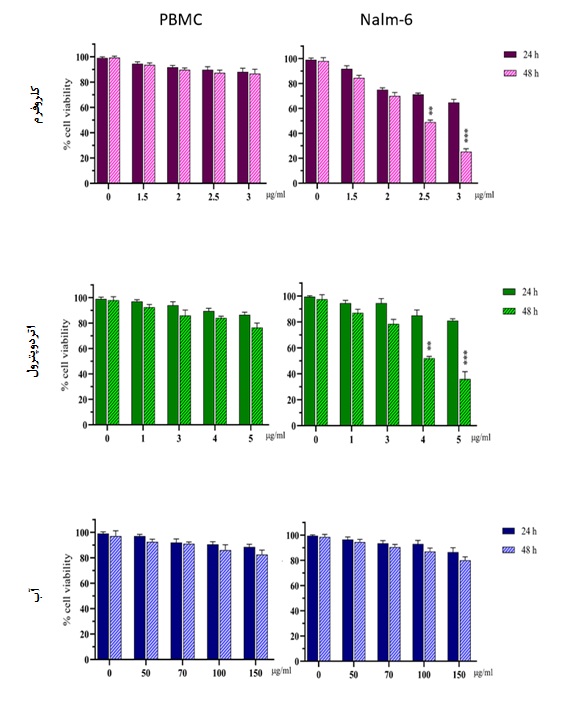
از تیمار سلولها با فرکشنهای یاد شده از گیاه جونیپروس اکسلسا، نشان داد که غلظت 5/2 و 3 میکروگرم در میلیلیتر از فرکشن کلروفرمی پس از 48 ساعت نسبت به گروه کنترل (تیمار نشده)، میزان زندهمانی سلولی را به طور قابل ملاحظهای کاهش داد. در فرکشن اتردوپترولی کاهش معنادار درصد سلولهای زنده پس از 48 ساعت در غلظت 4 و 5 میکروگرم در میلیلیتر نسبت به گروه کنترل رخ داد در حالیکه فرکشن آبی فاقد اثرات سایتوتوکسیک قابل مشاهده در بازه غلظتی مورد آزمایش بود.
همچنین سلولهای PBMC به عنوان سلولهای طبیعی خونی در تیمار با فرکشنهای ذکر شده، کاهش معناداری در میزان زندهمانی سلولی نشان ندادند. پس از مشاهده تاثیرات فرکشنها بر شاخص زندهمانی سلولی، به دلیل بیاثر بودن فرکشن آبی بر سلولهای Nalm-6 در غلظتهای 50 تا 150 میکروگرم در میلیلیتر، این عصاره در ادامه برای آزمونهای بیشتر از مطالعه خارج شد(نمودار 1).
اثر فرکشنهای کلروفرمی و اتردوپترولی بر فعالیت متابولیک سلولهای Nalm-6 وPBMC :
نتایج حاصل از بررسی فعالیت متابولیکی سلول با روش MTT نشان داد که پس از 48 ساعت از تیمار سلولهای Nalm-6 با فرکشن کلروفرمی و اتردوپترولی گیاه جونیپروس، به صورت وابسته به دوز و زمان کاهش معناداری در فعالیت متابولیکی سلولها نسبت به گروه کنترل (تیمار نشده) رخ داد. بدین ترتیب که در فرکشن کلروفرمی با شروع افزایش غلظت از 2 میکروگرم در میلیلیتر بین دو گروه تیمار 24 ساعت و 48 ساعت، اختلاف معنادار در درصد فعالیت متابولیک سلولها مشاهده شد. همچنین طبق نتایج آزمون MTT ، دوز IC50 فرکشن کلروفرمی پس از 48 ساعت تیمار سلولی که حداقل 50% از سلولها در آن زنده هستند، 5/2 میکروگرم در میلیلیتر محاسبه گردید. فرکشن اتردوپترولی نیز با افزایش غلظت از 4 میکروگـرم در میلـیلیـتر در دو گـروه زمانی ذکر شده، اختلاف معنادار در درصد فعالیت متابولیک سلولها را نشان داد. طبق این آزمون، دوز IC50 فرکشن اتردوپترولی نیز 4 میکروگرم در میلیلیتر محاسبه شد. سلولهای PBMC با غلظتهای ذکر شده با این فرکشنها تیمار شد و کاهش مختصری در فعالیت متابولیک سلولی گزارش گردید که معنادار نبـود(نمودار 2).

نمودار 2: بررسی و مقایسه میزان فعالیت متابولیک سلولهای لوسمیک Nalm-6 و سلولهای PBMC پس از تیمارهای 24 و 48 ساعت با فرکشنهای کلروفرمی، اتردوپترولی و آبی گیاه J.excelsa (*بیانگر 05/0 p< ، ** بیانگر 01/0 p< و *** بیانگر 001/0 p<).
شکل 1: بررسی میزان آپوپتوز سلولهای Nalm-6 توسط آزمون فلوسیتومتری پس از 48 ساعت با دوزهای 5/1 تا 5/2 میکروگرم در میلیلیتر از فرکشن کلروفرمی گیاه J.excelsa
بررسی آپوپتوز با روش فلوسیتومتری انکسین PI/V :
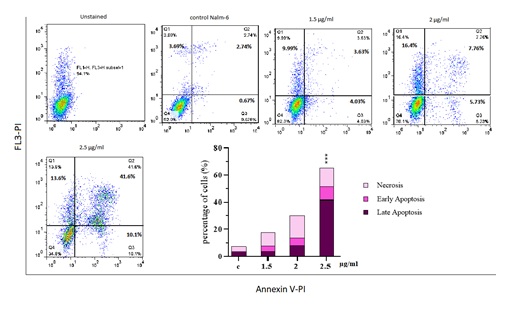
نتایج حاصل از آنالیز فلوسیتومتری آپوپتوز سلولی نشان داد که فرکشن کلروفرمی گیاه جونیپروس، قادر به افزایش قابل توجه آپوپتوز در سلولهای Nalm-6 به صورت وابسته به دوز میشود. درصد سلولهای انکسین V مثبت طی تیمار با غلظت 5/2 میکروگرم در میلیلیتر فرکشن کلروفرمی از 1 درصد در سلولهای کنترل، به 10 درصد در سلولهای تیمار شده افزایش یافت. همچنین درصد سلولهایی که هر دو مارکر انکسینV و PI را مثبت نشان دادند از 3 درصد در سلولهای گروه کنترل، به 41 درصد در سلولهای تیمار شده با غلظت 5/2 میکروگرم در میلیلیتر از این فرکشن افزایش یافت(شکل 1).
آزمونهای آماری:
دادههای مطالعه با کمک نرمافزار 23SPSS آنالیز شد. برای ارزیابی اختلاف آماری بین گروههای مورد مطالعه (تیمار شده و کنترل) از آزمونone-way-ANOVA استفاده شد و از 05/0 p< برای معناداری آزمونها استفاده گردید. همچنین 01/0 p< و 001/0 p< به ترتیب نشانگر میزان معناداری بیشتر نسبت به گروه کنترل بودند.
بحث
لوسمی لنفوبلاستیک حاد(ALL) در دسته شایعترین گروه لوسمیها قرار دارد و به طور میانگین سالانه حدود 30% از بدخیمیهای کودکان را به خود اختصاص میدهد. نتایج مطالعه حاضر بر روی فرکشنهای مختلف گیاه جونیپروس نشان از اثر مهاری رشد بر روی رده سلولی Nalm-6 داشت. یافتههای به دست آمده از آزمون زندهمانی و فعالیت متابولیک سلولی نشان داد که در فرکشن کلروفرمی، دوزهای 5/2 میکروگرم در میلیلیتر به بالا پس از 48 ساعت به طور معناداری نسبت به کنترل، درصد سلولهای زنده را کاهش داد. پس از آن اثرات سایتوتوکسیک فرکشن اتردوپترولی در غظتهای بالاتر از 4 میکروگرم در میلیلیتر به طور معناداری باعث کاهش بقای سلولی گردید. این درحالی است که فرکشن آبی حتی تا غلظت 150 میکروگرم در میلیلیتر فاقد اثرات مهاری رشد بود. در مطالعهای که توسط اسماعیلی و همکـاران در
سال 2014 انجام شد، اثرات سایتوتوکسیک عصاره تام جونیپروس و فرکشنهای کلروفرمی، اتردوپترولی و متانولی آن بر روی رده های سلولی MCF-7، HepG-2، MDBK ، A-549 و WEHI-164 توسط آزمون MTT بررسی شد و نشان داد که IC50 فرکشنهای یاد شده به مراتب پایینتر از عصاره تام این گیاه میباشد(13). همچنین در مطالعه دیگری که در ایران انجام شد، اثر سایتوتوکسیک عصاره اتانولی برگ و دانههای دو زیر گونه از گیاه جونیپروس بر روی ردههای سلولی Hela ، KB وMDA-MB-468 بررسی گردید.
نتایج نشان داد غلظتهای بالاتر از 5 میکروگرم در میلیلیتر دارای اثرات سایتوتوکسیک میباشد(11). در مطالعه دیگری، اثر عصاره متانولی و فرکشنهای کلروفرمی و اتردوپترولی این گیاه بر مهار رشد تومور بررسی گردید. نتایج حاصل از آن نشان داد که عصاره متانولی با 86% و فرکشن اتردوپترولی با 46% نسبت به داروی وینکریستین به ترتیب دارای بیشترین و کمترین اثر مهارکنندگی رشد تومور است(14). در مطالعه پیش رو، نتایج به دست آمده از بررسی آپوپتوز سلولی با آزمون فلوسیتومتری نشان داد غلظت 5/2 میکروگرم در میلیلیتر از فرکشن کلروفرمی توانست به طور قابل ملاحظهای (13 برابر) میزان آپوپتوز سلولی را نسبت به گره کنترل افزایش دهد. همان طور که در شکل 1 مشاهده شد، در این غلظت بیش از نیمی از سلولها دچار آپوپتوز شده و مارکرهای انکسینV و PI را بیان کردند که همسو با نتایج آزمون MTT بود. در مطالعه درویشی و همکارانش، اثر آپوپتوتیک عصاره متانولی این گیاه بر روی رده سلولی بررسی گردید. در مطالعه آنها، غلظت 4 میکروگرم در میلیلیتر به عنوان IC50 عصاره متانولی بر روی رده سلولی Nalm-6 و Reh معرفی گردید. آنها نشان دادند که عصاره متانولی جونیپروس اکسلسا با داروی وینکریستین به طور معنادار دارای اثر سینرژی بوده و توانست دوز وینکریستین را در رده سلولی Nalm-6 و Reh کاهش دهد(5).
در بررسیهای انجام شده پیرامون عصاره گیاه جونیپروس اکسلسا، مشخص شد که بیشترین اجزای مولکولی موجود در آن به ترتیب شامل ترکیبات فنولی(mg/g 54/21)، فلاونوئیدها(از عصاره یا فرکشن mg/g 66/19)، تاننها(از عصاره یا فرکشن mg/g 96/17)، آلکالوئیدها (از عصاره یا فرکشن mg/g 23/15) و دیترپنها (از عصاره یا فرکشن mg/g 43/14) میباشد. همچنین این ترکیبات دارای اثرات متعدد بر فرآیندهای حیاتی سلول از جمله متابولیسم، چرخه سلولی، آپوپتوز و ایجاد ترکیبات آنتیاکسیدانی است. با توجه به حلالهای متنوع مورد استفاده در فرآیند فرکشنگیری از عصارههای گیاهی، مولکولهای مختلف از نظر قطبیت و ویژگیهای ساختاری در طی این پروسه، جداسازی میشوند. طبق مطالعههای انجام شده بر روی ترکیبات موجود در فرکشنها و عصاره J.excelsa ، آلکالوئیدها در فرکشن اتردوپترولی وجود ندارند. از آنجا که ترکیبات آلکالوئیدی به شدت دارای خاصیت آنتیپرولیفراتیو هستند، از این رو به نظر میرسد علت اختلاف موجود در میزان سایتوتوکسیسیتی بین فرکشن کلروفرمی و اتردوپترولی مربوط به وجود آلکالوئیدها در فرکشن کلروفرمی باشد(15، 14). از جمله دیگر ترکیبات ثانویه موجود در این گیاه میتوان به پودوفیلوتوکسین و دئوکسی پودوفیلوتوکسین اشاره کرد که خواص ضد تومورال آن به اثبات رسیده است(16). در مطالعه اوچ و همکارانش، گیاه J.excelsa به عنوان منبع غنی از این ترکیبات محسوب شده اثرات کشندگی آن بر
ردههای سلولیJ 45.01 ، CEM-C1و CCRF-CEM بررسی گردید و نشان دادند که بین میزان پودوفیلوتوکسین و دئوکسی پودوفیلوتوکسین و اثرات کشندگی این گیاه رابطه معناداری وجود دارد(10). ساب و همکاران در بررسی انجام شده بین دو رده سلولی حساس به دارو CCRF-CE و مقاوم به دارو CEM/ADR5000 نسبت به روغن گیاه J.excelsa ، نشان دادند هیچ مقاومت دارویی نسبت به روغن استخراج شده از این گیاه مشاهده نشد(17).
نتیجهگیری
در مطالعه حاضر، برای اولین بار اثرات کشندگی فرکشنهای مختلف گیاه J.excelsa بر روی رده سلولی Nalm-6 بررسی شد. بر اساس اختلاف قطبیت متابولیتهای ثانویه، میتوان استنباط کرد که ترکیبات موجود در فرکشنهای کلروفرمی، اتردوپترولی و آبی J.excelsa متفاوت بوده و اساس تفاوت در میزان کشندگی آنها میباشد. پیشنهاد میگردد در مطالعههای بعدی پیرامون این گیاه، مکانیسم ایجاد آپوپتوز توسط فرکشنهای یاد شده در سلولهای سرطانی بررسی شود و ترکیبات ثانویه این گیاه، به عنوان پایهای برای ساخت ترکیبات جدید ضد سرطان مورد استفاده قرار گیرد.
متن کامل: (2062 مشاهده)
اثر آپوپتوتیک و آنتیپرولیفراتیو فرکشن های گیاه Juniperus excelsa بر روی
رده سلولی لوسمی لنفوبلاستیک حاد(Nalm-6)
لیلا نورآذر1، سمیه اسماعیلی2، پرگل مشاتی1، احمد قرهباغیان3، سینا سالاری4
چکیده
سابقه و هدف
لوسمی لنفوبلاستی حاد، از بدخیمیهای خونی رده لنفوئیدی میباشد. عوارض جانبی داروهای شیمی درمانی که از ابتدا در درمان سرطان مورد توجه بودند، علت گرایش به سمت داروهای گیاهی بودند. مطالعههای گذشته بر روی گیاه جونیپروس اکسلسا حاکی از وجود خاصیت ضد سرطانی بر روی برخی ردههای سلولی سرطانی بود. هدف از این مطالعه، بررسی اثرات کشندگی و انتخاب فرکشن توکسیکترگیاه جونیپروس اکسلسا بر روی رده سلولی ALL (Nalm-6) و سلولهای طبیعی PBMC بود.
مواد و روشها
در یک مطالعه تجربی، میزان سیتوتوکسیسیتی فرکشنها از طریق آزمونهای زندهمانی سلولی و فعالیت متابولیک ارزیابی شد. با استفاده از این دو آزمون، فرکشن توکسیکتر انتخاب گشته و سپس میزان آپوپتوز سلولی به روش رنگآمیزی آنکسین V و پروپیدیوم یدید به کمک فلوسیتومتری برای آن محاسبه شد. هر آزمون سه بار تکرار گردید. از آزمون one-way ANOVA و 23 SPSS برای آنالیز آماری دادهها استفاده شد.
یافتهها
یافتهها نشان داد که دوز µg/mL 5/2 و µg/mL 4 به ترتیب فرکشن کلروفرمی و اتردوپترولی گیاه جونیپروس، بدون تاثیر معنادار بر سلولهای PBMC ، درصد زندهمانی و فعالیت متابولیک سلولهای Nalm-6 را به طور معنادار کاهش داد(01/0 p<). فرکشن آبی آن فاقد اثرات سیتوتوکسیک بود. با این آزمونها، فرکشن توکسیکتر کلروفرمی انتخاب شد. آپوپتوز سلولهای Nalm-6 با فرکشن کلروفرمی توسط فلوسیتومتری، افزایش حدود 13 برابری در مقایسه با گروه تیمار نشده نشان داد(001/0 p<).
نتیجه گیری
نتایج حاصل از این مطالعه نشان داد فرکشن کلروفرمی و اتردوپترولی گیاه جونیپروس، دارای خاصیت کشندگی و آنتیپرولیفراتیو بوده و سلولهای Nalm-6 را وارد چرخه آپوپتوز میکند.
کلمات کلیدی: لوسمی لنفوبلاستیک حاد، آپوپتوز، جونیپروس
تاریخ دریافت: 16/4/99
تاریخ پذیرش: 25/5/99
1- دانشجوی کارشناسی ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- PhD فارماکوگنوزی ـ دانشیار گروه داروسازی سنتی ـ مرکز تحقیقات طب سنتی و مفردات پزشکی ـ دانشکده طب سنتی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
3- PhD ایمونوهماتولوژی بالینی ـ استاد دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای خونی مادرزادی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
4- مؤلف مسئول: فوق تخصص خون و سرطان بالغین – استادیار دانشگاه علوم پزشکی شهید بهشتی ـ بیمارستان آیت اله طالقانی - تهران ـ وانجک - ایران-
کدپستی:11151-19857
رده سلولی لوسمی لنفوبلاستیک حاد(Nalm-6)
لیلا نورآذر1، سمیه اسماعیلی2، پرگل مشاتی1، احمد قرهباغیان3، سینا سالاری4
چکیده
سابقه و هدف
لوسمی لنفوبلاستی حاد، از بدخیمیهای خونی رده لنفوئیدی میباشد. عوارض جانبی داروهای شیمی درمانی که از ابتدا در درمان سرطان مورد توجه بودند، علت گرایش به سمت داروهای گیاهی بودند. مطالعههای گذشته بر روی گیاه جونیپروس اکسلسا حاکی از وجود خاصیت ضد سرطانی بر روی برخی ردههای سلولی سرطانی بود. هدف از این مطالعه، بررسی اثرات کشندگی و انتخاب فرکشن توکسیکترگیاه جونیپروس اکسلسا بر روی رده سلولی ALL (Nalm-6) و سلولهای طبیعی PBMC بود.
مواد و روشها
در یک مطالعه تجربی، میزان سیتوتوکسیسیتی فرکشنها از طریق آزمونهای زندهمانی سلولی و فعالیت متابولیک ارزیابی شد. با استفاده از این دو آزمون، فرکشن توکسیکتر انتخاب گشته و سپس میزان آپوپتوز سلولی به روش رنگآمیزی آنکسین V و پروپیدیوم یدید به کمک فلوسیتومتری برای آن محاسبه شد. هر آزمون سه بار تکرار گردید. از آزمون one-way ANOVA و 23 SPSS برای آنالیز آماری دادهها استفاده شد.
یافتهها
یافتهها نشان داد که دوز µg/mL 5/2 و µg/mL 4 به ترتیب فرکشن کلروفرمی و اتردوپترولی گیاه جونیپروس، بدون تاثیر معنادار بر سلولهای PBMC ، درصد زندهمانی و فعالیت متابولیک سلولهای Nalm-6 را به طور معنادار کاهش داد(01/0 p<). فرکشن آبی آن فاقد اثرات سیتوتوکسیک بود. با این آزمونها، فرکشن توکسیکتر کلروفرمی انتخاب شد. آپوپتوز سلولهای Nalm-6 با فرکشن کلروفرمی توسط فلوسیتومتری، افزایش حدود 13 برابری در مقایسه با گروه تیمار نشده نشان داد(001/0 p<).
نتیجه گیری
نتایج حاصل از این مطالعه نشان داد فرکشن کلروفرمی و اتردوپترولی گیاه جونیپروس، دارای خاصیت کشندگی و آنتیپرولیفراتیو بوده و سلولهای Nalm-6 را وارد چرخه آپوپتوز میکند.
کلمات کلیدی: لوسمی لنفوبلاستیک حاد، آپوپتوز، جونیپروس
تاریخ دریافت: 16/4/99
تاریخ پذیرش: 25/5/99
1- دانشجوی کارشناسی ارشد خونشناسی آزمایشگاهی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- PhD فارماکوگنوزی ـ دانشیار گروه داروسازی سنتی ـ مرکز تحقیقات طب سنتی و مفردات پزشکی ـ دانشکده طب سنتی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
3- PhD ایمونوهماتولوژی بالینی ـ استاد دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای خونی مادرزادی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
4- مؤلف مسئول: فوق تخصص خون و سرطان بالغین – استادیار دانشگاه علوم پزشکی شهید بهشتی ـ بیمارستان آیت اله طالقانی - تهران ـ وانجک - ایران-
کدپستی:11151-19857
مقدمه
لوسمی لنفوبلاستی حاد(ALL)، یکی از انواع بدخیمیهای خونی است که با تکثیر پیشسازهای لنفوئیدی در مغز استخوان همراه میباشد که تواماً کودکان و بزرگسالان را درگیر میکند. سالانه به طور تقریبی، 6000 مورد ابتلا به این سرطان در ایالت متحده امریکا گزارش میشود که بیشترین رنج سنی بیماران بین کودکان و نوجوانان است(1). دو گروه سنی کودکان زیر 15 سال و افراد بالای 50 سال در این لوسمی بیشترین ابتلا را دارند و شایعترین پیک سنی درگیر در ALL کودکان، بین 2 تا 5 سال میباشد(2). این بدخیمی در کودکان با پیشآگهی مطلوب همراه است اما در بزرگسالان به صورت یک بیماری کشنده بروز مییابد(3). از شایعترین علائم ALL میتوان به کبودی یا خونریزی ناشی از ترومبوسیتوپنی، خستگی و رنگ پریدگی ناشی از کم خونی و عفونت ناشی از نوتروپنی اشاره کرد. در تشخیص ALL ، ارتشاح سلولهای لوسمی به کبد، طحال، غدد لنفاوی و مدیاستن و ایجاد لنفادنوپاتی کمک کننده است (1). پیشرفت مداوم در توسعه درمانهای مؤثر باعث شده است که میزان بهبودی در کودکان به بیش از 80% افزایش یابد و رویکردهای نوینی در جهت افزایش بقای عاری از سرطان ایجاد شود که به موجب آن شاهد کاهش عواض داروهای شیمی درمانی خواهیم بود(4). همانطور که میدانیم عوارض جانبی داروهای شیمی درمانی سرکوب شدید سیستم ایمنی، پوکی استخوان، نوروتوکسیسیتی و غیره، از محدودیتهای این درمان است. از آنجا که داروهای گیاهی به علت داشتن منشأ طبیعی در مقایسه با داروهای شیمیایی دارای عوارض جانبی کمتری بوده و به دلیل این که با ارگانیسم زنده از جمله بدن انسان سازگاری بیشتری دارند، تمایل به مصرف آنها رو به افزایش است و اکنون نیز به عنوان منبع مکملی برای داروهای شیمی درمانی مورد توجه هستند(5). اخیراً به کارگیری داروهای گیاهی در زمینه بهبود سرطان مورد توجه محققان قـرار گرفتهاند. شناخت ترکیبات مؤثره در این گیاهان و جداسازی، تخلیص و به کارگیری آنها در زمینه تحقیقات سرطان نشان داده است که این ترکیبات قادرند باعـث مهار رشد و
القای آپوپتوز شده در نهایت منجر به مرگ سلول سرطانی شوند. با نظر به این که داروهایی با پایه گیاهی تاثیرگذاری و پایداری بیشتر و عوارض جانبی کمتر و همچنین از لحاظ چرخه تولید، صرفه اقتصادی بالاتری نسبت به داروهای سنتتیک دارند، تمایل بیشتری در مصرف داروهای گیاهی به عنوان مکمل یا جایگزین داروهای سنتتیک در بین جوامع مختلف مشاهده میشود(6). امروزه، حدوداً 55% از داروهایی که به عنوان ضد سرطان در بالین بیمار مورد استفاده قرار میگیرد، از منابع گیاهی به دست آمده است(7). گیاه جونیپروس اکسلسا(Juniperus excelsa ; J.excelsa)، یک درخت یا درختچهای همیشه سبز از خانواده کوپرساسیا(Cupressaceae) است که در کشورهای ناحیه بالکان، ترکیه، سوریه، لبنان، گرجستان، دامنه قفقاز و قسمت شرقی ایران وجود دارد و فرمهای اصلاح شده متعددی از آن در ایران کاشته میشود که مردم محلی، آن را با نام ارس یا اردوج میشناسند(8). جونیپروس یک گیاه دارویی است که در گذشته برای درمان قاعدگی دردناک، سرفه و برونشیت مورد استفاده قرار میگرفت. همچنین فعالیت ضد میکروبی متعددی در میوه و برگهای این گیاه علیه برخی پاتوژنها مورد بررسی قرار گرفته است(9، 8). مطالعههای اخیر در مورد ترکیبات با منبع پودوفیلوتوکسین و دئوکسی پودوفیلوتوکسین موجود در عصاره برگ این گیاه نشان داد که این ترکیبات، خاصیت سیتوتوکسیک بر علیه سلولهای سرطانی از خود نشان میدهند(10). اثرات سیتوتوکسیک این عصاره بر روی ردههای سلولی مربوط به تومورهای جامد مانند رده سلولی Hela نیز در مقالهای مشابه به اثبات رسیده است(11). در مطالعه مشابه، عصاره تام جونیپروس اکسلسا، آپوپتوز را در سلولهای سرطانی رده لنفوبلاستی Reh و Nalm-6 القا کرد و همچنین توانست با اثر سینرژی، دوز داروی شیمیدرمانی وین کریستین را در این دو رده سلولی کاهش دهد(5). از طرف دیگر برخی از مطالعهها تایید کردهاند که میتوان از این عصاره به عنوان یک ماده نگهدارنده مواد غذایی استفاده کرد، چرا که خاصیت ضد میکروبی داشته و بر روی بدن انسان تاثیر سوء نخواهد گذاشت(12). در این مطالعه رده سلولی Nalm-6 که الگویی از لوسمی ALL است، به دلیل شیوع بیشتر در بین کودکان و پیش آگهی ضعیف آن در بزرگسالان، به عنوان رده سلولی مورد مطالعه برگزیده شد و برای اولین بار اثرات کشندگی سه فرکشن نامبرده گیاه فوق به طور خاص برروی رده سلولی Nalm-6 و سلولهای طبیعی تک هستهای خون فرد سالم(PBMC) مورد بررسی قرار گرفت.
مواد و روشها
1- آمادهسازی عصاره:
در یک مطالعه تجربی، 30 گرم از پودر گیاه خشک به نسبت 1 به 10 با حلال غیر قطبی پترولیوم اتر مخلوط شد. مخلوط ایجاد شده پس از 24 ساعت قرارگیری بر روی شیکر، صاف و فرکشن به دست آمده با روتاری تغلیظ یافت. پس از خشک شدن کامل نمونه تغلیظ شده در زیر هود شیمیایی، فرکشن خشک اتردوپترولی حاصل شد. در ادامه با افزودن حلال کلروفرم با نسبت 1 به 10 به باقیمانده خشک شده گیاه از مرحله قبل و تکرار فرآیند شرح داده شده، فرکشن کلروفرمی به دست آمد. از افزودن حلال متانولی به باقیمانده خشک، فرکشن متانولی استخراج گردید. در انتها با افزودن آب به عنوان حلال قطبی، عصاره آبی حاصل شد که با استفاده از دستگاه فریزدرایر، فرکشن خشک آبی استخراج شد. فرکشنهای به دست آمده تا زمان استفاده در دمای 4 درجه سانتیگراد نگهداری شد. تمامی مراحل استخراج فرکشنها در مرکز تحقیقات طب سنتی و مفردات پزشکی دانشگاه علوم پزشکی شهید بهشتی و زیر نظر متخصص فارماکوگنوزی انجام گرفت. به منظور تهیه ذخیره اولیه از فرکشنها، 20 میلیگرم از هر یک از فرکشنهای خشک درون ویال، با استفاده از ترازوی دیجیتال وزن شد و به استثنای فرکشن آبی، 1 میلیلیتر از DMSO به عنوان حلال استفاده گردید. از محیط کشت RPMI به عنوان حلال برای فرکشن آبی استفاده شد. غلظت نهایی استوک فرکشنها 20 میلیگرم در میلیلیتر بود و تا زمان تیمار سلولها با غلظتهای مورد نظر، در فریزر 20- درجه سانتیگراد نگهداری گردید. محیط کشت RPMI برای رقیقسازی فرکشنها از استوک اولیه استفاده شد و غلظت نهایی DMSO در غلظتهای مورد مطالعه به زیر 01/0 رسید و نیازی به کنترل DMSO نبود. مخلوط حاضر را به مدت 24 ساعت روی شیکر قرار داده و پس از طی این مدت، نمونه را با کاغذ صافی و قیف صاف کرده و حجم مایع به دست آمده را با روتاری کم نمودیم. پس از آن نمونه تغلیظ شده را درون ویال وزن شده ریخته و منتظر خشک شدن کامل آن شدیم که فرکشن حاصل از آن، فرکشن اتردوپترولی است. سپس ویال محتوی تفاله گیاه را وزن کرده و از اختلاف وزن نمونه خشک شده و ویال وزن شده، وزن تفاله خشک به دست میآمد. آن را زیر هود به نسبت 1 به 10 با حلال کلروفرم مخلوط نمودیم. 24 ساعت روی شیکر قرار داده و سپس مانند مرحله قبل آن را صاف کردیم. مایع صاف شده را تغلیظ کرده و زیر هود خشک نمودیم که فرکشن کلروفرمی از آن به دست آمد. در مرحله بعد، تفاله را با حلال متانول به طریق گفته شده 24 ساعت خیسانده و صاف کردیم. نمونه صاف شده را تغلیظ کرده و به عنوان فرکشن متانولی استفاده نمودیم. روی تفاله باقیمانده به نسبت 1 به 10 آب ریخته و با قیف بوخنر صاف نمودیم و مایع زیرین آن که فرکشن آبی است، درون ظرف فریزدرایر ریخته و داخل فریزر گذاشتیم.
2- کشت سلولی و تیمار سلولها:
مطالعه انجام شده از نوع تجربی بود و بدین منظور از رده سلولی Nalm-6 مربوط به لوسمی لنفوبلاستیک حاد استفاده شد. همچنین سلولهایPBMC به عنوان سلولهای تک هستهای خونی طبیعی و کنترل، برای ارزیابی عدم تاثیر دارو بر سلولهای خونی مورد استفاده قرار داده شد. رده سلولی Nalm-6از بانک سلولی انستیتو پاستور ایران (تهران، ایران) تهیه شد. به منظور کشت سلولی، ابتدا مراحل یخزدایی سلولها از تانک ازت انجام شد. سپس سلولها در محیط RPMI 1640 (آمریکا، جیبکو) حاوی10% FBS و 1% پنیسیلین - استرپتومایسین کشت داده شدند. فلاسکهای کشت سلولی در انکوباتور 37 درجه سانتیگراد با 5% CO2 انکوبه شدند. برای جداسازی سلولهای PBMC ، مقدار 20 میلیلیتر از خون فرد طبیعی در ضد انعقاد هپارین گرفته شد و به نسبت 1 به 1 با PBS فیلتر شده رقیق گردید. یک سوم حجم نهایی هر فالکون، فایکول ریخته شد و خون رقیق شده به آرامی با سمپلر از کنار دیواره فالکون بر روی فایکول ریخته شد. به دلیل سمی بودن فایکول، باید این مرحله به سرعت انجام گردد. سلولها به همراه فایکول در سانتریفوژ بدون ترمز با دور g 600 به مدت 25 دقیقه سانتریفوژ شدند.
پس از پایان سانتریفوژ، از پایین به بالا شاهد 4 لایه سلولی شامل گلبولهای قرمز، گرانولوسیتها، فایکول، سلولهای PBMC و در نهایت پلاسما هستیم. لایه پلاسما با سمپلر به آرامی دور ریخته شد. سلولهای PBMC که لایه ابر مانندی را تشکیل داده بودند، توسط پیپت پاستور استریل به یک فالکون تمیز منتقل و جهت شست و شو و خروج فایکول به آن PBS فیلتر شده اضافه شد. سلولها با دور g350 به مدت 5 دقیقه سانتریفوژ شدند. این کار سه مرتبه تکرار گردید. در مرحله آخر پس از خروج مایع رویی، محیط کشت RPMI به همراه FBS و آنتیبیوتیک اضافه شد و در پلیت 6 خانه کشت در انکوباتور 37 درجه سانتیگراد با 5% CO2 انکوبه گردید. بعد از این که سلولها به قدر کافی رشد کردند، سلولهای Nalm-6 و PBMC با غلظتهای مختلف از فرکشن کلروفرمی، اتردوپترولی و آبی به مدت 24 و 48 ساعت تیمار شدند. غلظتهای مختلف عصاره ها با استفاده از محیط کشت استریل رقیق سازی و تهیه شد و تمامـی آزمایـشها بـرای افـزایش دقـت کار سه بار تکرار گردید.
3- رنگآمیزی تریپانبلو:
برای شمارش سلولهای زنده جهت بررسی میزان بقا و
تکثیر سلولهای تیمار شده نسبت به کنترل، از رنگآمیزی تریپان بلو و لام هموسیتومتر(نئوبار) استفاده شد. پس از 24 و 48 ساعت از کشت سلولها با غلظتهای ذکر شده از فرکشنهای کلروفرمی، اتردوپترولی و آبی گیاه جونیپروس اکسلسا در چاهکهای پلیت 24 خانه، رنگ تریپانبلو به نسبت 1 به 1 به محیط موجود در چاهکها اضافه شد و پس از 5-3 دقیقه زیر میکروسکوپ بررسی گردید. اساس این آزمایش بدین ترتیب است که سلولهای زنده نسبت به ورود رنگ تریپانبلو نفوذ ناپذیر میباشند، در حالی که سلولهای مرده رنگ را جذب مینمایند. میزان زندهمانی سلولهای زنده با فرمول زیر محاسبه شد.
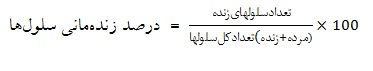
4- آزمون MTT به منظور سنجش فعالیت متابولیک :
برای سنجش تاثیر عصارههای کلروفرمی، اتردوپترولی و آبی گیاه جونیپروس اکسلسا بر میزان فعالیـت متابولیک، سلولهای لوسمیک Nalm-6 و طبیعی PBMC با دوزهای مختلف از فرکشنها در چاهکهای پلیت 96 خانه تیمار شدند. پس از 24 و 48 ساعت انکوباسیون در انکوباتور 37 درجه سانتیگراد و 5% CO2 ، به سلولهای داخل هر چاهک 10میکرولیتر محلول MTT (4,5 dimethyl diphenyl tetrazolium bromide) با غلظت mg/mL 5 اضافه شد و پلیت مجدداً به مدت 3 ساعت در انکوباتور قرار گرفت. در طی زمان انکوباسیون، رنگ تترازولیوم موجود در محلول MTT به وسیله آنزیم سوکسینات دهیدروژناز احیا میشود. احیا و شکسته شدن این رنگ موجب تولید کریستالهای آبی رنگ فورمازان میشود. میزان رنگ تولید شده با تعداد سلولهایی که از نظر فعالیت متابولیک فعال هستند (سلولهای زنده) رابطه مستقیم دارد.
در ادامه پلیت با دور g 2000 به مدت 15 دقیقه سانتریفوژ شده و پس از خالی کردن محلول رویی، 100 میکرولیتـر حـلال DMSO بـرای حــل رسوب رنگی فورمازان ایجاد شده که نامحلول در آب هستند به هر چاهک اضافه شد و جذب نوری چاهکها با استفاده از دستگاه رنگ سنجی EISA-reader در طول موج 570 نانومتر قرائت گردید.

درصد فعالیت متابولیک سلولها طبق فرمول بالا محاسبه گردید.
5- آزمـون فلـوسیتومتری بـه منظور سنجش میزان آپوپتوز:
به منظور تایید آپوپتوز در سلولهای لوسمیک تحت تاثیر فرکشنهای جونیپروس اکسلسا، از آزمون فلوسیتومتری انکسین PI/V استفاده شد. ابتدا سلولها در محیط RPMI حاوی FBS 10% در انکوباتور 37 درجه سانتیگراد حاوی 5% CO2 به منظور دسترسی به تعداد مورد نظر از سلولها، کشت شدند. طبق دستورالعمل کیت (Annexin V Apoptosis Detection Kit FITC ، بیوساینس) برای هر آزمون به 105×3 سلول در هر میلیلیتر نیاز است. سلولها در پلیت 6 خانه با غلظتهای 5/1 تا 5/2 میکروگرم در میلیلیتر عصاره کلروفرمی جونیپروس اکسلسا به مدت 48 ساعت تیمار شدند. و همچنین2 نانوگرم در میلیلیتر داروی وین کریستین تیمار و به مدت 48 ساعت انکوبه شدند.
بعد از انکوباسیون، سلولها به فالکون منتقل شده و سانتریفوژ شدند و مایع رویی آن دور ریخته شد. رسوب سلولی پس از یک بار شستشو با PBS ، با 500 میکرولیتر از بافر باند کننده X 1 مواجه شد. در ادامه 5 میکرولیتر انکسین V به نمونه ها اضافه شد و پس از 10 دقیقه انکوباسیون در تاریکی، این بار 5 میکرولیتر رنگ PI (Propidium Iodide) اضافه و مجدداً 10 دقیقه انکوبه شد. سپس نمونهها به ویالهای مربوط به فلوسیتومتری منتقل شدند و میزان خروج فسفاتیدیل سرین در سطح سلولها توسط دستگاه فلوسیتومتری مورد سنجش قرار گرفت و نتایج توسط نرمافزار FlowJo 7.6.1 آنالیز شد.
یافتهها
اثر فرکشنهای کلروفرمی، اتردوپترولی و آبی گیاه J.excelsa بر روی شاخص زندهمانی سلولهای Nalm-6 و PBMC :
نتایـج آزمایـش زندهمانی سلولی پس از24 و 48 ساعت
از تیمار سلولها با فرکشنهای یاد شده از گیاه جونیپروس اکسلسا، نشان داد که غلظت 5/2 و 3 میکروگرم در میلیلیتر از فرکشن کلروفرمی پس از 48 ساعت نسبت به گروه کنترل (تیمار نشده)، میزان زندهمانی سلولی را به طور قابل ملاحظهای کاهش داد. در فرکشن اتردوپترولی کاهش معنادار درصد سلولهای زنده پس از 48 ساعت در غلظت 4 و 5 میکروگرم در میلیلیتر نسبت به گروه کنترل رخ داد در حالیکه فرکشن آبی فاقد اثرات سایتوتوکسیک قابل مشاهده در بازه غلظتی مورد آزمایش بود.
همچنین سلولهای PBMC به عنوان سلولهای طبیعی خونی در تیمار با فرکشنهای ذکر شده، کاهش معناداری در میزان زندهمانی سلولی نشان ندادند. پس از مشاهده تاثیرات فرکشنها بر شاخص زندهمانی سلولی، به دلیل بیاثر بودن فرکشن آبی بر سلولهای Nalm-6 در غلظتهای 50 تا 150 میکروگرم در میلیلیتر، این عصاره در ادامه برای آزمونهای بیشتر از مطالعه خارج شد(نمودار 1).
اثر فرکشنهای کلروفرمی و اتردوپترولی بر فعالیت متابولیک سلولهای Nalm-6 وPBMC :
نتایج حاصل از بررسی فعالیت متابولیکی سلول با روش MTT نشان داد که پس از 48 ساعت از تیمار سلولهای Nalm-6 با فرکشن کلروفرمی و اتردوپترولی گیاه جونیپروس، به صورت وابسته به دوز و زمان کاهش معناداری در فعالیت متابولیکی سلولها نسبت به گروه کنترل (تیمار نشده) رخ داد. بدین ترتیب که در فرکشن کلروفرمی با شروع افزایش غلظت از 2 میکروگرم در میلیلیتر بین دو گروه تیمار 24 ساعت و 48 ساعت، اختلاف معنادار در درصد فعالیت متابولیک سلولها مشاهده شد. همچنین طبق نتایج آزمون MTT ، دوز IC50 فرکشن کلروفرمی پس از 48 ساعت تیمار سلولی که حداقل 50% از سلولها در آن زنده هستند، 5/2 میکروگرم در میلیلیتر محاسبه گردید. فرکشن اتردوپترولی نیز با افزایش غلظت از 4 میکروگـرم در میلـیلیـتر در دو گـروه زمانی ذکر شده، اختلاف معنادار در درصد فعالیت متابولیک سلولها را نشان داد. طبق این آزمون، دوز IC50 فرکشن اتردوپترولی نیز 4 میکروگرم در میلیلیتر محاسبه شد. سلولهای PBMC با غلظتهای ذکر شده با این فرکشنها تیمار شد و کاهش مختصری در فعالیت متابولیک سلولی گزارش گردید که معنادار نبـود(نمودار 2).

نمودار 1: تاثیر فرکشنهای کلروفرمی، اتردوپترولی و آبی گیاه J.excelsa بر شاخص زندهمانی سلولهای لوسمیک Nalm-6 و سلولهای PBMC (*بیانگر 05/0 p< ، ** بیانگر 01/0 p< و *** بیانگر 001/0 p<).

نمودار 2: بررسی و مقایسه میزان فعالیت متابولیک سلولهای لوسمیک Nalm-6 و سلولهای PBMC پس از تیمارهای 24 و 48 ساعت با فرکشنهای کلروفرمی، اتردوپترولی و آبی گیاه J.excelsa (*بیانگر 05/0 p< ، ** بیانگر 01/0 p< و *** بیانگر 001/0 p<).

شکل 1: بررسی میزان آپوپتوز سلولهای Nalm-6 توسط آزمون فلوسیتومتری پس از 48 ساعت با دوزهای 5/1 تا 5/2 میکروگرم در میلیلیتر از فرکشن کلروفرمی گیاه J.excelsa
بررسی آپوپتوز با روش فلوسیتومتری انکسین PI/V :
نتایج حاصل از آنالیز فلوسیتومتری آپوپتوز سلولی نشان داد که فرکشن کلروفرمی گیاه جونیپروس، قادر به افزایش قابل توجه آپوپتوز در سلولهای Nalm-6 به صورت وابسته به دوز میشود. درصد سلولهای انکسین V مثبت طی تیمار با غلظت 5/2 میکروگرم در میلیلیتر فرکشن کلروفرمی از 1 درصد در سلولهای کنترل، به 10 درصد در سلولهای تیمار شده افزایش یافت. همچنین درصد سلولهایی که هر دو مارکر انکسینV و PI را مثبت نشان دادند از 3 درصد در سلولهای گروه کنترل، به 41 درصد در سلولهای تیمار شده با غلظت 5/2 میکروگرم در میلیلیتر از این فرکشن افزایش یافت(شکل 1).
آزمونهای آماری:
دادههای مطالعه با کمک نرمافزار 23SPSS آنالیز شد. برای ارزیابی اختلاف آماری بین گروههای مورد مطالعه (تیمار شده و کنترل) از آزمونone-way-ANOVA استفاده شد و از 05/0 p< برای معناداری آزمونها استفاده گردید. همچنین 01/0 p< و 001/0 p< به ترتیب نشانگر میزان معناداری بیشتر نسبت به گروه کنترل بودند.
بحث
لوسمی لنفوبلاستیک حاد(ALL) در دسته شایعترین گروه لوسمیها قرار دارد و به طور میانگین سالانه حدود 30% از بدخیمیهای کودکان را به خود اختصاص میدهد. نتایج مطالعه حاضر بر روی فرکشنهای مختلف گیاه جونیپروس نشان از اثر مهاری رشد بر روی رده سلولی Nalm-6 داشت. یافتههای به دست آمده از آزمون زندهمانی و فعالیت متابولیک سلولی نشان داد که در فرکشن کلروفرمی، دوزهای 5/2 میکروگرم در میلیلیتر به بالا پس از 48 ساعت به طور معناداری نسبت به کنترل، درصد سلولهای زنده را کاهش داد. پس از آن اثرات سایتوتوکسیک فرکشن اتردوپترولی در غظتهای بالاتر از 4 میکروگرم در میلیلیتر به طور معناداری باعث کاهش بقای سلولی گردید. این درحالی است که فرکشن آبی حتی تا غلظت 150 میکروگرم در میلیلیتر فاقد اثرات مهاری رشد بود. در مطالعهای که توسط اسماعیلی و همکـاران در
سال 2014 انجام شد، اثرات سایتوتوکسیک عصاره تام جونیپروس و فرکشنهای کلروفرمی، اتردوپترولی و متانولی آن بر روی رده های سلولی MCF-7، HepG-2، MDBK ، A-549 و WEHI-164 توسط آزمون MTT بررسی شد و نشان داد که IC50 فرکشنهای یاد شده به مراتب پایینتر از عصاره تام این گیاه میباشد(13). همچنین در مطالعه دیگری که در ایران انجام شد، اثر سایتوتوکسیک عصاره اتانولی برگ و دانههای دو زیر گونه از گیاه جونیپروس بر روی ردههای سلولی Hela ، KB وMDA-MB-468 بررسی گردید.
نتایج نشان داد غلظتهای بالاتر از 5 میکروگرم در میلیلیتر دارای اثرات سایتوتوکسیک میباشد(11). در مطالعه دیگری، اثر عصاره متانولی و فرکشنهای کلروفرمی و اتردوپترولی این گیاه بر مهار رشد تومور بررسی گردید. نتایج حاصل از آن نشان داد که عصاره متانولی با 86% و فرکشن اتردوپترولی با 46% نسبت به داروی وینکریستین به ترتیب دارای بیشترین و کمترین اثر مهارکنندگی رشد تومور است(14). در مطالعه پیش رو، نتایج به دست آمده از بررسی آپوپتوز سلولی با آزمون فلوسیتومتری نشان داد غلظت 5/2 میکروگرم در میلیلیتر از فرکشن کلروفرمی توانست به طور قابل ملاحظهای (13 برابر) میزان آپوپتوز سلولی را نسبت به گره کنترل افزایش دهد. همان طور که در شکل 1 مشاهده شد، در این غلظت بیش از نیمی از سلولها دچار آپوپتوز شده و مارکرهای انکسینV و PI را بیان کردند که همسو با نتایج آزمون MTT بود. در مطالعه درویشی و همکارانش، اثر آپوپتوتیک عصاره متانولی این گیاه بر روی رده سلولی بررسی گردید. در مطالعه آنها، غلظت 4 میکروگرم در میلیلیتر به عنوان IC50 عصاره متانولی بر روی رده سلولی Nalm-6 و Reh معرفی گردید. آنها نشان دادند که عصاره متانولی جونیپروس اکسلسا با داروی وینکریستین به طور معنادار دارای اثر سینرژی بوده و توانست دوز وینکریستین را در رده سلولی Nalm-6 و Reh کاهش دهد(5).
در بررسیهای انجام شده پیرامون عصاره گیاه جونیپروس اکسلسا، مشخص شد که بیشترین اجزای مولکولی موجود در آن به ترتیب شامل ترکیبات فنولی(mg/g 54/21)، فلاونوئیدها(از عصاره یا فرکشن mg/g 66/19)، تاننها(از عصاره یا فرکشن mg/g 96/17)، آلکالوئیدها (از عصاره یا فرکشن mg/g 23/15) و دیترپنها (از عصاره یا فرکشن mg/g 43/14) میباشد. همچنین این ترکیبات دارای اثرات متعدد بر فرآیندهای حیاتی سلول از جمله متابولیسم، چرخه سلولی، آپوپتوز و ایجاد ترکیبات آنتیاکسیدانی است. با توجه به حلالهای متنوع مورد استفاده در فرآیند فرکشنگیری از عصارههای گیاهی، مولکولهای مختلف از نظر قطبیت و ویژگیهای ساختاری در طی این پروسه، جداسازی میشوند. طبق مطالعههای انجام شده بر روی ترکیبات موجود در فرکشنها و عصاره J.excelsa ، آلکالوئیدها در فرکشن اتردوپترولی وجود ندارند. از آنجا که ترکیبات آلکالوئیدی به شدت دارای خاصیت آنتیپرولیفراتیو هستند، از این رو به نظر میرسد علت اختلاف موجود در میزان سایتوتوکسیسیتی بین فرکشن کلروفرمی و اتردوپترولی مربوط به وجود آلکالوئیدها در فرکشن کلروفرمی باشد(15، 14). از جمله دیگر ترکیبات ثانویه موجود در این گیاه میتوان به پودوفیلوتوکسین و دئوکسی پودوفیلوتوکسین اشاره کرد که خواص ضد تومورال آن به اثبات رسیده است(16). در مطالعه اوچ و همکارانش، گیاه J.excelsa به عنوان منبع غنی از این ترکیبات محسوب شده اثرات کشندگی آن بر
ردههای سلولیJ 45.01 ، CEM-C1و CCRF-CEM بررسی گردید و نشان دادند که بین میزان پودوفیلوتوکسین و دئوکسی پودوفیلوتوکسین و اثرات کشندگی این گیاه رابطه معناداری وجود دارد(10). ساب و همکاران در بررسی انجام شده بین دو رده سلولی حساس به دارو CCRF-CE و مقاوم به دارو CEM/ADR5000 نسبت به روغن گیاه J.excelsa ، نشان دادند هیچ مقاومت دارویی نسبت به روغن استخراج شده از این گیاه مشاهده نشد(17).
نتیجهگیری
در مطالعه حاضر، برای اولین بار اثرات کشندگی فرکشنهای مختلف گیاه J.excelsa بر روی رده سلولی Nalm-6 بررسی شد. بر اساس اختلاف قطبیت متابولیتهای ثانویه، میتوان استنباط کرد که ترکیبات موجود در فرکشنهای کلروفرمی، اتردوپترولی و آبی J.excelsa متفاوت بوده و اساس تفاوت در میزان کشندگی آنها میباشد. پیشنهاد میگردد در مطالعههای بعدی پیرامون این گیاه، مکانیسم ایجاد آپوپتوز توسط فرکشنهای یاد شده در سلولهای سرطانی بررسی شود و ترکیبات ثانویه این گیاه، به عنوان پایهای برای ساخت ترکیبات جدید ضد سرطان مورد استفاده قرار گیرد.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






