جلد 17، شماره 3 - ( پاییز 1399 )
جلد 17 شماره 3 صفحات 178-171 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Naseri Rad M, Mardani A, Naghi A, Shahabi M. Determination of fucosyltransferase 3 gene polymorphisms frequency in Iranian blood donors. bloodj 2020; 17 (3) :171-178
URL: http://bloodjournal.ir/article-1-1311-fa.html
URL: http://bloodjournal.ir/article-1-1311-fa.html
ناصری راد مهشید، مردانی احمد، نقی امیر علی، شهابی مجید. تعیین فراوانی پلیمورفیسمهای ژن فوکوزیل ترانسفراز 3 در اهداکنندگان ایرانی. فصلنامه پژوهشی خون. 1399; 17 (3) :171-178
استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 516 kb]
(1475 دریافت)
| چکیده (HTML) (3385 مشاهده)
مقدمه
تاکنون 36 سیستم گروه خونی که بیش از 300 آنتیژن را در خود جای دادهاند، روی سطح گلبولهای قرمز شناسایی شده است(2، 1). بعضی از این آنتیژنها نقشهای بیولوژیک داشته و بعضی در ارتباط با بیماریها هستند(3). در این میان سیستم گروه خونی- بافتی لوئیس از دو آنتیژن عمده Lea و Leb تشکیل شده که شاخصهای آنها الیگوساکاریدهایی هستند که در اتصال با گلیکوپروتئینها یا گلیکولیپیدها قرار دارند(7-4). آنتیژنهای این سیستم نخستین بار روی گلبولهای قرمز (مورانت – سال 1946) و بعدها در پلاسما، بزاق و دیگر ترشحات یافت شدند(9، 8). در واقع، برخلاف سایر گروههای خونی، ساخت آنتیژنهای لوئیس در بافتهای اریتروئیدی رخ نمیدهد، بلکه این آنتیژنها به صورت ثانویه توسط غشای اریتروسیتها جذب میگردند(10). آنتیژنهای این گروه خونی از نظر بیوشیمیایی با آنتیژنهای سیستم ABH در ارتباط بوده و از همان پیشسازها منشا گرفتهاند(5). بیان آنتیژنهای لوئیس به دو فوکوزیل ترانسفراز مختلف که محصولات دو جایگاه ژنی مجزا(FUT2 و FUT3) روی کروموزوم 19 هستند، نیاز دارد(10). ژن FUT2 ، آنزیم آلفا 2 فوکوزیل ترانسفراز و ژن FUT3 ، آنزیم آلفا 3 و 4 فوکوزیل ترانسفراز را کد میکند. این آنزیمها در روده کوچک، کبد، کلیه و پانکراس فعال بوده و آنتیژنهای گلیکولیپیدی Lea و Leb را با اضافه کردن قند فوکوز به پیشسازهای اولیگوساکاریدی، میسازند. Lea و Leb مستقیما توسط آنزیم FUT3 ساخته میشوند اما برای ساخت Leb ، نیاز است که ابتدا آنزیم FUT2 پیشساز H تیپ 1 را ساخته باشد(11). افراد لوئیس منفی آنتیژنهای لوئیس را نمیسازند و در نتیجه گلبولهای قرمز این افراد با فنوتیپ Le(a-b-) مشخص میشوند(4). فنوتیپ Le(a-b-) در نتیجه حضور آللهای مختلف ژن le که ترانسفرازهای فاقد عملکرد کد میکنند، به وجود میآید. در این حالت صرف نظر از این که فرد سکرتور باشد یا نباشد، آنتیژنهای Lea و Leb بیان نمیشوند. واریانتهای خاموش ژن Lewis(le) یک سری پلیمورفیسمهای تک نوکلئوتیدی(SNPs) را در خود جای دادهاند که بسیاری از آنها باعث غیرفعال شدن آنزیم میشوند. بیش از 37 آلل نول FUT3 گزارش شده است که عمدتاً دارای حداقل دو موتاسیون هستند. بسیاری از آللها توزیع جغرافیایی و نژادی خاصی را نشان میدهند . شایعترین واریانت هاپلوتایپی مربوط به le59/508 است که در آسیاییها(24 درصد) و آفریقاییها (19درصد) شناسایی شده است. در حالی که le202/314 (17 درصد) و le59/1067 (4 درصد) عمدتاً در جمعیتهای اروپایی دیده میشود(5). شیوع بالاتر آسم برونشیال و دیابت ملیتوس غیر وابسته به انسولین در افرادی با گروه خونی Le(a-b-) مطرح شده است. از طرفی این فنوتیپ با شیوع بالاتر بیماریهای قلبی در ارتباط است. تا آن جا که مطالعهها نشان میدهند، چهار موتاسیون 202T>C ، 314C>T ، 508G>A و 1067T>A به طور مشخص با افزایش خطر بیماریهای قلبی ارتباط دارند(12). با توجه به ارتباط ژن لوئیس با برخی حالات پاتولوژیک و همین طور نقشی که در مطالعههای جمعیتشناسی دارد، برای اولین بار در ایران تعیین پلیمورفیسمهای ژن لوئیس با استفاده از روشهای مولکولی PCR و DNA sequencing صورت گرفت. هدف از این مطالعه، شناسایی پلیمورفیسمهای ژن لوئیس، واریانتهای هاپلوتایپی و تعیین فراوانی آنها در جمعیت ایرانی و مقایسه آن با سایر جمعیتها بود.
مواد و روشها
این مطالعه از نوع مقطعی- توصیفی بود و از روش نمونهگیری غیر احتمالی آسان استفاده شد. برای بیان نتایج از روشهای آماری توصیفی استفاده گردید.
اهداکنندگان:
پنج میلیلیتر خون EDTA دار از 100 اهداکننده مراجعهکننده به پایگاه انتقال خون تهران در سال 1396 جمعآوری شد. از تمام شرکتکنندگان در این پژوهش رضایتنامه کتبی اخذ شد.
روش مولکولی:
استخـراج DNA : DNA ژنـومــی از خــون کـامـــل
اهداکنندگان با استفاده از کیت ستونی استخراج شد(کره، GeneAll® ExgeneTM Blood SV min). به منظور ارزیابی کیفیت DNA و آگاهی از میزان خلوص آن، از دستگاه نانودراپ استفاده شد.
روش PCR :
توالی کد کننده آنزیم FUT3 ، بخشی از اگزون 3 این ژن میباشد که از 1086 جفت باز تشکیل شده است(4). تکثیر بخش کد کننده آنزیم FUT3 با استفاده از آغازگر پیشرو [5’- AAT GAC CCT CAC TCC TCT CTC C-3’] و آغازگر پیرو [5’-CCCAGGCAGATGAGGTTCCC-3’] صورت گرفت. برای انجام این روش از غلظت 100-50 نانوگرم DNA ، آغازگرهای مذکور، Master Mix PCR 2x (یکتا تجهیز آزما- ایران) در حجم نهایی 50 میکرولیتر استفاده شد. به جهت حصول به محصول اختصاصی، واکنشهای PCR به صورت Touchdown و به شرح زیر انجام شد: یک چرخه در 95 درجه سانتیگراد به مدت 5 دقیقه، 10 چرخه (در 94 درجه سانتیگراد به مدت 30 ثانیه، در 66 درجه سانتیگراد به مدت 30 ثانیه، در 72 درجه سانتیگراد به مدت 45 ثانیه)، 10 چرخه(در94 درجه سانتیگراد به مدت 10 ثانیه، در 62 درجه سانتیگراد به مدت 30 ثانیه، در 72 درجه سانتیگراد به مدت 45 ثانیه)، 12 چرخه (در94 درجه سانتیگراد به مدت 10 ثانیه، در 59 درجه سانتیگراد به مدت 30 ثانیه، در 72 درجه سانتیگراد به مدت 45 ثانیه) و 1 چرخه در 72 درجه سانتیگراد به مدت 5 دقیقه. محصول حاصل از تکثیر PCR با استفاده از ژل آگارز 5/1% مورد بررسی قرار گرفت.
تعیین توالی:
محصول PCR برای تعیین توالی به شرکت ژن فنآوران (ژن فنآوران، تهران، ایران) ارسال گردید. سپس توالیهای ارسال شده از سوی این شرکت با نرمافزارهای Chromas 2.6.6 و DNA Baser 5.15.0 مورد بررسی قرار گرفتند.
بررسیهاپلوتایپی:
پـس از بـررسی تـوالی نمونههـا، اطلاعات مرتبط با هر
نمونه از جمله SNP های هر نمونه و وضعیت توارث آن (هموزیگوت و یا هتروزیگوت بودن) در فایل اکسل ثبت گردید. سپس SNP های یافت شده در نمونهها با SNPهای از قبل شناسایی شدهی ژن FUT3 که در پایگاه داده NCBI موجود میباشد، مقایسه شد تا در صورت وجود SNP جدید، اقدامات بعدی انجام گیرد. از آن جا که در بین SNPهای موجود در نمونهها مورد جدیدی یافت نشد، از نرمافزار SNPAnalyzer 2.0 برای بررسی هاپلوتایپها و شیوع هاپلوتایپی استفاده گردید.
یافتهها
نتایج تعیین توالی کلیه نمونهها با استفاده از این دو نرمافزار به دقت مورد بررسی قرار گرفت. در مورد هر نمونه وضعیت حضور یا عدم حضور SNP در توالی ژنی و همین طور هموزیگوت یا هتروزیگوت بودن آن ثبت گردید.
جدول 1: پلیمورفیسمهای شناسایی شده و فراوانی آنها در نمونههای اهداکنندگان

جدول 2: هاپلوتایپهای شناسایی شده توسط نرمافزار SNP Analyzer

به طور کلی در این بررسیها، در مجموع هر 100 نمونه، 15 SNP شناسایی گردید. با استفاده از پایگاه داده NCBI، مشخص شد که همه موارد شناسایی شده، در مطالعههای قبلی که در مورد ژن FUT3 در سراسر جهان انجام شده، گزارش گردیده است و از این رو پلیمورفیسم جدیدی شناسایی نشد. پلیمورفیسمهای شناسایی شده در بین نمونهها و تاثیری که روی توالی آمینواسیدی پروتئین کد شده میگذارند در جدول ثبت شده است(جدول 1)(شکلهای 1 و 2).
از مجموع 15 مورد پلیمورفیسم شناسایی شده، 5 مورد مرتبط با موتاسیونهای هم معنی بوده و تغییری در توالی آمینواسیدی آنزیم حاصل ایجاد نمیکنند. از میان این موارد، SNP های 522G>A، 321C>T و 612A>G هر یک تنها در یک نمونه و به صورت منفرد و با توارث هتروزیگوت حضور داشتند. از آن جا که این SNP ها روی فعالیت آنزیم تاثیری نداشته و به صورت منفرد و در عدم حضور موتاسیونهای بیمعنی(non sense) ظاهر شدهاند، در بررسیهای هاپلوتایپی بعدی نادیده گرفته شدند. اما موتاسیونهای 858A>G و 258C>T با وجود این که در توالی آمینواسیدی آنزیم حاصل تاثیری ندارند، ولی به دلیل این که در نمونههایی ظاهر شده بودند که دارای موتاسیونهای بد معنی(missense) بودند، در بررسیهای هاپلوتایپی بعدی لحاظ شدند. نرمافزار SNP Analyzer برای جمعیت مورد مطالعه، 13 نوع هاپلوتایپ مختلف را تخمین زدند(جدول 2).
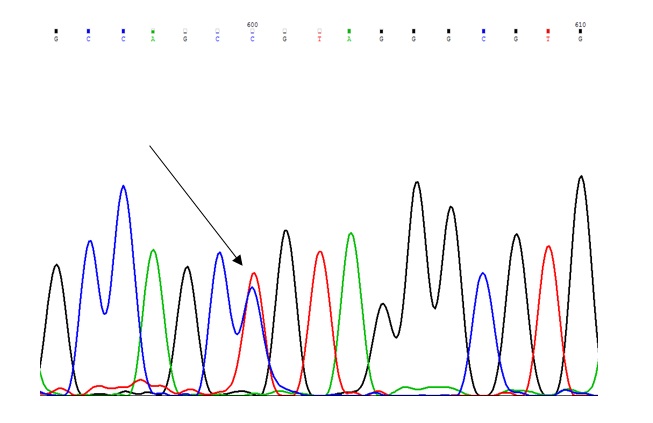
شکل 1: کروماتوگرام مربوط پلیمورفیسم 202T>C که به صورت هتروزیگوس میباشد و با پیکان نمایش داده شده است.

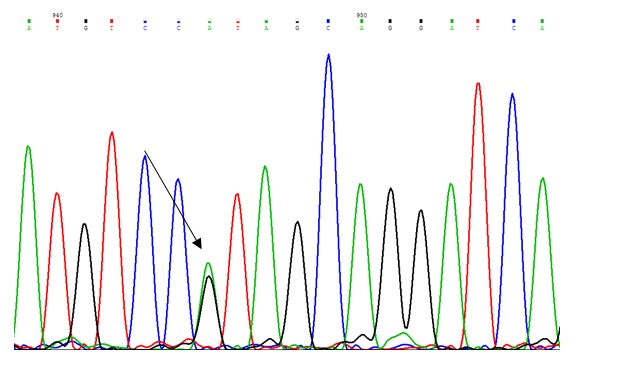
شکل 2 : کروماتوگرام مربوط پلیمورفیسم 508G>A که به صورت هتروزیگوس میباشد و با پیکان نمایش داده شده است.
در گام بعدی هاپلوتایپهای هر نمونه بررسی شده و وضعیت هتروزیگوت یا هموزیگوت بودن افراد تعیین گردید. با انجام این بررسیها مشخص شد که 48% افراد به صورت Le/Le ، 34% به صورت Le/le و 18% نیز le/le هستند.
بحث
در این مطالعه فراوانی آللهای ژن FUT3 در گروهی از اهداکنندگان خون در تهران بررسی شد که در مجموع 15 پلیمورفیسم و 13 هاپلوتایپ شناسائی شد. تمامی این پلیمورفیسمها قبلاً گزارش شده بودند و شایعترین آنها پلیمورفیسم 202T>C بود. شروع مطالعههای مولکولی مرتبط با موتاسیونهای ژن لوئیس به سالهای 1993 و 1994 بر میگردد. در ابتدا موتاسیون 1067T>A در میان اندونزیاییها و موتاسیونهای 1067T>A و 508G>A در میان ژاپنیها شناسایی گردید(13، 9). سپس این موتاسیونها در مطالعههایی که روی جمعیتی سوئدی انجام گرفت نیز شناسایی شد. در این مطالعهها علاوه بر موتاسیونهای مذکور، موتاسیونهای 202T>C و 314C>T نیز برای اولین بار معرفی شدند. به علاوه نشان داده شد که آلل لوئیس منفی le202,314 در افرادی با فنوتیپ Le(a-b-) حضور دارد (14). موتاسیون بدمعنی 59T>G نیز از جمله موتاسیونهایی بود که در جمعیتهای اندونزیایی، ژاپنـی و
سوئدی مورد توجه قرار گرفت(15). پنج پلیمورفیسم شایعی که در بیشتر جمعیت ها دیده شده عبارتند از: 202T>C، 314C>T، 59T>G، 508G>A و 1067T>A (16، 12، 11، 9). در مطالعه حاضر که برای نخستین بار در ایران به منظور بررسی پلیمورفیسمهای ژن FUT3 روی 100 اهداکننده مراجعهکننده به پایگاه انتقال خون تهران با استفاده از روشهای مولکولی PCR و DNAsequencing انجام گرفت، 15 پلیمورفیسم شناسایی شدند. از بین این موتاسیونها 5 مورد مرتبط با جهشهای هم معنی و بقیه موارد، مرتبط با جهشهای بدمعنی بودند. این جهشهای هم معنی عبارتند از: 858A>G، 612A>G، 258C>T، 321C>T و 522G>A. شایعترین پلیمورفیسمها به ترتیب عبارتند از: (39%) 202T>C ، (37%) 314C>T ، (20%) 59T>G، (9%)508G>A، (8%)474G>C و (2%) 1067T>A. همچنین 13 نوع هاپلوتایپ مختلف در جمعیت مورد مطالعه تخمین زده شد. در این میان 5 هاپلوتایپ بیشترین فراوانی را داشتند که عبارتند از: (2/66%) Le ، (5/17%) le202,314 ، (3/4%)le47,202,314 ، (1/4%)le59 و (4/3%) le59,508 . مطالعهای که توسط سوجیما و همکاران در سال 2008 بر روی سه جمعیت قفقازی(100نفر)، غنایی(106 نفر) و مغولی(50 نفر) با روش Direct sequencing انجام شد، نشان داد که پلیمورفیسمهای 59T>G، 202T>C، 314C>T، 508G>A و 1067T>A در هر سه جمعیت وجود داشتند(4). از طرفی بررسیهای هاپلوتایپی نشان داد که هاپلوتایپهای Le، le59,508، le59,1067 و le202,314 در هر سه جمعیت حضور دارند اما در مطالعه ما از بین هاپلوتایپهای مذکور، هاپلوتیپ le59,1067 حضور نداشت. آلل le47,202,314 نیز که در جمعیت قفقازی با شیوع کم و در حد 5/2% دیده شده بود، در جمعیت ما با فراوانی 3/4% قابل رؤیت بود. فراوانی آلل عملکردی لوئیس در جمعیتهای مغولی، قفقازی و غنایی به ترتیب معادل 61%، 5/70% و 3/44% اما در جمعیت مورد مطالعه ما 2/66% بود. فراوانی آلل le59,508 نیز در سه جمعیت مغولی، غنایی و قفقازی به ترتیب 24%، 5/1% و 9/18% و در جمعیت ما 4/3% بود.
در مطالعه مشابهی که توسط متزولد و همکاران در سال 2009 انجام گرفت، نمونه خون100 نفر از اهداکنندگان در اتریش با روش DNA sequencing مورد بررسی قرار گرفته و تنوع ژنتیکی و فراوانی آللی فوکوزیل ترانسفرازهای 1، 2 و 3 در جمعیت مورد مطالعه تعیین شد(16). در این مطالعه فراوانی آلل Le تقریباً مشابه با مطالعه ما و در حدود 65% بود. فراوانی آللهای شایع دیگر به ترتیب le202,314 (21%)، le59,1067 (6%)، le59,508 (2%)، le59 (1%) و le47,202,314 (1%) بود. در مطالعه ما برخلاف این مطالعه، آلل le59,1067 شناسایی نشد و فراوانی آللهای مذکور نیز اندکی تفاوت داشت.
به طور کلی آن چه از مطالعه حاضر و مقایسه آن با سایر مطالعهها برمیآید، نشاندهنده این است که فراوانی
پلیمورفیسمها و آللهای ژن FUT3 در جمعیتهای مختلف متفاوت بوده اما میتوان گفت که تعدادی از آنها در همه جمعیتها البته با فراوانی متفاوت وجود داشته که نشاندهنده به وجود آمدن آنها قبل از جدا شدن جمعیتهای مختلف انسانی میباشد. اهمیت گروه خونی لوئیس علاوه بر نقش آن در طب انتقال خون، تاثیر در استعداد ابتلا به بیماریهای عفونی و غیرعفونی میباشد که میتواند زمینه مطالعههای فراوانی در جمعیت ایرانی باشد(20-17).
نتیجهگیری
شناسایی پلیمورفیسمهای ایجادکننده گروههای خونی با روش مولکولی میتواند در شرایطی که روشهای سرولوژیک محدودیت دارند، راهگشا باشد. به علاوه با توجه به ارتباط واریانتهای مختلف این گروهها با بیماریهای مختلف، تعیین آللها و هاپلوتایپها در جمعیت ایرانی میتواند مطالعهها روی بیماریهای مختلف را تسهیل کند. ضمناً نتایج این پژوهش در مطالعههای جمعیتشناسی نیز کاربرد خواهد داشت.
تشکر و قدردانی
این تحقیق موضوع پایاننامه کارشناسی ارشد رشته خونشناسی و علوم انتقال خون با کد اخلاق IR.tmi.rec.1396.033 میباشد که هزینه آن توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین شده است.
متن کامل: (2105 مشاهده)
تعیین فراوانی پلیمورفیسمهای ژن فوکوزیل ترانسفراز 3 (FUT3)
در اهداکنندگان ایرانی
مهشید ناصریراد1، احمد مردانی2، امیر علی نقی3، مجید شهابی4
چکیده
سابقه و هدف
ژن FUT3 ، بیان آنتیژنهای گروه خونی لوئیس از جمله Lea و Leb را تنظیم میکند. افرادی که آنتیژنهای گروه خونی لوئیس را نمیسازند، هاپلوتایپهایی با پلیمورفیسمهای تک نوکلئوتیدی غیر فعالکننده آنزیم دارند که فراوانی آنها در بین نژادهای مختلف متفاوت است. در مطالعه حاضر، فراوانی این پلیمورفیسمها در اهداکنندگان ایرانی مورد بررسی قرار گرفت.
مواد و روشها
در این مطالعه مقطعی- توصیفی، 100 نفر از اهداکنندگان مراجعهکننده به پایگاه انتقال خون تهران در سال 1396 مورد بررسی قرار گرفتند. از PCR و DNA sequencing برای تعیین پلیمورفیسمهای تک نوکلئوتیدی ژن لوئیس استفاده شد. هاپلوتایپها نیز توسط نرم افزار SNP Analyzer مشخص شدند.
یافتهها
در مجموع 15 پلیمورفیسم شناسایی شد که از این تعداد 10 مورد مرتبط با موتاسیونهای missense بودند. فراوانی مهمترین پلیمورفیسمهای شناسایی شده عبارتند از: 202T>C 39%، 314C>T 37%، 59T>G 20% ، 508G>A 9% و 47G>C 8% . هم چنین 13 هاپلوتایپ نیز شناسایی شد که فراوانی مهمترین هاپلوتیپها عبارتند از: Le 2/66%، le202,314 5/17%، le47,202,314 3/4%، le59 1/4% و le59,508 4/3% .
نتیجه گیری
بر اساس این پژوهش، پلیمورفیسمهای 202T>C، 59T>G و 508G>A میتوانند به عنوان SNP های اصلی برای شناسایی آللهای لوئیس منفی در تعیین ژنوتیپ گروههای خونی لوئیس و مطالعههای مرتبط با بیماریها مفید واقع شوند.
کلمات کلیدی: پلیمورفیسمهای تک نوکلئوتیدی، هاپلوتایپها، آللها
تاریخ دریافت: 16/7/98
تاریخ پذیرش: 4 /4 /99
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD انگلشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- دکترای علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- مؤلف مسئول: PhD فرآوردههای بیولوژیـک ـ استادیـار مرکـز تحقیقـات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
در اهداکنندگان ایرانی
مهشید ناصریراد1، احمد مردانی2، امیر علی نقی3، مجید شهابی4
چکیده
سابقه و هدف
ژن FUT3 ، بیان آنتیژنهای گروه خونی لوئیس از جمله Lea و Leb را تنظیم میکند. افرادی که آنتیژنهای گروه خونی لوئیس را نمیسازند، هاپلوتایپهایی با پلیمورفیسمهای تک نوکلئوتیدی غیر فعالکننده آنزیم دارند که فراوانی آنها در بین نژادهای مختلف متفاوت است. در مطالعه حاضر، فراوانی این پلیمورفیسمها در اهداکنندگان ایرانی مورد بررسی قرار گرفت.
مواد و روشها
در این مطالعه مقطعی- توصیفی، 100 نفر از اهداکنندگان مراجعهکننده به پایگاه انتقال خون تهران در سال 1396 مورد بررسی قرار گرفتند. از PCR و DNA sequencing برای تعیین پلیمورفیسمهای تک نوکلئوتیدی ژن لوئیس استفاده شد. هاپلوتایپها نیز توسط نرم افزار SNP Analyzer مشخص شدند.
یافتهها
در مجموع 15 پلیمورفیسم شناسایی شد که از این تعداد 10 مورد مرتبط با موتاسیونهای missense بودند. فراوانی مهمترین پلیمورفیسمهای شناسایی شده عبارتند از: 202T>C 39%، 314C>T 37%، 59T>G 20% ، 508G>A 9% و 47G>C 8% . هم چنین 13 هاپلوتایپ نیز شناسایی شد که فراوانی مهمترین هاپلوتیپها عبارتند از: Le 2/66%، le202,314 5/17%، le47,202,314 3/4%، le59 1/4% و le59,508 4/3% .
نتیجه گیری
بر اساس این پژوهش، پلیمورفیسمهای 202T>C، 59T>G و 508G>A میتوانند به عنوان SNP های اصلی برای شناسایی آللهای لوئیس منفی در تعیین ژنوتیپ گروههای خونی لوئیس و مطالعههای مرتبط با بیماریها مفید واقع شوند.
کلمات کلیدی: پلیمورفیسمهای تک نوکلئوتیدی، هاپلوتایپها، آللها
تاریخ دریافت: 16/7/98
تاریخ پذیرش: 4 /4 /99
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD انگلشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- دکترای علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- مؤلف مسئول: PhD فرآوردههای بیولوژیـک ـ استادیـار مرکـز تحقیقـات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
تاکنون 36 سیستم گروه خونی که بیش از 300 آنتیژن را در خود جای دادهاند، روی سطح گلبولهای قرمز شناسایی شده است(2، 1). بعضی از این آنتیژنها نقشهای بیولوژیک داشته و بعضی در ارتباط با بیماریها هستند(3). در این میان سیستم گروه خونی- بافتی لوئیس از دو آنتیژن عمده Lea و Leb تشکیل شده که شاخصهای آنها الیگوساکاریدهایی هستند که در اتصال با گلیکوپروتئینها یا گلیکولیپیدها قرار دارند(7-4). آنتیژنهای این سیستم نخستین بار روی گلبولهای قرمز (مورانت – سال 1946) و بعدها در پلاسما، بزاق و دیگر ترشحات یافت شدند(9، 8). در واقع، برخلاف سایر گروههای خونی، ساخت آنتیژنهای لوئیس در بافتهای اریتروئیدی رخ نمیدهد، بلکه این آنتیژنها به صورت ثانویه توسط غشای اریتروسیتها جذب میگردند(10). آنتیژنهای این گروه خونی از نظر بیوشیمیایی با آنتیژنهای سیستم ABH در ارتباط بوده و از همان پیشسازها منشا گرفتهاند(5). بیان آنتیژنهای لوئیس به دو فوکوزیل ترانسفراز مختلف که محصولات دو جایگاه ژنی مجزا(FUT2 و FUT3) روی کروموزوم 19 هستند، نیاز دارد(10). ژن FUT2 ، آنزیم آلفا 2 فوکوزیل ترانسفراز و ژن FUT3 ، آنزیم آلفا 3 و 4 فوکوزیل ترانسفراز را کد میکند. این آنزیمها در روده کوچک، کبد، کلیه و پانکراس فعال بوده و آنتیژنهای گلیکولیپیدی Lea و Leb را با اضافه کردن قند فوکوز به پیشسازهای اولیگوساکاریدی، میسازند. Lea و Leb مستقیما توسط آنزیم FUT3 ساخته میشوند اما برای ساخت Leb ، نیاز است که ابتدا آنزیم FUT2 پیشساز H تیپ 1 را ساخته باشد(11). افراد لوئیس منفی آنتیژنهای لوئیس را نمیسازند و در نتیجه گلبولهای قرمز این افراد با فنوتیپ Le(a-b-) مشخص میشوند(4). فنوتیپ Le(a-b-) در نتیجه حضور آللهای مختلف ژن le که ترانسفرازهای فاقد عملکرد کد میکنند، به وجود میآید. در این حالت صرف نظر از این که فرد سکرتور باشد یا نباشد، آنتیژنهای Lea و Leb بیان نمیشوند. واریانتهای خاموش ژن Lewis(le) یک سری پلیمورفیسمهای تک نوکلئوتیدی(SNPs) را در خود جای دادهاند که بسیاری از آنها باعث غیرفعال شدن آنزیم میشوند. بیش از 37 آلل نول FUT3 گزارش شده است که عمدتاً دارای حداقل دو موتاسیون هستند. بسیاری از آللها توزیع جغرافیایی و نژادی خاصی را نشان میدهند . شایعترین واریانت هاپلوتایپی مربوط به le59/508 است که در آسیاییها(24 درصد) و آفریقاییها (19درصد) شناسایی شده است. در حالی که le202/314 (17 درصد) و le59/1067 (4 درصد) عمدتاً در جمعیتهای اروپایی دیده میشود(5). شیوع بالاتر آسم برونشیال و دیابت ملیتوس غیر وابسته به انسولین در افرادی با گروه خونی Le(a-b-) مطرح شده است. از طرفی این فنوتیپ با شیوع بالاتر بیماریهای قلبی در ارتباط است. تا آن جا که مطالعهها نشان میدهند، چهار موتاسیون 202T>C ، 314C>T ، 508G>A و 1067T>A به طور مشخص با افزایش خطر بیماریهای قلبی ارتباط دارند(12). با توجه به ارتباط ژن لوئیس با برخی حالات پاتولوژیک و همین طور نقشی که در مطالعههای جمعیتشناسی دارد، برای اولین بار در ایران تعیین پلیمورفیسمهای ژن لوئیس با استفاده از روشهای مولکولی PCR و DNA sequencing صورت گرفت. هدف از این مطالعه، شناسایی پلیمورفیسمهای ژن لوئیس، واریانتهای هاپلوتایپی و تعیین فراوانی آنها در جمعیت ایرانی و مقایسه آن با سایر جمعیتها بود.
مواد و روشها
این مطالعه از نوع مقطعی- توصیفی بود و از روش نمونهگیری غیر احتمالی آسان استفاده شد. برای بیان نتایج از روشهای آماری توصیفی استفاده گردید.
اهداکنندگان:
پنج میلیلیتر خون EDTA دار از 100 اهداکننده مراجعهکننده به پایگاه انتقال خون تهران در سال 1396 جمعآوری شد. از تمام شرکتکنندگان در این پژوهش رضایتنامه کتبی اخذ شد.
روش مولکولی:
استخـراج DNA : DNA ژنـومــی از خــون کـامـــل
اهداکنندگان با استفاده از کیت ستونی استخراج شد(کره، GeneAll® ExgeneTM Blood SV min). به منظور ارزیابی کیفیت DNA و آگاهی از میزان خلوص آن، از دستگاه نانودراپ استفاده شد.
روش PCR :
توالی کد کننده آنزیم FUT3 ، بخشی از اگزون 3 این ژن میباشد که از 1086 جفت باز تشکیل شده است(4). تکثیر بخش کد کننده آنزیم FUT3 با استفاده از آغازگر پیشرو [5’- AAT GAC CCT CAC TCC TCT CTC C-3’] و آغازگر پیرو [5’-CCCAGGCAGATGAGGTTCCC-3’] صورت گرفت. برای انجام این روش از غلظت 100-50 نانوگرم DNA ، آغازگرهای مذکور، Master Mix PCR 2x (یکتا تجهیز آزما- ایران) در حجم نهایی 50 میکرولیتر استفاده شد. به جهت حصول به محصول اختصاصی، واکنشهای PCR به صورت Touchdown و به شرح زیر انجام شد: یک چرخه در 95 درجه سانتیگراد به مدت 5 دقیقه، 10 چرخه (در 94 درجه سانتیگراد به مدت 30 ثانیه، در 66 درجه سانتیگراد به مدت 30 ثانیه، در 72 درجه سانتیگراد به مدت 45 ثانیه)، 10 چرخه(در94 درجه سانتیگراد به مدت 10 ثانیه، در 62 درجه سانتیگراد به مدت 30 ثانیه، در 72 درجه سانتیگراد به مدت 45 ثانیه)، 12 چرخه (در94 درجه سانتیگراد به مدت 10 ثانیه، در 59 درجه سانتیگراد به مدت 30 ثانیه، در 72 درجه سانتیگراد به مدت 45 ثانیه) و 1 چرخه در 72 درجه سانتیگراد به مدت 5 دقیقه. محصول حاصل از تکثیر PCR با استفاده از ژل آگارز 5/1% مورد بررسی قرار گرفت.
تعیین توالی:
محصول PCR برای تعیین توالی به شرکت ژن فنآوران (ژن فنآوران، تهران، ایران) ارسال گردید. سپس توالیهای ارسال شده از سوی این شرکت با نرمافزارهای Chromas 2.6.6 و DNA Baser 5.15.0 مورد بررسی قرار گرفتند.
بررسیهاپلوتایپی:
پـس از بـررسی تـوالی نمونههـا، اطلاعات مرتبط با هر
نمونه از جمله SNP های هر نمونه و وضعیت توارث آن (هموزیگوت و یا هتروزیگوت بودن) در فایل اکسل ثبت گردید. سپس SNP های یافت شده در نمونهها با SNPهای از قبل شناسایی شدهی ژن FUT3 که در پایگاه داده NCBI موجود میباشد، مقایسه شد تا در صورت وجود SNP جدید، اقدامات بعدی انجام گیرد. از آن جا که در بین SNPهای موجود در نمونهها مورد جدیدی یافت نشد، از نرمافزار SNPAnalyzer 2.0 برای بررسی هاپلوتایپها و شیوع هاپلوتایپی استفاده گردید.
یافتهها
نتایج تعیین توالی کلیه نمونهها با استفاده از این دو نرمافزار به دقت مورد بررسی قرار گرفت. در مورد هر نمونه وضعیت حضور یا عدم حضور SNP در توالی ژنی و همین طور هموزیگوت یا هتروزیگوت بودن آن ثبت گردید.
جدول 1: پلیمورفیسمهای شناسایی شده و فراوانی آنها در نمونههای اهداکنندگان

جدول 2: هاپلوتایپهای شناسایی شده توسط نرمافزار SNP Analyzer

به طور کلی در این بررسیها، در مجموع هر 100 نمونه، 15 SNP شناسایی گردید. با استفاده از پایگاه داده NCBI، مشخص شد که همه موارد شناسایی شده، در مطالعههای قبلی که در مورد ژن FUT3 در سراسر جهان انجام شده، گزارش گردیده است و از این رو پلیمورفیسم جدیدی شناسایی نشد. پلیمورفیسمهای شناسایی شده در بین نمونهها و تاثیری که روی توالی آمینواسیدی پروتئین کد شده میگذارند در جدول ثبت شده است(جدول 1)(شکلهای 1 و 2).
از مجموع 15 مورد پلیمورفیسم شناسایی شده، 5 مورد مرتبط با موتاسیونهای هم معنی بوده و تغییری در توالی آمینواسیدی آنزیم حاصل ایجاد نمیکنند. از میان این موارد، SNP های 522G>A، 321C>T و 612A>G هر یک تنها در یک نمونه و به صورت منفرد و با توارث هتروزیگوت حضور داشتند. از آن جا که این SNP ها روی فعالیت آنزیم تاثیری نداشته و به صورت منفرد و در عدم حضور موتاسیونهای بیمعنی(non sense) ظاهر شدهاند، در بررسیهای هاپلوتایپی بعدی نادیده گرفته شدند. اما موتاسیونهای 858A>G و 258C>T با وجود این که در توالی آمینواسیدی آنزیم حاصل تاثیری ندارند، ولی به دلیل این که در نمونههایی ظاهر شده بودند که دارای موتاسیونهای بد معنی(missense) بودند، در بررسیهای هاپلوتایپی بعدی لحاظ شدند. نرمافزار SNP Analyzer برای جمعیت مورد مطالعه، 13 نوع هاپلوتایپ مختلف را تخمین زدند(جدول 2).

شکل 1: کروماتوگرام مربوط پلیمورفیسم 202T>C که به صورت هتروزیگوس میباشد و با پیکان نمایش داده شده است.


شکل 2 : کروماتوگرام مربوط پلیمورفیسم 508G>A که به صورت هتروزیگوس میباشد و با پیکان نمایش داده شده است.
در گام بعدی هاپلوتایپهای هر نمونه بررسی شده و وضعیت هتروزیگوت یا هموزیگوت بودن افراد تعیین گردید. با انجام این بررسیها مشخص شد که 48% افراد به صورت Le/Le ، 34% به صورت Le/le و 18% نیز le/le هستند.
بحث
در این مطالعه فراوانی آللهای ژن FUT3 در گروهی از اهداکنندگان خون در تهران بررسی شد که در مجموع 15 پلیمورفیسم و 13 هاپلوتایپ شناسائی شد. تمامی این پلیمورفیسمها قبلاً گزارش شده بودند و شایعترین آنها پلیمورفیسم 202T>C بود. شروع مطالعههای مولکولی مرتبط با موتاسیونهای ژن لوئیس به سالهای 1993 و 1994 بر میگردد. در ابتدا موتاسیون 1067T>A در میان اندونزیاییها و موتاسیونهای 1067T>A و 508G>A در میان ژاپنیها شناسایی گردید(13، 9). سپس این موتاسیونها در مطالعههایی که روی جمعیتی سوئدی انجام گرفت نیز شناسایی شد. در این مطالعهها علاوه بر موتاسیونهای مذکور، موتاسیونهای 202T>C و 314C>T نیز برای اولین بار معرفی شدند. به علاوه نشان داده شد که آلل لوئیس منفی le202,314 در افرادی با فنوتیپ Le(a-b-) حضور دارد (14). موتاسیون بدمعنی 59T>G نیز از جمله موتاسیونهایی بود که در جمعیتهای اندونزیایی، ژاپنـی و
سوئدی مورد توجه قرار گرفت(15). پنج پلیمورفیسم شایعی که در بیشتر جمعیت ها دیده شده عبارتند از: 202T>C، 314C>T، 59T>G، 508G>A و 1067T>A (16، 12، 11، 9). در مطالعه حاضر که برای نخستین بار در ایران به منظور بررسی پلیمورفیسمهای ژن FUT3 روی 100 اهداکننده مراجعهکننده به پایگاه انتقال خون تهران با استفاده از روشهای مولکولی PCR و DNAsequencing انجام گرفت، 15 پلیمورفیسم شناسایی شدند. از بین این موتاسیونها 5 مورد مرتبط با جهشهای هم معنی و بقیه موارد، مرتبط با جهشهای بدمعنی بودند. این جهشهای هم معنی عبارتند از: 858A>G، 612A>G، 258C>T، 321C>T و 522G>A. شایعترین پلیمورفیسمها به ترتیب عبارتند از: (39%) 202T>C ، (37%) 314C>T ، (20%) 59T>G، (9%)508G>A، (8%)474G>C و (2%) 1067T>A. همچنین 13 نوع هاپلوتایپ مختلف در جمعیت مورد مطالعه تخمین زده شد. در این میان 5 هاپلوتایپ بیشترین فراوانی را داشتند که عبارتند از: (2/66%) Le ، (5/17%) le202,314 ، (3/4%)le47,202,314 ، (1/4%)le59 و (4/3%) le59,508 . مطالعهای که توسط سوجیما و همکاران در سال 2008 بر روی سه جمعیت قفقازی(100نفر)، غنایی(106 نفر) و مغولی(50 نفر) با روش Direct sequencing انجام شد، نشان داد که پلیمورفیسمهای 59T>G، 202T>C، 314C>T، 508G>A و 1067T>A در هر سه جمعیت وجود داشتند(4). از طرفی بررسیهای هاپلوتایپی نشان داد که هاپلوتایپهای Le، le59,508، le59,1067 و le202,314 در هر سه جمعیت حضور دارند اما در مطالعه ما از بین هاپلوتایپهای مذکور، هاپلوتیپ le59,1067 حضور نداشت. آلل le47,202,314 نیز که در جمعیت قفقازی با شیوع کم و در حد 5/2% دیده شده بود، در جمعیت ما با فراوانی 3/4% قابل رؤیت بود. فراوانی آلل عملکردی لوئیس در جمعیتهای مغولی، قفقازی و غنایی به ترتیب معادل 61%، 5/70% و 3/44% اما در جمعیت مورد مطالعه ما 2/66% بود. فراوانی آلل le59,508 نیز در سه جمعیت مغولی، غنایی و قفقازی به ترتیب 24%، 5/1% و 9/18% و در جمعیت ما 4/3% بود.
در مطالعه مشابهی که توسط متزولد و همکاران در سال 2009 انجام گرفت، نمونه خون100 نفر از اهداکنندگان در اتریش با روش DNA sequencing مورد بررسی قرار گرفته و تنوع ژنتیکی و فراوانی آللی فوکوزیل ترانسفرازهای 1، 2 و 3 در جمعیت مورد مطالعه تعیین شد(16). در این مطالعه فراوانی آلل Le تقریباً مشابه با مطالعه ما و در حدود 65% بود. فراوانی آللهای شایع دیگر به ترتیب le202,314 (21%)، le59,1067 (6%)، le59,508 (2%)، le59 (1%) و le47,202,314 (1%) بود. در مطالعه ما برخلاف این مطالعه، آلل le59,1067 شناسایی نشد و فراوانی آللهای مذکور نیز اندکی تفاوت داشت.
به طور کلی آن چه از مطالعه حاضر و مقایسه آن با سایر مطالعهها برمیآید، نشاندهنده این است که فراوانی
پلیمورفیسمها و آللهای ژن FUT3 در جمعیتهای مختلف متفاوت بوده اما میتوان گفت که تعدادی از آنها در همه جمعیتها البته با فراوانی متفاوت وجود داشته که نشاندهنده به وجود آمدن آنها قبل از جدا شدن جمعیتهای مختلف انسانی میباشد. اهمیت گروه خونی لوئیس علاوه بر نقش آن در طب انتقال خون، تاثیر در استعداد ابتلا به بیماریهای عفونی و غیرعفونی میباشد که میتواند زمینه مطالعههای فراوانی در جمعیت ایرانی باشد(20-17).
نتیجهگیری
شناسایی پلیمورفیسمهای ایجادکننده گروههای خونی با روش مولکولی میتواند در شرایطی که روشهای سرولوژیک محدودیت دارند، راهگشا باشد. به علاوه با توجه به ارتباط واریانتهای مختلف این گروهها با بیماریهای مختلف، تعیین آللها و هاپلوتایپها در جمعیت ایرانی میتواند مطالعهها روی بیماریهای مختلف را تسهیل کند. ضمناً نتایج این پژوهش در مطالعههای جمعیتشناسی نیز کاربرد خواهد داشت.
تشکر و قدردانی
این تحقیق موضوع پایاننامه کارشناسی ارشد رشته خونشناسی و علوم انتقال خون با کد اخلاق IR.tmi.rec.1396.033 میباشد که هزینه آن توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین شده است.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونوهماتولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






