جلد 15، شماره 3 - ( پاییز 1397 )
جلد 15 شماره 3 صفحات 234-226 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Barazandeh-Rokh M, Nasoohi N, Molaei M, Fallah P. The evaluation of P16 in chronic myeloid leukemia patients. bloodj 2018; 15 (3) :226-234
URL: http://bloodjournal.ir/article-1-1145-fa.html
URL: http://bloodjournal.ir/article-1-1145-fa.html
برازنده رخ مینا، نصوحی نیکو، ملایی مجتبی، فلاح پرویز. بیان ژن P16 در بیماران مبتلا به لوسمی میلوئیدی مزمن. فصلنامه پژوهشی خون. 1397; 15 (3) :226-234
استادیار دانشکده پیراپزشکی ـ دانشگاه علوم پزشکی البرز
متن کامل [PDF 439 kb]
(2236 دریافت)
| چکیده (HTML) (5597 مشاهده)
مقدمه
لوسمی میلوئیدی مزمن(Chronic Myelogenous Leukemia:CML)، یک اختلال کلونال سلولهای بنیادی مغز استخوان است که در آن، سلولهای گرانولوسیت بالغ (نوتروفیل، ائوزینوفیل و بازوفیل) و پیشسازهای آنها، گسترش مییابد. این نوع از اختلالات میلوپرولیفراتیو با ترانسلوکاسیون کروموزومی به نام کروموزوم فیلادلفیا همراه میباشد. پروتئین BCR-ABL به صورت مداوم فعالیت تیروزین کینازی دارد و به فعالسازی توسط سایر پروتئینهای پیامرسانی سلولی، نیاز ندارد. به نوبه خود، BCR-ABL ، باعث فعالیت آبشاری پروتئینهایی میشود که در بالا بردن سرعت تقسیم و کنترل چرخه سلولی نقش دارند. علاوه بر این، پروتئین BCR-ABL باعث ناپایداری ژنومی و مستعد شدن فرد به دیگر اختلالات کروموزومی، میشود. فعالیت این پروتئین علت پاتوفیزیولوژیک بیماری لوسمی میلوئیدی مزمن میباشد(1). این بیماری دارای سه مرحله پایدار، مزمن(Chronic Phase : CP)، تسریع شده (پیش رونده)(Accelerated Phase : AP) و بلاستیک(Blast Crisis : BC) میباشد. در بسیاری از بیماران، طول مرحله پایدار و مزمن بیماری 4 سال است و پس از گذر از مرحله پیشرونده، وارد فاز بلاستیک میشوند. در سال 2014 این بیماری در مردان 3% از انواع سرطانها را به خود اختصاص داده است. در کشورهای غربی، CML حدود 15% تا 20% از لوسمیهای بزرگسالان، 14% از کل لوسمیها(از جمله لوسمیهای مربوط به کودکان) و 2% از لوسمیهای کودکان را تشکیل میدهد. میزان بقای 5 ساله در این بیماران به علت کشف مهارکننده تیروزین کیناز BCR-ABL به میزان 63% بین سالهای 2003 تا 2011 افزایش یافته است(2). فعالیت بیش از حد تیروزین کینازی BCR-ABL باعث فعالشدن مسیرهای سیگنالدهی و اختلالات تنظیمی در پروسههای مختلف سلولی میشود. مسیرهای پاییندست BCR-ABL با بقا و تکثیر سلولی، چرخه سلولی، تمایز سلولی و آپوپتوزیس در ارتباط میباشد(4، 3).
پـروتئین P16 پروتئینـی156 اسیـد آمینـهای در گستره
وسیعی از بافتها و سلولها بیان میشود. پروتئین P16 با اتصال به CDK4 مانع از برهمکنش آن با سیکلین D میشود و به عبور سلول از مرحله G1 چرخه سلولی کمک میکند. این پروتئین در اغلب سرطانها غیر فعال میشود. همچنین P16 تنظیم کننده مسیرهای کنترل چرخه سلولی مهمی از جمله P53 وRb است. مهار آن به واسطه حذف، جهش نقطهای و یا متیلاسیون پروموتر رخ میدهد(5).
در CML نقش P16 در روند پیشروی این بیماری به درستی شناخته نشده است. اما در فاز بلاستیک این بیماری موتاسیون P16 گزارش شده است(6).
هدف از این مطالعه، بررسی بیان ژن P16 در بیماران مبتلا به لوسمی میلوئیدی مزمن بود تا با شناسایی تغییرات بیان ژن و آنالیز تغییرات مولکولی دخیل در بدخیمیهای سلولی بتوان از آن در تشخیص و درمان بیماری استفاده نمود.
مواد و روشها
جمعآوری نمونه از بیماران و افراد سالم:
در این مطالعه تجربی، از 40 بیمار تازه تشخیص داده شده CML در فاز مزمن و از 8 فرد سالم به عنوان کنترل، 5 میلیلیتر خون محیطی همراه با ضد انعقاد EDTA از آزمایشگاه تشخیص طبی و تخصصی پیوند جمعآوری شد. معیارهای انتخاب بیماران بر اساس یافتههای مورفولوژیکی خونشناسی خاص لوسمی میلوئیدی مزمن (از جمله افزایش تعداد گلبولهای سفید، افزایش رده میلوئیدی مانند پرومیلوسیت و نوتروفیل در خون محیطی) و هم چنین آزمایش مثبت PCR برای ترانسلوکاسیون کروموزوم 9 و22 بود. تمامی بیماران در فاز مزمن بودند و هیچ گونه دارویی مصرف نکرده بودند.معیار انتخاب افراد کنترل و سالم، نداشتن هیچ گونه بیماری از جمله بدخیمیهای خونی و دیگر بدخیمیها بود.
استخراج RNA :
به طور ثابت برای هر یک از نمونههای بیمار و کنترل، 100 میکرولیتر از بافیکوت(لایه سفید مایل به خاکستری شامل گلبولهای سفید) در یک میکروتیوب 2 میلیلیتری ریخته شد. سپس یک میلیلیتر RNX-PLUSبه رسوب سلولی اضافه گردید و آن را کاملاً مخلوط کردیم تا تمامی سلولها از کف پلیت کنده شدند. مخلوط به درون یک میکروتیوپ 5/1 میلیلیتری منتقل شد. به مخلوط سلولی 300 میکرولیتر کلروفرم اضافه شد، به مدت 1 دقیقه به شدت تکان داده شد، سپس به مدت 10 دقیقه در دمای اتاق انکوبه گردید. مخلوط حاصل در دمای 4 درجه سانتیگراد(در میکروسانتریفیوژ یخچالدار) با دور rpm 12000 به مدت 20 دقیقه سانتریفیوژ شد. با احتیاط و بدون مخلوط شدن فاز وسطی، مایع بیرنگ رویی به میکروتیوب RNase DNase free منتقل شد. سپس 600 تا 800 میکرولیتر، به آن اتانول 100% سرد اضافه و پیپتاژ شد. ترکیب را به طور overnight در 20- درجه سانتیگراد نگهداری کردیم. محلول فوق به مدت 15 دقیقه در دمای 4 درجه سانتیگراد(در میکروسانتریفیوژ یخچالدار) با دور rpm 12000 سانتریفیوژ شد. مایعرویی دور ریخته شد و به رسوب سفید رنگ، 1 میلیلیتر از اتانل 70% سرد اضافه گردید و به خوبی ورتکس شد تا رسوب از ته میکروتیوب جدا گردید. محلول مورد نظر مجدداً در دمای 4 درجه سانتیگراد(در میکروسانتریفیوژ یخچالدار) با دور rpm 12000 این بار به مدت 10 دقیقه سانتریفیوژ شد. اتانول روی رسوب دور ریخته شد. رسوب در دمای اتاق قرار داده شد تا در حد امکان خشک شود. در مرحله آخر، رسوب در 20 میکرولیتر آب RNase freeکاملاً حل شد و نهایتاً محلول حاصل، جهت نگهداری، به فریزر 70- درجه سانتیگراد منتقل گردید. سپس غلظت RNA استخراج شده با روش بیوفتومتری سنجیده شد.
ساخت cDNA :
بعد از اندازهگیری غلظت RNA با دستگاه اسپکتروفتومتری برای مراحل ساخت cDNA از کیت سیناژن استفاده شد. ساختcDNA بر اساس دستورالعمل این کیت صورت گرفته است. 2میکروگرم RNA تخلیص شـده به همراه 20 میکرولیتر از آغازگر راندوم هگزامر، 6 میکرولیتر از RT-Buffer ، 3 میکرولیتر از dNTP به همراه 1 میکرولیتر آنزیم RT(Reverse Transcriptase) مورد رونویسی معکوس قرار گرفت. cDNA های ساخته شده در دمای 20- درجه سانتیگراد نگهداری شدند.
بررسی بیان ژن با روش Real Time PCR :
سنجش میزان بیان ژنها با روش Real Time PCR در دستگاه StepOne ABI شرکت بیوسیستم صورت گرفت. در این تحقیق ژن بتا دو میکروگلوبولین(B2) به عنوان ژن استاندارد و House keeping gene در نظر گرفته شد. رنگ فلورسنتی که برای Real Time PCR مورد استفاده قرار میگیرد سایبرگرین I است که رنگ متصل شونده به DNA دو رشتهای است. از RealQ Plus 2X Master Mix Green, high ROX شرکت آمپلیکون استفاده شد.
مواد مورد استفاده که برای هر واکنش مورد استفاده قرار گرفت بر این اساس است(جدول 1):
جدول 1: مواد مورد نیاز برای هر واکنش Real Time PCR
یک نمونه کنترل منفی با عنوان NTC (No Template Control) نیز تهیه شد که شامل تمامی مواد فوق به غیر از cDNA میباشد.
نمونهها در دستگاه Real time PCR (ABI)، PCR شد (جداول 2 و 3).
بیان ژن P16 در بیماران CML و نمونههای افراد سالم به دست آمده و نتایج در برنامه REST2009 تجزیه و تحلیل شد.
در روش DDCt ، کارآیی PCR برای هر دو حالت و ژن House Keeping ، یکسان و 100% در نظر گرفته میشود؛ سپس با استفاده از فرمول زیر نسبت بیان ژن در دو حالت بررسی میشود.
DDCt- 2 = Fold change
نرمافزار REST 2009 یک الگوریتم مستقل است که به منظور آنالیز بیان ژن، نتایج خام حاصل از Real Time PCR را براساس روشهای محاسبات تصادفی (Randomization) و خود راهانداز (Bootstrapping) مورد تجزیه و تحلیل قرار میدهد. ضریب اطمینان (Confidense interval) حاصل از این آزمونها قادر است معناداری آماری آزمون را محاسبه کرده انحراف از معیار آنها را نیز اگرچه در بعضی از موارد بزرگ میشود، نشان دهد. نمودارهای ویشکرباکس (Wishker Box Plot) نتایج آنالیز هر ژن و پراکندگی این نتایج را نشان میدهند.
جدول 2: برنامه زمانی برای واکنش Real Time PCR
جدول 3: توالی آغازگرها برای بررسی بیان ژن
یافتهها
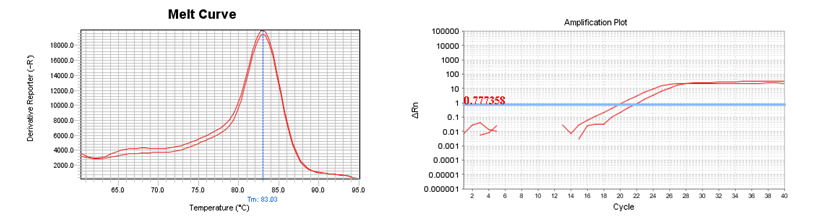
در بررسی اختصاصیت محصول Real-time PCR از منحنی ذوب استفاده میشود که قله منحنیها باید در راستای هم باشند(نمودار 1).
نتایـج Real Time PCR ، بیـان ژن P16 در بیمــاران نسبت به افراد سالم پس از آنالیز در برنامه REST2009 آمده است. بیان ژن P16 در 32 بیمارCML نسبت به گروه کنتـرل بـه طور معناداری کاهش بیان و در 8 بیمار نسبت به گروه کنترل به طور معناداری افزایش بیان را نشان داد (جداول 4 و 5، نمودارهای 2 و 3)(05/0 p≤). لازم به ذکر است که ژن B2M به عنوان کنترل داخلی در نظر گرفته شده است.
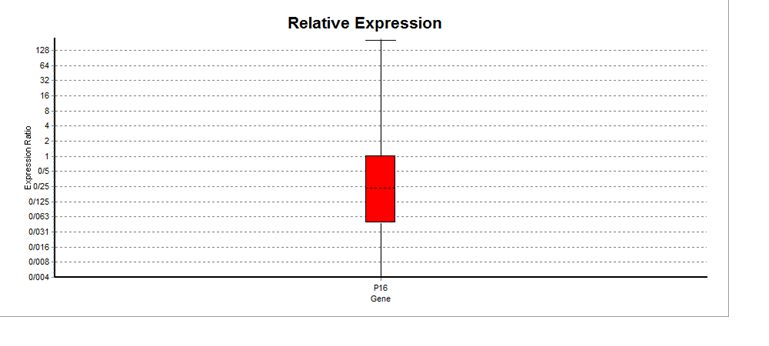
نمودار 2: کاهش بیان ژن P16 در بیماران مبتلا به لوسمی میلوئیدی مزمن(05/0 p≤)
جدول 5: افزایش بیان ژن P16 در 8 بیمار
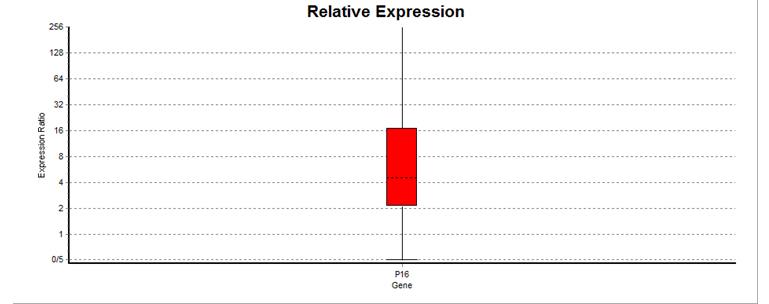
نمودار 3: افزایش بیان P16 در بیماران مبتلا به لوسمی میلوییدی مزمن(05/0 p≤)
بحث
در این مطالعه بررسی بیان ژن P16 در 40 بیمار با روشReal Time PCR انجام شد. مطالعه حاضر نشان داد که بیان ژن P16 در 32 بیمارCML نسبت به گروه کنتــرل
به طور معناداری کاهش و در 8 بیمار نسبت به گروه کنترل به طور معناداری افزایش بیان داشته است.
CML، به عنوان سرطانی که با ناهنجاری ژنتیکی و کروموزومی فیلادلفیا همراه است، شناخته شده است.
فعالیت پروتئین کیناز BCR-ABL علت پاتوفیزیولوژیک بیماری لوسمی میلوئیدی مزمن میباشد(7). خاموش شدن یا حذف ژنهای سرکوبگر تومور مانند P16 و P53 مرتبط با فنوتیپ بدخیم CML است. مطالعههای صورت گرفته توسط میر رشید و همکارانش ارتباط کاهش بیان این ژن با پیشروی CML را نشان میدهد(8، 7).
حدف ژن P16 در انواعی از بدخیمیها از جمله لوسمیهای خاص دیده میشود که در مورد لوسمیها بیشترین حذف ژنی در ALL(لوسمی لنفوبلاستیک حاد)(30%) با میزان قابل توجهی در T-ALL میباشد. میزان حذف در CLL (لوسمی لنفوییدی مزمن)، مالتیپل میلوما، AML (لوسمی میلوییدی حاد)، CMLو MDS (سندرم میلودیسپلازی) بسیار پایین است(12-9).
طبق مطالعههای صورت گرفته توسط نسیف و همکاران، افزایش بیان ژن P16 و P14 در 18بیمار در فاز مزمن CML و 4بیمار در فاز بلاستیک CML نشان داده شده است(13). این افزایش بیان با مطالعههای لی و همکارانش مطابقت دارد(12). افزایش P16 میتواند در به تاخیر انداختن پیشروی بیماری نقش داشته باشد. هم چنین افزایش بیان P16 در لوسمی میلوییدی حاد نیز گزارش شده است(13). اما افزایش بیان این ژن در CML بیشتر دیده میشود که این حالت ممکن است با پاتوفیزیولوژی این دو لوسمی مرتبط باشد. نتایج به دست آمده در دیگر لوسمیها و تومورهای توپر به دلیل این که انواع جهشها در CML خیلی کمتر از دیگر لوسمیها رخ میدهد، متفاوت میباشد(14). تانی گوشی و همکارانش بیان این ژن در چندین بدخیمی هماتولوژیک را بررسـی کردند که از 8 بیمار CML، در 5 مورد افزایش بیــان P16
گزارش شده است. هم چنین در مطالعه دیگری که بر روی نمونه مغز استخوان افراد مبتلا به CML انجام شده، افزایش بیان این ژن گزارش شده است(15، 14). گزارشهای چان هو دای نشان میدهد که P16 در بیماری PV (پلیسایتمیورا) افزایش بیان دارد که با مطالعههای لی و همکارانش مطابقت دارد(16).
به نظر میرسد مکانیسم پیری سلول و توقف چرخه سلولی با مسیرهای P16Ink4a/RB و P14ARF/P53در ارتباط باشد. مطالعهها نشان میدهد که افزایش پیری سلول در موش و در بافتهای پوستی و کلیوی انسان به طور قابل توجهی با افزایش بیان ژن P16 در ارتباط است(18، 17). علاوه بر نقش P16 در تنظیم چرخه سلولی، این پروتئین در دیگر پروسههای سلولی از جمله آپوپتوز، تهاجم سلولی و آنژیوژنز نیز نقش دارد که این فعالیتها ممکن است با افزایش بیان آن در سرطان مرتبط باشد(19).
در دیگر سرطانها نیز تومور ساپرسور P16 بیان متفاوتی را از خود نشان داده است، گزارشهای جدید حاکی از این است که عدم بیان P16 با کاهش سطح رسپتورهای استروژنی و مقاومت درمانی در سرطان پستان مرتبط است(20). بیان بیش از حد این ژن در تومورهای انسانی میتواند نشاندهنده دو وضعیت اصلی باشد: 1- بیان بیش از حد در ضایعات خوشخیم یا پیش بدخیم 2- بیان بیش از حد در ضایعات بدخیم که افزایش بیان آن به نظر میرسد به دلیل مکانیسم توقف تکثیر سلولی به واسطه شکست مسیر RB یا رتینو پلاستوما(عفونت، جهش و یا خاموش شدن ژن RB و ...) باشد(19).
هم چنین بیان این ژن از طریق فعال کردن ژنهای دیگر که در رگزایی نقش دارند، اهمیت بیشتری دارد، چون یکی از فاکتورهایی که در فرآیند تسریع تومور نقش دارد، دسترسی بافت مهاجم به تغذیه خونی است که P16 این شرایط را فراهم میکند. در گزارش دیگری که در سال 2016 منتشر شده است، بین افزایش بیان ژنهای P16 و P14 ، عود بیماری و پیشآگهی بد بیماری ارتباط وجود دارد(21).
بررسی بیان ژن P16 نتایج متفاوتی را نشان داده است.
در چندین نوع تومور کاهش بیان و در مواردی افزایش بیان داشته است(27-22). افزایش بیان این ژن در سرطانهای کولورکتال و کارسینوم سلول پایه(Basal Cell Carcinoma) مشاهده شده است(30-28). سرطانهای پانکراس نمونهای از تومورهایی هستند که در 98% از آنها کاهش عملکرد P16 رخ میدهد(33-31). در سال 2003 مطالعه مینامی و همکارانش نشان دادند که P16 به طور قابل توجهی در خونسازی، گسترش تمایز و آپوپتوز سلولهای اریتروئیدی نقش دارد، از این رو نقش این ژن در خونسازی حائز اهمیت میباشد(34).
با توجه به مطالعههای انجام شده، کاهش یا بیان بیش از حد این تومور سرکوبگر میتواند در مکانیسم مولکولی این بیماری نقش داشته باشد و در CML با پیشرفت این بیماری در ارتباط میباشد، از این رو به مطالعههای بیشتری نیاز است تا مکانیسم و عملکرد دقیق این مهارکننده تومور در سرطان مشخص شود. پیشنهاد میشود در جامعه آماری وسیعتری و در فازهای پیشرفتهتر این بیماری، بیان این ژن بررسی شود و هم چنین بیان این ژن در افراد تحت درمان با داروهای مهارکننده تیروزین کینازی نیز بررسی گردد.
نتیجهگیری
با توجه به دادههای کسب شده، میتوان نتیجه گرفت
که ژن P16 در لوسمی میلوئیدی مزمن نسبت به گروه کنترل در برخی بیماران کاهش و در برخی افزاش بیان داشت که میتواند نشاندهنده این باشد که تغییرات بیان آن با پاتوفیزیولژی و فاز بیماری در ارتباط میباشد. هم چنین به مطالعههای دیگری نیاز است تا با مشخص کردن تغییرات بیان در تمام فازهای این بیماری نقش دقیق این ژن را مشخص نمود.
تشکر و قدردانی
این پژوهش در قالب پروژه پایاننامه در آزمایشگاه تحقیقات دانشکده پیراپزشکی دانشگاه علوم پزشکی البرز انجام شده است که بدین وسیله از آنها قدردانی میشود. هم چنین از آزمایشگاه تشخیص طبی و تخصصی پیوند به خاظر کمک در جمعآوری نمونهها تشکر میشود.
متن کامل: (3356 مشاهده)
بیان ژن P16 در بیماران مبتلا به لوسمی میلوئیدی مزمن
مینا برازنده رخ1، نیکو نصوحی2، مجتبی ملایی3، پرویز فلاح4
چکیده
سابقه و هدف
لوسمی میلوئیدی مزمن، یک اختلال کلونال سلولهای بنیادی میباشد که علت آن اختلال درگیرنده تیروزین کینازی BCR-ABL است. ژن سرکوبگر تومور P16 ، کنترلکننده چرخه سلولی است. غیرفعال شدن این ژن با تومورزایی، پاتوژنز و پیشروی لوسمی در ارتباط میباشد. هدف از این مطالعه، بررسی بیان ژن P16 در بیماران مبتلا به لوسمی میلوییدی مزمن بود تا با شناسایی تغییرات بیان این ژن بتوان نقش آن را در پاتوفیزیولوژی بیشتر این بیماری مشخص نمود.
مواد و روشها
در یک مطالعه توصیفی، میزان بیان ژن P16 در 40 بیمار CML در فاز مزمن و 8 فرد سالم به عنوان کنترل که به آزمایشگاه تشخیص طبی پیوند مراجعه کرده بودند، با روش Real Time PCR و نرمافزار آماری REST2009 بررسی شد.
یافتهها
ژن P16 در بیماران CML در 32 بیمار به طور معناداری نسبت به گروه کنترل کاهش بیان داشت و در 8 بیمار به طور معناداری نسبت به گروه کنترل افزایش بیان داشت(05/0 p≤).
نتیجه گیری
با توجه به مطالعههای انجام شده، کاهش یا بیان بیش از حد این تومور سرکوبگر میتواند در مکانیسم مولکولی این بیماری نقش داشته باشد و در CML با پیشرفت این بیماری در ارتباط باشد، از این رو به مطالعههای بیشتری نیاز است تا عملکرد دقیق این مهارکننده تومور در سرطان مشخص شود.
کلمات کلیدی: لوسمی میلوییدی مزمن، PCR ، سلولهای بنیادی خونساز
تاریخ دریافت: 10/6/96
تاریخ پذیرش: 30/2/97
1- کارشناس ارشد ژنتیک ـ دانشکده علوم و فناوری نوین ـ واحد علوم دارویی دانشگاه آزاد اسلامی ـ تهران ـ ایران
2- دکترای ژنتیک ـ استادیار دانشکده علوم و فناوری نوین ـ واحد علوم دارویی دانشگاه آزاد اسلامی ـ تهران ـ ایران
3- کارشناس علوم آزمایشگاهی ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی البرز ـ کرج ـ ایران
4- مؤلف مسئول: PhD هماتولوژی و بانک خون ـ استادیار دانشکده پیراپزشکی ـ دانشگاه علوم پزشکی البرز ـ کرج ـ ایران ـ کدپستی: 3147734568
مینا برازنده رخ1، نیکو نصوحی2، مجتبی ملایی3، پرویز فلاح4
چکیده
سابقه و هدف
لوسمی میلوئیدی مزمن، یک اختلال کلونال سلولهای بنیادی میباشد که علت آن اختلال درگیرنده تیروزین کینازی BCR-ABL است. ژن سرکوبگر تومور P16 ، کنترلکننده چرخه سلولی است. غیرفعال شدن این ژن با تومورزایی، پاتوژنز و پیشروی لوسمی در ارتباط میباشد. هدف از این مطالعه، بررسی بیان ژن P16 در بیماران مبتلا به لوسمی میلوییدی مزمن بود تا با شناسایی تغییرات بیان این ژن بتوان نقش آن را در پاتوفیزیولوژی بیشتر این بیماری مشخص نمود.
مواد و روشها
در یک مطالعه توصیفی، میزان بیان ژن P16 در 40 بیمار CML در فاز مزمن و 8 فرد سالم به عنوان کنترل که به آزمایشگاه تشخیص طبی پیوند مراجعه کرده بودند، با روش Real Time PCR و نرمافزار آماری REST2009 بررسی شد.
یافتهها
ژن P16 در بیماران CML در 32 بیمار به طور معناداری نسبت به گروه کنترل کاهش بیان داشت و در 8 بیمار به طور معناداری نسبت به گروه کنترل افزایش بیان داشت(05/0 p≤).
نتیجه گیری
با توجه به مطالعههای انجام شده، کاهش یا بیان بیش از حد این تومور سرکوبگر میتواند در مکانیسم مولکولی این بیماری نقش داشته باشد و در CML با پیشرفت این بیماری در ارتباط باشد، از این رو به مطالعههای بیشتری نیاز است تا عملکرد دقیق این مهارکننده تومور در سرطان مشخص شود.
کلمات کلیدی: لوسمی میلوییدی مزمن، PCR ، سلولهای بنیادی خونساز
تاریخ دریافت: 10/6/96
تاریخ پذیرش: 30/2/97
1- کارشناس ارشد ژنتیک ـ دانشکده علوم و فناوری نوین ـ واحد علوم دارویی دانشگاه آزاد اسلامی ـ تهران ـ ایران
2- دکترای ژنتیک ـ استادیار دانشکده علوم و فناوری نوین ـ واحد علوم دارویی دانشگاه آزاد اسلامی ـ تهران ـ ایران
3- کارشناس علوم آزمایشگاهی ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی البرز ـ کرج ـ ایران
4- مؤلف مسئول: PhD هماتولوژی و بانک خون ـ استادیار دانشکده پیراپزشکی ـ دانشگاه علوم پزشکی البرز ـ کرج ـ ایران ـ کدپستی: 3147734568
مقدمه
لوسمی میلوئیدی مزمن(Chronic Myelogenous Leukemia:CML)، یک اختلال کلونال سلولهای بنیادی مغز استخوان است که در آن، سلولهای گرانولوسیت بالغ (نوتروفیل، ائوزینوفیل و بازوفیل) و پیشسازهای آنها، گسترش مییابد. این نوع از اختلالات میلوپرولیفراتیو با ترانسلوکاسیون کروموزومی به نام کروموزوم فیلادلفیا همراه میباشد. پروتئین BCR-ABL به صورت مداوم فعالیت تیروزین کینازی دارد و به فعالسازی توسط سایر پروتئینهای پیامرسانی سلولی، نیاز ندارد. به نوبه خود، BCR-ABL ، باعث فعالیت آبشاری پروتئینهایی میشود که در بالا بردن سرعت تقسیم و کنترل چرخه سلولی نقش دارند. علاوه بر این، پروتئین BCR-ABL باعث ناپایداری ژنومی و مستعد شدن فرد به دیگر اختلالات کروموزومی، میشود. فعالیت این پروتئین علت پاتوفیزیولوژیک بیماری لوسمی میلوئیدی مزمن میباشد(1). این بیماری دارای سه مرحله پایدار، مزمن(Chronic Phase : CP)، تسریع شده (پیش رونده)(Accelerated Phase : AP) و بلاستیک(Blast Crisis : BC) میباشد. در بسیاری از بیماران، طول مرحله پایدار و مزمن بیماری 4 سال است و پس از گذر از مرحله پیشرونده، وارد فاز بلاستیک میشوند. در سال 2014 این بیماری در مردان 3% از انواع سرطانها را به خود اختصاص داده است. در کشورهای غربی، CML حدود 15% تا 20% از لوسمیهای بزرگسالان، 14% از کل لوسمیها(از جمله لوسمیهای مربوط به کودکان) و 2% از لوسمیهای کودکان را تشکیل میدهد. میزان بقای 5 ساله در این بیماران به علت کشف مهارکننده تیروزین کیناز BCR-ABL به میزان 63% بین سالهای 2003 تا 2011 افزایش یافته است(2). فعالیت بیش از حد تیروزین کینازی BCR-ABL باعث فعالشدن مسیرهای سیگنالدهی و اختلالات تنظیمی در پروسههای مختلف سلولی میشود. مسیرهای پاییندست BCR-ABL با بقا و تکثیر سلولی، چرخه سلولی، تمایز سلولی و آپوپتوزیس در ارتباط میباشد(4، 3).
پـروتئین P16 پروتئینـی156 اسیـد آمینـهای در گستره
وسیعی از بافتها و سلولها بیان میشود. پروتئین P16 با اتصال به CDK4 مانع از برهمکنش آن با سیکلین D میشود و به عبور سلول از مرحله G1 چرخه سلولی کمک میکند. این پروتئین در اغلب سرطانها غیر فعال میشود. همچنین P16 تنظیم کننده مسیرهای کنترل چرخه سلولی مهمی از جمله P53 وRb است. مهار آن به واسطه حذف، جهش نقطهای و یا متیلاسیون پروموتر رخ میدهد(5).
در CML نقش P16 در روند پیشروی این بیماری به درستی شناخته نشده است. اما در فاز بلاستیک این بیماری موتاسیون P16 گزارش شده است(6).
هدف از این مطالعه، بررسی بیان ژن P16 در بیماران مبتلا به لوسمی میلوئیدی مزمن بود تا با شناسایی تغییرات بیان ژن و آنالیز تغییرات مولکولی دخیل در بدخیمیهای سلولی بتوان از آن در تشخیص و درمان بیماری استفاده نمود.
مواد و روشها
جمعآوری نمونه از بیماران و افراد سالم:
در این مطالعه تجربی، از 40 بیمار تازه تشخیص داده شده CML در فاز مزمن و از 8 فرد سالم به عنوان کنترل، 5 میلیلیتر خون محیطی همراه با ضد انعقاد EDTA از آزمایشگاه تشخیص طبی و تخصصی پیوند جمعآوری شد. معیارهای انتخاب بیماران بر اساس یافتههای مورفولوژیکی خونشناسی خاص لوسمی میلوئیدی مزمن (از جمله افزایش تعداد گلبولهای سفید، افزایش رده میلوئیدی مانند پرومیلوسیت و نوتروفیل در خون محیطی) و هم چنین آزمایش مثبت PCR برای ترانسلوکاسیون کروموزوم 9 و22 بود. تمامی بیماران در فاز مزمن بودند و هیچ گونه دارویی مصرف نکرده بودند.معیار انتخاب افراد کنترل و سالم، نداشتن هیچ گونه بیماری از جمله بدخیمیهای خونی و دیگر بدخیمیها بود.
استخراج RNA :
به طور ثابت برای هر یک از نمونههای بیمار و کنترل، 100 میکرولیتر از بافیکوت(لایه سفید مایل به خاکستری شامل گلبولهای سفید) در یک میکروتیوب 2 میلیلیتری ریخته شد. سپس یک میلیلیتر RNX-PLUSبه رسوب سلولی اضافه گردید و آن را کاملاً مخلوط کردیم تا تمامی سلولها از کف پلیت کنده شدند. مخلوط به درون یک میکروتیوپ 5/1 میلیلیتری منتقل شد. به مخلوط سلولی 300 میکرولیتر کلروفرم اضافه شد، به مدت 1 دقیقه به شدت تکان داده شد، سپس به مدت 10 دقیقه در دمای اتاق انکوبه گردید. مخلوط حاصل در دمای 4 درجه سانتیگراد(در میکروسانتریفیوژ یخچالدار) با دور rpm 12000 به مدت 20 دقیقه سانتریفیوژ شد. با احتیاط و بدون مخلوط شدن فاز وسطی، مایع بیرنگ رویی به میکروتیوب RNase DNase free منتقل شد. سپس 600 تا 800 میکرولیتر، به آن اتانول 100% سرد اضافه و پیپتاژ شد. ترکیب را به طور overnight در 20- درجه سانتیگراد نگهداری کردیم. محلول فوق به مدت 15 دقیقه در دمای 4 درجه سانتیگراد(در میکروسانتریفیوژ یخچالدار) با دور rpm 12000 سانتریفیوژ شد. مایعرویی دور ریخته شد و به رسوب سفید رنگ، 1 میلیلیتر از اتانل 70% سرد اضافه گردید و به خوبی ورتکس شد تا رسوب از ته میکروتیوب جدا گردید. محلول مورد نظر مجدداً در دمای 4 درجه سانتیگراد(در میکروسانتریفیوژ یخچالدار) با دور rpm 12000 این بار به مدت 10 دقیقه سانتریفیوژ شد. اتانول روی رسوب دور ریخته شد. رسوب در دمای اتاق قرار داده شد تا در حد امکان خشک شود. در مرحله آخر، رسوب در 20 میکرولیتر آب RNase freeکاملاً حل شد و نهایتاً محلول حاصل، جهت نگهداری، به فریزر 70- درجه سانتیگراد منتقل گردید. سپس غلظت RNA استخراج شده با روش بیوفتومتری سنجیده شد.
ساخت cDNA :
بعد از اندازهگیری غلظت RNA با دستگاه اسپکتروفتومتری برای مراحل ساخت cDNA از کیت سیناژن استفاده شد. ساختcDNA بر اساس دستورالعمل این کیت صورت گرفته است. 2میکروگرم RNA تخلیص شـده به همراه 20 میکرولیتر از آغازگر راندوم هگزامر، 6 میکرولیتر از RT-Buffer ، 3 میکرولیتر از dNTP به همراه 1 میکرولیتر آنزیم RT(Reverse Transcriptase) مورد رونویسی معکوس قرار گرفت. cDNA های ساخته شده در دمای 20- درجه سانتیگراد نگهداری شدند.
بررسی بیان ژن با روش Real Time PCR :
سنجش میزان بیان ژنها با روش Real Time PCR در دستگاه StepOne ABI شرکت بیوسیستم صورت گرفت. در این تحقیق ژن بتا دو میکروگلوبولین(B2) به عنوان ژن استاندارد و House keeping gene در نظر گرفته شد. رنگ فلورسنتی که برای Real Time PCR مورد استفاده قرار میگیرد سایبرگرین I است که رنگ متصل شونده به DNA دو رشتهای است. از RealQ Plus 2X Master Mix Green, high ROX شرکت آمپلیکون استفاده شد.
مواد مورد استفاده که برای هر واکنش مورد استفاده قرار گرفت بر این اساس است(جدول 1):
جدول 1: مواد مورد نیاز برای هر واکنش Real Time PCR
| اجزای تشکیلدهنده | غلظت(میکرولیتر) |
| Master Mix | 5/6 |
| Primer | 1 |
| cDNA | 1 |
| DiH2O | تا حجم 13 میکرولیتر |
یک نمونه کنترل منفی با عنوان NTC (No Template Control) نیز تهیه شد که شامل تمامی مواد فوق به غیر از cDNA میباشد.
نمونهها در دستگاه Real time PCR (ABI)، PCR شد (جداول 2 و 3).
بیان ژن P16 در بیماران CML و نمونههای افراد سالم به دست آمده و نتایج در برنامه REST2009 تجزیه و تحلیل شد.
در روش DDCt ، کارآیی PCR برای هر دو حالت و ژن House Keeping ، یکسان و 100% در نظر گرفته میشود؛ سپس با استفاده از فرمول زیر نسبت بیان ژن در دو حالت بررسی میشود.
DDCt- 2 = Fold change
نرمافزار REST 2009 یک الگوریتم مستقل است که به منظور آنالیز بیان ژن، نتایج خام حاصل از Real Time PCR را براساس روشهای محاسبات تصادفی (Randomization) و خود راهانداز (Bootstrapping) مورد تجزیه و تحلیل قرار میدهد. ضریب اطمینان (Confidense interval) حاصل از این آزمونها قادر است معناداری آماری آزمون را محاسبه کرده انحراف از معیار آنها را نیز اگرچه در بعضی از موارد بزرگ میشود، نشان دهد. نمودارهای ویشکرباکس (Wishker Box Plot) نتایج آنالیز هر ژن و پراکندگی این نتایج را نشان میدهند.
جدول 2: برنامه زمانی برای واکنش Real Time PCR
| مرحله | دما (سانتیگراد) | زمان | چرخه |
| فعالسازی آنزیم | 95 | 30 ثانیه | 1 |
| دناچوریشن | 95 | 5 ثانیه | 40 |
| آنیلینگ و اکستنشن | 60 | 30 ثانیه | 40 |
| برای رسم منحنی Melt افزایش دما از 50 درجه سانتیگراد تا 90 درجه سانتیگراد انجام شد. | |||
جدول 3: توالی آغازگرها برای بررسی بیان ژن
| ژن | توالی | |
| B2M | جلوبرنده | ATGCCTGCCGTGTGAAC |
| معکوس | ATCTTCAAACCTCCATGATG | |
| P16 | جلوبرنده | AAGGTCCCTCAGACATCC |
| معکوس | TCGGTGACTGATGATCTAAG | |
یافتهها
در بررسی اختصاصیت محصول Real-time PCR از منحنی ذوب استفاده میشود که قله منحنیها باید در راستای هم باشند(نمودار 1).
نتایـج Real Time PCR ، بیـان ژن P16 در بیمــاران نسبت به افراد سالم پس از آنالیز در برنامه REST2009 آمده است. بیان ژن P16 در 32 بیمارCML نسبت به گروه کنتـرل بـه طور معناداری کاهش بیان و در 8 بیمار نسبت به گروه کنترل به طور معناداری افزایش بیان را نشان داد (جداول 4 و 5، نمودارهای 2 و 3)(05/0 p≤). لازم به ذکر است که ژن B2M به عنوان کنترل داخلی در نظر گرفته شده است.

نمودار 1: نمونهای از منحنیهایReal Time PCR برای ژن P16
جدول 4: کاهش بیان ژن P16 در 32 بیمار
جدول 4: کاهش بیان ژن P16 در 32 بیمار
| ژن | نوع | بازدهی واکنش | بیان | نتیجه |
| B2M | رفرانس | 1 | 1 | |
| P16 | هدف | 1 | 248/0 | کاهش |

نمودار 2: کاهش بیان ژن P16 در بیماران مبتلا به لوسمی میلوئیدی مزمن(05/0 p≤)
جدول 5: افزایش بیان ژن P16 در 8 بیمار
| ژن | نوع | بازدهی واکنش | بیان | نتیجه |
| B2M | رفرانس | 1 | 1 | |
| P16 | هدف | 1 | 145/7 | افزایش |

نمودار 3: افزایش بیان P16 در بیماران مبتلا به لوسمی میلوییدی مزمن(05/0 p≤)
بحث
در این مطالعه بررسی بیان ژن P16 در 40 بیمار با روشReal Time PCR انجام شد. مطالعه حاضر نشان داد که بیان ژن P16 در 32 بیمارCML نسبت به گروه کنتــرل
به طور معناداری کاهش و در 8 بیمار نسبت به گروه کنترل به طور معناداری افزایش بیان داشته است.
CML، به عنوان سرطانی که با ناهنجاری ژنتیکی و کروموزومی فیلادلفیا همراه است، شناخته شده است.
فعالیت پروتئین کیناز BCR-ABL علت پاتوفیزیولوژیک بیماری لوسمی میلوئیدی مزمن میباشد(7). خاموش شدن یا حذف ژنهای سرکوبگر تومور مانند P16 و P53 مرتبط با فنوتیپ بدخیم CML است. مطالعههای صورت گرفته توسط میر رشید و همکارانش ارتباط کاهش بیان این ژن با پیشروی CML را نشان میدهد(8، 7).
حدف ژن P16 در انواعی از بدخیمیها از جمله لوسمیهای خاص دیده میشود که در مورد لوسمیها بیشترین حذف ژنی در ALL(لوسمی لنفوبلاستیک حاد)(30%) با میزان قابل توجهی در T-ALL میباشد. میزان حذف در CLL (لوسمی لنفوییدی مزمن)، مالتیپل میلوما، AML (لوسمی میلوییدی حاد)، CMLو MDS (سندرم میلودیسپلازی) بسیار پایین است(12-9).
طبق مطالعههای صورت گرفته توسط نسیف و همکاران، افزایش بیان ژن P16 و P14 در 18بیمار در فاز مزمن CML و 4بیمار در فاز بلاستیک CML نشان داده شده است(13). این افزایش بیان با مطالعههای لی و همکارانش مطابقت دارد(12). افزایش P16 میتواند در به تاخیر انداختن پیشروی بیماری نقش داشته باشد. هم چنین افزایش بیان P16 در لوسمی میلوییدی حاد نیز گزارش شده است(13). اما افزایش بیان این ژن در CML بیشتر دیده میشود که این حالت ممکن است با پاتوفیزیولوژی این دو لوسمی مرتبط باشد. نتایج به دست آمده در دیگر لوسمیها و تومورهای توپر به دلیل این که انواع جهشها در CML خیلی کمتر از دیگر لوسمیها رخ میدهد، متفاوت میباشد(14). تانی گوشی و همکارانش بیان این ژن در چندین بدخیمی هماتولوژیک را بررسـی کردند که از 8 بیمار CML، در 5 مورد افزایش بیــان P16
گزارش شده است. هم چنین در مطالعه دیگری که بر روی نمونه مغز استخوان افراد مبتلا به CML انجام شده، افزایش بیان این ژن گزارش شده است(15، 14). گزارشهای چان هو دای نشان میدهد که P16 در بیماری PV (پلیسایتمیورا) افزایش بیان دارد که با مطالعههای لی و همکارانش مطابقت دارد(16).
به نظر میرسد مکانیسم پیری سلول و توقف چرخه سلولی با مسیرهای P16Ink4a/RB و P14ARF/P53در ارتباط باشد. مطالعهها نشان میدهد که افزایش پیری سلول در موش و در بافتهای پوستی و کلیوی انسان به طور قابل توجهی با افزایش بیان ژن P16 در ارتباط است(18، 17). علاوه بر نقش P16 در تنظیم چرخه سلولی، این پروتئین در دیگر پروسههای سلولی از جمله آپوپتوز، تهاجم سلولی و آنژیوژنز نیز نقش دارد که این فعالیتها ممکن است با افزایش بیان آن در سرطان مرتبط باشد(19).
در دیگر سرطانها نیز تومور ساپرسور P16 بیان متفاوتی را از خود نشان داده است، گزارشهای جدید حاکی از این است که عدم بیان P16 با کاهش سطح رسپتورهای استروژنی و مقاومت درمانی در سرطان پستان مرتبط است(20). بیان بیش از حد این ژن در تومورهای انسانی میتواند نشاندهنده دو وضعیت اصلی باشد: 1- بیان بیش از حد در ضایعات خوشخیم یا پیش بدخیم 2- بیان بیش از حد در ضایعات بدخیم که افزایش بیان آن به نظر میرسد به دلیل مکانیسم توقف تکثیر سلولی به واسطه شکست مسیر RB یا رتینو پلاستوما(عفونت، جهش و یا خاموش شدن ژن RB و ...) باشد(19).
هم چنین بیان این ژن از طریق فعال کردن ژنهای دیگر که در رگزایی نقش دارند، اهمیت بیشتری دارد، چون یکی از فاکتورهایی که در فرآیند تسریع تومور نقش دارد، دسترسی بافت مهاجم به تغذیه خونی است که P16 این شرایط را فراهم میکند. در گزارش دیگری که در سال 2016 منتشر شده است، بین افزایش بیان ژنهای P16 و P14 ، عود بیماری و پیشآگهی بد بیماری ارتباط وجود دارد(21).
بررسی بیان ژن P16 نتایج متفاوتی را نشان داده است.
در چندین نوع تومور کاهش بیان و در مواردی افزایش بیان داشته است(27-22). افزایش بیان این ژن در سرطانهای کولورکتال و کارسینوم سلول پایه(Basal Cell Carcinoma) مشاهده شده است(30-28). سرطانهای پانکراس نمونهای از تومورهایی هستند که در 98% از آنها کاهش عملکرد P16 رخ میدهد(33-31). در سال 2003 مطالعه مینامی و همکارانش نشان دادند که P16 به طور قابل توجهی در خونسازی، گسترش تمایز و آپوپتوز سلولهای اریتروئیدی نقش دارد، از این رو نقش این ژن در خونسازی حائز اهمیت میباشد(34).
با توجه به مطالعههای انجام شده، کاهش یا بیان بیش از حد این تومور سرکوبگر میتواند در مکانیسم مولکولی این بیماری نقش داشته باشد و در CML با پیشرفت این بیماری در ارتباط میباشد، از این رو به مطالعههای بیشتری نیاز است تا مکانیسم و عملکرد دقیق این مهارکننده تومور در سرطان مشخص شود. پیشنهاد میشود در جامعه آماری وسیعتری و در فازهای پیشرفتهتر این بیماری، بیان این ژن بررسی شود و هم چنین بیان این ژن در افراد تحت درمان با داروهای مهارکننده تیروزین کینازی نیز بررسی گردد.
نتیجهگیری
با توجه به دادههای کسب شده، میتوان نتیجه گرفت
که ژن P16 در لوسمی میلوئیدی مزمن نسبت به گروه کنترل در برخی بیماران کاهش و در برخی افزاش بیان داشت که میتواند نشاندهنده این باشد که تغییرات بیان آن با پاتوفیزیولژی و فاز بیماری در ارتباط میباشد. هم چنین به مطالعههای دیگری نیاز است تا با مشخص کردن تغییرات بیان در تمام فازهای این بیماری نقش دقیق این ژن را مشخص نمود.
تشکر و قدردانی
این پژوهش در قالب پروژه پایاننامه در آزمایشگاه تحقیقات دانشکده پیراپزشکی دانشگاه علوم پزشکی البرز انجام شده است که بدین وسیله از آنها قدردانی میشود. هم چنین از آزمایشگاه تشخیص طبی و تخصصی پیوند به خاظر کمک در جمعآوری نمونهها تشکر میشود.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و انكولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






