جلد 14، شماره 4 - ( زمستان 1396 )
جلد 14 شماره 4 صفحات 334-325 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mahmoodian R, Salimian M, Hamidpour M, Gharehbaghian A. The effect of Platelets desensitization on the levels of residual platelets reactivity in the diabetes mellitus type 2 patients
. bloodj 2017; 14 (4) :325-334
URL: http://bloodjournal.ir/article-1-1130-fa.html
URL: http://bloodjournal.ir/article-1-1130-fa.html
محمودیان راضیه، سلیمیان مرتضی، حمیدپور محسن، قره باغیان احمد. تاثیر حساسیتزدایی پلاکتها بر مقادیر باقیمانده تحریکپذیری در پلاکتهای افراد مبتلا به دیابت ملیتوس نوع II
. فصلنامه پژوهشی خون. 1396; 14 (4) :325-334
دانشیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات سلولهای بنیادی خونساز دانشگاه علوم پزشکی شهید بهشتی
متن کامل [PDF 578 kb]
(1437 دریافت)
| چکیده (HTML) (5198 مشاهده)
مقدمه
دیابت، از گروه بیماریهای متابولیک است که با هایپرگلیسمی شناخته میشود و ناشی از اختلال در ترشح انسولین، عملکرد انسولین یا هر دو میباشد(1). نوع II دیابت قندی، عامل بیش از80% موارد دیابت ملیتوس است و در اثر تعامل بین فاکتورهای محیطی و وراثت شکل میگیرد(2). افزایش خطر ابتلا به آترواسکلروزیس از مهمترین وقایع ترومبوتیک در بیماران دیابت ملیتوس نوع II میباشد(3). هایپرگلیسمی به تنهایی تعریف دیابت نیست اما به عنوان یک فاکتور مستقل و مهم در ایجاد حالت پروترومبوتیک در بیماران دیابت ملیتوس نوع II نقش دارد(5، 4). فاکتورهای متعددی در ایجاد شرایط پروترومبوتیک در این بیماران تاثیر دارند(7، 6). تولید میکروپارتیکلهای پلاکتی در این شرایط بسیار حائز اهمیت است(8). مکانیسمهایی که باعث ایجاد پلاکتهای هایپراکتیو در این بیماران میشوند شامل: 1- هایپرگلیسمی، 2- کمبود انسولین و مقاومت به انسولین، 3- شرایط متابولیک مرتبط با دیابت مانند چاقی، دیس لیپیدمیا و افزایش التهاب سیستمیک(9). میکروپارتیکلهای پلاکتی(PMPs)، قطعات 1-1/0 میکرونی هستند که از غشای پلاکتهای فعال شده یا تحت استرس یا پلاکتهای در حال آپوپتوز با عمل ریزش(shedding) جدا میشوند. آنها غشای پلاسمایی فسفولیپیدی دارند و انواع رسپتورهای عملکردی را از پلاکتها به ارث میبرند(10). هم چنین میتوانند همانند پلاکت در هموستاز خون ، ترومبوز، سرطان و التهاب نقش ایفا کنند(11). مسیر وابسته به TF و میکروپارتیکلها به نظر نقش کلیدی در ترومبوفیلی دیابتی و عوارض قلبی ـ عروقی دارد(12).
حساسیتزدایی در پلاکتها پروسهای پیچیده و حساس است که نقش مهمی در خاموش کردن مسیرهای انتقال سیگنال در پلاکتها ایفا میکند و به سلول اجازه میدهد با تغییرات محیطی سازگار شود(13). در پلاکتهای هایپراکتیو، رها شدن مداوم و اتوکرین ADP از پلاکتهای فعال شده، منجر به حساسیتزدایی و کاهش حساسیت پلاکتها به آگونیست ADP میشود(14). هم چنین ممکن است این پدیده، در اثر عوارض جانبی ناشی از درمان طولانی مدت با داروهایی باشد که به عنوان آگونیست رسپتورها عمل میکنند(16، 15). آنتیژن سطحی ATP/CD39 دی فسفوهیدرولاز سطح عروق سالم، مانع از فعال شدن پلاکتها در شرایط طبیعی میشود و بنابراین در شرایط مختلف آسیب عروقی و اختلال در عملکرد عروق مانند بیماری دیابت، عملکرد این پروتئین مهار و سرکوب میشود و بنابراین فعال شدن پلاکتها اتفاق میافتد(17). ADP بیان دو دسته از رسپتورهای وابسته به G پروتئینها را فعال میکند: P2Y1 و P2Y12 . در پدیده حساسیتزدایی این دو رسپتور در پلاکتها نقش دارند و در اثر تماس طولانی مدت پلاکت ها با ADP، حساسیتزدایی اتفاق میافتد. مکانیسم حساسیتزدایی مکانیسمی پیچیده است و شامل فسفریلاسیون رسپتور، جدا شدن از G پروتئینها، داخل غشایی شدن(اینترنالیزه شدن) آنها توسط مکانیسمهای وابسته به کیناز و نهایتاً مهار داخل سلولی میشود(18). در این مطالعه سعی شده با تیمار خفیف آگونیستی پلاکتها، به بررسی این پدیده در پلاکتهای بیماران دیابتی پرداخته شود. رفتار پلاکتها در این مطالعه بر اساس بیان مارکر CD62P که مارکر فعال شدن پلاکت است، بررسی میشود. از آن جایی که میکروپارتیکلهای پلاکتی در بروز عوارض دیابت نقش مهم و قابل توجهی دارند، در این مطالعه میزان تشکیل میکروپارتیکلهای پلاکتی CD41+-Annexin-V+ نیز بررسی شده است.
مواد و روشها
جامعه مورد نظر در این مطالعه بنیادی ـ کاربردی از 40 نفر از بیماران دیابتی که به آزمایشگاه رفرانس دانشگاه علوم پزشکی کاشان مراجعه داشتند و 35 نفر از افراد سالم داوطلب انتخاب شد. افراد کنترل از بین مراجعهکنندگان به آزمایشگاه انتخاب شدند و افراد غیر دیابتی، غیر سیگاری، بدون سابقه مصرف مزمن دارویی و بدون سابقه بیماریهای ترومبوتیک بودند. شرط ورود به این مطالعه برای بیماران و افراد سالم ناشتا بودن و عدم مصرف داروهای آنتی پلاکتی بود که از افراد قبل از نمونهگیری سؤال پرسیده شد. هم چنین به منظور رعایت قوانین اخلاق از تمام شرکتکنندگان در پژوهش رضایت نامه کتبی گرفته شد. هم چنین نامه و مجوز کد اخلاق پزشکی به شماره IR.SBMU.RETECH.REC.1395.257 از دانشگاه علوم پزشکی شهید بهشتی دریافت شد.
جمعآوری نمونهها و آمادهسازی PRP :
نمونهها شامل 5 میلیلیتر از خون کامل در ضد انعقاد سیترات سدیم بود. پس از نمونهگیری، PRP توسط سانتریفیوژ با دور آهسته(RCT 2/0) و به مدت 10 دقیقه جدا شد. سپس PRP با پارافرمالدئید(PFA) 4% فیکس شد.
تیمار پلاکتها با دوز پایین و بالای ADP (Mild Agonist Stimulation Protocol):
تیمار خفیف آگونیستی با دوز پایین ADP انجام شد. به منظور القای تیمار خفیف آگونیستی در پلاکتهای موجود در نمونههای PRP ،PRP با غلظت پایین ADP (1 میکرومولار) و به مدت یک ساعت تیمار شد. تیمار پلاکتها با اضافه کردن پارافرمالدئید(PFA) با غلظت نهایی 1% متوقف گردید. پس از گذشت یک ساعت و تحریک پلاکتها با دوز پایین ADP ، پلاکتها در معرض ADP با غلظت بالا(10 میکرومولار) و به مدت 10 دقیقه تیمار شدند. این پروسه منجر به حساسیتزدایی پلاکتها به ADP گردید که با بررسیهای فلوسیتومتریک تایید شد. به منظور بررسی اثر هر کدام از غلظتهای ADP بر پلاکتها و مقایسه پلاکتهای دو گروه، برای هر نمونه PRP ، 4 لوله فلوسیتومتریک درنظر گرفته شد.
بررسیهای فلوسیتومتریک:
آنالیز نمونهها با استفاده از دستگاه فلوسیتومتری مدل (پارتک ـ آلمان، CyFlow®Space) انجام شد. برای هر نمونه PRP، 4 لوله در نظر گرفته شد. لوله اول حاوی پلاکتهای در حال استراحت(Baseline) و بدون اضافه کردن ADP بود. لوله دوم شامل پلاکتهای تیمار شده تنها با غلظت پایینADP (Low) به مدت انکوباسیون یک ساعت بود و لوله سوم حاوی پلاکتهای تیمار شده با ابتدا دوز پایین ADP و انکوباسیون یک ساعته و سپس تیمار شده با دوز بالای ADP (Low +High ADP) و انکوباسیون 10 دقیقه بود. لوله چهارم حاوی پلاکتهایی بود که تنها در معرض غلظت بالای ADP (High ADP) به مدت 10 دقیقه قرار گرفته بودند. سنجش فلوسیتومتری برای هر مرحله در دو لوله مجزا یکی برای انکوباسیون با آنتیبادی اختصاصی CD62P که با RPI کونژوگه(انگلیس، ABCAM) شده بود و لوله دیگر حاوی آنتیبادی اختصاصی CD41 کونژوگه شده با RPI (آلمان، داکو) و آنتیبادی اختصاصی Annexin- V کونژوگه شده با FITC (ترویژن، آمریکا) انجام شد. انکوباسیون نمونهها با آنتیبادیها به مدت یک ساعت و در دمای محیط با شیکینگ ملایم صورت گرفت. میزان بیان CD62P و مقدار میکروپارتیکلهای CD41+- Annexin-V+ در هر لوله سنجش شد. میزان بیان CD62P پس از گیتبندی پلاکتها در نمودار FSC در برابر SCC، به صورت نمودار هیستوگرام در کانال FL2 (آنتیبادی علیه CD62P) بررسی شد. در هر ران فلوسیتومتری از ایزوتایپ کنترل استفاده شد. به منظور گیتبندی میکروپارتیکلهای پلاکتی، در مرحله اول در نمودار FSC در برابر SCC، میکروپارتیکلها به صورت ذرات کمتر از یک میکرون گیتبندی شد و سپس با توجه به کانال FL1 (آنتیبادی علیه Annexin-V) و FL2 (آنتیبادی علیه CD41)، میکروپارتیکلها مشخص شدند. میزان بیان CD62P به صورت درصد و میزان شمارش میکروپارتیکلهای پلاکتی به صورت تعداد در میکرولیتر گزارش شد. دادههای حاصل از بررسیهای فلوسایتومتری توسط نرمافزار فلوجو(FlowJo 7.6.2, Engine 2.97000. OS version: Windows 7) تجزیه و تحلیل شدند.
آنالیزهای آماری:
به منظور مقایسه نتایج حاصل از فلوسایتومتری در هر دو گروه کنترل و بیمار از روشهای آماری One-way ANOVA و t test استفاده شد. هم چنین نمودارها با استفـاده از نـرمافـزار 16SPSS رسـم، مقـدار p valueبرای میـزان بیـن CD62P مسـاوی 003/0 و میــزان شمـــارش
میکروپارتیکلهای پلاکتی مساوی 004/0 محاسبه گردید.
یافتهها
بررسیهای فلوسایتومتریک نشان داد پلاکتهای بیماران دیابتی در مرحله Baseline بیان بالاتری از CD62P را دارا هستند و این پلاکتها حتی بدون حضور آگونیست ADP، سطح بالاتری از CD62P را بیان میکنند(شکل 1). در لولههای دوم تا چهارم مربوط به PRP ، این افزایش بیان CD62P در بیماران دیابتی نسبت به افراد سالم دیده شد که به علت پره اکتیو بودن پلاکتها در مرحله Baseline این تفاوت وجود داشت(نمودار 1). هم چنین از مقایسه لولههای High Dose با لولههای High+Low Dose میتوان نتیجه گرفت تیمار خفیف آگونیستی منجر به کاهش CD62P Induction و کاهش Reactivity پلاکتها میشود که این کاهش بیان CD62P ممکن است ناشی از پدیده Desensitization باشد که در اثر تیمار خفیف آگونیستی اتفاق افتاده است(نمودار 1). این پدیده نقش مهمی در خاموش کردن مسیرهای انتقال سیگنال در پلاکتهـا ایفـا میکند. این کاهش تحریکپذیری پلاکتها در برابر تیمار
خفیف آگونیستی در هر دو گروه پلاکتهای دیابتی و کنترل دیده شد اما در مورد پلاکتهای دیابتی میزان کاهش بیان CD62P بیشتر بود. هم چنین میزان حساسیت و تحریکپذیری پلاکتها نسبت به ADP محاسبه و به صورت افزایش یافته(Fold) گزارش گردید. این میزان حساسیت به ADP از طریق تقسیم میزان بیان CD62P در هر مرحله به میزان بیان CD62P در مرحله Baseline محاسبه شد و نمودار رسم گردید(نمودار 2). حساسیت و تحریکپذیری پلاکتها به ADP در نمونههای دیابتی کمتر و در نمونههای طبیعی بیشتر است. این بدین معنی است که هر چه پلاکت در فاز استراحت باشد، تحریکپذیری بیشتری با ADP دارد. از طرف دیگر تیمار خفیف آگونیستی پلاکتها که ممکن است موجب Desensitization پلاکتها گردد، منجر به کاهش تحریکپذیری پلاکتها به ADP شد.
پس از بررسی میزان بیان CD62P در هر لوله، شمارش میکروپارتیکلهای پلاکتی CD41+- Annexin-V+ نیز جداگانه در هر لوله انجام گرفت(نمودار 3 و شکل 2).
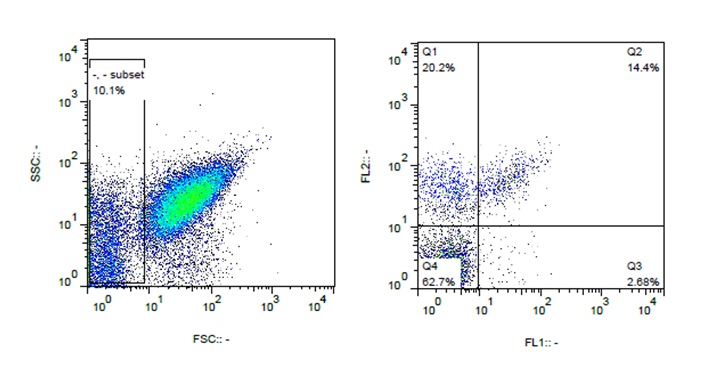
شکل 2: مراحل گیتبندی میکروپارتیکلهای پلاکتی. در مرحله اول در نمودار FSC در برابر SCC ، میکروپارتیکلها به صورت Event های کمتر از یک میکرون گیتبندی میشوند(سمت چپ). سپس با توجه با کانال FL1 (آنتیبادی علیه Annexin-V) و FL2(آنتیبادی علیه CD41) میکروپارتیکلها مشخص میشوند.
بحث
با توجه به دادههای حاصل از فلوسایتومتری میتوان گفت پلاکتها در مرحله Baseline و بدون تیمار با آگونیست در بیماران دیابتی، میزان CD62P بالاتری را بیان میکنند و از همان ابتدا پره اکتیو هستند که این وضعیت پلاکتها به محیط متابولیکی موجود در بیماران دیابتی مربوط است. پلاکتها به تغییرات محیطی بسیار حساسند و پاسخ میدهند. میزان غلظت گلوکز درون پلاکتها بیانگر مقدار غلظت گلوگز خارج سلولی است، چرا که گلوکـز برای ورود به پلاکت وابسته به انسولین نیست (21-19). هایپرگلیسمی مزمن و طولانی مدت امروزه به صورت مشخص یک فاکتور اصلی برای فعال شدن پلاکتها و ایجاد پلاکتهای هایپراکتیو در بیماران دیابتی شناخته شده است (24-22). تیمار پلاکتها با مقادیر خفیف آگونیست ADP در این مطالعه، منجر به کاهش القای بیان CD62P و کاهش Reactivity در پلاکتهای دیابتی و کنترل میشود و ممکن است ناشی از پدیده Desensitization باشد. میزان بیان CD62P در لولهای که تحت تیمار خفیف آگونیستی و سپس دوز بالای ADP قرار میگیرد نسبت به لوله تیمار شده، تنها با غلظت بالای ADP کمتر است و میتوان نتیجه گرفت پلاکتها تحت اثر پدیده Desensitization دچار کاهش پاسخ به آگونیست میشوند و این پدیده میتواند به پلاکتهایی که در محیط متابولیک دیابت، دائماً در معرض آگونیست قرار میگیرند کمک کند(25). این پدیده در پلاکتهای دیابتیک بیشتر است و منجر به کاهش بیشتر بیان CD62P میشود. پلاکتها در محیط متابولیک دیابت دائماً در معرض ADP تولید شده توسط پلاکتهایی هستند که در این محیط و تحت هایپرگلیسمی فعال شدهاند. بنابراین بر اساس یافتههای این پژوهش میتوان نتیجه گرفت این پدیده در کاهش فعال شدن پلاکتها در پاسخ به ADP مؤثر است. پلاکتها در بیماران دیابتیک پره اکتیو هستند و تحریکپذیری کمتری هم نسبت به ADP چه در دوز پایین و چه در دوز بالا نشان میدهند. این کاهش حساسیت و تحریکپذیری پلاکتهای دیابتیک ممکن است به این علـت بـاشد کـه Desensitization پلاکـتهای دیــابتی در
عروق دیابتی در تحریک مداوم با ADP اتفاق افتاده و منجر به کاهش پاسخ پلاکتها به ADP میشود. این در حالی است که در تمام مراحل تیمار آگونیستی، میزان حساسیت و تحریکپذیری پلاکتهای افراد غیر دیابتیک به ADP بیشتر است و میزان CD62P بالاتری را بیان میکنند. هم چنین تیمار خفیف آگونیستی در پلاکتها(در هر دو گروه) منجر به کاهش تحریکپذیری پلاکتها به ADP میشود. در مورد میکروپارتیکلهای پلاکتی یافتهها نشان میدهد چنانچه پلاکتهایی که در معرض تیمار خفیف آگونیستی در شرایط عروقی دیابتیک Desensitized شدند، اگر در معرض دوز بالای ADP مثلا تشکیل یک لخته ترومبوتیک قرار بگیرند میزان میکروپارتیکل بیشتری تولید میکنند. تولید زیاد و سیستماتیک میکروپارتیکلهای پلاکتی، یک مدیاتور پیش التهابی و فاکتور پاتولوژیکی محسوب میشود(26). هایپرگلیسمی مزمن و پلاکتهای هایپراکتیو با بیان بالای CD62P در بیماران دیابتی، فرد را مستعد آترواسکلروزیس میکند و امروزه آترواسکلروزیس، یکی از عوارض مطرح و مهم در این بیماران است. امروزه شواهد زیادی وجود دارد که نشان میدهد نقش پلاکتها در آترواسکلروزیس با واسطه تولید میکروپارتیکلهای پلاکتی میانجیگری میشود و این میکروپارتیکلها میتوانند به عنوان یک مارکر پیشآگهیدهنده در بیماریهای عروقی آترواسکلروتیک مانند دیابت به کار روند(28، 27). هم چنین پاسخ پلاکتها در این بیماران به مواد آنتیاگریگاسیون طبیعی در بدن مثل PGI2 و NO کاهش مییابد. تمام موارد در پاتوژنز آترواسکلروزیس در این بیماری نقش دارد. بر اساس دادههای حاصل از این پژوهش، در این بیماران پاسخ پلاکتها و تحریکپذیری آنها نسبت به ADP نیز کاهش نشان میدهد و این کاهش حساسیت به ADP ممکن است در کنار کاهش پاسخ به PGI2 و NO ، به نفع وقوع آترواسکلروزیس در این بیماران باشد(29). تولید لوکال میکروپارتیکلهای پلاکتی به دلیل ویژگیهای ساختاری و اندازه، آنها را به عنوان ابزاری قدرتمند در ارتباطات سلولی- پلاکتی، در انتقال مولکولهای بیواکتیو با منشاء پلاکت مانند فاکتورهای رشد و سایر مولکولهای سیگنالینگ و miRNA ها تبدیل کرده است. این در حالی است که در تولید سیستمیک و فراوان آنها در موقعیتهای پاتولوژیکی مختلف به عنوان یک مدیاتور پیش التهابی و فاکتور پاتولوژیکی عمل میکنند و باعث پیشبرد آترواسکلروزیس و عوارض ترومبوتیک میشوند(30). بنابراین بر اساس دادههای این پژوهش پلاکتهایی که دچار کاهش Reactivity میشوند، در عوض میکروپارتیکلهای بیشتری تولید میکنند و این میکروپارتیکلها در تولید سیستمیک، عوارض ترومبوتیک را به همراه میآورند و این پدیده ممکن است در عوارض دیابت نقش داشته باشد. زخمهای دیابتی یکی از شایعترین و جدیترین عوارض دیابت محسوب میشود. بهبود زخم یک پروسه دینامیک و بیولوژیک پیچیده است که شامل 4 فاز هموستاز، التهاب، پرولیفراتیو و ری مادلینگ میشود. این پروسهها شامل انواع سلولها، ترکیبات خارج سلولار، فاکتورهای رشد و سایتوکینها میشود که تمام این موارد در بیماری دیابت ملیتوس نوع II تحت تاثیر قرار میگیرد و منجر به تاخیر در بهبود زخمها در دیابت میشود. تیمار خفیف پلاکتها و ایجاد Desensitization، از آن جایی که
باعث کاهش Reactivity پلاکتها میشود، ممکن است خود عاملی باشد که به این دیر بهبود یافتن زخمهای دیابتی کمک کند(32، 31).
نتیجهگیری
پلاکتها در شرایط تیمار خفیف آگونیستی، با وجود بیان CD62P بالا، میزان تحریکپذیری پایینی به آگونیست ADP دارند که ممکن است ناشی از پدیده Desensitization باشد که به پلاکتها در سازگاری با محیط متابولیک خود کمک میکند. بنابراین این کاهش Reactivity پلاکتها نسبت به ADP میتواند در کنار کاهش حساسیت به PG-I2 و NO در افزایش بروز آترواسکلروزیس در بیماران دیابت نقش داشته باشد. از طرف دیگر پلاکتها تحت تاثیر این پدیده مستعد تولید میکروپارتیکلهای پلاکتی بیشتری میشوند که میتواند در عوارض ترومبوتیک دیابت نقش داشته باشد. هم چنین کاهش Reactivity پلاکتها نسبت به ADP در بیماران دیابتیک ممکن است خود عاملی باشد که به دیر بهبود یافتن زخمهای دیابتی کمک کند.
متن کامل: (3813 مشاهده)
تاثیر حساسیتزدایی پلاکتها بر مقادیر باقیمانده تحریکپذیری در
پلاکتهای افراد مبتلا به دیابت ملیتوس نوع II
راضیه محمودیان1، مرتضی سلیمیان2، محسن حمیدپور3، احمد قرهباغیان4
چکیده
سابقه و هدف
آترواسکلروزیس، از مهمترین وقایع ترومبوتیک در دیابت ملیتوس نوعII است. هیپرگلیسمی مزمن یک فاکتور اصلی برای فعال شدن پلاکتها در این بیماران میباشد. پدیده حساسیتزدایی در پلاکتها، پروسهای فیزیولوژیک است که نقش مهمی در خاموش کردن مسیرهای انتقال سیگنال در پاسخ به آگونیست دارد. در این پژوهش به بررسی این پدیده در پلاکتها در دیابت پرداخته شد.
مواد و روشها
در این مطالعه بنیادی ـ کاربردی،40 بیمار دیابت ملیتوس نوع II و 35 نفر از افراد داوطلب سالم به عنوان کنترل، انتخاب شدند. پس از جمعآوری نمونههای سیتراته و جدا کردن PRP ، حساسیتزدایی با دوز پایین ADP انجام شد. میزان بیان مارکر CD62P و میکروپارتیکلهای CD41+-Annexin-V+ با استفاده از فلوسیتومتری ارزیابی شد. نتایج دادهها با استفاده از آزمونهای آنوا و t-test تجزیه و تحلیل شدند.
یافتهها
نتایج نشان داد پلاکتهای دیابتیک در حالت Baseline نسبت به افراد سالم، CD62P بالاتری بیان میکنند. هم چنین در پلاکتهایی که حساسیتزدایی شدند، میزان بیان CD62P کمتر و میزان تشکیل میکروپارتیکل بیشتری داشتند(003/0 p=). میزان شمارش میکروپارتیکلهای پلاکتی در مورد پلاکتهای دیابتی بالاتر بود(52/74 ± SD: ، 004/0 p=).
نتیجه گیری
پلاکتها در شرایط تیمار خفیف آگونیستی، با وجود بیان CD62P بالا، تحریکپذیری پایینی به ADP دارند که ممکن است ناشی از پدیده حساسیتزدایی باشد که به پلاکتها در سازگاری با محیط متابولیک خود کمک میکند. هم چنین پلاکتها تحت تاثیر این پدیده مستعد تولید میکروپارتیکلهای پلاکتی بیشتری میشوند که میتواند در عوارض ترومبوتیک دیابت نقش داشته باشد.
کلمات کلیدی: ADP ، پلاکتها، دیابت قندی
تاریخ دریافت: 31/3/96
تاریخ پذیرش: 13/4/96
1- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- PhD هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی کاشان ـ کاشان ـ ایران
3- مؤلف مسئول: PhD خونشناسی و بانک خون ـ دانشیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات سلولهای بنیادی خونساز دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران ـ کد پستی: 1971653383
4- PhD ایمونوهماتولوژی بالینی ـ استاد دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای مادرزادی خونی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
پلاکتهای افراد مبتلا به دیابت ملیتوس نوع II
راضیه محمودیان1، مرتضی سلیمیان2، محسن حمیدپور3، احمد قرهباغیان4
چکیده
سابقه و هدف
آترواسکلروزیس، از مهمترین وقایع ترومبوتیک در دیابت ملیتوس نوعII است. هیپرگلیسمی مزمن یک فاکتور اصلی برای فعال شدن پلاکتها در این بیماران میباشد. پدیده حساسیتزدایی در پلاکتها، پروسهای فیزیولوژیک است که نقش مهمی در خاموش کردن مسیرهای انتقال سیگنال در پاسخ به آگونیست دارد. در این پژوهش به بررسی این پدیده در پلاکتها در دیابت پرداخته شد.
مواد و روشها
در این مطالعه بنیادی ـ کاربردی،40 بیمار دیابت ملیتوس نوع II و 35 نفر از افراد داوطلب سالم به عنوان کنترل، انتخاب شدند. پس از جمعآوری نمونههای سیتراته و جدا کردن PRP ، حساسیتزدایی با دوز پایین ADP انجام شد. میزان بیان مارکر CD62P و میکروپارتیکلهای CD41+-Annexin-V+ با استفاده از فلوسیتومتری ارزیابی شد. نتایج دادهها با استفاده از آزمونهای آنوا و t-test تجزیه و تحلیل شدند.
یافتهها
نتایج نشان داد پلاکتهای دیابتیک در حالت Baseline نسبت به افراد سالم، CD62P بالاتری بیان میکنند. هم چنین در پلاکتهایی که حساسیتزدایی شدند، میزان بیان CD62P کمتر و میزان تشکیل میکروپارتیکل بیشتری داشتند(003/0 p=). میزان شمارش میکروپارتیکلهای پلاکتی در مورد پلاکتهای دیابتی بالاتر بود(52/74 ± SD: ، 004/0 p=).
نتیجه گیری
پلاکتها در شرایط تیمار خفیف آگونیستی، با وجود بیان CD62P بالا، تحریکپذیری پایینی به ADP دارند که ممکن است ناشی از پدیده حساسیتزدایی باشد که به پلاکتها در سازگاری با محیط متابولیک خود کمک میکند. هم چنین پلاکتها تحت تاثیر این پدیده مستعد تولید میکروپارتیکلهای پلاکتی بیشتری میشوند که میتواند در عوارض ترومبوتیک دیابت نقش داشته باشد.
کلمات کلیدی: ADP ، پلاکتها، دیابت قندی
تاریخ دریافت: 31/3/96
تاریخ پذیرش: 13/4/96
1- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- PhD هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی کاشان ـ کاشان ـ ایران
3- مؤلف مسئول: PhD خونشناسی و بانک خون ـ دانشیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات سلولهای بنیادی خونساز دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران ـ کد پستی: 1971653383
4- PhD ایمونوهماتولوژی بالینی ـ استاد دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای مادرزادی خونی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
مقدمه
دیابت، از گروه بیماریهای متابولیک است که با هایپرگلیسمی شناخته میشود و ناشی از اختلال در ترشح انسولین، عملکرد انسولین یا هر دو میباشد(1). نوع II دیابت قندی، عامل بیش از80% موارد دیابت ملیتوس است و در اثر تعامل بین فاکتورهای محیطی و وراثت شکل میگیرد(2). افزایش خطر ابتلا به آترواسکلروزیس از مهمترین وقایع ترومبوتیک در بیماران دیابت ملیتوس نوع II میباشد(3). هایپرگلیسمی به تنهایی تعریف دیابت نیست اما به عنوان یک فاکتور مستقل و مهم در ایجاد حالت پروترومبوتیک در بیماران دیابت ملیتوس نوع II نقش دارد(5، 4). فاکتورهای متعددی در ایجاد شرایط پروترومبوتیک در این بیماران تاثیر دارند(7، 6). تولید میکروپارتیکلهای پلاکتی در این شرایط بسیار حائز اهمیت است(8). مکانیسمهایی که باعث ایجاد پلاکتهای هایپراکتیو در این بیماران میشوند شامل: 1- هایپرگلیسمی، 2- کمبود انسولین و مقاومت به انسولین، 3- شرایط متابولیک مرتبط با دیابت مانند چاقی، دیس لیپیدمیا و افزایش التهاب سیستمیک(9). میکروپارتیکلهای پلاکتی(PMPs)، قطعات 1-1/0 میکرونی هستند که از غشای پلاکتهای فعال شده یا تحت استرس یا پلاکتهای در حال آپوپتوز با عمل ریزش(shedding) جدا میشوند. آنها غشای پلاسمایی فسفولیپیدی دارند و انواع رسپتورهای عملکردی را از پلاکتها به ارث میبرند(10). هم چنین میتوانند همانند پلاکت در هموستاز خون ، ترومبوز، سرطان و التهاب نقش ایفا کنند(11). مسیر وابسته به TF و میکروپارتیکلها به نظر نقش کلیدی در ترومبوفیلی دیابتی و عوارض قلبی ـ عروقی دارد(12).
حساسیتزدایی در پلاکتها پروسهای پیچیده و حساس است که نقش مهمی در خاموش کردن مسیرهای انتقال سیگنال در پلاکتها ایفا میکند و به سلول اجازه میدهد با تغییرات محیطی سازگار شود(13). در پلاکتهای هایپراکتیو، رها شدن مداوم و اتوکرین ADP از پلاکتهای فعال شده، منجر به حساسیتزدایی و کاهش حساسیت پلاکتها به آگونیست ADP میشود(14). هم چنین ممکن است این پدیده، در اثر عوارض جانبی ناشی از درمان طولانی مدت با داروهایی باشد که به عنوان آگونیست رسپتورها عمل میکنند(16، 15). آنتیژن سطحی ATP/CD39 دی فسفوهیدرولاز سطح عروق سالم، مانع از فعال شدن پلاکتها در شرایط طبیعی میشود و بنابراین در شرایط مختلف آسیب عروقی و اختلال در عملکرد عروق مانند بیماری دیابت، عملکرد این پروتئین مهار و سرکوب میشود و بنابراین فعال شدن پلاکتها اتفاق میافتد(17). ADP بیان دو دسته از رسپتورهای وابسته به G پروتئینها را فعال میکند: P2Y1 و P2Y12 . در پدیده حساسیتزدایی این دو رسپتور در پلاکتها نقش دارند و در اثر تماس طولانی مدت پلاکت ها با ADP، حساسیتزدایی اتفاق میافتد. مکانیسم حساسیتزدایی مکانیسمی پیچیده است و شامل فسفریلاسیون رسپتور، جدا شدن از G پروتئینها، داخل غشایی شدن(اینترنالیزه شدن) آنها توسط مکانیسمهای وابسته به کیناز و نهایتاً مهار داخل سلولی میشود(18). در این مطالعه سعی شده با تیمار خفیف آگونیستی پلاکتها، به بررسی این پدیده در پلاکتهای بیماران دیابتی پرداخته شود. رفتار پلاکتها در این مطالعه بر اساس بیان مارکر CD62P که مارکر فعال شدن پلاکت است، بررسی میشود. از آن جایی که میکروپارتیکلهای پلاکتی در بروز عوارض دیابت نقش مهم و قابل توجهی دارند، در این مطالعه میزان تشکیل میکروپارتیکلهای پلاکتی CD41+-Annexin-V+ نیز بررسی شده است.
مواد و روشها
جامعه مورد نظر در این مطالعه بنیادی ـ کاربردی از 40 نفر از بیماران دیابتی که به آزمایشگاه رفرانس دانشگاه علوم پزشکی کاشان مراجعه داشتند و 35 نفر از افراد سالم داوطلب انتخاب شد. افراد کنترل از بین مراجعهکنندگان به آزمایشگاه انتخاب شدند و افراد غیر دیابتی، غیر سیگاری، بدون سابقه مصرف مزمن دارویی و بدون سابقه بیماریهای ترومبوتیک بودند. شرط ورود به این مطالعه برای بیماران و افراد سالم ناشتا بودن و عدم مصرف داروهای آنتی پلاکتی بود که از افراد قبل از نمونهگیری سؤال پرسیده شد. هم چنین به منظور رعایت قوانین اخلاق از تمام شرکتکنندگان در پژوهش رضایت نامه کتبی گرفته شد. هم چنین نامه و مجوز کد اخلاق پزشکی به شماره IR.SBMU.RETECH.REC.1395.257 از دانشگاه علوم پزشکی شهید بهشتی دریافت شد.
جمعآوری نمونهها و آمادهسازی PRP :
نمونهها شامل 5 میلیلیتر از خون کامل در ضد انعقاد سیترات سدیم بود. پس از نمونهگیری، PRP توسط سانتریفیوژ با دور آهسته(RCT 2/0) و به مدت 10 دقیقه جدا شد. سپس PRP با پارافرمالدئید(PFA) 4% فیکس شد.
تیمار پلاکتها با دوز پایین و بالای ADP (Mild Agonist Stimulation Protocol):
تیمار خفیف آگونیستی با دوز پایین ADP انجام شد. به منظور القای تیمار خفیف آگونیستی در پلاکتهای موجود در نمونههای PRP ،PRP با غلظت پایین ADP (1 میکرومولار) و به مدت یک ساعت تیمار شد. تیمار پلاکتها با اضافه کردن پارافرمالدئید(PFA) با غلظت نهایی 1% متوقف گردید. پس از گذشت یک ساعت و تحریک پلاکتها با دوز پایین ADP ، پلاکتها در معرض ADP با غلظت بالا(10 میکرومولار) و به مدت 10 دقیقه تیمار شدند. این پروسه منجر به حساسیتزدایی پلاکتها به ADP گردید که با بررسیهای فلوسیتومتریک تایید شد. به منظور بررسی اثر هر کدام از غلظتهای ADP بر پلاکتها و مقایسه پلاکتهای دو گروه، برای هر نمونه PRP ، 4 لوله فلوسیتومتریک درنظر گرفته شد.
بررسیهای فلوسیتومتریک:
آنالیز نمونهها با استفاده از دستگاه فلوسیتومتری مدل (پارتک ـ آلمان، CyFlow®Space) انجام شد. برای هر نمونه PRP، 4 لوله در نظر گرفته شد. لوله اول حاوی پلاکتهای در حال استراحت(Baseline) و بدون اضافه کردن ADP بود. لوله دوم شامل پلاکتهای تیمار شده تنها با غلظت پایینADP (Low) به مدت انکوباسیون یک ساعت بود و لوله سوم حاوی پلاکتهای تیمار شده با ابتدا دوز پایین ADP و انکوباسیون یک ساعته و سپس تیمار شده با دوز بالای ADP (Low +High ADP) و انکوباسیون 10 دقیقه بود. لوله چهارم حاوی پلاکتهایی بود که تنها در معرض غلظت بالای ADP (High ADP) به مدت 10 دقیقه قرار گرفته بودند. سنجش فلوسیتومتری برای هر مرحله در دو لوله مجزا یکی برای انکوباسیون با آنتیبادی اختصاصی CD62P که با RPI کونژوگه(انگلیس، ABCAM) شده بود و لوله دیگر حاوی آنتیبادی اختصاصی CD41 کونژوگه شده با RPI (آلمان، داکو) و آنتیبادی اختصاصی Annexin- V کونژوگه شده با FITC (ترویژن، آمریکا) انجام شد. انکوباسیون نمونهها با آنتیبادیها به مدت یک ساعت و در دمای محیط با شیکینگ ملایم صورت گرفت. میزان بیان CD62P و مقدار میکروپارتیکلهای CD41+- Annexin-V+ در هر لوله سنجش شد. میزان بیان CD62P پس از گیتبندی پلاکتها در نمودار FSC در برابر SCC، به صورت نمودار هیستوگرام در کانال FL2 (آنتیبادی علیه CD62P) بررسی شد. در هر ران فلوسیتومتری از ایزوتایپ کنترل استفاده شد. به منظور گیتبندی میکروپارتیکلهای پلاکتی، در مرحله اول در نمودار FSC در برابر SCC، میکروپارتیکلها به صورت ذرات کمتر از یک میکرون گیتبندی شد و سپس با توجه به کانال FL1 (آنتیبادی علیه Annexin-V) و FL2 (آنتیبادی علیه CD41)، میکروپارتیکلها مشخص شدند. میزان بیان CD62P به صورت درصد و میزان شمارش میکروپارتیکلهای پلاکتی به صورت تعداد در میکرولیتر گزارش شد. دادههای حاصل از بررسیهای فلوسایتومتری توسط نرمافزار فلوجو(FlowJo 7.6.2, Engine 2.97000. OS version: Windows 7) تجزیه و تحلیل شدند.
آنالیزهای آماری:
به منظور مقایسه نتایج حاصل از فلوسایتومتری در هر دو گروه کنترل و بیمار از روشهای آماری One-way ANOVA و t test استفاده شد. هم چنین نمودارها با استفـاده از نـرمافـزار 16SPSS رسـم، مقـدار p valueبرای میـزان بیـن CD62P مسـاوی 003/0 و میــزان شمـــارش
میکروپارتیکلهای پلاکتی مساوی 004/0 محاسبه گردید.
یافتهها
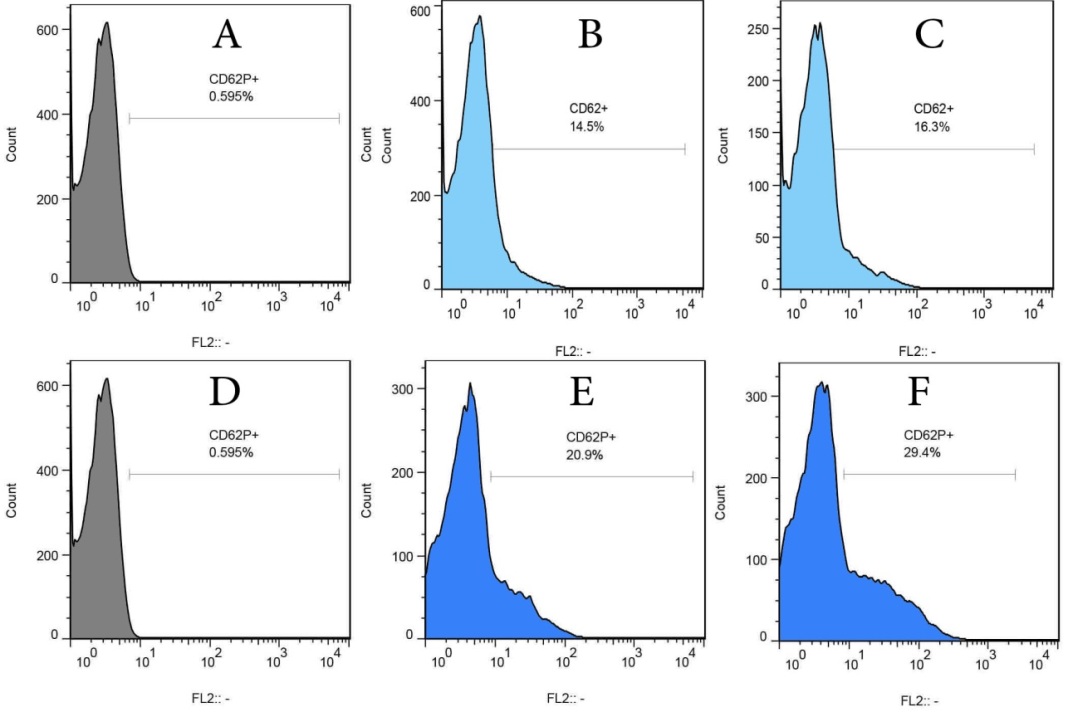
بررسیهای فلوسایتومتریک نشان داد پلاکتهای بیماران دیابتی در مرحله Baseline بیان بالاتری از CD62P را دارا هستند و این پلاکتها حتی بدون حضور آگونیست ADP، سطح بالاتری از CD62P را بیان میکنند(شکل 1). در لولههای دوم تا چهارم مربوط به PRP ، این افزایش بیان CD62P در بیماران دیابتی نسبت به افراد سالم دیده شد که به علت پره اکتیو بودن پلاکتها در مرحله Baseline این تفاوت وجود داشت(نمودار 1). هم چنین از مقایسه لولههای High Dose با لولههای High+Low Dose میتوان نتیجه گرفت تیمار خفیف آگونیستی منجر به کاهش CD62P Induction و کاهش Reactivity پلاکتها میشود که این کاهش بیان CD62P ممکن است ناشی از پدیده Desensitization باشد که در اثر تیمار خفیف آگونیستی اتفاق افتاده است(نمودار 1). این پدیده نقش مهمی در خاموش کردن مسیرهای انتقال سیگنال در پلاکتهـا ایفـا میکند. این کاهش تحریکپذیری پلاکتها در برابر تیمار
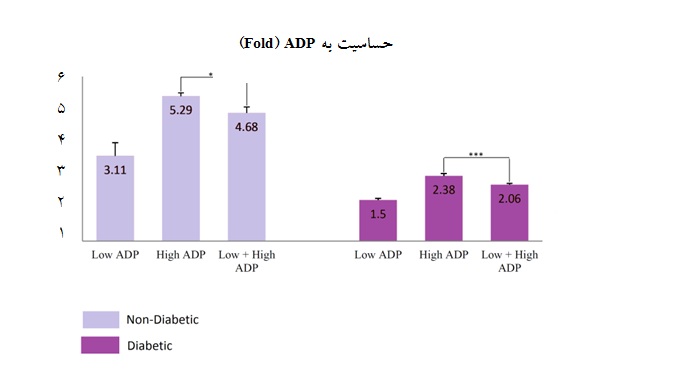
خفیف آگونیستی در هر دو گروه پلاکتهای دیابتی و کنترل دیده شد اما در مورد پلاکتهای دیابتی میزان کاهش بیان CD62P بیشتر بود. هم چنین میزان حساسیت و تحریکپذیری پلاکتها نسبت به ADP محاسبه و به صورت افزایش یافته(Fold) گزارش گردید. این میزان حساسیت به ADP از طریق تقسیم میزان بیان CD62P در هر مرحله به میزان بیان CD62P در مرحله Baseline محاسبه شد و نمودار رسم گردید(نمودار 2). حساسیت و تحریکپذیری پلاکتها به ADP در نمونههای دیابتی کمتر و در نمونههای طبیعی بیشتر است. این بدین معنی است که هر چه پلاکت در فاز استراحت باشد، تحریکپذیری بیشتری با ADP دارد. از طرف دیگر تیمار خفیف آگونیستی پلاکتها که ممکن است موجب Desensitization پلاکتها گردد، منجر به کاهش تحریکپذیری پلاکتها به ADP شد.
پس از بررسی میزان بیان CD62P در هر لوله، شمارش میکروپارتیکلهای پلاکتی CD41+- Annexin-V+ نیز جداگانه در هر لوله انجام گرفت(نمودار 3 و شکل 2).

شکل 1: میزان بیان CD62P در نمودارهای هیستوگرام در مراحل مختلف تیمار آگونیستی در نمونه PRP افراد سالم و دیابتی. نمودار A و D مربوط به ایزوتایپ کنترل هستند. نمودار B مربوط به مرحله Low+High ADP در نمونه کنترل و نمودار C مربوط به مرحله High ADP در نمونه کنترل. نمودار E مربوط به مرحله Low+High ADP در نمونه دیابتی و نمودار F مربوط به مرحله High ADP در نمونه دیابتیک.
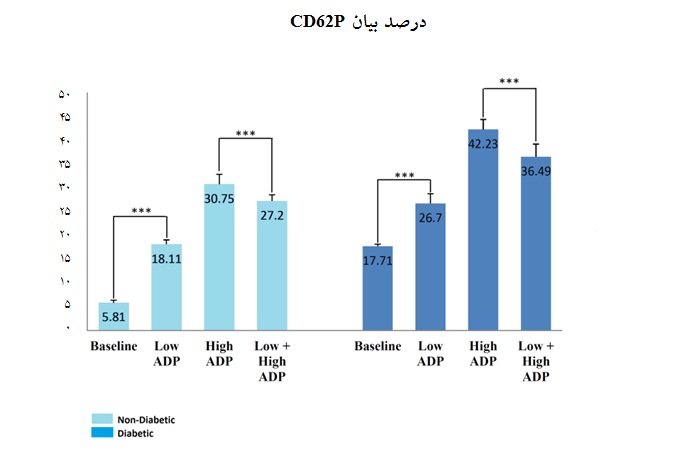
نمودار 1: میزان بروز CD62P در مرحله Baseline و سایر مراحل تیمار آگونیستی
***004/0 p = نشاندهنده وجود تغییرات معنادار در مقایسه با گروه غیر دیابتی است.

نمودار 1: میزان بروز CD62P در مرحله Baseline و سایر مراحل تیمار آگونیستی
***004/0 p = نشاندهنده وجود تغییرات معنادار در مقایسه با گروه غیر دیابتی است.

|
نمودار 2: میزان حساسیت پلاکتهای دیابتی و طبیعی به آگونیست ADP در لولههای مختلف
*** 003/0 p= نشاندهنده وجود تغییرات معنادار در مقایسه با گروه غیر دیابتی است. |
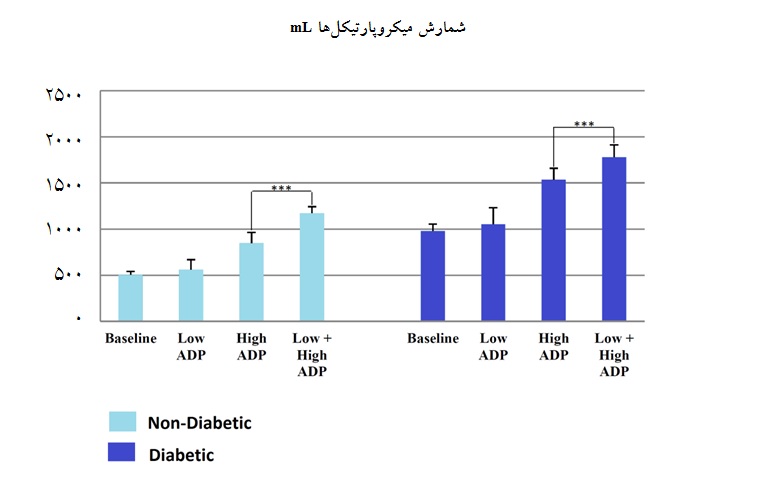
میزان شمارش میکروپارتیکلهای پلاکتی در هر چهار لوله در مورد پلاکتهای دیابتی بالاتر بود و تشکیل میکروپارتیکلها در این بیماران نسبت به افراد سالم افزایش بیشتری نشان داد. در نمونه پلاکتهای Baseline نیز، میکروپارتیکلها تشکیل شدند که ناشی از فعال شدن پلاکتها در طول فرآیند نمونهگیری و مراحل آمادهسازی است. اما یافته قابل توجه در مورد میکروپارتیکلها این بود که بیشترین میزان تشکیل میکروپارتیکلهای پلاکتی در لوله High +Low ADP بود و نه High ADP . بر خلاف انتظار، پلاکتهایی که با دوز پایین ADP ، تیمار شدند و پس از آن در معرض دوز بالای ADP قرار گرفتند، میزان تشکیل میکروپارتیکل بیشتری نسبت به پلاکتهایی داشتند که در معرض فقط تیمار با غلظت بالای ADP قرار گرفتند. بنابراین پلاکتهایی که در ابتدا در معرض تیمار خفیف آگونیستی قرار گرفته بودند و سپس با دوز بالای ADP تیمار شدند، علیرغم این که CD62P Induction پایینتری داشتند اما مستعد تولید میکروپارتیکلهای پلاکتی بیشتری بودند.

|
نمودار 3: میزان شمارش میکروپارتیکلهای پلاکتی در مراحل مختلف تیمار آگونیستی
*** 004/0 p= نشاندهنده وجود تغییرات معنادار در مقایسه با گروه غیر دیابتی است. |

شکل 2: مراحل گیتبندی میکروپارتیکلهای پلاکتی. در مرحله اول در نمودار FSC در برابر SCC ، میکروپارتیکلها به صورت Event های کمتر از یک میکرون گیتبندی میشوند(سمت چپ). سپس با توجه با کانال FL1 (آنتیبادی علیه Annexin-V) و FL2(آنتیبادی علیه CD41) میکروپارتیکلها مشخص میشوند.
بحث
با توجه به دادههای حاصل از فلوسایتومتری میتوان گفت پلاکتها در مرحله Baseline و بدون تیمار با آگونیست در بیماران دیابتی، میزان CD62P بالاتری را بیان میکنند و از همان ابتدا پره اکتیو هستند که این وضعیت پلاکتها به محیط متابولیکی موجود در بیماران دیابتی مربوط است. پلاکتها به تغییرات محیطی بسیار حساسند و پاسخ میدهند. میزان غلظت گلوکز درون پلاکتها بیانگر مقدار غلظت گلوگز خارج سلولی است، چرا که گلوکـز برای ورود به پلاکت وابسته به انسولین نیست (21-19). هایپرگلیسمی مزمن و طولانی مدت امروزه به صورت مشخص یک فاکتور اصلی برای فعال شدن پلاکتها و ایجاد پلاکتهای هایپراکتیو در بیماران دیابتی شناخته شده است (24-22). تیمار پلاکتها با مقادیر خفیف آگونیست ADP در این مطالعه، منجر به کاهش القای بیان CD62P و کاهش Reactivity در پلاکتهای دیابتی و کنترل میشود و ممکن است ناشی از پدیده Desensitization باشد. میزان بیان CD62P در لولهای که تحت تیمار خفیف آگونیستی و سپس دوز بالای ADP قرار میگیرد نسبت به لوله تیمار شده، تنها با غلظت بالای ADP کمتر است و میتوان نتیجه گرفت پلاکتها تحت اثر پدیده Desensitization دچار کاهش پاسخ به آگونیست میشوند و این پدیده میتواند به پلاکتهایی که در محیط متابولیک دیابت، دائماً در معرض آگونیست قرار میگیرند کمک کند(25). این پدیده در پلاکتهای دیابتیک بیشتر است و منجر به کاهش بیشتر بیان CD62P میشود. پلاکتها در محیط متابولیک دیابت دائماً در معرض ADP تولید شده توسط پلاکتهایی هستند که در این محیط و تحت هایپرگلیسمی فعال شدهاند. بنابراین بر اساس یافتههای این پژوهش میتوان نتیجه گرفت این پدیده در کاهش فعال شدن پلاکتها در پاسخ به ADP مؤثر است. پلاکتها در بیماران دیابتیک پره اکتیو هستند و تحریکپذیری کمتری هم نسبت به ADP چه در دوز پایین و چه در دوز بالا نشان میدهند. این کاهش حساسیت و تحریکپذیری پلاکتهای دیابتیک ممکن است به این علـت بـاشد کـه Desensitization پلاکـتهای دیــابتی در
عروق دیابتی در تحریک مداوم با ADP اتفاق افتاده و منجر به کاهش پاسخ پلاکتها به ADP میشود. این در حالی است که در تمام مراحل تیمار آگونیستی، میزان حساسیت و تحریکپذیری پلاکتهای افراد غیر دیابتیک به ADP بیشتر است و میزان CD62P بالاتری را بیان میکنند. هم چنین تیمار خفیف آگونیستی در پلاکتها(در هر دو گروه) منجر به کاهش تحریکپذیری پلاکتها به ADP میشود. در مورد میکروپارتیکلهای پلاکتی یافتهها نشان میدهد چنانچه پلاکتهایی که در معرض تیمار خفیف آگونیستی در شرایط عروقی دیابتیک Desensitized شدند، اگر در معرض دوز بالای ADP مثلا تشکیل یک لخته ترومبوتیک قرار بگیرند میزان میکروپارتیکل بیشتری تولید میکنند. تولید زیاد و سیستماتیک میکروپارتیکلهای پلاکتی، یک مدیاتور پیش التهابی و فاکتور پاتولوژیکی محسوب میشود(26). هایپرگلیسمی مزمن و پلاکتهای هایپراکتیو با بیان بالای CD62P در بیماران دیابتی، فرد را مستعد آترواسکلروزیس میکند و امروزه آترواسکلروزیس، یکی از عوارض مطرح و مهم در این بیماران است. امروزه شواهد زیادی وجود دارد که نشان میدهد نقش پلاکتها در آترواسکلروزیس با واسطه تولید میکروپارتیکلهای پلاکتی میانجیگری میشود و این میکروپارتیکلها میتوانند به عنوان یک مارکر پیشآگهیدهنده در بیماریهای عروقی آترواسکلروتیک مانند دیابت به کار روند(28، 27). هم چنین پاسخ پلاکتها در این بیماران به مواد آنتیاگریگاسیون طبیعی در بدن مثل PGI2 و NO کاهش مییابد. تمام موارد در پاتوژنز آترواسکلروزیس در این بیماری نقش دارد. بر اساس دادههای حاصل از این پژوهش، در این بیماران پاسخ پلاکتها و تحریکپذیری آنها نسبت به ADP نیز کاهش نشان میدهد و این کاهش حساسیت به ADP ممکن است در کنار کاهش پاسخ به PGI2 و NO ، به نفع وقوع آترواسکلروزیس در این بیماران باشد(29). تولید لوکال میکروپارتیکلهای پلاکتی به دلیل ویژگیهای ساختاری و اندازه، آنها را به عنوان ابزاری قدرتمند در ارتباطات سلولی- پلاکتی، در انتقال مولکولهای بیواکتیو با منشاء پلاکت مانند فاکتورهای رشد و سایر مولکولهای سیگنالینگ و miRNA ها تبدیل کرده است. این در حالی است که در تولید سیستمیک و فراوان آنها در موقعیتهای پاتولوژیکی مختلف به عنوان یک مدیاتور پیش التهابی و فاکتور پاتولوژیکی عمل میکنند و باعث پیشبرد آترواسکلروزیس و عوارض ترومبوتیک میشوند(30). بنابراین بر اساس دادههای این پژوهش پلاکتهایی که دچار کاهش Reactivity میشوند، در عوض میکروپارتیکلهای بیشتری تولید میکنند و این میکروپارتیکلها در تولید سیستمیک، عوارض ترومبوتیک را به همراه میآورند و این پدیده ممکن است در عوارض دیابت نقش داشته باشد. زخمهای دیابتی یکی از شایعترین و جدیترین عوارض دیابت محسوب میشود. بهبود زخم یک پروسه دینامیک و بیولوژیک پیچیده است که شامل 4 فاز هموستاز، التهاب، پرولیفراتیو و ری مادلینگ میشود. این پروسهها شامل انواع سلولها، ترکیبات خارج سلولار، فاکتورهای رشد و سایتوکینها میشود که تمام این موارد در بیماری دیابت ملیتوس نوع II تحت تاثیر قرار میگیرد و منجر به تاخیر در بهبود زخمها در دیابت میشود. تیمار خفیف پلاکتها و ایجاد Desensitization، از آن جایی که
باعث کاهش Reactivity پلاکتها میشود، ممکن است خود عاملی باشد که به این دیر بهبود یافتن زخمهای دیابتی کمک کند(32، 31).
نتیجهگیری
پلاکتها در شرایط تیمار خفیف آگونیستی، با وجود بیان CD62P بالا، میزان تحریکپذیری پایینی به آگونیست ADP دارند که ممکن است ناشی از پدیده Desensitization باشد که به پلاکتها در سازگاری با محیط متابولیک خود کمک میکند. بنابراین این کاهش Reactivity پلاکتها نسبت به ADP میتواند در کنار کاهش حساسیت به PG-I2 و NO در افزایش بروز آترواسکلروزیس در بیماران دیابت نقش داشته باشد. از طرف دیگر پلاکتها تحت تاثیر این پدیده مستعد تولید میکروپارتیکلهای پلاکتی بیشتری میشوند که میتواند در عوارض ترومبوتیک دیابت نقش داشته باشد. هم چنین کاهش Reactivity پلاکتها نسبت به ADP در بیماران دیابتیک ممکن است خود عاملی باشد که به دیر بهبود یافتن زخمهای دیابتی کمک کند.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





