جلد 14، شماره 3 - ( پاییز 1396 )
جلد 14 شماره 3 صفحات 236-227 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shokoohian F, Sharifi Z, Mohammadi Pour M, Yari F. Cloning and Expression of Recombinant Human CD40L in HEK293 Cell line. bloodj 2017; 14 (3) :227-236
URL: http://bloodjournal.ir/article-1-1114-fa.html
URL: http://bloodjournal.ir/article-1-1114-fa.html
شکوهیان بهاره، شریفی زهره، محمدی پور مهشید، یاری فاطمه. همسانهسازی و بیان ژن نوترکیب CD40Lانسانی در رده سلولی HEK293. فصلنامه پژوهشی خون. 1396; 14 (3) :227-236
دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 621 kb]
(2284 دریافت)
| چکیده (HTML) (5606 مشاهده)
مقدمه
CD40 لیگاند(CD40L ، CD145 ، gp39 ، HIGM1 ، IMD3 و TNFSF5) یک پروتئین غشایی تیپII ۳۹ کیلو دالتونی است که به خانواده فاکتور نکروز توموری (TNFSF) تعلق داشته و سهم زیادی در انتقال پیام سلولی در ایمنی ذاتی و تطبیقی دارا میباشد(1). این پروتئین توسط انواعی از سلولها هم چون لنفوسیت B و T پلاکتهای فعال شده، مونوسیت، سلولهای دندرتیک، ماکروفاژها، بیان میشود(3، 2). ژن CD40L بر روی کروموزومX واقع شده و یک گلیکوپروتئین 261 اسیدآمینهای را کد میکند که در فرم غشایی شامل سه دومین میباشد. چنانچه CD40L غشایی از متیونین 113 (Met113) دومین خارج سلولی شکسته شود،CD40L محلول یا sCD40L ایجاد میگردد. CD40L فعال، چه به فرم غشایی و چه به فرم محلول، ساختاری هوموترایمری دارد، این ساختار مالتیمری نقش مهمی در برهمکنش مؤثر با CD40 و پیامدهی سلولی متعاقب آن دارد(4، 2). برهمکنش CD40-CD40L برای پاسخ وابسته به T-cell لنفوسیتهای B به آنتیژنها، ایجاد سلولهای B خاطره و پلاسماسل و القای تولید آنتیبادی IgG ، افزایش شکلگیری مراکز زایا در هماهنگی با سلولهای T ضروری است. به علاوه ردپای سیستم دوتایی CD40-CD40L در بسیاری از بیماریها از جمله بیماریهای التهابی رودهIBD))، پیشرفت عفونت HIV و التهاب عصبی وابسته به HIV ، انواع سرطانها، آترواسکلروزیس، لوپوس، درماتومیوزیس و آلزایمر دیده میشود(10-5، 1). در واقع برهمکنش CD40 و CD40L با فراهم کردن سیگنال ثانویه مورد نیاز، منجر به آغاز پاسخ ایمنی هومورال و پاسخ ایمنی با واسطه سلولی میگردد(11، 7). این حقیقت که CD40L قادر به القای تکثیر و تمایز لنفوسیتهای B و T است، در مطالعههای بسیـاری بـه اثبـات رسیـده است (17-12، 7). اما اخیراً چندین بررسی آزمایشگاهی تأثیر چند برابری فرم مالتیمری CD40L نوترکیب را بر القای ایمنی هومورال و سلولی نشان دادهاند(21-18).
تولید فرم محلول پروتئینهای TNFSF ، بسیار حائز اهمیـت اسـت، زیـرا بـررسی این پروتئینها و گیرندههای
اختصاصی آنها در فرم غشایی پیچیدگیهای بسیاری داشته و به دلیل وجود عوامل مداخلهگر، تفسیر نتایج را غیر ممکن میسازد. به علاوه فرمهای محلول چندین پروتئین از این خانواده کاربرد درمانی دارد(24-22).
به منظور تولید پروتئینهای محلول از خانواده TNF دو راه وجود دارد: میتوان فرم غشایی را تولید کرد و پس از آن با اثر دادن پروتئاز، بخش خارج سلولی پروتئین را در محیط آزاد ساخت، و یا تنها بخش خارج غشایی را به همراه یک توالی راهنما کلون و سنتز کرد. در هر دو حالت، فرم محلول پروتئینهای TNFSF که هموترایمرهای تکی هستند، ناپایدار خواهند بود(25).
روشی که به طور معمول برای حل مشکل ناپایداری پروتئینهای مالتیمری در فرم محلول استفاده میشود، به کارگیری پروتئین مورد نظر در کنار یک قطعه از یک پروتئین دیگر که دارای توانایی دایمر و یا مالتیمر شدن به طور خودبهخودی میباشد، است(24). از جمله این پروتئینهای خود مالتیمر شونده سورفکتانت پروتئین D (SP-D) میباشد. SP-Dیک لکتین تیپ C است که توسط سلولهای اپیتلیال(عمدتاً سلولهای اپیتلیال ریه) بیان میشود. این پروتئین به شکل دودکامری(Dodecameric) متشکل از چهار زیر واحد ترایمری میباشد(26). با جایگزین کردن دومین خارج سلولی(ECD) پروتئینهای خانواده TNF با ناحیه لکتینی میتوان پروتئینهای دودکامری ایجاد کرد.
با توجه به این که بیشتر اعضای خانواده TNS نقش درمانی داشته و تولید آنها به شکل پروتئینهای محلول و مالتیمری امکانپذیر و مؤثر میباشد، بررسی و مطالعه چگونگی طراحی و ساخت پروتئینهای مالتیمری اهمیت پیدا میکند و این اهمیت با توجه به مطالعههای محدودی که در زمینه ساخت پروتئینهای مالتیمری در ایران صورت گرفته، پررنگتر میشود. در میان اعضای این خانواده، نقش کلیدی پروتئین CD40L در انواع زمینههای تشخیصی و درمانی از جمله کنترل التهاب، تولید واکسن، درمان سرطان و افزایش بازده تولید آنتیبادی و هم چنین عدم تولید این پروتئین در ایران، ما را برآن داشت تا شکل دودکامری CD40L محلول را از طریق پروتئین مالتیمرکننده سورفکتانت پروتئین D تولید و در سلولهای بیانی یوکاریوتی HEK293 بیان کنیم.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود.
طراحی و ساخت ژن SPD-CD40L :
به منظور طراحی سازه کایمری توالی آمینو اسیدی سورفکتانت پروتئین D انسانی با شماره دسترسی NP_003010.4 و پروتئین CD40L انسانی با شماره دسترسی NP_000065.1 از بانک اطلاعات پروتئین NCBI به دست آمد. با جایگزین کردن بخش خارج سلولی (ECD) پروتئین CD40L (اسیدآمینههای 47 تا 261) با ناحیه لکتینی سورفکتانت پروتئین D (اسیدآمینههای 262 تا 375)، توالی اولیه پروتئین به طول 472 اسیدآمینه طراحی شد. سپس ساختمان سوم پروتئین کایمری SPD-CD40L توسط نرمافزارهای بیوانفورماتیکی تایید شده و توالی نوکلئوتیدی آن توسط شرکت ژنکاست (لوگزامبورگ) ساخت و در حامل پلاسمیدی pcDNA3.1(+) قرار گرفت.
آمادهسازی پلاسمید نوترکیب و تراریختی سلولهای بیانی یوکاریوتی:
کشت شبانه باکتری E.coli سویه Top10 در mL 5 از محیط مایع LB (Lysogeny Broth) با گرماگذاری در دمای 37 درجه سانتیگراد و چرخش 200 دور در دقیقه (rpm) انجام شد. سپس محیط کشت باکتریها به مدت 5 دقیقه با سرعت 5000 دور در دقیقه(rpm) سانتریفیوژ گردید و پس از خارج کردن محیط کشت، رسوب باکتری با استفاده از تیمار شیمیایی توسط کلرید کلسیم(CaCl2) 1/0 مولار و قرار دادن بر روی یخ به سلول مستعد تبدیل شد. پس از آمادهسازی سلولهای E.coli جهت پذیرش پلاسمید، تراریختی سلولهای مستعد به روش شوک حرارتی انجام گرفت. سوسپانسیون باکتریایی حاصل بر روی محیط کشت LB جامد حاوی آنتیبیوتیک آمپیسیلین با غلظت µg/mL 100 پخش شده و به مدت یک شب در دمای 37 درجه سانتیگراد قرار داده شد.
پلاسمید pcDNA3.1(+) با استفاده از کیت استخراج پلاسمید شرکت وایوژن (Cat. NO. GF2001) و طبق روش مندرج کیت جداسازی شد. به منظور بررسی صحت همسانهسازی ژن هدف در حامل pcDNA3.1(+) ، از روش توالییابیsequencing)) و بررسی الگوی هضم آنزیمی (digestion pattern) استفاده شد. حامل پلاسمیدی نوترکیبpcDNA–SPD-CD40L با استفاده از آنزیمهای محدودکننده HindIII و EcoRI و طبق دستورالعمل شرکت سازنده آنزیمها(فرمنتاز، انگلستان) در دمای 37 درجه سانتیگراد به مدت 5 ساعت هضم شد. محصول واکنش هضم، با استفاده از الکتروفورز در ژل آگارز 1% بررسی گردید.
کشت و نگهداری سلولهای HEK293 :
رده سلولی HEK293 از بانک سلولی انستیتو پاستور ایران تهیه و در محیط کشت RPMI-1460 حاوی 10% سرم جنین گاوی(FBS)، محلول پنیسیلین(U/mL 100)، استرپتومایسین(µg/mL 100) و mM 2 L-گلوتامین کشت داده شد. سپس در انکوباتور 37 درجه سانتیگراد با CO2 5% نگهداری و هر دو روز یک بار محیط کشت آن تعویض گردید.
ترانسفکشن سلولهای HEK293 و جمعآوری محلول رویی:
سلولها روز قبل از ترانسفکشن شمارش شده و تعداد 105×5 سلول به هر چاهک از پلیت 6 خانهای اضافه شد. µg 2 پلاسمید استخراج شده حاوی قطعه ژن مورد نظر (معادل µL 10) به µL 190 محیط کشت فاقد FBS و آنتیبیوتیک پنیسیلین- استرپتومایسین اضافه شد و محلول به مدت 5 دقیقه در دمای محیط گرماگذاری گردید.
µL 6 X-tremeGENE™ HP DNA Transfection Reagent ((Cat. NO. 06366236001 محصول شرکت رُوش آلمان به محلول افزوده و محلول حاصل جهت تشکیل کمپلکس به مدت 30 دقیقه در دمای محیط گرماگذاری شد. محلول حاوی کمپلکس معرف و پلاسمید نوترکیب به محیط کشت سلولها اضافه شده و پلیت به مدت 6 ساعت در انکوباتور 37 درجه سانتیگراد گرماگذاری شد. سپس محیط کشت رویی خارج شده و محیط کشت جدید حاوی 10% FBS و 1% آنتیبیوتیک پنیسیلین - استرپتومایسین به سلولها اضافه شد. سلولها به مدت 24 و 48 ساعت در انکوباتور 37 درجه سانتیگراد گرماگذاری شدند.
بررسی و تأیید بیان پروتئین نوترکیب:
استخراج RNA :
استخراج RNA از سلولهای HEK293 تراریخت شده پس از جمعآوری مایع رویی سلولها، با استفاده از محلول ترایزول TriPure Isolation Reagent (رُوش، آلمان) طبق دستورالعمل شرکت سازنده انجام شد. کمیت و کیفیت RNA استخراج شده با دستگاه اسپکتروفتومتر نانودراپ و هم چنین الکتروفـورز بـر روی ژل آگـارز 1% سنجیـده شد.
ساخت cDNA :
ساخت cDNA به روش نسخهبرداری معکوس (فرمنتاز، انگلستان) انجام شد. برای این منظور µg 5/4 RNA با آب مقطر حاوی DEPC به حجم نهایی µL 20 رسید و آغازگرهای 6 نوکلئوتیدی تصادفی(Random hexamers) به آن اضافه شد. مخلوط حاصل به مدت 5 دقیقه در دمای 65 درجه سانتیگراد قرار گرفت و سپس به آن بافر، آنزیم نسخهبردار معکوس، نوکلئوتیدهای آزاد سه فسفاته (dNTPs) و مهارکننده RNase اضافه شد. مخلوط واکنش در ترمال سایکلر(بیوراد، آمریکا) تکثیر شد. بررسی کیفیت cDNA با واکنش PCR با استفاده از آغازگرهای اختصاصی ژن بتا اکتین به عنوان کنترل و بررسی وجود cDNA مربوط به SPD-CD40L با آغازگرهای اختصاصی نواحی داخلی ژن SPD-CD40L به طور جداگانه انجام شد و در نهایت محصول واکنشهای PCR با الکتروفورز برروی ژل آگارز 2% مشاهده و بررسی گردید(جدول 1).
آزمایش SDS-PAGE :
بـه منظـور تاییـد بیـان و بررسی وزن مولکولی پروتئین
SPD-CD40L ، پـس از تخلیـص پـروتئین از محیط کشت
سلولهای HEK293 24 و 48 ساعته بهوسیله ستون کروماتوگرافی تمایلی که حاوی آنتیبادی اختصاصی Anti-CD40L (ابکم، کمبریج، Cat. NO. ab47204) تثبیت شده بود، آزمایش SDS-PAGE در سیستم بافری ناپیوسته شامل ژل متراکم کننده و ژل جداکننده 12% انجام شد. نمونهها پس از سانتریفیوژ، به وسیله سرنگ همیلتون در کنار شاخص وزن مولکولی به چاهکهای ژل منتقل شدند. بعد از اتمام الکتروفورز به مدت 2:20 ساعت در اختلاف پتانسیل 120 ولت، کاست حاوی ژل باز شد. ژل پلیآکریلآمید با استفاده از رنگ کوماسیبلو به مدت 2 ساعت روی شیکر رنگ شده و پس از 2 ساعت رنگزدایی با محلول رنگبر مورد بررسی قرار گرفت.
آزمایش الایزا :
پس از آن اختصاصیت پروتئین نوترکیب SPD-CD40L با استفاده از روش الایزا بررسی شد. به این منظور µL 50 SPD-CD40L تخلیص شده از مایعرویی سلولی (24 و 48 ساعته) به عنوان نمونه مورد بررسی، sCD40L تخلیص شده از کنسانتره پلاکتی به عنوان کنترل مثبت و بافر PBS و HCG (گنادوتروپین) به عنوان کنترل منفی، به چاهکهای پلیت الایزا اضافه شد و پلیت به مدت یک شب در یخچال 4 درجه سانتیگراد قرار گرفت. سپس خانههای کوت شده، از پروتئین خالی گشته، µL 100 محلول مسدودکننده (آلبومین + آزاید) به هرکدام افزوده و به مدت 3 ساعت در دمای اتاق قرار گرفت. پساز خارج کردن محلول مسدودکننده از خانهها، µL 50 محلول آنتیبادی Anti-CD40L (ابکم، کمبریج، Cat. NO. ab47204) با رقت 1:200 در PBS به هر خانه اضافه شده و به مدت 1 ساعت در انکوباتور 37 درجه سانتیگراد گرماگذاری شد. چاهکها توسط محلول شستشو 05/0%PBS-T (PBS + Tween20) شستشو شدند و µL 50 از کونژوگه آنزیمیAnti-mouse IgG با آنزیمHRP (سیگما، آمریکا، (Cat. NO. A0170 با رقت 1:1000 به هـر خانه اضافه شد و پلیت به مدت 1 ساعت در دمای اتاق قرار گرفت.
جدول 1: توالی آغازگرهای طراحی شده برای ناحیه داخلی ژن SPD-CD40L و ژن بتااکتین
پس از شستشوی دوباره، µL 50 از محلول TMB به هر چاهک اضافه شده و پلیت به مدت 15 دقیقه در تاریکی و در دمای اتاق گرماگذاری شد. در نهایت با افزودن µL 50 محلول اسید کلریدریک به هر چاهک، واکنش متوقف گردید و جذب نوری چاهکها با استفاده از دستگاه خوانش الایزا در طول موج 450 نانومتر خوانده شد.
آزمایش دات بلات (Dot Blot):
برای بررسی وجود و اختصاصیت پروتئین نوترکیب، آزمایش دات بلات نیز انجام شد. در این روش محلول پروتئینی به طور مستقیم به شکل نقاط جدا از هم به غشاء PVDF (رُوش، آلمان) منتقل شد و آنتیبادی اختصاصی (آنتیبادی Anti-CD40L) اضافه گردید، سپس آنتیبادی کونژوگه با HRP افزوده شد که پس از مواجهه با سوبسترای ECL (Enhanced Chemi Lumineseence) باعث ایجاد سیگنال قابل مشاهده از طریق دستگاه تصویربرداری مولکولی گردید.
یافتهها
بررسی صحت همسانهسازی:
وکتور پلاسمیدی نوترکیبpcDNA–SPD-CD40L با استفاده از آنزیمهای محدودالاثر HindIII و EcoRI در بافر مشترک هضم شد. محصول واکنش هضم، با استفاده از الکتروفورز در ژل آگارز 1% بررسی گردید. خارج شدن قطعه 1428 جفت بازی حاصل از هضم آنزیمی با شاخص اندازه مولکولی، نشان دهنده صحت همسانهسازی بود (شکل1).
بررسی بیان در سطح RNA :
بـه منظـور مشاهـده قطعات مورد انتظار در نتیجه تکثیر
نواحی داخلی ژنهای بتا اکتین و SPD-CD40L، الکتروفورز انجام شد. در نتیجه الکتروفورز محصول واکنش PCR در ژل آگارز 2% در بافر TAE، مشاهده دو باند 190 جفت بازی حاصل تکثیر cDNA سلولهای آزمایش و کنترل با آغازگرهای بتااکتین نشاندهنده کیفیت cDNA بود، به علاوه وجود باند 118 جفت بازی محصول تکثیر ناحیه داخلی ژن کدکننده SPD-CD40L در سلولهای HEK293 با استفاده از آغازگرهای اختصاصی و عدم مشاهده این باند در نمونه کنترل نشان دهنده بیان ژن مورد نظر در سطح RNA بود (شکل2).
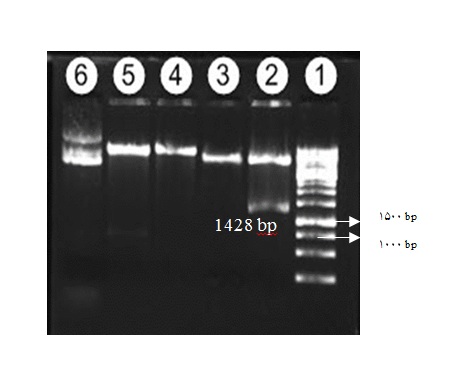
شکل1: الکتروفورز محصول واکنش هضم آنزیمی وکتور نوترکیب. ستون 1 شاخص اندازه مولکولی یک کیلو بازی، ستون 2 جدا شدن قطعه ژنی SPD-CD40L به طول 1428 جفت باز از پلاسمید pcDNA پس از هضم با آنزیمهای HindIII و EcoRI ، ستون 3 پلاسمید pcDNA بدون قطعه ورودی هضم شده با آنزیمهای HindIII و EcoRI ، ستون 4 وکتور نوترکیب برش خورده با آنزیم HindIII ، ستون 5 وکتور نوترکیب برش خورده با آنزیم EcoRI و ستون 6 وکتور نوترکیب هضم نشده که به سه شکل حلقوی، خطی و سوپرکویل وجود دارد را نشان میدهد.
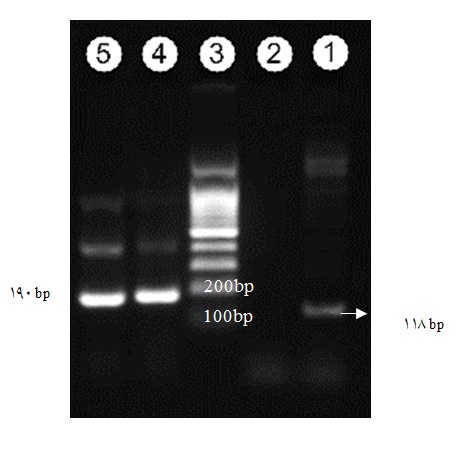
شکل 2: الکتروفورز محصول PCR. ستون 3 مارکر وزن مولکولی 100 جفتبازی میباشد. در ستون 1 و2 به ترتیب محصول تکثیر ژن SPD-CD40L از سلولهای HEK293 ترانسفکت شده و ترانسفکت نشده (کنترل منفی) نشان داده شده است. وجود باند 118 جفتبازی در ستون 1 بیانگر بیان ژن SPD-CD40L در سطح RNA میباشد. در ستونهای 4 و 5 نیز به ترتیب باند محصول تکثیر ژن بتا اکتین در سلولهای HEK293 تست و کنترل نشان داده شده است.
بررسی بیان و اختصاصیت پروتئین SPD-CD40L :
الکتروفورز پروتئینها با استفاده از روش SDS-PAGE انجام شد. باندهای حاصل از الکتروفورز عمودی SPD-CD40L تخلیص شده از محیط کشت سلولهای HEK293 به دست آمده از کشت 24 و 48 ساعته، با مطالعههای مشابه قبلی همخوانی داشت(شکل3). باندهای 58 و 64 کیلودالتونی نشاندهنده سطوح مختلف گلیکوزیلاسیون پروتئین نوترکیب میباشند. اختصاصیت پروتئین نوترکیب SPD-CD40L با استفاده از روش الایزا تایید شد. در این روش پس از اتصال پروتئین به کف پلیت و افزودن آنتیبادی اختصاصی (آنتیبادی Anti-CD40L)، آنتیبادی کونژوگه با HRP اضافه گردید که پس از مواجهه با سوبسترای TMB سبب واکنش رنگزا شد. تشکیل محصول رنگـی حاصـل از واکـنش آنزیمـی، نشـاندهنــده واکنش اختصاصی و ویژگی آنتیژن نوترکیب SPD-CD40L بود(جدول 2). آزمایش دات بلات بهمنظور بررسی وجود و اختصاصیت پروتئین موردنظر انجام شد.
لکههای تیره مشخص شده در شکل 4، نقاط واکنش مثبت سوبسترای ECL با آنتیبادی کونژوگه با HRP را نشان میدهند. مشاهده این نقاط، تأییدی بر وجود و ویژگی پروتئین SPD-CD40L تخلیص شده از محیط کشت سلولهای HEK293 میباشد.
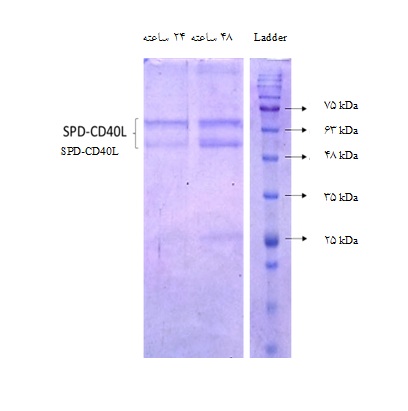
شکل 3 : SDS-PAGE پروتئین نوترکیب SPD-CD40L در ژل پلیآکریل آمید %12. ستون سمت راست نشاندهنده مارکر وزن مولکولی است. ستون وسط نشاندهنده SPD-CD40L تخلیص شده از مایع رویی سلولهای HEK293 پس از کشت 48 ساعته و ستون سمت چپ نشاندهنده SPD-CD40L تخلیص شده از مایع رویی سلولهای HEK293 پس از کشت 24 ساعته میباشد.
جدول 2: نتایج الایزا پروتئین نوترکیب SPD-CD40L

شکل 4: آزمایش دات بلات پروتئین نوترکیبSPD-CD40L . نقطه A نشاندهنده نمونه CD40L تخلیص شده از کنسانتره پلاکتی میباشد که به عنوان کنترل مثبت در نظر گرفته شده است. نقاط B و C نشاندهنده SPD-CD40L نوترکیب بیان شده توسط سلولهای HEK293 ، 48 و 24 ساعته میباشند. در نقطه D پروتئین BSA به عنوان کنترل منفی لکهگذاری شد و در این نقطه هیچ لکهای مشاهده نگردید. نقطه E نشاندهنده Lysate سلولهای HEK293 ترانسفکت شده و نقطه F نشاندهنده Lysate سلولهای HEK293 ترانسفکت نشده(به عنوان کنترل منفی نمونه Lysate) میباشد.
بحث
با توجه به اهمیت این پروتئین در انواع زمینههای تشخیصی و درمانی و عدم تولید آن در ایران، در مطالعه حاضر پروتئین SPD-CD40L با استفاده از نرمافزارهای بیوانفورماتیکی طراحی شده و توالی نوکلئوتیدی آن ساخت و در پلاسمید (+)pcDNA3.1 همسانهسازی شد. سلولهای HEK293 به عنوان میزبان بیانی مورد استفاده قرارگرفته و ترانسفکت شدند. بیان CD40L نوترکیب در سطح RNA توسط RT-PCR بررسی شد. پس از تأیید بیان در سطح RNA ، تخلیص پروتئین نوترکیب با روش کروماتوگرافی تمایلی صورت گرفت و وزن مولکولی پروتئین نوترکیب توسط SDS-PAGE تعیین گردید. به منظور بررسی اختصاصیت پروتئین نیز از آزمونهای ELISA وDot Blot استفاده شد.
ایجاد لنفوسیتهای B فعال همواره از جنبههای مختلف حائز اهمیت بوده است. عدهای از محققان با هدف تبدیل لنفوسیـت B بـه سلولهـای عـرضهکننده آنتیژن فعـال در
آزمایشگاه و به کارگیری این سلولها در جهت فعال کردن
و افزایش پاسخ T-cellها و عدهای دیگر به منظور افزایش بازده سلولهای هیبریدوما در تولید آنتیبادی، به این مهم پرداختهاند(27). به همین علت مطالعههای بسیاری به منظور افزایش تحریک و فعال کردن لنفوسیتهای B صورت گرفته است. یکی از پروتئینهایی که در سالهای اخیر به دلیل نقش کلیدی که در فعال کردن ایمنی ذاتی و تطبیقی دارد بسیار مورد توجه واقع شده، CD40L میباشد. اما بزرگترین مشکل در تحریک CD40 با واسطه منومرهای CD40L یا آنتیبادی، اثر ضعیف این پروتئینها بر تحریک و تکثیر B-cell است(18). بررسیهای بیشتر بر روی مکانیسم اثر CD40L نشان داد که این پروتئین از طریق کلاستر کردن گیرنده خود موجب انتقال پیام در سلول هدف شده و بنابراین با افزایش میزان تجمع گیرنده میتوان اثر قویتر و ماندگارتری را ایجاد کرد(11).
در سال 2001 هزول و همکارانش با تولید دو فرم مختلف از CD40L زاویهای متفاوت از تولید پروتئینهای نوترکیب مالتیمری را نشان دادند. اولین پروتئین تولیدی آنها یک ترایمر تکی از بخش خارج سلولی CD40L و دیگری پروتئین 4- ترایمری تشکیل شده از بدنه اصلی SP-D و بخش خارج سلولی CD40L موشی بود. نتایج آنها نشاندهنده اثر بیشتر فرم دودکامری در مقایسه با فرم ترایمری در فعالکردن لنفوسیتهای B بود. هزول به منظور اتصال پروتئین SP-D به بخش خارج سلولی CD40L از توالی لینکر GGGNS استفاده کرد که با بررسیهای بیوانفورماتیکی و پیشبینی ساختار سوم پروتئین بهنظر میرسد این توالی اثر مطلوبی در فولدینگ سازه نهایی نداشته باشد، بنابراین در این مطالعه، این توالی حذف شد(19).
مطالعه بعدی توسط هالر و کورنبلات در سال 2003 حاکی از تولید پروتئین ادغامی 2-ترایمری تشکیل شده از Acrp30 و بخش خارج سلولی CD40L بود. این پروتئین هگزامری اثری کمتر از فرم دودکامری اما بیشتر از شکل ترایمری پروتئین CD40L داشت(28).
در سـال 2005 جیانــگ و همکارانــــش با انتقال ژن
CD40L موشـی بـه لایــن سلولی H22 توسط وکتور بیانی pcDNA3.1(+) ، CD40L ترایمری را بیان کردند. در مطالعه
حاضر از CD40L انسانی و سلولهای HEK293 استفاده شده و علاوه بر 4- ترایمری بودن سازه، پروتئین به صورت ترشحی طراحی گشته است که این مسئله برداشت و تخلیص پروتئین را تسهیل میکند(29).
در سال 2006 استون و همکارانش هر دو شکل 2-ترایمری و 4- ترایمری CD40L را بیان کرده و به صورت in vivo مورد مطالعه قرار دادند، بررسیهای وزن مولکولی پروتئین نوترکیب با روش SDS-PAGE، توسط وی بیانگر تولید پروتئینی با وزن تقریبی 58 کیلودالتون بود که این نتیجه با مطالعه حاضر و بررسیهای بیوانفورماتیکی در مورد پیشبینی وزن مولکولی پروتئین نوترکیب (49 کیلودالتون به علاوهی وزن دو زنجیره کربوهیدراتی) مطابقت دارد (30).
در نهایت ریچارد کورنبلات در سال 2008 با ثبت انحصاری موفق به تولید این دو پروتئین با نام تجاری Multimeric Biotherapeutics شد(31).
با توجه به این که ظرفیت محدود و بازده پایین سلولهای هیبریدوما در تولید آنتیبادی مونوکلونال یکی از دلایل قیمت نسبتاً بالای این محصول محسوب میگردد، یافتن راهی جهت تحریک این سلولها میتواند راهکاری کارآمد برای کاهش هزینههای تولید آنتیبادی باشد و مطالعه حاضر اولین مرحله در راستای رسیدن به سوی هدف مذکور است. بنابراین مقایسه اثر CD40L مالتیمری نوترکیب با فرم طبیعی CD40L در محیط in vivo بر تحریک تولید آنتیبادی از لنفوسیتهای B در مطالعههای دیگر پیشنهاد میگردد.
نتیجهگیری
حاصل این مطالعه طراحی و همسانهسازی موفقیتآمیز شکل 4- ترایمری(دودکامری) پروتئین CD40L با استفاده از پروتئین خود مالتیمر شونده سورفکتانت پروتئین D بود که به دنبال آن پروتئین کایمری از طریق وکتور pcDNA3.1(+) در میزبان بیانی یوکاریوتی HEK293 بیان شد. پروتئین نوترکیب تخلیص شده و اختصاصیت آن تایید گردید. نتایج حاصل از SDS-PAGE بیانگر تولید فرم
دودکامری مورد نظر با وزن مولکولی مطلوب بود.
تشکر و قدردانی
این مقاله حاصل پایانامه دانشجویی دوره کارشناسی ارشد رشته بیوتکنولوژی پزشکی مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون با کد اخلاق IR.TMI.REC.1394.27 میباشد. بودجه این مطالعه توسط مؤسسهی آموزشی و پژوهشی طب انتقال خون تأمین گردیده و همه مراحل عملی پروژه در مرکز تحقیقات سازمان انتقال خون انجام شده است.
متن کامل: (3172 مشاهده)
همسانهسازی و بیان ژن نوترکیب CD40Lانسانی در
رده سلولی HEK293
بهاره شکوهیان1، زهره شریفی2، مهشید محمدیپور3، فاطمه یاری4
چکیده
سابقه و هدف
CD40L ، پروتئینی غشایی و یکی از اعضای خانواده TNF است که نقش مهمی در انتقال پیام سلولی در ایمنی ذاتی و تطبیقی دارد. از آن جاییکه این پروتئین نقش خود را از طریق تجمع گیرنده در سطح سلول هدف ایفا میکند، به نظر میرسد فرم مالتیمری آن بتواند اثر قویتری نسبت به فرم طبیعی ترایمری ایجاد کند. بر این اساس در این مطالعه کلونینگ و بیان فرم کایمری و دودکامری CD40L محلول، از طریق پروتئین خود مالتیمر شونده سورفاکتانت پروتئین (SP-D) D، در رده سلولی HEK293 مورد بررسی قرار گرفت.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود. پروتئین SPD-CD40L به صورت in silico طراحی و در پلاسمید pcDNA3.1(+) همسانهسازی شد. سلولهای HEK293 به عنوان میزبان بیانی مورد استفاده قرار گرفته و ترانسفکت شدند. بیان CD40L نوترکیب در سطح RNA به وسیله RT-PCR بررسی شد. پس از تخلیص پروتئین نوترکیب با روش کروماتوگرافی تمایلی، وزن مولکولی آن توسط SDS-PAGE تعیین گردید. به منظور بررسی اختصاصیت پروتئین نیز از روشهای ELISA وDot Blot استفاده شد.
یافتهها
نتایج به دست آمده نشاندهنده ترانسفکشن سلولهای HEK293 و بیان پروتئین نوترکیب پس از 24 و 48 ساعت از زمان ترانسفکشن بود. هم چنین نتایج حاصل از روش ELISA و Dot Blot بیانگر اختصاصیت پروتئین کایمری SPD-CD40L بود.
نتیجه گیری
پروتئین کایمری SPD-CD40L از طریق وکتور بیانی pcDNA3.1(+) در رده سلولی یوکاریوتی HEK293 بهطور موفقیتآمیز بیان شد و وزن مولکولی پروتئین 4-ترایمری(دودکامری) با مقدار مورد انتظار تطابق داشت.
کلمات کلیدی: CD40 لیگاند، رده سلولی HEK 293 ، ترانسفکشن
تاریخ دریافت: 21/1/96
تاریخ پذیرش: 23/3/96
1- کارشناس ارشد زیست فناوری پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ویروسشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD ژنتیک مولکولی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- مؤلف مسئول:PhD ایمنیشناسی پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
رده سلولی HEK293
بهاره شکوهیان1، زهره شریفی2، مهشید محمدیپور3، فاطمه یاری4
چکیده
سابقه و هدف
CD40L ، پروتئینی غشایی و یکی از اعضای خانواده TNF است که نقش مهمی در انتقال پیام سلولی در ایمنی ذاتی و تطبیقی دارد. از آن جاییکه این پروتئین نقش خود را از طریق تجمع گیرنده در سطح سلول هدف ایفا میکند، به نظر میرسد فرم مالتیمری آن بتواند اثر قویتری نسبت به فرم طبیعی ترایمری ایجاد کند. بر این اساس در این مطالعه کلونینگ و بیان فرم کایمری و دودکامری CD40L محلول، از طریق پروتئین خود مالتیمر شونده سورفاکتانت پروتئین (SP-D) D، در رده سلولی HEK293 مورد بررسی قرار گرفت.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود. پروتئین SPD-CD40L به صورت in silico طراحی و در پلاسمید pcDNA3.1(+) همسانهسازی شد. سلولهای HEK293 به عنوان میزبان بیانی مورد استفاده قرار گرفته و ترانسفکت شدند. بیان CD40L نوترکیب در سطح RNA به وسیله RT-PCR بررسی شد. پس از تخلیص پروتئین نوترکیب با روش کروماتوگرافی تمایلی، وزن مولکولی آن توسط SDS-PAGE تعیین گردید. به منظور بررسی اختصاصیت پروتئین نیز از روشهای ELISA وDot Blot استفاده شد.
یافتهها
نتایج به دست آمده نشاندهنده ترانسفکشن سلولهای HEK293 و بیان پروتئین نوترکیب پس از 24 و 48 ساعت از زمان ترانسفکشن بود. هم چنین نتایج حاصل از روش ELISA و Dot Blot بیانگر اختصاصیت پروتئین کایمری SPD-CD40L بود.
نتیجه گیری
پروتئین کایمری SPD-CD40L از طریق وکتور بیانی pcDNA3.1(+) در رده سلولی یوکاریوتی HEK293 بهطور موفقیتآمیز بیان شد و وزن مولکولی پروتئین 4-ترایمری(دودکامری) با مقدار مورد انتظار تطابق داشت.
کلمات کلیدی: CD40 لیگاند، رده سلولی HEK 293 ، ترانسفکشن
تاریخ دریافت: 21/1/96
تاریخ پذیرش: 23/3/96
1- کارشناس ارشد زیست فناوری پزشکی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ویروسشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- PhD ژنتیک مولکولی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- مؤلف مسئول:PhD ایمنیشناسی پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
CD40 لیگاند(CD40L ، CD145 ، gp39 ، HIGM1 ، IMD3 و TNFSF5) یک پروتئین غشایی تیپII ۳۹ کیلو دالتونی است که به خانواده فاکتور نکروز توموری (TNFSF) تعلق داشته و سهم زیادی در انتقال پیام سلولی در ایمنی ذاتی و تطبیقی دارا میباشد(1). این پروتئین توسط انواعی از سلولها هم چون لنفوسیت B و T پلاکتهای فعال شده، مونوسیت، سلولهای دندرتیک، ماکروفاژها، بیان میشود(3، 2). ژن CD40L بر روی کروموزومX واقع شده و یک گلیکوپروتئین 261 اسیدآمینهای را کد میکند که در فرم غشایی شامل سه دومین میباشد. چنانچه CD40L غشایی از متیونین 113 (Met113) دومین خارج سلولی شکسته شود،CD40L محلول یا sCD40L ایجاد میگردد. CD40L فعال، چه به فرم غشایی و چه به فرم محلول، ساختاری هوموترایمری دارد، این ساختار مالتیمری نقش مهمی در برهمکنش مؤثر با CD40 و پیامدهی سلولی متعاقب آن دارد(4، 2). برهمکنش CD40-CD40L برای پاسخ وابسته به T-cell لنفوسیتهای B به آنتیژنها، ایجاد سلولهای B خاطره و پلاسماسل و القای تولید آنتیبادی IgG ، افزایش شکلگیری مراکز زایا در هماهنگی با سلولهای T ضروری است. به علاوه ردپای سیستم دوتایی CD40-CD40L در بسیاری از بیماریها از جمله بیماریهای التهابی رودهIBD))، پیشرفت عفونت HIV و التهاب عصبی وابسته به HIV ، انواع سرطانها، آترواسکلروزیس، لوپوس، درماتومیوزیس و آلزایمر دیده میشود(10-5، 1). در واقع برهمکنش CD40 و CD40L با فراهم کردن سیگنال ثانویه مورد نیاز، منجر به آغاز پاسخ ایمنی هومورال و پاسخ ایمنی با واسطه سلولی میگردد(11، 7). این حقیقت که CD40L قادر به القای تکثیر و تمایز لنفوسیتهای B و T است، در مطالعههای بسیـاری بـه اثبـات رسیـده است (17-12، 7). اما اخیراً چندین بررسی آزمایشگاهی تأثیر چند برابری فرم مالتیمری CD40L نوترکیب را بر القای ایمنی هومورال و سلولی نشان دادهاند(21-18).
تولید فرم محلول پروتئینهای TNFSF ، بسیار حائز اهمیـت اسـت، زیـرا بـررسی این پروتئینها و گیرندههای
اختصاصی آنها در فرم غشایی پیچیدگیهای بسیاری داشته و به دلیل وجود عوامل مداخلهگر، تفسیر نتایج را غیر ممکن میسازد. به علاوه فرمهای محلول چندین پروتئین از این خانواده کاربرد درمانی دارد(24-22).
به منظور تولید پروتئینهای محلول از خانواده TNF دو راه وجود دارد: میتوان فرم غشایی را تولید کرد و پس از آن با اثر دادن پروتئاز، بخش خارج سلولی پروتئین را در محیط آزاد ساخت، و یا تنها بخش خارج غشایی را به همراه یک توالی راهنما کلون و سنتز کرد. در هر دو حالت، فرم محلول پروتئینهای TNFSF که هموترایمرهای تکی هستند، ناپایدار خواهند بود(25).
روشی که به طور معمول برای حل مشکل ناپایداری پروتئینهای مالتیمری در فرم محلول استفاده میشود، به کارگیری پروتئین مورد نظر در کنار یک قطعه از یک پروتئین دیگر که دارای توانایی دایمر و یا مالتیمر شدن به طور خودبهخودی میباشد، است(24). از جمله این پروتئینهای خود مالتیمر شونده سورفکتانت پروتئین D (SP-D) میباشد. SP-Dیک لکتین تیپ C است که توسط سلولهای اپیتلیال(عمدتاً سلولهای اپیتلیال ریه) بیان میشود. این پروتئین به شکل دودکامری(Dodecameric) متشکل از چهار زیر واحد ترایمری میباشد(26). با جایگزین کردن دومین خارج سلولی(ECD) پروتئینهای خانواده TNF با ناحیه لکتینی میتوان پروتئینهای دودکامری ایجاد کرد.
با توجه به این که بیشتر اعضای خانواده TNS نقش درمانی داشته و تولید آنها به شکل پروتئینهای محلول و مالتیمری امکانپذیر و مؤثر میباشد، بررسی و مطالعه چگونگی طراحی و ساخت پروتئینهای مالتیمری اهمیت پیدا میکند و این اهمیت با توجه به مطالعههای محدودی که در زمینه ساخت پروتئینهای مالتیمری در ایران صورت گرفته، پررنگتر میشود. در میان اعضای این خانواده، نقش کلیدی پروتئین CD40L در انواع زمینههای تشخیصی و درمانی از جمله کنترل التهاب، تولید واکسن، درمان سرطان و افزایش بازده تولید آنتیبادی و هم چنین عدم تولید این پروتئین در ایران، ما را برآن داشت تا شکل دودکامری CD40L محلول را از طریق پروتئین مالتیمرکننده سورفکتانت پروتئین D تولید و در سلولهای بیانی یوکاریوتی HEK293 بیان کنیم.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود.
طراحی و ساخت ژن SPD-CD40L :
به منظور طراحی سازه کایمری توالی آمینو اسیدی سورفکتانت پروتئین D انسانی با شماره دسترسی NP_003010.4 و پروتئین CD40L انسانی با شماره دسترسی NP_000065.1 از بانک اطلاعات پروتئین NCBI به دست آمد. با جایگزین کردن بخش خارج سلولی (ECD) پروتئین CD40L (اسیدآمینههای 47 تا 261) با ناحیه لکتینی سورفکتانت پروتئین D (اسیدآمینههای 262 تا 375)، توالی اولیه پروتئین به طول 472 اسیدآمینه طراحی شد. سپس ساختمان سوم پروتئین کایمری SPD-CD40L توسط نرمافزارهای بیوانفورماتیکی تایید شده و توالی نوکلئوتیدی آن توسط شرکت ژنکاست (لوگزامبورگ) ساخت و در حامل پلاسمیدی pcDNA3.1(+) قرار گرفت.
آمادهسازی پلاسمید نوترکیب و تراریختی سلولهای بیانی یوکاریوتی:
کشت شبانه باکتری E.coli سویه Top10 در mL 5 از محیط مایع LB (Lysogeny Broth) با گرماگذاری در دمای 37 درجه سانتیگراد و چرخش 200 دور در دقیقه (rpm) انجام شد. سپس محیط کشت باکتریها به مدت 5 دقیقه با سرعت 5000 دور در دقیقه(rpm) سانتریفیوژ گردید و پس از خارج کردن محیط کشت، رسوب باکتری با استفاده از تیمار شیمیایی توسط کلرید کلسیم(CaCl2) 1/0 مولار و قرار دادن بر روی یخ به سلول مستعد تبدیل شد. پس از آمادهسازی سلولهای E.coli جهت پذیرش پلاسمید، تراریختی سلولهای مستعد به روش شوک حرارتی انجام گرفت. سوسپانسیون باکتریایی حاصل بر روی محیط کشت LB جامد حاوی آنتیبیوتیک آمپیسیلین با غلظت µg/mL 100 پخش شده و به مدت یک شب در دمای 37 درجه سانتیگراد قرار داده شد.
پلاسمید pcDNA3.1(+) با استفاده از کیت استخراج پلاسمید شرکت وایوژن (Cat. NO. GF2001) و طبق روش مندرج کیت جداسازی شد. به منظور بررسی صحت همسانهسازی ژن هدف در حامل pcDNA3.1(+) ، از روش توالییابیsequencing)) و بررسی الگوی هضم آنزیمی (digestion pattern) استفاده شد. حامل پلاسمیدی نوترکیبpcDNA–SPD-CD40L با استفاده از آنزیمهای محدودکننده HindIII و EcoRI و طبق دستورالعمل شرکت سازنده آنزیمها(فرمنتاز، انگلستان) در دمای 37 درجه سانتیگراد به مدت 5 ساعت هضم شد. محصول واکنش هضم، با استفاده از الکتروفورز در ژل آگارز 1% بررسی گردید.
کشت و نگهداری سلولهای HEK293 :
رده سلولی HEK293 از بانک سلولی انستیتو پاستور ایران تهیه و در محیط کشت RPMI-1460 حاوی 10% سرم جنین گاوی(FBS)، محلول پنیسیلین(U/mL 100)، استرپتومایسین(µg/mL 100) و mM 2 L-گلوتامین کشت داده شد. سپس در انکوباتور 37 درجه سانتیگراد با CO2 5% نگهداری و هر دو روز یک بار محیط کشت آن تعویض گردید.
ترانسفکشن سلولهای HEK293 و جمعآوری محلول رویی:
سلولها روز قبل از ترانسفکشن شمارش شده و تعداد 105×5 سلول به هر چاهک از پلیت 6 خانهای اضافه شد. µg 2 پلاسمید استخراج شده حاوی قطعه ژن مورد نظر (معادل µL 10) به µL 190 محیط کشت فاقد FBS و آنتیبیوتیک پنیسیلین- استرپتومایسین اضافه شد و محلول به مدت 5 دقیقه در دمای محیط گرماگذاری گردید.
µL 6 X-tremeGENE™ HP DNA Transfection Reagent ((Cat. NO. 06366236001 محصول شرکت رُوش آلمان به محلول افزوده و محلول حاصل جهت تشکیل کمپلکس به مدت 30 دقیقه در دمای محیط گرماگذاری شد. محلول حاوی کمپلکس معرف و پلاسمید نوترکیب به محیط کشت سلولها اضافه شده و پلیت به مدت 6 ساعت در انکوباتور 37 درجه سانتیگراد گرماگذاری شد. سپس محیط کشت رویی خارج شده و محیط کشت جدید حاوی 10% FBS و 1% آنتیبیوتیک پنیسیلین - استرپتومایسین به سلولها اضافه شد. سلولها به مدت 24 و 48 ساعت در انکوباتور 37 درجه سانتیگراد گرماگذاری شدند.
بررسی و تأیید بیان پروتئین نوترکیب:
استخراج RNA :
استخراج RNA از سلولهای HEK293 تراریخت شده پس از جمعآوری مایع رویی سلولها، با استفاده از محلول ترایزول TriPure Isolation Reagent (رُوش، آلمان) طبق دستورالعمل شرکت سازنده انجام شد. کمیت و کیفیت RNA استخراج شده با دستگاه اسپکتروفتومتر نانودراپ و هم چنین الکتروفـورز بـر روی ژل آگـارز 1% سنجیـده شد.
ساخت cDNA :
ساخت cDNA به روش نسخهبرداری معکوس (فرمنتاز، انگلستان) انجام شد. برای این منظور µg 5/4 RNA با آب مقطر حاوی DEPC به حجم نهایی µL 20 رسید و آغازگرهای 6 نوکلئوتیدی تصادفی(Random hexamers) به آن اضافه شد. مخلوط حاصل به مدت 5 دقیقه در دمای 65 درجه سانتیگراد قرار گرفت و سپس به آن بافر، آنزیم نسخهبردار معکوس، نوکلئوتیدهای آزاد سه فسفاته (dNTPs) و مهارکننده RNase اضافه شد. مخلوط واکنش در ترمال سایکلر(بیوراد، آمریکا) تکثیر شد. بررسی کیفیت cDNA با واکنش PCR با استفاده از آغازگرهای اختصاصی ژن بتا اکتین به عنوان کنترل و بررسی وجود cDNA مربوط به SPD-CD40L با آغازگرهای اختصاصی نواحی داخلی ژن SPD-CD40L به طور جداگانه انجام شد و در نهایت محصول واکنشهای PCR با الکتروفورز برروی ژل آگارز 2% مشاهده و بررسی گردید(جدول 1).
آزمایش SDS-PAGE :
بـه منظـور تاییـد بیـان و بررسی وزن مولکولی پروتئین
SPD-CD40L ، پـس از تخلیـص پـروتئین از محیط کشت
سلولهای HEK293 24 و 48 ساعته بهوسیله ستون کروماتوگرافی تمایلی که حاوی آنتیبادی اختصاصی Anti-CD40L (ابکم، کمبریج، Cat. NO. ab47204) تثبیت شده بود، آزمایش SDS-PAGE در سیستم بافری ناپیوسته شامل ژل متراکم کننده و ژل جداکننده 12% انجام شد. نمونهها پس از سانتریفیوژ، به وسیله سرنگ همیلتون در کنار شاخص وزن مولکولی به چاهکهای ژل منتقل شدند. بعد از اتمام الکتروفورز به مدت 2:20 ساعت در اختلاف پتانسیل 120 ولت، کاست حاوی ژل باز شد. ژل پلیآکریلآمید با استفاده از رنگ کوماسیبلو به مدت 2 ساعت روی شیکر رنگ شده و پس از 2 ساعت رنگزدایی با محلول رنگبر مورد بررسی قرار گرفت.
آزمایش الایزا :
پس از آن اختصاصیت پروتئین نوترکیب SPD-CD40L با استفاده از روش الایزا بررسی شد. به این منظور µL 50 SPD-CD40L تخلیص شده از مایعرویی سلولی (24 و 48 ساعته) به عنوان نمونه مورد بررسی، sCD40L تخلیص شده از کنسانتره پلاکتی به عنوان کنترل مثبت و بافر PBS و HCG (گنادوتروپین) به عنوان کنترل منفی، به چاهکهای پلیت الایزا اضافه شد و پلیت به مدت یک شب در یخچال 4 درجه سانتیگراد قرار گرفت. سپس خانههای کوت شده، از پروتئین خالی گشته، µL 100 محلول مسدودکننده (آلبومین + آزاید) به هرکدام افزوده و به مدت 3 ساعت در دمای اتاق قرار گرفت. پساز خارج کردن محلول مسدودکننده از خانهها، µL 50 محلول آنتیبادی Anti-CD40L (ابکم، کمبریج، Cat. NO. ab47204) با رقت 1:200 در PBS به هر خانه اضافه شده و به مدت 1 ساعت در انکوباتور 37 درجه سانتیگراد گرماگذاری شد. چاهکها توسط محلول شستشو 05/0%PBS-T (PBS + Tween20) شستشو شدند و µL 50 از کونژوگه آنزیمیAnti-mouse IgG با آنزیمHRP (سیگما، آمریکا، (Cat. NO. A0170 با رقت 1:1000 به هـر خانه اضافه شد و پلیت به مدت 1 ساعت در دمای اتاق قرار گرفت.
جدول 1: توالی آغازگرهای طراحی شده برای ناحیه داخلی ژن SPD-CD40L و ژن بتااکتین
| ژن | اندازه محصول | دمای اتصال | توالی آغازگر |
| ناحیه داخلی SPD-CD40L | 118 جفت باز | 54 درجه سانتیگراد | جلوبرنده: 5’-GGAATTTGCACGAGGACTTC-3’ |
| معکوس:5’-TTGACAAACCCCTCGAACTG-3’ | |||
| بتااکتین | 190 جفت باز | 57 درجه سانتیگراد | جلوبرنده: 5’-TCATGAAGATCCTCACCGAG-3’ |
| معکوس:5’-TTGCCAATGGTGATGACCTG-3’ |
پس از شستشوی دوباره، µL 50 از محلول TMB به هر چاهک اضافه شده و پلیت به مدت 15 دقیقه در تاریکی و در دمای اتاق گرماگذاری شد. در نهایت با افزودن µL 50 محلول اسید کلریدریک به هر چاهک، واکنش متوقف گردید و جذب نوری چاهکها با استفاده از دستگاه خوانش الایزا در طول موج 450 نانومتر خوانده شد.
آزمایش دات بلات (Dot Blot):
برای بررسی وجود و اختصاصیت پروتئین نوترکیب، آزمایش دات بلات نیز انجام شد. در این روش محلول پروتئینی به طور مستقیم به شکل نقاط جدا از هم به غشاء PVDF (رُوش، آلمان) منتقل شد و آنتیبادی اختصاصی (آنتیبادی Anti-CD40L) اضافه گردید، سپس آنتیبادی کونژوگه با HRP افزوده شد که پس از مواجهه با سوبسترای ECL (Enhanced Chemi Lumineseence) باعث ایجاد سیگنال قابل مشاهده از طریق دستگاه تصویربرداری مولکولی گردید.
یافتهها
بررسی صحت همسانهسازی:
وکتور پلاسمیدی نوترکیبpcDNA–SPD-CD40L با استفاده از آنزیمهای محدودالاثر HindIII و EcoRI در بافر مشترک هضم شد. محصول واکنش هضم، با استفاده از الکتروفورز در ژل آگارز 1% بررسی گردید. خارج شدن قطعه 1428 جفت بازی حاصل از هضم آنزیمی با شاخص اندازه مولکولی، نشان دهنده صحت همسانهسازی بود (شکل1).
بررسی بیان در سطح RNA :
بـه منظـور مشاهـده قطعات مورد انتظار در نتیجه تکثیر
نواحی داخلی ژنهای بتا اکتین و SPD-CD40L، الکتروفورز انجام شد. در نتیجه الکتروفورز محصول واکنش PCR در ژل آگارز 2% در بافر TAE، مشاهده دو باند 190 جفت بازی حاصل تکثیر cDNA سلولهای آزمایش و کنترل با آغازگرهای بتااکتین نشاندهنده کیفیت cDNA بود، به علاوه وجود باند 118 جفت بازی محصول تکثیر ناحیه داخلی ژن کدکننده SPD-CD40L در سلولهای HEK293 با استفاده از آغازگرهای اختصاصی و عدم مشاهده این باند در نمونه کنترل نشان دهنده بیان ژن مورد نظر در سطح RNA بود (شکل2).

شکل1: الکتروفورز محصول واکنش هضم آنزیمی وکتور نوترکیب. ستون 1 شاخص اندازه مولکولی یک کیلو بازی، ستون 2 جدا شدن قطعه ژنی SPD-CD40L به طول 1428 جفت باز از پلاسمید pcDNA پس از هضم با آنزیمهای HindIII و EcoRI ، ستون 3 پلاسمید pcDNA بدون قطعه ورودی هضم شده با آنزیمهای HindIII و EcoRI ، ستون 4 وکتور نوترکیب برش خورده با آنزیم HindIII ، ستون 5 وکتور نوترکیب برش خورده با آنزیم EcoRI و ستون 6 وکتور نوترکیب هضم نشده که به سه شکل حلقوی، خطی و سوپرکویل وجود دارد را نشان میدهد.

شکل 2: الکتروفورز محصول PCR. ستون 3 مارکر وزن مولکولی 100 جفتبازی میباشد. در ستون 1 و2 به ترتیب محصول تکثیر ژن SPD-CD40L از سلولهای HEK293 ترانسفکت شده و ترانسفکت نشده (کنترل منفی) نشان داده شده است. وجود باند 118 جفتبازی در ستون 1 بیانگر بیان ژن SPD-CD40L در سطح RNA میباشد. در ستونهای 4 و 5 نیز به ترتیب باند محصول تکثیر ژن بتا اکتین در سلولهای HEK293 تست و کنترل نشان داده شده است.
بررسی بیان و اختصاصیت پروتئین SPD-CD40L :
الکتروفورز پروتئینها با استفاده از روش SDS-PAGE انجام شد. باندهای حاصل از الکتروفورز عمودی SPD-CD40L تخلیص شده از محیط کشت سلولهای HEK293 به دست آمده از کشت 24 و 48 ساعته، با مطالعههای مشابه قبلی همخوانی داشت(شکل3). باندهای 58 و 64 کیلودالتونی نشاندهنده سطوح مختلف گلیکوزیلاسیون پروتئین نوترکیب میباشند. اختصاصیت پروتئین نوترکیب SPD-CD40L با استفاده از روش الایزا تایید شد. در این روش پس از اتصال پروتئین به کف پلیت و افزودن آنتیبادی اختصاصی (آنتیبادی Anti-CD40L)، آنتیبادی کونژوگه با HRP اضافه گردید که پس از مواجهه با سوبسترای TMB سبب واکنش رنگزا شد. تشکیل محصول رنگـی حاصـل از واکـنش آنزیمـی، نشـاندهنــده واکنش اختصاصی و ویژگی آنتیژن نوترکیب SPD-CD40L بود(جدول 2). آزمایش دات بلات بهمنظور بررسی وجود و اختصاصیت پروتئین موردنظر انجام شد.
|
1428 bp
|

شکل 3 : SDS-PAGE پروتئین نوترکیب SPD-CD40L در ژل پلیآکریل آمید %12. ستون سمت راست نشاندهنده مارکر وزن مولکولی است. ستون وسط نشاندهنده SPD-CD40L تخلیص شده از مایع رویی سلولهای HEK293 پس از کشت 48 ساعته و ستون سمت چپ نشاندهنده SPD-CD40L تخلیص شده از مایع رویی سلولهای HEK293 پس از کشت 24 ساعته میباشد.
جدول 2: نتایج الایزا پروتئین نوترکیب SPD-CD40L
| نمونه | OD (nm 450) |
| PBS | 031/0 ± 098/0 |
| HCG | 011/0 ± 056/0 |
| کنترل مثبت | 084/0 ± 851/0 |
| SPD-CD40L 48 hour | 061/0 ± 638/0 |
| SPD-CD40L 24 hour | 038/0 ± 262/0 |

شکل 4: آزمایش دات بلات پروتئین نوترکیبSPD-CD40L . نقطه A نشاندهنده نمونه CD40L تخلیص شده از کنسانتره پلاکتی میباشد که به عنوان کنترل مثبت در نظر گرفته شده است. نقاط B و C نشاندهنده SPD-CD40L نوترکیب بیان شده توسط سلولهای HEK293 ، 48 و 24 ساعته میباشند. در نقطه D پروتئین BSA به عنوان کنترل منفی لکهگذاری شد و در این نقطه هیچ لکهای مشاهده نگردید. نقطه E نشاندهنده Lysate سلولهای HEK293 ترانسفکت شده و نقطه F نشاندهنده Lysate سلولهای HEK293 ترانسفکت نشده(به عنوان کنترل منفی نمونه Lysate) میباشد.
بحث
با توجه به اهمیت این پروتئین در انواع زمینههای تشخیصی و درمانی و عدم تولید آن در ایران، در مطالعه حاضر پروتئین SPD-CD40L با استفاده از نرمافزارهای بیوانفورماتیکی طراحی شده و توالی نوکلئوتیدی آن ساخت و در پلاسمید (+)pcDNA3.1 همسانهسازی شد. سلولهای HEK293 به عنوان میزبان بیانی مورد استفاده قرارگرفته و ترانسفکت شدند. بیان CD40L نوترکیب در سطح RNA توسط RT-PCR بررسی شد. پس از تأیید بیان در سطح RNA ، تخلیص پروتئین نوترکیب با روش کروماتوگرافی تمایلی صورت گرفت و وزن مولکولی پروتئین نوترکیب توسط SDS-PAGE تعیین گردید. به منظور بررسی اختصاصیت پروتئین نیز از آزمونهای ELISA وDot Blot استفاده شد.
ایجاد لنفوسیتهای B فعال همواره از جنبههای مختلف حائز اهمیت بوده است. عدهای از محققان با هدف تبدیل لنفوسیـت B بـه سلولهـای عـرضهکننده آنتیژن فعـال در
آزمایشگاه و به کارگیری این سلولها در جهت فعال کردن
و افزایش پاسخ T-cellها و عدهای دیگر به منظور افزایش بازده سلولهای هیبریدوما در تولید آنتیبادی، به این مهم پرداختهاند(27). به همین علت مطالعههای بسیاری به منظور افزایش تحریک و فعال کردن لنفوسیتهای B صورت گرفته است. یکی از پروتئینهایی که در سالهای اخیر به دلیل نقش کلیدی که در فعال کردن ایمنی ذاتی و تطبیقی دارد بسیار مورد توجه واقع شده، CD40L میباشد. اما بزرگترین مشکل در تحریک CD40 با واسطه منومرهای CD40L یا آنتیبادی، اثر ضعیف این پروتئینها بر تحریک و تکثیر B-cell است(18). بررسیهای بیشتر بر روی مکانیسم اثر CD40L نشان داد که این پروتئین از طریق کلاستر کردن گیرنده خود موجب انتقال پیام در سلول هدف شده و بنابراین با افزایش میزان تجمع گیرنده میتوان اثر قویتر و ماندگارتری را ایجاد کرد(11).
در سال 2001 هزول و همکارانش با تولید دو فرم مختلف از CD40L زاویهای متفاوت از تولید پروتئینهای نوترکیب مالتیمری را نشان دادند. اولین پروتئین تولیدی آنها یک ترایمر تکی از بخش خارج سلولی CD40L و دیگری پروتئین 4- ترایمری تشکیل شده از بدنه اصلی SP-D و بخش خارج سلولی CD40L موشی بود. نتایج آنها نشاندهنده اثر بیشتر فرم دودکامری در مقایسه با فرم ترایمری در فعالکردن لنفوسیتهای B بود. هزول به منظور اتصال پروتئین SP-D به بخش خارج سلولی CD40L از توالی لینکر GGGNS استفاده کرد که با بررسیهای بیوانفورماتیکی و پیشبینی ساختار سوم پروتئین بهنظر میرسد این توالی اثر مطلوبی در فولدینگ سازه نهایی نداشته باشد، بنابراین در این مطالعه، این توالی حذف شد(19).
مطالعه بعدی توسط هالر و کورنبلات در سال 2003 حاکی از تولید پروتئین ادغامی 2-ترایمری تشکیل شده از Acrp30 و بخش خارج سلولی CD40L بود. این پروتئین هگزامری اثری کمتر از فرم دودکامری اما بیشتر از شکل ترایمری پروتئین CD40L داشت(28).
در سـال 2005 جیانــگ و همکارانــــش با انتقال ژن
CD40L موشـی بـه لایــن سلولی H22 توسط وکتور بیانی pcDNA3.1(+) ، CD40L ترایمری را بیان کردند. در مطالعه
حاضر از CD40L انسانی و سلولهای HEK293 استفاده شده و علاوه بر 4- ترایمری بودن سازه، پروتئین به صورت ترشحی طراحی گشته است که این مسئله برداشت و تخلیص پروتئین را تسهیل میکند(29).
در سال 2006 استون و همکارانش هر دو شکل 2-ترایمری و 4- ترایمری CD40L را بیان کرده و به صورت in vivo مورد مطالعه قرار دادند، بررسیهای وزن مولکولی پروتئین نوترکیب با روش SDS-PAGE، توسط وی بیانگر تولید پروتئینی با وزن تقریبی 58 کیلودالتون بود که این نتیجه با مطالعه حاضر و بررسیهای بیوانفورماتیکی در مورد پیشبینی وزن مولکولی پروتئین نوترکیب (49 کیلودالتون به علاوهی وزن دو زنجیره کربوهیدراتی) مطابقت دارد (30).
در نهایت ریچارد کورنبلات در سال 2008 با ثبت انحصاری موفق به تولید این دو پروتئین با نام تجاری Multimeric Biotherapeutics شد(31).
با توجه به این که ظرفیت محدود و بازده پایین سلولهای هیبریدوما در تولید آنتیبادی مونوکلونال یکی از دلایل قیمت نسبتاً بالای این محصول محسوب میگردد، یافتن راهی جهت تحریک این سلولها میتواند راهکاری کارآمد برای کاهش هزینههای تولید آنتیبادی باشد و مطالعه حاضر اولین مرحله در راستای رسیدن به سوی هدف مذکور است. بنابراین مقایسه اثر CD40L مالتیمری نوترکیب با فرم طبیعی CD40L در محیط in vivo بر تحریک تولید آنتیبادی از لنفوسیتهای B در مطالعههای دیگر پیشنهاد میگردد.
نتیجهگیری
حاصل این مطالعه طراحی و همسانهسازی موفقیتآمیز شکل 4- ترایمری(دودکامری) پروتئین CD40L با استفاده از پروتئین خود مالتیمر شونده سورفکتانت پروتئین D بود که به دنبال آن پروتئین کایمری از طریق وکتور pcDNA3.1(+) در میزبان بیانی یوکاریوتی HEK293 بیان شد. پروتئین نوترکیب تخلیص شده و اختصاصیت آن تایید گردید. نتایج حاصل از SDS-PAGE بیانگر تولید فرم
دودکامری مورد نظر با وزن مولکولی مطلوب بود.
تشکر و قدردانی
این مقاله حاصل پایانامه دانشجویی دوره کارشناسی ارشد رشته بیوتکنولوژی پزشکی مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون با کد اخلاق IR.TMI.REC.1394.27 میباشد. بودجه این مطالعه توسط مؤسسهی آموزشی و پژوهشی طب انتقال خون تأمین گردیده و همه مراحل عملی پروژه در مرکز تحقیقات سازمان انتقال خون انجام شده است.
نوع مطالعه: پژوهشي |
موضوع مقاله:
بيوتكنولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





