جلد 14، شماره 3 - ( پاییز 1396 )
جلد 14 شماره 3 صفحات 226-217 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Moradi F, Babashah S, Sadeghizadeh M. The Effects of Msi2 Knock down on Expression Levels of Musashi2-Numb Pathway and Genes Involved in the Proliferation and Apoptosis of Chronic Myeloid Leukemia Cells. bloodj 2017; 14 (3) :217-226
URL: http://bloodjournal.ir/article-1-1108-fa.html
URL: http://bloodjournal.ir/article-1-1108-fa.html
مرادی فروزان، باباشاه صادق، صادقی زاده مجید. اثرات مهار بیان ژن Msi2 بر الگوی بیانی مسیر Musashi2-Numb و ژنهای درگیر در تکثیر و آپوپتوز سلولهای لوکمی میلوئیدی مزمن. فصلنامه پژوهشی خون. 1396; 14 (3) :217-226
استادیار گروه ژنتیک مولکولی
متن کامل [PDF 602 kb]
(1739 دریافت)
| چکیده (HTML) (5878 مشاهده)
مقدمه
کروموزوم[MOU4] فیلادلفیا که در اثر جابهجایی دو طرفه بین کروموزومهای 9 و 22 ایجاد میشود، شاخص سیتوژنتیک لوکمی میلوئیدی مزمن(CML ، Chronic myeloid leukemia) است. ماحصل این جابهجایی، شکلگیری ژن امتزاجی BCR-ABL1 است که تایروزین کیناز همیشه فعال BCR-ABL1 را کد مینماید. کشف این مهم که پروتئین ادغامی BCR-ABL1 نقشی محوری در بیماریزاییCML ایفا مینماید، موجب تکامل و تحول در استراتژیهای درمانی با هدف مهار اختصاصی این کیناز گردیده است (3-1). بد تنظیمی ژنهای کلیدی که خودنوزایی و سرنوشت سلول را در سلولهای بنیادی خونساز (Hematopoietic stem cells, HSCs) کنترل میکنند، میتواند در پیشرفت لوکمی نقش داشته باشد(4). یکی از این بد تنظیمیها مربوط به محور پیامرسانی Musashi2-Numb است. مطالعههای قبلی نشان داده است که در CML، ژن Msi2 از ژن امتزاجی Msi2/HoxA9 در پی شکست ناحیه ژنی 7p15 بازآرایی شده است(5). گزارشها حاکی از آن هستند که بین بیان ژن Msi2 و بیان mRNA BCR-ABL1 ارتباطی وجود دارد(8-6). بیان Msi2 در مرحله بحران بلاست CML در مقایسه با مرحله مزمن افزایش مییابد و این افزایش بیان در مرحله بلاستیک با خطر عود CML ارتباط مستقیمی دارد. ژن Msi2 نه فقط در طول پیشرفت CML انسانی افزایش بیان مییابد بلکه یک نشانگر ضعیف بیماری نیز محسوب میشود. این نکته حائز اهمیت است که با پیشرفت CML از مرحله مزمن به مرحله بلاست، تکثیر افزایش مییابد در حالی که از درجه تمایز کاسته میشود(9، 8).
اگر چه مهارکنندههای تیروزین کیناز، فعالیت کینازی پروتئین ادغامی BCR-ABL1 را مهار نموده و قادر به القای بهبودی نسبی در اکثریت مبتلایان به CML میباشند، گزارشهایی از عدم پاسخ بیماران به این نوع داروها وجود دارد که میتوانند سبب عود بیماری به شیوه شدیدتر پس از درمان باشند(10). فعالیت نابهجای مسیر پیامرسانی Musashi2-Numb در لوکمی و هم چنین سلولهای بنیادی لوکمیایـی گـزارش شـده اسـت(6). در مطالعـه حاضر، ژن
Msi2 در محور تنظیمی Musashi2-Numb که به طور ویژه در سیستمهای خونساز و سلولهای لوکمیایی بیش تنظیم است، مورد ارزیابی قرار گرفت و احتمال مشارکت فعالیت ژن Msi2 در بقای سلولهای لوکمیایی بررسی شد. در این راستا به نظر میرسد ژن Msi2 گزینهای اختصاصی برای هدفگیری سلولهای لوکمیایی بوده و مهار آن از طریق استراتژی RNAi منجر به افزایش در الگوی بیانی ژن Numb (به عنوان ژن تعیین کننده سرنوشت سلول)، افزایش الگوی بیانی ژن P21 (ژن چرخه سلولی) و کاهش بیان ژن Bcl-2 (ژن آنتی آپوپتوز) و القای آپوپتوز در این سلولها گردد. استراتژی ارائه شده میتواند گامی مؤثر به سوی درمان نهایی انواع لوکمیهای میلوئیدی باشد.
مواد و روشها
کشت رده سلولی:
در یک مطالعه تجربی، رده سلولی K562از سازمان انتقال خون تهیه شد. سلولهای K562 در محیط کشت RPMI (Roswell Park Memorial Institute 1640) حاوی ۱۰% سرم جنینی گوساله (FBS ، Fetal Bovine Serum)، 100 واحد بر میلیلیتر پنیسیلین(Penicillin G)، ۱۰۰ میکروگرم بر میلیلیتر استرپتومایسین(Streptomycin) و در انکوباتور مرطوب با ۵% دیاکسید کربن و دمای ۳۷ درجه سانتیگراد نگهداری شدند.
سرکوب بیان ژن Msi2 از طریق استراتژی تداخل RNA :
الیگونوکلئوتیدهای siRNA دو رشتهای سنتتیک که نواحی متفاوتی از رونوشت ژن Msi2 را هدف میگیرند با شماره کاتولوگ(sc-75834) از شرکت سانتا کروز بیوتکنولوژی خریداری شد. برای انجام ترانسفکشن، تعداد مناسبی از سلولها (حدود 8۰ هزار سلول) به ازای هر چاهک پلیت ۲۴ خانهای به همراه ۵۰۰ میکرولیتر محیط کشت و فاقد آنتیبیوتیک کشت داده شدند. پس از آن که سلولها به تراکم سطحی 50% رسیدند، محیط کشت سلولها تخلیه و سلولها با PBS شستشو شدند. میزان[a5] 5 میکرولیتر از سوسپانسیون siRNA با غلظت Pmol/µL 20 در 245 میکرولیتر از محیط Opti-MEM (اینویتروژن) به ازای هر چاهک افزوده شد. میزان 6 میکرولیتر از واکنشگر لیپوفکتامین RNAiMAX در 245 میکرولیتر از محیط Opti-MEM به ازای هر چاهک افزوده شد. دو محلول فوق با یکدیگر در آمیخته و سوسپانسیون حاصل به مدت 10 الی 20 دقیقه در دمای اتاق انکوبه گردید. میزان 2 میلیلیتر از محیط کشت حاوی سرم و فاقد آنتیبیوتیک به هر یک از چاهکهای حاوی سلولهای آماده برای ترانسفکشن افزوده شد. میزان 500 میکرولیتر از سوسپانسیون مرحله قبل به هر یک از چاهکهای پلیت افزوده شد و سپس پلیت جهت همگن شدن مخلوط تکان داده شد. یک تا دو روز بعد، محیط کشت سلولها با محیط کشت تازه تعویض شد و از سلولها برای مطالعههای بعدی استفاده گردید.
استخراج RNA تام سلولی و ساخت cDNA :
جهت بررسی بیان ژن های مورد مطالعه، RNA تام از سلول با استفاده از واکنشگر ترایزول(اینویتروژن) استخراج و به منظور حذف آلودگی احتمالی با DNA ژنومی، با آنزیم DNase (فرمنتاز) تیمار شد. کیفیت RNA استخراج شده با الکتروفورز روی ژل آگارز تایید و خلوص و غلظت آن توسط اسپکتروفتومتری با جذب نوری در طول موجهای 260 و 280 نانومتر سنجیده شد. به[a6] منظور ساخت cDNA بر اساس روش کار ارائه شده توسط شرکت Takara، ابتدا مخلوط واکنشی شامل 3 میکروگرم RNA تام استخراج شده، 1 میکرولیتر آغازگر هگزامر تصادفی و 1 میکرولیتر مخلوط dNTP که توسط آب دیونیزه عاری از RNase به حجم 10 میکرولیتر رسانیده شد، تهیه گردید. این مخلوط به مدت 5 دقیقه در دمای 65 درجه سانتیگراد انکوبه و بیدرنگ روی یخ انتقال داده شد. سپس مخلوط واکنشی دوم شامل 4 میکرولیتر بافر 5x PrimerScriptTM ، 5/0 میکرولیتر مهار کننده RNAse ، 1 میکرولیتر آنزیم رونوشتبردار معکوس PrimeScriptTM RTase که توسط آب دیونیزه عاری از RNase به حجم 20 میکرولیتر رسانیده شد، تهیه گردید. مخلوط واکنشی دوم به آرامی به مخلوط واکنشی اول افزوده و مخلوط واکنشی نهایی به مدت 60 دقیقه در دمای 42 درجه سانتیگراد و سپس 10 دقیقه در دمای 70 درجه سانتیگراد انکوبه شد. نمونههای cDNA ساخته شده تا زمان انجام PCR در 20- درجه سانتیگراد نگهداری شدند.
واکنش Real-time PCR کمی و بررسی منحنی ذوب:
آغازگرهای الیگونوکلئوتیدی برای ژنهای Msi2 ، Numb ، P21 ، Bcl-2 و GAPDH توسط نرمافزار GeneRunner طراحی شدند(جدول 1). ویژگی (Specificity) و یکتا بودن توالی آغازگرها در ژنوم انسان با استفاده از نرمافزار بلاست(http: //blast. ncbi. nlm. nih. gov/ Blast. cgi) ارزیابی شد. مخلوط واکنشی در حجم نهایی 20 میکرولیتر شامل 10 میکرولیتر SYBR Green I Master Mix (تاکارا)، 5/0 میکرولیتر[a7] (معادل 5 پیکومول) از هر آغازگر، 1 میکرولیتر [a8] (معادل 5 نانوگرم) cDNA ساخته شده و 8 میکرولیتر آب تهیه شد. واکنش Q-RT-PCR برای هر ژن، دو سری و به صورت هم زمان انجام شد و میانگین Ct (چرخه آستانه) به دست آمده برای هر ژن محاسبه شد. واکنش در دستگاه ABI StepOne sequence Detection System (بیوسیستم) تحت شرایط دمایی و زمانی زیر انجام یافت: در ابتدا 95 درجه سانتیگراد به مدت 5 دقیقه به عنوان مرحله واسرشتگی اولیه در نظر گرفته شد. سپس برنامه دمایی زیر در 40 چرخه تکرار شد: مرحله واسرشتگی در دمای 95 درجه سانتیگراد به مدت 10 ثانیه و مراحل اتصال/ توسعه در 60 درجه سانتیگراد به مدت 30 ثانیه. از[a9] آن جایی که رنگ SYBR Green I که برای شناسایی محصول PCR استفاده میشود، به هر نوع DNA دو رشتهای متصل شده و توانایی تشخیص محصول اختصاصی از غیر اختصاصی را ندارد، لذا وجود مواردی چون جفتشدگی آغازگرها(دایمر پرایمر) یا محصول غیر اختصاصی نیز سبب افزایش در سیگنال نور فلورسنت میشوند(11).
به منظور تأیید صحت قطعه تکثیر شده و اطمینان از عدم وجود محصول غیر اختصاصی از نمودار ذوب (Melting curve) استفاده شد. از این رو، هر مرحله تکثیری کامـل، تـوسط یک مرحلـه تفکیـک(Dissociation) شامـل
جدول 1: آغازگرهای الیگونوکلئوتیدی به کار رفته در سنجش Real-time PCR
95 درجه سانتیگراد برای 15 ثانیه، 60 درجه سانتیگراد برای 30 ثانیه و 95 درجه سانتیگراد برای 15 ثانیه به منظور تجزیه و تحلیل منحنی ذوب ادامه یافت.
با[a10] اتمام تکثیر و بر اساس نمودار رسم شده، چرخه آستانه (Cycle of threshold, CT) تعیین شد. در ادامه پس از محاسبه تفاضل میانگین CT ژن مرجع از میانگین CT ژن مورد نظر برای هر دو نمونه کنترل و آزمایش، شاخص ΔCT در دو نمونه کنترل و آزمایش به دست آمد. هم چنین از تفاضل دو ΔCT ، شاخصی تحت عنوان ΔΔCT محاسبه شد. در ادامه نسبت تغییرات بیانی بین دو نمونه آزمایش و کنترل با استفاده از فرمول 2-ΔΔCt تعیین شد. مقادیر رونوشتهای ژنهای هدف در مقایسه با بیان ژن GAPDH به عنوان ژن خانهدار(Housekeeping) تعیین شد.
بررسی فلوسایتومتری سلولهای رنگآمیزی شده با Annexin V-FITC و PI :
میزان[a11] القای آپوپتوز توسط رنگ آمیزی با کیت شناسایی آپوپتوز Annexin-V FITC (سیگما) مطابق دستورالعمل سازنده سنجیده شد. در این زمینه، سلولها 24 و 48 ساعت پس از ترانسفکشن با PBS شستشو و در بافر اتصال به صورت سوسپانسیون درآورده شدند. سپس 10 میکرولیتر از رنگ Annexin V-FITC به ازای هر 106 سلول افزوده و به مدت 15 دقیقه در دمای اتاق و در شرایط تاریکی انکوبه شد.
پس از شستشوی مجدد، رسوب سلولی در بافر اتصال محلول و میزان 5 میکرولیتر از محلول PI به واکنش افزوده و سلولها با کمک دستگاه فلوسیتومتر(Becton Dickinson) آنالیز شدند. آنالیز دادهها توسط نرمافزار Flowing Software 2 انجام شد. سلولهای زنده به صورت (Annexin V منفی/ PI منفی)، سلولهای در مرحله آپوپتوز اولیه به صورت(Annexin V مثبت/ PI منفی)، سلولهای در مرحله آپوپتوز نهایی به صورت (Annexin V مثبت/ PI مثبت) و سلولهای نکروز یافتـه بـه صورت (Annexin V منفی/ PI مثبت) نمایش داده شدند.
آنالیز آماری دادهها:
دادهها به صورت میانگین ± انحراف معیار ارائه شدند. آنالیز آماری تغییرات دادهها توسط نرمافزار GraphPad Prism 6 و بـا استفـاده از آزمـون t-test انجام شد. مقادیر p-value کوچکتر از 05/0 از نظر آماری معنادار در نظر گرفته شد.
یافتهها
بررسی اختصاصی بودن تکثیر توسط آنالیز منحنی ذوب:
در شکل ۱ با توجه به وجود تنها یک پیک مشاهده شده
برای هر ژن در دمای ذوب منحصر به خودش، اختصاصی بودن محصولReal-time PCR مشخص گردید. بر این اساس از عدم وجود مواردی چون تکثیر غیر اختصاصی، جفتشدگی آغازگرها(دایمر پرایمر) و آلودگی اطمینان حاصل شد.
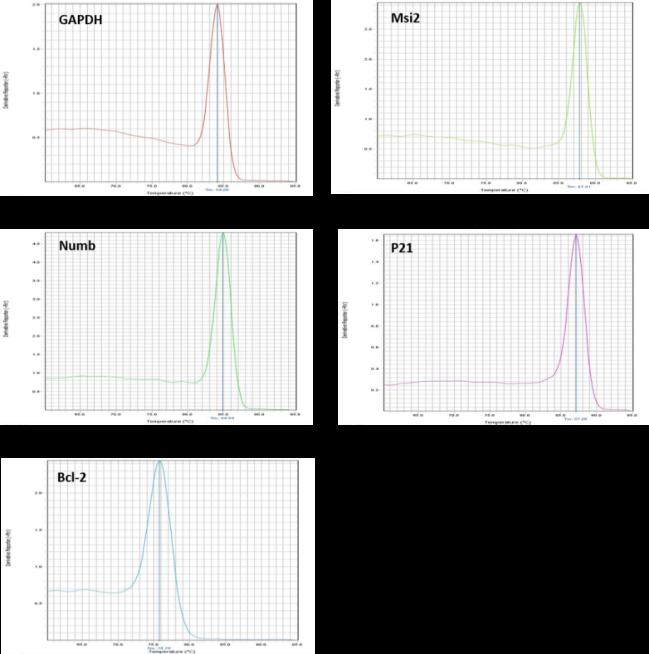
شکل 1: منحنیهای ذوب ژنهای مورد مطالعه؛ وجود تنها یک پیک برای هر ژن در دمای ذوب ویژه آن، نشاندهنده اختصاصی بودن محصول تکثیر بود.
ارزیابی بیان رونوشت ژنهای Msi2 و Numb در سلولهای لوکمیایی ترانسفکت شده با siRNA اختصاصی بر علیه Msi2 :
به منظور بررسی اثرات خاموشکنندگی siRNA بر روی بیان رونوشت ژن Msi2 ، رده سلولی k562 که با siRNA اختصاصی علیه Msi2 (siMsi2) یا الیگونوکلئوتیدهای کنترل خاموشسازی(siCtrl) ترانسفکت شده بودند، پردازش و برای ارزیابی میزان بیان mRNA آنالیز شدند. نتایج آنالیز Real-time PCR نشان داد siMsi2 باعث کاهش محسوس در بیان mRNA ژن Msi2 در سلولهای ترانسفکت شده به شیوه وابسته به زمان میشود(05/0 p<) (نمودار 1). به منظور بررسی ارتباط ممکن مابین دو ژن Msi2 وNumb (به عنوان ژن تعیین سرنوشت سلول)، سطوح رونوشتهای Numb در پی خاموشسازی بیان Msi2 بررسی شد. نتایج Real-time PCR نشان داد سلولهای لوکمیایی ترانسفکت شده با siMsi2 دارای سطوح به مراتب بیشتری از رونوشتهای Numb در مقایسه با گروه سلولی کنترل بودند(05/0 p<)(نمودار 1).
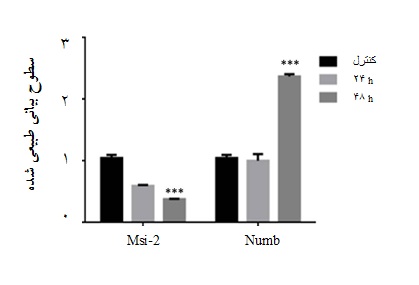
نمودار 1: سطوح نسبی بیان رونوشتهای Msi2 و Numb در رده سلول[MOU12] لوکمیایی K562 ترانسفکت شده با siMsi2 . همان گونه که ملاحظه میشود عملکرد siMsi2 منجر به کاهش محسوس بیان رونوشت Msi2 در رده سلولی K562 به شیوه وابسته به زمان شده است. هم چنین عملکرد siMsi2 باعث افزایش محسوس در سطوح نسبی بیان رونوشت Numb پس از 48 ساعت شده است. تغییرات بیان هر دو ژن از نظر آماری معنادار میباشد(05/0 p<).
ارزیابی بیان رونوشت ژنهای p21 و Bcl-2 در سلولهای لوکمیایی ترانسفکت شده با siRNA اختصاصی برعلیه Msi2 :
به منظور بررسی اثر عملکردی سرکوب بیان ژن Msi2 ، میزان سطوح بیانی رونوشت ژنهای p21 و Bcl-2 در سلولهای لوکمیایی ترانسفکت شده با siMsi2 در مقایسه با گروه کنترل ارزیابی شد. نتایج Real-time PCR نشان داد بیان ژن P21 در رده سلولی K562 ترانسفکت شده با siMsi2 نسبت به سلولهای گروه کنترل به شیوه وابسته به زمان افزایش یافت(05/0 p<)(نمودار 2). ارزیابی بیان ژن ضد آپوپتوز Bcl-2 نیز نشان داد بیان این ژن در رده سلولهای ترانسفکت شده با siMsi2 نسبت به سلولهای گروه کنترل به شیوه وابسته به زمان کاهش یافت(05/0 p<) (نمودار 3).
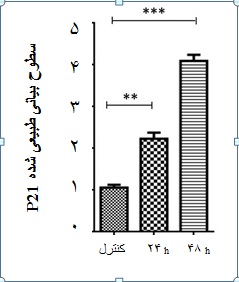
نمودار 2: سطوح نسبی بیان رونوشت ژن p21 در رده سلول[MOU13] لوکمیایی K562 ترانسفکت شده با siMsi2 . همان گونه که ملاحظه میشود عملکرد siMsi2 منجر به افزایش محسوس بیان رونوشت p21 در رده سلولی K562 به شیوه وابسته به زمان شده است تغییرات بیان ژن از نظر آماری معنادار میباشد(05/0 p<).
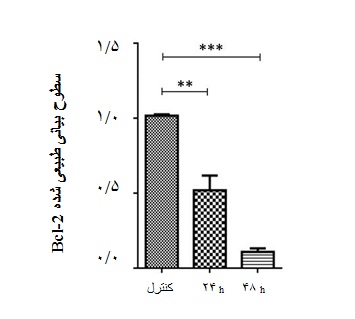
نمودار 3: سطوح نسبی بیان رونوشت ژن Bcl-2 در رده سلول[MOU14] لوکمیایی K562 ترانسفکت شده با siMsi2 . همان گونه که ملاحظه میشود عملکردsiMsi2 منجر به کاهش محسوس بیان رونوشت Bcl-2 در رده سلولی K562 به شیوه وابسته به زمان شده است. تغییرات بیان ژن از نظر آماری معنادار میباشد(05/0 p<).
ارزیابی القای آپوپتوز در سلولهای لوکمیایی ترانسفکت شده با siRNA اختصاصی برعلیه Msi2 :
به منظور بررسی احتمال وقوع آپوپتوز در پی سرکوب بیان ژن Msi2 ، سلولهای لوکمیایی ترانسفکت شده با siMsi2 با Annexin V رنگآمیزی و میزان مرگ سلولی توسط بررسی فلوسایتومتری سنجیده شد. آنالیز هیستوگرامهای Annexin V/ PI فلوسایتومتری نشان داد سرکوب بیان ژن Msi2 در سلولهای لوکمیایی ترانسفکت شده با siMsi2 ، آپوپتوز را به طور محسوسی در مقایسه با گروه کنترل افزایش داد. آنالیز هیستوگرامهایAnnexin سنجش منتخب برای رده سلولی K562 ، نشان داد که 24 ساعت پس از ترانسفکشن با siMsi2 ، بالغ بر 52% سلولها دچار آپوپتوز شده است(شکل 2). هم چنین میزان آپوپتوز پس از 48 ساعت به بیش از 60% افزایش یافت.
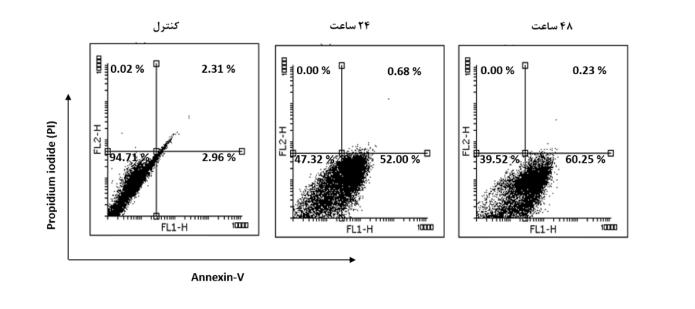
شکل 2: بررسی Annexin V+/PI+ سلولهای K562 ترانسفکت شده شده با siMsi2 در یک سنجش منتخب. سلولهای مرده به صورت نکروتیک(Annexin V منفی/ PI مثبت) یا آپوپتوتیک (Annexin V مثبت/ PI منفی و Annexin V مثبت/ PI مثبت) در نظر گرفته میشوند. محور x ، Annexin-V-FITC و محور y ، Propidium iodide (PI) را نشان میدهد. همان گونه که ملاحظه میشود سرکوب بیان ژن Msi2 در سلولهای لوکمیایی ترانسفکت شده با siMsi2 آپوپتوز[MOU15] را به طور محسوسی در مقایسه با گروه سلولی کنترل افزایش داده است.
بحث
بر اساس نتایج این تحقیق، به نظر می رسد ژن Mis2 گزینهای اختصاصی برای هدفگیری سلولهای لوکمیایی بوده و مهار آن از طریق استراتژی RNAi ، منجر به القای آپوپتوز در سلولهای لوکمیایی میگردد. لوکمی میلوئیدی مزمن(CML)، نوعی بدخیمی تکثیر شونده دودمان میلوئیدی است که از سلول بنیادی خونساز ایجاد میگردد و دارای مراحل مزمن و بحران بلاست میباشد. عامل بروز این اختــلال، فعالیت تیروزین کینازی مداوم حاصل از بیان انکوژن BCR-ABL1 اســت، بر همین اساس امروزه درمانهای نســبتاً مناســب بالینی بــر پایه اســتفاده از مهارکنندههای تیروزین کیناز بنا شــده اســت ولــی این روند درمانی همیشــه موفقیتآمیز نبوده و برخی از بیماران نسبت به این نوع از داروها از خود مقاومت نشــان میدهند. در نتیجه درمان با این داروها دارای محدودیتهایی میباشد لــذا روشهای درمان مولکولی جدید مــد نظر قرارگرفته اســت(14-12).
مطالعههای گذشته نشان دادهاند که مسیر Musashi2-Numb ، نقشی اساسی در لوکموژنز بر عهده دارد و فعالیت آن منجر به تکثیر، توسعه و بقای سلولهای لوکمیایی میشود(17-15). Msi2 مارکر پیش آگهی ضعیفی گزارش شده است که در تعیین استراتژی درمانی لوکمی ارزش تشخیصی زیادی دارد(19، 18). در این راستا، خاراس و همکاران نشان دادند بیان Msi2 در شکلگیری کلونیهای خونساز با فنوتیپ میلوئیدی نابالغ در شرایط آزمایشگاهی افزایش مییابد و در داخل بدن سبب گسترش سلولهای بنیادی خونساز(HSCs) و سلولهای پیشساز کوتاهمدت میگردد(20). از طرفی گزارش نمودند Msi2 در مراحل پیشرفته CML (مرحله بحران بلاست) در سطوح بالاتری نسبت به مراحل اولیه CML (مرحله مزمن) بیان میشود و این افزایش سطوح بیانی Msi2 در ارتباط معکوس با میزان بیان ژن Numb میباشد. در سال 2010، ایتو و همکاران ارتباط مابین افزایش بیان Numb و کاهش سلولهای لوکمی در مدلهای موشی را گزارش نمودند(8). آنها نشان دادند که سطوح بیانی Numb میتواند مانع پیشرفت بیماری شود. علاوه بر آن، گزارش کردند مهار بیان ژن Msi2 با استفاده از shRNA رشد سلولهای لوکمی و نرخ بقا را به طور قابل توجهی به خصوص در مرحله بحران بلاست کاهش میدهد. مشابه با القای Numb ، مهار Msi2 توسط shRNA تمایز را در سلولهای لوکمی القا میکند و توانایی تکثیر و انتشار آنها را مهار میکند. در سال ۲۰۱۶ گارسیا ـ آلگریا و همکاران غیرفعالسازی سطوح بیانی Numb برای کاهش سلولهای لوکمیایی را تایید کردند(12). در سال ۲۰۱۰ خاراس و همکاران به دنبال مهار ژن Msi2 ، افزایش بیان رونوشت Numb را در رده سلولـی LAMA-84 (رده سلولـی مشتـق شـده از بیمـاران
مرحله بحران بلاستیک CML) گزارش نمودند(20).
در مطالعه حاضر، بیان ژن Numb در رده سلولی K562 (رده سلول میلوئیدی مربوط به CML)، پس از ترانسفکت siRNA علیه ژن Msi2 بررسی گردید و ارتباط معکوس بین ژن Msi2 و Numb در رده سلولی مذکور نیز مشهود بود. در این مطالعه دریافتیم مهار ژن Msi2 منجر به افزایش بیان ژن P21 به عنوان ژن کلیدی چرخه سلولی در سلولهای K562 میگردد. مطابق با نتایج ما، ژانگ و همکاران نشان دادند که مهار Msi2 منجر به کاهش تکثیر در رده سلولیKG-1a (رده سلول میلوئیدی مربوط به لوکمی میلوئیدی حاد یا AML) میگردد(21). خاراس و همکاران کاهش تکثیر را به دنبال مهار Msi2 ، در ردههای سلولی Nomo-1 و THP-1 (مشتق از لوکمی میلوئیدی حاد) و LAMA-84 و AR230 (مشتق از لوکمی میلوئیدی مزمن) گزارش نمودند. به طور مشابه اندروسـ آگوآیو و همکاران و هوپ و همکاران نشان دادند که مهارMsi2 به طور چشمگیری سلولهای بنیادی هماتوپویتیک موش را در فاز S-G2/M کاهش میدهد(23-21).
در این مطالعه همچنین مشاهده کردیم که مهار Msi2 درصد آپوپتوز اولیه و نهایی را در سلولهای K562 افزایش میدهد، این یافتهها با نتایج خاراس و همکاران که گزارش نمودند مهار Msi2 توسط shRNA سبب القای قابل توجه آپوپتوز در ردههای سلولی لوکمی Nomo-1 و THP-1 و LAMA-84 و AR230 شده است، سازگار است(20). علاوه بر آن، در این مطالعه مشخص شد رونوشت Bcl-2 که فاکتور مهم ضد آپوپتوزی است، بعد از مهار Msi2 در رده سلولی K562، به طور چشمگیری کاهش یافت. نتایج ما با یافتههای مطالعه ژانگ و همکاران (18) که القای آپوپتوز را با کاهش بیان Bcl-2 در سطح mRNA و پروتئین نشان دادند، سازگار است (22).
نتیجهگیری
اگر چه در سالهای اخیر گامهای مهمی در جهت درمان مبتلایان لوکمی برداشته شده است، ارائه رویکردی که به طور اختصاصی قادر باشد سبب کاهش سلولهای لوکمیایی شود، میتواند نویدبخش درمان مؤثر سرطان باشد(26-24). به نظر میرسد هدفگیری ژنهای کلیدی میتواند استراتژی درمانی مؤثری را برای از بین بردن سلولهای لوکمیایی مزمن ارائه دهد. در مطالعه حاضر احتمال مشارکت فعالیت مسیر پیامرسانی Musashi2-Numb در القای آپوپتوز سلولهای لوکمیایی بررسی شد. با توجه به نتایج به دست آمده، مهار Msi2 از طریق استراتژی تداخل RNA (RNA interference, RNAi) منجر به افزایش سطوح بیانی ژن Numb (به عنوان ژن تعیین کننده سرنوشت سلول)، القای آپوپتوز، افزایش الگوی بیانی ژن P21 (ژن چرخه سلولی) و کاهش ژن Bcl-2 (ژن آنتی آپوپتوزی) در سلولهای K562گردید. آنچه به عنوان مکانیسمی محتمل در این زمینه میتواند مطرح باشد این است که اثرات مهاری سرکوب بیان Msi2 روی سلولهای لوکمیایی ممکن است با اثرات تنظیمی Numb که عاملی تعیینکننده در سرنوشت سلول است، مرتبط باشد زیرا کاهش بیان Msi2 سبب افزایش سطوح بیانی Numb که
باعث از بین رفتن سلولهای CML میشود، میگردد و این یافتهها احتمالاً در ارتباط با مسیرهای پیامرسانی دیگری است که در نهایت رشد سلولهای لوکمی را کاهش میدهند. در این راستا، مطالعههای بیشتری نیاز است. استراتژی ارایه شده میتواند گامی مؤثر به سوی درمان نهایی لوکمی میلوئیدی به شمار آید.
تشکر و قدردانی
مطالعـه حاضـر برگرفتـه از پایاننامــه کارشناسی ارشد
رشته ژنتیک مولکولی است و با پشتیبانی مالی دانشگاه تربیت مدرس و ستاد توسعه علوم و فناوریهای سلولهای بنیادی معاونت علمی و فناوری ریاست جمهوری(موافقت نامه 77230/11) انجام شده است. نویسندگان مراتب قدردانی خود را نسبت به معاونت محترم پژوهشی دانشگاه تربیت مدرس و هم چنین معاونت محترم علمی و فناوری ریاست جمهوری اعلام میدارند.
متن کامل: (5093 مشاهده)
اثرات مهار بیان ژن Msi2 بر الگوی بیانی مسیر Musashi2-Numb و ژنهای
درگیر در تکثیر و آپوپتوز سلولهای لوکمی میلوئیدی مزمن
فروزان مرادی1، صادق باباشاه2، مجید صادقیزاده3
چکیده
سابقه و هدف
بیان ژن Numb به عنوان ژن تعیینکننده سرنوشت سلول، سبب کاهش رشد سلولهای لوکمیایی و سطوح بالای ژن Msi2 منجر به مهار بیان ژن Numb در سلولهای لوکمی میلوئیدی مزمن میگردد. هدف[a1] از مطالعه، مهار ژن Msi2 توسط استراتژی RNAi و اثرات مهار Msi2 بر بیان محور Musashi2-Numb و ژنهای درگیر در تکثیر و آپوپتوز سلولهای لوکمیایی K562 بود.
مواد و روشها
در این مطالعه تجربی، الیگونوکلئوتید siRNA سنتتیک که ژن Msi2 را هدف قرار میدهد، با استفاده از لیپوفکتامین به سلولهای K562 به صورت دو بار تکرار ترانسفکت شد. تغییر بیان ژنهای Msi2 ، Numb ، P21 و Bcl-2 ، ۲۴ و ۴۸ ساعت پس از ترانسفکشن، توسط Real-time PCR ارزیابی شد. از آزمون فلوسایتومتری Annexin V-PI جهت ارزیابی القای آپوپتوز استفاده شد. آنالیز آماری با آزمون t-test انجام گرفت.
یافتهها
با مهار ژن Msi2 ، بیان ژن Numb در رده سلولی K562 پس از 48 ساعت به بیش از دو برابر افزایش و متعاقب با آن، بیان ژن P21 به عنوان تنظیم کننده کلیدی چرخه سلولی افزایش و بیان ژن Bcl-2 به عنوان ژن ضدآپوپتوز کاهش یافت(05/0 p<). نتایج[a2] آزمون فلوسایتومتری، حاکی از افزایش القای آپوپتوز در سلولهای K562 ، به بیش از 52% و 60% به ترتیب ۲۴ و ۴۸ ساعت پس از ترانسفکشن بود.
نتیجه گیری
به نظر میرسد ژن Msi2 گزینهای اختصاصی برای هدفگیری سلولهای لوکمیایی بوده و مهار آن از طریق استراتژی RNAi منجر به القای آپوپتوز در سلولهای لوکمیایی میگردد؛ که ممکن است گامی موثر به سوی درمان نهایی لوکمی به شمار آید.
کلمات کلیدی: لوکمی میلوئیدی مزمن، تزاید[a3] سلولی، آپوپتوز
تاریخ دریافت: 17/11/95
تاریخ پذیرش: 30/2 /96
1- دانشجوی کارشناسی ارشد ژنتیک مولکولی ـ دانشکده علوم زیستی دانشگاه تربیت مدرس ـ تهران ـ ایران
2- مژلف مسئول: PhD ژنتیک مولکولی ـ استادیارگروه ژنتیک دانشکده علوم زیستی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ کد پستی: 1411713116
3- استاد گروه ژنتیک ـ دانشکده علوم زیستی دانشگاه تربیت مدرس ـ تهران ـ ایران
درگیر در تکثیر و آپوپتوز سلولهای لوکمی میلوئیدی مزمن
فروزان مرادی1، صادق باباشاه2، مجید صادقیزاده3
چکیده
سابقه و هدف
بیان ژن Numb به عنوان ژن تعیینکننده سرنوشت سلول، سبب کاهش رشد سلولهای لوکمیایی و سطوح بالای ژن Msi2 منجر به مهار بیان ژن Numb در سلولهای لوکمی میلوئیدی مزمن میگردد. هدف[a1] از مطالعه، مهار ژن Msi2 توسط استراتژی RNAi و اثرات مهار Msi2 بر بیان محور Musashi2-Numb و ژنهای درگیر در تکثیر و آپوپتوز سلولهای لوکمیایی K562 بود.
مواد و روشها
در این مطالعه تجربی، الیگونوکلئوتید siRNA سنتتیک که ژن Msi2 را هدف قرار میدهد، با استفاده از لیپوفکتامین به سلولهای K562 به صورت دو بار تکرار ترانسفکت شد. تغییر بیان ژنهای Msi2 ، Numb ، P21 و Bcl-2 ، ۲۴ و ۴۸ ساعت پس از ترانسفکشن، توسط Real-time PCR ارزیابی شد. از آزمون فلوسایتومتری Annexin V-PI جهت ارزیابی القای آپوپتوز استفاده شد. آنالیز آماری با آزمون t-test انجام گرفت.
یافتهها
با مهار ژن Msi2 ، بیان ژن Numb در رده سلولی K562 پس از 48 ساعت به بیش از دو برابر افزایش و متعاقب با آن، بیان ژن P21 به عنوان تنظیم کننده کلیدی چرخه سلولی افزایش و بیان ژن Bcl-2 به عنوان ژن ضدآپوپتوز کاهش یافت(05/0 p<). نتایج[a2] آزمون فلوسایتومتری، حاکی از افزایش القای آپوپتوز در سلولهای K562 ، به بیش از 52% و 60% به ترتیب ۲۴ و ۴۸ ساعت پس از ترانسفکشن بود.
نتیجه گیری
به نظر میرسد ژن Msi2 گزینهای اختصاصی برای هدفگیری سلولهای لوکمیایی بوده و مهار آن از طریق استراتژی RNAi منجر به القای آپوپتوز در سلولهای لوکمیایی میگردد؛ که ممکن است گامی موثر به سوی درمان نهایی لوکمی به شمار آید.
کلمات کلیدی: لوکمی میلوئیدی مزمن، تزاید[a3] سلولی، آپوپتوز
تاریخ دریافت: 17/11/95
تاریخ پذیرش: 30/2 /96
1- دانشجوی کارشناسی ارشد ژنتیک مولکولی ـ دانشکده علوم زیستی دانشگاه تربیت مدرس ـ تهران ـ ایران
2- مژلف مسئول: PhD ژنتیک مولکولی ـ استادیارگروه ژنتیک دانشکده علوم زیستی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ کد پستی: 1411713116
3- استاد گروه ژنتیک ـ دانشکده علوم زیستی دانشگاه تربیت مدرس ـ تهران ـ ایران
مقدمه
کروموزوم[MOU4] فیلادلفیا که در اثر جابهجایی دو طرفه بین کروموزومهای 9 و 22 ایجاد میشود، شاخص سیتوژنتیک لوکمی میلوئیدی مزمن(CML ، Chronic myeloid leukemia) است. ماحصل این جابهجایی، شکلگیری ژن امتزاجی BCR-ABL1 است که تایروزین کیناز همیشه فعال BCR-ABL1 را کد مینماید. کشف این مهم که پروتئین ادغامی BCR-ABL1 نقشی محوری در بیماریزاییCML ایفا مینماید، موجب تکامل و تحول در استراتژیهای درمانی با هدف مهار اختصاصی این کیناز گردیده است (3-1). بد تنظیمی ژنهای کلیدی که خودنوزایی و سرنوشت سلول را در سلولهای بنیادی خونساز (Hematopoietic stem cells, HSCs) کنترل میکنند، میتواند در پیشرفت لوکمی نقش داشته باشد(4). یکی از این بد تنظیمیها مربوط به محور پیامرسانی Musashi2-Numb است. مطالعههای قبلی نشان داده است که در CML، ژن Msi2 از ژن امتزاجی Msi2/HoxA9 در پی شکست ناحیه ژنی 7p15 بازآرایی شده است(5). گزارشها حاکی از آن هستند که بین بیان ژن Msi2 و بیان mRNA BCR-ABL1 ارتباطی وجود دارد(8-6). بیان Msi2 در مرحله بحران بلاست CML در مقایسه با مرحله مزمن افزایش مییابد و این افزایش بیان در مرحله بلاستیک با خطر عود CML ارتباط مستقیمی دارد. ژن Msi2 نه فقط در طول پیشرفت CML انسانی افزایش بیان مییابد بلکه یک نشانگر ضعیف بیماری نیز محسوب میشود. این نکته حائز اهمیت است که با پیشرفت CML از مرحله مزمن به مرحله بلاست، تکثیر افزایش مییابد در حالی که از درجه تمایز کاسته میشود(9، 8).
اگر چه مهارکنندههای تیروزین کیناز، فعالیت کینازی پروتئین ادغامی BCR-ABL1 را مهار نموده و قادر به القای بهبودی نسبی در اکثریت مبتلایان به CML میباشند، گزارشهایی از عدم پاسخ بیماران به این نوع داروها وجود دارد که میتوانند سبب عود بیماری به شیوه شدیدتر پس از درمان باشند(10). فعالیت نابهجای مسیر پیامرسانی Musashi2-Numb در لوکمی و هم چنین سلولهای بنیادی لوکمیایـی گـزارش شـده اسـت(6). در مطالعـه حاضر، ژن
Msi2 در محور تنظیمی Musashi2-Numb که به طور ویژه در سیستمهای خونساز و سلولهای لوکمیایی بیش تنظیم است، مورد ارزیابی قرار گرفت و احتمال مشارکت فعالیت ژن Msi2 در بقای سلولهای لوکمیایی بررسی شد. در این راستا به نظر میرسد ژن Msi2 گزینهای اختصاصی برای هدفگیری سلولهای لوکمیایی بوده و مهار آن از طریق استراتژی RNAi منجر به افزایش در الگوی بیانی ژن Numb (به عنوان ژن تعیین کننده سرنوشت سلول)، افزایش الگوی بیانی ژن P21 (ژن چرخه سلولی) و کاهش بیان ژن Bcl-2 (ژن آنتی آپوپتوز) و القای آپوپتوز در این سلولها گردد. استراتژی ارائه شده میتواند گامی مؤثر به سوی درمان نهایی انواع لوکمیهای میلوئیدی باشد.
مواد و روشها
کشت رده سلولی:
در یک مطالعه تجربی، رده سلولی K562از سازمان انتقال خون تهیه شد. سلولهای K562 در محیط کشت RPMI (Roswell Park Memorial Institute 1640) حاوی ۱۰% سرم جنینی گوساله (FBS ، Fetal Bovine Serum)، 100 واحد بر میلیلیتر پنیسیلین(Penicillin G)، ۱۰۰ میکروگرم بر میلیلیتر استرپتومایسین(Streptomycin) و در انکوباتور مرطوب با ۵% دیاکسید کربن و دمای ۳۷ درجه سانتیگراد نگهداری شدند.
سرکوب بیان ژن Msi2 از طریق استراتژی تداخل RNA :
الیگونوکلئوتیدهای siRNA دو رشتهای سنتتیک که نواحی متفاوتی از رونوشت ژن Msi2 را هدف میگیرند با شماره کاتولوگ(sc-75834) از شرکت سانتا کروز بیوتکنولوژی خریداری شد. برای انجام ترانسفکشن، تعداد مناسبی از سلولها (حدود 8۰ هزار سلول) به ازای هر چاهک پلیت ۲۴ خانهای به همراه ۵۰۰ میکرولیتر محیط کشت و فاقد آنتیبیوتیک کشت داده شدند. پس از آن که سلولها به تراکم سطحی 50% رسیدند، محیط کشت سلولها تخلیه و سلولها با PBS شستشو شدند. میزان[a5] 5 میکرولیتر از سوسپانسیون siRNA با غلظت Pmol/µL 20 در 245 میکرولیتر از محیط Opti-MEM (اینویتروژن) به ازای هر چاهک افزوده شد. میزان 6 میکرولیتر از واکنشگر لیپوفکتامین RNAiMAX در 245 میکرولیتر از محیط Opti-MEM به ازای هر چاهک افزوده شد. دو محلول فوق با یکدیگر در آمیخته و سوسپانسیون حاصل به مدت 10 الی 20 دقیقه در دمای اتاق انکوبه گردید. میزان 2 میلیلیتر از محیط کشت حاوی سرم و فاقد آنتیبیوتیک به هر یک از چاهکهای حاوی سلولهای آماده برای ترانسفکشن افزوده شد. میزان 500 میکرولیتر از سوسپانسیون مرحله قبل به هر یک از چاهکهای پلیت افزوده شد و سپس پلیت جهت همگن شدن مخلوط تکان داده شد. یک تا دو روز بعد، محیط کشت سلولها با محیط کشت تازه تعویض شد و از سلولها برای مطالعههای بعدی استفاده گردید.
استخراج RNA تام سلولی و ساخت cDNA :
جهت بررسی بیان ژن های مورد مطالعه، RNA تام از سلول با استفاده از واکنشگر ترایزول(اینویتروژن) استخراج و به منظور حذف آلودگی احتمالی با DNA ژنومی، با آنزیم DNase (فرمنتاز) تیمار شد. کیفیت RNA استخراج شده با الکتروفورز روی ژل آگارز تایید و خلوص و غلظت آن توسط اسپکتروفتومتری با جذب نوری در طول موجهای 260 و 280 نانومتر سنجیده شد. به[a6] منظور ساخت cDNA بر اساس روش کار ارائه شده توسط شرکت Takara، ابتدا مخلوط واکنشی شامل 3 میکروگرم RNA تام استخراج شده، 1 میکرولیتر آغازگر هگزامر تصادفی و 1 میکرولیتر مخلوط dNTP که توسط آب دیونیزه عاری از RNase به حجم 10 میکرولیتر رسانیده شد، تهیه گردید. این مخلوط به مدت 5 دقیقه در دمای 65 درجه سانتیگراد انکوبه و بیدرنگ روی یخ انتقال داده شد. سپس مخلوط واکنشی دوم شامل 4 میکرولیتر بافر 5x PrimerScriptTM ، 5/0 میکرولیتر مهار کننده RNAse ، 1 میکرولیتر آنزیم رونوشتبردار معکوس PrimeScriptTM RTase که توسط آب دیونیزه عاری از RNase به حجم 20 میکرولیتر رسانیده شد، تهیه گردید. مخلوط واکنشی دوم به آرامی به مخلوط واکنشی اول افزوده و مخلوط واکنشی نهایی به مدت 60 دقیقه در دمای 42 درجه سانتیگراد و سپس 10 دقیقه در دمای 70 درجه سانتیگراد انکوبه شد. نمونههای cDNA ساخته شده تا زمان انجام PCR در 20- درجه سانتیگراد نگهداری شدند.
واکنش Real-time PCR کمی و بررسی منحنی ذوب:
آغازگرهای الیگونوکلئوتیدی برای ژنهای Msi2 ، Numb ، P21 ، Bcl-2 و GAPDH توسط نرمافزار GeneRunner طراحی شدند(جدول 1). ویژگی (Specificity) و یکتا بودن توالی آغازگرها در ژنوم انسان با استفاده از نرمافزار بلاست(http: //blast. ncbi. nlm. nih. gov/ Blast. cgi) ارزیابی شد. مخلوط واکنشی در حجم نهایی 20 میکرولیتر شامل 10 میکرولیتر SYBR Green I Master Mix (تاکارا)، 5/0 میکرولیتر[a7] (معادل 5 پیکومول) از هر آغازگر، 1 میکرولیتر [a8] (معادل 5 نانوگرم) cDNA ساخته شده و 8 میکرولیتر آب تهیه شد. واکنش Q-RT-PCR برای هر ژن، دو سری و به صورت هم زمان انجام شد و میانگین Ct (چرخه آستانه) به دست آمده برای هر ژن محاسبه شد. واکنش در دستگاه ABI StepOne sequence Detection System (بیوسیستم) تحت شرایط دمایی و زمانی زیر انجام یافت: در ابتدا 95 درجه سانتیگراد به مدت 5 دقیقه به عنوان مرحله واسرشتگی اولیه در نظر گرفته شد. سپس برنامه دمایی زیر در 40 چرخه تکرار شد: مرحله واسرشتگی در دمای 95 درجه سانتیگراد به مدت 10 ثانیه و مراحل اتصال/ توسعه در 60 درجه سانتیگراد به مدت 30 ثانیه. از[a9] آن جایی که رنگ SYBR Green I که برای شناسایی محصول PCR استفاده میشود، به هر نوع DNA دو رشتهای متصل شده و توانایی تشخیص محصول اختصاصی از غیر اختصاصی را ندارد، لذا وجود مواردی چون جفتشدگی آغازگرها(دایمر پرایمر) یا محصول غیر اختصاصی نیز سبب افزایش در سیگنال نور فلورسنت میشوند(11).
به منظور تأیید صحت قطعه تکثیر شده و اطمینان از عدم وجود محصول غیر اختصاصی از نمودار ذوب (Melting curve) استفاده شد. از این رو، هر مرحله تکثیری کامـل، تـوسط یک مرحلـه تفکیـک(Dissociation) شامـل
جدول 1: آغازگرهای الیگونوکلئوتیدی به کار رفته در سنجش Real-time PCR
| ژن | دمای Tm | درصد GC | آغازگر | ترادف | طول قطعه(bp) |
| Gapdh | 94/61 | 14/57 | جلوبرنده | 5′- ACACCCACTCCTCCACCTTTG -3' | 112 |
| 99/61 | 14/57 | معکوس | 5′- TCCACCACCCTGTTGCTGTAG-3' | ||
| Msi2 | 32/59 | 00/50 | جلوبرنده | 5′- AGCTCAGCCGAAAGAAGTCA-3' | 180 |
| 45/59 | 00/55 | معکوس | 5′- AAGCCTGGGAACTGATAGCC-3' | ||
| Numb | 89/59 | 00/55 | جلوبرنده | 5′- GCTGTCAAGGACACAGGTGA-3' | 223 |
| 09/60 | 45/45 | معکوس | 5′- CAGCTTTCTTGGCATCTTGCAT-3' | ||
| P21 | 26/62 | 00/50 | جلوبرنده | 5′- ACCTGTCACTGTCTTGTACCCTTG-3' | 131 |
| 87/59 | 83/47 | معکوس | 5′- GCGTTTGGAGTGGTAGAAATCTG-3' | ||
| Bcl-2 | 18/60 | 00/55 | جلوبرنده | 5′- CCCGCGACTCCTGATTCATT-3' | 167 |
| 28/60 | 00/44 | معکوس | 5′- CAGTCTACTTCCTCTGTGATGTTGT-3' |
95 درجه سانتیگراد برای 15 ثانیه، 60 درجه سانتیگراد برای 30 ثانیه و 95 درجه سانتیگراد برای 15 ثانیه به منظور تجزیه و تحلیل منحنی ذوب ادامه یافت.
با[a10] اتمام تکثیر و بر اساس نمودار رسم شده، چرخه آستانه (Cycle of threshold, CT) تعیین شد. در ادامه پس از محاسبه تفاضل میانگین CT ژن مرجع از میانگین CT ژن مورد نظر برای هر دو نمونه کنترل و آزمایش، شاخص ΔCT در دو نمونه کنترل و آزمایش به دست آمد. هم چنین از تفاضل دو ΔCT ، شاخصی تحت عنوان ΔΔCT محاسبه شد. در ادامه نسبت تغییرات بیانی بین دو نمونه آزمایش و کنترل با استفاده از فرمول 2-ΔΔCt تعیین شد. مقادیر رونوشتهای ژنهای هدف در مقایسه با بیان ژن GAPDH به عنوان ژن خانهدار(Housekeeping) تعیین شد.
بررسی فلوسایتومتری سلولهای رنگآمیزی شده با Annexin V-FITC و PI :
میزان[a11] القای آپوپتوز توسط رنگ آمیزی با کیت شناسایی آپوپتوز Annexin-V FITC (سیگما) مطابق دستورالعمل سازنده سنجیده شد. در این زمینه، سلولها 24 و 48 ساعت پس از ترانسفکشن با PBS شستشو و در بافر اتصال به صورت سوسپانسیون درآورده شدند. سپس 10 میکرولیتر از رنگ Annexin V-FITC به ازای هر 106 سلول افزوده و به مدت 15 دقیقه در دمای اتاق و در شرایط تاریکی انکوبه شد.
پس از شستشوی مجدد، رسوب سلولی در بافر اتصال محلول و میزان 5 میکرولیتر از محلول PI به واکنش افزوده و سلولها با کمک دستگاه فلوسیتومتر(Becton Dickinson) آنالیز شدند. آنالیز دادهها توسط نرمافزار Flowing Software 2 انجام شد. سلولهای زنده به صورت (Annexin V منفی/ PI منفی)، سلولهای در مرحله آپوپتوز اولیه به صورت(Annexin V مثبت/ PI منفی)، سلولهای در مرحله آپوپتوز نهایی به صورت (Annexin V مثبت/ PI مثبت) و سلولهای نکروز یافتـه بـه صورت (Annexin V منفی/ PI مثبت) نمایش داده شدند.
آنالیز آماری دادهها:
دادهها به صورت میانگین ± انحراف معیار ارائه شدند. آنالیز آماری تغییرات دادهها توسط نرمافزار GraphPad Prism 6 و بـا استفـاده از آزمـون t-test انجام شد. مقادیر p-value کوچکتر از 05/0 از نظر آماری معنادار در نظر گرفته شد.
یافتهها
بررسی اختصاصی بودن تکثیر توسط آنالیز منحنی ذوب:
در شکل ۱ با توجه به وجود تنها یک پیک مشاهده شده
برای هر ژن در دمای ذوب منحصر به خودش، اختصاصی بودن محصولReal-time PCR مشخص گردید. بر این اساس از عدم وجود مواردی چون تکثیر غیر اختصاصی، جفتشدگی آغازگرها(دایمر پرایمر) و آلودگی اطمینان حاصل شد.

شکل 1: منحنیهای ذوب ژنهای مورد مطالعه؛ وجود تنها یک پیک برای هر ژن در دمای ذوب ویژه آن، نشاندهنده اختصاصی بودن محصول تکثیر بود.
ارزیابی بیان رونوشت ژنهای Msi2 و Numb در سلولهای لوکمیایی ترانسفکت شده با siRNA اختصاصی بر علیه Msi2 :
به منظور بررسی اثرات خاموشکنندگی siRNA بر روی بیان رونوشت ژن Msi2 ، رده سلولی k562 که با siRNA اختصاصی علیه Msi2 (siMsi2) یا الیگونوکلئوتیدهای کنترل خاموشسازی(siCtrl) ترانسفکت شده بودند، پردازش و برای ارزیابی میزان بیان mRNA آنالیز شدند. نتایج آنالیز Real-time PCR نشان داد siMsi2 باعث کاهش محسوس در بیان mRNA ژن Msi2 در سلولهای ترانسفکت شده به شیوه وابسته به زمان میشود(05/0 p<) (نمودار 1). به منظور بررسی ارتباط ممکن مابین دو ژن Msi2 وNumb (به عنوان ژن تعیین سرنوشت سلول)، سطوح رونوشتهای Numb در پی خاموشسازی بیان Msi2 بررسی شد. نتایج Real-time PCR نشان داد سلولهای لوکمیایی ترانسفکت شده با siMsi2 دارای سطوح به مراتب بیشتری از رونوشتهای Numb در مقایسه با گروه سلولی کنترل بودند(05/0 p<)(نمودار 1).

نمودار 1: سطوح نسبی بیان رونوشتهای Msi2 و Numb در رده سلول[MOU12] لوکمیایی K562 ترانسفکت شده با siMsi2 . همان گونه که ملاحظه میشود عملکرد siMsi2 منجر به کاهش محسوس بیان رونوشت Msi2 در رده سلولی K562 به شیوه وابسته به زمان شده است. هم چنین عملکرد siMsi2 باعث افزایش محسوس در سطوح نسبی بیان رونوشت Numb پس از 48 ساعت شده است. تغییرات بیان هر دو ژن از نظر آماری معنادار میباشد(05/0 p<).
ارزیابی بیان رونوشت ژنهای p21 و Bcl-2 در سلولهای لوکمیایی ترانسفکت شده با siRNA اختصاصی برعلیه Msi2 :
به منظور بررسی اثر عملکردی سرکوب بیان ژن Msi2 ، میزان سطوح بیانی رونوشت ژنهای p21 و Bcl-2 در سلولهای لوکمیایی ترانسفکت شده با siMsi2 در مقایسه با گروه کنترل ارزیابی شد. نتایج Real-time PCR نشان داد بیان ژن P21 در رده سلولی K562 ترانسفکت شده با siMsi2 نسبت به سلولهای گروه کنترل به شیوه وابسته به زمان افزایش یافت(05/0 p<)(نمودار 2). ارزیابی بیان ژن ضد آپوپتوز Bcl-2 نیز نشان داد بیان این ژن در رده سلولهای ترانسفکت شده با siMsi2 نسبت به سلولهای گروه کنترل به شیوه وابسته به زمان کاهش یافت(05/0 p<) (نمودار 3).

نمودار 2: سطوح نسبی بیان رونوشت ژن p21 در رده سلول[MOU13] لوکمیایی K562 ترانسفکت شده با siMsi2 . همان گونه که ملاحظه میشود عملکرد siMsi2 منجر به افزایش محسوس بیان رونوشت p21 در رده سلولی K562 به شیوه وابسته به زمان شده است تغییرات بیان ژن از نظر آماری معنادار میباشد(05/0 p<).

نمودار 3: سطوح نسبی بیان رونوشت ژن Bcl-2 در رده سلول[MOU14] لوکمیایی K562 ترانسفکت شده با siMsi2 . همان گونه که ملاحظه میشود عملکردsiMsi2 منجر به کاهش محسوس بیان رونوشت Bcl-2 در رده سلولی K562 به شیوه وابسته به زمان شده است. تغییرات بیان ژن از نظر آماری معنادار میباشد(05/0 p<).
ارزیابی القای آپوپتوز در سلولهای لوکمیایی ترانسفکت شده با siRNA اختصاصی برعلیه Msi2 :
به منظور بررسی احتمال وقوع آپوپتوز در پی سرکوب بیان ژن Msi2 ، سلولهای لوکمیایی ترانسفکت شده با siMsi2 با Annexin V رنگآمیزی و میزان مرگ سلولی توسط بررسی فلوسایتومتری سنجیده شد. آنالیز هیستوگرامهای Annexin V/ PI فلوسایتومتری نشان داد سرکوب بیان ژن Msi2 در سلولهای لوکمیایی ترانسفکت شده با siMsi2 ، آپوپتوز را به طور محسوسی در مقایسه با گروه کنترل افزایش داد. آنالیز هیستوگرامهایAnnexin سنجش منتخب برای رده سلولی K562 ، نشان داد که 24 ساعت پس از ترانسفکشن با siMsi2 ، بالغ بر 52% سلولها دچار آپوپتوز شده است(شکل 2). هم چنین میزان آپوپتوز پس از 48 ساعت به بیش از 60% افزایش یافت.

شکل 2: بررسی Annexin V+/PI+ سلولهای K562 ترانسفکت شده شده با siMsi2 در یک سنجش منتخب. سلولهای مرده به صورت نکروتیک(Annexin V منفی/ PI مثبت) یا آپوپتوتیک (Annexin V مثبت/ PI منفی و Annexin V مثبت/ PI مثبت) در نظر گرفته میشوند. محور x ، Annexin-V-FITC و محور y ، Propidium iodide (PI) را نشان میدهد. همان گونه که ملاحظه میشود سرکوب بیان ژن Msi2 در سلولهای لوکمیایی ترانسفکت شده با siMsi2 آپوپتوز[MOU15] را به طور محسوسی در مقایسه با گروه سلولی کنترل افزایش داده است.
بحث
بر اساس نتایج این تحقیق، به نظر می رسد ژن Mis2 گزینهای اختصاصی برای هدفگیری سلولهای لوکمیایی بوده و مهار آن از طریق استراتژی RNAi ، منجر به القای آپوپتوز در سلولهای لوکمیایی میگردد. لوکمی میلوئیدی مزمن(CML)، نوعی بدخیمی تکثیر شونده دودمان میلوئیدی است که از سلول بنیادی خونساز ایجاد میگردد و دارای مراحل مزمن و بحران بلاست میباشد. عامل بروز این اختــلال، فعالیت تیروزین کینازی مداوم حاصل از بیان انکوژن BCR-ABL1 اســت، بر همین اساس امروزه درمانهای نســبتاً مناســب بالینی بــر پایه اســتفاده از مهارکنندههای تیروزین کیناز بنا شــده اســت ولــی این روند درمانی همیشــه موفقیتآمیز نبوده و برخی از بیماران نسبت به این نوع از داروها از خود مقاومت نشــان میدهند. در نتیجه درمان با این داروها دارای محدودیتهایی میباشد لــذا روشهای درمان مولکولی جدید مــد نظر قرارگرفته اســت(14-12).
مطالعههای گذشته نشان دادهاند که مسیر Musashi2-Numb ، نقشی اساسی در لوکموژنز بر عهده دارد و فعالیت آن منجر به تکثیر، توسعه و بقای سلولهای لوکمیایی میشود(17-15). Msi2 مارکر پیش آگهی ضعیفی گزارش شده است که در تعیین استراتژی درمانی لوکمی ارزش تشخیصی زیادی دارد(19، 18). در این راستا، خاراس و همکاران نشان دادند بیان Msi2 در شکلگیری کلونیهای خونساز با فنوتیپ میلوئیدی نابالغ در شرایط آزمایشگاهی افزایش مییابد و در داخل بدن سبب گسترش سلولهای بنیادی خونساز(HSCs) و سلولهای پیشساز کوتاهمدت میگردد(20). از طرفی گزارش نمودند Msi2 در مراحل پیشرفته CML (مرحله بحران بلاست) در سطوح بالاتری نسبت به مراحل اولیه CML (مرحله مزمن) بیان میشود و این افزایش سطوح بیانی Msi2 در ارتباط معکوس با میزان بیان ژن Numb میباشد. در سال 2010، ایتو و همکاران ارتباط مابین افزایش بیان Numb و کاهش سلولهای لوکمی در مدلهای موشی را گزارش نمودند(8). آنها نشان دادند که سطوح بیانی Numb میتواند مانع پیشرفت بیماری شود. علاوه بر آن، گزارش کردند مهار بیان ژن Msi2 با استفاده از shRNA رشد سلولهای لوکمی و نرخ بقا را به طور قابل توجهی به خصوص در مرحله بحران بلاست کاهش میدهد. مشابه با القای Numb ، مهار Msi2 توسط shRNA تمایز را در سلولهای لوکمی القا میکند و توانایی تکثیر و انتشار آنها را مهار میکند. در سال ۲۰۱۶ گارسیا ـ آلگریا و همکاران غیرفعالسازی سطوح بیانی Numb برای کاهش سلولهای لوکمیایی را تایید کردند(12). در سال ۲۰۱۰ خاراس و همکاران به دنبال مهار ژن Msi2 ، افزایش بیان رونوشت Numb را در رده سلولـی LAMA-84 (رده سلولـی مشتـق شـده از بیمـاران
مرحله بحران بلاستیک CML) گزارش نمودند(20).
در مطالعه حاضر، بیان ژن Numb در رده سلولی K562 (رده سلول میلوئیدی مربوط به CML)، پس از ترانسفکت siRNA علیه ژن Msi2 بررسی گردید و ارتباط معکوس بین ژن Msi2 و Numb در رده سلولی مذکور نیز مشهود بود. در این مطالعه دریافتیم مهار ژن Msi2 منجر به افزایش بیان ژن P21 به عنوان ژن کلیدی چرخه سلولی در سلولهای K562 میگردد. مطابق با نتایج ما، ژانگ و همکاران نشان دادند که مهار Msi2 منجر به کاهش تکثیر در رده سلولیKG-1a (رده سلول میلوئیدی مربوط به لوکمی میلوئیدی حاد یا AML) میگردد(21). خاراس و همکاران کاهش تکثیر را به دنبال مهار Msi2 ، در ردههای سلولی Nomo-1 و THP-1 (مشتق از لوکمی میلوئیدی حاد) و LAMA-84 و AR230 (مشتق از لوکمی میلوئیدی مزمن) گزارش نمودند. به طور مشابه اندروسـ آگوآیو و همکاران و هوپ و همکاران نشان دادند که مهارMsi2 به طور چشمگیری سلولهای بنیادی هماتوپویتیک موش را در فاز S-G2/M کاهش میدهد(23-21).
در این مطالعه همچنین مشاهده کردیم که مهار Msi2 درصد آپوپتوز اولیه و نهایی را در سلولهای K562 افزایش میدهد، این یافتهها با نتایج خاراس و همکاران که گزارش نمودند مهار Msi2 توسط shRNA سبب القای قابل توجه آپوپتوز در ردههای سلولی لوکمی Nomo-1 و THP-1 و LAMA-84 و AR230 شده است، سازگار است(20). علاوه بر آن، در این مطالعه مشخص شد رونوشت Bcl-2 که فاکتور مهم ضد آپوپتوزی است، بعد از مهار Msi2 در رده سلولی K562، به طور چشمگیری کاهش یافت. نتایج ما با یافتههای مطالعه ژانگ و همکاران (18) که القای آپوپتوز را با کاهش بیان Bcl-2 در سطح mRNA و پروتئین نشان دادند، سازگار است (22).
نتیجهگیری
اگر چه در سالهای اخیر گامهای مهمی در جهت درمان مبتلایان لوکمی برداشته شده است، ارائه رویکردی که به طور اختصاصی قادر باشد سبب کاهش سلولهای لوکمیایی شود، میتواند نویدبخش درمان مؤثر سرطان باشد(26-24). به نظر میرسد هدفگیری ژنهای کلیدی میتواند استراتژی درمانی مؤثری را برای از بین بردن سلولهای لوکمیایی مزمن ارائه دهد. در مطالعه حاضر احتمال مشارکت فعالیت مسیر پیامرسانی Musashi2-Numb در القای آپوپتوز سلولهای لوکمیایی بررسی شد. با توجه به نتایج به دست آمده، مهار Msi2 از طریق استراتژی تداخل RNA (RNA interference, RNAi) منجر به افزایش سطوح بیانی ژن Numb (به عنوان ژن تعیین کننده سرنوشت سلول)، القای آپوپتوز، افزایش الگوی بیانی ژن P21 (ژن چرخه سلولی) و کاهش ژن Bcl-2 (ژن آنتی آپوپتوزی) در سلولهای K562گردید. آنچه به عنوان مکانیسمی محتمل در این زمینه میتواند مطرح باشد این است که اثرات مهاری سرکوب بیان Msi2 روی سلولهای لوکمیایی ممکن است با اثرات تنظیمی Numb که عاملی تعیینکننده در سرنوشت سلول است، مرتبط باشد زیرا کاهش بیان Msi2 سبب افزایش سطوح بیانی Numb که
باعث از بین رفتن سلولهای CML میشود، میگردد و این یافتهها احتمالاً در ارتباط با مسیرهای پیامرسانی دیگری است که در نهایت رشد سلولهای لوکمی را کاهش میدهند. در این راستا، مطالعههای بیشتری نیاز است. استراتژی ارایه شده میتواند گامی مؤثر به سوی درمان نهایی لوکمی میلوئیدی به شمار آید.
تشکر و قدردانی
مطالعـه حاضـر برگرفتـه از پایاننامــه کارشناسی ارشد
رشته ژنتیک مولکولی است و با پشتیبانی مالی دانشگاه تربیت مدرس و ستاد توسعه علوم و فناوریهای سلولهای بنیادی معاونت علمی و فناوری ریاست جمهوری(موافقت نامه 77230/11) انجام شده است. نویسندگان مراتب قدردانی خود را نسبت به معاونت محترم پژوهشی دانشگاه تربیت مدرس و هم چنین معاونت محترم علمی و فناوری ریاست جمهوری اعلام میدارند.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و انكولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





