جلد 14، شماره 2 - ( تابستان 1396 )
جلد 14 شماره 2 صفحات 91-84 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
khosravi A, Shams Asanja K, Shaiegan M, Samiei S, Ataee Z, Abdollahi M, et al . The allele frequencies of human Neutrophil Antigens 5 (HNA-5) in Tabriz city. bloodj 2017; 14 (2) :84-91
URL: http://bloodjournal.ir/article-1-1106-fa.html
URL: http://bloodjournal.ir/article-1-1106-fa.html
خسروی عطیه، شمس اسنجان کریم، شایگان مژگان، سمیعی شهرام، عطایی کچویی زهرا، عبدالهی مریم، و همکاران.. فراوانی آللی آنتیژن نوتروفیلی پنج (HNA-5) در اهداکنندگان خون تبریز. فصلنامه پژوهشی خون. 1396; 14 (2) :84-91
عطیه خسروی 
 ، کریم شمس اسنجان
، کریم شمس اسنجان 
 ، مژگان شایگان*
، مژگان شایگان* 
 ، شهرام سمیعی
، شهرام سمیعی 
 ، زهرا عطایی کچویی
، زهرا عطایی کچویی 
 ، مریم عبدالهی
، مریم عبدالهی 
 ، مهناز کواری
، مهناز کواری 
 ، محبوبه شفیعی الماسیان
، محبوبه شفیعی الماسیان 
 ، پریسا حسین زاده
، پریسا حسین زاده 


 ، کریم شمس اسنجان
، کریم شمس اسنجان 
 ، مژگان شایگان*
، مژگان شایگان* 
 ، شهرام سمیعی
، شهرام سمیعی 
 ، زهرا عطایی کچویی
، زهرا عطایی کچویی 
 ، مریم عبدالهی
، مریم عبدالهی 
 ، مهناز کواری
، مهناز کواری 
 ، محبوبه شفیعی الماسیان
، محبوبه شفیعی الماسیان 
 ، پریسا حسین زاده
، پریسا حسین زاده 

دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 1657 kb]
(1626 دریافت)
| چکیده (HTML) (6216 مشاهده)
مقدمه
نوتروفیلها بیشترین جمعیت(70%-40%) گلبولهای سفید را شامل میشوند(1). آنتیژنهای اختصاصی نوتروفیلی که تحت عنوان آنتیژنهای نوتروفیلی انسانی (Human Neutrophil Antigens) HNAs نامیده میشوند، شامل 5 سیستم آنتیژنی میباشند که در واقع گلیکوپروتئینهای روی غشای پلاسمایی نوتروفیلها هستند(3، 2). با توجه به قدرت ایمنیزایی این آنتیژنها، واکنش با آنتیبادی ضد این آنتیژنها باعث ایجاد عوارض متعددی نظیر: آسیب حاد ریوی بعد از انتقال خون (Transfusion Related Acute Lung Injury) TRALI ، نوتروپنی اتوایمیون نوزادی، نوتروپنی دارویی و نوتروپنی ایمیون بعد از پیوند مغز استخوان در گیرنده میگردد(3).
یکی از این سیستمهای آنتیژنی، سیستم HNA-5 با دو نوع آلل میباشد که روی زیر واحدαL (CD11a) از مجموعه مولکول چسبندگی اینتگرینی (LFA-1 ، CD11a/CD18) قرار گرفته است(4). تفاوت بین دو شکل آنتیژنهایHNA-5a (onda) و HNA-5b به علت وجود یک موتاسیون در جایگاه 791 (اگزون 21 ، ایزوفرم 1) یا جایگاه 707 (اگزون 19، ایزوفرم 2) از نقطه شروع ATG میباشد(4). به ترتیب رونوشت ایزوفرم 1 و 2 شامل bp 5226 (1170 اسید آمینه) و bp 4974 (1086 اسید آمینه) میباشد. HNA-5a به وسیله یک SNP در موقعیت C2466G و جایگزینی آرژنین با تریونین(Thr 766 Arg) ایجاد میشود(6، 5). زیر واحد αLβ2 اختصاصی نوتروفیلها است و واکنشها و تبادلات داخل سلولی بین لکوسیتها را تسهیل میکند(6). آنتیبادی HNA-5 در بیماران مبتلا به آنمی آپلاستیک با دریافت چند بار خون پیدا شده و این افراد در پیوند پوست با HLA ناسازگار، بقای طولانی قابل توجهی را نشان دادهاند. بنابراین ممکن است آنتیبادیهای HNA-5a مانع میانکنش بین لکوسیتها در بافت پیوندی و در نتیجه تاخیر در پس زدن بافت گردند(6). وفور ژنوتیپی HNA-5a در جمعیتهای مختلف در محدوده 79% الی 88% متفاوت گزارش شده است(7).
با توجه به عدم وجود گزارش منتشر شده از وفور ژنی و آللی سیستم HNA-5 ، در این مطالعه فراوانی آللهای آن به روش PCR-RFLP در بین 190 اهداکننده خون ساکن شهر تبریز گزارش میشوند. در این روش بعد از تکثیر توالی مورد نظر، از آنزیم( Sdu1 (Bsp1286Iاستفاده شد. پس از هضم توسط آنزیم، در صورت وجود ژن HNA-5a، توالی مورد نظر توسط آنزیم هضم شده و دو باند bp 65 و bp 136 را ایجاد میکند اما در صورت عدم وجود این ژن، روی ژل یک باند bp 201 مشاهده میشود(8). بدین وسیله افراد هتروزیگوت و هموزیگوت مشخص میشوند و شیوع بیماریهای مربوط به HNA-5 قابل تخمین است.
مواد و روشها
مطالعه حاضر از نوع توصیفی بود. از 214 اهداکننده غیرخویشاوند خون با قومیت آذری در پایگاه انتقال خون شهر تبریز در استان آذربایجان شرقی، نمونه خون کامل وریدی به حجم 3 میلیلیتر در لولههای حاوی ماده ضد انعقاد EDTA ، در حین نمونهگیری برای انجام آزمایشهای غربالگری خون جمعآوری شد که با توجه به عدم مناسب بودن کیفیت برخی نمونهها، 190 نفر مورد ارزیابی نهایی قرار گرفتند. قبل از نمونهگیری، از اهداکنندگان خواسته شده تا فرم رضایتمندی را پر کنند و مقاله دارای کد اخلاق(IR-TMI-REC-1393-10) میباشد. نمونهگیری به صورت تصادفی انجام شد. اطلاعات مورد نیاز از قبیل سن، جنسیت، تعداد بارداری زنان، گروه خونی و نژاد افراد از اهداکنندگان ثبت شدند. بعد از نمونهگیری و انتقال نمونهها به آزمایشگاه، استخراج DNA با استفاده از کیت تجاری پارس طوس(ستونهای فیلتردار سیلیکایی) و طبق بروشور کیت انجام شد. به طور خلاصه، 20 میکرولیتر از آنزیم پروتئینازK ( (PK با 200 میکرولیتر از خون کامل و 200 میکرولیتر از محلول بافر فسفات((PB به مدت20 دقیقه در دمای 57 درجه سانتیگراد انکوبه شد. پس از افزودن 200 میکرولیتر از absolute ethanol به ویال، مجدداً 10 ثانیه میکروفیوژ شد. بعد از چرخش سریع (quick spin)، محتوای لیزات در یک ستون فیلتردار ریخته شده و 1 دقیقه با دور rpm 8000 سانتریفیوژ گردید. بعد از دوبار شستشو با محلولهای شستشوی پارس طوس(PW1 و PW2) نمونههـا بـا 100 میکرولیتـر از محلـول الـوشــن
جدول 1: توالی آغازگرها، اندازه، غلظت نهایی و اندازه مورد انتظار برای محصولات تکثیری در هر آنتیژن
جدول 2: تغییرات دما و زمان در این مطالعه
جدول 3: فراوانی ژنی HNA-5a و HNA-5b در مطالعههای مختلف
جدول 4: مقایسه نتایج مطالعه حاضر با مطالعه شاهین و همکاران(16)
استان تهران از قومیت فارس(به روش مشابه با روش کار مطالعه فعلی) پرداختند(16).
وفور آللهای HNA-5a و HNA-5b در مطالعه شاهین به ترتیب 73/0 و 27/0 به دست آمد که با مطالعه حاضر مشابه نیست اما بین وفور فنوتیپ HNA-5a+/5a+ بین دو جمعیت آذری در مطالعه حاضر و جمعیت با قومیت فارس در مطالعه شاهین تفاوتی وجود ندارد(جدول 4). همان گونه که هاوک و همکاران مطرح نمودند در صورت شباهت در وفور ژنی بین جمعیتها، انتقال خون بین دو گروه فوق باعث تولید آلوآنتیبادی ضد آنتیژنهای نوتروفیلی نمیگردد(12).
نتیجهگیری
روش به کار رفته در این مطالعه مبتنی بر PCR-RFLP بوده که بررسی وفور آللهای آنتیژنهای نوتروفیلی کارآمـد میباشد. بررسیها نشان داد که وفور کلی آللهای
HNA-5a و HNA-5b در قومیت آذری ساکن تبریز به ترتیب 51/0 و 49/0 میباشد. بررسی آماری نشان داد وفور آللی HNA-5 بین دو قومیت فارس و آذری ساکن کشور نیز شبیه نیست، به نظر میرسد برای انتقال خون بین دو قومیت باید ملاحظات و بررسی بیشتری صورت گیرد.
تشکر و قدردانی
این مقاله بخشی از پایان نامه دوره کارشناسی ارشد با حمایت مالی مؤسسه عالی آموزشی و پژوهشی طب انتقال خون/تهران و دانشگاه علوم پزشکی تبریز(دانشکده پزشکی) میباشد. نویسندگان مقاله بدینوسیله از دکتر وحید مثمر (مدیر کل مرکز انتقال خون استان آذربایجان شرقی) و خانم سریه محمدی از همکاران محترم مرکز اهدای خون اداره کل پایگاه انتقال خون استان آذربایجان شرقی واقع در شهر تبریز تشکر مینمایند.
متن کامل: (1779 مشاهده)
فراوانی آللی آنتیژن نوتروفیلی پنج (HNA-5) در اهداکنندگان خون تبریز
عطیه خسروی1، کریم شمس اسنجان2، مژگان شایگان3، شهرام سمیعی4، زهرا عطایی کچویی5، مریم عبدالهی6،
مهناز کواری6، محبوبه شفیعی الماسیان7، پریسا حسینزاده7
چکیده
سابقه و هدف
آنتیژنهای نوتروفیلی انسانی، شامل 5 سیستم آنتیژنی است که بر روی غشای گلیکوپروتئینی گلبولهای سفید قرار دارند. هدف از مطالعه، اطلاع از وفور آللی HNA در یک جمعیت به منظور تخمین شیوع بیماریهای مربوط به HNA-5 بود.
مواد و روشها
در این مطالعه توصیفی، از 190 اهداکننده آذری غیرخویشاوند ساکن تبریز مراجعهکننده به پایگاه انتقال خون تبریز، نمونه خون دریافت شد. با استفاده از کیت تجاری پارس طوس، DNAها استخراج و سپس بررسی مولکولی HNA-5a-(or HNA-5b) وHNA-5a+ به روش PCR-RFLPانجام شد. محصول PCR با استفاده از آنزیمSdu1 Bsp1286I هضم شد. وفور ژنی آنتیژنهای HNA-5a وHNA-5b با استفاده از معادله هاردی واینبرگ محاسبه شد.
یافتهها
فنوتیپهای مشاهده شده HNA-5a(+/+) به ترتیب در 93 نفر، (+/-) HNA-5 در 10 نفر وHNA-5a (-/-) در 87 نفر مشاهده گردیدند. فراوانی مشاهده شده با قانون هاردی واینبرگ تطابق داشت. فراوانی آللی HNA-5a طبق قانون مذکور برابر با 51/0 و HNA-5a- (یا HNA5-b) برابر با 49/0 به دست آمد.
نتیجه گیری
فراوانی آللهای HNA-5 در این مطالعه، مشابه نتایج به دست آمده برای سایر جمعیتها نمیباشد.
کلمات کلیدی: نوتروفیلها، PCR ، اهداکنندگان خون
تاریخ دریافت: 16/11/95
تاریخ پذیرش: 4 /2 /96
1- کارشناس ارشد خونشناسی و بانک خون ـ مرکز تحقیقات ایمونولوژی ـ دانشگاه علوم پزشکی تبریز ـ تبریز ـ ایران
2- PhD خونشناسی و بانک خون ـ استادیار مرکز تحقیقات خون و انکولوژی دانشگاه علوم پزشکی تبریز و مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهـران ـ ایران
3- مؤلف مسئول: PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهـران ـ ایران ـ صندوق پستی: 1157-14665
4- کارشناس ارشد بیوشیمی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- کارشناس زیستشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- کارشناس میکروبیولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
7- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و پایگاه منطقهای آموزشی انتقال خون تبریز ـ تبریز ـ ایران
عطیه خسروی1، کریم شمس اسنجان2، مژگان شایگان3، شهرام سمیعی4، زهرا عطایی کچویی5، مریم عبدالهی6،
مهناز کواری6، محبوبه شفیعی الماسیان7، پریسا حسینزاده7
چکیده
سابقه و هدف
آنتیژنهای نوتروفیلی انسانی، شامل 5 سیستم آنتیژنی است که بر روی غشای گلیکوپروتئینی گلبولهای سفید قرار دارند. هدف از مطالعه، اطلاع از وفور آللی HNA در یک جمعیت به منظور تخمین شیوع بیماریهای مربوط به HNA-5 بود.
مواد و روشها
در این مطالعه توصیفی، از 190 اهداکننده آذری غیرخویشاوند ساکن تبریز مراجعهکننده به پایگاه انتقال خون تبریز، نمونه خون دریافت شد. با استفاده از کیت تجاری پارس طوس، DNAها استخراج و سپس بررسی مولکولی HNA-5a-(or HNA-5b) وHNA-5a+ به روش PCR-RFLPانجام شد. محصول PCR با استفاده از آنزیمSdu1 Bsp1286I هضم شد. وفور ژنی آنتیژنهای HNA-5a وHNA-5b با استفاده از معادله هاردی واینبرگ محاسبه شد.
یافتهها
فنوتیپهای مشاهده شده HNA-5a(+/+) به ترتیب در 93 نفر، (+/-) HNA-5 در 10 نفر وHNA-5a (-/-) در 87 نفر مشاهده گردیدند. فراوانی مشاهده شده با قانون هاردی واینبرگ تطابق داشت. فراوانی آللی HNA-5a طبق قانون مذکور برابر با 51/0 و HNA-5a- (یا HNA5-b) برابر با 49/0 به دست آمد.
نتیجه گیری
فراوانی آللهای HNA-5 در این مطالعه، مشابه نتایج به دست آمده برای سایر جمعیتها نمیباشد.
کلمات کلیدی: نوتروفیلها، PCR ، اهداکنندگان خون
تاریخ دریافت: 16/11/95
تاریخ پذیرش: 4 /2 /96
1- کارشناس ارشد خونشناسی و بانک خون ـ مرکز تحقیقات ایمونولوژی ـ دانشگاه علوم پزشکی تبریز ـ تبریز ـ ایران
2- PhD خونشناسی و بانک خون ـ استادیار مرکز تحقیقات خون و انکولوژی دانشگاه علوم پزشکی تبریز و مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهـران ـ ایران
3- مؤلف مسئول: PhD ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهـران ـ ایران ـ صندوق پستی: 1157-14665
4- کارشناس ارشد بیوشیمی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- کارشناس زیستشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- کارشناس میکروبیولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
7- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و پایگاه منطقهای آموزشی انتقال خون تبریز ـ تبریز ـ ایران
مقدمه
نوتروفیلها بیشترین جمعیت(70%-40%) گلبولهای سفید را شامل میشوند(1). آنتیژنهای اختصاصی نوتروفیلی که تحت عنوان آنتیژنهای نوتروفیلی انسانی (Human Neutrophil Antigens) HNAs نامیده میشوند، شامل 5 سیستم آنتیژنی میباشند که در واقع گلیکوپروتئینهای روی غشای پلاسمایی نوتروفیلها هستند(3، 2). با توجه به قدرت ایمنیزایی این آنتیژنها، واکنش با آنتیبادی ضد این آنتیژنها باعث ایجاد عوارض متعددی نظیر: آسیب حاد ریوی بعد از انتقال خون (Transfusion Related Acute Lung Injury) TRALI ، نوتروپنی اتوایمیون نوزادی، نوتروپنی دارویی و نوتروپنی ایمیون بعد از پیوند مغز استخوان در گیرنده میگردد(3).
یکی از این سیستمهای آنتیژنی، سیستم HNA-5 با دو نوع آلل میباشد که روی زیر واحدαL (CD11a) از مجموعه مولکول چسبندگی اینتگرینی (LFA-1 ، CD11a/CD18) قرار گرفته است(4). تفاوت بین دو شکل آنتیژنهایHNA-5a (onda) و HNA-5b به علت وجود یک موتاسیون در جایگاه 791 (اگزون 21 ، ایزوفرم 1) یا جایگاه 707 (اگزون 19، ایزوفرم 2) از نقطه شروع ATG میباشد(4). به ترتیب رونوشت ایزوفرم 1 و 2 شامل bp 5226 (1170 اسید آمینه) و bp 4974 (1086 اسید آمینه) میباشد. HNA-5a به وسیله یک SNP در موقعیت C2466G و جایگزینی آرژنین با تریونین(Thr 766 Arg) ایجاد میشود(6، 5). زیر واحد αLβ2 اختصاصی نوتروفیلها است و واکنشها و تبادلات داخل سلولی بین لکوسیتها را تسهیل میکند(6). آنتیبادی HNA-5 در بیماران مبتلا به آنمی آپلاستیک با دریافت چند بار خون پیدا شده و این افراد در پیوند پوست با HLA ناسازگار، بقای طولانی قابل توجهی را نشان دادهاند. بنابراین ممکن است آنتیبادیهای HNA-5a مانع میانکنش بین لکوسیتها در بافت پیوندی و در نتیجه تاخیر در پس زدن بافت گردند(6). وفور ژنوتیپی HNA-5a در جمعیتهای مختلف در محدوده 79% الی 88% متفاوت گزارش شده است(7).
با توجه به عدم وجود گزارش منتشر شده از وفور ژنی و آللی سیستم HNA-5 ، در این مطالعه فراوانی آللهای آن به روش PCR-RFLP در بین 190 اهداکننده خون ساکن شهر تبریز گزارش میشوند. در این روش بعد از تکثیر توالی مورد نظر، از آنزیم( Sdu1 (Bsp1286Iاستفاده شد. پس از هضم توسط آنزیم، در صورت وجود ژن HNA-5a، توالی مورد نظر توسط آنزیم هضم شده و دو باند bp 65 و bp 136 را ایجاد میکند اما در صورت عدم وجود این ژن، روی ژل یک باند bp 201 مشاهده میشود(8). بدین وسیله افراد هتروزیگوت و هموزیگوت مشخص میشوند و شیوع بیماریهای مربوط به HNA-5 قابل تخمین است.
مواد و روشها
مطالعه حاضر از نوع توصیفی بود. از 214 اهداکننده غیرخویشاوند خون با قومیت آذری در پایگاه انتقال خون شهر تبریز در استان آذربایجان شرقی، نمونه خون کامل وریدی به حجم 3 میلیلیتر در لولههای حاوی ماده ضد انعقاد EDTA ، در حین نمونهگیری برای انجام آزمایشهای غربالگری خون جمعآوری شد که با توجه به عدم مناسب بودن کیفیت برخی نمونهها، 190 نفر مورد ارزیابی نهایی قرار گرفتند. قبل از نمونهگیری، از اهداکنندگان خواسته شده تا فرم رضایتمندی را پر کنند و مقاله دارای کد اخلاق(IR-TMI-REC-1393-10) میباشد. نمونهگیری به صورت تصادفی انجام شد. اطلاعات مورد نیاز از قبیل سن، جنسیت، تعداد بارداری زنان، گروه خونی و نژاد افراد از اهداکنندگان ثبت شدند. بعد از نمونهگیری و انتقال نمونهها به آزمایشگاه، استخراج DNA با استفاده از کیت تجاری پارس طوس(ستونهای فیلتردار سیلیکایی) و طبق بروشور کیت انجام شد. به طور خلاصه، 20 میکرولیتر از آنزیم پروتئینازK ( (PK با 200 میکرولیتر از خون کامل و 200 میکرولیتر از محلول بافر فسفات((PB به مدت20 دقیقه در دمای 57 درجه سانتیگراد انکوبه شد. پس از افزودن 200 میکرولیتر از absolute ethanol به ویال، مجدداً 10 ثانیه میکروفیوژ شد. بعد از چرخش سریع (quick spin)، محتوای لیزات در یک ستون فیلتردار ریخته شده و 1 دقیقه با دور rpm 8000 سانتریفیوژ گردید. بعد از دوبار شستشو با محلولهای شستشوی پارس طوس(PW1 و PW2) نمونههـا بـا 100 میکرولیتـر از محلـول الـوشــن
جدول 1: توالی آغازگرها، اندازه، غلظت نهایی و اندازه مورد انتظار برای محصولات تکثیری در هر آنتیژن
| سیستم | آنتیژن | غلظت نهایی (µM) | توالی | اندازه محصول |
| HNA-5 | پیش برنده 5a | 1 | 5'CTTCAGCATCTCCACCTTGC3' | bp 201 |
| معکوس 5a | 1 | 5'TTCTGATATTCCCCACCCTGA3' | bp 201 | |
| HGH | پیش برنده | 25/0 | 5'TGCCTTCCCAACCATTCCCTTA3' | bp 434 |
| معکوس | 25/0 | 5'CCACTCACGGATTTCTGTTGTGTTTC3' | bp 434 |
جدول 2: تغییرات دما و زمان در این مطالعه
| مرحله | Activation | Denaturation | Annealing | Extension | Final Elongation | پایانی |
| زمان (دقیقه/ثانیه) | 10 دقیقه | 20 ثانیه | 20 ثانیه | 20 ثانیه | 10 دقیقه | 4 دقیقه |
| دما (°C) | 95 | 94 | 57 | 74 | 74 | 4 |
| تعداد چرخه | 1 | 30 | 1 | 1 | ||
پارس طوس(PE) انکوبه شدند. نهایتاً DNA با 5 دقیقه سانتریفیوژ از فیلتر خارج و جمعآوری گردید.
با توجه به این که نسبت280/260A به عنوان درجه خلوص DNA و کنترل کیفیت DNAاستخراج شده با محدوده 9/1-7/1 نانومتر مطرح است، بنابراین کنترل کیفیت DNA استخراج شده با استفاده از دستگاه اسپکتروفتومتر نانودراپ WPA biowave II جذب نوری در طول موجهای 230 نانومتر،280 نانومتر و 260 نانومتر و نسبتهای آنها قرائت شد(9). از 214 نمونه، 190 نمونه در این بازه قرار میگرفتند که وارد مطالعه شدند.
ژنوتیپ HNA-5a با روش PCR-RFLP (PCR-Restriction Fragment Length Polymorphisms ) تعیین شد. با استفاده از توالی آغازگرهای قید شده در منابع مختلف، توالی آغازگرها مشخص و ویژگیهای آنها توسط نرمافزار BLAST تعیین گردید و برای تهیه به شرکت سیناکلون سفارش داده شدند(10، 8). حضور یا عدم حضور باند تکثیر شده(محصول واکنش) نشانه حضور یا عدم حضور آلل مربوطه در ژنوم فرد میباشد، برای کنترل صحت انجام واکنش تکثیر(PCR) در هر واکنش یک جفت آغازگر که قسمتی از ژن هورمون رشد انسان (HGH) را تکثیر میکند به عنوان کنترل داخلی به کار گرفته میشوند(جدول 1). غلظت آغازگرهای HGH به گونهای در نظر گرفته شده است که کمتر از غلظت آغازگرهای HNA-5a باشند، لذا در زمانی که تکثیر آنتیژنهای نوتروفیلی به صورت مطلوب انجام شوند، تکثیر ژن HGH هم انجام خواهد شد و رقابت نمیکنند. حجم کلی محتوای واکنش، 20 میکرولیتر(شامل 6 میکرولیتر از نمونه (ng 25) DNA ، 10 میکرولیتر از (ژنتبیو) 2 x master mix و 1 میکرولیتر از هر یک از آغازگرهای HGH-reverse (µM 25/0)، HGH-forward (µM 25/0)، HNA-5a-forward (µM 1) و HNA-5a-reverse (µM 1) و 3/0 میکرولیتر از آنزیم (unit/µL 5) Abm-good Hotstart-taq polymerase در هر لوله بود. سپس مخلوط تهیه شده بعد از اضافه کردن 25 میکرولیتر روغن جامد dinoil در ترموسایکلر قرار داده شد(جدول 2).
سپس 10 میکرولیتر از محصول PCR به 5/7 میکرولیتر H2O و 5/0 میکرولیتر آنزیم محدود کننده (U/µL 10) (Bsp1286I) Sdu1 و 2 میکرولیتر بافر 10x buffer Sdul افزوده شد. مخلوط آماده شده را 15 دقیقه در دمای 37 درجه سانتیگراد قرار دادیم. سپس برای غیر فعال شدن آنزیم مذکور، ویالها را در 95 درجه سانتیگراد قرار داده؛ با گذاشتن ویالها در ظرف حاوی یخ، عمل هضم متوقف میشود. پس از انجام مراحل تکثیر، محصولات PCR روی ژل آگارز 2% حاوی اتیدیوم بروماید همراه با Loading dye و با ولتاژ 100 ولت ران شده و با دستگاه UV ترانسایلومیناتور مشاهده و قرائت شدند.
باندهای مربوط به هضم یا عدم هضم توسط آنزیم Bsp1286I با یک سایز مارکر مقایسه و مشخص میشود. باندهایی که در مقابل سایز مارکرهایbp 65 و bp136 قرار میگیرند نشاندهنده وجود ژن HNA-5a هستند(شکل 1). درصورتی که قطعه ژنتیکی توسط آنزیم, هضم و شکسته نشود در مقابل باند 201 جفت باز قرار میگیرد که نشان میدهد HNA-5a- (در نتیجه HNA-5b) است(3).
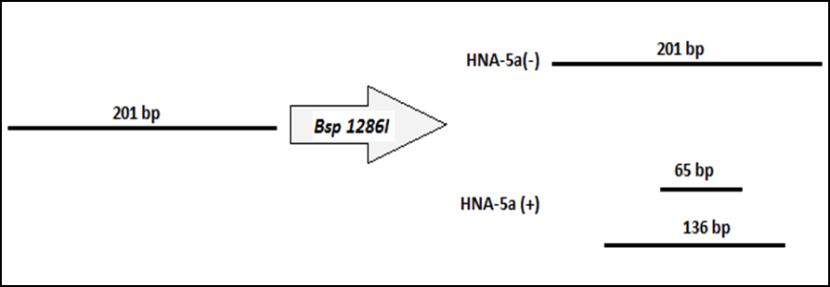
شکل1: (بالا) سایزهای قطعات تولید شده توسط آنزیم هضمکننده Sdu1 (Bsp1286I) . (پایین) توالی DNA شکسته شده توسط آنزیم محدودکننده Sdu 1 bsp1286I
موارد مشاهده شده با آزمون آماری کایدو بررسی و مشخص گردید با قانون هاردی واینبرگ تطابق داشت (52/0 p=). سپس با وارد کردن فراوانی موارد هموزیگوت و هتروزیگوت مشاهده شده در محاسبهگر هاردی واینبرگ، وفور ژنی یا آللی a و b برای HNA-5 به دست آمد. برای مقایسه فراوانی نسبی ژنهای بین مطالعه حاضر با جمعیتهای مختلف نیز از آزمون کایدو استفاده شد.
یافتهها
نمونه خون کامل از 190 اهداکننده خون غیر خویشاوند مراجعهکننده به پایگاه انتقال خون آذربایجان شرقی(مرکز مسجد کبود) شامل 53 زن(9/27%) و 137 مرد(1/72%) در این پژوهش مورد بررسی فنوتیپ قرار گرفتند. فنوتیپ HNA-5a (+/+) در 93 نفر (یا هموزیگوت HNA-5a/5a در 12/41%) شامل 23 زن و 70 مرد، HNA-5a (+/-) در 10 نفر(یا هتروزیگوت HNA-5a/5b در 33/7%) شامل 3 زن و 7 مرد، HNA-5a (-/-)در 87 نفر (یا هموزیگوتHNA-5b/5b در 55/54%) شامل 22 زن و 65 مرد مشاهده گردیدند. فراوانی مشاهده شده مذکور با قانون هاردی واینبرگ تطابق داشت(96/0 p>). فراوانی آللی یا ژنی HNA-5a برابر با 51/0 و HNA-5b برابر با 49/0 به دست آمد(شکل 2).
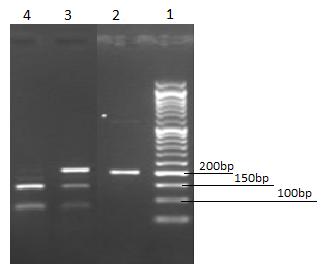
شکل 2: نتایج الکتروفورز محصول PCR-RFLP مربوط به ژن HNA-5 . ستون اول سایز مارکر bp 50 ، ستون دوم نمونه HNA-5a-/5a- (یا HNA5b/5b هموزیگوت)،ستون سوم نمونه HNA5a+/5a- (هتروزیگوت HNA5a/5b) ستون چهارم نمونه هموزیگوت HNA5a+/5a+ .
بحث
نتایج این مطالعه نشان دادند وفور آللی HNA-5a و HNA-5b به ترتیب برابر با 51/0 و 49/0 میباشند. ژنوتیپ HNA با استفاده از روشهای مختلف PCR از اعتبـار بیشتـری نسبـت بـه روشهای سرولوژی برخوردار است، روشهای سرولوژی، به منظور تعیین فنوتیپ HNA به علت جداسازی نوتروفیل بسیار وقتگیر است که ممکن است با توجه به نیمه عمر پایین نوتروفیل بر روی نتایج تاثیر بگذارد(8). به دلیل شناسایی اساس مولکولی آنتیژنهای نوتروفیلی، تعیین ژنوتیپ DNA با استفاده از روشهای مولکولی به روش PCR نسبت به آزمایشهای سرولوژیک ارجحیت دارد. ژنوتیپ HNA-1,-3,-4,-5 را میتوان با PCR-SSP و PCR-RFLP تعیین نمود(11). در سال 2011 هادوک و همکاران شیوع HNA-1,-3,-4,-5 را در 119 اهداکننده خون آلمانی و 118 اهداکننده ترکیهای به وسیله روش SSP-PCR بررسی کردند(12). فراوانی آنتیژنهای نوتروفیلی HNA-5a و HNA-5b به ترتیب در آلمان 731/0 و 269/0 و در ترکیه 754/0 و 246/0 بود. تفاوت چشمگیر آماری بین این دو گروه مشاهده نشد و نتایج نشان میدهد که انتقال خون و فرآوردههای آن بین جمعیت این دو کشور باعث تولید آلوآنتیبادی بر ضد آنتیژنهای نوتروفیلی نمیشود.
ماتسوهاشی و همکارانش در سال 2012 فراوانی HNA-1,-3,-4,-5 را به روش مولکولی و سرولوژیک بر روی 500 فـرد ژاپنـی بـررسی کردند. ژنوتیپ HNA-5 با روش PCR-SSP بررسی شد. نتایج این مطالعه در پیشبینی آلوایمیونیزه شدن به HNA به خصوص در انتقال خون و ناسازگاری مادر و جنین مفید و کارآمد بوده و اولین مطالعه جامع است که همه آنتیژنها را بررسی کرده است(13).
در سال 2013 در تایلند چانگسری و همکاران به بررسی شیوع HNA-1,-3,-4,-5 در 300 نفر از اهداکنندگان خون در محدوده سنی 58-18 سال پرداختند. در این روش از خون کامل با ضد انعقاد EDTA استفاده شد. ژنوتیپ HNA-5 با روش PCR-RFLP بررسی شد. نتایج مطالعهها حاکی از وجود فراوانی آللی HNA-5a به میزان 79/0 بود.(8)
به طور کلی فراوانی آللهای HNA-5a و HNA-5b در جمعیتهای مختلف به ترتیب در محدوده 86/0-71/0 و 289/0-145/0 میباشند(جدول 3).
بررسی آماری نشان داد که وفور آللهای HNA-5a و HNA-5b در جمعیت آذریها در مطالعه حاضر با وفور این آللها در سایر مطالعهها متفاوت است(8).
در مطالعهای در سال 1393 شاهین و همکاران به بررسی مولکولی وفور آللی آنتیژنهای نوتروفیلی 1 الی 5 در 167 اهـداکننده خـون مراجعهکننده به مرکز انتقال خون
با توجه به این که نسبت280/260A به عنوان درجه خلوص DNA و کنترل کیفیت DNAاستخراج شده با محدوده 9/1-7/1 نانومتر مطرح است، بنابراین کنترل کیفیت DNA استخراج شده با استفاده از دستگاه اسپکتروفتومتر نانودراپ WPA biowave II جذب نوری در طول موجهای 230 نانومتر،280 نانومتر و 260 نانومتر و نسبتهای آنها قرائت شد(9). از 214 نمونه، 190 نمونه در این بازه قرار میگرفتند که وارد مطالعه شدند.
ژنوتیپ HNA-5a با روش PCR-RFLP (PCR-Restriction Fragment Length Polymorphisms ) تعیین شد. با استفاده از توالی آغازگرهای قید شده در منابع مختلف، توالی آغازگرها مشخص و ویژگیهای آنها توسط نرمافزار BLAST تعیین گردید و برای تهیه به شرکت سیناکلون سفارش داده شدند(10، 8). حضور یا عدم حضور باند تکثیر شده(محصول واکنش) نشانه حضور یا عدم حضور آلل مربوطه در ژنوم فرد میباشد، برای کنترل صحت انجام واکنش تکثیر(PCR) در هر واکنش یک جفت آغازگر که قسمتی از ژن هورمون رشد انسان (HGH) را تکثیر میکند به عنوان کنترل داخلی به کار گرفته میشوند(جدول 1). غلظت آغازگرهای HGH به گونهای در نظر گرفته شده است که کمتر از غلظت آغازگرهای HNA-5a باشند، لذا در زمانی که تکثیر آنتیژنهای نوتروفیلی به صورت مطلوب انجام شوند، تکثیر ژن HGH هم انجام خواهد شد و رقابت نمیکنند. حجم کلی محتوای واکنش، 20 میکرولیتر(شامل 6 میکرولیتر از نمونه (ng 25) DNA ، 10 میکرولیتر از (ژنتبیو) 2 x master mix و 1 میکرولیتر از هر یک از آغازگرهای HGH-reverse (µM 25/0)، HGH-forward (µM 25/0)، HNA-5a-forward (µM 1) و HNA-5a-reverse (µM 1) و 3/0 میکرولیتر از آنزیم (unit/µL 5) Abm-good Hotstart-taq polymerase در هر لوله بود. سپس مخلوط تهیه شده بعد از اضافه کردن 25 میکرولیتر روغن جامد dinoil در ترموسایکلر قرار داده شد(جدول 2).
سپس 10 میکرولیتر از محصول PCR به 5/7 میکرولیتر H2O و 5/0 میکرولیتر آنزیم محدود کننده (U/µL 10) (Bsp1286I) Sdu1 و 2 میکرولیتر بافر 10x buffer Sdul افزوده شد. مخلوط آماده شده را 15 دقیقه در دمای 37 درجه سانتیگراد قرار دادیم. سپس برای غیر فعال شدن آنزیم مذکور، ویالها را در 95 درجه سانتیگراد قرار داده؛ با گذاشتن ویالها در ظرف حاوی یخ، عمل هضم متوقف میشود. پس از انجام مراحل تکثیر، محصولات PCR روی ژل آگارز 2% حاوی اتیدیوم بروماید همراه با Loading dye و با ولتاژ 100 ولت ران شده و با دستگاه UV ترانسایلومیناتور مشاهده و قرائت شدند.
باندهای مربوط به هضم یا عدم هضم توسط آنزیم Bsp1286I با یک سایز مارکر مقایسه و مشخص میشود. باندهایی که در مقابل سایز مارکرهایbp 65 و bp136 قرار میگیرند نشاندهنده وجود ژن HNA-5a هستند(شکل 1). درصورتی که قطعه ژنتیکی توسط آنزیم, هضم و شکسته نشود در مقابل باند 201 جفت باز قرار میگیرد که نشان میدهد HNA-5a- (در نتیجه HNA-5b) است(3).

شکل1: (بالا) سایزهای قطعات تولید شده توسط آنزیم هضمکننده Sdu1 (Bsp1286I) . (پایین) توالی DNA شکسته شده توسط آنزیم محدودکننده Sdu 1 bsp1286I

موارد مشاهده شده با آزمون آماری کایدو بررسی و مشخص گردید با قانون هاردی واینبرگ تطابق داشت (52/0 p=). سپس با وارد کردن فراوانی موارد هموزیگوت و هتروزیگوت مشاهده شده در محاسبهگر هاردی واینبرگ، وفور ژنی یا آللی a و b برای HNA-5 به دست آمد. برای مقایسه فراوانی نسبی ژنهای بین مطالعه حاضر با جمعیتهای مختلف نیز از آزمون کایدو استفاده شد.
یافتهها
نمونه خون کامل از 190 اهداکننده خون غیر خویشاوند مراجعهکننده به پایگاه انتقال خون آذربایجان شرقی(مرکز مسجد کبود) شامل 53 زن(9/27%) و 137 مرد(1/72%) در این پژوهش مورد بررسی فنوتیپ قرار گرفتند. فنوتیپ HNA-5a (+/+) در 93 نفر (یا هموزیگوت HNA-5a/5a در 12/41%) شامل 23 زن و 70 مرد، HNA-5a (+/-) در 10 نفر(یا هتروزیگوت HNA-5a/5b در 33/7%) شامل 3 زن و 7 مرد، HNA-5a (-/-)در 87 نفر (یا هموزیگوتHNA-5b/5b در 55/54%) شامل 22 زن و 65 مرد مشاهده گردیدند. فراوانی مشاهده شده مذکور با قانون هاردی واینبرگ تطابق داشت(96/0 p>). فراوانی آللی یا ژنی HNA-5a برابر با 51/0 و HNA-5b برابر با 49/0 به دست آمد(شکل 2).

شکل 2: نتایج الکتروفورز محصول PCR-RFLP مربوط به ژن HNA-5 . ستون اول سایز مارکر bp 50 ، ستون دوم نمونه HNA-5a-/5a- (یا HNA5b/5b هموزیگوت)،ستون سوم نمونه HNA5a+/5a- (هتروزیگوت HNA5a/5b) ستون چهارم نمونه هموزیگوت HNA5a+/5a+ .
بحث
نتایج این مطالعه نشان دادند وفور آللی HNA-5a و HNA-5b به ترتیب برابر با 51/0 و 49/0 میباشند. ژنوتیپ HNA با استفاده از روشهای مختلف PCR از اعتبـار بیشتـری نسبـت بـه روشهای سرولوژی برخوردار است، روشهای سرولوژی، به منظور تعیین فنوتیپ HNA به علت جداسازی نوتروفیل بسیار وقتگیر است که ممکن است با توجه به نیمه عمر پایین نوتروفیل بر روی نتایج تاثیر بگذارد(8). به دلیل شناسایی اساس مولکولی آنتیژنهای نوتروفیلی، تعیین ژنوتیپ DNA با استفاده از روشهای مولکولی به روش PCR نسبت به آزمایشهای سرولوژیک ارجحیت دارد. ژنوتیپ HNA-1,-3,-4,-5 را میتوان با PCR-SSP و PCR-RFLP تعیین نمود(11). در سال 2011 هادوک و همکاران شیوع HNA-1,-3,-4,-5 را در 119 اهداکننده خون آلمانی و 118 اهداکننده ترکیهای به وسیله روش SSP-PCR بررسی کردند(12). فراوانی آنتیژنهای نوتروفیلی HNA-5a و HNA-5b به ترتیب در آلمان 731/0 و 269/0 و در ترکیه 754/0 و 246/0 بود. تفاوت چشمگیر آماری بین این دو گروه مشاهده نشد و نتایج نشان میدهد که انتقال خون و فرآوردههای آن بین جمعیت این دو کشور باعث تولید آلوآنتیبادی بر ضد آنتیژنهای نوتروفیلی نمیشود.
ماتسوهاشی و همکارانش در سال 2012 فراوانی HNA-1,-3,-4,-5 را به روش مولکولی و سرولوژیک بر روی 500 فـرد ژاپنـی بـررسی کردند. ژنوتیپ HNA-5 با روش PCR-SSP بررسی شد. نتایج این مطالعه در پیشبینی آلوایمیونیزه شدن به HNA به خصوص در انتقال خون و ناسازگاری مادر و جنین مفید و کارآمد بوده و اولین مطالعه جامع است که همه آنتیژنها را بررسی کرده است(13).
در سال 2013 در تایلند چانگسری و همکاران به بررسی شیوع HNA-1,-3,-4,-5 در 300 نفر از اهداکنندگان خون در محدوده سنی 58-18 سال پرداختند. در این روش از خون کامل با ضد انعقاد EDTA استفاده شد. ژنوتیپ HNA-5 با روش PCR-RFLP بررسی شد. نتایج مطالعهها حاکی از وجود فراوانی آللی HNA-5a به میزان 79/0 بود.(8)
به طور کلی فراوانی آللهای HNA-5a و HNA-5b در جمعیتهای مختلف به ترتیب در محدوده 86/0-71/0 و 289/0-145/0 میباشند(جدول 3).
بررسی آماری نشان داد که وفور آللهای HNA-5a و HNA-5b در جمعیت آذریها در مطالعه حاضر با وفور این آللها در سایر مطالعهها متفاوت است(8).
در مطالعهای در سال 1393 شاهین و همکاران به بررسی مولکولی وفور آللی آنتیژنهای نوتروفیلی 1 الی 5 در 167 اهـداکننده خـون مراجعهکننده به مرکز انتقال خون
جدول 3: فراوانی ژنی HNA-5a و HNA-5b در مطالعههای مختلف
| کشور | سال | جمعیت | تعداد | روش | HNA-5a | HNA-5b | منابع |
| Brazilian India | 2006 | اهداکننده خون | 123 | PCR RFLP | 711/0 | 289/0 | Cardone, et al. (3) |
| سرخپوست | 114 | 855/0 | 145/0 | ||||
| German & Turkish | 2011 | اهداکننده خون | 119 | SSP-PCR | 731/0 | 269/0 | Hauck et al. (12) |
| 118 | 754/0 | 246/0 | |||||
| Chinese (GuangzhouHan) | 2011 | اهداکننده خون | 493 | PCR | 854/0 | 146/0 | Xia et al. (14) |
| Japanese | 2012 | افراد سالم | 508 | SSP-PCR | 840/0 | 16/0 | Matsuhashi et al. (3) |
| Chinese (Zhejian) | 2013 | افراد سالم غیر خویشاوند | 400 | PCR | 896/0 | 104/0 | He et al. (15) |
| Thailand | 2014 | اهداکننده خون | 300 | PCR-RFLP | 79/0 | - | Changsri et al. (8) |
| Azari ethnicity | 2016 | اهداکننده خون | 191 | PCR-RFLP | 51/0 | 49/0 | مطالعه حاضر |
جدول 4: مقایسه نتایج مطالعه حاضر با مطالعه شاهین و همکاران(16)
| ژنوتیپ | مطالعه شاهین تعداد (درصد) |
مطالعه حاضر تعداد (درصد |
مجموع | ارزش p |
| HNA-5 neg/neg (HNA-5b/5b) | 13 (8/7) | 87 (79/45) | 100 (01/28) | 00001/0 |
| HNA-5 pos/neg (HNA-5a/5b) | 64 (3/38) | 10 (26/5) | 74 (73/20) | 00001/0 |
| HNA-5 pos/pos (HNA-5a/5a) | 90 (9/53) | 93 (95/48) | 183 (26/51) | 35/0 |
| مجموع | 167 | 190 | 357 |
استان تهران از قومیت فارس(به روش مشابه با روش کار مطالعه فعلی) پرداختند(16).
وفور آللهای HNA-5a و HNA-5b در مطالعه شاهین به ترتیب 73/0 و 27/0 به دست آمد که با مطالعه حاضر مشابه نیست اما بین وفور فنوتیپ HNA-5a+/5a+ بین دو جمعیت آذری در مطالعه حاضر و جمعیت با قومیت فارس در مطالعه شاهین تفاوتی وجود ندارد(جدول 4). همان گونه که هاوک و همکاران مطرح نمودند در صورت شباهت در وفور ژنی بین جمعیتها، انتقال خون بین دو گروه فوق باعث تولید آلوآنتیبادی ضد آنتیژنهای نوتروفیلی نمیگردد(12).
نتیجهگیری
روش به کار رفته در این مطالعه مبتنی بر PCR-RFLP بوده که بررسی وفور آللهای آنتیژنهای نوتروفیلی کارآمـد میباشد. بررسیها نشان داد که وفور کلی آللهای
HNA-5a و HNA-5b در قومیت آذری ساکن تبریز به ترتیب 51/0 و 49/0 میباشد. بررسی آماری نشان داد وفور آللی HNA-5 بین دو قومیت فارس و آذری ساکن کشور نیز شبیه نیست، به نظر میرسد برای انتقال خون بین دو قومیت باید ملاحظات و بررسی بیشتری صورت گیرد.
تشکر و قدردانی
این مقاله بخشی از پایان نامه دوره کارشناسی ارشد با حمایت مالی مؤسسه عالی آموزشی و پژوهشی طب انتقال خون/تهران و دانشگاه علوم پزشکی تبریز(دانشکده پزشکی) میباشد. نویسندگان مقاله بدینوسیله از دکتر وحید مثمر (مدیر کل مرکز انتقال خون استان آذربایجان شرقی) و خانم سریه محمدی از همکاران محترم مرکز اهدای خون اداره کل پایگاه انتقال خون استان آذربایجان شرقی واقع در شهر تبریز تشکر مینمایند.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



