جلد 14، شماره 1 - ( بهار 1396 )
جلد 14 شماره 1 صفحات 52-43 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sadreazami P, Safar-Oughlou Azar A, Bashash D. Evaluation of the effect of selective p110δ inhibitor on acute lymphoblastic leukemia cells. bloodj 2017; 14 (1) :43-52
URL: http://bloodjournal.ir/article-1-1090-fa.html
URL: http://bloodjournal.ir/article-1-1090-fa.html
صدراعظمی پریسا، صفراوغلی آذر آوا، بشاش داوود. اثر مهارگر اختصاصی p110 در سلولهای لوسمی لنفوبلاستیک حاد. فصلنامه پژوهشی خون. 1396; 14 (1) :43-52
استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ گروه هماتولوژی
متن کامل [PDF 570 kb]
(1642 دریافت)
| چکیده (HTML) (5899 مشاهده)
مقدمه
ALL نوعی بدخیمی هماتولوژیک است و مشخصه اصلی آن تکثیر بی رویه و تجمع لنفوبلاستهای غیر طبیعی در مغز استخوان میباشد(1). برای درمان این بیماری از داروهای شیمی درمانی مختلفی هم چون گلوکوکورتیکوئیدها، وینکا آلکالوئیدها و آنتراسیکلین استفاده میشود. بهعلاوه، پیوند مغز استخوان نیز یکی دیگر از گزینههای درمانی برای بیماران با خطر بالا به حساب میآید(3، 2). با وجود پیشرفتهای قابل توجه در زمینه افزایش میزان بقای بیماران مبتلا به ALL ، مقاومت به داروهای رایج، هم چنان از جمله مهمترین معضلات درمانی این بیماران محسوب میشود.
PI3Ks آنزیمهایی مسئول در کنترل فرآیندهای مهم سلولی از جمله تنظیم چرخه سلولی، آپوپتوز، ترمیمDNA ، پیری، رگزایی و متابولیسم هستند و به عنوان مولکولهای میانجیگر عمل کرده و اغلب به دلیل نقششان در مسیر سیگنالینگ PI3K/AKT/mTOR معروف میباشند(4). PI3Kها به سه خانواده PI3K-1 ، PI3K-2 و PI3K-3 تقسیم میشوند. اخیراً شواهدی از ارتباط خانواده PI3K-1 با سرطان یافته شده است. این خانواده از PI3Kها هترودایمر بوده و به دو زیر خانواده1A و 1B تقسیم میشوند.
PI3K-1A از یک زیر واحد کاتالیتیک(p110) و یک زیر واحد تنظیمی(p85) تشکیل میشود. زیر واحد کاتالیتیک این خانواده از نظر ساختاری دارای 3 ایزوفرم α، β و d میباشد. لازم به ذکر است که ایزوفرمهای α و β به طور گسترده در تمام سلولها بیان میشوند؛ این در حالی است که بیان ایزوفرم δ تنها به سلولهای خونساز محدود میگردد(5). مطالعههای پیشین نشان میدهند که ایزوفرم p110δ در عملکرد و هموستاز لنفوسیتهای B نقش حیاتی دارد. در بررسی انجام شده در سال 2002 ، گزارش شده است که جهش غیرفعال کننده p110δ در موشها نه تنها منجر به کاهش تعداد لنفوسیتهای B1 و مارژینال میشود؛ بلکه میزان تیتر ایمنوگلوبولین را نیز در آنها به پایینتر از حد نرمال میرساند(6). با توجه به نقش گسترده این مسیر پیامرسانی، بدیهی است که هر گونه اختلال در تنظیم آن و یا فعال شدن نابهجای آن، با بروز بسیاری از بیماریها از جمله سرطانهای انسانی همراه باشد. اخیراً پیامرسانی p110δ به عنوان مکانیسم دخیل در بقا و گسترش انواع بدخیمیهای B cell معرفی شده است(7). از آن جایی که فعال شدن مسیر انتقال پیام PI3K از طریق BCR ، باعث افزایش بقای B cell های بدخیم میشود و هم چنین با توجه به این موضوع که p110δ غالباً در پیامرسانی BCR نقش دارد، به نظر میرسد که این ایزوفرم میتواند به عنوان هدفی مناسب در درمان بدخیمیهای B cell در نظر گرفته شود(8). GS-1101 مهارکننده اختصاصی p110δ است و تاکنون نتایج تحقیقات حاکی از اثر بخشی این دارو در بدخیمیهای B cell مانند: CLL ، MM و nHL بوده است(10، 9، 4). با توجه به نقش مسیر PI3K در بروز بدخیمیهای B cell ، در این مطالعه بر آن شدیم تا اثر مهار ایزوفرم p110δ را در سلولهای Nalm-6 بررسی نماییم.
مواد و روشها
کشت سلولی و تیمار دارویی:
مطالعه انجام شده از نوع تجربی بود. سلولهای Nalm-6 که از رده لوسمی لنفوبلاستیک حاد میباشند، در محیط کشت RPMI-1640 حاوی 10% سرم گاوی، U/mL100 پنیسیلین و µg/mL 100 استرپتومایسین در دمای 37 درجه سانتیگراد و فشار دیاکسید کربن 5% کشت داده شدند. داروی مورد استفاده GS-1101 بود که از شرکت Selleckchem آمریکا تهیه شده است. داروی فوق به شکل پودر بوده که به منظور تهیه محلول ذخیره 500 میکرومولار، آن را در DMSO استریل حل کرده و تا زمان استفاده در دمای20- درجه سانتیگراد نگهداری گردید. جهت جلوگیری از اثرات حلال بر روی میزان تکثیر و بقا، سلولها با غلظت مشخص شدهای از DMSO به عنوان کنترل منفی تیمار شدند. سلولهای Nalm-6 با غلظتهای 5 تا 50 میکرومولار به مدت 24، 36 و 48 ساعت تیمار شدند. تمامی آزمایشها به منظور افزایش دقت کار به صورت تریپلیکیت انجام شد.
بررسی شمارش سلولی به روش تریپان بلو:
بـرای شمارش سلولهـا از رنگآمیزی تریپانبـلو و لام
هموسایتومتر(لام نئوبار) استفاده شد. اساس این آزمایش بدین ترتیب است که سلولهای زنده نسبت به ورود رنگ نفوذناپذیر میباشند، حال آن که سلولهای مرده رنگ را جذب مینمایند. برای شمارش تعداد سلولهای زنده، تعداد سلولهای رنگ نگرفته در هر چهار سری خانههای شانزدهتایی(خانه شمارش WBC) شمارش شده و میانگین گرفته شد.
اندازهگیری فعالیت متابولیک سلولی به روشMTT :
برای ارزیابی تاثیر داروی GS-1101 بر فعالیت متابولیک سلولهای Nalm-6 ، تعداد 5000 سلول به هر چاهک پلیت 96 خانهای و فاقد داروی اضافه و به مدت زمان 24، 36 و 48 ساعت در انکوباتور CO2 دار انکوبه شد. پس از گذشت مدت زمان مورد نظر به سلولهای داخل پلیت محلول mg/mL 5 MTT اضافه گردید و به مدت 3ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت.
سپس پلیت با دور g 1000 به مدت 10 دقیقه سانتریفیوژ شده و پس از خالی کردن محلول رویی، 100 میکرولیتر DMSO به هر چاهک اضافه شد. جذب نوری هر چاهک توسط دستگاه الایزا ریدر در طول موج 570 نانومتر قرائت شد.
بررسی فعالیت چرخه سلولی:
ابتدا 105 × 5 سلول Nalm-6 با غلظتهای 20، 30 و 50 میکرومولار GS-1101 به مدت 36 ساعت تیمار شدند. پس از پایان انکوباسیون، سلولها به فالکون انتقال یافته و با دور g1000 سانتریفیوژ و در محلول PBS سوسپانسه شدند. سپس سلولها به وسیله اتانول 70% تثبیت شده و در ادامه 1 میلیلیتر محلول PI Master mix به آنها اضافه شد. سپس سوسپانسیون سلولی 30 دقیقه در دمای 37 درجه سانتیگراد انکوبه شد. در آخر الگوی رنگپذیری DNA با استفاده از دستگاه فلوسایتومتر مورد بررسی قرار گرفته و دادهها توسط نرمافزار فلومکس 3/2 تحلیل شدند.
استخراج RNA :
پس از تیمار سلولهای Nalm-6 با داروی GS-1101 به
مدت 36 ساعت، RNA آنها طبق دستورالعمل کیت high pure RNA isolation kit (رُوش) استخراج شده و به منظور تولید cDNA مورد استفاده قرار گرفت.
برای ساخت cDNA از کیتRevertAid First Strand cDNA Synthesis kit (رُوش) استفاده شد. حجم مورد نظر برای انجام این واکنش 20 میکرولیتر است و محتویات آن شامل 4 میکرولیتر x5 PCR ، 2 میکرولیتر dNTP ، 1 میکرولیتر رندوم هگزامر، 1میکرولیتر آب تیمار شده با دیاتیل پیروکربنات، 1 میکرولیتر مهارکننده RNase (U/µL 20)، 1 میکرولیتر ترانس کریپتاز معکوس M-MuLV (U/µL 200) و 1 میکروگرم از RNA مورد آزمایش میباشد.
محلول فوق به مدت 5 دقیقه در 65 درجه سانتیگراد، 5 دقیقه در 25 درجه سانتیگراد و یک ساعت در دمای 42 درجه سانتیگراد انکوبه شدند و در نهایت، واکنش ساخت cDNA با 5 دقیقه انکوباسیون در 70 درجه سانتیگراد خاتمه یافت. آزمایش Real-Time PCR در دستگاه(رُوش) light-cycler و در حجم 20 میکرولیتر انجام شد. به ازای هر واکنش 10 میکرولیتر از Syber premix Ex Taq (تاکارا)، 2 میکرولیتر از cDNA ، 5/0 میکرولیتر از هر یک از آغازگرهـا و 7 میکرولیتر آب عـاری از نوکلئاز استفـاده شد.
شرایط دمایی مورد استفاده شامل یک مرحله فعالسازی اولیه در دمای 95 درجه سانتیگراد به مدت 30 ثانیه و در ادامه، 40 چرخه برای دناتوراسیون(5 ثانیه در 95 درجه سانتیگراد) و آنیلینگ/اکستنشن توام(20 ثانیه در 60 درجه سانتیگراد) میباشد. برای بررسی اختصاصیت محصول تکثیر شده، منحنی ذوب مورد بررسی قرار گرفت. در انتها و برای محاسبه نسبی تعداد نسخه mRNA تکثیر شده از فرمول 2 -ΔΔctاستفاده شد(جدول 1).
آنالیز آماری:
تمامی آزمایشها به شکل سه آزمون مستقل انجام و مقادیر گزارش شده به شکل Mean ± SD قید شدند. هم چنیــن بــرای محـاسبـــات آمـــاری از روش t - test و نرمافزارSPSS17 و GraphPad Prism7 استفاده شد.
جدول 1: توالی آغازگرهای به کار رفته در آزمون Real Time Quantitative RT-PCR
علامت * بیانگر این است که اختلاف میانگین گروه آزمون با کنترل در سطح 05/0 p ≤ ، معنادار بوده است.
علامت ** بیانگر این است که اختلاف میانگین گروه آزمون با کنترل در سطح 01/0 p≤ ، معنادار بوده است.
علامت *** بیانگر این است که اختلاف میانگین گروه آزمون با کنترل در سطح 001/0 p≤ ، معنادار بوده است.
یافتهها
GS-1101 به صورت وابسته به دوز و زمان باعث کاهش شمارش سلولهای Nalm-6 میشود:
به منظور بررسی اثر آنتیپرولیفراتیو داروی GS-1101 ، سلولهای Nalm-6 به دوزهای مختلف مهارکننده(50-5 میکرومولار) به مدت 24، 36 و 48 ساعت تیمار شدند و سپس شمارش سلولهای زنده(Cell count) با استفاده از آزمایش تریپانبلو مورد ارزیابی قرار گرفت. گروهی از سلولها نیز به عنوان شاهد هیچ دارویی دریافت نکردند. نتایج به دست آمده نشان داد که GS-1101 میتواند باعث کاهش تعداد سلولهای Nalm-6 هم به صورت وابسته به دوز و هم به صورت وابسته به زمان شود. اگر چه داروی GS-1101 در دوز 5 میکرومولار تاثیر چندانی بر روی شمارش سلولها ندارد؛ اما افزایش دوز این دارو به بالای 10 میکرومولار قادر است به صورت کاملاً معناداری شمارش سلولهای زنده را کاهش دهد(نمودار 1).
GS-1101 هم به طور وابسته به دوز و هم به طور وابسته به زمان سبب مهار فعالیت متابولیکی سلولهای Nalm-6 میشود:
سلولهـای Nalm-6 بـا دوزهـای 5 تـا 50 میکرومـولار
مهارکننده P110d به مدت 24، 36 و 48 ساعت تیمار شدند
و میزان فعالیت متابولیک آنها توسط آزمایش MTT assay بررسی شد. نتایج به دست آمده نشاندهنده کاهش فعالیت متابولیک سلولهای Nalm-6 تیمار شده در مقایسه با سلولهای کنترل به طور وابسته به دوز و زمان میباشد. غلظت µM 5 دارو اثر چشمگیری در کاهش فعالیت متابولیکی سلولهای Nalm-6 ندارد، این در حالی است که دوز µM 30 از دارو طی مدت زمان 24، 36 و 48 ساعت به ترتیب این شاخص را به 75% ، 64% و 51% میرساند (نمودار 2).
.jpg)
نمودار 1: تاثیر داروی GS-1101 بر شمارش سلولی در سلولهایNalm-6 به صورت وابسته به دوز و زمان. سلولهای Nalm-6 به تعداد 000/390 و با غلظتهای 5 تا 50 میکرومولار از دارو تیمار و پس از گذشت 24، 36 و 48 ساعت، شمارش سلولی با روش تریپانبلو انجام شد. همان گونه که در شکل مشاهده میشود، GS-1101 به صورت وابسته به دوز و زمان شمارش سلولی را کاهش داده و دوز 50 میکرومولار دارای بیشترین اثرات آنتیپرولیفراتیو میباشد.
هم چنین با افزایش غلظت دارو به µM 50 شاهد کاهش معنادار فعالیت متابولیک به ترتیب 69% ، 56% و 39% در زمانهای ذکر شده میباشیم. با توجه به نتایج به دست آمده میتوان نتیجه گرفت که داروی GS-1101 هم به طور وابسته به دوز و هم به طور وابسته به زمان سبب مهار فعالیت متابولیکی سلولهای Nalm-6 میشود.
.jpg)
نمودار 2: بررسی اثر GS-1101 بر فعالیت متابولیک سلولهای Nalm-6 به طور وابسته به دوز و زمان. سلولهای Nalm-6 در تعداد 5000 سلول در پلیت 96 خانهای تحت تأثیر مقادیر مختلف GS-1101 قرار گرفته و به مدت 24، 36 و 48 ساعت انکوبه شدند. میانگین و انحراف معیار نتایج حاصل از سه بار تکرار(mean ± SD) محاسبه و p value به دستآمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با نمونه کنترل میباشد(* ، بیانگر 05/0 p< و ** ، بیانگر 01/0 p< و *** ، بیانگر 001/0 p< است).
GS-1101 موجب توقف چرخه سلولی در مرحله G1 و افزایش درصد سلولهای Nalm-6 در مرحلهsub-G1 میشود:
برای بررسی اثر مهاری GS-1101 بر چرخه سلولی، سلولهای Nalm-6 با دوزهای 20 ، 30 و 50 میکرومولار دارو به مدت 36 ساعت تیمار شدند و با فلوسایتومتری مورد آنالیز قرار گرفتند. نتایج به دست آمده حاکی از آن است که افزایش دوز GS-1101 منجر به افزایش درصد سلولها در فاز G1 میشود. بدین ترتیب که درصد سلولها در فاز G1 در گروه کنترل30% و در دوزهای 10، 20 و 30 به ترتیب 38%،40% و 59% میباشد(نمودار A3). هم چنین 36 ساعت پس از تیمار سلولهای Nalm-6 با دارو، میزان جمعیت سلولهای فاز Sub-G1اندازهگیری شد(نمودار B3). نتایج نشان داد افزایش دوز GS-1101 باعث افزایش جمعیت سلولها در مرحله Sub-G1 میشود که خود مؤیدی بر بروز مرگ سلولی(آپوپتوز) میباشد. به طوری که تیمار سلولها با دوز µM 50 دارو میزان جمعیت سلولها را در فاز Sub-G1 به میزان 8/5 برابر افزایش میدهد.
.jpg)
نمودار3 : بررسی اثر GS-1101 بر توزیع سلولها در چرخه سلولی. A) پس از تیمار سلولهای Nalm-6 با دوزهای مختلف GS-1101 به مدت 36 ساعت، میزان جمعیت سلولهای تیمار شده در مرحله G1 از چرخه سلولی به صورت معناداری افزایش یافت که خود مؤید توقف چرخه سلولی در این مرحله میباشد. B) تیمار سلولهای Nalm-6 با مهارکننده PI3K منجر به افزایش جمعیت سلولها در مرحله sub-G1 به صورت وابسته به دوز گردید. میانگین و انحراف معیار نتایج حاصل از سه بار تکرار(mean ± SD) محاسبه و p value به دستآمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با نمونه کنترل میباشد(*، بیانگر 05/0 p< و ** ، بیانگر 01/0 p< است).
تیمار سلولهای Nalm-6 با GS-1101 منجر به افزایش بیان ژن p21 میشود:
پس از آن که مشخص شد که داروی GS-1101 باعث توقف چرخه سلولی در مرحله G1 میشود؛ بر آن شدیم تا تاثیر مولکولی این دارو بر روی یکی از مهمترین ژنهای تنظیمکننده چرخه سلولی را مورد ارزیابی قرار دهیم.
مطالعههای پیشین نشان دادهاند که ژن p21 در تنظیم چرخه سلولی و پیش رفت آن از مرحله G1 به S نقش به سزایی را ایفا مینماید. p21 یک پروتئین مهارکننده سیکلین است که با اتصال به سیکلینهای CDK2 ، CDK1 و مجموعه CDK4/6 آنها را مهار کرده و به عنوان تنظیم کننده پیشروی سیکل سلولی در فازهای G1 و S عمل میکند. توقف سیکل سلولی به وسیله p21 تمایز را افزایش داده و از تکثیر جلوگیری مینماید(11). بر همین اساس در این بررسی پس از تیمار سلولهای Nalm-6 با دوز مؤثره دارو (50 میکرومولار)، میزان تغییر بیان mRNA ژن p21 با کمک روش Rq-PCR سنجیده شد(نمودار 4). همان طور که در نمودار 4 نمایش داده شده است، این دارو میتواند پس از گذشت 36 ساعت به صورت کاملاً معناداری میزان بیان ژن p21 را افزایش دهد.
.jpg)
نمودار 4: GS-1101 سبب افزایش فعالیت رونویسی ژن p21 میشود. پس از تیمار 36 ساعته سلولهای Nalm-6 با دوز 50 میکرومولار از داروی GS-1101، میزان بیان mRNA ژن p21 به صورت معناداری افزایش یافت. میانگین و انحراف معیار نتایج حاصل از سه بار تکرار(mean ± SD) محاسبه و p value به دست آمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با نمونه کنترل میباشد (*بیانگر 05/0 p< است).
GS-1101 باعث افزایش بیان ژن Bax در سلولهای Nalm-6 میشود:
پروتئین Bax به عنوان یک پروتئین کلیدی در آپوپتوز،
با اتصال به پروتئینهای مهارکننده آپوپتوز و آنتاگونیزه کردن اثر مهاری آنها، روند آپوپتوز را فعال میکند. از طرفی پروتئین Bcl-2 که یک مهار کننده آپوپتوز است، با جلوگیری از آزاد شدن سیتوکروم c از میتوکندری اثر مهاری خود را اعمال میکند(12). برای بررسی تاثیر GS-1101 بر بیان ژنهای Bax و Bcl-2 ، میزان بیان mRNA این دو ژن توسط روش Real-Time PCR مورد ارزیابی قرار گرفت. نتایج حاصل نشان میدهند که دوز 50 میکرومولار GS-1101 منجر به افزایش 13 برابری بیان ژن Bax شده است. لازم به ذکر است که این دارو تاثیر معنا داری بر روی فعالیت رونویسی ژن Bcl-2 ندارد(نمودار 5).
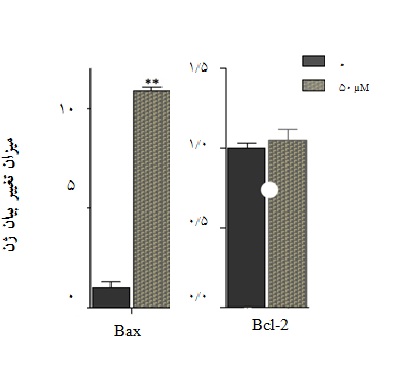
نمودار 5 : تاثیر GS-1101 در القای مرگ سلولی در سلولهای Nalm-6. سلولهای Nalm-6 با غلظت 50 میکرومولار از دارو به مدت 36 ساعت تیمار و پس از ساخت cDNA میزان بیان ژنها با استفاده از روش Quantitative RT-PCR محاسبه شد. GS-1101 باعث افزایش بیان ژن پروآپوپتوتیک Bax میشود. این در حالی است که داروی GS-1101 تاثیر معناداری بر روی میزان بیان mRNA ژن آنتیآپوپتوتیک Bcl-2 نمیگذارد. میانگین و انحراف از معیار نتایج حاصل از سه بار تکرار(Mean ± SD) محاسبه و p. value به دست آمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل میباشد(**، بیانگر 01/0 p< است).
بحث
نتایـج حاصـل از ایـن تحقیـق نشـان داد کـه استفاده از
مهارکننده مسیرهای مهم پیامرسانی دخیل در پاتوژنز سرطان، هم چون GS-1101 که مهارکننده p110dPI3K میباشد، میتواند به عنوان راهکار نوین در درمان لوسمیهای حاد مورد توجه قرار گیرد. اگـر چـه پیشرفتهای اخیر در دستورالعملهای شیمی درمانی و پیوند سلولهای بنیادی، میزان بقای مبتلایان بهALL را افزایش داده است؛ با این وجود تعدادی از بیماران به علت عود بیماری و یا مقاومت به درمان پیشآگهی بسیار ضعیفی دارند. بنابراین تلاشهای تحقیقاتی بر یافتن رویکردهای درمانی جدید که مسیرهای پیامرسانی مسئول بقای سلولهای سرطانی و مقاومت آنها به داروها را هدف قرار میدهند، متمرکز شده است(7). یکی از این مسیرهای پیامرسانی، مسیر انتقال پیامPI3K/Akt/mTOR میباشد که در نتیجه تغییرات ژنتیکی در طیف وسیعی از سرطانها دچار اختلال میشود(13). ایزوفرم p110δبه عنوان یکی از مهمترین ایزوفرمهای PI3K در بروز بدخیمیهای B cell شناخته میشود(14). GS-1101 یک مهارکننده انتخابی زیر واحد p110δ میباشد که اثر خود را با مهار رقابتی محل اتصال ATP در این ایزوفرم اعمال میکند(15). در مطالعههای آزمایشگاهی انجام شده بر روی سلولهای CLL ،GS-1101 عملکردهای مسیر PI3Kδ را مهار کرده و منجر به کاهش زندهمانی سلولها و القای آپوپتوز در آنها میشود(17، 16). در این مطالعه به بررسی اثر مهارکننده p110δ (GS-1101) بر روی سلولهای Nalm-6 که از نوع Pre B-ALL هستند، پرداخته شده است.
نتایج به دست آمده در این بررسی نشان دادند که GS-1101 باعث کاهش شمارش سلولی و فعالیت متابولیک سلولهای Nalm-6 به صورت وابسته به دوز و زمان میشود. این بررسیها نشان میدهد که GS-1101 در دوز 50 میکرومولار میتواند بیش از نیمی از سلولهای Nalm-6 (IC50) را در طی 48 ساعت نابود نماید و این تأییدی دال بر اثرات سایتوتوکسیک و آنتیپرولیفراتیو این دارو در سلولهای مشتق شده از pre-B ALL میباشد. مشابه با یافتههای این پژوهش، نگوئن و همکارانش نیز در سال 2014 گزارش نمودهاند که متعاقب تیمار سلولهای میلوئیدی با این مهارکننده PI3K ، نه تنها میزان تکثیر سلولها کاهش مییابد؛ بلکه میزان فعالیت متابولیک آنها نیز به صورت معناداری مهار میشود(18). هم چنین نتایج بعدی این مطالعه مشخص نمودند که اثر آنتیپرولیفراتیو این دارو در سلول Nalm-6 تا حدودی از طریق مهار چرخه سلولی در مرحله G1، کاهش درصد سلولهای مرحله S و افزایش بیان mRNA ژن p21 صورت میگیرد. p21 ، پروتئین مهارکننده سیکلین، از جمله مهمترین مولکولهای درگیر در مهار چرخه سلولی در مرحله G1 و S میباشد که توسط بسیاری از مسیرهای انتقال پیام همچون مسیرهای وابسته به p53 فعال میشود و با تجمع سلولها در مرحله G1 چرخه سلولی، باعث القای مرگ سلولی میشوند(21-19). مطالعه اخیر صورت گرفته بر روی یکی دیگر از داروهای مهارکننده مسیر PI3K/Akt نیز نشان میدهد که مهار این مسیر انتقال پیام و کاهش میزان فسفریلاسیون Akt نیز میتواند با افزایش بیان ژن p21 و از طریق مسیر وابسته به p53 باعث توقف چرخه سلولی در سلولهای رده ALL گردد(22). بنابراین یکی از تفسیرهایی که میتوان از نتایج به دست آمده انجام داد این است که داروی GS-1101 اثرات آنتیپرولیفراتیو خود را از طریق مهار چرخه سلولی در مرحله G1 و آن هم با واسطه افزایش بیان ژن p21 اعمال مینماید. در همین راستا، در مطالعه صورت گرفته بر روی رده سلولی K562 ، چن و همکارانش نیز اعلام نمودند که داروی GS-1101 میتواند با مهار فسفریلاسیون Akt و هم چنین با افزایش بیان ژنهای کنترل کننده چرخه سلولی هم چون سیکلینها، توقف چرخه سلولی را در پی داشته و بدین ترتیب اثرات آنتیپرولیفراتیو و سایتوتوکسیک خود را اعمال نماید (23).
اختلال در مسیر PI3K در سلولهای سرطانی از طریق برهم زدن تعادل بین ژنهای پرو و آنتیآپوپتوتیک منجر به گریز از مرگ سلولی میشود. مطالعههای بیشماری در این خصوص نشان میدهند که تیمار سلولهای سرطانی با داروهای مهارکننده مسیر PI3K میتواند منجر به القای آپوپتوز در سلولهای سرطانی گردد. در این بررسی نیز متوجه شدیم که تیمار سلولهای لوسمیک Nalm-6 با GS-1101 باعث افزایش جمعیت سلولها در مرحله Sub-G1 چرخه سلولی میگردد؛ که این خود مؤید بروز آپوپتوز در این سلولهای pre-B ALL میباشد. هم چنین بررسیهای بعدی صورت گرفته بر روی ژنهای کنترل کننده آپوپتوز، از جمله Bax به عنوان مهمترین مولکولهای پروآپوپتوتیک نشان داد که داروی GS-1101 به صورت قابل توجهی میتواند بیان ژن Bax را افزایش دهد و بدین ترتیب با افزایش نسبت بین ژنهای پرو به آنتیآپوپتوتیک، باعث فعال شدن مسیرهای آپوپتوزی در رده سلولی Nalm-6 گردد. در همین خصوص سیوالرو و همکارانش نیز با بررسی اثر یکی از مهارکنندگان مسیر PI3K بر روی شاخص آپوپتوز در سلولهای لنفوما، دریافتند که مهار این مسیر با شکسته شدن کاسپاز 3، 8 و 9 و فعال شدن مسیر داخلی و خارجی آپوپتوز همراه میباشد. علاوه بر این در این پژوهش به این نتیجه رسیدند که القای آپوپتوز در سلولهای تحت تیمار با مهارکننده PI3K تا حد زیادی با افزایش بیان فاکتورهای پروآپوپتوتیک(BIM ، BAD و
PUMA) و نیز کاهش بیان فاکتورهای آنتیآپوپتوتیک (MCL-1 ، BCL-XL) صورت میگیرد(24).
نتیجهگیری
در کل، این مطالعه کارآیی داروی GS-1101 را در سلولهای Nalm-6 که از نوع pre-B ALL هستند، نشان میدهد. با توجه به تحملپذیری بالای این مهارکننده و مؤثر بودن آن در بدخیمیهای لنفوپرولیفراتیو مزمن، این مطالعه GS-1101 را بهعنوان عامل نوید بخشی در درمان لوسمی حاد لنفوئیدی مطرح میسازد. این در حالی است که تحقیقات بیشتری مانند کارآزماییهای بالینی و مطالعه دقیقتر مکانیسم عملکرد دارو، سرنخهای با ارزشی در اختیار پزشکان بهجهت انتخاب این مهارکننده اختصاصی p110δ برای درمان بیماران مبتلا به ALL قرار خواهد داد.
متن کامل: (2374 مشاهده)
اثر مهارگر اختصاصی p110d در سلولهای لوسمی لنفوبلاستیک حاد
پریسا صدراعظمی1، آوا صفراوغلی آذر1، داود بشاش2
چکیده
سابقه و هدف
اختلال در مسیر PI3K در لوسمی لنفوبلاستیک حاد(ALL) همراه با نقش مهم آن در ایجاد مقاومت به داروهای شیمی درمانی، باعث شده است که استفاده از مهارگران PI3K در درمان ALL اهمیت به سزایی پیدا کند. بر این اساس، بر آن شدیم تا اثر مهارگر اختصاصی ایزوفرم p110δ (GS-1101) را در سلولهای لوسمی لنفوبلاستیک حاد Nalm-6 بررسی کنیم.
مواد و روشها
در یک مطالعه تجربی، به منظور بررسی اثرات سایتوتوکسیک و آنتیپرولیفراتیو GS-1101، پس از تیمار سلولهای Nalm-6 با غلظتهای مختلف این مهارکننده، فعالیت متابولیک، تعداد و توزیع سلولها در چرخه سلولی توسط آزمونهای MTT، تریپانبلو و فلوسایتومتری بررسی گردید. در نهایت، جهت ارزیابی میزان تغییر در بیان ژنهای کنترل کننده چرخه سلولی، پروآپوپتوتیک و آنتیآپوپتوتیک، آزمایش Rq-PCR انجام شد.
یافتهها
نتایج نشان دادند که GS-1101 نه تنها میتواند تعداد سلولهای Nalm-6 را کاهش دهد(از 105 * 24 عدد سلول در گروه کنترل در زمان 48 ساعت به 103 * 986 عدد در گروه تیمار شده با دوز 50 میکرومولار از مهارکننده)؛ بلکه قادر است فعالیت متابولیک این سلولها را نیز مهار نماید. هم چنین احتمالاً این دارو از طریق افزایش بیان mRNA ژن p21 ، از پیشرفت چرخه سلولی در مرحله G1 جلوگیری مینماید. از سوی دیگر، افزایش بیان ژن پروآپوپتوتیک Bax و تجمع سلولها در مرحله sub-G1 متعاقب تیمار با این دارو، نشانگر القای آپوپتوز در سلولهای Nalm-6 میباشد.
نتیجه گیری
GS-1101 دارای اثرات آپوپتوتیک و آنتیپرولیفراتیو در سلولهای Nalm-6 است و این اثرات به واسطه توقف چرخه سلولی، افزایش بیان ژنهای p21 و پروآپوپتوتیک اعمال میشود.
کلمات کلیدی: لوسمی لنفوبلاستیک حاد، آپوپتوزیس، چرخه سلولی
تاریخ دریافت : 23/8 /95
تاریخ پذیرش : 12/10/95
1- کارشناس ارشد خونشناسی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ گروه هماتولوژی ـ میدان قدس ـ خیابان دربند ـ تهران ـ ایران ـ کدپستی: 1971653312
پریسا صدراعظمی1، آوا صفراوغلی آذر1، داود بشاش2
چکیده
سابقه و هدف
اختلال در مسیر PI3K در لوسمی لنفوبلاستیک حاد(ALL) همراه با نقش مهم آن در ایجاد مقاومت به داروهای شیمی درمانی، باعث شده است که استفاده از مهارگران PI3K در درمان ALL اهمیت به سزایی پیدا کند. بر این اساس، بر آن شدیم تا اثر مهارگر اختصاصی ایزوفرم p110δ (GS-1101) را در سلولهای لوسمی لنفوبلاستیک حاد Nalm-6 بررسی کنیم.
مواد و روشها
در یک مطالعه تجربی، به منظور بررسی اثرات سایتوتوکسیک و آنتیپرولیفراتیو GS-1101، پس از تیمار سلولهای Nalm-6 با غلظتهای مختلف این مهارکننده، فعالیت متابولیک، تعداد و توزیع سلولها در چرخه سلولی توسط آزمونهای MTT، تریپانبلو و فلوسایتومتری بررسی گردید. در نهایت، جهت ارزیابی میزان تغییر در بیان ژنهای کنترل کننده چرخه سلولی، پروآپوپتوتیک و آنتیآپوپتوتیک، آزمایش Rq-PCR انجام شد.
یافتهها
نتایج نشان دادند که GS-1101 نه تنها میتواند تعداد سلولهای Nalm-6 را کاهش دهد(از 105 * 24 عدد سلول در گروه کنترل در زمان 48 ساعت به 103 * 986 عدد در گروه تیمار شده با دوز 50 میکرومولار از مهارکننده)؛ بلکه قادر است فعالیت متابولیک این سلولها را نیز مهار نماید. هم چنین احتمالاً این دارو از طریق افزایش بیان mRNA ژن p21 ، از پیشرفت چرخه سلولی در مرحله G1 جلوگیری مینماید. از سوی دیگر، افزایش بیان ژن پروآپوپتوتیک Bax و تجمع سلولها در مرحله sub-G1 متعاقب تیمار با این دارو، نشانگر القای آپوپتوز در سلولهای Nalm-6 میباشد.
نتیجه گیری
GS-1101 دارای اثرات آپوپتوتیک و آنتیپرولیفراتیو در سلولهای Nalm-6 است و این اثرات به واسطه توقف چرخه سلولی، افزایش بیان ژنهای p21 و پروآپوپتوتیک اعمال میشود.
کلمات کلیدی: لوسمی لنفوبلاستیک حاد، آپوپتوزیس، چرخه سلولی
تاریخ دریافت : 23/8 /95
تاریخ پذیرش : 12/10/95
1- کارشناس ارشد خونشناسی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ گروه هماتولوژی ـ میدان قدس ـ خیابان دربند ـ تهران ـ ایران ـ کدپستی: 1971653312
مقدمه
ALL نوعی بدخیمی هماتولوژیک است و مشخصه اصلی آن تکثیر بی رویه و تجمع لنفوبلاستهای غیر طبیعی در مغز استخوان میباشد(1). برای درمان این بیماری از داروهای شیمی درمانی مختلفی هم چون گلوکوکورتیکوئیدها، وینکا آلکالوئیدها و آنتراسیکلین استفاده میشود. بهعلاوه، پیوند مغز استخوان نیز یکی دیگر از گزینههای درمانی برای بیماران با خطر بالا به حساب میآید(3، 2). با وجود پیشرفتهای قابل توجه در زمینه افزایش میزان بقای بیماران مبتلا به ALL ، مقاومت به داروهای رایج، هم چنان از جمله مهمترین معضلات درمانی این بیماران محسوب میشود.
PI3Ks آنزیمهایی مسئول در کنترل فرآیندهای مهم سلولی از جمله تنظیم چرخه سلولی، آپوپتوز، ترمیمDNA ، پیری، رگزایی و متابولیسم هستند و به عنوان مولکولهای میانجیگر عمل کرده و اغلب به دلیل نقششان در مسیر سیگنالینگ PI3K/AKT/mTOR معروف میباشند(4). PI3Kها به سه خانواده PI3K-1 ، PI3K-2 و PI3K-3 تقسیم میشوند. اخیراً شواهدی از ارتباط خانواده PI3K-1 با سرطان یافته شده است. این خانواده از PI3Kها هترودایمر بوده و به دو زیر خانواده1A و 1B تقسیم میشوند.
PI3K-1A از یک زیر واحد کاتالیتیک(p110) و یک زیر واحد تنظیمی(p85) تشکیل میشود. زیر واحد کاتالیتیک این خانواده از نظر ساختاری دارای 3 ایزوفرم α، β و d میباشد. لازم به ذکر است که ایزوفرمهای α و β به طور گسترده در تمام سلولها بیان میشوند؛ این در حالی است که بیان ایزوفرم δ تنها به سلولهای خونساز محدود میگردد(5). مطالعههای پیشین نشان میدهند که ایزوفرم p110δ در عملکرد و هموستاز لنفوسیتهای B نقش حیاتی دارد. در بررسی انجام شده در سال 2002 ، گزارش شده است که جهش غیرفعال کننده p110δ در موشها نه تنها منجر به کاهش تعداد لنفوسیتهای B1 و مارژینال میشود؛ بلکه میزان تیتر ایمنوگلوبولین را نیز در آنها به پایینتر از حد نرمال میرساند(6). با توجه به نقش گسترده این مسیر پیامرسانی، بدیهی است که هر گونه اختلال در تنظیم آن و یا فعال شدن نابهجای آن، با بروز بسیاری از بیماریها از جمله سرطانهای انسانی همراه باشد. اخیراً پیامرسانی p110δ به عنوان مکانیسم دخیل در بقا و گسترش انواع بدخیمیهای B cell معرفی شده است(7). از آن جایی که فعال شدن مسیر انتقال پیام PI3K از طریق BCR ، باعث افزایش بقای B cell های بدخیم میشود و هم چنین با توجه به این موضوع که p110δ غالباً در پیامرسانی BCR نقش دارد، به نظر میرسد که این ایزوفرم میتواند به عنوان هدفی مناسب در درمان بدخیمیهای B cell در نظر گرفته شود(8). GS-1101 مهارکننده اختصاصی p110δ است و تاکنون نتایج تحقیقات حاکی از اثر بخشی این دارو در بدخیمیهای B cell مانند: CLL ، MM و nHL بوده است(10، 9، 4). با توجه به نقش مسیر PI3K در بروز بدخیمیهای B cell ، در این مطالعه بر آن شدیم تا اثر مهار ایزوفرم p110δ را در سلولهای Nalm-6 بررسی نماییم.
مواد و روشها
کشت سلولی و تیمار دارویی:
مطالعه انجام شده از نوع تجربی بود. سلولهای Nalm-6 که از رده لوسمی لنفوبلاستیک حاد میباشند، در محیط کشت RPMI-1640 حاوی 10% سرم گاوی، U/mL100 پنیسیلین و µg/mL 100 استرپتومایسین در دمای 37 درجه سانتیگراد و فشار دیاکسید کربن 5% کشت داده شدند. داروی مورد استفاده GS-1101 بود که از شرکت Selleckchem آمریکا تهیه شده است. داروی فوق به شکل پودر بوده که به منظور تهیه محلول ذخیره 500 میکرومولار، آن را در DMSO استریل حل کرده و تا زمان استفاده در دمای20- درجه سانتیگراد نگهداری گردید. جهت جلوگیری از اثرات حلال بر روی میزان تکثیر و بقا، سلولها با غلظت مشخص شدهای از DMSO به عنوان کنترل منفی تیمار شدند. سلولهای Nalm-6 با غلظتهای 5 تا 50 میکرومولار به مدت 24، 36 و 48 ساعت تیمار شدند. تمامی آزمایشها به منظور افزایش دقت کار به صورت تریپلیکیت انجام شد.
بررسی شمارش سلولی به روش تریپان بلو:
بـرای شمارش سلولهـا از رنگآمیزی تریپانبـلو و لام
هموسایتومتر(لام نئوبار) استفاده شد. اساس این آزمایش بدین ترتیب است که سلولهای زنده نسبت به ورود رنگ نفوذناپذیر میباشند، حال آن که سلولهای مرده رنگ را جذب مینمایند. برای شمارش تعداد سلولهای زنده، تعداد سلولهای رنگ نگرفته در هر چهار سری خانههای شانزدهتایی(خانه شمارش WBC) شمارش شده و میانگین گرفته شد.
اندازهگیری فعالیت متابولیک سلولی به روشMTT :
برای ارزیابی تاثیر داروی GS-1101 بر فعالیت متابولیک سلولهای Nalm-6 ، تعداد 5000 سلول به هر چاهک پلیت 96 خانهای و فاقد داروی اضافه و به مدت زمان 24، 36 و 48 ساعت در انکوباتور CO2 دار انکوبه شد. پس از گذشت مدت زمان مورد نظر به سلولهای داخل پلیت محلول mg/mL 5 MTT اضافه گردید و به مدت 3ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت.
سپس پلیت با دور g 1000 به مدت 10 دقیقه سانتریفیوژ شده و پس از خالی کردن محلول رویی، 100 میکرولیتر DMSO به هر چاهک اضافه شد. جذب نوری هر چاهک توسط دستگاه الایزا ریدر در طول موج 570 نانومتر قرائت شد.
بررسی فعالیت چرخه سلولی:
ابتدا 105 × 5 سلول Nalm-6 با غلظتهای 20، 30 و 50 میکرومولار GS-1101 به مدت 36 ساعت تیمار شدند. پس از پایان انکوباسیون، سلولها به فالکون انتقال یافته و با دور g1000 سانتریفیوژ و در محلول PBS سوسپانسه شدند. سپس سلولها به وسیله اتانول 70% تثبیت شده و در ادامه 1 میلیلیتر محلول PI Master mix به آنها اضافه شد. سپس سوسپانسیون سلولی 30 دقیقه در دمای 37 درجه سانتیگراد انکوبه شد. در آخر الگوی رنگپذیری DNA با استفاده از دستگاه فلوسایتومتر مورد بررسی قرار گرفته و دادهها توسط نرمافزار فلومکس 3/2 تحلیل شدند.
استخراج RNA :
پس از تیمار سلولهای Nalm-6 با داروی GS-1101 به
مدت 36 ساعت، RNA آنها طبق دستورالعمل کیت high pure RNA isolation kit (رُوش) استخراج شده و به منظور تولید cDNA مورد استفاده قرار گرفت.
برای ساخت cDNA از کیتRevertAid First Strand cDNA Synthesis kit (رُوش) استفاده شد. حجم مورد نظر برای انجام این واکنش 20 میکرولیتر است و محتویات آن شامل 4 میکرولیتر x5 PCR ، 2 میکرولیتر dNTP ، 1 میکرولیتر رندوم هگزامر، 1میکرولیتر آب تیمار شده با دیاتیل پیروکربنات، 1 میکرولیتر مهارکننده RNase (U/µL 20)، 1 میکرولیتر ترانس کریپتاز معکوس M-MuLV (U/µL 200) و 1 میکروگرم از RNA مورد آزمایش میباشد.
محلول فوق به مدت 5 دقیقه در 65 درجه سانتیگراد، 5 دقیقه در 25 درجه سانتیگراد و یک ساعت در دمای 42 درجه سانتیگراد انکوبه شدند و در نهایت، واکنش ساخت cDNA با 5 دقیقه انکوباسیون در 70 درجه سانتیگراد خاتمه یافت. آزمایش Real-Time PCR در دستگاه(رُوش) light-cycler و در حجم 20 میکرولیتر انجام شد. به ازای هر واکنش 10 میکرولیتر از Syber premix Ex Taq (تاکارا)، 2 میکرولیتر از cDNA ، 5/0 میکرولیتر از هر یک از آغازگرهـا و 7 میکرولیتر آب عـاری از نوکلئاز استفـاده شد.
شرایط دمایی مورد استفاده شامل یک مرحله فعالسازی اولیه در دمای 95 درجه سانتیگراد به مدت 30 ثانیه و در ادامه، 40 چرخه برای دناتوراسیون(5 ثانیه در 95 درجه سانتیگراد) و آنیلینگ/اکستنشن توام(20 ثانیه در 60 درجه سانتیگراد) میباشد. برای بررسی اختصاصیت محصول تکثیر شده، منحنی ذوب مورد بررسی قرار گرفت. در انتها و برای محاسبه نسبی تعداد نسخه mRNA تکثیر شده از فرمول 2 -ΔΔctاستفاده شد(جدول 1).
آنالیز آماری:
تمامی آزمایشها به شکل سه آزمون مستقل انجام و مقادیر گزارش شده به شکل Mean ± SD قید شدند. هم چنیــن بــرای محـاسبـــات آمـــاری از روش t - test و نرمافزارSPSS17 و GraphPad Prism7 استفاده شد.
جدول 1: توالی آغازگرهای به کار رفته در آزمون Real Time Quantitative RT-PCR
| ژن | آغازگر جلوبرنده (5'-3') | آغازگر معکوس(5'-3') | سایز محصول (bp) |
| HPRT | TGGACAGGACTGAACGTCTTG | CCAGCAGGTCAGCAAAGAATTTA | 111 |
| p21 | CCTGTCACTGTCTTGTACCCT | GCGTTTGGAGTGGTAGAAATCT | 130 |
| Bax | CGAGAGGTCTTTTTCCGAGTG | GTGGGCGTCCCAAAGTAGG | 242 |
| Bcl-2 | CGGTGGGGTCATGTGTGTG | CGGTTCAGGTACTCAGTCATCC | 90 |
علامت * بیانگر این است که اختلاف میانگین گروه آزمون با کنترل در سطح 05/0 p ≤ ، معنادار بوده است.
علامت ** بیانگر این است که اختلاف میانگین گروه آزمون با کنترل در سطح 01/0 p≤ ، معنادار بوده است.
علامت *** بیانگر این است که اختلاف میانگین گروه آزمون با کنترل در سطح 001/0 p≤ ، معنادار بوده است.
یافتهها
GS-1101 به صورت وابسته به دوز و زمان باعث کاهش شمارش سلولهای Nalm-6 میشود:
به منظور بررسی اثر آنتیپرولیفراتیو داروی GS-1101 ، سلولهای Nalm-6 به دوزهای مختلف مهارکننده(50-5 میکرومولار) به مدت 24، 36 و 48 ساعت تیمار شدند و سپس شمارش سلولهای زنده(Cell count) با استفاده از آزمایش تریپانبلو مورد ارزیابی قرار گرفت. گروهی از سلولها نیز به عنوان شاهد هیچ دارویی دریافت نکردند. نتایج به دست آمده نشان داد که GS-1101 میتواند باعث کاهش تعداد سلولهای Nalm-6 هم به صورت وابسته به دوز و هم به صورت وابسته به زمان شود. اگر چه داروی GS-1101 در دوز 5 میکرومولار تاثیر چندانی بر روی شمارش سلولها ندارد؛ اما افزایش دوز این دارو به بالای 10 میکرومولار قادر است به صورت کاملاً معناداری شمارش سلولهای زنده را کاهش دهد(نمودار 1).
GS-1101 هم به طور وابسته به دوز و هم به طور وابسته به زمان سبب مهار فعالیت متابولیکی سلولهای Nalm-6 میشود:
سلولهـای Nalm-6 بـا دوزهـای 5 تـا 50 میکرومـولار
مهارکننده P110d به مدت 24، 36 و 48 ساعت تیمار شدند
و میزان فعالیت متابولیک آنها توسط آزمایش MTT assay بررسی شد. نتایج به دست آمده نشاندهنده کاهش فعالیت متابولیک سلولهای Nalm-6 تیمار شده در مقایسه با سلولهای کنترل به طور وابسته به دوز و زمان میباشد. غلظت µM 5 دارو اثر چشمگیری در کاهش فعالیت متابولیکی سلولهای Nalm-6 ندارد، این در حالی است که دوز µM 30 از دارو طی مدت زمان 24، 36 و 48 ساعت به ترتیب این شاخص را به 75% ، 64% و 51% میرساند (نمودار 2).
.jpg)
نمودار 1: تاثیر داروی GS-1101 بر شمارش سلولی در سلولهایNalm-6 به صورت وابسته به دوز و زمان. سلولهای Nalm-6 به تعداد 000/390 و با غلظتهای 5 تا 50 میکرومولار از دارو تیمار و پس از گذشت 24، 36 و 48 ساعت، شمارش سلولی با روش تریپانبلو انجام شد. همان گونه که در شکل مشاهده میشود، GS-1101 به صورت وابسته به دوز و زمان شمارش سلولی را کاهش داده و دوز 50 میکرومولار دارای بیشترین اثرات آنتیپرولیفراتیو میباشد.
هم چنین با افزایش غلظت دارو به µM 50 شاهد کاهش معنادار فعالیت متابولیک به ترتیب 69% ، 56% و 39% در زمانهای ذکر شده میباشیم. با توجه به نتایج به دست آمده میتوان نتیجه گرفت که داروی GS-1101 هم به طور وابسته به دوز و هم به طور وابسته به زمان سبب مهار فعالیت متابولیکی سلولهای Nalm-6 میشود.
.jpg)
نمودار 2: بررسی اثر GS-1101 بر فعالیت متابولیک سلولهای Nalm-6 به طور وابسته به دوز و زمان. سلولهای Nalm-6 در تعداد 5000 سلول در پلیت 96 خانهای تحت تأثیر مقادیر مختلف GS-1101 قرار گرفته و به مدت 24، 36 و 48 ساعت انکوبه شدند. میانگین و انحراف معیار نتایج حاصل از سه بار تکرار(mean ± SD) محاسبه و p value به دستآمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با نمونه کنترل میباشد(* ، بیانگر 05/0 p< و ** ، بیانگر 01/0 p< و *** ، بیانگر 001/0 p< است).
GS-1101 موجب توقف چرخه سلولی در مرحله G1 و افزایش درصد سلولهای Nalm-6 در مرحلهsub-G1 میشود:
برای بررسی اثر مهاری GS-1101 بر چرخه سلولی، سلولهای Nalm-6 با دوزهای 20 ، 30 و 50 میکرومولار دارو به مدت 36 ساعت تیمار شدند و با فلوسایتومتری مورد آنالیز قرار گرفتند. نتایج به دست آمده حاکی از آن است که افزایش دوز GS-1101 منجر به افزایش درصد سلولها در فاز G1 میشود. بدین ترتیب که درصد سلولها در فاز G1 در گروه کنترل30% و در دوزهای 10، 20 و 30 به ترتیب 38%،40% و 59% میباشد(نمودار A3). هم چنین 36 ساعت پس از تیمار سلولهای Nalm-6 با دارو، میزان جمعیت سلولهای فاز Sub-G1اندازهگیری شد(نمودار B3). نتایج نشان داد افزایش دوز GS-1101 باعث افزایش جمعیت سلولها در مرحله Sub-G1 میشود که خود مؤیدی بر بروز مرگ سلولی(آپوپتوز) میباشد. به طوری که تیمار سلولها با دوز µM 50 دارو میزان جمعیت سلولها را در فاز Sub-G1 به میزان 8/5 برابر افزایش میدهد.
.jpg)
نمودار3 : بررسی اثر GS-1101 بر توزیع سلولها در چرخه سلولی. A) پس از تیمار سلولهای Nalm-6 با دوزهای مختلف GS-1101 به مدت 36 ساعت، میزان جمعیت سلولهای تیمار شده در مرحله G1 از چرخه سلولی به صورت معناداری افزایش یافت که خود مؤید توقف چرخه سلولی در این مرحله میباشد. B) تیمار سلولهای Nalm-6 با مهارکننده PI3K منجر به افزایش جمعیت سلولها در مرحله sub-G1 به صورت وابسته به دوز گردید. میانگین و انحراف معیار نتایج حاصل از سه بار تکرار(mean ± SD) محاسبه و p value به دستآمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با نمونه کنترل میباشد(*، بیانگر 05/0 p< و ** ، بیانگر 01/0 p< است).
تیمار سلولهای Nalm-6 با GS-1101 منجر به افزایش بیان ژن p21 میشود:
پس از آن که مشخص شد که داروی GS-1101 باعث توقف چرخه سلولی در مرحله G1 میشود؛ بر آن شدیم تا تاثیر مولکولی این دارو بر روی یکی از مهمترین ژنهای تنظیمکننده چرخه سلولی را مورد ارزیابی قرار دهیم.
مطالعههای پیشین نشان دادهاند که ژن p21 در تنظیم چرخه سلولی و پیش رفت آن از مرحله G1 به S نقش به سزایی را ایفا مینماید. p21 یک پروتئین مهارکننده سیکلین است که با اتصال به سیکلینهای CDK2 ، CDK1 و مجموعه CDK4/6 آنها را مهار کرده و به عنوان تنظیم کننده پیشروی سیکل سلولی در فازهای G1 و S عمل میکند. توقف سیکل سلولی به وسیله p21 تمایز را افزایش داده و از تکثیر جلوگیری مینماید(11). بر همین اساس در این بررسی پس از تیمار سلولهای Nalm-6 با دوز مؤثره دارو (50 میکرومولار)، میزان تغییر بیان mRNA ژن p21 با کمک روش Rq-PCR سنجیده شد(نمودار 4). همان طور که در نمودار 4 نمایش داده شده است، این دارو میتواند پس از گذشت 36 ساعت به صورت کاملاً معناداری میزان بیان ژن p21 را افزایش دهد.
.jpg)
نمودار 4: GS-1101 سبب افزایش فعالیت رونویسی ژن p21 میشود. پس از تیمار 36 ساعته سلولهای Nalm-6 با دوز 50 میکرومولار از داروی GS-1101، میزان بیان mRNA ژن p21 به صورت معناداری افزایش یافت. میانگین و انحراف معیار نتایج حاصل از سه بار تکرار(mean ± SD) محاسبه و p value به دست آمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با نمونه کنترل میباشد (*بیانگر 05/0 p< است).
GS-1101 باعث افزایش بیان ژن Bax در سلولهای Nalm-6 میشود:
پروتئین Bax به عنوان یک پروتئین کلیدی در آپوپتوز،
با اتصال به پروتئینهای مهارکننده آپوپتوز و آنتاگونیزه کردن اثر مهاری آنها، روند آپوپتوز را فعال میکند. از طرفی پروتئین Bcl-2 که یک مهار کننده آپوپتوز است، با جلوگیری از آزاد شدن سیتوکروم c از میتوکندری اثر مهاری خود را اعمال میکند(12). برای بررسی تاثیر GS-1101 بر بیان ژنهای Bax و Bcl-2 ، میزان بیان mRNA این دو ژن توسط روش Real-Time PCR مورد ارزیابی قرار گرفت. نتایج حاصل نشان میدهند که دوز 50 میکرومولار GS-1101 منجر به افزایش 13 برابری بیان ژن Bax شده است. لازم به ذکر است که این دارو تاثیر معنا داری بر روی فعالیت رونویسی ژن Bcl-2 ندارد(نمودار 5).

نمودار 5 : تاثیر GS-1101 در القای مرگ سلولی در سلولهای Nalm-6. سلولهای Nalm-6 با غلظت 50 میکرومولار از دارو به مدت 36 ساعت تیمار و پس از ساخت cDNA میزان بیان ژنها با استفاده از روش Quantitative RT-PCR محاسبه شد. GS-1101 باعث افزایش بیان ژن پروآپوپتوتیک Bax میشود. این در حالی است که داروی GS-1101 تاثیر معناداری بر روی میزان بیان mRNA ژن آنتیآپوپتوتیک Bcl-2 نمیگذارد. میانگین و انحراف از معیار نتایج حاصل از سه بار تکرار(Mean ± SD) محاسبه و p. value به دست آمده نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل میباشد(**، بیانگر 01/0 p< است).
بحث
نتایـج حاصـل از ایـن تحقیـق نشـان داد کـه استفاده از
مهارکننده مسیرهای مهم پیامرسانی دخیل در پاتوژنز سرطان، هم چون GS-1101 که مهارکننده p110dPI3K میباشد، میتواند به عنوان راهکار نوین در درمان لوسمیهای حاد مورد توجه قرار گیرد. اگـر چـه پیشرفتهای اخیر در دستورالعملهای شیمی درمانی و پیوند سلولهای بنیادی، میزان بقای مبتلایان بهALL را افزایش داده است؛ با این وجود تعدادی از بیماران به علت عود بیماری و یا مقاومت به درمان پیشآگهی بسیار ضعیفی دارند. بنابراین تلاشهای تحقیقاتی بر یافتن رویکردهای درمانی جدید که مسیرهای پیامرسانی مسئول بقای سلولهای سرطانی و مقاومت آنها به داروها را هدف قرار میدهند، متمرکز شده است(7). یکی از این مسیرهای پیامرسانی، مسیر انتقال پیامPI3K/Akt/mTOR میباشد که در نتیجه تغییرات ژنتیکی در طیف وسیعی از سرطانها دچار اختلال میشود(13). ایزوفرم p110δبه عنوان یکی از مهمترین ایزوفرمهای PI3K در بروز بدخیمیهای B cell شناخته میشود(14). GS-1101 یک مهارکننده انتخابی زیر واحد p110δ میباشد که اثر خود را با مهار رقابتی محل اتصال ATP در این ایزوفرم اعمال میکند(15). در مطالعههای آزمایشگاهی انجام شده بر روی سلولهای CLL ،GS-1101 عملکردهای مسیر PI3Kδ را مهار کرده و منجر به کاهش زندهمانی سلولها و القای آپوپتوز در آنها میشود(17، 16). در این مطالعه به بررسی اثر مهارکننده p110δ (GS-1101) بر روی سلولهای Nalm-6 که از نوع Pre B-ALL هستند، پرداخته شده است.
نتایج به دست آمده در این بررسی نشان دادند که GS-1101 باعث کاهش شمارش سلولی و فعالیت متابولیک سلولهای Nalm-6 به صورت وابسته به دوز و زمان میشود. این بررسیها نشان میدهد که GS-1101 در دوز 50 میکرومولار میتواند بیش از نیمی از سلولهای Nalm-6 (IC50) را در طی 48 ساعت نابود نماید و این تأییدی دال بر اثرات سایتوتوکسیک و آنتیپرولیفراتیو این دارو در سلولهای مشتق شده از pre-B ALL میباشد. مشابه با یافتههای این پژوهش، نگوئن و همکارانش نیز در سال 2014 گزارش نمودهاند که متعاقب تیمار سلولهای میلوئیدی با این مهارکننده PI3K ، نه تنها میزان تکثیر سلولها کاهش مییابد؛ بلکه میزان فعالیت متابولیک آنها نیز به صورت معناداری مهار میشود(18). هم چنین نتایج بعدی این مطالعه مشخص نمودند که اثر آنتیپرولیفراتیو این دارو در سلول Nalm-6 تا حدودی از طریق مهار چرخه سلولی در مرحله G1، کاهش درصد سلولهای مرحله S و افزایش بیان mRNA ژن p21 صورت میگیرد. p21 ، پروتئین مهارکننده سیکلین، از جمله مهمترین مولکولهای درگیر در مهار چرخه سلولی در مرحله G1 و S میباشد که توسط بسیاری از مسیرهای انتقال پیام همچون مسیرهای وابسته به p53 فعال میشود و با تجمع سلولها در مرحله G1 چرخه سلولی، باعث القای مرگ سلولی میشوند(21-19). مطالعه اخیر صورت گرفته بر روی یکی دیگر از داروهای مهارکننده مسیر PI3K/Akt نیز نشان میدهد که مهار این مسیر انتقال پیام و کاهش میزان فسفریلاسیون Akt نیز میتواند با افزایش بیان ژن p21 و از طریق مسیر وابسته به p53 باعث توقف چرخه سلولی در سلولهای رده ALL گردد(22). بنابراین یکی از تفسیرهایی که میتوان از نتایج به دست آمده انجام داد این است که داروی GS-1101 اثرات آنتیپرولیفراتیو خود را از طریق مهار چرخه سلولی در مرحله G1 و آن هم با واسطه افزایش بیان ژن p21 اعمال مینماید. در همین راستا، در مطالعه صورت گرفته بر روی رده سلولی K562 ، چن و همکارانش نیز اعلام نمودند که داروی GS-1101 میتواند با مهار فسفریلاسیون Akt و هم چنین با افزایش بیان ژنهای کنترل کننده چرخه سلولی هم چون سیکلینها، توقف چرخه سلولی را در پی داشته و بدین ترتیب اثرات آنتیپرولیفراتیو و سایتوتوکسیک خود را اعمال نماید (23).
اختلال در مسیر PI3K در سلولهای سرطانی از طریق برهم زدن تعادل بین ژنهای پرو و آنتیآپوپتوتیک منجر به گریز از مرگ سلولی میشود. مطالعههای بیشماری در این خصوص نشان میدهند که تیمار سلولهای سرطانی با داروهای مهارکننده مسیر PI3K میتواند منجر به القای آپوپتوز در سلولهای سرطانی گردد. در این بررسی نیز متوجه شدیم که تیمار سلولهای لوسمیک Nalm-6 با GS-1101 باعث افزایش جمعیت سلولها در مرحله Sub-G1 چرخه سلولی میگردد؛ که این خود مؤید بروز آپوپتوز در این سلولهای pre-B ALL میباشد. هم چنین بررسیهای بعدی صورت گرفته بر روی ژنهای کنترل کننده آپوپتوز، از جمله Bax به عنوان مهمترین مولکولهای پروآپوپتوتیک نشان داد که داروی GS-1101 به صورت قابل توجهی میتواند بیان ژن Bax را افزایش دهد و بدین ترتیب با افزایش نسبت بین ژنهای پرو به آنتیآپوپتوتیک، باعث فعال شدن مسیرهای آپوپتوزی در رده سلولی Nalm-6 گردد. در همین خصوص سیوالرو و همکارانش نیز با بررسی اثر یکی از مهارکنندگان مسیر PI3K بر روی شاخص آپوپتوز در سلولهای لنفوما، دریافتند که مهار این مسیر با شکسته شدن کاسپاز 3، 8 و 9 و فعال شدن مسیر داخلی و خارجی آپوپتوز همراه میباشد. علاوه بر این در این پژوهش به این نتیجه رسیدند که القای آپوپتوز در سلولهای تحت تیمار با مهارکننده PI3K تا حد زیادی با افزایش بیان فاکتورهای پروآپوپتوتیک(BIM ، BAD و
PUMA) و نیز کاهش بیان فاکتورهای آنتیآپوپتوتیک (MCL-1 ، BCL-XL) صورت میگیرد(24).
نتیجهگیری
در کل، این مطالعه کارآیی داروی GS-1101 را در سلولهای Nalm-6 که از نوع pre-B ALL هستند، نشان میدهد. با توجه به تحملپذیری بالای این مهارکننده و مؤثر بودن آن در بدخیمیهای لنفوپرولیفراتیو مزمن، این مطالعه GS-1101 را بهعنوان عامل نوید بخشی در درمان لوسمی حاد لنفوئیدی مطرح میسازد. این در حالی است که تحقیقات بیشتری مانند کارآزماییهای بالینی و مطالعه دقیقتر مکانیسم عملکرد دارو، سرنخهای با ارزشی در اختیار پزشکان بهجهت انتخاب این مهارکننده اختصاصی p110δ برای درمان بیماران مبتلا به ALL قرار خواهد داد.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





