جلد 14، شماره 2 - ( تابستان 1396 )
جلد 14 شماره 2 صفحات 134-126 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Dadashi M, Bashash D. Cytotoxic effect of PI3Kδ inhibitor in acute promyelocytic leukemia cells. bloodj 2017; 14 (2) :126-134
URL: http://bloodjournal.ir/article-1-1082-fa.html
URL: http://bloodjournal.ir/article-1-1082-fa.html
داداشی مریم، بشاش داود. تاثیر سایتوتوکسیک مهارکننده PI3K در رده سلولی لوسمی پرومیلوسیتیک حاد. فصلنامه پژوهشی خون. 1396; 14 (2) :126-134
دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی
متن کامل [PDF 2124 kb]
(1656 دریافت)
| چکیده (HTML) (5465 مشاهده)
مقدمه
لوسمی پرومیلوسیتیک حاد(APL) ، زیر گروهی از AML است که دارای مورفولوژی سیتولوژیک مشخص M3 یا M3V بر اساس طبقهبندی FAB میباشد(1). این لوسمی، 10%-5% از موارد لوسمی میلوئیدی حاد را شامل میشود و در مجموع میتوان گفت بیشترین شیوع این بیماری در جوانان میباشد(2، 1). 97% از موارد APL به علت یک جابهجایی بین دو کروموزوم 15 و 17 اتفاق میافتد که منجر به ایجاد ژن ترکیبی PML/RARα و بیان پروتئین کایمریکPML/RARα میشود(3). هر چند از سال 1988 نقش ATRA به طور گستردهای در درمان بیماران APL مشخص شده است، اما درمان با ATRA دارای محدودیتهایی از قبیل سندرم رتینوئیک اسید و ایجاد مقاومت در بیماران درمان شده با آن طی 3 ماه تا 1 سال پس از شروع درمان میباشد(5، 4). لازم به ذکر است که یکی از استراتژیهای درمانی در بیماران مقاوم به ATRA ، استفاده از آرسنیکتریاکساید(AS2O3) میباشد؛ اما علیرغم اثربخشی و نتایج قابل قبول، این دارو نیز دارای اثرات سمی و عوارض جانبی زیادی است(6). طی مطالعههای گذشته مشخص شده است که مسیر PI3K/Akt یکی از مهمترین دلایل مقاومت به آرسنیک تری اکساید و دیگر عوامل درمانی مؤثر در APL است (7). مسیر PI3K/Akt/mTOR به طور مداوم در سلولهای لوسمیک AML فعال بوده و باعث بقا و تکثیر نامحدود و مقاومت این سلولها به آپوپتوز میشود(8، 7). بر اساس مطالعههای گوناگون، ایزوفرم p110δ مهمترین ایزوفرم PI3K در سلولهای لوسمیک بیماران AML میباشد که سطح بیان آن به طور چشمگیری افزایش یافته است(8، 7).
در میان مهارکنندگان انتخابی PI3K، امروزه توجه گستردهای به دارویی تحت عنوان Idelalisib معطوف شده است. این دارو که به عنوان یک مهارگر اختصاصی ایزوفرم (Isoform-specific inhibitor) عمل میکند، در واقع مهارکننده ایزوفرم p110δ میباشد. Idelalisib با مهار مسیر پیامرسانی PI3K منجر به کاهش فسفریلاسیون Akt و افکتورهای پایین دست آن شده و باعث افزایش پلی ADP- ریبوز پلیمراز، شکستن کاسپاز و القای آپوپتوز میشود(9). همچنین مشخص شده است که درمان با Idelalisib باعث توقف چرخه سلولی و آپوپتوز در سل لاینهای لنفوم هوچکین میشود(10). اثرات سایتوتوکسیک این دارو در سللاینهای میلومایی INA-6 و LB نیز گزارش شده است(11).
با توجه به نتایج اثربخش تیمار سللاینهای سرطانی با Idelalisib و از طرفی با در نظر گرفتن عدم موفقیت کامل راهکارهای درمانی معمول در APL ، برآن شدیم تا در این تحقیق اثربخشی Idelalisib بر روی سلولهای رده NB4 مشتق شده از APL را مورد بررسی قرار دهیم.
مواد و روشها
کشت سلولی و تیمار دارویی با Idelalisib :
در این مطالعه تجربی، سلولهای NB4(مشتق از لوسمی پرومیلوسیتی حاد) در محیط کشت RPMI 1640 همراه با 10% FBS ، U/mL100 پنیسیلین و µg/mL 100 استرپتومایسین کشت داده شد و در انکوباتور با دمای 37 درجه سانتیگراد و فشار دیاکسیدکربن 5% نگهداری شدند. به علاوه، جهت اطمینان از صحت سلولهای NB4 ، mRNA ژن ترکیبی PML/RARα با استفاده از روش RT-PCR برای این سللاین مورد بررسی قرار گرفت. پودر 10 میلیگرم Idelalisib به صورت لیوفیلیزه از شرکت سلکچم (آمریکا) خریداری شد. به منظور تهیه استوک 500 میکرومولار، مقادیر مورد نظر از پودر دارو در DMSO حل شد و تا زمان استفاده در دمای 20- درجه سانتیگراد نگهداری گردید. تیمار سلولهای NB4 با غلظتهای مختلف Idelalisib و در زمانهای 24 ،36 و 48 ساعت صورت گرفت. جهت جلوگیری از اثرات حلال بر روی میزان پرولیفراسیون و بقای سللاین، سلولها با غلظت مشخص شدهای از DMSO به عنوان کنترل منفی تیمار شدند. تمامی آزمایشها به منظور افزایش دقت کار به صورت تریپلیکیت انجام شد.
ارزیابی زندهمانی و شمارش سلولی به روش تریپان بلو:
برای شمارش سلولها از رنگآمیزی تریپانبلو و لام هموسایتومتر(لام نئوبار) استفاده شد. اساس این آزمایش بدین ترتیب است که سلولهای زنده نسبت به ورود رنگ نفوذناپذیر میباشند، حال آن که سلولهای مرده رنگ را جذب میکنند. برای شمارش تعداد سلولهای زنده، تعداد سلولهای رنگ نگرفته در هر چهار سری خانههای شانزدهتایی(خانه شمارش WBC) شمارش شده و میانگین گرفته شد. همچنین زندهمانی سلولها نیز با استفاده از فرمول زیر محاسبه شد.
تعداد سلولهای زنده
100 * = درصد زندهمانی سلولها
کل سلولها
ارزیابی فعالیت متابولیک سلولها به روش MTT :
برای ارزیابی تاثیر دارو بر فعالیت متابولیک سلولها، از آزمون MTT ((Microculture Tetrazolium Test استفاده شد. پس از تیمار سلولها با غلظتهای مختلف دارو، تعداد 103×5 سلول به هر چاهک از پلیت 96 خانهای ریخته شد. پلیتها به مدت 24، 36 و 48 ساعت در انکوباتور CO2 دار انکوبه شدند. پس از پایان زمان انکوباسیون، سلولها با µL 100 معرف تترازولیوم mg/mL) 5 (مجاور و به مدت چهار ساعت در انکوباتور انکوبه شدند. پس از طی زمان مذکور، پلیت را به مدت 10 دقیقه با دور 3000 دور در دقیقه سانتریفوژ کرده و محلول رویی را خارج کردیم. مقدار µL 100 از DMSO به چاهکها اضافه و در نهایت جذب نوری هر چاهک توسط دستگاه الایزا ریدر در طول موج nm 570 قرائت شد.
بررسی القای آپوپتوز با استفاده از فلوسیتومتری:
به منظور بررسی اثر پروآپوپتوتیک دارو بر روی سلولها از کیت Annexin/PI (رُوش) استفاده شد. در این روش، ابتدا سلولهای تیمار شده با دارو جمعآوری شد، با دور g 600 در دمای اتاق به مدت 5 دقیقه سانتریفوژ و سپس 1 بار با PBS شستشو داده شد. به هر لوله µL 100 از Binding Buffer که به آن µL 1 از رنگ Annexin با غلظت استوک mg/mL 5/0 و µL 1 از PI با غلظت استوک mg/mL 1/0 اضافه شده بود، افزوده و لولهها به آرامی ورتکس شدند. لولهها به مدت 15-10 دقیقه در تاریکی و در دمـای اتــاق انکــوبـه و سپــس بــلافاصلـه تـوسـط
فلوسایتومتری آنالیز شدند.
استخراج RNA ، ساخت cDNA و انجام آزمون Real-Time PCR :
برای استخراج RNA ، از کیتTriPure (رُوش) طبق دستورالعمل استفاده شد. پس از تیمار سلولهای NB4 با Idelalisib و متعاقب گذشت 48 ساعت، RNA سلولها استخراج و کمیت آنها با روش اسپکتروفتومتری با استفاده از دستگاه نانودراپ ND-1000 اندازهگیری شد. برای انجام واکنش رونویسی معکوس از Revert Aid First Strand (تاکارابیو) cDNA Synthesis Kit استفاده شد. آزمون Real-Time PCR در دستگاه light cycler (رُوش) و در حجم 20 میکرولیتر انجام شد. به ازاء هر واکنش،μL 10 از SYBR Premix Ex Taq، μL 2 از محصول cDNA، μL 5/0 از هر یک از آغازگرها pmol)10) و μL 7 آب عاری از نوکلئاز استفاده شد(جدول 1). شرایط دمایی مورد استفاده شامل یک مرحله فعالسازی اولیه در دمای 95 درجه سانتیگراد به مدت 30 ثانیه و در ادامه، 45 چرخه برای دناتوراسیون (5 ثانیه در 95 درجه سانتیگراد) و مرحله آنیلینگ/اکستنشن توام (20 ثانیه در 60 درجه سانتیگراد( میباشد. برای بررسی اختصاصیت محصول تکثیر شده، منحنی ذوب مورد بررسی قرار گرفت. در انتها برای محاسبه نسبی تعداد نسخه mRNA تکثیر شده از فرمول زیر استفاده شد. DDct-2 = میزان بیان ژن
آنالیز آماری:
تمامی آزمایشها به شکل سه آزمون مستقل انجام و مقادیر گزارش شده به شکل Mean ± SD قید شدند. هم چنین برای محاسبات آماری از روش t-test و نرمافزار 18SPSS و GraphPad Prism7 استفاده شد.
*: بیانگر این است که اختلاف میانگین گروههای آزمون با کنترل در سطح 05/0 p< معنادار بوده است.
**: بیانگر این است که اختلاف میانگین گروههای آزمون با کنترل در سطح 01/0 p< معنادار بوده است.
***: بیانگر این است که اختلاف میانگیـن گروههـای آزمـون بـا کنتـرل در سطح 001/0 p< معنادار بوده است.
جدول 1: توالی آغازگرهای به کار رفته در آزمون Real Time Quantitative RT-PCR
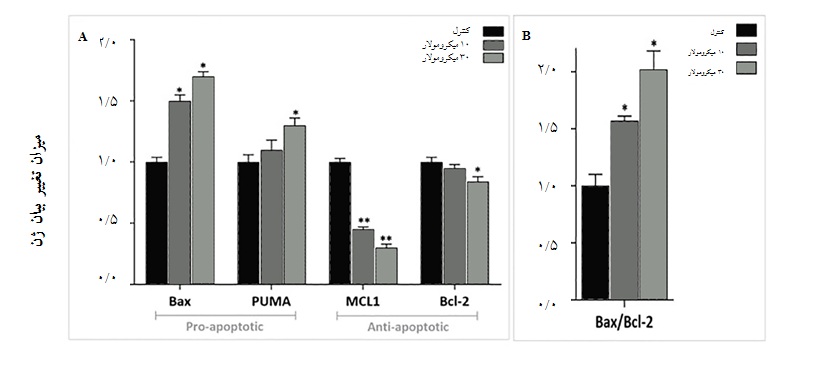
نمودار 5 : تاثیر Idelalisib بر سطح mRNA ژنهای پروآپوپتوتیک و آنتیآپوپتوتیک در سلولهای NB4. سلولهای NB4 در تعداد 106×2 با غلظتهای 10 و 30 میکرومولار ازIdelalisib به مدت 48 ساعت تیمار و پس از ساخت cDNA میزان بیان ژنها با استفاده از روش Quantitative RT-PCR محاسبه شد. A) Idelalisib باعث افزایش بیان ژنهای پروآپوپتوتیک و کاهش در بیان Mcl-1 میشود. B) تیمار سلولهای NB4 با Idelalisibباعث افزایش نسبت ژنهای Bax/Bcl-2 در غلظتهای 10 و 30 میکرومولار میشود. میانگین و انحراف از معیار نتایج حاصل از سه ران کاری مختلف (Mean ± SD) محاسبه و p.value به دست آمده (*، 05/0p < ؛ **،01/0(p< نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل میباشد.
هم چنین نتایج به دست آمده نشان داد که بیان ژن PUMA به عنوان یکی دیگر از اعضاء پروآپوپتوتیک خانواده Bcl2 نیز متعاقب تیمار با دوز µM 30 از Idelalisib به میزان 3/1 برابر نسبت به کنترل افزایش داشت.
در بررسی میزان تغییر بیان ژنهای آنتیآپوپتوتیک خانواده Bcl2 نیز نتایج نشان داد که بیان ژن Mcl-1 متعاقب تیمار با Idelalisib بهترتیب به میزان 6/0 و 8/0 با استفاده از دوزهای 10 و 30 میکرومولار کاهش یافت. هم چنین همان طور که در این نمودار مشخص است، میزان بیـان Bcl-2 متعاقب تیمار دارویی با کاهش معنادار همراه نبود. از آن جایی که در واقع نسبت Bax/Bcl-2 ، به جای تغییرات هر کدام از این ژنها به تنهایی، تعیینکننده سرنوشت سلول در پاسخ به دارو است، به همین دلیل میزان تغییر این دو ژن نسبت به یکدیگر نیز بررسی شد. نسبت Bax/Bcl-2 در دوزهای 10 و 30 میکرومولار از Idelalisib به ترتیب افزایش 5/1 و 2 برابری نسبت به کنترل داشت(نمودار B 5).
بحث
مسیر PI3K/Akt/mTOR مسیری است که به طور مداوم در سلولهای پرومیلوسیت غیر طبیعی در APL فعال میباشد و باعث بقا و تکثیر نامحدود این سلولها میشود. این مسیر در پروسههای مختلف سلولی از قبیل متابولیسم، تمایز، التهاب، بقا و آپوپتوز نقش به سزایی را ایفا میکند (12). مطالعههای گذشته نشان میدهد که ایزوفرم p110δ آنزیم PI3K ، مهمترین ایزوفرم در سلولهای لوسمیک APL است که دارای افزایش بیان بالایی میباشد(13). بنابراین مهارکنندههای مسیر PI3K/Akt در درمان بسیاری از بدخیمیها از جمله لوسمیهای میلوییدی مورد توجه ویژه قرار گرفته است(7). مهارکنندههای PI3K به طور کلی شامل دو دسته Pan-PI3K inhibitor و Isoform-specific inhibitor میباشد که Idelalisib به عنوان یک Isoform-specific inhibitor ، در واقع مهارکننده ایزوفرم p110δ بوده و بـا مهـار انتقال پیام PI3K باعث کاهش در فسفریلاسیون
Akt و افکتورهای زیردست آن میشود(9). نکته قابل توجه
این است که این دارو در سال 2014 توسط آمریکا و اتحادیه اروپا در درمان سه نئوپلاسم indolent B-Cell تائیدیه گرفته است(14). Idelalisib به عنوان یک منوتراپی در درمان بیماران CLL و indolent non-Hodgkin lymphoma مؤثر بوده و با مهار مسیر انتقال پیام PI3K/Akt/mTOR در سللاینهای مختلف، باعث کاهش بقا و تکثیر سلولهای بدخیم، توقف چرخه سلولی و هم چنین القای آپوپتوز میشود(17-15، 10).
نتایج به دست آمده از این تحقیق نشاندهنده آن بود که Idelalisib در سلولهای NB4 باعث کاهش شمارش سلولی، زندهمانی و فعالیت متابولیک سلولها به طور وابسته به دوز و زمان میشود. در مطالعه انجام شده در سال 2010 توسط هیروشی ایکدا و همکارانش نتایجی مشابه در مالتیپل میلوما به دست آمده است؛ مطالعهای که در آن مشخص شد که Idelalisib باعث کاهش ساخت DNA و کاهش تکثیر در دو سللاین میلومایی LB و INA-6 میشود(11). به منظور بررسی این که آیا کاهش زندهمانی سلولها از طریق مسیر آپوپتوتیک در سلولهای NB4 صورت گرفته است، القای آپوپتوز در سلولهای NB4 پس از تیمار با Idelaliisb بررسی شد. نتایج به دستآمده نشان داد که پس از تیمار سلولهای NB4 با Idelalisib ، تعداد جمعیت سلولهای Annexin V+ و هم چنین AnnexinV+/PI+ نسبت به کنترل افزایش داشت. در مطالعه انجام شده در سال 2012 توسط میدوسا و همکارانش مشخص شد که این مهار کننده PI3K در سللاینهای لنفوم هوچکین نیز باعث افزایش 5-2 برابری سلولهای AnnexinV+ نسبت به کنترل میشود(10).
در ادامه و به منظور بررسی مکانیسم مولکولی دخیل در القای آپوپتوز، میزان بیان mRNA ژنهای پروآپوپتوتیک و آنتیآپوپتوتیک مورد بررسی قرار گرفت. سه کلاس از پروتئینهای خانواده Bcl-2 وجود دارد که باعث تنظیم
آپوپتوز میشود: مهارکنندههای آپوپتوز همچون Mcl-1 و Bcl-2؛ پیش برندههای آپوپتوز هم چون Bax و PUMA ؛ و پروتئینهای تنظیمی که ممکن است به عنوان فعالکننده و یا مهارکننده عمل کنند(18). PUMA یک پروتئین پروآپوپتوتیک میباشد که میتواند از هر دو مسیر وابسته به p53 و غیر وابسته به p53 باعث افزایش آپوپتوز شود. فعالیت این پروتئین به گونهای است که با لوکالیزاسیون در میتوکندری و ایجاد تداخل با Bcl-2 باعث القاء مرگ در سلولها میشود(20، 19). شواهد اخیر نشان میدهد که Bax به عنوان یک مدیاتور اصلی در آپوپتوز ایجاد شده توسط PUMA میباشد(21). در مطالعه دیگری مشخص شده است که نقص در ژن Bax از آپوپتوز ایجاد شده توسط PUMA جلوگیری میکند(22). نتایج حاصل از این مطالعه نشان داد که Idelalisib نه تنها از طریق افزایش بیان پروتئینهای پروآپوپتوتیک Bax و PUMA سبب القای مرگ در سلولهای NB4 میشود، بلکه کاهش بیان mRNA ژن Mcl-1 نیز میتواند به عنوان مکانیسم دخیل دیگر در سایتوتوکسیسیته این دارو مطرح باشد. در مطالعه انجامشده در سال 2011 توسط لانوتی و همکارانش، مشخص شد که Idelalisib در سلولهای CLL از طریق کاهش بیان ژن Mcl-1 سبب القا مرگ میشود(9).
نتیجهگیری
در مجموع، با توجه به فعال بودن p110δ در بیماران APL و هم چنین اثربخشی داروی Idelalisib در القای اثرات سایتوتوکسیک در سلولهای پرومیلوسیتیک NB4، میتوان چنین پیشنهاد کرد که این دارو میتواند به عنوان یک راهکار درمانی مناسب، چه به صورت منوتراپی و چه به صورت داروی مکمل همراه با داروهای متداول مورد استفاده، در بیماران APL مد نظر گرفته شود.
متن کامل: (2066 مشاهده)
تاثیر سایتوتوکسیک مهارکننده PI3Kd در رده سلولی لوسمی پرومیلوسیتیک حاد
مریم داداشی1، داود بشاش2
چکیده
سابقه و هدف
مسیر PI3K/Akt که در تنظیم رشد سلولی و تکثیر نقش مهمی ایفا میکند، تقریباً در 70%-50% بیماران APL فعالیت بالایی را نشان میدهد. مشخص شده است که در سلولهای لوسمیک این بدخیمی، فعالیت PI3K عمدتاً ناشی از افزایش بیان ایزوفرم p110δ میباشد. در این مطالعه بر آن شدیم تا اثر بخشی داروی Idelalisib را که یکی از مهمترین مهارکنندههای p110δمیباشد، در سلولهای NB4 مشتق از APL بررسی کنیم.
مواد و روشها
در یک مطالعه تجربی، اثرات مهاری دارو بر فعالیت متابولیک و زندهمانی سلولهای NB4 بررسی شد. همچنین از روش فلوسایتومتری جهت بررسی آپوپتوز و از روش Quantitative RT-PCR جهت بررسی تغییر بیان mRNA ژنهای دخیل در آپوپتوز استفاده شد.
یافتهها
نتایج نشان داد که Idelalisib نه تنها باعث کاهش زندهمانی و فعالیت متابولیک سلولهای NB4 به صورت وابسته به دوز و زمان شد، بلکه متوجه شدیم که اثرات سایتوتوکسیک این دارو از طریق فعالکردن مسیر آپوپتوتیک میباشد. هم چنین در بررسی مکانیسم مولکولی دخیل در القای مرگ سلولی مشخص شد که داروی Idelalisib از طریق افزایش بیان ژنهای پروآپوپتوتیک Bax و PUMA و کاهش بیان ژن آنتیآپوپتوتیک Mcl-1 اثر خود را اعمال میکند.
نتیجه گیری
با توجه به فعالبودن p110δ در بیماران APL و هم چنین اثر بخشی داروی Idelalisib در القای اثرات سایتوتوکسیک در سلولهای پرومیلوسیتیک NB4، میتوان چنین پیشنهاد کرد که این دارو میتواند به عنوان یک راهکار درمانی مناسب، چه به صورت منوتراپی و چه به صورت داروی مکمل همراه با داروهای متداول مورد استفاده، در بیماران APL مد نظر گرفته شود.
کلمات کلیدی: لوسمی پرومیلوسیتیک حاد، مهارکننده، آپوپتوز
تاریخ دریافت : 25/8/95
تاریخ پذیرش : 21/1/96
1- کارشناس ارشد خونشناسی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ گروه هماتولوژی ـ میدان قدس ـ خیابان دربند ـ تهران ـ ایران ـ کدپستی: 1971653312
مریم داداشی1، داود بشاش2
چکیده
سابقه و هدف
مسیر PI3K/Akt که در تنظیم رشد سلولی و تکثیر نقش مهمی ایفا میکند، تقریباً در 70%-50% بیماران APL فعالیت بالایی را نشان میدهد. مشخص شده است که در سلولهای لوسمیک این بدخیمی، فعالیت PI3K عمدتاً ناشی از افزایش بیان ایزوفرم p110δ میباشد. در این مطالعه بر آن شدیم تا اثر بخشی داروی Idelalisib را که یکی از مهمترین مهارکنندههای p110δمیباشد، در سلولهای NB4 مشتق از APL بررسی کنیم.
مواد و روشها
در یک مطالعه تجربی، اثرات مهاری دارو بر فعالیت متابولیک و زندهمانی سلولهای NB4 بررسی شد. همچنین از روش فلوسایتومتری جهت بررسی آپوپتوز و از روش Quantitative RT-PCR جهت بررسی تغییر بیان mRNA ژنهای دخیل در آپوپتوز استفاده شد.
یافتهها
نتایج نشان داد که Idelalisib نه تنها باعث کاهش زندهمانی و فعالیت متابولیک سلولهای NB4 به صورت وابسته به دوز و زمان شد، بلکه متوجه شدیم که اثرات سایتوتوکسیک این دارو از طریق فعالکردن مسیر آپوپتوتیک میباشد. هم چنین در بررسی مکانیسم مولکولی دخیل در القای مرگ سلولی مشخص شد که داروی Idelalisib از طریق افزایش بیان ژنهای پروآپوپتوتیک Bax و PUMA و کاهش بیان ژن آنتیآپوپتوتیک Mcl-1 اثر خود را اعمال میکند.
نتیجه گیری
با توجه به فعالبودن p110δ در بیماران APL و هم چنین اثر بخشی داروی Idelalisib در القای اثرات سایتوتوکسیک در سلولهای پرومیلوسیتیک NB4، میتوان چنین پیشنهاد کرد که این دارو میتواند به عنوان یک راهکار درمانی مناسب، چه به صورت منوتراپی و چه به صورت داروی مکمل همراه با داروهای متداول مورد استفاده، در بیماران APL مد نظر گرفته شود.
کلمات کلیدی: لوسمی پرومیلوسیتیک حاد، مهارکننده، آپوپتوز
تاریخ دریافت : 25/8/95
تاریخ پذیرش : 21/1/96
1- کارشناس ارشد خونشناسی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسئول: PhD خونشناسی و بانک خون ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ گروه هماتولوژی ـ میدان قدس ـ خیابان دربند ـ تهران ـ ایران ـ کدپستی: 1971653312
مقدمه
لوسمی پرومیلوسیتیک حاد(APL) ، زیر گروهی از AML است که دارای مورفولوژی سیتولوژیک مشخص M3 یا M3V بر اساس طبقهبندی FAB میباشد(1). این لوسمی، 10%-5% از موارد لوسمی میلوئیدی حاد را شامل میشود و در مجموع میتوان گفت بیشترین شیوع این بیماری در جوانان میباشد(2، 1). 97% از موارد APL به علت یک جابهجایی بین دو کروموزوم 15 و 17 اتفاق میافتد که منجر به ایجاد ژن ترکیبی PML/RARα و بیان پروتئین کایمریکPML/RARα میشود(3). هر چند از سال 1988 نقش ATRA به طور گستردهای در درمان بیماران APL مشخص شده است، اما درمان با ATRA دارای محدودیتهایی از قبیل سندرم رتینوئیک اسید و ایجاد مقاومت در بیماران درمان شده با آن طی 3 ماه تا 1 سال پس از شروع درمان میباشد(5، 4). لازم به ذکر است که یکی از استراتژیهای درمانی در بیماران مقاوم به ATRA ، استفاده از آرسنیکتریاکساید(AS2O3) میباشد؛ اما علیرغم اثربخشی و نتایج قابل قبول، این دارو نیز دارای اثرات سمی و عوارض جانبی زیادی است(6). طی مطالعههای گذشته مشخص شده است که مسیر PI3K/Akt یکی از مهمترین دلایل مقاومت به آرسنیک تری اکساید و دیگر عوامل درمانی مؤثر در APL است (7). مسیر PI3K/Akt/mTOR به طور مداوم در سلولهای لوسمیک AML فعال بوده و باعث بقا و تکثیر نامحدود و مقاومت این سلولها به آپوپتوز میشود(8، 7). بر اساس مطالعههای گوناگون، ایزوفرم p110δ مهمترین ایزوفرم PI3K در سلولهای لوسمیک بیماران AML میباشد که سطح بیان آن به طور چشمگیری افزایش یافته است(8، 7).
در میان مهارکنندگان انتخابی PI3K، امروزه توجه گستردهای به دارویی تحت عنوان Idelalisib معطوف شده است. این دارو که به عنوان یک مهارگر اختصاصی ایزوفرم (Isoform-specific inhibitor) عمل میکند، در واقع مهارکننده ایزوفرم p110δ میباشد. Idelalisib با مهار مسیر پیامرسانی PI3K منجر به کاهش فسفریلاسیون Akt و افکتورهای پایین دست آن شده و باعث افزایش پلی ADP- ریبوز پلیمراز، شکستن کاسپاز و القای آپوپتوز میشود(9). همچنین مشخص شده است که درمان با Idelalisib باعث توقف چرخه سلولی و آپوپتوز در سل لاینهای لنفوم هوچکین میشود(10). اثرات سایتوتوکسیک این دارو در سللاینهای میلومایی INA-6 و LB نیز گزارش شده است(11).
با توجه به نتایج اثربخش تیمار سللاینهای سرطانی با Idelalisib و از طرفی با در نظر گرفتن عدم موفقیت کامل راهکارهای درمانی معمول در APL ، برآن شدیم تا در این تحقیق اثربخشی Idelalisib بر روی سلولهای رده NB4 مشتق شده از APL را مورد بررسی قرار دهیم.
مواد و روشها
کشت سلولی و تیمار دارویی با Idelalisib :
در این مطالعه تجربی، سلولهای NB4(مشتق از لوسمی پرومیلوسیتی حاد) در محیط کشت RPMI 1640 همراه با 10% FBS ، U/mL100 پنیسیلین و µg/mL 100 استرپتومایسین کشت داده شد و در انکوباتور با دمای 37 درجه سانتیگراد و فشار دیاکسیدکربن 5% نگهداری شدند. به علاوه، جهت اطمینان از صحت سلولهای NB4 ، mRNA ژن ترکیبی PML/RARα با استفاده از روش RT-PCR برای این سللاین مورد بررسی قرار گرفت. پودر 10 میلیگرم Idelalisib به صورت لیوفیلیزه از شرکت سلکچم (آمریکا) خریداری شد. به منظور تهیه استوک 500 میکرومولار، مقادیر مورد نظر از پودر دارو در DMSO حل شد و تا زمان استفاده در دمای 20- درجه سانتیگراد نگهداری گردید. تیمار سلولهای NB4 با غلظتهای مختلف Idelalisib و در زمانهای 24 ،36 و 48 ساعت صورت گرفت. جهت جلوگیری از اثرات حلال بر روی میزان پرولیفراسیون و بقای سللاین، سلولها با غلظت مشخص شدهای از DMSO به عنوان کنترل منفی تیمار شدند. تمامی آزمایشها به منظور افزایش دقت کار به صورت تریپلیکیت انجام شد.
ارزیابی زندهمانی و شمارش سلولی به روش تریپان بلو:
برای شمارش سلولها از رنگآمیزی تریپانبلو و لام هموسایتومتر(لام نئوبار) استفاده شد. اساس این آزمایش بدین ترتیب است که سلولهای زنده نسبت به ورود رنگ نفوذناپذیر میباشند، حال آن که سلولهای مرده رنگ را جذب میکنند. برای شمارش تعداد سلولهای زنده، تعداد سلولهای رنگ نگرفته در هر چهار سری خانههای شانزدهتایی(خانه شمارش WBC) شمارش شده و میانگین گرفته شد. همچنین زندهمانی سلولها نیز با استفاده از فرمول زیر محاسبه شد.
تعداد سلولهای زنده
100 * = درصد زندهمانی سلولها
کل سلولها
ارزیابی فعالیت متابولیک سلولها به روش MTT :
برای ارزیابی تاثیر دارو بر فعالیت متابولیک سلولها، از آزمون MTT ((Microculture Tetrazolium Test استفاده شد. پس از تیمار سلولها با غلظتهای مختلف دارو، تعداد 103×5 سلول به هر چاهک از پلیت 96 خانهای ریخته شد. پلیتها به مدت 24، 36 و 48 ساعت در انکوباتور CO2 دار انکوبه شدند. پس از پایان زمان انکوباسیون، سلولها با µL 100 معرف تترازولیوم mg/mL) 5 (مجاور و به مدت چهار ساعت در انکوباتور انکوبه شدند. پس از طی زمان مذکور، پلیت را به مدت 10 دقیقه با دور 3000 دور در دقیقه سانتریفوژ کرده و محلول رویی را خارج کردیم. مقدار µL 100 از DMSO به چاهکها اضافه و در نهایت جذب نوری هر چاهک توسط دستگاه الایزا ریدر در طول موج nm 570 قرائت شد.
بررسی القای آپوپتوز با استفاده از فلوسیتومتری:
به منظور بررسی اثر پروآپوپتوتیک دارو بر روی سلولها از کیت Annexin/PI (رُوش) استفاده شد. در این روش، ابتدا سلولهای تیمار شده با دارو جمعآوری شد، با دور g 600 در دمای اتاق به مدت 5 دقیقه سانتریفوژ و سپس 1 بار با PBS شستشو داده شد. به هر لوله µL 100 از Binding Buffer که به آن µL 1 از رنگ Annexin با غلظت استوک mg/mL 5/0 و µL 1 از PI با غلظت استوک mg/mL 1/0 اضافه شده بود، افزوده و لولهها به آرامی ورتکس شدند. لولهها به مدت 15-10 دقیقه در تاریکی و در دمـای اتــاق انکــوبـه و سپــس بــلافاصلـه تـوسـط
فلوسایتومتری آنالیز شدند.
استخراج RNA ، ساخت cDNA و انجام آزمون Real-Time PCR :
برای استخراج RNA ، از کیتTriPure (رُوش) طبق دستورالعمل استفاده شد. پس از تیمار سلولهای NB4 با Idelalisib و متعاقب گذشت 48 ساعت، RNA سلولها استخراج و کمیت آنها با روش اسپکتروفتومتری با استفاده از دستگاه نانودراپ ND-1000 اندازهگیری شد. برای انجام واکنش رونویسی معکوس از Revert Aid First Strand (تاکارابیو) cDNA Synthesis Kit استفاده شد. آزمون Real-Time PCR در دستگاه light cycler (رُوش) و در حجم 20 میکرولیتر انجام شد. به ازاء هر واکنش،μL 10 از SYBR Premix Ex Taq، μL 2 از محصول cDNA، μL 5/0 از هر یک از آغازگرها pmol)10) و μL 7 آب عاری از نوکلئاز استفاده شد(جدول 1). شرایط دمایی مورد استفاده شامل یک مرحله فعالسازی اولیه در دمای 95 درجه سانتیگراد به مدت 30 ثانیه و در ادامه، 45 چرخه برای دناتوراسیون (5 ثانیه در 95 درجه سانتیگراد) و مرحله آنیلینگ/اکستنشن توام (20 ثانیه در 60 درجه سانتیگراد( میباشد. برای بررسی اختصاصیت محصول تکثیر شده، منحنی ذوب مورد بررسی قرار گرفت. در انتها برای محاسبه نسبی تعداد نسخه mRNA تکثیر شده از فرمول زیر استفاده شد. DDct-2 = میزان بیان ژن
آنالیز آماری:
تمامی آزمایشها به شکل سه آزمون مستقل انجام و مقادیر گزارش شده به شکل Mean ± SD قید شدند. هم چنین برای محاسبات آماری از روش t-test و نرمافزار 18SPSS و GraphPad Prism7 استفاده شد.
*: بیانگر این است که اختلاف میانگین گروههای آزمون با کنترل در سطح 05/0 p< معنادار بوده است.
**: بیانگر این است که اختلاف میانگین گروههای آزمون با کنترل در سطح 01/0 p< معنادار بوده است.
***: بیانگر این است که اختلاف میانگیـن گروههـای آزمـون بـا کنتـرل در سطح 001/0 p< معنادار بوده است.
جدول 1: توالی آغازگرهای به کار رفته در آزمون Real Time Quantitative RT-PCR
| ژن | Accession number | آغازگر جلوبرنده(5'-3') | آغازگر معکوس(5'-3') | اندازه (bp) |
| Bax | 138761- NM | CGAGAGGTCTTTTTCCGAGTG | GTGGGCGTCCCAAAGTAGG | 242 |
| PUMA | 014417 – NM | GACCTCAACGCACAGTACGAG | AGGAGTCCCATGATGAGATTGT | 98 |
| Bcl-2 | 000633 – NM | CGGTGGGGTCATGTGTGTG | CGGTTCAGGTACTCAGTCATCC | 90 |
| Mcl-1 | 021960 - NM | AGAAAGCTGCATCGAACCAT | CCAGCTCCTACTCCAGCAAC | 183 |
یافتهها
کاهش شمارش سلولی و زندهمانی سلولهای NB4 پس از تیمار با Idelalisib بهصورت وابسته به دوز و زمان:
با استفاده از آزمایش تریپانبلو، شمارش سلولی(Cell Count) و زندهمانی(Viability) سلولهای NB4 مورد مطالعه قرار گرفت. برای انجام این آزمون، سلولها با دوزهای متغیر دارو(20،10،5 و 30 میکرومولار) برای مدت زمان 24، 36 و 48 ساعت تیمار شدند. گروهی از سلولها نیز به عنوان شاهد هیچ دارویی دریافت نکردند. نتایج به دست آمده نشان داد که Idelalisib میتواند باعث کاهش تعداد و زندهمانی در سلولهای NB4 هم به صورت وابسته به دوز و هم به صورت وابسته به زمان شود. بیشترین اثر مهاری Idelalisib بر تعداد سلولهای NB4 متعاقب تیمار آنها با دوز µM 30 و طی 48 ساعت دیده میشود(نمودار 1).
همچنین در 48 ساعت، میزان زندهمانی سلولها در دوزهای 5 ، 10، 20 و30 میکرومولار از Idelalisib به ترتیب به 84%، 63%، 38% و 25% رسیده است که نشاندهنده کاهش چشمگیر زنده مانی سلولها به طور وابسته به دوز میباشد(نمودار 2). با توجه به نتایج حاصل، میتوان نتیجهگیری کرد که Idelalisib باعث کاهش شمارش و زندهمانی سلولها به صورت وابسته به دوز و زمان در سلولهای NB4 میشود.
کاهش فعالیت متابولیک سلولهای NB4 پس از تیمار با Idelalisib :
در این مطالعه و به منظور بررسی اثر داروی Idelalisib
در مهار فعالیت متابولیک رده سلولی NB4 ، آزمایش MTT انجام شد. 24 ساعت پس از تیمار سلولهای NB4 با غلظتهای 5، 10، 20 و 30 میکرومولار از Idelalisib ، به ترتیب فعالیت متابولیک 12%، 17%، 30% و 50% کاهش مییابد(نمودار 3). هم چنین نتایج به دست آمده نشان میدهد که اثر مهاری دارو با گذشت زمان افزایش مییابد؛ به نحوی که بیشترین مهار فعالیت متابولیک را پس از 48 ساعت شاهد هستیم. در مجموع و با توجه به نتایج به دست آمده میتوان نتیجهگیری کرد که Idelalisib باعث کاهش فعالیت متابولیک سلولهای NB4 هم به صورت وابسته به دوز و هم به صورت وابسته به زمان میشود.
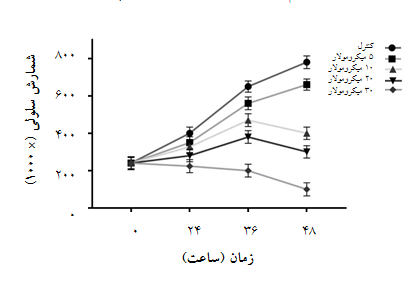
نمودار 1 : تاثیر داروی Idelalisib بر شمارش سلولی در سلولهایNB4 به صورت وابسته به دوز و زمان. سلولهای NB4 در تعداد 000/200 در پلیتهای 16 تایی در مقادیر مختلف 5 ، 10، 20 و 30 میکرومولار تیمار و پس از گذشت 24، 36 و 48 ساعت، شمارش سلولی با روش تریپان بلو انجام شد(3 n= ، Mean ± SD). همان گونه که در شکل مشاهده میشود، Idelalisib به صورت وابسته به دوز و زمان شمارش سلولی را کاهش داده و دوز 30 میکرومولار دارای بیشترین اثرات سایتوتوکسیک میباشد.
اثر پروآپوپتوتیک داروی Idelalisib در سلولهای NB4 :
48 ساعـت پـس از تیمار سلولهای NB4 با Idelalisib
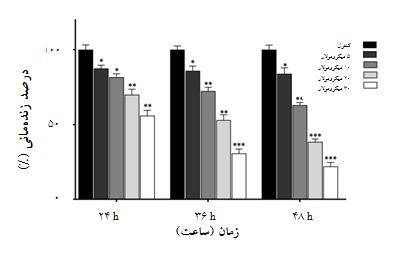
نمودار 2: تاثیر Idelalisib در زندهمانی سلولهای NB4. میزان زندهمانی سلولهای NB4 پس از تیمار با غلظتهای مختلف Idelalisib در24 ، 36 و 4 8 ساعت، با روش تریپانبلو ارزیابی شد. همان طور که در شکل مشاهده میشود، Idelalisib به صورت وابسته به دوز و زمان زندهمانی سلولها را کاهش میدهد. میانگین و انحراف از معیار نتایج حاصل از سه ران کاری مختلف محاسبه و p value به دست آمده (* ، 05/0 p< ، ** ، 01/0 p< ، *** 001/0 p<) نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل بود.
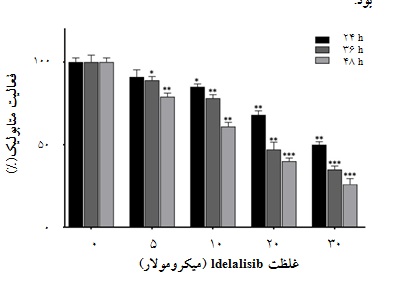
نمودار3: تاثیر داروی Idelalisib بر فعالیت متابولیک بر روی سلولهای NB4 به صورت وابسته به دوز و زمان. سلولهای NB4 در تعداد 5000 سلول در هر چاهک با غلظتهای مختلف Idelalisib در زمانهای 24، 36 و 48 ساعت تیمار و سپس فعالیت متابولیک با روش MTT ارزیابی شد. همان طور که در شکل مشاهده میشود، Idelalisib به صورت وابسته به دوز و زمان فعالیـت متابولیـک را کاهـش مـیدهد. میانگیـن و انحراف از معیار نتایـج حاصل از سه رانکاری مختلف (Mean ± SD) محاسبه و p. value به دستآمده (*، 05/0p < ؛ **،01/0< p؛ ***، 001/0(p< نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل بـود.
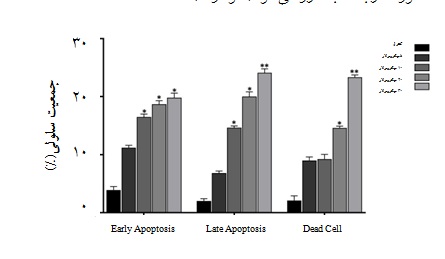
نمودار 4: تاثیر Idelalisib در القای آپوپتوز در سلولهای NB4. سلولهای NB4 در تعداد 105 × 5 در پلیتهای 24 خانهای با دوزهای مختلف Idelalisib تیمار و پس از گذشت 48 ساعت میزان آپوپتوز با استفاده از کیت رنگی دوگانه AnnexinV/PI بررسی شد. همان طور که در شکل مشاهده میشود، Idelalisib باعث القای آپوپتوز به صورت وابسته به دوز میشود. میانگین و انحراف از معیار نتایج حاصل از سه ران کاری مختلف (Mean ± SD) محاسبه و p value به دست آمده (*، 05/0p < ؛ **،01/0(p< نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل میباشد.
تاثیر Idelalisib بر روی بیان ژنهای Bax ، PUMA ، Bcl-2 و Mcl-1 :
به منظور بررسی مکانیسمهای مولکولی دخیل در القای آپوپتوز، میزان بیان mRNA ژنهای پروآپوپتوتیک و آنتیآپوپتوتیک با استفاده از روش Quantitative RT-PCR مورد مطالعه قرار گرفت. میزان بیان ژن Bax ، به عنوان یک پروتئین پروآپوپتوتیـک از خانـواده Bcl2 ، متعاقـب تیمـار سلولهای NB4 با دوزهای 10 و 30 میکرومولارIdelalisib به ترتیب 5/1 و 7/1 برابر نسبت به کنترل افزایش یافته است(نمودار A 5).
کاهش شمارش سلولی و زندهمانی سلولهای NB4 پس از تیمار با Idelalisib بهصورت وابسته به دوز و زمان:
با استفاده از آزمایش تریپانبلو، شمارش سلولی(Cell Count) و زندهمانی(Viability) سلولهای NB4 مورد مطالعه قرار گرفت. برای انجام این آزمون، سلولها با دوزهای متغیر دارو(20،10،5 و 30 میکرومولار) برای مدت زمان 24، 36 و 48 ساعت تیمار شدند. گروهی از سلولها نیز به عنوان شاهد هیچ دارویی دریافت نکردند. نتایج به دست آمده نشان داد که Idelalisib میتواند باعث کاهش تعداد و زندهمانی در سلولهای NB4 هم به صورت وابسته به دوز و هم به صورت وابسته به زمان شود. بیشترین اثر مهاری Idelalisib بر تعداد سلولهای NB4 متعاقب تیمار آنها با دوز µM 30 و طی 48 ساعت دیده میشود(نمودار 1).
همچنین در 48 ساعت، میزان زندهمانی سلولها در دوزهای 5 ، 10، 20 و30 میکرومولار از Idelalisib به ترتیب به 84%، 63%، 38% و 25% رسیده است که نشاندهنده کاهش چشمگیر زنده مانی سلولها به طور وابسته به دوز میباشد(نمودار 2). با توجه به نتایج حاصل، میتوان نتیجهگیری کرد که Idelalisib باعث کاهش شمارش و زندهمانی سلولها به صورت وابسته به دوز و زمان در سلولهای NB4 میشود.
کاهش فعالیت متابولیک سلولهای NB4 پس از تیمار با Idelalisib :
در این مطالعه و به منظور بررسی اثر داروی Idelalisib
در مهار فعالیت متابولیک رده سلولی NB4 ، آزمایش MTT انجام شد. 24 ساعت پس از تیمار سلولهای NB4 با غلظتهای 5، 10، 20 و 30 میکرومولار از Idelalisib ، به ترتیب فعالیت متابولیک 12%، 17%، 30% و 50% کاهش مییابد(نمودار 3). هم چنین نتایج به دست آمده نشان میدهد که اثر مهاری دارو با گذشت زمان افزایش مییابد؛ به نحوی که بیشترین مهار فعالیت متابولیک را پس از 48 ساعت شاهد هستیم. در مجموع و با توجه به نتایج به دست آمده میتوان نتیجهگیری کرد که Idelalisib باعث کاهش فعالیت متابولیک سلولهای NB4 هم به صورت وابسته به دوز و هم به صورت وابسته به زمان میشود.

نمودار 1 : تاثیر داروی Idelalisib بر شمارش سلولی در سلولهایNB4 به صورت وابسته به دوز و زمان. سلولهای NB4 در تعداد 000/200 در پلیتهای 16 تایی در مقادیر مختلف 5 ، 10، 20 و 30 میکرومولار تیمار و پس از گذشت 24، 36 و 48 ساعت، شمارش سلولی با روش تریپان بلو انجام شد(3 n= ، Mean ± SD). همان گونه که در شکل مشاهده میشود، Idelalisib به صورت وابسته به دوز و زمان شمارش سلولی را کاهش داده و دوز 30 میکرومولار دارای بیشترین اثرات سایتوتوکسیک میباشد.
اثر پروآپوپتوتیک داروی Idelalisib در سلولهای NB4 :
48 ساعـت پـس از تیمار سلولهای NB4 با Idelalisib

نمودار 2: تاثیر Idelalisib در زندهمانی سلولهای NB4. میزان زندهمانی سلولهای NB4 پس از تیمار با غلظتهای مختلف Idelalisib در24 ، 36 و 4 8 ساعت، با روش تریپانبلو ارزیابی شد. همان طور که در شکل مشاهده میشود، Idelalisib به صورت وابسته به دوز و زمان زندهمانی سلولها را کاهش میدهد. میانگین و انحراف از معیار نتایج حاصل از سه ران کاری مختلف محاسبه و p value به دست آمده (* ، 05/0 p< ، ** ، 01/0 p< ، *** 001/0 p<) نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل بود.

نمودار3: تاثیر داروی Idelalisib بر فعالیت متابولیک بر روی سلولهای NB4 به صورت وابسته به دوز و زمان. سلولهای NB4 در تعداد 5000 سلول در هر چاهک با غلظتهای مختلف Idelalisib در زمانهای 24، 36 و 48 ساعت تیمار و سپس فعالیت متابولیک با روش MTT ارزیابی شد. همان طور که در شکل مشاهده میشود، Idelalisib به صورت وابسته به دوز و زمان فعالیـت متابولیـک را کاهـش مـیدهد. میانگیـن و انحراف از معیار نتایـج حاصل از سه رانکاری مختلف (Mean ± SD) محاسبه و p. value به دستآمده (*، 05/0p < ؛ **،01/0< p؛ ***، 001/0(p< نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل بـود.

نمودار 4: تاثیر Idelalisib در القای آپوپتوز در سلولهای NB4. سلولهای NB4 در تعداد 105 × 5 در پلیتهای 24 خانهای با دوزهای مختلف Idelalisib تیمار و پس از گذشت 48 ساعت میزان آپوپتوز با استفاده از کیت رنگی دوگانه AnnexinV/PI بررسی شد. همان طور که در شکل مشاهده میشود، Idelalisib باعث القای آپوپتوز به صورت وابسته به دوز میشود. میانگین و انحراف از معیار نتایج حاصل از سه ران کاری مختلف (Mean ± SD) محاسبه و p value به دست آمده (*، 05/0p < ؛ **،01/0(p< نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل میباشد.
تاثیر Idelalisib بر روی بیان ژنهای Bax ، PUMA ، Bcl-2 و Mcl-1 :
به منظور بررسی مکانیسمهای مولکولی دخیل در القای آپوپتوز، میزان بیان mRNA ژنهای پروآپوپتوتیک و آنتیآپوپتوتیک با استفاده از روش Quantitative RT-PCR مورد مطالعه قرار گرفت. میزان بیان ژن Bax ، به عنوان یک پروتئین پروآپوپتوتیـک از خانـواده Bcl2 ، متعاقـب تیمـار سلولهای NB4 با دوزهای 10 و 30 میکرومولارIdelalisib به ترتیب 5/1 و 7/1 برابر نسبت به کنترل افزایش یافته است(نمودار A 5).

نمودار 5 : تاثیر Idelalisib بر سطح mRNA ژنهای پروآپوپتوتیک و آنتیآپوپتوتیک در سلولهای NB4. سلولهای NB4 در تعداد 106×2 با غلظتهای 10 و 30 میکرومولار ازIdelalisib به مدت 48 ساعت تیمار و پس از ساخت cDNA میزان بیان ژنها با استفاده از روش Quantitative RT-PCR محاسبه شد. A) Idelalisib باعث افزایش بیان ژنهای پروآپوپتوتیک و کاهش در بیان Mcl-1 میشود. B) تیمار سلولهای NB4 با Idelalisibباعث افزایش نسبت ژنهای Bax/Bcl-2 در غلظتهای 10 و 30 میکرومولار میشود. میانگین و انحراف از معیار نتایج حاصل از سه ران کاری مختلف (Mean ± SD) محاسبه و p.value به دست آمده (*، 05/0p < ؛ **،01/0(p< نشاندهنده معنادار بودن نتایج از نظر آماری در مقایسه با کنترل میباشد.
هم چنین نتایج به دست آمده نشان داد که بیان ژن PUMA به عنوان یکی دیگر از اعضاء پروآپوپتوتیک خانواده Bcl2 نیز متعاقب تیمار با دوز µM 30 از Idelalisib به میزان 3/1 برابر نسبت به کنترل افزایش داشت.
در بررسی میزان تغییر بیان ژنهای آنتیآپوپتوتیک خانواده Bcl2 نیز نتایج نشان داد که بیان ژن Mcl-1 متعاقب تیمار با Idelalisib بهترتیب به میزان 6/0 و 8/0 با استفاده از دوزهای 10 و 30 میکرومولار کاهش یافت. هم چنین همان طور که در این نمودار مشخص است، میزان بیـان Bcl-2 متعاقب تیمار دارویی با کاهش معنادار همراه نبود. از آن جایی که در واقع نسبت Bax/Bcl-2 ، به جای تغییرات هر کدام از این ژنها به تنهایی، تعیینکننده سرنوشت سلول در پاسخ به دارو است، به همین دلیل میزان تغییر این دو ژن نسبت به یکدیگر نیز بررسی شد. نسبت Bax/Bcl-2 در دوزهای 10 و 30 میکرومولار از Idelalisib به ترتیب افزایش 5/1 و 2 برابری نسبت به کنترل داشت(نمودار B 5).
بحث
مسیر PI3K/Akt/mTOR مسیری است که به طور مداوم در سلولهای پرومیلوسیت غیر طبیعی در APL فعال میباشد و باعث بقا و تکثیر نامحدود این سلولها میشود. این مسیر در پروسههای مختلف سلولی از قبیل متابولیسم، تمایز، التهاب، بقا و آپوپتوز نقش به سزایی را ایفا میکند (12). مطالعههای گذشته نشان میدهد که ایزوفرم p110δ آنزیم PI3K ، مهمترین ایزوفرم در سلولهای لوسمیک APL است که دارای افزایش بیان بالایی میباشد(13). بنابراین مهارکنندههای مسیر PI3K/Akt در درمان بسیاری از بدخیمیها از جمله لوسمیهای میلوییدی مورد توجه ویژه قرار گرفته است(7). مهارکنندههای PI3K به طور کلی شامل دو دسته Pan-PI3K inhibitor و Isoform-specific inhibitor میباشد که Idelalisib به عنوان یک Isoform-specific inhibitor ، در واقع مهارکننده ایزوفرم p110δ بوده و بـا مهـار انتقال پیام PI3K باعث کاهش در فسفریلاسیون
Akt و افکتورهای زیردست آن میشود(9). نکته قابل توجه
این است که این دارو در سال 2014 توسط آمریکا و اتحادیه اروپا در درمان سه نئوپلاسم indolent B-Cell تائیدیه گرفته است(14). Idelalisib به عنوان یک منوتراپی در درمان بیماران CLL و indolent non-Hodgkin lymphoma مؤثر بوده و با مهار مسیر انتقال پیام PI3K/Akt/mTOR در سللاینهای مختلف، باعث کاهش بقا و تکثیر سلولهای بدخیم، توقف چرخه سلولی و هم چنین القای آپوپتوز میشود(17-15، 10).
نتایج به دست آمده از این تحقیق نشاندهنده آن بود که Idelalisib در سلولهای NB4 باعث کاهش شمارش سلولی، زندهمانی و فعالیت متابولیک سلولها به طور وابسته به دوز و زمان میشود. در مطالعه انجام شده در سال 2010 توسط هیروشی ایکدا و همکارانش نتایجی مشابه در مالتیپل میلوما به دست آمده است؛ مطالعهای که در آن مشخص شد که Idelalisib باعث کاهش ساخت DNA و کاهش تکثیر در دو سللاین میلومایی LB و INA-6 میشود(11). به منظور بررسی این که آیا کاهش زندهمانی سلولها از طریق مسیر آپوپتوتیک در سلولهای NB4 صورت گرفته است، القای آپوپتوز در سلولهای NB4 پس از تیمار با Idelaliisb بررسی شد. نتایج به دستآمده نشان داد که پس از تیمار سلولهای NB4 با Idelalisib ، تعداد جمعیت سلولهای Annexin V+ و هم چنین AnnexinV+/PI+ نسبت به کنترل افزایش داشت. در مطالعه انجام شده در سال 2012 توسط میدوسا و همکارانش مشخص شد که این مهار کننده PI3K در سللاینهای لنفوم هوچکین نیز باعث افزایش 5-2 برابری سلولهای AnnexinV+ نسبت به کنترل میشود(10).
در ادامه و به منظور بررسی مکانیسم مولکولی دخیل در القای آپوپتوز، میزان بیان mRNA ژنهای پروآپوپتوتیک و آنتیآپوپتوتیک مورد بررسی قرار گرفت. سه کلاس از پروتئینهای خانواده Bcl-2 وجود دارد که باعث تنظیم
آپوپتوز میشود: مهارکنندههای آپوپتوز همچون Mcl-1 و Bcl-2؛ پیش برندههای آپوپتوز هم چون Bax و PUMA ؛ و پروتئینهای تنظیمی که ممکن است به عنوان فعالکننده و یا مهارکننده عمل کنند(18). PUMA یک پروتئین پروآپوپتوتیک میباشد که میتواند از هر دو مسیر وابسته به p53 و غیر وابسته به p53 باعث افزایش آپوپتوز شود. فعالیت این پروتئین به گونهای است که با لوکالیزاسیون در میتوکندری و ایجاد تداخل با Bcl-2 باعث القاء مرگ در سلولها میشود(20، 19). شواهد اخیر نشان میدهد که Bax به عنوان یک مدیاتور اصلی در آپوپتوز ایجاد شده توسط PUMA میباشد(21). در مطالعه دیگری مشخص شده است که نقص در ژن Bax از آپوپتوز ایجاد شده توسط PUMA جلوگیری میکند(22). نتایج حاصل از این مطالعه نشان داد که Idelalisib نه تنها از طریق افزایش بیان پروتئینهای پروآپوپتوتیک Bax و PUMA سبب القای مرگ در سلولهای NB4 میشود، بلکه کاهش بیان mRNA ژن Mcl-1 نیز میتواند به عنوان مکانیسم دخیل دیگر در سایتوتوکسیسیته این دارو مطرح باشد. در مطالعه انجامشده در سال 2011 توسط لانوتی و همکارانش، مشخص شد که Idelalisib در سلولهای CLL از طریق کاهش بیان ژن Mcl-1 سبب القا مرگ میشود(9).
نتیجهگیری
در مجموع، با توجه به فعال بودن p110δ در بیماران APL و هم چنین اثربخشی داروی Idelalisib در القای اثرات سایتوتوکسیک در سلولهای پرومیلوسیتیک NB4، میتوان چنین پیشنهاد کرد که این دارو میتواند به عنوان یک راهکار درمانی مناسب، چه به صورت منوتراپی و چه به صورت داروی مکمل همراه با داروهای متداول مورد استفاده، در بیماران APL مد نظر گرفته شود.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





