جلد 13، شماره 4 - ( زمستان 1395 )
جلد 13 شماره 4 صفحات 364-348 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Dorgalaleh A, Tabibian S, Farshi Y, Hosseini M, Shams M, Tavasoli B, et al . A practical approach in laboratory diagnosis of Factor XIII deficiency. bloodj 2016; 13 (4) :348-364
URL: http://bloodjournal.ir/article-1-963-fa.html
URL: http://bloodjournal.ir/article-1-963-fa.html
درگلاله اکبر، طبیبیان شادی، فرشی یداله، حسینی مریم سادات، شمس محمود، توسلی بهناز، و همکاران.. رویکرد عملی در تشخیص آزمایشگاهی و مولکولی کمبود فاکتور سیزده. فصلنامه پژوهشی خون. 1395; 13 (4) :348-364
اکبر درگلاله* 
 ، شادی طبیبیان
، شادی طبیبیان 
 ، یداله فرشی
، یداله فرشی 
 ، مریم سادات حسینی
، مریم سادات حسینی 
 ، محمود شمس
، محمود شمس 
 ، بهناز توسلی
، بهناز توسلی 
 ، مرضیه شکوری
، مرضیه شکوری 
 ، فاطمه روشن ضمیر
، فاطمه روشن ضمیر 


 ، شادی طبیبیان
، شادی طبیبیان 
 ، یداله فرشی
، یداله فرشی 
 ، مریم سادات حسینی
، مریم سادات حسینی 
 ، محمود شمس
، محمود شمس 
 ، بهناز توسلی
، بهناز توسلی 
 ، مرضیه شکوری
، مرضیه شکوری 
 ، فاطمه روشن ضمیر
، فاطمه روشن ضمیر 

تهران ـ ایران ـ صندوق پستی: 14155-5983
متن کامل [PDF 576 kb]
(2094 دریافت)
| چکیده (HTML) (6621 مشاهده)
مقدمه
فاکتور سیزده انعقادی(FXIII)، یک پیشآنزیم هتروتترامر میباشد که از دو زیر واحد A ( FXIII-A2) و دو زیر واحد B (FXIII-B2) تشکیل شده است. FXIII-A2 نقش آنزیمی داشته در حالی که FXIII-B2 به عنوان حامل زیر واحد A عمل میکند. کمبود فاکتور سیزده، اختلالی نادر با شیوع 1 نفر به ازای هر 2 میلیون نفر میباشد که علائم بالینی مختلفی از جمله خونریزی طولانی از بند ناف، خونریزی مغزی، تاخیر در التیام زخم، سقط مکرر و خونریزی از بینی دارد(3-1).
تاخیر در تشخیص کمبود فاکتور سیزده موجب بروز مرگ و میر در حدود نیمی از بیماران میگردد(4). تمامی آزمایشهای معمول انعقادی مانند زمان خونروی(BT)، زمان پروترومبین(PT)، زمان ترومبوپلاستین نسبی فعال شده(APTT) و تعداد پلاکت در کمبود فاکتور سیزده، طبیعی میباشند و این موضوع تشخیص بیماری را دشوار میسازد(5-3).
هر چند تشخیص کمبود فاکتور سیزده در تمامی کشورها یک چالش اساسی است اما با معرفی آزمایشهای تشخیصی دقیق مانند بررسی کمی فعالیت فاکتور سیزده و هم چنین بررسی سطح آنتیژنی فاکتور سیزده، تشخیص بیماری با سهولت بیشتری انجام میشود. با این وجود این آزمایشها نیز تحت تاثیر متغیرهای بسیاری قرار میگیرند که آگاهی از این فاکتورها میتواند به تشخیص صحیح بیماری کمک کند(9- 6).
آزمایشهای مولکولی نیز نقش به سزایی در تایید نهایی کمبود فاکتور سیزده دارند و در کشورهایی که این مطالعهها به طور گسترده انجام شدهاند، میتوان از بررسیهای مولکولی برای تشخیص پیش از تولد، شناسایی ناقلین و بیماران استفاده کرد(8).
در مطالعه مروری حاضر به بررسی آزمایشهای کیفی، کمی و مولکولی پرداخته شده و فاکتورهای دخیل در این آزمایشها مورد بررسی قرار گرفتهاند و راهکارهای مناسب جهت بهبود این آزمایشها ارایه شده است تا از عدم تشخیص و تشخیص دیرهنگام و عوارض مرگبار کمبود فاکتور سیزده جلوگیری شود(8 ،4).
نقش فاکتور سیزده در انعقاد:
فاکتور سیزده انعقادی، یک پیش آنزیم بوده و عملکردهای مختلفی دارد. این فاکتور علاوه بر نقش تاثیرگذار در حفظ تعادل انعقادی، در حفظ بارداری، بهبود زخم و رگزایی نیز نقش دارد(12-10). عملکرد مهم انعقادی فاکتور سیزده فعال(FXIIIa)، پایدار کردن لخته و حفاظت از فیبرین تازه شکل گرفته در برابر سیستم فیبرینولیتیکی میباشد(10). علاوه بر ایجاد اتصالات عرضی بین رشتههای سست فیبرین، این فاکتور انعقادی با پیوندهای کووالانسی به پروتئینهای دیگر پلاسما که در ایجاد لخته و فیبرینولیز نقش دارند مثل فیبرین و پلاسمینوژن متصل شده و امکان اتصال آنها را به یکدیگر فراهم میسازد(13-10).
فاکتور سیزده پلاسمایی(pFXIII) متشکل از دو زیر واحد پیشآنزیم A و دو زیر واحد حامل/ حفاظت کننده B میباشد که به صورت غیرکووالانسی به هم متصل شده و ساختـار تترامری(FXIII-A2B2) را تشکیل میدهند(14، 10).
شکل داخل سلولی فاکتور سیزده(cFXIII) به صورت همودایمر متشکل از دو زیر واحد A میباشد که در سیتوپلاسم پلاکت، منوسیت و سلولهای مشتق از منوسیت قرار داشته و در عملکردهای مختلف سلولی از جمله؛ فعالسازی پلاکت، نقل و انتقال مواد در سلولهای مشتق از منوسیت، فاگوسیتوز و یا بیان ژنهای مختلف نقش دارد (15، 10). زیر واحد A از چندین قسمت شامل پپتید فعال، بارل 1 و 2، ناحیه بتاساندویچ و مرکز کاتالیتیک با فعالیت آنزیماتیک تشکیل شده است(شکل 1).
فعالسازی هر دو شکل دایمریک و تترامریک فاکتور سیزده به وسیله فعالیت هماهنگ ترومبین و یون کلسیم صورت میگیرد. پس از هیدرولیز پیوند پپتیدی بین آرژنین 37 و گلیسین 38 در زیر واحد A ، پپتید فعالسازی از انتهای N مولکول جدا شده و در پلاسما آزاد میشود. در حضور یون کلسیم، ترومبین باعث برش پروتئولیتیکی زیر واحد A شده و در پی آن پیوند بین زیر واحد A و B فاکتور سیزده تضعیف شده و در نهایت زیر واحد B جدا میشود(17، 16، 10)(شکل 2) .
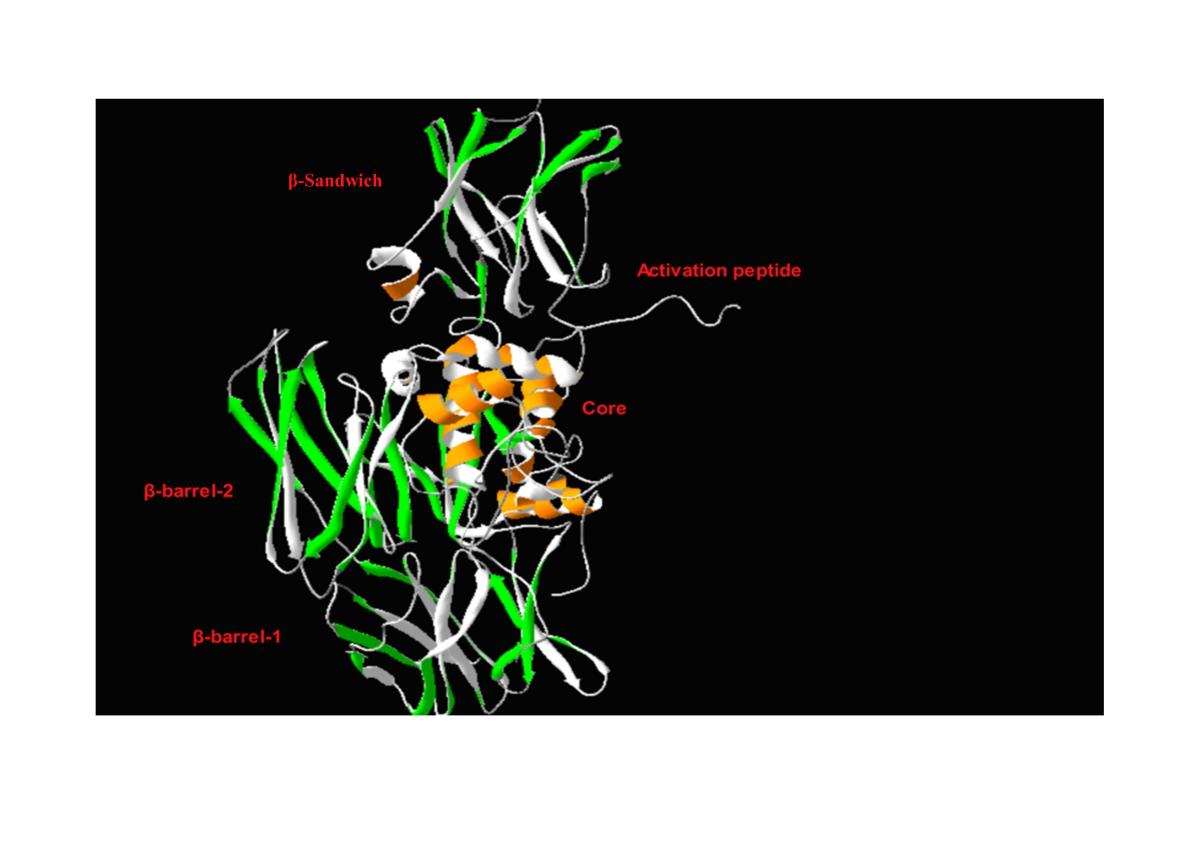
شکل 1: ساختار سه بعدی زیر واحد A فاکتور سیزده. این زیر واحد متشکل از پپتید فعال، بتا بارل 1 و 2، بتا ساندویچ و مرکز کاتالیتیک میباشد(2).

شکل 2: فعالسازی فاکتور سیزده. فعالسازی کامل فاکتور سیزده طی دو مرحله انجام میشود: در مرحله نخست، ترومبین پپتید فعال فاکتور سیزده را جدا میکند. در ادامه، کلسیم به فاکتور سیزده متصل شده و منجر به جدا شدن زیر واحد A از زیر واحد B میشود(2).
جدول 1: روشهای مختلف اندازهگیری فعالیت فاکتور سیزده

به همین دلیل توصیه میشود بر اساس امکانات هر منطقه، رویکرد مناسب برای تشخیص بیماری استفاده شود. در مناطقی که آزمایشگاههای انعقاد مجهز نبوده و سرمایهگذاری اندکی در راستای راهاندازی آزمایشهای تخصصی برای تشخیص فاکتور سیزده انجام شده، توصیه میشود آزمایش حلالیت لخته ارتقاء یافته و حساسیت آن افزایش یابد و این روش بهبود یافته برای غربالگری بیماری استفاده شود. بررسیها حاکی از این است که هنگامی که از ترومبین به عنوان عامل لخته کننده و از اسید استیک به عنوان عامل حلکننده لخته استفاده میشود، آزمایش حلالیت لخته دارای بیشترین حساسیت بوده و روشی مناسب برای غربالگری کمبود فاکتور سیزده میباشد(28، 8). حتی در این مناطق توصیه میشود اندازهگیری کمی فاکتور سیزده در آزمایشگاه انعقاد مرجع برای تایید تشخیص بیماری استفاده شود(شکل 3).
در کشورهایی مانند ایران، پاکستان، تونس، فنلاند و حتی هندوستان که دارای تعداد زیادی بیمار بوده و بررسی مولکولی بیماری به طور گستردهای انجام شده، این بررسیها منجر به شناسایی چند جهش اندک شدهاند که به طور مکرر در افراد این کشورها، شناسایی شدهاند. لذا توصیه میشود در مرحله اول برای تشخیص بیماری، بررسی مولکولی یک یا چند جهش خاص شایع به کار رود. بررسی فعالیت فاکتور سیزده نیز در این کشورها میتواند برای تشخیص و طبقهبندی بیماری استفاده گردد(28، 8-6، 1). در برخی مناطق دیگر که آزمایشگاههای مجهز انعقاد وجود دارد، در مرحله اول توصیه میشود از اندازهگیری فعالیت فاکتور سیزده برای غربالگری بیماری استفاده شود. در این مناطق آزمایش حلالیت لخته نباید حتی برای غربالگری استفاده گردد. در نهایت در این کشورها بررسی مولکولی باید برای تایید بیماری استفاده شود. برای بررسی مولکولی ابتدا باید تعیین توالی ژن زیر واحد A انجام شود و در صورتی که جهشی در این زیر واحد شناسایی نشد، توالی ژن زیر واحد B باید به طور کامل تعیین گردد. این رویکرد آزمایشگاهی همراه با بررسی علائم بالینی و نیز بررسی سابقه خانوادگی بیماری میتواند به تشخیص دقیق و به موقع بیماری کمک کرده و از عوارض مرگبار بیماری جلوگیری کند(62، 61، 28).
نتیجهگیری
هر چند کمبود فاکتور سیزده اختلالی خونریزیدهنده با علائم بالینی شدید میباشد اما رویکرد آزمایشگاهی مناسب میتواند منجر به تشخیص به موقع بیماری شده و میزان مرگ و میر را در این بیماران به طور قابل ملاحظهای بکاهد[FA2] .
تشکر و قدردانی
بدینوسیله از بیماران مبتلا به اختلالات خونریزیدهنده که در طرحهای تحقیقاتی همکاری میکنند، قدردانی میگردد.
متن کامل: (7471 مشاهده)
رویکرد عملی در تشخیص آزمایشگاهی و مولکولی کمبود فاکتور سیزده
اکبر درگلاله1، شادی طبیبیان2، یداله فرشی3، مریم سادات حسینی4، محمود شمس5، بهناز توسلی5،
مرضیه شکوری6، فاطمه روشن ضمیر3
چکیده
سابقه و هدف
کمبود فاکتور سیزده، اختلالی خونریزیدهنده با شیوع بسیار پایین بوده که تخمین زده میشود شیوع آن حدود 1 نفر در هر 2 میلیون نفر باشد. تمامی آزمایشهای معمول انعقادی در کمبود فاکتور سیزده طبیعی بوده و این موضوع، تشخیص این اختلال انعقادی را دشوار میسازد. لذا در مطالعه مروری حاضر، یک رویکرد آزمایشگاهی مناسب برای تشخیص کمبود فاکتور سیزده ارائه گردید.
مواد و روشها
مطالب مطالعه مروری حاضر با استفاده از کلمات کلیدی مناسب و به وسیله بررسی 50 مقاله معتبر علمی فارسی و انگلیسی جمعآوری شده است. برخی قسمتهای مقاله بر اساس تجربیات نویسندگان مقاله و بر اساس اطلاعات به دست آمده از بیماران ایرانی مبتلا به کمبود فاکتور سیزده ارایه شد.
یافتهها
آزمایش حلالیت لخته پر کاربردترین آزمایش مورد استفاده برای بررسی کمبود فاکتور سیزده میباشد که حساسیت و اختصاصیت کمی داشته و تحت تاثیر فاکتورهای بسیاری مانند معرف استفاده شده برای منعقد کردن خون و عوامل حل کننده لخته قرار میگیرد. هر چند این آزمایش برای غربالگری کمبود فاکتور سیزده توصیه نمیشود ولی به دلیل استفاده گسترده از این آزمایش، امکان حذف آن وجود ندارد ولی میتوان آزمایش را بهبود بخشید و جهت غربالگری بیماری استفاده کرد. اندازهگیری کمی فعالیت فاکتور سیزده، آزمایشی است که به عنوان خط نخست غربالگری بیماری توصیه میشود. این آزمایش با روشهای مختلفی انجام میشود که در بین آنها روش نورسنجی کاربرد بیشتری داشته، در صورت عدم استفاده از بلانک پلاسما، فعالیت فاکتور سیزده را بیش از حد نشان خواهد داد که در برخی مواقع خطرناک بوده و عواقب مرگباری برای بیمار میتواند به همراه داشته باشد.
نتیجه گیری
کمبود فاکتور سیزده بیماری نادر با عوارض مرگبار میباشد اما رویکرد آزمایشگاهی مناسب منجر به تشخیص به موقع کمبود فاکتور سیزده شده و از تشخیص نادرست بیماری و عواقب ناشی از آن جلوگیری میکند.
کلمات کلیدی: کمبود فاکتور سیزده، خونریزی، تشخیص آزمایشگاهی
تاریخ دریافت: 18/3/94
تاریخ پذیرش: 19/4/95
1- مؤلف مسئول: دانشجـوی دکتـرای تخصصـی هماتولـوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران ـ صندوق پستی: 14155-5983
2- دانشجوی دکترای تخصصی هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
3- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
اکبر درگلاله1، شادی طبیبیان2، یداله فرشی3، مریم سادات حسینی4، محمود شمس5، بهناز توسلی5،
مرضیه شکوری6، فاطمه روشن ضمیر3
چکیده
سابقه و هدف
کمبود فاکتور سیزده، اختلالی خونریزیدهنده با شیوع بسیار پایین بوده که تخمین زده میشود شیوع آن حدود 1 نفر در هر 2 میلیون نفر باشد. تمامی آزمایشهای معمول انعقادی در کمبود فاکتور سیزده طبیعی بوده و این موضوع، تشخیص این اختلال انعقادی را دشوار میسازد. لذا در مطالعه مروری حاضر، یک رویکرد آزمایشگاهی مناسب برای تشخیص کمبود فاکتور سیزده ارائه گردید.
مواد و روشها
مطالب مطالعه مروری حاضر با استفاده از کلمات کلیدی مناسب و به وسیله بررسی 50 مقاله معتبر علمی فارسی و انگلیسی جمعآوری شده است. برخی قسمتهای مقاله بر اساس تجربیات نویسندگان مقاله و بر اساس اطلاعات به دست آمده از بیماران ایرانی مبتلا به کمبود فاکتور سیزده ارایه شد.
یافتهها
آزمایش حلالیت لخته پر کاربردترین آزمایش مورد استفاده برای بررسی کمبود فاکتور سیزده میباشد که حساسیت و اختصاصیت کمی داشته و تحت تاثیر فاکتورهای بسیاری مانند معرف استفاده شده برای منعقد کردن خون و عوامل حل کننده لخته قرار میگیرد. هر چند این آزمایش برای غربالگری کمبود فاکتور سیزده توصیه نمیشود ولی به دلیل استفاده گسترده از این آزمایش، امکان حذف آن وجود ندارد ولی میتوان آزمایش را بهبود بخشید و جهت غربالگری بیماری استفاده کرد. اندازهگیری کمی فعالیت فاکتور سیزده، آزمایشی است که به عنوان خط نخست غربالگری بیماری توصیه میشود. این آزمایش با روشهای مختلفی انجام میشود که در بین آنها روش نورسنجی کاربرد بیشتری داشته، در صورت عدم استفاده از بلانک پلاسما، فعالیت فاکتور سیزده را بیش از حد نشان خواهد داد که در برخی مواقع خطرناک بوده و عواقب مرگباری برای بیمار میتواند به همراه داشته باشد.
نتیجه گیری
کمبود فاکتور سیزده بیماری نادر با عوارض مرگبار میباشد اما رویکرد آزمایشگاهی مناسب منجر به تشخیص به موقع کمبود فاکتور سیزده شده و از تشخیص نادرست بیماری و عواقب ناشی از آن جلوگیری میکند.
کلمات کلیدی: کمبود فاکتور سیزده، خونریزی، تشخیص آزمایشگاهی
تاریخ دریافت: 18/3/94
تاریخ پذیرش: 19/4/95
1- مؤلف مسئول: دانشجـوی دکتـرای تخصصـی هماتولـوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران ـ صندوق پستی: 14155-5983
2- دانشجوی دکترای تخصصی هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
3- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
4- دانشجوی دکترای تخصصی هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
5- دانشجوی دکترای تخصصی هماتولوژی و بانک خون ـ گروه علوم آزمایشگاهی ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی بابل ـ بابل ـ ایران
6- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
5- دانشجوی دکترای تخصصی هماتولوژی و بانک خون ـ گروه علوم آزمایشگاهی ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی بابل ـ بابل ـ ایران
6- کارشناس ارشد هماتولوژی و بانک خون ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
مقدمه
فاکتور سیزده انعقادی(FXIII)، یک پیشآنزیم هتروتترامر میباشد که از دو زیر واحد A ( FXIII-A2) و دو زیر واحد B (FXIII-B2) تشکیل شده است. FXIII-A2 نقش آنزیمی داشته در حالی که FXIII-B2 به عنوان حامل زیر واحد A عمل میکند. کمبود فاکتور سیزده، اختلالی نادر با شیوع 1 نفر به ازای هر 2 میلیون نفر میباشد که علائم بالینی مختلفی از جمله خونریزی طولانی از بند ناف، خونریزی مغزی، تاخیر در التیام زخم، سقط مکرر و خونریزی از بینی دارد(3-1).
تاخیر در تشخیص کمبود فاکتور سیزده موجب بروز مرگ و میر در حدود نیمی از بیماران میگردد(4). تمامی آزمایشهای معمول انعقادی مانند زمان خونروی(BT)، زمان پروترومبین(PT)، زمان ترومبوپلاستین نسبی فعال شده(APTT) و تعداد پلاکت در کمبود فاکتور سیزده، طبیعی میباشند و این موضوع تشخیص بیماری را دشوار میسازد(5-3).
هر چند تشخیص کمبود فاکتور سیزده در تمامی کشورها یک چالش اساسی است اما با معرفی آزمایشهای تشخیصی دقیق مانند بررسی کمی فعالیت فاکتور سیزده و هم چنین بررسی سطح آنتیژنی فاکتور سیزده، تشخیص بیماری با سهولت بیشتری انجام میشود. با این وجود این آزمایشها نیز تحت تاثیر متغیرهای بسیاری قرار میگیرند که آگاهی از این فاکتورها میتواند به تشخیص صحیح بیماری کمک کند(9- 6).
آزمایشهای مولکولی نیز نقش به سزایی در تایید نهایی کمبود فاکتور سیزده دارند و در کشورهایی که این مطالعهها به طور گسترده انجام شدهاند، میتوان از بررسیهای مولکولی برای تشخیص پیش از تولد، شناسایی ناقلین و بیماران استفاده کرد(8).
در مطالعه مروری حاضر به بررسی آزمایشهای کیفی، کمی و مولکولی پرداخته شده و فاکتورهای دخیل در این آزمایشها مورد بررسی قرار گرفتهاند و راهکارهای مناسب جهت بهبود این آزمایشها ارایه شده است تا از عدم تشخیص و تشخیص دیرهنگام و عوارض مرگبار کمبود فاکتور سیزده جلوگیری شود(8 ،4).
نقش فاکتور سیزده در انعقاد:
فاکتور سیزده انعقادی، یک پیش آنزیم بوده و عملکردهای مختلفی دارد. این فاکتور علاوه بر نقش تاثیرگذار در حفظ تعادل انعقادی، در حفظ بارداری، بهبود زخم و رگزایی نیز نقش دارد(12-10). عملکرد مهم انعقادی فاکتور سیزده فعال(FXIIIa)، پایدار کردن لخته و حفاظت از فیبرین تازه شکل گرفته در برابر سیستم فیبرینولیتیکی میباشد(10). علاوه بر ایجاد اتصالات عرضی بین رشتههای سست فیبرین، این فاکتور انعقادی با پیوندهای کووالانسی به پروتئینهای دیگر پلاسما که در ایجاد لخته و فیبرینولیز نقش دارند مثل فیبرین و پلاسمینوژن متصل شده و امکان اتصال آنها را به یکدیگر فراهم میسازد(13-10).
فاکتور سیزده پلاسمایی(pFXIII) متشکل از دو زیر واحد پیشآنزیم A و دو زیر واحد حامل/ حفاظت کننده B میباشد که به صورت غیرکووالانسی به هم متصل شده و ساختـار تترامری(FXIII-A2B2) را تشکیل میدهند(14، 10).
شکل داخل سلولی فاکتور سیزده(cFXIII) به صورت همودایمر متشکل از دو زیر واحد A میباشد که در سیتوپلاسم پلاکت، منوسیت و سلولهای مشتق از منوسیت قرار داشته و در عملکردهای مختلف سلولی از جمله؛ فعالسازی پلاکت، نقل و انتقال مواد در سلولهای مشتق از منوسیت، فاگوسیتوز و یا بیان ژنهای مختلف نقش دارد (15، 10). زیر واحد A از چندین قسمت شامل پپتید فعال، بارل 1 و 2، ناحیه بتاساندویچ و مرکز کاتالیتیک با فعالیت آنزیماتیک تشکیل شده است(شکل 1).
فعالسازی هر دو شکل دایمریک و تترامریک فاکتور سیزده به وسیله فعالیت هماهنگ ترومبین و یون کلسیم صورت میگیرد. پس از هیدرولیز پیوند پپتیدی بین آرژنین 37 و گلیسین 38 در زیر واحد A ، پپتید فعالسازی از انتهای N مولکول جدا شده و در پلاسما آزاد میشود. در حضور یون کلسیم، ترومبین باعث برش پروتئولیتیکی زیر واحد A شده و در پی آن پیوند بین زیر واحد A و B فاکتور سیزده تضعیف شده و در نهایت زیر واحد B جدا میشود(17، 16، 10)(شکل 2) .

شکل 1: ساختار سه بعدی زیر واحد A فاکتور سیزده. این زیر واحد متشکل از پپتید فعال، بتا بارل 1 و 2، بتا ساندویچ و مرکز کاتالیتیک میباشد(2).

شکل 2: فعالسازی فاکتور سیزده. فعالسازی کامل فاکتور سیزده طی دو مرحله انجام میشود: در مرحله نخست، ترومبین پپتید فعال فاکتور سیزده را جدا میکند. در ادامه، کلسیم به فاکتور سیزده متصل شده و منجر به جدا شدن زیر واحد A از زیر واحد B میشود(2).
با تغییر در ساختار کونفورماسیونی دایمر A ، سیستئین به عنوان جایگاه فعال پروتئین که در توالی Tyr-Gly-Gln-Cys-Trp قرار داشته و در مولکول اولیه در دومین هسته اصلی کاتالیزوری پوشیده شده بود، آشکار شده و برای واکنش با سوبسترای خود در دسترس قرار میگیرد. نکته قابل توجه این است که فعالسازی کامل ترانس گلوتامینازی فاکتور سیزده فعال به وسیله آزادسازی پپتید فعالسازی از یکی از دو زیرواحد A از دایمر A2 میتواند صورت گیرد(18-16). در نتیجه جدا شدن زیر واحد B در طی فعالسازی، لخته فیبرین نهایی فاقد زیر واحد B بوده، این در حالی است که هنوز بیش از 90٪ پروتئین FXIII-A در شبکه فیبرینی وجود دارد(19) .
اولین اتصال عرضی ایجاد شده، به ویسله فاکتور سیزده فعال در فیبرین بین دایمر زنجیره گاما(γ) بوده که این اتصال بین لیزین موجود در 406 γیک زنجیره γ و باقی ماندههای گلوتامین در جایگاههای 398γ یا 399γ از زنجیره γ دیگر از دو مولکول فیبرین مجاور در جهت طولی تشکیل میشود. در نتیجه اتصال طولی ناهمسوی دو مولکول فیبرینوژن بین نواحی D ، دایمریزاسیون دو مولکول فیبرینوژن به صورت سریع در 5 تا 10 دقیقه طول میکشد.
اگر چه اتصال عرضی زنجیره آلفا(α) از زنجیره γ کندتر است، ولی باعث افزایش بیشتر استحکام لخته فیبرینی میشود. تعدادی از باقیماندههای زنجیره α همانند لیزین (229،219،208 Lys) و گلوتامین(366، 328، 237، 221 Glu) که در اتصالات عرضی زنجیره α درگیر هستند، منجر به شکلگیری پلیمری با جرم مولکولی بالا میشوند. جهتگیری اتصالات عرضی زنجیره α به صورت عمودی بر رشتههای طولی میباشد(19). اتصالات عرضی زنجیره α قویترین شبکه برای محافظت از لخته فیبرینی در جریان خون با فشار بالا بوده و از تخریب لخته توسط پلاسمین جلوگیری میکند. به طور کلی، تمام این اتصالات عرضی ایجاد شده توسط FXIIIa به طور چشمگیری خصوصیات ویسکوالاستیک لخته فیبرینی را تغییر داده و پس از آن لخته نسبت به لخته اولیه فاقد اتصالات عرضی مقاومتر میشود(21-19). از سوی دیگر پایداری لخته فیبرین در برابر سیستم فیبرینولیز توسط عملکرد فاکتور سیزده افزایش مییابد. علاوه بر این، -α2 آنتی پلاسمین که مهارکننده طبیعی پلاسمین است، بلافاصله پس از پلیمریزه شدن فیبرین به وسیله FXIIIa به زنجیره α فیبرین متصل میشود (21). هم چنین اتصالات عرضی فیبرین، اتصال پلاسمینوژن به فیبرین را کاهش داده و به این ترتیب فعالسازی پلاسمینوژن توسط فعالکننده پلاسمینوژن بافتی (TPA = Tissue plasminogen activator) را کاهش میدهد. نقش فاکتور سیزده پلاکتی کاملاً مشخص نیست اما مشخص شده است که پس از فعال شدن پلاکت، cFXIII ممکن است استحکام لخته فیبرینی را بالا ببرد. پلیمریزه شدن فیبرین نیز بر روی سطح پلاکت فعال تسریع میشود. به طور کلی با توجه به نقش FXIII-A تظاهرات خونریزیدهنده در بیماران مبتلا به کمبود این زیر واحد در مقایسه با بیماران دچار کمبود یا نقص FXIII-B شدیدتر است. بنابراین این موضوع ممکن است نشاندهنده نقش مهم cFXIII در انعقاد باشد. علاوه بر این، فاکتور سیزده در پلاسما و ساباندوتلیوم به سایر پروتئینها مثل فیبرونکتین، فاکتور ونویلبراند، ویترونکتین، کلاژن، فاکتور V انعقادی، ترومبواسپاندین و مهارکننده فعالکننده پلاسمینوژن نیز متصل میشود(23-20).
کمبود فاکتور سیزده
کمبود فاکتور سیزده اختلالی خونریزی دهنده با توارث اتوزوم مغلوب و بسیار نادر میباشد که تخمین زده میشود بروز آن حدود 1 نفر در هر 2 میلیون نفر در جمعیت عمومی باشد. کمبود این فاکتور منجر به نقص در ایجاد اتصالات عرضی کوالانس بین رشتههای فیبرین شده و در پی آن باعث تشکیل لخته ضعیف و ناپایدار میشود. در کمبود فاکتور سیزده، لخته ممکن است به طور طبیعی تشکیل شود اما بعد از 24 تا 48 ساعت، به دلیل اتصالات عرضی ضعیف و یا عدم وجود اتصالات عرضی بین رشتههای فیبرین، لخته سست و ناپایدار تخریب شده و خونریزی بروز مییابد(26-24، 1). کمبود فاکتور سیزده میتواند به علت جهش در ژن زیر واحد (FXIII-A) A و یا زیر واحد(FXIII-B) B رخ دهد، با این وجود، اختلالات مربوط به ژن زیر واحد A شایعتر است(25). بیماران مبتلا به کمبود شدید فاکتور سیزده معمولاً دارای سطح پلاسمایی کمتر از 1٪ فاکتور سیزده بوده و بنابراین دارای تمایل بالقوه برای بروز خونریزی شدید میباشند. تظاهرات بالینی کمبود فاکتور سیزده شامل بهبود تاخیری زخم، سقط مکرر، خونریزیهای شدید خود به خودی و خونریزی داخل جمجمهای به عنوان علت اصلی مرگ و میر در این بیماران است. با تشخیص به موقع بیماری میتوان از پلاسمای تازه منجمد(FFP)، رسوب کرایو، کنسانتره فاکتور سیزده (فیبروگامین) و یا فاکتور سیزده نوترکیب برای درمان این بیماران استفاده کرد(27-25، 1).
تشخیص کمبود فاکتور سیزده:
به دلیل خونریزیهای تهدیدکننده حیات در کمبود فاکتور سیزده، تشخیص بیماری از اهمیت ویژهای برخوردار است. برخی علائم بالینی بیماری میتوانند برای تشخیص بیماری کمککننده باشد. خونریزی طولانی از بند نـاف شایـعترین عـلامت بالینـی در کمبـود فـاکتور سیزده
میباشد که به تشخیص بیماری کمک بسیار زیادی میکند (29، 28، 7-5). خونریزی مغزی، سقط مکرر، خونریزی تاخیری و تاخیر در التیام زخم از دیگر علائم بالینی هستند که به تشخیص بیماری کمک میکنند(27). از آن جا که بیماری به صورت اتوزم مغلوب به ارث میرسد، وجود سابقه فامیلی کمبود فاکتور سیزده نیز به تشخیص بیماری کمک عمدهای میکند. علاوه بر علائم بالینی و سابقه فامیلی، رویکرد آزمایشگاهی مناسب نیز میتواند به تشخیص بیماری کمک کند(30). تمامی آزمایشهای خط اول انعقادی مانند زمان خونروی(BT)، زمان پروترومبین (PT)، زمان ترومبوپلاستین نسبی فعال شده(APTT) و تعداد پلاکت در کمبود فاکتور سیزده طبیعی بوده و بنابراین، تشخیص اولیه این بیماری در بیماران بر پایه آزمون حلالیت لخته در اوره 5 مولار و یا مونوکلریک استیک اسید(MCA) 1٪ میباشد. هم چنین میتوان تشخیص دقیق کمبود فاکتور سیزده را با اندازهگیری فعالیت و سنجش سطوح آنتیژنی فاکتور سیزده انجام داده و با بررسی مولکولی و جهش عامل بیماری در ژن زیر واحد A یا B ، کمبود فاکتور سیزده را تایید کرد(30-27). برای سنجش فاکتور سیزده مانند سایر آزمایشهای انعقادی، نمونه باید صبح زود جمعآوری شود. لوله آزمایش باید با رعایت نسبت ضد انعقاد و خون، با مخلوط کردن 1 حجم از سیترات سدیم و 9 حجم از خون، تهیه شود. باید توجه شود که حداقل 90% از حجم لوله پر شود زیرا در صورت عدم پر شدن این حجم، رقیق شدن قابل توجه نمونه و در نتیجه نتایج منفی کاذب را به دنبال خواهد داشت. در مواردی که سطح هماتوکریت بالاتر از 55% میباشد، حجم ضد انعقاد باید مطابق با آن تنظیم گردد. در صورتی که نیاز به ذخیرهسازی طولانی مدت نمونه باشد، نمونه را در منفی 24 درجه یا کمتر به مدت 3 ماه یا در منفی 74 درجه سانتیگراد برای حداکثر 18 ماه میتوان نگهداری نمود. نمونه فریز شده را باید در 37 درجه سانتیگراد برای مدت 3 تا 5 دقیقه بلافاصله قبل از سنجش فاکتور سیزده ذوب نمود(32، 31). کمیته بینالمللی ISTH (International Society on Thrombosis and Haemostasis) برای تشخیص و طبقـهبنـدی کمبود فاکتور
13 ، الگوریتمی توصیه کرده که به صورت زیر است:
1- آزمایش کمی فعالیت عملکردی فاکتور سیزده به عنوان
خط اول برای تشخیص کمبود فاکتور سیزده درخواست میشود. این آزمایش قادر به تشخیص تمامی حالات کمبود فاکتور سیزده میباشد. در نتیجه، اگر فعالیت فاکتور سیزده کاهش یابد، بررسیهای بیشتری برای تشخیص و طبقهبندی کمبود فاکتور سیزده توصیه میشود.
2- سطح آنتیژنی فاکتور سیزده(A2B2) در پلاسما اندازهگیری میشود. اگر غلظت آنتیژن آن کاهش یابد، بررسیهای بیشتری برای تعیین کمبود زیرگونههای فاکتور سیزده باید انجام گیرد. ابتدا سطح آنتیژنی زیر واحدهای A و B اندازهگیری میشود. برای شناسایی کمبود فاکتور سیزده نوع پلاکتی، میزان فعالیت و سطح آنتیژنی زیر واحد A در لیزات پلاکت باید بررسی شود.
3- برای تشخیص اتوآنتیبادی علیه زیر واحدهای فاکتور سیزده ، روش مخلوط کردن پلاسما (mixing study) و روش اتصال شونده(Binding assay) باید انجام شود. روش مخلوط کردن پلاسما و روش اتصال شونده باید به ترتیب برای تشخیص آنتیبادیهای خنثی کننده علیه زیر واحد A و آنتیبادیهای غیر خنثیکننده علیه زیر واحد B انجام گیرد.
4- اگر تمام آزمایشها فوق طبیعی بودند، آزمایشهای اضافی مانند الکتروفورز پروتئین برروی ژل سدیم دو دسیل سولفات- پلیآکریل آمید (SDS-PAGE = Sodium Dodecylsulfate-polyacrylamide) انجام میگیرد.
5- در نهایت شناسایی مولکولی نقص ژنتیکی فاکتور سیزده توصیه میشود (29).
آزمایشهای غربالگری خط اول:
آزمایشهای غربالگری خط اول شامل آزمایشهای BT ، PT ، APTT و تعداد پلاکت میباشد. اگر چه آزمایشهای PT و APTT معمولترین آزمایشهای انعقادی در آزمایشگاه انعقاد هستند، ولی برای ارزیابی کمبود فاکتور انعقادی بسیار حساس نیستند، با این وجود این آزمایشهای معمول انعقادی باید به عنوان گام نخست در تشخیص آزمایشگاهی اختلالات خونریزیدهنده مورد استفاده قرار گیرد. همه این آزمایشهای معمول آزمایشگاهی در بیماران مبتلا به کمبود فاکتور سیزده طبیعی هستند(7-5).
زمان پروترومبین:
در طی روند آزمایشگاهی، PT پلاسمای فقیر از پلاکت با ترومبوپلاستین(فاکتور بافتی) و کلرید کلسیم مخلوط شده سپس زمان لخته شدن خون اندازهگیری میشود. این آزمایش فاکتورهای انعقادی درگیر در مسیر خارجی (فاکتور VII) و مشترک (فاکتور X، V، II و فیبرینوژن) آبشار انعقادی را ارزیابی کرده و نیز برای ارزیابی درمان با وارفارین استفاده میشود.
به دلیل حساسیت متفاوت معرفهای ترومبوپلاستین تجاری، به منظور حل مشکل تفاوت در نتایج PT در میان آزمایشگاههای مختلف، INR (International normalized ratio) توسط سازمان بهداشت جهانی(WHO) معرفی شده است. تفاوت بین ترومبوپلاستین استاندارد تهیه شده توسط WHO و معرفهای ترومبوپلاستین تجاری به عنوان شاخص بینالمللی حساسیت(ISI = International Sensitivity Index) تعریف شده و INR به این روش محاسبه میشود(33):
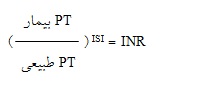
زمان ترومبوپلاستین نسبی فعال شده:
آزمایش APTT طولانی در کمبود فاکتورهای درگیر در مسیر مشترک(X، V، II و فیبرینوژن) و فاکتورهای دخیل در مسیر درونی(XI، IX و VIII) آبشار انعقاد و نیز در طول درمان با هپارین مشاهده میشود(35، 34). در این آزمایش PPP (Platelet poor plasma) با معرف APTT (شامل؛ ترومبوپلاستین نسبی و عوامل لختهکننده مانند کائولین، سیلیس میکرونیزه شده و اسید الاجیک) و کلسیم در 37 درجه سانتیگراد مخلوط شده و سپس زمان تشکیـل لختـه
اندازهگیری میشود(35).
زمان خونروی:
زمان خونروی اگر چه ، جزء اولین آزمایشهای غربالگری برای عملکرد پلاکت و سنجش فاکتور فونویلبراند بود ولی از آن جایی که این آزمایش دارای اشکالات متعددی است، امروزه کمتر انجام شده و به عنوان یک آزمایش بالینی توصیه نمیشود. این آزمایش با چندین روش مختلف شامل؛ روش Duck ، IVY و زمان خونروی Template (TBT) انجام میشود(36).
این آزمایش تحت تاثیر عوامل مختلفی از جمله؛ فرد آزمایشکننده، دمای پوست، فشار وریدی، جهت، عمق و وسعت زخم قرار دارد. از آن جایی که برخی از عوامل ذکر شده مانند فشار وریدی، جهت، طول و عمق برش در روش TBT استاندارد شده، این روش میان روشهای مختلف آزمایش زمان خونروی قابل قبولتر میباشد(37، 36).
شمارش پلاکت:
شمارش پلاکت در محدوده 103 × 450-150 بر میکرولیتر میباشد. کاهش در شمارش پلاکت ممکن است که با افزایش خطر خونریزی همراه باشد.
گرچه اغلب موارد کاهش در تعداد پلاکت شمارش شده به علت کاهش واقعی تعداد پلاکت در خون است، ولی ترومبوسیتوپنی کاذب از مشکلات شایع در آزمایشگاه هماتولوژی بوده و ممکن است در اثر عوامل مختلفی روی دهد(39، 38).
از جمله این عوامل میتوان به آگلوتیناسیون پلاکتی، اتصال پلاکت به نوتروفیل و سندرمهای ماکروترومبوسیتوپنی کاذب اشاره کرد. بنابراین بررسی لام خون محیطی در تشخیص این موارد میتواند کمککننده باشد(41، 40). گرچه آزمایشهای معمول انعقادی در تشخیص بسیاری از موارد کمبود فاکتورهای انعقادی مؤثر هستند، اما نتایج حاصل از این آزمایشها در کمبود فاکتور سیزده طبیعی بوده و بنابراین این آزمایشها قادر به تشخیص کمبود فاکتور سیزده نیستند(42).
آزمایش حلالیت لخته:
روش حلالیت لخته نخستین گام برای تشخیص کمبود فاکتور سیزده بوده و اولین مورد کمبود فاکتور سیزده توسط این روش در سال 1960 تشخیص داده شد. آزمایش حلالیت لخته در محلولهای اوره، اسید استیک یا MCA برای غربالگری کمبود فاکتور سیزده استفاده شدهاند. آزمایش حلالیت اوره و مونوکلریک استیک اسید به طور معمول به منظور تشخیص کمبود فاکتور سیزده استفاده میشوند(44، 43، 8-4). روش استانداردی برای آزمایش حلالیت لخته وجود نداشته و روشهای مختلف برای انجام این آزمایش معرفی شدهاند. در ابتدا، 9 حجم از کل خون با 1 حجم ضد انعقاد سیترات سدیم 2/3% مخلوط شده و پس از جدا کردن پلاسما، کلرید کلسیم با یا بدون ترومبین و بافر به پلاسما اضافه میشود و سپس محلول برای تشکیل لخته، یک ساعت در دمای اتاق یا 37 درجه سانتیگراد انکوبه میشود. سپس لخته ایجاد شده در محلول اوره 5 مولار یا MCA معلق شده و سپس در دمای اتاق یا 37 درجه سانتیگراد انکوبه میشود. سپس، حل شدن لخته به طور منظم در 15 دقیقه، 1 و 24 ساعت مورد بررسی قرار میگیرد. در نمونه دارای کمبود فاکتور سیزده، لخته عمدتاً در عرض چند دقیقه تا یک ساعت حل میشود، اما در نمونه طبیعی، لخته حدود 1 روز پایدار است. در روش مبتنی بر اسید استیک، لخته شکل گرفته در محلول استیک اسید معلق شده و سپس به مدت 6 ساعت انکوبه میشود. در روش نیمه کمی برای تشخیص کمبود فاکتور سیزده، نمونه پلاسما با اضافه کردن ترومبین لخته شده، و سپس لخته در رقتهای مختلف محلول اوره و یا MCA معلق میشود(8، 7). قبلاً آزمایش حلالیت لخته در محلول MCA برای شناسایی میزان فعالیت فاکتور سیزده انجام میشده است. در این روش، پلاسمای رقیق شده با فاکتور سیزده تهی از فیبرینوژن مخلوط شده، سپس پلاسما با افزودن ترومبین و کلرید کلسیم(CaCl2) لخته میشود و سپس حل شدن لخته به وسیله اضافه کردن MCA 1% بررسی میشود(45، 43).
آزمایش حلالیت لخته روش کیفی بوده و فقط قادر به تشخیص نوع شدید کمبود فاکتور سیزده میباشد. آزمایش حلالیت اوره و MCA در صورتی مثبت خواهند شد که سطح فاکتور سیزده پلاسمایی خیلی اندک باشد(تقریباً 1٪)، در حالی که حساسیت آزمایش حلالیت استیک اسید حدود 2 برابر بیشتر از آزمایش اوره و مونوکلریک استیک اسید میباشد. اگر چه، آزمایش حلالیت استیک اسید حساستر و سریعتر از آزمایش حلالیت در محیط اوره است، اما اختصاصیت کمتری داشته و مشاهده شده است که پلاسمای عادی تقریباً بعد از 4 روز در استیک اسید حل میشود در حالی که هرگز در روش حلالیت در اوره این حالت رخ نمیدهد(43، 8، 7). در روش معمول حلالیت لخته، اگر سطح فاکتور سیزده بیش از 2٪ باشد، ممکن است که بیماران مبتلا به کمبود فاکتور سیزده به اشتباه طبیعی در نظر گرفته شوند(28).
محدودیتهای آزمایش حلالیت لخته:
آزمایش حلالیت لخته استاندارد نبوده و بررسیهای بیشتر الزامی است. حساسیت این آزمایش بسته به سطح فیبرینوژن، معرف استفاده شده برای منعقد کردن خون (یون کلسیم، ترومبین و غیره) و عوامل حل کننده لخته (مونوکلریک استیک اسید، استیک اسید و اوره 5 مولار) متفاوت است. به کارگیری ترکیبی از استیک اسید/ ترومبین، استیک اسید/کلسیم، و هم چنین اوره/ کلسیم، و اوره/ترومبین ممکن است تغییر در میزان حساسیت نسبی سنجش حلالیت لخته داشته باشد. حساسیت روش اوره/ کلسیم مورد تردید بوده و اتفاق نظری در متون وجود ندارد(7، 6). از طرف دیگر سطح آستانه تشخیصی فاکتور سیزده توسط ژاکوبسن و گدال در سال 1974حدود 5%-3%، توسط فرانسیس در سال 1980 کمتر از 5/0٪ و توسط جنینگز و همکارانش در سال 2003 در حدود 5%-1% گزارش شده است. جنینگز و همکارانش هم چنین گزارش کردند که روش ترومبین/ استیک اسید حداقل به 10% از فاکتور سیزده حساس بوده، در حالی که حساسیت روش کلسیم/استیک اسید و ترومبین/ اوره متوسط میباشد. فرانسیس در سال 1980 گزارش داد که آستانه سطح شناسایی فاکتور سیزده در پلاسما توسط روش استیک اسید/ کلسیم محدود به صفر تا 3 درصد است(44، 7، 6). اطلاعات گزارش شده توسط پیهونگ و همکارانش در سال 2014 نشان داد که آزمایش حلالیت لخته مرسوم، فقط قادر به تشخیص 16% از بیماران با سطح فاکتور سیزده پلاسمایی کمتر از 2% میباشد، در حالی که استفاده از روش ترومبین میتوانست شناسایی بهتری داشته باشد. در مطالعه پیهونگ، نمونه با سطح 1% از سطح فاکتور سیزده نیز در روشهای مرسوم دقیقتر از نمونه با سطح 2% فاکتور سیزده تشخیص داده شد(46). بیماران مبتلا به هیپرفیبرینولیز باید کنار گذاشته شوند چرا که این وضعیت مانع از شکلگیری و تثبیت لخته خونی میشود. به طور کلی، آزمایش حلالیت لخته با استفاده از ترومبین به خصوص روش ترکیبی ترومبین/استیک اسید حساستر هستند. باید در نظر داشت که این روش قادر به افتراق بین فرم شدید بیماری از حالت متوسط یا خفیف، هتروزیگوت از هموزیگوت و فرم اکتسابی از فرم ارثی نمیباشد. به دلیل مقدار کم مهارکننده فاکتور سیزده، میزان فعالیت فاکتور سیزده کمتر از 1% کاهش نمییابد، بنابراین موارد با این وضعیت به وسیله این آزمایش به خوبی تشخیص داده نمیشوند(8-6). به علاوه تجویز فاکتور سیزده طی چند هفته قبل از انجام آزمایش، نتایج این آزمایش را طبیعی نشان میدهد. بنابراین با توجه به بالا بودن تعداد تشخیص داده نشده و یا دیر تشخیص داده از موارد کمبود فاکتور سیزده، این روش به عنوان یک آزمایش غربالگری روزمره توصیه نمیشود(8).
آزمایش کمی در تشخیص آزمایشگاهی کمبود فاکتور سیزده(سنجش فعالیت و آنتیژنی فاکتور):
در صورتی که بیمار با آزمایش کیفی، مشکوک به کمبود فاکتور سیزده باشد، برای تایید و طبقهبندی بیماری باید از اندازهگیری کمی فعالیت فاکتور سیزده استفاده شود. اندازهگیری کمی فاکتور سیزده روش ارجح برای غربالگری و تشخیص کمبود فاکتور سیزده میباشد زیرا قادر به تشخیص فرم اکتسابی و ارثی بیماری است، بنابراین برای تشخیص دقیق بیماری استفاده میشود(9، 8). روشهایی که برای اندازهگیری فعالیت فاکتور سیزده استفاده میشوند، عبارتند از:
1- سنجش فتومتری:
ایـن روش بـر پایـه آزادسـازی آمونیاک در مرحله اول
واکنش ترانس گلوتامیناز فاکتور سیزده میباشد. در این روش، زیر واحد A فاکتور سیزده سوبسترای با وزن مولکولی کم را با الیگونوکلئوتید حاوی گلوتامین اتصال متقاطع میدهد. سپس آمونیاک در طول این واکنش آزاد شده و با واکنش وابسته به [NAD(P) = Nicotinamide adenine dinucleotide (phosphate)) [ به صورت نورسنجی سنجش میشود. کاهش در جذب نوری، نشانگر کمبود فاکتور سیزده است. این روش به سرعت انجام میشود، در آنالیزرهای انعقاد به راحتی قابل برنامهریزی است، قادر به پایش یک واکنش در 340 نانومتر بوده و روش یک مرحلهای سنتتیک واقعی است، اما بزرگترین ایراد این روش، حساسیت نسبتا پایین آن بوده که محدوده تشخیص در حدود 5%-3% میباشد(47، 8، 5). علاوه بر این عدم وجود نمونه بلانک در روشهای تجاری، منجر به کاهش دقت آنها میشود. نمونه پلاسمای بلانک برای اصلاح برخی از واکنشهای آمونیاک تولیدی و NADH مصرفی، مستقل از زیر واحد A فاکتور سیزده موجود در پلاسما ضروری است. در غیر این صورت، بدون استفاده از نمونه بلانک، فعالیت فاکتور سیزده به اشتباه بیشتر تشخیص داده خواهد شد(45، 20). تخمین بیش از حد در مواردی با محدوده طبیعی فاکتور سیزده نمیتواند مشکلی ایجاد کند، اما در کمبود شدید فاکتور بسیار تاثیرگذار خواهد بود(45). رایجترین کیتهای در دسترس برای این روش شامل؛ بریکروم فاکتور سیزده(دید بهرینگ، آلمان)، REA - کروم فاکتور سیزده(رینال، مجارستان) و تکنوکروم فاکتور سیزده (تکنوکلون، اتریش) میباشند(8).
مزایا ومعایب روش فتومتریک:
از آن جایی که مقدار کمی از فاکتور سیزده(10%-5%) برای حفظ هموستاز کافی است، تخمین زیاد در سطح فاکتور ممکن است که عواقب بالینی داشته باشد(45، 8-6). هماننـد مطالعـه لیـم و همکارانش، نتایـج گزارش شده نشـان دادند که سطح فعالیت فاکتور سیزده در بیماران دارای کمبـود شدیـد(2% >) در محدوده 14%-8% با روش
اولین اتصال عرضی ایجاد شده، به ویسله فاکتور سیزده فعال در فیبرین بین دایمر زنجیره گاما(γ) بوده که این اتصال بین لیزین موجود در 406 γیک زنجیره γ و باقی ماندههای گلوتامین در جایگاههای 398γ یا 399γ از زنجیره γ دیگر از دو مولکول فیبرین مجاور در جهت طولی تشکیل میشود. در نتیجه اتصال طولی ناهمسوی دو مولکول فیبرینوژن بین نواحی D ، دایمریزاسیون دو مولکول فیبرینوژن به صورت سریع در 5 تا 10 دقیقه طول میکشد.
اگر چه اتصال عرضی زنجیره آلفا(α) از زنجیره γ کندتر است، ولی باعث افزایش بیشتر استحکام لخته فیبرینی میشود. تعدادی از باقیماندههای زنجیره α همانند لیزین (229،219،208 Lys) و گلوتامین(366، 328، 237، 221 Glu) که در اتصالات عرضی زنجیره α درگیر هستند، منجر به شکلگیری پلیمری با جرم مولکولی بالا میشوند. جهتگیری اتصالات عرضی زنجیره α به صورت عمودی بر رشتههای طولی میباشد(19). اتصالات عرضی زنجیره α قویترین شبکه برای محافظت از لخته فیبرینی در جریان خون با فشار بالا بوده و از تخریب لخته توسط پلاسمین جلوگیری میکند. به طور کلی، تمام این اتصالات عرضی ایجاد شده توسط FXIIIa به طور چشمگیری خصوصیات ویسکوالاستیک لخته فیبرینی را تغییر داده و پس از آن لخته نسبت به لخته اولیه فاقد اتصالات عرضی مقاومتر میشود(21-19). از سوی دیگر پایداری لخته فیبرین در برابر سیستم فیبرینولیز توسط عملکرد فاکتور سیزده افزایش مییابد. علاوه بر این، -α2 آنتی پلاسمین که مهارکننده طبیعی پلاسمین است، بلافاصله پس از پلیمریزه شدن فیبرین به وسیله FXIIIa به زنجیره α فیبرین متصل میشود (21). هم چنین اتصالات عرضی فیبرین، اتصال پلاسمینوژن به فیبرین را کاهش داده و به این ترتیب فعالسازی پلاسمینوژن توسط فعالکننده پلاسمینوژن بافتی (TPA = Tissue plasminogen activator) را کاهش میدهد. نقش فاکتور سیزده پلاکتی کاملاً مشخص نیست اما مشخص شده است که پس از فعال شدن پلاکت، cFXIII ممکن است استحکام لخته فیبرینی را بالا ببرد. پلیمریزه شدن فیبرین نیز بر روی سطح پلاکت فعال تسریع میشود. به طور کلی با توجه به نقش FXIII-A تظاهرات خونریزیدهنده در بیماران مبتلا به کمبود این زیر واحد در مقایسه با بیماران دچار کمبود یا نقص FXIII-B شدیدتر است. بنابراین این موضوع ممکن است نشاندهنده نقش مهم cFXIII در انعقاد باشد. علاوه بر این، فاکتور سیزده در پلاسما و ساباندوتلیوم به سایر پروتئینها مثل فیبرونکتین، فاکتور ونویلبراند، ویترونکتین، کلاژن، فاکتور V انعقادی، ترومبواسپاندین و مهارکننده فعالکننده پلاسمینوژن نیز متصل میشود(23-20).
کمبود فاکتور سیزده
کمبود فاکتور سیزده اختلالی خونریزی دهنده با توارث اتوزوم مغلوب و بسیار نادر میباشد که تخمین زده میشود بروز آن حدود 1 نفر در هر 2 میلیون نفر در جمعیت عمومی باشد. کمبود این فاکتور منجر به نقص در ایجاد اتصالات عرضی کوالانس بین رشتههای فیبرین شده و در پی آن باعث تشکیل لخته ضعیف و ناپایدار میشود. در کمبود فاکتور سیزده، لخته ممکن است به طور طبیعی تشکیل شود اما بعد از 24 تا 48 ساعت، به دلیل اتصالات عرضی ضعیف و یا عدم وجود اتصالات عرضی بین رشتههای فیبرین، لخته سست و ناپایدار تخریب شده و خونریزی بروز مییابد(26-24، 1). کمبود فاکتور سیزده میتواند به علت جهش در ژن زیر واحد (FXIII-A) A و یا زیر واحد(FXIII-B) B رخ دهد، با این وجود، اختلالات مربوط به ژن زیر واحد A شایعتر است(25). بیماران مبتلا به کمبود شدید فاکتور سیزده معمولاً دارای سطح پلاسمایی کمتر از 1٪ فاکتور سیزده بوده و بنابراین دارای تمایل بالقوه برای بروز خونریزی شدید میباشند. تظاهرات بالینی کمبود فاکتور سیزده شامل بهبود تاخیری زخم، سقط مکرر، خونریزیهای شدید خود به خودی و خونریزی داخل جمجمهای به عنوان علت اصلی مرگ و میر در این بیماران است. با تشخیص به موقع بیماری میتوان از پلاسمای تازه منجمد(FFP)، رسوب کرایو، کنسانتره فاکتور سیزده (فیبروگامین) و یا فاکتور سیزده نوترکیب برای درمان این بیماران استفاده کرد(27-25، 1).
تشخیص کمبود فاکتور سیزده:
به دلیل خونریزیهای تهدیدکننده حیات در کمبود فاکتور سیزده، تشخیص بیماری از اهمیت ویژهای برخوردار است. برخی علائم بالینی بیماری میتوانند برای تشخیص بیماری کمککننده باشد. خونریزی طولانی از بند نـاف شایـعترین عـلامت بالینـی در کمبـود فـاکتور سیزده
میباشد که به تشخیص بیماری کمک بسیار زیادی میکند (29، 28، 7-5). خونریزی مغزی، سقط مکرر، خونریزی تاخیری و تاخیر در التیام زخم از دیگر علائم بالینی هستند که به تشخیص بیماری کمک میکنند(27). از آن جا که بیماری به صورت اتوزم مغلوب به ارث میرسد، وجود سابقه فامیلی کمبود فاکتور سیزده نیز به تشخیص بیماری کمک عمدهای میکند. علاوه بر علائم بالینی و سابقه فامیلی، رویکرد آزمایشگاهی مناسب نیز میتواند به تشخیص بیماری کمک کند(30). تمامی آزمایشهای خط اول انعقادی مانند زمان خونروی(BT)، زمان پروترومبین (PT)، زمان ترومبوپلاستین نسبی فعال شده(APTT) و تعداد پلاکت در کمبود فاکتور سیزده طبیعی بوده و بنابراین، تشخیص اولیه این بیماری در بیماران بر پایه آزمون حلالیت لخته در اوره 5 مولار و یا مونوکلریک استیک اسید(MCA) 1٪ میباشد. هم چنین میتوان تشخیص دقیق کمبود فاکتور سیزده را با اندازهگیری فعالیت و سنجش سطوح آنتیژنی فاکتور سیزده انجام داده و با بررسی مولکولی و جهش عامل بیماری در ژن زیر واحد A یا B ، کمبود فاکتور سیزده را تایید کرد(30-27). برای سنجش فاکتور سیزده مانند سایر آزمایشهای انعقادی، نمونه باید صبح زود جمعآوری شود. لوله آزمایش باید با رعایت نسبت ضد انعقاد و خون، با مخلوط کردن 1 حجم از سیترات سدیم و 9 حجم از خون، تهیه شود. باید توجه شود که حداقل 90% از حجم لوله پر شود زیرا در صورت عدم پر شدن این حجم، رقیق شدن قابل توجه نمونه و در نتیجه نتایج منفی کاذب را به دنبال خواهد داشت. در مواردی که سطح هماتوکریت بالاتر از 55% میباشد، حجم ضد انعقاد باید مطابق با آن تنظیم گردد. در صورتی که نیاز به ذخیرهسازی طولانی مدت نمونه باشد، نمونه را در منفی 24 درجه یا کمتر به مدت 3 ماه یا در منفی 74 درجه سانتیگراد برای حداکثر 18 ماه میتوان نگهداری نمود. نمونه فریز شده را باید در 37 درجه سانتیگراد برای مدت 3 تا 5 دقیقه بلافاصله قبل از سنجش فاکتور سیزده ذوب نمود(32، 31). کمیته بینالمللی ISTH (International Society on Thrombosis and Haemostasis) برای تشخیص و طبقـهبنـدی کمبود فاکتور
13 ، الگوریتمی توصیه کرده که به صورت زیر است:
1- آزمایش کمی فعالیت عملکردی فاکتور سیزده به عنوان
خط اول برای تشخیص کمبود فاکتور سیزده درخواست میشود. این آزمایش قادر به تشخیص تمامی حالات کمبود فاکتور سیزده میباشد. در نتیجه، اگر فعالیت فاکتور سیزده کاهش یابد، بررسیهای بیشتری برای تشخیص و طبقهبندی کمبود فاکتور سیزده توصیه میشود.
2- سطح آنتیژنی فاکتور سیزده(A2B2) در پلاسما اندازهگیری میشود. اگر غلظت آنتیژن آن کاهش یابد، بررسیهای بیشتری برای تعیین کمبود زیرگونههای فاکتور سیزده باید انجام گیرد. ابتدا سطح آنتیژنی زیر واحدهای A و B اندازهگیری میشود. برای شناسایی کمبود فاکتور سیزده نوع پلاکتی، میزان فعالیت و سطح آنتیژنی زیر واحد A در لیزات پلاکت باید بررسی شود.
3- برای تشخیص اتوآنتیبادی علیه زیر واحدهای فاکتور سیزده ، روش مخلوط کردن پلاسما (mixing study) و روش اتصال شونده(Binding assay) باید انجام شود. روش مخلوط کردن پلاسما و روش اتصال شونده باید به ترتیب برای تشخیص آنتیبادیهای خنثی کننده علیه زیر واحد A و آنتیبادیهای غیر خنثیکننده علیه زیر واحد B انجام گیرد.
4- اگر تمام آزمایشها فوق طبیعی بودند، آزمایشهای اضافی مانند الکتروفورز پروتئین برروی ژل سدیم دو دسیل سولفات- پلیآکریل آمید (SDS-PAGE = Sodium Dodecylsulfate-polyacrylamide) انجام میگیرد.
5- در نهایت شناسایی مولکولی نقص ژنتیکی فاکتور سیزده توصیه میشود (29).
آزمایشهای غربالگری خط اول:
آزمایشهای غربالگری خط اول شامل آزمایشهای BT ، PT ، APTT و تعداد پلاکت میباشد. اگر چه آزمایشهای PT و APTT معمولترین آزمایشهای انعقادی در آزمایشگاه انعقاد هستند، ولی برای ارزیابی کمبود فاکتور انعقادی بسیار حساس نیستند، با این وجود این آزمایشهای معمول انعقادی باید به عنوان گام نخست در تشخیص آزمایشگاهی اختلالات خونریزیدهنده مورد استفاده قرار گیرد. همه این آزمایشهای معمول آزمایشگاهی در بیماران مبتلا به کمبود فاکتور سیزده طبیعی هستند(7-5).
زمان پروترومبین:
در طی روند آزمایشگاهی، PT پلاسمای فقیر از پلاکت با ترومبوپلاستین(فاکتور بافتی) و کلرید کلسیم مخلوط شده سپس زمان لخته شدن خون اندازهگیری میشود. این آزمایش فاکتورهای انعقادی درگیر در مسیر خارجی (فاکتور VII) و مشترک (فاکتور X، V، II و فیبرینوژن) آبشار انعقادی را ارزیابی کرده و نیز برای ارزیابی درمان با وارفارین استفاده میشود.
به دلیل حساسیت متفاوت معرفهای ترومبوپلاستین تجاری، به منظور حل مشکل تفاوت در نتایج PT در میان آزمایشگاههای مختلف، INR (International normalized ratio) توسط سازمان بهداشت جهانی(WHO) معرفی شده است. تفاوت بین ترومبوپلاستین استاندارد تهیه شده توسط WHO و معرفهای ترومبوپلاستین تجاری به عنوان شاخص بینالمللی حساسیت(ISI = International Sensitivity Index) تعریف شده و INR به این روش محاسبه میشود(33):
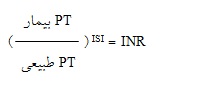
زمان ترومبوپلاستین نسبی فعال شده:
آزمایش APTT طولانی در کمبود فاکتورهای درگیر در مسیر مشترک(X، V، II و فیبرینوژن) و فاکتورهای دخیل در مسیر درونی(XI، IX و VIII) آبشار انعقاد و نیز در طول درمان با هپارین مشاهده میشود(35، 34). در این آزمایش PPP (Platelet poor plasma) با معرف APTT (شامل؛ ترومبوپلاستین نسبی و عوامل لختهکننده مانند کائولین، سیلیس میکرونیزه شده و اسید الاجیک) و کلسیم در 37 درجه سانتیگراد مخلوط شده و سپس زمان تشکیـل لختـه
اندازهگیری میشود(35).
زمان خونروی:
زمان خونروی اگر چه ، جزء اولین آزمایشهای غربالگری برای عملکرد پلاکت و سنجش فاکتور فونویلبراند بود ولی از آن جایی که این آزمایش دارای اشکالات متعددی است، امروزه کمتر انجام شده و به عنوان یک آزمایش بالینی توصیه نمیشود. این آزمایش با چندین روش مختلف شامل؛ روش Duck ، IVY و زمان خونروی Template (TBT) انجام میشود(36).
این آزمایش تحت تاثیر عوامل مختلفی از جمله؛ فرد آزمایشکننده، دمای پوست، فشار وریدی، جهت، عمق و وسعت زخم قرار دارد. از آن جایی که برخی از عوامل ذکر شده مانند فشار وریدی، جهت، طول و عمق برش در روش TBT استاندارد شده، این روش میان روشهای مختلف آزمایش زمان خونروی قابل قبولتر میباشد(37، 36).
شمارش پلاکت:
شمارش پلاکت در محدوده 103 × 450-150 بر میکرولیتر میباشد. کاهش در شمارش پلاکت ممکن است که با افزایش خطر خونریزی همراه باشد.
گرچه اغلب موارد کاهش در تعداد پلاکت شمارش شده به علت کاهش واقعی تعداد پلاکت در خون است، ولی ترومبوسیتوپنی کاذب از مشکلات شایع در آزمایشگاه هماتولوژی بوده و ممکن است در اثر عوامل مختلفی روی دهد(39، 38).
از جمله این عوامل میتوان به آگلوتیناسیون پلاکتی، اتصال پلاکت به نوتروفیل و سندرمهای ماکروترومبوسیتوپنی کاذب اشاره کرد. بنابراین بررسی لام خون محیطی در تشخیص این موارد میتواند کمککننده باشد(41، 40). گرچه آزمایشهای معمول انعقادی در تشخیص بسیاری از موارد کمبود فاکتورهای انعقادی مؤثر هستند، اما نتایج حاصل از این آزمایشها در کمبود فاکتور سیزده طبیعی بوده و بنابراین این آزمایشها قادر به تشخیص کمبود فاکتور سیزده نیستند(42).
آزمایش حلالیت لخته:
روش حلالیت لخته نخستین گام برای تشخیص کمبود فاکتور سیزده بوده و اولین مورد کمبود فاکتور سیزده توسط این روش در سال 1960 تشخیص داده شد. آزمایش حلالیت لخته در محلولهای اوره، اسید استیک یا MCA برای غربالگری کمبود فاکتور سیزده استفاده شدهاند. آزمایش حلالیت اوره و مونوکلریک استیک اسید به طور معمول به منظور تشخیص کمبود فاکتور سیزده استفاده میشوند(44، 43، 8-4). روش استانداردی برای آزمایش حلالیت لخته وجود نداشته و روشهای مختلف برای انجام این آزمایش معرفی شدهاند. در ابتدا، 9 حجم از کل خون با 1 حجم ضد انعقاد سیترات سدیم 2/3% مخلوط شده و پس از جدا کردن پلاسما، کلرید کلسیم با یا بدون ترومبین و بافر به پلاسما اضافه میشود و سپس محلول برای تشکیل لخته، یک ساعت در دمای اتاق یا 37 درجه سانتیگراد انکوبه میشود. سپس لخته ایجاد شده در محلول اوره 5 مولار یا MCA معلق شده و سپس در دمای اتاق یا 37 درجه سانتیگراد انکوبه میشود. سپس، حل شدن لخته به طور منظم در 15 دقیقه، 1 و 24 ساعت مورد بررسی قرار میگیرد. در نمونه دارای کمبود فاکتور سیزده، لخته عمدتاً در عرض چند دقیقه تا یک ساعت حل میشود، اما در نمونه طبیعی، لخته حدود 1 روز پایدار است. در روش مبتنی بر اسید استیک، لخته شکل گرفته در محلول استیک اسید معلق شده و سپس به مدت 6 ساعت انکوبه میشود. در روش نیمه کمی برای تشخیص کمبود فاکتور سیزده، نمونه پلاسما با اضافه کردن ترومبین لخته شده، و سپس لخته در رقتهای مختلف محلول اوره و یا MCA معلق میشود(8، 7). قبلاً آزمایش حلالیت لخته در محلول MCA برای شناسایی میزان فعالیت فاکتور سیزده انجام میشده است. در این روش، پلاسمای رقیق شده با فاکتور سیزده تهی از فیبرینوژن مخلوط شده، سپس پلاسما با افزودن ترومبین و کلرید کلسیم(CaCl2) لخته میشود و سپس حل شدن لخته به وسیله اضافه کردن MCA 1% بررسی میشود(45، 43).
آزمایش حلالیت لخته روش کیفی بوده و فقط قادر به تشخیص نوع شدید کمبود فاکتور سیزده میباشد. آزمایش حلالیت اوره و MCA در صورتی مثبت خواهند شد که سطح فاکتور سیزده پلاسمایی خیلی اندک باشد(تقریباً 1٪)، در حالی که حساسیت آزمایش حلالیت استیک اسید حدود 2 برابر بیشتر از آزمایش اوره و مونوکلریک استیک اسید میباشد. اگر چه، آزمایش حلالیت استیک اسید حساستر و سریعتر از آزمایش حلالیت در محیط اوره است، اما اختصاصیت کمتری داشته و مشاهده شده است که پلاسمای عادی تقریباً بعد از 4 روز در استیک اسید حل میشود در حالی که هرگز در روش حلالیت در اوره این حالت رخ نمیدهد(43، 8، 7). در روش معمول حلالیت لخته، اگر سطح فاکتور سیزده بیش از 2٪ باشد، ممکن است که بیماران مبتلا به کمبود فاکتور سیزده به اشتباه طبیعی در نظر گرفته شوند(28).
محدودیتهای آزمایش حلالیت لخته:
آزمایش حلالیت لخته استاندارد نبوده و بررسیهای بیشتر الزامی است. حساسیت این آزمایش بسته به سطح فیبرینوژن، معرف استفاده شده برای منعقد کردن خون (یون کلسیم، ترومبین و غیره) و عوامل حل کننده لخته (مونوکلریک استیک اسید، استیک اسید و اوره 5 مولار) متفاوت است. به کارگیری ترکیبی از استیک اسید/ ترومبین، استیک اسید/کلسیم، و هم چنین اوره/ کلسیم، و اوره/ترومبین ممکن است تغییر در میزان حساسیت نسبی سنجش حلالیت لخته داشته باشد. حساسیت روش اوره/ کلسیم مورد تردید بوده و اتفاق نظری در متون وجود ندارد(7، 6). از طرف دیگر سطح آستانه تشخیصی فاکتور سیزده توسط ژاکوبسن و گدال در سال 1974حدود 5%-3%، توسط فرانسیس در سال 1980 کمتر از 5/0٪ و توسط جنینگز و همکارانش در سال 2003 در حدود 5%-1% گزارش شده است. جنینگز و همکارانش هم چنین گزارش کردند که روش ترومبین/ استیک اسید حداقل به 10% از فاکتور سیزده حساس بوده، در حالی که حساسیت روش کلسیم/استیک اسید و ترومبین/ اوره متوسط میباشد. فرانسیس در سال 1980 گزارش داد که آستانه سطح شناسایی فاکتور سیزده در پلاسما توسط روش استیک اسید/ کلسیم محدود به صفر تا 3 درصد است(44، 7، 6). اطلاعات گزارش شده توسط پیهونگ و همکارانش در سال 2014 نشان داد که آزمایش حلالیت لخته مرسوم، فقط قادر به تشخیص 16% از بیماران با سطح فاکتور سیزده پلاسمایی کمتر از 2% میباشد، در حالی که استفاده از روش ترومبین میتوانست شناسایی بهتری داشته باشد. در مطالعه پیهونگ، نمونه با سطح 1% از سطح فاکتور سیزده نیز در روشهای مرسوم دقیقتر از نمونه با سطح 2% فاکتور سیزده تشخیص داده شد(46). بیماران مبتلا به هیپرفیبرینولیز باید کنار گذاشته شوند چرا که این وضعیت مانع از شکلگیری و تثبیت لخته خونی میشود. به طور کلی، آزمایش حلالیت لخته با استفاده از ترومبین به خصوص روش ترکیبی ترومبین/استیک اسید حساستر هستند. باید در نظر داشت که این روش قادر به افتراق بین فرم شدید بیماری از حالت متوسط یا خفیف، هتروزیگوت از هموزیگوت و فرم اکتسابی از فرم ارثی نمیباشد. به دلیل مقدار کم مهارکننده فاکتور سیزده، میزان فعالیت فاکتور سیزده کمتر از 1% کاهش نمییابد، بنابراین موارد با این وضعیت به وسیله این آزمایش به خوبی تشخیص داده نمیشوند(8-6). به علاوه تجویز فاکتور سیزده طی چند هفته قبل از انجام آزمایش، نتایج این آزمایش را طبیعی نشان میدهد. بنابراین با توجه به بالا بودن تعداد تشخیص داده نشده و یا دیر تشخیص داده از موارد کمبود فاکتور سیزده، این روش به عنوان یک آزمایش غربالگری روزمره توصیه نمیشود(8).
آزمایش کمی در تشخیص آزمایشگاهی کمبود فاکتور سیزده(سنجش فعالیت و آنتیژنی فاکتور):
در صورتی که بیمار با آزمایش کیفی، مشکوک به کمبود فاکتور سیزده باشد، برای تایید و طبقهبندی بیماری باید از اندازهگیری کمی فعالیت فاکتور سیزده استفاده شود. اندازهگیری کمی فاکتور سیزده روش ارجح برای غربالگری و تشخیص کمبود فاکتور سیزده میباشد زیرا قادر به تشخیص فرم اکتسابی و ارثی بیماری است، بنابراین برای تشخیص دقیق بیماری استفاده میشود(9، 8). روشهایی که برای اندازهگیری فعالیت فاکتور سیزده استفاده میشوند، عبارتند از:
1- سنجش فتومتری:
ایـن روش بـر پایـه آزادسـازی آمونیاک در مرحله اول
واکنش ترانس گلوتامیناز فاکتور سیزده میباشد. در این روش، زیر واحد A فاکتور سیزده سوبسترای با وزن مولکولی کم را با الیگونوکلئوتید حاوی گلوتامین اتصال متقاطع میدهد. سپس آمونیاک در طول این واکنش آزاد شده و با واکنش وابسته به [NAD(P) = Nicotinamide adenine dinucleotide (phosphate)) [ به صورت نورسنجی سنجش میشود. کاهش در جذب نوری، نشانگر کمبود فاکتور سیزده است. این روش به سرعت انجام میشود، در آنالیزرهای انعقاد به راحتی قابل برنامهریزی است، قادر به پایش یک واکنش در 340 نانومتر بوده و روش یک مرحلهای سنتتیک واقعی است، اما بزرگترین ایراد این روش، حساسیت نسبتا پایین آن بوده که محدوده تشخیص در حدود 5%-3% میباشد(47، 8، 5). علاوه بر این عدم وجود نمونه بلانک در روشهای تجاری، منجر به کاهش دقت آنها میشود. نمونه پلاسمای بلانک برای اصلاح برخی از واکنشهای آمونیاک تولیدی و NADH مصرفی، مستقل از زیر واحد A فاکتور سیزده موجود در پلاسما ضروری است. در غیر این صورت، بدون استفاده از نمونه بلانک، فعالیت فاکتور سیزده به اشتباه بیشتر تشخیص داده خواهد شد(45، 20). تخمین بیش از حد در مواردی با محدوده طبیعی فاکتور سیزده نمیتواند مشکلی ایجاد کند، اما در کمبود شدید فاکتور بسیار تاثیرگذار خواهد بود(45). رایجترین کیتهای در دسترس برای این روش شامل؛ بریکروم فاکتور سیزده(دید بهرینگ، آلمان)، REA - کروم فاکتور سیزده(رینال، مجارستان) و تکنوکروم فاکتور سیزده (تکنوکلون، اتریش) میباشند(8).
مزایا ومعایب روش فتومتریک:
از آن جایی که مقدار کمی از فاکتور سیزده(10%-5%) برای حفظ هموستاز کافی است، تخمین زیاد در سطح فاکتور ممکن است که عواقب بالینی داشته باشد(45، 8-6). هماننـد مطالعـه لیـم و همکارانش، نتایـج گزارش شده نشـان دادند که سطح فعالیت فاکتور سیزده در بیماران دارای کمبـود شدیـد(2% >) در محدوده 14%-8% با روش
جدول 1: روشهای مختلف اندازهگیری فعالیت فاکتور سیزده
| روش اندازهگیری فعالیت فاکتور سیزده | کیت مورد استفاده | پایینترین مقدار قابل تشخیص | دامنه نرمال | مزایا | معایب | مرجع |
| روش فتومتریک | Berichrom FXIII | 5% < | UdL-1 140-70 | به راحتی اتوماسیون میشود. یک مرحلهای و ساده میباشد. | حساسیت پایین | 7 |
| REA-chrom FXIII | 3% < | UdL-1 143-69 | ||||
| Technochrom FXIII | 5% < | UdL-1 140-70 | ||||
| روش الحاق | Pafakit FXIIID | - | UdL-1 200-46 (Leu 34 Val حالت طبیعی) |
حساسیت بالا | زمانبر | 8 |
| UdL-1 251-97 (Leu 34 Val هتروزیگوت) |
||||||
| UdL-1 483-151 (Leu 34 Val هموزیگوت) |
||||||
| روش فلورسانس | N-zymebio Tec | 5% < | UdL-1 140-70 | روشی ساده مستقل از سایر فعالیتهای آنزیماتیک بدن | - | 8 |
بریکروم قرار گرفته بود. در مطالعه لونته کراتی و همکارانـش در سـال 2000، نیـز 8% بـرآورد بیش از مقدار
واقعی با استفاده از روش بریکروم رخ داده بود که جایگزینی NADPH با NADH نتایج را بهبود بخشید اما مشکل را حذف نکرد (48، 45). اگر نمونه بلانک به صورت تجاری فراهم نگردد، مشکل تخمین بیش از حد مـیتواند بـه وسیلـه آماده کردن نمونه بلانک با اضافه کردن ذرات یدواستامید توسط مصرف کننده حل شود(48).
2- روش الحاق (Incorporation assay) :
در ایـن روش فاکتـور سیزده به وسیله کلسیم و ترومبین فعال میشود و سپس اندازهگیری فعالیت فاکتور سیزده به وسیله اضافه کردن سوبسترا که میتواند بیوتین آمیدوپنتیلامین یا بیوتینیل کاداورین باشد، انجام میگیرد. در نهایت واکنش با اضافه کردن EDTA متوقف شده و سطح محصول بیوتینیله شده به وسیله استروپتوآویدین بتاگالاکتوزیداز و استروپتوآویدین آلکالن فسفاتاز اندازهگیری میشود.
کیت در دسترسPefakit FXIIID Kit (پنتافارم، سوئیس) میباشد(50، 49، 9-6).
مزایا و معایب این روش:
این روش دارای حساسیت بالا بوده، اما زمانبر، استاندارد کردن آن مشکل، و به خاطر مرحله جداسازی، برای طراحی یک روش سنتتیک درست مشکل است. علاوه بر این هم چنین نمیتوان آن را با آنالیزرهای کلینیکی شیمیایی تطبیق داد.
به میزان قابل توجهی، آزمون الحاق آمین حساس به پلیمورفیسم Val34Leu زیر واحد A فاکتور سیزده بوده و فعالیت فاکتور سیزده در این وضعیت بسیار افزایش مییابد(50، 49).
3- روش فلورسانس:
این روش بر اساس فعالیت ایزوپپتیداز فاکتور سیزده میباشد. فاکتور سیزده به عنوان آنزیمی ترانسگلوتامینازی با فعالیت ایزوپپتیدازی خودش سوبسترای افزوده شده در روش فلورسانس را تحت تاثیر قرار میدهد. میزان فلورسانسی که در پایان آزمایش دیده میشود، متناسب با فعالیت فاکتور سیزده است. این آزمایش برای اولین بار توسط پارامسوارن و همکارانش معرفی شد. کیت در دسترس برای این روش N ـ زیمبیوتک(آلمان) است. در مقایسـه بـا روش فتومتریـک ایـن روش مستقیـم، سـاده و
مستقل از فعالیت بعدی آنزیمی است(48، 45، 8، 5).
مزایا و معایب این روش:
روش فلورومتریک ارتباط نزدیکی با نتایج سنجش آنتیژنی فاکتور سیزده دارد. در شرایطی مانند کمبود شدید فاکتور سیزده که سطح فاکتور سیزده به اشتباه بالا گزارش میشود، میتوان از این روش برای تعیین دقیق فعالیت فاکتور سیزده بهره برد. محدوده فعایت تشخیص داده شده برای فاکتور سیزده در این روش 14/0%- 07/0% میباشد (جدول 1)(48، 45، 8، 5).
محدودیتهای روش سنجش فعالیت فاکتور سیزده:
روشهای کمی قادر به افتراق فعالیت کم فاکتور به دلیل آنتیبادیهای خودی و یا کمبود فاکتور نیستند. پلاسما لیپمیک و بالا رفتن آمونیاک به طور کاذب باعث افزایش فعالیت فاکتور سیزده میشوند. برای به حداقل رساندن این مداخلات، نمونه پلاسمای بلانک به موازات نمونه دارای فعالیت فاکتور سیزده کمتر از 10%، به منظور اصلاح فاکتور سیزده مستقل از NADPH مصرفی در پلاسما و جلوگیری از برآورد بیش از حد فعالیت فاکتور سیزده که ممکن است از نظر بالینی قابل توجه باشد، توصیه میشود. علاوه بر این، پلاسمای ایکتریک منجر به کاهش فعالیت فاکتور سیزده اندازهگیری شده به طور کاذب میشود(8-5).
سنجش آنتیژنی:
امروزه چندین روش سنجش آنتیژنی فاکتور سیزده از جمله روش ایمونواسی به منظور اندازهگیری زیر واحد A ، زیر واحد B و کمپلکس A2B2 فاکتور سیزده در دسترس هستند. با توجه به مطالعه پی هونگ و همکارانش در سال 2014، 80% از آزمایشگاهها که آنتیژن فاکتور سیزده را تعیین میکنند، از روش هموسیل استفاده میکنند. روش هموسیل یک روش خودکار یا یک روش لاتکس ارتقا یافته میباشد که به طور اختصاصی برای اندازهگیری زیر واحد A خاص استفاده میشود. چندین روش الایزا با استفاده از آنتیبادیهای مونوکلونال ضد زیر واحد A و B برای تشخیص کمپلکس A2B2 فاکتور سیزده ایجاد شدهاند (46، 6). گر چه روش الکتروایمونواسی(EIA) یکی از روشهای نسبتاً پرکاربرد میباشد، ولی به اندازه کافی حساس نیست. روش رادیوایمونواسی(RIAs) برای زیر واحدهای A و B دشوار بوده و ممکن است پروتئینهایی غیر از فاکتور سیزده را شناسایی کند(51).
برای افتراق زیر واحد B آزاد از B در کمپلکـس بـا زیر
واحد A در پلاسما، دو روش ساندویچ الایزا نیز وجود دارد. روش جدید الایزای ساندویچ یک مرحلهای با استفاده از آنتیبادیهای مونوکلونال ضد زیر واحدهای A و B که به ترتیب با HRP (Horse radish proxidase) و بیوتین نشاندار شده را شرح دادند، که برای اندازهگیری مقدار بسیار کم کمپلکس فاکتور سیزده پلاسمایی در بیماران مبتلا به کمبود فاکتور سیزده هموزیگوت بسیار حساس و اختصاصی نیز طراحی شده است. این آزمایش را میتوان در کمتر از 2 ساعت انجام داد. زیر واحد B آزاد و فیبرینوژن هیچ تداخلی با این روش ندارد و نتایج نیز میتوانند به صورت غلظت گزارش شوند(52، 8). از روشهای دیگر مورد استفاده برای اندازهگیری مقدار زیر واحد A ، استفاده از دو آنتیبادی مونوکلونال علیه اپیتوپهای مختلف این زیر واحد میباشد. این روش بسیار حساس و سریع بوده و میتواند غلظت زیر واحد A را با دقت بالا در محدوده کم در پلاسما و سلولهای لیز شده تشخیص دهد(10-6). پس از تایید، از کمبود فاکتور سیزده با اندازهگیری فعالیت فاکتور سیزده، سنجش آنتیژنی میتواند برای تایید و طبقهبندی کمبود فاکتور سیزده به شرح زیر انجام شود:
1- اندازهگیری فرم تترامری فاکتور سیزده(A2B2) در پلاسما
2- اندازهگیری آنتیژنی زیر واحد A و B در پلاسما (در صورتی که غلظت آنتیژنی فرم تترامری فاکتور سیزده کم باشد)
3- اندازهگیری فرم دایمر زیر واحد A در پلاکت
کیت تجاری الایزا برای تعیین سطح آنتیژنی از زیر گروههای فاکتور سیزده استفاده میشوند. کیت الایزا فاکتور سیزده انسانی ابکم در شرایط آزمایشگاهی(انگلستان، کمبریج) برای اندازهگیری کمی فاکتور سیزده در پلاسما، سرم و محلول کشت سلولی طراحی شده است(8-6).
سنجش مهارکننده کمبود فاکتور سیزده:
اگر چه ایجاد مهار کننده علیه فاکتور سیزده یک پدیده بسیار نادر میباشد، اما باید برای افتراق کمبود فاکتور سیزده اکتسابی و مادرزادی در مواردی با رخدادهای خونریزیدهنده، که نتایج طبیعی را آزمایشهای غربالگری نشان میدهند، در نظر گرفته شود. در کمبود فاکتور سیزده مادرزادی، گسترش مهارکننده به صورت پاسخ ایمنی به فاکتور سیزده برونزاد به علت دریافت درمانهای جایگزین تعریف شده است(48، 8-6). این رویداد هنگامی که یک بیمار دیگر به درمانهای جایگزینی پاسخ نداده و خونریزی ادامه مییابد، مورد شک قرار میگیرد. مهار کننده فاکتور اکتسابی سیزده از نوع ایمونوگلوبولین G از زیر کلاس(مونوکلونال IgG1) بوده که در آن زنجیره سبک منحصراً زنجیره λ است. ایـن عمدتـاً به طور خود به خودی و یا در بیمارانی که تحت درمانهای جایگزین بلند مدت یا تحت درمان با داروهای خاص از جمله ایزونیازید، پنیسیلین، فنیتوئین و هم چنین پراکتولول و آمیودارون هستند، رخ میدهد. هم چنین در چند مورد با بیماریهای زمینهای مانند گاماپاتی مونوکلونال با اهمیت ناشناخته، آرتریت روماتوئید و لوپوس اریتماتوی سیستمیک گزارش شده است. از آن جا که این مهارکنندهها معمولاً با تمایل بالا به خونریزی شدید همراه هستند، تشخیص زود هنگام و مدیریت این بیماران ضروری است(8، 7). بیمارانی که مهار کننده فاکتور سیزده در آنها گسترش یافته، علاوه بر درمانهای جایگزین، هم چنین نیازمند پلاسما فرز و یا عوامل سرکوب کننده سیستم ایمنی مانند کورتیکو استروئیدها و سیکلوفسفامید هستند که ممکن است باعث کاهش تیتر مهارکننده و بهبود فنوتیپ بالینی بیماری شود. ریتوکسیماب انتخاب دیگری برای درمان میباشد که ممکن است به تنهایی یا در ترکیب با سایر داروهای سرکوبکننده سیستم ایمنی تجویز شود. این یک آنتیبادی مونوکلونال ضد CD20 میباشد که ممکن است منجر به کاهش تولید آنتیبادی توسط سلولهای BCD20+ شود (8، 7).
غربالگری و سنجش کمی از مهارکننده فاکتور سیزده:
برای تعیین این که آیا یک مهار کننده فاکتور سیزده وجود دارد یا نه، مطالعه روش پلاسمای مخلوط مفید خواهد بود. در این روش، سنجش حلالیت لخته در مخلوطی با حجم مشابه از پلاسمای بیمار و پلاسمای طبیعی بررسی میشود. اگر نتیجه این روش تصحیح شود ممکن است که نشاندهنده نقص ارثی فاکتور باشد ولی در صورتی که تصحیح نشد، ممکن است که مهارکننده فاکتور سیزده وجود داشته باشد(45، 9-6).
در این مورد آنتیبادیهای غیر خنثیکننده بر علیه زیر واحد A و B به وسیله روش اتصالی توصیه میشوند. در این روش آنتیبادیهای IgG موجود در پلاسمای بیمار با فاکتور A2B2 ، A2 و B خالص شده موجود در چاهکهای پلیت الایزا یا ژل الکتروفورز سدیم دو دسیل سولفات پلیآکریلآمید(PAGE) متصل میشود. پس از الکتروفورز، وسترن بلات انجام میشود(23، 8). [FA1] تحقیقات بیشتر در مهار کننده فاکتور سیزده از طریق تیتراسیون آنتی بادی، معمولاً با استفاده از روش بتسدا انجام میشود. در روش مرسوم، اندازهگیری فعالیت باقیمانده فاکتور سیزده بعد از انکوباسیون پلاسمای بیمار و کنترل در غلظتهای مختلف به مدت 2 ساعت در 37 درجه سانتیگراد انجام میگیرد. رقت معکوس پلاسمای بیمار که منجر به باقی ماندن 50٪ از فعالیت فاکتور سیزده میشود، به عنوان تیتر بازدارنده در واحد بتسدا (BU) در نظر گرفته میشود(53، 8-6).
اساس مولکولی و تشخیص مولکولی کمبود فاکتور سیزده:
کمبود فاکتور سیزده ارثی یک اختلال نادر اتوزومال مغلوب بوده که اکثراً ناشی از موتاسیون در ژن زیر واحد A میباشد. نقص مولکولی در این زیر واحد با شیوع 1 نفر در 2 میلیون رخ میدهد. رایج ترین نقص مولکولی در زیر واحد A فاکتور سیزده، جهش بد معنی(بیش از 50%) میباشد. جهش بیمعنی و حذف/اضافه از دیگر نقصهای معمول ژن زیر واحد A فاکتور سیزده در بیماران مبتلا به ایـن کمبـود هستند. چندین جهش شایع که باعث نقص ژن در میان جوامع مختلف میشوند، مشاهده شده است. در بین بیماران اروپایی شایعترین جهش IVS5-1G>A میباشد و در میان بیماران اروپایی با ملیتهای مختلف از جمله؛ بیماران هلندی، لهستانی، انگلستانی و غیره مشاهده شده است. جهش Arg661stop در اگزون 14 ژن زیر واحد A فاکتور سیزده، نقص شایع دیگری در میان بیماران اروپایی بوده و در فنلاند، سوئیس، لهستان، سوئد و غیره گزارش شده است. این جهش شایع در هند نیز مشاهده شده است(55، 54، 6). هم چنین جهش Arg326Gln در ژن زیر واحد A در بیمارانی از آلمان و هلند مشاهده شده است. بنابراین در بیماران مبتلا در اروپا، این سه جهش میتوانند به عنوان نخستین گام در تشخیص مولکولی کمبود فاکتور سیزده انتخاب شوند. در بیماران ایرانی مبتلا به کمبود فاکتور سیزده، اولین جهش انتخاب شده باید Trp187Arg باشد که در 348 بیمار مبتلا به کمبود فاکتور سیزده مادرزادی شدید مشاهده شده است. جهش دوم انتخاب شده در این بیماران باید Arg77His باشد که یک جهش مکرر در میان بیماران ایرانی مبتلا به کمبود فاکتور سیزده میباشد(8، 1). در میان بیماران هند، جهش در اگزون شماره 6 و 10 معمولاً مشاهده شده است. به نظر میرسد که پلیمورفیسم IVS1 A246G ، شایعترین پلیمورفیسم فاکتور سیزده در بیماران هندی بوده و یک نشانگر تشخیصی مناسب برای کمبود فاکتور سیزده در این کشور است. روش واکنش زنجیره پلیمراز و هضم توسط آنزیم محدودالاثر(PCR-RFLP = Polymerase Chain Reaction-Restriction Fragment Length Polymorphism) و یا PCR اگزون ویژه برای پیگیری کمبود فاکتور سیزده در این چند کشور میتواند به عنوان اولین مارکر نشانگر تشخیصی ژنتیکی استفاده شود، اما در دیگر نقاط جهان جهشتکرار شونده عامل بیماری مشاهده نشده و بیش از 150 جهش مختلف پراکنده در سراسر ژن فاکتور سیزده وجـود دارد کـه تعییـن تـوالی کامـل آن اجتنـاب نـاپذیـر
است(59-55، 8). تعداد کمی از جهشهای ژن زیر واحد B مشاهده شده است و با توجه به نقش این فاکتور به عنوان حامل زیر واحد A ، جهش در این زیر واحد با کمبود فاکتور سیزده شدید همراه نیست. بـه دلیل اندازه کوچک ژن زیر واحد B، تشخیص جهش در ایـن زیر واحد راحتتر است(8-6).
بررسی توالی DNA :
ژن زیرواحد A دارای 15 اگزون و 126 کیلو بایت بوده کـه بـرای استفـاده از تعیین توالی به عنوان روش غربالگری برای جهشهای ناشناخته خیلی بزرگ میباشد، امـا بـه علت فقدان نقص ژنتیکی شایع در جمعیت عمومی، استفاده از این روش در بیشتر بیماران اجتناب نـاپذیر اسـت. گـر چـه، PCR-RFLP و PCR Sequencing محصول PCR را میتوان به عنوان یک روش تشخیصی قابل اعتماد در برخی از بیماران از جمله ایرانی، سوئیسی و فنلاندی در نظر گرفت، اما حتی در این بیماران هنگامی که روش غربالگری استفاده شده برای تشخیص جهش ناموفق باشد، تعیین توالی ژن کل فاکتور سیزده ممکن است اجتناب ناپذیر باشد(28، 1).
با روشهای جدید تعیین توالی اتوماتیک، تنها مقدار کمی از DNA الگو مورد نیاز است. هنگامی که یک جهش در یک خانواده و یا بستگان نزدیک شناسایی شد و یا اثر بنیانگذار تایید شد، تشخیص بیماران و یا حامل را به سادگی میتوان با روش PCR و در پی آن (PCR-RFLP) که در آن جایگاه جهش، جایگاهی برای آنزیم محدود کننده ایجاد کرده است، انجام داد. با توجه به فقدان جهش شایع و هم چنین اندازه کوچکتر ژن زیر واحد B، تعیین توالی کل ژن از این زیر واحد در افراد مشکوک به نقص از این زیر واحد، عملیتر است(28، 7، 6).
تشخیص پیش از تولد (PND = Prenatal Diagnosis):
خونریزی بند ناف و خونریزی داخل جمجمهای شایع بوده و از عوامل خونریزیدهنده تهدیدکننده زندگی در میان نوزادان مبتلا به کمبود فاکتور سیزده مادرزادی شدید میباشند.
با توجه به این حملات خونریزی شدید، PND نقش بسیار مهمی در افراد در معرض خطر دارد. با شناسایی جهشهای ایجاد کننده کمبود فاکتور سیزده در خانواده جنین، PND به راحتی میتواند با روش PCR و پس از آن تعیین توالی RFLP در نمونه پرزهای جفتی برای نمونه در سه ماهه اول بارداری انجام گیرد. این نمونه باید قبل از استخراج DNA و تکثیر به وسیله بافر فسفات سالین شستشو شود. با نمونهبرداری استاندارد میتوان بیش از 50 میکروگرم DNA به دست آورد. تعیین توالی PCR از PCR-RFLP میتواند وضعیت جنین را در 1 یا 2 روز تعیین کند(60، 8، 1).
بحث
کمبود فاکتور سیزده اختلالی بسیار نادر با علائم خونریزیدهنده شدید و تهدیدکننده حیات میباشد. در صورت عدم تشخیص بیماری و یا تشخیص دیرهنگام
بیماری، حدود نیمی از بیماران مبتلا به بیماری دچار مرگ و میر میشوند. از آن جا که بیماری همراه با نتیجه طبیعی در آزمایشهای روتین انعقادی میباشد، تشخیص بیماری دشوار است(3-1). آزمایش حلالیت لخته پرکاربردترین آزمایش مورد استفاده برای غربالگری و تشخیص بیماری میباشد که دارای حساسیت و اختصاصیت پایینی است به همین دلیل کارشناسان استفاده از این آزمایش را برای تشخیص بیماری توصیه نمیکنند. با این وجود به دلیل استفاده گسترده از این آزمایش در کشورهای در حال توسعه و نیز حدود 20% آزمایشگاههای کشورهای توسعهیافته، در حال حاضر امکان حذف این آزمایش و جایگزین کردن آن با آزمایشهای حساستر و اختصاصیتر وجود ندارد(28، 8).
واقعی با استفاده از روش بریکروم رخ داده بود که جایگزینی NADPH با NADH نتایج را بهبود بخشید اما مشکل را حذف نکرد (48، 45). اگر نمونه بلانک به صورت تجاری فراهم نگردد، مشکل تخمین بیش از حد مـیتواند بـه وسیلـه آماده کردن نمونه بلانک با اضافه کردن ذرات یدواستامید توسط مصرف کننده حل شود(48).
2- روش الحاق (Incorporation assay) :
در ایـن روش فاکتـور سیزده به وسیله کلسیم و ترومبین فعال میشود و سپس اندازهگیری فعالیت فاکتور سیزده به وسیله اضافه کردن سوبسترا که میتواند بیوتین آمیدوپنتیلامین یا بیوتینیل کاداورین باشد، انجام میگیرد. در نهایت واکنش با اضافه کردن EDTA متوقف شده و سطح محصول بیوتینیله شده به وسیله استروپتوآویدین بتاگالاکتوزیداز و استروپتوآویدین آلکالن فسفاتاز اندازهگیری میشود.
کیت در دسترسPefakit FXIIID Kit (پنتافارم، سوئیس) میباشد(50، 49، 9-6).
مزایا و معایب این روش:
این روش دارای حساسیت بالا بوده، اما زمانبر، استاندارد کردن آن مشکل، و به خاطر مرحله جداسازی، برای طراحی یک روش سنتتیک درست مشکل است. علاوه بر این هم چنین نمیتوان آن را با آنالیزرهای کلینیکی شیمیایی تطبیق داد.
به میزان قابل توجهی، آزمون الحاق آمین حساس به پلیمورفیسم Val34Leu زیر واحد A فاکتور سیزده بوده و فعالیت فاکتور سیزده در این وضعیت بسیار افزایش مییابد(50، 49).
3- روش فلورسانس:
این روش بر اساس فعالیت ایزوپپتیداز فاکتور سیزده میباشد. فاکتور سیزده به عنوان آنزیمی ترانسگلوتامینازی با فعالیت ایزوپپتیدازی خودش سوبسترای افزوده شده در روش فلورسانس را تحت تاثیر قرار میدهد. میزان فلورسانسی که در پایان آزمایش دیده میشود، متناسب با فعالیت فاکتور سیزده است. این آزمایش برای اولین بار توسط پارامسوارن و همکارانش معرفی شد. کیت در دسترس برای این روش N ـ زیمبیوتک(آلمان) است. در مقایسـه بـا روش فتومتریـک ایـن روش مستقیـم، سـاده و
مستقل از فعالیت بعدی آنزیمی است(48، 45، 8، 5).
مزایا و معایب این روش:
روش فلورومتریک ارتباط نزدیکی با نتایج سنجش آنتیژنی فاکتور سیزده دارد. در شرایطی مانند کمبود شدید فاکتور سیزده که سطح فاکتور سیزده به اشتباه بالا گزارش میشود، میتوان از این روش برای تعیین دقیق فعالیت فاکتور سیزده بهره برد. محدوده فعایت تشخیص داده شده برای فاکتور سیزده در این روش 14/0%- 07/0% میباشد (جدول 1)(48، 45، 8، 5).
محدودیتهای روش سنجش فعالیت فاکتور سیزده:
روشهای کمی قادر به افتراق فعالیت کم فاکتور به دلیل آنتیبادیهای خودی و یا کمبود فاکتور نیستند. پلاسما لیپمیک و بالا رفتن آمونیاک به طور کاذب باعث افزایش فعالیت فاکتور سیزده میشوند. برای به حداقل رساندن این مداخلات، نمونه پلاسمای بلانک به موازات نمونه دارای فعالیت فاکتور سیزده کمتر از 10%، به منظور اصلاح فاکتور سیزده مستقل از NADPH مصرفی در پلاسما و جلوگیری از برآورد بیش از حد فعالیت فاکتور سیزده که ممکن است از نظر بالینی قابل توجه باشد، توصیه میشود. علاوه بر این، پلاسمای ایکتریک منجر به کاهش فعالیت فاکتور سیزده اندازهگیری شده به طور کاذب میشود(8-5).
سنجش آنتیژنی:
امروزه چندین روش سنجش آنتیژنی فاکتور سیزده از جمله روش ایمونواسی به منظور اندازهگیری زیر واحد A ، زیر واحد B و کمپلکس A2B2 فاکتور سیزده در دسترس هستند. با توجه به مطالعه پی هونگ و همکارانش در سال 2014، 80% از آزمایشگاهها که آنتیژن فاکتور سیزده را تعیین میکنند، از روش هموسیل استفاده میکنند. روش هموسیل یک روش خودکار یا یک روش لاتکس ارتقا یافته میباشد که به طور اختصاصی برای اندازهگیری زیر واحد A خاص استفاده میشود. چندین روش الایزا با استفاده از آنتیبادیهای مونوکلونال ضد زیر واحد A و B برای تشخیص کمپلکس A2B2 فاکتور سیزده ایجاد شدهاند (46، 6). گر چه روش الکتروایمونواسی(EIA) یکی از روشهای نسبتاً پرکاربرد میباشد، ولی به اندازه کافی حساس نیست. روش رادیوایمونواسی(RIAs) برای زیر واحدهای A و B دشوار بوده و ممکن است پروتئینهایی غیر از فاکتور سیزده را شناسایی کند(51).
برای افتراق زیر واحد B آزاد از B در کمپلکـس بـا زیر
واحد A در پلاسما، دو روش ساندویچ الایزا نیز وجود دارد. روش جدید الایزای ساندویچ یک مرحلهای با استفاده از آنتیبادیهای مونوکلونال ضد زیر واحدهای A و B که به ترتیب با HRP (Horse radish proxidase) و بیوتین نشاندار شده را شرح دادند، که برای اندازهگیری مقدار بسیار کم کمپلکس فاکتور سیزده پلاسمایی در بیماران مبتلا به کمبود فاکتور سیزده هموزیگوت بسیار حساس و اختصاصی نیز طراحی شده است. این آزمایش را میتوان در کمتر از 2 ساعت انجام داد. زیر واحد B آزاد و فیبرینوژن هیچ تداخلی با این روش ندارد و نتایج نیز میتوانند به صورت غلظت گزارش شوند(52، 8). از روشهای دیگر مورد استفاده برای اندازهگیری مقدار زیر واحد A ، استفاده از دو آنتیبادی مونوکلونال علیه اپیتوپهای مختلف این زیر واحد میباشد. این روش بسیار حساس و سریع بوده و میتواند غلظت زیر واحد A را با دقت بالا در محدوده کم در پلاسما و سلولهای لیز شده تشخیص دهد(10-6). پس از تایید، از کمبود فاکتور سیزده با اندازهگیری فعالیت فاکتور سیزده، سنجش آنتیژنی میتواند برای تایید و طبقهبندی کمبود فاکتور سیزده به شرح زیر انجام شود:
1- اندازهگیری فرم تترامری فاکتور سیزده(A2B2) در پلاسما
2- اندازهگیری آنتیژنی زیر واحد A و B در پلاسما (در صورتی که غلظت آنتیژنی فرم تترامری فاکتور سیزده کم باشد)
3- اندازهگیری فرم دایمر زیر واحد A در پلاکت
کیت تجاری الایزا برای تعیین سطح آنتیژنی از زیر گروههای فاکتور سیزده استفاده میشوند. کیت الایزا فاکتور سیزده انسانی ابکم در شرایط آزمایشگاهی(انگلستان، کمبریج) برای اندازهگیری کمی فاکتور سیزده در پلاسما، سرم و محلول کشت سلولی طراحی شده است(8-6).
سنجش مهارکننده کمبود فاکتور سیزده:
اگر چه ایجاد مهار کننده علیه فاکتور سیزده یک پدیده بسیار نادر میباشد، اما باید برای افتراق کمبود فاکتور سیزده اکتسابی و مادرزادی در مواردی با رخدادهای خونریزیدهنده، که نتایج طبیعی را آزمایشهای غربالگری نشان میدهند، در نظر گرفته شود. در کمبود فاکتور سیزده مادرزادی، گسترش مهارکننده به صورت پاسخ ایمنی به فاکتور سیزده برونزاد به علت دریافت درمانهای جایگزین تعریف شده است(48، 8-6). این رویداد هنگامی که یک بیمار دیگر به درمانهای جایگزینی پاسخ نداده و خونریزی ادامه مییابد، مورد شک قرار میگیرد. مهار کننده فاکتور اکتسابی سیزده از نوع ایمونوگلوبولین G از زیر کلاس(مونوکلونال IgG1) بوده که در آن زنجیره سبک منحصراً زنجیره λ است. ایـن عمدتـاً به طور خود به خودی و یا در بیمارانی که تحت درمانهای جایگزین بلند مدت یا تحت درمان با داروهای خاص از جمله ایزونیازید، پنیسیلین، فنیتوئین و هم چنین پراکتولول و آمیودارون هستند، رخ میدهد. هم چنین در چند مورد با بیماریهای زمینهای مانند گاماپاتی مونوکلونال با اهمیت ناشناخته، آرتریت روماتوئید و لوپوس اریتماتوی سیستمیک گزارش شده است. از آن جا که این مهارکنندهها معمولاً با تمایل بالا به خونریزی شدید همراه هستند، تشخیص زود هنگام و مدیریت این بیماران ضروری است(8، 7). بیمارانی که مهار کننده فاکتور سیزده در آنها گسترش یافته، علاوه بر درمانهای جایگزین، هم چنین نیازمند پلاسما فرز و یا عوامل سرکوب کننده سیستم ایمنی مانند کورتیکو استروئیدها و سیکلوفسفامید هستند که ممکن است باعث کاهش تیتر مهارکننده و بهبود فنوتیپ بالینی بیماری شود. ریتوکسیماب انتخاب دیگری برای درمان میباشد که ممکن است به تنهایی یا در ترکیب با سایر داروهای سرکوبکننده سیستم ایمنی تجویز شود. این یک آنتیبادی مونوکلونال ضد CD20 میباشد که ممکن است منجر به کاهش تولید آنتیبادی توسط سلولهای BCD20+ شود (8، 7).
غربالگری و سنجش کمی از مهارکننده فاکتور سیزده:
برای تعیین این که آیا یک مهار کننده فاکتور سیزده وجود دارد یا نه، مطالعه روش پلاسمای مخلوط مفید خواهد بود. در این روش، سنجش حلالیت لخته در مخلوطی با حجم مشابه از پلاسمای بیمار و پلاسمای طبیعی بررسی میشود. اگر نتیجه این روش تصحیح شود ممکن است که نشاندهنده نقص ارثی فاکتور باشد ولی در صورتی که تصحیح نشد، ممکن است که مهارکننده فاکتور سیزده وجود داشته باشد(45، 9-6).
در این مورد آنتیبادیهای غیر خنثیکننده بر علیه زیر واحد A و B به وسیله روش اتصالی توصیه میشوند. در این روش آنتیبادیهای IgG موجود در پلاسمای بیمار با فاکتور A2B2 ، A2 و B خالص شده موجود در چاهکهای پلیت الایزا یا ژل الکتروفورز سدیم دو دسیل سولفات پلیآکریلآمید(PAGE) متصل میشود. پس از الکتروفورز، وسترن بلات انجام میشود(23، 8). [FA1] تحقیقات بیشتر در مهار کننده فاکتور سیزده از طریق تیتراسیون آنتی بادی، معمولاً با استفاده از روش بتسدا انجام میشود. در روش مرسوم، اندازهگیری فعالیت باقیمانده فاکتور سیزده بعد از انکوباسیون پلاسمای بیمار و کنترل در غلظتهای مختلف به مدت 2 ساعت در 37 درجه سانتیگراد انجام میگیرد. رقت معکوس پلاسمای بیمار که منجر به باقی ماندن 50٪ از فعالیت فاکتور سیزده میشود، به عنوان تیتر بازدارنده در واحد بتسدا (BU) در نظر گرفته میشود(53، 8-6).
اساس مولکولی و تشخیص مولکولی کمبود فاکتور سیزده:
کمبود فاکتور سیزده ارثی یک اختلال نادر اتوزومال مغلوب بوده که اکثراً ناشی از موتاسیون در ژن زیر واحد A میباشد. نقص مولکولی در این زیر واحد با شیوع 1 نفر در 2 میلیون رخ میدهد. رایج ترین نقص مولکولی در زیر واحد A فاکتور سیزده، جهش بد معنی(بیش از 50%) میباشد. جهش بیمعنی و حذف/اضافه از دیگر نقصهای معمول ژن زیر واحد A فاکتور سیزده در بیماران مبتلا به ایـن کمبـود هستند. چندین جهش شایع که باعث نقص ژن در میان جوامع مختلف میشوند، مشاهده شده است. در بین بیماران اروپایی شایعترین جهش IVS5-1G>A میباشد و در میان بیماران اروپایی با ملیتهای مختلف از جمله؛ بیماران هلندی، لهستانی، انگلستانی و غیره مشاهده شده است. جهش Arg661stop در اگزون 14 ژن زیر واحد A فاکتور سیزده، نقص شایع دیگری در میان بیماران اروپایی بوده و در فنلاند، سوئیس، لهستان، سوئد و غیره گزارش شده است. این جهش شایع در هند نیز مشاهده شده است(55، 54، 6). هم چنین جهش Arg326Gln در ژن زیر واحد A در بیمارانی از آلمان و هلند مشاهده شده است. بنابراین در بیماران مبتلا در اروپا، این سه جهش میتوانند به عنوان نخستین گام در تشخیص مولکولی کمبود فاکتور سیزده انتخاب شوند. در بیماران ایرانی مبتلا به کمبود فاکتور سیزده، اولین جهش انتخاب شده باید Trp187Arg باشد که در 348 بیمار مبتلا به کمبود فاکتور سیزده مادرزادی شدید مشاهده شده است. جهش دوم انتخاب شده در این بیماران باید Arg77His باشد که یک جهش مکرر در میان بیماران ایرانی مبتلا به کمبود فاکتور سیزده میباشد(8، 1). در میان بیماران هند، جهش در اگزون شماره 6 و 10 معمولاً مشاهده شده است. به نظر میرسد که پلیمورفیسم IVS1 A246G ، شایعترین پلیمورفیسم فاکتور سیزده در بیماران هندی بوده و یک نشانگر تشخیصی مناسب برای کمبود فاکتور سیزده در این کشور است. روش واکنش زنجیره پلیمراز و هضم توسط آنزیم محدودالاثر(PCR-RFLP = Polymerase Chain Reaction-Restriction Fragment Length Polymorphism) و یا PCR اگزون ویژه برای پیگیری کمبود فاکتور سیزده در این چند کشور میتواند به عنوان اولین مارکر نشانگر تشخیصی ژنتیکی استفاده شود، اما در دیگر نقاط جهان جهشتکرار شونده عامل بیماری مشاهده نشده و بیش از 150 جهش مختلف پراکنده در سراسر ژن فاکتور سیزده وجـود دارد کـه تعییـن تـوالی کامـل آن اجتنـاب نـاپذیـر
است(59-55، 8). تعداد کمی از جهشهای ژن زیر واحد B مشاهده شده است و با توجه به نقش این فاکتور به عنوان حامل زیر واحد A ، جهش در این زیر واحد با کمبود فاکتور سیزده شدید همراه نیست. بـه دلیل اندازه کوچک ژن زیر واحد B، تشخیص جهش در ایـن زیر واحد راحتتر است(8-6).
بررسی توالی DNA :
ژن زیرواحد A دارای 15 اگزون و 126 کیلو بایت بوده کـه بـرای استفـاده از تعیین توالی به عنوان روش غربالگری برای جهشهای ناشناخته خیلی بزرگ میباشد، امـا بـه علت فقدان نقص ژنتیکی شایع در جمعیت عمومی، استفاده از این روش در بیشتر بیماران اجتناب نـاپذیر اسـت. گـر چـه، PCR-RFLP و PCR Sequencing محصول PCR را میتوان به عنوان یک روش تشخیصی قابل اعتماد در برخی از بیماران از جمله ایرانی، سوئیسی و فنلاندی در نظر گرفت، اما حتی در این بیماران هنگامی که روش غربالگری استفاده شده برای تشخیص جهش ناموفق باشد، تعیین توالی ژن کل فاکتور سیزده ممکن است اجتناب ناپذیر باشد(28، 1).
با روشهای جدید تعیین توالی اتوماتیک، تنها مقدار کمی از DNA الگو مورد نیاز است. هنگامی که یک جهش در یک خانواده و یا بستگان نزدیک شناسایی شد و یا اثر بنیانگذار تایید شد، تشخیص بیماران و یا حامل را به سادگی میتوان با روش PCR و در پی آن (PCR-RFLP) که در آن جایگاه جهش، جایگاهی برای آنزیم محدود کننده ایجاد کرده است، انجام داد. با توجه به فقدان جهش شایع و هم چنین اندازه کوچکتر ژن زیر واحد B، تعیین توالی کل ژن از این زیر واحد در افراد مشکوک به نقص از این زیر واحد، عملیتر است(28، 7، 6).
تشخیص پیش از تولد (PND = Prenatal Diagnosis):
خونریزی بند ناف و خونریزی داخل جمجمهای شایع بوده و از عوامل خونریزیدهنده تهدیدکننده زندگی در میان نوزادان مبتلا به کمبود فاکتور سیزده مادرزادی شدید میباشند.
با توجه به این حملات خونریزی شدید، PND نقش بسیار مهمی در افراد در معرض خطر دارد. با شناسایی جهشهای ایجاد کننده کمبود فاکتور سیزده در خانواده جنین، PND به راحتی میتواند با روش PCR و پس از آن تعیین توالی RFLP در نمونه پرزهای جفتی برای نمونه در سه ماهه اول بارداری انجام گیرد. این نمونه باید قبل از استخراج DNA و تکثیر به وسیله بافر فسفات سالین شستشو شود. با نمونهبرداری استاندارد میتوان بیش از 50 میکروگرم DNA به دست آورد. تعیین توالی PCR از PCR-RFLP میتواند وضعیت جنین را در 1 یا 2 روز تعیین کند(60، 8، 1).
بحث
کمبود فاکتور سیزده اختلالی بسیار نادر با علائم خونریزیدهنده شدید و تهدیدکننده حیات میباشد. در صورت عدم تشخیص بیماری و یا تشخیص دیرهنگام
بیماری، حدود نیمی از بیماران مبتلا به بیماری دچار مرگ و میر میشوند. از آن جا که بیماری همراه با نتیجه طبیعی در آزمایشهای روتین انعقادی میباشد، تشخیص بیماری دشوار است(3-1). آزمایش حلالیت لخته پرکاربردترین آزمایش مورد استفاده برای غربالگری و تشخیص بیماری میباشد که دارای حساسیت و اختصاصیت پایینی است به همین دلیل کارشناسان استفاده از این آزمایش را برای تشخیص بیماری توصیه نمیکنند. با این وجود به دلیل استفاده گسترده از این آزمایش در کشورهای در حال توسعه و نیز حدود 20% آزمایشگاههای کشورهای توسعهیافته، در حال حاضر امکان حذف این آزمایش و جایگزین کردن آن با آزمایشهای حساستر و اختصاصیتر وجود ندارد(28، 8).

|
شکل 3: الگوریتم پیشنهادی برای تشخیص کمبود فاکتور سیزده
|
در کشورهایی مانند ایران، پاکستان، تونس، فنلاند و حتی هندوستان که دارای تعداد زیادی بیمار بوده و بررسی مولکولی بیماری به طور گستردهای انجام شده، این بررسیها منجر به شناسایی چند جهش اندک شدهاند که به طور مکرر در افراد این کشورها، شناسایی شدهاند. لذا توصیه میشود در مرحله اول برای تشخیص بیماری، بررسی مولکولی یک یا چند جهش خاص شایع به کار رود. بررسی فعالیت فاکتور سیزده نیز در این کشورها میتواند برای تشخیص و طبقهبندی بیماری استفاده گردد(28، 8-6، 1). در برخی مناطق دیگر که آزمایشگاههای مجهز انعقاد وجود دارد، در مرحله اول توصیه میشود از اندازهگیری فعالیت فاکتور سیزده برای غربالگری بیماری استفاده شود. در این مناطق آزمایش حلالیت لخته نباید حتی برای غربالگری استفاده گردد. در نهایت در این کشورها بررسی مولکولی باید برای تایید بیماری استفاده شود. برای بررسی مولکولی ابتدا باید تعیین توالی ژن زیر واحد A انجام شود و در صورتی که جهشی در این زیر واحد شناسایی نشد، توالی ژن زیر واحد B باید به طور کامل تعیین گردد. این رویکرد آزمایشگاهی همراه با بررسی علائم بالینی و نیز بررسی سابقه خانوادگی بیماری میتواند به تشخیص دقیق و به موقع بیماری کمک کرده و از عوارض مرگبار بیماری جلوگیری کند(62، 61، 28).
نتیجهگیری
هر چند کمبود فاکتور سیزده اختلالی خونریزیدهنده با علائم بالینی شدید میباشد اما رویکرد آزمایشگاهی مناسب میتواند منجر به تشخیص به موقع بیماری شده و میزان مرگ و میر را در این بیماران به طور قابل ملاحظهای بکاهد[FA2] .
تشکر و قدردانی
بدینوسیله از بیماران مبتلا به اختلالات خونریزیدهنده که در طرحهای تحقیقاتی همکاری میکنند، قدردانی میگردد.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



