جلد 12، شماره 2 - ( تابستان 1394 )
جلد 12 شماره 2 صفحات 110-101 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Darbari E, Soheili Z. Cloning of human SOX2 in lentiviral vector and transduction of HEK293T cell line. bloodj 2015; 12 (2) :101-110
URL: http://bloodjournal.ir/article-1-936-fa.html
URL: http://bloodjournal.ir/article-1-936-fa.html
درباری انسیه، سهیلی زهرا سهیلا. همسانهسازی ژن SOX2 انسانی در ناقل لنتی ویروسی و القای ژنی در سلولهای HEK293T. فصلنامه پژوهشی خون. 1394; 12 (2) :101-110
تهران ـ ایران ـ صندوق پستی: 161/14965
متن کامل [PDF 578 kb]
(2305 دریافت)
| چکیده (HTML) (8120 مشاهده)
مقدمه
در طی تکامل جنینی با تقسیم سلولی، تمایز، مهاجرت و تشکیل اندامها، خاصیت پرتوانی این سلولهای بنیادی به طور برگشتناپذیر از دست میرود. در سال 2006 تاکاهاشی و یاماناکا با بیان چهار فاکتور c-MYC ، KLF4 ، SOX2 و OCT4 در سلولهای تمایز یافته فیبروبلاست، سلولهای شبیه سلولهای بنیادی جنینی تولید کردند(1). این سلولها، سلولهای بنیادی پرتوان القایی(iPSC= induce Pluripotent Stem Cell) نامیده شدند. مزیت ایجاد سلولهای پرتوان القایی در توانایی آنها در تمایز به تمامی سلولهای بالغ است. از این رو میتوان از آنها در درمان بیماریهای غیر قابل درمان مانند بیماریهای پارکینسون، آلزایمر، بیماریهای قلبی و تخریب عصبی استفاده نمود(2). این فرآیند تولید سلولهای بنیادی القایی از سلولهای تمایز یافته«دوباره باز برنامهنویسی (reprogramming)» نامیده شد. به دلیل این که منشا اولیه این سلولها میتواند خود بیمار باشد، کاربرد این سلولها در سلول درمانی سیستم ایمنی بدن را تحریک نمیکند. علاوه بر این، تکنولوژی حاضر به محققان این امکان را میدهد که بتوانند بیماریها را در محیط in vitro مدلسازی کنند و عوامل مؤثر در پیشرفت یا درمان و کنترل بیماری را شناسایی نموده و بهترین روش درمان را انتخاب نمایند(3). اما استفاده از تکنولوژی سلولهای بنیادی پرتوان القایی دارای معایبی نیز میباشد(4). فاکتورهای c-MYC و KLF4 میتوانند سبب ایجاد تومور گردند(5). هم چنین برای انتقال فاکتورهای رونویسی القایی باید از لنتی ویروسها استفاده نمود که گاهی با داخل شدن ژنوم ویروس به داخل ژنوم میزبان، جهش و سرطان زایی رخ میدهد(6). امروزه برای جلوگیری از تومورزایی توسط فاکتورهای c-MYC و KLF4 تنها از دو ژن SOX2 ، OCT4 برای دوباره باز برنامهنویسی استفاده میگردد(7).
ژن پروتئین SOX2 برای تولید پروتئینهایی که در تشکیل بافتهای مختلف در طی تکامل جنینی نقش حیاتی دارند، لازم است. SOX2در زیگوت بیان شده و بیان آن بیـن مرحلـه مـرولا و بلاستوسیـت افزایـش پیـدا مـیکند.
پروتئیـن آن 317 اسیـد آمینـه دارد و به مناطق خاص ژنوم
متصل شده و فعالیت ژنها را تنظیم میکند(8).
این پروتئین با OCT4 بر روی DNA کمپلکس تشکیل میدهد و بیان تعدادی از ژنها مانند:
Yamaguchi sarcoma viral oncogene homolog1 (YES1)
Fibroblast Growth Factor (FGF4)
Undifferentiated embryonic cell Transcription Factor 1, (UTF1)
Zinc Finger protein (ZFP206)
و
F-box and leucine-rich repeat protein (FBX)
را که در تکامل جنینی نقش دارند کنترل میکند. کمپلکس OCT4 وSOX2 با پروتئین Nanog واکنش داده و رونویسی فاکتور Rex1 را تنظیم میکند و موجب حفظ خاصیت پرتوانی سلولها میشود(9).
ژن درمانی یک روش درمانی جدید برای درمان بیماریهای ژنتیکی، متابولیسمی، سرطان، عصبی و ایدز میباشد. هدف اصلی از ژن درمانی، انتقال یک ژن خاص به سلول مورد نظر و بیان این ژن برای درمان بیماری است(10). برای ژن درمانی و انتقال ژن مورد نظر به داخل سلول، روشهای متعددی وجود دارد. این روشها به دو دسته ویروسی و غیر ویروسی تقسیم میشوند.
در روشهای غیر ویروسی، انتقال ژن به وسیله ویروسهای مصنوعی(لیپوزومها با ترکیبات مصنوعی)، پلاسمیدهای باکتریایی، وکتورهای پروتئین- چربی و کروموزومهای مصنوعی انجام میشود(11).
در روشهای ویروسی، وکتورهای ویروسی adeno-associated viruses ، adenoviruses ، retroviruses ، flavor viruses-herpes-simplex viruses استفاده میشوند. هر گروه از این وکتورها برای ژن درمانی در انسان دارای محدودیتهایی هستند. به عنوان مثال adenovirusو herpes- simplex viruses با القای سیستم ایمنی میزبان، مانع انتقال پایدار ژن در ژنوم میزبان میشوند و انتقال ژنوم در adeno-associated viruses وابسته به وکتورهای کمکی میباشند در حالی که تواناییهای منحصر به فرد لنتی ویروسها مانند توانایی انتقال ژن به صورت کارآمد و با بازدهی بالا به انواع سلولهای پستانداران، بیان طولانی مدت ژن نوترکیب، توانایی انتقال ژن به سلولهای تقسیم شونـده و غیـر تقسیـم شونـده، عـدم ایجـاد پاسـخ ایمنـی
ناخواسته و توانایی بیان نسبتاً بالای یک ژن در انواع سلولهای پستانداران، مثل انواع ردههای سلولهای بنیادی، منجر به استفاده گسترده از این وکتورها در ژن درمانی در محیط in vivo و in vitro گردیده است. با این حال اشکالات و نگرانیهایی نیز در استفاده از این ابزار مهم وجود دارد. ملاحظات موجود عبارتند از امکان تولید لنتی ویروسهای قادر به همانندسازی، جابهجایی حامل توسط رترو ویروس درونزا مستقر در ژنوم بیماران، جهشزایی افزایشی که منجر به سرطان میشود، تغییر ژرم - لاین که منجر به اثرات بین نسلها شده و انتشار ویروسهای جدید از بیماران ژن درمانی شده(12). برای تولید لنتی ویروس حاوی ژن مورد نظر در محیط in vitro ، از سلولهای HEK293T استفاده میگردد. لنتیویروسهای نوترکیب را میتوان از ترنسفکت هم زمان وکتور ناقل ژن به همراه وکتورهای کمکی کدکننده آنزیمها و نوکلئوپوششها و غشا به سلولهای HEK293T تولید کرد. این ویروسهای نوترکیب را میتوان از محیطرویی سلولهای HEK293T جمعآوری کرد. ژنهای پوششی مختلف اجازه تولید لنتیویروسهای سروتایپ مختلفی را میدهد که تروپیسمهای(تمایل نسبت به سلولی خاص) متفاوتی را نشان میدهند(13). این تحقیق مقدمهای برای استفاده از ناقلین ساخته شده در آلودهسازی سلولهای بنیادی مزانشیمی مغز استخوان است. در این مرحله هدف تولید ذرات ویروسی ناقل ژن مورد نظر، اثبات آلوده شدن یک نوع سلول آزمایشی و بیان ژن مورد نظر و صحت عملکرد سازهها بود.
مواد و روشها
تایید سازه نوترکیب PCR2.1SOX2 توسط هضم آنزیمی:
در یک مطالعه تجربی، با توجه به توالیهای موجود در بانک اطلاعاتی NCBI ، توالی ژن SOX2 تعیین و سفارش ساخت به شرکت Eurofin MWG Operon آلمان ارایه گردید. در هنگام طراحی توالی جهت تسهیل مراحل بعدی همسانهسازی، در انتهای 5' جایگاه برشی XhoI و در انتهای 3' جایگاه برشی BamHI قرار داده شد. در نهایت ژن SOX2 ساخته شده و در پلاسمید pCR2.1 دریافت گردید. بعد از دریافت سازه ژنی pCR2.1-SOX2 ، این سازه نوترکیب به باکتری E.coli-DH5α مستعد(Competent) با روش شوک حرارتی ترانسفرم گردید و سپس روی پلیت LB حاوی آنتیبیوتیک آمپیسیلین کشت و در انکوباتور 37 درجه سانتیگراد به مدت 24 ساعت انکوبه شد. از کلونیهای رشد کرده بر روی پلیت حاوی آمپیسیلین استخراج پلاسمید با کیت DNA-spin™Plasmid Purification Kit (کیاژن، آلمان) صورت پذیرفت.
واکنش هضم آنزیمی از سازه pCR2.1-SOX2 و بازیابی ژن SOX2 :
بعد از تایید شدن سازه نوترکیب pCR2.1-SOX2 ، ژن SOX2 توسط واکنش هضم آنزیمی با آنزیمهای BamHI و XhoI برش خورده و روی ژل آگارز 1% الکتروفورز شد. بدین منظور واکنش هضم آنزیمی در حجم زیادتر(50 میکرولیتر) انجام گردید و بعد از جدا شدن باندها در روی ژل آگارز 1%، باند مربوط به ژن SOX2 (966 جفت باز) از روی ژل توسط تیغ اسکالپل بریده شده و توسط کیت تخلیص از روی ژل High Pure DNA Purification Kit شرکت رُوش، تخلیص و برای کلون شدن در پلاسمید pLEX-MCS-pur (ترموساینتیفیک) مورد استفاده قرار گرفت.
واکنش اتصال و تایید سازه نوترکیب pLEX-SOX2-pur :
در مرحله بعد، ژن تخلیص شده از روی ژل جهت واکنش لیگاسیون 1 با ناقل pLEX-MCS مورد استفاده قرار گرفت. به این منظور ابتدا واکنش هضم آنزیمی بر روی ناقل pLEX-MCS توسط آنزیمهای BamHI و XhoI انجام پذیرفت و سپس واکنش لیگاسیون به مدت 16 ساعت در دمای 16 درجه سانتیگراد با نسبت 3:1 از ناقل به ژن هدف انجام گرفت.
محصول لیگاسیون به باکتری E.coli-DH5α مستعد ترانسفرم گردید و روی پلیت LB حاوی 50 میکروگرم آنتیبیوتیک کانامایسین کشت داده شد و در انکوباتور 37 درجه سانتیگراد به صورت شبانه قرار گرفت. روز بعد از کلـونـیهـای رشـد یـافتـه استخـراج پلاسمید انجام شد و
واکنش هضم آنزیمی توسط آنزیمهای XhoI و BamHI صورت گرفت.
تولید ذرات لنتی ویروس حاوی ژن SOX2 :
سازه نوترکیب pLEX-SOX2-pur به همراه دو ناقل کمکی pMD2G و psPAX2 به صورت انتقـال هـم زمـان و بـا روش کلسیم فسفات به سلولهای HEK293T منتقل شدند(شکلهای 3-1). ذرات لنتی ویروس در سلولهای HEK293T تولید شد و سپس سلولهای HEK293T توسط ذرات ویروسی آلوده گردیدند. سلولهای آلوده شده توسط مقاومت به آنتیبیوتیک پورومایسین انتخاب شدند.
مراحل ترنسفکشن بدین شرح صورت گرفت: کشت سلولهای HEK293T 24 ساعت قبل از ترنسفکشن انجام شد و سپس mL 2 از mL 4 محیط کشت با mL 2 محیط تازه بدون سرم تعویض گردید. برای ترانسفکشن ابتدا در یک ویال استریلDNA ، CaCl2 و آب تزریقی استریل کاملاً با هم مخلوط گردید و به مدت 20 دقیقه در دمای محیط انکوبه شد. سپس این محلول به لوله فالکون حاوی µL 435 محلول از (X 10) HBS و بافر فسفات و کلسیم کلراید 2 مولار و سود یک نرمال اضافه گردید. اضافه شدن محلول DNA به محلول فوق به صورت قطره قطره و هم زمان همراه با حبابسازی توسط پیپت و پیپتور بود. محلول فوق به مدت 20 دقیقه در دمای اتاق انکوبه شد و پـس از آن بـه صـورت قطـره قطـره به پلیت حاوی سلول
اضافه گردید.
تایید بیان سازه نوترکیب در سلولهای HEK293T :
جهت تایید قدرت بیان سازه نوترکیــب pLEX-SOX2-
pur، این سازه به تنهایی و بدون ناقلهای کمکی با استفاده از روش کلسیم فسفات به سلولهای HEK293T ترنسفکت گردید. 24 ساعت بعد از ترنسفکت، استخراج RNA از سلولهای HEK293T صورت گرفت. پس از ساخت cDNA و انجام واکنش PCR ، بیان ژن SOX2 روی ژل آگارز بررسی گردید.
یافتهها
برای تخلیص ژن SOX2 ، واکنش هضم آنزیمی از سازه pCR2.1-SOX2 صورت گرفته و باند مربوط به ژن SOX2 از روی ژل تخلیص گردید (شکل 4).
بعد از همسانهسازی، سازه نوترکیب pLEX- SOX2-pur، آزمایشهای تاییدی برای اطمینان از صحت همسانهسازی صورت گرفت. با استفاده از PCR با آغازگرهای اختصاصی دو سر ژن، باند مربوط به SOX2 (966 جفـت بـاز) روی ژل آگارز 1% مشاهده شد(شکل 5).
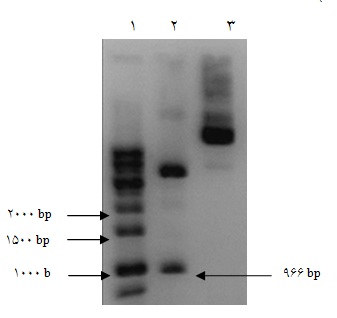
شکل 4: الکتروفورز مربوط به استخراج miniprep و هضم آنزیمی از pCR2.1-SOX2 ،1- 1Kb DNA Ladder BiORON ، 2- محصول هضم آنزیمی، 3- محصول استخراج
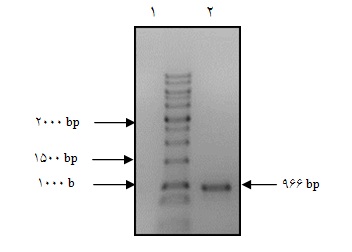
شکل 5 : الکتروفورز مربوط به انجام PCR از pLEX- SOX2-pur برای ژن SOX-2 1- 1Kb DNA ladder Bioron 2- محصول PCR
ترادف آغازگرهای SOX2 :
آغازگر جلوبرنده: (ATGTATAATATGATGGAGACTGAG)
آغازگر معکوس:(TCGCATGTAGAGGGGCAG)
به منظور اطمینان بیشتر، هضم آنزیمی روی پلاسمید استخراج شده حاکی از همسانهسازی صحیح ژن SOX2 در ناقل مورد نظر بود(شکل 6). هم چنین، تعیین توالی سازه نوترکیب با آغازگرهای اختصاصی پیشرو و پسرو انجام شد. توالی فرستاده شده با استفاده از نرمافزارهای Edit Seq
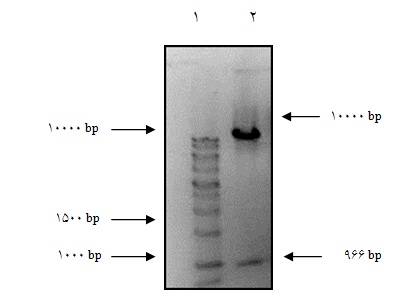
شکل 6: الکتروفورز مربوط به هضم آنزیمی از سازه نوترکیب pLEX-SOX2-pur 1- DNA ، Kb ladder BiORON ، 2- محصول هضم آنزیمی
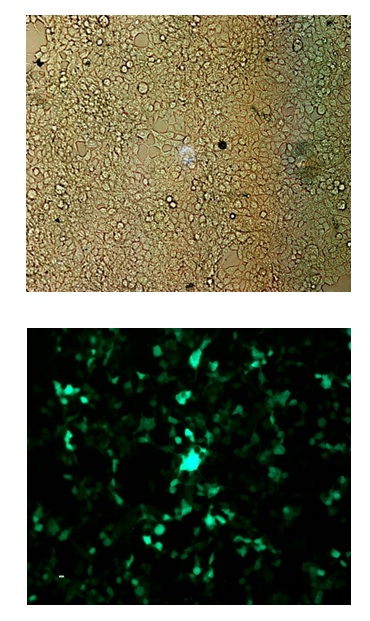
شکل 7- بیان GFP در سلولهای HEK293T (X 100)
و Seq Man مورد بررسی قرار گرفت و پس از هم ردیفی توالی با دادههای بانک ژنی، صحت توالی کلون شده تایید گردید.
به عنوان کنترل از ناقل لنتی ویروس حاوی ژن GFP جهت ترنسفکت سلولهای HEK293T استفاده گردید. بعد از ترنسفکت سازه حاوی GFP به سلولهای HEK293T ، محیط رویی این سلولها بعد از 24 و 48 ساعت جمعآوری گردید. سپس سلولهای HEK293T توسط رقت 3-10 * 2 از نمونه ویروسهای جمعآوری شده آلوده گردیدند و مشاهده شد که پس از 24 ساعت، بیش از 90% سلولهای HEK293T بیان GFP (Green Fluorescent protein) را نشان دادند(شکل 7).
24 ساعت بعد از ترنسفکت، استخراج RNA از سلولهای HEK293T صورت گرفت. نتایج RT-PCR بیان ژن SOX2 در سلولهای HEK293T را تایید نمود(شکل 8).
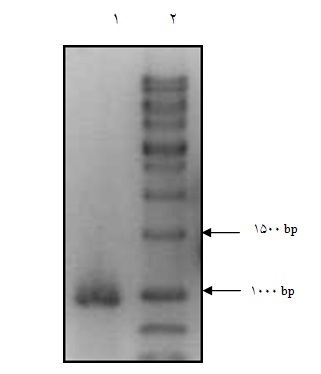
شکل 8: الکتروفورز مربوط به تایید بیان وکتور pLEX-MCS SOX2 در سلولهای HEK293T ترنسفکت شده. 1- محصول PCR، 2- BiORON ، 1 Kb ladder DNA
بحث
سلول درمانی یک روش در پزشکی ترمیمی میباشد که در آن سلولهای سالم با سلولهایی که مردهاند و یا در عملکرد آنها اختلال به وجود آمده جایگزین میشوند (16، 15). برای مثال، در رتینیتیس پیگمنتوزا سلولهای فوتورسپتور از بین میروند. جایگزین درمانی برای این مورد شامل ترنسپلنت سلولهایی است که با شبکیه میزبان همراه شده و به عنوان فوتورسپتور عمل میکنند(18, 17). در کنار اهمیت انتخاب منبع سلولی مناسب، یکی دیگر از مباحث بسیار با اهمیت در سلول درمانی و ژن درمانی انتخاب یک ناقل مناسب میباشد(20, 19). لنتی ویروسها به عنوان ناقل، دارای ویژگیهای منحصر به فردی مانند توانایی انتقال ژن به صورت کارآمد و با بازدهی بالا به انواع سلولهای پستانداران، بیان طولانی مدت ژن نوترکیب، توانایی انتقال ژن به سلولهای تقسیم شونده و غیر تقسیم شونده و عدم ایجـاد پاسـخ ایمنـی ناخواستـه، میباشند که سبب استفاده گسترده از این ناقلها برای ژن درمانی در محیط in vivo و in vitro گردیده است(22, 21).
یکی از راههای ایجاد تمایز هدفمند در سلولهای بنیادی، استفاده از بیان فاکتورهای رونویسی جهت تمایز سلولها در محیط in vitro و سپس استفاده از این سلولهای تمایز یافته و یا نیمه تمایز یافته جهت سلول درمانی میباشد. با توجه به مزیتهای ذکر شده برای استفاده از سیستمهای لنتی ویروسی، در این تحقیق، از سیستم سه ناقلی لنتی ویروسی pLEX-MCS استفاده گردید. در ناقل ترانسفر مورد استفاده در این پژوهش، ژن SOX2 به همراه ژن مقاومت به پورومایسین به صورت هم زمان بیان میشوند. در نتیجه میتوان گفت که در سلولهایی که مقاومت به پورومایسین را نشان میدهند، ژن SOX2 نیز به صورت هم زمان بیان گردیده است که البته این موضوع توسط Real-Time PCR بررسی و تایید شد. یکی از راههای ایجاد تمایز هدفمند در سلولهای بنیادی، استفاده از بیان فاکتورهای رونویسی جهت تمایز سلولها در محیط in vitro و سپس استفاده از این سلولهای تمایز یافته و یا نیمه تمایز یافته جهت سلول درمانی میباشد. برای جایگزین سلول درمانی سلولهای آسیب دیده از طریق بهرهمندی از سلولهای بنیادی، وجود یک ژن تنظیمگر بنیادی که تمامی نیازهای تمایزی را برآورده سازد، مهمترین عامل است. در این تحقیق با توجه به ویژگیهای ژن SOX2 و نقش مهم آن در پایداری ویژگیهای خود تکثیری و بنیادی بودن، از این فاکتور کلونینگ استفاده گردید تا در پژوهشهای آتی برای تمایز زدایی از سلولهای تمایز یافته و مطالعههای مربوط به ایجاد سلولهای خونی، از سلولهای تمایز زدایی شده استفاده شود. بنابر مطالعههای صورت گرفته، به نظر میرسد که تهیه ذرات ویروسی حاوی این فاکتور رونویسی میتواند برای مطالعههای بیشتر جهت بررسی تمایز هدفمند انواع سلولهای بنیادی به سمت سلولهای مختلف استفاده گردد. به همین دلیل ژن بسیار مهم SOX2 در مطالعههای آتی به سلولهای بنیادی مزانشیمی مغز استخوان انتقال یافته و در محیطهای مناسب تمایزی امکان تمایز به ردههای خونساز نیز بررسی خواهد شد.
در این تحقیق، بعد از همسانهسازی ژن SOX2 و تایید سازه نوترکیب pLEX-SOX2-pur توسط روشهای مولکولی، سازه تایید شده به تنهایی به سلولهای HEK293T ترانسفکت گردید و توانایی بیان این ژن توسط RT-PCR در سلولهای HEK293T بررسی شد. این موضوع در آزمایشهایی که با بیان یک سازه نوترکیب مربوط است حایز اهمیت میباشد. چون این احتمال وجود دارد که در حین انجام مراحل همسانهسازی به علت جهشهای احتمالی در سازه نوترکیب، این سازه قدرت بیان ژن مورد نظر را از دست بدهد، بنابراین میتوان بعد از همسانهسازی ژن مورد نظر، بیان آن را بررسی و از صحت سازه نوترکیب مطمئن گردید.
بررسیهای ما نشان داد که ژن SOX2 به خوبی و با صحت ترادف در ناقل لنتی ویروسی مورد نظر کلون گردید و ناقل بیانی حاصل به همراه دو ناقل کمکی توانستند سلولهای HEK293T را در یک ترانسفکشن سهتایی آلوده کنند و پارتیکلهای ویروسی را تولید نمایند. این ذرات ویروسی قادر بودند سلولهای HEK293T را آلوده ساخته و بیان ژن SOX2 و GFP رانشان دهند. نتایج و محصولات این مطالعه برای مطالعههای باز برنامهنویسی سلولی و یا القای تمایز در سلولهای بنیادی با دیدگاه تمایز به سمت سلولهای خونساز مورد استفاده قرار
میگیرند. در مطالعههای مشابه انجام شده دو جنبه از عملکرد SOX2 ، که تمایز و تکثیر hMSCs (Human Mesenchymal Stem Cells) است مورد توجه قرار گرفته است. مکانیسم مولکولی که در هنگام از دست دادن SOX2 باعث تمایز میشود، در این مطالعهها بررسی شدهاند. بیان SOX2 در بقای توانایی چند قوهای بودن hMSCs بسیارمهم است. این وظایف عملکرد SOX2 تا حد زیادی از طریق تنظیم بیان c-Myc انجام میشود که کاملاً متفاوت از نقش آن در ESCs (Embryonic Stem Cells) است. این نتایج یک مکانیزم و نقش جدید را برای بیان SOX2 در تمایز سلولهای بنیادی بالغ مطرح ساخته و یک راهنمای مهم برای تحقیقات بالینی بیشتر در hMSCs و مطالعههای رشد و تکوین سلولهای بنیادی بالغ ارایه میکنند(23).
نتیجهگیری
بررسیهای ما نشان داد که ژن SOX2 به خوبی و با صحت ترادف در ناقل لنتی ویروسی مورد نظر کلون گردید و ناقل بیانی حاصل به همراه دو ناقل کمکی توانستند سلولهای HEK293T را در یک ترانسفکشن سهتایی آلوده کنند و پارتیکلهای ویروسی را تولید نمایند. این ذرات ویروسی قادر بودند سلولهایHEK293T را آلوده ساخته و بیان ژن SOX2 و GFP را نشان دهند. نتایج و محصولات این مطالعه برای مطالعههای باز برنامهنویسی سلولی و یا القای تمایز در سلولهای بنیادی با دیدگاه تمایز به سمت سلولهای خونساز مورد استفاده قرار میگیرند.
تشکر و قدردانی
تحقیق ارایه شده با کمک حمایت مالی صندوق حمایت از پژوهشگران و پژوهشگاه ملی مهندسی ژنتیک و زیست فناوری انجام شده است. نویسندگان مقاله صمیمانه از حمایتهای مالی صندوق حمایت از پژوهشگران و پژوهشگاه ملی مهندسی ژنتیک و زیست فناوری تشکر میکنند.
متن کامل: (3318 مشاهده)
همسانهسازی ژن SOX2 انسانی در ناقل لنتی ویروسی و القای ژنی
در سلولهای HEK293T
انسیه درباری1، زهرا سهیلا سهیلی2
چکیده
سابقه و هدف
ژن SOX2 در میان گونهها، حفاظت شده بوده و از فاکتورهای مهم در القای سلولهای پیشساز از سلولهای تمایز یافته میباشد که موجب حفظ خاصیت پرتوانی سلولهای پیشساز میشود. SOX2 ، OCT4 ، cMYC و KLF4 سبب باز برنامهنویسی سلولهای سوماتیک به سلولهای بنیادی میشوند. امروزه از ژن SOX2 در جهت تولید سلولهای iPS و سلول درمانی استفاده میشود. در این تحقیق همسانهسازی ژن SOX2 در ناقل لنتی ویروس و آلودهسازی سلولهای HEK293T بررسی شد.
مواد و روشها
در یک مطالعه تجربی، توالی کدکننده ژن SOX2 سنتز و در ناقل همسانهسازی pUC57 دریافت گردید. ژن ساختـه شده در ناقل بیانی لنتی ویروس pLEX-MCS ساب ـ کلون شد. سازه نوترکیب توسط روشهای PCR ، هضم آنزیمی و توالییابی تایید شد. ذرات لنتی ویروس در سلولهای تولید کننده HEK293T تولید شدند. از وکتور لنتی ویروسی حاوی ژن GFP به عنوان کنترل استفاده شد. سلولهای HEK293T توسط ذرات ویروسی آلوده شده و به وسیله مقاومت به آنتیبیوتیک پورومایسین انتخاب گردیدند. بیان SOX2 در سلولهای HEK293T توسط RT-PCR بررسی شد.
یافتهها
سازه نوترکیب بیانکننده SOX2ساخته و تایید گردید. سلولهای HEK293T توسط ذرات ویروس آلوده شدند و پس از 24 ساعت، بیش از 90% سلولهای HEK293T بیان GFP را از خود نشان دادند. با استفاده از روش RT-PCR بیان SOX2در سلولهای HEK293T تایید شد.
نتیجه گیری
سلولهایHEK293T با موفقیت سازههای نوترکیب را دریافت و ژنهای GFP و SOX2را بیان نمودند.
کلمات کلیدی: فاکتور رونویسی SOX2، وکتورهای کلونینگ، پروتئینهای فلورسنت سبز
تاریخ دریافت : 12/11/93
تاریخ پذیرش : 30/2 /94
1- دانشجوی کارشناسی ارشد سلولی و مولکولی ـ پژوهشگاه ملی مهندسی ژنتیک و تکنولوژی زیستی ـ تهران ـ ایران
2- مؤلف مسؤول: PhD بیوشیمی ـ استادیار پژوهشگاه ملی مهندسی ژنتیک و تکنولوژی زیستی ـ تهران ـ ایران ـ صندوق پستی: 161/14965
در سلولهای HEK293T
انسیه درباری1، زهرا سهیلا سهیلی2
چکیده
سابقه و هدف
ژن SOX2 در میان گونهها، حفاظت شده بوده و از فاکتورهای مهم در القای سلولهای پیشساز از سلولهای تمایز یافته میباشد که موجب حفظ خاصیت پرتوانی سلولهای پیشساز میشود. SOX2 ، OCT4 ، cMYC و KLF4 سبب باز برنامهنویسی سلولهای سوماتیک به سلولهای بنیادی میشوند. امروزه از ژن SOX2 در جهت تولید سلولهای iPS و سلول درمانی استفاده میشود. در این تحقیق همسانهسازی ژن SOX2 در ناقل لنتی ویروس و آلودهسازی سلولهای HEK293T بررسی شد.
مواد و روشها
در یک مطالعه تجربی، توالی کدکننده ژن SOX2 سنتز و در ناقل همسانهسازی pUC57 دریافت گردید. ژن ساختـه شده در ناقل بیانی لنتی ویروس pLEX-MCS ساب ـ کلون شد. سازه نوترکیب توسط روشهای PCR ، هضم آنزیمی و توالییابی تایید شد. ذرات لنتی ویروس در سلولهای تولید کننده HEK293T تولید شدند. از وکتور لنتی ویروسی حاوی ژن GFP به عنوان کنترل استفاده شد. سلولهای HEK293T توسط ذرات ویروسی آلوده شده و به وسیله مقاومت به آنتیبیوتیک پورومایسین انتخاب گردیدند. بیان SOX2 در سلولهای HEK293T توسط RT-PCR بررسی شد.
یافتهها
سازه نوترکیب بیانکننده SOX2ساخته و تایید گردید. سلولهای HEK293T توسط ذرات ویروس آلوده شدند و پس از 24 ساعت، بیش از 90% سلولهای HEK293T بیان GFP را از خود نشان دادند. با استفاده از روش RT-PCR بیان SOX2در سلولهای HEK293T تایید شد.
نتیجه گیری
سلولهایHEK293T با موفقیت سازههای نوترکیب را دریافت و ژنهای GFP و SOX2را بیان نمودند.
کلمات کلیدی: فاکتور رونویسی SOX2، وکتورهای کلونینگ، پروتئینهای فلورسنت سبز
تاریخ دریافت : 12/11/93
تاریخ پذیرش : 30/2 /94
1- دانشجوی کارشناسی ارشد سلولی و مولکولی ـ پژوهشگاه ملی مهندسی ژنتیک و تکنولوژی زیستی ـ تهران ـ ایران
2- مؤلف مسؤول: PhD بیوشیمی ـ استادیار پژوهشگاه ملی مهندسی ژنتیک و تکنولوژی زیستی ـ تهران ـ ایران ـ صندوق پستی: 161/14965
مقدمه
در طی تکامل جنینی با تقسیم سلولی، تمایز، مهاجرت و تشکیل اندامها، خاصیت پرتوانی این سلولهای بنیادی به طور برگشتناپذیر از دست میرود. در سال 2006 تاکاهاشی و یاماناکا با بیان چهار فاکتور c-MYC ، KLF4 ، SOX2 و OCT4 در سلولهای تمایز یافته فیبروبلاست، سلولهای شبیه سلولهای بنیادی جنینی تولید کردند(1). این سلولها، سلولهای بنیادی پرتوان القایی(iPSC= induce Pluripotent Stem Cell) نامیده شدند. مزیت ایجاد سلولهای پرتوان القایی در توانایی آنها در تمایز به تمامی سلولهای بالغ است. از این رو میتوان از آنها در درمان بیماریهای غیر قابل درمان مانند بیماریهای پارکینسون، آلزایمر، بیماریهای قلبی و تخریب عصبی استفاده نمود(2). این فرآیند تولید سلولهای بنیادی القایی از سلولهای تمایز یافته«دوباره باز برنامهنویسی (reprogramming)» نامیده شد. به دلیل این که منشا اولیه این سلولها میتواند خود بیمار باشد، کاربرد این سلولها در سلول درمانی سیستم ایمنی بدن را تحریک نمیکند. علاوه بر این، تکنولوژی حاضر به محققان این امکان را میدهد که بتوانند بیماریها را در محیط in vitro مدلسازی کنند و عوامل مؤثر در پیشرفت یا درمان و کنترل بیماری را شناسایی نموده و بهترین روش درمان را انتخاب نمایند(3). اما استفاده از تکنولوژی سلولهای بنیادی پرتوان القایی دارای معایبی نیز میباشد(4). فاکتورهای c-MYC و KLF4 میتوانند سبب ایجاد تومور گردند(5). هم چنین برای انتقال فاکتورهای رونویسی القایی باید از لنتی ویروسها استفاده نمود که گاهی با داخل شدن ژنوم ویروس به داخل ژنوم میزبان، جهش و سرطان زایی رخ میدهد(6). امروزه برای جلوگیری از تومورزایی توسط فاکتورهای c-MYC و KLF4 تنها از دو ژن SOX2 ، OCT4 برای دوباره باز برنامهنویسی استفاده میگردد(7).
ژن پروتئین SOX2 برای تولید پروتئینهایی که در تشکیل بافتهای مختلف در طی تکامل جنینی نقش حیاتی دارند، لازم است. SOX2در زیگوت بیان شده و بیان آن بیـن مرحلـه مـرولا و بلاستوسیـت افزایـش پیـدا مـیکند.
پروتئیـن آن 317 اسیـد آمینـه دارد و به مناطق خاص ژنوم
متصل شده و فعالیت ژنها را تنظیم میکند(8).
این پروتئین با OCT4 بر روی DNA کمپلکس تشکیل میدهد و بیان تعدادی از ژنها مانند:
Yamaguchi sarcoma viral oncogene homolog1 (YES1)
Fibroblast Growth Factor (FGF4)
Undifferentiated embryonic cell Transcription Factor 1, (UTF1)
Zinc Finger protein (ZFP206)
و
F-box and leucine-rich repeat protein (FBX)
را که در تکامل جنینی نقش دارند کنترل میکند. کمپلکس OCT4 وSOX2 با پروتئین Nanog واکنش داده و رونویسی فاکتور Rex1 را تنظیم میکند و موجب حفظ خاصیت پرتوانی سلولها میشود(9).
ژن درمانی یک روش درمانی جدید برای درمان بیماریهای ژنتیکی، متابولیسمی، سرطان، عصبی و ایدز میباشد. هدف اصلی از ژن درمانی، انتقال یک ژن خاص به سلول مورد نظر و بیان این ژن برای درمان بیماری است(10). برای ژن درمانی و انتقال ژن مورد نظر به داخل سلول، روشهای متعددی وجود دارد. این روشها به دو دسته ویروسی و غیر ویروسی تقسیم میشوند.
در روشهای غیر ویروسی، انتقال ژن به وسیله ویروسهای مصنوعی(لیپوزومها با ترکیبات مصنوعی)، پلاسمیدهای باکتریایی، وکتورهای پروتئین- چربی و کروموزومهای مصنوعی انجام میشود(11).
در روشهای ویروسی، وکتورهای ویروسی adeno-associated viruses ، adenoviruses ، retroviruses ، flavor viruses-herpes-simplex viruses استفاده میشوند. هر گروه از این وکتورها برای ژن درمانی در انسان دارای محدودیتهایی هستند. به عنوان مثال adenovirusو herpes- simplex viruses با القای سیستم ایمنی میزبان، مانع انتقال پایدار ژن در ژنوم میزبان میشوند و انتقال ژنوم در adeno-associated viruses وابسته به وکتورهای کمکی میباشند در حالی که تواناییهای منحصر به فرد لنتی ویروسها مانند توانایی انتقال ژن به صورت کارآمد و با بازدهی بالا به انواع سلولهای پستانداران، بیان طولانی مدت ژن نوترکیب، توانایی انتقال ژن به سلولهای تقسیم شونـده و غیـر تقسیـم شونـده، عـدم ایجـاد پاسـخ ایمنـی
ناخواسته و توانایی بیان نسبتاً بالای یک ژن در انواع سلولهای پستانداران، مثل انواع ردههای سلولهای بنیادی، منجر به استفاده گسترده از این وکتورها در ژن درمانی در محیط in vivo و in vitro گردیده است. با این حال اشکالات و نگرانیهایی نیز در استفاده از این ابزار مهم وجود دارد. ملاحظات موجود عبارتند از امکان تولید لنتی ویروسهای قادر به همانندسازی، جابهجایی حامل توسط رترو ویروس درونزا مستقر در ژنوم بیماران، جهشزایی افزایشی که منجر به سرطان میشود، تغییر ژرم - لاین که منجر به اثرات بین نسلها شده و انتشار ویروسهای جدید از بیماران ژن درمانی شده(12). برای تولید لنتی ویروس حاوی ژن مورد نظر در محیط in vitro ، از سلولهای HEK293T استفاده میگردد. لنتیویروسهای نوترکیب را میتوان از ترنسفکت هم زمان وکتور ناقل ژن به همراه وکتورهای کمکی کدکننده آنزیمها و نوکلئوپوششها و غشا به سلولهای HEK293T تولید کرد. این ویروسهای نوترکیب را میتوان از محیطرویی سلولهای HEK293T جمعآوری کرد. ژنهای پوششی مختلف اجازه تولید لنتیویروسهای سروتایپ مختلفی را میدهد که تروپیسمهای(تمایل نسبت به سلولی خاص) متفاوتی را نشان میدهند(13). این تحقیق مقدمهای برای استفاده از ناقلین ساخته شده در آلودهسازی سلولهای بنیادی مزانشیمی مغز استخوان است. در این مرحله هدف تولید ذرات ویروسی ناقل ژن مورد نظر، اثبات آلوده شدن یک نوع سلول آزمایشی و بیان ژن مورد نظر و صحت عملکرد سازهها بود.
مواد و روشها
تایید سازه نوترکیب PCR2.1SOX2 توسط هضم آنزیمی:
در یک مطالعه تجربی، با توجه به توالیهای موجود در بانک اطلاعاتی NCBI ، توالی ژن SOX2 تعیین و سفارش ساخت به شرکت Eurofin MWG Operon آلمان ارایه گردید. در هنگام طراحی توالی جهت تسهیل مراحل بعدی همسانهسازی، در انتهای 5' جایگاه برشی XhoI و در انتهای 3' جایگاه برشی BamHI قرار داده شد. در نهایت ژن SOX2 ساخته شده و در پلاسمید pCR2.1 دریافت گردید. بعد از دریافت سازه ژنی pCR2.1-SOX2 ، این سازه نوترکیب به باکتری E.coli-DH5α مستعد(Competent) با روش شوک حرارتی ترانسفرم گردید و سپس روی پلیت LB حاوی آنتیبیوتیک آمپیسیلین کشت و در انکوباتور 37 درجه سانتیگراد به مدت 24 ساعت انکوبه شد. از کلونیهای رشد کرده بر روی پلیت حاوی آمپیسیلین استخراج پلاسمید با کیت DNA-spin™Plasmid Purification Kit (کیاژن، آلمان) صورت پذیرفت.
واکنش هضم آنزیمی از سازه pCR2.1-SOX2 و بازیابی ژن SOX2 :
بعد از تایید شدن سازه نوترکیب pCR2.1-SOX2 ، ژن SOX2 توسط واکنش هضم آنزیمی با آنزیمهای BamHI و XhoI برش خورده و روی ژل آگارز 1% الکتروفورز شد. بدین منظور واکنش هضم آنزیمی در حجم زیادتر(50 میکرولیتر) انجام گردید و بعد از جدا شدن باندها در روی ژل آگارز 1%، باند مربوط به ژن SOX2 (966 جفت باز) از روی ژل توسط تیغ اسکالپل بریده شده و توسط کیت تخلیص از روی ژل High Pure DNA Purification Kit شرکت رُوش، تخلیص و برای کلون شدن در پلاسمید pLEX-MCS-pur (ترموساینتیفیک) مورد استفاده قرار گرفت.
واکنش اتصال و تایید سازه نوترکیب pLEX-SOX2-pur :
در مرحله بعد، ژن تخلیص شده از روی ژل جهت واکنش لیگاسیون 1 با ناقل pLEX-MCS مورد استفاده قرار گرفت. به این منظور ابتدا واکنش هضم آنزیمی بر روی ناقل pLEX-MCS توسط آنزیمهای BamHI و XhoI انجام پذیرفت و سپس واکنش لیگاسیون به مدت 16 ساعت در دمای 16 درجه سانتیگراد با نسبت 3:1 از ناقل به ژن هدف انجام گرفت.
محصول لیگاسیون به باکتری E.coli-DH5α مستعد ترانسفرم گردید و روی پلیت LB حاوی 50 میکروگرم آنتیبیوتیک کانامایسین کشت داده شد و در انکوباتور 37 درجه سانتیگراد به صورت شبانه قرار گرفت. روز بعد از کلـونـیهـای رشـد یـافتـه استخـراج پلاسمید انجام شد و
واکنش هضم آنزیمی توسط آنزیمهای XhoI و BamHI صورت گرفت.
تولید ذرات لنتی ویروس حاوی ژن SOX2 :
سازه نوترکیب pLEX-SOX2-pur به همراه دو ناقل کمکی pMD2G و psPAX2 به صورت انتقـال هـم زمـان و بـا روش کلسیم فسفات به سلولهای HEK293T منتقل شدند(شکلهای 3-1). ذرات لنتی ویروس در سلولهای HEK293T تولید شد و سپس سلولهای HEK293T توسط ذرات ویروسی آلوده گردیدند. سلولهای آلوده شده توسط مقاومت به آنتیبیوتیک پورومایسین انتخاب شدند.
مراحل ترنسفکشن بدین شرح صورت گرفت: کشت سلولهای HEK293T 24 ساعت قبل از ترنسفکشن انجام شد و سپس mL 2 از mL 4 محیط کشت با mL 2 محیط تازه بدون سرم تعویض گردید. برای ترانسفکشن ابتدا در یک ویال استریلDNA ، CaCl2 و آب تزریقی استریل کاملاً با هم مخلوط گردید و به مدت 20 دقیقه در دمای محیط انکوبه شد. سپس این محلول به لوله فالکون حاوی µL 435 محلول از (X 10) HBS و بافر فسفات و کلسیم کلراید 2 مولار و سود یک نرمال اضافه گردید. اضافه شدن محلول DNA به محلول فوق به صورت قطره قطره و هم زمان همراه با حبابسازی توسط پیپت و پیپتور بود. محلول فوق به مدت 20 دقیقه در دمای اتاق انکوبه شد و پـس از آن بـه صـورت قطـره قطـره به پلیت حاوی سلول
اضافه گردید.
تایید بیان سازه نوترکیب در سلولهای HEK293T :
جهت تایید قدرت بیان سازه نوترکیــب pLEX-SOX2-
pur، این سازه به تنهایی و بدون ناقلهای کمکی با استفاده از روش کلسیم فسفات به سلولهای HEK293T ترنسفکت گردید. 24 ساعت بعد از ترنسفکت، استخراج RNA از سلولهای HEK293T صورت گرفت. پس از ساخت cDNA و انجام واکنش PCR ، بیان ژن SOX2 روی ژل آگارز بررسی گردید.
یافتهها
برای تخلیص ژن SOX2 ، واکنش هضم آنزیمی از سازه pCR2.1-SOX2 صورت گرفته و باند مربوط به ژن SOX2 از روی ژل تخلیص گردید (شکل 4).
بعد از همسانهسازی، سازه نوترکیب pLEX- SOX2-pur، آزمایشهای تاییدی برای اطمینان از صحت همسانهسازی صورت گرفت. با استفاده از PCR با آغازگرهای اختصاصی دو سر ژن، باند مربوط به SOX2 (966 جفـت بـاز) روی ژل آگارز 1% مشاهده شد(شکل 5).

شکل 4: الکتروفورز مربوط به استخراج miniprep و هضم آنزیمی از pCR2.1-SOX2 ،1- 1Kb DNA Ladder BiORON ، 2- محصول هضم آنزیمی، 3- محصول استخراج

شکل 5 : الکتروفورز مربوط به انجام PCR از pLEX- SOX2-pur برای ژن SOX-2 1- 1Kb DNA ladder Bioron 2- محصول PCR
ترادف آغازگرهای SOX2 :
آغازگر جلوبرنده: (ATGTATAATATGATGGAGACTGAG)
آغازگر معکوس:(TCGCATGTAGAGGGGCAG)
به منظور اطمینان بیشتر، هضم آنزیمی روی پلاسمید استخراج شده حاکی از همسانهسازی صحیح ژن SOX2 در ناقل مورد نظر بود(شکل 6). هم چنین، تعیین توالی سازه نوترکیب با آغازگرهای اختصاصی پیشرو و پسرو انجام شد. توالی فرستاده شده با استفاده از نرمافزارهای Edit Seq

شکل 6: الکتروفورز مربوط به هضم آنزیمی از سازه نوترکیب pLEX-SOX2-pur 1- DNA ، Kb ladder BiORON ، 2- محصول هضم آنزیمی

شکل 7- بیان GFP در سلولهای HEK293T (X 100)
و Seq Man مورد بررسی قرار گرفت و پس از هم ردیفی توالی با دادههای بانک ژنی، صحت توالی کلون شده تایید گردید.
به عنوان کنترل از ناقل لنتی ویروس حاوی ژن GFP جهت ترنسفکت سلولهای HEK293T استفاده گردید. بعد از ترنسفکت سازه حاوی GFP به سلولهای HEK293T ، محیط رویی این سلولها بعد از 24 و 48 ساعت جمعآوری گردید. سپس سلولهای HEK293T توسط رقت 3-10 * 2 از نمونه ویروسهای جمعآوری شده آلوده گردیدند و مشاهده شد که پس از 24 ساعت، بیش از 90% سلولهای HEK293T بیان GFP (Green Fluorescent protein) را نشان دادند(شکل 7).
24 ساعت بعد از ترنسفکت، استخراج RNA از سلولهای HEK293T صورت گرفت. نتایج RT-PCR بیان ژن SOX2 در سلولهای HEK293T را تایید نمود(شکل 8).

شکل 8: الکتروفورز مربوط به تایید بیان وکتور pLEX-MCS SOX2 در سلولهای HEK293T ترنسفکت شده. 1- محصول PCR، 2- BiORON ، 1 Kb ladder DNA
بحث
سلول درمانی یک روش در پزشکی ترمیمی میباشد که در آن سلولهای سالم با سلولهایی که مردهاند و یا در عملکرد آنها اختلال به وجود آمده جایگزین میشوند (16، 15). برای مثال، در رتینیتیس پیگمنتوزا سلولهای فوتورسپتور از بین میروند. جایگزین درمانی برای این مورد شامل ترنسپلنت سلولهایی است که با شبکیه میزبان همراه شده و به عنوان فوتورسپتور عمل میکنند(18, 17). در کنار اهمیت انتخاب منبع سلولی مناسب، یکی دیگر از مباحث بسیار با اهمیت در سلول درمانی و ژن درمانی انتخاب یک ناقل مناسب میباشد(20, 19). لنتی ویروسها به عنوان ناقل، دارای ویژگیهای منحصر به فردی مانند توانایی انتقال ژن به صورت کارآمد و با بازدهی بالا به انواع سلولهای پستانداران، بیان طولانی مدت ژن نوترکیب، توانایی انتقال ژن به سلولهای تقسیم شونده و غیر تقسیم شونده و عدم ایجـاد پاسـخ ایمنـی ناخواستـه، میباشند که سبب استفاده گسترده از این ناقلها برای ژن درمانی در محیط in vivo و in vitro گردیده است(22, 21).
یکی از راههای ایجاد تمایز هدفمند در سلولهای بنیادی، استفاده از بیان فاکتورهای رونویسی جهت تمایز سلولها در محیط in vitro و سپس استفاده از این سلولهای تمایز یافته و یا نیمه تمایز یافته جهت سلول درمانی میباشد. با توجه به مزیتهای ذکر شده برای استفاده از سیستمهای لنتی ویروسی، در این تحقیق، از سیستم سه ناقلی لنتی ویروسی pLEX-MCS استفاده گردید. در ناقل ترانسفر مورد استفاده در این پژوهش، ژن SOX2 به همراه ژن مقاومت به پورومایسین به صورت هم زمان بیان میشوند. در نتیجه میتوان گفت که در سلولهایی که مقاومت به پورومایسین را نشان میدهند، ژن SOX2 نیز به صورت هم زمان بیان گردیده است که البته این موضوع توسط Real-Time PCR بررسی و تایید شد. یکی از راههای ایجاد تمایز هدفمند در سلولهای بنیادی، استفاده از بیان فاکتورهای رونویسی جهت تمایز سلولها در محیط in vitro و سپس استفاده از این سلولهای تمایز یافته و یا نیمه تمایز یافته جهت سلول درمانی میباشد. برای جایگزین سلول درمانی سلولهای آسیب دیده از طریق بهرهمندی از سلولهای بنیادی، وجود یک ژن تنظیمگر بنیادی که تمامی نیازهای تمایزی را برآورده سازد، مهمترین عامل است. در این تحقیق با توجه به ویژگیهای ژن SOX2 و نقش مهم آن در پایداری ویژگیهای خود تکثیری و بنیادی بودن، از این فاکتور کلونینگ استفاده گردید تا در پژوهشهای آتی برای تمایز زدایی از سلولهای تمایز یافته و مطالعههای مربوط به ایجاد سلولهای خونی، از سلولهای تمایز زدایی شده استفاده شود. بنابر مطالعههای صورت گرفته، به نظر میرسد که تهیه ذرات ویروسی حاوی این فاکتور رونویسی میتواند برای مطالعههای بیشتر جهت بررسی تمایز هدفمند انواع سلولهای بنیادی به سمت سلولهای مختلف استفاده گردد. به همین دلیل ژن بسیار مهم SOX2 در مطالعههای آتی به سلولهای بنیادی مزانشیمی مغز استخوان انتقال یافته و در محیطهای مناسب تمایزی امکان تمایز به ردههای خونساز نیز بررسی خواهد شد.
در این تحقیق، بعد از همسانهسازی ژن SOX2 و تایید سازه نوترکیب pLEX-SOX2-pur توسط روشهای مولکولی، سازه تایید شده به تنهایی به سلولهای HEK293T ترانسفکت گردید و توانایی بیان این ژن توسط RT-PCR در سلولهای HEK293T بررسی شد. این موضوع در آزمایشهایی که با بیان یک سازه نوترکیب مربوط است حایز اهمیت میباشد. چون این احتمال وجود دارد که در حین انجام مراحل همسانهسازی به علت جهشهای احتمالی در سازه نوترکیب، این سازه قدرت بیان ژن مورد نظر را از دست بدهد، بنابراین میتوان بعد از همسانهسازی ژن مورد نظر، بیان آن را بررسی و از صحت سازه نوترکیب مطمئن گردید.
بررسیهای ما نشان داد که ژن SOX2 به خوبی و با صحت ترادف در ناقل لنتی ویروسی مورد نظر کلون گردید و ناقل بیانی حاصل به همراه دو ناقل کمکی توانستند سلولهای HEK293T را در یک ترانسفکشن سهتایی آلوده کنند و پارتیکلهای ویروسی را تولید نمایند. این ذرات ویروسی قادر بودند سلولهای HEK293T را آلوده ساخته و بیان ژن SOX2 و GFP رانشان دهند. نتایج و محصولات این مطالعه برای مطالعههای باز برنامهنویسی سلولی و یا القای تمایز در سلولهای بنیادی با دیدگاه تمایز به سمت سلولهای خونساز مورد استفاده قرار
میگیرند. در مطالعههای مشابه انجام شده دو جنبه از عملکرد SOX2 ، که تمایز و تکثیر hMSCs (Human Mesenchymal Stem Cells) است مورد توجه قرار گرفته است. مکانیسم مولکولی که در هنگام از دست دادن SOX2 باعث تمایز میشود، در این مطالعهها بررسی شدهاند. بیان SOX2 در بقای توانایی چند قوهای بودن hMSCs بسیارمهم است. این وظایف عملکرد SOX2 تا حد زیادی از طریق تنظیم بیان c-Myc انجام میشود که کاملاً متفاوت از نقش آن در ESCs (Embryonic Stem Cells) است. این نتایج یک مکانیزم و نقش جدید را برای بیان SOX2 در تمایز سلولهای بنیادی بالغ مطرح ساخته و یک راهنمای مهم برای تحقیقات بالینی بیشتر در hMSCs و مطالعههای رشد و تکوین سلولهای بنیادی بالغ ارایه میکنند(23).
نتیجهگیری
بررسیهای ما نشان داد که ژن SOX2 به خوبی و با صحت ترادف در ناقل لنتی ویروسی مورد نظر کلون گردید و ناقل بیانی حاصل به همراه دو ناقل کمکی توانستند سلولهای HEK293T را در یک ترانسفکشن سهتایی آلوده کنند و پارتیکلهای ویروسی را تولید نمایند. این ذرات ویروسی قادر بودند سلولهایHEK293T را آلوده ساخته و بیان ژن SOX2 و GFP را نشان دهند. نتایج و محصولات این مطالعه برای مطالعههای باز برنامهنویسی سلولی و یا القای تمایز در سلولهای بنیادی با دیدگاه تمایز به سمت سلولهای خونساز مورد استفاده قرار میگیرند.
تشکر و قدردانی
تحقیق ارایه شده با کمک حمایت مالی صندوق حمایت از پژوهشگران و پژوهشگاه ملی مهندسی ژنتیک و زیست فناوری انجام شده است. نویسندگان مقاله صمیمانه از حمایتهای مالی صندوق حمایت از پژوهشگران و پژوهشگاه ملی مهندسی ژنتیک و زیست فناوری تشکر میکنند.
نوع مطالعه: پژوهشي |
موضوع مقاله:
بيوتكنولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |