جلد 12، شماره 3 - ( پاييز 1394 )
جلد 12 شماره 3 صفحات 243-233 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ehsan M, Abroun S, Anjomshoaa A, Rezapour M, Rezaei Z. Association of alleles and haplotypes of HLA-A,-B,-DRB1 patients with Acute Myeloid Leukemia (AML) in Kerman province. bloodj 2015; 12 (3) :233-243
URL: http://bloodjournal.ir/article-1-935-fa.html
URL: http://bloodjournal.ir/article-1-935-fa.html
احسان محسن، آبرون سعید، انجم شعاع احمد، رضاپور محسن، رضایی زهرا. ارتباط آللهای HLA-A,-B,-DRB1 در بیماران مبتلا به لوسمی میلوئیدی حاد (AML) در استان کرمان. فصلنامه پژوهشی خون. 1394; 12 (3) :233-243
تهران ـ ایران ـ صندوق پستی: 331-14115
متن کامل [PDF 695 kb]
(3307 دریافت)
| چکیده (HTML) (8739 مشاهده)
مقدمه
لوکوسهای ژنتیکی که در پس زدن بافتهای بیگانه دخالت دارند، کمپلکس اصلی سازگاری بافتی(MHC = Major Histocompatibility Complex) نامیده میشوند. عملکرد اصلی این کمپلکس در واقع ارایه آنتیژنهای عرضه شده توسط سلولهای عرضه کننده آنتیژن به لنفوسیتهای T میباشد. جایگاه ژنی MHC حاوی بیشترین اطلاعات برای عرضه مناسب آنتیژنها بوده و به سه ناحیه ژنی مشخص کلاس I ، II و III تقسیم میشود. در کلاس I جایگاههای ژنهای A ،B وC و در کلاس II جایگاههای ژنهای DP ،DQ و DR وجود دارند که در نهایت موجب تولید پروتئینهایی بدین نامها میشوند. هر یک از پروتئینهای کلاس II دارای زنجیرههای αو β هستند که تحت عنوان DRA1و DRB1و یاDPA1 ، DPB1 و... نامگذاری میشوند. در ناحیه کلاس IIIنیز جایگاههای ژنهای مهمی وجود دارند که از جمله آنها میتوان به ژنهای برخی از پروتئینهای کمپلمان (C2 ، C4B ،C4A)، یک سری از سایتوکاینها (TNF-β ، LTA و LTB) و نیز پروتئینهای شوک حرارتی اشاره کرد.
مطالعه آللها و هاپلوتیپهایHLA به چند جهت دارای اهمیت هستند: 1- پیوند بافت و اعضا، 2- مطالعههای مردم شناسی، مهاجرت و آمیختگیهای جوامع مختلف، 3- تایید یا رد اصالت والدین و تشخیص هویت در پزشکی قانونی، 4- مطالعه ارتباط آللها و هاپلوتیپهای HLA با خطر ابتلا و یا مقاومت به یک سری از بیماریها که اهمیت بالینی نیز دارد(4-1).
به جهت نقش اصلی مولکولهای HLA در تنظیم پاسخ ایمنی و پلیمورفیسم بسیار زیاد این سیستم، تحقیقات نشاندهنده این نکته بوده که برخی از آللهای HLA ، با یک سری از بیماریها مرتبط میباشند. از جمله مهمترین بیماریهایی که ارتباطشان با تعدادی از آللهای HLA بررسی شده است: بیماریهای اتوایمیون، بیماریهای عفونی و سرطانها هستند.
سرطان یکی از مشکلات اصلی سلامت در سراسر جهان است. این بیماری از جمله بیماریهایی است که تا کنون موجب مرگ و میر بسیاری از کودکـان و بزرگسـالان
در نقاط مختلف دنیا شده است. بدخیمی سلولهای سرطانی تا حدود زیادی توسط فعالیت تکثیری کنترل نشده، مقاومت به آپوپتوز و توانایی سلولهای سرطانی در تهاجم به بافتهای میزبان و متاستاز به مناطق دور دست تعیین میگردد(5).
وجود این احتمال که سرطان میتواند به وسیله پاسخهای ایمنی کنترل شود، سبب شده است تا تحقیقات وسیعی در زمینه ایمونولوژی سرطان انجام پذیرد. نظریه مراقبت ایمنی که به وسیله برنت در دهه 1950 مطرح شد، تاکید میکند که وظیفه فیزیولوژیک سیستم ایمنی آن است که کلونهای سلولی تغییر شکل یافته را پیش از آن که رشد مضاعف نمایند و به صورت توده سرطانی درآیند، شناسایی و منهدم نماید و در صورتی که نتواند آنها را نابود کند، فعالیت آنها را تا حد ممکن محدود سازد(6).
لوسمی میلوئید حاد (AML) یک بیماری بدخیم کلونال خون است که با تجمع سلولهای میلوئید نابالغ و اختلال در خونسازی طبیعی همراه است(7). تقریباً به ازای هر 100000 کودک، 2 تا 3 نفر از آنها به لوسمی میلوئید حاد مبتلا میشوند که با افزایش سن میزان ابتلا به 15 نفر در هر 100000 فرد بزرگسال میرسد. علت اصلی لوسمی میلوئید حاد هنوز کاملاً مشخص نیست ولی مطالعههای گوناگون صورت گرفته در این مبحث، از تاثیر عوامل محیطی و ژنتیکی در استعداد ابتلا به این بیماری حکایت میکنند. مقادیر بسیار بالای اشعههای یونیزان، تماس مداوم با بنزن، استنشاق مزمن دود تنباکو، مصرف الکل و از همه مهمتر بیماران دارای لنفوم یا سرطانهای غیر خونی که در معرض شیمی درمانی شدید قرار میگیرند، به خصوص در مواردی که درمان بیمار با عوامل آلکیله کننده یا مهارکنندههای توپوایزومرازII صورت گرفته است، از جمله مهمترین عوامل مستعد کننده محیطی هستند که موجب ابتلا به لوسمی میلوئید حاد(AML) میشوند(8).
تریزومی 21 (سندرم داون)، آنمی فانکونی، سندرم شواخمن - دیاموند، مونوزومی 7 خانوادگی و بسیاری از بیماریهای مادرزادی دیگر از جمله بیماریهای ژنتیکی مستعدکننده ابتلا به AML میباشند(12-9). علاوه بر بیماریها و سندرمهای ژنتیکی مذکور که استعداد ابتلا به لوسمی را افزایش میدهند، برخی از آللهای HLA نیز به عنوان عوامل ایمنوژنتیک مؤثر، میتوانند در استعداد ابتلا و یا ایجاد مقاومت به لوسمی نقش داشته باشند(18-13).
بنابراین مطالعه آللهای HLA در بیماران AML میتواند از دو جهت حایز اهمیت باشد: به عنوان مکملی در کنار سایر آزمایشهای تشخیصی، میتواند به تعیین پیشآگهی، چگونگی روند درمان و یا حتی احتمال عود مجدد بیماری کمک کند و این که استفاده از اطلاعات به دست آمده از ایمنوژنتیک مبتلایان میتواند به عنوان فاکتور خطر مستعدکننده به ابتلا و یا عامل مقاومتدهنده به بیماری در جوامع مختلف بررسی شود (21-19). در این مطالعه گروه مردم کرمان برای بررسی موارد فوق انتخاب شد.
مواد و روشها
نوع مطالعه اپیدمیولوژیک در نظر گرفته شده برای این تحقیق، مورد- شاهدی بود، از همین رو 33 بیمار مبتلا به AML (14 زن با میانگین سنی 6/11 ± 5/36 سال و 19 مرد با میانگین سنی 3/15 ± 2/33 سال) که بر اساس تشخیص پزشک معالجشان در بخش انکولوژی بیمارستان باهنر کرمان بستری بودند و 270 نفر از گروه کنترل سالم(130 زن با میانگین سنی 8/15 ± 9/29 سال و 140 مرد با میانگین سنی 8/16 ± 6/29 سال) که هیچ نسبت فامیلی با بیماران نداشتند، مورد بررسی قرار گرفتند. از افراد مذکور به میزان 5/2 میلیلیتر نمونه خون محیطی در ویال حاوی ضد انعقاد DETA-K2(2H2O) 5% جمعآوری گردید. با استفاده از روش ستونی، DNA ژنومی نمونهها استخراج شد.
از کیت ABDR-PCR-SSPمحصول کمپانی TBG به منظور انجام واکنش زنجیرهای پلیمراز و تکثیر آللهای HLA-A,-B,-DRB1 استفاده شد. این کیت دارای یک مجموعه 96 چاهکی است که چاهک اول کنترل منفی تست میباشد، چاهکهای 2 تا 24 مربوط به بررسی HLA-A ، چاهکهای 25 تا 72 مربوط به بررسی HLA-B و چاهکهای 73 تا 96 مربوط به بررسیHLA-DRB1 هستنـد. بـر طبق دستوالعمل کیت، رونـد تکثیـر آلـلهـای HLA-A,-B,-DRB1 طی شد.
سپس الکتروفورز محصول واکنش زنجیرهای پلیمراز توسط بافر TBE1x انجام شد. پس از اتمام مرحله الکتروفورز، با استفاده از دستگاه ژل داک از ژل تصویربرداری انجام شد و تصاویر به دست آمده توسط نرمافزار TBG (MorganTM SSPal HLA Typing Analysis) Software نسخه 3/2 آنالیز شدند(شکل 1). بدین طریق آللهای HLA-A,-B,-DRB1 گروههای هدف تعیین گشت. پس از اتمام مراحل آزمایشگاهی به منظور بررسی تفاوت فراوانی هر یک از آللهای HLA-A,-B,-DRB1 ، در میان گروه بیماران AML و گروه کنترل سالم از آزمون مربع کای استفاده شد. در بررسی وجود رابطه بین آللهای HLA-A,-B,-DRB1 ، گروه بیمار با گروه کنترل سالم، نسبت شانس ابتلا (OR)و فاصله اطمینان آن 95% (CI) بوده و 05/0 p = یا کمتر از آن معنادار در نظر گرفته شد. تمامی این محاسبات با استفاده از نرمافزار SPSS نسخه 19 انجام شد.
شکل 1: تصویر به دست آمده از الکتروفورز محصول واکنش زنجیرهای پلیمراز
یافتهها
لوکوس HLA-A :
در مطالعه لوکوس HLA-A به منظور بررسی آللهای مستعدکننده برای بیماری AML ،آلل HLA-A*11 با فراوانی 19 مورد(8/28%) در بیماران و 92 مورد (17%) در گروه کنترل سالم با 02/0p= ، 97/1OR= و 51/3-10/1 = 95% CI به عنوان آلل مستعدکننده معنادار در ابتلا به بیماریAML ، شناخته شد.
در بررسی آللهای محافظتکننده در برابر بیماری AML ، آلل محافظت کننده معناداری در برابر بیماری یافت نشد. در این لوکوس آلل HLA-A*01 با فراوانی 1 مورد در بیماران (5/1%) و 39 مورد (2/7%) در گروه کنترل سالم
با 08/0p= ، 19/0 = OR و 46/1-03/0 = 95% CI و هم چنین آلل HLA-A*68 با فراوانی 1 مورد در بیماران (5/1%) و 38 مورد (2/7%) در گروه کنتـرل سالم با 08/0 p= ، 20/0 OR = و 51/1-03/0 = 95% CI به نظر میرسند که کاهش فراوانی محسوسی نسبت به سایر آللها در بیماران دارند ولی این تفاوتها معنادار نبودند(جدول 1 و نمودار 1).
جدول 3: بررسی آللهای لوکوس HLA-DRB1 گروه بیمار و گروه کنترل سال
کاهش فراوانی محسوسی نسبت به سایر آللها در بیماران دارد ولی این تفاوت معنادار نبود(نمودار 2 و جدول 2).
لوکوس HLA-DRB1 :
در مطالعه لوکوس HLA-DRB1 به منظور بررسی آللهای مستعدکننده برای بیمار AML، آلل مستعدکننده معناداری یافت نشد. در این لوکوس آلل HLA- DRB1*11 با فراوانی 10 مورد در بیماران (2/15%) و 48 مورد (9/8%) در گروه کنترل سالم با 10/0p= ، 83/1OR= و 82/3-88/0 = 95% CI به نظر میرسد که افزایش فراوانی محسوسی نسبت به سایر آللها در بیماران دارد ولی معنادار نشد.
در بررسی آللهای محافظت کننده در برابر بیماری AML در لوکوسHLA-DRB1 ، آلل معناداری دیده نشد. این در حالی است که آلل HLA- DRB1*01 با فراوانی 7 مورد در بیماران (6/10%) و 49 مورد (17%) در گروه کنترل سالم با 18/0p= ، 58/0OR= و 31/1-26/0 = 95% CI به نظر میرسد که کاهش فراوانی محسوسی نسبت به سایر آللها در بیماران دارد ولی این تفاوت معنادار نبود(جدول 3 و نمودار 3).
بحث
اولین مطالعه پیرامون ارتباط بین اختلالات هماتولوژی و MHC در سال 1964 توسط لیلی و همکارانش بر روی گونههای مختلف موش مبتلا به لنفوما انجام شد(22). پس از آن نیز مطالعهها برروی گونههای موشی توسط تنانت و همکارانش ادامه یافت ولوکوس H-2 به عنوان فاکتور مستعد کننده به بدخیمیهای هماتولوژیک در موش معرفی شد(23). در سال 1967 اولین مطالعه ارتباط بین بدخیمیهای هماتولوژیک انسان و HLA توسط آمیل و همکارانش انجام شد که به بررسی ایمنوژنتیک بیماران مبتلا بهALL پرداختند. در این مطالعه فراوانی HLA-A*02 در بیماران بیشتر از سایر آللها بود(24). در طی این 50 سال مطالعههای مختلفی پیرامون ارتباط آللهای کلاسهای مختلف HLA با بیماری AML در جریان بوده ولی در بسیاری از آنها از روش سرولوژی برای تعیین آنتیژنهای HLA استفـاده شـده اسـت. بـه دلیـل هـم خـوانـی بیشتـر
تحقیقات با یکدیگر در این بخش سعی شده به بررسی مطالعههایی که به روش مولکولار انجام شدهاند پرداخته شود.
در سال 2002 گوانس و همکارانش در بررسی آللهای HLA کلاس I و II150بیمار AML در انگلستان، ارتباط معنادار میان بیماری و آللهای HLA نیافتند(25). با توجه به نتایج بررسی حاضر، به دست آمدن چنین نتایجی دور از ذهن نیست چرا که از بین آللهای HLA کلاس I و II مطالعه اخیر نیز تنها آلل HLA-A*11 معنادار بود.
در سال 2006 صراف نژاد وهمکارانش به بررسی آللهای HLA کلاس IIبیمارانAML در ایران پرداختند و آللHLA-DRB1*11 را به عنوان عامل مستعد کننده در بیماران معرفی نمودند(26). در نتایجی هم که در این مطالعه به دست آمده، HLA- DRB1*11 در گروه بیماران افزایش فراوانی داشت ولی در مقایسه با گروه کنترل معنادار نبود، ممکن است تعداد کم بیماران مطالعه شده در این ارزیابی، علت این امر باشد.
در سال 2013 فرنانداز ـ تورز وهمکارانش در مطالعه آللهای HLA کلاس I بیماران AML در مکزیک، آلل HLA-B*27 را به عنوان فاکتور ژنتیکی مستعد کننده و آللهای HLA-B*15 و HLA-B*40 را به عنوان فاکتورهای ژنتیکی مقاومت دهنده در برابر AML معرفی کردهاند(27). نکته جالب مقایسه پژوهش فوق با مطالعه انجام شده این است که از آلل HLA-B*15 حتی یک مورد هم در بیماران کرمانی دیده نشد، شاید بتوان آن را به عنوان عامل مقاومت دهنده بررسی کرد هر چند که به علت فراوانی کم HLA-B*15 در گروه کنترل سالم، این ارتباط معنادار نبود.
مقایسه مطالعههایی که پیش از این انجام شده با مطالعه اخیر بیانگر یک سری تفاوت در نتایج میباشد که اشاره به 2 نکته مهم در این بین میتواند راهگشا باشد: اول این که با توجه به گستردگی آللهای HLA کلاسI و II به علت پلیمورفیسم فراوان آنها و تنوع ژنتیکی متفاوت گسترش آللهای HLA در میان اقوام و نژادهای مختلف جهان رسیدن به نتایج یکسان دشوار است، دوم این که فاکتورهای متعدد محیطی و ژنتیکی در ایجاد بیماری AML نقـش دارنـد و نمیتوان یک عامل را صرفاً بـه عنوان دلیل
بیماری در نظر گرفت.
با توجه به شرایط فوق نکته قابل تامل دیگر این است که در تمام مطالعههای انجام شده تا کنون هیچ یک از محققان پس از اعلام نتیجه نهایی و عنوان کردن آللهای مستعد کننده و یا مقاومت دهنده به بیماری AML در مطالعه خود، اشارهای به چگونگی و مکانیسم اثر آن آلل در استعداد ابتلا و یا مقاومت به دست آمده نداشتهاند. به هرحال ارتباط بین بیماریهای سرطانی و آللهای HLA ارتباط ضعیفی است ولی ارتباط آللهای HLA با عوامل سرطانزای دیگر مثل بیماریهای عفونی، ارتباط به مراتب قویتری میباشد. یکی از این عوامل عفونی که میتواند موجب بدخیمیهای هماتولوژیک شود، ویروس اپشتاین بار (EBV) میباشد. بررسیهای ایمنولوژیک در مورد این ویروس نشان میدهد که آنتیژنهای پروتئینی ویروس توسط سلولهای عرضهکننده آنتیژن((APC شناسایی شده و به منظور عرضه در سطح سلول در اختیارسیستم HLA قرار میگیرند. در این میان زمانی که فرد مبتلا دارای HLA-A*11 باشد، ویروس اپشتاین بار منجر به خاموش شدن این آلل و عدم عرضه مناسب آن به سطح سلول شده در نتیجه لنفوسیتT سایتوتوکسیک قادر به شناسایی EBV نیست و به علت همین نقص در ایمنی سلولی، واکنش مناسبی بر علیه ویروس دیده نمیشود(29، 28). این توانایی در خاموش کردن سیستم ایمنی بدن موجب میشود که ویروس در بدن افراد دارای HLA-A*11 فعال باقی بماند که خود عاملی در استعداد ابتلا به بدخیمیهـای هماتولوژیک محسوب میشود.
لازم به ذکر است که EBV ، یکی از عوامل مهم در ایجاد لنفوم بورکیت، سرطان بینی و گلو، لنفوم پس از پیوند کلیه، برخی سرطانهای لنفاوی و بیماری هوچکین میباشد(30). درمان هریک از بیماران مذکور با داروهای شیمی درمانی شدید به خصوص در مواردی که درمان بیمار با عوامل آلکیله کننده یا مهارکنندههای توپوایزومراز II صورت گرفته است، از جمله مهمترین عوامل ایجاد بیماری AML به شمار میرود. علاوه بر این، EBV به عنوان یک ویروس DNA دار سرطانزا میتواند به شکل غیر مستقیم موجب بیماری AML گردد(31).
نتیجهگیری
در مطالعه اخیر آلل HLA-A*11 در بیماران AML دارای فراوانی معنادار بیشتر نسبت به گروه کنترل سالم بود از این رو ممکن است وجود HLA-A*11 در بیماران AML فاکتور مستعد کننده ژنتیکی برای ابتلا به این بیماری باشد.
تشکر و قدردانی
از مدیریت و پرسنل آزمایشگاه ایمنوژنتیک کلینیک تخصصی و فوق تخصصی جوادالائمه(ع) وپزشکان محترم بخش انکولوژی بیمارستان باهنر دانشگاه علوم پزشکی کرمان که به ما در جهت پیشبرد این مطالعه یاری رساندند کمال تشکر را داریم.
متن کامل: (4062 مشاهده)
ارتباط آللهای HLA-A,-B,-DRB1 در بیماران مبتلا به لوسمی
میلوئیدی حاد (AML) در استان کرمان
محسن احسان1، سعید آبرون2، احمد انجم شعاع3، محسن رضاپور4، زهرا رضایی5
چکیده
سابقه و هدف
سیستم HLA نقش کلیدی در فرار سلولهای سرطانی از سیستم ایمنی ایفا میکند. AML سرطان رده میلوئیدی سلولهای خونی است که با رشد سریع سلولهای سفید غیر طبیعی در مغز استخوان شناخته میشود. مطالعههای متعدد در سراسر جهان ارتباط AML با آللهای HLA را بررسی نمودهاند. این مطالعه با هدف بررسی ارتباط بین آللهای HLA-A,-B,-DRB1 و بیماریAML در استان کرمان انجام شد.
مواد و روشها
در یک مطالعه مورد ـ شاهدی، آللهای HLA-A,B,-DRB1 با استفاده از روش مولکولی PCR-SSP، در 33 بیمار AML و 270 فرد گروه شاهد سالم غیر مرتبط با بیماران در استان کرمان ایران بررسی گردید. یافتهها توسط آزمون 2c و نرمافزار 19 SPSS تجزیه و تحلیل شدند.
یافتهها
دراین بررسی فراوانی آلل HLA-A*11 در بیماران مبتلا به AML ، 19 مورد (8/28%) و در گروه کنترل سالم 92 مورد (17%) بود که با 02/0p= ، 97/1OR= و 51/3-10/1 = 95% CI نشاندهنده وجود ارتباط مثبت معنادار بین حضور این آلل و بیماری AML بود.
نتیجه گیری
وجود HLA-A*11 در بیماران AML ممکن است فاکتور مستعد کنندهای برای ابتلا به این بیماری باشد.
کلمات کلیدی: لوسمی میلوئیدی حاد، HLA-A ، HLA DRB1 ، فراوانی آلل
تاریخ دریافت : 12/11/93
تاریخ پذیرش : 3 /3 /94
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ دانشکده علوم پزشکی دانشگاه تربیت مدرس تهران و دانشکده پزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- مؤلف مسئول: PhD هماتولوژی و بانک خون ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 331-14115
3- PhD ژنتیک پزشکی ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
4- PhD آمار ـ استادیار دانشکده ریاضی و کامپیوتر دانشگاه شهید باهنر کرمان ـ کرمان ـ ایران
5- کارشناس علوم آزمایشگاهی ـ دانشکده پزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
میلوئیدی حاد (AML) در استان کرمان
محسن احسان1، سعید آبرون2، احمد انجم شعاع3، محسن رضاپور4، زهرا رضایی5
چکیده
سابقه و هدف
سیستم HLA نقش کلیدی در فرار سلولهای سرطانی از سیستم ایمنی ایفا میکند. AML سرطان رده میلوئیدی سلولهای خونی است که با رشد سریع سلولهای سفید غیر طبیعی در مغز استخوان شناخته میشود. مطالعههای متعدد در سراسر جهان ارتباط AML با آللهای HLA را بررسی نمودهاند. این مطالعه با هدف بررسی ارتباط بین آللهای HLA-A,-B,-DRB1 و بیماریAML در استان کرمان انجام شد.
مواد و روشها
در یک مطالعه مورد ـ شاهدی، آللهای HLA-A,B,-DRB1 با استفاده از روش مولکولی PCR-SSP، در 33 بیمار AML و 270 فرد گروه شاهد سالم غیر مرتبط با بیماران در استان کرمان ایران بررسی گردید. یافتهها توسط آزمون 2c و نرمافزار 19 SPSS تجزیه و تحلیل شدند.
یافتهها
دراین بررسی فراوانی آلل HLA-A*11 در بیماران مبتلا به AML ، 19 مورد (8/28%) و در گروه کنترل سالم 92 مورد (17%) بود که با 02/0p= ، 97/1OR= و 51/3-10/1 = 95% CI نشاندهنده وجود ارتباط مثبت معنادار بین حضور این آلل و بیماری AML بود.
نتیجه گیری
وجود HLA-A*11 در بیماران AML ممکن است فاکتور مستعد کنندهای برای ابتلا به این بیماری باشد.
کلمات کلیدی: لوسمی میلوئیدی حاد، HLA-A ، HLA DRB1 ، فراوانی آلل
تاریخ دریافت : 12/11/93
تاریخ پذیرش : 3 /3 /94
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ دانشکده علوم پزشکی دانشگاه تربیت مدرس تهران و دانشکده پزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
2- مؤلف مسئول: PhD هماتولوژی و بانک خون ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 331-14115
3- PhD ژنتیک پزشکی ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
4- PhD آمار ـ استادیار دانشکده ریاضی و کامپیوتر دانشگاه شهید باهنر کرمان ـ کرمان ـ ایران
5- کارشناس علوم آزمایشگاهی ـ دانشکده پزشکی دانشگاه علوم پزشکی کرمان ـ کرمان ـ ایران
مقدمه
لوکوسهای ژنتیکی که در پس زدن بافتهای بیگانه دخالت دارند، کمپلکس اصلی سازگاری بافتی(MHC = Major Histocompatibility Complex) نامیده میشوند. عملکرد اصلی این کمپلکس در واقع ارایه آنتیژنهای عرضه شده توسط سلولهای عرضه کننده آنتیژن به لنفوسیتهای T میباشد. جایگاه ژنی MHC حاوی بیشترین اطلاعات برای عرضه مناسب آنتیژنها بوده و به سه ناحیه ژنی مشخص کلاس I ، II و III تقسیم میشود. در کلاس I جایگاههای ژنهای A ،B وC و در کلاس II جایگاههای ژنهای DP ،DQ و DR وجود دارند که در نهایت موجب تولید پروتئینهایی بدین نامها میشوند. هر یک از پروتئینهای کلاس II دارای زنجیرههای αو β هستند که تحت عنوان DRA1و DRB1و یاDPA1 ، DPB1 و... نامگذاری میشوند. در ناحیه کلاس IIIنیز جایگاههای ژنهای مهمی وجود دارند که از جمله آنها میتوان به ژنهای برخی از پروتئینهای کمپلمان (C2 ، C4B ،C4A)، یک سری از سایتوکاینها (TNF-β ، LTA و LTB) و نیز پروتئینهای شوک حرارتی اشاره کرد.
مطالعه آللها و هاپلوتیپهایHLA به چند جهت دارای اهمیت هستند: 1- پیوند بافت و اعضا، 2- مطالعههای مردم شناسی، مهاجرت و آمیختگیهای جوامع مختلف، 3- تایید یا رد اصالت والدین و تشخیص هویت در پزشکی قانونی، 4- مطالعه ارتباط آللها و هاپلوتیپهای HLA با خطر ابتلا و یا مقاومت به یک سری از بیماریها که اهمیت بالینی نیز دارد(4-1).
به جهت نقش اصلی مولکولهای HLA در تنظیم پاسخ ایمنی و پلیمورفیسم بسیار زیاد این سیستم، تحقیقات نشاندهنده این نکته بوده که برخی از آللهای HLA ، با یک سری از بیماریها مرتبط میباشند. از جمله مهمترین بیماریهایی که ارتباطشان با تعدادی از آللهای HLA بررسی شده است: بیماریهای اتوایمیون، بیماریهای عفونی و سرطانها هستند.
سرطان یکی از مشکلات اصلی سلامت در سراسر جهان است. این بیماری از جمله بیماریهایی است که تا کنون موجب مرگ و میر بسیاری از کودکـان و بزرگسـالان
در نقاط مختلف دنیا شده است. بدخیمی سلولهای سرطانی تا حدود زیادی توسط فعالیت تکثیری کنترل نشده، مقاومت به آپوپتوز و توانایی سلولهای سرطانی در تهاجم به بافتهای میزبان و متاستاز به مناطق دور دست تعیین میگردد(5).
وجود این احتمال که سرطان میتواند به وسیله پاسخهای ایمنی کنترل شود، سبب شده است تا تحقیقات وسیعی در زمینه ایمونولوژی سرطان انجام پذیرد. نظریه مراقبت ایمنی که به وسیله برنت در دهه 1950 مطرح شد، تاکید میکند که وظیفه فیزیولوژیک سیستم ایمنی آن است که کلونهای سلولی تغییر شکل یافته را پیش از آن که رشد مضاعف نمایند و به صورت توده سرطانی درآیند، شناسایی و منهدم نماید و در صورتی که نتواند آنها را نابود کند، فعالیت آنها را تا حد ممکن محدود سازد(6).
لوسمی میلوئید حاد (AML) یک بیماری بدخیم کلونال خون است که با تجمع سلولهای میلوئید نابالغ و اختلال در خونسازی طبیعی همراه است(7). تقریباً به ازای هر 100000 کودک، 2 تا 3 نفر از آنها به لوسمی میلوئید حاد مبتلا میشوند که با افزایش سن میزان ابتلا به 15 نفر در هر 100000 فرد بزرگسال میرسد. علت اصلی لوسمی میلوئید حاد هنوز کاملاً مشخص نیست ولی مطالعههای گوناگون صورت گرفته در این مبحث، از تاثیر عوامل محیطی و ژنتیکی در استعداد ابتلا به این بیماری حکایت میکنند. مقادیر بسیار بالای اشعههای یونیزان، تماس مداوم با بنزن، استنشاق مزمن دود تنباکو، مصرف الکل و از همه مهمتر بیماران دارای لنفوم یا سرطانهای غیر خونی که در معرض شیمی درمانی شدید قرار میگیرند، به خصوص در مواردی که درمان بیمار با عوامل آلکیله کننده یا مهارکنندههای توپوایزومرازII صورت گرفته است، از جمله مهمترین عوامل مستعد کننده محیطی هستند که موجب ابتلا به لوسمی میلوئید حاد(AML) میشوند(8).
تریزومی 21 (سندرم داون)، آنمی فانکونی، سندرم شواخمن - دیاموند، مونوزومی 7 خانوادگی و بسیاری از بیماریهای مادرزادی دیگر از جمله بیماریهای ژنتیکی مستعدکننده ابتلا به AML میباشند(12-9). علاوه بر بیماریها و سندرمهای ژنتیکی مذکور که استعداد ابتلا به لوسمی را افزایش میدهند، برخی از آللهای HLA نیز به عنوان عوامل ایمنوژنتیک مؤثر، میتوانند در استعداد ابتلا و یا ایجاد مقاومت به لوسمی نقش داشته باشند(18-13).
بنابراین مطالعه آللهای HLA در بیماران AML میتواند از دو جهت حایز اهمیت باشد: به عنوان مکملی در کنار سایر آزمایشهای تشخیصی، میتواند به تعیین پیشآگهی، چگونگی روند درمان و یا حتی احتمال عود مجدد بیماری کمک کند و این که استفاده از اطلاعات به دست آمده از ایمنوژنتیک مبتلایان میتواند به عنوان فاکتور خطر مستعدکننده به ابتلا و یا عامل مقاومتدهنده به بیماری در جوامع مختلف بررسی شود (21-19). در این مطالعه گروه مردم کرمان برای بررسی موارد فوق انتخاب شد.
مواد و روشها
نوع مطالعه اپیدمیولوژیک در نظر گرفته شده برای این تحقیق، مورد- شاهدی بود، از همین رو 33 بیمار مبتلا به AML (14 زن با میانگین سنی 6/11 ± 5/36 سال و 19 مرد با میانگین سنی 3/15 ± 2/33 سال) که بر اساس تشخیص پزشک معالجشان در بخش انکولوژی بیمارستان باهنر کرمان بستری بودند و 270 نفر از گروه کنترل سالم(130 زن با میانگین سنی 8/15 ± 9/29 سال و 140 مرد با میانگین سنی 8/16 ± 6/29 سال) که هیچ نسبت فامیلی با بیماران نداشتند، مورد بررسی قرار گرفتند. از افراد مذکور به میزان 5/2 میلیلیتر نمونه خون محیطی در ویال حاوی ضد انعقاد DETA-K2(2H2O) 5% جمعآوری گردید. با استفاده از روش ستونی، DNA ژنومی نمونهها استخراج شد.
از کیت ABDR-PCR-SSPمحصول کمپانی TBG به منظور انجام واکنش زنجیرهای پلیمراز و تکثیر آللهای HLA-A,-B,-DRB1 استفاده شد. این کیت دارای یک مجموعه 96 چاهکی است که چاهک اول کنترل منفی تست میباشد، چاهکهای 2 تا 24 مربوط به بررسی HLA-A ، چاهکهای 25 تا 72 مربوط به بررسی HLA-B و چاهکهای 73 تا 96 مربوط به بررسیHLA-DRB1 هستنـد. بـر طبق دستوالعمل کیت، رونـد تکثیـر آلـلهـای HLA-A,-B,-DRB1 طی شد.
سپس الکتروفورز محصول واکنش زنجیرهای پلیمراز توسط بافر TBE1x انجام شد. پس از اتمام مرحله الکتروفورز، با استفاده از دستگاه ژل داک از ژل تصویربرداری انجام شد و تصاویر به دست آمده توسط نرمافزار TBG (MorganTM SSPal HLA Typing Analysis) Software نسخه 3/2 آنالیز شدند(شکل 1). بدین طریق آللهای HLA-A,-B,-DRB1 گروههای هدف تعیین گشت. پس از اتمام مراحل آزمایشگاهی به منظور بررسی تفاوت فراوانی هر یک از آللهای HLA-A,-B,-DRB1 ، در میان گروه بیماران AML و گروه کنترل سالم از آزمون مربع کای استفاده شد. در بررسی وجود رابطه بین آللهای HLA-A,-B,-DRB1 ، گروه بیمار با گروه کنترل سالم، نسبت شانس ابتلا (OR)و فاصله اطمینان آن 95% (CI) بوده و 05/0 p = یا کمتر از آن معنادار در نظر گرفته شد. تمامی این محاسبات با استفاده از نرمافزار SPSS نسخه 19 انجام شد.

شکل 1: تصویر به دست آمده از الکتروفورز محصول واکنش زنجیرهای پلیمراز
یافتهها
لوکوس HLA-A :
در مطالعه لوکوس HLA-A به منظور بررسی آللهای مستعدکننده برای بیماری AML ،آلل HLA-A*11 با فراوانی 19 مورد(8/28%) در بیماران و 92 مورد (17%) در گروه کنترل سالم با 02/0p= ، 97/1OR= و 51/3-10/1 = 95% CI به عنوان آلل مستعدکننده معنادار در ابتلا به بیماریAML ، شناخته شد.
در بررسی آللهای محافظتکننده در برابر بیماری AML ، آلل محافظت کننده معناداری در برابر بیماری یافت نشد. در این لوکوس آلل HLA-A*01 با فراوانی 1 مورد در بیماران (5/1%) و 39 مورد (2/7%) در گروه کنترل سالم
با 08/0p= ، 19/0 = OR و 46/1-03/0 = 95% CI و هم چنین آلل HLA-A*68 با فراوانی 1 مورد در بیماران (5/1%) و 38 مورد (2/7%) در گروه کنتـرل سالم با 08/0 p= ، 20/0 OR = و 51/1-03/0 = 95% CI به نظر میرسند که کاهش فراوانی محسوسی نسبت به سایر آللها در بیماران دارند ولی این تفاوتها معنادار نبودند(جدول 1 و نمودار 1).
جدول 1: بررسی آللهای لوکوس HLA-A گروه بیمار و گروه کنترل سالم
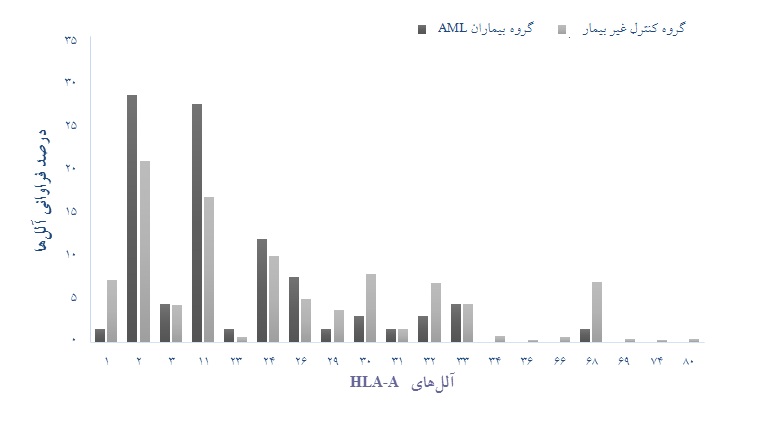
نمودار 1: مقایسه آللهای لوکوس HLA-A گروه بیمار با گروه کنترل سالم

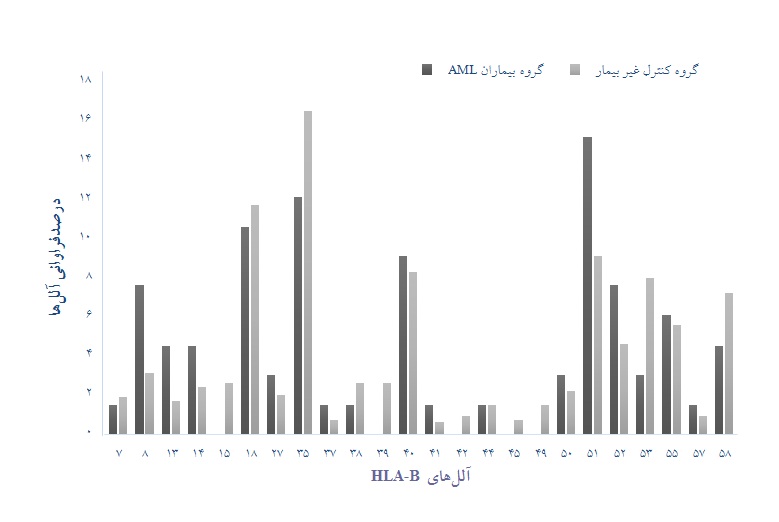
نمودار 2: مقایسه آللهای لوکوس HLA-B گروه بیمار با گروه کنترل سالم
جدول 2: بررسی آللهای لوکوس HLA-B گروه بیمار و گروه کنترل سالم
| HLA-A | بیماران(33 نفر) | گروه کنترل سالم(270 نفر) | شانس ابتلا | فاصله اطمینان 95% | p value | ||
| آلل(66) | درصد | آلل(540) | درصد | OR | CI | P* | |
| 01 | 1 | 5/1 | 39 | 20/7 | 19/0 | 46/1-03/0 | 08/0 |
| 02 | 19 | 8/28 | 114 | 10/21 | - | - | - |
| 03 | 3 | 5/4 | 23 | 30/4 | - | - | - |
| 11 | 19 | 8/28 | 92 | 17 | 97/1 | 51/3-10/1 | 02/0 |
| 23 | 1 | 5/1 | 3 | 60/0 | - | - | - |
| 24 | 8 | 10/12 | 54 | 10 | - | - | - |
| 26 | 5 | 60/7 | 27 | 5 | - | - | - |
| 29 | 1 | 5/1 | 20 | 70/3 | - | - | - |
| 30 | 2 | 3 | 43 | 8 | - | - | - |
| 31 | 1 | 5/1 | 8 | 50/1 | - | - | - |
| 32 | 2 | 3 | 37 | 9/6 | - | - | - |
| 33 | 3 | 5/4 | 24 | 40/4 | - | - | - |
| 34 | 0 | 0 | 4 | 70/0 | - | - | - |
| 36 | 0 | 0 | 1 | 20/0 | - | - | - |
| 66 | 0 | 0 | 3 | 60/0 | - | - | - |
| 68 | 1 | 5/1 | 38 | 7 | 20/0 | 51/1-03/0 | 08/0 |
| 69 | 0 | 0 | 2 | 40/0 | - | - | - |
| 74 | 0 | 0 | 1 | 20/0 | - | - | - |
| 80 | 0 | 0 | 2 | 40/0 | - | - | - |
|
گروه کنترل غیر بیمار
|
|
گروه بیماران AML
|

نمودار 1: مقایسه آللهای لوکوس HLA-A گروه بیمار با گروه کنترل سالم

|
گروه کنترل غیر بیمار
|
|
گروه بیماران AML
|

نمودار 2: مقایسه آللهای لوکوس HLA-B گروه بیمار با گروه کنترل سالم
جدول 2: بررسی آللهای لوکوس HLA-B گروه بیمار و گروه کنترل سالم
| HLA-B | بیماران(33 نفر) | گروه کنترل سالم(270 نفر) | شانس ابتلا | فاصله اطمینان 95% | p value | ||
| آلل(66) | درصد | آلل(540) | درصد | OR | CI | P* | |
| 07 | 1 | 5/1 | 10 | 90/1 | - | - | - |
| 08 | 5 | 60/7 | 17 | 10/3 | 81/2 | 08/7-89/0 | 07/0 |
| 13 | 3 | 5/4 | 9 | 70/1 | - | - | - |
| 14 | 3 | 5/4 | 13 | 40/2 | - | - | - |
| 15 | 0 | 0 | 14 | 7/11 | - | - | - |
| 18 | 7 | 6/10 | 63 | 2 | - | - | - |
| 27 | 2 | 3 | 11 | 5/16 | - | - | - |
| 35 | 8 | 10/12 | 89 | 70/0 | - | - | - |
| 37 | 1 | 5/1 | 4 | 60/2 | - | - | - |
| 38 | 1 | 5/1 | 14 | 60/2 | - | - | - |
| 39 | 0 | 0 | 45 | 30/8 | - | - | - |
| 40 | 6 | 1/9 | 3 | 60/0 | - | - | - |
| 41 | 1 | 5/1 | 5 | 90/0 | - | - | - |
| 42 | 0 | 0 | 8 | 50/1 | - | - | - |
| 44 | 1 | 5/1 | 4 | 70/0 | - | - | - |
| 45 | 0 | 0 | 8 | - | - | - | |
| 49 | 0 | 0 | 8 | 50/1 | - | - | - |
| 50 | 2 | 3 | 12 | 20/2 | - | - | - |
| 51 | 10 | 2/15 | 49 | 10/9 | 79/1 | 73/3-86/0 | 12/0 |
| 52 | 5 | 60/7 | 25 | 60/4 | - | - | - |
| 53 | 2 | 3 | 43 | 8 | 36/0 | 52/1-85/0 | 15/0 |
| 55 | 4 | 1/6 | 30 | 60/5 | - | - | - |
| 57 | 1 | 5/1 | 5 | 90/0 | - | - | - |
| 58 | 3 | 5/4 | 39 | 20/7 | - | - | - |
لوکوس HLA-B :
در مطالعه لوکوس HLA-B به منظور بررسی آللهای مستعدکننده برای بیماری AML ، آلل مستعد کننده معنـاداری یافـت نشـد. در ایـن لوکوس آلل HLA-B*08 با فراوانی 5 مورد در بیماران (6/7%) و 17 مورد (1/3%) در گروه کنترل سالم با 07/0p= ، 81/2OR= و 08/7-89/0 = 95% CI و هم چنین آلل HLA-B*51 با فراوانی 10 مورد در بیماران(2/15%) و 49 مورد (1/9%) در گروه کنتـرل سالـم با 12/0p= ، 79/1OR= و 73/3-86/0 = 95% CI به نظر میرسند که افزایش فراوانی محسوسی نسبت به سایر آللها در بیماران دارند ولی این تفاوتها معنادار نبودند.
در بررسی آللهای محافظت کننده در برابر بیماری AML در لوکوس HLA-B ، آلل معناداری یافت نشد. هر چند که آلل HLA-B*53 با فراوانی 2 مورد در بیماران (3%) و 49 مورد (1/9%) در گروه کنترل سالم با 15/0p= ، 36/0OR= و 52/1-85/0 = 95% CI بـه نظـر مـیرسـد که
در مطالعه لوکوس HLA-B به منظور بررسی آللهای مستعدکننده برای بیماری AML ، آلل مستعد کننده معنـاداری یافـت نشـد. در ایـن لوکوس آلل HLA-B*08 با فراوانی 5 مورد در بیماران (6/7%) و 17 مورد (1/3%) در گروه کنترل سالم با 07/0p= ، 81/2OR= و 08/7-89/0 = 95% CI و هم چنین آلل HLA-B*51 با فراوانی 10 مورد در بیماران(2/15%) و 49 مورد (1/9%) در گروه کنتـرل سالـم با 12/0p= ، 79/1OR= و 73/3-86/0 = 95% CI به نظر میرسند که افزایش فراوانی محسوسی نسبت به سایر آللها در بیماران دارند ولی این تفاوتها معنادار نبودند.
در بررسی آللهای محافظت کننده در برابر بیماری AML در لوکوس HLA-B ، آلل معناداری یافت نشد. هر چند که آلل HLA-B*53 با فراوانی 2 مورد در بیماران (3%) و 49 مورد (1/9%) در گروه کنترل سالم با 15/0p= ، 36/0OR= و 52/1-85/0 = 95% CI بـه نظـر مـیرسـد که
جدول 3: بررسی آللهای لوکوس HLA-DRB1 گروه بیمار و گروه کنترل سال
| HLA-DRB1 | بیماران(33 نفر) | گروه کنترل سالم(270 نفر) | شانس ابتلا | فاصله اطمینان(95%) | p value | ||
| آلل(66) | درصد | آلل(540) | درصد | OR | CI | P* | |
| 01 | 7 | 10 | 92 | 17 | 58/0 | 31/1-26/0 | 18/0 |
| 03 | 10 | 2/15 | 106 | 60/19 | - | - | - |
| 04 | 2 | 3 | 36 | 70/6 | - | - | - |
| 07 | 4 | 1/6 | 38 | 7 | - | - | - |
| 08 | 1 | 5/1 | 13 | 40/2 | - | - | - |
| 09 | 0 | 0 | 6 | 10/1 | - | - | - |
| 10 | 1 | 5/1 | 14 | 60/2 | - | - | - |
| 11 | 10 | 2/15 | 48 | 9 | 83/1 | 82/3-88/0 | 10/0 |
| 12 | 1 | 5/1 | 5 | 90/0 | - | - | - |
| 13 | 7 | 6/10 | 32 | 90/5 | - | - | - |
| 14 | 4 | 1/6 | 14 | 60/2 | - | - | - |
| 15 | 9 | 60/13 | 53 | 80/9 | - | - | - |
| 16 | 10 | 2/15 | 79 | 60/14 | - | - | - |
| 49 | 0 | 0 | 8 | 50/1 | - | - | - |
| 50 | 2 | 3 | 12 | 20/2 | - | - | - |
| 51 | 10 | 2/15 | 49 | 10/9 | 79/1 | 73/3-86/0 | 12/0 |
| 52 | 5 | 60/7 | 25 | 60/4 | - | - | - |
| 53 | 2 | 3 | 43 | 8 | 36/0 | 52/1-85/0 | 15/0 |
| 55 | 4 | 1/6 | 30 | 60/5 | - | - | - |
| 57 | 1 | 5/1 | 5 | 90/0 | - | - | - |
| 58 | 3 | 5/4 | 39 | 20/7 | - | - | - |
|
گروه کنترل غیر بیمار
|
|
گروه بیماران AML
|

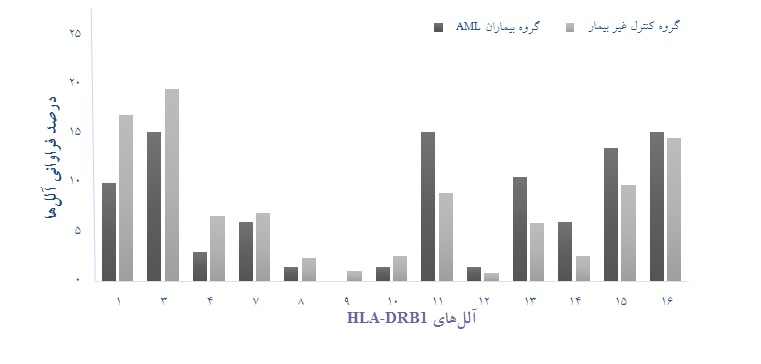
نمودار 3: مقایسه آللهای لوکوسDRB1 -HLA گروه بیمار با گروه کنترل سالم
کاهش فراوانی محسوسی نسبت به سایر آللها در بیماران دارد ولی این تفاوت معنادار نبود(نمودار 2 و جدول 2).
لوکوس HLA-DRB1 :
در مطالعه لوکوس HLA-DRB1 به منظور بررسی آللهای مستعدکننده برای بیمار AML، آلل مستعدکننده معناداری یافت نشد. در این لوکوس آلل HLA- DRB1*11 با فراوانی 10 مورد در بیماران (2/15%) و 48 مورد (9/8%) در گروه کنترل سالم با 10/0p= ، 83/1OR= و 82/3-88/0 = 95% CI به نظر میرسد که افزایش فراوانی محسوسی نسبت به سایر آللها در بیماران دارد ولی معنادار نشد.
در بررسی آللهای محافظت کننده در برابر بیماری AML در لوکوسHLA-DRB1 ، آلل معناداری دیده نشد. این در حالی است که آلل HLA- DRB1*01 با فراوانی 7 مورد در بیماران (6/10%) و 49 مورد (17%) در گروه کنترل سالم با 18/0p= ، 58/0OR= و 31/1-26/0 = 95% CI به نظر میرسد که کاهش فراوانی محسوسی نسبت به سایر آللها در بیماران دارد ولی این تفاوت معنادار نبود(جدول 3 و نمودار 3).
بحث
اولین مطالعه پیرامون ارتباط بین اختلالات هماتولوژی و MHC در سال 1964 توسط لیلی و همکارانش بر روی گونههای مختلف موش مبتلا به لنفوما انجام شد(22). پس از آن نیز مطالعهها برروی گونههای موشی توسط تنانت و همکارانش ادامه یافت ولوکوس H-2 به عنوان فاکتور مستعد کننده به بدخیمیهای هماتولوژیک در موش معرفی شد(23). در سال 1967 اولین مطالعه ارتباط بین بدخیمیهای هماتولوژیک انسان و HLA توسط آمیل و همکارانش انجام شد که به بررسی ایمنوژنتیک بیماران مبتلا بهALL پرداختند. در این مطالعه فراوانی HLA-A*02 در بیماران بیشتر از سایر آللها بود(24). در طی این 50 سال مطالعههای مختلفی پیرامون ارتباط آللهای کلاسهای مختلف HLA با بیماری AML در جریان بوده ولی در بسیاری از آنها از روش سرولوژی برای تعیین آنتیژنهای HLA استفـاده شـده اسـت. بـه دلیـل هـم خـوانـی بیشتـر
تحقیقات با یکدیگر در این بخش سعی شده به بررسی مطالعههایی که به روش مولکولار انجام شدهاند پرداخته شود.
در سال 2002 گوانس و همکارانش در بررسی آللهای HLA کلاس I و II150بیمار AML در انگلستان، ارتباط معنادار میان بیماری و آللهای HLA نیافتند(25). با توجه به نتایج بررسی حاضر، به دست آمدن چنین نتایجی دور از ذهن نیست چرا که از بین آللهای HLA کلاس I و II مطالعه اخیر نیز تنها آلل HLA-A*11 معنادار بود.
در سال 2006 صراف نژاد وهمکارانش به بررسی آللهای HLA کلاس IIبیمارانAML در ایران پرداختند و آللHLA-DRB1*11 را به عنوان عامل مستعد کننده در بیماران معرفی نمودند(26). در نتایجی هم که در این مطالعه به دست آمده، HLA- DRB1*11 در گروه بیماران افزایش فراوانی داشت ولی در مقایسه با گروه کنترل معنادار نبود، ممکن است تعداد کم بیماران مطالعه شده در این ارزیابی، علت این امر باشد.
در سال 2013 فرنانداز ـ تورز وهمکارانش در مطالعه آللهای HLA کلاس I بیماران AML در مکزیک، آلل HLA-B*27 را به عنوان فاکتور ژنتیکی مستعد کننده و آللهای HLA-B*15 و HLA-B*40 را به عنوان فاکتورهای ژنتیکی مقاومت دهنده در برابر AML معرفی کردهاند(27). نکته جالب مقایسه پژوهش فوق با مطالعه انجام شده این است که از آلل HLA-B*15 حتی یک مورد هم در بیماران کرمانی دیده نشد، شاید بتوان آن را به عنوان عامل مقاومت دهنده بررسی کرد هر چند که به علت فراوانی کم HLA-B*15 در گروه کنترل سالم، این ارتباط معنادار نبود.
مقایسه مطالعههایی که پیش از این انجام شده با مطالعه اخیر بیانگر یک سری تفاوت در نتایج میباشد که اشاره به 2 نکته مهم در این بین میتواند راهگشا باشد: اول این که با توجه به گستردگی آللهای HLA کلاسI و II به علت پلیمورفیسم فراوان آنها و تنوع ژنتیکی متفاوت گسترش آللهای HLA در میان اقوام و نژادهای مختلف جهان رسیدن به نتایج یکسان دشوار است، دوم این که فاکتورهای متعدد محیطی و ژنتیکی در ایجاد بیماری AML نقـش دارنـد و نمیتوان یک عامل را صرفاً بـه عنوان دلیل
بیماری در نظر گرفت.
با توجه به شرایط فوق نکته قابل تامل دیگر این است که در تمام مطالعههای انجام شده تا کنون هیچ یک از محققان پس از اعلام نتیجه نهایی و عنوان کردن آللهای مستعد کننده و یا مقاومت دهنده به بیماری AML در مطالعه خود، اشارهای به چگونگی و مکانیسم اثر آن آلل در استعداد ابتلا و یا مقاومت به دست آمده نداشتهاند. به هرحال ارتباط بین بیماریهای سرطانی و آللهای HLA ارتباط ضعیفی است ولی ارتباط آللهای HLA با عوامل سرطانزای دیگر مثل بیماریهای عفونی، ارتباط به مراتب قویتری میباشد. یکی از این عوامل عفونی که میتواند موجب بدخیمیهای هماتولوژیک شود، ویروس اپشتاین بار (EBV) میباشد. بررسیهای ایمنولوژیک در مورد این ویروس نشان میدهد که آنتیژنهای پروتئینی ویروس توسط سلولهای عرضهکننده آنتیژن((APC شناسایی شده و به منظور عرضه در سطح سلول در اختیارسیستم HLA قرار میگیرند. در این میان زمانی که فرد مبتلا دارای HLA-A*11 باشد، ویروس اپشتاین بار منجر به خاموش شدن این آلل و عدم عرضه مناسب آن به سطح سلول شده در نتیجه لنفوسیتT سایتوتوکسیک قادر به شناسایی EBV نیست و به علت همین نقص در ایمنی سلولی، واکنش مناسبی بر علیه ویروس دیده نمیشود(29، 28). این توانایی در خاموش کردن سیستم ایمنی بدن موجب میشود که ویروس در بدن افراد دارای HLA-A*11 فعال باقی بماند که خود عاملی در استعداد ابتلا به بدخیمیهـای هماتولوژیک محسوب میشود.
لازم به ذکر است که EBV ، یکی از عوامل مهم در ایجاد لنفوم بورکیت، سرطان بینی و گلو، لنفوم پس از پیوند کلیه، برخی سرطانهای لنفاوی و بیماری هوچکین میباشد(30). درمان هریک از بیماران مذکور با داروهای شیمی درمانی شدید به خصوص در مواردی که درمان بیمار با عوامل آلکیله کننده یا مهارکنندههای توپوایزومراز II صورت گرفته است، از جمله مهمترین عوامل ایجاد بیماری AML به شمار میرود. علاوه بر این، EBV به عنوان یک ویروس DNA دار سرطانزا میتواند به شکل غیر مستقیم موجب بیماری AML گردد(31).
نتیجهگیری
در مطالعه اخیر آلل HLA-A*11 در بیماران AML دارای فراوانی معنادار بیشتر نسبت به گروه کنترل سالم بود از این رو ممکن است وجود HLA-A*11 در بیماران AML فاکتور مستعد کننده ژنتیکی برای ابتلا به این بیماری باشد.
تشکر و قدردانی
از مدیریت و پرسنل آزمایشگاه ایمنوژنتیک کلینیک تخصصی و فوق تخصصی جوادالائمه(ع) وپزشکان محترم بخش انکولوژی بیمارستان باهنر دانشگاه علوم پزشکی کرمان که به ما در جهت پیشبرد این مطالعه یاری رساندند کمال تشکر را داریم.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونوهماتولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





