جلد 12، شماره 3 - ( پاييز 1394 )
جلد 12 شماره 3 صفحات 232-223 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Fallah P, Timori Naghadeh H, Soleimani M, Amirizadeh N, Poopak B, Toogeh G, et al . The assessment of miR-150 and miR-155 on chronic myelogenous leukemia patients. bloodj 2015; 12 (3) :223-232
URL: http://bloodjournal.ir/article-1-906-fa.html
URL: http://bloodjournal.ir/article-1-906-fa.html
فلاح پرویز، تیموری نقده حسین، سلیمانی مسعود، امیریزاده ناصر، پوپک بهزاد، توگه غلامرضا، و همکاران. و همکاران.. بررسی بیان miR-150 و miR-155 در بیماران مبتلا به لوسمی میلوئیدی مزمن. فصلنامه پژوهشی خون. 1394; 12 (3) :223-232
پرویز فلاح 
 ، حسین تیموری نقده*
، حسین تیموری نقده* 
 ، مسعود سلیمانی
، مسعود سلیمانی 
 ، ناصر امیریزاده
، ناصر امیریزاده 
 ، بهزاد پوپک
، بهزاد پوپک 
 ، غلامرضا توگه
، غلامرضا توگه 
 ، احسان عارفیان
، احسان عارفیان 
 ، شیرین بلوری
، شیرین بلوری 
 ، طلوع گلکار
، طلوع گلکار 
 ، زینب پیر محمد جماعت
، زینب پیر محمد جماعت 


 ، حسین تیموری نقده*
، حسین تیموری نقده* 
 ، مسعود سلیمانی
، مسعود سلیمانی 
 ، ناصر امیریزاده
، ناصر امیریزاده 
 ، بهزاد پوپک
، بهزاد پوپک 
 ، غلامرضا توگه
، غلامرضا توگه 
 ، احسان عارفیان
، احسان عارفیان 
 ، شیرین بلوری
، شیرین بلوری 
 ، طلوع گلکار
، طلوع گلکار 
 ، زینب پیر محمد جماعت
، زینب پیر محمد جماعت 

تهران ـ ایران ـ صندوق پستی: 1157-14665
متن کامل [PDF 383 kb]
(5859 دریافت)
| چکیده (HTML) (9165 مشاهده)
مقدمه
لوسمی میلوژنوس مزمن(CML)، یک اختلال کلونال سلولهای بنیادی خونساز میباشد، که جزو اختلالات میلوپرولیفراتیو تقسیمبندی میشود و حدود 15% لوسمی بزرگسالان را به خود اختصاص داده است. وقوع این بیماری سالانه 1 تا 2 نفر در هر 100000 نفر است. سن درگیری بیماران 45 تا 55 سال است، اما این بیماری در تمام گروههای سنی حتی کودکان هم دیده میشود(2، 1). میکرو RNA ها توالیهای RNA کوچک 18 تا 22 نوکلئوتید تک رشتهای هستند و نشان داده شده است که نقشی اساسی در تنظیم بیان ژن از طریق مهار mRNAهای هدف، ایفا میکنند(3). میکرو RNA ها بر اساس ژنهای هدف خاص، پروسههای سلولی مختلفی از جمله تکثیر، انتقال سیگنال، آپوپتوز و تومورژنزیس را تنظیم میکنند(4). همین طور میکرو RNA ها تنظیم کنندههای مهم رونویسی در خونسازی هستند(5). نقش میکرو RNA ها در ایجاد سرطان در انسان شناخته شده و از جهتی توانایی بالقوه این RNAهای کوچک غیر کدکننده در درمان و تشخیص سرطان توجه بسیاری از دانشمندان را به خود جلب کرده است(6).میکرو RNA ها میتوانند با مکانیسمهای متفاوتی در ایجاد سرطان نقش داشته باشند. یکی از این مکانیسمها وجود جهش در ژن میکرو RNAها میباشد. نتایج حاصل از آنالیز کامپیوتری و تحقیقات آزمایشگاهی نشانگر بیان بیش از 1000 نوع میکرو RNA در انسان میباشد، که بیش از 50% از این میکرو RNA ها در جایگاهی از ژنوم واقع شدهاند که از نظر ژنتیکی ناحیه حساس به جهش شناخته شده و در بسیاری از سرطانها، ناهنجاریهای ژنتیکی در این ناحیه مشاهده میشود. بسیاری از ژنهای مهارکننده سرطان و آنکوژنها، تحت کنترل دقیق میکرو RNA ها میباشند(7). بنابراین هر گونه تغییر در بیان میکرو RNA های تارگتکننده این ژنها میتواند باعث اختلالات تنظیمی در بیان ژنها شده و نهایتاً منجر به سرطان شود که با استفاده از این ویژگی میتوان از میکرو RNA ها در تشخیص، پیشگیری و حتی اندازهگیری حداقل بیماری باقیمانده(MRD) استفاده نمود(8). در سالهای اخیر با افزایش پیشرفت در زمینه روشهای مولکولی و مطالعههای انجام شده بر روی میکرو RNA ها، نقش این عناصر تنظیمی اپیژنتیک در تمایز سلولهای خونساز مورد توجه قرار گرفت و مشخص شد که میکرو RNA ها سهم قابل توجهی در طول این فرآیند سلولی دارند(9). میزان بیان میکرو RNA ها در ارتباط با پاتوژنز بعضی بدخیمیهای خونی شناخته شده است(10). هم چنین بیان نامعمول (غیر عادی) میکرو RNA ها در بسیاری از سرطانهای انسانی از جمله لوسمی میلوئیدی حاد توصیف شده است(11). نقش میکرو RNA ها در ایجاد سرطان در انسان و از جهتی توانایی بالقوه این RNA های کوچک غیر کدکننده در درمان و تشخیص سرطان توجه بسیاری از دانشمندان را به خود جلب کرده است(12). بنابراین نقش میکرو RNA ها و بیان ژنها امروزه به طور گستردهای در بدخیمیهای انسان مطالعه شده و ترکیبات شیمیایی که سطح میکرو RNA ها را تغییر میدهند، به طور بالقوه میتوانند استراتژیهای تشخیصی و درمانی جدیدی برای CML باشند. لذا هدف از این مطالعه، بررسی بیان miR-150 و miR-155 دخیل در لوسمی میلوژنوس مزمن بود تا با شناسایی تغییرات این میکرو RNA ها بتوان از آنها در تشخیص، درمان و تخمین حداقل بیماری باقیمانده (MRD = Minimal Residual Disease) استفاده نمود.
مواد و روشها
جمعآوری نمونههای بیماران و افراد سالم:
در این مطالعه تجربی، از 25 بیمار تازه تشخیص داده شده CML در فاز مزمن و هم چنین از 25 فرد سالم به عنوان کنترل، 5 میلیلیتر خون محیطی همراه با ضد انعقاد EDTA از آزمایشگاه تشخیص طبی و تخصصی پیوند جمعآوری شد. قابل ذکر است که حجم نمونه بر اساس مطالعههای قبلی انتخاب شده است(13). معیارهای انتخاب بیماران بر اساس یافتههای مورفولوژیکی خونشناسی خاص لوسمی میلوئیدی مزمن (از جمله افزایش تعداد گلبولهای سفید، افزایش رده میلوئیدی مانند پرومیلوسیت و نوتروفیل در خون محیطی) و هـم چنیـن آزمـایـش مثبـت PCR بـرای ترانسلوکاسیون (9;22)(BCR-ABL1) (210 kD) بود. تمامی بیماران در فاز مزمن بودند و هیچ گونه دارویی مصرف نکرده بودند. خون کامل در دور 3000 دور در دقیقه به مدت 20 دقیقه در دمای 22 درجه سانتیگراد سانتریفوژ شد و لایه بافیکوت جدا شد و در دمای منهای 70 درجه سانتیگراد برای ادامه کار نگهداری شدند.
پیشبینی miRNA های با اهمیت در CML :
برای پیشگویی miRNA هایی که ژنهای کلیدی را در مسیر سیگنالینگ این بیماری هدف قرار میدهند، از نرمافزارها و برنامههای زیر استفاده شد:
نرمافزار Pictar (http://pictar.mdc-berlin.de/)
نرمافزار MicroCosm (http://www.ebi.ac.uk/enright-srv/microcosm/htdocs/ targets/v5)
نرمافزار Target Scan (2/5Target Scan release http://www.targetscan.org/)
نرمافزار miRWalk (http://www. umm. uni-heidelberg. de/ apps/ zmf/ miRwalk)
نرمافزار miRanda (http://www.microrna.org)
نرمافزار Diana-microT و هم چنین از سایت KEGG (http://www.genome.jp/kegg/) که مسیرهای سیگنالینگ داخل سلولی در بیماریهای مختلف را نشان میدهد و سایت DAVID (http:// david. abcc. ncifcrf.gov/) استفاده شد. طی بررسی مقالههای متعدد، با توجه به نقشهای مهم و تعداد ژنهای هدف زیاد miR-150 و-155 miR در لوسمی میلوژنوس مزمن، این دو میکرو RNA برای این مطالعه انتخاب شدند(16-13).
طراحی آغازگر:
miRNA ها توالیهای کوتاه 25-22 نوکلئوتیدی هستند که ردیابی آنها با آغازگرهای معمول امکان پذیر نمیباشد. برای ردیابی آنها از ساختاری به نام ساقه- حلقه (stem-loop) استفاده شد. ساختار اولیه ساقه- حلقه از مقالهای که در سال 2005 چاپ شده بود گرفته شد(17). طول این توالی در بخش حلقه با اضافه نمودن چند نوکلئوتید طولانیتر شد. هم چنین ساختار نوکلئوتیدی با تغییر تعدادی از بازها طوری تغییر کرد که بدون به هم خوردن ساختار حلقه یا ساقه، دمای جدا شدن نیمی از دو رشتهها (Melting temperature) از 102 درجه سانتیگراد به حدود 85 درجه سانتیگراد رسید. به انتهای ساختار ساقه- حلقه، 6-4 نوکلئوتید مکمل انتهای ′3 هر miRNA اضافه شد تا امکان cDNA سازی اختصاصیتر را فراهم نماید. بنابراین برای هر miRNA یک ساختار حدود 70 نوکلئوتیدی که شامل بخش ثابت ساقه- حلقه و انتهای ′3 متغیر(مربوط به شناسایی miRNA) بود طراحی شد. برای طراحیها از برنامههای AlleleID6، GeneRunner، Oligo6 و mfold (برای بررسی ساختارهای ثانویه) استفاده شد. آغازگر سنس برای هر miRNA مکمل توالی نوکلئوتیدی miRNA (با کنار گذاشتن نوکلئوتیدهایی که برای اضافه نمودن Tm در صورت نیاز به انتهای 5' آغازگر افزوده شد) طراحی شد. بر روی ساقه ساختار ساقه- حلقه نیز آغازگر آنتیسنس طراحی شد تا امکان ردیابی miRNA کوتاه را فراهم نماید(جدول1).
برای طبیعی کردن بیان miRNA ها از آغازگرهای اختصاصی ژن SNORD 47 به عنوان housekeeping gene که طراحی آن هم به صورت ساختار ساقه- حلقه بود استفاده شد.
استخراج میکروRNA :
مراحل کار به شرح زیر میباشد:
یک میلیلیتر RNX-Plus سرد به بافیکوت (لایه حاوی گلبولهای سفید) اضافه شده و خوب مخلوط شد. سپس سوسپانسیون وارد یک میکروتیوب 5/1 میلیلیتر گردید و به مدت 1 دقیقه ورتکس شد. بعد از ورتکس، این مخلوط 5 دقیقه در دمای اتاق گذاشته شد. 200 میکرولیتر کلروفرم (به منظور جداسازی اجزای سلولی برحسب چگالی) به محتویات میکروتیوب اضافه کرده و یک دقیقه به شدت تکان داده شد. سپس 5 دقیقه در دمای 4 درجه سانتیگراد قرار داده شد. سانتریفوژ 4 درجه سانتیگراد، 20 دقیقه در rpm 12000 انجام شد. جداسازی محلول رویی (فاز آبی) و انتقال آن به میکروتیوب جدید صورت گرفت. هم حجم فاز آبی (محلول رویی) به آن اتانول 100% سرد (به منظور آبگیری) اضافه گردید.
سپس به آرامی مخلوط کرده و به صورتOvernight در دمای 20- درجه سانتیگراد قرار داده شد. سانتریفوژ 4 درجه سانتیگراد، 45 دقیقه در rpm 12000و دور ریختن محلول رویی(رسوب سفید رنگی دیده میشود) انجام شد. یک میلیلیتر اتانول 70% سرد اضافه و ورتکس کرده تا رسوب از ته لوله کنده شود. سانتریفوژ 4 درجه سانتیگراد، 15 دقیقه در rpm 12000 صورت گرفت. محلول رویی دور ریخته شد و درب لوله 10 دقیقه باز ماند تاRNA رسوب کرده خشک شود. حدود50-30 میکرولیتر آبRNase-DNase free اضافه گردید و غلظت RNA استخراج شده تعیین شد. نهایتاً محلول حاصل، جهت نگهداری به فریزر 70- درجه سانتیگراد منتقل شد.
ساخت cDNA :
مراحل ساخت cDNA به شرح زیر انجام شد:
یـک میکـروگرم از RNA تخلیص شده در دو لوله 200
میکرولیتر جداگانه، با 5/1 میکرولیتر از آغازگر 10پیکومول Stem-Loop RT-primer مخلوط گردیده و حجم در هر تیوب با آب RNase-DNase free به 13 میکرولیتر رسانده شد. درب لولهها را بسته و به مدت 10 دقیقه در دمای 70 درجه سانتیگراد در ترموسایکلر گذاشته شد. سپس لولهها فوراً بر روی یخ قرار گرفت و به هر کدام از آنها، 4 میکرولیتر بافر X 5 (فرمنتاز)، 2 میکرولیتر dNTP (mm 10) و 1 میکرولیتر Reverse transcriptase (فرمنتاز) افزوده شد. سپس درب لوله را بسته و طبق دستورالعمل دمایی، در زیر ترموسایکلر گذاشته شد. دستورالعمل دمایی به این صورت بود: دمای 25 درجه سانتیگراد به مدت 10 دقیقه، دمای 37 درجه سانتیگراد 10 دقیقه، دمای 42 درجه سانتیگراد 45 دقیقه و در نهایت 75 درجه سانتیگراد (برای غیر فعال کردن آنزیم) 10 دقیقه.
جدول 2 : اجزای لازم برای واکنش Real-Time PCR در دستگاه 6000 Rotor Gene
جدول 3: برنامه زمانی مراحل واکنش Real-Time qPCR برای miRNA ها
واکنش Real-Time PCR برای بررسی میزان بیان میکرو RNA ها:
پس از استخراج RNA و cDNA سازی با آغازگر RT حلقه- ساقه که برای هر miRNA با اضافه نمودن بخش انتهای توالی miRNA هدف اختصاصی شده بود، واکنش Real-Time PCR به صورت دو مرحلهای در دستگاه 6000 Rotor Gene (استرالیا، NSW ، Concorde ، Corbett) صـورت گرفـت. از ژن (47U) 47 SNORD به عنوان RNA ای با طول کوتاه به عنوان کنترل داخلی برای طبیعی کردن نتایج استفاده شد( جداول 2 و 3).
بیان miR-150 و miR-155 و SNORD47 در بیماران CML و نمونههای افراد سالم به دست آمده و نتایج در برنامه 2009 REST تجزیه و تحلیل شد. یافتههای آزمایشگاهی وارد نرمافزار 16 SPSS شد و با آزمون کایدو و پیرسون آنالیز آماری صورت گرفت.
یافتهها
نتایج Real-Time PCR :
نتایج Real-Time PCR ، بیان miR-150 و miR-155 در بیماران نسبت به افراد سالم پس از آنالیز در برنامه 2009 REST در جدول 4 و نمودار 1 آورده شده است.
در مقایسه میزان بیان miR-150 و miR-155 در بیماران مبتلا به CML نسبت به گروه کنترل(افراد سالم) به ترتیب بیان آنها 512/0 و 2552/0 شد که هر دو کاهش بیان را نشان دادند. بیان این دو miRNA در بیماران نسبت به افراد سالم به طور معناداری کاهش داشت(03/0 p=). لازم به ذکر است که ژن SNORD به عنوان کنترل داخلی در کار استفاده شده است.
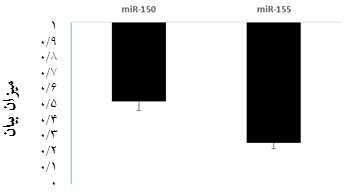

نمودار 1: بیان miR-150 و miR-155 در بیماران مبتلا به لوسمی
میلوژنوس مزمن در مقایسه با نمونههای افراد سالم(05/0 p≤)
یافتههای آزمایشگاهی(بالینی):
در جدول 5 یافتههای آزمایشگاهی(بالینی) 25 بیمار شامل سن، جنس، تعداد گلبولهای سفید(WBC)، نوتروفیل، لنفوسیت، منوسیت، ائوزینوفیل و بازوفیل نشان داده شده است.
ارتباط بین یافتههای آزمایشگاهی و تغییرات بیان میکرو RNA ها :
ارتباط بین تغییرات بیان هر یک از میکرو RNA ها با جنس، سـن، تعداد گلبولهای سفید، تعداد مطلق نوتروفیل، لنفوسیت، منوسیت، ائوزینوفیل و بازوفیل (Pearson correlation) سنجیده شد. ارتباط معناداری بین آنها وجود نداشت اما با افزایش سن بیماران، بیان miR-155 به طور معناداری کاهش بیشتری نشان داد که میتواند نشاندهنده این باشد که با افزایش سن بیماران، بیان این میکرو RNA ها کاهش مییابد.(002/0 p=). در جدول 6 ارتباط بین یافتههای بالینی بیماران و تغییرات بیان میکرو RNA ها نشان داده شده است.
بحث
لوسمی میلوژنوس مزمن(CML)، یک اختلال کلونال سلولهای بنیادی خونساز میباشد، که جزو اختلالات میلوپرولیفراتیو تقسیمبندی میشود و حدود 15% لوسمی بزرگسالان را به خود اختصاص داده است(18). این لوسمی در 95% موارد همراه با یک ناهنجاری کروموزومی به نام فیلادلفیا(Ph) میباشد که این ناهنجاری در نتیجه جابهجایی دو طرفه کروموزومی به دنبال شکست در باند q34 کروموزوم 9 و شکست در باند q11 کروموزوم 22 رخ میدهد(q34;q11) (9;22)t، در نتیجه کایمریسم BCR-ABL1 به وجود میآید. ژن BCR-ABL1 به پروتئین KD 210 ترجمه میشود که به عنوان BCR-ABL1 210P شناخته میشود(19).
در سالهای اخیر شبکه جدیدی از چرخههای تنظیمی در سطح mRNA مورد توجه قرار گرفته است که شامل یک کلاس از RNAهای غیر کدکننده به نام میکرو RNA است.
میکرو RNA ها مولکولهای RNA کوچک و تک رشتهای غیر کدکنندهای هستند که مکمل mRNA یک ژن کدکننده پروتئین دیگر میباشند و میتوانند از بیان یک ژن و تولید پروتئین مربوطه جلوگیری کنند(20). میکرو RNAها تنظیمکنندههای مهم رونویسی در خونسازی هستند. میزان بیان آنها در ارتباط با پاتوژنز بعضی بدخیمیهای خونی شناخته شده است(21، 9). در سالهای اخیر با افزایش پیشرفت در زمینه روشهای مولکولی و مطالعههای انجام شده بر روی میکرو RNAها، نقش این عناصر تنظیمی اپی ژنتیک در تمایز سلولهای خونساز مورد توجه قرار گرفت و مشخص شد که میکرو RNAها سهم قابل توجهی در طول این فرآیند سلولی دارند(13). بیان نامعمول(غیر عادی) میکرو RNAها در بسیاری از سرطانهای انسانی از جمله لوسمی لنفوئیدی مزمن توصیف شده است(22). نقش میکرو RNA ها در ایجاد سرطان در انسان و از جهتی توانایی بالقوه این RNA های کوچک غیر کدکننده در تشخیص، درمان و کنترل حداقل بیماری باقیمانده آن توجه بسیاری از دانشمندان را به خود جلـب کـرده اسـت(23). میکـرو RNA ها مـیتـواننـد بـا
مکانیسمهای متفاوتی در ایجاد سرطان نقش داشته باشند. یکی از مکانیسمهای ایجاد سرطان به وسیله آنها وجود جهش در ژن میکرو RNAها میباشد. نتایج حاصل از آنالیز کامپیوتری و تحقیقات آزمایشگاهی نشانگر بیان بیش از 1000 نوع میکرو RNA در انسان است، که بیش از 50% از این میکرو RNA ها در جایگاهی از ژنوم واقع شدهاند که از نظر ژنتیکی ناحیه حساس به جهش شناخته شده و در بسیاری از سرطانها ناهنجاریهای ژنتیکی در این ناحیه مشاهده میشود. به عنوان مثال، miR-15 و miR-16 از جمله میکرو RNA های موجود در نواحی جهشزا هستند که عملکرد آنها به عنوان مهارکننده سرطان به اثبات رسیده است، به طوری که جهش ژنتیکی این میکرو RNA ها اولین بار در بیماران مبتلا به B-CLL نشان داده شده و در ادامه، این جهش در 65% بیماران مبتلا به CLL ، در 50% mantle cell lymphomas ، 15 تا 40 درصد multiple myelomas و 60% سرطان پروستات گزارش شده است(24). اختلال در میزان بیان، یکی دیگر از مکانیسمهای ایجاد سرطان به وسیله میکرو RNA ها است. بسیاری از ژنهای مهارکننده سرطان و انکوژنها تحت کنترل دقیق میکرو RNA ها میباشند. بنابرین هر گونه تغییر در بیان میکرو RNA های هدف قرار دهنده این ژنها میتواند باعث اختلالات تنظیمی در بیان ژنها شده و نهایتاً منجر به سرطان شود که با استفاده از این ویژگی میتوان از میکرو RNA ها در تشخیص، پیشگیری و حتی اندازهگیری حداقل بیماری باقیمانده استفاده نمود. نقش میکرو RNA ها در ایجاد سرطان در انسان و از جهتی توانایی بالقوه این RNA های کوچک غیر کدکننده در درمان و تشخیص سرطان توجه بسیاری از دانشمندان را به خود جلب کرده است. در مطالعه فلامانت بعد از دو هفته درمان بیماران CML با ایماتینیب، افزایش بیان miR-150 و miR-146a و کاهش بیان miR-142-3p و miR-199b نشان داده شد(25). در مطالعه پولاکوا، پروفایلینگ بیان میکروRNA با روش microarray نشان داد بیان miR-19 ، miR-221 و miR-126 افزایش و بیان miR-150 و miR-103 کاهش مییابد(26). در مطالعه روکا کاهش بیان miR-31 ، miR-155 و miR-564 در ردههای سلولی CML نشان داده شد(27). اما در مطالعـه حاضـر هـدف بـررسی بیان میکرو RNA های دخیل در بیماران لوسمی میلوژنوس مزمن بود تا با شناسایی میکرو RNA هایی که در پاتوژنز CML دخیل هستند، بتوان از آنها برای تشخیص، درمان و تخمین حداقل بیماری باقیمانده و هم چنین به عنوان عامل پیشآگهی دهنده استفاده کرد.
همان طور که گفته شد، هدف از انجام مطالعه حاضر، بررسی بیان miR-150 و miR-155 در بیماران مبتلا به لوسمی میلوژنوس مزمن با روش Real-Time PCR بود. که به این منظور از گلبولهای سفید خون محیطی بیماران تازه تشخیص داده شده CML که هیچ نوع درمانی نگرفته بودند و هم چنین افراد سالم، RNA استخراج گردید و با روش Stem-loop RT-PCR ، ساخت cDNA صورت گرفت و میـزان بیـان ایـن دو میکرو RNA بـا استفاده از روش Real-time PCR سنجیده شد. نتایج نشان داد که miR-150 و miR-155 در بیماران نسبت به افراد سالم کاهش دارد.
نتیجهگیری
با توجه به دادههای کسب شده، میتوان نتیجه گرفت که miR-150 و miR-155 در لوسمی میلوژنوس مزمن بیان کاهشی دارد که میتواند پیشگوکننده این باشد که با القای افزایش بیان این دو میکرو RNA میتوان از تکثیر زیاد سلولها در این بیماری کاست. هم چنین به مطالعههای دیگری نیاز است تا با مشخص کردن ژنهای هدف این میکرو RNA ها ، نقش دقیق آنها را در این بیماری مشخص کرد.
تشکر و قدردانی
این پژوهش در قالب پایاننامه دانشجویی و با مساعدتهای مالی مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و مرکز تحقیقات بنیاخته انجام شده است که بدین وسیله از آنها قدردانی میشود.
متن کامل: (2938 مشاهده)
بررسی بیان miR-150 و miR-155 در بیماران مبتلا به لوسمی میلوئیدی مزمن
پرویز فلاح1، حسین تیموری نقده2، مسعود سلیمانی3، ناصر امیریزاده4، بهزاد پوپک5، غلامرضا توگه6،
احسان عارفیان7، شیرین بلوری8، طلوع گلکار9، زینب پیر محمد جماعت10
چکیده
سابقه و هدف
میکرو RNAها، نوعی از RNAهای کوچک غیر کدکننده هستند و اخیراً مشخص شده که نقشی اساسی در فرآیندهای مهم سلولی از جمله تکامل و تمایز از طریق تنظیم پس از رونویسی، ایفا میکنند. میزان بیان میکرو RNAها در ارتباط با بیماریزایی بعضی بدخیمیهای خونی از جمله لوسمی میلوئیدی حاد شناخته شده است. هدف از این مطالعه، بررسی بیان miR-150 و miR-155 در بیماری لوسمی میلوژنوس مزمن(CML) بود تا با شناسایی تغییرات این میکرو RNAها بتوان از آنها در تشخیص، درمان و تخمین حداقل بیماری باقیمانده (MRD) استفاده نمود.
مواد و روشها
در یک مطالعه توصیفی، بیان miR-150 و miR-155 در 25 بیمار CML در فاز مزمن و 25 فرد سالم که به آزمایشگاه تشخیص طبی پیوند مراجعه کرده بودند، با روشهای Stem-loop RT-PCR و Real Time PCR سنجیده شد. یافتهها توسط آزمون آماری پیرسون، تجزیه و تحلیل شدند.
یافتهها
miR-150 و miR-155 در بیماران CML نسبت به افراد سالم کاهش بیان داشت(به ترتیب 512/0 و 2552/0).
آنالیز آماری پیرسون ارتباطی بین یافتههای آزمایشگاهی و بیان این دو miR نشان نداد. اما miR-155 با سن بیماران ارتباط معکوس داشت(01/0 p≤).
نتیجه گیری
با توجه به دادههای کسب شده، کاهش بیان miR-150 و miR-155 در CML میتواند پیشگوکننده این باشد که با القای افزایش بیان این دو میکرو RNA ها، میتوان از تکثیر زیاد سلولها در این بیماری کاست. هم چنین به مطالعههای دیگری نیاز است تا با شناخت ژنهای هدف این میکرو RNA ها، به نقش دقیق آنها در این بیماری پی برد.
کلمات کلیدی: میکرو RNA ها، miR-150 انسانی، miR-155 انسانی، لوسمی میلوژنوس مزمن
تاریخ دریافت : 23/7/93
تاریخ پذیرش : 3/10/93
1- دانشجوی PhD هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران و مربی دانشکده پیراپزشکی دانشگاه علوم پزشکی البرز ـ کرج ـ ایران
2- مؤلف مسئول: متخصص آسیبشناسی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- مؤلف مسئول : PhD هماتولوژی و بانک خون ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 111-14115
4- PhD هماتولوژی و بانک خون ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- PhD هماتولوژی و بانک خون ـ استادیار دانشگاه آزاد اسلامی ـ واحد پزشکی تهران ـ تهران ـ ایران
6- فوق تخصص خون و انکولوژی ـ دانشیار دانشکده پزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
7- PhD ویروسشناسی پزشکی ـ استادیار دانشکده زیستشناسی دانشگاه تهران ـ تهران ـ ایران
8- کارشناس ارشد بیوشیمی ـ آزمایشگاه تشخیص طبی و تخصصی پیوند ـ تهران ـ ایران
9- کارشناس ارشد زیستشناسی سلولی و مولکولی ـ آزمایشگاه تشخیص طبی و تخصصی پیوند ـ تهران ـ ایران
10- کارشناس ارشد بیوتکنولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
پرویز فلاح1، حسین تیموری نقده2، مسعود سلیمانی3، ناصر امیریزاده4، بهزاد پوپک5، غلامرضا توگه6،
احسان عارفیان7، شیرین بلوری8، طلوع گلکار9، زینب پیر محمد جماعت10
چکیده
سابقه و هدف
میکرو RNAها، نوعی از RNAهای کوچک غیر کدکننده هستند و اخیراً مشخص شده که نقشی اساسی در فرآیندهای مهم سلولی از جمله تکامل و تمایز از طریق تنظیم پس از رونویسی، ایفا میکنند. میزان بیان میکرو RNAها در ارتباط با بیماریزایی بعضی بدخیمیهای خونی از جمله لوسمی میلوئیدی حاد شناخته شده است. هدف از این مطالعه، بررسی بیان miR-150 و miR-155 در بیماری لوسمی میلوژنوس مزمن(CML) بود تا با شناسایی تغییرات این میکرو RNAها بتوان از آنها در تشخیص، درمان و تخمین حداقل بیماری باقیمانده (MRD) استفاده نمود.
مواد و روشها
در یک مطالعه توصیفی، بیان miR-150 و miR-155 در 25 بیمار CML در فاز مزمن و 25 فرد سالم که به آزمایشگاه تشخیص طبی پیوند مراجعه کرده بودند، با روشهای Stem-loop RT-PCR و Real Time PCR سنجیده شد. یافتهها توسط آزمون آماری پیرسون، تجزیه و تحلیل شدند.
یافتهها
miR-150 و miR-155 در بیماران CML نسبت به افراد سالم کاهش بیان داشت(به ترتیب 512/0 و 2552/0).
آنالیز آماری پیرسون ارتباطی بین یافتههای آزمایشگاهی و بیان این دو miR نشان نداد. اما miR-155 با سن بیماران ارتباط معکوس داشت(01/0 p≤).
نتیجه گیری
با توجه به دادههای کسب شده، کاهش بیان miR-150 و miR-155 در CML میتواند پیشگوکننده این باشد که با القای افزایش بیان این دو میکرو RNA ها، میتوان از تکثیر زیاد سلولها در این بیماری کاست. هم چنین به مطالعههای دیگری نیاز است تا با شناخت ژنهای هدف این میکرو RNA ها، به نقش دقیق آنها در این بیماری پی برد.
کلمات کلیدی: میکرو RNA ها، miR-150 انسانی، miR-155 انسانی، لوسمی میلوژنوس مزمن
تاریخ دریافت : 23/7/93
تاریخ پذیرش : 3/10/93
1- دانشجوی PhD هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران و مربی دانشکده پیراپزشکی دانشگاه علوم پزشکی البرز ـ کرج ـ ایران
2- مؤلف مسئول: متخصص آسیبشناسی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- مؤلف مسئول : PhD هماتولوژی و بانک خون ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 111-14115
4- PhD هماتولوژی و بانک خون ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- PhD هماتولوژی و بانک خون ـ استادیار دانشگاه آزاد اسلامی ـ واحد پزشکی تهران ـ تهران ـ ایران
6- فوق تخصص خون و انکولوژی ـ دانشیار دانشکده پزشکی دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
7- PhD ویروسشناسی پزشکی ـ استادیار دانشکده زیستشناسی دانشگاه تهران ـ تهران ـ ایران
8- کارشناس ارشد بیوشیمی ـ آزمایشگاه تشخیص طبی و تخصصی پیوند ـ تهران ـ ایران
9- کارشناس ارشد زیستشناسی سلولی و مولکولی ـ آزمایشگاه تشخیص طبی و تخصصی پیوند ـ تهران ـ ایران
10- کارشناس ارشد بیوتکنولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
لوسمی میلوژنوس مزمن(CML)، یک اختلال کلونال سلولهای بنیادی خونساز میباشد، که جزو اختلالات میلوپرولیفراتیو تقسیمبندی میشود و حدود 15% لوسمی بزرگسالان را به خود اختصاص داده است. وقوع این بیماری سالانه 1 تا 2 نفر در هر 100000 نفر است. سن درگیری بیماران 45 تا 55 سال است، اما این بیماری در تمام گروههای سنی حتی کودکان هم دیده میشود(2، 1). میکرو RNA ها توالیهای RNA کوچک 18 تا 22 نوکلئوتید تک رشتهای هستند و نشان داده شده است که نقشی اساسی در تنظیم بیان ژن از طریق مهار mRNAهای هدف، ایفا میکنند(3). میکرو RNA ها بر اساس ژنهای هدف خاص، پروسههای سلولی مختلفی از جمله تکثیر، انتقال سیگنال، آپوپتوز و تومورژنزیس را تنظیم میکنند(4). همین طور میکرو RNA ها تنظیم کنندههای مهم رونویسی در خونسازی هستند(5). نقش میکرو RNA ها در ایجاد سرطان در انسان شناخته شده و از جهتی توانایی بالقوه این RNAهای کوچک غیر کدکننده در درمان و تشخیص سرطان توجه بسیاری از دانشمندان را به خود جلب کرده است(6).میکرو RNA ها میتوانند با مکانیسمهای متفاوتی در ایجاد سرطان نقش داشته باشند. یکی از این مکانیسمها وجود جهش در ژن میکرو RNAها میباشد. نتایج حاصل از آنالیز کامپیوتری و تحقیقات آزمایشگاهی نشانگر بیان بیش از 1000 نوع میکرو RNA در انسان میباشد، که بیش از 50% از این میکرو RNA ها در جایگاهی از ژنوم واقع شدهاند که از نظر ژنتیکی ناحیه حساس به جهش شناخته شده و در بسیاری از سرطانها، ناهنجاریهای ژنتیکی در این ناحیه مشاهده میشود. بسیاری از ژنهای مهارکننده سرطان و آنکوژنها، تحت کنترل دقیق میکرو RNA ها میباشند(7). بنابراین هر گونه تغییر در بیان میکرو RNA های تارگتکننده این ژنها میتواند باعث اختلالات تنظیمی در بیان ژنها شده و نهایتاً منجر به سرطان شود که با استفاده از این ویژگی میتوان از میکرو RNA ها در تشخیص، پیشگیری و حتی اندازهگیری حداقل بیماری باقیمانده(MRD) استفاده نمود(8). در سالهای اخیر با افزایش پیشرفت در زمینه روشهای مولکولی و مطالعههای انجام شده بر روی میکرو RNA ها، نقش این عناصر تنظیمی اپیژنتیک در تمایز سلولهای خونساز مورد توجه قرار گرفت و مشخص شد که میکرو RNA ها سهم قابل توجهی در طول این فرآیند سلولی دارند(9). میزان بیان میکرو RNA ها در ارتباط با پاتوژنز بعضی بدخیمیهای خونی شناخته شده است(10). هم چنین بیان نامعمول (غیر عادی) میکرو RNA ها در بسیاری از سرطانهای انسانی از جمله لوسمی میلوئیدی حاد توصیف شده است(11). نقش میکرو RNA ها در ایجاد سرطان در انسان و از جهتی توانایی بالقوه این RNA های کوچک غیر کدکننده در درمان و تشخیص سرطان توجه بسیاری از دانشمندان را به خود جلب کرده است(12). بنابراین نقش میکرو RNA ها و بیان ژنها امروزه به طور گستردهای در بدخیمیهای انسان مطالعه شده و ترکیبات شیمیایی که سطح میکرو RNA ها را تغییر میدهند، به طور بالقوه میتوانند استراتژیهای تشخیصی و درمانی جدیدی برای CML باشند. لذا هدف از این مطالعه، بررسی بیان miR-150 و miR-155 دخیل در لوسمی میلوژنوس مزمن بود تا با شناسایی تغییرات این میکرو RNA ها بتوان از آنها در تشخیص، درمان و تخمین حداقل بیماری باقیمانده (MRD = Minimal Residual Disease) استفاده نمود.
مواد و روشها
جمعآوری نمونههای بیماران و افراد سالم:
در این مطالعه تجربی، از 25 بیمار تازه تشخیص داده شده CML در فاز مزمن و هم چنین از 25 فرد سالم به عنوان کنترل، 5 میلیلیتر خون محیطی همراه با ضد انعقاد EDTA از آزمایشگاه تشخیص طبی و تخصصی پیوند جمعآوری شد. قابل ذکر است که حجم نمونه بر اساس مطالعههای قبلی انتخاب شده است(13). معیارهای انتخاب بیماران بر اساس یافتههای مورفولوژیکی خونشناسی خاص لوسمی میلوئیدی مزمن (از جمله افزایش تعداد گلبولهای سفید، افزایش رده میلوئیدی مانند پرومیلوسیت و نوتروفیل در خون محیطی) و هـم چنیـن آزمـایـش مثبـت PCR بـرای ترانسلوکاسیون (9;22)(BCR-ABL1) (210 kD) بود. تمامی بیماران در فاز مزمن بودند و هیچ گونه دارویی مصرف نکرده بودند. خون کامل در دور 3000 دور در دقیقه به مدت 20 دقیقه در دمای 22 درجه سانتیگراد سانتریفوژ شد و لایه بافیکوت جدا شد و در دمای منهای 70 درجه سانتیگراد برای ادامه کار نگهداری شدند.
پیشبینی miRNA های با اهمیت در CML :
برای پیشگویی miRNA هایی که ژنهای کلیدی را در مسیر سیگنالینگ این بیماری هدف قرار میدهند، از نرمافزارها و برنامههای زیر استفاده شد:
نرمافزار Pictar (http://pictar.mdc-berlin.de/)
نرمافزار MicroCosm (http://www.ebi.ac.uk/enright-srv/microcosm/htdocs/ targets/v5)
نرمافزار Target Scan (2/5Target Scan release http://www.targetscan.org/)
نرمافزار miRWalk (http://www. umm. uni-heidelberg. de/ apps/ zmf/ miRwalk)
نرمافزار miRanda (http://www.microrna.org)
نرمافزار Diana-microT و هم چنین از سایت KEGG (http://www.genome.jp/kegg/) که مسیرهای سیگنالینگ داخل سلولی در بیماریهای مختلف را نشان میدهد و سایت DAVID (http:// david. abcc. ncifcrf.gov/) استفاده شد. طی بررسی مقالههای متعدد، با توجه به نقشهای مهم و تعداد ژنهای هدف زیاد miR-150 و-155 miR در لوسمی میلوژنوس مزمن، این دو میکرو RNA برای این مطالعه انتخاب شدند(16-13).
طراحی آغازگر:
miRNA ها توالیهای کوتاه 25-22 نوکلئوتیدی هستند که ردیابی آنها با آغازگرهای معمول امکان پذیر نمیباشد. برای ردیابی آنها از ساختاری به نام ساقه- حلقه (stem-loop) استفاده شد. ساختار اولیه ساقه- حلقه از مقالهای که در سال 2005 چاپ شده بود گرفته شد(17). طول این توالی در بخش حلقه با اضافه نمودن چند نوکلئوتید طولانیتر شد. هم چنین ساختار نوکلئوتیدی با تغییر تعدادی از بازها طوری تغییر کرد که بدون به هم خوردن ساختار حلقه یا ساقه، دمای جدا شدن نیمی از دو رشتهها (Melting temperature) از 102 درجه سانتیگراد به حدود 85 درجه سانتیگراد رسید. به انتهای ساختار ساقه- حلقه، 6-4 نوکلئوتید مکمل انتهای ′3 هر miRNA اضافه شد تا امکان cDNA سازی اختصاصیتر را فراهم نماید. بنابراین برای هر miRNA یک ساختار حدود 70 نوکلئوتیدی که شامل بخش ثابت ساقه- حلقه و انتهای ′3 متغیر(مربوط به شناسایی miRNA) بود طراحی شد. برای طراحیها از برنامههای AlleleID6، GeneRunner، Oligo6 و mfold (برای بررسی ساختارهای ثانویه) استفاده شد. آغازگر سنس برای هر miRNA مکمل توالی نوکلئوتیدی miRNA (با کنار گذاشتن نوکلئوتیدهایی که برای اضافه نمودن Tm در صورت نیاز به انتهای 5' آغازگر افزوده شد) طراحی شد. بر روی ساقه ساختار ساقه- حلقه نیز آغازگر آنتیسنس طراحی شد تا امکان ردیابی miRNA کوتاه را فراهم نماید(جدول1).
جدول 1:توالی آغازگرهای طراحی شده برای ردیابی miRNA ها
| دما | سکانس | miRNA |
| UCUCCCAACCCUUGUACCAGUG | >hsa-miR-150 | |
| 8/94 درجه سانتیگراد | GGTCGTATGCAGAGCAGGGTCCGAGGTATCCATCGCACGCATCGCACTGCATACGACCCACTGG | miR-15 RT stem-loop |
| 7/60 درجه سانتیگراد | ACATCTCCCAACCCTTGTAC | miR-150 Forward Primer |
| UUAAUGCUAAUCGUGAUAGGGGU | >hsa-miR-155 | |
| 3/94 درجه سانتیگراد | GTCGTATGCAGAGCAGGGTCCGAGGTATTCGCACTGCATACGACACCCCT | miR-155 RT stem-loop |
| 1/61 درجه سانتیگراد | CGGTTTAATGCTAATCGTGA | miR-155 Forward Primer |
| 1/59 درجه سانتیگراد | GAGCAGGGTCCGAGGT | Universal Reverse |
برای طبیعی کردن بیان miRNA ها از آغازگرهای اختصاصی ژن SNORD 47 به عنوان housekeeping gene که طراحی آن هم به صورت ساختار ساقه- حلقه بود استفاده شد.
استخراج میکروRNA :
مراحل کار به شرح زیر میباشد:
یک میلیلیتر RNX-Plus سرد به بافیکوت (لایه حاوی گلبولهای سفید) اضافه شده و خوب مخلوط شد. سپس سوسپانسیون وارد یک میکروتیوب 5/1 میلیلیتر گردید و به مدت 1 دقیقه ورتکس شد. بعد از ورتکس، این مخلوط 5 دقیقه در دمای اتاق گذاشته شد. 200 میکرولیتر کلروفرم (به منظور جداسازی اجزای سلولی برحسب چگالی) به محتویات میکروتیوب اضافه کرده و یک دقیقه به شدت تکان داده شد. سپس 5 دقیقه در دمای 4 درجه سانتیگراد قرار داده شد. سانتریفوژ 4 درجه سانتیگراد، 20 دقیقه در rpm 12000 انجام شد. جداسازی محلول رویی (فاز آبی) و انتقال آن به میکروتیوب جدید صورت گرفت. هم حجم فاز آبی (محلول رویی) به آن اتانول 100% سرد (به منظور آبگیری) اضافه گردید.
سپس به آرامی مخلوط کرده و به صورتOvernight در دمای 20- درجه سانتیگراد قرار داده شد. سانتریفوژ 4 درجه سانتیگراد، 45 دقیقه در rpm 12000و دور ریختن محلول رویی(رسوب سفید رنگی دیده میشود) انجام شد. یک میلیلیتر اتانول 70% سرد اضافه و ورتکس کرده تا رسوب از ته لوله کنده شود. سانتریفوژ 4 درجه سانتیگراد، 15 دقیقه در rpm 12000 صورت گرفت. محلول رویی دور ریخته شد و درب لوله 10 دقیقه باز ماند تاRNA رسوب کرده خشک شود. حدود50-30 میکرولیتر آبRNase-DNase free اضافه گردید و غلظت RNA استخراج شده تعیین شد. نهایتاً محلول حاصل، جهت نگهداری به فریزر 70- درجه سانتیگراد منتقل شد.
ساخت cDNA :
مراحل ساخت cDNA به شرح زیر انجام شد:
یـک میکـروگرم از RNA تخلیص شده در دو لوله 200
میکرولیتر جداگانه، با 5/1 میکرولیتر از آغازگر 10پیکومول Stem-Loop RT-primer مخلوط گردیده و حجم در هر تیوب با آب RNase-DNase free به 13 میکرولیتر رسانده شد. درب لولهها را بسته و به مدت 10 دقیقه در دمای 70 درجه سانتیگراد در ترموسایکلر گذاشته شد. سپس لولهها فوراً بر روی یخ قرار گرفت و به هر کدام از آنها، 4 میکرولیتر بافر X 5 (فرمنتاز)، 2 میکرولیتر dNTP (mm 10) و 1 میکرولیتر Reverse transcriptase (فرمنتاز) افزوده شد. سپس درب لوله را بسته و طبق دستورالعمل دمایی، در زیر ترموسایکلر گذاشته شد. دستورالعمل دمایی به این صورت بود: دمای 25 درجه سانتیگراد به مدت 10 دقیقه، دمای 37 درجه سانتیگراد 10 دقیقه، دمای 42 درجه سانتیگراد 45 دقیقه و در نهایت 75 درجه سانتیگراد (برای غیر فعال کردن آنزیم) 10 دقیقه.
جدول 2 : اجزای لازم برای واکنش Real-Time PCR در دستگاه 6000 Rotor Gene
| اجزای تشکیلدهنده | غلظت(µM) | |
| Master Mix(SYBRR Premix Ex TaqTM- Takara) | µL (5/12) * 1 | |
| Forward Primer (10pmol) | 5/0 | |
| Universal Reverse Primer (10pmol) | 5/0 | |
| Template (cDNA) | µL 2 | |
| diH2O | تا حجم 25 | |
جدول 3: برنامه زمانی مراحل واکنش Real-Time qPCR برای miRNA ها
| مرحله | دما (درجه سانتیگراد) |
زمان (ثانیه) |
چرخه |
| فعالسازی آنزیم | 95 | 30 | 1 |
| دناچوراسیون | 95 | 5 | 45 |
| آنیلینگ و اکستنشن | 60 | 30 | |
| برای رسم منحنی Melt افزایش دما از 50 درجه سانتیگراد تا 90 درجه سانتیگراد | |||
پس از استخراج RNA و cDNA سازی با آغازگر RT حلقه- ساقه که برای هر miRNA با اضافه نمودن بخش انتهای توالی miRNA هدف اختصاصی شده بود، واکنش Real-Time PCR به صورت دو مرحلهای در دستگاه 6000 Rotor Gene (استرالیا، NSW ، Concorde ، Corbett) صـورت گرفـت. از ژن (47U) 47 SNORD به عنوان RNA ای با طول کوتاه به عنوان کنترل داخلی برای طبیعی کردن نتایج استفاده شد( جداول 2 و 3).
بیان miR-150 و miR-155 و SNORD47 در بیماران CML و نمونههای افراد سالم به دست آمده و نتایج در برنامه 2009 REST تجزیه و تحلیل شد. یافتههای آزمایشگاهی وارد نرمافزار 16 SPSS شد و با آزمون کایدو و پیرسون آنالیز آماری صورت گرفت.
یافتهها
نتایج Real-Time PCR :
نتایج Real-Time PCR ، بیان miR-150 و miR-155 در بیماران نسبت به افراد سالم پس از آنالیز در برنامه 2009 REST در جدول 4 و نمودار 1 آورده شده است.
در مقایسه میزان بیان miR-150 و miR-155 در بیماران مبتلا به CML نسبت به گروه کنترل(افراد سالم) به ترتیب بیان آنها 512/0 و 2552/0 شد که هر دو کاهش بیان را نشان دادند. بیان این دو miRNA در بیماران نسبت به افراد سالم به طور معناداری کاهش داشت(03/0 p=). لازم به ذکر است که ژن SNORD به عنوان کنترل داخلی در کار استفاده شده است.


نمودار 1: بیان miR-150 و miR-155 در بیماران مبتلا به لوسمی
میلوژنوس مزمن در مقایسه با نمونههای افراد سالم(05/0 p≤)
یافتههای آزمایشگاهی(بالینی):
در جدول 5 یافتههای آزمایشگاهی(بالینی) 25 بیمار شامل سن، جنس، تعداد گلبولهای سفید(WBC)، نوتروفیل، لنفوسیت، منوسیت، ائوزینوفیل و بازوفیل نشان داده شده است.
ارتباط بین یافتههای آزمایشگاهی و تغییرات بیان میکرو RNA ها :
ارتباط بین تغییرات بیان هر یک از میکرو RNA ها با جنس، سـن، تعداد گلبولهای سفید، تعداد مطلق نوتروفیل، لنفوسیت، منوسیت، ائوزینوفیل و بازوفیل (Pearson correlation) سنجیده شد. ارتباط معناداری بین آنها وجود نداشت اما با افزایش سن بیماران، بیان miR-155 به طور معناداری کاهش بیشتری نشان داد که میتواند نشاندهنده این باشد که با افزایش سن بیماران، بیان این میکرو RNA ها کاهش مییابد.(002/0 p=). در جدول 6 ارتباط بین یافتههای بالینی بیماران و تغییرات بیان میکرو RNA ها نشان داده شده است.
جدول 4: نتایج Real-Time PCR بیان miR-150 و miR-155 در بیماران نسبت به افراد سالم(TRG:Target ، REF: Reference)
جدول 5 : یافتههای آزمایشگاهی بیماران
جدول 6: ارتباط بین یافتههای بالینی بیماران و تغییرات بیان میکرو RNA ها
| ژن | انواع | Reaction Efficiency | Expression | نتایج |
| SNORD | REF | 0/1 | 000/1 | |
| miR-150 | TRG | 0/1 | 512/0 | DOWN |
| miR-155 | TRG | 0/1 | 2552/0 | DOWN |
| شماره بیمار | جنس | سن | گلبول سفید | نوتروفیل | لنفوسیت | منوسیت | ائوزینوفیل | بازوفیل |
| 1 | 1 | 57 | 81/137 | 53/98 | 22/21 | 69/4 | 52/1 | 85/11 |
| 2 | 1 | 56 | 38/193 | 21/163 | 41/11 | 9/8 | 8/5 | 06/4 |
| 3 | 1 | 49 | 93/120 | 48/97 | 28/10 | 11 | 36/0 | 81/1 |
| 4 | 1 | 56 | 84/188 | 54/164 | 44/12 | 1/8 | 57/0 | 83/2 |
| 5 | 0 | 19 | 06/221 | 19/196 | 94/11 | 97/5 | 54/3 | 42/4 |
| 6 | 0 | 43 | 38/105 | 83/88 | 27/9 | 85/4 | 53/0 | 9/1 |
| 7 | 1 | 40 | 29/113 | 31/91 | 8/12 | 76/4 | 36/1 | 06/3 |
| 8 | 1 | 26 | 85/236 | 56/192 | 24/27 | 11/7 | 36/4 | 68/5 |
| 9 | 1 | 66 | 67/151 | 44/135 | 83/6 | 04/8 | 15/0 | 21/1 |
| 10 | 0 | 27 | 47/50 | 47/24 | 52/12 | 48/3 | 72/1 | 28/8 |
| 11 | 1 | 82 | 81/138 | 86 | 1/7 | 4/4 | 1 | |
| 12 | 0 | 43 | 60/166 | 1/90 | 3/4 | 4/3 | 8/0 | |
| 13 | 1 | 39 | 41/138 | 74/114 | 12/14 | 4/5 | 46/3 | |
| 14 | 1 | 23 | 92/28 | 09/19 | 44/5 | 02/2 | 59/1 | 78/0 |
| 15 | 0 | 68 | 10/23 | 57/15 | 45/5 | 22/1 | 28/0 | 58/0 |
| 16 | 1 | 55 | 08/120 | 56/7 | 66/87 | 5/24 | 12/0 | 24/0 |
| 17 | 0 | 35 | 90/64 | 18/54 | 43/6 | 86/2 | 32/0 | 17/1 |
| 18 | 1 | 73 | 78/71 | 64/55 | 76/9 | 8/3 | 1 | 58/1 |
| 19 | 1 | 45 | 34/254 | 25/131 | 77/51 | 24/53 | 15/5 | 93/3 |
| 20 | 0 | 63 | 49/103 | 87/19 | 51/68 | 9/14 | 0 | 21/0 |
| 21 | 1 | 46 | 58/109 | 16/92 | 53/9 | 04/5 | 21/1 | 64/1 |
| 22 | 0 | 23 | 75/110 | 29/81 | 17/15 | 1/2 | 11/1 | 08/11 |
| 23 | 1 | 31 | 79/72 | 33/63 | 95/4 | 91/2 | 44/0 | 16/1 |
| 24 | 1 | 38 | 76/102 | 78/84 | 48/10 | 75/5 | 21/0 | 54/1 |
| 25 | 1 | 76 | 02/51 | 38/44 | 93/3 | 35/2 | 26/0 | 1/0 |
جدول 6: ارتباط بین یافتههای بالینی بیماران و تغییرات بیان میکرو RNA ها
| جنس | گلبول سفید | نوتروفیل | لنفوسیت | منوسیت | ائوزینوفیل | بازوفیل | |
| miR150 | 119/0- | 177/0 | 227/0- | 452/0 | 473/0 | 408/0 | 073/0 |
| miR155 | 222/0- | 007/0- | 145/0- | 321/0 | 258/0 | 204/0 | 015/0 |
بحث
لوسمی میلوژنوس مزمن(CML)، یک اختلال کلونال سلولهای بنیادی خونساز میباشد، که جزو اختلالات میلوپرولیفراتیو تقسیمبندی میشود و حدود 15% لوسمی بزرگسالان را به خود اختصاص داده است(18). این لوسمی در 95% موارد همراه با یک ناهنجاری کروموزومی به نام فیلادلفیا(Ph) میباشد که این ناهنجاری در نتیجه جابهجایی دو طرفه کروموزومی به دنبال شکست در باند q34 کروموزوم 9 و شکست در باند q11 کروموزوم 22 رخ میدهد(q34;q11) (9;22)t، در نتیجه کایمریسم BCR-ABL1 به وجود میآید. ژن BCR-ABL1 به پروتئین KD 210 ترجمه میشود که به عنوان BCR-ABL1 210P شناخته میشود(19).
در سالهای اخیر شبکه جدیدی از چرخههای تنظیمی در سطح mRNA مورد توجه قرار گرفته است که شامل یک کلاس از RNAهای غیر کدکننده به نام میکرو RNA است.
میکرو RNA ها مولکولهای RNA کوچک و تک رشتهای غیر کدکنندهای هستند که مکمل mRNA یک ژن کدکننده پروتئین دیگر میباشند و میتوانند از بیان یک ژن و تولید پروتئین مربوطه جلوگیری کنند(20). میکرو RNAها تنظیمکنندههای مهم رونویسی در خونسازی هستند. میزان بیان آنها در ارتباط با پاتوژنز بعضی بدخیمیهای خونی شناخته شده است(21، 9). در سالهای اخیر با افزایش پیشرفت در زمینه روشهای مولکولی و مطالعههای انجام شده بر روی میکرو RNAها، نقش این عناصر تنظیمی اپی ژنتیک در تمایز سلولهای خونساز مورد توجه قرار گرفت و مشخص شد که میکرو RNAها سهم قابل توجهی در طول این فرآیند سلولی دارند(13). بیان نامعمول(غیر عادی) میکرو RNAها در بسیاری از سرطانهای انسانی از جمله لوسمی لنفوئیدی مزمن توصیف شده است(22). نقش میکرو RNA ها در ایجاد سرطان در انسان و از جهتی توانایی بالقوه این RNA های کوچک غیر کدکننده در تشخیص، درمان و کنترل حداقل بیماری باقیمانده آن توجه بسیاری از دانشمندان را به خود جلـب کـرده اسـت(23). میکـرو RNA ها مـیتـواننـد بـا
مکانیسمهای متفاوتی در ایجاد سرطان نقش داشته باشند. یکی از مکانیسمهای ایجاد سرطان به وسیله آنها وجود جهش در ژن میکرو RNAها میباشد. نتایج حاصل از آنالیز کامپیوتری و تحقیقات آزمایشگاهی نشانگر بیان بیش از 1000 نوع میکرو RNA در انسان است، که بیش از 50% از این میکرو RNA ها در جایگاهی از ژنوم واقع شدهاند که از نظر ژنتیکی ناحیه حساس به جهش شناخته شده و در بسیاری از سرطانها ناهنجاریهای ژنتیکی در این ناحیه مشاهده میشود. به عنوان مثال، miR-15 و miR-16 از جمله میکرو RNA های موجود در نواحی جهشزا هستند که عملکرد آنها به عنوان مهارکننده سرطان به اثبات رسیده است، به طوری که جهش ژنتیکی این میکرو RNA ها اولین بار در بیماران مبتلا به B-CLL نشان داده شده و در ادامه، این جهش در 65% بیماران مبتلا به CLL ، در 50% mantle cell lymphomas ، 15 تا 40 درصد multiple myelomas و 60% سرطان پروستات گزارش شده است(24). اختلال در میزان بیان، یکی دیگر از مکانیسمهای ایجاد سرطان به وسیله میکرو RNA ها است. بسیاری از ژنهای مهارکننده سرطان و انکوژنها تحت کنترل دقیق میکرو RNA ها میباشند. بنابرین هر گونه تغییر در بیان میکرو RNA های هدف قرار دهنده این ژنها میتواند باعث اختلالات تنظیمی در بیان ژنها شده و نهایتاً منجر به سرطان شود که با استفاده از این ویژگی میتوان از میکرو RNA ها در تشخیص، پیشگیری و حتی اندازهگیری حداقل بیماری باقیمانده استفاده نمود. نقش میکرو RNA ها در ایجاد سرطان در انسان و از جهتی توانایی بالقوه این RNA های کوچک غیر کدکننده در درمان و تشخیص سرطان توجه بسیاری از دانشمندان را به خود جلب کرده است. در مطالعه فلامانت بعد از دو هفته درمان بیماران CML با ایماتینیب، افزایش بیان miR-150 و miR-146a و کاهش بیان miR-142-3p و miR-199b نشان داده شد(25). در مطالعه پولاکوا، پروفایلینگ بیان میکروRNA با روش microarray نشان داد بیان miR-19 ، miR-221 و miR-126 افزایش و بیان miR-150 و miR-103 کاهش مییابد(26). در مطالعه روکا کاهش بیان miR-31 ، miR-155 و miR-564 در ردههای سلولی CML نشان داده شد(27). اما در مطالعـه حاضـر هـدف بـررسی بیان میکرو RNA های دخیل در بیماران لوسمی میلوژنوس مزمن بود تا با شناسایی میکرو RNA هایی که در پاتوژنز CML دخیل هستند، بتوان از آنها برای تشخیص، درمان و تخمین حداقل بیماری باقیمانده و هم چنین به عنوان عامل پیشآگهی دهنده استفاده کرد.
همان طور که گفته شد، هدف از انجام مطالعه حاضر، بررسی بیان miR-150 و miR-155 در بیماران مبتلا به لوسمی میلوژنوس مزمن با روش Real-Time PCR بود. که به این منظور از گلبولهای سفید خون محیطی بیماران تازه تشخیص داده شده CML که هیچ نوع درمانی نگرفته بودند و هم چنین افراد سالم، RNA استخراج گردید و با روش Stem-loop RT-PCR ، ساخت cDNA صورت گرفت و میـزان بیـان ایـن دو میکرو RNA بـا استفاده از روش Real-time PCR سنجیده شد. نتایج نشان داد که miR-150 و miR-155 در بیماران نسبت به افراد سالم کاهش دارد.
نتیجهگیری
با توجه به دادههای کسب شده، میتوان نتیجه گرفت که miR-150 و miR-155 در لوسمی میلوژنوس مزمن بیان کاهشی دارد که میتواند پیشگوکننده این باشد که با القای افزایش بیان این دو میکرو RNA میتوان از تکثیر زیاد سلولها در این بیماری کاست. هم چنین به مطالعههای دیگری نیاز است تا با مشخص کردن ژنهای هدف این میکرو RNA ها ، نقش دقیق آنها را در این بیماری مشخص کرد.
تشکر و قدردانی
این پژوهش در قالب پایاننامه دانشجویی و با مساعدتهای مالی مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب انتقال خون و مرکز تحقیقات بنیاخته انجام شده است که بدین وسیله از آنها قدردانی میشود.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



