جلد 10، شماره 4 - ( زمستان 1392 )
جلد 10 شماره 4 صفحات 325-319 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shiri R, Yari F, Amirizadeh N, Gharehbaghian A, Ahmadinejad M, Tabatabaie M. Effects of caspase 3 inhibitor on the survival of platelet concentrate during storage . bloodj 2014; 10 (4) :319-325
URL: http://bloodjournal.ir/article-1-837-fa.html
URL: http://bloodjournal.ir/article-1-837-fa.html
شیری رضا، یاری فاطمه، امیریزاده ناصر، قرهباغیان احمد، احمدینژاد مینو، طباطبایی محمدرضا. تاثیر مهارگر کاسپاز 3 بر بقای پلاکت کنسانتره در طول زمان ذخیره. فصلنامه پژوهشی خون. 1392; 10 (4) :319-325
دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 332 kb]
(3314 دریافت)
| چکیده (HTML) (11377 مشاهده)
مقدمه
با این که آپوپتوز در سلولهای هستهدار اتفاق میافتد، مشخص شده است که علاوه بر سلولهای هستهدار، سلولهای فاقد هسته مانند پلاکتها هم دچار فرآیند آپوپتوز میشوند. مهمترین اندامک دخیل در آپوپتوز پلاکتها، میتوکندری است. پلاکتها با وجود این که فاقد هسته و DNA درون هسته هستند، قابلیت ساخت پروتئینهای درگیر در آپوپتوز را دارا میباشند(2، 1). در پلاکتها میتوکندریها نقش مهمی در بقا و نیز تنظیم مرگ سلولی ایفا میکنند. آنها از طرفی عامل تنفس سلولی و ایجاد انرژی بوده و از طرف دیگر، در آپوپتوز سلول نقش دارند.
یونوفور کلسیم و نیز آگونیستهای فعالکننده پلاکتی مثل ترومبین، کلاژن و ترومبوکسان A2 میتوانند سبب القای آپوپتوز در پلاکتها شوند، هم چنین در پلاکتهایی که به مدت طولانی در دمای اتاق در بانک خون نگهداری میشوند، آپوپتوز رخ میدهد. نگهداری پلاکتها در دمای 37 درجه سانتیگراد در مقایسه با دمای 22 درجه سانتیگراد باعث القای آپوپتوز میشود(6-3).
با توجه به این که مدت زمان نگهداری فرآورده پلاکت در دمای 22 درجه سانتیگراد محدود به 3 الی 5 روز میباشد، لذا به منظور حفظ پایداری بیشتر پلاکت و افزایش زمان نگهداری این فرآورده، تلاشهای فراوانی در دست انجام است. طبق مطالعههای انجام شده علت محدود بودن زمان نگهداری این فرآورده آن است که در طی زمان ذخیرهسازی پلاکتها، پدیده آسیب در زمان ذخیره (storage lesion) در آنها رخ میدهد که طی آن ساختار، بیوشیمی و عملکرد پلاکتها دچار تغییر شده و در نهایت مرگ برنامهریزی شده (آپوپتوز) در آنها القا میشود(7).
کاسپازها جزو خانواده سیستئین پروتئازها هستند که نقش محوری در شروع و فاز اجرایی آپوپتوز ایفا مینمایند. به دنبال فعال شدن، این آنزیمها روی سوبستراهای خود عمل نموده و تغییرات بیوشیمیایی و مورفولوژیک در سلول آپوپتوتیک ایجاد مینمایند. بنابراین ارزیابی فعالیت آنزیمهای کاسپاز به عنوان یک شاخص بیوشیمیایـی آپـوپتوز مطرح میباشـد کـه در این بین نقش
کاسپاز 3 بسیار مهم است(9، 8).
مطالعه میزان بقای پلاکتها در حضور یا فقدان حضور یک پپتید مهارکننده کاسپاز 3 ، هدف این تحقیق میباشد. در رابطه با به کارگیری این پپتیدها در فرآورده پلاکت انسانی به صورت کنسانتره، مطالعههای محدودی وجود دارد. از جمله در مطالعهای در رابطه با پلاکت تهیه شده به روش آفرزیس، تاثیر مهارکنندههای کاسپاز در رابطه با بهینه کردن کیفیت پلاکت کنسانتره به دلیل این که در پلاکتها، فعال شدن کاسپازها یک واقعه تاخیری محسوب میشود، نفی میگردد(10). در حالی که مطالعههای دیگر در لوله آزمایش و یا در حیوانات انجام شده و اثبات کننده این تاثیر میباشند(12، 11). در پاسخ به تاثیرگذاری و یا عدم تاثیرگذاری پپتیدهای مهارگر در رابطه با حفظ بهتر کیفیت پلاکت کنسانتره، این مطالعه صورت گرفته و امید است یافتههای حاصل از این پژوهش بتواند به شناخت روشهای مناسب و کاربردی جهت ایجاد تاخیر در آپوپتوز در طول زمان ذخیره پلاکت کنسانتره کمک نماید.
مواد و روشها
در یک مطالعه بنیادی ـ کاربردی، واحدهای کنسانتره پلاکتی از اهداکنندگان خون مراجعهکننده به پایگاه انتقال خون تهران به شکل تصادفی تهیه گردید. با توجه به این که جهت تکمیل آزمایشهای غربالگری ویروسی(HIV، HCV و HBV) روی کنسانترههای پلاکتی، زمان لازم بود، لذا کنسانتره پلاکتی ۱٢ تا 24 ساعت پس از زمان خونگیری تحویل گرفته شدند.
برای تقسیم هر کیسه کنسانتره پلاکتی در سیستم بسته، لازم بود از کیسههای جمعآوری خون که حاوی 2 الی 3 کیسه اقماری و 1 کیسه حاوی ماده ضد انعقاده/نگهدارنده (CPDA) بود، استفاده شود. کیسههای اقماری دوتایی با کوردهای مناسب و استریل برای اتصال به هر کدام از کنسانترههای پلاکتی استفاده شد. اتصال کیسههای اقماری به کیسههای حاوی کنسانتره پلاکتی باید به شکل استریل و در یک سیستم بسته انجام میشد، برای نیل به این هدف، از دستگاه متصل کننده (connecting device)استفاده شد که به صورت استریل امکان اتصال کوردهای کیسه را بدون باز
کردن کیسهها فراهم مینماید.
جهت مهار آپوپتوز سلولی، از یک پپتید سنتتیک به نام Z-DEVD-FMK (بیوویژن) استفاده شد که به طور برگشتناپذیری فعالیت کاسپاز 3 را مهار میکند. به منظور تسهیل نفوذ این مهارگر به داخل سلول و مهار کاسپاز که درون سلول حضور دارند، این مهارگر حاوی متیل استراز میباشد. پس از انجام آزمایشهای مقدماتی و استفاده از غلظتهای متفاوت پپتید مهارگر کاسپاز(غلظت 8 میکرومول تا 32 میکرومول)، در نهایت غلظت 16 میکرومول آن جهت کیسههای پلاکتی انتخاب گردید. تزریق پپتید مهارگر کاسپاز 3 به کیسههای پلاکت در روز سوم ذخیره کیسه و در غلظت 16 میکرومول انجام و مجدداً کیسهها به شیکر انکوباتور 22 درجه سانتیگراد بازگردانده شدند تا در روزهای چهارم و هفتم نمونهبرداری شوند. لازم به ذکر است در مجموع 30 کنسانتره پلاکتی شامل 15 نمونه آزمایش و 15 نمونه کنترل استفاده شد.
جهت بررسی فعالیت کاسپاز 3 پلاکتی در روزهای 4 و 7 نگهداری کنسانتره پلاکتی، از کیت Caspase assay (بیوویژن) استفاده شد(13). برای انجام این آزمایش ابتدا 20 میکرولیتر از نمونهها را با 80 میکرولیتر از بافر PBS رقیق کرده، جهت لیز به آنها 100 میکرولیتر بافر Cell Lyse اضافه گردید و به مدت 30 دقیقه در دمای 4 درجه سانتیگراد قرار داده شدند. بعد از 30 دقیقه نمونهها با دور g 3300 به مدت 5 دقیقه سانتریفیوژ شدند تا لاشه پلاکتها جدا شوند. سپس عصارهرویی حاصل از این سانتریفیوژ به میکروتیوبهای دیگر منتقل شده و غلظت پروتئینی آنها در حضور نمونههای استاندارد و به روش Bradford سنجیده شد. غلظت نهایی عصاره پلاکتی برای سنجش فعالیت کاسپازی µg/mL 200 انتخاب گردید که رقیقسازی آن توسط بافر Dilution و درحجم نهایی 50 میکرولیتر انجام شد. سپس 50 میکرولیتر از بافر 2x reaction/DTT به نمونهها اضافه گردیده و در ادامه 5 میکرولیتر از سوبسترای(Ac-DEVD-pNA) acetyl-Asp-Glu-Val-Asp p-nitroanilide افزوده شد. بعد از انکوباسیون به مدت 2 ساعت در 37 درجه سانتیگراد، جذب نوری آنها در طول موج nm 405 قرائت گردید. در این آزمایش میزان فعالیت کاسپاز با سنجش میزان تجزیه سوبسترا و آزاد شدن PNA (p-nitroanilide) مشخص میشود که هر چه فعالیت آن بیشتر باشد PNA بیشتری تولید شده وجذب نوری بالاتر است.
جهت بررسی بقای سلولهای پلاکتی در کیسههای اصلی حاوی مهارگر و کیسههای کنترل، از آزمایش MTT استفاده شد. در این روش، شاخص بقای سلول، حضور میتوکندری فعال و عملکرد آنزیمهای دهیدروژناز آنها در سلول میباشد(14). برای انجام این آزمایش به 100 میکرولیتر سلول، 10 میکرولیتر از رنگ MTT اضافه کرده و ماده حاصل به مدت 4 ساعت در انکوباتور CO2 دار، انکوبه گردید. بعد از 4 ساعت به هر کدام از نمونهها، 100 میکرولیتر محلول حلکننده افزوده و بعد از 24 ساعت انکوبه در 37 درجه سانتیگراد، جذب نوری آنها با استفاده از دستگاه اسپکتروفتومتر در طول موج 575 نانومتر قرائت میشد. در این روش، میزان جذب نوری مورد انتظار در نمونههای تحت آپوپتوز کمتر میباشد. در آزمایش یاد شده رنگ زرد MTT توسط آنزیمهای میتوکندریایی سلولهای زنده شکسته شده و با تولید نمک رنگی فورمازان، میزان بقای سلولها به واسطه جذب نوری مشخص گردید. دادههای به دست آمده به وسیله آزمون Paired Samples T-Test مورد مقایسه قرار گرفت.
یافتهها
نتایج آزمایشهای سنجش فعالیت کاسپازی در نمونههای روز 4 و 7 نشاندهنده کاهش فعالیت کاسپازی در پلاکتهای دریافتکننده دارو در مقایسه با کنترل بود. در این غلظت از دارو، نتایج نشان داد که بین شرایط دریافت دارو و کنترل در روز چهارم و هفتم به ترتیب با p معادل 001 /0 و 01/0 ، اختلاف معنادار مشاهده میشود (شکل 1).
از طرف دیگر نتایج این بررسی نشان داد که میزان بقای سلولهای پلاکتی که با فعالیت متابولیکی آنزیمهای دهیدروژناز میتوکندری در سلول متناسب میباشد، در زمان نگهداری با گذشت زمان کاهش مییابد به طوری که میزان بقای پلاکتها در روز 7 در مقایسه با روز 4 پایینتر است. این در حالی است که میانگین بقا در نمونههای روز 4 و روز 7 ذخیره در دوز 16 میکرومول از دارو، نشاندهنده بقای بیشتر پلاکتها در کیسههای اصلی دریافتکننده مهارگر در مقایسه با کنترل میباشد. با توجه به p به دست آمده برای روزهای 4 و 7 که به ترتیب 001/0 و 05/0 بود، این اختلاف به نفع به کارگیری داروی مهارگر معنادار بود(جدول 1).
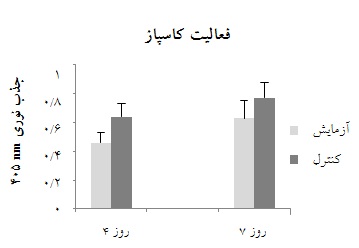
نمودار 1: نمایش میانگین فعالیت کاسپازی به صورت جذب نوری درکیسههای پلاکتی مربوط به روزهای 4 و 7 ذخیره به دست آمده از کیسه آزمایش(دریافتکننده پپتید مهارگر) با غلظت 16 میکرومول در روز سوم نگهداری و کیسه کنترل(بدون دریافت پپتید مهارگر). بین شرایط دریافت دارو و کنترل در روز چهارم و هفتم به ترتیب با p-value معادل 001 /0 و 01/0 اختلاف معنادار مشاهده میشود. لازم به ذکر است فعالیت کاسپازی به صورت جذب نوری در طول موج nm 405 منظور شده است.
جدول 1: میانگین نتایج OD در آزمایش MTT در نمونههای کیسه پلاکتی مربوط به روزهای 4 و 7 ذخیره به دست آمده از کیسه اصلی(دریافتکننده پپتید مهارگر با غلظت 16 میکرومول در روز سوم نگهداری) و کیسه کنترل(بدون دریافت پپتید مهارگر)

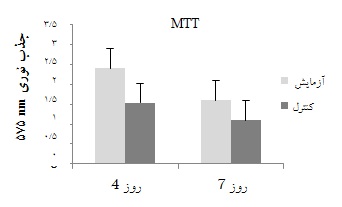
نمودار 2: نمایش میانگین نتایج آزمایشMTT در نمونههای کیسه پلاکتی مربوط به روزهای 4 و 7 ذخیره به دست آمده از کیسه اصلی Test (دریافتکننده پپتید مهارگر با غلظت 16 میکرومول در روز سوم نگهداری) و کیسه کنترل(بدون دریافت پپتید مهارگر)
بحث
در پلاکتهای دریافتکننده پپتید مهارگر، کاهش معنادار فعالیت کاسپازی در مقایسه با گروه کنترل ملاحظه شد. از طرفی مطالعه نشان داد میزان بقای سلولهای پلاکتی در طول مدت نگهداری آنها در کیسههای دریافتکننده پپتید مهارگر کاسپاز نسبت به کیسههای کنترل که فاقد داروی مهارگر بودند، به طور معناداری میزان بقای بالاتری را نشان دادند.
زمان کوتاه نگهداری فرآورده پلاکت، موجب کاهش ذخیره پلاکتی شده و بانک خون را ملزم به تولید روزانه آن میکند، لذا به منظور حفظ پایداری بیشتر پلاکت و افزایش زمان نگهداری این فرآورده، تلاشهایی در دست انجام است(15).
طبق مطالعههای انجام شده با توجه به این که در طی ذخیرهسازی پلاکتها، پدیده آسیبهای زمان ذخیره در آنها رخ میدهد که طی آن مرگ برنامهریزی شده(آپوپتوز) در آنها القا میشود، چنانچه بتوان با مهار یا کاهش میزان آپوپتوز، زمان پایداری پلاکت را افزایش داد، از هدر رفتن واحدهای پلاکتی جلوگیری خواهد شد. با توجه به این امر در مطالعهای که انجام شد از مهارگر اختصاصی کاسپاز 3 استفاده شد تا بقای مطلوبتر پلاکتی با مهار آپوپتوز صورت گیرد.
حاصـل ایـن مطالعـه نشـان داد به کارگیری این داروی
مهارگـر در مقـدار مناسـب، میتوانـد سبــب مهار فعالیت
آنزیمهای کاسپاز و افزایش در میزان بقای پلاکت کنسانتره در طول زمان نگهداری شود(آزمایشها در غلظتهای 8 میکرومول دارو شروع و تا غلظت 32 میکرومول آن ادامه یافته و در نهایت غلظت 16 میکرومول به دلیل نتیجه بهتر انتخاب شد). این غلظت شبیه غلظت به کار گرفته شده توسط کهن و همکارانش است که از مهارکننده عمومی کاسپاز((Z-VAD-FMK ، با غلظت 20 میکرومول جهت پلاکت به دست آمده از خون Rat در لوله آزمایش استفاده نمودند(12). مطالعههایی صورت گرفته که نشان میدهند آپوپتوز، علاوه بر سلولهای هستهدار، در پلاکتهای فاقد هسته نیز روی میدهد(20-16). به عنوان مثال در مطالعههای اولیه در سال 1999، شربینا نقش کاسپازها را در پلاکتها بیان نمود(8). در زمینه روشهای مؤثر در مهار آپوپتوز در پلاکتها، استفاده از پپتید مهارگر کاسپاز، در مطالعههای معدودی صورت گرفته که غالباً در ارتباط با فرآورده کنسانتره پلاکتی نبودهاند.
پیگوئت و همکارانش در مطالعهای که در سال 2002 انجام دادند، نشان دادند که استفاده از نوع دیگری از مهارگر کاسپاز به نام Z-VAD-FMKمیتواند سبب کاهش فعالسازی کاسپاز در پلاکتها در یک مدل حیوانی مبتلا به مالاریا شود(11). هر چند مطالعه ما در شرایط in vitro و در کیسههای کنسانتره پلاکتی صورت گرفت، ولی نتایجی مشابه با نتایج پیگوئت نشان داد به طوری که در هر دو، استفاده از پپتید مهارگر با کاهش فعال شدن آنزیمهای کاسپاز در پلاکتها همراه بود.
در مطالعهای که در سال 2004 توسط کوهن و همکارانش انجام شد، از مهارکننده عمومی کاسپازZ-VAD-FMK، با غلظت 20 میکرومول جهت پلاکت به دست آمده از خون Rat در لوله آزمایش استفاده شد. نتیجه نشان داد در پلاکتهایی که به مدت 45 دقیقه با Z-VAD-FMK مواجه شدهاند، میزان بیان فسفاتیدیل سرین به طور مشهود
کاهش پیدا میکند(12). این مطالعه علیرغم بررسی اندکسهای متفاوت، با کار ما ایده مشابه داشته و نقش یک پپتید مهارگر فعالیت کاسپازی را بر روی پلاکت بررسی مینماید. مطالعه کوهن هر چند مواجهه کوتاه مدت با پپتید مهارگر را در لوله آزمایش بررسی مینماید در مقایسه با مطالعه حاضر که در طول 7 روز نگهداری پلاکت کنسانتره انجام شده است، میتواند بیانگر تاثیرگذاری سریع داروی استفاده شده در زمان کوتاه پس از افزودن آن باشد.
در سال 2008، کوهن و همکاران در حیوان رت مبتلا به دیابت نوع II نشان دادند که استفاده از Z-VAD-FMK که یک مهارگر عمومی کاسپازها میباشد، میتواند در فعالیت پلاکتها و بیان فسفاتیدیل سرین بر سطح آنها تاثیر گذارد(21). لازم به ذکر است تظاهر فسفاتیدیل سرین در لایه خارجیتر غشای پلاسمایی، علاوه بر این که میتواند تا حدودی مبین فعالیت آپوپتوزی در پلاکتها باشد، بلکه مرتبط با فعالیت پلاکتی و شرایط متابولیکی آنها نیز میباشد(22).
نتیجهگیری
با توجه به یافتهها و دادههای به دست آمده از این تحقیق و نیز استناد بر یافتههای سایر مطالعهها، میتوان نتیجه گرفت که اگر مهارگر کاسپاز 3 در زمان مناسب از ذخیره پلاکت کنسانتره و در غلظت مناسب به کیسه پلاکت تزریق شود، میتواند در میزان فعالیت میتوکندریایی و بقای پلاکت کنسانتره تاثیر مثبت داشته باشد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد هماتولوژی مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدین وسیله نویسندگان مراتب تشکر و قدردانی خود را به خاطر حمایت مالی و معنوی مؤسسه ابراز میدارند.
متن کامل: (1726 مشاهده)
تاثیر مهارگر کاسپاز 3 بر بقای پلاکت کنسانتره در طول زمان ذخیره
رضا شیری1، فاطمه یاری2، ناصر امیریزاده3، احمد قرهباغیان4، مینو احمدینژاد5، محمدرضا طباطبایی6
چکیده
سابقه و هدف
زمان نگهداری فرآورده کنسانتره پلاکتی به 5-3 روز محدود میشود. یکی ازعلل آن، پدیده آسیبهای زمان ذخیره(storage lesion)، آسیب به سلولهای پلاکتی و نهایتاً آپوپتوز است که در طول مدت نگهداری در این سلولها القا میشود. مطالعهها نشان داده است که آپوپتوز در بعضی سلولهای بدون هسته و از جمله پلاکتها نیز رخ میدهد. در این مطالعه، به کارگیری مهارگرآنزیم کاسپاز3 در زمان ذخیره پلاکت کنسانتره در دستیابی به پلاکتی با طول عمر بیشتر مورد ارزیابی قرار گرفت .
مواد و روشها
مطالعه انجام شده از نوع بنیادی ـ کاربردی بود. بعد از تهیه و آماده کردن نمونههای پلاکتی، پپتید مهارگر کاسپاز3 به کیسههای کنسانتره پلاکتی تزریق شد. این کیسه ها به همراه کیسههای کنترل که فاقد مهارگر بودند، به مدت 7 روز در شیکر انکوباتور 22 درجه سانتیگراد نگهداری شدند. در طول مدت نگهداری از کیسه های اصلی و کنترل نمونهبرداری شده، فعالیت کاسپازی وبقای پلاکتها در آنها ارزیابی شد.
یافتهها
در پلاکتهای دریافتکننده پپتید مهارگر، کاهش معنادار فعالیت کاسپازی در مقایسه با گروه کنترل ملاحظه شد(05/0 p<). از طرفی مطالعه نشان داد در حالی که میزان بقای سلولهای پلاکتی در طول مدت نگهداری آنها با گذشت زمان کاهش مییابد، کیسههای دریافتکننده پپتید مهارگر کاسپاز نسبت به کیسههای کنترل که فاقد داروی مهارگر بودند، به طور معناداری میزان بقای بالاتری را نشان دادند(05/0 p<).
نتیجه گیری
تزریق پپتید مهارگر کاسپاز 3 در زمان مناسب از ذخیره پلاکتی و در دوز مناسب میتواند باعث کاهش فرآیند آپوپتوز و افزایش بقا در پلاکتهای ذخیره شده به مدت 7 روز شود.
کلمات کلیدی: پلاکتها، کاسپاز 3، مهارگرهای کاسپاز
تاریخ دریافت : 28/5/91
تاریخ پذیرش : 23/5/92
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسؤول: PhD ایمنیشناسی پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- PhD ایمونوهماتولوژی بالینی ـ دانشیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای مادرزادی خونی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
5- متخصص آسیبشناسی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
رضا شیری1، فاطمه یاری2، ناصر امیریزاده3، احمد قرهباغیان4، مینو احمدینژاد5، محمدرضا طباطبایی6
چکیده
سابقه و هدف
زمان نگهداری فرآورده کنسانتره پلاکتی به 5-3 روز محدود میشود. یکی ازعلل آن، پدیده آسیبهای زمان ذخیره(storage lesion)، آسیب به سلولهای پلاکتی و نهایتاً آپوپتوز است که در طول مدت نگهداری در این سلولها القا میشود. مطالعهها نشان داده است که آپوپتوز در بعضی سلولهای بدون هسته و از جمله پلاکتها نیز رخ میدهد. در این مطالعه، به کارگیری مهارگرآنزیم کاسپاز3 در زمان ذخیره پلاکت کنسانتره در دستیابی به پلاکتی با طول عمر بیشتر مورد ارزیابی قرار گرفت .
مواد و روشها
مطالعه انجام شده از نوع بنیادی ـ کاربردی بود. بعد از تهیه و آماده کردن نمونههای پلاکتی، پپتید مهارگر کاسپاز3 به کیسههای کنسانتره پلاکتی تزریق شد. این کیسه ها به همراه کیسههای کنترل که فاقد مهارگر بودند، به مدت 7 روز در شیکر انکوباتور 22 درجه سانتیگراد نگهداری شدند. در طول مدت نگهداری از کیسه های اصلی و کنترل نمونهبرداری شده، فعالیت کاسپازی وبقای پلاکتها در آنها ارزیابی شد.
یافتهها
در پلاکتهای دریافتکننده پپتید مهارگر، کاهش معنادار فعالیت کاسپازی در مقایسه با گروه کنترل ملاحظه شد(05/0 p<). از طرفی مطالعه نشان داد در حالی که میزان بقای سلولهای پلاکتی در طول مدت نگهداری آنها با گذشت زمان کاهش مییابد، کیسههای دریافتکننده پپتید مهارگر کاسپاز نسبت به کیسههای کنترل که فاقد داروی مهارگر بودند، به طور معناداری میزان بقای بالاتری را نشان دادند(05/0 p<).
نتیجه گیری
تزریق پپتید مهارگر کاسپاز 3 در زمان مناسب از ذخیره پلاکتی و در دوز مناسب میتواند باعث کاهش فرآیند آپوپتوز و افزایش بقا در پلاکتهای ذخیره شده به مدت 7 روز شود.
کلمات کلیدی: پلاکتها، کاسپاز 3، مهارگرهای کاسپاز
تاریخ دریافت : 28/5/91
تاریخ پذیرش : 23/5/92
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسؤول: PhD ایمنیشناسی پزشکی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- PhD ایمونوهماتولوژی بالینی ـ دانشیار دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ مرکز تحقیقات بیماریهای مادرزادی خونی کودکان دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
5- متخصص آسیبشناسی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
6- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
با این که آپوپتوز در سلولهای هستهدار اتفاق میافتد، مشخص شده است که علاوه بر سلولهای هستهدار، سلولهای فاقد هسته مانند پلاکتها هم دچار فرآیند آپوپتوز میشوند. مهمترین اندامک دخیل در آپوپتوز پلاکتها، میتوکندری است. پلاکتها با وجود این که فاقد هسته و DNA درون هسته هستند، قابلیت ساخت پروتئینهای درگیر در آپوپتوز را دارا میباشند(2، 1). در پلاکتها میتوکندریها نقش مهمی در بقا و نیز تنظیم مرگ سلولی ایفا میکنند. آنها از طرفی عامل تنفس سلولی و ایجاد انرژی بوده و از طرف دیگر، در آپوپتوز سلول نقش دارند.
یونوفور کلسیم و نیز آگونیستهای فعالکننده پلاکتی مثل ترومبین، کلاژن و ترومبوکسان A2 میتوانند سبب القای آپوپتوز در پلاکتها شوند، هم چنین در پلاکتهایی که به مدت طولانی در دمای اتاق در بانک خون نگهداری میشوند، آپوپتوز رخ میدهد. نگهداری پلاکتها در دمای 37 درجه سانتیگراد در مقایسه با دمای 22 درجه سانتیگراد باعث القای آپوپتوز میشود(6-3).
با توجه به این که مدت زمان نگهداری فرآورده پلاکت در دمای 22 درجه سانتیگراد محدود به 3 الی 5 روز میباشد، لذا به منظور حفظ پایداری بیشتر پلاکت و افزایش زمان نگهداری این فرآورده، تلاشهای فراوانی در دست انجام است. طبق مطالعههای انجام شده علت محدود بودن زمان نگهداری این فرآورده آن است که در طی زمان ذخیرهسازی پلاکتها، پدیده آسیب در زمان ذخیره (storage lesion) در آنها رخ میدهد که طی آن ساختار، بیوشیمی و عملکرد پلاکتها دچار تغییر شده و در نهایت مرگ برنامهریزی شده (آپوپتوز) در آنها القا میشود(7).
کاسپازها جزو خانواده سیستئین پروتئازها هستند که نقش محوری در شروع و فاز اجرایی آپوپتوز ایفا مینمایند. به دنبال فعال شدن، این آنزیمها روی سوبستراهای خود عمل نموده و تغییرات بیوشیمیایی و مورفولوژیک در سلول آپوپتوتیک ایجاد مینمایند. بنابراین ارزیابی فعالیت آنزیمهای کاسپاز به عنوان یک شاخص بیوشیمیایـی آپـوپتوز مطرح میباشـد کـه در این بین نقش
کاسپاز 3 بسیار مهم است(9، 8).
مطالعه میزان بقای پلاکتها در حضور یا فقدان حضور یک پپتید مهارکننده کاسپاز 3 ، هدف این تحقیق میباشد. در رابطه با به کارگیری این پپتیدها در فرآورده پلاکت انسانی به صورت کنسانتره، مطالعههای محدودی وجود دارد. از جمله در مطالعهای در رابطه با پلاکت تهیه شده به روش آفرزیس، تاثیر مهارکنندههای کاسپاز در رابطه با بهینه کردن کیفیت پلاکت کنسانتره به دلیل این که در پلاکتها، فعال شدن کاسپازها یک واقعه تاخیری محسوب میشود، نفی میگردد(10). در حالی که مطالعههای دیگر در لوله آزمایش و یا در حیوانات انجام شده و اثبات کننده این تاثیر میباشند(12، 11). در پاسخ به تاثیرگذاری و یا عدم تاثیرگذاری پپتیدهای مهارگر در رابطه با حفظ بهتر کیفیت پلاکت کنسانتره، این مطالعه صورت گرفته و امید است یافتههای حاصل از این پژوهش بتواند به شناخت روشهای مناسب و کاربردی جهت ایجاد تاخیر در آپوپتوز در طول زمان ذخیره پلاکت کنسانتره کمک نماید.
مواد و روشها
در یک مطالعه بنیادی ـ کاربردی، واحدهای کنسانتره پلاکتی از اهداکنندگان خون مراجعهکننده به پایگاه انتقال خون تهران به شکل تصادفی تهیه گردید. با توجه به این که جهت تکمیل آزمایشهای غربالگری ویروسی(HIV، HCV و HBV) روی کنسانترههای پلاکتی، زمان لازم بود، لذا کنسانتره پلاکتی ۱٢ تا 24 ساعت پس از زمان خونگیری تحویل گرفته شدند.
برای تقسیم هر کیسه کنسانتره پلاکتی در سیستم بسته، لازم بود از کیسههای جمعآوری خون که حاوی 2 الی 3 کیسه اقماری و 1 کیسه حاوی ماده ضد انعقاده/نگهدارنده (CPDA) بود، استفاده شود. کیسههای اقماری دوتایی با کوردهای مناسب و استریل برای اتصال به هر کدام از کنسانترههای پلاکتی استفاده شد. اتصال کیسههای اقماری به کیسههای حاوی کنسانتره پلاکتی باید به شکل استریل و در یک سیستم بسته انجام میشد، برای نیل به این هدف، از دستگاه متصل کننده (connecting device)استفاده شد که به صورت استریل امکان اتصال کوردهای کیسه را بدون باز
کردن کیسهها فراهم مینماید.
جهت مهار آپوپتوز سلولی، از یک پپتید سنتتیک به نام Z-DEVD-FMK (بیوویژن) استفاده شد که به طور برگشتناپذیری فعالیت کاسپاز 3 را مهار میکند. به منظور تسهیل نفوذ این مهارگر به داخل سلول و مهار کاسپاز که درون سلول حضور دارند، این مهارگر حاوی متیل استراز میباشد. پس از انجام آزمایشهای مقدماتی و استفاده از غلظتهای متفاوت پپتید مهارگر کاسپاز(غلظت 8 میکرومول تا 32 میکرومول)، در نهایت غلظت 16 میکرومول آن جهت کیسههای پلاکتی انتخاب گردید. تزریق پپتید مهارگر کاسپاز 3 به کیسههای پلاکت در روز سوم ذخیره کیسه و در غلظت 16 میکرومول انجام و مجدداً کیسهها به شیکر انکوباتور 22 درجه سانتیگراد بازگردانده شدند تا در روزهای چهارم و هفتم نمونهبرداری شوند. لازم به ذکر است در مجموع 30 کنسانتره پلاکتی شامل 15 نمونه آزمایش و 15 نمونه کنترل استفاده شد.
جهت بررسی فعالیت کاسپاز 3 پلاکتی در روزهای 4 و 7 نگهداری کنسانتره پلاکتی، از کیت Caspase assay (بیوویژن) استفاده شد(13). برای انجام این آزمایش ابتدا 20 میکرولیتر از نمونهها را با 80 میکرولیتر از بافر PBS رقیق کرده، جهت لیز به آنها 100 میکرولیتر بافر Cell Lyse اضافه گردید و به مدت 30 دقیقه در دمای 4 درجه سانتیگراد قرار داده شدند. بعد از 30 دقیقه نمونهها با دور g 3300 به مدت 5 دقیقه سانتریفیوژ شدند تا لاشه پلاکتها جدا شوند. سپس عصارهرویی حاصل از این سانتریفیوژ به میکروتیوبهای دیگر منتقل شده و غلظت پروتئینی آنها در حضور نمونههای استاندارد و به روش Bradford سنجیده شد. غلظت نهایی عصاره پلاکتی برای سنجش فعالیت کاسپازی µg/mL 200 انتخاب گردید که رقیقسازی آن توسط بافر Dilution و درحجم نهایی 50 میکرولیتر انجام شد. سپس 50 میکرولیتر از بافر 2x reaction/DTT به نمونهها اضافه گردیده و در ادامه 5 میکرولیتر از سوبسترای(Ac-DEVD-pNA) acetyl-Asp-Glu-Val-Asp p-nitroanilide افزوده شد. بعد از انکوباسیون به مدت 2 ساعت در 37 درجه سانتیگراد، جذب نوری آنها در طول موج nm 405 قرائت گردید. در این آزمایش میزان فعالیت کاسپاز با سنجش میزان تجزیه سوبسترا و آزاد شدن PNA (p-nitroanilide) مشخص میشود که هر چه فعالیت آن بیشتر باشد PNA بیشتری تولید شده وجذب نوری بالاتر است.
جهت بررسی بقای سلولهای پلاکتی در کیسههای اصلی حاوی مهارگر و کیسههای کنترل، از آزمایش MTT استفاده شد. در این روش، شاخص بقای سلول، حضور میتوکندری فعال و عملکرد آنزیمهای دهیدروژناز آنها در سلول میباشد(14). برای انجام این آزمایش به 100 میکرولیتر سلول، 10 میکرولیتر از رنگ MTT اضافه کرده و ماده حاصل به مدت 4 ساعت در انکوباتور CO2 دار، انکوبه گردید. بعد از 4 ساعت به هر کدام از نمونهها، 100 میکرولیتر محلول حلکننده افزوده و بعد از 24 ساعت انکوبه در 37 درجه سانتیگراد، جذب نوری آنها با استفاده از دستگاه اسپکتروفتومتر در طول موج 575 نانومتر قرائت میشد. در این روش، میزان جذب نوری مورد انتظار در نمونههای تحت آپوپتوز کمتر میباشد. در آزمایش یاد شده رنگ زرد MTT توسط آنزیمهای میتوکندریایی سلولهای زنده شکسته شده و با تولید نمک رنگی فورمازان، میزان بقای سلولها به واسطه جذب نوری مشخص گردید. دادههای به دست آمده به وسیله آزمون Paired Samples T-Test مورد مقایسه قرار گرفت.
یافتهها
نتایج آزمایشهای سنجش فعالیت کاسپازی در نمونههای روز 4 و 7 نشاندهنده کاهش فعالیت کاسپازی در پلاکتهای دریافتکننده دارو در مقایسه با کنترل بود. در این غلظت از دارو، نتایج نشان داد که بین شرایط دریافت دارو و کنترل در روز چهارم و هفتم به ترتیب با p معادل 001 /0 و 01/0 ، اختلاف معنادار مشاهده میشود (شکل 1).
از طرف دیگر نتایج این بررسی نشان داد که میزان بقای سلولهای پلاکتی که با فعالیت متابولیکی آنزیمهای دهیدروژناز میتوکندری در سلول متناسب میباشد، در زمان نگهداری با گذشت زمان کاهش مییابد به طوری که میزان بقای پلاکتها در روز 7 در مقایسه با روز 4 پایینتر است. این در حالی است که میانگین بقا در نمونههای روز 4 و روز 7 ذخیره در دوز 16 میکرومول از دارو، نشاندهنده بقای بیشتر پلاکتها در کیسههای اصلی دریافتکننده مهارگر در مقایسه با کنترل میباشد. با توجه به p به دست آمده برای روزهای 4 و 7 که به ترتیب 001/0 و 05/0 بود، این اختلاف به نفع به کارگیری داروی مهارگر معنادار بود(جدول 1).

نمودار 1: نمایش میانگین فعالیت کاسپازی به صورت جذب نوری درکیسههای پلاکتی مربوط به روزهای 4 و 7 ذخیره به دست آمده از کیسه آزمایش(دریافتکننده پپتید مهارگر) با غلظت 16 میکرومول در روز سوم نگهداری و کیسه کنترل(بدون دریافت پپتید مهارگر). بین شرایط دریافت دارو و کنترل در روز چهارم و هفتم به ترتیب با p-value معادل 001 /0 و 01/0 اختلاف معنادار مشاهده میشود. لازم به ذکر است فعالیت کاسپازی به صورت جذب نوری در طول موج nm 405 منظور شده است.
جدول 1: میانگین نتایج OD در آزمایش MTT در نمونههای کیسه پلاکتی مربوط به روزهای 4 و 7 ذخیره به دست آمده از کیسه اصلی(دریافتکننده پپتید مهارگر با غلظت 16 میکرومول در روز سوم نگهداری) و کیسه کنترل(بدون دریافت پپتید مهارگر)
| روز نمونهگیری نمونه |
میانگین نتایج OD در آزمایش MTT در روز چهارم | میانگین نتایج OD در آزمایش MTT در روز هفتم |
| کیسه اصلی | 61/0 ± 44/2 | 8/0 ± 61/1 |
| کیسه کنترل | 70/0 ± 85/1 | 56/0 ± 09/1 |
| p-value | 001/0 | 05/0 |


نمودار 2: نمایش میانگین نتایج آزمایشMTT در نمونههای کیسه پلاکتی مربوط به روزهای 4 و 7 ذخیره به دست آمده از کیسه اصلی Test (دریافتکننده پپتید مهارگر با غلظت 16 میکرومول در روز سوم نگهداری) و کیسه کنترل(بدون دریافت پپتید مهارگر)
بحث
در پلاکتهای دریافتکننده پپتید مهارگر، کاهش معنادار فعالیت کاسپازی در مقایسه با گروه کنترل ملاحظه شد. از طرفی مطالعه نشان داد میزان بقای سلولهای پلاکتی در طول مدت نگهداری آنها در کیسههای دریافتکننده پپتید مهارگر کاسپاز نسبت به کیسههای کنترل که فاقد داروی مهارگر بودند، به طور معناداری میزان بقای بالاتری را نشان دادند.
زمان کوتاه نگهداری فرآورده پلاکت، موجب کاهش ذخیره پلاکتی شده و بانک خون را ملزم به تولید روزانه آن میکند، لذا به منظور حفظ پایداری بیشتر پلاکت و افزایش زمان نگهداری این فرآورده، تلاشهایی در دست انجام است(15).
طبق مطالعههای انجام شده با توجه به این که در طی ذخیرهسازی پلاکتها، پدیده آسیبهای زمان ذخیره در آنها رخ میدهد که طی آن مرگ برنامهریزی شده(آپوپتوز) در آنها القا میشود، چنانچه بتوان با مهار یا کاهش میزان آپوپتوز، زمان پایداری پلاکت را افزایش داد، از هدر رفتن واحدهای پلاکتی جلوگیری خواهد شد. با توجه به این امر در مطالعهای که انجام شد از مهارگر اختصاصی کاسپاز 3 استفاده شد تا بقای مطلوبتر پلاکتی با مهار آپوپتوز صورت گیرد.
حاصـل ایـن مطالعـه نشـان داد به کارگیری این داروی
مهارگـر در مقـدار مناسـب، میتوانـد سبــب مهار فعالیت
آنزیمهای کاسپاز و افزایش در میزان بقای پلاکت کنسانتره در طول زمان نگهداری شود(آزمایشها در غلظتهای 8 میکرومول دارو شروع و تا غلظت 32 میکرومول آن ادامه یافته و در نهایت غلظت 16 میکرومول به دلیل نتیجه بهتر انتخاب شد). این غلظت شبیه غلظت به کار گرفته شده توسط کهن و همکارانش است که از مهارکننده عمومی کاسپاز((Z-VAD-FMK ، با غلظت 20 میکرومول جهت پلاکت به دست آمده از خون Rat در لوله آزمایش استفاده نمودند(12). مطالعههایی صورت گرفته که نشان میدهند آپوپتوز، علاوه بر سلولهای هستهدار، در پلاکتهای فاقد هسته نیز روی میدهد(20-16). به عنوان مثال در مطالعههای اولیه در سال 1999، شربینا نقش کاسپازها را در پلاکتها بیان نمود(8). در زمینه روشهای مؤثر در مهار آپوپتوز در پلاکتها، استفاده از پپتید مهارگر کاسپاز، در مطالعههای معدودی صورت گرفته که غالباً در ارتباط با فرآورده کنسانتره پلاکتی نبودهاند.
پیگوئت و همکارانش در مطالعهای که در سال 2002 انجام دادند، نشان دادند که استفاده از نوع دیگری از مهارگر کاسپاز به نام Z-VAD-FMKمیتواند سبب کاهش فعالسازی کاسپاز در پلاکتها در یک مدل حیوانی مبتلا به مالاریا شود(11). هر چند مطالعه ما در شرایط in vitro و در کیسههای کنسانتره پلاکتی صورت گرفت، ولی نتایجی مشابه با نتایج پیگوئت نشان داد به طوری که در هر دو، استفاده از پپتید مهارگر با کاهش فعال شدن آنزیمهای کاسپاز در پلاکتها همراه بود.
در مطالعهای که در سال 2004 توسط کوهن و همکارانش انجام شد، از مهارکننده عمومی کاسپازZ-VAD-FMK، با غلظت 20 میکرومول جهت پلاکت به دست آمده از خون Rat در لوله آزمایش استفاده شد. نتیجه نشان داد در پلاکتهایی که به مدت 45 دقیقه با Z-VAD-FMK مواجه شدهاند، میزان بیان فسفاتیدیل سرین به طور مشهود
کاهش پیدا میکند(12). این مطالعه علیرغم بررسی اندکسهای متفاوت، با کار ما ایده مشابه داشته و نقش یک پپتید مهارگر فعالیت کاسپازی را بر روی پلاکت بررسی مینماید. مطالعه کوهن هر چند مواجهه کوتاه مدت با پپتید مهارگر را در لوله آزمایش بررسی مینماید در مقایسه با مطالعه حاضر که در طول 7 روز نگهداری پلاکت کنسانتره انجام شده است، میتواند بیانگر تاثیرگذاری سریع داروی استفاده شده در زمان کوتاه پس از افزودن آن باشد.
در سال 2008، کوهن و همکاران در حیوان رت مبتلا به دیابت نوع II نشان دادند که استفاده از Z-VAD-FMK که یک مهارگر عمومی کاسپازها میباشد، میتواند در فعالیت پلاکتها و بیان فسفاتیدیل سرین بر سطح آنها تاثیر گذارد(21). لازم به ذکر است تظاهر فسفاتیدیل سرین در لایه خارجیتر غشای پلاسمایی، علاوه بر این که میتواند تا حدودی مبین فعالیت آپوپتوزی در پلاکتها باشد، بلکه مرتبط با فعالیت پلاکتی و شرایط متابولیکی آنها نیز میباشد(22).
نتیجهگیری
با توجه به یافتهها و دادههای به دست آمده از این تحقیق و نیز استناد بر یافتههای سایر مطالعهها، میتوان نتیجه گرفت که اگر مهارگر کاسپاز 3 در زمان مناسب از ذخیره پلاکت کنسانتره و در غلظت مناسب به کیسه پلاکت تزریق شود، میتواند در میزان فعالیت میتوکندریایی و بقای پلاکت کنسانتره تاثیر مثبت داشته باشد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد هماتولوژی مصوب مرکز تحقیقات مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدین وسیله نویسندگان مراتب تشکر و قدردانی خود را به خاطر حمایت مالی و معنوی مؤسسه ابراز میدارند.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





