جلد 11، شماره 4 - ( زمستان 1393 )
جلد 11 شماره 4 صفحات 305-295 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Heydari-keshel S, Rezaei Taviranii M, Ai J, Soleimani M, Ghanbari Z, Baradaran-Rafii A. Isolation and characterization of endometrial mesenchymal stem cells and the evaluation of surface markers in comparison to bone marrow mesenchymal stem cells. bloodj 2015; 11 (4) :295-305
URL: http://bloodjournal.ir/article-1-804-fa.html
URL: http://bloodjournal.ir/article-1-804-fa.html
حیدری کشل سعید، رضایی طاویرانی مصطفی، آی جعفر، سلیمانی مسعود، قنبری زینت، برادران رفیعی علیرضا. جداسازی سلولهای بنیادی مزانشیمال بافت اندومتریال و بررسی بیان مارکرهای اختصاصی سلولهای بنیادی در قیاس با سلولهای بنیادی مزانشیمی مغز استخوان. فصلنامه پژوهشی خون. 1393; 11 (4) :295-305
سعید حیدری کشل* 
 ، مصطفی رضایی طاویرانی
، مصطفی رضایی طاویرانی 
 ، جعفر آی
، جعفر آی 
 ، مسعود سلیمانی
، مسعود سلیمانی 
 ، زینت قنبری
، زینت قنبری 
 ، علیرضا برادران رفیعی
، علیرضا برادران رفیعی 


 ، مصطفی رضایی طاویرانی
، مصطفی رضایی طاویرانی 
 ، جعفر آی
، جعفر آی 
 ، مسعود سلیمانی
، مسعود سلیمانی 
 ، زینت قنبری
، زینت قنبری 
 ، علیرضا برادران رفیعی
، علیرضا برادران رفیعی 

تهران ـ ایران
متن کامل [PDF 407 kb]
(3365 دریافت)
| چکیده (HTML) (8317 مشاهده)
مقدمه
سلولهای بنیادی انسانی در بالغین، از بافتهای مختلفی جداسازی شدهاند. به طور کلی پتانسیل تمایزی آنها ممکن است، منعکس کننده محیط طبیعی آنها باشد. آنها فاقد خصوصیات اختصاصی بافت هستند، اما تحت تاثیر سیگنالهای مناسب میتوانند به سلولهای تخصص یافته با فنوتیپی متمایز از پیشساز اولیه، تمایز یابند. این امکان وجود دارد که سلولهای بنیادی در بافتهای بالغین به صورت سلولهای جبرانکننده، ذخیره شوند تا در صورت نیاز، مهاجرت نموده و در پاسخ به سیگنالهای زخم یا شرایط بیماری تمایز پیدا کنند(1). در حال حاضر اطلاعات اندکی در مورد بیولوژی جمعیت سلولهای بنیادی درونزاد در بالغین و نقش دقیقشان در ترمیم بافتی، در دسترس است(2). این ممکن است به علت فقدان مارکرهای مفید ویژه سلول بنیادی باشد. پیشرفتهای اخیر در جداسازی و تعیین خصوصیات این سلولها به توسعه و تکمیل روشهای درمانی، منجر شده است(3، 2). سلولهای بنیادی مزانشیمی(MSCs) در بخش استرومای مغز استخوان ساکن هستند و اولین بار در مطالعههای فرید انشاین و پتراکوا در سال 1996 شناسایی شدند که از سلولهای پیشساز ایجادکننده مغز استخوان موش صحرایی(Rat) جدا شده بودند(5، 4). آنها ظرفیت تمایزی برای رده سلولهای بافت پیوندی شامل استخوان، چربی، غضروف و عضله را دارا میباشند. علاوه بر این، آنها در سیستم حمایتی استرومال از سلولهای بنیادی خونساز در مغز استخوان نقش دارند(7، 6). سلولهای بنیادی مزانشیمی(MSCs)، بخش بسیار کوچکی(01/0- 001/0 درصد) از کل جمعیت سلولهای هستهدار مغز استخوان را در بر میگیرند. با این وجود آنها را میتوان با کارایی بالا جداسازی و تکثیر نموده و به ردههای مختلف تحت شرایط معین محیط کشت، تمایز داد. مطالعههای آزمایشگاهی و بالینی نشان دادند که MSCs ارزش درمانی دارند، همچنان که آزمایشهای درمانی این سلولها به خوبی در حال پیشرفت است، هنوز سؤالات زیادی در رابطه با نقش جمعیت سلولهای بنیادی درونزاد در بالغین و عملکرد نیچهها وجود دارد (9، 8). با مرور دادههای ارایه شده در مقالات فوقالذکر میتوان دریافت که چندین جمعیت سلولی با ویژگیهای سلولهای پیشساز میتواند وجود داشته باشد(10). از آن جایی که در بافت اندومتر، بازسازی با قدرت بسیار بالا و به طور مداوم طی دوره مشخصی در حال انجام میباشد، به نظر میرسد که تمامی جمعیتهای پیشساز، از یک جد واحد منشا گرفتهاند(11). به نظر میرسد جد این سلولها از قابلیتهای بسیار بالایی در ترمیم و بازسازی برخوردار هستند(12). از آن جا که اطلاعات در مورد سلولهای بنیادی مزانشیمال مغز استخوان زیاد است، با مقایسه سلولهای بنیادی اندومتر با سلولهای بنیادی مغز استخوان میتوان با بررسی وجود یا عدم وجود یک سری از مارکرهای سطحی و ارتباطات موجود میان آنها، به شبکه عملکردی پروتئینی موجود در این سلولها پی برده و با شناسنامه مولکولی (Molecular signature) آنها بیشتر آشنا شد(14، 13). در مطالعه حاضر سلولهای بنیادی اندومتر از بافت طبیعی جداسازی و بیان مارکر های سطحی آنها با سلولهای بنیادی مغز استخوان مقایسه شد و ارزش بیان مارکر CD146 در این سلولها مورد تاکید قرار گرفت.
مواد و روشها
جداسازی سلولهای بنیادی اندومتریال:
مطالعه انجام شده از نوع تجربی بود و دریافت نمونهها با اخذ رضایتنامه و ارایه توضیحات به فرد اهداکننده صورت پذیرفت. بیوپسی از زنان بیمار در رده سنی 40-23 سال، که به علت مشکلات ناباروری به درمانگاه نازایی مرکز تحقیقات بهداشت باروری ولیعصر مراجعه کرده بودند، به کمک وسیله نمونهبرداری از رحم صورت گرفت. این بیماران در روزهای 24-19 سیکل قاعدگی بوده و بیمارانی هستند که هیچ گونه مشکل اندومتریوز و فیبروم و ...نداشته، فاقد IUD بوده و در سه ماه قبل از نمونهبرداری، از داروهای هورمونی استفاده نکرده بودند. این بیماران در روزهای 24-19 سیکل قاعدگی به روش سرپایی توسط کورت نواک یا Pipper device تحت بیوپسی اندومتر قرار گرفتند. طی این بیوپسی قطعاتی از اندومتر به صورت full
جدول 1: اطلاعات مربوط به افراد تحت بررسی جهت دریافت نمونه بافت اندومتر سالم در بیمارستان امام خمینی و اهداکنندگان مغز استخوان در بیمارستان طالقانی
thickness بـه دسـت آمـد. بـافت بیوپسـی پس از جدا شدن، در بافر هنکس (Hanks) قرار گرفت و به آزمایشگاه کشت سلول منتقل شد و سپس با بافر Hanks حاوی آنتیبیوتیک(پنیسیلین، آمفوتریپسین، استرپتومایسین) شستشو داده شد. از آنزیم پروتئولیتیک کلاژناز I برای هضم بافت استفاده شد. به منظور جداسازی گلبولهای قرمز از سلولهای بنیادی اندومتریال از فایکول استفاده شد و به مدت 20 دقیقه سانتریفوژ شد. سپس در فلاسک 25 حاوی محیط DMEM و 10%FBS در انکوباتور با دمای 37 درجه سانتیگراد ، 5% CO2 و 95% رطوبت کشت داده شد. تعویض محیط کشت هر 2 روز یک بار صورت پذیرفت(جدول 1).
جداسازی سلولهای بنیادی مزانشیمی و کشت آنها:
سلولهای تک هستهای از نمونه مغز استخوان به روش انتقال بر روی فایکول و سانتریفوژ از گلبولهای قرمز جدا شده و به صورت سوسپانسیون به یک فلاسک 2cm 25 که حاوی محیط DMEM و 10% سرم جنین گاوی(FBS)، µM 10 دگزامتازون و U/mL 1000 پنیسیلین و mg 1/0 استرپتومایسین میباشد، منتقل و در انکوباتور CO2 5% و دمای 37 درجه سانتیگراد و رطوبت 98% قرار داده شد(1). بعد از گذشت 3 روز محیط رویی را دور ریخته و محیط تازه اضافه گردید. سلولهای بنیادی مزانشیمی به کف فلاسک چسبیده و تکثیر خواهند شد، بدین ترتیب خالص و جداسازی میشوند.
برداشت سلولهای بنیادی مزانشیمی از فلاسک:
از آن جایی که سلولهای بنیادی مزانشیمی چسبنده هستند و به کف فلاسک میچسبند، برای جداسازی آنها از کف فلاسک، ابتدا بایستی محیط کشت را به طور کامل برداشته و با استفاده از محلول PBS حاوی EDTA آن را شستشو داد، سپس آنزیم 25/0% تریپسین حاوی EDTA به فلاسک اضافه نموده و به مدت 2 دقیقه در انکوباتور قرار داده شود. بعد از آن محیط کشت DMEM حاوی 10% FBS را به آن افزوده و برای کشت به یک فلاسک 2cm 75 منتقل میگردد.
تعیین درصد زنده بودن سلولها:(Viability test)
50 میکرولیتـر از سـوسپانسیـون سلولی را با 50 میکرولیتر رنگ تریپانبلو(4/0%) مخلوط کرده پس از 5 دقیقه، مقدار 20 میکرولیتر از این مخلوط را برداشته و با استفاده از لام نئوبار در خانههای مربوط به شمارش گلبول سفید، شمارش شدند. رنگ تریبانبلو در سلولهای مرده نفوذ کرده و آنها را آبی رنگ میکند اما سلولهای زنده رنگ نمیگیرند و بیرنگ میباشند. به این ترتیب درصد زنده بودن سلولها به دست میآید.
آنالیز فلوسایتومتری برای سلولهای بنیادی اندومتر و مغز استخوان:
ابتدا سلولهای بنیادی مزانشیمی چسبنده آندومتر را تریپسینه کرده و مورد شمارش قرار دادیم. در هر لوله تعداد 105 تا 106 سلول قرار داده و به مدت 1 ساعت درون انکوباتور و روی شیکر گذاشتیم و سپس سلولها در دور rpm1000 به مدت 6 دقیقه سانتریفوژ شدند. به رسوب سلولی حاصله، سرم انسانی 3% اضافه نموده و مخلوط حاصل را 30 دقیقه در دمای اتاق قرار دادیم. سپس در دور rpm1000 و به مدت 6 دقیقه دوباره سلولها را سانتریفوژ نموده، به رسوب سلولی حاصل PBS اضافه گردید، مخلوط سلولی را از فیلتر عبور داده، به هر لوله مقدار 100 میکرولیتر از آن اضافه شد. تعداد 106-105 سلول را در µL 100 از PBS به همراه آنتیبادیهای Anti-CD34 ، Anti-CD45 ، Anti-CD90 ، Anti-CD105 و CD133 و به مدت 45 دقیقه در 4 درجه سانتیگراد به دور از نور نگهداری کرده، پس از شستشو، سلولها را در µL 100 محلول 1% پارافرم آلدهید قرار دادیم. سپس آنالیز فلوسایتومتری، روی آن انجام گردید. ﺑﺎ دﺳﺘﮕﺎه ﻓﻠﻮﺳـﺎﻳﺘﻮﻣﺘﺮی(بکتون ـ دیکنسون) و ﻧﺮماﻓﺰار WinMDI بررسی ﺷﺪﻧﺪ. آﻧﺎﻟﻴﺰ آﻣـﺎری آﻧﺘﻲژنﻫﺎی ﺳﻄﺢ ﺳﻠﻮل ﺑﺎ اﺳﺘﻔﺎده از ﻧﺮماﻓﺰار ﺗﺤﻠﻴﻞ دادهﻫـﺎی آﻣـﺎری SPSS وﻳﺮاﺳﺖ 13، آزمون t - test و به صورت میانگین ± انحراف معیار بررسی گردید. رﺳﻢ ﻧﻤﻮدارﻫﺎ در ﻧﺮماﻓﺰارMicrosoft office 2007Excel اﻧﺠﺎمﮔﺮﻓﺖ. ﻣﻘـﺎدﻳﺮ 001/0 p< ﻣﻌﻨادار در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﺷﺪ.
آنالیز کاریوتایپ برای سلولهای بنیادی اندومتر :
ابتدا سلولها را برای مدت 4-3 ساعت با µg/mL 1/0 کولسمید درون انکوباتور قرار داده سپس سلولها را تریپسینه کرده و M075/0 محلول KCl را به سلولها اضافه نمودیم و به مدت 20 دقیقه در دمای 37 درجه سانتیگراد و 5% CO2 درون انکوباتور قرار داده شد. در مرحله بعد، متانول و اسید استیک به نسبت 3 به 1 جهت فیکس کردن نمونهها اضافه شد سپس سلولها را از ارتفاعی بر سطح لام گسترانیده و کروموزومها مورد آنالیز کاریوتیپ قرار گرفتند.
تمایز سلولهای بنیادی اندومتریال به چربی و استخوان:
به منظور اثبات ماهیت مزانشیمی، سلولها به دودمان مزانشیمی تمایز داده شدند. ﻣﺤـﻴﻂ ﺗﻤـﺎﻳﺰ ﺑـﻪ اﺳـﺘﺨﻮان ﺷـﺎﻣﻞ DMEM ﻣﺤﺘﻮی 50 ﻣﻴﻜﺮوﮔﺮم در ﻣﻴﻠـﻲﻟﻴﺘـﺮ اﺳـﻜﻮرﺑﻴﻚ اﺳـﻴﺪ ﺳـﻪ ﻓـﺴﻔﺎت(آمریکا، سیگما)، 10 ﻧــﺎﻧﻮﻣﻮﻻر دﮔﺰاﻣﺘــﺎزون, (آمریکا، سیگما)، 10 ﻣﻴﻠﻲﻣﻮﻻرﺑﺘﺎ-ﮔﻠﻴﺴﺮول ﻓﺴﻔﺎت(آمریکا، سیگما) و ﻣﺤﻴﻂ ﭼﺮﺑﻲ ﺷﺎﻣﻞ DMEM ﺣــﺎوی 50 ﻣﻴﻜﺮوﮔـﺮم در ﻣﻴﻠـﻲﻟﻴﺘـﺮ اﺳـﻜﻮرﺑﻴﻚ -3 ﻓـﺴﻔﺎت(آمریکا، سیگما)، 50 ﻧــﺎﻧﻮﻣﻮﻻر دﮔﺰاﻣﺘــﺎزون(آمریکا، سیگما) و 100 ﻣﻴﻜﺮوﮔﺮم در ﻣﻴﻠﻲﻟﻴﺘﺮ اﻳﻨﺪوﻣﺘﺎﺳﻴﻦ(آمریکا، سیگما) ﺑﻮد.
ارزﻳﺎﺑﻲ ﺗﻤﺎﻳﺰ:
در ﭘﺎﻳﺎن ﻫﻔﺘﻪ ﺳﻮم، ﺗﻤﺎﻳﺰ ﺳﻠﻮلﻫﺎ ﻣﻮرد ارزیابی ﻗـﺮار ﮔﺮﻓـﺖ. ﺑـﺮای استئوبلاست از رﻧﮓآﻣﻴﺰی آﻟﻴﺰارﻳﻦ رد و ﺑﺮای آدیپوسیت از رﻧﮓآﻣﻴﺰی اوﻳﻞ رد اﺳﺘﻔﺎده ﺷﺪ.
رﻧﮓآﻣﻴﺰی آﻟﻴﺰارﻳﻦ رد:
ﺗﻚ ﻻﻳﻪ ﺳﻠﻮﻟﻲ ﺑﺎ PBS ﺷﺴﺘﻪ و به مدت 10 دﻗﻴﻘﻪ ﺑﺎ ﻣﺘﺎﻧﻮل(مِرک ـ آلمان) ﻓﻴﻜﺲ ﺷﺪ و ﺳﭙﺲ رﻧــﮓآﻣﻴــﺰی ﺑــﺎ ﻣﺤﻠــﻮل رﻧﮕــﻲ(1% آﻟﻴــﺰارﻳﻦ رد درآب آﻣﻮﻧﻴــﺎﻛﻲ 25%)(آمریکا، سیگما) ﺑﻪ ﻣﺪت دو دﻗﻴﻘﻪ اﻧﺠﺎم ﺷﺪ. در اداﻣﻪ ﺳﻠﻮلﻫﺎ ﺑﺎ آب ﻣﻘﻄﺮ ﺷﺴﺘﻪ و ﭘﺲ از ﺧﺸﻚ ﺷﺪن ﺑﺎ ﻣﻴﻜﺮوﺳﻜﻮپ ﻣﺸﺎﻫﺪه ﺷـﺪند.
رﻧﮓآﻣﻴﺰی اوﻳﻞ رد:
ﺳﻠﻮلﻫﺎ ﺑﻪ ﻣﺪت ﻳـﻚ ﺳـﺎﻋﺖ در دﻣـﺎی اﺗـﺎق ﺑـﺎ ﻓﺮﻣﺎﻟﻴﻦ 4% ﻓﻴﻜﺲ ﺷﺪﻧﺪ و ﺳﭙﺲ ﺑﺎ اﻟﻜﻞ 70% ﺷﺴﺘﻪ و ﺑـﻪ ﻣـﺪت 15دﻗﻴﻘﻪ در ﻣﺤﻠـﻮل اﻳﺰوﭘﺮوﭘﺎﻧـﻞ اﻟﻜـﻞ 99%، با Oil
red 5% رﻧﮓآﻣﻴﺰی ﺷﺪند و در اﻧﺘﻬﺎ ﻣﺤﻠـﻮل رﻧﮕﻲ خارج و
ﺳﻪ ﺑﺎر ﺑﺎ اﻟﻜﻞ70% ﺷﺴﺘﺸﻮ داده و ﺑﺎ ﻣﻴﻜﺮوﺳﻜﻮپ ﻣﺸﺎﻫﺪه شد.
آنالیز :RT-PCR
از سلولهای استخراج شده از بافت اندومتر و سلولهای تمایز یافته حاصل از این سلولها، استخراج RNA با استفاده از کیت کیاژن صورت گرفت. برای رفع آلودگی احتمالی DNA نیز، نمونههای استخراج شده با آنزیم DNase1 (فرمنتاز) تیمار شدند. پس از تعیین میزان RNA به وسیله دستگاه اسپکتروفتومتر، مقدار 2 میکروگرم RNA بــرای ساخت cDNA با استفاده از کیت فرمنتاز مورد استفاده قرار گرفت. در نهایت واکنش PCR با
جدول 2: آغازگرهایی که برای بررسی تمایز استئوژنز و آدیپوژنز مورد استفاده قرار گرفتند
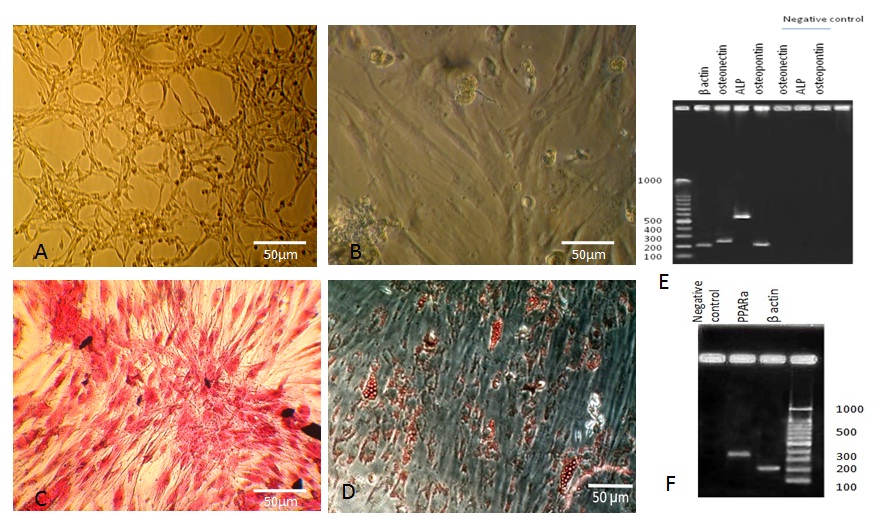
شکل شماره 1: (A) سلولهای بنیادی دوکی شکل و چسبنده بافت اندومتر نرمال را نشان میدهند که در پاساژ 3 میباشند. (B) سلولهای بنیادی مزانشیمی مغز استخوان انسان که در پاساژ 3 قرار دارند. (C) رنگآمیزی آلیزارین رد جهت بررسی توان تمایزی سلولهای بنیادی اندومتر به رده استئوبلاست. (D) رنگآمیزی اویل رد که بیانگر تمایز موفقیتآمیز به رده سلولی آدیپوسیت میباشد. (E) نتایج بیان ژنهای اختصاصی تمایزی به استئوبلاست شامل استئونکتین، استئوپوینتن، آلکالین فسفاتاز را نشان میدهد. (F) نتایج بیان ژن مربوط به بیان ژن PPARa اختصاصی سلولهای آدیپوسیت را نشان میدهد. ژن بتا اکتین به عنوان کنترل داخلی مورد استفاده قرار گرفت.
و 4/1% CD133: را شامل میشدند و این در حالی بود که در سلولهـای بنیادی مزانشیمال خون مغز استخوان، میزان بیــان مارکرهـای : 9/97% CD73 ، 5/0% CD34: ، 4/98% CD90: ، 6/98% CD105: ، 3/0% CD45: ، 13% CD146: ، 3/89% CD44: ، 9/97% ، 6/0% CD133: بود(جدول 3).
تمایز سلولهای بنیادی اندومتر به رده مزودرمی (استئوبلاست و آدیپوسیت):
در سلولهای پاساژ سوم که به مدت سه هفته در محیط استخوان ساز قرار گرفته بودند، تغییرات مورفولوژیکی تمایز به سمت سلولهای استخوانی مشاهده شد و شروع به تشکیل ماتریکس معدنی نمود، که با رنگآمیزی اختصاصی آلیزارین رد به رنگ قرمز در آمدند و ناشی از معدنـی شدن ماتریکس ترشح شده از سلولها بودند(شکل C 1).
نتایج مربوط به بیان ژنهای استئوبلاستی با روش RT-PCR نشاندهنده بیان ژنهای استئوکلسین، استئوپونتین و آلکالین فسفاتاز در سلولهای تمایز یافته به سلولهای استخوانی بعد از 21 روز تمایز بود(شکل D 1). پس از سه هفته کشت سلولهای بنیادی اندومتریال در محیط آدیپوژنیک, سلولها تغییر مورفولوژی دادند و به تدریج در آنها واکوئولهای چربی نمایان شد و رنگآمیزی اویل رد نشان داد که قطرات چربی در سیتوپلاسم سلولها تجمع یافته است (شکل E 1).
جدول 3: میزان بیان مارکرهای سطح سلول در فلوسایتومتری
همچنین نتایج مربوط به بیان ژن آدیپوسیت با روش RT-PCR نشاندهنده بیان ژن PPARa در سلولهای تمایز یافته به سلولهای چربی بعد از 21 روز تمایز بود(شکل F 1).
کاریوتایپ سلولی:
سلولهای بنیادی اندومتر، پس از جداسازی و کشت در شرایط In-vitro ، مورد بررسی نظم کروموزومی قرار گرفتند تا مشخص شود این سلولها در پی تقسیمات متوالی دچار ناهنجاریهای کروموزومی میشوند یا خیر. این آزمایش در پاساژ 15 انجام شد. نتایج نشان داد که آرایش کروموزومی 44XX در این سلولها وجود داشته و فاقد هرگونه ناهنجاری کروموزومی میباشند(شکل 2). سلولهای بنیادی مزانشیمی نیز در شرایط In-vitro دچار ناهنجاریهای کروموزومی نمیشوند( نتایج نشان داده نشده است). بنابراین در این ویژگی هر دو سلول شبیه یکدیگر میباشند. این مهم میتواند تداعیگر وجود مکانیسمهای حمایتی فعال در سلولهای بنیادی باشد.
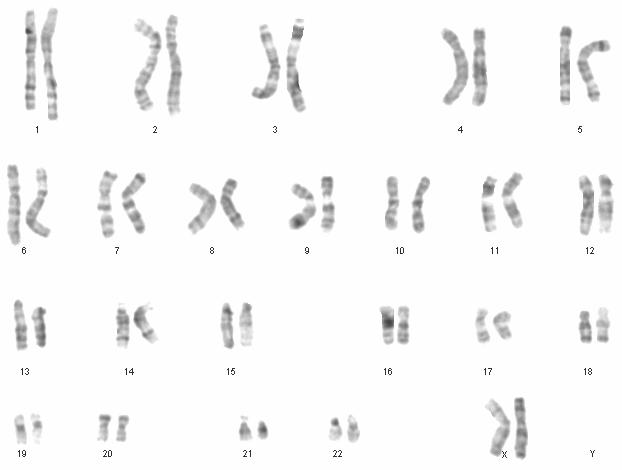
شکل 2: شمایی از نظم کروموزومی 46XX در سلولهای بنیادی اندومتر که به طور پیوسته به پاساژ 15 رسیدهاند. این سلولها علیرغم پشت سر نهادن چندین پاساژ پی در پی، نه تنها در مورفولوژی و سرعت تکثیر دچار تغییر نشدند بلکه آرایش کروموزومی نرمال نیز داشتند.
بحث
سلولهای بنیادی بالغ، سلولهــای تمایز نیافتهای هستنـد کـه در میـان سلولهای تمایز یافته در یک بافت یا
عضو وجود دارند، این سلولها میتوانند خودشان را تجدید کنند به عبارتی self - renewable هستند. همچنین میتوانند به نوع خاصی از سلولهای تخصص یافته، تمایز یابند. نقش اولیه سلولهای بنیادی بالغ در یک موجود زنده، ترمیم بافت در موارد مورد نیاز است(3). یکی از نکات مهم در مورد سلولهای بنیادی بالغ این است که تعداد آنها در هر بافتی محدود است. این سلولها در حالت عادی در ناحیه خاصی از هر بافت به صورت ساکت و آرام به حالت تقسیم نشده وجود دارند، در صورت بروز آسیب یا تخریب، این سلولها تقسیم و تمایز مییابند. در واقع نقش اصلی سلولهای بنیادی، شرکت در پدیده ترمیم و بازسازی بافت است. به دلیل محدود بودن سلولهای بنیادی در هر بافت، کشت دادن این سلولها با استفاده از روشهای بیوتکنولوژی و کسب تجربه در کشت سلول، کمک زیادی به موفقیت در دستیابی به مهندسی بافت و انواع پیوند، مینماید. یکی از اهداف مهم تحقیق پیرامون سلولهای بنیادی، یافتن منبعی قابل دسترس است (7-4). اندومتریوم بافتی است که وضعیت دینامیکی داشته و حدود 400 دوره نوزایش، تمایز و خونریزی را در طی سالهای زایا بودن یک زن متحمل میشود. فعالیتهای مداوم و منظم استروژن و پروژسترون این تغییر وضعیت را اداره میکند تا اندومتریوم پذیرای بلاستوسیست کاشته شده در یک دوره حاملگی گردد. اندومتریوم شامل یک بافت با قدرت بازسازی بالا بوده و در مجاورت میومتریوم ماهیچهای قرار گرفته است. اتصال اندومتریوم با میومتریوم به صورت نامنظم است و هیچ بافت زیر مخاطی برای جدا کردن بافت غدهای اندومتریال از بافت ماهیچهای صاف میومتریال زیر آن وجود ندارد(18-15). اندومتریوم و میومتریوم(زیراندومتریوم) هر دو از مجاری مولر در طول زندگی جنینی منشا میگیرند. در صورتی که میومتریوم خارجی منشا غیر مولرینی دارد(19). ریزش لایه فانکشنال اندومتریوم در زمان قاعدگی و بازسازی دوباره آن از لایه قاعدهای یا بازال نشان میدهد که، سلولهای بنیادی بالغ همگی در این لایه بازال قرار دارند و از آن جا که اندومتریوم حاوی غدد، اپیتلیوم سطحی و استروما میباشد، چنین گفته میشود که هر دو دسته از سلولهای بنیادی و پیشساز استرومال و اپیتلیال مسؤول بازسازی اندومتریوم میباشند(20، 19).
این امر که سلولهای بنیادی اندومتریال مسؤول بازسازی لایه اندومتر رحم در هر سیکل قاعدگی است، از سالها پیش گزارش شده است اما تلاش برای جداسازی و شناسایی خصوصیات سلولهای بنیادی اندومتریال فقط در طی چند سال اخیر، بعد از شناسایی سلولهای بنیادی و پروژنیتور سایر بافتها، طی آزمایشهایی پیگیری شده است. سلولهای بنیادی بالغ به وسیله خصوصیات عملکردی و بیان مارکرهای خود شناسایی میشوند. شواهدی برای وجود سلولهای بنیادی بالغ و سلولهای پروژنیتور در اندومتر رحم انسان و موش با بررسی سلولهای بنیادی عملکردی در بافتها و سلولهای رحمی فراهم آمده است. این مطالعههای عملکردی بر سلولهای بنیادی و پروژنیتورهای اندومتریال، زمینه را برای شناخت فیزیولوژی و پاتولوژی انواع بی نظمیهای ژنیکولوژیک همراه با تکثیر غیر طبیعی اندومتر رحم شامل سرطان اندومتر، هایپرپلازیای اندومتری، اندومتریوزیس و آدنومیوزیس و... فراهم ساخته است(21). اخیراً، سلولهای بنیادی مزانشیمی با استفاده از بیان همزمان دو مارکر اطراف عروقی CD146 و PDGFRa از اندومتریوم انسان جداسازی شده است. این سلولها، قابلیت تمایز به آدیپوسیت، میوبلاست، کندروسیت و استئوبلاست را در محیطهای تمایز مناسب، از خود نشان دادهاند(24-22). تعداد زیادی از فاکتورهای رشد اپیدرمی(EGF)، فاکتور رشد تغییر شکل دهنده α (TGFα) و فاکتور رشد مشتق شده از پلاکتها (PDGF-BB) BB ، برای رشد سلولهای اپیتلیال و رشد CFU لازم است. فاکتورهای رشد پایه فیبروبلاست(bFGF) برای سلولهای بنیادی لازم بوده ولی برای رشد سلولهای اپیتلیال لازم نیست. یک زیر جمعیت (subpopulation) ازسلولهای استرومای آندومتر انسانی با خواص سلولهای بنیادی مزانشیمی و فعالیت CFU و multilineage (چربی، ماهیچه، غضروف و استخوان) توسط بیان CD146 و گِیرنده PDGF β جدا شدهاند. همچنین جمعیتی از سلولهای بنیادی در اندومتریوم شناسایی شدهاند که پس از 68 بار مضاعف شدن، هم چنان کاریوتیپ نرمالی داشته و قادر به تمایز به بافتهای مختلفی بودهاند(24). این سلولها به راحتی قابل تکثیر بوده و از آن جایی که با یک بیوپسی ساده از اندومتر به دست میآیند و نیز مشکلات اخلاقی ندارند، میتوانند به صورت اتولوگ در درمانهای مختلف مورد استفاده قرار گیرند. علاوه بر این، سلولهای بنیادی اندمتریال توانایی تمایز به سلولهای بافتهای دیگر مانند استخوان، چربی و غضروف را از خود نشان دادهاند. بنابراین، اندومتریوم انسانی منبعی جدید برای سلولهای بنیادی در سلول درمانی به شمار میآید(25، 22).
در مطالعه حاضر، بیان مارکرهای سطحی اختصاصی سلولهای بنیادی در دو جمعیت سلول بنیادی به دست آمده از بافت اندومتر و مغز استخوان با یکدیگر مقایسه شدند. این دو سلول از نظر مورفولوژی و نیازمندیهای کشت و هم چنین توان تمایزی بسیار شبیه یکدیگر بودند. تاکنون گزارشی مبنی بر بررسی مارکرهای سطحی به شکل هم زمان و مقایسه آنها با سلولهای بنیادی مغز استخوان انجام نشده بود ولی گزارشهای پراکندهای به طور جزئی این مارکرها را مورد بررسی قرار داده بودند(26). سلول بنیادی اندومتر امروزه به عنوان یک سلول بنیادی قدرتمند برای سلول درمانی مطرح میباشد. آگاهی از الگوهای بیان و رفتارهای این سلول میتواند حدود تواناییهای آن را مشخص نموده و نحوه به کارگیری این سلولها را در سلول درمانی مشخص کند. مطالعه حاضر نشان داد که میزان بیان مارکرهای سطحی CD73 ، CD146 ، CD44 ، CD90 و CD105 در سطح قابل قبولی قرار داشته و گویای بنیادی بودن سلولهای تحت بررسی میباشد. بیان مارکر اختصاصی رده هماتوپویتیک CD45 و CD34 در هر دو منفی بود و مارکرهای(epithelial cell marker) CD105 وCD90 که هر دو جزء مارکرهای شاخص سلول بنیادی هستند نیز به شکل مشابه، بیان داشتند. بیان مارکر CD 146 وCD 44 به طور معناداری نسبت به سلول بنیادی مغز استخوان متفاوت بود(27). ارزیابی مارکرهای سطحی و پروفایل ژنی میتواند تا حدود زیادی نیچه یا ریز محیط اطراف سلولهای بنیادی اندومتر را مشخص نماید تا رفتارهای این سلول در شرایط برون تنی و درون تنی قابل پیشبینیتر باشد. طبق تحقیقات صورت گرفته مشخص شده است که بیان مارکر CD146 میتواند در سلولهای بنیادی پیشساز عروق و به عنوان مارکر اندوتلیال معرفی شوند. بیان مارکر CD146 در بافتهای نرمال و نئوپلاست قابل مقایسه میباشند. در برخی بافتها نظیر عضله صاف، اندوتلیوم، پستان، ریه، فولیکول مو، سلولهای گانگلیون، پاراتیروئید و تروفوبلاست میانی در هر دو فرم سالم و تومورال بیان مثبت دارند ولی در برخی از بافتها و سلولها نظیر میوفیبروبلاست، سلولهای شوان تنها در بافتهای نرمال دارای بیان مثبت میباشند و در بافتهای سرطانی فاقد بیان هستند. در سلولهایی نظیر ملانوسیت نیز بیان این مارکر در فرم سرطانی تنها مثبت میباشد و در فرم نرمال فاقد بیان است(28). اما مطالعههای تکمیلی، گرایش ویژه سلولها را به رده میوژنیک با بیان مارکرهای اولیه و نهایی نظیر آلفا SMA ، Smooth muscle MHC و Contractile SMC نیز نشان داد(29). البته در تحقیق صورت گرفته، فراوانی سلولهای بنیادی CD146+ را 1/3± 3/0 درصد، بیان نمودند که بر خلاف گزارش آنها(2012 گارگت) در پژوهش حاضر میزان بیان این مارکر حدوداً 60% بود که اختلاف معنادار میباشد(30). البته تغییر در بیان مارکرها، متغیر شرایط جداسازی و محیط است. سلولهای بنیادی اندومتر نرمال با توان تکثیر بالا و قابلیتهای تمایزی میتوانند در مثلث مهندسی بافت ضلع قابل اعتماد باشند(31). با توجه به این مهم که در سلول درمانی، پیوند سلولهای بنیادی اتولوگ در اولویت هستند و این سلولها نیز تنها در جنس مؤنث میباشند، بهترین گزینه برای کاربرد آنها در بیماریهای زنان و مخصوصاً در ناحیه طبیعی خود این سلولها میباشند(32). از تلفیق سلول بنیادی استرومال اندومتر و روشهای مهندسی بافت میتوان برای پیوندهای اتولوگ استفاده کرد. از جمله بیماریهای شایع که اهمیت درمانی زیادی میتواند داشته باشد، پرولاپس اعضای لگنی است(32). پرولاپس لگنی، جابهجایی یکی از اعضای لگن به سمت پایین و جلو نسبت به مکان طبیعی آن است و در واقع منظور از پرولاپس
اعضای لگنی، جابهجایی مثانه، رحم یا رکتوم است. این حالت شایع بوده و به طور پیشروندهای درصد زیادی از زنان مسن را درگیر میکند(32). اگر چه مرگ و میر مرتبط با آن قابل چشم پوشی است اما موربیدیتی قابل ملاحظهای را در زنان مبتلا، ایجاد میکند. اثرات مستقیم این حالت بر روی دستگاه ادراری، گوارشی و فعالیت جنسی، میتواند بر روی فعالیتهای روزمره زنان اثر گذاشته و آنها را دچار مشکل کند(33). راهکاری را که میتوان برای برطرف نمودن این مشکل پیشنهاد داد استفاده از سلولهای بنیادی استرومال اندومتر به همراه داربست زیست سازگار و حمایتکننده جهت افزایش استحکام رباط کاردینال میباشد که انجام مطالعههای بیشتر و تعریف فازهای کلینیکی لازم است.
نتیجهگیری
سلولهای بنیادی جداسازی شده از بافت اندومتریال، دارای جمعیت ناهمگونی از سلولها بوده و سلولهای بنیادی جداسازی شده دارای سطوح بالایی از بیان مارکر سطحی ویژه سلولهای بنیادی، خصوصاً منشاء مزودم میباشند. این سلولها میتوانند منبعی قابل دسترس برای سلولهای بنیادی باشند و در تحقیقات مربوط به سلول درمانی و مهندسی بافت مورد استفاده قرار گیرند. لازم به ذکر است تحقیقات آینده گروه تحقیقاتی سلولهای بنیادی مرکز تحقیقات پروتئومیکس بر روی پروفایل بیان ژنی مخصوصاً ژنهای مرتبط با مسیرهای پلوریپوتنسی، مهاجرت سلولی و هم چنین سلولهای بنیادی سرطانی میباشند. انجام تحقیقات وسیعتر برای آگاهی از رفتارهای سلولهای بنیادی که میتوانند در آینده کاربرد کلینیکی داشته باشند لازم و ضروری میباشد.
تشکر و قدردانی
بدینوسیله از شورای علمی مرکز تحقیقات پروتئومیکس دانشگاه علوم پزشکی شهید بهشتی و گروه سلولهای بنیادی و مهندسی بافت تشکر میشود. مقاله حاضر برگرفته از پایاننامه مقطع دکترا سعید حیدری کشل مصوب دانشگاه علوم پزشکی شهید بهشتی است.
متن کامل: (5799 مشاهده)
جداسازی سلولهای بنیادی مزانشیمال بافت اندومتریال و بررسی بیان مارکرهای
اختصاصی سلولهای بنیادی در قیاس با سلولهای بنیادی مزانشیمی
مغز استخوان
سعید حیدری کشل1، مصطفی رضایی طاویرانی2، جعفر آی3، مسعود سلیمانی4، زینب قنبری5، علیرضا برادران رفیعی6
چکیده
سابقه و هدف
سلولهای بنیادی انسانی در بالغین، فاقد خصوصیات اختصاصی بافت هستند و در سلول درمانی و مهندسی بافت از جایگاه ویژهای برخوردار میباشند. در تحقیق حاضر، سلولهای بنیادی از بافت اندومتر تخلیص و به منظور تعیین ماهیت با سلولهای بنیادی مزانشیمی مغز استخوان مورد مقایسه قرار گرفت.
مواد و روشها
در یک مطالعه تجربی 5 نمونه بافت اندومتر و آسپیره خون مغز استخوان از اهداکنندگان سالم، با کسب رضایت آگاهانه توسط متخصصین مربوطه گرفته شد. پس از جداسازی و گذشت سه پاساژ، برای مارکرهای سطحی ویژه سلول بنیادی، CD45 ، CD34 ، CD146 ، CD105 ، CD73 ، CD133 و CD90 با استفاده از روش فلوسیتومتری مورد مقایسه قرار گرفتند. آنالیز کاریوتایپ نیز برای سلولهای بنیادی اندومتر انجام پذیرفت.
یافتهها
در آنالیز فلوسیتومتری سلولهای چسبنده، میزان بیان مثبت مارکرهای بنیادی سطحی: 9/0% :CD34 ، 8/95% CD90: ، 3/98% CD105: ، 4/1% CD133 ، 84% CD44: ، 96% CD73: ، 1/1% CD45: و 3/59% CD146: را شامل میشدند و این در حالی بود که در سلولهای بنیادی مزانشیمال خون مغز استخوان، میزان بیان مارکرهای 3/0% CD45: ، 13% CD146: ، 3/89% CD44: ، 9/97% CD73: ، 5/0% CD34: ، 4/98% CD90: ، 6/98% CD105: و 6/0% CD133: بود. مورفولوژی سلولهای اندومتریال، شبیه سلولهای مزانشیمی و به حالت دوکی فرم بوده و دارای کاریوتایپ 46XX طبیعی بودند.
نتیجه گیری
سلولهای بنیادی جداسازی شده از بافت اندومتریال، دارای جمعیت ناهمگونی از سلولها بوده و سلولهای بنیادی جداسازی شده دارای سطوح بالایی از بیان مارکر سطحی ویژه سلولهای بنیادی، خصوصاً منشاء مزودرم میباشند.
کلمات کلیدی: اندومتر، سلولهای بنیادی بالغ، فلوسیتومتری
تاریخ دریافت : 12/8/92
تاریخ پذیرش : 27/3/93
1- دانشجوی PhD پرتئومیکس کاربردی ـ مرکز تحقیقات پرتئومیکس ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسؤول: PhD بیوفیزیک ـ مرکز تحقیقات پرتئومیکس ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران ـ کدپستی: 1971653314
3- PhD بافت شناسی ـ گروه مهندسی بافت و سلول درمانی ـ دانشکده فن آوریهای نوین پزشکی ـ دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
4- PhD خونشناسی ـ دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
5- متخصص زنان و زایمان ـ دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
6- متخصص چشم ـ دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
اختصاصی سلولهای بنیادی در قیاس با سلولهای بنیادی مزانشیمی
مغز استخوان
سعید حیدری کشل1، مصطفی رضایی طاویرانی2، جعفر آی3، مسعود سلیمانی4، زینب قنبری5، علیرضا برادران رفیعی6
چکیده
سابقه و هدف
سلولهای بنیادی انسانی در بالغین، فاقد خصوصیات اختصاصی بافت هستند و در سلول درمانی و مهندسی بافت از جایگاه ویژهای برخوردار میباشند. در تحقیق حاضر، سلولهای بنیادی از بافت اندومتر تخلیص و به منظور تعیین ماهیت با سلولهای بنیادی مزانشیمی مغز استخوان مورد مقایسه قرار گرفت.
مواد و روشها
در یک مطالعه تجربی 5 نمونه بافت اندومتر و آسپیره خون مغز استخوان از اهداکنندگان سالم، با کسب رضایت آگاهانه توسط متخصصین مربوطه گرفته شد. پس از جداسازی و گذشت سه پاساژ، برای مارکرهای سطحی ویژه سلول بنیادی، CD45 ، CD34 ، CD146 ، CD105 ، CD73 ، CD133 و CD90 با استفاده از روش فلوسیتومتری مورد مقایسه قرار گرفتند. آنالیز کاریوتایپ نیز برای سلولهای بنیادی اندومتر انجام پذیرفت.
یافتهها
در آنالیز فلوسیتومتری سلولهای چسبنده، میزان بیان مثبت مارکرهای بنیادی سطحی: 9/0% :CD34 ، 8/95% CD90: ، 3/98% CD105: ، 4/1% CD133 ، 84% CD44: ، 96% CD73: ، 1/1% CD45: و 3/59% CD146: را شامل میشدند و این در حالی بود که در سلولهای بنیادی مزانشیمال خون مغز استخوان، میزان بیان مارکرهای 3/0% CD45: ، 13% CD146: ، 3/89% CD44: ، 9/97% CD73: ، 5/0% CD34: ، 4/98% CD90: ، 6/98% CD105: و 6/0% CD133: بود. مورفولوژی سلولهای اندومتریال، شبیه سلولهای مزانشیمی و به حالت دوکی فرم بوده و دارای کاریوتایپ 46XX طبیعی بودند.
نتیجه گیری
سلولهای بنیادی جداسازی شده از بافت اندومتریال، دارای جمعیت ناهمگونی از سلولها بوده و سلولهای بنیادی جداسازی شده دارای سطوح بالایی از بیان مارکر سطحی ویژه سلولهای بنیادی، خصوصاً منشاء مزودرم میباشند.
کلمات کلیدی: اندومتر، سلولهای بنیادی بالغ، فلوسیتومتری
تاریخ دریافت : 12/8/92
تاریخ پذیرش : 27/3/93
1- دانشجوی PhD پرتئومیکس کاربردی ـ مرکز تحقیقات پرتئومیکس ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
2- مؤلف مسؤول: PhD بیوفیزیک ـ مرکز تحقیقات پرتئومیکس ـ دانشکده پیراپزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران ـ کدپستی: 1971653314
3- PhD بافت شناسی ـ گروه مهندسی بافت و سلول درمانی ـ دانشکده فن آوریهای نوین پزشکی ـ دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
4- PhD خونشناسی ـ دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
5- متخصص زنان و زایمان ـ دانشگاه علوم پزشکی تهران ـ تهران ـ ایران
6- متخصص چشم ـ دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
مقدمه
سلولهای بنیادی انسانی در بالغین، از بافتهای مختلفی جداسازی شدهاند. به طور کلی پتانسیل تمایزی آنها ممکن است، منعکس کننده محیط طبیعی آنها باشد. آنها فاقد خصوصیات اختصاصی بافت هستند، اما تحت تاثیر سیگنالهای مناسب میتوانند به سلولهای تخصص یافته با فنوتیپی متمایز از پیشساز اولیه، تمایز یابند. این امکان وجود دارد که سلولهای بنیادی در بافتهای بالغین به صورت سلولهای جبرانکننده، ذخیره شوند تا در صورت نیاز، مهاجرت نموده و در پاسخ به سیگنالهای زخم یا شرایط بیماری تمایز پیدا کنند(1). در حال حاضر اطلاعات اندکی در مورد بیولوژی جمعیت سلولهای بنیادی درونزاد در بالغین و نقش دقیقشان در ترمیم بافتی، در دسترس است(2). این ممکن است به علت فقدان مارکرهای مفید ویژه سلول بنیادی باشد. پیشرفتهای اخیر در جداسازی و تعیین خصوصیات این سلولها به توسعه و تکمیل روشهای درمانی، منجر شده است(3، 2). سلولهای بنیادی مزانشیمی(MSCs) در بخش استرومای مغز استخوان ساکن هستند و اولین بار در مطالعههای فرید انشاین و پتراکوا در سال 1996 شناسایی شدند که از سلولهای پیشساز ایجادکننده مغز استخوان موش صحرایی(Rat) جدا شده بودند(5، 4). آنها ظرفیت تمایزی برای رده سلولهای بافت پیوندی شامل استخوان، چربی، غضروف و عضله را دارا میباشند. علاوه بر این، آنها در سیستم حمایتی استرومال از سلولهای بنیادی خونساز در مغز استخوان نقش دارند(7، 6). سلولهای بنیادی مزانشیمی(MSCs)، بخش بسیار کوچکی(01/0- 001/0 درصد) از کل جمعیت سلولهای هستهدار مغز استخوان را در بر میگیرند. با این وجود آنها را میتوان با کارایی بالا جداسازی و تکثیر نموده و به ردههای مختلف تحت شرایط معین محیط کشت، تمایز داد. مطالعههای آزمایشگاهی و بالینی نشان دادند که MSCs ارزش درمانی دارند، همچنان که آزمایشهای درمانی این سلولها به خوبی در حال پیشرفت است، هنوز سؤالات زیادی در رابطه با نقش جمعیت سلولهای بنیادی درونزاد در بالغین و عملکرد نیچهها وجود دارد (9، 8). با مرور دادههای ارایه شده در مقالات فوقالذکر میتوان دریافت که چندین جمعیت سلولی با ویژگیهای سلولهای پیشساز میتواند وجود داشته باشد(10). از آن جایی که در بافت اندومتر، بازسازی با قدرت بسیار بالا و به طور مداوم طی دوره مشخصی در حال انجام میباشد، به نظر میرسد که تمامی جمعیتهای پیشساز، از یک جد واحد منشا گرفتهاند(11). به نظر میرسد جد این سلولها از قابلیتهای بسیار بالایی در ترمیم و بازسازی برخوردار هستند(12). از آن جا که اطلاعات در مورد سلولهای بنیادی مزانشیمال مغز استخوان زیاد است، با مقایسه سلولهای بنیادی اندومتر با سلولهای بنیادی مغز استخوان میتوان با بررسی وجود یا عدم وجود یک سری از مارکرهای سطحی و ارتباطات موجود میان آنها، به شبکه عملکردی پروتئینی موجود در این سلولها پی برده و با شناسنامه مولکولی (Molecular signature) آنها بیشتر آشنا شد(14، 13). در مطالعه حاضر سلولهای بنیادی اندومتر از بافت طبیعی جداسازی و بیان مارکر های سطحی آنها با سلولهای بنیادی مغز استخوان مقایسه شد و ارزش بیان مارکر CD146 در این سلولها مورد تاکید قرار گرفت.
مواد و روشها
جداسازی سلولهای بنیادی اندومتریال:
مطالعه انجام شده از نوع تجربی بود و دریافت نمونهها با اخذ رضایتنامه و ارایه توضیحات به فرد اهداکننده صورت پذیرفت. بیوپسی از زنان بیمار در رده سنی 40-23 سال، که به علت مشکلات ناباروری به درمانگاه نازایی مرکز تحقیقات بهداشت باروری ولیعصر مراجعه کرده بودند، به کمک وسیله نمونهبرداری از رحم صورت گرفت. این بیماران در روزهای 24-19 سیکل قاعدگی بوده و بیمارانی هستند که هیچ گونه مشکل اندومتریوز و فیبروم و ...نداشته، فاقد IUD بوده و در سه ماه قبل از نمونهبرداری، از داروهای هورمونی استفاده نکرده بودند. این بیماران در روزهای 24-19 سیکل قاعدگی به روش سرپایی توسط کورت نواک یا Pipper device تحت بیوپسی اندومتر قرار گرفتند. طی این بیوپسی قطعاتی از اندومتر به صورت full
جدول 1: اطلاعات مربوط به افراد تحت بررسی جهت دریافت نمونه بافت اندومتر سالم در بیمارستان امام خمینی و اهداکنندگان مغز استخوان در بیمارستان طالقانی
| ویژگیهای بالینی بیماران | ||||
| نمونه سالم بافتی | مورد | جداسازی استم سل | موفقیت | سن |
| بافت اندومتریال | مورد 1 | ترشحی | موفق | 21 |
| مورد 2 | تمایز یافته | رد | 22 | |
| مورد 3 | تمایز یافته | موفق | 34 | |
| مورد 4 | ترشحی | موفق | 23 | |
| مورد 5 | تمایز یافته | موفق | 26 | |
| مغز استخوان خون | مورد 1 | نرمال | موفق | 17 |
| مورد 2 | نرمال | موفق | 20 | |
| مورد 3 | نرمال | موفق | 34 | |
| مورد 4 | نرمال | موفق | 19 | |
| مورد 5 | نرمال | موفق | 28 | |
thickness بـه دسـت آمـد. بـافت بیوپسـی پس از جدا شدن، در بافر هنکس (Hanks) قرار گرفت و به آزمایشگاه کشت سلول منتقل شد و سپس با بافر Hanks حاوی آنتیبیوتیک(پنیسیلین، آمفوتریپسین، استرپتومایسین) شستشو داده شد. از آنزیم پروتئولیتیک کلاژناز I برای هضم بافت استفاده شد. به منظور جداسازی گلبولهای قرمز از سلولهای بنیادی اندومتریال از فایکول استفاده شد و به مدت 20 دقیقه سانتریفوژ شد. سپس در فلاسک 25 حاوی محیط DMEM و 10%FBS در انکوباتور با دمای 37 درجه سانتیگراد ، 5% CO2 و 95% رطوبت کشت داده شد. تعویض محیط کشت هر 2 روز یک بار صورت پذیرفت(جدول 1).
جداسازی سلولهای بنیادی مزانشیمی و کشت آنها:
سلولهای تک هستهای از نمونه مغز استخوان به روش انتقال بر روی فایکول و سانتریفوژ از گلبولهای قرمز جدا شده و به صورت سوسپانسیون به یک فلاسک 2cm 25 که حاوی محیط DMEM و 10% سرم جنین گاوی(FBS)، µM 10 دگزامتازون و U/mL 1000 پنیسیلین و mg 1/0 استرپتومایسین میباشد، منتقل و در انکوباتور CO2 5% و دمای 37 درجه سانتیگراد و رطوبت 98% قرار داده شد(1). بعد از گذشت 3 روز محیط رویی را دور ریخته و محیط تازه اضافه گردید. سلولهای بنیادی مزانشیمی به کف فلاسک چسبیده و تکثیر خواهند شد، بدین ترتیب خالص و جداسازی میشوند.
برداشت سلولهای بنیادی مزانشیمی از فلاسک:
از آن جایی که سلولهای بنیادی مزانشیمی چسبنده هستند و به کف فلاسک میچسبند، برای جداسازی آنها از کف فلاسک، ابتدا بایستی محیط کشت را به طور کامل برداشته و با استفاده از محلول PBS حاوی EDTA آن را شستشو داد، سپس آنزیم 25/0% تریپسین حاوی EDTA به فلاسک اضافه نموده و به مدت 2 دقیقه در انکوباتور قرار داده شود. بعد از آن محیط کشت DMEM حاوی 10% FBS را به آن افزوده و برای کشت به یک فلاسک 2cm 75 منتقل میگردد.
تعیین درصد زنده بودن سلولها:(Viability test)
50 میکرولیتـر از سـوسپانسیـون سلولی را با 50 میکرولیتر رنگ تریپانبلو(4/0%) مخلوط کرده پس از 5 دقیقه، مقدار 20 میکرولیتر از این مخلوط را برداشته و با استفاده از لام نئوبار در خانههای مربوط به شمارش گلبول سفید، شمارش شدند. رنگ تریبانبلو در سلولهای مرده نفوذ کرده و آنها را آبی رنگ میکند اما سلولهای زنده رنگ نمیگیرند و بیرنگ میباشند. به این ترتیب درصد زنده بودن سلولها به دست میآید.
آنالیز فلوسایتومتری برای سلولهای بنیادی اندومتر و مغز استخوان:
ابتدا سلولهای بنیادی مزانشیمی چسبنده آندومتر را تریپسینه کرده و مورد شمارش قرار دادیم. در هر لوله تعداد 105 تا 106 سلول قرار داده و به مدت 1 ساعت درون انکوباتور و روی شیکر گذاشتیم و سپس سلولها در دور rpm1000 به مدت 6 دقیقه سانتریفوژ شدند. به رسوب سلولی حاصله، سرم انسانی 3% اضافه نموده و مخلوط حاصل را 30 دقیقه در دمای اتاق قرار دادیم. سپس در دور rpm1000 و به مدت 6 دقیقه دوباره سلولها را سانتریفوژ نموده، به رسوب سلولی حاصل PBS اضافه گردید، مخلوط سلولی را از فیلتر عبور داده، به هر لوله مقدار 100 میکرولیتر از آن اضافه شد. تعداد 106-105 سلول را در µL 100 از PBS به همراه آنتیبادیهای Anti-CD34 ، Anti-CD45 ، Anti-CD90 ، Anti-CD105 و CD133 و به مدت 45 دقیقه در 4 درجه سانتیگراد به دور از نور نگهداری کرده، پس از شستشو، سلولها را در µL 100 محلول 1% پارافرم آلدهید قرار دادیم. سپس آنالیز فلوسایتومتری، روی آن انجام گردید. ﺑﺎ دﺳﺘﮕﺎه ﻓﻠﻮﺳـﺎﻳﺘﻮﻣﺘﺮی(بکتون ـ دیکنسون) و ﻧﺮماﻓﺰار WinMDI بررسی ﺷﺪﻧﺪ. آﻧﺎﻟﻴﺰ آﻣـﺎری آﻧﺘﻲژنﻫﺎی ﺳﻄﺢ ﺳﻠﻮل ﺑﺎ اﺳﺘﻔﺎده از ﻧﺮماﻓﺰار ﺗﺤﻠﻴﻞ دادهﻫـﺎی آﻣـﺎری SPSS وﻳﺮاﺳﺖ 13، آزمون t - test و به صورت میانگین ± انحراف معیار بررسی گردید. رﺳﻢ ﻧﻤﻮدارﻫﺎ در ﻧﺮماﻓﺰارMicrosoft office 2007Excel اﻧﺠﺎمﮔﺮﻓﺖ. ﻣﻘـﺎدﻳﺮ 001/0 p< ﻣﻌﻨادار در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﺷﺪ.
آنالیز کاریوتایپ برای سلولهای بنیادی اندومتر :
ابتدا سلولها را برای مدت 4-3 ساعت با µg/mL 1/0 کولسمید درون انکوباتور قرار داده سپس سلولها را تریپسینه کرده و M075/0 محلول KCl را به سلولها اضافه نمودیم و به مدت 20 دقیقه در دمای 37 درجه سانتیگراد و 5% CO2 درون انکوباتور قرار داده شد. در مرحله بعد، متانول و اسید استیک به نسبت 3 به 1 جهت فیکس کردن نمونهها اضافه شد سپس سلولها را از ارتفاعی بر سطح لام گسترانیده و کروموزومها مورد آنالیز کاریوتیپ قرار گرفتند.
تمایز سلولهای بنیادی اندومتریال به چربی و استخوان:
به منظور اثبات ماهیت مزانشیمی، سلولها به دودمان مزانشیمی تمایز داده شدند. ﻣﺤـﻴﻂ ﺗﻤـﺎﻳﺰ ﺑـﻪ اﺳـﺘﺨﻮان ﺷـﺎﻣﻞ DMEM ﻣﺤﺘﻮی 50 ﻣﻴﻜﺮوﮔﺮم در ﻣﻴﻠـﻲﻟﻴﺘـﺮ اﺳـﻜﻮرﺑﻴﻚ اﺳـﻴﺪ ﺳـﻪ ﻓـﺴﻔﺎت(آمریکا، سیگما)، 10 ﻧــﺎﻧﻮﻣﻮﻻر دﮔﺰاﻣﺘــﺎزون, (آمریکا، سیگما)، 10 ﻣﻴﻠﻲﻣﻮﻻرﺑﺘﺎ-ﮔﻠﻴﺴﺮول ﻓﺴﻔﺎت(آمریکا، سیگما) و ﻣﺤﻴﻂ ﭼﺮﺑﻲ ﺷﺎﻣﻞ DMEM ﺣــﺎوی 50 ﻣﻴﻜﺮوﮔـﺮم در ﻣﻴﻠـﻲﻟﻴﺘـﺮ اﺳـﻜﻮرﺑﻴﻚ -3 ﻓـﺴﻔﺎت(آمریکا، سیگما)، 50 ﻧــﺎﻧﻮﻣﻮﻻر دﮔﺰاﻣﺘــﺎزون(آمریکا، سیگما) و 100 ﻣﻴﻜﺮوﮔﺮم در ﻣﻴﻠﻲﻟﻴﺘﺮ اﻳﻨﺪوﻣﺘﺎﺳﻴﻦ(آمریکا، سیگما) ﺑﻮد.
ارزﻳﺎﺑﻲ ﺗﻤﺎﻳﺰ:
در ﭘﺎﻳﺎن ﻫﻔﺘﻪ ﺳﻮم، ﺗﻤﺎﻳﺰ ﺳﻠﻮلﻫﺎ ﻣﻮرد ارزیابی ﻗـﺮار ﮔﺮﻓـﺖ. ﺑـﺮای استئوبلاست از رﻧﮓآﻣﻴﺰی آﻟﻴﺰارﻳﻦ رد و ﺑﺮای آدیپوسیت از رﻧﮓآﻣﻴﺰی اوﻳﻞ رد اﺳﺘﻔﺎده ﺷﺪ.
رﻧﮓآﻣﻴﺰی آﻟﻴﺰارﻳﻦ رد:
ﺗﻚ ﻻﻳﻪ ﺳﻠﻮﻟﻲ ﺑﺎ PBS ﺷﺴﺘﻪ و به مدت 10 دﻗﻴﻘﻪ ﺑﺎ ﻣﺘﺎﻧﻮل(مِرک ـ آلمان) ﻓﻴﻜﺲ ﺷﺪ و ﺳﭙﺲ رﻧــﮓآﻣﻴــﺰی ﺑــﺎ ﻣﺤﻠــﻮل رﻧﮕــﻲ(1% آﻟﻴــﺰارﻳﻦ رد درآب آﻣﻮﻧﻴــﺎﻛﻲ 25%)(آمریکا، سیگما) ﺑﻪ ﻣﺪت دو دﻗﻴﻘﻪ اﻧﺠﺎم ﺷﺪ. در اداﻣﻪ ﺳﻠﻮلﻫﺎ ﺑﺎ آب ﻣﻘﻄﺮ ﺷﺴﺘﻪ و ﭘﺲ از ﺧﺸﻚ ﺷﺪن ﺑﺎ ﻣﻴﻜﺮوﺳﻜﻮپ ﻣﺸﺎﻫﺪه ﺷـﺪند.
رﻧﮓآﻣﻴﺰی اوﻳﻞ رد:
ﺳﻠﻮلﻫﺎ ﺑﻪ ﻣﺪت ﻳـﻚ ﺳـﺎﻋﺖ در دﻣـﺎی اﺗـﺎق ﺑـﺎ ﻓﺮﻣﺎﻟﻴﻦ 4% ﻓﻴﻜﺲ ﺷﺪﻧﺪ و ﺳﭙﺲ ﺑﺎ اﻟﻜﻞ 70% ﺷﺴﺘﻪ و ﺑـﻪ ﻣـﺪت 15دﻗﻴﻘﻪ در ﻣﺤﻠـﻮل اﻳﺰوﭘﺮوﭘﺎﻧـﻞ اﻟﻜـﻞ 99%، با Oil
red 5% رﻧﮓآﻣﻴﺰی ﺷﺪند و در اﻧﺘﻬﺎ ﻣﺤﻠـﻮل رﻧﮕﻲ خارج و
ﺳﻪ ﺑﺎر ﺑﺎ اﻟﻜﻞ70% ﺷﺴﺘﺸﻮ داده و ﺑﺎ ﻣﻴﻜﺮوﺳﻜﻮپ ﻣﺸﺎﻫﺪه شد.
آنالیز :RT-PCR
از سلولهای استخراج شده از بافت اندومتر و سلولهای تمایز یافته حاصل از این سلولها، استخراج RNA با استفاده از کیت کیاژن صورت گرفت. برای رفع آلودگی احتمالی DNA نیز، نمونههای استخراج شده با آنزیم DNase1 (فرمنتاز) تیمار شدند. پس از تعیین میزان RNA به وسیله دستگاه اسپکتروفتومتر، مقدار 2 میکروگرم RNA بــرای ساخت cDNA با استفاده از کیت فرمنتاز مورد استفاده قرار گرفت. در نهایت واکنش PCR با
جدول 2: آغازگرهایی که برای بررسی تمایز استئوژنز و آدیپوژنز مورد استفاده قرار گرفتند
| سکانس | ژن | |
| 5′-ACCATCTTTCTGCTCACTCTG-3 | جلوبرنده | ALP |
| 5′-GTGATACCATAGATGCGTTTGTAG-3 | معکوس | |
| 5′- CAGTGATTTGCTTTTGCCTGTTTG-3 | جلوبرنده | Osteopontine |
| 5′-GGTCTCATCAGACTCATCCGAATG-3 | معکوس | |
| 5'-GGC AGT AGT GAC TCA TCC GAA GAA-3 | جلوبرنده | Osteonectin |
| 5'-GGT ACT GGT GCC GTT TAT GCC TTG -3 | معکوس | |
| 5′-ATGGTATGATGTGCAGAGTGTAG-3 | جلوبرنده | PPAR-a |
| 5′-CACACATCATGTTAATGGTGAC | معکوس | |
| 5'- TCCCTGGAGAAGAGCTACG-3` | جلوبرنده | Beta-actin |
| 5'-GTAGTTTCGTGGATGCCACA-3` | معکوس | |
واکنشهای زنجیره پلیمراز(Reverse transcriptase PCR) با دستگاه T100 ترمال سایکلر 6000 (بیوراد) انجام شد و در همه واکنشها مقدار یکسانی(2 میکرو لیتر) از cDNA ساخته شده مورد استفاده قرار گرفت.
بعد از بهینهسازی شرایط PCR ، برای هر سه ژن سریال رقت تهیه شد. سپس نمودار استاندارد و در نهایت محاسبه Efficiency انجام گرفت. حجم نهایی واکنش µL 10 بود(جدول 2). فرآیند PCR نیز بدین ترتیب انجام شد: 95 درجه سانتیگراد 1 دقیقه، 40 چرخه شامل 95 درجه سانتیگراد 40 ثانیه، دمای آنیلینگ(Annealing) به مدت 40 ثانیه و 72 درجه سانتیگراد به مدت 1 دقیقه برنامهریزی شـده و نهایتاً دمـای بسـط انتهایی 72 درجه سانتیگراد بـه
مـدت 5 دقیقـه صـورت پذیرفت. محصول نهایی PCR در ژل آگارز 2% الکتروفورز شده و با اتیدیوم بروماید مورد ارزیابی قرار گرفت.
یافتهها
مورفولوژی سلولهای بنیادی اندومتر نرمال:
از 5 نمونه بافت دریافت شده مربوط به اندومتر سالم، 4
نمونه مورد جداسازی موفقیتآمیز قرار گرفت . شکل A1
نمایی از سلولهای بنیادی اندومتر را نمایش میدهد که در آن، سلولها دوکی شکل و چسبنده میباشند. این سلولها توانستند بیش از 25 پاساژ پی در پی را پشت سر نهاده و تکثیر یابند. این سلولها برای رشد نیاز به مواد اختصاصی و همچنین بسترهای تخصصی نظیر ECM (ماتریکس خارج سلولی) نداشتند.
جداسازی سلولهای بنیادی مزانشیمی از خون مغز استخوان:
به منظور یکسانسازی نمونهها، برداشت نمونه محدود به جنس مؤنث شد. تمامی 5 نمونه آسپیره مغز استخوان با موفقیت مورد جداسازی قرار گرفتند. شکل B 1 نمایی از این سلولها را در پاساژ 3 نمایش میدهد. شباهت ظاهری بسیاری بین سلول بنیادی اندومتر و سلول بنیادی مزانشیمی خون مغز استخوان وجود دارد.
نتایج مربوط به مقایسه بیان مارکرهای سطحی سلول بنیادی مغز استخوان و سلول بنیادی اندومتر نرمال:
نتایج فلوسیتومتری، میزان بیان مارکرهای سطح سلولی در دو سلول بنیادی اندومتر و مزانشیمی مغز استخوان را نشـان میدهـد. در آنالیـز فلوسیتومتـری سلولهـای بنیادی اندومتـر، میـزان بیـان مثبـت مارکرهـای بنیـادی سطحــی: 8/95% CD90 ، 3/98% CD105: ، 3/59% CD146: ، 9/0% CD34: ، 84% CD44: ، 96% CD73: ، 1/1% CD45 :
بعد از بهینهسازی شرایط PCR ، برای هر سه ژن سریال رقت تهیه شد. سپس نمودار استاندارد و در نهایت محاسبه Efficiency انجام گرفت. حجم نهایی واکنش µL 10 بود(جدول 2). فرآیند PCR نیز بدین ترتیب انجام شد: 95 درجه سانتیگراد 1 دقیقه، 40 چرخه شامل 95 درجه سانتیگراد 40 ثانیه، دمای آنیلینگ(Annealing) به مدت 40 ثانیه و 72 درجه سانتیگراد به مدت 1 دقیقه برنامهریزی شـده و نهایتاً دمـای بسـط انتهایی 72 درجه سانتیگراد بـه
مـدت 5 دقیقـه صـورت پذیرفت. محصول نهایی PCR در ژل آگارز 2% الکتروفورز شده و با اتیدیوم بروماید مورد ارزیابی قرار گرفت.
یافتهها
مورفولوژی سلولهای بنیادی اندومتر نرمال:
از 5 نمونه بافت دریافت شده مربوط به اندومتر سالم، 4
نمونه مورد جداسازی موفقیتآمیز قرار گرفت . شکل A1
نمایی از سلولهای بنیادی اندومتر را نمایش میدهد که در آن، سلولها دوکی شکل و چسبنده میباشند. این سلولها توانستند بیش از 25 پاساژ پی در پی را پشت سر نهاده و تکثیر یابند. این سلولها برای رشد نیاز به مواد اختصاصی و همچنین بسترهای تخصصی نظیر ECM (ماتریکس خارج سلولی) نداشتند.
جداسازی سلولهای بنیادی مزانشیمی از خون مغز استخوان:
به منظور یکسانسازی نمونهها، برداشت نمونه محدود به جنس مؤنث شد. تمامی 5 نمونه آسپیره مغز استخوان با موفقیت مورد جداسازی قرار گرفتند. شکل B 1 نمایی از این سلولها را در پاساژ 3 نمایش میدهد. شباهت ظاهری بسیاری بین سلول بنیادی اندومتر و سلول بنیادی مزانشیمی خون مغز استخوان وجود دارد.
نتایج مربوط به مقایسه بیان مارکرهای سطحی سلول بنیادی مغز استخوان و سلول بنیادی اندومتر نرمال:
نتایج فلوسیتومتری، میزان بیان مارکرهای سطح سلولی در دو سلول بنیادی اندومتر و مزانشیمی مغز استخوان را نشـان میدهـد. در آنالیـز فلوسیتومتـری سلولهـای بنیادی اندومتـر، میـزان بیـان مثبـت مارکرهـای بنیـادی سطحــی: 8/95% CD90 ، 3/98% CD105: ، 3/59% CD146: ، 9/0% CD34: ، 84% CD44: ، 96% CD73: ، 1/1% CD45 :

شکل شماره 1: (A) سلولهای بنیادی دوکی شکل و چسبنده بافت اندومتر نرمال را نشان میدهند که در پاساژ 3 میباشند. (B) سلولهای بنیادی مزانشیمی مغز استخوان انسان که در پاساژ 3 قرار دارند. (C) رنگآمیزی آلیزارین رد جهت بررسی توان تمایزی سلولهای بنیادی اندومتر به رده استئوبلاست. (D) رنگآمیزی اویل رد که بیانگر تمایز موفقیتآمیز به رده سلولی آدیپوسیت میباشد. (E) نتایج بیان ژنهای اختصاصی تمایزی به استئوبلاست شامل استئونکتین، استئوپوینتن، آلکالین فسفاتاز را نشان میدهد. (F) نتایج بیان ژن مربوط به بیان ژن PPARa اختصاصی سلولهای آدیپوسیت را نشان میدهد. ژن بتا اکتین به عنوان کنترل داخلی مورد استفاده قرار گرفت.
و 4/1% CD133: را شامل میشدند و این در حالی بود که در سلولهـای بنیادی مزانشیمال خون مغز استخوان، میزان بیــان مارکرهـای : 9/97% CD73 ، 5/0% CD34: ، 4/98% CD90: ، 6/98% CD105: ، 3/0% CD45: ، 13% CD146: ، 3/89% CD44: ، 9/97% ، 6/0% CD133: بود(جدول 3).
تمایز سلولهای بنیادی اندومتر به رده مزودرمی (استئوبلاست و آدیپوسیت):
در سلولهای پاساژ سوم که به مدت سه هفته در محیط استخوان ساز قرار گرفته بودند، تغییرات مورفولوژیکی تمایز به سمت سلولهای استخوانی مشاهده شد و شروع به تشکیل ماتریکس معدنی نمود، که با رنگآمیزی اختصاصی آلیزارین رد به رنگ قرمز در آمدند و ناشی از معدنـی شدن ماتریکس ترشح شده از سلولها بودند(شکل C 1).
نتایج مربوط به بیان ژنهای استئوبلاستی با روش RT-PCR نشاندهنده بیان ژنهای استئوکلسین، استئوپونتین و آلکالین فسفاتاز در سلولهای تمایز یافته به سلولهای استخوانی بعد از 21 روز تمایز بود(شکل D 1). پس از سه هفته کشت سلولهای بنیادی اندومتریال در محیط آدیپوژنیک, سلولها تغییر مورفولوژی دادند و به تدریج در آنها واکوئولهای چربی نمایان شد و رنگآمیزی اویل رد نشان داد که قطرات چربی در سیتوپلاسم سلولها تجمع یافته است (شکل E 1).
جدول 3: میزان بیان مارکرهای سطح سلول در فلوسایتومتری
| سلول بنیادی مغز استخوان انسان | سلول بنیادی اندومتر انسان | p value |
| (3/1 ±) 4/98% CD90: | (6/1 ±) 8/95% CD90: | 001/0 < |
| (4/2 ±) 6/98% CD105: | (8/1 ±) 3/98% CD105: | 001/0 < |
| (1/3 ±) 9/97% CD73: | (6/2 ±) 96% CD73: | 001/0 < |
| (1/4 ±) 3/89% CD44: | (5/2 ±) 84% CD44: | 001/0 < |
| (8/3 ±) 13% CD146: | (1/3 ±) 3/59% CD146: | 001/0 < |
| (6/0 ±) 3/0% CD45: | (3/0 ±) 1/1% CD45: | 001/0 < |
| (01/0 ±) 5/0% CD34: | (01/0 ±) 9/0% CD34: | 001/0 < |
| (03/0 ±) 6/0% CD133: | (001/0 ±) 4/1% CD133: | 001/0 < |
کاریوتایپ سلولی:
سلولهای بنیادی اندومتر، پس از جداسازی و کشت در شرایط In-vitro ، مورد بررسی نظم کروموزومی قرار گرفتند تا مشخص شود این سلولها در پی تقسیمات متوالی دچار ناهنجاریهای کروموزومی میشوند یا خیر. این آزمایش در پاساژ 15 انجام شد. نتایج نشان داد که آرایش کروموزومی 44XX در این سلولها وجود داشته و فاقد هرگونه ناهنجاری کروموزومی میباشند(شکل 2). سلولهای بنیادی مزانشیمی نیز در شرایط In-vitro دچار ناهنجاریهای کروموزومی نمیشوند( نتایج نشان داده نشده است). بنابراین در این ویژگی هر دو سلول شبیه یکدیگر میباشند. این مهم میتواند تداعیگر وجود مکانیسمهای حمایتی فعال در سلولهای بنیادی باشد.

شکل 2: شمایی از نظم کروموزومی 46XX در سلولهای بنیادی اندومتر که به طور پیوسته به پاساژ 15 رسیدهاند. این سلولها علیرغم پشت سر نهادن چندین پاساژ پی در پی، نه تنها در مورفولوژی و سرعت تکثیر دچار تغییر نشدند بلکه آرایش کروموزومی نرمال نیز داشتند.
بحث
سلولهای بنیادی بالغ، سلولهــای تمایز نیافتهای هستنـد کـه در میـان سلولهای تمایز یافته در یک بافت یا
عضو وجود دارند، این سلولها میتوانند خودشان را تجدید کنند به عبارتی self - renewable هستند. همچنین میتوانند به نوع خاصی از سلولهای تخصص یافته، تمایز یابند. نقش اولیه سلولهای بنیادی بالغ در یک موجود زنده، ترمیم بافت در موارد مورد نیاز است(3). یکی از نکات مهم در مورد سلولهای بنیادی بالغ این است که تعداد آنها در هر بافتی محدود است. این سلولها در حالت عادی در ناحیه خاصی از هر بافت به صورت ساکت و آرام به حالت تقسیم نشده وجود دارند، در صورت بروز آسیب یا تخریب، این سلولها تقسیم و تمایز مییابند. در واقع نقش اصلی سلولهای بنیادی، شرکت در پدیده ترمیم و بازسازی بافت است. به دلیل محدود بودن سلولهای بنیادی در هر بافت، کشت دادن این سلولها با استفاده از روشهای بیوتکنولوژی و کسب تجربه در کشت سلول، کمک زیادی به موفقیت در دستیابی به مهندسی بافت و انواع پیوند، مینماید. یکی از اهداف مهم تحقیق پیرامون سلولهای بنیادی، یافتن منبعی قابل دسترس است (7-4). اندومتریوم بافتی است که وضعیت دینامیکی داشته و حدود 400 دوره نوزایش، تمایز و خونریزی را در طی سالهای زایا بودن یک زن متحمل میشود. فعالیتهای مداوم و منظم استروژن و پروژسترون این تغییر وضعیت را اداره میکند تا اندومتریوم پذیرای بلاستوسیست کاشته شده در یک دوره حاملگی گردد. اندومتریوم شامل یک بافت با قدرت بازسازی بالا بوده و در مجاورت میومتریوم ماهیچهای قرار گرفته است. اتصال اندومتریوم با میومتریوم به صورت نامنظم است و هیچ بافت زیر مخاطی برای جدا کردن بافت غدهای اندومتریال از بافت ماهیچهای صاف میومتریال زیر آن وجود ندارد(18-15). اندومتریوم و میومتریوم(زیراندومتریوم) هر دو از مجاری مولر در طول زندگی جنینی منشا میگیرند. در صورتی که میومتریوم خارجی منشا غیر مولرینی دارد(19). ریزش لایه فانکشنال اندومتریوم در زمان قاعدگی و بازسازی دوباره آن از لایه قاعدهای یا بازال نشان میدهد که، سلولهای بنیادی بالغ همگی در این لایه بازال قرار دارند و از آن جا که اندومتریوم حاوی غدد، اپیتلیوم سطحی و استروما میباشد، چنین گفته میشود که هر دو دسته از سلولهای بنیادی و پیشساز استرومال و اپیتلیال مسؤول بازسازی اندومتریوم میباشند(20، 19).
این امر که سلولهای بنیادی اندومتریال مسؤول بازسازی لایه اندومتر رحم در هر سیکل قاعدگی است، از سالها پیش گزارش شده است اما تلاش برای جداسازی و شناسایی خصوصیات سلولهای بنیادی اندومتریال فقط در طی چند سال اخیر، بعد از شناسایی سلولهای بنیادی و پروژنیتور سایر بافتها، طی آزمایشهایی پیگیری شده است. سلولهای بنیادی بالغ به وسیله خصوصیات عملکردی و بیان مارکرهای خود شناسایی میشوند. شواهدی برای وجود سلولهای بنیادی بالغ و سلولهای پروژنیتور در اندومتر رحم انسان و موش با بررسی سلولهای بنیادی عملکردی در بافتها و سلولهای رحمی فراهم آمده است. این مطالعههای عملکردی بر سلولهای بنیادی و پروژنیتورهای اندومتریال، زمینه را برای شناخت فیزیولوژی و پاتولوژی انواع بی نظمیهای ژنیکولوژیک همراه با تکثیر غیر طبیعی اندومتر رحم شامل سرطان اندومتر، هایپرپلازیای اندومتری، اندومتریوزیس و آدنومیوزیس و... فراهم ساخته است(21). اخیراً، سلولهای بنیادی مزانشیمی با استفاده از بیان همزمان دو مارکر اطراف عروقی CD146 و PDGFRa از اندومتریوم انسان جداسازی شده است. این سلولها، قابلیت تمایز به آدیپوسیت، میوبلاست، کندروسیت و استئوبلاست را در محیطهای تمایز مناسب، از خود نشان دادهاند(24-22). تعداد زیادی از فاکتورهای رشد اپیدرمی(EGF)، فاکتور رشد تغییر شکل دهنده α (TGFα) و فاکتور رشد مشتق شده از پلاکتها (PDGF-BB) BB ، برای رشد سلولهای اپیتلیال و رشد CFU لازم است. فاکتورهای رشد پایه فیبروبلاست(bFGF) برای سلولهای بنیادی لازم بوده ولی برای رشد سلولهای اپیتلیال لازم نیست. یک زیر جمعیت (subpopulation) ازسلولهای استرومای آندومتر انسانی با خواص سلولهای بنیادی مزانشیمی و فعالیت CFU و multilineage (چربی، ماهیچه، غضروف و استخوان) توسط بیان CD146 و گِیرنده PDGF β جدا شدهاند. همچنین جمعیتی از سلولهای بنیادی در اندومتریوم شناسایی شدهاند که پس از 68 بار مضاعف شدن، هم چنان کاریوتیپ نرمالی داشته و قادر به تمایز به بافتهای مختلفی بودهاند(24). این سلولها به راحتی قابل تکثیر بوده و از آن جایی که با یک بیوپسی ساده از اندومتر به دست میآیند و نیز مشکلات اخلاقی ندارند، میتوانند به صورت اتولوگ در درمانهای مختلف مورد استفاده قرار گیرند. علاوه بر این، سلولهای بنیادی اندمتریال توانایی تمایز به سلولهای بافتهای دیگر مانند استخوان، چربی و غضروف را از خود نشان دادهاند. بنابراین، اندومتریوم انسانی منبعی جدید برای سلولهای بنیادی در سلول درمانی به شمار میآید(25، 22).
در مطالعه حاضر، بیان مارکرهای سطحی اختصاصی سلولهای بنیادی در دو جمعیت سلول بنیادی به دست آمده از بافت اندومتر و مغز استخوان با یکدیگر مقایسه شدند. این دو سلول از نظر مورفولوژی و نیازمندیهای کشت و هم چنین توان تمایزی بسیار شبیه یکدیگر بودند. تاکنون گزارشی مبنی بر بررسی مارکرهای سطحی به شکل هم زمان و مقایسه آنها با سلولهای بنیادی مغز استخوان انجام نشده بود ولی گزارشهای پراکندهای به طور جزئی این مارکرها را مورد بررسی قرار داده بودند(26). سلول بنیادی اندومتر امروزه به عنوان یک سلول بنیادی قدرتمند برای سلول درمانی مطرح میباشد. آگاهی از الگوهای بیان و رفتارهای این سلول میتواند حدود تواناییهای آن را مشخص نموده و نحوه به کارگیری این سلولها را در سلول درمانی مشخص کند. مطالعه حاضر نشان داد که میزان بیان مارکرهای سطحی CD73 ، CD146 ، CD44 ، CD90 و CD105 در سطح قابل قبولی قرار داشته و گویای بنیادی بودن سلولهای تحت بررسی میباشد. بیان مارکر اختصاصی رده هماتوپویتیک CD45 و CD34 در هر دو منفی بود و مارکرهای(epithelial cell marker) CD105 وCD90 که هر دو جزء مارکرهای شاخص سلول بنیادی هستند نیز به شکل مشابه، بیان داشتند. بیان مارکر CD 146 وCD 44 به طور معناداری نسبت به سلول بنیادی مغز استخوان متفاوت بود(27). ارزیابی مارکرهای سطحی و پروفایل ژنی میتواند تا حدود زیادی نیچه یا ریز محیط اطراف سلولهای بنیادی اندومتر را مشخص نماید تا رفتارهای این سلول در شرایط برون تنی و درون تنی قابل پیشبینیتر باشد. طبق تحقیقات صورت گرفته مشخص شده است که بیان مارکر CD146 میتواند در سلولهای بنیادی پیشساز عروق و به عنوان مارکر اندوتلیال معرفی شوند. بیان مارکر CD146 در بافتهای نرمال و نئوپلاست قابل مقایسه میباشند. در برخی بافتها نظیر عضله صاف، اندوتلیوم، پستان، ریه، فولیکول مو، سلولهای گانگلیون، پاراتیروئید و تروفوبلاست میانی در هر دو فرم سالم و تومورال بیان مثبت دارند ولی در برخی از بافتها و سلولها نظیر میوفیبروبلاست، سلولهای شوان تنها در بافتهای نرمال دارای بیان مثبت میباشند و در بافتهای سرطانی فاقد بیان هستند. در سلولهایی نظیر ملانوسیت نیز بیان این مارکر در فرم سرطانی تنها مثبت میباشد و در فرم نرمال فاقد بیان است(28). اما مطالعههای تکمیلی، گرایش ویژه سلولها را به رده میوژنیک با بیان مارکرهای اولیه و نهایی نظیر آلفا SMA ، Smooth muscle MHC و Contractile SMC نیز نشان داد(29). البته در تحقیق صورت گرفته، فراوانی سلولهای بنیادی CD146+ را 1/3± 3/0 درصد، بیان نمودند که بر خلاف گزارش آنها(2012 گارگت) در پژوهش حاضر میزان بیان این مارکر حدوداً 60% بود که اختلاف معنادار میباشد(30). البته تغییر در بیان مارکرها، متغیر شرایط جداسازی و محیط است. سلولهای بنیادی اندومتر نرمال با توان تکثیر بالا و قابلیتهای تمایزی میتوانند در مثلث مهندسی بافت ضلع قابل اعتماد باشند(31). با توجه به این مهم که در سلول درمانی، پیوند سلولهای بنیادی اتولوگ در اولویت هستند و این سلولها نیز تنها در جنس مؤنث میباشند، بهترین گزینه برای کاربرد آنها در بیماریهای زنان و مخصوصاً در ناحیه طبیعی خود این سلولها میباشند(32). از تلفیق سلول بنیادی استرومال اندومتر و روشهای مهندسی بافت میتوان برای پیوندهای اتولوگ استفاده کرد. از جمله بیماریهای شایع که اهمیت درمانی زیادی میتواند داشته باشد، پرولاپس اعضای لگنی است(32). پرولاپس لگنی، جابهجایی یکی از اعضای لگن به سمت پایین و جلو نسبت به مکان طبیعی آن است و در واقع منظور از پرولاپس
اعضای لگنی، جابهجایی مثانه، رحم یا رکتوم است. این حالت شایع بوده و به طور پیشروندهای درصد زیادی از زنان مسن را درگیر میکند(32). اگر چه مرگ و میر مرتبط با آن قابل چشم پوشی است اما موربیدیتی قابل ملاحظهای را در زنان مبتلا، ایجاد میکند. اثرات مستقیم این حالت بر روی دستگاه ادراری، گوارشی و فعالیت جنسی، میتواند بر روی فعالیتهای روزمره زنان اثر گذاشته و آنها را دچار مشکل کند(33). راهکاری را که میتوان برای برطرف نمودن این مشکل پیشنهاد داد استفاده از سلولهای بنیادی استرومال اندومتر به همراه داربست زیست سازگار و حمایتکننده جهت افزایش استحکام رباط کاردینال میباشد که انجام مطالعههای بیشتر و تعریف فازهای کلینیکی لازم است.
نتیجهگیری
سلولهای بنیادی جداسازی شده از بافت اندومتریال، دارای جمعیت ناهمگونی از سلولها بوده و سلولهای بنیادی جداسازی شده دارای سطوح بالایی از بیان مارکر سطحی ویژه سلولهای بنیادی، خصوصاً منشاء مزودم میباشند. این سلولها میتوانند منبعی قابل دسترس برای سلولهای بنیادی باشند و در تحقیقات مربوط به سلول درمانی و مهندسی بافت مورد استفاده قرار گیرند. لازم به ذکر است تحقیقات آینده گروه تحقیقاتی سلولهای بنیادی مرکز تحقیقات پروتئومیکس بر روی پروفایل بیان ژنی مخصوصاً ژنهای مرتبط با مسیرهای پلوریپوتنسی، مهاجرت سلولی و هم چنین سلولهای بنیادی سرطانی میباشند. انجام تحقیقات وسیعتر برای آگاهی از رفتارهای سلولهای بنیادی که میتوانند در آینده کاربرد کلینیکی داشته باشند لازم و ضروری میباشد.
تشکر و قدردانی
بدینوسیله از شورای علمی مرکز تحقیقات پروتئومیکس دانشگاه علوم پزشکی شهید بهشتی و گروه سلولهای بنیادی و مهندسی بافت تشکر میشود. مقاله حاضر برگرفته از پایاننامه مقطع دکترا سعید حیدری کشل مصوب دانشگاه علوم پزشکی شهید بهشتی است.
نوع مطالعه: پژوهشي |
موضوع مقاله:
سلولهاي بنيادي
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



