جلد 10، شماره 1 - ( بهار 1392 )
جلد 10 شماره 1 صفحات 39-31 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Azad M, Kaviani S, Mortazavi Y, Norouzinia M, Soleimani M, Abroun S, et al . Evaluation of methylation pattern in the promoter regions of P15 and P16 genes and the expression status of these factors in cord blood CD34+ stem cells . bloodj 2013; 10 (1) :31-39
URL: http://bloodjournal.ir/article-1-737-fa.html
URL: http://bloodjournal.ir/article-1-737-fa.html
آزاد مهدی، کاویانی سعید، مرتضوی یوسف، نوروزینیا مهرداد، سلیمانی مسعود، آبرون سعید، و همکاران.. ارزیابی الگوی متیلاسیون در نواحی پروموتوری دو ژن P15 و P16 و وضعیت بیان این فاکتورها در سلولهای بنیادی CD34+ خون بند ناف. فصلنامه پژوهشی خون. 1392; 10 (1) :31-39
مهدی آزاد 
 ، سعید کاویانی*
، سعید کاویانی* 
 ، یوسف مرتضوی
، یوسف مرتضوی 
 ، مهرداد نوروزینیا
، مهرداد نوروزینیا 
 ، مسعود سلیمانی
، مسعود سلیمانی 
 ، سعید آبرون
، سعید آبرون 
 ، زهرا ذنوبی
، زهرا ذنوبی 
 ، امیر آتشی
، امیر آتشی 


 ، سعید کاویانی*
، سعید کاویانی* 
 ، یوسف مرتضوی
، یوسف مرتضوی 
 ، مهرداد نوروزینیا
، مهرداد نوروزینیا 
 ، مسعود سلیمانی
، مسعود سلیمانی 
 ، سعید آبرون
، سعید آبرون 
 ، زهرا ذنوبی
، زهرا ذنوبی 
 ، امیر آتشی
، امیر آتشی 

دانشیار دانشکده علوم پزشکی دانشگاه تربیت مدرس
متن کامل [PDF 523 kb]
(2566 دریافت)
| چکیده (HTML) (13793 مشاهده)
مقدمه
مطالعههای انجام شده روی مکانیسمهای شکلگیری گونههای مختلف سلولی در محیطهای آزمایشگاهی خارج از بدن، منجر به دستیابی بشر به مفاهیم پایه در ارتباط با مکانیسمهای عمومی کنترل نسخهبرداری و تنظیم بیان ژن شده است(5-1). در واقع، فرآیندهای تمایزی در سلولهای ابتدایی، شدیداً وابسته به کنترل بیان ژن و نظارت دقیق بر پیامدهی داخل سلول میباشند که مرتبط با آن، نیاز مبرم و مسجل سلول به فاکتورهای کنترلی خاص نظیر سیتوکینها، فاکتورهای نسخهبرداری ویژه، عناصر کنترلکننده چرخه سلولی، تکثیر و آپوپتوز، کاملاً موجه خواهد بود(8-6).
دو مورد از این فاکتورهای حیاتی که در گروه پروتئینهای سرکوبگر تومور دستهبندی میشوند عبارتند از مهارگر کینازهای وابسته به سایکلین نوع 2A و 2B که به ترتیب P16 و P15 نامیده میشوند. P16 ، در دسته عناصر سرکوبگر تومور و نیز عوامل کنترلکننده چرخه سلولی قرار میگیرد(9). پر رنگ شدن نقش P16 در خونسازی به یک مطالعه در سال 2003 توسط مینامی و همکارانش بر میگردد که در آن تحقیق، نشان داده شد که p16 قادر به کنترل تمایز و آپوپتوز در ردههای اریترویید میباشد(10). پروتئینهای کینازی CDK-4 و CDK-6 ، که توسط P16 مهار میشوند، قادرند پروتئینی به اسم mdm 2 را در حالت طبیعی فعال کنند. mdm 2 ، خود یک مهارگر بالقوه برای P53 میباشد و P53 نیز در واقع یکی از پروتئینهای نظارتکننده بر چرخه سلولی است. بنابراین در حضور P16 ، به صورت زنجیرهوار، P53 نیز سالم مانده و مانع از ایجاد تومور در بدن میشود(11).
ژنهای مربوط به P15 و P16 ، همجوار با یکدیگر و روی کروموزوم 9 قرار دارند و حذف آنها در اکثر تومورها با هم رخ میدهد(13-11). محصول ژن P15 نیز، یک پروتئین سرکوبگر تومور میباشد که به طور بالقوه، کمپلکس سایکلین D را با کینازهای CDK4 و CDK6 مهار کرده و به این ترتیب، چرخه سلولی را در نقطه G1 کنترل مینماید(15، 14).
این دو فاکتور، با توجه به بیـان آنها، میبایسـت نقـش
مهمی در کنترل و تغییر الگوی ژنی سلولهای بنیادی داشته باشند که از مکانیسمهای کنترلی آنها نیز میتوان اپیژنتیک را نام برد. اپیژنتیک مساله مهمی است که امروزه به عنوان یکی از مسیرهای کنترل بیان ژن معرفی شده و به تغییر در بیان ژن بدون تغییر پایه در سکوئنسینگ اطلاق میگردد(18-16).
یکی از مکانیسمهای مهم و تاثیرگذار اپیژنتیک، متیلاسیون نواحی پروموتوری ژنهاست که خاموش شدن ژنهای مورد نظر را در پی دارد(20، 19).
اپیژنتیک و مکانیسمهای آن نظیر متیلاسیون و استیلاسیون، در واقع قادرند مراحل تکثیر و تمایز را در گروهی از سلولها و بافتهای ویژه، دستکاری کنند(22، 21).
با توجه به این که الگوی متیلاسیون و وضعیت بیان P15 و P16 به عنوان فاکتورهای مؤثر در کنترل تکثیر و تمایز سلولی، در سلولهای بنیادی CD34+ جدا شده از خون بند ناف، تاکنون مشخص نشده است، در این مطالعه به این امر پرداخته و الگوی بیان ژنهای ذکر شده در سلولهای بنیادی تخلیص شده از خون بند ناف، مورد ارزیابی قرار گرفت و در مرحله دوم نیز الگوی متیلاسیون این دو فاکتور سرکوبگر تومور مورد بررسی و آزمون قرار گرفت.
مواد و روشها
جداسازی و تکثیر سلولهای بنیادین CD34+ :
در یک مطالعه تجربی، در چندین مرحله کیسههای خون بند ناف از بیمارستان صارم و سازمان انتقال خون تهران تهیه شد. در گام بعدی، سلولهای CD34+ با استفاده از کیتIndirect CD34 MicroBead شرکت میلتن بیوتک و روش جداسازی سلولی با آنتیبادی منوکلونال(MACS) و طبق دستورالعمل کیت، تخلیص شد.
سپس با استفاده از محیط Stem Span که از قبل به آن فاکتورهای رشدFlt3 ، TPO و SCF ، با غلظت نهایی ng/mL 50 اضافه شده بود، سلولهای جدا شده را یک تا دو روز تکثیر داده و در نهایت پس از شست و شو با بافر PBS ، جهت ادامه آزمونها از محیط جداسازی کردیم.
جدول 1: توالی آغازگرهای مورد استفاده در روش RT-PCR
جدول 2: مشخصات آغازگرهای مورد استفاده در روش MSP

شکل 1: میزان بیان مارکر CD34 ، بر روی سلولهای هماتوپویتیک که از خون بند ناف جدا شده است.
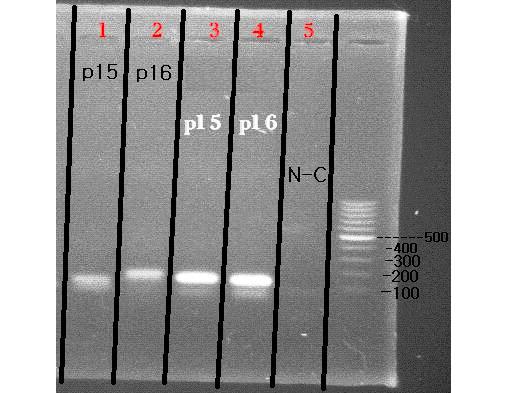
شکل 2: ژل آگاروز 5/1% است که باندهای قابل مشاهده در آن نشاندهنده محصولات واکنش PCR برای ژنهای مورد مطالعه در این تحقیق میباشد.N-C بیانگر کنترل منفی میباشد (واکنشی که در آن از نمونه cDNA، استفاده نشده است). باندهای مربوط به خانههای یک و سه مربوط به ژن P15 میباشند که در دو دمای آنیلینگ متفاوت به صورت گرادیان گذاشته شده است. باندهای مربوط به خانههای دو و چهار نیز مربوط به ژن P16 میباشند که در دو دمای آنیلینگ متفاوت به صورت گرادیان گذاشته شده است. با توجه به شکل، هر دو فاکتور مورد مطالعه در این تحقیق، در سلولهای بنیادی مورد نظر، کم و بیش بیان میشوند.
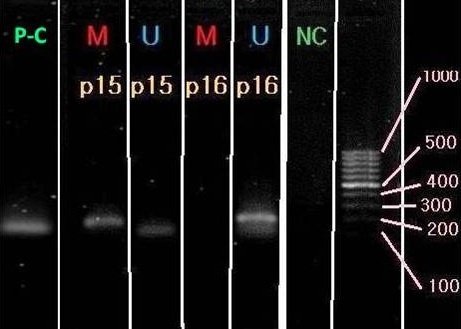
شکل 3: ژل آگاروز 5/1% که باندهای قابل مشاهده در آن نشاندهنده محصولات واکنش PCR برای حالتهای متیله یا غیر متیله ژنهای مورد مطالعه در این تحقیق است.
محدوده و به ترتیب bp104 و bp159 میباشد.
در این مرحله از تحقیق، محصولات PCR برای ثبت باند مربوط به هر ژن، روی ژل تهیه شده از پودر آگاروز بارگذاری شد. سپس ژل مورد نظر برای مشاهده باند، زیر نور UV قرار گرفت. شکل 2، که توسط دستگاه Biometra Gel Doc ثبت شده است، مشخصکننده وجود باند در همه چاهکهای ژل بوده و بیان ژنهای مربوطه را در سلولهای بنیادی مورد نظر نشان میدهد.
همانطور که ذکر شد، با آغازگرهای طراحی شده جهت استفاده در Real Time PCR و نیز cDNA سنتز شده از ژنوم سلولهای بنیادی پس از تکثیر، واکنش PCR برای هر دو ژن انجام شد. با توجه به مشروحات بالا، مشاهده باند در این مرحله در هر صورت نشاندهنده بیان ژن مورد نظر در سلول هماتوپویتیک است و با توجه به این که در همه خانههای ژل در این مرحله، باند DNA ، در همان محدوده قابل انتظار مشاهده میشود، میتوان به این نتیجه رسید که هر دو فاکتور مورد مطالعه در این تحقیق، در الگوی بیان ژنی سلولهای بنیادی CD34+ بند ناف وجود دارند.
در بخش دیگر تحقیق، DNA از سلولهای هماتوپویتیک بند ناف، پس از تخلیص و تکثیر و پردازش برای بررسی الگوی متیلاسیون، با روش MSP مورد آزمون قرار گرفت. از مشکلات مرتبط با MSP ، در واقع دشواری قابل توجه مرحله تنظیم، برای این روش است و در این مطالعه نیز مدت زمان زیادی جهت این منظور اختصاص یافت که در مدت حدود چند ماه، نتایج و تصاویر زیادی ثبت شد. اندازه باند DNA برای محصولات MSP برای ژنهای مختلف مورد مطالعه، باز هم تقریباً در یک محدوده و به طور دقیق از این قرار بود:
Methylated P16 Gene – 150 bp
Unmethylated P16 Gene – 151 bp
Methylated P15 Gene – 148 bp
Unmethylated P15 Gene – 154 bp
بر اساس یکی از بهترین و گویاترین تصاویر ثبت شده در این مرحله، میتوان نتایج را به این صورت تفسیر کرد (شکل 3):
در مورد ژن P15 با توجه به مشاهده باند در هر دو واکنش مربوط به آغازگرهای متیله و غیر متیله، یک متیلاسیون نسبی در پروموتور این ژن در این مرحله قابل پیشگویی میباشد که نشاندهنده بیان نسبی ژن است. در مورد ژن دیگر یعنی P16 ، فقط در خانههای مربوط به آغازگر غیر متیله، باند دیده میشود که بیانگر عدم متیلاسیون ژن فوق در این مرحله و بنابراین بیان آن میباشد. در شکل 3، خانههایی که با حرف M (قرمز رنگ) نشان داده شده است، مربوط به واکنشهایی است که در آنها از آغازگرهای مربوط به ژن مورد نظر در حالت متیله استفاده شده است و خانههایی که با حرف U (آبی رنگ) نشان داده شده است، مربوط به واکنشهایی است که در آنها از آغازگرهای مربوط به ژن مورد نظر در حالت غیر متیله استفاده شده است. N-C و P-C، به ترتیب بیانگر وضعیت کنترل منفی و کنترل مثبت MSP میباشند. در کنترل مثبت، از نمونه DNA استفاده میشود که از قبل، با یک آنزیم متیلاز نظیر Sss1 ، پردازش شده و از متیلاسیون آن، اطمینان خاطر وجود دارد. بنابراین در واکنش MSP ، باید مثبت شود تا صحت باندهای دیگر، مورد تایید قرار بگیرد. در وضعیت کنترل منفی نیز، از نمونه DNA پردازش نشده استفاده شد که طبیعتاً نباید محصولی نیز در MSP داشته باشد.
بحث
همانطور که شرح داده شد، اپیژنتیک، علم تغییر بیان ژن بدون تغییر در توالی نوکلئوتیدی میباشد. مکانیسمهای مختلف اپیژنتیک، به خصوص متیلاسیون، قادر است همه مراحل رشد و تمایز سلولی را تحت تاثیر قرار دهد(20-16).
بر مبنای تحقیقات فراوان بر روی مکانیسمهای تکوینی مختلف، تمایز به گروههای سلولی، در سطح بالایی وابسته به کنترل دقیق بیان ژن و عناصر متنوع پیامدهی داخل سلول نظیر فاکتورهای نسخهبرداری و سرکوبگر تومور است که دو مورد از این عناصر حد واسط عبارتند از فاکتورهای(P16 INK 4a) و (P15 INK 4b) که به ترتیب P16 و P15 نامیده میشوند. این دو فاکتور از پروتئینهای سرکوبگر تومور هستند که از نقشهای دیگر آنها مهار CDK-4 ، CDK-6 و کنترل چرخه سلولی در نقطه G1 میباشد(10-6).
سلولهای بنیادی با توجه به این که در تمام طول عمر خود دارای قدرت خود نوسازی میباشند، از سلولهای دیگر و پروژنیتورهای خود، متفاوت بوده و دارای الگوی بیان ژن به صورت مجزا و منحصر به فرد هستند. قدرت خودنوسازی سلولهای بنیادی با ظرفیت تمایزی آنها همواره در تعدیل است. الگوی بیان ژن در سلولهای اولیه عموماً مرتبط با گروهی از ژنهاست که در فرآیندهای نسخهبرداری عمومی، تنظیم سیکل سلولی و مرگ برنامهریزی شده سلول دخیل هستند. دو مورد از این ژنها، P16 و P15 هستند که در این مطالعه به بررسی آنها پرداخته شده است. در واقع مکانیسمهای تنظیم بیان ژن، الگوی بیان و جزییات دقیق آن در سلولهای هماتوپویتیک بند ناف، هنوز تا حدود زیادی ناشناخته باقی مانده است(5-3).
متیلاسیون جزایر غنی از سیتوزین و گوانین، پدیده اپیژنتیکی شایعی است که در ارتباط با بیان اکثریت پروتئینهای سرکوبگر تومور در بدن رخ میدهد و از مسیرهای اصلی تنظیم بیان، برای این ژنها محسوب میگردد. تعدادی از مسیرهای سلولی که توسط متیلاسیون، غیر فعال یا کنترل میشوند عبارتند از: تعمیر DNA آسیبدیده(hMLH1 و MGMT)، چرخه سلولی(P14 ، P15 و P16)، آپوپتوز(DAPK)، چسبندگی سلولی(CDH1-13)، سمیتزدایی(GSTP1) و ...(12). اگر چه هنوز در این رابطه، ناگفتههای زیادی باقی مانده است، این که همه ژنهای مذکور، در تنظیم فرآیندهای مختلف سلولی، چگونه ایفای نقش میکنند و این تنظیمات تا چه حد با متیلاسیون این ژنها ارتباط دارد، هنوز مجهول و ناگفته است. ولی با همه این تفاسیر، از زمانی که روشهای بررسی متیلاسیون ژنها نظیر MSP شناخته شده، به گروهی از این سؤالات نیز پاسخ داده شده است. در این مطالعه برای بررسی الگوی متیلاسیون از MSP و برای تایید نتایج آن، از بررسی بیان ژن بهره برده شده است.
در سال 1986 به این نکته اشاره شد که معمولاً متیلاسیون یک ژن در نواحی پروموتوری آن رخ میدهد و این متیلاسیون به طور دقیق مربوط به جزایر CpG (نواحی غنی از سیتوزین و گوانین) میباشد(20). در آن زمان مشخص شد که نواحی CpG ، عمدتاً در انتهای '5 قسمت غیرقابل ترجمه ژنها قرار دارد که گاهاً در اولین اگزون نیز گزارش شده است(19). از نظر تاریخچه، متیلاسیون یک ژن سرکوبگر تومور، برای اولین بار در سال 1989 و در مورد رتینوبلاستوما مطرح شد(15). در ادامه در سال 1994، هیپرمتیلاسیون ژن vHL ( فون هیپل لیندا) و غیر فعال شدن آن در بدخیمیهای انسانی گزارش شد(18). یک سال بعد یعنی در 1995، غیر فعال شدن ژن P16 ، در بدخیمیها توسط متیلاسیون نواحی پروموتوری، نشان داده شد و به این ترتیب، نقش متیلاسیون در نواحی پروموتوری ژنهای سرکوبگر تومور، به عنوان یکی از مسیرهای کنترل بیان ژن، پر رنگ شده و مورد توجه محافل علمی قرار گرفت(12). در سال 2001 نشان داده شد در بافتهایی که دارای متیلاسیون در نواحی پروموتوری هستند، فعالیت آنزیمهای متیل ترانسفراز نیز افزایش مییابد. در راستای این مطالعهها، ژنهایی معرفی شد که کدکننده آنزیمهای متیل ترانسفراز هستند(DNMT1 ، DNMT2 ، DNMT3a و DNMT3b )(20).
در ادامه مطالعههای انجام شده، متیلاسیون ژن P15 ، در اکثریت لوسمیها و متیلاسیون ژن P16 ، در طیف وسیعی از بدخیمیها نشان داده شد(11). نکته دیگری که قابل توجه و لازم به ذکر است، این است که متیلاسیون نواحی پروموتوری ژنهای P15 و P16 ، به عنوان یک مسیر تنظیم بیان ژن، نسبت به دیگر ژنهای سرکوبگر تومور، بسیار رایجتر هستند(21).
ژنهای مورد مطالعه در این تحقیق از دو جنبه مورد بررسی قرار گرفتند؛ یکی از این ابعاد، موضوع بیان ژنهای مورد نظر در سلولهای بنیادی CD34+ میباشد. موضوع دیگر روشن شدن وضعیت متیلاسیون در نواحی پروموتور همین ژنهاست که از مکانیسمهای تنظیم بیان ژن محسوب میشود. به زبان دیگر اگر یک ژن در نواحی پروموتوری خود دارای جزایر غنی از سیتوزین و گوانین(GpG) باشد، این بدین معنا است که وضعیت متیلاسیون نواحی مزبور میتواند منتهی به خاموش شدن یا روشن شدن بیان ژن مورد نظر شود(22-20). حال آن که ممکن است در برخی موارد، پروموتور ژنها به طور نسبی دچار متیلاسیون شوند که طبیعتاً تحت این شرایط، بیان نسبی ژن مربوطه، پیامد قابل انتظار شرایط فوق خواهد بود. بنابراین بیان یک ژن (Gene Expression) در الگوی سلول مد نظر در مرحله نسخهبرداری، با اصولی هم چون اپیژنتیک و متیلاسیون میتواند دارای ارتباط تنگاتنگ باشد(22-16).
در واقع همان طور که ذکر شد، نتایج MSP برای ژن P15 به صورت متیلاسیون نسبی و نتایج بررسی بیان ژن نیز برای مورد فوق مثبت است که میتوان همخوانی دادههای به دست آمده را نتیجهگیری کرد.
از طرف دیگر برای ژنهای P16 نیز، نتایج MSP بیانگر عدم متیلاسیون در این مرحله و نتایج آنالیز بیان ژن نشاندهنده وجود محصول قابل انتظار در PCR و در نهایت بیان مثبت ژنی میباشد که مجدداً همخوانی دادهها قابل مشاهده است.
نتیجهگیری
نتایج به دست آمده در مراحل مختلف مطالعه حاضر نشان میدهد که متیلاسیون نواحی پروموتوری ژنهای مورد مطالعه(P15-P16)، یکی از مسیرهای قطعی و مهم کنترل بیان فاکتورهای مورد نظر هستند. در واقع بیان هیچ کدام از فاکتورهای مورد بحث در سلولهای هماتوپویتیک منفی نمیباشد و گویای این نکته است که هر دو ژن، در متابولیسم سلولهای بنیادی CD34+ ، دارای نقش مشخص هستند. در میزان بیان فاکتورهای مورد نظر و نیز الگوی متیلاسیون در نواحی پروموتوری فاکتورهای فوق نیز، همخوانی قابل قبولی دیده میشود اگر چه وجود مغایرت در این رابطه نیز دور از انتظار نخواهد بود چرا که میتوان گفت نتایج متیلاسیون در این تحقیق با استفاده از روش MSP به دست آمده است که قادر به گزارش تفاوتهای کمی متیلاسیون نیست و به مقایسه الگوهای متیلاسیون به صورت کیفی میپردازد. ضمناً در تنظیم میزان بیان ژنها فقط یک مکانیسم ویژه ایفای نقش نمیکند و برآیند گروهی از مکانیسمهای مختلف است که سطوح بیان هر ژن را در سلول، تعیین مینماید.
تشکر و قدردانی
بدینوسیله از خانم دکتر مهین نیکوگفتار و آقای دکتر کامران عطاردی که در جمعآوری خون بند ناف به این گروه، یاری و کمک رساندند نهایت تشکر را داریم.
متن کامل: (2319 مشاهده)
ارزیابی الگوی متیلاسیون در نواحی پروموتوری دو ژن P15 و P16 و وضعیت بیان
این فاکتورها در سلولهای بنیادی CD34+ خون بند ناف
مهدی آزاد1، سعید کاویانی2، یوسف مرتضوی3، مهرداد نوروزینیا4، مسعود سلیمانی5،
سعید آبرون6، زهرا ذنوبی7، امیر آتشی6
چکیده
سابقه و هدف
عناصر پیامدهی داخل سلول نظیر P15 و P16 ، نقش به سزایی در تمایز سلولهای اولیه به گونههای سلولی متنوع، ایفا میکنند. فاکتورهای مذکور توسط مکانیسمهای مختلفی در کنترل بیان ژن دخیلند که در بین آنها، اپیژنتیک به خصوص متیلاسیون قابل ذکر است. اهداف اصلی در این مطالعه، پی بردن به وضعیت بیان ژنهای مورد نظر در سلولهای بنیادی CD34+ بند ناف و تعیین تغییرات متیلاسیون ژنهای مورد نظر در همین مرحله بود.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود. پس از جمعآوری کیسههای خون بند ناف و تخلیص و ازدیاد سلولهای بنیادی، ژنوم سلولی جدا شد. در مراحل بعد به ترتیب از RNA و DNA سلولهای اولیه، cDNA و Bisulfite treated DNA ساخته شد. در ادامه نیز برای هر دو ژن، واکنشهای PCR و Methylation Specific PCR انجام گرفت.
یافتهها
پس از انجام MSP ، مشخص شد که P15 دارای متیلاسیون و بیان نسبی در سلولهای بنیادی CD34+ بوده و ژن دیگر یعنی P16 نیز فاقد متیلاسیون در این مرحله و دارای بیان کامل است. نتایج PCR ، نشاندهنده بیان هر دو ژن انتخاب شده، در سلولهای بنیادی CD34+ میباشد.
نتیجه گیری
همواره، الگوی بیان ژن توسط هر بافت یا هر سلول، متناسب با عملکردهای آن میباشد. بیان مشخص P15 و P16 نیز، میتواند بیانگر نقش آنها در بیولوژی سلولهای بنیادی CD34+ خون بند ناف باشد. همواره همخوانی قابل توجهی میان بیان یک ژن و تغییرات اپیژنتیک وجود دارد.
کلمات کلیدی: متیلاسیون، سلولهای بنیادی، بند ناف
تاریخ دریافت : 19/1/91
تاریخ پذیرش : 28/4/91
1- دانشجوی دکترای هماتولوژی و بانک خون ـ دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
2- مؤلف مسؤول: PhD هماتولوژی و بانک خون ـ دانشیار دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 331-14115
3- PhD هماتولوژی ـ دانشیار دانشگاه علوم پزشکی زنجان ـ زنجان ـ ایران
4- PhD ژنتیک پزشکی ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
5- PhD هماتولوژی ـ دانشیار دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
6- PhD هماتولوژی ـ استادیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
7- متخصص زنان و زایمان ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
این فاکتورها در سلولهای بنیادی CD34+ خون بند ناف
مهدی آزاد1، سعید کاویانی2، یوسف مرتضوی3، مهرداد نوروزینیا4، مسعود سلیمانی5،
سعید آبرون6، زهرا ذنوبی7، امیر آتشی6
چکیده
سابقه و هدف
عناصر پیامدهی داخل سلول نظیر P15 و P16 ، نقش به سزایی در تمایز سلولهای اولیه به گونههای سلولی متنوع، ایفا میکنند. فاکتورهای مذکور توسط مکانیسمهای مختلفی در کنترل بیان ژن دخیلند که در بین آنها، اپیژنتیک به خصوص متیلاسیون قابل ذکر است. اهداف اصلی در این مطالعه، پی بردن به وضعیت بیان ژنهای مورد نظر در سلولهای بنیادی CD34+ بند ناف و تعیین تغییرات متیلاسیون ژنهای مورد نظر در همین مرحله بود.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود. پس از جمعآوری کیسههای خون بند ناف و تخلیص و ازدیاد سلولهای بنیادی، ژنوم سلولی جدا شد. در مراحل بعد به ترتیب از RNA و DNA سلولهای اولیه، cDNA و Bisulfite treated DNA ساخته شد. در ادامه نیز برای هر دو ژن، واکنشهای PCR و Methylation Specific PCR انجام گرفت.
یافتهها
پس از انجام MSP ، مشخص شد که P15 دارای متیلاسیون و بیان نسبی در سلولهای بنیادی CD34+ بوده و ژن دیگر یعنی P16 نیز فاقد متیلاسیون در این مرحله و دارای بیان کامل است. نتایج PCR ، نشاندهنده بیان هر دو ژن انتخاب شده، در سلولهای بنیادی CD34+ میباشد.
نتیجه گیری
همواره، الگوی بیان ژن توسط هر بافت یا هر سلول، متناسب با عملکردهای آن میباشد. بیان مشخص P15 و P16 نیز، میتواند بیانگر نقش آنها در بیولوژی سلولهای بنیادی CD34+ خون بند ناف باشد. همواره همخوانی قابل توجهی میان بیان یک ژن و تغییرات اپیژنتیک وجود دارد.
کلمات کلیدی: متیلاسیون، سلولهای بنیادی، بند ناف
تاریخ دریافت : 19/1/91
تاریخ پذیرش : 28/4/91
1- دانشجوی دکترای هماتولوژی و بانک خون ـ دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
2- مؤلف مسؤول: PhD هماتولوژی و بانک خون ـ دانشیار دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران ـ صندوق پستی: 331-14115
3- PhD هماتولوژی ـ دانشیار دانشگاه علوم پزشکی زنجان ـ زنجان ـ ایران
4- PhD ژنتیک پزشکی ـ دانشیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
5- PhD هماتولوژی ـ دانشیار دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
6- PhD هماتولوژی ـ استادیار دانشکده پزشکی دانشگاه تربیت مدرس ـ تهران ـ ایران
7- متخصص زنان و زایمان ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی شهید بهشتی ـ تهران ـ ایران
مقدمه
مطالعههای انجام شده روی مکانیسمهای شکلگیری گونههای مختلف سلولی در محیطهای آزمایشگاهی خارج از بدن، منجر به دستیابی بشر به مفاهیم پایه در ارتباط با مکانیسمهای عمومی کنترل نسخهبرداری و تنظیم بیان ژن شده است(5-1). در واقع، فرآیندهای تمایزی در سلولهای ابتدایی، شدیداً وابسته به کنترل بیان ژن و نظارت دقیق بر پیامدهی داخل سلول میباشند که مرتبط با آن، نیاز مبرم و مسجل سلول به فاکتورهای کنترلی خاص نظیر سیتوکینها، فاکتورهای نسخهبرداری ویژه، عناصر کنترلکننده چرخه سلولی، تکثیر و آپوپتوز، کاملاً موجه خواهد بود(8-6).
دو مورد از این فاکتورهای حیاتی که در گروه پروتئینهای سرکوبگر تومور دستهبندی میشوند عبارتند از مهارگر کینازهای وابسته به سایکلین نوع 2A و 2B که به ترتیب P16 و P15 نامیده میشوند. P16 ، در دسته عناصر سرکوبگر تومور و نیز عوامل کنترلکننده چرخه سلولی قرار میگیرد(9). پر رنگ شدن نقش P16 در خونسازی به یک مطالعه در سال 2003 توسط مینامی و همکارانش بر میگردد که در آن تحقیق، نشان داده شد که p16 قادر به کنترل تمایز و آپوپتوز در ردههای اریترویید میباشد(10). پروتئینهای کینازی CDK-4 و CDK-6 ، که توسط P16 مهار میشوند، قادرند پروتئینی به اسم mdm 2 را در حالت طبیعی فعال کنند. mdm 2 ، خود یک مهارگر بالقوه برای P53 میباشد و P53 نیز در واقع یکی از پروتئینهای نظارتکننده بر چرخه سلولی است. بنابراین در حضور P16 ، به صورت زنجیرهوار، P53 نیز سالم مانده و مانع از ایجاد تومور در بدن میشود(11).
ژنهای مربوط به P15 و P16 ، همجوار با یکدیگر و روی کروموزوم 9 قرار دارند و حذف آنها در اکثر تومورها با هم رخ میدهد(13-11). محصول ژن P15 نیز، یک پروتئین سرکوبگر تومور میباشد که به طور بالقوه، کمپلکس سایکلین D را با کینازهای CDK4 و CDK6 مهار کرده و به این ترتیب، چرخه سلولی را در نقطه G1 کنترل مینماید(15، 14).
این دو فاکتور، با توجه به بیـان آنها، میبایسـت نقـش
مهمی در کنترل و تغییر الگوی ژنی سلولهای بنیادی داشته باشند که از مکانیسمهای کنترلی آنها نیز میتوان اپیژنتیک را نام برد. اپیژنتیک مساله مهمی است که امروزه به عنوان یکی از مسیرهای کنترل بیان ژن معرفی شده و به تغییر در بیان ژن بدون تغییر پایه در سکوئنسینگ اطلاق میگردد(18-16).
یکی از مکانیسمهای مهم و تاثیرگذار اپیژنتیک، متیلاسیون نواحی پروموتوری ژنهاست که خاموش شدن ژنهای مورد نظر را در پی دارد(20، 19).
اپیژنتیک و مکانیسمهای آن نظیر متیلاسیون و استیلاسیون، در واقع قادرند مراحل تکثیر و تمایز را در گروهی از سلولها و بافتهای ویژه، دستکاری کنند(22، 21).
با توجه به این که الگوی متیلاسیون و وضعیت بیان P15 و P16 به عنوان فاکتورهای مؤثر در کنترل تکثیر و تمایز سلولی، در سلولهای بنیادی CD34+ جدا شده از خون بند ناف، تاکنون مشخص نشده است، در این مطالعه به این امر پرداخته و الگوی بیان ژنهای ذکر شده در سلولهای بنیادی تخلیص شده از خون بند ناف، مورد ارزیابی قرار گرفت و در مرحله دوم نیز الگوی متیلاسیون این دو فاکتور سرکوبگر تومور مورد بررسی و آزمون قرار گرفت.
مواد و روشها
جداسازی و تکثیر سلولهای بنیادین CD34+ :
در یک مطالعه تجربی، در چندین مرحله کیسههای خون بند ناف از بیمارستان صارم و سازمان انتقال خون تهران تهیه شد. در گام بعدی، سلولهای CD34+ با استفاده از کیتIndirect CD34 MicroBead شرکت میلتن بیوتک و روش جداسازی سلولی با آنتیبادی منوکلونال(MACS) و طبق دستورالعمل کیت، تخلیص شد.
سپس با استفاده از محیط Stem Span که از قبل به آن فاکتورهای رشدFlt3 ، TPO و SCF ، با غلظت نهایی ng/mL 50 اضافه شده بود، سلولهای جدا شده را یک تا دو روز تکثیر داده و در نهایت پس از شست و شو با بافر PBS ، جهت ادامه آزمونها از محیط جداسازی کردیم.
جدول 1: توالی آغازگرهای مورد استفاده در روش RT-PCR
| Oligo name | توالی |
| P15-F | GGGAAAGAAGGGAAGAGTGTCGTT |
| P15-R | GCATGCCCTTGTTCTCCTCG |
| P16-F | GGGGGACCAGAGGCAGT |
| P16-R | GGTTGTGGCGGGGGCAGTT |
جدول 2: مشخصات آغازگرهای مورد استفاده در روش MSP
| ژن | سایز (bp) |
چرخه | دما (درجه سانتیگراد) |
نوع آغازگر | توالی 5' to 3' |
|
| P15 | 249 | 38 | 50 | UF | TGT GAT GTG TTT GTA TTT TGT GGT T | |
| UR | CCA TAC AAT AAC CAA ACA ACC AA | |||||
| 237 | 38 | 60 | MF | GCG TTC GTA TTT TGC GGT T | ||
| MR | CGT ACA ATA ACC GAA CGA CCG A | |||||
| P16 | 151 | 35 | 60 | UF | TTA TTA GAG GGT GGG GTG GAT TGT | |
| UR | CAA CCC CAA ACC ACA ACC ATA A | |||||
| 150 | 35 | 65 | MF | TTA TTA GAG GGT GGG GCG GAT CGC | ||
| MR | GAC CCC GAA CCG CGA CCG TAA | |||||
جداسازی DNA و RNAی سلولهای تکثیر شده:
DNA و RNAی سلولهای مورد نظر با کیتهای تخلیص DNA و RNA کیاژن، بر اساس دستورالعملهای کیت، جداسازی شده و جهت ادامه آزمونها در فریزر 20- درجه سانتیگراد نگهداری شد.
سنجش بیان ژنهای مورد مطالعه با روش RT-PCR :
در این مرحله، سنتز cDNA با کیت کیاژن و با استفاده از RNA ذخیره شده در مراحل قبلی بر اساس دستورالعمل کیت، انجام شد و با آغازگرهای سفارش داده شده جهت بررسی بیان ژن، واکنش PCR برای هر ژن به طور جداگانه انجام گرفت(جدول 1). دمای آنیلینگ مناسب برای این آغازگرها، 60-57 درجه سانتیگراد میباشد و برای دیگر مواد موردنیاز هم از Taq PCR Master mix کیاژن استفاده شد.
پردازش DNA و انجام واکنش MSP جهت سنجش الگوی متیلاسیون:
در مرحله اول، DNA ذخیره شده از مراحل قبل با کیت EpiTect ® Bisulfite کیاژن و طبق دستورالعمل کیت تحت پردازش قرار گرفت و برای استفاده درMSP (Methylation-Specific PCR) آماده شد. در مرحله بعد، با استفاده از DNA پردازش شده، واکنش MSP برای هر ژن به طور جداگانه انجام شد(جدول 2). دمای آنیلینگ مناسب برای این آغازگرها، از 50 درجه سانتیگراد تا 65 درجه سانتیگراد متغیر میباشد.
یافتهها
نتایج فلوسیتومتری برای میزان خلوص سلولهای هماتوپویتیک جدا شده از خون بند ناف با استفاده از آنتیبادی منوکلونال CD34 و دستگاه فلوسیتومتر BD، به دست آمد(شکل 1). رنگ فلورسنت مورد استفاده برای نشاندار کردن آنتیبادی در این مرحله برای CD34 ، فیکو اریترین میباشد. نرمافزار مورد استفاده برای تفسیر دادههای فلوسیتومتری، Cyflogic است. تصویر A-1 مربوط به کنترل ایزوتیپ و تصویر B-1 نیز مربوط به آنتیبادی CD34 میباشد. تصویر C-1 میزان خلوص 80 درصدی را در سلولهای جدا شده از خون بند ناف نشان میدهد.
در ادامه، cDNA تهیه شده از ژنوم سلولهای بنیادی، با روش RT-PCR جهت سنجش بیان یا عدم بیان ژنهـای مورد مطالعه در سلولهای هماتوپویتیک بند ناف، پس از تخلیص و تکثیر، مورد آزمون قرار گرفتند. طول باند DNA بـرای محصـولات PCR بــرای P15 و P16 تقریباً در یـک
DNA و RNAی سلولهای مورد نظر با کیتهای تخلیص DNA و RNA کیاژن، بر اساس دستورالعملهای کیت، جداسازی شده و جهت ادامه آزمونها در فریزر 20- درجه سانتیگراد نگهداری شد.
سنجش بیان ژنهای مورد مطالعه با روش RT-PCR :
در این مرحله، سنتز cDNA با کیت کیاژن و با استفاده از RNA ذخیره شده در مراحل قبلی بر اساس دستورالعمل کیت، انجام شد و با آغازگرهای سفارش داده شده جهت بررسی بیان ژن، واکنش PCR برای هر ژن به طور جداگانه انجام گرفت(جدول 1). دمای آنیلینگ مناسب برای این آغازگرها، 60-57 درجه سانتیگراد میباشد و برای دیگر مواد موردنیاز هم از Taq PCR Master mix کیاژن استفاده شد.
پردازش DNA و انجام واکنش MSP جهت سنجش الگوی متیلاسیون:
در مرحله اول، DNA ذخیره شده از مراحل قبل با کیت EpiTect ® Bisulfite کیاژن و طبق دستورالعمل کیت تحت پردازش قرار گرفت و برای استفاده درMSP (Methylation-Specific PCR) آماده شد. در مرحله بعد، با استفاده از DNA پردازش شده، واکنش MSP برای هر ژن به طور جداگانه انجام شد(جدول 2). دمای آنیلینگ مناسب برای این آغازگرها، از 50 درجه سانتیگراد تا 65 درجه سانتیگراد متغیر میباشد.
یافتهها
نتایج فلوسیتومتری برای میزان خلوص سلولهای هماتوپویتیک جدا شده از خون بند ناف با استفاده از آنتیبادی منوکلونال CD34 و دستگاه فلوسیتومتر BD، به دست آمد(شکل 1). رنگ فلورسنت مورد استفاده برای نشاندار کردن آنتیبادی در این مرحله برای CD34 ، فیکو اریترین میباشد. نرمافزار مورد استفاده برای تفسیر دادههای فلوسیتومتری، Cyflogic است. تصویر A-1 مربوط به کنترل ایزوتیپ و تصویر B-1 نیز مربوط به آنتیبادی CD34 میباشد. تصویر C-1 میزان خلوص 80 درصدی را در سلولهای جدا شده از خون بند ناف نشان میدهد.
در ادامه، cDNA تهیه شده از ژنوم سلولهای بنیادی، با روش RT-PCR جهت سنجش بیان یا عدم بیان ژنهـای مورد مطالعه در سلولهای هماتوپویتیک بند ناف، پس از تخلیص و تکثیر، مورد آزمون قرار گرفتند. طول باند DNA بـرای محصـولات PCR بــرای P15 و P16 تقریباً در یـک

شکل 1: میزان بیان مارکر CD34 ، بر روی سلولهای هماتوپویتیک که از خون بند ناف جدا شده است.

شکل 2: ژل آگاروز 5/1% است که باندهای قابل مشاهده در آن نشاندهنده محصولات واکنش PCR برای ژنهای مورد مطالعه در این تحقیق میباشد.N-C بیانگر کنترل منفی میباشد (واکنشی که در آن از نمونه cDNA، استفاده نشده است). باندهای مربوط به خانههای یک و سه مربوط به ژن P15 میباشند که در دو دمای آنیلینگ متفاوت به صورت گرادیان گذاشته شده است. باندهای مربوط به خانههای دو و چهار نیز مربوط به ژن P16 میباشند که در دو دمای آنیلینگ متفاوت به صورت گرادیان گذاشته شده است. با توجه به شکل، هر دو فاکتور مورد مطالعه در این تحقیق، در سلولهای بنیادی مورد نظر، کم و بیش بیان میشوند.

شکل 3: ژل آگاروز 5/1% که باندهای قابل مشاهده در آن نشاندهنده محصولات واکنش PCR برای حالتهای متیله یا غیر متیله ژنهای مورد مطالعه در این تحقیق است.
محدوده و به ترتیب bp104 و bp159 میباشد.
در این مرحله از تحقیق، محصولات PCR برای ثبت باند مربوط به هر ژن، روی ژل تهیه شده از پودر آگاروز بارگذاری شد. سپس ژل مورد نظر برای مشاهده باند، زیر نور UV قرار گرفت. شکل 2، که توسط دستگاه Biometra Gel Doc ثبت شده است، مشخصکننده وجود باند در همه چاهکهای ژل بوده و بیان ژنهای مربوطه را در سلولهای بنیادی مورد نظر نشان میدهد.
همانطور که ذکر شد، با آغازگرهای طراحی شده جهت استفاده در Real Time PCR و نیز cDNA سنتز شده از ژنوم سلولهای بنیادی پس از تکثیر، واکنش PCR برای هر دو ژن انجام شد. با توجه به مشروحات بالا، مشاهده باند در این مرحله در هر صورت نشاندهنده بیان ژن مورد نظر در سلول هماتوپویتیک است و با توجه به این که در همه خانههای ژل در این مرحله، باند DNA ، در همان محدوده قابل انتظار مشاهده میشود، میتوان به این نتیجه رسید که هر دو فاکتور مورد مطالعه در این تحقیق، در الگوی بیان ژنی سلولهای بنیادی CD34+ بند ناف وجود دارند.
در بخش دیگر تحقیق، DNA از سلولهای هماتوپویتیک بند ناف، پس از تخلیص و تکثیر و پردازش برای بررسی الگوی متیلاسیون، با روش MSP مورد آزمون قرار گرفت. از مشکلات مرتبط با MSP ، در واقع دشواری قابل توجه مرحله تنظیم، برای این روش است و در این مطالعه نیز مدت زمان زیادی جهت این منظور اختصاص یافت که در مدت حدود چند ماه، نتایج و تصاویر زیادی ثبت شد. اندازه باند DNA برای محصولات MSP برای ژنهای مختلف مورد مطالعه، باز هم تقریباً در یک محدوده و به طور دقیق از این قرار بود:
Methylated P16 Gene – 150 bp
Unmethylated P16 Gene – 151 bp
Methylated P15 Gene – 148 bp
Unmethylated P15 Gene – 154 bp
بر اساس یکی از بهترین و گویاترین تصاویر ثبت شده در این مرحله، میتوان نتایج را به این صورت تفسیر کرد (شکل 3):
در مورد ژن P15 با توجه به مشاهده باند در هر دو واکنش مربوط به آغازگرهای متیله و غیر متیله، یک متیلاسیون نسبی در پروموتور این ژن در این مرحله قابل پیشگویی میباشد که نشاندهنده بیان نسبی ژن است. در مورد ژن دیگر یعنی P16 ، فقط در خانههای مربوط به آغازگر غیر متیله، باند دیده میشود که بیانگر عدم متیلاسیون ژن فوق در این مرحله و بنابراین بیان آن میباشد. در شکل 3، خانههایی که با حرف M (قرمز رنگ) نشان داده شده است، مربوط به واکنشهایی است که در آنها از آغازگرهای مربوط به ژن مورد نظر در حالت متیله استفاده شده است و خانههایی که با حرف U (آبی رنگ) نشان داده شده است، مربوط به واکنشهایی است که در آنها از آغازگرهای مربوط به ژن مورد نظر در حالت غیر متیله استفاده شده است. N-C و P-C، به ترتیب بیانگر وضعیت کنترل منفی و کنترل مثبت MSP میباشند. در کنترل مثبت، از نمونه DNA استفاده میشود که از قبل، با یک آنزیم متیلاز نظیر Sss1 ، پردازش شده و از متیلاسیون آن، اطمینان خاطر وجود دارد. بنابراین در واکنش MSP ، باید مثبت شود تا صحت باندهای دیگر، مورد تایید قرار بگیرد. در وضعیت کنترل منفی نیز، از نمونه DNA پردازش نشده استفاده شد که طبیعتاً نباید محصولی نیز در MSP داشته باشد.
بحث
همانطور که شرح داده شد، اپیژنتیک، علم تغییر بیان ژن بدون تغییر در توالی نوکلئوتیدی میباشد. مکانیسمهای مختلف اپیژنتیک، به خصوص متیلاسیون، قادر است همه مراحل رشد و تمایز سلولی را تحت تاثیر قرار دهد(20-16).
بر مبنای تحقیقات فراوان بر روی مکانیسمهای تکوینی مختلف، تمایز به گروههای سلولی، در سطح بالایی وابسته به کنترل دقیق بیان ژن و عناصر متنوع پیامدهی داخل سلول نظیر فاکتورهای نسخهبرداری و سرکوبگر تومور است که دو مورد از این عناصر حد واسط عبارتند از فاکتورهای(P16 INK 4a) و (P15 INK 4b) که به ترتیب P16 و P15 نامیده میشوند. این دو فاکتور از پروتئینهای سرکوبگر تومور هستند که از نقشهای دیگر آنها مهار CDK-4 ، CDK-6 و کنترل چرخه سلولی در نقطه G1 میباشد(10-6).
سلولهای بنیادی با توجه به این که در تمام طول عمر خود دارای قدرت خود نوسازی میباشند، از سلولهای دیگر و پروژنیتورهای خود، متفاوت بوده و دارای الگوی بیان ژن به صورت مجزا و منحصر به فرد هستند. قدرت خودنوسازی سلولهای بنیادی با ظرفیت تمایزی آنها همواره در تعدیل است. الگوی بیان ژن در سلولهای اولیه عموماً مرتبط با گروهی از ژنهاست که در فرآیندهای نسخهبرداری عمومی، تنظیم سیکل سلولی و مرگ برنامهریزی شده سلول دخیل هستند. دو مورد از این ژنها، P16 و P15 هستند که در این مطالعه به بررسی آنها پرداخته شده است. در واقع مکانیسمهای تنظیم بیان ژن، الگوی بیان و جزییات دقیق آن در سلولهای هماتوپویتیک بند ناف، هنوز تا حدود زیادی ناشناخته باقی مانده است(5-3).
متیلاسیون جزایر غنی از سیتوزین و گوانین، پدیده اپیژنتیکی شایعی است که در ارتباط با بیان اکثریت پروتئینهای سرکوبگر تومور در بدن رخ میدهد و از مسیرهای اصلی تنظیم بیان، برای این ژنها محسوب میگردد. تعدادی از مسیرهای سلولی که توسط متیلاسیون، غیر فعال یا کنترل میشوند عبارتند از: تعمیر DNA آسیبدیده(hMLH1 و MGMT)، چرخه سلولی(P14 ، P15 و P16)، آپوپتوز(DAPK)، چسبندگی سلولی(CDH1-13)، سمیتزدایی(GSTP1) و ...(12). اگر چه هنوز در این رابطه، ناگفتههای زیادی باقی مانده است، این که همه ژنهای مذکور، در تنظیم فرآیندهای مختلف سلولی، چگونه ایفای نقش میکنند و این تنظیمات تا چه حد با متیلاسیون این ژنها ارتباط دارد، هنوز مجهول و ناگفته است. ولی با همه این تفاسیر، از زمانی که روشهای بررسی متیلاسیون ژنها نظیر MSP شناخته شده، به گروهی از این سؤالات نیز پاسخ داده شده است. در این مطالعه برای بررسی الگوی متیلاسیون از MSP و برای تایید نتایج آن، از بررسی بیان ژن بهره برده شده است.
در سال 1986 به این نکته اشاره شد که معمولاً متیلاسیون یک ژن در نواحی پروموتوری آن رخ میدهد و این متیلاسیون به طور دقیق مربوط به جزایر CpG (نواحی غنی از سیتوزین و گوانین) میباشد(20). در آن زمان مشخص شد که نواحی CpG ، عمدتاً در انتهای '5 قسمت غیرقابل ترجمه ژنها قرار دارد که گاهاً در اولین اگزون نیز گزارش شده است(19). از نظر تاریخچه، متیلاسیون یک ژن سرکوبگر تومور، برای اولین بار در سال 1989 و در مورد رتینوبلاستوما مطرح شد(15). در ادامه در سال 1994، هیپرمتیلاسیون ژن vHL ( فون هیپل لیندا) و غیر فعال شدن آن در بدخیمیهای انسانی گزارش شد(18). یک سال بعد یعنی در 1995، غیر فعال شدن ژن P16 ، در بدخیمیها توسط متیلاسیون نواحی پروموتوری، نشان داده شد و به این ترتیب، نقش متیلاسیون در نواحی پروموتوری ژنهای سرکوبگر تومور، به عنوان یکی از مسیرهای کنترل بیان ژن، پر رنگ شده و مورد توجه محافل علمی قرار گرفت(12). در سال 2001 نشان داده شد در بافتهایی که دارای متیلاسیون در نواحی پروموتوری هستند، فعالیت آنزیمهای متیل ترانسفراز نیز افزایش مییابد. در راستای این مطالعهها، ژنهایی معرفی شد که کدکننده آنزیمهای متیل ترانسفراز هستند(DNMT1 ، DNMT2 ، DNMT3a و DNMT3b )(20).
در ادامه مطالعههای انجام شده، متیلاسیون ژن P15 ، در اکثریت لوسمیها و متیلاسیون ژن P16 ، در طیف وسیعی از بدخیمیها نشان داده شد(11). نکته دیگری که قابل توجه و لازم به ذکر است، این است که متیلاسیون نواحی پروموتوری ژنهای P15 و P16 ، به عنوان یک مسیر تنظیم بیان ژن، نسبت به دیگر ژنهای سرکوبگر تومور، بسیار رایجتر هستند(21).
ژنهای مورد مطالعه در این تحقیق از دو جنبه مورد بررسی قرار گرفتند؛ یکی از این ابعاد، موضوع بیان ژنهای مورد نظر در سلولهای بنیادی CD34+ میباشد. موضوع دیگر روشن شدن وضعیت متیلاسیون در نواحی پروموتور همین ژنهاست که از مکانیسمهای تنظیم بیان ژن محسوب میشود. به زبان دیگر اگر یک ژن در نواحی پروموتوری خود دارای جزایر غنی از سیتوزین و گوانین(GpG) باشد، این بدین معنا است که وضعیت متیلاسیون نواحی مزبور میتواند منتهی به خاموش شدن یا روشن شدن بیان ژن مورد نظر شود(22-20). حال آن که ممکن است در برخی موارد، پروموتور ژنها به طور نسبی دچار متیلاسیون شوند که طبیعتاً تحت این شرایط، بیان نسبی ژن مربوطه، پیامد قابل انتظار شرایط فوق خواهد بود. بنابراین بیان یک ژن (Gene Expression) در الگوی سلول مد نظر در مرحله نسخهبرداری، با اصولی هم چون اپیژنتیک و متیلاسیون میتواند دارای ارتباط تنگاتنگ باشد(22-16).
در واقع همان طور که ذکر شد، نتایج MSP برای ژن P15 به صورت متیلاسیون نسبی و نتایج بررسی بیان ژن نیز برای مورد فوق مثبت است که میتوان همخوانی دادههای به دست آمده را نتیجهگیری کرد.
از طرف دیگر برای ژنهای P16 نیز، نتایج MSP بیانگر عدم متیلاسیون در این مرحله و نتایج آنالیز بیان ژن نشاندهنده وجود محصول قابل انتظار در PCR و در نهایت بیان مثبت ژنی میباشد که مجدداً همخوانی دادهها قابل مشاهده است.
نتیجهگیری
نتایج به دست آمده در مراحل مختلف مطالعه حاضر نشان میدهد که متیلاسیون نواحی پروموتوری ژنهای مورد مطالعه(P15-P16)، یکی از مسیرهای قطعی و مهم کنترل بیان فاکتورهای مورد نظر هستند. در واقع بیان هیچ کدام از فاکتورهای مورد بحث در سلولهای هماتوپویتیک منفی نمیباشد و گویای این نکته است که هر دو ژن، در متابولیسم سلولهای بنیادی CD34+ ، دارای نقش مشخص هستند. در میزان بیان فاکتورهای مورد نظر و نیز الگوی متیلاسیون در نواحی پروموتوری فاکتورهای فوق نیز، همخوانی قابل قبولی دیده میشود اگر چه وجود مغایرت در این رابطه نیز دور از انتظار نخواهد بود چرا که میتوان گفت نتایج متیلاسیون در این تحقیق با استفاده از روش MSP به دست آمده است که قادر به گزارش تفاوتهای کمی متیلاسیون نیست و به مقایسه الگوهای متیلاسیون به صورت کیفی میپردازد. ضمناً در تنظیم میزان بیان ژنها فقط یک مکانیسم ویژه ایفای نقش نمیکند و برآیند گروهی از مکانیسمهای مختلف است که سطوح بیان هر ژن را در سلول، تعیین مینماید.
تشکر و قدردانی
بدینوسیله از خانم دکتر مهین نیکوگفتار و آقای دکتر کامران عطاردی که در جمعآوری خون بند ناف به این گروه، یاری و کمک رساندند نهایت تشکر را داریم.
نوع مطالعه: پژوهشي |
موضوع مقاله:
سلولهاي بنيادي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



