جلد 11، شماره 2 - ( تابستان 1393 )
جلد 11 شماره 2 صفحات 125-116 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghanizadeh-Vesali S, Shirali S, Zaker F, Mohammadi S, Aryanpour J, Yazdanparast S. Simvastatin synergistically potentiating the anti-tumoreffects of arsenic trioxide on human promyelocyticleukemia (NB-4) cells. bloodj 2014; 11 (2) :116-125
URL: http://bloodjournal.ir/article-1-732-fa.html
URL: http://bloodjournal.ir/article-1-732-fa.html
غنی زاده وصالی صمد، شیرعلی سعید، ذاکر فرهاد، محمدی سارا، آریان پور ژنی، یزدان پرست سید امیر. تاثیر سینرژیک سیم واستاتین در افزایش آثار ضد توموری آرسنیک تریاکسید در رده سلولی لوسمی پرومیلوسیتی حاد انسانی (NB-4) . فصلنامه پژوهشی خون. 1393; 11 (2) :116-125
استاد مرکز تحقیقات سلولی و مولکولی دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران
متن کامل [PDF 561 kb]
(2060 دریافت)
| چکیده (HTML) (9340 مشاهده)
مقدمه
لوسمی پرومیلوسیتی حاد(APL)، زیر گونهای از لوسمی میلوئیدی حاد با تمایل شدید به خونریزی میباشد که توسط حضور جابهجایی کروموزومی t(15-17) مشخص میشود. ناهنجاری سیتوژنتیکی مذکور، سبب اتصال ژن لوسمی پرومیلوسیتی (PML) واقع بر روی کروموزوم 15 به ژن گیرنده آلفا اسید رتینوئیک (RARα) واقع بر روی کروموزوم 17 میشود(1). انکوپروتئین حاصل، باعث مهار نسخهبرداری از ژنهای تمایزی، آپوپتوزی و خود- نوسازی سلول و در نتیجه فزونی سلولهای نابالغ (پرومیلوسیت) در خون و مغز استخوان میگردد(2).
شواهد بسیاری مبنی بر توانایی ضد سرطانی آرسنیک تری اکسید(ATO) بر علیه انواع مختلفی از بدخیمیهای انسانی وجود دارد. مطالعههای In vitro نشان دادهاند که ATO از راههای گوناگون هم چون فعالسازی پروتئینهای پیشآپوپتوزی، سرکوب پروتئینهای ضد آپوپتوزی، افزایش تولید گونههای واکنشپذیر اکسیژن(ROS)، کاهش پتانسیل غشای میتوکندری و فعالسازی کاسپازها، سبب بروز مرگ برنامهریزی شده در سلولهای لوسمیک میشود(3). امروزه ATO به عنوان تک داروی مؤثر در القای رمیسیون در بیماران تازه تشخیص لوسمی پرومیلوسیتیک حاد معرفی گشته است، به طوری که ATO با دوز mg/kg 15/0-10/0، در 90%-85% از موارد تازه تشخیص APL ، سبب دستیابی به رمیسیون مولکولی یا سیتوژنتیکی میشود. با استفاده از این غلظت، بیشتر عوارض گزارش شده خفیف و گذرا بوده و شامل راشهای پوستی، دردهای اسکلتی- عضلانی، سردرد، سرگیجه، افزایش کراتینین، افزایش ترانس آمینازهای کبدی، آریتمی قلبی و در برخی موارد مرگ ناگهانی است(4). نیاز به دوزهای بالاتر در بیماران دچار عود یا لوسمی رفرکتوری از یک سو و افزایش سمیت و عوارض دارو در دوزهای بالاتر از سوی دیگر باعث ایجاد انگیزه در زمینه دستیابی به روشهای درمانی مطلوبتری در بیماران APL گشته است. این موضوع در مورد بیماران سالمند که شیوع بیماریهای هم زمان در آنها سبب محدودیـت توان تحمـل دوزهـای بـالای شیمـی درمانــی
میشود، نمود بیشتری مییابد(5).
سیم واستاتین عضوی از خانواده استاتینها یا داروهای کاهنده کلسترول خون است که هم چون سایر اعضای این خانواده، با مهار رقابتی آنزیم 3- هیدروکسی-3 متیل گلوتاریل کوآنزیم A (HMG-CoA) ردوکتاز در مسیر موالونات، از ساخت کلسترول جلوگیری میکند(6). اعضای این خانواده شامل لو واستاتین، سیم واستاتین و پرا واستاتین به عنوان مشتقهای طبیعی حاصل از فرآیند تخمیر قارچها و در مقابل فلو واستاتین، آتور واستاتین، سری واستاتین، روسو واستاتین و پیتا واستاتین به عنوان مشتقهای صناعی از این خانواده محسوب میشوند(7). استاتینها آثار چندگانهای(پلئوتروپیک) هم چون مهار التهاب، تنظیم آنژیوژنز، مهار رشد و ایجاد مرگ سلولی در ردههای سلولی مختلفی از تومورهای انسانی را دارند(12-8). هم چنین نشان داده شده است که استاتینها در In vitro باعث توقف رشد در فاز G1/S در تومورهای بافت توپر و بدخیمیهای خونی میشوند(14، 13). علاوه برآن، مطالعهها نشان دادهاند که استاتینها در In vivo نیز سبب توقف تکثیر سلولهای AML در موشهای SCID و مهار رشد تومورهای روده در موشها میشوند(16، 15).
امروزه استفاده از درمان ترکیبی یا پلیتراپی از جمله راه حلهای پذیرفته شده در مدیریت بالینی بدخیمیهای مقاوم و غلبه بر محدودیتهای توکسیک دارویی است (17). با توجه به خاصیت اثبات شده دو دارو در القای آپوپتوز، هدف از مطالعه پیش رو بررسی اثر ترکیبی SV و ATO در مهار رشد و القای مرگ برنامهریزی شده سلولهای NB-4 میباشد.
مواد و روشها
کشت و تیمار رده سلولی NB-4 با آرسنیک تریاکسید و سیم واستاتین:
سلول NB-4 مورد استفاده در این مطالعه تجربی، از بانک سلولی انستیتو پاستور ایران و به شکل ویال تهیه شد. تایید رده سلولی NB-4 با بررسی وجود رونوشت PML-RARa و با روش RT-PCR انجام پذیرفت. سلولهای NB-4 در محیط کشت RPMI-1640 محتوی 10% سرم(FBS)، U/mL 100 پنیسیلین و µg/mL 100 استرپتومایسین در شرایط دمایی 37 درجه سانتیگراد و فشار 5% گاز CO2 کشت داده شدند. در این مطالعه تجربی، رقتهای مختلفی (0 ، 5/0 ، 5/1 و 2 میکرومولار) از آمپول As2O3 (سینا دارو) در محیط کشت RPMI-1640 فاقد FBS تهیه شد. هم چنین با حل کردن پودر سیم واستاتین(سیگما- آلدریچ) در DMSO ، استوک دارو تهیه و رقتهای مختلف(0، 5، 10، 15 و 20 میکرومولار) آن در محیط RPMI-1640 فاقد FBS فراهم شد. میزان برابری از DMSO به نمونههای کنترل اضافه شد که در این حالت غلظت نهایی DMSO متجاوز از 1% از حجم نهایی نبود.
بررسی تاثیرات سایتوتوکسیک ATO و SV :
برای بررسی تاثیرات سایتوتوکسیک و تعیین مقادیر IC50 داروهای مذکور، از روش رنگسنجی MTT استفاده شد. اساس آزمایش بر مبنای توانایی سلولهای زنده در احیای نمک محلول تترازولیوم بروماید و تبدیل آن به رسوب فورمازان است. به همین منظور، 100 میکرولیتر سوسپانسیون حاوی 103 * 5 عدد از سلولهای NB-4 که در فاز رشد لگاریتمی بودند به هر چاهک از پلیت 96 خانهای منتقل شد، سپس به هر چاهک، از رقتهای µM 20-5 داروی SV و رقتهای µM 2-5/0 داروی ATO اضافه گشت. به دنبال 48 ساعت مواجهه با دارو، تترازولیوم بروماید (سیگما) با غلظت نهایی mg/mL 5/0 در محیط RPMI-1640 تهیه و به هر چاهک اضافه گشت و به مدت 4-3 ساعت در شرایط کشت انکوبه شد. سپس پلیت را سانتریفیوژ نموده و پس از دور ریختن مایع رویی، به رسوب ته پلیت 100 میکرولیتر DMSO اضافه گردید. در نهایت خوانش جذب نوری چاهکها در طول موج 570 نانومتر انجام گرفت. به منظور برآورد اثر مهار از فرمول زیر استفاده شد:

بررسی درصد زندهمانی سلولها:
جهت ارزیابی درصد سلولهای زنده از رنگ تریپانبلو (TB) به روش Trypan Blue Dye Exclusion استفاده شد. اساس آزمایش بر مبنای توانایی سلولهای زنده در خارجسازی رنگ TB میباشد. برای انجام این آزمایش تعدادی برابر از سلولها در پلیتهای 6 خانهای کشت داده شدند و شمارش و ارزیابی زندهمانی آنها پس از 24 ساعت تیمار با داروهای ATO و SV با استفاده از لام نئوبار و میکروسکوپ نوری انجام پذیرفت. درصد زندهمانی مربوط به هر دوز با استفاده از فرمول زیر به شکل درصدی از زندهمانی کنترل(سلولهای تیمار نشده) محاسبه و در نمودار 1 به نمایش درآمده است(نمودار 1).

بررسی آپوپتوز با فلوسایتومتری:
برای ارزیابی کمّی آپوپتوز در سلولهای NB-4 مواجهه شده با ATO و SV ، از کیت Annexin V FITC/PI assay (رُوش) استفاده شد. از هر دوز، تعداد 106 * 1 سلول با PBS شسته شده، پس از به سوسپانسیون درآوردن، بر اساس دستورالعمل کیت در دمای اتاق به مدت 15 دقیقه در µL 100 محلول کار حاوی آنکسین و پروپیدیم یدید انکوبه شدند و سپس با دستگاه فلوسایتومتری مورد بررسی قرار گرفتند.
استخراج RNA و ساخت cDNA :
استخراج RNA توسط کیت High Pure RNA Isolation Kit (رُوش) مطابق دستورالعمل شرکت سازنده انجام شد. در مرحله بعد، RNA استخراج شده به طور کمی و کیفی مورد ارزیابی قرار گرفته و مقدار µg 1 از RNA برای ساخت cDNA توسط کیت cDNA Synthesis Kit (رُوش) استفاده شد.
بررسی بیان ژنها توسط RQ-PCR :
بـرای بـررسی کمّـی بیـان ژنها به روش RQ-PCR ، از دستگـاه Step One Plus (بیوسیستـــم) و کیت SYBER
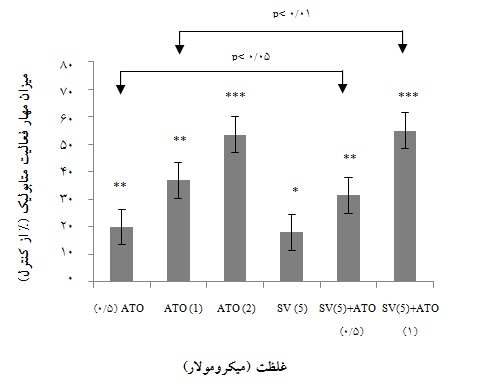
نمودار 1: تیمار ترکیبی با ATO و SV سبب مهار فعالیت متابولیکی سلولهای NB-4 میشود. در تیمار ترکیبی، SV با دوز 5 میکرومولار سبب افزایش معناداری در اثر بخشی دوز 1 میکرومولار ATO گشته است، به گونهای که تقریباً با دوز 2 میکرومولار ATO برابری میکند.
جدول 1: توالی آغازگرها و طول قطعات تکثیر شده
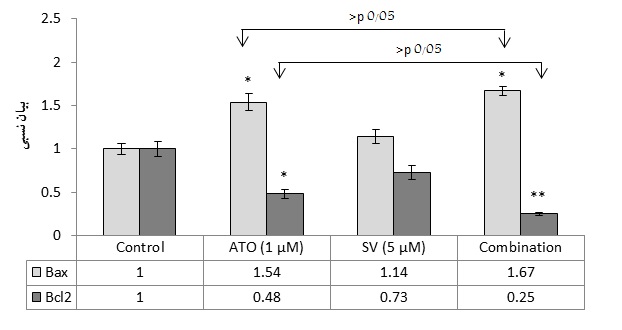
نمودار 3: تاثیر تیمار ترکیبی آرسنیک تریاکسید و سیم واستاتین بر روی بیان ژنهای Bax و Bcl-2 در رده سلولی NB-4. اعداد زیر نمودار مربوط به میانگین بیان ژنها میباشند و نمودار فوق بر اساس میانگین ± انحراف معیار رسم شده است. همان گونه که در نمودار مشخص است، SV به طور معناداری سبب تقویت اثر ATO در افزیش بیان Bax و کاهش بیان Bcl-2 گشته است(05/0p<). نسبت بیان Bax به Bcl-2 نیز در حالت ترکیب(ATO+SV) حدود 2 برابر ATO به تنهایی میباشد(001/0P<)(نسبت Bax به Bcl-2 پس از مواجهه با ATO ، SV و ATO+SV به ترتیب 2/3 ، 5/1 و 6/6 است).
تیمار ترکیبی سبب تقویت مسیر داخلی آپوپتوز میشود. برای ارزیابی مکانیسم آپوپتوز القا شده توسط دو دارو، بیان دو ژن پیش آپوپتوزی Bax و ضد آپوپتوزی Bcl-2 مورد ارزیابی قرار گرفته و نسبت آنها به عنوان شاخص میتوکندریال آپوپتوز در پاسخ به دارو در نظر گرفته شدند. چنانچه در نمودار 3 مشاهده میگردد، آرسنیک تریاکسید و سیم واستاتین هر یک به تنهایی سبب افزایش بیان Bax و کاهش بیان Bcl-2 میگردند و این اثر در حالت تیمار ترکیبی به وضوح افزایش مییابد. هم چنین نسبت Bax/Bcl-2 در حالت تیمار ترکیبی، افزایش معناداری نسبت به دوزهای منفرد SV و ATO داشته است.
بحث
امروزه به رغم پیشرفتهای انجام گرفته، دریچه امید به درمان با استفاده از داروهای ضد سرطان شامل داروهای سیتوتوکسیک نظیر آرسنیک تریاکسید هم چنان بسیار باریک است. در اکثر موارد، بیماران با دوزهایی که به بیشینه دوز قابل تحمل(MTD) نزدیک است درمان میشوند. بنابراین، نیاز به یافتن ترکیبی که بتواند به طور بالینی مورد استفاده قرار گیرد و آثار جانبی شیمی درمانی بر بافتهای طبیعی را محدود سازد، احساس میشود. در این مطالعه به بررسی اثر تیمار ترکیبی داروهای SV و ATO بر روی رده سلولی لوسمی پرومیلوسیتی حاد NB-4، واجد جابه جایی کروموزومیt(15;17)، پرداخته شد.
شواهد محکمی وجود دارد مبنی بر این که ATO مسیرهای پیامرسانی بیشماری را متاثر ساخته و منجر به تغییرات گسترده در عملکرد سلول میشود به گونهای که آثاری هم چون بروز آپوپتوز، توقف رشد و مهار آنژیوژنز را برجای میگذارد(19). هم چنین مطالعههای متعددی به اثر پیش آپوپتوزی استاتینها اشاره داشتهاند. برای مثال، هایندلر و همکارانش نشان دادند که استاتینها باعث ایجاد مرگ آپوپتوتیک در سلولهای مشتق از لوسمی میلومونوسیتیک جوانان، بدخیمیهای بافت توپر کودکان (رابدومیوسارکوما و مدولوبلاستوما)، مزوتلیوم بدخیم، آستروسیتوما و سرطان سلولهای سنگفرشی میشوند(20). علاوه برآن، مشخص شده است که حساسیت سلولهای تومور نسبت به مرگ سلولی القا شده توسط استاتینها به طور معناداری متفاوت است، به طوری که سلولهای AML و نوروبلاستوما حساسیت زیادی دارند، در حالی که سلولهای ALL نسبتاً مقاوم هستند(22، 21).
شواهد روزافزونی نشان میدهند که استاتینها میتوانند
فعالیت ضد تومور سایتوکاینها و داروهای شیمی درمانی را افزایش دهند. برای مثال، گزارش شده که تجویز همزمان لوواستاتین و TNF-α، رشد ردههای سلولی لوسمی و ملانومای موشی را مهار میکند و بقای موشهای دارای تومور را افزایش میدهد(23). هم چنین نشان داده شده است که لوواستاتین، علاوه بر افزایش اثر ضد تومور دوکسوروبیسین، سبب کاهش عوارض مرتبط با تجویز دوکسوروبیسین نیز میشود(24).
با توجه به این پیش زمینه، و نیز با هدف کاهش دوز موثر ATO در جهت کاهش سمیت مرتبط، سیم واستاتین به عنوان کاندید مناسبی جهت ارزیابیهای بیشتر انتخاب شد. در این مطالعه غلظتهای مورد استفاده برای تیمار ترکیبی 24 ساعته، شامل 1 میکرومولار برای ATO و 5 میکرومولار برای SV بود. همان گونه که یافتههای این مطالعه نشان میدهند، داروهای مذکور هر یک به تنهایی توانایی مهار فعالیت متابولیک، کاهش زندهمانی و القای آپوپتوز سلول های NB-4 را دارند، که این اثر در حالت ترکیبی به شکل سینرژیک ازدیاد مییابد.
مکانیسم پیشنهادی برای آپوپتوز به واسطه استاتینها شامل افزایش بیان پروتئینهای پیش آپوپتوزی(مانند Bax ، Bim)، به همراه کاهش بیان پروتئینهای ضد آپوپتوزی (مانند Bcl-2) است. علاوه برآن، نشان داده شده است که فعال شدن کاسپازها در مرگ برنامهریزی شده سلولی به واسطه استاتینها نقش دارند(20). بنابراین در تلاش برای بررسی مکانیسم مولکولی مرگ سلولی، بیان Bax و Bcl-2 در سطح mRNA و به شکل نیمه کمّی در سلولهای NB-4 تیمار شده با ATO، SV، و ATO به همراه SV بررسی گشت. اعضای خانواده Bcl-2 شامل Bax و Bcl-2 از طریق کنترل نفوذپذیری غشای میتوکندری، نقش عمدهای در تنظیم مسیر داخلی آپوپتوز ایفا میکنند. پروتئین Bax از طریق فرآیندهای هترودایمریزاسیون، هومودایمریزاسیون و الیگومریزاسیون بر روی غشای خارجی میتوکندری ایجاد منفذ نموده و سبب خروج سیتوکروم C میشود، که به نوبه خود آبشار کاسپازها را فعال ساخته و منجر به بروز آپوپتوز میگردد. در طرف مقابل، پروتئین Bcl-2 عمدتاً از طریق اتصال به Bax و سایر اعضای پیش آپوپتوزی، مانع فعال شدن آنها شده و در نتیجه از وقوع آپوپتوز جلوگیری میکند(25). در این مطالعه و مطابق انتظار، ATO و SV هم در حالت منفرد و هم در حالت ترکیبی سبب افزایش رونوشت Bax و کاهش رونوشت Bcl-2 شدند. نسبت Bax/Bcl-2 از پیشبینیکنندههای مستقل سرنوشت سلول در مسیر آپوپتوز است و شواهد نشان میدهند که افزایش این نسبت با پیش آگهی مطلوبی در درمان بیماران AML همراه میباشد (26). در این مطالعه تیمار ترکیبی سبب افزایش معنادار در نسبت فوق گشته که میتواند به عنوان نشانهای مطلوب در پاسخ به دارو منظور
گردد(نمودار 3).
نتیجهگیری
نتایج مطالعه حاضر نشان میدهند که SV سبب تحریک
آثار سیتوتوکسیک ATO و تقویت عملکرد پیش آپوپتوزی آن بر روی سلولهای NB-4 میشود. براساس یافتههای این مطالعه و با توجه به گزارشهای متعدد از ایمنی و تحملپذیری بالای SV در بالین، میتوان اظهار داشت SV ممکن است سبب تقویت آثار درمانی ATO در بیماران لوسمی پرومیلوسیتی حاد شود که البته تایید آن به نوبه خود نیازمند مطالعههای بیشتری در این زمینه میباشد.
تشکر و قدردانی
بدین وسیله از دانشگاه علوم پزشکی ایران به جهت تامین بودجه طرح قدردانی میشود.
متن کامل: (2745 مشاهده)
تاثیر سینرژیک سیم واستاتین در افزایش آثار ضد توموری آرسنیک تریاکسید
در رده سلولی لوسمی پرومیلوسیتی حاد انسانی (NB-4)
صمد غنیزاده وصالی1، سعید شیر علی2، فرهاد ذاکر3، سارا محمدی4، ژنی آریانپور1، سید امیر یزدان پرست5
چکیده
سابقه و هدف
تاثیر آرسنیک تریاکسید(ATO)، به عنوان یک ترکیب سمی، در درمان لوسمی پرومیلوسیتی حاد(APL) مورد پذیرش گسترده قرار دارد. با توجه به عوارض مرتبط با دوز بالای ATO، درمان ترکیبی یک روش معقول برای افزایش اثر بخشی ATO میباشد. از این رو در این مطالعه از سیم واستاتین(SV)، داروی کاهنده کلسترول، استفاده و فرض نمودیم که SV به همراه ATO ممکن است سبب تقویت اثرات ATO در دوزهای پایینتر شود.
مواد و روشها
در یک مطالعه تجربی، اثر سایتوتوکسیک ATO و SV (به تنهایی و ترکیبی) بر اساس میزان مهار فعالیت متابولیک در آزمایش MTT ، درصـد زندهمانی با رنگ تریپان بلو، آپوپتوز با فلوسایتومتری و میزان تغییرات در رونوشت ژنهای Bax و Bcl-2 به روش RQ-PCR اندازه گیری شد. از آزمون آماری Student’s t-test و one-way ANOVA و نرمافزار 21SPSS برای تجزیه آماری اطلاعات استفاده شد.
یافتهها
ATO و SV هر یک به طور وابسته به دوز باعث کاهش فعالیت متابولیک سلولهای NB-4 میشوند. علاوه برآن، تیمار ترکیبی سبب کاهش زندهمانی و افزایش جمعیت سلولهای آپوپتوتیک و هم چنین افزایش نسبت Bax/Bcl-2 میگردد.
نتیجه گیری
نتایج نشان میدهند که ATO و SV به شکل همافزایی در القای مرگ سلولی و مهار تکثیر سلولهای NB-4 با یکدیگر همکاری نمودهاند. علاوه برآن، نتایج پیشنهاد میکنند که تیمار ترکیبی باعث افزایش مرگ برنامهریزی شده سلولی احتمالاً از طریق تقویت مسیر داخلی آپوپتوز میشود. در مجموع و با توجه به دادههای حاصل، SV نشان داده است که توان کاهش دوز موثر ATO را دارد.
کلمات کلیدی: لوسمی پرومیلوسیتیک حاد، آرسنیک تری اکسید، سیم واستاتین، آپوپتوز
تاریخ دریافت : 21/12/91
تاریخ پذیرش : 16/7 /92
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات سلولی و مولکولی دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
2- PhD بیوشیمی بالینی ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی جندی شاپور ـ اهواز ـ ایران
3- مؤلف مسؤول: PhD هماتولوژی ـ استاد مرکز تحقیقات سلولی و مولکولی دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران ـ صندوق پستی: 6183-14155
4- کارشناس علوم آزمایشگاهی ـ دانشکده پیراپزشکی دانشگاه آزاد اسلامی واحد پزشکی تهران ـ تهران ـ ایران
5- دکترای قارچشناسی پزشکی ـ دانشیار دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
در رده سلولی لوسمی پرومیلوسیتی حاد انسانی (NB-4)
صمد غنیزاده وصالی1، سعید شیر علی2، فرهاد ذاکر3، سارا محمدی4، ژنی آریانپور1، سید امیر یزدان پرست5
چکیده
سابقه و هدف
تاثیر آرسنیک تریاکسید(ATO)، به عنوان یک ترکیب سمی، در درمان لوسمی پرومیلوسیتی حاد(APL) مورد پذیرش گسترده قرار دارد. با توجه به عوارض مرتبط با دوز بالای ATO، درمان ترکیبی یک روش معقول برای افزایش اثر بخشی ATO میباشد. از این رو در این مطالعه از سیم واستاتین(SV)، داروی کاهنده کلسترول، استفاده و فرض نمودیم که SV به همراه ATO ممکن است سبب تقویت اثرات ATO در دوزهای پایینتر شود.
مواد و روشها
در یک مطالعه تجربی، اثر سایتوتوکسیک ATO و SV (به تنهایی و ترکیبی) بر اساس میزان مهار فعالیت متابولیک در آزمایش MTT ، درصـد زندهمانی با رنگ تریپان بلو، آپوپتوز با فلوسایتومتری و میزان تغییرات در رونوشت ژنهای Bax و Bcl-2 به روش RQ-PCR اندازه گیری شد. از آزمون آماری Student’s t-test و one-way ANOVA و نرمافزار 21SPSS برای تجزیه آماری اطلاعات استفاده شد.
یافتهها
ATO و SV هر یک به طور وابسته به دوز باعث کاهش فعالیت متابولیک سلولهای NB-4 میشوند. علاوه برآن، تیمار ترکیبی سبب کاهش زندهمانی و افزایش جمعیت سلولهای آپوپتوتیک و هم چنین افزایش نسبت Bax/Bcl-2 میگردد.
نتیجه گیری
نتایج نشان میدهند که ATO و SV به شکل همافزایی در القای مرگ سلولی و مهار تکثیر سلولهای NB-4 با یکدیگر همکاری نمودهاند. علاوه برآن، نتایج پیشنهاد میکنند که تیمار ترکیبی باعث افزایش مرگ برنامهریزی شده سلولی احتمالاً از طریق تقویت مسیر داخلی آپوپتوز میشود. در مجموع و با توجه به دادههای حاصل، SV نشان داده است که توان کاهش دوز موثر ATO را دارد.
کلمات کلیدی: لوسمی پرومیلوسیتیک حاد، آرسنیک تری اکسید، سیم واستاتین، آپوپتوز
تاریخ دریافت : 21/12/91
تاریخ پذیرش : 16/7 /92
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات سلولی و مولکولی دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
2- PhD بیوشیمی بالینی ـ استادیار دانشکده پیراپزشکی دانشگاه علوم پزشکی جندی شاپور ـ اهواز ـ ایران
3- مؤلف مسؤول: PhD هماتولوژی ـ استاد مرکز تحقیقات سلولی و مولکولی دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران ـ صندوق پستی: 6183-14155
4- کارشناس علوم آزمایشگاهی ـ دانشکده پیراپزشکی دانشگاه آزاد اسلامی واحد پزشکی تهران ـ تهران ـ ایران
5- دکترای قارچشناسی پزشکی ـ دانشیار دانشکده پیراپزشکی دانشگاه علوم پزشکی ایران ـ تهران ـ ایران
مقدمه
لوسمی پرومیلوسیتی حاد(APL)، زیر گونهای از لوسمی میلوئیدی حاد با تمایل شدید به خونریزی میباشد که توسط حضور جابهجایی کروموزومی t(15-17) مشخص میشود. ناهنجاری سیتوژنتیکی مذکور، سبب اتصال ژن لوسمی پرومیلوسیتی (PML) واقع بر روی کروموزوم 15 به ژن گیرنده آلفا اسید رتینوئیک (RARα) واقع بر روی کروموزوم 17 میشود(1). انکوپروتئین حاصل، باعث مهار نسخهبرداری از ژنهای تمایزی، آپوپتوزی و خود- نوسازی سلول و در نتیجه فزونی سلولهای نابالغ (پرومیلوسیت) در خون و مغز استخوان میگردد(2).
شواهد بسیاری مبنی بر توانایی ضد سرطانی آرسنیک تری اکسید(ATO) بر علیه انواع مختلفی از بدخیمیهای انسانی وجود دارد. مطالعههای In vitro نشان دادهاند که ATO از راههای گوناگون هم چون فعالسازی پروتئینهای پیشآپوپتوزی، سرکوب پروتئینهای ضد آپوپتوزی، افزایش تولید گونههای واکنشپذیر اکسیژن(ROS)، کاهش پتانسیل غشای میتوکندری و فعالسازی کاسپازها، سبب بروز مرگ برنامهریزی شده در سلولهای لوسمیک میشود(3). امروزه ATO به عنوان تک داروی مؤثر در القای رمیسیون در بیماران تازه تشخیص لوسمی پرومیلوسیتیک حاد معرفی گشته است، به طوری که ATO با دوز mg/kg 15/0-10/0، در 90%-85% از موارد تازه تشخیص APL ، سبب دستیابی به رمیسیون مولکولی یا سیتوژنتیکی میشود. با استفاده از این غلظت، بیشتر عوارض گزارش شده خفیف و گذرا بوده و شامل راشهای پوستی، دردهای اسکلتی- عضلانی، سردرد، سرگیجه، افزایش کراتینین، افزایش ترانس آمینازهای کبدی، آریتمی قلبی و در برخی موارد مرگ ناگهانی است(4). نیاز به دوزهای بالاتر در بیماران دچار عود یا لوسمی رفرکتوری از یک سو و افزایش سمیت و عوارض دارو در دوزهای بالاتر از سوی دیگر باعث ایجاد انگیزه در زمینه دستیابی به روشهای درمانی مطلوبتری در بیماران APL گشته است. این موضوع در مورد بیماران سالمند که شیوع بیماریهای هم زمان در آنها سبب محدودیـت توان تحمـل دوزهـای بـالای شیمـی درمانــی
میشود، نمود بیشتری مییابد(5).
سیم واستاتین عضوی از خانواده استاتینها یا داروهای کاهنده کلسترول خون است که هم چون سایر اعضای این خانواده، با مهار رقابتی آنزیم 3- هیدروکسی-3 متیل گلوتاریل کوآنزیم A (HMG-CoA) ردوکتاز در مسیر موالونات، از ساخت کلسترول جلوگیری میکند(6). اعضای این خانواده شامل لو واستاتین، سیم واستاتین و پرا واستاتین به عنوان مشتقهای طبیعی حاصل از فرآیند تخمیر قارچها و در مقابل فلو واستاتین، آتور واستاتین، سری واستاتین، روسو واستاتین و پیتا واستاتین به عنوان مشتقهای صناعی از این خانواده محسوب میشوند(7). استاتینها آثار چندگانهای(پلئوتروپیک) هم چون مهار التهاب، تنظیم آنژیوژنز، مهار رشد و ایجاد مرگ سلولی در ردههای سلولی مختلفی از تومورهای انسانی را دارند(12-8). هم چنین نشان داده شده است که استاتینها در In vitro باعث توقف رشد در فاز G1/S در تومورهای بافت توپر و بدخیمیهای خونی میشوند(14، 13). علاوه برآن، مطالعهها نشان دادهاند که استاتینها در In vivo نیز سبب توقف تکثیر سلولهای AML در موشهای SCID و مهار رشد تومورهای روده در موشها میشوند(16، 15).
امروزه استفاده از درمان ترکیبی یا پلیتراپی از جمله راه حلهای پذیرفته شده در مدیریت بالینی بدخیمیهای مقاوم و غلبه بر محدودیتهای توکسیک دارویی است (17). با توجه به خاصیت اثبات شده دو دارو در القای آپوپتوز، هدف از مطالعه پیش رو بررسی اثر ترکیبی SV و ATO در مهار رشد و القای مرگ برنامهریزی شده سلولهای NB-4 میباشد.
مواد و روشها
کشت و تیمار رده سلولی NB-4 با آرسنیک تریاکسید و سیم واستاتین:
سلول NB-4 مورد استفاده در این مطالعه تجربی، از بانک سلولی انستیتو پاستور ایران و به شکل ویال تهیه شد. تایید رده سلولی NB-4 با بررسی وجود رونوشت PML-RARa و با روش RT-PCR انجام پذیرفت. سلولهای NB-4 در محیط کشت RPMI-1640 محتوی 10% سرم(FBS)، U/mL 100 پنیسیلین و µg/mL 100 استرپتومایسین در شرایط دمایی 37 درجه سانتیگراد و فشار 5% گاز CO2 کشت داده شدند. در این مطالعه تجربی، رقتهای مختلفی (0 ، 5/0 ، 5/1 و 2 میکرومولار) از آمپول As2O3 (سینا دارو) در محیط کشت RPMI-1640 فاقد FBS تهیه شد. هم چنین با حل کردن پودر سیم واستاتین(سیگما- آلدریچ) در DMSO ، استوک دارو تهیه و رقتهای مختلف(0، 5، 10، 15 و 20 میکرومولار) آن در محیط RPMI-1640 فاقد FBS فراهم شد. میزان برابری از DMSO به نمونههای کنترل اضافه شد که در این حالت غلظت نهایی DMSO متجاوز از 1% از حجم نهایی نبود.
بررسی تاثیرات سایتوتوکسیک ATO و SV :
برای بررسی تاثیرات سایتوتوکسیک و تعیین مقادیر IC50 داروهای مذکور، از روش رنگسنجی MTT استفاده شد. اساس آزمایش بر مبنای توانایی سلولهای زنده در احیای نمک محلول تترازولیوم بروماید و تبدیل آن به رسوب فورمازان است. به همین منظور، 100 میکرولیتر سوسپانسیون حاوی 103 * 5 عدد از سلولهای NB-4 که در فاز رشد لگاریتمی بودند به هر چاهک از پلیت 96 خانهای منتقل شد، سپس به هر چاهک، از رقتهای µM 20-5 داروی SV و رقتهای µM 2-5/0 داروی ATO اضافه گشت. به دنبال 48 ساعت مواجهه با دارو، تترازولیوم بروماید (سیگما) با غلظت نهایی mg/mL 5/0 در محیط RPMI-1640 تهیه و به هر چاهک اضافه گشت و به مدت 4-3 ساعت در شرایط کشت انکوبه شد. سپس پلیت را سانتریفیوژ نموده و پس از دور ریختن مایع رویی، به رسوب ته پلیت 100 میکرولیتر DMSO اضافه گردید. در نهایت خوانش جذب نوری چاهکها در طول موج 570 نانومتر انجام گرفت. به منظور برآورد اثر مهار از فرمول زیر استفاده شد:

بررسی درصد زندهمانی سلولها:
جهت ارزیابی درصد سلولهای زنده از رنگ تریپانبلو (TB) به روش Trypan Blue Dye Exclusion استفاده شد. اساس آزمایش بر مبنای توانایی سلولهای زنده در خارجسازی رنگ TB میباشد. برای انجام این آزمایش تعدادی برابر از سلولها در پلیتهای 6 خانهای کشت داده شدند و شمارش و ارزیابی زندهمانی آنها پس از 24 ساعت تیمار با داروهای ATO و SV با استفاده از لام نئوبار و میکروسکوپ نوری انجام پذیرفت. درصد زندهمانی مربوط به هر دوز با استفاده از فرمول زیر به شکل درصدی از زندهمانی کنترل(سلولهای تیمار نشده) محاسبه و در نمودار 1 به نمایش درآمده است(نمودار 1).

بررسی آپوپتوز با فلوسایتومتری:
برای ارزیابی کمّی آپوپتوز در سلولهای NB-4 مواجهه شده با ATO و SV ، از کیت Annexin V FITC/PI assay (رُوش) استفاده شد. از هر دوز، تعداد 106 * 1 سلول با PBS شسته شده، پس از به سوسپانسیون درآوردن، بر اساس دستورالعمل کیت در دمای اتاق به مدت 15 دقیقه در µL 100 محلول کار حاوی آنکسین و پروپیدیم یدید انکوبه شدند و سپس با دستگاه فلوسایتومتری مورد بررسی قرار گرفتند.
استخراج RNA و ساخت cDNA :
استخراج RNA توسط کیت High Pure RNA Isolation Kit (رُوش) مطابق دستورالعمل شرکت سازنده انجام شد. در مرحله بعد، RNA استخراج شده به طور کمی و کیفی مورد ارزیابی قرار گرفته و مقدار µg 1 از RNA برای ساخت cDNA توسط کیت cDNA Synthesis Kit (رُوش) استفاده شد.
بررسی بیان ژنها توسط RQ-PCR :
بـرای بـررسی کمّـی بیـان ژنها به روش RQ-PCR ، از دستگـاه Step One Plus (بیوسیستـــم) و کیت SYBER

نمودار 1: تیمار ترکیبی با ATO و SV سبب مهار فعالیت متابولیکی سلولهای NB-4 میشود. در تیمار ترکیبی، SV با دوز 5 میکرومولار سبب افزایش معناداری در اثر بخشی دوز 1 میکرومولار ATO گشته است، به گونهای که تقریباً با دوز 2 میکرومولار ATO برابری میکند.
جدول 1: توالی آغازگرها و طول قطعات تکثیر شده
| ژن | آغازگر مستقیم | آغازگر معکوس | اندازه (bp) |
| HPRT | TGGACAGGACTGAACGTCTTG | CCAGCAGGTCAGCAAAGAATTTA | 111 |
| Bax | CCCGAGAGGTCTTTTTCCGAG | CCAGCCCATGATGGTTCTGAT | 155 |
| Bcl-2 | CGGTGGGGTCATGTGTGTG | CGGTTCAGGTACTCAGTCATCC | 90 |
Green PrecisionTM 2X qPCRMastermix (PrimerDesign) استفاده شد. واکنشهای PCR در حجم نهایی 20 میکرولیتر شامل µL 17 میکس، µL1 آغازگر (غلظت 1 پیکومول) و µL 2 از cDNA مربوطه انجام گرفت. چرخه دمایی شامل یک مرحله 95 درجه سانتیگراد به مدت 10 دقیقه برای فعالسازی آنزیم و متعاقب آن 45 چرخه دمایی شامل 95 درجه سانتیگراد به مدت 15 ثانیه (واسرشتگی)، 60 درجه سانتیگراد به مدت 15 ثانیه (اتصال آغازگر به هدف)، 72 درجه سانتیگراد به مدت 15 ثانیه(تکثیر) انجام شد.
پس از آن مرحله منحنی دمای ذوب(Melting Curve) انجام شد تا از تکثیر اختصاصی رشته DNA هدف، اطمینان حاصل شود.
طراحی آغازگرها با استفاده از نرمافزار Gene Runner و
تایید آنها با نرمافزار تحت وب Primer-BLAST انجام گرفت(جدول 1). تغییرات قیاسی در سطح mRNA با روش Comparative Ct (بدون نیاز به منحنی استاندارد) محاسبه شد که برای این منظور از ژن هیپوگزانتین فسفوریبوزیل ترانسفراز(HPRT) برای نرمالیزه کردن بیان ژنها و نمونه تیمار نشده به عنوان نمونه مرجع استفاده شد.
تجزیه و تحلیل آماری:
در مطالعه پیش رو، تمامی آزمایشها به شکل سه آزمون مستقل(Triplicate) انجام گرفته و نتایج به صورت میانگین ± انحراف معیار(SD) نمایش داده شده است. برای محاسبات آماری و رسم منحنی، از نرمافزار 21 SPSS و روش Student’s t-test و one-way ANOVA استفاده شد. مقادیـر p کمتر از 05/0 معنادار در نظر گرفته شدند (05/0P < *، 01/0P < **، 001/0P < ***).
یافتهها
اثر سینرژیک ATO وSV بر روی سلولهای NB-4 :
پس از تیمار سلولها با غلظت های مختلف ATO و SV ، میزان اثر هر یک به تنهایی و در حالت ترکیبی به روش MTT بررسی شد(جدول 2 و نمودار 1). سپس با استفاده از نرمافزار GraphPad Prism ، مقدار غلظت مهاری 50% (IC50) برای داروهای ATO و SV بعد از 24 ساعت تیمار به ترتیب µM 8/1 و µM 2/13 به دست آمد. در ادامه به روش Chou شاخص ترکیب(Combination Index; CI) بر اساس غلظتهای IC50 محاسبه گشت (833/0CI=) که مبین اثر سینرژیسم داروها بود(1CI< ) (18).
جدول 2: تاثیر مهاری سیم واستاتین بر روی فعالیت متابولیک سلولهای NB-4 . سلولها به مدت 24 ساعت تحت تیمار با غلظتهای نشان داده شده از دارو قرار گرفتند و به روش MTT بررسی شدند.
با توجه به نتایج به دست آمده، غلظت µM 5 سیم واستاتین و µM 1 آرسنیک تریاکسید برای ادامه کار انتخاب شدند. همان گونه که در نمودار 1 مشاهده میشود، SV در غلظت 5 میکرومولار، توانایی افزایش درصد مهارکنندگی ATO در غلظت 1 میکرومولار را دارد (01/0P< ).
کاهش درصد زندهمانی سلولها به دنبال تیمار ترکیبی ATO و SV :
پـس از 24 ساعـت تیمـار سلولهـا با دوزهای انتخاب
شده، حدود 20 میکرولیتر از سلولها، با رنگ تریپان بلو مجاور شدند و پس از شمارش سلولها، درصد زندهمانی آنها محاسبه شد(نمودار 2). همان گونه که انتظار میرفت نتایج نشاندهنده کاهش چشمگیر زندهمانی سلولها به دنبال تیمار ترکیبی ATO و SV بودند.
SV سبب افزایش حساسیت سلولها به آپوپتوز القا شده توسط ATO میگردد:
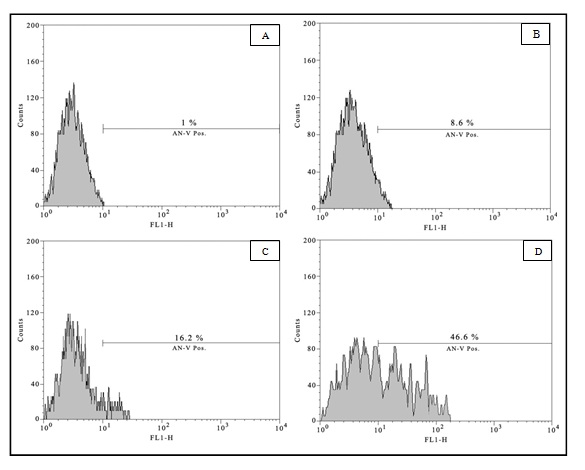
برای بررسی بیشتر آثار تیمار ترکیبی داروهای SV و ATO ، از تغییرات در اکسترنالیزه شدن فسفاتیدیل سرین به عنوان معیاری مناسب در شناسایی آپوپتوز استفاده شد. جمعیت آنکسین- 5 مثبت و PI منفی نشاندهنده سلولهایی میباشد که در مراحل ابتدایی آپوپتوز(Early Apoptotic) قرار دارند، سلولهایی که واجد تمامیت غشایی برای خارجسازی PI و در عین حال تغییرات آپوپتوتیک غشایی هم چون اکسترنالیزه شدن فسفاتیدیل سرین هستند. همان گونه که در شکل 1 نمایش داده شده است پـس از 24 ساعت تیمار، SV (5 میکرومولار)، ATO (1 میکرومولار)، و ترکیب آن دو به ترتیب سبب القای آپوپتوز در 7/1 ± 1/9 ، 75/2 ± 9/15 و 2 ± 7/47 درصد از سلولهای NB-4 میگردند.
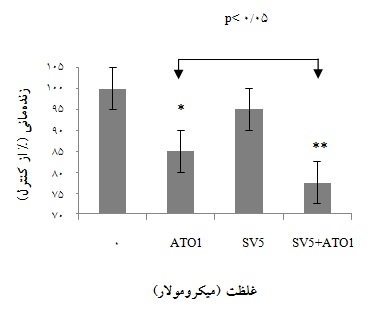
نمودار 2: میزان زندهمانی سلولها بعد از تیمار ترکیبی با ATO و SV کاهش یافت. ATO وSV ، در مقایسه با کنترل، هر یک به تنهایی میزان زندهمانی را به ترتیب حدود 08/15% و 8/5% کاهش میدهند، که این میزان در حالت ترکیب به 4/23% افزایش مییابد.
پس از آن مرحله منحنی دمای ذوب(Melting Curve) انجام شد تا از تکثیر اختصاصی رشته DNA هدف، اطمینان حاصل شود.
طراحی آغازگرها با استفاده از نرمافزار Gene Runner و
تایید آنها با نرمافزار تحت وب Primer-BLAST انجام گرفت(جدول 1). تغییرات قیاسی در سطح mRNA با روش Comparative Ct (بدون نیاز به منحنی استاندارد) محاسبه شد که برای این منظور از ژن هیپوگزانتین فسفوریبوزیل ترانسفراز(HPRT) برای نرمالیزه کردن بیان ژنها و نمونه تیمار نشده به عنوان نمونه مرجع استفاده شد.
تجزیه و تحلیل آماری:
در مطالعه پیش رو، تمامی آزمایشها به شکل سه آزمون مستقل(Triplicate) انجام گرفته و نتایج به صورت میانگین ± انحراف معیار(SD) نمایش داده شده است. برای محاسبات آماری و رسم منحنی، از نرمافزار 21 SPSS و روش Student’s t-test و one-way ANOVA استفاده شد. مقادیـر p کمتر از 05/0 معنادار در نظر گرفته شدند (05/0P < *، 01/0P < **، 001/0P < ***).
یافتهها
اثر سینرژیک ATO وSV بر روی سلولهای NB-4 :
پس از تیمار سلولها با غلظت های مختلف ATO و SV ، میزان اثر هر یک به تنهایی و در حالت ترکیبی به روش MTT بررسی شد(جدول 2 و نمودار 1). سپس با استفاده از نرمافزار GraphPad Prism ، مقدار غلظت مهاری 50% (IC50) برای داروهای ATO و SV بعد از 24 ساعت تیمار به ترتیب µM 8/1 و µM 2/13 به دست آمد. در ادامه به روش Chou شاخص ترکیب(Combination Index; CI) بر اساس غلظتهای IC50 محاسبه گشت (833/0CI=) که مبین اثر سینرژیسم داروها بود(1CI< ) (18).
جدول 2: تاثیر مهاری سیم واستاتین بر روی فعالیت متابولیک سلولهای NB-4 . سلولها به مدت 24 ساعت تحت تیمار با غلظتهای نشان داده شده از دارو قرار گرفتند و به روش MTT بررسی شدند.
| غلظت سیم واستاتین (میکرومولار) | میزان مهار فعالیت متابولیک (انحراف معیار ± درصد از کنترل) |
| 5 | 7/1 ± 62/25 |
| 10 | 3/2 ± 56/40 |
| 15 | 1/3 ± 80/54 |
| 20 | 5/1 ± 54/66 |
با توجه به نتایج به دست آمده، غلظت µM 5 سیم واستاتین و µM 1 آرسنیک تریاکسید برای ادامه کار انتخاب شدند. همان گونه که در نمودار 1 مشاهده میشود، SV در غلظت 5 میکرومولار، توانایی افزایش درصد مهارکنندگی ATO در غلظت 1 میکرومولار را دارد (01/0P< ).
کاهش درصد زندهمانی سلولها به دنبال تیمار ترکیبی ATO و SV :
پـس از 24 ساعـت تیمـار سلولهـا با دوزهای انتخاب
شده، حدود 20 میکرولیتر از سلولها، با رنگ تریپان بلو مجاور شدند و پس از شمارش سلولها، درصد زندهمانی آنها محاسبه شد(نمودار 2). همان گونه که انتظار میرفت نتایج نشاندهنده کاهش چشمگیر زندهمانی سلولها به دنبال تیمار ترکیبی ATO و SV بودند.
SV سبب افزایش حساسیت سلولها به آپوپتوز القا شده توسط ATO میگردد:
برای بررسی بیشتر آثار تیمار ترکیبی داروهای SV و ATO ، از تغییرات در اکسترنالیزه شدن فسفاتیدیل سرین به عنوان معیاری مناسب در شناسایی آپوپتوز استفاده شد. جمعیت آنکسین- 5 مثبت و PI منفی نشاندهنده سلولهایی میباشد که در مراحل ابتدایی آپوپتوز(Early Apoptotic) قرار دارند، سلولهایی که واجد تمامیت غشایی برای خارجسازی PI و در عین حال تغییرات آپوپتوتیک غشایی هم چون اکسترنالیزه شدن فسفاتیدیل سرین هستند. همان گونه که در شکل 1 نمایش داده شده است پـس از 24 ساعت تیمار، SV (5 میکرومولار)، ATO (1 میکرومولار)، و ترکیب آن دو به ترتیب سبب القای آپوپتوز در 7/1 ± 1/9 ، 75/2 ± 9/15 و 2 ± 7/47 درصد از سلولهای NB-4 میگردند.

نمودار 2: میزان زندهمانی سلولها بعد از تیمار ترکیبی با ATO و SV کاهش یافت. ATO وSV ، در مقایسه با کنترل، هر یک به تنهایی میزان زندهمانی را به ترتیب حدود 08/15% و 8/5% کاهش میدهند، که این میزان در حالت ترکیب به 4/23% افزایش مییابد.

شکل 1: تیمار ترکیبی سبب افزایش جمعیت سلولهای آپوپتوتیک میشود. هیستوگرامهای فوق جمعیت سلولهای آنکسین- 5 مثبت(و PI منفی) را به دنبال مواجهه با سیم واستاتین(B)، آرسنیک تریاکسید(C)و آرسنیک تریاکسید به همراه سیم واستاتین(D) در قیاس با کنترل(A) نمایش داده است(در مقایسه جمعیت سلولهای آنکسین-5 مثبت گروه C با گروه D ، P کمتر از 01/0 میباشد).

نمودار 3: تاثیر تیمار ترکیبی آرسنیک تریاکسید و سیم واستاتین بر روی بیان ژنهای Bax و Bcl-2 در رده سلولی NB-4. اعداد زیر نمودار مربوط به میانگین بیان ژنها میباشند و نمودار فوق بر اساس میانگین ± انحراف معیار رسم شده است. همان گونه که در نمودار مشخص است، SV به طور معناداری سبب تقویت اثر ATO در افزیش بیان Bax و کاهش بیان Bcl-2 گشته است(05/0p<). نسبت بیان Bax به Bcl-2 نیز در حالت ترکیب(ATO+SV) حدود 2 برابر ATO به تنهایی میباشد(001/0P<)(نسبت Bax به Bcl-2 پس از مواجهه با ATO ، SV و ATO+SV به ترتیب 2/3 ، 5/1 و 6/6 است).
تیمار ترکیبی سبب تقویت مسیر داخلی آپوپتوز میشود. برای ارزیابی مکانیسم آپوپتوز القا شده توسط دو دارو، بیان دو ژن پیش آپوپتوزی Bax و ضد آپوپتوزی Bcl-2 مورد ارزیابی قرار گرفته و نسبت آنها به عنوان شاخص میتوکندریال آپوپتوز در پاسخ به دارو در نظر گرفته شدند. چنانچه در نمودار 3 مشاهده میگردد، آرسنیک تریاکسید و سیم واستاتین هر یک به تنهایی سبب افزایش بیان Bax و کاهش بیان Bcl-2 میگردند و این اثر در حالت تیمار ترکیبی به وضوح افزایش مییابد. هم چنین نسبت Bax/Bcl-2 در حالت تیمار ترکیبی، افزایش معناداری نسبت به دوزهای منفرد SV و ATO داشته است.
بحث
امروزه به رغم پیشرفتهای انجام گرفته، دریچه امید به درمان با استفاده از داروهای ضد سرطان شامل داروهای سیتوتوکسیک نظیر آرسنیک تریاکسید هم چنان بسیار باریک است. در اکثر موارد، بیماران با دوزهایی که به بیشینه دوز قابل تحمل(MTD) نزدیک است درمان میشوند. بنابراین، نیاز به یافتن ترکیبی که بتواند به طور بالینی مورد استفاده قرار گیرد و آثار جانبی شیمی درمانی بر بافتهای طبیعی را محدود سازد، احساس میشود. در این مطالعه به بررسی اثر تیمار ترکیبی داروهای SV و ATO بر روی رده سلولی لوسمی پرومیلوسیتی حاد NB-4، واجد جابه جایی کروموزومیt(15;17)، پرداخته شد.
شواهد محکمی وجود دارد مبنی بر این که ATO مسیرهای پیامرسانی بیشماری را متاثر ساخته و منجر به تغییرات گسترده در عملکرد سلول میشود به گونهای که آثاری هم چون بروز آپوپتوز، توقف رشد و مهار آنژیوژنز را برجای میگذارد(19). هم چنین مطالعههای متعددی به اثر پیش آپوپتوزی استاتینها اشاره داشتهاند. برای مثال، هایندلر و همکارانش نشان دادند که استاتینها باعث ایجاد مرگ آپوپتوتیک در سلولهای مشتق از لوسمی میلومونوسیتیک جوانان، بدخیمیهای بافت توپر کودکان (رابدومیوسارکوما و مدولوبلاستوما)، مزوتلیوم بدخیم، آستروسیتوما و سرطان سلولهای سنگفرشی میشوند(20). علاوه برآن، مشخص شده است که حساسیت سلولهای تومور نسبت به مرگ سلولی القا شده توسط استاتینها به طور معناداری متفاوت است، به طوری که سلولهای AML و نوروبلاستوما حساسیت زیادی دارند، در حالی که سلولهای ALL نسبتاً مقاوم هستند(22، 21).
شواهد روزافزونی نشان میدهند که استاتینها میتوانند
فعالیت ضد تومور سایتوکاینها و داروهای شیمی درمانی را افزایش دهند. برای مثال، گزارش شده که تجویز همزمان لوواستاتین و TNF-α، رشد ردههای سلولی لوسمی و ملانومای موشی را مهار میکند و بقای موشهای دارای تومور را افزایش میدهد(23). هم چنین نشان داده شده است که لوواستاتین، علاوه بر افزایش اثر ضد تومور دوکسوروبیسین، سبب کاهش عوارض مرتبط با تجویز دوکسوروبیسین نیز میشود(24).
با توجه به این پیش زمینه، و نیز با هدف کاهش دوز موثر ATO در جهت کاهش سمیت مرتبط، سیم واستاتین به عنوان کاندید مناسبی جهت ارزیابیهای بیشتر انتخاب شد. در این مطالعه غلظتهای مورد استفاده برای تیمار ترکیبی 24 ساعته، شامل 1 میکرومولار برای ATO و 5 میکرومولار برای SV بود. همان گونه که یافتههای این مطالعه نشان میدهند، داروهای مذکور هر یک به تنهایی توانایی مهار فعالیت متابولیک، کاهش زندهمانی و القای آپوپتوز سلول های NB-4 را دارند، که این اثر در حالت ترکیبی به شکل سینرژیک ازدیاد مییابد.
مکانیسم پیشنهادی برای آپوپتوز به واسطه استاتینها شامل افزایش بیان پروتئینهای پیش آپوپتوزی(مانند Bax ، Bim)، به همراه کاهش بیان پروتئینهای ضد آپوپتوزی (مانند Bcl-2) است. علاوه برآن، نشان داده شده است که فعال شدن کاسپازها در مرگ برنامهریزی شده سلولی به واسطه استاتینها نقش دارند(20). بنابراین در تلاش برای بررسی مکانیسم مولکولی مرگ سلولی، بیان Bax و Bcl-2 در سطح mRNA و به شکل نیمه کمّی در سلولهای NB-4 تیمار شده با ATO، SV، و ATO به همراه SV بررسی گشت. اعضای خانواده Bcl-2 شامل Bax و Bcl-2 از طریق کنترل نفوذپذیری غشای میتوکندری، نقش عمدهای در تنظیم مسیر داخلی آپوپتوز ایفا میکنند. پروتئین Bax از طریق فرآیندهای هترودایمریزاسیون، هومودایمریزاسیون و الیگومریزاسیون بر روی غشای خارجی میتوکندری ایجاد منفذ نموده و سبب خروج سیتوکروم C میشود، که به نوبه خود آبشار کاسپازها را فعال ساخته و منجر به بروز آپوپتوز میگردد. در طرف مقابل، پروتئین Bcl-2 عمدتاً از طریق اتصال به Bax و سایر اعضای پیش آپوپتوزی، مانع فعال شدن آنها شده و در نتیجه از وقوع آپوپتوز جلوگیری میکند(25). در این مطالعه و مطابق انتظار، ATO و SV هم در حالت منفرد و هم در حالت ترکیبی سبب افزایش رونوشت Bax و کاهش رونوشت Bcl-2 شدند. نسبت Bax/Bcl-2 از پیشبینیکنندههای مستقل سرنوشت سلول در مسیر آپوپتوز است و شواهد نشان میدهند که افزایش این نسبت با پیش آگهی مطلوبی در درمان بیماران AML همراه میباشد (26). در این مطالعه تیمار ترکیبی سبب افزایش معنادار در نسبت فوق گشته که میتواند به عنوان نشانهای مطلوب در پاسخ به دارو منظور
گردد(نمودار 3).
نتیجهگیری
نتایج مطالعه حاضر نشان میدهند که SV سبب تحریک
آثار سیتوتوکسیک ATO و تقویت عملکرد پیش آپوپتوزی آن بر روی سلولهای NB-4 میشود. براساس یافتههای این مطالعه و با توجه به گزارشهای متعدد از ایمنی و تحملپذیری بالای SV در بالین، میتوان اظهار داشت SV ممکن است سبب تقویت آثار درمانی ATO در بیماران لوسمی پرومیلوسیتی حاد شود که البته تایید آن به نوبه خود نیازمند مطالعههای بیشتری در این زمینه میباشد.
تشکر و قدردانی
بدین وسیله از دانشگاه علوم پزشکی ایران به جهت تامین بودجه طرح قدردانی میشود.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





