جلد 22، شماره 3 - ( پائیز 1404 )
جلد 22 شماره 3 صفحات 237-227 |
برگشت به فهرست نسخه ها
Ethics code: IR.TMU.REC.1394.300
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Arjomandnejad M, Rahbarizadeh F. Impact of CAR Structure in Nanobody-Based Constructs on the Cytotoxic Function of CAR-T Cells Targeting CD19⁺ Cells. bloodj 2025; 22 (3) :227-237
URL: http://bloodjournal.ir/article-1-1595-fa.html
URL: http://bloodjournal.ir/article-1-1595-fa.html
ارجمندنژاد مطهره، رهبریزاده فاطمه. تأثیر ساختار CAR در سازههای مبتنی بر نانوبادی بر توانایی سیتوتوکسیک سلولهای CAR-T علیه سلولهای +CD19. فصلنامه پژوهشی خون. 1404; 22 (3) :227-237
استاد دانشکده علوم پزشکی دانشگاه تربیت مدرس ـ گروه بیوتکنولوژی پزشکی
متن کامل [PDF 1070 kb]
(467 دریافت)
| چکیده (HTML) (1051 مشاهده)
مقدمه
بدخیمیهای خونی به ویژه لوسمیها و لنفومها از جمله بیماریهای کشندهای هستند که علیرغم پیشرفتهای درمانی همچنان با نرخ بالای عود و مقاومت دارویی همراهاند (1). روشهای درمانی رایج از جمله شیمیدرمانی، پرتودرمانی و پیوند سلولهای بنیادی، در بسیاری از بیماران پـاسخ کامل و پایداری ایجاد نمیکنند و با عوارض جانبی شدید و کاهش کیفیت زندگی همراه هستند. بنابراین، نیاز به درمانهای دقیقتر و هدفمندتر برای نابودی سلولهای سرطانی احساس میشود (5-2).
در سالهای اخیر، سلولهای T مهندسیشده با گیرندههای کایمریک (CAR-T cells) به عنوان یکی از نوآورانهترین و مؤثرترین روشهای درمانی سرطانهای هماتولوژیک مطرح شدهاند. این سلولها با بهرهگیری از گیرندههای مصنوعی، قادرند سلولهای توموری را مستقل از MHC شناسایی کرده و از بین ببرند. با وجود موفقیتهای CAR-T سلها، محدودیتهایی چون پاسخ ایمنی علیه بخشهای غیرانسانی گیرنـده، پایداری پایین و تجمعات غیراختصاصی وجود دارد (8-6).
برای غلبه بر این مشکلات، استفاده از نـانوبادیها (VHH) به عنوان جایگزین scFv در ساختار CAR پیشنهاد شده است. نانوبادیها قطعات آنتیبادی مشتق از شترسانان هستند که از نظر ساختار تـکدومینی، بسیار پایدار، نفوذپذیر، کمحجم و ایمنتر از scFv ها هستند. این ویژگیها نانوبادیها را به گزینهای جذاب برای طراحی نسل جدید CAR-T سلها تبدیل کرده است. در همین راستا، مطالعههای پیشین صورت گرفته در آزمایشگاه ما نیز قابلیـت نانوبادیها را در هدفگیری مؤثر و اختصاصی سلولهای سرطانی تأیید کردهاند؛ از جمله این مطالعهها میتوان به طراحی CAR های مبتنی بر نانوبادی علیه آنتیژنهای HER2، CD19 و MUC1 اشاره کرد که در آنها سلولهای T مهندسی شده با گیرندههای VHH توانستند کارآیی سیتوتوکسیک قابل مقایسه یا حتی بالاتری نسبت به سازههای رایج از خود نشان دهند (11-9).
در پروژه حاضر، از نانوبادی ضد CD19 که توسط دکتر بنیهاشم تولید و مشخصهیابی شده بود، برای طراحی ساختار گیرنده کایمریک استفاده شد(12). CD19 آنتیژنی است که به صورت اختصاصی بر سطح سلولهای B بیان میشود و در اکثر بدخیمیهای B سلولی مانند ALL و DLBCL بیشبیان میگردد. هدف اصلی این پژوهش، طراحی و تولید CAR-T سلهایی با گیرنده نانوبادی ضد CD19 و بررسی عملکرد اختصاصی آنها در شناسایی و از بین بردن سلولهای CD19⁺ در شرایط آزمایشگاهی بود. این تحقیق گامی مؤثر در جهت ارتقاء کارایی، ایمنی و پایداری سلولهای CAR-T و ارائه جایگزینی مناسب برای گیرنـدههای مرسوم در ایمونوتراپی سرطانهای خونی بهشمار میرود.
مواد و روشها
ردههای سلولی و محیطهای کشت:
محیطهای کشت سلولی: محیطهای کشت RPMI1640 (Glu+) و DMEM از شرکت جیبکو، ImmunoCult™-XF T Cell Expansion Medium از شرکت StemCell Technologies تهیه گردیدند.
FBS : از شرکت جیبکو خریداری و به منظور غیرفعالسازی سیستم کمپلمان و سایر عوامل مخرب پروتئینی به مدت 30 دقیقه در دمای 56 درجه سانتیگراد در بنماری حرارت داده شد.
محیط فریز کردن سلولها: از ترکیب 10% DMSO و 90% FBS برای ذخیرهسازی همه ردههای سلولی استفاده شد.
ردههای سلولی Raji (بیانکننده CD19) و K562 (فاقد CD19) از بانک سلولی ATCC تهیه شدند.
تولید ذرات ویروسی حامل سازه CAR:
در این تحقیق برای تولید ذرات ویروسی حاوی ژن کایمریک از وکتورهای لنتیویروسی نسل سوم (Self Inactivating) هدیه از آزمایشگاه دکتر فلات استفاده شد. پس از تأیید صحت توالی سازههای طراحیشده، استخراج پلاسمیدها با استفاده از کیت کیاژن Midiprep مطابق با دستورالعمل شرکت سازنده انجام شد. پلاسمیدهای استخراج شده جهت تولید لنتی ویروسهای حامل گیرنده کایمریـک (CAR) به مرکز Viral Vector Core دانشگاه ماساچوست ارسال شدند (13).
جداسازی سلولهای T از خون محیطی اهداکننده سالم و فعالسازی آنها:
جهت جـداسازی سلولهای T از خون محیطی افراد سالم، از کیت RosetteSep™ Human T Cell Enrichment Cocktail مطابق بـا دستورالعمل شرکت سازنده استفاده شد. نمونههای خونی از دو زن 67 و 31 ساله و سه مرد 77، 41 و 35 ساله جمعآوری گردید. پس از جداسازی، تعداد 106×1 سلول در هر چاهک از پلیتهای 48 خانهای در حجم 1 میلیلیتر از محیط کشتImmunoCult™-XF T Cell Expansion Medium کشت داده شدند. به منظور فعالسازی سلولهای T، عوامل تحریککننده شامل ImmunoCult Human CD2/CD3/CD28 T cell Activator و سیتـوکاینهای IL-
21 ، IL-15 وIL-7 به محیط کشت اضافه شده و سلولهــا
به مدت ۴۸ ساعت در انکوباتور نگهداری شدند.
ترانسفکت کردن سلولهای T :
به طور خلاصه، محلول رترونکتین با غلظت 30 میکروگرم بر میلیلیتر در PBS رقیق شد و به میزان 500 میکرولیتر از این محلول به هر چاهک از پلیتهای 24 چاهکی تیمار نشده اضافه گردید. پلیتها به مدت 2 ساعت در دمای اتاق انکوبه شدند. سپس محلول رترونکتین خارج شد و 500 میکرولیتر محلول بلاکینگ شاملHanks' balanced salt solution (HBSS) به همراه BSA 2 درصد بـه هر چاهک افزوده شد. پلیتها به مدت 30 دقیقه در دمای اتاق انکوبه شدند و سپس محلول بلاکینگ خارج گردید و چاهکها با محلول HBSS حاوی BSA 5/2 % شست و شو شدند. لنتیویروسها بهسرعت ذوب و به هر چاهک پوشش دادهشده با رترونکتین با نسبت تکثیر عفونی (MOI : Multi plicity of infection) برابر با 20 در محیط کشت سلول T (1 میلیلیتر بهازای هر چاهک) اضافه شدند. پلیتها بـه مدت 2 ساعت در g 2000 و دمای 32 درجه سانتیگراد سانتریفیوژ شدند و سپس یک میلیون سلول تحریکشده در ازاء هر چاهک به پلیتهای پوشش داده شده با رترونکتین اضافه شدند و به مدت 30 دقیقه در g 1000 و 32 درجه سانتیگراد سانتریفیوژ شدند و در نهایت به مدت یک شب در دمای 37 درجـه سانتیگراد انکوبه شدند. عمل ترانسداکشن روز بعد تکرار شد و پلیتها یک شب دیگر انکوبه شدند (14).
تکثیر سلولهای T حاوی سازه CAR با استفاده از سلولهای مغذی:
برای آمادهسازی سلولهای مغذی، از سلولهای PBMC (Peripheral blood mononuclear cells) تازه جدا شده از فرد سالم و همچنین رده سلولی TM-LCL (هدیهای از آزمایشگاه دکتر جنسن) استفاده شد. به منظور مهار تکثیر، سلولهای PBMC و TM-LCL به ترتیب تحت تابش با دوزهای 35 Gy و 8 Gy قرار گرفتند. ۲۴ ساعت پس از ترانسفکشن سلولهای T با لنتیویروسهای حاوی سازه CAR، سلولهای مغذی به همراه محیط کشت تازه حاوی سیتوکـاینهای IL-21، IL-15 وIL-7 به محیط کشت اضافه شد. به منظور حفظ شرایط رشد و تحریک مناسب، دو سوم محیط کشت هر دو روز یک بار با محیط تازه حاوی همان سیتوکاینها تعویض شد.
بررسی قابلیت کشندگی سلولهای T حاوی سازه CAR با استفاده از تست لوسیفراز:
در این روش، از دو رده سلولی Raji و k562 کـه بـه طور
پایدار بیانکننده لوسیفراز بودند، به عنوان سلولهای هدف استفاده شد. سلولهای T ترانسدوسشده با سازه CAR به مدت ۲۴ ساعت با سلولهای هدف، با نسبت ۱۰ به ۱ )سلول هدف به سلول (T ، همکشتی داده شد. پس از این مدت، سوبسترای دی لوسیفرین به محیط کشت افزوده شد و پس از ۱۰ دقیقه انکوباسیون، میزان نور تولید شده به عنوان شاخصی از زندهمانی سلولهای هدف و در نتیجه کارآیی کشندگی سلولهای T اندازهگیری گردید. نقطه مرجع 100% لیز با کشت سلولهای هدف در محلول SDS %1 به عنوان MINSDS تعیین شد. نقطه مرجع 0% لیز (MAXmedia) با کشت سلولهای هدف در محیط کشت بدون سلولهای T مشخص گردید. درصد سیتوتوکسیسیتی سلولهای CAR-T با استفاده از فرمول زیر محاسبه شد (15):
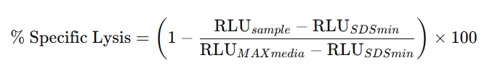
RLU: Relative Luminescence Unit یا واحد نسبی نور
RLU sample : مقدار RLU برای نمونه مورد نظر
RLUSDSMIN : مقدار RLU حاصل از لیز کامل سلول ها در حضور SDS(کنترل مثبت)
RLUMAXmedia : مقدار RLU در شرایط پایه (سلول ها در محیط کشت بدون تیمار؛ کنترل منفی)
مقادیر خـارج از بازه 0% تا 100% که بهعلت نوسانات فنی-زیستی و محدودیتهای کنترلها رخ میدهند، مطابق رویه رایج، تنها به 0% یا 100% کپ شدند و سایر دادهها بدون تغییر گزارش گردیدند.
فلو سیتومتری:
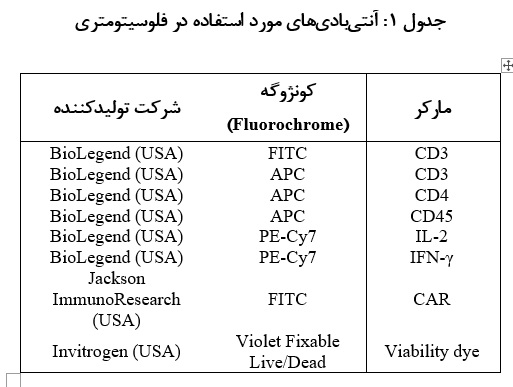
در روز سوم پس از ترانسداکشن، سلولها با آنتیبـادیهای کونژوگه فلورسانت رنگآمیزی شدند (جدول 1). سپس نمونهها با دستگاه فلوسیتومتر مدل LSRII مورد تحلیل قرار گرفتند و دادههای به دست آمده با استفاده از نرمافزار FlowJo تحلیل و تفسیر شدند.
سنجش تولید اینترفرون-گاما و اینترلوکین-2 توسط سلولهای T مهندسی شده:
به منظور ارزیابی تولید سیتوکاینهای اینترلوکین-2 و اینترفرون-گاما در سلولهای CAR-T، این سلولها به مدت یک شب با سلولهای هدف همکشتی داده شدند. در چهار ساعت پایانی کشت، به محیط موننسین (Monensin) افزوده شد تا از ترشح سیتوکاین جلوگیری شود و سپس انکوباسیون ادامه یافت. در ادامه، سلولها با آنتیبادیهای کونژوگـه ضد اینترلوکین-2 و اینترفرون-گـاما رنگآمیزی داخل سلولی شده و با استفاده از فلوسیتومتری مورد تحلیل قرار گرفتند. همچنین، مایع رویی کشت برای سنجش مقدار ترشح شده اینترلوکین-2 و اینترفرون-گاما با استفاده از کیت ELISA (Invitrogen) بررسی شد.
تحلیل آماری دادهها:
تجزیـه و تحلیل دادههای تجربی با استفاده از نرمافزار GraphPad Prism انجام شد. برای مقایسه میان گروهها از آزمونهای آماری ANOVA یک طرفه و دو طرفه و همچنین آزمون T مستقل استفاده گردید. اختلافـات با مقدار p کمتر از 05/0 معنادار در نظر گرفته شدند.
یافتهها
افزایش کارآیی ترانسداکشن و بیان گیرنده کایمریک در سلولهای T با استفاده از سلولهای مغذی و سیتوکایــنها:
جهت طراحی گیرندههای کایمریک (CAR) مورد استفاده در این مطالعه، از نـانوبادیهای اختصاصی علیه آنتیژن CD19 استفاده شد. این نانوبادیها پیشتر توسط دکتر بنیهـاشم از میان مجموعهای از نانوبادیهای مشتق از شترسانان جداسازی و مشخصهیابی شده بودند. در میان آنها، دو نانوبادی H2 و H85 بالاترین میزان اتصال (affinity) به CD19 را نشان دادند و در ساختار گیرندههای CAR مورد استفاده قرار گرفتند.
هر دو سازه طراحی شده شامل ناحیه شناساییکننده آنتیژن (نـانوبادی)، ناحیه لولا (hinge)، نـاحیه ترانس ممبران (CD3، 4-1BB و یا هر دو) و نـاحیه سیگنالدهنده داخل سلولیCD3 بودند که به صورت توالی ژنی در پلاسمیدهای لنتیویروسی کلون شدند. بررسی کیفیت سلولهای T توسط فلوسیتومتری و مقایسه آن با سلولهای PBMCs جدا شده از خون نشان میدهد که پس از جداسازی حدود 95% سلولها حاوی CD3+ میباشند که در مقایسه با سلولهای PBMCs (%45) میزان خلوص 2 برابر افزایش یافته است (شکل A-1). بـا توجه به پایین بودن سطح بیان گیرنده کایمریک (CAR) در سلولهای T پس از ترانسداکشن اولیه با وکتور ویروسی، از یـک دستورالعمل بهینهسازی شده برای تکثیر و گسترش سلولهای ترانسداکت شده بهره گرفته شد. در این دستورالعمل، به منظور بهبود زندهمانی، رشد، و القای بیان پایدار سازه در سلولهای T، از سلولهای مغذی استفاده گردید. بدین ترتیب، سلولهای T ترانسداکت شده در مجاورت سلولهای مغذی که پیشتر با اشعه گاما غیرتکثیرپذیر شده بودند، در محیط کشت حاوی ترکیب سیتوکاینهای IL-21، IL-15 وIL-7 بـه مدت ۱۲ روز انکوبه شدند (شکل B-1).
برای صحتسنجی نقش سلولهای مغذی در بهبود بیان، گروه کنترلی از سلولهای T ترانسداکت شده بدون تیمار سلولهای مغذی نیز به صورت هم زمان تجزیه و تحلیل گردید. نتایج حاصل از آنالیز فلوسیتومتری نشان داد که گروه دریـافتکننده سلولهای مغذی، حدود ۱۲ درصد افزایش در سطح بیان گیرنده CAR نسبت به گروه کنترل داشتهاند (شکل C-1).
این افزایش بیان به ویژه در سلولهای زنده، که با gating اختصاصی در نمودار فلوسیتومتری تفکیک شدهاند، مشهود بود. این یافته تأکیدی بر نقش کلیدی محیط همکشت و سیگنالهـای همافزای سلولهای مغذی و سیتوکاینها در ارتقاء کارآیی ترانسداکشن و بیان پایـدار گیرندههای کایمریک در سلولهای Tمیباشد.
تولید اینترفرون-گاما توسط CAR-T های حاوی نانوبادی H85 و H2 در مواجهه با CD19:
یکی از ویژگیهای کلیدی سلولهای CAR-T، توانایی آنها در تولید سیتوکـاینهای التهابی از جمله اینترفرون-گاما (IFN-γ) در پاسخ به شناسایی آنتیژن هدف است. این پاسخ سیتوکاینی نقش مهمی در تحریک سیستم ایمنی و القای مرگ سلولهای توموری دارد و به عنوان یکی از شاخصهای مهم ارزیابی عملکرد سلولهای CAR-T مورد استفاده قرار میگیرد (16).
در این مطالعه، به منظور ارزیـابی عملکرد سیتوکاینی سلولهای مهندسیشده، میزان تولید اینترفرون-گاما در شرایط مختـلف از طریق دو روش مکمل شامل فلوسیتومتری داخلسلولی و آزمون الایزا (ELISA) بررسی گردید. در این آزمایشها، سلولهای CAR-T با سلولهای هدف دارای آنتیژن CD19 (سلولهایRaji ) و نیز با سلولهای فاقد CD19 (سلولهای K562) انکوبه شدند. همچنین، یک گروه بدون سلول هدف بـه عنوان کنترل منفی برای بررسی سطح پایهای تولید سیتوکاین در نظر گرفته شد، و تحریـک با آنتیبادیهای CD3/CD28 نیز به عنوان کنتـرل مثبت به منظور ارزیابی کلی عملکرد سلولهای T انجام شد.
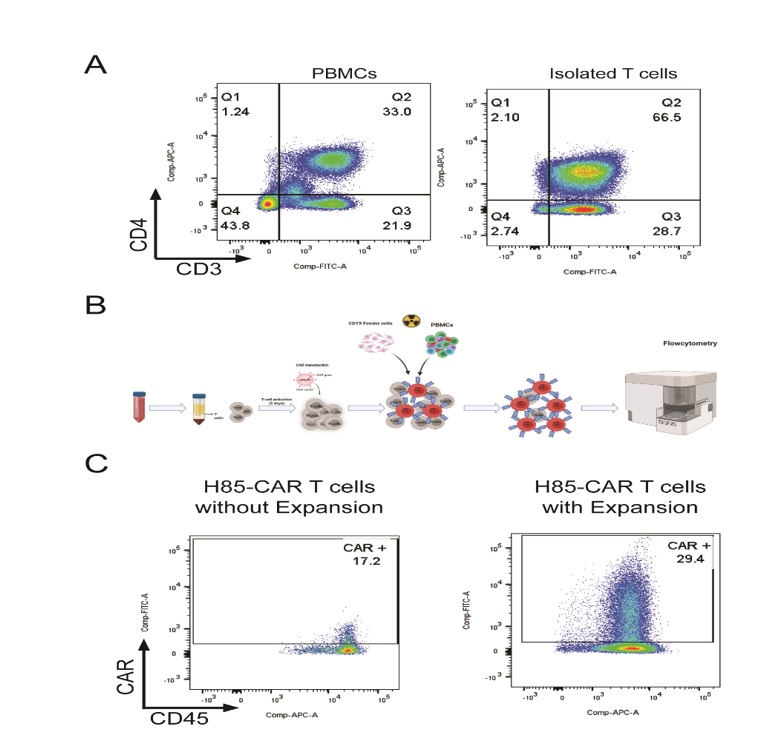
شکل 1: ارزیابی تکثیر و بیان گیرنده در سلولهای CAR-T. A) تحلیل فلوسیتومتری سلولهای PBMC پیش و پس از جداسازی سلولهای T؛ پیش از جداسازی حدود 55% سلولها از نوع T بوده و پس از جداسازی خلوص سلولهای T به حدود 95% افزایش یافت. تنها سلولهای زنده در نمودار نمایش داده شدهاند. B) نمای کلی از فرآیند تکثیر سلولهای CAR-T پس از ترانسداکشن و کشت در حضور سیتوکاینها و سلولهای مغذی. C) نمودار فلوسیتومتری نشاندهنده بیان گیرنده CAR در سلولهای T مهندسی شده، با و بدون فرآیند تکثیر. نتایج نشان میدهد میزان بیان CAR پس از تکثیر تقریباً دو برابر افزایش یافته است. تنها سلولهای زنده در نمودار نمایش داده شدهاند.
شکل 3: طراحی و ارزیابی عملکرد سازههای مختلف CAR-T بر پایه نانوبادی. A) نمای شماتیک از ساختار سازههای مختلف CAR طراحیشده در این مطالعه. B) طرح کلی نحوه انجام آزمون سیتوتوکسیسیتی در همکشتی با سلولهای هدف. C) نتایج مقایسه سیتوتوکسیسیتی دو سازه نسل سوم حاوی نانوبادیهای H2 و H85. D) مقایسه عملکرد سازههای نسل دوم حاوی نانوبادی H2 با لولای کوتاه در برابر لولای بلند در آزمایش سیتوتوکسیسیتی. E) ارزیابی تفاوت عملکرد بین سازههای نسل دوم و سوم CAR حاوی نانوبادی H2 در آزمایش سیتوتوکسیسیتی. سلولهای هدف شامل Raji (حاوی آنتیژن CD19) و K562 (فاقد آنتیژن CD19) بودند. نمودارها بر اساس دادههای حاصل از سه دهنده مستقل تهیه شدهاند که هر آزمایش برای هر دهنده در شش تکرار انجام شده است. نمودارها بر اساس میانگین ± SEM ترسیم شدهاند. تجزیه و تحلیل آماری با استفاده از آزمون دوطرفه ANOVA (2-way ANOVA) انجام شد. ns: غیرمعنادار 9999/0 p>)؛ * 05/0 p< ؛ ** 005/0 p< ؛ *** 0001/0 p= ؛ **** 0001/0 p< .
در مجموع، این نتایج نشان میدهند که طراحی مناسب نانوبادی، طول ناحیه لولا و نوع نسل سازه CAR میتواند نقش مهمی در بهینهسازی عملکرد کشندگی سلولهای CAR-T ایفا کند.
بحث
نتایج حاصل از این مطالعه نشان داد که طراحی و تولید سلولهای CAR-T بر پایه نانوبادی ضد CD19 میتواند منجر به القای پاسخهای ایمنی اختصاصی و کارآمد علیه سلولهای B بدخیم شود. برخلاف ساختارهای رایج مبتنی برscFv، که معمولاً از آنتیبادیهای کامل انسانی یا موشی مشتق میشوند و مستعد تشکیل دیمرهای ناپایدار و القای پاسخهای ایمنی هستند، نانوبادیها (VHH) به واسطه انـدازه کوچک (~15 kDa)، ساختار تک دومینی، پایداری حرارتی بالا و قابلیت بیان مؤثر در سلولهای پستانداران و حتی پروکـاریوتها، جایگزینی مطلوب برای افزایش پایداری و عملکرد CAR محسوب میشوند (17، 11).
در مطالعه حاضر، جـایگزینی scFv با نانوبادی منجر به افزایش بیـان گیرنده در سطح سلولهای Tو تقویت پـاسخهای عملکردی علیه سلولهای CD19+ گردید. یافتههای این مطالعه در راستای گزارش اخیر منتشر شده توسط نصیری و همکاران نیز قرار دارد، که در آن نشان داده شد سلولهای T مهندسی شده با گیرنده کایمریک مبتنی بر نانوبادی ضد CD19 (VHH-CAR) دارای کارآیی کشندگی توموری مشابه با سلولهای CAR-T کلاسیک بر پایه scFv (FMC63) هستند، بدون آن که تفاوت معناداری در تولید سیتوکاین یا توان تکثیر مشاهده شود (10). همراستایی دادههـای ما با این گزارش، به ویژه در زمینه اثربخشی عملکردی، بیان سطحی CAR و پایداری سلولی، نشان میدهد که نـانوبادیها میتوانند جایگزینی مؤثر و ایمن برای scFv در طراحی نسلهـای جدید سلولهای CAR-T بـاشند و گزینهای جذاب برای کاهش پیچیدگی ساختاری، بهبود نفوذ بافتی و کاهش ایمنیزایی تلقی شوند. افزون بر این، مطالعههای متعددی نیز مزایای مشابهی برای نانوبادیها گزارش کردهاند، از جمله کاهش ایمنیزایی، بهبود نفوذ به بافتهای توموری، و توانایی هدفگیری آنتیژنهایی با دسترسی محدود یا اپیتوپهای مخفیشده، که در طراحیهای مبتنی بر scFv بهسختی قابل دستیابی هستند (19، 18).
از سوی دیگر، استفاده از نـانوبادیها با حذف ناحیه linker میان زنجیرههای سنگین و سبک، خطر mispairing یا جفت شدن نامناسب را نیز کاهش میدهد که در بسیاری از scFvهـا دیده میشود و موجب کاهش کارآیی یا حتی القای سیگنالهای نامناسب میگردد. همچنین نانوبادیها به واسطه توانایی مهندسی بالا و قابلیت ادغام در فرمتهای دو گانه یا چند گانه هدفگیری آنتیژن، فرصتهایی جدید برای توسعه نسلهای بعدی CAR-T فراهم میکنند (20).
یکی از یـافتههای مهم این پژوهش، عملکرد برتر سازه حاوی نانوبادی H85 نسبت به H2 در القای پاسخ سیتوکاینی، به ویژه اینترفرون-گاما، و افزایش کشندگی در برابر سلولهای CD19+بود. این تفاوت عملکردی میتواند نـاشی از ویژگیهای متفاوت اتصال آنتیژنی، پایداری فضایی، یـا توانایی فعالسازی مؤلفههای سیگنالدهی پایین دستی در این دو نانوبادی باشد. جالب توجه است که سطوح تولید اینترلوکین-2 بین دو سازه تفاوت معناداری نداشت، که ممکن است نشاندهنده تفاوت در مسیرهای سیگنالدهی وابسته به نوع سیتوکاین یا تفاوت در آستانه تحریـک باشد. این یافته با گزارشهای پیشین از جمله مطالعه بنیهاشم و همکاران همراستا است که نشان دادند نـانوبادی H85 دارای تمایل اتصال (affinity) بالاتری به CD19 نسبت به H2 میباشد (12). همچنین، مشاهدات مشابهی در مطالعههای دیگری مانند مائو و همکـاران نیز گزارش شده است که در آن، تفاوتهای عملکردی میان CAR هایی با دامنههای شناسایی مختلف مورد بررسی قرار گرفته بود (21).
افزون بر این، تحلیل سازههای مختلف نشان داد کـه طول ناحیه لولا و نوع اجزای سیگنالدهی داخلسلولی اثر تعیینکنندهای بر عملکرد نهایی سلولهای CAR-T دارند. در مقایسه سازههایی با لولاهای کوتاه و بلند و طراحیهای نسل دوم و سوم، سازه حاوی لولای کوتاه و طراحی نسل دوم (مشتمل بر دومـینهای CD28 وCD3ζ ) توان سیتوتوکسیک قویتری در برابر سلولهای CD19+ از خود نشان داد. این یـافته با نتایج مطالعههای پیشین همسو است که در آن نشان داده شد طول و انعطافپذیری نـاحیه لولا میتواند فاصله فیزیکی میان CAR و آنتیژن هدف را تنظیم کرده و در نتیجه بر نحوه سیناپس ایمنی و شدت سیگنالدهی اثرگذار باشد (24-22). نقش لولا نه تنها در تنظیم فـاصله فضایی، بلکه در پایداری گیرنده، آنتیژنگیری و در دسترسبودن دامنه شناسایی نیز اهمیت دارد. گزارشهـای دیگر نیز نشان دادهاند که طول بیش از حد لولا ممکن است با کاهش ثبات ساختاری و اختلال در انتقال سیگنال همراه باشد، در حالیکه لولاهای کوتاهتر میتوانند تعامـل مؤثرتری میان CAR و آنتیژن ایجاد کنند (26، 25).
از منظر طراحی داخل سلولی، نتایج مطالعه ما نشان داد کـه نوع دومینهای سیگنالدهی نقش تعیینکنندهای در عملکرد نهایی سلولهای CAR-T دارد. مقایسه میان سازههای نسل دوم و سوم حاکی از آن بود که، علیرغم پیچیدگی بیشتر طراحی نسل سوم که به طور معمول شامل دو دومین هم تحریکی مانند CD28و 4-1BB میبـاشد، سازه نسل دوم (CD3ζ و CD28) در این مطالعه پاسخ سیتوتوکسیک قویتری از خود نشان داد. این تفاوت میتواند ناشی از تداخل یا تعارض در مسیرهای سیگنالدهی همزمان باشد، که موجب کاهش شدت پاسخ اولیه یا تأخیر در فعالسازی سلول میشود؛ موضوعی که پیشتر نیز در مطالعهها مطرح شده است (28، 27). در برخی گزارشها، مانند مطالعه ژائو و همکاران، سازههای نسل سوم مزایایی نظیر پایداری عملکردی طولانیتر و کاهش خستگی سلولی را در شرایط مزمن نشان دادهاند (29، 27). با این حال، در زمینه درمانهـای نیازمند پاسخ فوری و قوی، همچون بدخیمی سلولهای B با بیان بالای CD19، ممکن است طراحی نسل دوم با پاسخ سریعتر و مؤثرتر، عملکرد بهتری ارائه دهد.
افزون بر این، مطالعاتی نظیرلانگ و همکاران نیز نشان دادهانـد که نوع دومین هم تحریکی نه تنها بر قدرت و دوام پاسخ اثر میگذارد، بلکه بر ویژگیهای حـافظهای، بقای درونتنی، و سطح بیان سیتوکاینها نیز تأثیرگذار است (30). دادههای ما این موضوع را تأیید میکند، بـه گونهای که سازه نسل دوم در شرایط آزمایشگاهی پاسخ کشندگی بهتری نسبت به نسل سوم ارائه داد. این یافتهها بر اهمیت انتخـاب هدفمند دومینهای داخلسلولی بر اساس نوع بیماری، شدت آنتیژن و هدف درمانی تأکید دارد.
در مجموع، یافتههای مـا بر اهمیت طراحی ساختاری دقیق در سازههای CAR تأکید دارد و نشان میدهد که انتخاب هدفمند نوع دامنه شناسایی، طول لولا و دومینهای سیگنالدهی داخلسلولی باید با در نظر گرفتن توازن میان شدت پاسخ اولیه، دوام طولانی مدت و اجتناب از خستگی سلولی صورت گیرد. این ملاحظات میتوانند به بهینهسازی کارآیی درمـانی سلولهای CAR-T، به ویژه در مواجهه با تومورهای مقاوم یا محیطهای سرکوبگر ایمنی، کمک شایانی نمایند.
نتیجهگیری
در مجموع، مطالعه حاضر نشان داد که سلولهای CAR-T مبتنی بر نـانوبادی ضد CD19 میتوانند به طور مؤثری سلولهای B بدخیم را شناسایی و از بین ببرند. بهکارگیری نانوبادی در ساختار گیرنده کایمریک منجر به افزایش پاسخ سیتوکاینی و کشندگی هدفمند شد و انتخاب نوع نانوبادی، طول نـاحیه لولا و نسل سازه نقش تعیینکنندهای در بهینهسازی عملکرد این سلولها ایفا کردند. این یافتهها پتانسیل بـالای نانوبادیها را به عنوان جایگزینی مؤثر برای scFv در نسلهای آینده سلولهای CAR-T نشان میدهد و میتوانـد راه را برای طراحی درمانهای ایمنتر و مؤثرتر در سرطانهای خونی هموار سازد.
حمایت مالی
این پژوهش به عنوان بخشی از رساله دکتری و بـا حمایت مالی دانشکده علوم پزشکی دانشگاه تربیت مدرس انجام شده است.
ملاحظات اخلاقی
این مطالعه توسط کمیته اخلاق دانشگاه تربیت مدرس مجوز گرفته است (IR.TMU.REC.1394.300).
عدم تعارض منافع
نویسندگان اظهار کردند در انتشار این مقاله، هیچ گونه منافع تجاری نداشتند.
نقش نویسندگان
مطهره ارجمندنژاد: طراحی مطالعه، ایده پردازی، انجام آزمایشها، بررسی و تحلیل دادهها، نگارش و ویرایش مقاله.
دکتر فاطمه رهبریزاده: طراحی مطالعه، ایده پردازی، بررسی و نظارت بر انجام آزمایشها، نگارش و ویرایش مقاله.
تشکر و قدردانی
این پژوهش به عنوان بخشی از رساله دکتری و بـا حمایت مالی دانشکده علوم پزشکی دانشگاه تربیت مدرس انجام شده است.
بدینوسیله مراتب سپاس و قدردانی صمیمانه خود را از دانشگاه University of Massachusetts Chan Medical School، (دکتر Terence Flotte و دکتر Allison Keeler)، به دلیل نقش مؤثرشان در پیشبرد این پژوهش ابراز میداریم.
متن کامل: (221 مشاهده)
تأثیر ساختار CAR در سازههای مبتنی بر نانوبادی بر توانایی سیتوتوکسیک سلولهای CAR-T علیه سلولهای CD19+
مطهره ارجمندنژاد1 ، فاطمه رهبریزاده2
1- دانشجوی دکترای دانشگاه تربیت مدرس ـ دانشکده علوم پزشکی ـ گروه بیوتکنولوژی پزشکی ـ تهران ـ ایران
2- PhD بیوشیمی بالینی ـ استاد دانشگاه تربیت مدرس ـ دانشکده علوم پزشکی ـ گروه بیوتکنولوژی پزشکی ـ تهران ـ ایران
1- دانشجوی دکترای دانشگاه تربیت مدرس ـ دانشکده علوم پزشکی ـ گروه بیوتکنولوژی پزشکی ـ تهران ـ ایران
2- PhD بیوشیمی بالینی ـ استاد دانشگاه تربیت مدرس ـ دانشکده علوم پزشکی ـ گروه بیوتکنولوژی پزشکی ـ تهران ـ ایران

 http://dx.doi.org/10.61186/bloodj.22.1.54 Citation: Arjomandnejad M, Rahbarizadeh F. Impact of CAR Structure in Nanobody-Based Constructs on the Cytotoxic Function of CAR-T Cells Targeting CD19⁺ Cells. J Iran Blood Transfus. 2025: 22 (3): 227-237 نویسنده مسئول: دکتر فاطمه رهبریزاده. استاد دانشگاه تربیت مدرس - دانشکده علوم پزشکی - گروه بیوتکنولوژی پزشکی - تهران - ایران صندوق پستی: 111-14115 E-mail:
کد اخلاق: IR.TMU.REC.1394.300 |
چکیده سابقه و هدف در سالهای اخیر، درمان با سلولهای T مهندسی شده با گیرنده کایمریک (CAR-T) تحولی چشمگیر در درمان سرطانهای خونی، به ویژه بدخیمیهای B سلول مانند ALL و لنفومهای غیر هوچکینی ایجاد کرده است. بیشترCARها از ناحیه متغیر زنجیره آنتیبادیها ((scFvs) single-chain variable fragments) به عنوان بخش شناساییکننده آنتیژن استفاده میکنند، اما محـدودیتهایی مانند پایداری پایین، تجمع ناپایدار و ایمنیزایی بالا، توجهها را به سوی جایگزینهایی مانند نانوبادیها (VHH) جلب کرده است. در این مطالعه، سلولهایCAR-T مجهز به گیرنده نانوبادی ضد CD19 طراحی و ساخته شد و توانایی اختصاصی آنها در شناسایی و حذف سلولهای CD19⁺ در شرایط آزمایشگاهی مورد ارزیابی قرار گرفت. مواد و روشها در این مطالعه تجربی، ساختار CAR حاوی نانوبادی ضد CD19 طراحی و در قالب نسل دوم و سوم، با دومینهای CD28 و 4-1BB ساخته شد. سازهها در وکتور لنتیویروسی کلون شده و به سلولهایT انسانی ترانسداکت شدند. پس از بررسی راندمان ترانسداکشن با فلوسیتومتری، عملکرد سلولهای مهندسی شده در مواجهه با سلولهای CD19+ از نظر بیان مارکرهای فعالسازی، ترشح سیتوکاین (اینترفرون-گاما و اینترلوکین-2) و سمیت سلولی ارزیابی شد. تحلیل دادههای تجربی با استفاده از نرمافزار GraphPad prism و مقایسه گروهها با آزمونهای ANOVA یک طرفه و دو طرفه و آزمون t انجام شد. یافتهها سلولهای CAR-T تولید شده بیان بالایی از گیرنده را نشان داده و در مواجهه با سلولهای CD19+، پاسخ سیتوکاینی و سمیت اختصاصی داشتند. در مقابل، نسبت به سلولهای CD19- پاسخ نداشتند. تفاوت عملکرد بین لولاهای کوتاه و بلند و نیز بین نسل دوم و سوم نشاندهنده اهمیت طراحی ساختاری در بهینهسازی عملکرد است. نتیجه گیری این مطالعه که توسط نخستین تیم پژوهشی در ایران توسعه دهنده سازههای CAR مبتنی بر نانوبادی ضد CD19 انجام شد، نشان میدهد این رویکرد میتواند جایگزینی ایمن و کارآمد برای scFv-CAR ها باشد و چشمانداز عملی برای بهبود درمانهای مبتنی بر سلولهای CAR-T فراهم کند. کلمات کلیدی: CAR-T سل تراپی، آنتیبادیهای تکدومینی، آنتیژن CD19 |
مقدمه
بدخیمیهای خونی به ویژه لوسمیها و لنفومها از جمله بیماریهای کشندهای هستند که علیرغم پیشرفتهای درمانی همچنان با نرخ بالای عود و مقاومت دارویی همراهاند (1). روشهای درمانی رایج از جمله شیمیدرمانی، پرتودرمانی و پیوند سلولهای بنیادی، در بسیاری از بیماران پـاسخ کامل و پایداری ایجاد نمیکنند و با عوارض جانبی شدید و کاهش کیفیت زندگی همراه هستند. بنابراین، نیاز به درمانهای دقیقتر و هدفمندتر برای نابودی سلولهای سرطانی احساس میشود (5-2).
در سالهای اخیر، سلولهای T مهندسیشده با گیرندههای کایمریک (CAR-T cells) به عنوان یکی از نوآورانهترین و مؤثرترین روشهای درمانی سرطانهای هماتولوژیک مطرح شدهاند. این سلولها با بهرهگیری از گیرندههای مصنوعی، قادرند سلولهای توموری را مستقل از MHC شناسایی کرده و از بین ببرند. با وجود موفقیتهای CAR-T سلها، محدودیتهایی چون پاسخ ایمنی علیه بخشهای غیرانسانی گیرنـده، پایداری پایین و تجمعات غیراختصاصی وجود دارد (8-6).
برای غلبه بر این مشکلات، استفاده از نـانوبادیها (VHH) به عنوان جایگزین scFv در ساختار CAR پیشنهاد شده است. نانوبادیها قطعات آنتیبادی مشتق از شترسانان هستند که از نظر ساختار تـکدومینی، بسیار پایدار، نفوذپذیر، کمحجم و ایمنتر از scFv ها هستند. این ویژگیها نانوبادیها را به گزینهای جذاب برای طراحی نسل جدید CAR-T سلها تبدیل کرده است. در همین راستا، مطالعههای پیشین صورت گرفته در آزمایشگاه ما نیز قابلیـت نانوبادیها را در هدفگیری مؤثر و اختصاصی سلولهای سرطانی تأیید کردهاند؛ از جمله این مطالعهها میتوان به طراحی CAR های مبتنی بر نانوبادی علیه آنتیژنهای HER2، CD19 و MUC1 اشاره کرد که در آنها سلولهای T مهندسی شده با گیرندههای VHH توانستند کارآیی سیتوتوکسیک قابل مقایسه یا حتی بالاتری نسبت به سازههای رایج از خود نشان دهند (11-9).
در پروژه حاضر، از نانوبادی ضد CD19 که توسط دکتر بنیهاشم تولید و مشخصهیابی شده بود، برای طراحی ساختار گیرنده کایمریک استفاده شد(12). CD19 آنتیژنی است که به صورت اختصاصی بر سطح سلولهای B بیان میشود و در اکثر بدخیمیهای B سلولی مانند ALL و DLBCL بیشبیان میگردد. هدف اصلی این پژوهش، طراحی و تولید CAR-T سلهایی با گیرنده نانوبادی ضد CD19 و بررسی عملکرد اختصاصی آنها در شناسایی و از بین بردن سلولهای CD19⁺ در شرایط آزمایشگاهی بود. این تحقیق گامی مؤثر در جهت ارتقاء کارایی، ایمنی و پایداری سلولهای CAR-T و ارائه جایگزینی مناسب برای گیرنـدههای مرسوم در ایمونوتراپی سرطانهای خونی بهشمار میرود.
مواد و روشها
ردههای سلولی و محیطهای کشت:
محیطهای کشت سلولی: محیطهای کشت RPMI1640 (Glu+) و DMEM از شرکت جیبکو، ImmunoCult™-XF T Cell Expansion Medium از شرکت StemCell Technologies تهیه گردیدند.
FBS : از شرکت جیبکو خریداری و به منظور غیرفعالسازی سیستم کمپلمان و سایر عوامل مخرب پروتئینی به مدت 30 دقیقه در دمای 56 درجه سانتیگراد در بنماری حرارت داده شد.
محیط فریز کردن سلولها: از ترکیب 10% DMSO و 90% FBS برای ذخیرهسازی همه ردههای سلولی استفاده شد.
ردههای سلولی Raji (بیانکننده CD19) و K562 (فاقد CD19) از بانک سلولی ATCC تهیه شدند.
تولید ذرات ویروسی حامل سازه CAR:
در این تحقیق برای تولید ذرات ویروسی حاوی ژن کایمریک از وکتورهای لنتیویروسی نسل سوم (Self Inactivating) هدیه از آزمایشگاه دکتر فلات استفاده شد. پس از تأیید صحت توالی سازههای طراحیشده، استخراج پلاسمیدها با استفاده از کیت کیاژن Midiprep مطابق با دستورالعمل شرکت سازنده انجام شد. پلاسمیدهای استخراج شده جهت تولید لنتی ویروسهای حامل گیرنده کایمریـک (CAR) به مرکز Viral Vector Core دانشگاه ماساچوست ارسال شدند (13).
جداسازی سلولهای T از خون محیطی اهداکننده سالم و فعالسازی آنها:
جهت جـداسازی سلولهای T از خون محیطی افراد سالم، از کیت RosetteSep™ Human T Cell Enrichment Cocktail مطابق بـا دستورالعمل شرکت سازنده استفاده شد. نمونههای خونی از دو زن 67 و 31 ساله و سه مرد 77، 41 و 35 ساله جمعآوری گردید. پس از جداسازی، تعداد 106×1 سلول در هر چاهک از پلیتهای 48 خانهای در حجم 1 میلیلیتر از محیط کشتImmunoCult™-XF T Cell Expansion Medium کشت داده شدند. به منظور فعالسازی سلولهای T، عوامل تحریککننده شامل ImmunoCult Human CD2/CD3/CD28 T cell Activator و سیتـوکاینهای IL-
21 ، IL-15 وIL-7 به محیط کشت اضافه شده و سلولهــا
به مدت ۴۸ ساعت در انکوباتور نگهداری شدند.
ترانسفکت کردن سلولهای T :
به طور خلاصه، محلول رترونکتین با غلظت 30 میکروگرم بر میلیلیتر در PBS رقیق شد و به میزان 500 میکرولیتر از این محلول به هر چاهک از پلیتهای 24 چاهکی تیمار نشده اضافه گردید. پلیتها به مدت 2 ساعت در دمای اتاق انکوبه شدند. سپس محلول رترونکتین خارج شد و 500 میکرولیتر محلول بلاکینگ شاملHanks' balanced salt solution (HBSS) به همراه BSA 2 درصد بـه هر چاهک افزوده شد. پلیتها به مدت 30 دقیقه در دمای اتاق انکوبه شدند و سپس محلول بلاکینگ خارج گردید و چاهکها با محلول HBSS حاوی BSA 5/2 % شست و شو شدند. لنتیویروسها بهسرعت ذوب و به هر چاهک پوشش دادهشده با رترونکتین با نسبت تکثیر عفونی (MOI : Multi plicity of infection) برابر با 20 در محیط کشت سلول T (1 میلیلیتر بهازای هر چاهک) اضافه شدند. پلیتها بـه مدت 2 ساعت در g 2000 و دمای 32 درجه سانتیگراد سانتریفیوژ شدند و سپس یک میلیون سلول تحریکشده در ازاء هر چاهک به پلیتهای پوشش داده شده با رترونکتین اضافه شدند و به مدت 30 دقیقه در g 1000 و 32 درجه سانتیگراد سانتریفیوژ شدند و در نهایت به مدت یک شب در دمای 37 درجـه سانتیگراد انکوبه شدند. عمل ترانسداکشن روز بعد تکرار شد و پلیتها یک شب دیگر انکوبه شدند (14).
تکثیر سلولهای T حاوی سازه CAR با استفاده از سلولهای مغذی:
برای آمادهسازی سلولهای مغذی، از سلولهای PBMC (Peripheral blood mononuclear cells) تازه جدا شده از فرد سالم و همچنین رده سلولی TM-LCL (هدیهای از آزمایشگاه دکتر جنسن) استفاده شد. به منظور مهار تکثیر، سلولهای PBMC و TM-LCL به ترتیب تحت تابش با دوزهای 35 Gy و 8 Gy قرار گرفتند. ۲۴ ساعت پس از ترانسفکشن سلولهای T با لنتیویروسهای حاوی سازه CAR، سلولهای مغذی به همراه محیط کشت تازه حاوی سیتوکـاینهای IL-21، IL-15 وIL-7 به محیط کشت اضافه شد. به منظور حفظ شرایط رشد و تحریک مناسب، دو سوم محیط کشت هر دو روز یک بار با محیط تازه حاوی همان سیتوکاینها تعویض شد.
بررسی قابلیت کشندگی سلولهای T حاوی سازه CAR با استفاده از تست لوسیفراز:
در این روش، از دو رده سلولی Raji و k562 کـه بـه طور
پایدار بیانکننده لوسیفراز بودند، به عنوان سلولهای هدف استفاده شد. سلولهای T ترانسدوسشده با سازه CAR به مدت ۲۴ ساعت با سلولهای هدف، با نسبت ۱۰ به ۱ )سلول هدف به سلول (T ، همکشتی داده شد. پس از این مدت، سوبسترای دی لوسیفرین به محیط کشت افزوده شد و پس از ۱۰ دقیقه انکوباسیون، میزان نور تولید شده به عنوان شاخصی از زندهمانی سلولهای هدف و در نتیجه کارآیی کشندگی سلولهای T اندازهگیری گردید. نقطه مرجع 100% لیز با کشت سلولهای هدف در محلول SDS %1 به عنوان MINSDS تعیین شد. نقطه مرجع 0% لیز (MAXmedia) با کشت سلولهای هدف در محیط کشت بدون سلولهای T مشخص گردید. درصد سیتوتوکسیسیتی سلولهای CAR-T با استفاده از فرمول زیر محاسبه شد (15):
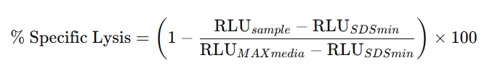
RLU: Relative Luminescence Unit یا واحد نسبی نور
RLU sample : مقدار RLU برای نمونه مورد نظر
RLUSDSMIN : مقدار RLU حاصل از لیز کامل سلول ها در حضور SDS(کنترل مثبت)
RLUMAXmedia : مقدار RLU در شرایط پایه (سلول ها در محیط کشت بدون تیمار؛ کنترل منفی)
مقادیر خـارج از بازه 0% تا 100% که بهعلت نوسانات فنی-زیستی و محدودیتهای کنترلها رخ میدهند، مطابق رویه رایج، تنها به 0% یا 100% کپ شدند و سایر دادهها بدون تغییر گزارش گردیدند.
فلو سیتومتری:
در روز سوم پس از ترانسداکشن، سلولها با آنتیبـادیهای کونژوگه فلورسانت رنگآمیزی شدند (جدول 1). سپس نمونهها با دستگاه فلوسیتومتر مدل LSRII مورد تحلیل قرار گرفتند و دادههای به دست آمده با استفاده از نرمافزار FlowJo تحلیل و تفسیر شدند.

سنجش تولید اینترفرون-گاما و اینترلوکین-2 توسط سلولهای T مهندسی شده:
به منظور ارزیابی تولید سیتوکاینهای اینترلوکین-2 و اینترفرون-گاما در سلولهای CAR-T، این سلولها به مدت یک شب با سلولهای هدف همکشتی داده شدند. در چهار ساعت پایانی کشت، به محیط موننسین (Monensin) افزوده شد تا از ترشح سیتوکاین جلوگیری شود و سپس انکوباسیون ادامه یافت. در ادامه، سلولها با آنتیبادیهای کونژوگـه ضد اینترلوکین-2 و اینترفرون-گـاما رنگآمیزی داخل سلولی شده و با استفاده از فلوسیتومتری مورد تحلیل قرار گرفتند. همچنین، مایع رویی کشت برای سنجش مقدار ترشح شده اینترلوکین-2 و اینترفرون-گاما با استفاده از کیت ELISA (Invitrogen) بررسی شد.
تحلیل آماری دادهها:
تجزیـه و تحلیل دادههای تجربی با استفاده از نرمافزار GraphPad Prism انجام شد. برای مقایسه میان گروهها از آزمونهای آماری ANOVA یک طرفه و دو طرفه و همچنین آزمون T مستقل استفاده گردید. اختلافـات با مقدار p کمتر از 05/0 معنادار در نظر گرفته شدند.
یافتهها
افزایش کارآیی ترانسداکشن و بیان گیرنده کایمریک در سلولهای T با استفاده از سلولهای مغذی و سیتوکایــنها:
جهت طراحی گیرندههای کایمریک (CAR) مورد استفاده در این مطالعه، از نـانوبادیهای اختصاصی علیه آنتیژن CD19 استفاده شد. این نانوبادیها پیشتر توسط دکتر بنیهـاشم از میان مجموعهای از نانوبادیهای مشتق از شترسانان جداسازی و مشخصهیابی شده بودند. در میان آنها، دو نانوبادی H2 و H85 بالاترین میزان اتصال (affinity) به CD19 را نشان دادند و در ساختار گیرندههای CAR مورد استفاده قرار گرفتند.
هر دو سازه طراحی شده شامل ناحیه شناساییکننده آنتیژن (نـانوبادی)، ناحیه لولا (hinge)، نـاحیه ترانس ممبران (CD3، 4-1BB و یا هر دو) و نـاحیه سیگنالدهنده داخل سلولیCD3 بودند که به صورت توالی ژنی در پلاسمیدهای لنتیویروسی کلون شدند. بررسی کیفیت سلولهای T توسط فلوسیتومتری و مقایسه آن با سلولهای PBMCs جدا شده از خون نشان میدهد که پس از جداسازی حدود 95% سلولها حاوی CD3+ میباشند که در مقایسه با سلولهای PBMCs (%45) میزان خلوص 2 برابر افزایش یافته است (شکل A-1). بـا توجه به پایین بودن سطح بیان گیرنده کایمریک (CAR) در سلولهای T پس از ترانسداکشن اولیه با وکتور ویروسی، از یـک دستورالعمل بهینهسازی شده برای تکثیر و گسترش سلولهای ترانسداکت شده بهره گرفته شد. در این دستورالعمل، به منظور بهبود زندهمانی، رشد، و القای بیان پایدار سازه در سلولهای T، از سلولهای مغذی استفاده گردید. بدین ترتیب، سلولهای T ترانسداکت شده در مجاورت سلولهای مغذی که پیشتر با اشعه گاما غیرتکثیرپذیر شده بودند، در محیط کشت حاوی ترکیب سیتوکاینهای IL-21، IL-15 وIL-7 بـه مدت ۱۲ روز انکوبه شدند (شکل B-1).
برای صحتسنجی نقش سلولهای مغذی در بهبود بیان، گروه کنترلی از سلولهای T ترانسداکت شده بدون تیمار سلولهای مغذی نیز به صورت هم زمان تجزیه و تحلیل گردید. نتایج حاصل از آنالیز فلوسیتومتری نشان داد که گروه دریـافتکننده سلولهای مغذی، حدود ۱۲ درصد افزایش در سطح بیان گیرنده CAR نسبت به گروه کنترل داشتهاند (شکل C-1).
این افزایش بیان به ویژه در سلولهای زنده، که با gating اختصاصی در نمودار فلوسیتومتری تفکیک شدهاند، مشهود بود. این یافته تأکیدی بر نقش کلیدی محیط همکشت و سیگنالهـای همافزای سلولهای مغذی و سیتوکاینها در ارتقاء کارآیی ترانسداکشن و بیان پایـدار گیرندههای کایمریک در سلولهای Tمیباشد.
تولید اینترفرون-گاما توسط CAR-T های حاوی نانوبادی H85 و H2 در مواجهه با CD19:
یکی از ویژگیهای کلیدی سلولهای CAR-T، توانایی آنها در تولید سیتوکـاینهای التهابی از جمله اینترفرون-گاما (IFN-γ) در پاسخ به شناسایی آنتیژن هدف است. این پاسخ سیتوکاینی نقش مهمی در تحریک سیستم ایمنی و القای مرگ سلولهای توموری دارد و به عنوان یکی از شاخصهای مهم ارزیابی عملکرد سلولهای CAR-T مورد استفاده قرار میگیرد (16).
در این مطالعه، به منظور ارزیـابی عملکرد سیتوکاینی سلولهای مهندسیشده، میزان تولید اینترفرون-گاما در شرایط مختـلف از طریق دو روش مکمل شامل فلوسیتومتری داخلسلولی و آزمون الایزا (ELISA) بررسی گردید. در این آزمایشها، سلولهای CAR-T با سلولهای هدف دارای آنتیژن CD19 (سلولهایRaji ) و نیز با سلولهای فاقد CD19 (سلولهای K562) انکوبه شدند. همچنین، یک گروه بدون سلول هدف بـه عنوان کنترل منفی برای بررسی سطح پایهای تولید سیتوکاین در نظر گرفته شد، و تحریـک با آنتیبادیهای CD3/CD28 نیز به عنوان کنتـرل مثبت به منظور ارزیابی کلی عملکرد سلولهای T انجام شد.

شکل 1: ارزیابی تکثیر و بیان گیرنده در سلولهای CAR-T. A) تحلیل فلوسیتومتری سلولهای PBMC پیش و پس از جداسازی سلولهای T؛ پیش از جداسازی حدود 55% سلولها از نوع T بوده و پس از جداسازی خلوص سلولهای T به حدود 95% افزایش یافت. تنها سلولهای زنده در نمودار نمایش داده شدهاند. B) نمای کلی از فرآیند تکثیر سلولهای CAR-T پس از ترانسداکشن و کشت در حضور سیتوکاینها و سلولهای مغذی. C) نمودار فلوسیتومتری نشاندهنده بیان گیرنده CAR در سلولهای T مهندسی شده، با و بدون فرآیند تکثیر. نتایج نشان میدهد میزان بیان CAR پس از تکثیر تقریباً دو برابر افزایش یافته است. تنها سلولهای زنده در نمودار نمایش داده شدهاند.
نتایج حاصل از فلوسیتومتری نشان داد که در حضور سلولهای Raji، سلولهای CAR-T حاوی هر دو سازه و نانوبادیهای H2 و H85 به طور چشمگیری تولید اینترفرون-گاما را افزایش دادند؛ به طوری که درصد سلولهـای تولید کننده اینترفرون-گاما در این شرایط به مراتـب بالاتر از شرایط فاقد آنتیژن یا گروه کنترل بـدون محرک بود (شکل A-2). این یافته نشاندهنده پاسخ اختصاصی سلولهای مهندسی شده به حضور آنتـیژن CD19 است.
نکته قابـل توجه دیگر آن است که در مقایسه بین دو سازه طراحی شده، سلولهای حاوی سازه نانوبادی H85 در مواجهه با سلولهای Raji تقریباً دو برابر بیش از سلولهای حـاوی سازه شامل نانوبادی H2، اینترفرون-گاما تولید کردند. این تفاوت معنادار عملکردی میتواند ناشی از ویژگیهای بیولوژیکی بهتر نانوبادی H85 در شناسایی و اتصال به CD19 باشد، که منجر به فعالسازی قویتر مسیرهای سیگنالینگ در سلولهای CAR-T میشود.
نتایج به دست آمده از آزمون ELISA برای اندازهگیری اینترفرون-گاما در مایع رویی کشت نیز این یافتهها را تایید کرد و همراستا با دادههای فلوسیتومتری نشان داد که سلولهای حاوی سازه H85 در مواجهه با سلولهای Raji، مقادیر بیشتری از این سیتوکـاین را ترشح میکنند (شکل B-2).
همچنین در آنالیز فلوسیتومتری، تنها سلولهای زنده مورد تحلیل قرار گرفتند تـا از صحت دادهها و حذف نویز ناشی از سلولهای مرده اطمینان حاصل شود. در مجموع، این دادهها مؤید آن است که سازه حاوی نانوبادی H85 از نظر القای پاسخ عملکردی در سلولهایT، اثربخشی بالاتری نسبت به H2 دارد و میتواند گزینه مناسبی برای توسعه نسل جدیدی از سلولهای CAR-T بر پایه نانوبادیها باشد.
افزایش تولید سیتوکـاینها، بهویژه اینترلوکین-2، یکی از شاخصهای کلیدی فعالسازی سلولهای T مهندسی شده با گیرنده کایمریک (CAR-T) پس از شناسایی آنتیژن هدف میبـاشد. به منظور بررسی عملکرد سازههای طراحی
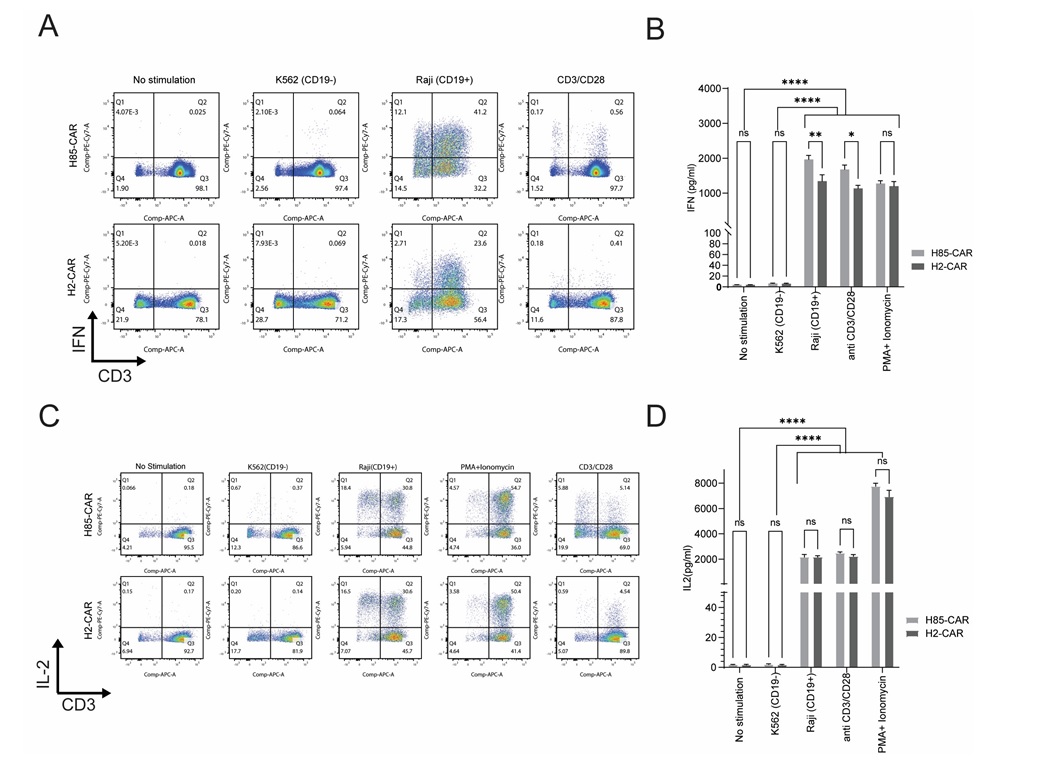
شکل 2: تحلیل عملکرد سلولهای CAR-T در شرایط کشت متفاوت. A) تجزیه و تحلیل فلوسیتومتری داخلسلولی برای بررسی تولید اینترفرون-گاما (IFN-γ) در سلولهای CAR-T حاوی نانوبادیهای H2 و H85 پس از کشت در شرایط مختلف. B) سنجش غلظت اینترفرون-گاما (IFN-γ) در مایع رویی سلولهای CAR-T حاوی نانوبادیهای H2 و H85 با استفاده از آزمون ELISA. C) بررسی تولید داخلسلولی اینترلوکین-2 با فلوسیتومتری پس از تحریک سلولهای CAR-T حاوی نانوبادیهای H2 و H85.D) سنجش غلظت اینترلوکین-2 در مایع رویی کشت با استفاده از آزمون ELISA. نمودارها بر اساس دادههای حاصل از سه دهندهی مستقل تهیه شدهاند که هر آزمایش برای هر دهنده در شش تکرار انجام شده است. دادهها به صورت میانگین ± SEMنمایش داده شدهاند. تجزیه و تحلیل آماری با استفاده از آزمون دو طرفه ANOVA (2-way ANOVA) انجام شد. ns: غیرمعنادار (9999/0 p>)؛ * 05/0 p< ؛ ** 005/0 p< ؛ *** 0001/0 p= ؛ **** 0001/0 p< . بدون تحریک (کنترل منفی)، تحریک با آنتیبادی CD3/CD28 (کنترل مثبت)، کشت با سلولهای Raji، کشت با سلولهای K562 و تحریک با PMA/ionomycin (کنترل مثبت) بوده است.
نکته قابـل توجه دیگر آن است که در مقایسه بین دو سازه طراحی شده، سلولهای حاوی سازه نانوبادی H85 در مواجهه با سلولهای Raji تقریباً دو برابر بیش از سلولهای حـاوی سازه شامل نانوبادی H2، اینترفرون-گاما تولید کردند. این تفاوت معنادار عملکردی میتواند ناشی از ویژگیهای بیولوژیکی بهتر نانوبادی H85 در شناسایی و اتصال به CD19 باشد، که منجر به فعالسازی قویتر مسیرهای سیگنالینگ در سلولهای CAR-T میشود.
نتایج به دست آمده از آزمون ELISA برای اندازهگیری اینترفرون-گاما در مایع رویی کشت نیز این یافتهها را تایید کرد و همراستا با دادههای فلوسیتومتری نشان داد که سلولهای حاوی سازه H85 در مواجهه با سلولهای Raji، مقادیر بیشتری از این سیتوکـاین را ترشح میکنند (شکل B-2).
همچنین در آنالیز فلوسیتومتری، تنها سلولهای زنده مورد تحلیل قرار گرفتند تـا از صحت دادهها و حذف نویز ناشی از سلولهای مرده اطمینان حاصل شود. در مجموع، این دادهها مؤید آن است که سازه حاوی نانوبادی H85 از نظر القای پاسخ عملکردی در سلولهایT، اثربخشی بالاتری نسبت به H2 دارد و میتواند گزینه مناسبی برای توسعه نسل جدیدی از سلولهای CAR-T بر پایه نانوبادیها باشد.
افزایش تولید سیتوکـاینها، بهویژه اینترلوکین-2، یکی از شاخصهای کلیدی فعالسازی سلولهای T مهندسی شده با گیرنده کایمریک (CAR-T) پس از شناسایی آنتیژن هدف میبـاشد. به منظور بررسی عملکرد سازههای طراحی

شکل 2: تحلیل عملکرد سلولهای CAR-T در شرایط کشت متفاوت. A) تجزیه و تحلیل فلوسیتومتری داخلسلولی برای بررسی تولید اینترفرون-گاما (IFN-γ) در سلولهای CAR-T حاوی نانوبادیهای H2 و H85 پس از کشت در شرایط مختلف. B) سنجش غلظت اینترفرون-گاما (IFN-γ) در مایع رویی سلولهای CAR-T حاوی نانوبادیهای H2 و H85 با استفاده از آزمون ELISA. C) بررسی تولید داخلسلولی اینترلوکین-2 با فلوسیتومتری پس از تحریک سلولهای CAR-T حاوی نانوبادیهای H2 و H85.D) سنجش غلظت اینترلوکین-2 در مایع رویی کشت با استفاده از آزمون ELISA. نمودارها بر اساس دادههای حاصل از سه دهندهی مستقل تهیه شدهاند که هر آزمایش برای هر دهنده در شش تکرار انجام شده است. دادهها به صورت میانگین ± SEMنمایش داده شدهاند. تجزیه و تحلیل آماری با استفاده از آزمون دو طرفه ANOVA (2-way ANOVA) انجام شد. ns: غیرمعنادار (9999/0 p>)؛ * 05/0 p< ؛ ** 005/0 p< ؛ *** 0001/0 p= ؛ **** 0001/0 p< . بدون تحریک (کنترل منفی)، تحریک با آنتیبادی CD3/CD28 (کنترل مثبت)، کشت با سلولهای Raji، کشت با سلولهای K562 و تحریک با PMA/ionomycin (کنترل مثبت) بوده است.
شده در القای پاسخ ایمنی، میزان ترشح اینترلوکین-2 در شرایط تحریکی مختلف به صورت دقیق ارزیابی گردید. برای این منظور از دو روش مکمل، شامل فلوسیتومتری داخل سلولی و آزمون ELISA بر روی مایع رویی کشت، استفاده شد.
نتایج حاصل از فلوسیتومتری نشان داد که در سلولهای CAR-T بیان کننده هر دو سازه نـانوبادیH85 و نانوبادی H2، میزان تولید اینترلوکین-2 پس از همکشتی با سلولهای هدف Raji (دارای آنتیژنCD19 ) افزایش قابل توجهی داشت، در حالی که در شرایط فاقد آنتیژن (همکشت با سلولهای K562) یا عدم وجود محرک، چنین افزایشی مشاهده نشد (شکل C-2). این نتایج بیانگر فعال شدن سلولهای T در پاسخ به شناسایی آنتـــیژن CD19
میباشد.
با این حال، بر خلاف آن چه در مورد اینترفرون-گاما مشاهده شد، مقایسه بین دو سازه نشان داد که میزان ترشح اینترلوکین-2 در سلولهای حاوی نانوبادی H85 و H2 تفاوت معناداری ندارد، و پاسخ ایمنی مشابهی از نظر این سیتوکـاین میان دو گروه دیده میشود. این یافته میتواند نشاندهنده آن باشد که گرچه هر دو سازه توانایی تحریک ترشح اینترلوکین-2 را دارند، اما سازه H85 نسبت به سازه H2 در این زمینه برتری عملکردی خاصی ندارد.
نتایج حـاصل از آزمون ELISA نیز این یافتهها را تایید نمود (شکل D-2). ترشح اینترلوکین-2 به طور معناداری در همکشت با سلولهای Raji افزایش یافته بود، در حالی که همکشتی با سلولهای K562 و یا عدم وجود محرک، منجر بـه ترشح قابل توجهی از این سیتوکاین نشد. همچنین مشابه با نتایج فلوسیتومتری، تفاوت بارزی میان سازه H85 و H2 از نظر سطح ترشح اینترلوکین-2 مشاهده نگردید. این عدم تفاوت در پاسخ اینترلوکین-2 ، در تضاد با نتایج حاصل از بررسی ترشح اینترفرون-گاما میباشد، که در آن سازه H85 عملکرد بهتری از خود نشان داده بود.
به طور کلی، این نتایج نشان میدهند که هر دو سازه قادر به فعالسازی مسیرهای ترشح اینترلوکین-2 در پاسخ بـه آنتیژن CD19 هستند، اما برخلاف اینترفرون-گاما، از نظر قدرت پاسخدهی تفاوت معناداری بین آنها مشاهده نمیشود. این تفاوت در الگوی سیتوکـاینی میتواند به ساختار نـانوبادی، ویژگیهای سیگنالی CAR یا حتی حساسیت تنظیم مسیرهای سیگنالی متفاوت در سلولهای T باز گردد، که نیاز به بررسیهای بیشتر دارد.
تأثیر طراحی سازه CAR بر توان کشندگی سلولهای T مهندسی شده:
در این مطالعه، سازههای مختلف گیرنده کایمریـک (CAR) شامل لولاهای کوتاه و بلند و نیز نسل دوم و سوم طراحی و در سلولهای T بیان شدنــد (شکل A-3). بـرای
بررسی توانایی شناسایی آنتیژن مستقل از MHC و هـدفگیری سلولهای توموری، سلولهای CAR-T با ردههای Raji و K562 بیانکننده ژن لوسیفراز به نسبت 10:1 همکشت شدند. پس از 24 ساعت، میزان زندهمانی سلولهای هدف بـا افزودن دیلوسیفرین و سنجش لومینسانس اندازهگیری شد (شکل B-3). نتایج حاصــل از این آزمون نشان داد که هر دو سازه H2 و H85 فعالیت کشندگی قابل توجهی علیه سلولهایRaji دارند، در حالی که چنین اثری بر سلولهای K562 مشاهده نشد (شکل C -3). همچنین مقایسه بین سازهها نشان داد که سلولهای CAR-T حاوی نانوبادی H85 نسبت به سازه H2 عملکرد بهتری در القای کشندگی از خود نشان میدهند.
در مرحله بعد، جهت بررسی تـأثیر طول ناحیه لولا (hinge region) بر کارآیی سازه، دو نسخه از سازههای نسل دوم حاوی نانوبادی H2 بـا لولاهای کوتاه و بلند مورد آزمون قرار گرفتند. نتایج نشان داد که هر دو سازه دارای توان کشندگی قابلتوجهی علیه سلولهای Raji هستند، اما نسخـه دارای لولای کوتاهتر در القای کشندگی عملکرد بهتری نسبت به سازه با لولای بلندتر نشان داد (شکل D -3).
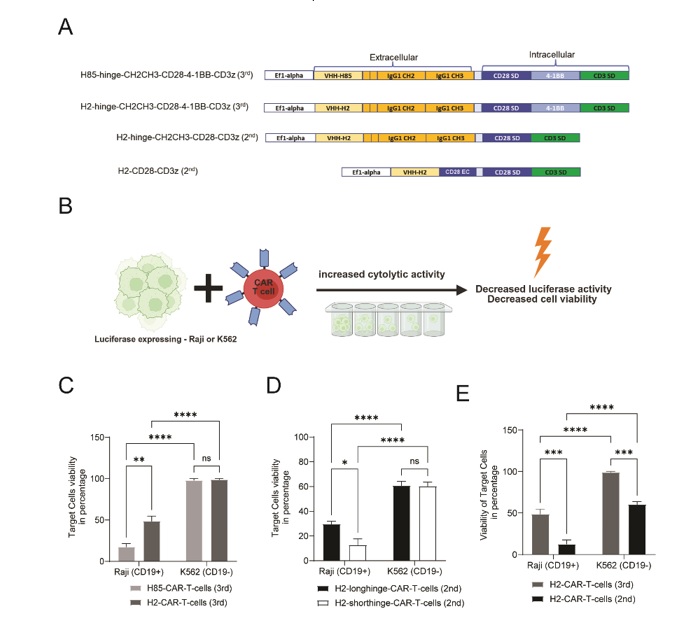
نتایج حاصل از فلوسیتومتری نشان داد که در سلولهای CAR-T بیان کننده هر دو سازه نـانوبادیH85 و نانوبادی H2، میزان تولید اینترلوکین-2 پس از همکشتی با سلولهای هدف Raji (دارای آنتیژنCD19 ) افزایش قابل توجهی داشت، در حالی که در شرایط فاقد آنتیژن (همکشت با سلولهای K562) یا عدم وجود محرک، چنین افزایشی مشاهده نشد (شکل C-2). این نتایج بیانگر فعال شدن سلولهای T در پاسخ به شناسایی آنتـــیژن CD19
میباشد.
با این حال، بر خلاف آن چه در مورد اینترفرون-گاما مشاهده شد، مقایسه بین دو سازه نشان داد که میزان ترشح اینترلوکین-2 در سلولهای حاوی نانوبادی H85 و H2 تفاوت معناداری ندارد، و پاسخ ایمنی مشابهی از نظر این سیتوکـاین میان دو گروه دیده میشود. این یافته میتواند نشاندهنده آن باشد که گرچه هر دو سازه توانایی تحریک ترشح اینترلوکین-2 را دارند، اما سازه H85 نسبت به سازه H2 در این زمینه برتری عملکردی خاصی ندارد.
نتایج حـاصل از آزمون ELISA نیز این یافتهها را تایید نمود (شکل D-2). ترشح اینترلوکین-2 به طور معناداری در همکشت با سلولهای Raji افزایش یافته بود، در حالی که همکشتی با سلولهای K562 و یا عدم وجود محرک، منجر بـه ترشح قابل توجهی از این سیتوکاین نشد. همچنین مشابه با نتایج فلوسیتومتری، تفاوت بارزی میان سازه H85 و H2 از نظر سطح ترشح اینترلوکین-2 مشاهده نگردید. این عدم تفاوت در پاسخ اینترلوکین-2 ، در تضاد با نتایج حاصل از بررسی ترشح اینترفرون-گاما میباشد، که در آن سازه H85 عملکرد بهتری از خود نشان داده بود.
به طور کلی، این نتایج نشان میدهند که هر دو سازه قادر به فعالسازی مسیرهای ترشح اینترلوکین-2 در پاسخ بـه آنتیژن CD19 هستند، اما برخلاف اینترفرون-گاما، از نظر قدرت پاسخدهی تفاوت معناداری بین آنها مشاهده نمیشود. این تفاوت در الگوی سیتوکـاینی میتواند به ساختار نـانوبادی، ویژگیهای سیگنالی CAR یا حتی حساسیت تنظیم مسیرهای سیگنالی متفاوت در سلولهای T باز گردد، که نیاز به بررسیهای بیشتر دارد.
تأثیر طراحی سازه CAR بر توان کشندگی سلولهای T مهندسی شده:
در این مطالعه، سازههای مختلف گیرنده کایمریـک (CAR) شامل لولاهای کوتاه و بلند و نیز نسل دوم و سوم طراحی و در سلولهای T بیان شدنــد (شکل A-3). بـرای
بررسی توانایی شناسایی آنتیژن مستقل از MHC و هـدفگیری سلولهای توموری، سلولهای CAR-T با ردههای Raji و K562 بیانکننده ژن لوسیفراز به نسبت 10:1 همکشت شدند. پس از 24 ساعت، میزان زندهمانی سلولهای هدف بـا افزودن دیلوسیفرین و سنجش لومینسانس اندازهگیری شد (شکل B-3). نتایج حاصــل از این آزمون نشان داد که هر دو سازه H2 و H85 فعالیت کشندگی قابل توجهی علیه سلولهایRaji دارند، در حالی که چنین اثری بر سلولهای K562 مشاهده نشد (شکل C -3). همچنین مقایسه بین سازهها نشان داد که سلولهای CAR-T حاوی نانوبادی H85 نسبت به سازه H2 عملکرد بهتری در القای کشندگی از خود نشان میدهند.
در مرحله بعد، جهت بررسی تـأثیر طول ناحیه لولا (hinge region) بر کارآیی سازه، دو نسخه از سازههای نسل دوم حاوی نانوبادی H2 بـا لولاهای کوتاه و بلند مورد آزمون قرار گرفتند. نتایج نشان داد که هر دو سازه دارای توان کشندگی قابلتوجهی علیه سلولهای Raji هستند، اما نسخـه دارای لولای کوتاهتر در القای کشندگی عملکرد بهتری نسبت به سازه با لولای بلندتر نشان داد (شکل D -3).

شکل 3: طراحی و ارزیابی عملکرد سازههای مختلف CAR-T بر پایه نانوبادی. A) نمای شماتیک از ساختار سازههای مختلف CAR طراحیشده در این مطالعه. B) طرح کلی نحوه انجام آزمون سیتوتوکسیسیتی در همکشتی با سلولهای هدف. C) نتایج مقایسه سیتوتوکسیسیتی دو سازه نسل سوم حاوی نانوبادیهای H2 و H85. D) مقایسه عملکرد سازههای نسل دوم حاوی نانوبادی H2 با لولای کوتاه در برابر لولای بلند در آزمایش سیتوتوکسیسیتی. E) ارزیابی تفاوت عملکرد بین سازههای نسل دوم و سوم CAR حاوی نانوبادی H2 در آزمایش سیتوتوکسیسیتی. سلولهای هدف شامل Raji (حاوی آنتیژن CD19) و K562 (فاقد آنتیژن CD19) بودند. نمودارها بر اساس دادههای حاصل از سه دهنده مستقل تهیه شدهاند که هر آزمایش برای هر دهنده در شش تکرار انجام شده است. نمودارها بر اساس میانگین ± SEM ترسیم شدهاند. تجزیه و تحلیل آماری با استفاده از آزمون دوطرفه ANOVA (2-way ANOVA) انجام شد. ns: غیرمعنادار 9999/0 p>)؛ * 05/0 p< ؛ ** 005/0 p< ؛ *** 0001/0 p= ؛ **** 0001/0 p< .
در ادامه، دو سازه از نسل دوم و سوم CAR، هر دو حاوی نانوبادی H2، با یکدیگر مقایسه شدند (شکل E-3). نتایج نشان داد که هر دو سازه توانایی کشندگی معناداری علیه سلولهای هدف CD19+ دارند، اما فعالیت سازه نسل دوم به طور نسبی بالاتر از نسل سوم بوده و تفاوت معناداری بین این دو در پاسخ به سلولهای هدف مشاهده شد. علاوه بر این، هر دو سازه به طور معناداری بین سلولهای Raji و K562 تمایز عملکردی از نظر کشندگی نشان دادند.
در مجموع، این نتایج نشان میدهند که طراحی مناسب نانوبادی، طول ناحیه لولا و نوع نسل سازه CAR میتواند نقش مهمی در بهینهسازی عملکرد کشندگی سلولهای CAR-T ایفا کند.
بحث
نتایج حاصل از این مطالعه نشان داد که طراحی و تولید سلولهای CAR-T بر پایه نانوبادی ضد CD19 میتواند منجر به القای پاسخهای ایمنی اختصاصی و کارآمد علیه سلولهای B بدخیم شود. برخلاف ساختارهای رایج مبتنی برscFv، که معمولاً از آنتیبادیهای کامل انسانی یا موشی مشتق میشوند و مستعد تشکیل دیمرهای ناپایدار و القای پاسخهای ایمنی هستند، نانوبادیها (VHH) به واسطه انـدازه کوچک (~15 kDa)، ساختار تک دومینی، پایداری حرارتی بالا و قابلیت بیان مؤثر در سلولهای پستانداران و حتی پروکـاریوتها، جایگزینی مطلوب برای افزایش پایداری و عملکرد CAR محسوب میشوند (17، 11).
در مطالعه حاضر، جـایگزینی scFv با نانوبادی منجر به افزایش بیـان گیرنده در سطح سلولهای Tو تقویت پـاسخهای عملکردی علیه سلولهای CD19+ گردید. یافتههای این مطالعه در راستای گزارش اخیر منتشر شده توسط نصیری و همکاران نیز قرار دارد، که در آن نشان داده شد سلولهای T مهندسی شده با گیرنده کایمریک مبتنی بر نانوبادی ضد CD19 (VHH-CAR) دارای کارآیی کشندگی توموری مشابه با سلولهای CAR-T کلاسیک بر پایه scFv (FMC63) هستند، بدون آن که تفاوت معناداری در تولید سیتوکاین یا توان تکثیر مشاهده شود (10). همراستایی دادههـای ما با این گزارش، به ویژه در زمینه اثربخشی عملکردی، بیان سطحی CAR و پایداری سلولی، نشان میدهد که نـانوبادیها میتوانند جایگزینی مؤثر و ایمن برای scFv در طراحی نسلهـای جدید سلولهای CAR-T بـاشند و گزینهای جذاب برای کاهش پیچیدگی ساختاری، بهبود نفوذ بافتی و کاهش ایمنیزایی تلقی شوند. افزون بر این، مطالعههای متعددی نیز مزایای مشابهی برای نانوبادیها گزارش کردهاند، از جمله کاهش ایمنیزایی، بهبود نفوذ به بافتهای توموری، و توانایی هدفگیری آنتیژنهایی با دسترسی محدود یا اپیتوپهای مخفیشده، که در طراحیهای مبتنی بر scFv بهسختی قابل دستیابی هستند (19، 18).
از سوی دیگر، استفاده از نـانوبادیها با حذف ناحیه linker میان زنجیرههای سنگین و سبک، خطر mispairing یا جفت شدن نامناسب را نیز کاهش میدهد که در بسیاری از scFvهـا دیده میشود و موجب کاهش کارآیی یا حتی القای سیگنالهای نامناسب میگردد. همچنین نانوبادیها به واسطه توانایی مهندسی بالا و قابلیت ادغام در فرمتهای دو گانه یا چند گانه هدفگیری آنتیژن، فرصتهایی جدید برای توسعه نسلهای بعدی CAR-T فراهم میکنند (20).
یکی از یـافتههای مهم این پژوهش، عملکرد برتر سازه حاوی نانوبادی H85 نسبت به H2 در القای پاسخ سیتوکاینی، به ویژه اینترفرون-گاما، و افزایش کشندگی در برابر سلولهای CD19+بود. این تفاوت عملکردی میتواند نـاشی از ویژگیهای متفاوت اتصال آنتیژنی، پایداری فضایی، یـا توانایی فعالسازی مؤلفههای سیگنالدهی پایین دستی در این دو نانوبادی باشد. جالب توجه است که سطوح تولید اینترلوکین-2 بین دو سازه تفاوت معناداری نداشت، که ممکن است نشاندهنده تفاوت در مسیرهای سیگنالدهی وابسته به نوع سیتوکاین یا تفاوت در آستانه تحریـک باشد. این یافته با گزارشهای پیشین از جمله مطالعه بنیهاشم و همکاران همراستا است که نشان دادند نـانوبادی H85 دارای تمایل اتصال (affinity) بالاتری به CD19 نسبت به H2 میباشد (12). همچنین، مشاهدات مشابهی در مطالعههای دیگری مانند مائو و همکـاران نیز گزارش شده است که در آن، تفاوتهای عملکردی میان CAR هایی با دامنههای شناسایی مختلف مورد بررسی قرار گرفته بود (21).
افزون بر این، تحلیل سازههای مختلف نشان داد کـه طول ناحیه لولا و نوع اجزای سیگنالدهی داخلسلولی اثر تعیینکنندهای بر عملکرد نهایی سلولهای CAR-T دارند. در مقایسه سازههایی با لولاهای کوتاه و بلند و طراحیهای نسل دوم و سوم، سازه حاوی لولای کوتاه و طراحی نسل دوم (مشتمل بر دومـینهای CD28 وCD3ζ ) توان سیتوتوکسیک قویتری در برابر سلولهای CD19+ از خود نشان داد. این یـافته با نتایج مطالعههای پیشین همسو است که در آن نشان داده شد طول و انعطافپذیری نـاحیه لولا میتواند فاصله فیزیکی میان CAR و آنتیژن هدف را تنظیم کرده و در نتیجه بر نحوه سیناپس ایمنی و شدت سیگنالدهی اثرگذار باشد (24-22). نقش لولا نه تنها در تنظیم فـاصله فضایی، بلکه در پایداری گیرنده، آنتیژنگیری و در دسترسبودن دامنه شناسایی نیز اهمیت دارد. گزارشهـای دیگر نیز نشان دادهاند که طول بیش از حد لولا ممکن است با کاهش ثبات ساختاری و اختلال در انتقال سیگنال همراه باشد، در حالیکه لولاهای کوتاهتر میتوانند تعامـل مؤثرتری میان CAR و آنتیژن ایجاد کنند (26، 25).
از منظر طراحی داخل سلولی، نتایج مطالعه ما نشان داد کـه نوع دومینهای سیگنالدهی نقش تعیینکنندهای در عملکرد نهایی سلولهای CAR-T دارد. مقایسه میان سازههای نسل دوم و سوم حاکی از آن بود که، علیرغم پیچیدگی بیشتر طراحی نسل سوم که به طور معمول شامل دو دومین هم تحریکی مانند CD28و 4-1BB میبـاشد، سازه نسل دوم (CD3ζ و CD28) در این مطالعه پاسخ سیتوتوکسیک قویتری از خود نشان داد. این تفاوت میتواند ناشی از تداخل یا تعارض در مسیرهای سیگنالدهی همزمان باشد، که موجب کاهش شدت پاسخ اولیه یا تأخیر در فعالسازی سلول میشود؛ موضوعی که پیشتر نیز در مطالعهها مطرح شده است (28، 27). در برخی گزارشها، مانند مطالعه ژائو و همکاران، سازههای نسل سوم مزایایی نظیر پایداری عملکردی طولانیتر و کاهش خستگی سلولی را در شرایط مزمن نشان دادهاند (29، 27). با این حال، در زمینه درمانهـای نیازمند پاسخ فوری و قوی، همچون بدخیمی سلولهای B با بیان بالای CD19، ممکن است طراحی نسل دوم با پاسخ سریعتر و مؤثرتر، عملکرد بهتری ارائه دهد.
افزون بر این، مطالعاتی نظیرلانگ و همکاران نیز نشان دادهانـد که نوع دومین هم تحریکی نه تنها بر قدرت و دوام پاسخ اثر میگذارد، بلکه بر ویژگیهای حـافظهای، بقای درونتنی، و سطح بیان سیتوکاینها نیز تأثیرگذار است (30). دادههای ما این موضوع را تأیید میکند، بـه گونهای که سازه نسل دوم در شرایط آزمایشگاهی پاسخ کشندگی بهتری نسبت به نسل سوم ارائه داد. این یافتهها بر اهمیت انتخـاب هدفمند دومینهای داخلسلولی بر اساس نوع بیماری، شدت آنتیژن و هدف درمانی تأکید دارد.
در مجموع، یافتههای مـا بر اهمیت طراحی ساختاری دقیق در سازههای CAR تأکید دارد و نشان میدهد که انتخاب هدفمند نوع دامنه شناسایی، طول لولا و دومینهای سیگنالدهی داخلسلولی باید با در نظر گرفتن توازن میان شدت پاسخ اولیه، دوام طولانی مدت و اجتناب از خستگی سلولی صورت گیرد. این ملاحظات میتوانند به بهینهسازی کارآیی درمـانی سلولهای CAR-T، به ویژه در مواجهه با تومورهای مقاوم یا محیطهای سرکوبگر ایمنی، کمک شایانی نمایند.
نتیجهگیری
در مجموع، مطالعه حاضر نشان داد که سلولهای CAR-T مبتنی بر نـانوبادی ضد CD19 میتوانند به طور مؤثری سلولهای B بدخیم را شناسایی و از بین ببرند. بهکارگیری نانوبادی در ساختار گیرنده کایمریک منجر به افزایش پاسخ سیتوکاینی و کشندگی هدفمند شد و انتخاب نوع نانوبادی، طول نـاحیه لولا و نسل سازه نقش تعیینکنندهای در بهینهسازی عملکرد این سلولها ایفا کردند. این یافتهها پتانسیل بـالای نانوبادیها را به عنوان جایگزینی مؤثر برای scFv در نسلهای آینده سلولهای CAR-T نشان میدهد و میتوانـد راه را برای طراحی درمانهای ایمنتر و مؤثرتر در سرطانهای خونی هموار سازد.
حمایت مالی
این پژوهش به عنوان بخشی از رساله دکتری و بـا حمایت مالی دانشکده علوم پزشکی دانشگاه تربیت مدرس انجام شده است.
ملاحظات اخلاقی
این مطالعه توسط کمیته اخلاق دانشگاه تربیت مدرس مجوز گرفته است (IR.TMU.REC.1394.300).
عدم تعارض منافع
نویسندگان اظهار کردند در انتشار این مقاله، هیچ گونه منافع تجاری نداشتند.
نقش نویسندگان
مطهره ارجمندنژاد: طراحی مطالعه، ایده پردازی، انجام آزمایشها، بررسی و تحلیل دادهها، نگارش و ویرایش مقاله.
دکتر فاطمه رهبریزاده: طراحی مطالعه، ایده پردازی، بررسی و نظارت بر انجام آزمایشها، نگارش و ویرایش مقاله.
تشکر و قدردانی
این پژوهش به عنوان بخشی از رساله دکتری و بـا حمایت مالی دانشکده علوم پزشکی دانشگاه تربیت مدرس انجام شده است.
بدینوسیله مراتب سپاس و قدردانی صمیمانه خود را از دانشگاه University of Massachusetts Chan Medical School، (دکتر Terence Flotte و دکتر Allison Keeler)، به دلیل نقش مؤثرشان در پیشبرد این پژوهش ابراز میداریم.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و انكولوژي
فهرست منابع
1. Rheingold SR, Bhojwani D, Ji L, Xu X, Devidas M, Kairalla JA, et al. Determinants of survival after first relapse of acute lymphoblastic leukemia: a Children's Oncology Group study. Leukemia 2024; 38(11): 2382-94. [DOI:10.1038/s41375-024-02395-4] [PMID] []
2. Iqbal M, Kharfan-Dabaja MA. Relapse of Hodgkin lymphoma after autologous hematopoietic cell transplantation: A current management perspective. Hematol Oncol Stem Cell Ther 2021; 14(2): 95-103. [DOI:10.1016/j.hemonc.2020.05.011] [PMID]
3. Zhou D, Zhu X, Xiao Y. CAR-T cell combination therapies in hematologic malignancies. Exp Hematology Oncol 2024; 13(1): 69. [DOI:10.1186/s40164-024-00536-0] [PMID] []
4. Cuenca M, Peperzak V. Advances and Perspectives in the Treatment of B-Cell Malignancies. Cancers (Basel) 2021; 13(9): 2266. [DOI:10.3390/cancers13092266] [PMID] []
5. Maleki EH, Bahrami AR, Matin MM. Cancer cell cycle heterogeneity as a critical determinant of therapeutic resistance. Genes Dis 2024; 11(1): 189-204. [DOI:10.1016/j.gendis.2022.11.025] [PMID] []
6. Mazinani M, Rahbarizadeh F. New cell sources for CAR-based immunotherapy. Biomark Res 2023; 11(1): 49. [DOI:10.1186/s40364-023-00482-9] [PMID] []
7. Ramírez-Chacón A, Betriu-Méndez S, Bartoló-Ibars A, González A, Martí M, Juan M. Ligand-based CAR-T cell: Different strategies to drive T cells in future new treatments. Front Immunol 2022; 13: 932559. [DOI:10.3389/fimmu.2022.932559] [PMID] []
8. Tang L, Huang Z, Mei H, Hu Y. Immunotherapy in hematologic malignancies: achievements, challenges and future prospects. Signal Transduct Target Ther 2023; 8(1): 306. [DOI:10.1038/s41392-023-01521-5] [PMID] []
9. Rajabzadeh A, Rahbarizadeh F, Ahmadvand D, Kabir Salmani M, Hamidieh AA. A VHH-Based Anti-MUC1 Chimeric Antigen Receptor for Specific Retargeting of Human Primary T Cells to MUC1-Positive Cancer Cells. Cell J 2021; 22(4): 502-13. [DOI:10.1186/s12860-021-00397-z] [PMID] []
10. Nasiri F, Safarzadeh Kozani P, Rahbarizadeh F. T-cells engineered with a novel VHH-based chimeric antigen receptor against CD19 exhibit comparable tumoricidal efficacy to their FMC63-based counterparts. Front Immunol 2023; 14: 1063838. [DOI:10.3389/fimmu.2023.1063838] [PMID] []
11. Jamnani FR, Rahbarizadeh F, Shokrgozar MA, Mahboudi F, Ahmadvand D, Sharifzadeh Z, et al. T cells expressing VHH-directed oligoclonal chimeric HER2 antigen receptors: Towards tumor-directed oligoclonal T cell therapy. Biochim Biophys Acta 2014; 1840(1): 378-86. [DOI:10.1016/j.bbagen.2013.09.029] [PMID]
12. Banihashemi SR, Hosseini AZ, Rahbarizadeh F, Ahmadvand D. Development of specific nanobodies (VHH) for CD19 immuno-targeting of human B-lymphocytes. Iran J Basic Med Sci 2018; 21(5): 455-64.
13. Sena-Esteves M, Gao G. Production of High-Titer Retrovirus and Lentivirus Vectors. Cold Spring Harb Protoc 2018; 2018(4). [DOI:10.1101/pdb.prot095687] [PMID]
14. Arjomandnejad M, Sylvia K, Blackwood M, Nixon T, Tang Q, Muhuri M, et al. Modulating immune responses to AAV by expanded polyclonal T-regs and capsid specific chimeric antigen receptor T-regulatory cells. Mol Ther Methods Clin Dev 2021; 23: 490-506. [DOI:10.1016/j.omtm.2021.10.010] [PMID] []
15. Brown CE, Wright CL, Naranjo A, Vishwanath RP, Chang WC, Olivares S, et al. Biophotonic cytotoxicity assay for high-throughput screening of cytolytic killing. J Immunol Methods 2005; 297(1-2): 39-52. [DOI:10.1016/j.jim.2004.11.021] [PMID]
16. Benmebarek MR, Karches CH, Cadilha BL, Lesch S, Endres S, Kobold S. Killing Mechanisms of Chimeric Antigen Receptor (CAR) T Cells. Int J Mol Sci 2019; 20(6): 1283. [DOI:10.3390/ijms20061283] [PMID] []
17. Safarzadeh Kozani P, Naseri A, Mirarefin SMJ, Salem F, Nikbakht M, Evazi Bakhshi S, et al. CAR-T cells for cancer immunotherapy. Biomark Res 2022; 10(1): 24. [DOI:10.1186/s40364-022-00371-7] [PMID] []
18. Bannas P, Hambach J, Koch-Nolte F. Nanobodies and Nanobody-Based Human Heavy Chain Antibodies As Antitumor Therapeutics. Front Immunol 2017; 8: 1603. [DOI:10.3389/fimmu.2017.01603] [PMID] []
19. Mazinani M, Rahbarizadeh F. CAR-T cell potency: from structural elements to vector backbone components. Biomark Res 2022; 10(1): 70. [DOI:10.1186/s40364-022-00417-w] [PMID] []
20. Bao C, Gao Q, Li LL, Han L, Zhang B, Ding Y, et al. The Application of Nanobody in CAR-T Therapy. Biomolecules 2021; 11(2): 238. [DOI:10.3390/biom11020238] [PMID] []
21. Mao R, Kong W, He Y. The affinity of antigen-binding domain on the antitumor efficacy of CAR T cells: Moderate is better. Front Immunol 2022; 13: 1032403. [DOI:10.3389/fimmu.2022.1032403] [PMID] []
22. Hirobe S, Imaeda K, Tachibana M, Okada N. The Effects of Chimeric Antigen Receptor (CAR) Hinge Domain Post-Translational Modifications on CAR-T Cell Activity. Int J Mol Sci 2022; 23(7): 4056. [DOI:10.3390/ijms23074056] [PMID] []
23. Qin L, Lai Y, Zhao R, Wei X, Weng J, Lai P, et al. Incorporation of a hinge domain improves the expansion of chimeric antigen receptor T cells. J Hematol Oncol 2017; 10(1): 68. [DOI:10.1186/s13045-017-0437-8] [PMID] []
24. Fujiwara K, Tsunei A, Kusabuka H, Ogaki E, Tachibana M, Okada N. Hinge and Transmembrane Domains of Chimeric Antigen Receptor Regulate Receptor Expression and Signaling Threshold. Cells 2020; 9(5): 1182. [DOI:10.3390/cells9051182] [PMID] []
25. Hudecek M, Sommermeyer D, Kosasih PL, Silva-Benedict A, Liu L, Rader C, et al. The nonsignaling extracellular spacer domain of chimeric antigen receptors is decisive for in vivo antitumor activity. Cancer Immunol Res 2015; 3(2): 125-35. [DOI:10.1158/2326-6066.CIR-14-0127] [PMID] []
26. Li N, Quan A, Li D, Pan J, Ren H, Hoeltzel G, et al. The IgG4 hinge with CD28 transmembrane domain improves VHH-based CAR T cells targeting a membrane-distal epitope of GPC1 in pancreatic cancer. Nat Commun 2023; 14(1): 1986. [DOI:10.1038/s41467-023-37616-4] [PMID] []
27. Zhao Z, Condomines M, van der Stegen SJC, Perna F, Kloss CC, Gunset G, et al. Structural Design of Engineered Costimulation Determines Tumor Rejection Kinetics and Persistence of CAR T Cells. Cancer Cell 2015; 28(4): 415-28. [DOI:10.1016/j.ccell.2015.09.004] [PMID] []
28. Milone MC, Fish JD, Carpenito C, Carroll RG, Binder GK, Teachey D, et al. Chimeric receptors containing CD137 signal transduction domains mediate enhanced survival of T cells and increased antileukemic efficacy in vivo. Mol Ther 2009; 17(8): 1453-64. [DOI:10.1038/mt.2009.83] [PMID] []
29. Gomes-Silva D, Mukherjee M, Srinivasan M, Krenciute G, Dakhova O, Zheng Y, et al. Tonic 4-1BB Costimulation in Chimeric Antigen Receptors Impedes T Cell Survival and Is Vector-Dependent. Cell Rep 2017; 21(1): 17-26. [DOI:10.1016/j.celrep.2017.09.015] [PMID] []
30. Long AH, Haso WM, Shern JF, Wanhainen KM, Murgai M, Ingaramo M, et al. 4-1BB costimulation ameliorates T cell exhaustion induced by tonic signaling of chimeric antigen receptors. Nat Med 2015; 21(6): 581-90. [DOI:10.1038/nm.3838] [PMID] []
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







