جلد 22، شماره 3 - ( پائیز 1404 )
جلد 22 شماره 3 صفحات 263-248 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Jafarpoury M R, Shiri Y, Yazdandoust E. Transfusion-Related Acute Lung Injury (TRALI) and Transfusion-Associated Circulatory Overload (TACO): Pathophysiology, Prevention and Management. bloodj 2025; 22 (3) :248-263
URL: http://bloodjournal.ir/article-1-1580-fa.html
URL: http://bloodjournal.ir/article-1-1580-fa.html
جعفرپوری محمدرضا، شیری یاشار، یزدان دوست احسان. آسیب حاد ریوی ناشی از انتقال خون و گرانباری گردشی مرتبط با تزریق خون: پاتوفیزیولوژی، پیشگیری و مدیریت. فصلنامه پژوهشی خون. 1404; 22 (3) :248-263
مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
واژههای کلیدی: تزریق خون، واکنشهای انتقال خون، عوامل خطر، آسیب حاد ریوی مرتبط با انتقال خون، گرانباری گردشی ناشی از تزریق خون
متن کامل [PDF 871 kb]
(474 دریافت)
| چکیده (HTML) (1698 مشاهده)
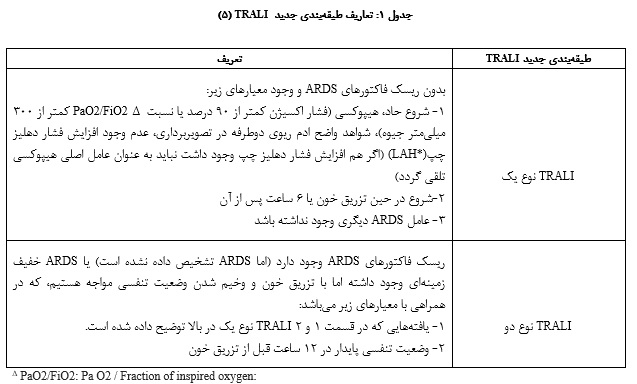
رنج طبیعی آن 300 تا 500 میلی متر جیوه می باشد موارد با ARDS خفیف نسبت 200 تا 300 میلی متر جیوه دارند. در صورتی که ارتفاع محل زندگی بیشتر از 1000 متر باشد، فاکتور تصحیح نیز باید به صورت زیر محاسبه گردد(5).
[(PaO2/FiO2) × (barometric pressure/760)]
LAH: left atrial hypertension*
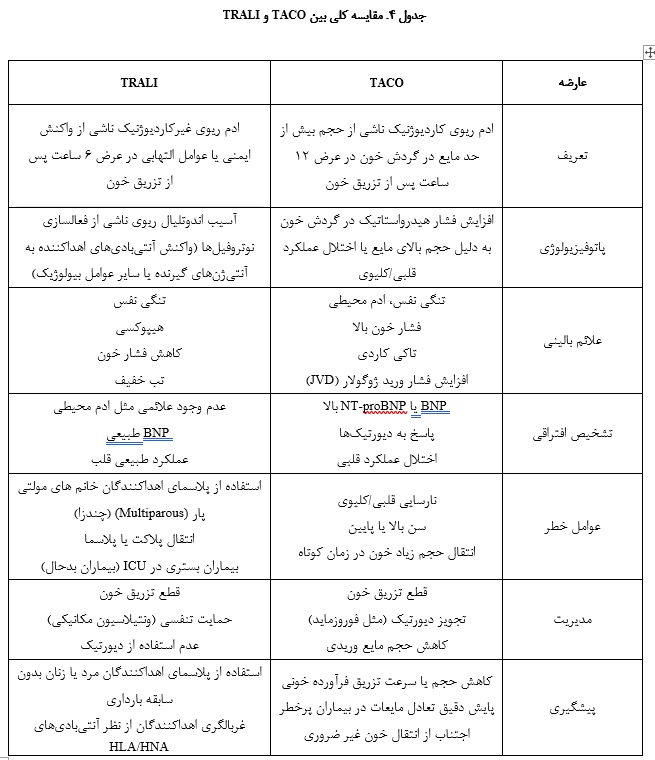
از دیگر راههای پیشگیری، کاهش حجم فرآوردهها با سانتریفیوژ کردن واحدهای گلبول قرمز و پلاکت قبل از تزریق به منظور حذف پلاسمای اضافی میباشد. برای بیمارانی که در معرض خطر بالاتری برای TACO هستند، استفاده از داروهای مدر قبل از تزریق ممکن است در پیشگیری از TACO مؤثر باشد؛ با این حال این رویکرد پیشگیرانه هنوز درمراحل اولیــه بررسی است (104، 103). در حال حاضر، همچنین یک کارآزمایی بالینی برای بررسی تأثیر فرآوردههای خونی سلولی شسته شده برای جلوگیری از TACO در حال انجام است (77). به طور خلاصه مقایسه TACO و TRALI با توجه به مطالب ارائه شده در این مقاله در جدول آورده شده است (جدول 4).
بحث
با وجود پیشرفتهای اخیر در شناخت پاتوفیزیولوژی TRALI و TACO، هنوز چالشهای مهمی در زمینه تشخیص دقیق، پیشگیری مؤثر و درمان هدفمند این عوارض وجود دارد. بر اساس تازهترین شواهد پژوهشی، اهداف آینده مطالعهها در این حوزه با توجه به مطالعههایی که در این مقاله بررسی شده شامل موارد زیر است:
1- توسعه بیومارکرهای جدید برای افتراق TRALI از TACO:
مطالعههای اخیر پیشنهاد دادهاند که استفاده ترکیبی از مارکرهایی مانند BNP، ST2 و سایر سیتوکاینها میتواند به تمایز دقیقتر این دو عارضه کمک کند، به ویژه در بیماران با شرایط جسمانی وخیم و بحرانی (83).
2- استفاده از مدلهای حیوانی و بالینی برای بررسی مکانیسمهای ایمنی و التهابی:
پژوهشها نشان دادهاند که تنظیم پاسخ نوتروفیلی و نقش سلولهای Treg و IL-10 میتواند در کاهش شدت TRALI مؤثر باشد و باید در مطالعههای آینده بررسی شود (19).
3- بررسی کارآیی محصولات خونی کاهشیافته از نظر حجم و آنتیبادی:
استفاده از پلاسما یا پلاکتهای کاهش حجم یافته یــا
فاقد آنتیبادیهای HLA/HNA در مطالعههای حیوانی مؤثر گزارش شده و مطالعههای انسانی در این زمینه توصیه شده است (105).
4- ارزیابی درمانهای هدفمند مانند آنتیاکسیدانها و ایمنیدرمانی:
مطالعههای بالینی اولیه با آسکوربیک اسید و مداخلات ایمنی نشاندهنده اثرات امیدوارکنندهای بودهاند که نیازمند تایید در کارآزماییهای بزرگتر است (39).
5- طراحی دستورالعملهای پیشگیرانه شخصیسازی شده برای بیماران پرخطر:
استفاده از الگوریتمهای تصمیمگیری مبتنی بر هوش مصنوعی و پرونده سلامت الکترونیک در شناسایی بیماران در معرض TACO و TRALI میتواند گام مهمی در کاهش بروز این عوارض باشد (57).
نتیجهگیری
مرور نتایج مطالعهها نشان داد آسیب حاد ریوی مرتبط با تزریق خون (TRALI) و گرانباری گردش مرتبط با تزریق خون (TACO) که در دسته واکنشهای حاد ناشی از انتقال خون قرار میگیرند، یکی از علل اصلی عوارض و مرگ و میر بعد از تزریق خون و فرآوردههای خونی میباشند و یافتههای این مطالعه نشان داد که راهکارهای تشخیصی TRALI و TACO با توجه به شناخت پاتوفیزیولوژی آنها امروزه بهبود یافته و به کارگیری اقدامات پیشگیرانه میتواند بروز این عوارض را کاهش دهد. از جمله این اقدامات پیشگیرانه میتوان به استفاده از فرآورده خون شسته شده و استفاده از Solvent/detergent plasma در پیشگیری از رخداد TRALI و کاهش حجم یا سرعت تزریق فرآورده خونی و استفاده از داروهای مدر قبل از تزریق فرآورده خونی اشاره کرد که میتواند در پیشگیری از TACO مؤثر باشد.
این نتایج میتوانند در تدوین دستورالعملهای بالینی برای انتخاب نوع فرآورده و روش تزریق در بیماران پرخطر بسیار کاربردی باشند و به عنوان پایهای برای طراحی مطالعههای آیندهنگر و سیاستهای هموویژیلانس در سیستمهای انتقال خون به کار روند.
عدم تعارض منافع
نویسندگان اظهار میکنند هیچگونه تعارض منافعی در
این مطالعه وجود نداشته است.
نقش نویسندگان
محمدرضا جعفریپور: جمعآوری اطلاعات و نگارش نسخه اولیه مقاله
یاشار شیری: جمعآوری اطلاعات و نگارش نسخه اولیه
مقاله
دکتر احسان یزداندوست: ایده مقاله، اصلاح و تهیه نسخه نهایی مقاله، نظارت بر تحقیق و نگارش مقاله
متن کامل: (537 مشاهده)
آسیب حاد ریوی ناشی از انتقال خون و گرانباری گردشی مرتبط با تزریق خون: پاتوفیزیولوژی، پیشگیری و مدیریت
محمدرضا جعفرپوری1، یاشار شیری1، احسان یزداندوست2
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات فرآوردههای بیولوژیک و سلامت خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD هماتولوژی آزمایشگاهی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات فرآوردههای بیولوژیک و سلامت خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD هماتولوژی آزمایشگاهی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
https://doi.org/10.18502/avr.v34i2.18052 Citation: Jafarpoury MR, Shiri Y, Yazdandoust E. Transfusion-Related Acute Lung Injury (TRALI) and Transfusion-Associated Circulatory Overload (TACO): Pathophysiology, Prevention and Management. J Iran Blood Transfus. 2025: 22 (2): 248-263 نویسنده مسئول: دکتر احسان یزداندوست. مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون، تهران، ایران صندوق پستی: 1157-14665 E-mail:
|
چکیده سابقه و هدف آسیب حاد ریوی مرتبط با انتقال خون (TRALI) و گرانباری گردش مرتبط با تزریق خون (TACO)از مهمترین علل عوارض شدید و مرگومیر ناشی از تزریق فرآوردههای خونی به شمار میروند. این واکنشها عمدتاً در طی شش ساعت نخست پس از تزریق رخ میدهند و در گروه واکنشهای حاد انتقال خون طبقهبندی میشوند. هدف این مرور، بررسی تاریخچه و اپیدمیولوژی، عوامل خطر، پاتوفیزیولوژی، تظاهرات بالینی، روشهای تشخیصی، مدیریت و راهکارهای پیشگیری از این عوارض است. مواد و روشها در یک مطالعه مروری، برای دسترسی به مطالعههای پیرامون TRALI و TACO در پژوهشهای معتبر منتشر شده و پایگاههای اطلاعاتی Google scholar ، PubMed و MEDLINE جستجو صورت گرفت و یافتههای 104 مقاله از سال 1996 تا 2025 مورد استناد قرار گرفت. یافتهها TRALI معمولاً با ادم ریوی غیرقلبی، هیپوکسی و دیسترس تنفسی مشخص میشود. مکانیسمهای ایمنی شامل وجود آنتیبادیهای ضد HLA و HNA و نیز عواملی مانند سیتوکاینها و لیپیدهای فعال در ایجاد آن نقش دارند. TACO بیشتر ناشی از حجم یا سرعت زیاد تزریق در بیماران پرخطر (سالمندان، بیماران قلبی–کلیوی) رخ میدهد و با ادم قلبی ـ ریوی، افزایش فشار وریدی و پاسخ مطلوب به دیورتیکها همراه است. مطالعه پیش رو همچنین نشان داد که راهکارهای تشخیصی TRALI و TACO با توجه به شناخت پاتوفیزیولوژی آنها امروزه بهبود یافته و به کارگیری اقدامات پیشگیرانه از جمله استفاده از فرآورده خون شسته شده و استفاده از Solvent-detergent plasma در پیشگیری از رخداد TRALI و کاهش حجم یا سرعت تزریق فرآوردههای خونی و استفاده از داروهای مدر (دیورتیک) قبل از تزریق ممکن است در پیشگیری از TACO مؤثر باشد. نتیجه گیری مرور حاضر نشان داد که اجرای سیاست استفاده از پلاسمای اهداکنندگان مرد و غربالگری آنتیبادیهای ضد HLA/HNA در مراکزی که این اقدامات انجام شدهاند، موجب کاهش بروز TRALI گردیده است. از نظر اپیدمیولوژیک،TACO در بیماران سالمند و مبتلایان به بیماریهای قلبی یا کلیوی شایعتر است و در سطح پاتوفیزیولوژیک، مکانیسمهای ایمنی در TRALI و فاکتورهای حجم و فشار در TACO نقش اصلی را دارند. به کارگیری بیومارکرهایی مانند BNP و NT-proBNP میتواند در افتراق دقیقتر این دو عارضه مؤثر باشد. پیشرفت در شناخت پاتوفیزیولوژی، توسعه بیومارکرهای تشخیصی و اجرای راهکارهای پیشگیرانه میتواند به کاهش بروز این عوارض و ارتقای ایمنی انتقال خون کمک کند. کلمات کلیدی: تزریق خون، واکنشهای انتقال خون، عوامل خطر، آسیب حاد ریوی مرتبط با انتقال خون، گرانباری گردشی ناشی از تزریق خون |
|
1- Acridine Orange
|
|
1- Biological safety cabinet
|
|
1- Platelet Concentrate
2- Food and Drug Administration 3- Normal Skin Flora 4- Platelet Rich Plasma-Platelet Concentrate 5- Eosin-Methylene blue 6- Thioglycolate |
|
1- Acridine Orange
|
|
1- Biological safety cabinet
|
|
1- Platelet Concentrate
2- Food and Drug Administration 3- Normal Skin Flora 4- Platelet Rich Plasma-Platelet Concentrate 5- Eosin-Methylene blue 6- Thioglycolate |
مقدمه
به طور کلی تزریق خون بدون بروز عوارض جانبی و ایمن میباشد اما در برخی مواقع میتواند باعث ایجاد واکنشهای متعددی در فرد گیرنده شود؛ پس با وجود این که تزریق خون میتواند زندگیبخش باشد اما در برخی موارد با آسیبهای جبرانناپذیری همراه بوده و زندگی گیرندگان خون را به خطر میاندازد؛ این واکنشها میتوانند به دنبال تزریق هر کدام از محصولات خونی (گلبول قرمز، پلاسما، پلاکت و..) ایجاد شوند و تهدید کننده حیات باشند. این واکنشها اگر در طی 24 ساعت از تزریق خون و فرآوردههای خونی رخ دهند، در دسته واکنشهای حاد جای میگیرند و اگر روزها تا هفتهها بعد رخ دهند جزو واکنشهای تأخیری در نظر گرفته میشوند (1). آسیب حاد ریه مرتبط با تزریق خون (TRALI) و گرانباری گردش مرتبط با تزریق خون (TACO) یکی از عوامل اصلی عوارض و مرگ و میر بعد از تزریق خون و فرآوردههای خونی میباشد. این واکنشها عموماً در عرض 6 ساعت پس از تزریق خون نمایان میشود و از آن جایی که تا 24 ساعت از تزریق خون و فرآوردههای خونی رخ میدهند، در دسته واکنشهای حاد جای میگیرند (2). در این مقاله مروری به پاتوفیزیولوژی، فاکتورهای خطر رخداد، روشهای تشخیصی و راهکارهای کاهش رخداد این 2 عارضه، مدیریت بیماری و ویژگیهای آزمایشگاهی این عوارض پرداخته شده است.
مواد و روشها
بدین منظور از پژوهشهای معتبر منتشر شده و پایگاههای اطلاعاتی Google scholar ، PubMed و MEDLINE با استفاده از کلید واژههای تزریق خون، واکنشهای تزریق خون، عوامل خطر، آسیب حاد ریوی مرتبط با انتقال خون (TRALI) و گرانباری گردشی ناشی از تزریق خون (TACO) جستجو صورت گرفت و یافتههای 104 مقاله از سال 1996 تا 2025 مورد استناد قرار گرفت.
یافتهها
آسیب حاد ریوی مرتبط با انتقال خونTRALI (Transfusion Related Acute Lung Injury) :
آسیب حاد ریوی یک عارضه ناشایع و شدید تزریق خون میباشد که به عنوان یک عامل مهم مرگ و میر ناشی از تزریق خون در نظر گرفته میشود. وقوعTRALI میتواند هم در حین تزریق خون و هم بعد از تزریق (معمولاً در طی 6 ساعت) باشد که با ادم ریوی و هیپوکسی تشخیص داده میشود (1).
تاریخچه و اپیدمیولوژی:
اولین مورد TRALI در سال 1957 گزارش شد؛ در آن زمان به اشتباه تصور میشد که انتقال غیر فعال لکوآگلوتینینهای با عیار بالا علت این عارضه است (2). در سال 2004 اولین تعریف واحد و معیار استاندارد برای TRALI توسط مؤسسه ملی قلب، ریه و خون NHBLI) : National Heart, Lung and Blood Institute) و کنفرانس اجماع کانادا CCC) : Central Carolina Community) منتشر شد که در آن TRALI به عنوان یک آسیب حاد ریوی/ سندرم دیسترس تنفسی حاد شناخته شد که در حین تزریق خون یا 6 ساعت پس از آن ایجاد میگردد (4، 3). طبق این تعریف معیارهای تشخیصی برای TRALI عبارتند از:
شیوع:
آمار و ارقام متفاوتی در مورد میزان بروز TRALI وجود
دارد؛ به علت تنوع علایم بالینی، فقدان مارکرهـای خـاص
به طور کلی تزریق خون بدون بروز عوارض جانبی و ایمن میباشد اما در برخی مواقع میتواند باعث ایجاد واکنشهای متعددی در فرد گیرنده شود؛ پس با وجود این که تزریق خون میتواند زندگیبخش باشد اما در برخی موارد با آسیبهای جبرانناپذیری همراه بوده و زندگی گیرندگان خون را به خطر میاندازد؛ این واکنشها میتوانند به دنبال تزریق هر کدام از محصولات خونی (گلبول قرمز، پلاسما، پلاکت و..) ایجاد شوند و تهدید کننده حیات باشند. این واکنشها اگر در طی 24 ساعت از تزریق خون و فرآوردههای خونی رخ دهند، در دسته واکنشهای حاد جای میگیرند و اگر روزها تا هفتهها بعد رخ دهند جزو واکنشهای تأخیری در نظر گرفته میشوند (1). آسیب حاد ریه مرتبط با تزریق خون (TRALI) و گرانباری گردش مرتبط با تزریق خون (TACO) یکی از عوامل اصلی عوارض و مرگ و میر بعد از تزریق خون و فرآوردههای خونی میباشد. این واکنشها عموماً در عرض 6 ساعت پس از تزریق خون نمایان میشود و از آن جایی که تا 24 ساعت از تزریق خون و فرآوردههای خونی رخ میدهند، در دسته واکنشهای حاد جای میگیرند (2). در این مقاله مروری به پاتوفیزیولوژی، فاکتورهای خطر رخداد، روشهای تشخیصی و راهکارهای کاهش رخداد این 2 عارضه، مدیریت بیماری و ویژگیهای آزمایشگاهی این عوارض پرداخته شده است.
مواد و روشها
بدین منظور از پژوهشهای معتبر منتشر شده و پایگاههای اطلاعاتی Google scholar ، PubMed و MEDLINE با استفاده از کلید واژههای تزریق خون، واکنشهای تزریق خون، عوامل خطر، آسیب حاد ریوی مرتبط با انتقال خون (TRALI) و گرانباری گردشی ناشی از تزریق خون (TACO) جستجو صورت گرفت و یافتههای 104 مقاله از سال 1996 تا 2025 مورد استناد قرار گرفت.
یافتهها
آسیب حاد ریوی مرتبط با انتقال خونTRALI (Transfusion Related Acute Lung Injury) :
آسیب حاد ریوی یک عارضه ناشایع و شدید تزریق خون میباشد که به عنوان یک عامل مهم مرگ و میر ناشی از تزریق خون در نظر گرفته میشود. وقوعTRALI میتواند هم در حین تزریق خون و هم بعد از تزریق (معمولاً در طی 6 ساعت) باشد که با ادم ریوی و هیپوکسی تشخیص داده میشود (1).
تاریخچه و اپیدمیولوژی:
اولین مورد TRALI در سال 1957 گزارش شد؛ در آن زمان به اشتباه تصور میشد که انتقال غیر فعال لکوآگلوتینینهای با عیار بالا علت این عارضه است (2). در سال 2004 اولین تعریف واحد و معیار استاندارد برای TRALI توسط مؤسسه ملی قلب، ریه و خون NHBLI) : National Heart, Lung and Blood Institute) و کنفرانس اجماع کانادا CCC) : Central Carolina Community) منتشر شد که در آن TRALI به عنوان یک آسیب حاد ریوی/ سندرم دیسترس تنفسی حاد شناخته شد که در حین تزریق خون یا 6 ساعت پس از آن ایجاد میگردد (4، 3). طبق این تعریف معیارهای تشخیصی برای TRALI عبارتند از:
- شروع ناگهانی (در حین تزریق خون یا 6 ساعت پس از آن)
- هیپوکسی (90% SpO2<)
- ارتشاح دو طرفه در تصویربرداری ریه
- شواهدی از گرانباری گردشی و افزایش فشار خون دهلیز چپ وجود نداشته باشد
- قبل از تزریق خون شواهدی از آسیب حاد ریه یا ARDS (Acute respiratory distress syndrome) در فرد دیده نشود.
شیوع:
آمار و ارقام متفاوتی در مورد میزان بروز TRALI وجود
دارد؛ به علت تنوع علایم بالینی، فقدان مارکرهـای خـاص

رنج طبیعی آن 300 تا 500 میلی متر جیوه می باشد موارد با ARDS خفیف نسبت 200 تا 300 میلی متر جیوه دارند. در صورتی که ارتفاع محل زندگی بیشتر از 1000 متر باشد، فاکتور تصحیح نیز باید به صورت زیر محاسبه گردد(5).
[(PaO2/FiO2) × (barometric pressure/760)]
LAH: left atrial hypertension*
بیماری و آزمایشهای تشخیصی و تعاریف متعدد در مورد TRALI، آمار مربوط به TRALI دقیق و کامل نیست (6). یک مطالعه متاآنالیز در سال 2024 با غربالگری صدها مقاله منتشر شده و انتخاب 80 مطالعه (شامل 176 میلیون واحد خونی تزریق شده) آمار و ارقام مربوط به بروز TRALIرا مورد پایش قرار داد. این مطالعه نشان داد میزان بروز TRALI بر اساس محصولات خونی به این صورت بود: تزریق در فرآورده گلبول قرمز به میزان 17/0 در هر 10،000 واحد گلبول قرمز که معادل 0017/0 درصد یا یک در هر 58824 واحد RBC موارد میباشد. فرآورده پلاکت به میزان 31/0 در هر 10،000 واحد که معادل 0031/0درصد یا یک در هر 32258 واحد پلاکت است و در مورد فرآورده پلاسما 19/3 در هر 10،000 واحد (معادل 032/0 درصد یا یک در 3134 واحد پلاسما) تزریق شده میباشد (7).
مطالعههای قبلی میزان بروزTRALI را بالاتر گزارش کرده بودند؛ به عنوان مثال قبل از اجرای راهکارهای کاهش TRALI بروز آن تقریباً 04/0 تا 1/0 درصد به ازای هر بیماری که تزریق فرآورده خون انجام داده یا تقریباً در 2/0 درصد از واحدهای تزریق شده، گزارش شده بود (یک مورد در هر 5000 واحد تزریقی) (9، 8). علاوه بر موارد بیان شده، لازم به ذکر است که میزان بروز TRALI به وضعیت بیماران نیز بستگی دارد؛ به عنوان مثال برآوردها نشان میدهند که میزان رخداد TRALI در بیماران بدحال (بیماران بستری که وضعیت سلامتی آنها به شدت وخیم است و نیاز به مراقبتهای فوری و تخصصی دارند) ممکن است به 5 تا 8 درصد نیز برسد (11، 10).
پیشآگهی :
به طور کلی افراد مبتلا به TRALI پیشآگهی نسبتا ًخوبی دارند و عمده بیماران معمولاً در طی 48 تا 96 ساعت بعد از واکنش بهبود مییابند؛ با این حال TRALI یک واکنش جدی انتقال خون است. میزان مرگ و میر آن بسته به جمعیت بیماران متفاوت است؛ به طور کلی در 5 تا 10 درصد موارد باعث مرگ میشود (14-12)؛ این میزان در بیماران تحت مراقبت شدید و جراحی حتی تا 47 درصد هم میرسد (10).
علایم بالینی:
تظاهـرات بالینـی TRALIعمدتـاً در طی 6 ساعت اول
بعد از تزریق خون مشاهده میشود (تا 24ساعت بعد از تزریق خون هم ممکن است رخ دهد)؛ شدت علایم بسته به شرایط فرد متغیر خواهد بود. اختلالات تنفسی مانند تنگی نفس (Dyspnea)، افزایش تعداد تنفس (Tachypnea) و هیپوکسی از علایم اصلی TRALI هستند؛ این عوارض به علت افزایش نفوذپذیری عروق ریوی و متعاقب آن ادم ریوی می باشد. از علایم شایع دیگر در TRALI میتوان به تب، افت یا افزایش فشار خون و سیانوز اشاره کرد (15، 6). کاهش گذرای نوتروفیل خون محیطی به علت تجمع آنها در ریه، نیز گزارش شده است (16).
علایم TRALI بسیار شبیه به گرانباری گردشی ناشی از تزریق خون (TACO : Transfusion-Associated Circulatory Overload) است؛ به همین دلیل تشخیص و تمایز TRALI از TACO مشکل میباشد؛ چون هر دو با دیسترس تنفسی موقت بعد از انتقال خون همراه هستند؛ با این تفاوت که در TACO ادم قلبی- ریوی بوده ولی در TRALI ادم غیر قلبی است (18، 17).
عوامل خطر (Risk factors):
یک مطالعه کوهورت آیندهنگر چند مرکزی با استفاده از استراتژیهای نظارتی فعال برای تشخیص TRALI، عوامل خطر گیرنده را شناسایی کرد. طبق این مطالعه عوامل خطر TRALI قبل از تزریق خون شامل موارد جراحی پیوند کبد، مصرف مزمن الکل، مصرف سیگار، مقادیر بالای اینترلوکین 8، فشار بالای راه هوایی در هنگام تهویه مکانیکی با وِنتیلاتور و تعادل مثبت مایعات میباشد. همچنین مشاهده شده است که کاهش سطح اینترلوکین 10(ضد التهابی) و افزایش پروتئین C واکنشی (CRP) با افزایش خطر بروز TRALI مرتبط هستند (19).
پاتوفیزیولوژی:
علیرغم مطالعهها و اطلاعات فراوان به دست آمده در سالهای اخیر، مکانیسم دقیق وقوع TRALI همچنان به طور کامل مشخص نشده است اما عوامل مختلف ایمونولوژیک و غیر ایمونولوژیک میتوانند در ایجاد TRALI نقش داشته باشند (20). همه فرآوردههایی که حاوی پلاسما هستند (مانند خون کامل، پلاسمای منجمد تازه، رسوب کرایو و پلاکت آفرزیس) ممکن است این واکنش را ایجاد کنند (21)؛ حتی مقادیر کم پلاسما (15-10میلیلیتر) هـم ممکـن اسـت باعـث القـــــای TRALI گردد (22).
چندین مکانیسم مختلف برای ایجاد TRALI گزارش شده است؛ اولین و شاید مهمترین مکانیسم، حضور آلوآنتیبادی علیه آنتیژنهای لکوسیتی 1 و 2 (HLA 1,2) و آنتیژنهای نوتروفیلی (HNA) در پلاسما میباشد. این آنتیبادیها مسئول 80-50 درصد موارد TRALI هستند (23). در اکثر موارد منشا این آنتیبادیها پلاسمای فرد اهداکننده است؛ در کمتر از 10 درصد موارد ممکن است آنتیبادیها در فرد گیرنده وجود داشته باشد (24، 8).
اتصال آنتیبادی به گرانولیستها باعث تثبیت کمپلمان شده و متعاقب آن محصولات کمپلمان مانند C5a باعث ورود و تجمع نوتروفیلها در عروق ریه گردیده و در نتیجه نوتروفیلهای فعال شده، پروتئاز و رادیکالهای آزاد اکسیژن (ROS) تولید میکنند که باعث تخریب اندوتلیال عروق ریوی میگردند. به دنبال این اتفاقات پروتئینها و مایعات از فضای عروقی وارد آلوئولها و فضای بینابینی ریه شده و درنهایت ادم ریوی رخ میدهد (25).
یکی دیگر از عواملی که میتواند باعث ایجاد TRALI شود، لیپیدهای فعال میباشند؛ این لیپیدها که از غشای سلولهای خونی منشا میگیرند در حین ذخیرهسازی محصولات خونی در بانک خون، مقادیرشان افزایش یافته و موجب فعال شدن نوتروفیلها و آسیب عروق ریوی میگردند (27، 26). مکانیسم دیگری که در پاتوژنز TRALI نقش دارد، اصلاحکنندههای پاسخ بیولوژیک (BRM: Biologic response modifiers ( مانند CD40Lو سیتوکاینهای التهابی (IL1 ,6 و TNFα) هستند که در حین ذخیرهسازی تولید میشوند؛ 10 تا 15 درصد موارد TRALI مرتبط با این BRMs ها میباشد؛ بنابراین وقوع TRALI در تزریق محصولات فاقد آنتیبادی هم امکانپذیر است (29، 28). این سیتوکاینهای التهابی بیان ICAM1 روی سلولهای اندوتلیال را افزایش میدهند و نوتروفیلها از طریق β2 اینتگرین خود به آنها متصل شده و باعث پیشبرد TRALI میگردند (30). به نظر میرسد ماکروفاژها و نوتروفیلها نقش اساسی در شروع TRALI دارند و سلولهایی مانندT تنظیمی و دندرتیک سل نقش محافظتی در برابر TRALI ایفا میکنند (31، 19).
پاتوژنز TRALI را در دو تئوری میتوان توصیف نمود؛ در تئوری اول شرایط بالینی زمینهای فرد و در تئوری دوم عوامل خطرساز موجود در کیسه خون با یکدیگر میتوانند نقش بسیار مهمی در ایجاد TRALI ایفا کنند (32)؛ در تئوری اول وضعیت زمینهای فرد عامل بسیار مهمی در نظر گرفته شده که در آن سلولهای اندوتلیال ریوی و سلولهای نوتروفیل (PMN)ها فعال شده و باعث بروز آسیب میگردند (29). بیماری و شرایط زمینهای افراد مانند سپسیس، مصرف مزمن الکل، پیوند کبد، بدخیمیهای خونی، مصرف سیگار و شرایط میکروآنژیوپاتیک با افزایش خطر TRALI مرتبط است (33). در تئوری دوم عوامل موجود در محصولات خونی تزریق شده، سلولهای مختلفی از جمله نوتروفیلها، ماکروفاژها، منوسیتها، سلولهای اندوتلیال ریوی و حتی پلاکتها را تحریک میکنند که منجر به آزادسازی فاکتورهای پاتوژنتیک گردیده و در نهایت القا تجمع لکوسیتی و آسیب ریوی ایجاد میشود. تئوری دوم بر اساس شناسایی عوامل موجود در کیسه تزریق شده به دو دسته وابسته به آنتیبادی و مستقل از آنتیبادی (BRMها) تقسیم میگردد (29).
به طور کلی پاتوژنز TRALI را میتوان در 3 مرحله 1-فاز اولیه 2-واکنش ریوی 3- فاز عملکردی(Effector) که با یکدیگر همپوشانی دارند توصیف نمود: در فاز اول عوامل فاکتورهای خطر گیرنده و بیماریهای زمینهای آنها مانند التهاب سیستمیک، نارسایی کبدی، جراحی، بیماریهای قلبی و.. منجر به تحریک سلولهای اندوتلیال و ماکروفاژها شده که باعث جذب سلولهای نوتروفیل (PMN) به سمت ریه و شروع فاز اولیه TRALI میگردند؛ بنابراین عوامل بالینی زمینهای افراد نقش بسیار مهمی در شروع TRALI ایفا میکند؛ غربالگری این عوامل در گیرندگان خون میتواند نتایج بالینی را بهبود ببخشد (29).
در فاز دوم به دنبال فعال شدن سلولهای اندوتلیال و PMN ها (به علت عوامل زمینهای گیرنده)، عوامل پاتوژنیک موجود در اجزای خون فرد اهداکننده مانند آنتیبادیها و BRM ها سلولهای مختلفی از میزبان (اعم از هماتوپوئتیک و غیر هماتوپوئتیک) را مورد هدف قرار میدهند و بدین ترتیب این عوامل نقش به سزایی در پاسخ میزبان و پیشرفت TRALI دارند (35، 34).
در فاز سوم سلولهای فعال شده مانند سلولهای اندوتلیال، منوسیتها، ماکروفاژها و به خصوص نوتروفیلها با تولید رادیکالهای آزاد اکسیژن (ROS) و ایجاد دام خارج سلولی (NETs; neutrophil extracellular traps) باعث آسیب مستقیم به اندوتلیال عروق ریوی و در نهایت ادم ریوی میگردند (29).
مدیریت و درمان:
در سالهای اخیر با روشهایی که شامل مدیریت خون اهداکننده (donor vigilance)، پردازش اجزای خون (blood component processing) و مدیریت خون بیمار (patient blood management) است، توانستهاند عوارض مربوط به TRALI را کاهش دهند؛ با این وجود تاکنون درمان خاص و کاملی برای TRALI در دسترس نیست (37، 36، 29)؛ بنابراین مدیریت و انتخابهای درمانی TRALI بیشتر اقدامات حمایتی مانند اکسیژناسیون، لولهگذاری نایی و تهویه مکانیکی است (38، 29).
در زمان افت شدید فشار خون، استفاده از داروهای افزایشدهنده فشار خون (وازوپرسور) میتواند کمککننده باشد. در یک آزمایش بالینی مشخص شد که با تزریق داخل وریدی دوز بالای آسکوربیک اسید، افراد بد حال TRALI بقای بهتری نشان میدهند؛ به دلیل این که آسکوربیک اسید میتواند آسیب ROS ها را محدود کند (39). لازم به ذکر است که اگر در حین تزریق این عارضه رخ دهد همانند واکنشهای دیگر، اولین اقدام قطع فوری تزریق خون است (40).
در رویکردهای درمانی جدید به کاهش التهاب مرتبط با TRALI توجه زیادی نمودهاند؛ اهدافی مانند فاکتورهای ضد التهابی و تنظیمکنندههای ایمنی مورد بررسی قرار گرفتهاند؛ بلاککردن گیرنده اینترلوکین 8، ایجاد اختلال در تشکیل NET، مهارکنندههای کمپلمان، القاء کاهش سطح CRP و.. از جمله این رویکردهای درمانی جدید هستند (41، 18).
پیشگیری:
همان طور که ذکر کردیم آنتیبادیها و عوامل خطرساز موجود در محصولات خونی میتوانند باعث بروز TRALI شوند؛ بنابراین باید اقدامات پیشگیرانه در ارتباط با این عوامل انجام دهیم. از جمله اقدامات پیشگیرانه میتوان موارد زیر را نام برد:
1- استفاده از فرآورده خون شسته شده؛ از مهمترین و مؤثرترین راههای پیشگیری از TRALI میباشد؛ در خــون
شستـه شـده پلاسمـا و آنتــیبادیهای همـراه آن حذف گردیده و از بروز TRALIجلوگیری میگردد (42).
2- معافیت اهداکنندگانی که آنتیبادیهای مسئول ایجاد TRALI در آنها شناسایی شده است و این افراد برای همیشه از اهدای خون معاف خواهند شد (8).
3- معافیت بانوان با زایمانهای متعدد از اهدای پلاسما و استفاده از پلاسمای مردان، ازدیگر اقدامات پیشگرانه است؛ چون در زنان میزان آنتیبادیهای ضد HLAبا افزایش تعداد دفعات زایمان افزایش مییابد (43).
4- غربالگری آنتیبادیهای آنتیلکوسیتی تمام افراد دهنده؛ این راه به علت هزینههای گزاف آن به طور روتین انجام نمیگردد (44).
5- فرآیند فیلترکردن گلبولهای سفید در مراکز انتقال خون (Leukofiltration) از دیگر راههای مؤثر پیشگیری از TRALI است؛ این فرآیند باعث کاهش لکوسیتها و به دنبال آن کاهش عوامل پیش التهابی مشتق ازآن (مانند IL1, IL6 و TNFα) میشود (45).
6- استفاده از محلولهای افزودنی پلاکت به جای پلاسمای موجود در فرآورده پلاکت میتواند عوارض مرتبط با TRALI را کاهش دهد، این راهکار به خصوص در مورد فرآورده پلاکتی اهداکنندگان خانم که میزان و شیوع آنتیبادی علیه HLA در آنها بیشتر از اهداکنندگان مرد میباشد، اهمیت بیشتری دارد (47، 46).
7- استفـــاده از پلاسمای تیمار شده بـا حـلال شـوینـده
(solvent/detergent-treated plasma)؛ هر واحد پلاسمای S/D از چندین اهداکننده تهیه شده تا آنتیبادیهای ضد لکوسیت که منجر به TRALI میشود توسط آنتیژنهای محلول HLA موجود در سایر پلاسماها خنثیسازی شده و همچنین این مخلوط کردن پلاسماها باعث رقیقسازی آنتیبادیهای ضد HLA موجود در پلاسما خواهد شد. رخداد TRALI از طریق S/D-Plasma به شدت نادر است به طوری که در مرکز دادههای هموویژیلانس فرانسه در سالهای 2007 و 2008 ، هیچ گزارشی از وقوع TRALI در پی تزریق 212000 واحد S/D-Plasma مشاهده نشد در حالی که رخداد TRALI در تزریق FFP شیوع 1 در هر 31000 واحد دارد (49، 48). استفاده از پلاسمای S/D در سال 2013 توسط سازمان غذا و داروی آمریکا تایید شده و به طور گسترده در بسیاری از کشورهای اروپایی استفاده میگردد (49).
اپیدمیولوژی:
گرانباری گردشی مرتبط با تزریق خون (TACO):
TACO (Transfusion-associated circulatory overload) که به عنوان یک عارضه حاد ناشی از تزریق خون تلقی گردیده، مجموعهای از علایم و نشانههای ادم ریوی در حین تزریق خون یا 6 تا 12 ساعت پس از آن
مطالعههای قبلی میزان بروزTRALI را بالاتر گزارش کرده بودند؛ به عنوان مثال قبل از اجرای راهکارهای کاهش TRALI بروز آن تقریباً 04/0 تا 1/0 درصد به ازای هر بیماری که تزریق فرآورده خون انجام داده یا تقریباً در 2/0 درصد از واحدهای تزریق شده، گزارش شده بود (یک مورد در هر 5000 واحد تزریقی) (9، 8). علاوه بر موارد بیان شده، لازم به ذکر است که میزان بروز TRALI به وضعیت بیماران نیز بستگی دارد؛ به عنوان مثال برآوردها نشان میدهند که میزان رخداد TRALI در بیماران بدحال (بیماران بستری که وضعیت سلامتی آنها به شدت وخیم است و نیاز به مراقبتهای فوری و تخصصی دارند) ممکن است به 5 تا 8 درصد نیز برسد (11، 10).
پیشآگهی :
به طور کلی افراد مبتلا به TRALI پیشآگهی نسبتا ًخوبی دارند و عمده بیماران معمولاً در طی 48 تا 96 ساعت بعد از واکنش بهبود مییابند؛ با این حال TRALI یک واکنش جدی انتقال خون است. میزان مرگ و میر آن بسته به جمعیت بیماران متفاوت است؛ به طور کلی در 5 تا 10 درصد موارد باعث مرگ میشود (14-12)؛ این میزان در بیماران تحت مراقبت شدید و جراحی حتی تا 47 درصد هم میرسد (10).
علایم بالینی:
تظاهـرات بالینـی TRALIعمدتـاً در طی 6 ساعت اول
بعد از تزریق خون مشاهده میشود (تا 24ساعت بعد از تزریق خون هم ممکن است رخ دهد)؛ شدت علایم بسته به شرایط فرد متغیر خواهد بود. اختلالات تنفسی مانند تنگی نفس (Dyspnea)، افزایش تعداد تنفس (Tachypnea) و هیپوکسی از علایم اصلی TRALI هستند؛ این عوارض به علت افزایش نفوذپذیری عروق ریوی و متعاقب آن ادم ریوی می باشد. از علایم شایع دیگر در TRALI میتوان به تب، افت یا افزایش فشار خون و سیانوز اشاره کرد (15، 6). کاهش گذرای نوتروفیل خون محیطی به علت تجمع آنها در ریه، نیز گزارش شده است (16).
علایم TRALI بسیار شبیه به گرانباری گردشی ناشی از تزریق خون (TACO : Transfusion-Associated Circulatory Overload) است؛ به همین دلیل تشخیص و تمایز TRALI از TACO مشکل میباشد؛ چون هر دو با دیسترس تنفسی موقت بعد از انتقال خون همراه هستند؛ با این تفاوت که در TACO ادم قلبی- ریوی بوده ولی در TRALI ادم غیر قلبی است (18، 17).
عوامل خطر (Risk factors):
یک مطالعه کوهورت آیندهنگر چند مرکزی با استفاده از استراتژیهای نظارتی فعال برای تشخیص TRALI، عوامل خطر گیرنده را شناسایی کرد. طبق این مطالعه عوامل خطر TRALI قبل از تزریق خون شامل موارد جراحی پیوند کبد، مصرف مزمن الکل، مصرف سیگار، مقادیر بالای اینترلوکین 8، فشار بالای راه هوایی در هنگام تهویه مکانیکی با وِنتیلاتور و تعادل مثبت مایعات میباشد. همچنین مشاهده شده است که کاهش سطح اینترلوکین 10(ضد التهابی) و افزایش پروتئین C واکنشی (CRP) با افزایش خطر بروز TRALI مرتبط هستند (19).
پاتوفیزیولوژی:
علیرغم مطالعهها و اطلاعات فراوان به دست آمده در سالهای اخیر، مکانیسم دقیق وقوع TRALI همچنان به طور کامل مشخص نشده است اما عوامل مختلف ایمونولوژیک و غیر ایمونولوژیک میتوانند در ایجاد TRALI نقش داشته باشند (20). همه فرآوردههایی که حاوی پلاسما هستند (مانند خون کامل، پلاسمای منجمد تازه، رسوب کرایو و پلاکت آفرزیس) ممکن است این واکنش را ایجاد کنند (21)؛ حتی مقادیر کم پلاسما (15-10میلیلیتر) هـم ممکـن اسـت باعـث القـــــای TRALI گردد (22).
چندین مکانیسم مختلف برای ایجاد TRALI گزارش شده است؛ اولین و شاید مهمترین مکانیسم، حضور آلوآنتیبادی علیه آنتیژنهای لکوسیتی 1 و 2 (HLA 1,2) و آنتیژنهای نوتروفیلی (HNA) در پلاسما میباشد. این آنتیبادیها مسئول 80-50 درصد موارد TRALI هستند (23). در اکثر موارد منشا این آنتیبادیها پلاسمای فرد اهداکننده است؛ در کمتر از 10 درصد موارد ممکن است آنتیبادیها در فرد گیرنده وجود داشته باشد (24، 8).
اتصال آنتیبادی به گرانولیستها باعث تثبیت کمپلمان شده و متعاقب آن محصولات کمپلمان مانند C5a باعث ورود و تجمع نوتروفیلها در عروق ریه گردیده و در نتیجه نوتروفیلهای فعال شده، پروتئاز و رادیکالهای آزاد اکسیژن (ROS) تولید میکنند که باعث تخریب اندوتلیال عروق ریوی میگردند. به دنبال این اتفاقات پروتئینها و مایعات از فضای عروقی وارد آلوئولها و فضای بینابینی ریه شده و درنهایت ادم ریوی رخ میدهد (25).
یکی دیگر از عواملی که میتواند باعث ایجاد TRALI شود، لیپیدهای فعال میباشند؛ این لیپیدها که از غشای سلولهای خونی منشا میگیرند در حین ذخیرهسازی محصولات خونی در بانک خون، مقادیرشان افزایش یافته و موجب فعال شدن نوتروفیلها و آسیب عروق ریوی میگردند (27، 26). مکانیسم دیگری که در پاتوژنز TRALI نقش دارد، اصلاحکنندههای پاسخ بیولوژیک (BRM: Biologic response modifiers ( مانند CD40Lو سیتوکاینهای التهابی (IL1 ,6 و TNFα) هستند که در حین ذخیرهسازی تولید میشوند؛ 10 تا 15 درصد موارد TRALI مرتبط با این BRMs ها میباشد؛ بنابراین وقوع TRALI در تزریق محصولات فاقد آنتیبادی هم امکانپذیر است (29، 28). این سیتوکاینهای التهابی بیان ICAM1 روی سلولهای اندوتلیال را افزایش میدهند و نوتروفیلها از طریق β2 اینتگرین خود به آنها متصل شده و باعث پیشبرد TRALI میگردند (30). به نظر میرسد ماکروفاژها و نوتروفیلها نقش اساسی در شروع TRALI دارند و سلولهایی مانندT تنظیمی و دندرتیک سل نقش محافظتی در برابر TRALI ایفا میکنند (31، 19).
پاتوژنز TRALI را در دو تئوری میتوان توصیف نمود؛ در تئوری اول شرایط بالینی زمینهای فرد و در تئوری دوم عوامل خطرساز موجود در کیسه خون با یکدیگر میتوانند نقش بسیار مهمی در ایجاد TRALI ایفا کنند (32)؛ در تئوری اول وضعیت زمینهای فرد عامل بسیار مهمی در نظر گرفته شده که در آن سلولهای اندوتلیال ریوی و سلولهای نوتروفیل (PMN)ها فعال شده و باعث بروز آسیب میگردند (29). بیماری و شرایط زمینهای افراد مانند سپسیس، مصرف مزمن الکل، پیوند کبد، بدخیمیهای خونی، مصرف سیگار و شرایط میکروآنژیوپاتیک با افزایش خطر TRALI مرتبط است (33). در تئوری دوم عوامل موجود در محصولات خونی تزریق شده، سلولهای مختلفی از جمله نوتروفیلها، ماکروفاژها، منوسیتها، سلولهای اندوتلیال ریوی و حتی پلاکتها را تحریک میکنند که منجر به آزادسازی فاکتورهای پاتوژنتیک گردیده و در نهایت القا تجمع لکوسیتی و آسیب ریوی ایجاد میشود. تئوری دوم بر اساس شناسایی عوامل موجود در کیسه تزریق شده به دو دسته وابسته به آنتیبادی و مستقل از آنتیبادی (BRMها) تقسیم میگردد (29).
به طور کلی پاتوژنز TRALI را میتوان در 3 مرحله 1-فاز اولیه 2-واکنش ریوی 3- فاز عملکردی(Effector) که با یکدیگر همپوشانی دارند توصیف نمود: در فاز اول عوامل فاکتورهای خطر گیرنده و بیماریهای زمینهای آنها مانند التهاب سیستمیک، نارسایی کبدی، جراحی، بیماریهای قلبی و.. منجر به تحریک سلولهای اندوتلیال و ماکروفاژها شده که باعث جذب سلولهای نوتروفیل (PMN) به سمت ریه و شروع فاز اولیه TRALI میگردند؛ بنابراین عوامل بالینی زمینهای افراد نقش بسیار مهمی در شروع TRALI ایفا میکند؛ غربالگری این عوامل در گیرندگان خون میتواند نتایج بالینی را بهبود ببخشد (29).
در فاز دوم به دنبال فعال شدن سلولهای اندوتلیال و PMN ها (به علت عوامل زمینهای گیرنده)، عوامل پاتوژنیک موجود در اجزای خون فرد اهداکننده مانند آنتیبادیها و BRM ها سلولهای مختلفی از میزبان (اعم از هماتوپوئتیک و غیر هماتوپوئتیک) را مورد هدف قرار میدهند و بدین ترتیب این عوامل نقش به سزایی در پاسخ میزبان و پیشرفت TRALI دارند (35، 34).
در فاز سوم سلولهای فعال شده مانند سلولهای اندوتلیال، منوسیتها، ماکروفاژها و به خصوص نوتروفیلها با تولید رادیکالهای آزاد اکسیژن (ROS) و ایجاد دام خارج سلولی (NETs; neutrophil extracellular traps) باعث آسیب مستقیم به اندوتلیال عروق ریوی و در نهایت ادم ریوی میگردند (29).
مدیریت و درمان:
در سالهای اخیر با روشهایی که شامل مدیریت خون اهداکننده (donor vigilance)، پردازش اجزای خون (blood component processing) و مدیریت خون بیمار (patient blood management) است، توانستهاند عوارض مربوط به TRALI را کاهش دهند؛ با این وجود تاکنون درمان خاص و کاملی برای TRALI در دسترس نیست (37، 36، 29)؛ بنابراین مدیریت و انتخابهای درمانی TRALI بیشتر اقدامات حمایتی مانند اکسیژناسیون، لولهگذاری نایی و تهویه مکانیکی است (38، 29).
در زمان افت شدید فشار خون، استفاده از داروهای افزایشدهنده فشار خون (وازوپرسور) میتواند کمککننده باشد. در یک آزمایش بالینی مشخص شد که با تزریق داخل وریدی دوز بالای آسکوربیک اسید، افراد بد حال TRALI بقای بهتری نشان میدهند؛ به دلیل این که آسکوربیک اسید میتواند آسیب ROS ها را محدود کند (39). لازم به ذکر است که اگر در حین تزریق این عارضه رخ دهد همانند واکنشهای دیگر، اولین اقدام قطع فوری تزریق خون است (40).
در رویکردهای درمانی جدید به کاهش التهاب مرتبط با TRALI توجه زیادی نمودهاند؛ اهدافی مانند فاکتورهای ضد التهابی و تنظیمکنندههای ایمنی مورد بررسی قرار گرفتهاند؛ بلاککردن گیرنده اینترلوکین 8، ایجاد اختلال در تشکیل NET، مهارکنندههای کمپلمان، القاء کاهش سطح CRP و.. از جمله این رویکردهای درمانی جدید هستند (41، 18).
پیشگیری:
همان طور که ذکر کردیم آنتیبادیها و عوامل خطرساز موجود در محصولات خونی میتوانند باعث بروز TRALI شوند؛ بنابراین باید اقدامات پیشگیرانه در ارتباط با این عوامل انجام دهیم. از جمله اقدامات پیشگیرانه میتوان موارد زیر را نام برد:
1- استفاده از فرآورده خون شسته شده؛ از مهمترین و مؤثرترین راههای پیشگیری از TRALI میباشد؛ در خــون
شستـه شـده پلاسمـا و آنتــیبادیهای همـراه آن حذف گردیده و از بروز TRALIجلوگیری میگردد (42).
2- معافیت اهداکنندگانی که آنتیبادیهای مسئول ایجاد TRALI در آنها شناسایی شده است و این افراد برای همیشه از اهدای خون معاف خواهند شد (8).
3- معافیت بانوان با زایمانهای متعدد از اهدای پلاسما و استفاده از پلاسمای مردان، ازدیگر اقدامات پیشگرانه است؛ چون در زنان میزان آنتیبادیهای ضد HLAبا افزایش تعداد دفعات زایمان افزایش مییابد (43).
4- غربالگری آنتیبادیهای آنتیلکوسیتی تمام افراد دهنده؛ این راه به علت هزینههای گزاف آن به طور روتین انجام نمیگردد (44).
5- فرآیند فیلترکردن گلبولهای سفید در مراکز انتقال خون (Leukofiltration) از دیگر راههای مؤثر پیشگیری از TRALI است؛ این فرآیند باعث کاهش لکوسیتها و به دنبال آن کاهش عوامل پیش التهابی مشتق ازآن (مانند IL1, IL6 و TNFα) میشود (45).
6- استفاده از محلولهای افزودنی پلاکت به جای پلاسمای موجود در فرآورده پلاکت میتواند عوارض مرتبط با TRALI را کاهش دهد، این راهکار به خصوص در مورد فرآورده پلاکتی اهداکنندگان خانم که میزان و شیوع آنتیبادی علیه HLA در آنها بیشتر از اهداکنندگان مرد میباشد، اهمیت بیشتری دارد (47، 46).
7- استفـــاده از پلاسمای تیمار شده بـا حـلال شـوینـده
(solvent/detergent-treated plasma)؛ هر واحد پلاسمای S/D از چندین اهداکننده تهیه شده تا آنتیبادیهای ضد لکوسیت که منجر به TRALI میشود توسط آنتیژنهای محلول HLA موجود در سایر پلاسماها خنثیسازی شده و همچنین این مخلوط کردن پلاسماها باعث رقیقسازی آنتیبادیهای ضد HLA موجود در پلاسما خواهد شد. رخداد TRALI از طریق S/D-Plasma به شدت نادر است به طوری که در مرکز دادههای هموویژیلانس فرانسه در سالهای 2007 و 2008 ، هیچ گزارشی از وقوع TRALI در پی تزریق 212000 واحد S/D-Plasma مشاهده نشد در حالی که رخداد TRALI در تزریق FFP شیوع 1 در هر 31000 واحد دارد (49، 48). استفاده از پلاسمای S/D در سال 2013 توسط سازمان غذا و داروی آمریکا تایید شده و به طور گسترده در بسیاری از کشورهای اروپایی استفاده میگردد (49).
اپیدمیولوژی:
گرانباری گردشی مرتبط با تزریق خون (TACO):
TACO (Transfusion-associated circulatory overload) که به عنوان یک عارضه حاد ناشی از تزریق خون تلقی گردیده، مجموعهای از علایم و نشانههای ادم ریوی در حین تزریق خون یا 6 تا 12 ساعت پس از آن

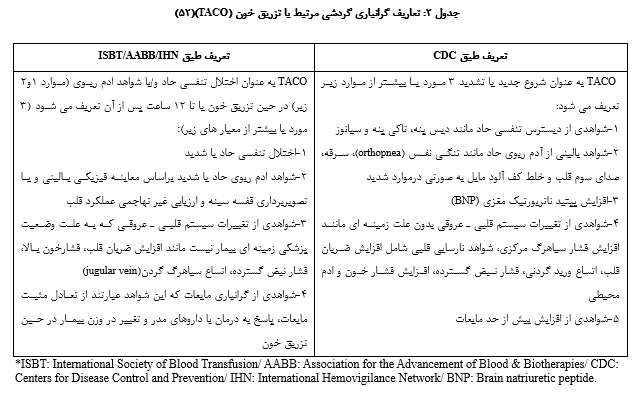
توصیف میشود. برای توضیح سادهتر این واکنش،TACO زمانی رخ میدهد که حجم محصول خونی تزریقی، سیستم قلبی ـ عروقی فرد گیرنده را تحت تاثیر قرار داده و منجر به ادم ریوی گردد (50). در حال حاضر تعاریف متعددی برای TACO استفاده میشود که در جدول ارایه شده است (51) (جدول 2).
در طول دهه 1980 و1990، TACO به عنوان یک واکنش جدی انتقال خون با مرگ و میر بالا شناخته شد. به مرور افزایش آگاهی در مورد TACO منجر به افزایش گزارش بروز TACO گردید (53)؛ اما همچنان به علت عدم وجود یک تست آزمایشگاهی بسیار حساس و اختصاصی، میزان دقیق بروز TACO نامشخص است (54).
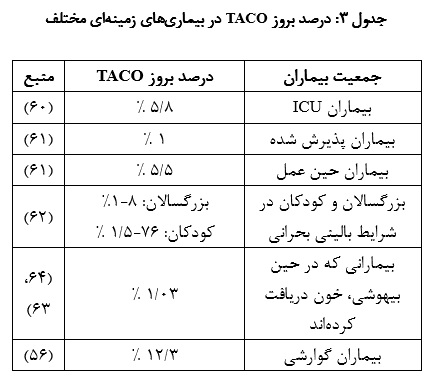
هم چنین ارزیابی TACO به دلیل گزارش ناکافی و فقدان یک تعریف واحد برای آن دشوار میباشد. طبق مطالعهها و گزارشهای منتشر شده، وقوع TACO بین 1 تا 3/12 درصد متفاوت است. (بسته به جمعیت مورد مطالعه که میتواند افراد با بیماری خفیف تا شدید باشد)(56، 55). در یک مطالعه انجام شده در بین 56208 نفر از افرادی که تزریق خون انجام دادند، TACO در 102 نفر از آنها مشاهده شد (18/0درصد)(57).
TACO میتواند پس از تزریق هر فرآورده خونی رخ دهد، اما در بین فرآوردههای خونی، بیشتر با انتقال گلبولهای قرمز مرتبط میباشد و علت آن حجم تزریق شده در مورد واحد گلبول قرمز از آن جایی میباشد که هر واحد گلبول قرمز 350-300 میلیلیتر حجم دارد (56).
TACO از واکنشهای تبزای غیر همولیتیک (FNHTR) (Febrile non-hemolytic transfusion reaction) و آلرژی کمتر شایع بوده ولی از واکنش آنافیلاکسی ناشی از انتقال خون، GVHD ناشی از انتقال خون (Transfusion – associated graft– versus – host disease) (TA-GVHD) و TRALI شایعتر است (59، 58).
علایم بالینی:
تغییرات علایم حیاتی در طول پیشرفت TACO مشاهده میگردد؛ این علایم میتواند در چند دقیقه اول پس از تزریق خون تا 12 ساعت پس از قطع تزریق، رخ دهد (65). اولین و شاید مهمترین تغییر، افزایش فشار خون سیستولی/دیاستولی و فشار خون ورید مرکزی اسـت
(66، 60).
از دیگر تغییرات علایم حیاتی در TACO میتوان به افزایش تعداد تنفس (Tachypnea)، افزایش ضربان قلب (Tachycardia)، تنگی نفس (Dyspnea)، کاهش اشباع اکسیژن شریانی به زیر 90 درصد و اتساع سیاهرگ گردنی (jugular vein) اشاره کرد (65). همچنین سیانوز، خلط صورتی و کف آلود، سرفه و کاهش برونده ادرار در TACO دیده شده است (65). جالب توجه است که یک سوم افراد با عارضه TACO تب دارند؛ علت این که چرا تب در برخی از افراد با عارضه TACO وجود دارد و در برخی وجود ندارد، مشخص نیست (67، 65). در تصویربرداری اشعه ایکس ممکن است علایم بزرگی قلب وجود داشته باشد؛ همچنین در بررسی ریه صدای غیر طبیعی ریوی (Crackles on auscultation) ممکن است شنیده شود (65).
عوامل خطر(Risk factors) :
TACO میتواند در هر فردی رخ دهد اما احتمال بروز آن در افرادی که عوامل خطرزا را دارند، بیشتر است؛ شناسایی این عوامل میتواند در تشخیص زودتر، درمان بهتر و کاهش شدت عوارض کمک کند. چندین عامل خطر بالینی برای بروز و پیشرفت TACO شناسایی شده است:
1- سن: افراد مسن در معرض خطر بیشتری برای بروز TACO قرار دارند (69، 68). بر اساس SHOT DATA (Serious Hazards of Transfusion) تقریباً 60 درصد افراد با عارضه TACO بالای 70 سال سن داشتند؛ همچنین کودکان کمتر از 3 سال هم در معرض خطر زیادی قرار
هم چنین ارزیابی TACO به دلیل گزارش ناکافی و فقدان یک تعریف واحد برای آن دشوار میباشد. طبق مطالعهها و گزارشهای منتشر شده، وقوع TACO بین 1 تا 3/12 درصد متفاوت است. (بسته به جمعیت مورد مطالعه که میتواند افراد با بیماری خفیف تا شدید باشد)(56، 55). در یک مطالعه انجام شده در بین 56208 نفر از افرادی که تزریق خون انجام دادند، TACO در 102 نفر از آنها مشاهده شد (18/0درصد)(57).
TACO میتواند پس از تزریق هر فرآورده خونی رخ دهد، اما در بین فرآوردههای خونی، بیشتر با انتقال گلبولهای قرمز مرتبط میباشد و علت آن حجم تزریق شده در مورد واحد گلبول قرمز از آن جایی میباشد که هر واحد گلبول قرمز 350-300 میلیلیتر حجم دارد (56).
TACO از واکنشهای تبزای غیر همولیتیک (FNHTR) (Febrile non-hemolytic transfusion reaction) و آلرژی کمتر شایع بوده ولی از واکنش آنافیلاکسی ناشی از انتقال خون، GVHD ناشی از انتقال خون (Transfusion – associated graft– versus – host disease) (TA-GVHD) و TRALI شایعتر است (59، 58).
علایم بالینی:
تغییرات علایم حیاتی در طول پیشرفت TACO مشاهده میگردد؛ این علایم میتواند در چند دقیقه اول پس از تزریق خون تا 12 ساعت پس از قطع تزریق، رخ دهد (65). اولین و شاید مهمترین تغییر، افزایش فشار خون سیستولی/دیاستولی و فشار خون ورید مرکزی اسـت
(66، 60).

از دیگر تغییرات علایم حیاتی در TACO میتوان به افزایش تعداد تنفس (Tachypnea)، افزایش ضربان قلب (Tachycardia)، تنگی نفس (Dyspnea)، کاهش اشباع اکسیژن شریانی به زیر 90 درصد و اتساع سیاهرگ گردنی (jugular vein) اشاره کرد (65). همچنین سیانوز، خلط صورتی و کف آلود، سرفه و کاهش برونده ادرار در TACO دیده شده است (65). جالب توجه است که یک سوم افراد با عارضه TACO تب دارند؛ علت این که چرا تب در برخی از افراد با عارضه TACO وجود دارد و در برخی وجود ندارد، مشخص نیست (67، 65). در تصویربرداری اشعه ایکس ممکن است علایم بزرگی قلب وجود داشته باشد؛ همچنین در بررسی ریه صدای غیر طبیعی ریوی (Crackles on auscultation) ممکن است شنیده شود (65).
عوامل خطر(Risk factors) :
TACO میتواند در هر فردی رخ دهد اما احتمال بروز آن در افرادی که عوامل خطرزا را دارند، بیشتر است؛ شناسایی این عوامل میتواند در تشخیص زودتر، درمان بهتر و کاهش شدت عوارض کمک کند. چندین عامل خطر بالینی برای بروز و پیشرفت TACO شناسایی شده است:
1- سن: افراد مسن در معرض خطر بیشتری برای بروز TACO قرار دارند (69، 68). بر اساس SHOT DATA (Serious Hazards of Transfusion) تقریباً 60 درصد افراد با عارضه TACO بالای 70 سال سن داشتند؛ همچنین کودکان کمتر از 3 سال هم در معرض خطر زیادی قرار
دارند؛ به خصوص اگر کودک عوامل خطر دیگری نیز داشته باشد (70).
2- تعادل مثبت مایعات(Positive Fluid Balance) : داشتن تعادل مثبت مایعات در 24 ساعت قبل از تزریق، احتمال بروز TACO را افزایش میدهد (53). در یک مطالعه اخیر که بر روی 901 بیمار انجام شد، افرادی که TACO در آنها ایجاد شده بود، تعادل مثبت مایع بیشتری در مقایسه با افراد کنترل داشتند (71).
3- نارسایی کلیه: اختلال در عملکرد کلیه میتواند بروزTACO در افراد را افزایش دهد. نارسایی کلیه در افراد با عارضه TACO بیشتر از افراد TRALI گزارش شده است (72). هم چنین احتمال ایجاد TACO در افراد دیالیزی نیز زیاد است (74، 73).
4- سکته قلبی(Acute myocardial infarction) : مشاهدات نشان دادهاند که بیمارانی که بعد از سکته قلبی حاد تزریق گلبول قرمز انجام دادهاند، در خطر بیشتری برای TACO هستند (76، 75).
5- داروهای مسدود کننده گیرندههای بتا (b-Blockers):
استفاده از این داروها قبل از تزریق خون، میتواند احتمال ایجاد TACO را در فرد افزایش دهد (77).
6- اختلال عملکرد بطن چپ :این اختلال که منجر به نارسایی احتقانی قلب در افراد سالمند شده، یک عامل خطر مهم برای پیشرفت TACO است (78). علت آن این است که بطن چپ سرکوب شده و قادر نیست به طور مؤثر در هنگام افزایش حجم خون، عمل کند؛ نارسایی قلبی هم چنین با کاهش پرفیوژن کلیه و احتباس مایعات مرتبط است که بیماران را مستعد گرانباری مایعات میکند (61). بنابراین تشخیص هرگونه سابقه نارسایی قلبی در بیماران قبل از تزریق خون، برای کاهش احتمال بروز TACO بسیار مهم است (76).
7- جنس و نژاد: طبق تحقیقات انجام شده احتمال بروز TACO در جنس مؤنث بیشتر ازجنس مذکر و در نژاد سفید پوست بیشتر از نژاد سیاه پوست مشاهده شده اســت (79، 65، 61).
تشخیص:
تشخیص TACO ممکن است چالش برانگیز باشــد. در
بیشتر موارد تشخیص بالینیTACO بر اساس معاینه فیزیکی، سابقه پزشکی و پاسخ به داروهای مدر (دیورتیک) است(80). هیچ آزمایش یا روش آزمایشگاهی وجود ندارد که به طور قطعی بتواندTACO را تشخیص دهد (81، 65)؛ بنابراین در بیمارانی که علایم و نشانههای TACOدارند، علایم حیاتی مانند وضعیت اکسیژنرسانی (با آنالیز گازهای خون شریانی)، ضربان قلب، تعداد تنفس و فشار خون باید ارزیابی شوند (81). تصویربرداری از قفسه سینه میتواند کمککننده و مفید باشد و باید برای تأیید ادم ریوی و از بین بردن سایر علل دیسترس تنفسی (مانند TRALI) انجام شود (82).
همان طور که پیشتر ذکر کردیم، آزمایش تشخیصی که بتواند TACO را به طور قطع تشخیص دهد وجود ندارد اما با این حال امروزه یک تست آزمایشگاهی وجود دارد که میتواند در تشخیص TACO بسیار کمککننده باشد. این آزمایش میزان BNP (B-type natriuretic peptide) و NT-proBNP (N-terminal proBNP) را اندازهگیری میکند (83). این دو هورمونهایی هستند که توسط میوکارد دهلیزی و بطنی در پاسخ به افزایش فشار و کشش میوسیتهای قلبی ترشح شده و باعث کاهش جذب کلیوی، افزایش بروندهی ادرار و اتساع عروق میگردند؛ سطح BNP معمولاً در موارد نارسایی احتقانی قلب افزایش مییابد. چندین مطالعه نشان دادهاند که میزان BNP در افراد با عارضه TACO در قبل و بعد از تزریق خون افزایش یافته است؛ بنابراین بررسی سطح این هورمونها در تشخیص TACO کمککننده بوده و مارکر تشخیصی خوبی برای TACO میباشد (86-84).
NT-proBNP به علت پایدار بودن و طول عمر بیشتر در شرایط In vivo و In vitro، مارکر بهتر و حساستری ازBNP است (50). با این حال هیچ شواهد قطعی برای تایید این که چه میزان BNP نشاندهنده TACO است، وجود ندارد. یک بررسی سیستماتیک اخیر نشان داد که تعیین یک حد تصمیمگیری (cutoff) برایBNP و NT-proBNP بعد از تزریق خون به ترتیب کمتر از pg/mL 300 و pg/mL 2000 است (83). همچنین نسبت بعد از تزریق به قبل از تزریـق مقـدار NT-proBNP بایـد از 5/1 بیشتــر باشــــد (1.5<NT proBNP NT proBNP 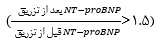 (83).
(83).
اخیراً مارکر تازهای برای تشخیص TACO شناخته شده که این مارکر مرتبط با قلب و عروق است؛ این مارکر سرکوب تومورزایی محلول 2 (ST-2)(soluble suppression of tumorgenicity-2) نام دارد (83). این مارکر از خانواده گیرنده اینترلوکین 1 بوده و همانند BNP در پاسخ به کشش میوکارد آزاد میگردد. گفتنی است که این مارکر فرآیندهای التهابی در نارسایی مزمن قلبی را تنظیم میکند (87).
پاتوفیزیولوژی:
دلیل و علت اصلی ایجاد TACO هنوز به طور کامل مشخص نشده است؛ به نظر میرسد علت TACO چند عاملی باشد. یکی از مکانیسمهایی که برای ایجاد TACO شناخته شده این است که افزایش فشار هیدرواستاتیک به دنبال تزریق خون باعث ادم ریوی میگردد (88)؛ به عبارتی تجمع مایع در مویرگهای ریوی منجر به افزایش فشار هیدرواستاتیک گردیده و در نتیجه مایعات از رگها خارج و وارد فضای بینابینی ریوی میگردند (77). همچنین افزایش بیشتر فشار ورید ریوی به 25 میلیمتر جیوه یا بالاتر ممکن است منجر به عبور مایع از اپیتلیوم ریه به فضای آلوئولی شود (89).
مکانیسم دیگری که برای پیشرفت TACO فرض شده است، یک پاسخ TRALI مانند است (90، 45)؛ این مکانیسم یک فرآیند التهابی است که شامل فعال شدن نوتروفیلها و متعاقب آن نشت مویرگی و در نهایت ادم ریوی میباشد. در راستای آن مکانیسم شروع سندرم دیسترس حاد تنفسی مرتبط با افزایش فشار ریوی است که نشان میدهد گرانباری گردشی در حضور نشت مویرگی، منجر به ادم بینابینی ریوی خواهد شد (91، 77). مکانیسم احتمالی بعدی مرتبط با شکستن عملکرد سد اندوتلیال است؛ گلیکوکالیس اندوتلیال نقش بسیار مهمی در رابطه با تبادل مایعات، غلظت پروتئینهای پلاسما و فشار مویرگی دارد. گلیکوکالیس تسهیلکننده فشار ناشی از افزایش نفوذپذیری، با انتقال مکانیکی و سد تنظیمی در عروق ریز ریه است (93، 92، 77). وقتی این سد اندوتلیال یا گلیکوکالیس به علت عواملی مانند التهاب حاد یا تزریق مختل شود، نفوذ (فیلتراسیون) مایعات به فضای بینابینی ریه میتواند ده برابر یا حتی بیشتر افزایش یابد (95، 94).
مکانسیم فرض شده بعدی اثر ضایعات ذخیرهسازی شامل همولیز، تشکیل میکروپارتیکلها، هموگلوبین آزاد و متعاقب آن از بین رفتن نیتریک اکساید (NO) است. کاهش زیستی NO باعث انقباض عروق و اختلال عملکرد سد اندوتلیال میگردد. انقباض عروق میتواند مشاهدات بالینی فشار خون افزایش یافته را توضیح دهد و اختلال عملکـرد سـد انـدوتلیال همــان طور کـه پیشتر ذکر شد، میتواند منجر به ادم بینابینی شود (97، 96).
درمان و مدیریت:
اولین اقدام به محض دیدن علایم TACO قطع فوری تزریق خون است. درمانTACO بر اساس شدت واکنش میباشد و عمدتاً بر روی حمایتهای درمانی مانند اکسیژناسیون و تهویه مکانیکی (در موارد شدید) متمرکز است (77). به هنگام رخ دادن TACO پزشک مربوطه و پرسنل بانک خون باید مطلع شوند. پرستار بایستی یک نمونه خون از بیمار بگیرد و به بانک خون برای انجام آزمایشهای لازم، ارسال نماید (65). همچنین پرستار باید بیمار را در حالت خوابیده به پشت بر روی تخت قرار دهد (80). در برخی موارد، درمان با فشار مثبت مداوم راه هوایی و تهویه مکانیکی برای حفظ اشباع اکسیژن مورد نیاز است و ممکن اسـت توســـط پزشک تجویز شود (65).
کلید اصلی در درمان TACO استفاده از داروهای مدر (دیورتیک) است. برخلاف TRALI که به دیورتیکها پاسخ نمیدهد، استفاده از این داروها برای درمان TACO مؤثر است (98). رایجترین دارویی که برای این هدف استفاده میشود، فوروزماید نام دارد؛ تزریق داخل وریدی آن به علت اثر سریعتر ارجح است (99، 65). اثر گشادکنندگی فوروزماید منجر به کاهش فشار هیدرواستاتیک در مویرگهای ریه میگردد (100).
هم چنین نیتروگلیسیرین نیز ممکن است در کاهش گرانباری و کاهش فشار دیاستولیک انتهای بطن چپ نقش داشته باشد (90، 77).
پیشگیری:
اولین قدم برای پیشگیری از TACOارزیابی فرد قبل از تزریق است که شامل ارزیابی قلبی-ریوی و تعیین عملکرد کلیه میباشد. این ارزیابیها قبل از تزریق خون در پیشگیری از TACO مثمرثمر هستند و همان طور که قبلتر توضیح داده شد، شناسایی افرادی که در آنها عوامل خطر وجود دارد، در پیشگیری از TACO بسیار سودمند است (76).
میزان سرعت تزریق فرآورده خونی یک عامل بسیار تاثیرگذار در ایجاد و پیشگیری از TACO است (101). شواهد نشان میدهند که افزایش سرعت تزریق مرتبط با افزایش احتمال بروز TACO است (102، 71). درحقیقت حجم خون فرآورده تزریق شده با افزایش فشار مویرگهای ریوی مرتبط میباشد (102).
در حال حاضر کتابهای پزشکی انتقال خون، میزان mL/min 2-4 را سرعت مناسب تزریق برای واحدهای گلبول قرمز دانستهاند و برای فرآورده پلاسمایی و پلاکتی سرعت بالاتری پیشنهاد کردهاند (80). میزان سرعت تزریق تقریبا mL/kg5/2- 2 در هر ساعت برای تزریق روتین فرآوردههای خونی معقول است که البته این میزان به وضعیت بالینی فرد و توانایی آن در تحمل حجم اضافه
شده بستگی دارد (80).
واحد گلبول قرمز فشرده (Packed RBC) با حجم 350 میلیلیتر باید با سرعت mL/min 1-2 در 15 دقیقه اول تزریق شود؛ سپس مابقی آن معمولاً در طی 5/1 تا 2 ساعت تزریق گردد. پلاکتهای مشتق از 4 تا 6 واحد خون کامل یا یک واحد آفرزیس با حجم 300-200 میلیلیتر باید با سرعت mL/min 2-5 در 15 دقیقه اول تزریق شده و تزریق باقیمانده آن در طی یک تا 2 ساعت در صورت تحمل انجام گیرد.
2- تعادل مثبت مایعات(Positive Fluid Balance) : داشتن تعادل مثبت مایعات در 24 ساعت قبل از تزریق، احتمال بروز TACO را افزایش میدهد (53). در یک مطالعه اخیر که بر روی 901 بیمار انجام شد، افرادی که TACO در آنها ایجاد شده بود، تعادل مثبت مایع بیشتری در مقایسه با افراد کنترل داشتند (71).
3- نارسایی کلیه: اختلال در عملکرد کلیه میتواند بروزTACO در افراد را افزایش دهد. نارسایی کلیه در افراد با عارضه TACO بیشتر از افراد TRALI گزارش شده است (72). هم چنین احتمال ایجاد TACO در افراد دیالیزی نیز زیاد است (74، 73).
4- سکته قلبی(Acute myocardial infarction) : مشاهدات نشان دادهاند که بیمارانی که بعد از سکته قلبی حاد تزریق گلبول قرمز انجام دادهاند، در خطر بیشتری برای TACO هستند (76، 75).
5- داروهای مسدود کننده گیرندههای بتا (b-Blockers):
استفاده از این داروها قبل از تزریق خون، میتواند احتمال ایجاد TACO را در فرد افزایش دهد (77).
6- اختلال عملکرد بطن چپ :این اختلال که منجر به نارسایی احتقانی قلب در افراد سالمند شده، یک عامل خطر مهم برای پیشرفت TACO است (78). علت آن این است که بطن چپ سرکوب شده و قادر نیست به طور مؤثر در هنگام افزایش حجم خون، عمل کند؛ نارسایی قلبی هم چنین با کاهش پرفیوژن کلیه و احتباس مایعات مرتبط است که بیماران را مستعد گرانباری مایعات میکند (61). بنابراین تشخیص هرگونه سابقه نارسایی قلبی در بیماران قبل از تزریق خون، برای کاهش احتمال بروز TACO بسیار مهم است (76).
7- جنس و نژاد: طبق تحقیقات انجام شده احتمال بروز TACO در جنس مؤنث بیشتر ازجنس مذکر و در نژاد سفید پوست بیشتر از نژاد سیاه پوست مشاهده شده اســت (79، 65، 61).
تشخیص:
تشخیص TACO ممکن است چالش برانگیز باشــد. در
بیشتر موارد تشخیص بالینیTACO بر اساس معاینه فیزیکی، سابقه پزشکی و پاسخ به داروهای مدر (دیورتیک) است(80). هیچ آزمایش یا روش آزمایشگاهی وجود ندارد که به طور قطعی بتواندTACO را تشخیص دهد (81، 65)؛ بنابراین در بیمارانی که علایم و نشانههای TACOدارند، علایم حیاتی مانند وضعیت اکسیژنرسانی (با آنالیز گازهای خون شریانی)، ضربان قلب، تعداد تنفس و فشار خون باید ارزیابی شوند (81). تصویربرداری از قفسه سینه میتواند کمککننده و مفید باشد و باید برای تأیید ادم ریوی و از بین بردن سایر علل دیسترس تنفسی (مانند TRALI) انجام شود (82).
همان طور که پیشتر ذکر کردیم، آزمایش تشخیصی که بتواند TACO را به طور قطع تشخیص دهد وجود ندارد اما با این حال امروزه یک تست آزمایشگاهی وجود دارد که میتواند در تشخیص TACO بسیار کمککننده باشد. این آزمایش میزان BNP (B-type natriuretic peptide) و NT-proBNP (N-terminal proBNP) را اندازهگیری میکند (83). این دو هورمونهایی هستند که توسط میوکارد دهلیزی و بطنی در پاسخ به افزایش فشار و کشش میوسیتهای قلبی ترشح شده و باعث کاهش جذب کلیوی، افزایش بروندهی ادرار و اتساع عروق میگردند؛ سطح BNP معمولاً در موارد نارسایی احتقانی قلب افزایش مییابد. چندین مطالعه نشان دادهاند که میزان BNP در افراد با عارضه TACO در قبل و بعد از تزریق خون افزایش یافته است؛ بنابراین بررسی سطح این هورمونها در تشخیص TACO کمککننده بوده و مارکر تشخیصی خوبی برای TACO میباشد (86-84).
NT-proBNP به علت پایدار بودن و طول عمر بیشتر در شرایط In vivo و In vitro، مارکر بهتر و حساستری ازBNP است (50). با این حال هیچ شواهد قطعی برای تایید این که چه میزان BNP نشاندهنده TACO است، وجود ندارد. یک بررسی سیستماتیک اخیر نشان داد که تعیین یک حد تصمیمگیری (cutoff) برایBNP و NT-proBNP بعد از تزریق خون به ترتیب کمتر از pg/mL 300 و pg/mL 2000 است (83). همچنین نسبت بعد از تزریق به قبل از تزریـق مقـدار NT-proBNP بایـد از 5/1 بیشتــر باشــــد (1.5<
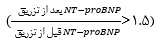 (83).
(83).اخیراً مارکر تازهای برای تشخیص TACO شناخته شده که این مارکر مرتبط با قلب و عروق است؛ این مارکر سرکوب تومورزایی محلول 2 (ST-2)(soluble suppression of tumorgenicity-2) نام دارد (83). این مارکر از خانواده گیرنده اینترلوکین 1 بوده و همانند BNP در پاسخ به کشش میوکارد آزاد میگردد. گفتنی است که این مارکر فرآیندهای التهابی در نارسایی مزمن قلبی را تنظیم میکند (87).
پاتوفیزیولوژی:
دلیل و علت اصلی ایجاد TACO هنوز به طور کامل مشخص نشده است؛ به نظر میرسد علت TACO چند عاملی باشد. یکی از مکانیسمهایی که برای ایجاد TACO شناخته شده این است که افزایش فشار هیدرواستاتیک به دنبال تزریق خون باعث ادم ریوی میگردد (88)؛ به عبارتی تجمع مایع در مویرگهای ریوی منجر به افزایش فشار هیدرواستاتیک گردیده و در نتیجه مایعات از رگها خارج و وارد فضای بینابینی ریوی میگردند (77). همچنین افزایش بیشتر فشار ورید ریوی به 25 میلیمتر جیوه یا بالاتر ممکن است منجر به عبور مایع از اپیتلیوم ریه به فضای آلوئولی شود (89).
مکانیسم دیگری که برای پیشرفت TACO فرض شده است، یک پاسخ TRALI مانند است (90، 45)؛ این مکانیسم یک فرآیند التهابی است که شامل فعال شدن نوتروفیلها و متعاقب آن نشت مویرگی و در نهایت ادم ریوی میباشد. در راستای آن مکانیسم شروع سندرم دیسترس حاد تنفسی مرتبط با افزایش فشار ریوی است که نشان میدهد گرانباری گردشی در حضور نشت مویرگی، منجر به ادم بینابینی ریوی خواهد شد (91، 77). مکانیسم احتمالی بعدی مرتبط با شکستن عملکرد سد اندوتلیال است؛ گلیکوکالیس اندوتلیال نقش بسیار مهمی در رابطه با تبادل مایعات، غلظت پروتئینهای پلاسما و فشار مویرگی دارد. گلیکوکالیس تسهیلکننده فشار ناشی از افزایش نفوذپذیری، با انتقال مکانیکی و سد تنظیمی در عروق ریز ریه است (93، 92، 77). وقتی این سد اندوتلیال یا گلیکوکالیس به علت عواملی مانند التهاب حاد یا تزریق مختل شود، نفوذ (فیلتراسیون) مایعات به فضای بینابینی ریه میتواند ده برابر یا حتی بیشتر افزایش یابد (95، 94).
مکانسیم فرض شده بعدی اثر ضایعات ذخیرهسازی شامل همولیز، تشکیل میکروپارتیکلها، هموگلوبین آزاد و متعاقب آن از بین رفتن نیتریک اکساید (NO) است. کاهش زیستی NO باعث انقباض عروق و اختلال عملکرد سد اندوتلیال میگردد. انقباض عروق میتواند مشاهدات بالینی فشار خون افزایش یافته را توضیح دهد و اختلال عملکـرد سـد انـدوتلیال همــان طور کـه پیشتر ذکر شد، میتواند منجر به ادم بینابینی شود (97، 96).
درمان و مدیریت:
اولین اقدام به محض دیدن علایم TACO قطع فوری تزریق خون است. درمانTACO بر اساس شدت واکنش میباشد و عمدتاً بر روی حمایتهای درمانی مانند اکسیژناسیون و تهویه مکانیکی (در موارد شدید) متمرکز است (77). به هنگام رخ دادن TACO پزشک مربوطه و پرسنل بانک خون باید مطلع شوند. پرستار بایستی یک نمونه خون از بیمار بگیرد و به بانک خون برای انجام آزمایشهای لازم، ارسال نماید (65). همچنین پرستار باید بیمار را در حالت خوابیده به پشت بر روی تخت قرار دهد (80). در برخی موارد، درمان با فشار مثبت مداوم راه هوایی و تهویه مکانیکی برای حفظ اشباع اکسیژن مورد نیاز است و ممکن اسـت توســـط پزشک تجویز شود (65).
کلید اصلی در درمان TACO استفاده از داروهای مدر (دیورتیک) است. برخلاف TRALI که به دیورتیکها پاسخ نمیدهد، استفاده از این داروها برای درمان TACO مؤثر است (98). رایجترین دارویی که برای این هدف استفاده میشود، فوروزماید نام دارد؛ تزریق داخل وریدی آن به علت اثر سریعتر ارجح است (99، 65). اثر گشادکنندگی فوروزماید منجر به کاهش فشار هیدرواستاتیک در مویرگهای ریه میگردد (100).
هم چنین نیتروگلیسیرین نیز ممکن است در کاهش گرانباری و کاهش فشار دیاستولیک انتهای بطن چپ نقش داشته باشد (90، 77).
پیشگیری:
اولین قدم برای پیشگیری از TACOارزیابی فرد قبل از تزریق است که شامل ارزیابی قلبی-ریوی و تعیین عملکرد کلیه میباشد. این ارزیابیها قبل از تزریق خون در پیشگیری از TACO مثمرثمر هستند و همان طور که قبلتر توضیح داده شد، شناسایی افرادی که در آنها عوامل خطر وجود دارد، در پیشگیری از TACO بسیار سودمند است (76).
میزان سرعت تزریق فرآورده خونی یک عامل بسیار تاثیرگذار در ایجاد و پیشگیری از TACO است (101). شواهد نشان میدهند که افزایش سرعت تزریق مرتبط با افزایش احتمال بروز TACO است (102، 71). درحقیقت حجم خون فرآورده تزریق شده با افزایش فشار مویرگهای ریوی مرتبط میباشد (102).
در حال حاضر کتابهای پزشکی انتقال خون، میزان mL/min 2-4 را سرعت مناسب تزریق برای واحدهای گلبول قرمز دانستهاند و برای فرآورده پلاسمایی و پلاکتی سرعت بالاتری پیشنهاد کردهاند (80). میزان سرعت تزریق تقریبا mL/kg5/2- 2 در هر ساعت برای تزریق روتین فرآوردههای خونی معقول است که البته این میزان به وضعیت بالینی فرد و توانایی آن در تحمل حجم اضافه
شده بستگی دارد (80).
واحد گلبول قرمز فشرده (Packed RBC) با حجم 350 میلیلیتر باید با سرعت mL/min 1-2 در 15 دقیقه اول تزریق شود؛ سپس مابقی آن معمولاً در طی 5/1 تا 2 ساعت تزریق گردد. پلاکتهای مشتق از 4 تا 6 واحد خون کامل یا یک واحد آفرزیس با حجم 300-200 میلیلیتر باید با سرعت mL/min 2-5 در 15 دقیقه اول تزریق شده و تزریق باقیمانده آن در طی یک تا 2 ساعت در صورت تحمل انجام گیرد.

فرآورده پلاسمایی (مانند FFP) با حجم 250-200 میلیلیتر باید با سرعت mL/min 2-5 در طی 15 دقیقه اول تزریق گردد و ادامه آن در 30 تا 60 دقیقه (در صورت تحمل) تزریق شود (80).
از دیگر راههای پیشگیری، کاهش حجم فرآوردهها با سانتریفیوژ کردن واحدهای گلبول قرمز و پلاکت قبل از تزریق به منظور حذف پلاسمای اضافی میباشد. برای بیمارانی که در معرض خطر بالاتری برای TACO هستند، استفاده از داروهای مدر قبل از تزریق ممکن است در پیشگیری از TACO مؤثر باشد؛ با این حال این رویکرد پیشگیرانه هنوز درمراحل اولیــه بررسی است (104، 103). در حال حاضر، همچنین یک کارآزمایی بالینی برای بررسی تأثیر فرآوردههای خونی سلولی شسته شده برای جلوگیری از TACO در حال انجام است (77). به طور خلاصه مقایسه TACO و TRALI با توجه به مطالب ارائه شده در این مقاله در جدول آورده شده است (جدول 4).
بحث
با وجود پیشرفتهای اخیر در شناخت پاتوفیزیولوژی TRALI و TACO، هنوز چالشهای مهمی در زمینه تشخیص دقیق، پیشگیری مؤثر و درمان هدفمند این عوارض وجود دارد. بر اساس تازهترین شواهد پژوهشی، اهداف آینده مطالعهها در این حوزه با توجه به مطالعههایی که در این مقاله بررسی شده شامل موارد زیر است:
1- توسعه بیومارکرهای جدید برای افتراق TRALI از TACO:
مطالعههای اخیر پیشنهاد دادهاند که استفاده ترکیبی از مارکرهایی مانند BNP، ST2 و سایر سیتوکاینها میتواند به تمایز دقیقتر این دو عارضه کمک کند، به ویژه در بیماران با شرایط جسمانی وخیم و بحرانی (83).
2- استفاده از مدلهای حیوانی و بالینی برای بررسی مکانیسمهای ایمنی و التهابی:
پژوهشها نشان دادهاند که تنظیم پاسخ نوتروفیلی و نقش سلولهای Treg و IL-10 میتواند در کاهش شدت TRALI مؤثر باشد و باید در مطالعههای آینده بررسی شود (19).
3- بررسی کارآیی محصولات خونی کاهشیافته از نظر حجم و آنتیبادی:
استفاده از پلاسما یا پلاکتهای کاهش حجم یافته یــا
فاقد آنتیبادیهای HLA/HNA در مطالعههای حیوانی مؤثر گزارش شده و مطالعههای انسانی در این زمینه توصیه شده است (105).
4- ارزیابی درمانهای هدفمند مانند آنتیاکسیدانها و ایمنیدرمانی:
مطالعههای بالینی اولیه با آسکوربیک اسید و مداخلات ایمنی نشاندهنده اثرات امیدوارکنندهای بودهاند که نیازمند تایید در کارآزماییهای بزرگتر است (39).
5- طراحی دستورالعملهای پیشگیرانه شخصیسازی شده برای بیماران پرخطر:
استفاده از الگوریتمهای تصمیمگیری مبتنی بر هوش مصنوعی و پرونده سلامت الکترونیک در شناسایی بیماران در معرض TACO و TRALI میتواند گام مهمی در کاهش بروز این عوارض باشد (57).
نتیجهگیری
مرور نتایج مطالعهها نشان داد آسیب حاد ریوی مرتبط با تزریق خون (TRALI) و گرانباری گردش مرتبط با تزریق خون (TACO) که در دسته واکنشهای حاد ناشی از انتقال خون قرار میگیرند، یکی از علل اصلی عوارض و مرگ و میر بعد از تزریق خون و فرآوردههای خونی میباشند و یافتههای این مطالعه نشان داد که راهکارهای تشخیصی TRALI و TACO با توجه به شناخت پاتوفیزیولوژی آنها امروزه بهبود یافته و به کارگیری اقدامات پیشگیرانه میتواند بروز این عوارض را کاهش دهد. از جمله این اقدامات پیشگیرانه میتوان به استفاده از فرآورده خون شسته شده و استفاده از Solvent/detergent plasma در پیشگیری از رخداد TRALI و کاهش حجم یا سرعت تزریق فرآورده خونی و استفاده از داروهای مدر قبل از تزریق فرآورده خونی اشاره کرد که میتواند در پیشگیری از TACO مؤثر باشد.
این نتایج میتوانند در تدوین دستورالعملهای بالینی برای انتخاب نوع فرآورده و روش تزریق در بیماران پرخطر بسیار کاربردی باشند و به عنوان پایهای برای طراحی مطالعههای آیندهنگر و سیاستهای هموویژیلانس در سیستمهای انتقال خون به کار روند.
عدم تعارض منافع
نویسندگان اظهار میکنند هیچگونه تعارض منافعی در
این مطالعه وجود نداشته است.
نقش نویسندگان
محمدرضا جعفریپور: جمعآوری اطلاعات و نگارش نسخه اولیه مقاله
یاشار شیری: جمعآوری اطلاعات و نگارش نسخه اولیه
مقاله
دکتر احسان یزداندوست: ایده مقاله، اصلاح و تهیه نسخه نهایی مقاله، نظارت بر تحقیق و نگارش مقاله
نوع مطالعه: مروري |
موضوع مقاله:
ايمونوهماتولوژي
فهرست منابع
1. Guo K, Ma S. The Immune System in Transfusion-Related Acute Lung Injury Prevention and Therapy: Update and Perspective. Front Mol Biosci 2021; 8: 639976. [DOI:10.3389/fmolb.2021.639976] [PMID] []
2. Brittingham TE. Immunologic studies on leukocytes. Vox Sang 1957; 2(4): 242-8.
https://doi.org/10.1111/j.1423-0410.1957.tb03699.x [DOI:10.1159/000478325] [PMID]
3. Toy P, Looney MR, Popovsky M, Palfi M, Berlin G, Chapman CE, et al. Transfusion-related Acute Lung Injury: 36 Years of Progress (1985-2021). Ann Am Thorac Soc 2022; 19(5): 705-12. [DOI:10.1513/AnnalsATS.202108-963CME] [PMID] []
4. Kleinman S, Caulfield T, Chan P, Davenport R, McFarland J, McPhedran S, et al. Toward an understanding of transfusion-related acute lung injury: statement of a consensus panel. Transfusion 2004; 44(12): 1774-89. [DOI:10.1111/j.0041-1132.2004.04347.x] [PMID]
5. Vlaar APJ, Toy P, Fung M, Looney MR, Juffermans NP, Bux J, et al. A consensus redefinition of transfusion-related acute lung injury. Transfusion 2019; 59(7): 2465-76. [DOI:10.1111/trf.15311] [PMID] []
6. Vlaar AP, Juffermans NP. Transfusion-related acute lung injury: a clinical review. Lancet 2013; 382(9896): 984-94. [DOI:10.1016/S0140-6736(12)62197-7] [PMID]
7. White SK, Walker BS, Schmidt RL, Metcalf RA. The incidence of transfusion-related acute lung injury using active surveillance: A systematic review and meta-analysis. Transfusion 2024; 64(2): 289-300. [DOI:10.1111/trf.17688] [PMID]
8. Popovsky MA, Moore SB. Diagnostic and pathogenetic considerations in transfusion-related acute lung injury. Transfusion 1985; 25(6): 573-7. [DOI:10.1046/j.1537-2995.1985.25686071434.x] [PMID]
9. Wallis JP. Transfusion-related acute lung injury (TRALI)--under-diagnosed and under-reported. Br J Anaesth 2003; 90(5): 573-6.
10. Vlaar AP, Binnekade JM, Prins D, van Stein D, Hofstra JJ, Schultz MJ, et al. Risk factors and outcome of transfusion-related acute lung injury in the critically ill: a nested case-control study. Crit Care Med 2010; 38(3): 771-8. [DOI:10.1097/CCM.0b013e3181cc4d4b] [PMID]
11. Gajic O, Rana R, Winters JL, Yilmaz M, Mendez JL, Rickman OB, et al. Transfusion-related acute lung injury in the critically ill: prospective nested case-control study. Am J Respir Crit Care Med 2007; 176(9): 886-91. [DOI:10.1164/rccm.200702-271OC] [PMID] []
12. Wallis JP, Lubenko A, Wells AW, Chapman CE. Single hospital experience of TRALI. Transfusion 2003; 43(8): 1053-9. [DOI:10.1046/j.1537-2995.2003.00466.x] [PMID]
13. Moore SB. Transfusion-related acute lung injury (TRALI): clinical presentation, treatment, and prognosis. Crit Care Med 2006; 34(5 Suppl): S114-7. [DOI:10.1097/01.CCM.0000214312.20718.3E] [PMID]
14. Popovsky MA. Transfusion and lung injury. Transfus Clin Biol 2001; 8(3): 272-7. [DOI:10.1016/S1246-7820(01)00111-2] [PMID]
15. Kopko PM, Holland PV. Transfusion-related acute lung injury. Br J Haematol 1999; 105(2): 322-9. [DOI:10.1111/j.1365-2141.1999.01357.x] [PMID]
16. Nakagawa M, Toy P. Acute and transient decrease in neutrophil count in transfusion-related acute lung injury: cases at one hospital. Transfusion 2004; 44(12): 1689-94. [DOI:10.1111/j.0041-1132.2004.04194.x] [PMID]
17. Silliman CC, Fung YL, Ball JB, Khan SY. Transfusion-related acute lung injury (TRALI): current concepts and misconceptions. Blood Rev 2009; 23(6): 245-55. [DOI:10.1016/j.blre.2009.07.005] [PMID] []
18. Tung JP, Chiaretti S, Dean MM, Sultana AJ, Reade MC, Fung YL. Transfusion-related acute lung injury (TRALI): Potential pathways of development, strategies for prevention and treatment, and future research directions. Blood Rev 2022; 53: 100926. [DOI:10.1016/j.blre.2021.100926] [PMID]
19. Kapur R, Kim M, Aslam R, McVey MJ, Tabuchi A, Luo A, et al. T regulatory cells and dendritic cells protect against transfusion-related acute lung injury via IL-10. Blood 2017; 129(18): 2557-69. [DOI:10.1182/blood-2016-12-758185] [PMID] []
20. Lenahan SE, Domen RE, Silliman CC, Kingsley CP, Romano PJ. Transfusion-related acute lung injury secondary to biologically active mediators. Arch Pathol Lab Med 2001; 125(4): 523-6. [DOI:10.5858/2001-125-0523-TRALIS] [PMID]
21. Benson AB, Moss M, Silliman CC. Transfusion-related acute lung injury (TRALI): a clinical review with emphasis on the critically ill. Br J Haematol 2009; 147(4): 431-43. [DOI:10.1111/j.1365-2141.2009.07840.x] [PMID] []
22. Win N, Chapman C, Bowles K, Green A, Bradley S, Edmondson D, et al. How much residual plasma may cause TRALI? Transfus Med 2008; 18(5): 276-80. [DOI:10.1111/j.1365-3148.2008.00885.x] [PMID]
23. Bayat B, Nielsen KR, Bein G, Traum A, Burg-Roderfeld M, Sachs UJ. Transfusion of target antigens to preimmunized recipients: a new mechanism in transfusion-related acute lung injury. Blood Adv 2021; 5(20): 3975-85. [DOI:10.1182/bloodadvances.2020003843] [PMID] []
24. Ausley MB, Jr. Fatal transfusion reactions caused by donor antibodies to recipient leukocytes. Am J Forensic Med Pathol 1987; 8(4): 287-90. [DOI:10.1097/00000433-198712000-00004] [PMID]
25. Popovsky MA. Transfusion Reactions. USA: AABB; 1996. p. 237.
26. van Bommel J, Trouwborst A, Schwarte L, Siegemund M, Ince C, Henny Ch P. Intestinal and cerebral oxygenation during severe isovolemic hemodilution and subsequent hyperoxic ventilation in a pig model. Anesthesiology 2002; 97(3): 660-70. [DOI:10.1097/00000542-200209000-00021] [PMID]
27. Meier J, Kemming GI, Kisch-Wedel H, Wölkhammer S, Habler OP. Hyperoxic ventilation reduces 6-hour mortality at the critical hemoglobin concentration. Anesthesiology 2004; 100(1): 70-6. [DOI:10.1097/00000542-200401000-00014] [PMID]
28. Popovsky MA, Davenport RD. Transfusion-related acute lung injury: femme fatale? Transfusion 2001; 41(3): 312-5. [DOI:10.1046/j.1537-2995.2001.41030312.x] [PMID]
29. Yu Y, Lian Z. Update on transfusion-related acute lung injury: an overview of its pathogenesis and management. Front Immunol 2023; 14: 1175387. [DOI:10.3389/fimmu.2023.1175387] [PMID] []
30. Gilliss BM, Looney MR. Experimental models of transfusion-related acute lung injury. Transfus Med Rev 2011; 25(1): 1-11. [DOI:10.1016/j.tmrv.2010.08.002] [PMID] []
31. Yazdandoust E, Hajifathali A, Roshandel E, Zarif MN, Pourfathollah AA, Parkhideh S, et al. Gut microbiota intervention by pre and probiotics can induce regulatory T cells and reduce the risk of severe acute GVHD following allogeneic hematopoietic stem cell transplantation. Transplant Immunol 2023; 78: 101836. [DOI:10.1016/j.trim.2023.101836] [PMID]
32. Silliman CC, Boshkov LK, Mehdizadehkashi Z, Elzi DJ, Dickey WO, Podlosky L, et al. Transfusion-related acute lung injury: epidemiology and a prospective analysis of etiologic factors. Blood 2003; 101(2): 454-62. [DOI:10.1182/blood-2002-03-0958] [PMID]
33. Toy P, Gajic O, Bacchetti P, Looney MR, Gropper MA, Hubmayr R, et al. Transfusion-related acute lung injury: incidence and risk factors. Blood 2012; 119(7): 1757-67. [DOI:10.1182/blood-2011-08-370932] [PMID] []
34. Semple JW, Rebetz J, Kapur R. Transfusion-associated circulatory overload and transfusion-related acute lung injury. Blood 2019; 133(17): 1840-53. [DOI:10.1182/blood-2018-10-860809] [PMID]
35. Peters AL, van Hezel ME, Juffermans NP, Vlaar AP. Pathogenesis of non-antibody mediated transfusion-related acute lung injury from bench to bedside. Blood Rev 2015; 29(1): 51-61. [DOI:10.1016/j.blre.2014.09.007] [PMID]
36. Yazdandoust E, Maghsudlu M. The critical significance of hematopoietic stem cell donor vigilance and recruitment. J Iran Blood Transfus 2024; 21(4): 269-72. [Article in Farsi] [DOI:10.61186/bloodj.21.4.269]
37. Yazdandoust E, Hajifathali A, Teimourpour A, Amini-Kafiabad S, Roshandel E. The impact of ABO compatibility/incompatibility between donor and recipient of allogeneic bone marrow transplant on transplant outcomes. Transplant Immunol 2025; 91: 102231. [DOI:10.1016/j.trim.2025.102231] [PMID]
38. Cho MS, Modi P, Sharma S. Transfusion-Related Acute Lung Injury. StatPearls. Treasure Island (FL): StatPearls Publishing; 2024. Available from: https://www.ncbi.nlm.nih.gov/books/NBK507846/.
39. Kassem AB, Ahmed I, Omran G, Megahed M, Habib T. Role of ascorbic acid infusion in critically ill patients with transfusion-related acute lung injury. Br J Clin Pharmacol 2022; 88(5): 2327-39. [DOI:10.1111/bcp.15167] [PMID]
40. Marik PE, Corwin HL. Acute lung injury following blood transfusion: expanding the definition. Crit Care Med 2008; 36(11): 3080-4. [DOI:10.1097/CCM.0b013e31818c3801] [PMID]
41. Semple JW, McVey MJ, Kim M, Rebetz J, Kuebler WM, Kapur R. Targeting Transfusion-Related Acute Lung Injury: The Journey From Basic Science to Novel Therapies. Crit Care Med 2018; 46(5): e452-e8. [DOI:10.1097/CCM.0000000000002989] [PMID]
42. Reesink H, Lee J, Keller A, Dennington P, Pink J, Holdsworth R, et al. Measures to prevent transfusion‐related acute lung injury (TRALI). Vox Sang 2012; 3(103): 231-59. [DOI:10.1111/j.1423-0410.2012.01596.x] [PMID]
43. Palfi M, Berg S, Ernerudh J, Berlin G. A randomized controlled trial oftransfusion-related acute lung injury: is plasma from multiparous blood donors dangerous? Transfusion 2001; 41(3): 317-22. [DOI:10.1046/j.1537-2995.2001.41030317.x] [PMID]
44. Schönbacher M, Aichinger N, Weidner L, Jungbauer C, Grabmer C, Schuha B, et al. Leukocyte-Reactive Antibodies in Female Blood Donors: The Austrian Experience. Transfus Med Hemother 2021; 48(2): 99-108. [DOI:10.1159/000509946] [PMID] []
45. Blumberg N, Heal JM, Gettings KF, Phipps RP, Masel D, Refaai MA, et al. An association between decreased cardiopulmonary complications (transfusion-related acute lung injury and transfusion-associated circulatory overload) and implementation of universal leukoreduction of blood transfusions. Transfusion 2010; 50(12): 2738-44. [DOI:10.1111/j.1537-2995.2010.02748.x] [PMID] []
46. Kuldanek SA, Kelher M, Silliman CC. Risk factors, management and prevention of transfusion-related acute lung injury: a comprehensive update. Expert Rev Hematol 2019; 12(9): 773-85. [DOI:10.1080/17474086.2019.1640599] [PMID] []
47. van der Meer PF, de Korte D. Platelet Additive Solutions: A Review of the Latest Developments and Their Clinical Implications. Transfus Med Hemother 2018; 45(2): 98-102. [DOI:10.1159/000487513] [PMID] []
48. Ozier Y, Muller JY, Mertes PM, Renaudier P, Aguilon P, Canivet N, et al. Transfusion‐related acute lung injury: reports to the French Hemovigilance Network 2007 through 2008. Transfusion 2011; 51(10): 2102-10. [DOI:10.1111/j.1537-2995.2011.03073.x] [PMID]
49. Sinnott P, Bodger S, Gupta A, Brophy M. Presence of HLA antibodies in single‐donor‐derived fresh frozen plasma compared with pooled, solvent detergent‐treated plasma (Octaplas). Eur J Immunogenet 2004; 31(6): 271-4. [DOI:10.1111/j.1365-2370.2004.00481.x] [PMID]
50. Tobian AA, Sokoll LJ, Tisch DJ, Ness PM, Shan H. N-terminal pro-brain natriuretic peptide is a useful diagnostic marker for transfusion-associated circulatory overload. Transfusion 2008; 48(6): 1143-50. [DOI:10.1111/j.1537-2995.2008.01656.x] [PMID]
51. Berríos-Torres SI, Umscheid CA, Bratzler DW, Leas B, Stone EC, Kelz RR, et al. Centers for Disease Control and Prevention Guideline for the Prevention of Surgical Site Infection, 2017. JAMA Surg 2017; 152(8): 784-91. [DOI:10.1001/jamasurg.2017.0904] [PMID]
52. Berríos-Torres SI, Umscheid CA, Bratzler DW, Leas B, Stone EC, Kelz RR, et al. Centers for disease control and prevention guideline for the prevention of surgical site infection, 2017. JAMA Surg 2017; 152(8): 784-91. [DOI:10.1001/jamasurg.2017.0904] [PMID]
53. Popovsky MA, Audet AM, Andrzejewski C, Jr. Transfusion-associated circulatory overload in orthopedic surgery patients: a multi-institutional study. Immunohematology 1996; 12(2): 87-9. [DOI:10.21307/immunohematology-2019-753]
54. Hendrickson JE, Roubinian NH, Chowdhury D, Brambilla D, Murphy EL, Wu Y, et al. Incidence of transfusion reactions: a multicenter study utilizing systematic active surveillance and expert adjudication. Transfusion 2016; 56(10): 2587-96. [DOI:10.1111/trf.13730] [PMID] []
55. Bosboom JJ, Klanderman RB, Zijp M, Hollmann MW, Veelo DP, Binnekade JM, et al. Incidence, risk factors, and outcome of transfusion‐associated circulatory overload in a mixed intensive care unit population: a nested case‐control study. Transfusion 2018; 58(2): 498-506. [DOI:10.1111/trf.14432] [PMID]
56. Piccin A, Cronin M, Brady R, Sweeney J, Marcheselli L, Lawlor E. Transfusion‐associated circulatory overload in Ireland: a review of cases reported to the National Haemovigilance Office 2000 to 2010. Transfusion 2015; 55(6): 1223-30. [DOI:10.1111/trf.12965] [PMID]
57. Wang M, Goldgof GM, Patel A, Whitaker B, Belov A, Chan B, et al. Novel computational methods on electronic health record yields new estimates of transfusion-associated circulatory overload in populations enriched with high-risk patients. Transfusion 2023; 63(7): 1298-309. [DOI:10.1111/trf.17447] [PMID] []
58. Piccin A, Cronin M, Brady R, Sweeney J, Marcheselli L, Lawlor E. Transfusion-associated circulatory overload in Ireland: a review of cases reported to the National Haemovigilance Office 2000 to 2010. Transfusion 2015; 55(6): 1223-30. [DOI:10.1111/trf.12965] [PMID]
59. Yazdandoust E, Amini-Kafiabad S. Transfusion-associated graft-versus-host disease: pathophysiology, complications, prevention. J Iran Blood Transfus 2024; 21(1): 82-95. [Article in Farsi]
60. Bosboom JJ, Klanderman RB, Zijp M, Hollmann MW, Veelo DP, Binnekade JM, et al. Incidence, risk factors, and outcome of transfusion-associated circulatory overload in a mixed intensive care unit population: a nested case-control study. Transfusion 2018; 58(2): 498-506. [DOI:10.1111/trf.14432] [PMID]
61. Bulle EB, Klanderman RB, Pendergrast J, Cserti-Gazdewich C, Callum J, Vlaar APJ. The recipe for TACO: A narrative review on the pathophysiology and potential mitigation strategies of transfusion-associated circulatory overload. Blood Rev 2022; 52: 100891. [DOI:10.1016/j.blre.2021.100891] [PMID]
62. Gauvin F, Robitaille N. Diagnosis and management of transfusion‐associated circulatory overload in adults and children. ISBT Science Series 2020; 15(1): 23-30. [DOI:10.1111/voxs.12531]
63. Kim KN, Kim DW, Jeong MA. The usefulness of a classification and regression tree algorithm for detecting perioperative transfusion-related pulmonary complications. Transfusion 2015; 55(11): 2582-9. [DOI:10.1111/trf.13202] [PMID]
64. Kim KN, Kim DW, Jeong MA. The usefulness of a classification and regression tree algorithm for detecting perioperative transfusion‐related pulmonary complications. Transfusion 2015; 55(11): 2582-9. [DOI:10.1111/trf.13202] [PMID]
65. Carman M, Uhlenbrock JS, McClintock SM. CE: A Review of Current Practice in Transfusion Therapy. Am J Nurs 2018; 118(5): 36-44. [DOI:10.1097/01.NAJ.0000532808.81713.fc] [PMID]
66. Andrzejewski C Jr, Popovsky MA, Stec TC, Provencher J, O'Hearn L, Visintainer P, et al. Hemotherapy bedside biovigilance involving vital sign values and characteristics of patients with suspected transfusion reactions associated with fluid challenges: can some cases of transfusion-associated circulatory overload have proinflammatory aspects? Transfusion 2012; 52(11): 2310-20. [DOI:10.1111/j.1537-2995.2012.03595.x] [PMID]
67. van den Akker TA, Grimes ZM, Friedman MT. Transfusion-Associated Circulatory Overload and Transfusion-Related Acute Lung Injury. Am J Clin Pathol 2021; 156(4): 529-39. [DOI:10.1093/ajcp/aqaa279] [PMID]
68. Bierbaum BE, Callaghan JJ, Galante JO, Rubash HE, Tooms RE, Welch RB. An analysis of blood management in patients having a total hip or knee arthroplasty. J Bone Joint Surg Am 1999; 81(1): 2-10. [DOI:10.2106/00004623-199901000-00002] [PMID]
69. Popovsky MA. Pulmonary consequences of transfusion: TRALI and TACO. Transfus Apher Sci 2006; 34(3): 243-4. [DOI:10.1016/j.transci.2006.01.005] [PMID]
70. Skeate RC, Eastlund T. Distinguishing between transfusion related acute lung injury and transfusion associated circulatory overload. Curr Opin Hematol 2007; 14(6): 682-7. [DOI:10.1097/MOH.0b013e3282ef195a] [PMID]
71. Li G, Rachmale S, Kojicic M, Shahjehan K, Malinchoc M, Kor DJ, et al. Incidence and transfusion risk factors for transfusion-associated circulatory overload among medical intensive care unit patients. Transfusion 2011; 51(2): 338-43. [DOI:10.1111/j.1537-2995.2010.02816.x] [PMID] []
72. Li G, Daniels CE, Kojicic M, Krpata T, Wilson GA, Winters JL, et al. The accuracy of natriuretic peptides (brain natriuretic peptide and N-terminal pro-brain natriuretic) in the differentiation between transfusion-related acute lung injury and transfusion-related circulatory overload in the critically ill. Transfusion 2009; 49(1): 13-20. [DOI:10.1111/j.1537-2995.2008.01941.x] [PMID] []
73. Daurat A, Grenie J, Roger C, Daurat G, Cuvillon P, Muller L, et al. Outcomes and risk factors of transfusion-associated circulatory overload: a case control study. Transfusion 2019; 59(1): 191-5. [DOI:10.1111/trf.15040] [PMID]
74. Roubinian NH, Hendrickson JE, Triulzi DJ, Gottschall JL, Michalkiewicz M, Chowdhury D, et al. Contemporary Risk Factors and Outcomes of Transfusion-Associated Circulatory Overload. Crit Care Med 2018; 46(4): 577-85. [DOI:10.1097/CCM.0000000000002948] [PMID] []
75. Cooper HA, Rao SV, Greenberg MD, Rumsey MP, McKenzie M, Alcorn KW, et al. Conservative versus liberal red cell transfusion in acute myocardial infarction (the CRIT Randomized Pilot Study). Am J Cardiol 2011; 108(8): 1108-11. [DOI:10.1016/j.amjcard.2011.06.014] [PMID]
76. Alam A, Lin Y, Lima A, Hansen M, Callum JL. The prevention of transfusion-associated circulatory overload. Transfus Med Rev 2013; 27(2): 105-12. [DOI:10.1016/j.tmrv.2013.02.001] [PMID]
77. Bosboom JJ, Klanderman RB, Migdady Y, Bolhuis B, Veelo DP, Geerts BF, et al. Transfusion-Associated Circulatory Overload: A Clinical Perspective. Transfus Med Rev 2019; 33(2): 69-77. [DOI:10.1016/j.tmrv.2019.01.003] [PMID]
78. Gottdiener JS, Arnold AM, Aurigemma GP, Polak JF, Tracy RP, Kitzman DW, et al. Predictors of congestive heart failure in the elderly: the Cardiovascular Health Study. J Am Coll Cardiol 2000; 35(6): 1628-37. [DOI:10.1016/S0735-1097(00)00582-9] [PMID]
79. Menis M, Anderson SA, Forshee RA, McKean S, Johnson C, Holness L, et al. Transfusion-associated circulatory overload (TACO) and potential risk factors among the inpatient US elderly as recorded in Medicare administrative databases during 2011. Vox Sang 2014; 106(2): 144-52. [DOI:10.1111/vox.12070] [PMID]
80. Association Bulletin #15-02. Transfusion-associated circulatory overload (TACO). USA: AABB; 2023. Available from: https://www.aabb.org/docs/default-source/default-document-library/resources/association-bulletins/ab15-02-revised.pdf.
81. Roney JK, Whitley BE, Johnston L, Deleon M, Robnett JC. Should adding pain, oxygen saturation and physical assessment to vital signs become the new standard of care for detecting blood transfusion reactions? Vox Sang 2023; 118(2): 109-20. [DOI:10.1111/vox.13396] [PMID]
82. Roubinian N. TACO and TRALI: biology, risk factors, and prevention strategies. Hematology Am Soc Hematol Educ Program 2018; 2018(1): 585-94. [DOI:10.1182/asheducation-2018.1.585] [PMID] []
83. Klanderman RB, Bosboom JJ, Migdady Y, Veelo DP, Geerts BF, Murphy MF, et al. Transfusion-associated circulatory overload-a systematic review of diagnostic biomarkers. Transfusion 2019; 59(2): 795-805. [DOI:10.1111/trf.15068] [PMID] []
84. Roubinian NH, Looney MR, Keating S, Kor DJ, Lowell CA, Gajic O, et al. Differentiating pulmonary transfusion reactions using recipient and transfusion factors. Transfusion 2017; 57(7): 1684-90. [DOI:10.1111/trf.14118] [PMID] []
85. Callum JL, Cohen R, Cressman AM, Strauss R, Armali C, Lin Y, et al. Cardiac stress biomarkers after red blood cell transfusion in patients at risk for transfusion-associated circulatory overload: a prospective observational study. Transfusion 2018; 58(9): 2139-48. [DOI:10.1111/trf.14820] [PMID]
86. Zhou L, Giacherio D, Cooling L, Davenport RD. Use of B-natriuretic peptide as a diagnostic marker in the differential diagnosis of transfusion-associated circulatory overload. Transfusion 2005; 45(7): 1056-63. [DOI:10.1111/j.1537-2995.2005.04326.x] [PMID]
87. Villacorta H, Maisel AS. Soluble ST2 Testing: A Promising Biomarker in the Management of Heart Failure. Arq Bras Cardiol 2016; 106(2): 145-52. [DOI:10.5935/abc.20150151] [PMID] []
88. Bulle EB, Klanderman RB, de Wissel MB, Roelofs JJ, Veelo DP, van den Brom CE, et al. Can volume‐reduced plasma products prevent transfusion‐associated circulatory overload in a two‐hit animal model? Vox Sang 2023; 118(3): 185-92. [DOI:10.1111/vox.13395] [PMID]
89. Ware LB, Matthay MA. Clinical practice. Acute pulmonary edema. N Engl J Med 2005; 353(26): 2788-96. [DOI:10.1056/NEJMcp052699] [PMID]
90. Andrzejewski C, Jr., Casey MA, Popovsky MA. How we view and approach transfusion-associated circulatory overload: pathogenesis, diagnosis, management, mitigation, and prevention. Transfusion 2013; 53(12): 3037-47. [DOI:10.1111/trf.12454] [PMID]
91. Wiedemann HP, Wheeler AP, Bernard GR, Thompson BT, Hayden D, deBoisblanc B, et al. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med 2006; 354(24): 2564-75. [DOI:10.1056/NEJMoa062200] [PMID]
92. Woodcock TE, Woodcock TM. Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy. Br J Anaesth 2012; 108(3): 384-94. [DOI:10.1093/bja/aer515] [PMID]
93. Dull RO, Cluff M, Kingston J, Hill D, Chen H, Hoehne S, et al. Lung heparan sulfates modulate K(fc) during increased vascular pressure: evidence for glycocalyx-mediated mechanotransduction. Am J Physiol Lung Cell Mol Physiol 2012; 302(9): L816-28. [DOI:10.1152/ajplung.00080.2011] [PMID] []
94. Levick JR, Michel CC. Microvascular fluid exchange and the revised Starling principle. Cardiovasc Res 2010; 87(2): 198-210. [DOI:10.1093/cvr/cvq062] [PMID]
95. Chappell D, Jacob M, Hofmann-Kiefer K, Conzen P, Rehm M. A rational approach to perioperative fluid management. Anesthesiology 2008; 109(4): 723-40. [DOI:10.1097/ALN.0b013e3181863117] [PMID]
96. Shah A, Brunskill SJ, Desborough MJ, Doree C, Trivella M, Stanworth SJ. Transfusion of red blood cells stored for shorter versus longer duration for all conditions. Cochrane Database Syst Rev 2018; 12(12): Cd010801. [DOI:10.1002/14651858.CD010801.pub3] [PMID]
97. Donadee C, Raat NJ, Kanias T, Tejero J, Lee JS, Kelley EE, et al. Nitric oxide scavenging by red blood cell microparticles and cell-free hemoglobin as a mechanism for the red cell storage lesion. Circulation 2011; 124(4): 465-76. [DOI:10.1161/CIRCULATIONAHA.110.008698] [PMID] []
98. Piccin A, Spizzo G, Popovski MA, Russo FP, Armanaschi L, Vecchiato C, et al. Transfusion-associated circulatory overload in gastroenterology. Blood Transfus 2021; 19(3): 197-204.
99. Lieberman L, Maskens C, Cserti-Gazdewich C, Hansen M, Lin Y, Pendergrast J, et al. A retrospective review of patient factors, transfusion practices, and outcomes in patients with transfusion-associated circulatory overload. Transfus Med Rev 2013; 27(4): 206-12. [DOI:10.1016/j.tmrv.2013.07.002] [PMID]
100. Sarai M, Tejani AM. Loop diuretics for patients receiving blood transfusions. Cochrane Database Syst Rev 2015; 2015(2): Cd010138. [DOI:10.1002/14651858.CD010138.pub2] [PMID] []
101. Rygård SL, Holst LB, Perner A. Blood Product Administration in the Critical Care and Perioperative Settings. Crit Care Clin 2018; 34(2): 299-311. [DOI:10.1016/j.ccc.2017.12.005] [PMID]
102. Gupta SP, Nand N, Gupta MS. Left ventricular filling pressures after rapid blood transfusion in cases of chronic severe anemia. Angiology 1982; 33(5): 343-8. [DOI:10.1177/000331978203300509] [PMID]
103. Pendergrast J, Armali C, Cserti-Gazdewich C, Hansen M, Kiss A, Lieberman L, et al. Can furosemide prevent transfusion-associated circulatory overload? Results of a pilot, double-blind, randomized controlled trial. Transfusion 2019; 59(6): 1997-2006. [DOI:10.1111/trf.15270] [PMID]
104. Klanderman RB, Bosboom JJ, Veelo DP, Roelofs JJ, de Korte D, van Bruggen R, et al. Prophylactic furosemide to prevent transfusion-associated circulatory overload: a randomized controlled study in rats. Sci Rep 2022; 12(1): 12127. [DOI:10.1038/s41598-022-16465-z] [PMID] []
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







