جلد 21، شماره 1 - ( بهار 1403 )
جلد 21 شماره 1 صفحات 81-66 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mohammadali F, Jamali M. The effect of different oxygen concentrations on stemness of hematopoietic stem cells. bloodj 2024; 21 (1) :66-81
URL: http://bloodjournal.ir/article-1-1516-fa.html
URL: http://bloodjournal.ir/article-1-1516-fa.html
محمدعلی فاطمه، جمالی مصطفی. اثر غلظتهای مختلف اکسیژن بر بنیادینگی سلولهای بنیادی خونساز. فصلنامه پژوهشی خون. 1403; 21 (1) :66-81
استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 791 kb]
(791 دریافت)
| چکیده (HTML) (2408 مشاهده)
مقدمه
سلولهای بنیادی خونساز سلولهایی با قابلیت خودنوسازی و تمایز به ردههای مختلف سلولی میباشند که در درمان طیف وسیعی از بیماریها استفاده میشوند. روشهای مختلفی برای تکثیر آزمایشگاهی (in vitro) سلولهای بنیادی خونساز (HSC : Hematopoietic Stem Cell) وجود دارد (1). در کنار عوامل شناخته شده در زمینه رشد in vitro سلولهای بنیادی خونساز، قرار گرفتن در معرض اکسیژن یک عامل مهم در تعیین سرنوشت سلولهای بنیادی به شمار میآید. به منظور تأمین بهترین شرایط برای کشت HSC در in vitro باید میزان غلظت حقیقی اکسیژن نیچ سلولهای بنیادی در نظر گرفته شود. در حال حاضر اندازهگیری دقیق غلظت اکسیژن نیچ امکانپذیر نیست اما در مطالعههای وسیعی پذیرفته شده است که غلظت اکسیژن در نیچ هماتوپوئیتیک، پایینتر از غلظت اکسیژن محیطی است و مشخصه نیچ هماتوپوئیتیک اکسیژن پایین آن است. به همین دلیل به آن نیچ هیپوکسیک نیز گفته میشود(2). میزان اکسیژن در بافتهای مختلف متفاوت است .غلظت واقعی اکسیژن به خونرسانی بافت و فعالیت متابولیکی آن بستگی دارد (3).
در شرایط هموستاتیک غلظت اکسیژن سلولها در مغز استخوان به حدود 2 تا 9 درصد (8/64-4/14 میلیمتر جیوه) میرسد (4). در عروق خونی بند ناف، غلظت اکسیژن کمی بالاتر است. در زمان زایمان غلظت اکسیژن 38-25 میلیمتر جیوه است که حدود 5-3 درصد میباشد (5). در جفت (حدود 12 هفته پس از حاملگی) به حدود 60 میلیمتر جیوه (10-8 درصد) میرسد (7، 6).
با وجود این که مکان آناتومیک نیچ هیپوکسی مشخص نشده است اما مشاهدات زیادی نشان میدهد که سلولهای HSC ، میکرومحیط هیپوکسی را نسبت به محیط غنی از اکسیژن ترجیح میدهند. از جمله: مدلسازی ریاضی توزیع غلظت اکسیژن در مغز استخوان نشان داده است که HSC در محیطی هیپوکسیک واقع شده است (8). از سوی دیگر کشت هیپوکسیک HSC در اکسیژن پایین باعث افزایش تولید ردههای اریتروئیدی- مگاکاریوسیتی و پروژنتیورهای گرانولوسیتی- مـونوسیتی مـیشود (10، 9).
کشت هیپوکسی باعث افزایش پیوندپذیری HSC میشود (13-11). نهایتاً مطالعههای داخل بدن(in vivo) نشان دادهاند که HSC با فنوتیپ اولیهتر در ناحیه هیپوکسیک نیچ واقع شده است (17-14). روی هم رفته این نتایج نشان میدهند که میکرو محیط با غلظت اکسیژن کم توسط HSC تحمل نمیشود بلکه برای حفظ بنیادینگی آن ضروری است.
سلولها در پاسخ به میزان اکسیژن موجود، بیان ژنهای خود را تغییر میدهند که این تغییرات متابولیسم، ایمنی و سازماندهی بافتی سلول را تحت تأثیر قرار میدهد. پاسخهای سلولی به هیپوکسی عمدتاً از طریق فاکتور رونویسی Hypoxia Inducible Factor 1) )HIF1 واسطهگری میشود که خود باعث تغییر بیان ژنهای درگیر در آنژیوژنز، پرولیفراسیون سلولی و بقا در شرایط هیپوکسیک میشود. معمولاً سلولها در پاسخ به غلظت اکسیژن، پاسخهای مختلفی ایجاد میکنند از جمله: کاهش فسفوریلاسیون اکسیداتیو، توقف چرخه سلولی و تحریک تشکیل عروق خونی جدید که با آزاد کردن فاکتورهایی چون فاکتور رشد اندوتلیال عروقی (Vascular endothelial growth factor) VEGF ، فاکتور رشد ترانسفورمه کننده بتا (Transforming growth factor beta) TGF-B ، آنژیوپوئیتین 1 (Angiopoietin 1) ANG-1 و فاکتور رشد فیبروبلاستی 2 (Fibroblast growth factor2) FGF2 همراه است (18).
غلظت بالای اکسیژن باعث القای سیتوتوکسیسیتی به علت تولید گونههای فعال اکسیژن ROS (Reactive oxygen species) میشود که با اکسیداسیون لیپید، پروتئین و نوکلئیک اسید منجر به اختلال عملکرد سلولی میگردد. معمولاً سلولها سطوح مختلفی از آنتیاکسیدانها و آنزیمهای ردوکس (Redox) برای مقابله با تجمع ROS دارند اما در برخی موارد این سیستم توان مقابله کافی با تولید ROS را نداشته و منجر به درجات مختلفی از تولرانس ROS میشود (19).
نتایج مطالعههای مختلف نشان میدهد که غلظت کم اکسیژن که در نیچ مغز استخوان وجود دارد، میتواند بر ظرفیت پرولیفراتیو، بقا و بنیادینگی سلولهای بنیادی تأثیر بگذارد (20). سلولهای هماتوپوئیتیک خاموش در ناحیه اندوستئال (Endosteal) نیچ مغز استخوان با شرایط هیپوکسیک فراوان ترند (21). در خصوص سیستم هماتوپوئیتیک تعادل بین تکثیر سلولی و خاموشی برای HSC با غلظت اکسیژن حدود 5 درصد گزارش شده است (23، 22).
خاصیت بنیادینگی Stemness)) به ترکیبی از خواص مختلف همچون حفظ خودنوسازی، پتانسیل پیوندپذیری طولانی مدت، لانهگزینی و تمایز چند ردهای اطلاق میشود. باید به این مسأله توجه داشت که مارکر واحدی به عنوان مارکر مختص و قطعی برای بنیادینگی سلولهای بنیادی وجود نداشته، بلکه ترکیبی از مارکرها هستند که بیانگر بنیادینگی بوده و با اطمینان میتوان گفت که عدم حضور تعداد قابل توجهی از این مارکرها، ماهیت بنیادی بودن یک سلول را رد مینماید. در این مطالعه به بررسی روشهای القای هیپوکسی، اثر هیپوکسی بر سلولهای بنیادی خونساز، اثر هیپوکسی بر سلولهای بنیادی خونساز در همکشتی با سایر سلولها، ارتباط هیپوکسی با فاکتور HIF1a و ارتباط هیپوکسی با بنیادینگی سلولهای بنیادی پرداخته شد.
مواد و روشها
در این مقاله مروری بیش از 100 مقاله در دیتابیس pubmed با کلمات کلیدی هیپوکسی، بنیادینگی و سلولهای بنیادی خونساز مرور گردید.
یافتهها
روشهای فیزیکی القای هیپوکسی:
چمبرهای (Chamber) هیپوکسیک، انکوباتورهای سه گازه و ایستگاه کاری (Workstation) هیپوکسی:
انکوباتورها و چمبرهای هیپوکسیک فراوانترین سیستمهای مورد استفاده برای ایجاد شرایط هیپوکسی هستند. چمبرها از مواد جامد ثابت و سایز مناسب برای 12 ظرف محیط کشت 10 سانتیمتری و تجهیزاتی چون رگولاتور Regulator)) و لولهکشی پمپها برای تأمین گاز داخل محفظه تشکیل شده است. در این چمبرها باید از آب مقطر در ظروف استریل برای حفظ رطوبت داخل چمبر استفاده شود (24). یکی از نقایص این چمبرها نشت آن است به همین دلیل امروزه عمدتاً از انکوباتورهای سه گازه استفاده میشود. اولین انکوباتور سه گازه در سال 1979 استفاده شد، در این انکوباتورها دو گاز CO2 و N2 باعث کاهش غلظت اکسیژن میشوند. یکی دیگر از روشها استفاده از کیسههای بیهوازی (آنئروپک) است که در چندین مقاله بررسی شده است (26، 25). این کیسهها کاربری بسیار راحتی دارند و نیازی به آب یا کاتالیست ندارند و فقط باید آنها را در داخل جار قرار داد. یکی از مزایای مهم آن قیمت کم و حمل و نقل راحت آن است.
استفاده از Workstation هیپوکسی که کنترل دقیق درصد اکسیژن و دیاکسید کربن را امکانپذیر میکند، روشی مناسب است (27). این محفظهها سلولها را در معرض عدم تغییر غلظت اکسیژن قرار میدهند چون میتوان محیط کشت را بدون تغییر سطح اکسیژن آن تعویض کرد. این ابزار مجهز به سنسور اکسیژن است که غلظت اکسیژن را پایش میکند و دو دستکش دارد که جابهجایی نمونه را امکانپذیر میکند (27). این ابزار برای ایجاد شرایط آنوکسی یا غلظت اکسیژن بسیار پایین مناسب است.
اخیرا دستگاه پیچیده میکروفلوئیدی برای ایجاد شرایط کاهش اکسیژن با امکان سنجش دقیق فشار اکسیژن پیشنهاد شده است. ابعاد کوچک این وسیله فاصله انتشار اکسیژن را به حداقل رسانده و یک سیستم میکروواسکولار Microvascular)) با حجمهای کوچک (در حد میکرولیتر) را فراهم میآورد (28). تعیین مقادیر دقیق اکسیژن سلولها امکانپذیر نیست چون میزان مصرف اکسیژن توسط سلولها به چندین متغیر نوع ظروف کشت سلول، نوع سلول، میزان سلول کشت داده شده، حجم محیط کشت و ترکیبات آن، دما و رطوبت محیط کشت و تعداد دفعات بازشدن درب انکوباتور بستگی دارد (29). به عنوان مثال تعویض محیط کشت باعث میشود مدتی زمان ببرد تا سلولها با غلظت اکسیژن جدید به تعادل برسند (29). به همین دلیل قرار دادن سنسورهای اکسیژن در محیط کشت برای اندازهگیری غلظت اکسیژن پیشنهاد میشود تا تمام نوسانات اکسیژن را اندازهگیری کند هر چند که به طور روتین استفاده نمیشود (30).
روشهای شیمیایی القای هیپوکسی:
روش دیگر مطالعه بررسی هیپوکسی، استفاده از تیمار دارویی و ترکیبات شیمیایی تحت عنوان ترکیبات مقلد هیپوکسی میباشد که در میان آنها کلرید کبالت، دی متیل اگزالیل گلایسین (DMOG) و دفروکسامین (DFO) ترکیباتی است که بسیار استفاده میشوند (31).
DMOG مهارکننده رقابتی ایزوفرم 3 پرولیل هیدروکسیلاز (PHD : Proly 1 Hydroxylase Domain) است که مهارکننده HIF میباشد و به عنوان آنالوگ 2-اکسوگلوتارات (2OG : کوسوبسترای PHD) عمل میکند و در جایگاه کاتالیتیک قرار گرفته و باعث مهار فعالیت آنزیمی میشود (32).
DFO شلاتور آهن است که کوفاکتور دیگر فعالیت PHD است. کمبود آهن در دسترس باعث مهار فعالیت PHD و تحریک تجمع HIF1α و افزایش فعالیت آن میشود (33). کلرید کبالت باعث مهار PHD با جایگزینی آهن و افزایش سطح پروتئین HIF1α و القای فعالیت رونویسی آن میشود (34) کبالت مانع اتصال HIF1α به پروتئین وون هیپل لاندا (VHL) و مهار تخریب HIF1α و تخلیه آسکوربات میشود که برای حفظ PHD ضروری است. افزایش سطح HIF1α بعد از تیمار با کلرید کبالت همچنین با تولید ROS مرتبط دانسته شده است (35). با این که این روش ارزان بوده و امکان باز کردن ظروف کشت سلول توسط اپراتور بدون تغییر در غلظت اکسیژن را فراهم میآورد، اما احتمالاً علاوه بر القای HIF مکانیسمهای ناشناخته دیگری را نیز تحت تاثیر قرار میدهد (36). از سوی دیگر مدت زمان قرار گرفتن در معرض این مواد شیمیایی عامل متغیر مهم دیگری است (37). همچنین پاسخهای سلولی مختلفی ممکن است بسته به ایزوفرم HIF فعال شده رخ دهد. در مطالعهها نشان داده شده که HIF1 پاسخهای اولیه در 24 ساعت اول را ایجاد میکند در حالی که HIF2 در پاسخهای مزمن پس از 24 ساعت نقش دارد (38).
تاثیر هیپوکسی بر سلولهای بنیادی خونساز:
هیپوکسـی نقـش مهمـی در تنظیم خونسازی دارد که با
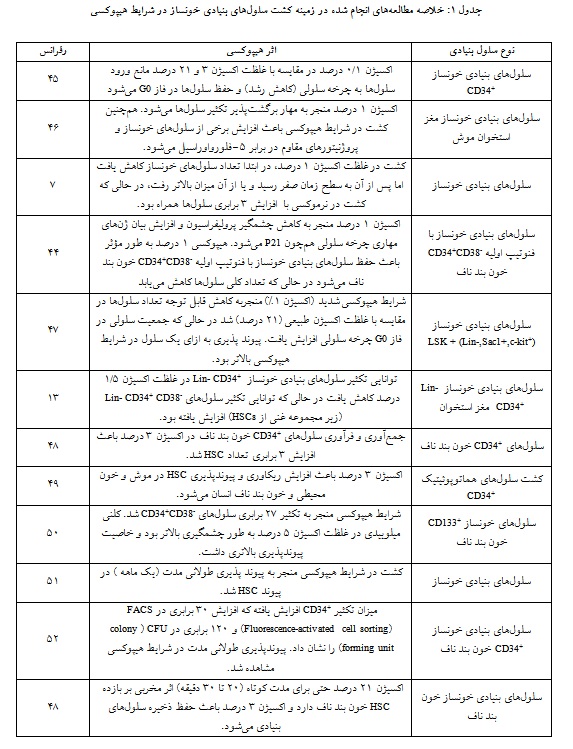
با حمایت HSC از استرس اکسیداتیو همراه است و یک مدیاتور مهم در پیری HSC میباشد (40، 39) بسیاری از مطالعهها به بررسی نقش هیپوکسی در فعالیت خونسازی موش/انسان و مقایسه بقا و تکثیر، فعالیت پروژنیتورهای خونساز، فعالیت لانه گزینی در In vivo و چرخه سلولی سلولهای خونساز کشت داده شده در نرموکسی در مقابل هیپوکسی پرداختهاند (44-41، 13، 9، 7، 6). تفاوت نتایج مطالعههای مختلف به علت تفاوت در بافت مورد استفاده، سیستم کشت هماتوپوئیتیک مورد استفاده (تشخیص حداقل 5 نوع پروژنیتورمختلف)، سطح اکسیژن، زمان قرار گرفتن در معرض هیپوکسی و ترکیبهای مختلف از سیتوکاین (فاکتور محرک کلنی گرانولوسیت/ماکروفاژ (GM-CSF)، اینترلوکین 3 (IL-3) و اینترلوکین6 (IL-6)، استم سل فاکتور(SCF)، ترومبوپپتین (TPO)، لیگاند شبه FMS- تیروزین کیناز 3 (FLT-3) ) در محیط کشت بوده است. بسته به شرایط محیط کشت، تعداد سلولهای خونساز کاهش، افزایش و یا بدون تغییر در مقایسه با زمان صفر بوده است. خلاصه مطالعههایی که به بررسی اثر هیپوکسی بر سلولهای بنیادی خونساز پرداختهاند در جدول ذکر گردیده است (جدول 1). به طور کلی کشت سلولها در آنوکسی (اکسیژن 1 درصد و کمتر) موجب افزایش حفظ و بازگشت HSC به فاز خاموشی و G0 میشود (53) اما کشت در غلظتهای بالاتر (3 و 5 درصد) باعث حفظ پرولیفراسیون در کنار حفظ خودنوسازی سلولهای HSC موشی و انسانی میگردد (11).
تفاوت در نتایج مشاهده شده در مطالعههای مختلف به دلیل روشهای القای هیپوکسی مختلف (شیمیایی یا فیزیکی)، درصد اکسیژن مورد استفاده، مدلهای سلولهای بنیادی استفاده شده و زمان در معرض هیپوکسی بودن میباشد. علاوه براین متابولیسم سلولهای بنیادی تعیینکننده مهم فرآیندهای سلولی است که در پرولیفراسیون، بنیادینگی و تعهد به رده نقش دارند.
اثر هیپوکسی بر سلولهای بنیادی خونساز در سیستمهای هم کشتی:
در مطالعههای مختلفی اثر هیپوکسی در کنار سیستمهای
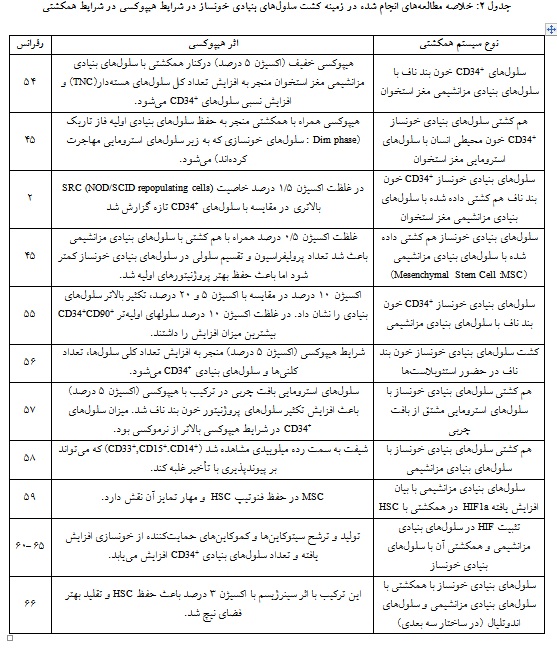
همکشتی بر سلولهای بنیادی خونساز نیز بررسی شده است (جدول 2).
در نهایـت استفاده از نیچ هیپوکسیک برای افزایش تکثیر منـاسب HSC و در کنـار آن حفـظ فنوتیــپ آن در
In vivo نیاز به مطالعههای گسترده دارد (67).
ارتباط هیپوکسی با HIF1a :
HIF تنظیم کننـده اصلـی هموستـاز اکسیـژن اسـت که
تاکنون هزاران هدف ژنی برای آن شناخته شده است. HIF یک فاکتور رونویسی هترودایمر است که از دو زیر واحد تشکیل شده است : HIF1α و HIF1β (68).
HIF1α تنظیمکننده اصلی هیپوکسی است و عمدتاً در سطح بعد از رونویسی تنظیم میشود (69). امروزه 3 زیر واحد α شناسایی شده است HIF 1α ، HIF 2α و HIF 3α که (70) که هر کدام عملکرد متفاوتی دارند (71). هر سه ایزوفرم هترودایمری با HIF1β تشکیل داده و به جایگاه اتصال به HIF متصل میشوند (72).
HIF در حالت طبیعی در سطوح پایه در سلولها بیان میشود اما در غلظت اکسیژن بالا یعنی اکسیژن 21 درصد (که به آن نرموکسی نیز میگویند) یوبیکوئیتینه شده و تخریب میشود. که توسط آنزیم پرولیل هیدروکسیلاز دومین (PHD) هیدروکسیله شده و جایگاه اتصال برای پروتئین وون هیپل لاندا ایجاد میکنند که جزیی از کمپلکس E3 یوبیکوئیتین لیگاز است و باعث تخریب پروتئازومی HIFIα میشود در نتیجه HIFIα در شرایط نرموکسی سریعاً تخریب میشود (73).
در شرایط غلظت اکسیژن پایین (که به آن هیپوکسی نیز گفته میشود) PHD غیرفعال است و پروتئین HIFIα پایدار مانده و زیرگروههای HIFα و HIFβ هترودایمری را تشکیل میدهند که نام آن کمپلکس انتقال هستهای رسپتور آریل هیدروکربن (ARNT : Aryl Hydrocarbon Receptor Nuclear Translocator) است که به هسته منتقل میشود. وقتی این هترو دایمر در هسته تشکیل میشود، توسط کواکتیویتورها (Coactivator) شناسایی شده و به توالی حفاظت شده در عنصر پاسخ دهنده به هیپوکسی (HRE : Hypoxia response element) ژنهای هدف متصل شده و باعث تنظیم رونویسی میشود (74).
بحث
نتایج مطالعه تاکوبو و همکاران با موشهای حذف ژنی شده نشان داد که HIF-1α بر خاموشی HSC و عملکرد آن در داخل بدن نقش دارد (75). با این که هیپوکسی با واسطه HIF و اثر آن در تکثیر HSC بسیار مهم است، شرایط نرموکسی/فعالسازی پیوستهHIF-1α اثــرات منفـی
بر روی عملکرد HSCدارد.
نتایج مطالعهها نشان داده است کـه حـذف ژنی HIF2α
در سیستم هماتوپوئیتیک تأثیری بر عملکرد HSC ندارد هر چند که حذف ژنی آن در جمعیت غنی از سلولهای بنیادی و پروژنیتوری CD34+ منجر به اختلال در ظرفیت بازسازی میشود (77، 76). البته موش HIF2α Null زمانی که با سلولهای اهدایی نوع وحشی پیوند داده میشود، نقص در هماتوپوئز نشان میدهد که نشاندهنده نقش HIF2α در هماتوپوئز طبیعی در میکرومحیط HSC میباشد (77(.
ناک اوت ژنتیکی تنظیمکنندههای منفی HIF نیز منجر به افزایش سیگنالینگ هیپوکسی میشود. به عنوان مثال حذف PHD منجر به تثبیت HIFIα و HIF2α میشود (78). موش گیرنده پیوند با نقص PHD در مغز استخوان افزایش پیوندپذیری را نشان داد که نشان میدهد حذف PHD و افزایش سیگنالینگ هیپوکسی باعث افزایش پرولیفراسیون HSC پس از پیوند میشود. به طور مشابه حذف مونوآللی وون هیپل لاندا که لیگاز E3 HIF است، باعث افزایش خاموشی در HSC و افزایش پیوندپذیری در مغز استخوان شد (79). از سوی دیگر حذف ژنی CITED2 (Cbp/p300-interacting transactivator 2) که یک تنظیمکننده منفی HIFIα است، در سیستم هماتوپوئیتیک منجر به از دست دادن HSC و نقص مغز استخوان شد (80). این نتایج نشان میدهد که کنترل مناسب سطوح HIF درHSC در نیچ برای تعیین سرنوشت سلول بنیادی ضروری است.
بنابراین تنظیم دقیق سطح HIFIα برای حفظ خاموشی HSC ضروری است و به نظر میرسد محور HIFIα در اثرات هیپوکسی بر سلولهای بنیادی خونساز نقش اصلی را داشته باشد.
هیپوکسی و بنیادینگی:
غلظت اکسیژن به طور نزدیکی با حفظ بنیادینگی سلولهای بنیادی در نیچ بافتی (جایگاه آناتومیکی که در تولید و حفظ و ترمیم سلولهای بنیادی نقش دارد) ارتباط دارد (83-81). نیچ سلولهای بنیادی یک ساختار پیچیده، هتروتیپیک و دینامیکی است که شامل ماتریکس خارج سلولی، سلولهای مجاور در نیچ، فاکتورهای سیگنالینگ محلـول تـرشح شـده و سیگنالهـای مختلـف فیزیکــی و
محیطی میباشد (85، 84).
در مطالعههای مختلف نشان داده شده است که سلول بنیادی در شرایط هیپوکسیک در نیچ قرار دارند اما اندازهگیری دقیق میزان اکسیژن در نیچ با روشهای فعلی امکانپذیر نیست اما با تخمین حدود غلظت اکسیژن 3 تا 13 درصد در نیچ سلولهای بنیادی وجود دارد (86).
خاصیت بنیادینگی (Stemness) به ترکیبی از خواص مختلف همچون حفظ خودنوسازی، پتانسیل پیوندپذیری طولانی مدت، لانهگزینی و تمایز چند رده ای اطلاق میشود. باید به این مسأله توجه داشت که مارکر واحدی به عنوان مارکر مختص و قطعی برای بنیادینگی سلولهای بنیادی وجود نداشته، بلکه ترکیبی از مارکرها هستند که بیانگر بنیادینگی میباشند.
حفظ خودنوسازی و بنیادینگی سلولهای بنیادی توسط فاکتورهای سلولی داخلی و خارجی تنظیم میشود. همان طور که قبلاً بحث شد غلظت کم اکسیژن یا هیپوکسی با حفظ بنیادینگی سلولهای بنیادی مرتبط است. سلولهای بنیادی کشت داده شده در شرایط هیپوکسیک میتوانند خاصیت خودنوسازی و ظرفیت بنیادینگی خود را حفظ کنند که در مورد HSC به خوبی نشان داده شده است. فشار اکسیژن کم با مکانیسمی که شرایط In vivo را تقلید میکند، منجر به افزایش بیان ژنهای مرتبط با بنیادینگی میشود (87). این فاکتورهای بنیادینگی میتوانند باعث تنظیم بیان سایر ژنهای درگیر در بنیادینگی به صورت آبشاری شوند (88).
بنیادینگی با بیان فاکتورهای رونویسی مثل OCT4 (octamer-binding transcription factor 4) و SRY (SRY-Box Transcription Factor2) و NANOG مرتبط است که نقش مهمی در شبکه رونویسی سلولهای بنیادی دارد (89). علاوه بر این پروتئینهای متعددی چون ESRRB (Estrogen-related receptor beta) و ZFX (Zinc Finger Protein X-Linked) در کنترل خودنوسازی، E2F1 (E2F Transcription)، KLF4 (Kruppel-like factor 4) و C-MYC در تنظیم چرخه سلولی و SMAD1 (SMAD Family Member) و BMP (Bone morphogenetic protein) و LIF (Leukemia inhibitory factor) در حفظ کیفیت سلول شناسایی شده است (90). NANOG تنظیمکننده بالا دست و فعالکننده STAT3 (Signal transducer and activatior of transcription 3) و OCT4 است و از طریق کمپلکس متشکل از فاکتورهای رونویسی KLF4 ، SOX2 و OCT4 تنظیم بنیادینگی آن اتفاق میافتد (91).
با وجود این که NANOG ، OCT4 و SOX2 بیشترین مارکرهای بنیادینگی بررسی شده هستند، REX1 (reduced expression-1) فاکتور مهم دیگری است که در ترکیب با ژنهای بالا نقش مهمی در پیشروی چرخه سلولی و حفظ بنیادینگی دارد (92). علاوه بر فاکتورهای ژنتیکی، مدیفیکاسیونهای اپیژنتیک مثل متیلاسیون DNA و تغییر نوکلئوزوم و مدیفیکاسیونهای بعد از ترجمه در هیستونها نیز نقش مهمی در حفظ بنیادینگی سلولهای بنیادی دارند.
در مطالعهای که به بررسی اثر اسفر سلولهای بنیادی مزانشیمی بر سلولهای بنیادی خونساز در شرایط هیپوکسیک پرداخته بودند در کنار افزایش بازده سلولی، افزایش خودنوسازی و افزایش ژنهای درگیر در لانهگزینی را گزارش کردند (93).
مطالعهای نشان داد که غلظت اکسیژن یک درصد باعث حفظ بهتر سلولهای LTC-IC میشود. بنابراین نتیجه گرفتند که غلظت اکسیژن یک درصد باعث حفظ بنیادینگی و خاموشی سلولهای بنیادی خونساز با فعالسازی مسیرهای سیگنالینگ Notch و Wnt/β-catenin و Hedgehog از طریق فاکتورهای مرتبط با HIF میشود (94).
در مطالعه دیگری سلولهای بنیادی مزانشیمی و سلولهای بنیادی خونساز CD34+ از سلولهای تک هستهای خون بند ناف جدا شدند. سلولهای بنیادی مزانشیمی خون بند ناف با یک یا چند ناقل بیانی sSCF ، mSCF و SDF-1 نوکلئوفکت شدند. سپس سلولهای CD34+ HSC جدا شـده با سلولهای بنیادی مزانشیمی نوکلئوفکت شده در 10 گروه در محیط کشت حاوی TPO و Flt3L با یا بدون SCF کشت داده شدند. سپس تعداد CD34+HSC ، ظرفیـت کلونوژنیک و سطوح رونویسی ژنهای تنظیمی و بنیادینگی شامل:
CXCR4 (chemokine receptor type 4) C-X-C ، HomeoboxB4 (HOXB4)، BMI1 و SALL4 (Sal-like protein 4) متعاقب هم کشتی با سلولهای بنیادی مزانشیمی اصلاح شده مورد ارزیابی قرار گرفت. نتیجه این تحقیق نشان داد که سلولهای CD34+HSC که هم کشتی با سلولهای بنیادی مزانشیمی با افزایش بیان mSCF/sSCF/SDF-1 داشتند، بیشترین افزایش را در تعداد کلی سلول (26/0 ± 73/4 برابر)، ظرفیت کلونوژنیک (25/0 ± 3/5 برابر) و هم چنین سطوح رونویسی ژنهای CXCR4، HOXB4 و BMI1نشان دادند (95).
در مطالعهای ما به بررسی بیان ژن HOXB4 به عنوان ژن درگیر در خودنوسازی پرداختیم (96). نتایج ما نشان داد بیشترین بیان ژن HOXB4 در سلولهای بنیادی خونساز +CD34 خون بند ناف در شرایط هم کشتی با سلولهای بنیادی مزانشیمی همراه با سیتوکاینها در شرایط هیپوکسی خفیف بود (8/1 برابری در روز 7). در گروه فیدر + سیتوکاین با غلظت اکسیژن 20 درصد بیان ژن HOXB4 بالاتر از بیان آن در شرایط کشت سیتوکاین به تنهایی و فیدر به تنهایی بود. از آن جا که سیتوکاینها باعث پیشروی تمایز به سلولهای بالغتر میشوند، بنابراین در شرایط کشت سیتوکاین به تنهایی بیان مارکرهای مرتبط با خودنوسازی کاهش مییابد. در شرایط هیپوکسی نسبت به نرموکسی، افزایش معنادار بیانHOXB4 (8/1-3/1 برابر در روز 7) مشاهده شد. در مطالعههای قبلی نیز گزارش شده است که هیپوکسی در حفظ خصوصیات خود نوسازی HSCs سودمند است (7، 6). در مطالعه ما بیان HOXB4 در طول زمان تکثیر، کاهش یافت در حالی که هم کشتی با سلولهای بنیادی مزانشیمی کاهش آن را جبران کرد. ما بیان ژن HOXB4 را به عنوان مارکر خود نوسازی HSC انتخاب کردیم زیرا HOXB4 یکی از مهمترین تنظیمکنندههای خودنوسازی HSC میباشد (97). در سلولهای بنیادی بیان میشود و سپس در طی تمایز در انسان و موش کاهش بیان مییابد (99، 98).
مطالعههـای متعـددی نشـان دادهاند کـه HOXB4 باعث
تکثیـر ex vivoوin vivo HSCs میشود (102-100).
مطالعههـای متعددی گزارش کردهاند که سیتوکاینهایی مانند GM-CSF ، IL-3 ، SCF وTPO موجب افزایش تکثیر HSC موشی و انسانی میشود اما با افزایش سریع ROS در سلولها نیز همراه هستند (103). به نظر میرسد که همکشتی با سلولهای بنیادی مزانشیمی از عوارض جانبی ROS کاسته و باعث حفظ بهتر خودنوسازی HSC میشود.
هیپوکسی با سرکوب چرخه سلولی و القای خاموشی، HSC ها را در شرایط ex vivo حفظ میکند.
هیپوکسی باعث مهار فعالیت فاکتور رونویسی c-Myc و سیگنالینگ mTOR نیز میشود و باعث القای مهارکننده Cdk (Cyclin-dependent kinases) میشود. هیپوکسی بیان پروتئین Fbxw7 (F-box/WD repeat-containing protein 7) را در HSC افزایش میدهد بنابراین میتوان نتیجه گرفت که مکانیسم مهار c-Myc در طول هیپوکسی توسط مسیر وابسته به Fbxw7 تنظیم میشود. نتایج تحقیقی نشان داد که مسیر هیپوکسی وابسته به Fbxw7مکانیسمی است که از طریق آن فشار کم اکسیژن نقش مهمی در حفظ عملکرد طبیعی HSC دارد. علاوه بر کشت هیپوکسیک، تغییر بیان یا فعالیت Fbxw7 میتواند ابزاری امید بخش برای حفظ ex vivo HSCs باشد (104).
در مطالعهای که به بررسی غلظت اکسیژن 4-1 درصد بر سلولهای بنیادی هماتوپوئیتیک پرداختند، سلولهای بنیادی هماتوپوئیتیک در غلظت اکسیژن کم افزایش کلسیم سیتوزولیک و میتوکندریایی، ترانسپورتر ABC (ATP-binding cassette super-family G) ABCG2 member 2 و بیان جابهجاکننده سدیم هیدروژن NHE1 (The sodium-hydrogen antiporter 1) را مشاهده کردند که با افزایش جمعیت LSK همراه بوده و نقش تنظیم کلسیم در حفظ فنوتیپی سلولهای بنیادی خونساز را نشان میدهد (105).
به منظور پیوندپذیری موفق، سلولهای بنیادی خونساز باید به مغز استخوان مهاجرت کنند (لانه گزینی) سپس پیوند یافته و تکثیر و تمایز پیدا کنند. بنابراین بررسی مارکرهای لانهگزینی HSC گامی مهم در بررسی بنیادینگی HSC میباشد.
لانهگزینـی مغـز استخـوان فـرآیندی سـریع و هماهنگ
است که در آن سلولهای بنیادی هماتوپوئیتیک و پروژنیتور وارد مغز استخوان میشوند، پس از پیوند فعال شدن اینتگرینی از طریق SDF1 (stromal cell-derived factor 1) باعث القای چسبندگی HSC به دیواره اندوتلیال میشوند و HSC میتواند از طریق لایه اندوتلیال مهاجرت کند و در نهایت HSC به نیچ خود لنگر انداخته و باعث پیوندپذیری طولانی مدت میشود.
CXCR4در سطح سلولهای هماتوپوئیتیک و پروژنیتور بیان میشود (106). بیان گیرنده CXCR4 برای لانهگزینی سلولی و پیوندپذیری HSC به مغز استخوان و فراخوانی پروژنیتورهای هماتوپوئیتیک و اندوتلیال ضروری است و همچنین به عنوان عامل پروآنژیوژنیک باعث افزایش تشکیل عروق جدید در مدل موشی ایسکمی میشود (108، 107).
در رویکرد بالینی چندین مطالعه نشان دادهاند که کاهش مطلق بیان CXCR4 میتواند عواقب شدیدی بر روی قابلیت پیوند سلولهای بنیادی خونسازCD34+ داشته باشد (109). از سوی دیگر، با سلولهایی که مقدار بالایی از CXCR4 را بیان میکردند، میزان سلولهای CD34+ موبیلیزه شده کمتری به ازای هر کیلو وزن بدن برای پیوند مورد نیاز بود (110).
نتایج مطالعه ما نشان داد بیشترین بیان ژن CXCR4 در سلولهای +CD34 در شرایط هم کشتی با سلولهای بنیادی مزانشیمی همراه با سیتوکاینها در هیپوکسی خفیف بود (که میتواند نقش مهمی در افزایش لانه گزینی HSC به مغز استخوان داشته باشد) (54). نتایج ما نشان داد که با وجود تکثیر بیشتر HSC در گروه سیتوکاین، بیان ژن CXCR4 در این گروه نسبت به گروه فیدر و فیدر + سیتوکاین پایینتر بود. سیتوکاینها نه تنها باعث القای تقسیم سلولی میشوند بلکه باعث پیشروی تمایز به سلولهای بالغ تر نیز میشوند که توانایی پیوندپذیری ندارند (113-111). بنابراین انتخاب صحیح ترکیب سیتوکاینی برای حفظ پیوند ضروری است. مقالات مختلف کاهش بیان CXCR4 متعاقب افزایش بیان رسپتور چسبندگی AR (Adhesion receptor) را در طول کشت CD34+ بـا سیتوکایـن نشـان دادنـد کـه نقـص لانه گزینی
میتواند به این علت باشد (109).
کاهش بیان CXCR4 در طول تکثیر یکی از دلایل اصلی عدم پیوندپذیری به دلیل عدم لانه گزینی مناسب HSC میباشد. هم راستا با نتایج مطالعه ما نسبت بالاتری از سلولهای CXCR4 منفی در کشتهای تکثیر شده با سیتوکاین مشاهده شده است. در این تحقیق دلیل آن را کاهش تولید CXCR4 به علت کاهش CXCR4 داخلی یا به علت اینترنالیزه شدن CXCR4 از سطح به داخل گزارش کردند (109). نشان داده شده که افزایش بیان CXCR4 با هیپوکسی باعث افزایش بهبود سلتراپی میشود (114).
مطالعههای متعددی نشان دادند که ژن CXCR4 یکی از اهداف ژن HIF-1α است (115). بنابراین، دلیل افزایش بیان CXCR4 در هیپوکسی به نظر میرسد که اتصال HIF-1α به توالی هدف آن باشد. همچنین نشان داده شده که وون هیپل لاندا پروتئینی است که به طور منفی با بیان CXCR4 مرتبط است (از طریق مسیر فعالسازی CXCR4 وابسته به HIF)(116).
غلظت اکسیژن 5 درصد باعث افزایش چشمگیر بیان HIF-1α و VEGF (Vascular endothelial growth factor)، ABCG2 ، CXCR4 میشود. در مطالعههای فلوسایتومتری افزایش چشمگیر بیان CXCR4 در هیپوکسی (9/1 ± 1/43 درصد) در مقابل نرموکسی (86/1 ± 32 درصد) مشاهده شد. بیان mRNA HIF-1α نیز حدود 45/2 برابر در اکسیژن 5 درصد بالاتر از اکسیژن 20 درصد بود اما بیان HIF-2α ثابت بود (116).
در مطالعهای که به بررسی سلولهای CD133 مثبت خون بند ناف در شرایط هیپوکسی پرداخته بودند، در غلظت اکسیژن 5 درصد در مقایسه با 20 درصد در ده روز لانهگزینی SCID (Severe combined immunodeficiency) در هیپوکسی بهتر حفظ شدند و هیپوکسی باعث القای VEGF و ABCG2,CXCR4با واسطه HIF-1α شد (22).
نتیجهگیری
هدف از این مقاله مروری، بررسی ارتباط بین غلظتهای مختلف اکسیژن بر سلولهای بنیادی خونساز بود و به بررسی مدلهای کشت سلول و انواع مختلف سلول به عنوان ابزاری مهم برای بررسی مکانیسم درگیر در هیپوکسی پرداخته شد که مسلماً در توسعه روشهای جدید برای بهبود روشهای درمانی بر پایه سلولهای بنیادی کمککننده خواهد بود.
در مطالعههای مختلف پیشنهاد شده است که کاهش غلظت اکسیژن که منجر به تقلید فضای نیچ میشود، فنوتیپ اولیه سلولها را بهتر حفظ میکند. نتایج مطالعههای مختلف نشان دادند که غلظت اکسیژن کم در حفظ بنیادینگی، پرولیفراسیون سلولی و مهار پیری و پلاستیسیتی سلولی نقش دارد. در اکثر مطالعهها غلظت اکسیژن مورد بررسی 1 تا 5 درصد تعیین شده و غلظت کمتر از 1 درصد تحت عنوان آنوکسی با خاموشی سلولها گزارش شده است.
مطالعههای آینده میتواند در جهت بررسی روشهایی جهت اندازهگیری دقیق اکسیژن محیط کشت باشد که امکان مقایسه نتایج آزمایشگاهی بین مراکز مختلف را فراهم آورد. به این دلیل که تغییرات کوچک در سطح اکسیژن میتواند پاسخهای داخل سلولی و مسیرهای سیگنالینگ متفاوتی را فعال کند. بنابراین استفاده از سنسورهای اکسیژن برای سنجش دقیق اکسیژن محیط کشت ارزش بالایی دارد.
علاوه بر این سطوح بالای استاندارد سازی شرایط کشت از نظر غلظت اکسیژن برای تفسیر و مقایسه نتایج روشهای فیزیکی و شیمیایی از نظر منبع سلول بنیادی مورد استفاده، پارامترهای کشت همچون غلظت سلول، درجه تراکم سلولها در محیط کشت و ترکیبات مغذی و زمان در معرض هیپوکسی بودن (حاد یا مزمن) مورد نیاز است. مسلماً شناسایی مکانیسمهای درگیر در غلظت اکسیژن مختلف میتواند در توسعه مولکولهای هدف جدید و درمانهای طب ترمیمی در بیماریهای مختلف همچون سرطان کمککننده باشد.
نقش نویسندگان
دکتر فاطمه محمد علی: جستجوی مقالهها و جمعبندی، نگارش اولیه مقاله، ساختاربندی
دکتر مصطفی جمالی: ویرایش و اصلاح نسخه نهایی مقاله
متن کامل: (1083 مشاهده)
اثر غلظتهای مختلف اکسیژن بر بنیادینگی سلولهای بنیادی خونساز
فاطمه محمدعلی1، مصطفی جمالی2
چکیده
سابقه و هدف
اخیراً مطالعهها در زمینه عوامل دخیل در بنیادینگی سلولهای بنیادی به دلیل اهمیت آن در درمانهای بر پایه سلولهای بنیادی مورد توجه زیادی قرار گرفته است. یکی از محرکهای مهم در تعیین سرنوشت سلولهای بنیادی، میزان اکسیژن محیطی است. نتایج مطالعههای مختلف نشان میدهد که غلظت اکسیژن پایین در نیچ سلولهای بنیادی، مسئول حفظ ذخایر آن است. بنابراین در این مطالعه هدف بررسی اثر هیپوکسی بر سلولهای بنیادی خونساز یا HSC و مکانیسمهای دخیل بود.
مواد و روشها
در این مقاله مروری بیش از 100 مقاله در دیتابیسPubmed مرور گردید. در این مطالعه به بررسی روشهای القای هیپوکسی، اثر هیپوکسی بر HSC ، اثر هیپوکسی در همکشتی HSC با سایر سلولها، ارتباط هیپوکسی با فاکتور HIF1a و ارتباط هیپوکسی با بنیادینگی سلولهای بنیادی پرداخته شد.
یافتهها
نتایج این بررسی مروری نشان داد که غلظت کم اکسیژن میتواند بر ظرفیت بنیادینگی سلولهای بنیادی تاثیر بگذارد. تفاوت در نتایج مشاهده شده در مطالعههای مختلف به دلیل روشهای مختلف القای هیپوکسی،درصد اکسیژن مورد استفاده، نوع سلولهای بنیادی و زمان قرار گرفتن در معرض هیپوکسی بود که ضرورت بهینهسازی دستورالعملهای القای هیپوکسی را نشان میدهد.
نتیجه گیری
در مقایسه با غلظت اکسیژن محیط، غلظتهای بسیار پایین اکسیژن 1% (آنوکسی) سلولهای بنیادی را در فاز خاموشی برده و بنیادینگی بالایی را حفظ میکنند در حالی که در غلظتهای بالاتر (5%) در کنار حفظ تکثیر سلولها، بنیادینگی نیز حفظ میشود. مسلماً طراحی محیطهای کشت بهینه با غلظت اکسیژن مشخص و شناخت مکانیسمهای درگیر میتواند در توسعه مولکولهای هدف جدید و درمانهای بر پایه سلولهای بنیادی کمککننده باشد.
کلمات کلیدی: هیپوکسی، اکسیژن، سلولهای بنیادی خونساز
تاریخ دریافت: 11/09/1402
تاریخ پذیرش: 11/10/1402
1- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
2- متخصص آسیبشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
فاطمه محمدعلی1، مصطفی جمالی2
چکیده
سابقه و هدف
اخیراً مطالعهها در زمینه عوامل دخیل در بنیادینگی سلولهای بنیادی به دلیل اهمیت آن در درمانهای بر پایه سلولهای بنیادی مورد توجه زیادی قرار گرفته است. یکی از محرکهای مهم در تعیین سرنوشت سلولهای بنیادی، میزان اکسیژن محیطی است. نتایج مطالعههای مختلف نشان میدهد که غلظت اکسیژن پایین در نیچ سلولهای بنیادی، مسئول حفظ ذخایر آن است. بنابراین در این مطالعه هدف بررسی اثر هیپوکسی بر سلولهای بنیادی خونساز یا HSC و مکانیسمهای دخیل بود.
مواد و روشها
در این مقاله مروری بیش از 100 مقاله در دیتابیسPubmed مرور گردید. در این مطالعه به بررسی روشهای القای هیپوکسی، اثر هیپوکسی بر HSC ، اثر هیپوکسی در همکشتی HSC با سایر سلولها، ارتباط هیپوکسی با فاکتور HIF1a و ارتباط هیپوکسی با بنیادینگی سلولهای بنیادی پرداخته شد.
یافتهها
نتایج این بررسی مروری نشان داد که غلظت کم اکسیژن میتواند بر ظرفیت بنیادینگی سلولهای بنیادی تاثیر بگذارد. تفاوت در نتایج مشاهده شده در مطالعههای مختلف به دلیل روشهای مختلف القای هیپوکسی،درصد اکسیژن مورد استفاده، نوع سلولهای بنیادی و زمان قرار گرفتن در معرض هیپوکسی بود که ضرورت بهینهسازی دستورالعملهای القای هیپوکسی را نشان میدهد.
نتیجه گیری
در مقایسه با غلظت اکسیژن محیط، غلظتهای بسیار پایین اکسیژن 1% (آنوکسی) سلولهای بنیادی را در فاز خاموشی برده و بنیادینگی بالایی را حفظ میکنند در حالی که در غلظتهای بالاتر (5%) در کنار حفظ تکثیر سلولها، بنیادینگی نیز حفظ میشود. مسلماً طراحی محیطهای کشت بهینه با غلظت اکسیژن مشخص و شناخت مکانیسمهای درگیر میتواند در توسعه مولکولهای هدف جدید و درمانهای بر پایه سلولهای بنیادی کمککننده باشد.
کلمات کلیدی: هیپوکسی، اکسیژن، سلولهای بنیادی خونساز
تاریخ دریافت: 11/09/1402
تاریخ پذیرش: 11/10/1402
1- مؤلف مسئول: PhD هماتولوژی آزمایشگاهی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
2- متخصص آسیبشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
سلولهای بنیادی خونساز سلولهایی با قابلیت خودنوسازی و تمایز به ردههای مختلف سلولی میباشند که در درمان طیف وسیعی از بیماریها استفاده میشوند. روشهای مختلفی برای تکثیر آزمایشگاهی (in vitro) سلولهای بنیادی خونساز (HSC : Hematopoietic Stem Cell) وجود دارد (1). در کنار عوامل شناخته شده در زمینه رشد in vitro سلولهای بنیادی خونساز، قرار گرفتن در معرض اکسیژن یک عامل مهم در تعیین سرنوشت سلولهای بنیادی به شمار میآید. به منظور تأمین بهترین شرایط برای کشت HSC در in vitro باید میزان غلظت حقیقی اکسیژن نیچ سلولهای بنیادی در نظر گرفته شود. در حال حاضر اندازهگیری دقیق غلظت اکسیژن نیچ امکانپذیر نیست اما در مطالعههای وسیعی پذیرفته شده است که غلظت اکسیژن در نیچ هماتوپوئیتیک، پایینتر از غلظت اکسیژن محیطی است و مشخصه نیچ هماتوپوئیتیک اکسیژن پایین آن است. به همین دلیل به آن نیچ هیپوکسیک نیز گفته میشود(2). میزان اکسیژن در بافتهای مختلف متفاوت است .غلظت واقعی اکسیژن به خونرسانی بافت و فعالیت متابولیکی آن بستگی دارد (3).
در شرایط هموستاتیک غلظت اکسیژن سلولها در مغز استخوان به حدود 2 تا 9 درصد (8/64-4/14 میلیمتر جیوه) میرسد (4). در عروق خونی بند ناف، غلظت اکسیژن کمی بالاتر است. در زمان زایمان غلظت اکسیژن 38-25 میلیمتر جیوه است که حدود 5-3 درصد میباشد (5). در جفت (حدود 12 هفته پس از حاملگی) به حدود 60 میلیمتر جیوه (10-8 درصد) میرسد (7، 6).
با وجود این که مکان آناتومیک نیچ هیپوکسی مشخص نشده است اما مشاهدات زیادی نشان میدهد که سلولهای HSC ، میکرومحیط هیپوکسی را نسبت به محیط غنی از اکسیژن ترجیح میدهند. از جمله: مدلسازی ریاضی توزیع غلظت اکسیژن در مغز استخوان نشان داده است که HSC در محیطی هیپوکسیک واقع شده است (8). از سوی دیگر کشت هیپوکسیک HSC در اکسیژن پایین باعث افزایش تولید ردههای اریتروئیدی- مگاکاریوسیتی و پروژنتیورهای گرانولوسیتی- مـونوسیتی مـیشود (10، 9).
کشت هیپوکسی باعث افزایش پیوندپذیری HSC میشود (13-11). نهایتاً مطالعههای داخل بدن(in vivo) نشان دادهاند که HSC با فنوتیپ اولیهتر در ناحیه هیپوکسیک نیچ واقع شده است (17-14). روی هم رفته این نتایج نشان میدهند که میکرو محیط با غلظت اکسیژن کم توسط HSC تحمل نمیشود بلکه برای حفظ بنیادینگی آن ضروری است.
سلولها در پاسخ به میزان اکسیژن موجود، بیان ژنهای خود را تغییر میدهند که این تغییرات متابولیسم، ایمنی و سازماندهی بافتی سلول را تحت تأثیر قرار میدهد. پاسخهای سلولی به هیپوکسی عمدتاً از طریق فاکتور رونویسی Hypoxia Inducible Factor 1) )HIF1 واسطهگری میشود که خود باعث تغییر بیان ژنهای درگیر در آنژیوژنز، پرولیفراسیون سلولی و بقا در شرایط هیپوکسیک میشود. معمولاً سلولها در پاسخ به غلظت اکسیژن، پاسخهای مختلفی ایجاد میکنند از جمله: کاهش فسفوریلاسیون اکسیداتیو، توقف چرخه سلولی و تحریک تشکیل عروق خونی جدید که با آزاد کردن فاکتورهایی چون فاکتور رشد اندوتلیال عروقی (Vascular endothelial growth factor) VEGF ، فاکتور رشد ترانسفورمه کننده بتا (Transforming growth factor beta) TGF-B ، آنژیوپوئیتین 1 (Angiopoietin 1) ANG-1 و فاکتور رشد فیبروبلاستی 2 (Fibroblast growth factor2) FGF2 همراه است (18).
غلظت بالای اکسیژن باعث القای سیتوتوکسیسیتی به علت تولید گونههای فعال اکسیژن ROS (Reactive oxygen species) میشود که با اکسیداسیون لیپید، پروتئین و نوکلئیک اسید منجر به اختلال عملکرد سلولی میگردد. معمولاً سلولها سطوح مختلفی از آنتیاکسیدانها و آنزیمهای ردوکس (Redox) برای مقابله با تجمع ROS دارند اما در برخی موارد این سیستم توان مقابله کافی با تولید ROS را نداشته و منجر به درجات مختلفی از تولرانس ROS میشود (19).
نتایج مطالعههای مختلف نشان میدهد که غلظت کم اکسیژن که در نیچ مغز استخوان وجود دارد، میتواند بر ظرفیت پرولیفراتیو، بقا و بنیادینگی سلولهای بنیادی تأثیر بگذارد (20). سلولهای هماتوپوئیتیک خاموش در ناحیه اندوستئال (Endosteal) نیچ مغز استخوان با شرایط هیپوکسیک فراوان ترند (21). در خصوص سیستم هماتوپوئیتیک تعادل بین تکثیر سلولی و خاموشی برای HSC با غلظت اکسیژن حدود 5 درصد گزارش شده است (23، 22).
خاصیت بنیادینگی Stemness)) به ترکیبی از خواص مختلف همچون حفظ خودنوسازی، پتانسیل پیوندپذیری طولانی مدت، لانهگزینی و تمایز چند ردهای اطلاق میشود. باید به این مسأله توجه داشت که مارکر واحدی به عنوان مارکر مختص و قطعی برای بنیادینگی سلولهای بنیادی وجود نداشته، بلکه ترکیبی از مارکرها هستند که بیانگر بنیادینگی بوده و با اطمینان میتوان گفت که عدم حضور تعداد قابل توجهی از این مارکرها، ماهیت بنیادی بودن یک سلول را رد مینماید. در این مطالعه به بررسی روشهای القای هیپوکسی، اثر هیپوکسی بر سلولهای بنیادی خونساز، اثر هیپوکسی بر سلولهای بنیادی خونساز در همکشتی با سایر سلولها، ارتباط هیپوکسی با فاکتور HIF1a و ارتباط هیپوکسی با بنیادینگی سلولهای بنیادی پرداخته شد.
مواد و روشها
در این مقاله مروری بیش از 100 مقاله در دیتابیس pubmed با کلمات کلیدی هیپوکسی، بنیادینگی و سلولهای بنیادی خونساز مرور گردید.
یافتهها
روشهای فیزیکی القای هیپوکسی:
چمبرهای (Chamber) هیپوکسیک، انکوباتورهای سه گازه و ایستگاه کاری (Workstation) هیپوکسی:
انکوباتورها و چمبرهای هیپوکسیک فراوانترین سیستمهای مورد استفاده برای ایجاد شرایط هیپوکسی هستند. چمبرها از مواد جامد ثابت و سایز مناسب برای 12 ظرف محیط کشت 10 سانتیمتری و تجهیزاتی چون رگولاتور Regulator)) و لولهکشی پمپها برای تأمین گاز داخل محفظه تشکیل شده است. در این چمبرها باید از آب مقطر در ظروف استریل برای حفظ رطوبت داخل چمبر استفاده شود (24). یکی از نقایص این چمبرها نشت آن است به همین دلیل امروزه عمدتاً از انکوباتورهای سه گازه استفاده میشود. اولین انکوباتور سه گازه در سال 1979 استفاده شد، در این انکوباتورها دو گاز CO2 و N2 باعث کاهش غلظت اکسیژن میشوند. یکی دیگر از روشها استفاده از کیسههای بیهوازی (آنئروپک) است که در چندین مقاله بررسی شده است (26، 25). این کیسهها کاربری بسیار راحتی دارند و نیازی به آب یا کاتالیست ندارند و فقط باید آنها را در داخل جار قرار داد. یکی از مزایای مهم آن قیمت کم و حمل و نقل راحت آن است.
استفاده از Workstation هیپوکسی که کنترل دقیق درصد اکسیژن و دیاکسید کربن را امکانپذیر میکند، روشی مناسب است (27). این محفظهها سلولها را در معرض عدم تغییر غلظت اکسیژن قرار میدهند چون میتوان محیط کشت را بدون تغییر سطح اکسیژن آن تعویض کرد. این ابزار مجهز به سنسور اکسیژن است که غلظت اکسیژن را پایش میکند و دو دستکش دارد که جابهجایی نمونه را امکانپذیر میکند (27). این ابزار برای ایجاد شرایط آنوکسی یا غلظت اکسیژن بسیار پایین مناسب است.
اخیرا دستگاه پیچیده میکروفلوئیدی برای ایجاد شرایط کاهش اکسیژن با امکان سنجش دقیق فشار اکسیژن پیشنهاد شده است. ابعاد کوچک این وسیله فاصله انتشار اکسیژن را به حداقل رسانده و یک سیستم میکروواسکولار Microvascular)) با حجمهای کوچک (در حد میکرولیتر) را فراهم میآورد (28). تعیین مقادیر دقیق اکسیژن سلولها امکانپذیر نیست چون میزان مصرف اکسیژن توسط سلولها به چندین متغیر نوع ظروف کشت سلول، نوع سلول، میزان سلول کشت داده شده، حجم محیط کشت و ترکیبات آن، دما و رطوبت محیط کشت و تعداد دفعات بازشدن درب انکوباتور بستگی دارد (29). به عنوان مثال تعویض محیط کشت باعث میشود مدتی زمان ببرد تا سلولها با غلظت اکسیژن جدید به تعادل برسند (29). به همین دلیل قرار دادن سنسورهای اکسیژن در محیط کشت برای اندازهگیری غلظت اکسیژن پیشنهاد میشود تا تمام نوسانات اکسیژن را اندازهگیری کند هر چند که به طور روتین استفاده نمیشود (30).
روشهای شیمیایی القای هیپوکسی:
روش دیگر مطالعه بررسی هیپوکسی، استفاده از تیمار دارویی و ترکیبات شیمیایی تحت عنوان ترکیبات مقلد هیپوکسی میباشد که در میان آنها کلرید کبالت، دی متیل اگزالیل گلایسین (DMOG) و دفروکسامین (DFO) ترکیباتی است که بسیار استفاده میشوند (31).
DMOG مهارکننده رقابتی ایزوفرم 3 پرولیل هیدروکسیلاز (PHD : Proly 1 Hydroxylase Domain) است که مهارکننده HIF میباشد و به عنوان آنالوگ 2-اکسوگلوتارات (2OG : کوسوبسترای PHD) عمل میکند و در جایگاه کاتالیتیک قرار گرفته و باعث مهار فعالیت آنزیمی میشود (32).
DFO شلاتور آهن است که کوفاکتور دیگر فعالیت PHD است. کمبود آهن در دسترس باعث مهار فعالیت PHD و تحریک تجمع HIF1α و افزایش فعالیت آن میشود (33). کلرید کبالت باعث مهار PHD با جایگزینی آهن و افزایش سطح پروتئین HIF1α و القای فعالیت رونویسی آن میشود (34) کبالت مانع اتصال HIF1α به پروتئین وون هیپل لاندا (VHL) و مهار تخریب HIF1α و تخلیه آسکوربات میشود که برای حفظ PHD ضروری است. افزایش سطح HIF1α بعد از تیمار با کلرید کبالت همچنین با تولید ROS مرتبط دانسته شده است (35). با این که این روش ارزان بوده و امکان باز کردن ظروف کشت سلول توسط اپراتور بدون تغییر در غلظت اکسیژن را فراهم میآورد، اما احتمالاً علاوه بر القای HIF مکانیسمهای ناشناخته دیگری را نیز تحت تاثیر قرار میدهد (36). از سوی دیگر مدت زمان قرار گرفتن در معرض این مواد شیمیایی عامل متغیر مهم دیگری است (37). همچنین پاسخهای سلولی مختلفی ممکن است بسته به ایزوفرم HIF فعال شده رخ دهد. در مطالعهها نشان داده شده که HIF1 پاسخهای اولیه در 24 ساعت اول را ایجاد میکند در حالی که HIF2 در پاسخهای مزمن پس از 24 ساعت نقش دارد (38).
تاثیر هیپوکسی بر سلولهای بنیادی خونساز:
هیپوکسـی نقـش مهمـی در تنظیم خونسازی دارد که با
با حمایت HSC از استرس اکسیداتیو همراه است و یک مدیاتور مهم در پیری HSC میباشد (40، 39) بسیاری از مطالعهها به بررسی نقش هیپوکسی در فعالیت خونسازی موش/انسان و مقایسه بقا و تکثیر، فعالیت پروژنیتورهای خونساز، فعالیت لانه گزینی در In vivo و چرخه سلولی سلولهای خونساز کشت داده شده در نرموکسی در مقابل هیپوکسی پرداختهاند (44-41، 13، 9، 7، 6). تفاوت نتایج مطالعههای مختلف به علت تفاوت در بافت مورد استفاده، سیستم کشت هماتوپوئیتیک مورد استفاده (تشخیص حداقل 5 نوع پروژنیتورمختلف)، سطح اکسیژن، زمان قرار گرفتن در معرض هیپوکسی و ترکیبهای مختلف از سیتوکاین (فاکتور محرک کلنی گرانولوسیت/ماکروفاژ (GM-CSF)، اینترلوکین 3 (IL-3) و اینترلوکین6 (IL-6)، استم سل فاکتور(SCF)، ترومبوپپتین (TPO)، لیگاند شبه FMS- تیروزین کیناز 3 (FLT-3) ) در محیط کشت بوده است. بسته به شرایط محیط کشت، تعداد سلولهای خونساز کاهش، افزایش و یا بدون تغییر در مقایسه با زمان صفر بوده است. خلاصه مطالعههایی که به بررسی اثر هیپوکسی بر سلولهای بنیادی خونساز پرداختهاند در جدول ذکر گردیده است (جدول 1). به طور کلی کشت سلولها در آنوکسی (اکسیژن 1 درصد و کمتر) موجب افزایش حفظ و بازگشت HSC به فاز خاموشی و G0 میشود (53) اما کشت در غلظتهای بالاتر (3 و 5 درصد) باعث حفظ پرولیفراسیون در کنار حفظ خودنوسازی سلولهای HSC موشی و انسانی میگردد (11).
تفاوت در نتایج مشاهده شده در مطالعههای مختلف به دلیل روشهای القای هیپوکسی مختلف (شیمیایی یا فیزیکی)، درصد اکسیژن مورد استفاده، مدلهای سلولهای بنیادی استفاده شده و زمان در معرض هیپوکسی بودن میباشد. علاوه براین متابولیسم سلولهای بنیادی تعیینکننده مهم فرآیندهای سلولی است که در پرولیفراسیون، بنیادینگی و تعهد به رده نقش دارند.
اثر هیپوکسی بر سلولهای بنیادی خونساز در سیستمهای هم کشتی:
در مطالعههای مختلفی اثر هیپوکسی در کنار سیستمهای


در نهایـت استفاده از نیچ هیپوکسیک برای افزایش تکثیر منـاسب HSC و در کنـار آن حفـظ فنوتیــپ آن در
In vivo نیاز به مطالعههای گسترده دارد (67).
ارتباط هیپوکسی با HIF1a :
HIF تنظیم کننـده اصلـی هموستـاز اکسیـژن اسـت که
تاکنون هزاران هدف ژنی برای آن شناخته شده است. HIF یک فاکتور رونویسی هترودایمر است که از دو زیر واحد تشکیل شده است : HIF1α و HIF1β (68).
HIF1α تنظیمکننده اصلی هیپوکسی است و عمدتاً در سطح بعد از رونویسی تنظیم میشود (69). امروزه 3 زیر واحد α شناسایی شده است HIF 1α ، HIF 2α و HIF 3α که (70) که هر کدام عملکرد متفاوتی دارند (71). هر سه ایزوفرم هترودایمری با HIF1β تشکیل داده و به جایگاه اتصال به HIF متصل میشوند (72).
HIF در حالت طبیعی در سطوح پایه در سلولها بیان میشود اما در غلظت اکسیژن بالا یعنی اکسیژن 21 درصد (که به آن نرموکسی نیز میگویند) یوبیکوئیتینه شده و تخریب میشود. که توسط آنزیم پرولیل هیدروکسیلاز دومین (PHD) هیدروکسیله شده و جایگاه اتصال برای پروتئین وون هیپل لاندا ایجاد میکنند که جزیی از کمپلکس E3 یوبیکوئیتین لیگاز است و باعث تخریب پروتئازومی HIFIα میشود در نتیجه HIFIα در شرایط نرموکسی سریعاً تخریب میشود (73).
در شرایط غلظت اکسیژن پایین (که به آن هیپوکسی نیز گفته میشود) PHD غیرفعال است و پروتئین HIFIα پایدار مانده و زیرگروههای HIFα و HIFβ هترودایمری را تشکیل میدهند که نام آن کمپلکس انتقال هستهای رسپتور آریل هیدروکربن (ARNT : Aryl Hydrocarbon Receptor Nuclear Translocator) است که به هسته منتقل میشود. وقتی این هترو دایمر در هسته تشکیل میشود، توسط کواکتیویتورها (Coactivator) شناسایی شده و به توالی حفاظت شده در عنصر پاسخ دهنده به هیپوکسی (HRE : Hypoxia response element) ژنهای هدف متصل شده و باعث تنظیم رونویسی میشود (74).
بحث
نتایج مطالعه تاکوبو و همکاران با موشهای حذف ژنی شده نشان داد که HIF-1α بر خاموشی HSC و عملکرد آن در داخل بدن نقش دارد (75). با این که هیپوکسی با واسطه HIF و اثر آن در تکثیر HSC بسیار مهم است، شرایط نرموکسی/فعالسازی پیوستهHIF-1α اثــرات منفـی
بر روی عملکرد HSCدارد.
نتایج مطالعهها نشان داده است کـه حـذف ژنی HIF2α
در سیستم هماتوپوئیتیک تأثیری بر عملکرد HSC ندارد هر چند که حذف ژنی آن در جمعیت غنی از سلولهای بنیادی و پروژنیتوری CD34+ منجر به اختلال در ظرفیت بازسازی میشود (77، 76). البته موش HIF2α Null زمانی که با سلولهای اهدایی نوع وحشی پیوند داده میشود، نقص در هماتوپوئز نشان میدهد که نشاندهنده نقش HIF2α در هماتوپوئز طبیعی در میکرومحیط HSC میباشد (77(.
ناک اوت ژنتیکی تنظیمکنندههای منفی HIF نیز منجر به افزایش سیگنالینگ هیپوکسی میشود. به عنوان مثال حذف PHD منجر به تثبیت HIFIα و HIF2α میشود (78). موش گیرنده پیوند با نقص PHD در مغز استخوان افزایش پیوندپذیری را نشان داد که نشان میدهد حذف PHD و افزایش سیگنالینگ هیپوکسی باعث افزایش پرولیفراسیون HSC پس از پیوند میشود. به طور مشابه حذف مونوآللی وون هیپل لاندا که لیگاز E3 HIF است، باعث افزایش خاموشی در HSC و افزایش پیوندپذیری در مغز استخوان شد (79). از سوی دیگر حذف ژنی CITED2 (Cbp/p300-interacting transactivator 2) که یک تنظیمکننده منفی HIFIα است، در سیستم هماتوپوئیتیک منجر به از دست دادن HSC و نقص مغز استخوان شد (80). این نتایج نشان میدهد که کنترل مناسب سطوح HIF درHSC در نیچ برای تعیین سرنوشت سلول بنیادی ضروری است.
بنابراین تنظیم دقیق سطح HIFIα برای حفظ خاموشی HSC ضروری است و به نظر میرسد محور HIFIα در اثرات هیپوکسی بر سلولهای بنیادی خونساز نقش اصلی را داشته باشد.
هیپوکسی و بنیادینگی:
غلظت اکسیژن به طور نزدیکی با حفظ بنیادینگی سلولهای بنیادی در نیچ بافتی (جایگاه آناتومیکی که در تولید و حفظ و ترمیم سلولهای بنیادی نقش دارد) ارتباط دارد (83-81). نیچ سلولهای بنیادی یک ساختار پیچیده، هتروتیپیک و دینامیکی است که شامل ماتریکس خارج سلولی، سلولهای مجاور در نیچ، فاکتورهای سیگنالینگ محلـول تـرشح شـده و سیگنالهـای مختلـف فیزیکــی و
محیطی میباشد (85، 84).
در مطالعههای مختلف نشان داده شده است که سلول بنیادی در شرایط هیپوکسیک در نیچ قرار دارند اما اندازهگیری دقیق میزان اکسیژن در نیچ با روشهای فعلی امکانپذیر نیست اما با تخمین حدود غلظت اکسیژن 3 تا 13 درصد در نیچ سلولهای بنیادی وجود دارد (86).
خاصیت بنیادینگی (Stemness) به ترکیبی از خواص مختلف همچون حفظ خودنوسازی، پتانسیل پیوندپذیری طولانی مدت، لانهگزینی و تمایز چند رده ای اطلاق میشود. باید به این مسأله توجه داشت که مارکر واحدی به عنوان مارکر مختص و قطعی برای بنیادینگی سلولهای بنیادی وجود نداشته، بلکه ترکیبی از مارکرها هستند که بیانگر بنیادینگی میباشند.
حفظ خودنوسازی و بنیادینگی سلولهای بنیادی توسط فاکتورهای سلولی داخلی و خارجی تنظیم میشود. همان طور که قبلاً بحث شد غلظت کم اکسیژن یا هیپوکسی با حفظ بنیادینگی سلولهای بنیادی مرتبط است. سلولهای بنیادی کشت داده شده در شرایط هیپوکسیک میتوانند خاصیت خودنوسازی و ظرفیت بنیادینگی خود را حفظ کنند که در مورد HSC به خوبی نشان داده شده است. فشار اکسیژن کم با مکانیسمی که شرایط In vivo را تقلید میکند، منجر به افزایش بیان ژنهای مرتبط با بنیادینگی میشود (87). این فاکتورهای بنیادینگی میتوانند باعث تنظیم بیان سایر ژنهای درگیر در بنیادینگی به صورت آبشاری شوند (88).
بنیادینگی با بیان فاکتورهای رونویسی مثل OCT4 (octamer-binding transcription factor 4) و SRY (SRY-Box Transcription Factor2) و NANOG مرتبط است که نقش مهمی در شبکه رونویسی سلولهای بنیادی دارد (89). علاوه بر این پروتئینهای متعددی چون ESRRB (Estrogen-related receptor beta) و ZFX (Zinc Finger Protein X-Linked) در کنترل خودنوسازی، E2F1 (E2F Transcription)، KLF4 (Kruppel-like factor 4) و C-MYC در تنظیم چرخه سلولی و SMAD1 (SMAD Family Member) و BMP (Bone morphogenetic protein) و LIF (Leukemia inhibitory factor) در حفظ کیفیت سلول شناسایی شده است (90). NANOG تنظیمکننده بالا دست و فعالکننده STAT3 (Signal transducer and activatior of transcription 3) و OCT4 است و از طریق کمپلکس متشکل از فاکتورهای رونویسی KLF4 ، SOX2 و OCT4 تنظیم بنیادینگی آن اتفاق میافتد (91).
با وجود این که NANOG ، OCT4 و SOX2 بیشترین مارکرهای بنیادینگی بررسی شده هستند، REX1 (reduced expression-1) فاکتور مهم دیگری است که در ترکیب با ژنهای بالا نقش مهمی در پیشروی چرخه سلولی و حفظ بنیادینگی دارد (92). علاوه بر فاکتورهای ژنتیکی، مدیفیکاسیونهای اپیژنتیک مثل متیلاسیون DNA و تغییر نوکلئوزوم و مدیفیکاسیونهای بعد از ترجمه در هیستونها نیز نقش مهمی در حفظ بنیادینگی سلولهای بنیادی دارند.
در مطالعهای که به بررسی اثر اسفر سلولهای بنیادی مزانشیمی بر سلولهای بنیادی خونساز در شرایط هیپوکسیک پرداخته بودند در کنار افزایش بازده سلولی، افزایش خودنوسازی و افزایش ژنهای درگیر در لانهگزینی را گزارش کردند (93).
مطالعهای نشان داد که غلظت اکسیژن یک درصد باعث حفظ بهتر سلولهای LTC-IC میشود. بنابراین نتیجه گرفتند که غلظت اکسیژن یک درصد باعث حفظ بنیادینگی و خاموشی سلولهای بنیادی خونساز با فعالسازی مسیرهای سیگنالینگ Notch و Wnt/β-catenin و Hedgehog از طریق فاکتورهای مرتبط با HIF میشود (94).
در مطالعه دیگری سلولهای بنیادی مزانشیمی و سلولهای بنیادی خونساز CD34+ از سلولهای تک هستهای خون بند ناف جدا شدند. سلولهای بنیادی مزانشیمی خون بند ناف با یک یا چند ناقل بیانی sSCF ، mSCF و SDF-1 نوکلئوفکت شدند. سپس سلولهای CD34+ HSC جدا شـده با سلولهای بنیادی مزانشیمی نوکلئوفکت شده در 10 گروه در محیط کشت حاوی TPO و Flt3L با یا بدون SCF کشت داده شدند. سپس تعداد CD34+HSC ، ظرفیـت کلونوژنیک و سطوح رونویسی ژنهای تنظیمی و بنیادینگی شامل:
CXCR4 (chemokine receptor type 4) C-X-C ، HomeoboxB4 (HOXB4)، BMI1 و SALL4 (Sal-like protein 4) متعاقب هم کشتی با سلولهای بنیادی مزانشیمی اصلاح شده مورد ارزیابی قرار گرفت. نتیجه این تحقیق نشان داد که سلولهای CD34+HSC که هم کشتی با سلولهای بنیادی مزانشیمی با افزایش بیان mSCF/sSCF/SDF-1 داشتند، بیشترین افزایش را در تعداد کلی سلول (26/0 ± 73/4 برابر)، ظرفیت کلونوژنیک (25/0 ± 3/5 برابر) و هم چنین سطوح رونویسی ژنهای CXCR4، HOXB4 و BMI1نشان دادند (95).
در مطالعهای ما به بررسی بیان ژن HOXB4 به عنوان ژن درگیر در خودنوسازی پرداختیم (96). نتایج ما نشان داد بیشترین بیان ژن HOXB4 در سلولهای بنیادی خونساز +CD34 خون بند ناف در شرایط هم کشتی با سلولهای بنیادی مزانشیمی همراه با سیتوکاینها در شرایط هیپوکسی خفیف بود (8/1 برابری در روز 7). در گروه فیدر + سیتوکاین با غلظت اکسیژن 20 درصد بیان ژن HOXB4 بالاتر از بیان آن در شرایط کشت سیتوکاین به تنهایی و فیدر به تنهایی بود. از آن جا که سیتوکاینها باعث پیشروی تمایز به سلولهای بالغتر میشوند، بنابراین در شرایط کشت سیتوکاین به تنهایی بیان مارکرهای مرتبط با خودنوسازی کاهش مییابد. در شرایط هیپوکسی نسبت به نرموکسی، افزایش معنادار بیانHOXB4 (8/1-3/1 برابر در روز 7) مشاهده شد. در مطالعههای قبلی نیز گزارش شده است که هیپوکسی در حفظ خصوصیات خود نوسازی HSCs سودمند است (7، 6). در مطالعه ما بیان HOXB4 در طول زمان تکثیر، کاهش یافت در حالی که هم کشتی با سلولهای بنیادی مزانشیمی کاهش آن را جبران کرد. ما بیان ژن HOXB4 را به عنوان مارکر خود نوسازی HSC انتخاب کردیم زیرا HOXB4 یکی از مهمترین تنظیمکنندههای خودنوسازی HSC میباشد (97). در سلولهای بنیادی بیان میشود و سپس در طی تمایز در انسان و موش کاهش بیان مییابد (99، 98).
مطالعههـای متعـددی نشـان دادهاند کـه HOXB4 باعث
تکثیـر ex vivoوin vivo HSCs میشود (102-100).
مطالعههـای متعددی گزارش کردهاند که سیتوکاینهایی مانند GM-CSF ، IL-3 ، SCF وTPO موجب افزایش تکثیر HSC موشی و انسانی میشود اما با افزایش سریع ROS در سلولها نیز همراه هستند (103). به نظر میرسد که همکشتی با سلولهای بنیادی مزانشیمی از عوارض جانبی ROS کاسته و باعث حفظ بهتر خودنوسازی HSC میشود.
هیپوکسی با سرکوب چرخه سلولی و القای خاموشی، HSC ها را در شرایط ex vivo حفظ میکند.
هیپوکسی باعث مهار فعالیت فاکتور رونویسی c-Myc و سیگنالینگ mTOR نیز میشود و باعث القای مهارکننده Cdk (Cyclin-dependent kinases) میشود. هیپوکسی بیان پروتئین Fbxw7 (F-box/WD repeat-containing protein 7) را در HSC افزایش میدهد بنابراین میتوان نتیجه گرفت که مکانیسم مهار c-Myc در طول هیپوکسی توسط مسیر وابسته به Fbxw7 تنظیم میشود. نتایج تحقیقی نشان داد که مسیر هیپوکسی وابسته به Fbxw7مکانیسمی است که از طریق آن فشار کم اکسیژن نقش مهمی در حفظ عملکرد طبیعی HSC دارد. علاوه بر کشت هیپوکسیک، تغییر بیان یا فعالیت Fbxw7 میتواند ابزاری امید بخش برای حفظ ex vivo HSCs باشد (104).
در مطالعهای که به بررسی غلظت اکسیژن 4-1 درصد بر سلولهای بنیادی هماتوپوئیتیک پرداختند، سلولهای بنیادی هماتوپوئیتیک در غلظت اکسیژن کم افزایش کلسیم سیتوزولیک و میتوکندریایی، ترانسپورتر ABC (ATP-binding cassette super-family G) ABCG2 member 2 و بیان جابهجاکننده سدیم هیدروژن NHE1 (The sodium-hydrogen antiporter 1) را مشاهده کردند که با افزایش جمعیت LSK همراه بوده و نقش تنظیم کلسیم در حفظ فنوتیپی سلولهای بنیادی خونساز را نشان میدهد (105).
به منظور پیوندپذیری موفق، سلولهای بنیادی خونساز باید به مغز استخوان مهاجرت کنند (لانه گزینی) سپس پیوند یافته و تکثیر و تمایز پیدا کنند. بنابراین بررسی مارکرهای لانهگزینی HSC گامی مهم در بررسی بنیادینگی HSC میباشد.
لانهگزینـی مغـز استخـوان فـرآیندی سـریع و هماهنگ
است که در آن سلولهای بنیادی هماتوپوئیتیک و پروژنیتور وارد مغز استخوان میشوند، پس از پیوند فعال شدن اینتگرینی از طریق SDF1 (stromal cell-derived factor 1) باعث القای چسبندگی HSC به دیواره اندوتلیال میشوند و HSC میتواند از طریق لایه اندوتلیال مهاجرت کند و در نهایت HSC به نیچ خود لنگر انداخته و باعث پیوندپذیری طولانی مدت میشود.
CXCR4در سطح سلولهای هماتوپوئیتیک و پروژنیتور بیان میشود (106). بیان گیرنده CXCR4 برای لانهگزینی سلولی و پیوندپذیری HSC به مغز استخوان و فراخوانی پروژنیتورهای هماتوپوئیتیک و اندوتلیال ضروری است و همچنین به عنوان عامل پروآنژیوژنیک باعث افزایش تشکیل عروق جدید در مدل موشی ایسکمی میشود (108، 107).
در رویکرد بالینی چندین مطالعه نشان دادهاند که کاهش مطلق بیان CXCR4 میتواند عواقب شدیدی بر روی قابلیت پیوند سلولهای بنیادی خونسازCD34+ داشته باشد (109). از سوی دیگر، با سلولهایی که مقدار بالایی از CXCR4 را بیان میکردند، میزان سلولهای CD34+ موبیلیزه شده کمتری به ازای هر کیلو وزن بدن برای پیوند مورد نیاز بود (110).
نتایج مطالعه ما نشان داد بیشترین بیان ژن CXCR4 در سلولهای +CD34 در شرایط هم کشتی با سلولهای بنیادی مزانشیمی همراه با سیتوکاینها در هیپوکسی خفیف بود (که میتواند نقش مهمی در افزایش لانه گزینی HSC به مغز استخوان داشته باشد) (54). نتایج ما نشان داد که با وجود تکثیر بیشتر HSC در گروه سیتوکاین، بیان ژن CXCR4 در این گروه نسبت به گروه فیدر و فیدر + سیتوکاین پایینتر بود. سیتوکاینها نه تنها باعث القای تقسیم سلولی میشوند بلکه باعث پیشروی تمایز به سلولهای بالغ تر نیز میشوند که توانایی پیوندپذیری ندارند (113-111). بنابراین انتخاب صحیح ترکیب سیتوکاینی برای حفظ پیوند ضروری است. مقالات مختلف کاهش بیان CXCR4 متعاقب افزایش بیان رسپتور چسبندگی AR (Adhesion receptor) را در طول کشت CD34+ بـا سیتوکایـن نشـان دادنـد کـه نقـص لانه گزینی
میتواند به این علت باشد (109).
کاهش بیان CXCR4 در طول تکثیر یکی از دلایل اصلی عدم پیوندپذیری به دلیل عدم لانه گزینی مناسب HSC میباشد. هم راستا با نتایج مطالعه ما نسبت بالاتری از سلولهای CXCR4 منفی در کشتهای تکثیر شده با سیتوکاین مشاهده شده است. در این تحقیق دلیل آن را کاهش تولید CXCR4 به علت کاهش CXCR4 داخلی یا به علت اینترنالیزه شدن CXCR4 از سطح به داخل گزارش کردند (109). نشان داده شده که افزایش بیان CXCR4 با هیپوکسی باعث افزایش بهبود سلتراپی میشود (114).
مطالعههای متعددی نشان دادند که ژن CXCR4 یکی از اهداف ژن HIF-1α است (115). بنابراین، دلیل افزایش بیان CXCR4 در هیپوکسی به نظر میرسد که اتصال HIF-1α به توالی هدف آن باشد. همچنین نشان داده شده که وون هیپل لاندا پروتئینی است که به طور منفی با بیان CXCR4 مرتبط است (از طریق مسیر فعالسازی CXCR4 وابسته به HIF)(116).
غلظت اکسیژن 5 درصد باعث افزایش چشمگیر بیان HIF-1α و VEGF (Vascular endothelial growth factor)، ABCG2 ، CXCR4 میشود. در مطالعههای فلوسایتومتری افزایش چشمگیر بیان CXCR4 در هیپوکسی (9/1 ± 1/43 درصد) در مقابل نرموکسی (86/1 ± 32 درصد) مشاهده شد. بیان mRNA HIF-1α نیز حدود 45/2 برابر در اکسیژن 5 درصد بالاتر از اکسیژن 20 درصد بود اما بیان HIF-2α ثابت بود (116).
در مطالعهای که به بررسی سلولهای CD133 مثبت خون بند ناف در شرایط هیپوکسی پرداخته بودند، در غلظت اکسیژن 5 درصد در مقایسه با 20 درصد در ده روز لانهگزینی SCID (Severe combined immunodeficiency) در هیپوکسی بهتر حفظ شدند و هیپوکسی باعث القای VEGF و ABCG2,CXCR4با واسطه HIF-1α شد (22).
نتیجهگیری
هدف از این مقاله مروری، بررسی ارتباط بین غلظتهای مختلف اکسیژن بر سلولهای بنیادی خونساز بود و به بررسی مدلهای کشت سلول و انواع مختلف سلول به عنوان ابزاری مهم برای بررسی مکانیسم درگیر در هیپوکسی پرداخته شد که مسلماً در توسعه روشهای جدید برای بهبود روشهای درمانی بر پایه سلولهای بنیادی کمککننده خواهد بود.
در مطالعههای مختلف پیشنهاد شده است که کاهش غلظت اکسیژن که منجر به تقلید فضای نیچ میشود، فنوتیپ اولیه سلولها را بهتر حفظ میکند. نتایج مطالعههای مختلف نشان دادند که غلظت اکسیژن کم در حفظ بنیادینگی، پرولیفراسیون سلولی و مهار پیری و پلاستیسیتی سلولی نقش دارد. در اکثر مطالعهها غلظت اکسیژن مورد بررسی 1 تا 5 درصد تعیین شده و غلظت کمتر از 1 درصد تحت عنوان آنوکسی با خاموشی سلولها گزارش شده است.
مطالعههای آینده میتواند در جهت بررسی روشهایی جهت اندازهگیری دقیق اکسیژن محیط کشت باشد که امکان مقایسه نتایج آزمایشگاهی بین مراکز مختلف را فراهم آورد. به این دلیل که تغییرات کوچک در سطح اکسیژن میتواند پاسخهای داخل سلولی و مسیرهای سیگنالینگ متفاوتی را فعال کند. بنابراین استفاده از سنسورهای اکسیژن برای سنجش دقیق اکسیژن محیط کشت ارزش بالایی دارد.
علاوه بر این سطوح بالای استاندارد سازی شرایط کشت از نظر غلظت اکسیژن برای تفسیر و مقایسه نتایج روشهای فیزیکی و شیمیایی از نظر منبع سلول بنیادی مورد استفاده، پارامترهای کشت همچون غلظت سلول، درجه تراکم سلولها در محیط کشت و ترکیبات مغذی و زمان در معرض هیپوکسی بودن (حاد یا مزمن) مورد نیاز است. مسلماً شناسایی مکانیسمهای درگیر در غلظت اکسیژن مختلف میتواند در توسعه مولکولهای هدف جدید و درمانهای طب ترمیمی در بیماریهای مختلف همچون سرطان کمککننده باشد.
نقش نویسندگان
دکتر فاطمه محمد علی: جستجوی مقالهها و جمعبندی، نگارش اولیه مقاله، ساختاربندی
دکتر مصطفی جمالی: ویرایش و اصلاح نسخه نهایی مقاله
نوع مطالعه: مروري |
موضوع مقاله:
سلولهاي بنيادي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






