جلد 21، شماره 1 - ( بهار 1403 )
جلد 21 شماره 1 صفحات 8-1 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sharifi Z, Yadegari A, Paz Z. Investigating natural mutations in BCP and preC regions of hepatitis B virus in blood donors with chronic hepatitis B anti-HBe+. bloodj 2024; 21 (1) :1-8
URL: http://bloodjournal.ir/article-1-1515-fa.html
URL: http://bloodjournal.ir/article-1-1515-fa.html
شریفی زهره، یادگاری عباس، پاز زهرا. جهشهای طبیعی در نواحی BCP و preC ویروس هپاتیت B در اهداکنندگان خون با هپاتیت B مزمن anti-HBe+. فصلنامه پژوهشی خون. 1403; 21 (1) :1-8
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 490 kb]
(586 دریافت)
| چکیده (HTML) (1653 مشاهده)
مقدمه
ویروس هپاتیت B ((HBV میتواند سبب بیماری هپاتیت B به صورت حاد یا مزمن شود و از عفونت بدون علامت یا بیماری خفیف تا هپاتیت شدید و به ندرت برق آسا متغیر میباشد. هپاتیت B یکی از شایعترین عفونتهای ویروسی در انسان است و به عنوان یک چالش عمده سلامت عمومی در جهان مطرح است. علیرغم واکسن مؤثر، حدود یک سوم جمعیت جهان با ویروس هپاتیت B آلوده شدهاند و 257 میلیون عفونت مزمن در سراسر جهان و بیش از 880000 مرگ در سال، عمدتاً ناشی از سیروز و کارسینوم کبدی گزارش شده است (1). ویروس HBV ، از خانواده Hepadnaviridae است. ژنوم آن DNA حلقوی دو رشتهای شامل چهار، چارچوب خواندن باز است که باهم تا حدی یا کاملاً همپوشانی دارند (2). بر اساس حدود 4 تا 8 درصد تفاوت در توالی ژنومی، HBV از نظر فیلوژنتیکی به 10 ژنوتیپ (A-J) طبقهبندی شده است (2). ژنوتیپها و زیر ژنوتیپهای HBV دارای توزیع جغرافیایی متمایز هستند. چرخه تکثیر منحصر به فرد HBV شامل فعالیت آنزیم ترانس کریپتاز معکوس (RT) مستعد خطا است که گونههای ویروسی متعددی (شبه گونهها) تولید میکند. تکامل پیوسته HBV منجر به انتخاب مداوم جهشها از طریق فشار اعمال شده توسط سیستم ایمنی میزبان، درمانهای ضد ویروسی و واکسیناسیون میشود که به واکنش بین ویروس و میزبان مرتبط است و در نتیجه باعث ظهور جهشهای مؤثر در تظاهرات بالینی میشود (3).
وقوع جهش در HBV منعکسکننده تلاش ویروس برای فرار از مکانیسمهایی هست که تکثیر آن را به خطر میاندازد. متداولترین جهش مشاهده شده در preC/C ، جابهجایی G به A در نوکلئوتید 1896 است. این جایگزینی باعث کدون توقف ترجمه (TAG) در ژن preC/C میشود و از بیان پروتئین فیوژن preC/C که به عنوان پیشساز HBeAg عمل میکند، جلوگیری میکند. به همین ترتیب، جهش در پروموتر هسته پایه (BCP) منجر به کاهش بیان HBeAg اما افزایش تکثیر ویروسی میشود. BCP نقش اصلی را در تکثیر و مورفوژنز HBV ایفا میکند و رونویسی RNA پیش ژنومی و mRNA preC را هدایت میکند. تنوع توالی در BCP به دلیل نقش محوری آن در تکثیر ویروسی محدود است. جهش مضاعف، جایگزینی A به T در نوکلئوتید 1762 و جایگزینی G به A در نوکلئوتید 1764، در ناحیه BCP ، اغلب در بیماران مبتلا به هپاتیت مزمن، کارسینوم کبدی و برق آسا مشاهده شده است(5-3).
هدف از این مطالعه تعیین موتاسیونهای موجود در نواحی BCP و preC ژنوم ویروس هپاتیت B درناقلین فاقد علایم و نقش آن در پایداری عفونت هپاتیت B میباشد.
مواد و روشها
جمعآوری نمونه:
در این مطالعه توصیفی که با روش نمونهگیری غیر احتمالی آسان در سال 1397 انجام شد، با استفاده از نرمافزار STATA تعداد 40 نمونه از اهداکنندگان خون فاقد علایم که از نظر HBsAg و آزمایشهای تأییدی مثبت بودند و از نظر آزمایشهای anti- HCVو anti-HIVمنفی بودند، از پایگاه تهران وارد مطالعه شدند. از هر شرکتکننده 5 میلیلیتر خون جمعآوری شد و سرم آنها پس از سانتریفیوژ در g 3000 به مدت 15 دقیقه جداسازی شد و در دو لوله جداگانه برای آزمایشهای سرولوژیک و مولکولی تا زمان استفاده در فریزر 80- درجه سانتیگراد نگهداری شد. این پژوهش همچنین در کمیته اخلاق مؤسسـه عالـی طـب انتقـال خـون مـورد تأیید قرار گرفت.
آزمایشهای سرولوژیک:
بر روی تمامی نمونهها، آزمایشهای (Total)anti- HBc ، HBe Ag و anti-HBe با استفاده از کیتهای الایزای شرکت Dia pro (ایتالیا) بر اساس دستور عمل کیت انجام شد (6).
انجام آزمایشهای عملکرد کبد:
بر روی تمامی نمونهها آزمایشهای آلانین آمینوترانسفراز (ALT) و آسپارتات آمینوترانسفراز (AST) با استفاده از کیتهای شرکت پارس آزمون (ایران) بر اساس دستور عمل کیت انجام شد.
آزمایش HBV DNA Nested-PCR :
استخراج HBV DNA با استفاده از کیت SinaPure Viral (شرکت سینا کلون، ایران) بر اساس دستور عمل کیت انجام شد. جهت بررسی غلظت و خلوص DNA از دستگاه اسپکتروفتومتر نانودراپ (آمریکا) استفاده شد و جذب نوری نمونههای DNA در طول موجهای 260 و 280 نانومتر اندازهگیری شد. واکنش Nested-PCR با استفاده از 5/12 میکرولیتر مسترمیکس (X2) شرکت آمپلیکون (دانمارک) و یک میکرولیتر از هر جفت آغازگرهای جلوبرنده و معکوس (10 میکرو مولار)، 3 میکرولیتر از DNA استخراج شـده بـه همـراه نمونــه کنترل منفی، مثبت و NTC در میکروتیوبهای جداگانه و 5/7 میکرولیتر آب مقطر استریل به حجم نهایی 25 میکرولیتر انجام شد.
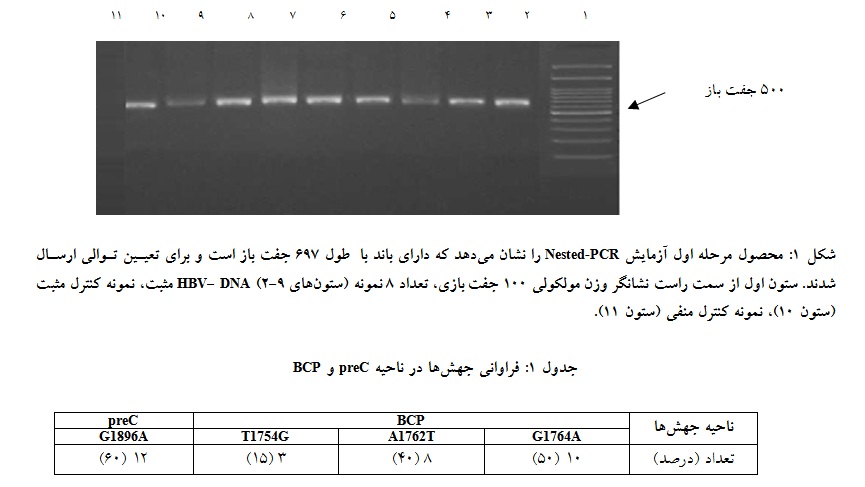
توالی آغازگرها در دور اول شامل 5′GCA CGT TGC ATG GAG ACC A-3′ و 5′TAAG CTG GAG GAG TGC GAA-3′ به طول 19 جفت باز و طول محصول 697 جفت باز و در دور دوم با آغازگرهای جلوبرنده 5′ATGGAGACCACCGTGAAC و ریورس 5′ATGCTCAGGAGACTCTAAGG-3′ و طول محصول 434 جفت باز با استفاده از چرخه دمایی واسرشت شدن اولیه 5 دقیقه در دمای 94 درجه سانتیگراد و 35 چرخه شامل واسرشت شدن 35 ثانیه در 94 درجه سانتیگراد، دمای اتصال 57 درجه سانتیگراد به مدت 30 ثانیه و طویل شدن در دمای 72 درجه سانتیگراد به مدت یک دقیقه و در نهایت طویل شدن نهایی در دمای 72 درجه سانتیگراد به مدت 10 دقیقه در دستگاه ترموسایکلر (PeQ Lab ، آلمان) به دست آمد. تشخیص محصول PCR با استفاده از ژل آگارز 2/1 درصد در بافر TBE 0.5X و DNA Green Viewer همراه با مارکر وزن مولکولی الکترفورز شد و در دستگاه ژل داکیومنتیشن (ATP ، ایران) تصویر برداری انجام شد.
تعیین توالی:
تعـداد 20 نمونـه مثبـت بـرای بـررسی موتاسیونها در
نواحی BCP و preC با آغازگرها در دور اول و روش PCR تکثیر شدند و به شرکت زیست فناوری پیشگام ارسال شد. تعیین توالی به روش Sanger انجام شد.
تجزیه و تحلیل دادهها:
تجزیه و تحلیل دادهها با استفاده از نرمافزار SPSS نسخه 22 انجام شد. از نرمافزارهای کروماس، BLAST و BioEdit برای بررسی و مرتب کردن و ویرایش نوکلئوتیدها استفاده شد. همچنین برای تعیین ژنوتیپ ویروس و موتاسیونها از نرمافزار آنلاین https://hbv.geno2pheno.org استفاده شد.
یافتهها
از تعداد 40 نمونه مورد بررسی، (8/94%) 38 نفر مرد و تعداد (2/5%) 2 نفر زن بودند. حداقل سن آنها 20 و حداکثر سن آنها 56 سال با میانگین سنی 6/8 ± 6/38 سال بود. میانگین و انحراف معیار حاصل از اندازهگیری ALT, AST در نمونههای سرمی برحسب واحد IU/L به ترتیب 5/8 ± 5/29 و 2/7 ± 28 بود که در محدوه طبیعی قرار داشت. تمامی نمونهها از نظر، HBe Ag منفی و از نظر (Total) anti- HBc و anti- HBe مثبت بودند. همه 40 نمونه با آغازگرهای اختصاصی ناحیه کور ویروس تکثیر شدند و نتایج آنها از نظر DNA - HBVمثبت بود. تعداد 20 نمونه که مرحله اول آزمایش Nested-PCR آنها دارای باند مناسب با طول 697 جفت باز داشتند برای تعیین توالی ارسال شدند (شکل 1).
برای تعیین ژنوتیپ ویروس و موتاسیونها از نرمافزار آنلاین https://hbv.geno2pheno.org استفاده شد و ژنوتیپ ایزولههای ویروس HBV در همه نمونهها، تعیین شد.
جهشها در) G1764A و BCP (A1762T که باعث کاهش سطح بیان HBeAg میشوند، به ترتیب در (50%) 10 و (40%) 8 مورد مشاهده شد. همچنین جهش T1754G در (15%) 3 نمونه از 20 نمونه HBV مثبت و HBeAg منفی، مشاهده شد. جهش در ناحیه preC و جایگاه نوکلئوتید G189b نیز در (60٪) 12 مورد یـافت شد (جدول 1).
در بیماران مبتلا به عفونت مزمن هپاتیت B ، میزان تولید HBV جدید ممکن است روزانه به 1011 ویریون برسد و فراوانی جهش حدود 5-10× (2/3-4/1) تعویض در توالی نوکلئوتیدی در سال تخمین زده میشود که تقریباً 10 برابر بیشتر از سایر ویروسهای DNA است. بنابراین، HBV به عنوان یک جمعیت شبه گونهای وجود دارد که در نهایت یک گونه غالب توسط عوامل درونزا (سیستم ایمنی میزبان) و عوامل برونزا (درمان ضد ویروسی و واکسیناسیون) انتخاب میشود(8 ، 7). تغییرات ژنتیکی در ژنوم ویروس هپاتیت B هم به دلیل فشار سیستم ایمنی میزبان و هم تکثیر مستعد خطای ویروس HBV ایجاد میشود (9، 4). معمولاً در مرحله فعال ایمنی هپاتیت مزمن، واریانتهای جدید ویروسی در اثر فشار سیستم ایمنی و مکانیسم گریز ویروس از سیستم دفاعی بدن به وجود میآید(10، 9). کاهش تولید یا از دست دادن انتخابی HBeAg به خاطر افزایش موتاسیونها در نواحی BCP و preC ، یکی از مهمترین روشهای ویروس برای گریز از سیستم دفاعی بدن برای جلوگیری از حذف ویروس از بدن میزبان و ایجاد عفونت پایدار میباشـد. معمـولاً حذف
HBeAg که یکی از هدفهای کلیدی پاسخ سیستم ایمنی بدن جهت حذف ویروس میباشد، در مرحله کنترل ایمنی عفونت روی میدهد و بدین ترتیب ویروس از سیستم ایمنی بدن میزبان پنهان میشود (12، 11). در مرحله کنترل ایمنی هپاتیت مزمن، در سرم افراد HBeAg قابل شناسایی نمیباشد ولی anti-HBe قابل تشخیص است و با پیشرفت سریعتر بیماری کبدی مشخص میشود. بنابراین هپاتیت HBeAg منفی به یک پدیده شناخته شده در سراسر جهان تبدیل شده است که از انتخاب واریانتهایی با جهشهای ایجاد شده در BCP و Pre-C ژنوم HBV ناشی میشود. متداولترین شکل واریانت عفونت مزمن هپاتیت B ، واریانت HBeAg منفی است که به دلیل تکثیر واریانتهای طبیعی HBV و تعویض برخی نوکلئوتیدها در نواحی BCP و preC ژنوم حاصل میشود و به جمعیت ویروسی غالب در ناقلهای مزمن HBsAg تبدیل میشوند، که نشاندهنـده بـرتری انتخاب در برابر نوع وحشی است (13).
حضور جهشها درHBV نشاندهنده پتانسیل گسترش و توسعه واریانتهای جدید با پیامدهای بالینی در سراسر جهان است. بنابراین، شیوع چنین جهشهایی در میان ژنوتیپهای مختلف HBV لازم است مورد تجزیه و تحلیل قرار گیرد. در مطالعه حاضر، موتاسیون در ناحیه preC/C و پروموتر هسته HBV (BCP) با هدف به دست آوردن بینش کلی در مورد جهشهای مرتبط با ناحیه preC/C و BCP ویروس هپاتیت B و فرار آن از سیستم ایمنی میزبان و ایجاد عفونت پایدار در افراد ناقل هپاتیت B فاقد علایم انجام شد. موتاسیون در ناحیه Pre-C یکی از فراوانترین موتاسیونها است که سبب جلوگیری از فرآیند ترجمه میشود. بیشتر این موتاسیونها باعث تغییر چارچوب یا ایجاد کدون توقف زودرس میشوند که مهمترین آن در جایگاه 1896 است که سبب جابهجایی نوکلئوتید G به A و تغییر کدون 28 از تریپتوفان به کدون خاتمه UAG میشود. در این مطالعه 12 نفر (60%) دارای موتاسیون A 1896 G در ناحیه Pre-Cبودند که نشاندهنده انتخاب واریانتهای HBeAg منفی و افزایش آن نسبت به ویروسهای تیپ وحشی میباشد. این واریانتهای HBeAg منفی ممکن است برخی ویژگیهایی بیولوژیک را داشته باشند که آسیبپذیری آنها در برابر واکنشهای سیستم ایمنی نسبت به تیپ وحشی را کاهش میدهد. در موافقت با این مطالعه در یک تحقیق در سال 2012 در ایران ، بر روی 50 نمونه از افراد مبتلا به HBV که82% از آنهاanti-HBe مثبت بودند، با روش INNO-LiPA موتاسیون در نواحی Pre-C ، 46% بود و ژنوتیپ تمامی واریانتهای ویروسی D گزارش شده است (14). در مطالعه دیگری در برزیل بر روی تعداد 161 فرد مبتلا به هپاتیت B ، موتاسیون Pre-C در آنها 61% گزارش شد (15). در مطالعهای در تونس در سال 2012، با روش توالییابی ناحیه Pre-C در بر روی 120 بیمار مبتلا به هپاتیت B مزمن، موتاسیون Pre-C در جایگاه 1896 از نوکلئوتید G به A حدود 8/74 % بود (16). در مطالعهای بر روی جهشهای Pre-C و ژنوتیپ D ویروس هپاتیت B نشان داده شد که بیش از نیمی از افراد آلوده به HBV دارای کدون توقف در ناحیه Pre-C هستند و این نشان میدهد میزان بروز موتاسیون در ناحیه Pre-C مشابه با مطالعههای انجام شده است (17).
موتاسیون در ناحیه BCP باعث جابه جایی نوکلئوتید A
به T در جایگاه 1762 و G به A در جایگاه 1764 و باعـث
کاهش HBeAg میشود که در این مطالعه در 40 الی 50 درصد افراد HBeAg منفی به ترتیب مشاهده شد. در مطالعه انجام شده در2012 ، بر روی 50 نمونه افراد مبتلا به HBV با روش INNO-LiPA موتاسیون در نواحی BCP در30 درصد موارد گزارش شد که با افزایش بار ویروس ارتباط مستقیمی داشت (14). در مطالعهای دیگر در تونس بر روی 120 بیمار مبتلا به هپاتیت B مزمن، موتاسیون BCP در جایگاه 1764 از نوکلئوتید G به A حدود 5/71 % بود (14). همچنین در مطالعه انجام شده در برزیل شیوع این موتاسیون 80 درصد گزارش شد که شیوع آن خیلی بیشتر از جامعه مورد مطالعه ما بود (15). موتاسیون در ناحیه BCP باعث کاهش سطح رونویسی mRNA Pre-C و در نتیجه کاهش سنتز HBeAg و افزایش کپسیداسیون، RNA پیش ژنومی (pgRNA) و تکثیر ویروس میشود بنابراین با افزایش تکثیر و بار ویروس ارتباط مستقیمی دارد.
عوامل مؤثر در شیوع جهش preC ، به ژنوتیپ ویروسی و مناطق جغرافیایی مرتبط است و بیشتر این موتاسیونها در مناطق آسیایی و ناحیه مدیترانهای با توجه به منشاء قومی ناقلان HBV ، مشاهده شده است (18). در این مطالعه تنها ژنوتیپ D ویروس مورد شناسایی قرار گرفت که با مطالعههای قبلی انجام شده در ایران موافقت دارد (14). بالاترین میزان جهش در ناحیه Pre-C و BCP مربوط به ژنوتیپ D ویروس HBV میباشد. مطالعهها نشان داده است که این موتاسیونها در ژنوتیپهای مختلف متفاوت است. جهش A1896 preC بیشتر در بیماران آلوده به ژنوتیپهای B ، D ،E ، ویروسHBV و به مقدار کمتر در ژنوتیپهای C و F یافت میشود (19). در مرحله کنترل ایمنی پس از تغییرات سرمی از حالت HBeAg مثبت به anti-HBe ، HBV DNA ، غیر قابل تشخیص یا بسیار کم مشخص میشود. سطوح طبیعی ALTو حداقل فعالیت نکروز و التهاب کبدی وجود دارد که با این مطالعه موافقت دارد و همه نمونهها دارای سطوح طبیعی ALTوAST بودند.
پدیده تداوم عفونت، پاکسازی و عـود عفونـت HBV ،
هنوز مشخص نشده است. برخی از بیماران به طور خود به
خود عفونت را کنترل میکنند، در حالی که در برخی دیگر عفونت مزمن ایجاد میشود. تصور میشود که لنفوسیتهای T CD4 اختصاصی ویروس برای کنترل عفونت ضروری هستند، زیرا هم برای سلول B و تولید آنتیبادی کارآمد و هم برای پاسخ سلولی T CD8 مورد نیاز هستند. اپیتوپهایی که عمدتاً توسط سلولهای T CD4 هدف قرار میگیرند متعلق به کورHBV است. در بیماران مبتلا به عفونت حاد یا عفونت مزمن کنترل شده HBV ، پاسخ سلولهای T CD4 به طور گستردهتر و شدیدتر در مقایسه با بیماران عفونت مزمن فعال، ایجاد شده است (21، 20).
همچنین، لنفوسیتهای T CD8 نقش مهمی در ایجاد عفونت مزمن با عملکردهای مؤثر سیتولیتیک یا غیر سیتولیتیک خود دارند. سلولهای T CD8 ، تمام پروتئینهای شناسایی شده HBV را هدف قرار میدهند. اما، در مراحل عفونت مزمن، سلولهای T CD8 از نظر عملکردی خسته و فرسوده میشوند، که تصور میشود، در اثر مواجهه مداوم با آنتیژن میباشد و نتیجه آن سبب فرار ویروس با تولید انواع واریانتها از سیستم ایمنی میباشد. بنابراین، فقدان بلوغ سلول خاطرهای T حفافظتکننده و فرسودگی سلولهای T اختصاصیHBV باعث تداوم حضور ویروس و عفونت مزمن همراه است (22). با سرکوب طولانی مدت تکثیرHBV و کاهش آنتیژن در بیماران تحت درمان با آنالوگهای نوکلئوزیدی، بازیابی نسبی عملکرد سلول T به وجود میآید که نشاندهنده اهمیت سلول T در مهار عفونت مزمن است. از آن جایی که HBeAg یک هدف مهم برای سیستم ایمنی هومورال و سلولی است، عدم تولید HBeAg که به دلیل جهش ویروس برای فرار از سیستم ایمنی میزبان میباشد، به ماندگاری ویروس و ادامه عفونت مزمن کمک میکند(23).
نتیجهگیری
در این مطالعه بیشترین فراوانی جهشها در نواحی (G1764A و BCP (A1762و G1896A Pre-core ویروس
هپاتیت B مشاهده شد که با توجه به هدف اصلی پاسخ سیستم ایمنی (HBe Ag)، ژنوتیپ D ویروس هپاتیت B ، منطقه جغرافیایی منشا ویروسی و میزان جهشهایی که به طور طبیعی در ویروس هپاتیت B ایجاد میشود، قابل تفسیر میباشد و میتواند به عنوان یکی از عوامل مؤثر در عدم پاکسازی و حذف ویروس توسط سیستم ایمنی در میزبان و ایجاد عفونت مزمن هپاتیت B مطرح باشد.
حمایت مالی
این پروژه توسط مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب ا نتقال خون تأمین مالی شده است.
ملاحظات اخلاقی
این مطالعه به تایید کمیته اخلاق مؤسسه عالی آموزشی و پژوهشی طب انتقال خون رسیده است (کد اخلاق: (IR.TMI.REC.1397.040).
عدم تعارض منافع
هیچگونه تعارض منافعی در مطالعه حاضر وجود نداشته است.
نقش نویسندگان
دکتر زهره شریفی: طراحی مطالعه، نگارش و ویرایش مقاله، بررسی و تفسیر دادهها، نظارت بر انجام آزمایشها
عباس یادگاری: نوشتن پایاننامه و انجام آزمایشها، روششناسی، تحلیل و بررسی دادهها
زهرا پاز: فراهم آوردن مواد مورد نیاز، آموزش روشها و تجهیزات، بررسی و نظارت بر انجام آزمایشها
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد زیست فناوری مؤسسه عالی آموزشی و پژوهشی انتقال خون ایران است. بدینوسیله از این مؤسسه به خاطر حمایتهای مالی آن تشکر میشود.
متن کامل: (684 مشاهده)
جهشهای طبیعی در نواحی BCP و preC ویروس هپاتیت B در اهداکنندگان
خون با هپاتیت B مزمن anti-HBe+
زهره شریفی1، عباس یادگاری1، زهرا پاز1
چکیده
سابقه و هدف
جهشهای مختلف در ژنوم HBV در طول عفونت مزمن ایجاد میشوند که به تکثیر ویروس مستعد خطا و فشار سیستم ایمنی میزبان نسبت داده شده است. هدف از این مطالعه، تعیین جهشها در نواحی BCP و preC ژنوم ویروس هپاتیت B درناقلین فاقد علایم و نقش آن در پایداری عفونت هپاتیت B بود.
مواد و روشها
در این مطالعه توصیفی، با نمونهگیری غیر احتمالی آسان در سال 1397 ، تعداد 40 اهداکننده فاقد علایم و مثبت از نظر HBsAg و آزمایشهای تأییدی و منفی از نظر anti- HCV وanti-HIV ، از پایگاه انتقال خون تهران وارد مطالعه شدند. بر روی تمامی نمونهها، آزمایشهای (Total) anti- HBc ، HBe Ag و anti- HBe و ALT وAST انجام شد. واکنش Nested-PCR بر روی DNA استخراج شده انجام و در نهایت تعیین توالی شدند. تحلیل دادهها با نرمافزار https://hbv.geno2pheno.org بود.
یافتهها
از 40 نمونه، (8/94%) 38 نفر مرد و (2/5 %) 2 نفر زن با میانگین سنی 6/8 ± 6/38 سال بودند. جهشها در (G1764A و BCP (A1762T ، به ترتیب در (50%) 10 و (40%) 8 مورد همچنین جهش T1754G در (15%) 3 نمونه از 20 نمونه HBV مثبت و HBeAg منفی مشاهده شد. جهش در ناحیه preC و جایگاه نوکلئوتید G1896A در (60٪) 12 مورد یافت شد.
نتیجه گیری
بیشترین جهشها در نواحی(G1764A و BCP (A1762T و (G1896A) Pre-core ویروس هپاتیت B مشاهده شد که میتواند به عنوان یکی از عوامل مؤثر در عدم پاکسازی و حذف ویروس توسط سیستم ایمنی در میزبان و ایجاد عفونت مزمن هپاتیت B مطرح باشد.
کلمات کلیدی: جهش، ویروس هپاتیت B ، اهداکنندگان خون
تاریخ دریافت: 20/08/1402
تاریخ پذیرش: 07/09/1402
1- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
2- کارشناس ارشد زیست فناوری پزشکی ـ مرکز تحقیقات انتقال خونـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خونـ تهرانـ ایران
3- کارشناس میکروبشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
خون با هپاتیت B مزمن anti-HBe+
زهره شریفی1، عباس یادگاری1، زهرا پاز1
چکیده
سابقه و هدف
جهشهای مختلف در ژنوم HBV در طول عفونت مزمن ایجاد میشوند که به تکثیر ویروس مستعد خطا و فشار سیستم ایمنی میزبان نسبت داده شده است. هدف از این مطالعه، تعیین جهشها در نواحی BCP و preC ژنوم ویروس هپاتیت B درناقلین فاقد علایم و نقش آن در پایداری عفونت هپاتیت B بود.
مواد و روشها
در این مطالعه توصیفی، با نمونهگیری غیر احتمالی آسان در سال 1397 ، تعداد 40 اهداکننده فاقد علایم و مثبت از نظر HBsAg و آزمایشهای تأییدی و منفی از نظر anti- HCV وanti-HIV ، از پایگاه انتقال خون تهران وارد مطالعه شدند. بر روی تمامی نمونهها، آزمایشهای (Total) anti- HBc ، HBe Ag و anti- HBe و ALT وAST انجام شد. واکنش Nested-PCR بر روی DNA استخراج شده انجام و در نهایت تعیین توالی شدند. تحلیل دادهها با نرمافزار https://hbv.geno2pheno.org بود.
یافتهها
از 40 نمونه، (8/94%) 38 نفر مرد و (2/5 %) 2 نفر زن با میانگین سنی 6/8 ± 6/38 سال بودند. جهشها در (G1764A و BCP (A1762T ، به ترتیب در (50%) 10 و (40%) 8 مورد همچنین جهش T1754G در (15%) 3 نمونه از 20 نمونه HBV مثبت و HBeAg منفی مشاهده شد. جهش در ناحیه preC و جایگاه نوکلئوتید G1896A در (60٪) 12 مورد یافت شد.
نتیجه گیری
بیشترین جهشها در نواحی(G1764A و BCP (A1762T و (G1896A) Pre-core ویروس هپاتیت B مشاهده شد که میتواند به عنوان یکی از عوامل مؤثر در عدم پاکسازی و حذف ویروس توسط سیستم ایمنی در میزبان و ایجاد عفونت مزمن هپاتیت B مطرح باشد.
کلمات کلیدی: جهش، ویروس هپاتیت B ، اهداکنندگان خون
تاریخ دریافت: 20/08/1402
تاریخ پذیرش: 07/09/1402
1- مؤلف مسئول: PhD ویروسشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
2- کارشناس ارشد زیست فناوری پزشکی ـ مرکز تحقیقات انتقال خونـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خونـ تهرانـ ایران
3- کارشناس میکروبشناسی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
ویروس هپاتیت B ((HBV میتواند سبب بیماری هپاتیت B به صورت حاد یا مزمن شود و از عفونت بدون علامت یا بیماری خفیف تا هپاتیت شدید و به ندرت برق آسا متغیر میباشد. هپاتیت B یکی از شایعترین عفونتهای ویروسی در انسان است و به عنوان یک چالش عمده سلامت عمومی در جهان مطرح است. علیرغم واکسن مؤثر، حدود یک سوم جمعیت جهان با ویروس هپاتیت B آلوده شدهاند و 257 میلیون عفونت مزمن در سراسر جهان و بیش از 880000 مرگ در سال، عمدتاً ناشی از سیروز و کارسینوم کبدی گزارش شده است (1). ویروس HBV ، از خانواده Hepadnaviridae است. ژنوم آن DNA حلقوی دو رشتهای شامل چهار، چارچوب خواندن باز است که باهم تا حدی یا کاملاً همپوشانی دارند (2). بر اساس حدود 4 تا 8 درصد تفاوت در توالی ژنومی، HBV از نظر فیلوژنتیکی به 10 ژنوتیپ (A-J) طبقهبندی شده است (2). ژنوتیپها و زیر ژنوتیپهای HBV دارای توزیع جغرافیایی متمایز هستند. چرخه تکثیر منحصر به فرد HBV شامل فعالیت آنزیم ترانس کریپتاز معکوس (RT) مستعد خطا است که گونههای ویروسی متعددی (شبه گونهها) تولید میکند. تکامل پیوسته HBV منجر به انتخاب مداوم جهشها از طریق فشار اعمال شده توسط سیستم ایمنی میزبان، درمانهای ضد ویروسی و واکسیناسیون میشود که به واکنش بین ویروس و میزبان مرتبط است و در نتیجه باعث ظهور جهشهای مؤثر در تظاهرات بالینی میشود (3).
وقوع جهش در HBV منعکسکننده تلاش ویروس برای فرار از مکانیسمهایی هست که تکثیر آن را به خطر میاندازد. متداولترین جهش مشاهده شده در preC/C ، جابهجایی G به A در نوکلئوتید 1896 است. این جایگزینی باعث کدون توقف ترجمه (TAG) در ژن preC/C میشود و از بیان پروتئین فیوژن preC/C که به عنوان پیشساز HBeAg عمل میکند، جلوگیری میکند. به همین ترتیب، جهش در پروموتر هسته پایه (BCP) منجر به کاهش بیان HBeAg اما افزایش تکثیر ویروسی میشود. BCP نقش اصلی را در تکثیر و مورفوژنز HBV ایفا میکند و رونویسی RNA پیش ژنومی و mRNA preC را هدایت میکند. تنوع توالی در BCP به دلیل نقش محوری آن در تکثیر ویروسی محدود است. جهش مضاعف، جایگزینی A به T در نوکلئوتید 1762 و جایگزینی G به A در نوکلئوتید 1764، در ناحیه BCP ، اغلب در بیماران مبتلا به هپاتیت مزمن، کارسینوم کبدی و برق آسا مشاهده شده است(5-3).
هدف از این مطالعه تعیین موتاسیونهای موجود در نواحی BCP و preC ژنوم ویروس هپاتیت B درناقلین فاقد علایم و نقش آن در پایداری عفونت هپاتیت B میباشد.
مواد و روشها
جمعآوری نمونه:
در این مطالعه توصیفی که با روش نمونهگیری غیر احتمالی آسان در سال 1397 انجام شد، با استفاده از نرمافزار STATA تعداد 40 نمونه از اهداکنندگان خون فاقد علایم که از نظر HBsAg و آزمایشهای تأییدی مثبت بودند و از نظر آزمایشهای anti- HCVو anti-HIVمنفی بودند، از پایگاه تهران وارد مطالعه شدند. از هر شرکتکننده 5 میلیلیتر خون جمعآوری شد و سرم آنها پس از سانتریفیوژ در g 3000 به مدت 15 دقیقه جداسازی شد و در دو لوله جداگانه برای آزمایشهای سرولوژیک و مولکولی تا زمان استفاده در فریزر 80- درجه سانتیگراد نگهداری شد. این پژوهش همچنین در کمیته اخلاق مؤسسـه عالـی طـب انتقـال خـون مـورد تأیید قرار گرفت.
آزمایشهای سرولوژیک:
بر روی تمامی نمونهها، آزمایشهای (Total)anti- HBc ، HBe Ag و anti-HBe با استفاده از کیتهای الایزای شرکت Dia pro (ایتالیا) بر اساس دستور عمل کیت انجام شد (6).
انجام آزمایشهای عملکرد کبد:
بر روی تمامی نمونهها آزمایشهای آلانین آمینوترانسفراز (ALT) و آسپارتات آمینوترانسفراز (AST) با استفاده از کیتهای شرکت پارس آزمون (ایران) بر اساس دستور عمل کیت انجام شد.
آزمایش HBV DNA Nested-PCR :
استخراج HBV DNA با استفاده از کیت SinaPure Viral (شرکت سینا کلون، ایران) بر اساس دستور عمل کیت انجام شد. جهت بررسی غلظت و خلوص DNA از دستگاه اسپکتروفتومتر نانودراپ (آمریکا) استفاده شد و جذب نوری نمونههای DNA در طول موجهای 260 و 280 نانومتر اندازهگیری شد. واکنش Nested-PCR با استفاده از 5/12 میکرولیتر مسترمیکس (X2) شرکت آمپلیکون (دانمارک) و یک میکرولیتر از هر جفت آغازگرهای جلوبرنده و معکوس (10 میکرو مولار)، 3 میکرولیتر از DNA استخراج شـده بـه همـراه نمونــه کنترل منفی، مثبت و NTC در میکروتیوبهای جداگانه و 5/7 میکرولیتر آب مقطر استریل به حجم نهایی 25 میکرولیتر انجام شد.
توالی آغازگرها در دور اول شامل 5′GCA CGT TGC ATG GAG ACC A-3′ و 5′TAAG CTG GAG GAG TGC GAA-3′ به طول 19 جفت باز و طول محصول 697 جفت باز و در دور دوم با آغازگرهای جلوبرنده 5′ATGGAGACCACCGTGAAC و ریورس 5′ATGCTCAGGAGACTCTAAGG-3′ و طول محصول 434 جفت باز با استفاده از چرخه دمایی واسرشت شدن اولیه 5 دقیقه در دمای 94 درجه سانتیگراد و 35 چرخه شامل واسرشت شدن 35 ثانیه در 94 درجه سانتیگراد، دمای اتصال 57 درجه سانتیگراد به مدت 30 ثانیه و طویل شدن در دمای 72 درجه سانتیگراد به مدت یک دقیقه و در نهایت طویل شدن نهایی در دمای 72 درجه سانتیگراد به مدت 10 دقیقه در دستگاه ترموسایکلر (PeQ Lab ، آلمان) به دست آمد. تشخیص محصول PCR با استفاده از ژل آگارز 2/1 درصد در بافر TBE 0.5X و DNA Green Viewer همراه با مارکر وزن مولکولی الکترفورز شد و در دستگاه ژل داکیومنتیشن (ATP ، ایران) تصویر برداری انجام شد.
تعیین توالی:
تعـداد 20 نمونـه مثبـت بـرای بـررسی موتاسیونها در
نواحی BCP و preC با آغازگرها در دور اول و روش PCR تکثیر شدند و به شرکت زیست فناوری پیشگام ارسال شد. تعیین توالی به روش Sanger انجام شد.
تجزیه و تحلیل دادهها:
تجزیه و تحلیل دادهها با استفاده از نرمافزار SPSS نسخه 22 انجام شد. از نرمافزارهای کروماس، BLAST و BioEdit برای بررسی و مرتب کردن و ویرایش نوکلئوتیدها استفاده شد. همچنین برای تعیین ژنوتیپ ویروس و موتاسیونها از نرمافزار آنلاین https://hbv.geno2pheno.org استفاده شد.
یافتهها
از تعداد 40 نمونه مورد بررسی، (8/94%) 38 نفر مرد و تعداد (2/5%) 2 نفر زن بودند. حداقل سن آنها 20 و حداکثر سن آنها 56 سال با میانگین سنی 6/8 ± 6/38 سال بود. میانگین و انحراف معیار حاصل از اندازهگیری ALT, AST در نمونههای سرمی برحسب واحد IU/L به ترتیب 5/8 ± 5/29 و 2/7 ± 28 بود که در محدوه طبیعی قرار داشت. تمامی نمونهها از نظر، HBe Ag منفی و از نظر (Total) anti- HBc و anti- HBe مثبت بودند. همه 40 نمونه با آغازگرهای اختصاصی ناحیه کور ویروس تکثیر شدند و نتایج آنها از نظر DNA - HBVمثبت بود. تعداد 20 نمونه که مرحله اول آزمایش Nested-PCR آنها دارای باند مناسب با طول 697 جفت باز داشتند برای تعیین توالی ارسال شدند (شکل 1).
برای تعیین ژنوتیپ ویروس و موتاسیونها از نرمافزار آنلاین https://hbv.geno2pheno.org استفاده شد و ژنوتیپ ایزولههای ویروس HBV در همه نمونهها، تعیین شد.
جهشها در) G1764A و BCP (A1762T که باعث کاهش سطح بیان HBeAg میشوند، به ترتیب در (50%) 10 و (40%) 8 مورد مشاهده شد. همچنین جهش T1754G در (15%) 3 نمونه از 20 نمونه HBV مثبت و HBeAg منفی، مشاهده شد. جهش در ناحیه preC و جایگاه نوکلئوتید G189b نیز در (60٪) 12 مورد یـافت شد (جدول 1).

بحث
در بیماران مبتلا به عفونت مزمن هپاتیت B ، میزان تولید HBV جدید ممکن است روزانه به 1011 ویریون برسد و فراوانی جهش حدود 5-10× (2/3-4/1) تعویض در توالی نوکلئوتیدی در سال تخمین زده میشود که تقریباً 10 برابر بیشتر از سایر ویروسهای DNA است. بنابراین، HBV به عنوان یک جمعیت شبه گونهای وجود دارد که در نهایت یک گونه غالب توسط عوامل درونزا (سیستم ایمنی میزبان) و عوامل برونزا (درمان ضد ویروسی و واکسیناسیون) انتخاب میشود(8 ، 7). تغییرات ژنتیکی در ژنوم ویروس هپاتیت B هم به دلیل فشار سیستم ایمنی میزبان و هم تکثیر مستعد خطای ویروس HBV ایجاد میشود (9، 4). معمولاً در مرحله فعال ایمنی هپاتیت مزمن، واریانتهای جدید ویروسی در اثر فشار سیستم ایمنی و مکانیسم گریز ویروس از سیستم دفاعی بدن به وجود میآید(10، 9). کاهش تولید یا از دست دادن انتخابی HBeAg به خاطر افزایش موتاسیونها در نواحی BCP و preC ، یکی از مهمترین روشهای ویروس برای گریز از سیستم دفاعی بدن برای جلوگیری از حذف ویروس از بدن میزبان و ایجاد عفونت پایدار میباشـد. معمـولاً حذف
HBeAg که یکی از هدفهای کلیدی پاسخ سیستم ایمنی بدن جهت حذف ویروس میباشد، در مرحله کنترل ایمنی عفونت روی میدهد و بدین ترتیب ویروس از سیستم ایمنی بدن میزبان پنهان میشود (12، 11). در مرحله کنترل ایمنی هپاتیت مزمن، در سرم افراد HBeAg قابل شناسایی نمیباشد ولی anti-HBe قابل تشخیص است و با پیشرفت سریعتر بیماری کبدی مشخص میشود. بنابراین هپاتیت HBeAg منفی به یک پدیده شناخته شده در سراسر جهان تبدیل شده است که از انتخاب واریانتهایی با جهشهای ایجاد شده در BCP و Pre-C ژنوم HBV ناشی میشود. متداولترین شکل واریانت عفونت مزمن هپاتیت B ، واریانت HBeAg منفی است که به دلیل تکثیر واریانتهای طبیعی HBV و تعویض برخی نوکلئوتیدها در نواحی BCP و preC ژنوم حاصل میشود و به جمعیت ویروسی غالب در ناقلهای مزمن HBsAg تبدیل میشوند، که نشاندهنـده بـرتری انتخاب در برابر نوع وحشی است (13).
حضور جهشها درHBV نشاندهنده پتانسیل گسترش و توسعه واریانتهای جدید با پیامدهای بالینی در سراسر جهان است. بنابراین، شیوع چنین جهشهایی در میان ژنوتیپهای مختلف HBV لازم است مورد تجزیه و تحلیل قرار گیرد. در مطالعه حاضر، موتاسیون در ناحیه preC/C و پروموتر هسته HBV (BCP) با هدف به دست آوردن بینش کلی در مورد جهشهای مرتبط با ناحیه preC/C و BCP ویروس هپاتیت B و فرار آن از سیستم ایمنی میزبان و ایجاد عفونت پایدار در افراد ناقل هپاتیت B فاقد علایم انجام شد. موتاسیون در ناحیه Pre-C یکی از فراوانترین موتاسیونها است که سبب جلوگیری از فرآیند ترجمه میشود. بیشتر این موتاسیونها باعث تغییر چارچوب یا ایجاد کدون توقف زودرس میشوند که مهمترین آن در جایگاه 1896 است که سبب جابهجایی نوکلئوتید G به A و تغییر کدون 28 از تریپتوفان به کدون خاتمه UAG میشود. در این مطالعه 12 نفر (60%) دارای موتاسیون A 1896 G در ناحیه Pre-Cبودند که نشاندهنده انتخاب واریانتهای HBeAg منفی و افزایش آن نسبت به ویروسهای تیپ وحشی میباشد. این واریانتهای HBeAg منفی ممکن است برخی ویژگیهایی بیولوژیک را داشته باشند که آسیبپذیری آنها در برابر واکنشهای سیستم ایمنی نسبت به تیپ وحشی را کاهش میدهد. در موافقت با این مطالعه در یک تحقیق در سال 2012 در ایران ، بر روی 50 نمونه از افراد مبتلا به HBV که82% از آنهاanti-HBe مثبت بودند، با روش INNO-LiPA موتاسیون در نواحی Pre-C ، 46% بود و ژنوتیپ تمامی واریانتهای ویروسی D گزارش شده است (14). در مطالعه دیگری در برزیل بر روی تعداد 161 فرد مبتلا به هپاتیت B ، موتاسیون Pre-C در آنها 61% گزارش شد (15). در مطالعهای در تونس در سال 2012، با روش توالییابی ناحیه Pre-C در بر روی 120 بیمار مبتلا به هپاتیت B مزمن، موتاسیون Pre-C در جایگاه 1896 از نوکلئوتید G به A حدود 8/74 % بود (16). در مطالعهای بر روی جهشهای Pre-C و ژنوتیپ D ویروس هپاتیت B نشان داده شد که بیش از نیمی از افراد آلوده به HBV دارای کدون توقف در ناحیه Pre-C هستند و این نشان میدهد میزان بروز موتاسیون در ناحیه Pre-C مشابه با مطالعههای انجام شده است (17).
موتاسیون در ناحیه BCP باعث جابه جایی نوکلئوتید A
به T در جایگاه 1762 و G به A در جایگاه 1764 و باعـث
کاهش HBeAg میشود که در این مطالعه در 40 الی 50 درصد افراد HBeAg منفی به ترتیب مشاهده شد. در مطالعه انجام شده در2012 ، بر روی 50 نمونه افراد مبتلا به HBV با روش INNO-LiPA موتاسیون در نواحی BCP در30 درصد موارد گزارش شد که با افزایش بار ویروس ارتباط مستقیمی داشت (14). در مطالعهای دیگر در تونس بر روی 120 بیمار مبتلا به هپاتیت B مزمن، موتاسیون BCP در جایگاه 1764 از نوکلئوتید G به A حدود 5/71 % بود (14). همچنین در مطالعه انجام شده در برزیل شیوع این موتاسیون 80 درصد گزارش شد که شیوع آن خیلی بیشتر از جامعه مورد مطالعه ما بود (15). موتاسیون در ناحیه BCP باعث کاهش سطح رونویسی mRNA Pre-C و در نتیجه کاهش سنتز HBeAg و افزایش کپسیداسیون، RNA پیش ژنومی (pgRNA) و تکثیر ویروس میشود بنابراین با افزایش تکثیر و بار ویروس ارتباط مستقیمی دارد.
عوامل مؤثر در شیوع جهش preC ، به ژنوتیپ ویروسی و مناطق جغرافیایی مرتبط است و بیشتر این موتاسیونها در مناطق آسیایی و ناحیه مدیترانهای با توجه به منشاء قومی ناقلان HBV ، مشاهده شده است (18). در این مطالعه تنها ژنوتیپ D ویروس مورد شناسایی قرار گرفت که با مطالعههای قبلی انجام شده در ایران موافقت دارد (14). بالاترین میزان جهش در ناحیه Pre-C و BCP مربوط به ژنوتیپ D ویروس HBV میباشد. مطالعهها نشان داده است که این موتاسیونها در ژنوتیپهای مختلف متفاوت است. جهش A1896 preC بیشتر در بیماران آلوده به ژنوتیپهای B ، D ،E ، ویروسHBV و به مقدار کمتر در ژنوتیپهای C و F یافت میشود (19). در مرحله کنترل ایمنی پس از تغییرات سرمی از حالت HBeAg مثبت به anti-HBe ، HBV DNA ، غیر قابل تشخیص یا بسیار کم مشخص میشود. سطوح طبیعی ALTو حداقل فعالیت نکروز و التهاب کبدی وجود دارد که با این مطالعه موافقت دارد و همه نمونهها دارای سطوح طبیعی ALTوAST بودند.
پدیده تداوم عفونت، پاکسازی و عـود عفونـت HBV ،
هنوز مشخص نشده است. برخی از بیماران به طور خود به
خود عفونت را کنترل میکنند، در حالی که در برخی دیگر عفونت مزمن ایجاد میشود. تصور میشود که لنفوسیتهای T CD4 اختصاصی ویروس برای کنترل عفونت ضروری هستند، زیرا هم برای سلول B و تولید آنتیبادی کارآمد و هم برای پاسخ سلولی T CD8 مورد نیاز هستند. اپیتوپهایی که عمدتاً توسط سلولهای T CD4 هدف قرار میگیرند متعلق به کورHBV است. در بیماران مبتلا به عفونت حاد یا عفونت مزمن کنترل شده HBV ، پاسخ سلولهای T CD4 به طور گستردهتر و شدیدتر در مقایسه با بیماران عفونت مزمن فعال، ایجاد شده است (21، 20).
همچنین، لنفوسیتهای T CD8 نقش مهمی در ایجاد عفونت مزمن با عملکردهای مؤثر سیتولیتیک یا غیر سیتولیتیک خود دارند. سلولهای T CD8 ، تمام پروتئینهای شناسایی شده HBV را هدف قرار میدهند. اما، در مراحل عفونت مزمن، سلولهای T CD8 از نظر عملکردی خسته و فرسوده میشوند، که تصور میشود، در اثر مواجهه مداوم با آنتیژن میباشد و نتیجه آن سبب فرار ویروس با تولید انواع واریانتها از سیستم ایمنی میباشد. بنابراین، فقدان بلوغ سلول خاطرهای T حفافظتکننده و فرسودگی سلولهای T اختصاصیHBV باعث تداوم حضور ویروس و عفونت مزمن همراه است (22). با سرکوب طولانی مدت تکثیرHBV و کاهش آنتیژن در بیماران تحت درمان با آنالوگهای نوکلئوزیدی، بازیابی نسبی عملکرد سلول T به وجود میآید که نشاندهنده اهمیت سلول T در مهار عفونت مزمن است. از آن جایی که HBeAg یک هدف مهم برای سیستم ایمنی هومورال و سلولی است، عدم تولید HBeAg که به دلیل جهش ویروس برای فرار از سیستم ایمنی میزبان میباشد، به ماندگاری ویروس و ادامه عفونت مزمن کمک میکند(23).
نتیجهگیری
در این مطالعه بیشترین فراوانی جهشها در نواحی (G1764A و BCP (A1762و G1896A Pre-core ویروس
هپاتیت B مشاهده شد که با توجه به هدف اصلی پاسخ سیستم ایمنی (HBe Ag)، ژنوتیپ D ویروس هپاتیت B ، منطقه جغرافیایی منشا ویروسی و میزان جهشهایی که به طور طبیعی در ویروس هپاتیت B ایجاد میشود، قابل تفسیر میباشد و میتواند به عنوان یکی از عوامل مؤثر در عدم پاکسازی و حذف ویروس توسط سیستم ایمنی در میزبان و ایجاد عفونت مزمن هپاتیت B مطرح باشد.
حمایت مالی
این پروژه توسط مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب ا نتقال خون تأمین مالی شده است.
ملاحظات اخلاقی
این مطالعه به تایید کمیته اخلاق مؤسسه عالی آموزشی و پژوهشی طب انتقال خون رسیده است (کد اخلاق: (IR.TMI.REC.1397.040).
عدم تعارض منافع
هیچگونه تعارض منافعی در مطالعه حاضر وجود نداشته است.
نقش نویسندگان
دکتر زهره شریفی: طراحی مطالعه، نگارش و ویرایش مقاله، بررسی و تفسیر دادهها، نظارت بر انجام آزمایشها
عباس یادگاری: نوشتن پایاننامه و انجام آزمایشها، روششناسی، تحلیل و بررسی دادهها
زهرا پاز: فراهم آوردن مواد مورد نیاز، آموزش روشها و تجهیزات، بررسی و نظارت بر انجام آزمایشها
تشکر و قدردانی
این تحقیق حاصل پایاننامه کارشناسی ارشد زیست فناوری مؤسسه عالی آموزشی و پژوهشی انتقال خون ایران است. بدینوسیله از این مؤسسه به خاطر حمایتهای مالی آن تشکر میشود.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ويروس شناسي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






