جلد 20، شماره 2 - ( تابستان 1402 )
جلد 20 شماره 2 صفحات 89-81 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Zadsar M, Sharifi Z, Aghai A. Evaluation of anti-hepatitis antibodies in intravenous immunoglobulin products from Iranian plasma. bloodj 2023; 20 (2) :81-89
URL: http://bloodjournal.ir/article-1-1480-fa.html
URL: http://bloodjournal.ir/article-1-1480-fa.html
زادسر مریم، شریفی زهره، آقایی افسانه. ارزیابی میزان آنتیبادیها بر علیه ویروسهای هپاتیت در فرآورده ایمونوگلوبین تزریق وریدی تهیه شده از پلاسمای ایرانی. فصلنامه پژوهشی خون. 1402; 20 (2) :81-89
دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 376 kb]
(900 دریافت)
| چکیده (HTML) (1778 مشاهده)
مقدمه
ایمونوگلوبولین تزریق وریدی(IVIG)، یک محصول درمانی مشتق از پلاسمای انسانی و شامل مخلوطی از IgG است که از پلاسمای تازه منجمد شده(FFP) اهداکنندگان خون کامل(پلاسمای بازیافتی) و یا پلاسمای آفرزیس (پلاسمای منبع) به دست میآید. تجویز IVIG به عنوان یک درمان جایگزین در بیماران مبتلا به نقص ایمنی اولیه و یا ثانویه است. همچنین یکی از مصارف اساسی برای این محصول بیولوژیکی، استفاده در درمانهای تعدیل ایمنی میباشد. برای محافظت از بیماران در برابر پاتوژنهای میکروبی مختلف از جمله باکتریها و ویروسها، طیف گستردهای از آنتیبادیها مورد نیاز است(2، 1).
محصولات ایمونوگلوبولین برای اخذ الزامات قانونی باید حاوی حداقل سطوح آنتیبادی علیه دیفتری، سرخک و ویروس فلج اطفال طبق فارماکوپه آمریکا، و علاوه بر این باید حاوی آنتیبادی علیه هپاتیت B طبق قوانین اروپا نیز باشد (3، 1). اگرچه، سطح حفاظتکننده آنتیبادی به طور دقیق در برابر سایر ویروسها وجود ندارد. محصولات IVIG از منابع مختلف پلاسمای انسانی به دست میآید و سطح آنتیبادی در برابر باکتریها و ویروسهای مختلف از یک بچ تولیدی به بچ دیگر متفاوت است(4). میزان آنتیبادیها در IVIG مستقیما تحت تاثیر پاتوژنهای بومی و شیـوع عفونتهـــا در یک منطقه قرار میگیرد. بنابراین، تولید آنتیبادی در اهداکنندگان در مناطق مختلف جغرافیایی بر اساس میزان قرار گرفتن در معرض پاتوژن خاص به صورت عفونت طبیعی و یا واکسیناسیون متفاوت است(4).
در دهه 1990، پس از پیدایش و گسترش اپیدمی ویروس نیل غربی(WNV)، افزایش قابل توجهی در سطح آنتیبادی ضد WNV در محصولات ایمونوگلوبولین مشاهده شد و مثبت شدن سرمی(Seroconversion) در جمعیت مورد تایید قرار گرفت(5). از آن زمان به بعد، مطالعه بر روی میزان آنتیبادیهای IVIG به عنوان یک ابزار اپیدمیولوژیک ارزشمند در نظر گرفته شد.
از طرف دیگر، اندمیسیتی ویروسهای هپاتیت در سراسر جهان به دلیل بهبود وضعیت اجتماعی- اقتصادی، افزایش بهداشت آب و غذا، هم چنین برقراری برنامه گسترده واکسیناسیون و موارد دیگر کاهش یافته است. به همین دلیل تاثیر این الگو بر محتوای پلاسمای انسانی باید بررسی و تعیین گردد که با وجود تغییرات در میزان آنتیبادیها در پلاسما و در نتیجه در IVIG ، آیا هنوز این محصولات در درمانهای جایگزینی مناسب میباشند(6).
علاوه بر این، انجام مطالعههای سرواپیدمیولوژیک در مورد ایمنسازی و میزان در معرض پاتوژنهای خاص قرار گرفتن ، به عنوان مثال هپاتیت ویروسی ، در جمعیت عمومی بسیار هزینهبر و به دلیل نیاز به بررسی بر روی حجم نمونه بسیار بزرگ دشوار است. ایمونوگلوبولین تزریق وریدی از پلاسمای هزاران اهداکننده سالم به دست میآید و بررسی سطح آنتیبادیها در برابر پاتوژنهای مشخص، نشانهای از مواجهه یا عدم مواجهه با پاتوژن و یا بررسی بومی بودن پاتوژن در جمعیت عمومی جامعه میباشد. از این رو، در مطالعه حاضر محتوای آنتیبادیهای ضد ویروسهای هپاتیت در محصولات ایمونوگلوبولین ساخته شده از پلاسمای ایرانی، اعم از پلاسمای بازیافتی و یا پلاسمای منبع، مورد مطالعه قرار گرفت و تیتر آنتی هپاتیت A و آنتیژن سطحی هپاتیت B تعیین شد و وجود یا عدم وجود آنتیبادی علیه HBc ، HEV، HDV و HGV بررسی گردید.
مواد و روشها
در این مطالعه مقطعی توصیفی، جامعه مورد مطالعه سریهای ساخت ایمونوگلوبولین تزریق وریدی تهیه شده از پلاسمای ایرانی بود که به صورت تصادفی نمونهگیری انجام شد و بر اساس شیوع آنتیبادی در جامعه و حسب مطالعههای قبلی مقدار حداقل بیست نمونه انتخاب گردید. بنابراین محصولات IVIG به تعداد 38 ویال به طور تصادفی انتخاب و وارد مطالعه شد. این محصولات از شرکت مادر تخصصی پالایش و پژوهش خون(IBRF) و شرکت درمان آرا تهیه گردید. ویالهای IVIG از شرکت مادر تخصصی پالایش و پژوهش خون از پلاسمای بازیافتی و ویالهای IVIG از شرکت درمان آرا از پلاسمای منبع تهیه شده بود. کیتهای بیوراد - فرانسه برای بررسی anti HBs (MonalisaTm Anti-HBs plus) ، برای anti-HAV (MonalisaTm Anti-HAV plus) و برای anti HBc (MonalisaTm Anti-HBc plus) به روش ELISA مورد استفاده قرار گرفت. در مورد anti-HDV از کیت دیاسورین - ایتالیا (ETI-DELTA-IGMK-2) استفاده شد. هم چنینanti-HGV و anti-HEV توسط کیتهای زلبیو - آلمان مورد بررسی قرار گرفت. برای سنجش کمی میزان آنتیبادی توتال آنتی HBs، ابتدا دو نمونه به صورت تصادفی تیتر شد و تیتر نهایی بسیار بالا مشاهده گردید. بنابراین، برای به دست آوردن تیتر متناسب با محدوده خطی استاندارد، رقت سریال تهیه شد. یک نمونه از پلاسمای بازیافتی و یک نمونه از پلاسمای منبع برای انجام رقت سریال و به دست آوردن تیتر بهینه رقیقسازی انتخاب شد. رقت صفر(نمونه بدون رقیقکننده) و رقتهای سریال 1-10 تا 6-10 از هر دو نمونه تهیه و طبق استاندارد کیت آزمایش شد و رقت 1-10 در محدوده خطی استاندارد کیت قرار گرفت و انتخاب شد. همه نمونهها با نرمال سالین به نسبت 1:10 رقیق و سپس آزمایش و نتایج با در نظر گرفتن ضریب رقت گزارش شد.
برای اندازهگیری کمی آنتیHAV نیز از ایمونواسی آنزیمی استفاده شد. ابتدا دو نمونه به صورت تصادفی تیتر شد و تیتر نهایی بسیار بالا مشاهده گردید. بنابراین، برای به دست آوردن تیتر متناسب با محدوده خطی استاندارد کیت، برای یک نمونه از پلاسمای بازیافتی و یک نمونه از پلاسمای منبع، رقتهای سریال 1-10 تا 6-10 مطابق روش ذکر شده برای آنتی HBs، تهیـه و تیتـر بهینـه رقیقسازی 3-10 انتخاب شد. همه نمونهها با نرمال سالین به نسبت 1:1000 رقیق، آزمایش و سپس با محاسبه ضریب رقت گزارش گردید. همچنین کیت ELISA غیرمستقیم با میکروپلیتهای پوشش داده شده توسط آنتیژنهای نوترکیب برای تشخیص آنتیبادی توتال(IgM و IgG) علیه آنتیژنهای هستهای ویروس هپاتیت B استفاده شد.
علاوه بر این، وجود آنتیبادی علیه HEV و یا HGV نیز با روش کیفی تعیین شد. کیت زلبیو، برای ارزیابی HEV-IgG و نیز HGV-IgG استفاده گردید. این کیت بر اساس ساندویچ ELISA کار میکند و شامل یک سنجش کیفی دو مرحلهای است و برای نمونههای سرم، لیزات سلولی، سوپرناتانت کشت سلولی و سایر مایعات بیولوژیکی قابل استفاده است.
برای تعیین کیفی وجود آنتیبادی علیه ویروس هپاتیت D (HDV)، کیت تشخیصی ELISA استفاده شد. ویروس هپاتیت D یک ویروس اقماری هپاتیت B است و فقط افرادی را آلوده میکند که به ویروس هپاتیت B (HBV) مبتلا شده باشند و باعث نارسایی حاد کبد در ناقلین HBs-Ag میشود. کیت تشخیصی ELISA بر اساس واکنش رقابتی سازماندهی شده است، به این معنی که اگر هر گونه anti-HDV در نمونه موجود باشد، برای اتصال به HDV پوشش داده شده به میکروپلیت، با anti-HDV نشاندار کیت رقابت میکند. مقدار آنتیبادی متصل به فاز جامد (میکروپلیت) و فعالیت آنزیمی متعاقب آن با غلظت anti-HDV در نمونه و یا کنترل مثبت رابطه معکوس دارد. فعالیت آنزیمی باعث ایجاد رنگ میشود که توسط نورسنجی اندازهگیری میشود.
یافتهها
بر اساس آزمون آماری تی تست مستقل(SPSS 23)، نتایج نشان داد که میانگین تیتر Anti-HAV در پلاسمای بازیافتی mIU/mL 16380±53174 با فاصله اطمینان 95% (CI)، برابر با 791/62078 و 449/44270 بود، در حالی که تیتر مرتبط در پلاسمای منبع mIU/mL 12989 ± 30572 با فاصله اطمینان 95% (CI)، برابر با 69/35663 و31/25480 بود. میانگین کل تیتر در محصول IVIG بدون توجه به نوع پلاسمایFFP (بازیافتی و یا منبع) mIU/mL 17735 ± 38304 با CI 95% برابر با 4552/43943 و 4848/32665 بود(جدول 1). تفاوت در تیتر آنتیبادی بین پلاسمای بازیافتی و پلاسمای منبع معنادار بود و بچهای IVIG حاصل از پلاسمای بازیافتی حاوی مقادیر بالاتری از anti-HAV نسبت به پلاسما بود(0001/0 p<).
میانگین تیتر anti-HBs در پلاسمای بازیافتی mIU/mL 471 ± 2186 بـا CI 95% بـرابـر بـا 21/2442 و 08/1930
بود، در حالی که در پلاسمای منبع میانگین تیتر به میزان mIU/mL 1124 ± 2650 با CI 95% برابر با 55/3091 و
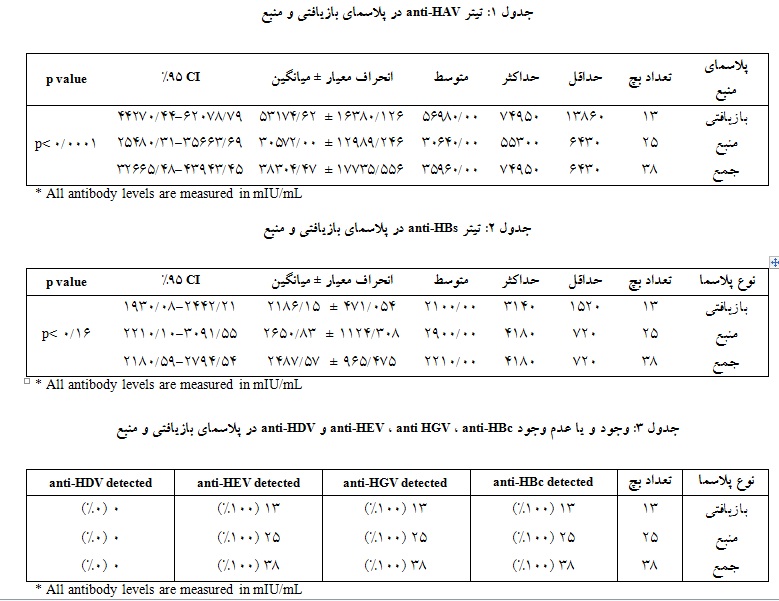
10/2210 مشاهده شد. میانگین کل تیتر در محصول IVIG بدون توجه به نوع پلاسمایFFP (بازیافتی و یا منبع) mIU/mL 965 ± 2487 با CI 95% برابر با 54/2794 و 59/21805 بود(جدول 2). اگر چه تیتر anti-HBs در پلاسمای بازیافتی در مقایسه با پلاسمای منبع کمتر بود، اما این تفاوت در تیتر آنتیبادی معنادار نبود. در تمام نمونههای IVIG مورد ارزیابی (پلاسمای بازیافتی و پلاسمای منبع)، anti-HBc مثبت(100%) گزارش گردید. همچنین در تمام نمونهها نتایج مثبت(100%) برایanti-HEV وanti-HGV مشاهده شد و کلیه نمونهها از نظرanti-HDV منفی(100%) گزارش شدند(جدول 3).
بحث
میزان آنتیبادی بر علیه ویروسهای هپاتیت در فرآورده
ایمونوگلوبولین تزریق وریدی تهیه شده از پلاسمای ایرانی برای اولین بار در ایران گزارش شده است. در این مطالعه تیتر آنتیبادی anti-HAV و anti-HBs تعیین و نشان داده شد که تیتر این آنتیبادیها در محصولات IVIG ساخته شده از پلاسمای ایرانی در سطح بالاتری نسبت به محصولات اروپایی و آمریکایی قرار دارد. هم چنین آنتیبادی علیه HBc ، HEV ، HDV و HGV در محصولات IVIG ساخته شده از پلاسمای ایرانی بررسی گردید.
انتقال غیرفعال آنتیبادیها به منظور پیشگیری و درمان عفونتهای ویروسی سالهاست که مورد تایید و استفاده قرار گرفته است(7). منبع اصلی آنتیبادی برای این نوع درمان، استفاده از فرآورده ایمونوگلوبولین تزریق وریدی و یا همان IVIG است که از پلاسما به دست میآید و حاوی آنتیبادیهای اختصاصی بیماریهای ویروسی مانند سیتومگالوویروس، ویروسهای هپاتیت A، B ، C ،HIV ، ویروس سنسیشیال تنفسی، ویروس سرخک و ویروس واریسلا زوستر میباشد(8، 7). تعداد کمی از محصولات ایمونوگلوبولینی خاص مانند محصول هیپرایمیون حاوی anti-HBs یا همان HBIG وجود دارد، اما این محصولات گرانقیمت هستند و در همه جا قابل دسترس نیستند. علاوه بر این، برای بسیاری از بیماریها، محصول هیپرایمونوگلوبولین اختصاصی در دسترس نیست و در این موارد محصولات طبیعی ایمونوگلوبولین و همان IVIG ، تنها انتخاب برای درمان جایگزین میباشد.
با توجه به این واقعیت که فرآوردههای خونی اهداکنندگان و در واقع پلاسمای اهداکنندگان حاوی آنتیبادیهای اختصاصی علیه ویروسهای خاص هستند، انتظار میرود افراد با سابقه ابتلا به عفونت در گذشته و یا پس از واکسیناسیون حاوی سطوح فزایندهای از این آنتیبادیها در پلاسما و متعاقب آن در محصولات ایمونوگلوبولین باشند. به همین منظور از پلاسمای این افراد برای تهیه محصولات هیپرایمیون استفاده شده است. به عنوان مثال، وجود آنتیبادی با تیتر بالا علیه ویروس نیل غربی در برخی از اهداکنندگان اسرائیلی(فلسطین اشغالی) منجر به تولید محصولات ایمونوگلوبولین هیپرایمیون علیه ویروس نیل غربی شده است(9).
در فرآیند تولید IVIG به سبب تغییر در میزان آنتیبادیها در پلاسمای اهداکنندگان، تغییرات در غلظت آنتیبادیها در محصول نهایی ایجاد میشود و تعیین حداقل معیارهای مشخص برای این آنتیبادیها دشوار است. با این حال، انواع مختلفی از تحقیقات برای ارزیابی مشکلات انجام شده است(10). اگر چه برای بعضی از این آنتیبادیها برای مثال برای anti-HAV حداقل سطح حفاظتی در فارماکوپه تعریف شده است، اما تعیین آن برای کلیه آنتیبادیها امکانپذیر نمیباشد. به همین دلیل پایش آنتیبادیهای خاص در فرآوردههای ایمونوگلوبولینی برای تدوین گایدلاین مناسب در سیاستگزاریهای درمانی و به صورت ارزیابی دورهای توصیه گردیده است(11).
در 50 سـال گذشتـه، کاهـش قابـل توجهـی در شیـوع
عفونت هپاتیت A در دنیا مشاهده شده است. مطالعهای در
اروپا(اتریش، آلمان و جمهوری چک) نشان داد که این کاهش در حال حاضر نیز ادامه دارد، به طوری که anti-HAV بیش از یک سوم در پلاسمای انسان کاهش یافته است (6). در سال 2016، سطح تیتر آنتیبادی علیه ویروسهای هپاتیت A و B در محصولات ایمونوگلوبولینی تولید شده در کره ارزیابی و سطح تیتر آنتیبادیها با محصولات تولید شده در ایالات متحده و ژاپن مقایسه گردید. نتایج این مطالعه نشان داد که سطح آنتیبادیهای anti-HAV در کره و ایالات متحده آمریکا در مقایسه با ژاپن بالاتر است. با این حال، حداقل سطح حفاظتی mIU/mL 20 در همه محصولات از هر سه کشور موجود بود (11). مطالعه اخیر بر روی محصولات حاصل از پلاسمای ایرانی نشان داد که این محصولات دارای سطح بالاتری ازanti-HAV در مقایسه با محصولات کرهای بوده و این تفاوت برابر با (mIU/mL) 43943-32665 در محصول ایرانی در مقابل (mIU/mL) 4489-7154 در محصول کرهای با CI 95% بوده است.
پس از عفونت با HAV، تیتر آنتیبادی در سرم 3 تا 30 برابر بیشتر از میزان مشاهده شده توسط واکسیناسیون HAV افزایش مییابد. حد آستانه میزان آنتیبادی پس از عفونت mIU/mL 11400 و پس از واکسیناسیون mIU/mL 404 گزارش شده است. بنابراین بهبود و گسترش واکسیناسیون عمومی در بسیاری از کشورها دلیل اصلی کاهش تیتر آنتیبادی در پلاسما میباشد(12).
فارست و همکاران نشان دادهاند که در نتیجه کاهش anti-HAV در پلاسمای اروپایی(24%) و در ایالات متحده آمریکا(41%)، از سال 2003 تا 2007، تیتر آنتیبادی در محصولات IVIG نیز کاهش یافته است. بر این اساس، تفاوت تیتر anti-HAV در محصولات اروپایی به میزان mIU/mL 680 ± 22910 نسبت به محصولات آمریکایی mIU/mL 480 ± 14600 معنادار بوده است. این تفاوت را میتوان در نتیجه استراتژیهای مختلف واکسیناسیون در آن مناطق توصیف کرد. در ایالات متحده، واکسیناسیون به طور معمول در دوران کودکی انجام میشود در حالی که در اروپا واکسیناسیون به میزان کمتری ارائه میشود که منجر به بروز طبیعی عفونت HAV میگردد(6). مقدار بالاتر آنتیHAV در محصولات مشتق از پلاسمای ایرانی را میتوان به عنوان پیامد عفونت طبیعی مکرر در اهداکنندگان ایرانی توصیف کرد.
همچنین در این مطالعه مشخص شد که میانگین تیتر anti-HAV در پلاسمای بازیافتی به طور معناداری بیشتر از پلاسمای منبع، mIU/mL 53174 در مقایسه با mIU/mL 30572 بوده است. پلاسمای منبع معمولاً از افراد جوان اهداکننده پلاسما به دست میآید که شانس کمتری برای آلوده شدن و یا در معرض قرار گرفتن قبلی با عفونت HAV داشتهاند. به عبارت دیگر افراد در طیف سنی جوانتر در مقایسه با اهداکنندگان پلاسمای بازیافتی، مواجهه کمتر با عفونت داشته و به این صورت مقادیر بالاتر anti-HAV در پلاسمای بازیافتی قابل توضیح میباشد. اما با توجه به طیف گسترده اهداکنندگان، رنج وسیع فاصله بین حداقل و حداکثر تیتر در هر دو گروه پلاسمای بازیافتی و منبع ملاحظه میگردد.
تاکنون هیچ الزامی برای سطح آنتیبادیهای HAV در فارماکوپه در مورد فرآورده IVIG تعیین نشده است. با این حال مقامات ذیصلاح تیتر آنتیبادی بیش از mIU/mL10 را در هر محصول جدید پیشنهاد میکنند، اگر چه که نمیتوان به راحتی این سطح را در هر بچ تولید حفظ کرد(13). به همین دلیل هم اندازهگیری و پایش مداوم تیتر آنتیبادیهای خاص در محصولات مختلف ایمونوگلوبولین ضروری است(12).
باید این نکته را مد نظر قرار داد که فرآیند تولید محصولات ایمونوگلوبولین نیز میتواند بر تیتر آنتیبادی محصول نهایی تأثیر بگذارد. محصولات ایمونوگلوبولینی تولید شده از پلاسمای ایرانی حاوی تیتر 1000 برابر بالاتر از حداقل سطح ضروری برای ممانعت از ایجاد عفونت توسط HAV است(6).
در مطالعه حاضر تیتر anti-HBs در محصول IVIG در پلاسمای بازیافتی کمتر از پلاسمای منبع بوده است، اگر چه این تفاوت با p value کمتر از 05/0 معنادار نبود. این موضوع به علت واکسیناسیون کشوری هپاتیت B از سال 1994 برای نوزادان قابل توجیه است، چرا که اهداکنندگان پلاسمای منبع اغلب از افراد جوان جامعه میباشند که واکسیناسیون هپاتیت B بر روی آنها انجام گرفته است و به همین دلیل HBs Ab در پلاسمای آنها نسبت به افراد واکسینه نشده تیتر بالاتری را نشان میدهد. مطالعهها نشان داده است که تیتر anti-HBs در محصولات مختلف ایمونوگلوبولین بسته به منشا تولید محصولات متفاوت بوده است. محصولات ساخت ایالات متحده در مقایسه با فرآوردههای ساخت کره تیتر بالاتری را نشان داده است. با این حال و با وجود کاهش تیتر در محصولات کشور کره حتی نسبت به مطالعههای پیشین، محصولات هم در کشور کره و هم در آمریکا غلظت مناسب anti-HBs و در حد بالاتر از حداقل سطح حفاظتی(minimal protective level)، به میزان mIU/mL10 را داشته است. این موضوع عمدتاً به استراتژیهای مختلف ملی ایمنسازی در این کشورها مرتبط است، در کشور آمریکا و کره واکسیناسیون روتین از سال 1991 آغاز شده است. هر چند وقوع طبیعی عفونتهای مختلف، ایمنیزایی واکسنها و دیگر عوامل نیز میتواند در محصولات هر کشور تاثیرگذار باشد(11).
حداقل تیتر آنتیبادی برعلیه هپاتیت B برای محصول IVIG در فارماکوپه اروپا برابر با IU/g IgG5/0 تعیین شده است(3).
مقادیر آنتیبادی در محصولات ایمونوگلوبولین تهیه شده از پلاسمای ایرانی تیتر بسیار بالاتری را نسبت به مطالعه انجام گرفته توسط سویانگ و همکارانش نشان داده است. در مطالعه سویانگ تیتر anti-HBs در محصولات کره بین mIU/mL 965-438 و در محصولات ژاپن بین mIU/mL 157-123 و در محصول مشابه امریکایی mIU/mL 1945 گزارش شده بود. بنابراین میانگین تیتر مشاهده شده mIU/mL 2487 در مطالعه اخیر و در محصول به دست آمده از پلاسمای ایرانی به طور قابل ملاحظهای بیشتر از مطالعه سویانگ میباشد.
نتایج بهدستآمده نشاندهنده وضعیت ایمنی هزاران اهداکننده خون سالم است و بنابراین میتواند ابزار ارزشمندی برای مطالعههای سرواپیدمیولوژیک باشد. میزان بروز عفونتهای HBV و HAV در کشورهای توسعه یافته در مقایسه با کشورهای در حال توسعه کمتر است. البته این نکته حائز اهمیت است که عفونت HAV وابستگی زیادی به وضعیت اجتماعی و اقتصادی جامعه دارد، در حالی که ابتلا به HBV از طریق خون، سمن و یا انتقال پریناتال از مادر آلوده به نوزاد صورت میگیرد و به همین دلیل تیتر آنتیبادی در کشورهای توسعه یافته کمتر از کشورهای در حال توسعه است. اگرچه واکسیناسیون گسترده نقش مهمی در پیشگیری از عفونت ایفا میکند، اما توجه به این نکته مهم است که بدون مواجهه طبیعی و یا واکسیناسیون بدون پاسخهای یادآور تقویتکننده، تیتر آنتیبادی به تدریج کاهش مییابد(11).
تمام محصولات IVIG به دست آمده از پلاسمای ایرانی، Anti-HBC ، Anti-HEV ، Anti-HGV مثبت بودند. در مورد عفونت ویروسی هپاتیت E و در مطالعه آنکورن ، 10 محصول مختلف از ایمونوگلوبولین مورد بررسی قرار گرفت که همه آنها سطح مناسبی از anti-HEV داشته و قادر به خنثیکردن آنتیژنهای HEV بودند(14). در همین راستا مطالعههای سالهای اخیر در نقاط مختلف ایران، عفونت ویروسی هپاتیت E را به صورت اندمیک و با شیوع سرمی HEV 10% نشان داده است که این میزان در ایران مشابه عربستان سعودی، کمتر از کشورهای آسیای جنوبی و بیشتر از کشورهای اروپایی بوده است(16، 15)، به طوری که وجود anti-HEV در تمام محصولات کمک به سلامت اولیه کرده و از ایجاد عفونت در بیماران دارای نقص سیستم ایمنی جلوگیری میکند. در مورد عفونت ویروسی هپاتیت G بر اساس مطالعه امینی و همکاران، HGV یک ویروس شایع در ایران است و در 8/4% اهداکنندگان HGV RNA گزارش شده است(17). بنابراین همان طور که قابل پیشبینی هم بود در کلیه محصولات IVIG تهیه شده از پلاسمای ایرانی anti-HGV و نیز anti-HEV مثبت گزارش گردید، در حالی که anti-HDV در کلیه محصولات منفی بود.
نتیجهگیری
علیرغم روند رو به کاهش شیوع عفونتهای هپاتیت ویروسی(A & B) در دنیا و نگرانی ناشی از احتمال تاثیر این میزان کاهش در فرآوردههای ایمونوگلوبولینی از نظر تامین سطوح حفاظتی آنتیبادی در بیماران، این مطالعه نشان داد تیتر آنتیبادی موجود در محصولات تهیه شده از پلاسمای ایرانی برای درمانهای جایگزینی مناسب میباشد. در واقع تیتر این آنتیبادیها بر علیه ویروس هپاتیت A و یا B ، نه تنها برای درمانهای جایگزینی کافی به نظر میرسد، بلکه از مقادیر ذکر شده در مطالعههای اروپا و آمریکا بالاتر نیز بوده است. بنابراین دو نکته اساسی در این مطالعه قابل استنتاج میباشد. اول این که تیتر متفاوت آنتیبادیها در انواع مختلف پلاسما(پلاسمای بازیافتی و یا پلاسمای منبع) میتواند در برنامهریزیهای استراتژیک پلاسمایی مد نظر قرار گیرد. دوم این که تیتر آنتیبادیها بر علیه هپاتیت B و A از تیترهای موجود در مطالعههای انجام گرفته در دنیا بسیار بالاتر بوده است. بنابراین از آن جایی که برای تهیه مشتقات پلاسمایی، پلاسما بدون هیچگونه غربالگری اولیه مورد استفاده قرار گرفته است، در صورتی که هدف تهیه محصولات ایمونوگلوبولینی هیپرایمیون باشد، غربالگری اولیه و انتخاب افراد با تیتر آنتیبادی بالا، برای تولید محصولات اختصاصی و هیپرایمیون پیشنهاد میگردد.
تشکر و قدردانی
این پروژه تحقیقاتی توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین مالی شده است. همچنین بدین وسیله از شرکت پالایش و پژوهش خون برای اهدای ویالهای IVIG تهیه شده از پلاسمای بازیافتی و از شرکت درمان آرا برای اهدای ویالهای IVIG تهیه شده از پلاسمای منبع، تشکر و قدردانی میشود.
متن کامل: (1025 مشاهده)
ارزیابی میزان آنتیبادیها بر علیه ویروسهای هپاتیت در فرآورده ایمونوگلوبین
تزریق وریدی تهیه شده از پلاسمای ایرانی
مریم زادسر1، زهره شریفی2، افسانه آقایی3
چکیده
سابقه و هدف
ایمونوگلوبولین تزریق وریدی ، یک محصول بیولوژیکی حاوی IgG است که برای محافظت از بیماریهای خاص در برابر پاتوژنهای میکروبی استفاده میشود. به دلیل کاهش شیوع هپاتیتهای ویروسی سراسر جهان، اثر محافظتی ایمونوگلوبولینها در درمان نیاز به بررسی مجدد دارد. لذا آنتیبادیهایanti-HAV و anti-HBs ، anti-HGV ، anti-HDV و anti-HEV در IVIG های ساخته شده از پلاسمای ایرانی مورد بررسی قرار گرفت.
مواد و روشها
در این مطالعه مقطعی توصیفی ، حضور و یا عدم حضور آنتیبادی علیه هپاتیتA ، E ، D ، G و آنتیبادیهای ضد آنتیژن سطحی هپاتیت B و آنتیژن هسته هپاتیت B در 38 سری ساخت مختلف محصول IVIG از پلاسمای بازیافتی و یا پلاسمای منبع با روش الایزا تعیین و آنتیبادی ضد HAV و ضد HBs تیتر گردید. یافتهها توسط آزمون t مستقل و 23 SPSS تجزیه و تحلیل شدند.
یافتهها
تیتر anti-HAV در محصول IVIG برابر با mIU/mL 17735 ± 38304 بود و این تیتر در IVIGهای تولید شده از پلاسمای بازیافتی به طور قابل توجهی بالاتر بود. تیتر anti-HBs در محصول IVIG برابر با mIU/mL 965 ± 2487 بود که تفاوت معناداری بین دو نوع پلاسمای منبع و بازیافتی مشاهده نگردید. آنتیبادی anti-HBc ، anti-HEV وanti-HGV در همه محصولات مورد مطالعه شناسایی شد، و هیچ آنتیبادی ضد HDV یافت نشد.
نتیجه گیری
با وجود کاهش شیوع هپاتیتهای ویروسی و گزارشهای کاهش تیترآنتیHAV و HBs در محصولات IVIG تولید شده در دنیا، محصولات IVIG پلاسمای ایرانی دارای تیتر قابل قبول آنتیHAV و آنتیHBs طبق فارماکوپه اروپا بوده و برای درمان جایگزینی مناسب میباشد.
کلمات کلیدی: ایمونوگلوبولین تزریق وریدی (IVIG)، هپاتیتها، ایران، پلاسما
تاریخ دریافت: 03/11/1401
تاریخ پذیرش : 10/12/1401
1- متخصص بیماریهای عفونی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ویروس شناسی ـ استاد مرکز تحقیقات انتقال خونـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خونـ تهرانـ ایران
3- مؤلف مسئول: PhD ایمنیشناسی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
تزریق وریدی تهیه شده از پلاسمای ایرانی
مریم زادسر1، زهره شریفی2، افسانه آقایی3
چکیده
سابقه و هدف
ایمونوگلوبولین تزریق وریدی ، یک محصول بیولوژیکی حاوی IgG است که برای محافظت از بیماریهای خاص در برابر پاتوژنهای میکروبی استفاده میشود. به دلیل کاهش شیوع هپاتیتهای ویروسی سراسر جهان، اثر محافظتی ایمونوگلوبولینها در درمان نیاز به بررسی مجدد دارد. لذا آنتیبادیهایanti-HAV و anti-HBs ، anti-HGV ، anti-HDV و anti-HEV در IVIG های ساخته شده از پلاسمای ایرانی مورد بررسی قرار گرفت.
مواد و روشها
در این مطالعه مقطعی توصیفی ، حضور و یا عدم حضور آنتیبادی علیه هپاتیتA ، E ، D ، G و آنتیبادیهای ضد آنتیژن سطحی هپاتیت B و آنتیژن هسته هپاتیت B در 38 سری ساخت مختلف محصول IVIG از پلاسمای بازیافتی و یا پلاسمای منبع با روش الایزا تعیین و آنتیبادی ضد HAV و ضد HBs تیتر گردید. یافتهها توسط آزمون t مستقل و 23 SPSS تجزیه و تحلیل شدند.
یافتهها
تیتر anti-HAV در محصول IVIG برابر با mIU/mL 17735 ± 38304 بود و این تیتر در IVIGهای تولید شده از پلاسمای بازیافتی به طور قابل توجهی بالاتر بود. تیتر anti-HBs در محصول IVIG برابر با mIU/mL 965 ± 2487 بود که تفاوت معناداری بین دو نوع پلاسمای منبع و بازیافتی مشاهده نگردید. آنتیبادی anti-HBc ، anti-HEV وanti-HGV در همه محصولات مورد مطالعه شناسایی شد، و هیچ آنتیبادی ضد HDV یافت نشد.
نتیجه گیری
با وجود کاهش شیوع هپاتیتهای ویروسی و گزارشهای کاهش تیترآنتیHAV و HBs در محصولات IVIG تولید شده در دنیا، محصولات IVIG پلاسمای ایرانی دارای تیتر قابل قبول آنتیHAV و آنتیHBs طبق فارماکوپه اروپا بوده و برای درمان جایگزینی مناسب میباشد.
کلمات کلیدی: ایمونوگلوبولین تزریق وریدی (IVIG)، هپاتیتها، ایران، پلاسما
تاریخ دریافت: 03/11/1401
تاریخ پذیرش : 10/12/1401
1- متخصص بیماریهای عفونی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- PhD ویروس شناسی ـ استاد مرکز تحقیقات انتقال خونـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خونـ تهرانـ ایران
3- مؤلف مسئول: PhD ایمنیشناسی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
ایمونوگلوبولین تزریق وریدی(IVIG)، یک محصول درمانی مشتق از پلاسمای انسانی و شامل مخلوطی از IgG است که از پلاسمای تازه منجمد شده(FFP) اهداکنندگان خون کامل(پلاسمای بازیافتی) و یا پلاسمای آفرزیس (پلاسمای منبع) به دست میآید. تجویز IVIG به عنوان یک درمان جایگزین در بیماران مبتلا به نقص ایمنی اولیه و یا ثانویه است. همچنین یکی از مصارف اساسی برای این محصول بیولوژیکی، استفاده در درمانهای تعدیل ایمنی میباشد. برای محافظت از بیماران در برابر پاتوژنهای میکروبی مختلف از جمله باکتریها و ویروسها، طیف گستردهای از آنتیبادیها مورد نیاز است(2، 1).
محصولات ایمونوگلوبولین برای اخذ الزامات قانونی باید حاوی حداقل سطوح آنتیبادی علیه دیفتری، سرخک و ویروس فلج اطفال طبق فارماکوپه آمریکا، و علاوه بر این باید حاوی آنتیبادی علیه هپاتیت B طبق قوانین اروپا نیز باشد (3، 1). اگرچه، سطح حفاظتکننده آنتیبادی به طور دقیق در برابر سایر ویروسها وجود ندارد. محصولات IVIG از منابع مختلف پلاسمای انسانی به دست میآید و سطح آنتیبادی در برابر باکتریها و ویروسهای مختلف از یک بچ تولیدی به بچ دیگر متفاوت است(4). میزان آنتیبادیها در IVIG مستقیما تحت تاثیر پاتوژنهای بومی و شیـوع عفونتهـــا در یک منطقه قرار میگیرد. بنابراین، تولید آنتیبادی در اهداکنندگان در مناطق مختلف جغرافیایی بر اساس میزان قرار گرفتن در معرض پاتوژن خاص به صورت عفونت طبیعی و یا واکسیناسیون متفاوت است(4).
در دهه 1990، پس از پیدایش و گسترش اپیدمی ویروس نیل غربی(WNV)، افزایش قابل توجهی در سطح آنتیبادی ضد WNV در محصولات ایمونوگلوبولین مشاهده شد و مثبت شدن سرمی(Seroconversion) در جمعیت مورد تایید قرار گرفت(5). از آن زمان به بعد، مطالعه بر روی میزان آنتیبادیهای IVIG به عنوان یک ابزار اپیدمیولوژیک ارزشمند در نظر گرفته شد.
از طرف دیگر، اندمیسیتی ویروسهای هپاتیت در سراسر جهان به دلیل بهبود وضعیت اجتماعی- اقتصادی، افزایش بهداشت آب و غذا، هم چنین برقراری برنامه گسترده واکسیناسیون و موارد دیگر کاهش یافته است. به همین دلیل تاثیر این الگو بر محتوای پلاسمای انسانی باید بررسی و تعیین گردد که با وجود تغییرات در میزان آنتیبادیها در پلاسما و در نتیجه در IVIG ، آیا هنوز این محصولات در درمانهای جایگزینی مناسب میباشند(6).
علاوه بر این، انجام مطالعههای سرواپیدمیولوژیک در مورد ایمنسازی و میزان در معرض پاتوژنهای خاص قرار گرفتن ، به عنوان مثال هپاتیت ویروسی ، در جمعیت عمومی بسیار هزینهبر و به دلیل نیاز به بررسی بر روی حجم نمونه بسیار بزرگ دشوار است. ایمونوگلوبولین تزریق وریدی از پلاسمای هزاران اهداکننده سالم به دست میآید و بررسی سطح آنتیبادیها در برابر پاتوژنهای مشخص، نشانهای از مواجهه یا عدم مواجهه با پاتوژن و یا بررسی بومی بودن پاتوژن در جمعیت عمومی جامعه میباشد. از این رو، در مطالعه حاضر محتوای آنتیبادیهای ضد ویروسهای هپاتیت در محصولات ایمونوگلوبولین ساخته شده از پلاسمای ایرانی، اعم از پلاسمای بازیافتی و یا پلاسمای منبع، مورد مطالعه قرار گرفت و تیتر آنتی هپاتیت A و آنتیژن سطحی هپاتیت B تعیین شد و وجود یا عدم وجود آنتیبادی علیه HBc ، HEV، HDV و HGV بررسی گردید.
مواد و روشها
در این مطالعه مقطعی توصیفی، جامعه مورد مطالعه سریهای ساخت ایمونوگلوبولین تزریق وریدی تهیه شده از پلاسمای ایرانی بود که به صورت تصادفی نمونهگیری انجام شد و بر اساس شیوع آنتیبادی در جامعه و حسب مطالعههای قبلی مقدار حداقل بیست نمونه انتخاب گردید. بنابراین محصولات IVIG به تعداد 38 ویال به طور تصادفی انتخاب و وارد مطالعه شد. این محصولات از شرکت مادر تخصصی پالایش و پژوهش خون(IBRF) و شرکت درمان آرا تهیه گردید. ویالهای IVIG از شرکت مادر تخصصی پالایش و پژوهش خون از پلاسمای بازیافتی و ویالهای IVIG از شرکت درمان آرا از پلاسمای منبع تهیه شده بود. کیتهای بیوراد - فرانسه برای بررسی anti HBs (MonalisaTm Anti-HBs plus) ، برای anti-HAV (MonalisaTm Anti-HAV plus) و برای anti HBc (MonalisaTm Anti-HBc plus) به روش ELISA مورد استفاده قرار گرفت. در مورد anti-HDV از کیت دیاسورین - ایتالیا (ETI-DELTA-IGMK-2) استفاده شد. هم چنینanti-HGV و anti-HEV توسط کیتهای زلبیو - آلمان مورد بررسی قرار گرفت. برای سنجش کمی میزان آنتیبادی توتال آنتی HBs، ابتدا دو نمونه به صورت تصادفی تیتر شد و تیتر نهایی بسیار بالا مشاهده گردید. بنابراین، برای به دست آوردن تیتر متناسب با محدوده خطی استاندارد، رقت سریال تهیه شد. یک نمونه از پلاسمای بازیافتی و یک نمونه از پلاسمای منبع برای انجام رقت سریال و به دست آوردن تیتر بهینه رقیقسازی انتخاب شد. رقت صفر(نمونه بدون رقیقکننده) و رقتهای سریال 1-10 تا 6-10 از هر دو نمونه تهیه و طبق استاندارد کیت آزمایش شد و رقت 1-10 در محدوده خطی استاندارد کیت قرار گرفت و انتخاب شد. همه نمونهها با نرمال سالین به نسبت 1:10 رقیق و سپس آزمایش و نتایج با در نظر گرفتن ضریب رقت گزارش شد.
برای اندازهگیری کمی آنتیHAV نیز از ایمونواسی آنزیمی استفاده شد. ابتدا دو نمونه به صورت تصادفی تیتر شد و تیتر نهایی بسیار بالا مشاهده گردید. بنابراین، برای به دست آوردن تیتر متناسب با محدوده خطی استاندارد کیت، برای یک نمونه از پلاسمای بازیافتی و یک نمونه از پلاسمای منبع، رقتهای سریال 1-10 تا 6-10 مطابق روش ذکر شده برای آنتی HBs، تهیـه و تیتـر بهینـه رقیقسازی 3-10 انتخاب شد. همه نمونهها با نرمال سالین به نسبت 1:1000 رقیق، آزمایش و سپس با محاسبه ضریب رقت گزارش گردید. همچنین کیت ELISA غیرمستقیم با میکروپلیتهای پوشش داده شده توسط آنتیژنهای نوترکیب برای تشخیص آنتیبادی توتال(IgM و IgG) علیه آنتیژنهای هستهای ویروس هپاتیت B استفاده شد.
علاوه بر این، وجود آنتیبادی علیه HEV و یا HGV نیز با روش کیفی تعیین شد. کیت زلبیو، برای ارزیابی HEV-IgG و نیز HGV-IgG استفاده گردید. این کیت بر اساس ساندویچ ELISA کار میکند و شامل یک سنجش کیفی دو مرحلهای است و برای نمونههای سرم، لیزات سلولی، سوپرناتانت کشت سلولی و سایر مایعات بیولوژیکی قابل استفاده است.
برای تعیین کیفی وجود آنتیبادی علیه ویروس هپاتیت D (HDV)، کیت تشخیصی ELISA استفاده شد. ویروس هپاتیت D یک ویروس اقماری هپاتیت B است و فقط افرادی را آلوده میکند که به ویروس هپاتیت B (HBV) مبتلا شده باشند و باعث نارسایی حاد کبد در ناقلین HBs-Ag میشود. کیت تشخیصی ELISA بر اساس واکنش رقابتی سازماندهی شده است، به این معنی که اگر هر گونه anti-HDV در نمونه موجود باشد، برای اتصال به HDV پوشش داده شده به میکروپلیت، با anti-HDV نشاندار کیت رقابت میکند. مقدار آنتیبادی متصل به فاز جامد (میکروپلیت) و فعالیت آنزیمی متعاقب آن با غلظت anti-HDV در نمونه و یا کنترل مثبت رابطه معکوس دارد. فعالیت آنزیمی باعث ایجاد رنگ میشود که توسط نورسنجی اندازهگیری میشود.
یافتهها
بر اساس آزمون آماری تی تست مستقل(SPSS 23)، نتایج نشان داد که میانگین تیتر Anti-HAV در پلاسمای بازیافتی mIU/mL 16380±53174 با فاصله اطمینان 95% (CI)، برابر با 791/62078 و 449/44270 بود، در حالی که تیتر مرتبط در پلاسمای منبع mIU/mL 12989 ± 30572 با فاصله اطمینان 95% (CI)، برابر با 69/35663 و31/25480 بود. میانگین کل تیتر در محصول IVIG بدون توجه به نوع پلاسمایFFP (بازیافتی و یا منبع) mIU/mL 17735 ± 38304 با CI 95% برابر با 4552/43943 و 4848/32665 بود(جدول 1). تفاوت در تیتر آنتیبادی بین پلاسمای بازیافتی و پلاسمای منبع معنادار بود و بچهای IVIG حاصل از پلاسمای بازیافتی حاوی مقادیر بالاتری از anti-HAV نسبت به پلاسما بود(0001/0 p<).
میانگین تیتر anti-HBs در پلاسمای بازیافتی mIU/mL 471 ± 2186 بـا CI 95% بـرابـر بـا 21/2442 و 08/1930
بود، در حالی که در پلاسمای منبع میانگین تیتر به میزان mIU/mL 1124 ± 2650 با CI 95% برابر با 55/3091 و

بحث
میزان آنتیبادی بر علیه ویروسهای هپاتیت در فرآورده
ایمونوگلوبولین تزریق وریدی تهیه شده از پلاسمای ایرانی برای اولین بار در ایران گزارش شده است. در این مطالعه تیتر آنتیبادی anti-HAV و anti-HBs تعیین و نشان داده شد که تیتر این آنتیبادیها در محصولات IVIG ساخته شده از پلاسمای ایرانی در سطح بالاتری نسبت به محصولات اروپایی و آمریکایی قرار دارد. هم چنین آنتیبادی علیه HBc ، HEV ، HDV و HGV در محصولات IVIG ساخته شده از پلاسمای ایرانی بررسی گردید.
انتقال غیرفعال آنتیبادیها به منظور پیشگیری و درمان عفونتهای ویروسی سالهاست که مورد تایید و استفاده قرار گرفته است(7). منبع اصلی آنتیبادی برای این نوع درمان، استفاده از فرآورده ایمونوگلوبولین تزریق وریدی و یا همان IVIG است که از پلاسما به دست میآید و حاوی آنتیبادیهای اختصاصی بیماریهای ویروسی مانند سیتومگالوویروس، ویروسهای هپاتیت A، B ، C ،HIV ، ویروس سنسیشیال تنفسی، ویروس سرخک و ویروس واریسلا زوستر میباشد(8، 7). تعداد کمی از محصولات ایمونوگلوبولینی خاص مانند محصول هیپرایمیون حاوی anti-HBs یا همان HBIG وجود دارد، اما این محصولات گرانقیمت هستند و در همه جا قابل دسترس نیستند. علاوه بر این، برای بسیاری از بیماریها، محصول هیپرایمونوگلوبولین اختصاصی در دسترس نیست و در این موارد محصولات طبیعی ایمونوگلوبولین و همان IVIG ، تنها انتخاب برای درمان جایگزین میباشد.
با توجه به این واقعیت که فرآوردههای خونی اهداکنندگان و در واقع پلاسمای اهداکنندگان حاوی آنتیبادیهای اختصاصی علیه ویروسهای خاص هستند، انتظار میرود افراد با سابقه ابتلا به عفونت در گذشته و یا پس از واکسیناسیون حاوی سطوح فزایندهای از این آنتیبادیها در پلاسما و متعاقب آن در محصولات ایمونوگلوبولین باشند. به همین منظور از پلاسمای این افراد برای تهیه محصولات هیپرایمیون استفاده شده است. به عنوان مثال، وجود آنتیبادی با تیتر بالا علیه ویروس نیل غربی در برخی از اهداکنندگان اسرائیلی(فلسطین اشغالی) منجر به تولید محصولات ایمونوگلوبولین هیپرایمیون علیه ویروس نیل غربی شده است(9).
در فرآیند تولید IVIG به سبب تغییر در میزان آنتیبادیها در پلاسمای اهداکنندگان، تغییرات در غلظت آنتیبادیها در محصول نهایی ایجاد میشود و تعیین حداقل معیارهای مشخص برای این آنتیبادیها دشوار است. با این حال، انواع مختلفی از تحقیقات برای ارزیابی مشکلات انجام شده است(10). اگر چه برای بعضی از این آنتیبادیها برای مثال برای anti-HAV حداقل سطح حفاظتی در فارماکوپه تعریف شده است، اما تعیین آن برای کلیه آنتیبادیها امکانپذیر نمیباشد. به همین دلیل پایش آنتیبادیهای خاص در فرآوردههای ایمونوگلوبولینی برای تدوین گایدلاین مناسب در سیاستگزاریهای درمانی و به صورت ارزیابی دورهای توصیه گردیده است(11).
در 50 سـال گذشتـه، کاهـش قابـل توجهـی در شیـوع
عفونت هپاتیت A در دنیا مشاهده شده است. مطالعهای در
اروپا(اتریش، آلمان و جمهوری چک) نشان داد که این کاهش در حال حاضر نیز ادامه دارد، به طوری که anti-HAV بیش از یک سوم در پلاسمای انسان کاهش یافته است (6). در سال 2016، سطح تیتر آنتیبادی علیه ویروسهای هپاتیت A و B در محصولات ایمونوگلوبولینی تولید شده در کره ارزیابی و سطح تیتر آنتیبادیها با محصولات تولید شده در ایالات متحده و ژاپن مقایسه گردید. نتایج این مطالعه نشان داد که سطح آنتیبادیهای anti-HAV در کره و ایالات متحده آمریکا در مقایسه با ژاپن بالاتر است. با این حال، حداقل سطح حفاظتی mIU/mL 20 در همه محصولات از هر سه کشور موجود بود (11). مطالعه اخیر بر روی محصولات حاصل از پلاسمای ایرانی نشان داد که این محصولات دارای سطح بالاتری ازanti-HAV در مقایسه با محصولات کرهای بوده و این تفاوت برابر با (mIU/mL) 43943-32665 در محصول ایرانی در مقابل (mIU/mL) 4489-7154 در محصول کرهای با CI 95% بوده است.
پس از عفونت با HAV، تیتر آنتیبادی در سرم 3 تا 30 برابر بیشتر از میزان مشاهده شده توسط واکسیناسیون HAV افزایش مییابد. حد آستانه میزان آنتیبادی پس از عفونت mIU/mL 11400 و پس از واکسیناسیون mIU/mL 404 گزارش شده است. بنابراین بهبود و گسترش واکسیناسیون عمومی در بسیاری از کشورها دلیل اصلی کاهش تیتر آنتیبادی در پلاسما میباشد(12).
فارست و همکاران نشان دادهاند که در نتیجه کاهش anti-HAV در پلاسمای اروپایی(24%) و در ایالات متحده آمریکا(41%)، از سال 2003 تا 2007، تیتر آنتیبادی در محصولات IVIG نیز کاهش یافته است. بر این اساس، تفاوت تیتر anti-HAV در محصولات اروپایی به میزان mIU/mL 680 ± 22910 نسبت به محصولات آمریکایی mIU/mL 480 ± 14600 معنادار بوده است. این تفاوت را میتوان در نتیجه استراتژیهای مختلف واکسیناسیون در آن مناطق توصیف کرد. در ایالات متحده، واکسیناسیون به طور معمول در دوران کودکی انجام میشود در حالی که در اروپا واکسیناسیون به میزان کمتری ارائه میشود که منجر به بروز طبیعی عفونت HAV میگردد(6). مقدار بالاتر آنتیHAV در محصولات مشتق از پلاسمای ایرانی را میتوان به عنوان پیامد عفونت طبیعی مکرر در اهداکنندگان ایرانی توصیف کرد.
همچنین در این مطالعه مشخص شد که میانگین تیتر anti-HAV در پلاسمای بازیافتی به طور معناداری بیشتر از پلاسمای منبع، mIU/mL 53174 در مقایسه با mIU/mL 30572 بوده است. پلاسمای منبع معمولاً از افراد جوان اهداکننده پلاسما به دست میآید که شانس کمتری برای آلوده شدن و یا در معرض قرار گرفتن قبلی با عفونت HAV داشتهاند. به عبارت دیگر افراد در طیف سنی جوانتر در مقایسه با اهداکنندگان پلاسمای بازیافتی، مواجهه کمتر با عفونت داشته و به این صورت مقادیر بالاتر anti-HAV در پلاسمای بازیافتی قابل توضیح میباشد. اما با توجه به طیف گسترده اهداکنندگان، رنج وسیع فاصله بین حداقل و حداکثر تیتر در هر دو گروه پلاسمای بازیافتی و منبع ملاحظه میگردد.
تاکنون هیچ الزامی برای سطح آنتیبادیهای HAV در فارماکوپه در مورد فرآورده IVIG تعیین نشده است. با این حال مقامات ذیصلاح تیتر آنتیبادی بیش از mIU/mL10 را در هر محصول جدید پیشنهاد میکنند، اگر چه که نمیتوان به راحتی این سطح را در هر بچ تولید حفظ کرد(13). به همین دلیل هم اندازهگیری و پایش مداوم تیتر آنتیبادیهای خاص در محصولات مختلف ایمونوگلوبولین ضروری است(12).
باید این نکته را مد نظر قرار داد که فرآیند تولید محصولات ایمونوگلوبولین نیز میتواند بر تیتر آنتیبادی محصول نهایی تأثیر بگذارد. محصولات ایمونوگلوبولینی تولید شده از پلاسمای ایرانی حاوی تیتر 1000 برابر بالاتر از حداقل سطح ضروری برای ممانعت از ایجاد عفونت توسط HAV است(6).
در مطالعه حاضر تیتر anti-HBs در محصول IVIG در پلاسمای بازیافتی کمتر از پلاسمای منبع بوده است، اگر چه این تفاوت با p value کمتر از 05/0 معنادار نبود. این موضوع به علت واکسیناسیون کشوری هپاتیت B از سال 1994 برای نوزادان قابل توجیه است، چرا که اهداکنندگان پلاسمای منبع اغلب از افراد جوان جامعه میباشند که واکسیناسیون هپاتیت B بر روی آنها انجام گرفته است و به همین دلیل HBs Ab در پلاسمای آنها نسبت به افراد واکسینه نشده تیتر بالاتری را نشان میدهد. مطالعهها نشان داده است که تیتر anti-HBs در محصولات مختلف ایمونوگلوبولین بسته به منشا تولید محصولات متفاوت بوده است. محصولات ساخت ایالات متحده در مقایسه با فرآوردههای ساخت کره تیتر بالاتری را نشان داده است. با این حال و با وجود کاهش تیتر در محصولات کشور کره حتی نسبت به مطالعههای پیشین، محصولات هم در کشور کره و هم در آمریکا غلظت مناسب anti-HBs و در حد بالاتر از حداقل سطح حفاظتی(minimal protective level)، به میزان mIU/mL10 را داشته است. این موضوع عمدتاً به استراتژیهای مختلف ملی ایمنسازی در این کشورها مرتبط است، در کشور آمریکا و کره واکسیناسیون روتین از سال 1991 آغاز شده است. هر چند وقوع طبیعی عفونتهای مختلف، ایمنیزایی واکسنها و دیگر عوامل نیز میتواند در محصولات هر کشور تاثیرگذار باشد(11).
حداقل تیتر آنتیبادی برعلیه هپاتیت B برای محصول IVIG در فارماکوپه اروپا برابر با IU/g IgG5/0 تعیین شده است(3).
مقادیر آنتیبادی در محصولات ایمونوگلوبولین تهیه شده از پلاسمای ایرانی تیتر بسیار بالاتری را نسبت به مطالعه انجام گرفته توسط سویانگ و همکارانش نشان داده است. در مطالعه سویانگ تیتر anti-HBs در محصولات کره بین mIU/mL 965-438 و در محصولات ژاپن بین mIU/mL 157-123 و در محصول مشابه امریکایی mIU/mL 1945 گزارش شده بود. بنابراین میانگین تیتر مشاهده شده mIU/mL 2487 در مطالعه اخیر و در محصول به دست آمده از پلاسمای ایرانی به طور قابل ملاحظهای بیشتر از مطالعه سویانگ میباشد.
نتایج بهدستآمده نشاندهنده وضعیت ایمنی هزاران اهداکننده خون سالم است و بنابراین میتواند ابزار ارزشمندی برای مطالعههای سرواپیدمیولوژیک باشد. میزان بروز عفونتهای HBV و HAV در کشورهای توسعه یافته در مقایسه با کشورهای در حال توسعه کمتر است. البته این نکته حائز اهمیت است که عفونت HAV وابستگی زیادی به وضعیت اجتماعی و اقتصادی جامعه دارد، در حالی که ابتلا به HBV از طریق خون، سمن و یا انتقال پریناتال از مادر آلوده به نوزاد صورت میگیرد و به همین دلیل تیتر آنتیبادی در کشورهای توسعه یافته کمتر از کشورهای در حال توسعه است. اگرچه واکسیناسیون گسترده نقش مهمی در پیشگیری از عفونت ایفا میکند، اما توجه به این نکته مهم است که بدون مواجهه طبیعی و یا واکسیناسیون بدون پاسخهای یادآور تقویتکننده، تیتر آنتیبادی به تدریج کاهش مییابد(11).
تمام محصولات IVIG به دست آمده از پلاسمای ایرانی، Anti-HBC ، Anti-HEV ، Anti-HGV مثبت بودند. در مورد عفونت ویروسی هپاتیت E و در مطالعه آنکورن ، 10 محصول مختلف از ایمونوگلوبولین مورد بررسی قرار گرفت که همه آنها سطح مناسبی از anti-HEV داشته و قادر به خنثیکردن آنتیژنهای HEV بودند(14). در همین راستا مطالعههای سالهای اخیر در نقاط مختلف ایران، عفونت ویروسی هپاتیت E را به صورت اندمیک و با شیوع سرمی HEV 10% نشان داده است که این میزان در ایران مشابه عربستان سعودی، کمتر از کشورهای آسیای جنوبی و بیشتر از کشورهای اروپایی بوده است(16، 15)، به طوری که وجود anti-HEV در تمام محصولات کمک به سلامت اولیه کرده و از ایجاد عفونت در بیماران دارای نقص سیستم ایمنی جلوگیری میکند. در مورد عفونت ویروسی هپاتیت G بر اساس مطالعه امینی و همکاران، HGV یک ویروس شایع در ایران است و در 8/4% اهداکنندگان HGV RNA گزارش شده است(17). بنابراین همان طور که قابل پیشبینی هم بود در کلیه محصولات IVIG تهیه شده از پلاسمای ایرانی anti-HGV و نیز anti-HEV مثبت گزارش گردید، در حالی که anti-HDV در کلیه محصولات منفی بود.
نتیجهگیری
علیرغم روند رو به کاهش شیوع عفونتهای هپاتیت ویروسی(A & B) در دنیا و نگرانی ناشی از احتمال تاثیر این میزان کاهش در فرآوردههای ایمونوگلوبولینی از نظر تامین سطوح حفاظتی آنتیبادی در بیماران، این مطالعه نشان داد تیتر آنتیبادی موجود در محصولات تهیه شده از پلاسمای ایرانی برای درمانهای جایگزینی مناسب میباشد. در واقع تیتر این آنتیبادیها بر علیه ویروس هپاتیت A و یا B ، نه تنها برای درمانهای جایگزینی کافی به نظر میرسد، بلکه از مقادیر ذکر شده در مطالعههای اروپا و آمریکا بالاتر نیز بوده است. بنابراین دو نکته اساسی در این مطالعه قابل استنتاج میباشد. اول این که تیتر متفاوت آنتیبادیها در انواع مختلف پلاسما(پلاسمای بازیافتی و یا پلاسمای منبع) میتواند در برنامهریزیهای استراتژیک پلاسمایی مد نظر قرار گیرد. دوم این که تیتر آنتیبادیها بر علیه هپاتیت B و A از تیترهای موجود در مطالعههای انجام گرفته در دنیا بسیار بالاتر بوده است. بنابراین از آن جایی که برای تهیه مشتقات پلاسمایی، پلاسما بدون هیچگونه غربالگری اولیه مورد استفاده قرار گرفته است، در صورتی که هدف تهیه محصولات ایمونوگلوبولینی هیپرایمیون باشد، غربالگری اولیه و انتخاب افراد با تیتر آنتیبادی بالا، برای تولید محصولات اختصاصی و هیپرایمیون پیشنهاد میگردد.
تشکر و قدردانی
این پروژه تحقیقاتی توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تأمین مالی شده است. همچنین بدین وسیله از شرکت پالایش و پژوهش خون برای اهدای ویالهای IVIG تهیه شده از پلاسمای بازیافتی و از شرکت درمان آرا برای اهدای ویالهای IVIG تهیه شده از پلاسمای منبع، تشکر و قدردانی میشود.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ويروس شناسي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |





