جلد 20، شماره 1 - ( بهار 1402 )
جلد 20 شماره 1 صفحات 33-28 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Abedini K, Yari F, Milani S. Investigating the solubilization conditions of packed red blood cells to obtain Duffy a antigen in the laboratory. bloodj 2023; 20 (1) :28-33
URL: http://bloodjournal.ir/article-1-1464-fa.html
URL: http://bloodjournal.ir/article-1-1464-fa.html
عابدینی کوثر، یاری فاطمه، میلانی سعیده. شرایط محلولسازی گلبول قرمز متراکم جهت دستیابی به آنتیژن Duffy a در آزمایشگاه. فصلنامه پژوهشی خون. 1402; 20 (1) :28-33
استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 393 kb]
(774 دریافت)
| چکیده (HTML) (1717 مشاهده)
مقدمه
یکی از آنتیژنهای مهم از نظر بالینی پس از ABO و Rh، آنتیژن Duffy میباشد. این آنتیژن در سال 1950 شناسایی شد. آنتیژن Duffy دارای زیر گروههای مختلف است که هر کدام به نوبه خود دارای اهمیت بالینی میباشند(1). گزارشهای متعددی مبنی بر ایجاد آنمی همولیتیک نوزادان(HDN) و ایجاد ناسازگاری حین انتقال خون به واسطه آنتیژن Duffy در مقالات مختلف ذکر شده است و شناسایی آنتیبادی علیه این آنتیژن اهمیت به سزایی در طی چرخه انتقال خون دارد(2).
خالصسازی آنتیژن از غشای گلبولهای قرمز نیاز به محلولسازی دارد و برای این منظور میتوان از مواد دترژانت کمک گرفت. حل شدن غشاهای بیولوژیکی توسط مواد دترژانت سالها است که مورد بررسی قرار گرفته است. دترژانتها ترکیباتی هستند که پروتئینها و لیپیدهای غشایی را حل میکنند و منجر به تخریب غشای سلولی در غلظتهای مناسب میشوند. با توجه به ویژگیهای فیزیکی و شیمیایی آنها مانند بار و غلظت بحرانی میسل(CMC : Critical micelle Concentration) برهمکنشهای متفاوتی رخ میدهد و پروتئینهای غشایی دناتوره می شوند. در دهههای گذشته، دترژانتهای جدیدی برای بهبود حلالیت پروتئینهای غشایی طراحی شدهاند. دترژانتهای آمیدوسولفوبتائین zwitteronic ASB-14 و ASB-16 (آلکیل آمیدو پروپیل دیمتیل آمینو پروپانوسولفوناتهای خطی) با 14 و 16 اتم کربن در زنجیره آسیل از آن جمله میباشند.
مواد دترژانتی شامل تریتون X100 یا NP-40 (غیر یونی) و CHAPS (زوئیتریونیک) در زمانهای متمادی برای الکتروفورز دو بعدی استفاده شدهاند (3). از پرکاربردترین مواد دترژانت برای حل کردن غشاء سلولی، انواع غیر یونی آن شامل Triton X-100 و NP-40 میباشند. NP-40 به عنوان یک جزء در بافر لیز سلولی برای استخراج پروتئینهای غشاء سلولی به همراه مهارکنندههای پروتئازی استفاده میشود(4). لیز سلولهای منفرد برای تجزیه و تحلیل را میتوان با ابزارهای نوری، صوتی، مکانیکی، الکتریکی یا شیمیایی انجام داد که هر کدام نقاط قوت و ضعف مربوط به خود را دارند. انتخاب مناسبترین روش لیز به ویژگیهای مورد انتظار از پروتئین هدف و زمان لازم جهت دستیابی به آن بستگی دارد(5). در این مطالعه، فرآیند محلولسازی غشای گلبول قرمز به کمک دترژانت، صورت گرفت. سپس، آنتیژن Fya خالصسازی شده و بررسی ویژگی آن بـه وسیلـه روش ELISA انجام شد.
مواد و روشها
در این مطالعه تجربی، تهیه و حمل خون مطابق با دستورالعملهای سازمان بوده و در این رابطه، رضایتنامه اهداکنندگان مبنی بر مجوز استفاده پژوهشی توسط سازمان اخذ گردید. روش نمونهگیری بر مبنای انتخاب فرآورده گلبول قرمزکه بیانکننده آنتیژن Fya و فاقد Fyb بود، به صورت دسترسی آسان انجام شد.
آزمایش آگلوتیناسیون جهت بررسی ویژگی Fya در کیسه گلبول قرمز متراکم:
پس از تهیه کیسه خون، سوسپانسیون 5-2 درصد از گلبولهای قرمز کیسه واجد Fy ، تهیه و پس از 3 بار شست و شو، 100 میکرولیتر از آنتیبادی Fya و در لوله مجزا، 100 میکرولیتر از آنتیبادی Fyb (هر دو از شرکت آلمانی، ایمونودیاگنوستیکا)، به 50 میکرولیتر از سوسپانسیون سلولی کیسه گلبول قرمز متراکم اضافه و به مدت 30 دقیقه در بنماری 37 درجه سانتیگراد قرار داده شد. پس از 3 بار شست و شو، آنتیهیومن گلوبولین ریخته و پس از سانتریفوژ، با ذرهبین X10 مشاهده شد.
محلولسازی غشایRBC :
کیسه گلبول قرمز متراکم با گروه خونی O-، Fya+، Fyb- تهیه و پس از تایید ویژگی آن، به منظور محلولسازی از بافر حاوی EDTA و دترژانتNP-40 با فرمول:
25 mM Tris-HCL, 150 mM NaCL, 10 mM EDTA, 1.0% NP-40, pH 7.5 and 2 mM phenylmethylsulfonyl fluoride
استفاده شد، به این ترتیب که mL 140 از این بافر درون بشر ریخته شده و با گلبول قرمز متراکم به حجم mL 250 رسانیده شد(6). برای حذف پروتئازها، سریعاً مهارکننده پروتئازیPMSF به آن اضافه شد. سپس 2 ساعت با مگنت چرخید تا کاملاً لیز غشای RBC انجام شود. خون لیز شده را به درون لوله فالکون منتقل کرده، لولهها با دور g 1300 به مدت 15 دقیقه سانتریفوژ شدند. سپس محتوی رویی لولهها به کیسههای دیالیز با D 5000 Cut off منتقل شد. سر و ته کیسههای دیالیز بسته شده و درون بشر حاوی PBS قرار داده شده و با مگنت 2 ساعت چرخید، سپس دو بار دیگر دیالیز در PBS تازه ادامه یافت.
ساخت ستون Fya :
برای تهیه بافر کربنات بیکربنات به عنوان بافر کنژوگه، 4 میلیلیتر از محلول Na2CO3 ، 2/0 مولار با mL 46 از محلول NaHCO3 ، 2/0 مولار مخلوط و به حجم 100 میلی لیتر رسانیده شد. 500 میلیگرم از پودر ژل سفاروز فعال شده با سیانوژن بروماید(سیگما، آمریکا) با بافر کنژوگه، متورم شده و حدود 3 ساعت روی روتاتور قرار داده شد. سیانوژن موجود در ژل نیاز به جفت الکترون آزاد دارد. لذا گروه آمین آنتیبادی به آن متصل میشود. پس از خارج کردن محلول رویی ژل، 60 میکروگرم آنتیبادی اضافه و 2 ساعت روی روتاتور قرار داده شد.
قبل از انتقال ژل به ستون، ابتدا یک دور آن را سانتریفوژ کرده و محلول رویی حاوی آنتیبادی اضافی، جدا شد. جذب نوری محلول رویی خوانش شد. سپس روی ژل، بافر فسفات(PBS) اضافه و به آرامی به ستون منتقل شد. در ادامه، روی ستون PBS اضافه شد تا nm 280 OD خروجی برابر صفر شود. سپس گلایسین 2/0 مولار از ستون عبور داده شد تا اتصالات سست گسسته شود. در ادامه جهت جلوگیری از اتصال پروتئینهای غیر اختصاصی، ظرفیتهای خالی با مولکولهای آمیندار کوچک پر شد. به این منظور، دیاتانول آمین mL/L 4/3 در ساختار بافر کنژوگه به ستون اضافه شد. پس از شستشوی ژل با بافر فسفات، پروتئینهای حاصل از گلبولهای قرمز پس از محلولسازی و دیالیز، 10 برابر رقیق شده و از ستون عبور داده شدند. سپس شست و شو با PBS انجام شد به گونهای که nm 280 OD محلول خروجی برابر صفر شد. سپس جداسازی آنتیژن متصل شده به ستون با استفاده از محلول گلایسین 1/0 مولار و 8/2 pH انجام شد.
انجام سنجش ELISA :
پروتئین خالص شده در غلظت µg/mL10 و حجم 50 میکرولیتر، در چاهکهای پلیت ELISA کوت شد. در یک ردیف، به جای آنتیژن در coating از بافر فسفات استفاده شد. پس از خالی کردن پلیت، جهت Blocking ، 100 میکرولیتر محلول آلبومین گاوی 2 درصد، اضافه و به مدت 24 ساعت انکوبه شد. آلبومین فضاهای خالی را پر میکند تا از چسبیدن غیر اختصاصی پروتئینهای لایه بعدی، ممانعت به عمل آید. در هر چاهک پلیت ELISA که آنتیژن خالص شده coat شده بود، µL 50 آنتیبادی اختصاصی اضافه شد. آنتی Fya (ایونودیاگنوستیکا) و آنتی Fyb تجاری (ایمونودیاگنوستیکا) به چاهکها اضافه شد. پس از 35 دقیقه انکوباسیون در دمای 37 درجه سانتیگراد و تخلیه چاهکها، شست و شو انجام و µL 50 آنتیبادی(آنتیهیومن گلوبولین) کنژوگه با HRP اضافه شد. پس از 35 دقیقه انکوباسیون، شستشو انجام و سوبسترا TMB اضافه و حدود 10 دقیقه زمان داده شد، سپس µL 25 محلول stop اضافه شد. در نهایت جذب نوری محصول حاصل با دستگاه الایزا ریدر در طول موج 450 نانومتر قرائت شد.
یافتهها
نتایج حاصل از آزمایش آگلوتیناسیون جهت بررسی ویژگی Fya در کیسه خون(گلبول قرمز متراکم):
مطابق روش توضیح داده شده در قسمت روش کار، نتیجه
جدول 1: نتیجه آزمایش الایزا جهت بررسی ویژگی آنتیژن خالص شده، نشاندهنده واکنشدهی آنتیژن مورد نظر با آنتیبادی ضد Fya و عدم واکنشدهی آن با آنتی Fyb میباشد.
* CV=coefficient of variation (SD/mean×100)، بیانگر ضریب تغییرات بوده و میزان تکرارپذیری آزمایش را نشان میدهد و مقدار ایده آل آن 10% و کمتر است. در این مورد، چون تنها مقادیر OD استفاده شده است و نه غلظت، و مقدار OD با اعداد کوچک سرو کار دارد، CV در یک مورد بالاتر از 10، به دست آمده است.
** لازم به ذکر است که مقادیر جذب نوری 197/0 که برای Fyb به دست آمده است نزدیک به رنگ زمینه میباشد و به نظر میرسد که اتصال اختصاصی را نشان نمیدهد زیرا نمونه مورد نظر از کیسه خون فاقد Fyb به دست آمده است.
آزمایش آگلوتیناسیون، با به کارگیری آنتیبادیهای ضد Fya و Fyb ، به ترتیب مثبت و منفی شد که بیانگر ویژگی Fya+ بودن کیسه خون مصرفی بود.
نتایج حاصل از تعیین ویژگی آنتیژن توسط آزمایش الایزا :
جهت تعیین ویژگی آنتیژن به دست آمده از روش الایزا و خوانش نتیجه، از دستگاه الایزا ریدر استفاده شده است(جدول 1).
بحث
در این مطالعه، محلولسازی غشاء گلبول قرمز به کمک دترژانت غیر یونی NP-40 صورت گرفت. برای این منظور، از کیسههای خون کامل Fya+ استفاده شد. در ادامه، خالصسازی آنتیژن Fya با استفاده از روش کروماتوگرافی تمایلی انجام شد. ویژگی آنتیژن به دست آمده، بررسی و تایید شد. حل شدن غشاهای بیولوژیکی توسط مواد دترژانت یکی از روشهای معمول جهت دستیابی به پروتئینهای غشایی مانند Fya است. در این رابطه، تاثیر دترژانت و ترکیب لیپیدی مشخص شده است(7). دترژانت غیر یونی NP-40 منجر به تخریب غشای سلولی در غلظت مناسب میشود. در سال 2002، پرت و همکاران نیز مشابه این مطالعه، در دو مطالعه مستقل، از دترژانتهای غیر یونی جهت محلولسازی غشای RBC استفاده کردند با این تفاوت که نوع دترژانت غیر یونی که آنها به کار بردند، در یک مطالعه، از خانواده پلیاکسیاتیلن آلکیل اتر و در مطالعه دیگر، Triton X-100 بود در حالی که در این مطالعه از NP-40 استفاده شد(9، 8).
خالصسازی آنتیژنهای گروه خونی به روشهای مختلفی قابل انجام است. کروماتوگرافی تمایلی، پر کاربردترین روش جداسازی برای خالصسازی و بازیابی بیومولکولهای بسیار ارزشمند است. علاوه بر نوع ماتریس مورد استفاده، عنصر مهم دیگری که بر عملکرد کروماتوگرافی تمایلی تأثیر میگذارد، لیگاند میل ترکیبی است، که مولکولی است که باید به صورت کووالانت به سطح ماتریس متصل شود و در طول فرآیند پایدار باشد. در این مطالعه، از لیگاند آنتیبادی اختصاصی جهت جداسازی آنتیژن Fy استفاده شد که با مطالعه داکور و همکاران هم راستا میباشد. آنها نیز از لیگاند آنتیبادی مونوکلونال جهت جداسازی آنتیژنهای گروه خونی Lea و Leb استفاده نمودند(10).
استفـاده از کـروماتوگرافی تمایلـی در رابطه با گروههای
خونی همواره جهت خالصسازی آنتیژن صورت نگرفته است. بر خلاف مطالعه حاضر که جداسازی یک آنتیژن گروه خونی را هدف قرار داده است، گربر و همکاران در تهیه IVIG ، یک مرحله کروماتوگرافی تمایلی گنجانیدند تا با به کارگیری آنتیژنهای سنتتیک(اولیگوساکارید های خالص) و تثبیت آنها، منجر به کاهش آنتیبادی ضد گروههای خونی A و B (ایزوآگلوتینینها) در محصول IVIG و کاهش احتمال همولیز به دنبال مصرف دارو شوند(11). تورس و همکاران بر خلاف مطالعه حاضر که از آنتیبادی اختصاصی ضد یک آنتیژن گروه خونی استفاده نموده است، به وسیله روش کروماتوگرافی تمایلی با استفاده از یک لکتین مربوط به حلزون “Helix pomatia”، اقدام به خالصسازی گلیکو لیپیدهای گروه A ، نمودهاند(12).
جهت تشخیص ویژگی آنتیژن خالص شـده Fya در ایـن
مطالعه، از روش الایزا استفاده شد. سوده ساکی و همکاران در تشخیص آنتیبادی بر علیه گروههای خونی A,B,M,N ،
از روش مشابهی استفاده نمودند. آنها آنتیژن را به صورت غشاهای اریتروسیتی کوت کردند در حالی که در این مطالعه، اختصاصیتر عمل شده و آنتیژن خالص شده کوت شد(13).
نتیجهگیری
تحقیق حاضر نشان داد جهت دستیابی به آنتیژن Fya، محلولسازی غشای گلبول قرمز با استفاده از دترژانت غیر یونی Nonidet P-40، و به کارگیری آنتیبادی تثبیت شده قابل انجام بوده و میتوان در مطالعههای آتی، از آنتیژن به دست آمده، در زمینههای مختلف از جمله ایمنیزایی و تولید آنتیبادی بهره برد.
تشکر و قدردانی
این مقاله حاصل پایاننامه کارشناسی ارشد با کد اخلاق IR.TMI.REC.1400.004 در مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدینوسیله نویسندگان مراتب تشکر خود را از همکاری مؤسسه اعلام میدارند.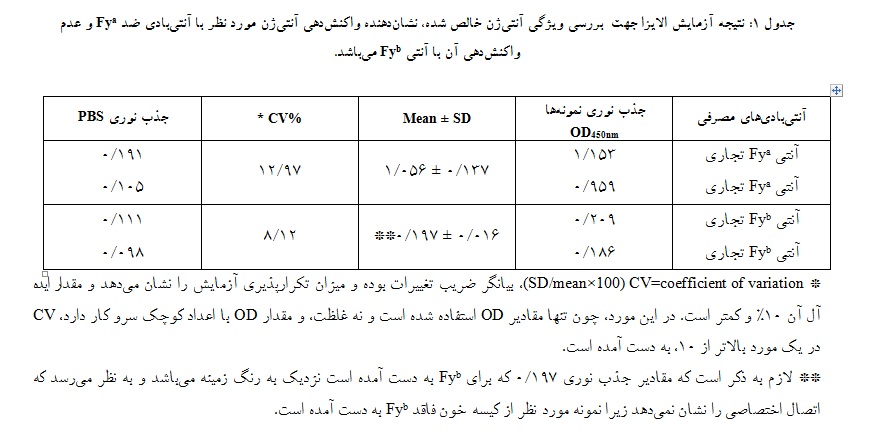
متن کامل: (1190 مشاهده)
شرایط محلولسازی گلبول قرمز متراکم جهت دستیابی به آنتیژن Duffy a
در آزمایشگاه
کوثر عابدینی1، فاطمه یاری2، سعیده میلانی3
چکیده
سابقه و هدف
یکی از آنتیژنهای فرعی گروه خونی،Duffy میباشد که شامل زیرگروههای مختلف است. سیستم گروه خونی Duffy ، از نظر انتقال خون، از اهمیت بالینی برخوردار است، لذا شناسایی دقیق این آنتیژن اهمیت به سزایی دارد. دراین مطالعه، فرآیند محلولسازی غشای گلبول قرمز و خالصسازی آنتیژن بررسی شد.
مواد و روشها
در این مطالعه تجربی، کیسه گلبول قرمز متراکم با ویژگی O- و Fya+ از پایگاه انتقال خون استان تهران، تهیه شده و با به کارگیری دترژانت Nonidet P-40، اقدام به محلولسازی غشای آنها شد. در مرحله بعد، آنتیژن Fya با استفاده از روش کروماتوگرافی تمایلی و به کارگیری آنتیبادی اختصاصی این آنتیژن خالصسازی شد. ویژگی پروتئین خالص شده با روشELISA بررسی شد.
یافتهها
ویژگی Fya+ در گلبولهای قرمز کیسه RBC با روش آگلوتیناسیون تایید شد. به علاوه، ویژگی آنتیژن تخلیص شده از کیسه یاد شده، با روش ELISA تایید شد. جذب نوریOD 450 nm آنتیژن تخلیص شده در روش ELISA با آنتیبادیهای Fya و Fyb، به ترتیب 137/0 ± 056/1 و 016/0 ± 197/0 (2 n=) بود.
نتیجه گیری
جهت دستیابی به آنتیژن Fya، محلولسازی غشای گلبول قرمز با استفاده از دترژانت غیر یونی Nonidet P-40، قابل انجام بوده و میتوان در مطالعههای بعدی از آنتیژن به دست آمده، در زمینههای مختلف از جمله ایمنیزایی و تولید آنتیبادی بهره برد.
کلمات کلیدی: کروماتوگرافی تمایلی، گلبول قرمز، سیستم گروه خونی دافی
تاریخ دریافت: 20/06/1401
تاریخ پذیرش: 07/08/1401
1- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- نویسنده مسئول: PhD ایمونولوژیـ استاد مرکز تحقیقات انتقال خونـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خونـ تهرانـ ایرانـ صندوق پستی: 1157-14665
3- PhD زیست فناوری پزشکی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
در آزمایشگاه
کوثر عابدینی1، فاطمه یاری2، سعیده میلانی3
چکیده
سابقه و هدف
یکی از آنتیژنهای فرعی گروه خونی،Duffy میباشد که شامل زیرگروههای مختلف است. سیستم گروه خونی Duffy ، از نظر انتقال خون، از اهمیت بالینی برخوردار است، لذا شناسایی دقیق این آنتیژن اهمیت به سزایی دارد. دراین مطالعه، فرآیند محلولسازی غشای گلبول قرمز و خالصسازی آنتیژن بررسی شد.
مواد و روشها
در این مطالعه تجربی، کیسه گلبول قرمز متراکم با ویژگی O- و Fya+ از پایگاه انتقال خون استان تهران، تهیه شده و با به کارگیری دترژانت Nonidet P-40، اقدام به محلولسازی غشای آنها شد. در مرحله بعد، آنتیژن Fya با استفاده از روش کروماتوگرافی تمایلی و به کارگیری آنتیبادی اختصاصی این آنتیژن خالصسازی شد. ویژگی پروتئین خالص شده با روشELISA بررسی شد.
یافتهها
ویژگی Fya+ در گلبولهای قرمز کیسه RBC با روش آگلوتیناسیون تایید شد. به علاوه، ویژگی آنتیژن تخلیص شده از کیسه یاد شده، با روش ELISA تایید شد. جذب نوریOD 450 nm آنتیژن تخلیص شده در روش ELISA با آنتیبادیهای Fya و Fyb، به ترتیب 137/0 ± 056/1 و 016/0 ± 197/0 (2 n=) بود.
نتیجه گیری
جهت دستیابی به آنتیژن Fya، محلولسازی غشای گلبول قرمز با استفاده از دترژانت غیر یونی Nonidet P-40، قابل انجام بوده و میتوان در مطالعههای بعدی از آنتیژن به دست آمده، در زمینههای مختلف از جمله ایمنیزایی و تولید آنتیبادی بهره برد.
کلمات کلیدی: کروماتوگرافی تمایلی، گلبول قرمز، سیستم گروه خونی دافی
تاریخ دریافت: 20/06/1401
تاریخ پذیرش: 07/08/1401
1- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- نویسنده مسئول: PhD ایمونولوژیـ استاد مرکز تحقیقات انتقال خونـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خونـ تهرانـ ایرانـ صندوق پستی: 1157-14665
3- PhD زیست فناوری پزشکی ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
یکی از آنتیژنهای مهم از نظر بالینی پس از ABO و Rh، آنتیژن Duffy میباشد. این آنتیژن در سال 1950 شناسایی شد. آنتیژن Duffy دارای زیر گروههای مختلف است که هر کدام به نوبه خود دارای اهمیت بالینی میباشند(1). گزارشهای متعددی مبنی بر ایجاد آنمی همولیتیک نوزادان(HDN) و ایجاد ناسازگاری حین انتقال خون به واسطه آنتیژن Duffy در مقالات مختلف ذکر شده است و شناسایی آنتیبادی علیه این آنتیژن اهمیت به سزایی در طی چرخه انتقال خون دارد(2).
خالصسازی آنتیژن از غشای گلبولهای قرمز نیاز به محلولسازی دارد و برای این منظور میتوان از مواد دترژانت کمک گرفت. حل شدن غشاهای بیولوژیکی توسط مواد دترژانت سالها است که مورد بررسی قرار گرفته است. دترژانتها ترکیباتی هستند که پروتئینها و لیپیدهای غشایی را حل میکنند و منجر به تخریب غشای سلولی در غلظتهای مناسب میشوند. با توجه به ویژگیهای فیزیکی و شیمیایی آنها مانند بار و غلظت بحرانی میسل(CMC : Critical micelle Concentration) برهمکنشهای متفاوتی رخ میدهد و پروتئینهای غشایی دناتوره می شوند. در دهههای گذشته، دترژانتهای جدیدی برای بهبود حلالیت پروتئینهای غشایی طراحی شدهاند. دترژانتهای آمیدوسولفوبتائین zwitteronic ASB-14 و ASB-16 (آلکیل آمیدو پروپیل دیمتیل آمینو پروپانوسولفوناتهای خطی) با 14 و 16 اتم کربن در زنجیره آسیل از آن جمله میباشند.
مواد دترژانتی شامل تریتون X100 یا NP-40 (غیر یونی) و CHAPS (زوئیتریونیک) در زمانهای متمادی برای الکتروفورز دو بعدی استفاده شدهاند (3). از پرکاربردترین مواد دترژانت برای حل کردن غشاء سلولی، انواع غیر یونی آن شامل Triton X-100 و NP-40 میباشند. NP-40 به عنوان یک جزء در بافر لیز سلولی برای استخراج پروتئینهای غشاء سلولی به همراه مهارکنندههای پروتئازی استفاده میشود(4). لیز سلولهای منفرد برای تجزیه و تحلیل را میتوان با ابزارهای نوری، صوتی، مکانیکی، الکتریکی یا شیمیایی انجام داد که هر کدام نقاط قوت و ضعف مربوط به خود را دارند. انتخاب مناسبترین روش لیز به ویژگیهای مورد انتظار از پروتئین هدف و زمان لازم جهت دستیابی به آن بستگی دارد(5). در این مطالعه، فرآیند محلولسازی غشای گلبول قرمز به کمک دترژانت، صورت گرفت. سپس، آنتیژن Fya خالصسازی شده و بررسی ویژگی آن بـه وسیلـه روش ELISA انجام شد.
مواد و روشها
در این مطالعه تجربی، تهیه و حمل خون مطابق با دستورالعملهای سازمان بوده و در این رابطه، رضایتنامه اهداکنندگان مبنی بر مجوز استفاده پژوهشی توسط سازمان اخذ گردید. روش نمونهگیری بر مبنای انتخاب فرآورده گلبول قرمزکه بیانکننده آنتیژن Fya و فاقد Fyb بود، به صورت دسترسی آسان انجام شد.
آزمایش آگلوتیناسیون جهت بررسی ویژگی Fya در کیسه گلبول قرمز متراکم:
پس از تهیه کیسه خون، سوسپانسیون 5-2 درصد از گلبولهای قرمز کیسه واجد Fy ، تهیه و پس از 3 بار شست و شو، 100 میکرولیتر از آنتیبادی Fya و در لوله مجزا، 100 میکرولیتر از آنتیبادی Fyb (هر دو از شرکت آلمانی، ایمونودیاگنوستیکا)، به 50 میکرولیتر از سوسپانسیون سلولی کیسه گلبول قرمز متراکم اضافه و به مدت 30 دقیقه در بنماری 37 درجه سانتیگراد قرار داده شد. پس از 3 بار شست و شو، آنتیهیومن گلوبولین ریخته و پس از سانتریفوژ، با ذرهبین X10 مشاهده شد.
محلولسازی غشایRBC :
کیسه گلبول قرمز متراکم با گروه خونی O-، Fya+، Fyb- تهیه و پس از تایید ویژگی آن، به منظور محلولسازی از بافر حاوی EDTA و دترژانتNP-40 با فرمول:
25 mM Tris-HCL, 150 mM NaCL, 10 mM EDTA, 1.0% NP-40, pH 7.5 and 2 mM phenylmethylsulfonyl fluoride
استفاده شد، به این ترتیب که mL 140 از این بافر درون بشر ریخته شده و با گلبول قرمز متراکم به حجم mL 250 رسانیده شد(6). برای حذف پروتئازها، سریعاً مهارکننده پروتئازیPMSF به آن اضافه شد. سپس 2 ساعت با مگنت چرخید تا کاملاً لیز غشای RBC انجام شود. خون لیز شده را به درون لوله فالکون منتقل کرده، لولهها با دور g 1300 به مدت 15 دقیقه سانتریفوژ شدند. سپس محتوی رویی لولهها به کیسههای دیالیز با D 5000 Cut off منتقل شد. سر و ته کیسههای دیالیز بسته شده و درون بشر حاوی PBS قرار داده شده و با مگنت 2 ساعت چرخید، سپس دو بار دیگر دیالیز در PBS تازه ادامه یافت.
ساخت ستون Fya :
برای تهیه بافر کربنات بیکربنات به عنوان بافر کنژوگه، 4 میلیلیتر از محلول Na2CO3 ، 2/0 مولار با mL 46 از محلول NaHCO3 ، 2/0 مولار مخلوط و به حجم 100 میلی لیتر رسانیده شد. 500 میلیگرم از پودر ژل سفاروز فعال شده با سیانوژن بروماید(سیگما، آمریکا) با بافر کنژوگه، متورم شده و حدود 3 ساعت روی روتاتور قرار داده شد. سیانوژن موجود در ژل نیاز به جفت الکترون آزاد دارد. لذا گروه آمین آنتیبادی به آن متصل میشود. پس از خارج کردن محلول رویی ژل، 60 میکروگرم آنتیبادی اضافه و 2 ساعت روی روتاتور قرار داده شد.
قبل از انتقال ژل به ستون، ابتدا یک دور آن را سانتریفوژ کرده و محلول رویی حاوی آنتیبادی اضافی، جدا شد. جذب نوری محلول رویی خوانش شد. سپس روی ژل، بافر فسفات(PBS) اضافه و به آرامی به ستون منتقل شد. در ادامه، روی ستون PBS اضافه شد تا nm 280 OD خروجی برابر صفر شود. سپس گلایسین 2/0 مولار از ستون عبور داده شد تا اتصالات سست گسسته شود. در ادامه جهت جلوگیری از اتصال پروتئینهای غیر اختصاصی، ظرفیتهای خالی با مولکولهای آمیندار کوچک پر شد. به این منظور، دیاتانول آمین mL/L 4/3 در ساختار بافر کنژوگه به ستون اضافه شد. پس از شستشوی ژل با بافر فسفات، پروتئینهای حاصل از گلبولهای قرمز پس از محلولسازی و دیالیز، 10 برابر رقیق شده و از ستون عبور داده شدند. سپس شست و شو با PBS انجام شد به گونهای که nm 280 OD محلول خروجی برابر صفر شد. سپس جداسازی آنتیژن متصل شده به ستون با استفاده از محلول گلایسین 1/0 مولار و 8/2 pH انجام شد.
انجام سنجش ELISA :
پروتئین خالص شده در غلظت µg/mL10 و حجم 50 میکرولیتر، در چاهکهای پلیت ELISA کوت شد. در یک ردیف، به جای آنتیژن در coating از بافر فسفات استفاده شد. پس از خالی کردن پلیت، جهت Blocking ، 100 میکرولیتر محلول آلبومین گاوی 2 درصد، اضافه و به مدت 24 ساعت انکوبه شد. آلبومین فضاهای خالی را پر میکند تا از چسبیدن غیر اختصاصی پروتئینهای لایه بعدی، ممانعت به عمل آید. در هر چاهک پلیت ELISA که آنتیژن خالص شده coat شده بود، µL 50 آنتیبادی اختصاصی اضافه شد. آنتی Fya (ایونودیاگنوستیکا) و آنتی Fyb تجاری (ایمونودیاگنوستیکا) به چاهکها اضافه شد. پس از 35 دقیقه انکوباسیون در دمای 37 درجه سانتیگراد و تخلیه چاهکها، شست و شو انجام و µL 50 آنتیبادی(آنتیهیومن گلوبولین) کنژوگه با HRP اضافه شد. پس از 35 دقیقه انکوباسیون، شستشو انجام و سوبسترا TMB اضافه و حدود 10 دقیقه زمان داده شد، سپس µL 25 محلول stop اضافه شد. در نهایت جذب نوری محصول حاصل با دستگاه الایزا ریدر در طول موج 450 نانومتر قرائت شد.
یافتهها
نتایج حاصل از آزمایش آگلوتیناسیون جهت بررسی ویژگی Fya در کیسه خون(گلبول قرمز متراکم):
مطابق روش توضیح داده شده در قسمت روش کار، نتیجه
جدول 1: نتیجه آزمایش الایزا جهت بررسی ویژگی آنتیژن خالص شده، نشاندهنده واکنشدهی آنتیژن مورد نظر با آنتیبادی ضد Fya و عدم واکنشدهی آن با آنتی Fyb میباشد.
| آنتیبادیهای مصرفی | جذب نوری نمونهها OD450nm |
Mean ± SD | * CV% | جذب نوری PBS |
| آنتی Fya تجاری | 153/1 | 137/0 ± 056/1 | 97/12 | 191/0 |
| آنتی Fya تجاری | 959/0 | 105/0 | ||
| آنتی Fyb تجاری | 209/0 | 016/0 ± 197/0** | 12/8 | 111/0 |
| آنتی Fyb تجاری | 186/0 | 098/0 |
** لازم به ذکر است که مقادیر جذب نوری 197/0 که برای Fyb به دست آمده است نزدیک به رنگ زمینه میباشد و به نظر میرسد که اتصال اختصاصی را نشان نمیدهد زیرا نمونه مورد نظر از کیسه خون فاقد Fyb به دست آمده است.
نتایج حاصل از تعیین ویژگی آنتیژن توسط آزمایش الایزا :
جهت تعیین ویژگی آنتیژن به دست آمده از روش الایزا و خوانش نتیجه، از دستگاه الایزا ریدر استفاده شده است(جدول 1).
بحث
در این مطالعه، محلولسازی غشاء گلبول قرمز به کمک دترژانت غیر یونی NP-40 صورت گرفت. برای این منظور، از کیسههای خون کامل Fya+ استفاده شد. در ادامه، خالصسازی آنتیژن Fya با استفاده از روش کروماتوگرافی تمایلی انجام شد. ویژگی آنتیژن به دست آمده، بررسی و تایید شد. حل شدن غشاهای بیولوژیکی توسط مواد دترژانت یکی از روشهای معمول جهت دستیابی به پروتئینهای غشایی مانند Fya است. در این رابطه، تاثیر دترژانت و ترکیب لیپیدی مشخص شده است(7). دترژانت غیر یونی NP-40 منجر به تخریب غشای سلولی در غلظت مناسب میشود. در سال 2002، پرت و همکاران نیز مشابه این مطالعه، در دو مطالعه مستقل، از دترژانتهای غیر یونی جهت محلولسازی غشای RBC استفاده کردند با این تفاوت که نوع دترژانت غیر یونی که آنها به کار بردند، در یک مطالعه، از خانواده پلیاکسیاتیلن آلکیل اتر و در مطالعه دیگر، Triton X-100 بود در حالی که در این مطالعه از NP-40 استفاده شد(9، 8).
خالصسازی آنتیژنهای گروه خونی به روشهای مختلفی قابل انجام است. کروماتوگرافی تمایلی، پر کاربردترین روش جداسازی برای خالصسازی و بازیابی بیومولکولهای بسیار ارزشمند است. علاوه بر نوع ماتریس مورد استفاده، عنصر مهم دیگری که بر عملکرد کروماتوگرافی تمایلی تأثیر میگذارد، لیگاند میل ترکیبی است، که مولکولی است که باید به صورت کووالانت به سطح ماتریس متصل شود و در طول فرآیند پایدار باشد. در این مطالعه، از لیگاند آنتیبادی اختصاصی جهت جداسازی آنتیژن Fy استفاده شد که با مطالعه داکور و همکاران هم راستا میباشد. آنها نیز از لیگاند آنتیبادی مونوکلونال جهت جداسازی آنتیژنهای گروه خونی Lea و Leb استفاده نمودند(10).
استفـاده از کـروماتوگرافی تمایلـی در رابطه با گروههای
خونی همواره جهت خالصسازی آنتیژن صورت نگرفته است. بر خلاف مطالعه حاضر که جداسازی یک آنتیژن گروه خونی را هدف قرار داده است، گربر و همکاران در تهیه IVIG ، یک مرحله کروماتوگرافی تمایلی گنجانیدند تا با به کارگیری آنتیژنهای سنتتیک(اولیگوساکارید های خالص) و تثبیت آنها، منجر به کاهش آنتیبادی ضد گروههای خونی A و B (ایزوآگلوتینینها) در محصول IVIG و کاهش احتمال همولیز به دنبال مصرف دارو شوند(11). تورس و همکاران بر خلاف مطالعه حاضر که از آنتیبادی اختصاصی ضد یک آنتیژن گروه خونی استفاده نموده است، به وسیله روش کروماتوگرافی تمایلی با استفاده از یک لکتین مربوط به حلزون “Helix pomatia”، اقدام به خالصسازی گلیکو لیپیدهای گروه A ، نمودهاند(12).
جهت تشخیص ویژگی آنتیژن خالص شـده Fya در ایـن
مطالعه، از روش الایزا استفاده شد. سوده ساکی و همکاران در تشخیص آنتیبادی بر علیه گروههای خونی A,B,M,N ،
از روش مشابهی استفاده نمودند. آنها آنتیژن را به صورت غشاهای اریتروسیتی کوت کردند در حالی که در این مطالعه، اختصاصیتر عمل شده و آنتیژن خالص شده کوت شد(13).
نتیجهگیری
تحقیق حاضر نشان داد جهت دستیابی به آنتیژن Fya، محلولسازی غشای گلبول قرمز با استفاده از دترژانت غیر یونی Nonidet P-40، و به کارگیری آنتیبادی تثبیت شده قابل انجام بوده و میتوان در مطالعههای آتی، از آنتیژن به دست آمده، در زمینههای مختلف از جمله ایمنیزایی و تولید آنتیبادی بهره برد.
تشکر و قدردانی
این مقاله حاصل پایاننامه کارشناسی ارشد با کد اخلاق IR.TMI.REC.1400.004 در مؤسسه عالی آموزشی و پژوهشی طب انتقال خون میباشد. بدینوسیله نویسندگان مراتب تشکر خود را از همکاری مؤسسه اعلام میدارند.

نوع مطالعه: پژوهشي |
موضوع مقاله:
ايمونوهماتولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






