جلد 19، شماره 4 - ( زمستان 1401 )
جلد 19 شماره 4 صفحات 300-292 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shekeft M, Milani S, Sharifi Z, Oodi A. Establishment of lymphoblastoid cell line producing Anti-RhE antibody using alloimmune thalassemia patient's blood. bloodj 2022; 19 (4) :292-300
URL: http://bloodjournal.ir/article-1-1454-fa.html
URL: http://bloodjournal.ir/article-1-1454-fa.html
شکفت مهدی، میلانی سعیده، شریفی زهره، اودی آرزو. ایجاد رده سلولی لنفوبلاستوئید تولیدکننده Anti-RhE با استفاده از خون بیماران تالاسمی آلوایمیون. فصلنامه پژوهشی خون. 1401; 19 (4) :292-300
مهدی شکفت 
 ، سعیده میلانی*
، سعیده میلانی* 

 ، زهره شریفی
، زهره شریفی 

 ، آرزو اودی
، آرزو اودی 



 ، سعیده میلانی*
، سعیده میلانی* 

 ، زهره شریفی
، زهره شریفی 

 ، آرزو اودی
، آرزو اودی 


استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 396 kb]
(752 دریافت)
| چکیده (HTML) (1458 مشاهده)
مقدمه
امروزه از آنتیبادیهای مونوکلونال در تحقیقات، تشخیص و درمان بیماریها استفاده میشود. اولین گام در فرآیند تولید آنتیبادی مونوکلونال، ایمیونیزاسیون درست لنفوسیتهای B ، با آنتیژن مناسب میباشد(1). با توجه به طول عمر کوتاه و محدود لنفوسیتهای B گام بعدی نامیراسازی این سلولهای سیستم ایمنی بوده که با استفاده از روشهای مختلفی مانند استفاده از مواد شیمیایی کارسینوژن، فعالسازی تلومرازها، آلودگی سلولها با ویروسهای انکوژن مانند EBV و هیبریدیزاسیون با سلولهای سرطانی صورت میگیرد(2). EBV از خانواده هرپس ویروسها(Herpes virus) بوده و لنفوسیتهای B و سلولهای اپیتلیال را از طریق گیرنده خود که CD21 میباشد، آلوده میسازد(4، 3). در شرایط In vitro ، EBV با آلودهسازی لنفوسیتهای B ، ابتدا منجر به تغییر شکل سلولها و سپس منجر به ترانسفورماسیون، نامیرایی و تبدیل شدن آنها بهLymphoblastoid Cell Line (LCL) میگردد. در واقع LCL ها، سلولهای ترانسفرم شدهای هستند که دائماً در حال تقسیم و تولید آنتیبادی میباشند(5). به علت حضور همزمان لنفوسیتهای B و T در مرحله آلودهسازی با EBV ، لنفوسیتهای T سیتوتوکسیک نیز ایجاد شده که سبب از بین بردن لنفوسیتهای B میگردند؛ برای جلوگیری از وقوع این پدیده از سیکلوسپورین A استفاده میشود(6). تالاسمی یک بیماری ارثی هماتولوژیک ناشی از کاهش یا عدم ساخت زنجیرههای گلوبین مولکول هموگلوبین بوده که سبب عدم تعادل زنجیرههای گلوبین و در نهایت همولیز، اریتروپوئز غیر مؤثر و آنمی میگردد(7). امروزه تالاسمی به 2 گروه وابسته به تزریق خون و غیر وابسته به تزریق خون تقسیم میگردد که این تقسیمبندی مبتنی بر شدت علائم بالینی بیمار و نیازمندی آنها به تزریق خون برای بقا است(8). آلوایمیونیزاسیون طی تزریق فرآوردههای خونی و بارداری رخ میدهد و به عنوان یکی از مشکلات اصلی در بیماران نیازمند تزریق خون مداوم شناخته میشود که میتواند منجر به واکنشهای تأخیری و شدید همولیتیک ناشی از تزریق خون و همچنین بیماریهای همولیتیکی جنینی- نوزادی گردد(10، 9). سیستم گروه خونی Rh یکی از پلیمورفترین و ایمونوژنترین سیستمهای گروه خونی در انسان میباشد. 5 آنتیژن مهم در این سیستم شامل D ، C ، c ، E و e است(11). بر پایه مطالعههای انجام شده در ایران، شیوع آنتیژن E حدود 35-29 درصد میباشد(13، 12). Anti-RhE آنتیبادی، جزو شایعترین آنتیبادیها در بیماریهای همولیتیک جنینی است(14)؛ Anti-RhE آنتیبادی، شایعترین آلوآنتیبادی ناشی از تزریق خون میباشد که میتواند منجر به واکنشهای همولیتیک ناشی از تزریق خون گردد(15، 9).
با توجه به این که تزریق خونهای متعدد خطر آلوایمیونیزاسیون را افزایش میدهد، تعیین فنوتیپ گلبولهای قرمز گیرنده و دهنده خون برای یافتن خون مناسب با حداکثر سازگاری و کمترین عوارض امری ضروری میباشد که این امر اهمیت تولید مونوکلونال آنتیبادیها و استفاده از آنها را در بانک خون مشخص میکند(16). ایجاد آلوآنتیبادی ضد آنتیژن RhE که از ایمنیزایی بالایی برخوردار بوده، میتواند با بروز عوارض نامطلوب، توالی تزریق خون در بیماران را افزایش دهد. بنابراین هدف از این مطالعه، جداسازی لنفوسیتهای ایمن شده از بیماران تالاسمی آلوایمیون و ترانسفورم آنها با ویروس اپیشتاین بار جهت دستیابی به رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی ضد آنتیژن RhE بود.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود.
تهیه نمونه خون:
کـار بـر روی نمونـه خـون 3 بیمار مبتلا به تالاسمی و
دارای پاسخ آلوایمن علیه آنتیژن RhE شروع گردید. تمامی نمونههای خون بیماران تالاسمی از مرکز درمان تالاسمی ظفر پس از تصویب پروژه، تایید و دریافت کد اخلاق با شماره IR.TMI.REC.1399.016 در سازمان انتقال خون و به پیوست رضایتنامهای که از بیماران جهت انجام مطالعه پژوهشی اخذ شده است، دریافت گردید.
تهیه سوپ ویروسی:
سلولهای Marmoset B95-8 (در فاز رشد نمایی) از مرکز ذخایر ژنتیک خریداری شده و در محیط کامل RPMI1640 کشت داده شدند. 5-3 روز پس از کشت و زرد کردن کامل محیط کشت، مایع رویی برداشته و به مدت 7-5 دقیقه با دور rpm 1500 سانتریفوژ گردید. مایع رویی از فیلتر 2/0 میکرون عبور داده شد و در فریزر70- درجه سانتیگراد نگهداری گردید.
جداسازی و ترانسفورماسیون سلولهای تک هستهای خون محیطی:
سلولهای تک هستهای موجود در نمونه خون دریافتی با استفاده از گرادیان غلظتی فایکول جدا شدند؛ سپس به این سلولها سوپ ویروسی اضافه گردید و به مدت 4 ساعت در انکوباتور 37 درجه سانتیگراد دارای 5 درصد CO2 انکوبه شد. هر 15 دقیقه یک بار سلولها به آرامی مخلوط گردیدند. سپس سلول ها در پلیت 96 خانهای، به میزان 100 هزار سلول در هر چاهک تقسیم شده و به چاهکها محیط کشت کامل FBS %10 + RPMI حاوی سیکلوسپورین (µg/mL 1/0) اضافه گردید(6 چاهک برای هر بیمار)؛ پلیت در انکوباتور 37 درجه سانتیگراد دارای 5 درصد CO2 انکوبه شده و پس از 24 ساعت مایع رویی هر چاهک با محیط تازه حاوی سیکلوسپورین تعویض گردید. تشکیل سلولهای لنفوبلاستوئید در فواصل زمانی مختلف بعد از ترانسفورماسیون با میکروسکوپ معکوس بررسی گردید. 3-2 هفته بعد از کشت سلولهای مجاور شده با ویروس اپشتاین بار، آزمایش میکروهماگلوتیناسیون جهت تعیین اختصاصیت آنتیبادی و آزمایش الایزا جهت تایید تولید آنتیبادی انجام شد.
هماگلوتیناسیون:
وجود آنتیبادی اختصاصی علیه آنتیژن E در مایـع رویـی هـر چاهـک بـا انجـام آزمایـش میکرو هماگلوتیناسیون تایید شد. 50 میکرولیتر از مایعرویی هر چاهک به انتهای چاهک 96 خانهای U شکل اضافه شد و 25 میکرولیتر از سوسپانسیون 2%-1% گلبولهای قرمز E مثبت تهیه شده از سلولهای غربالگر به چاهکها اضافه گردید. سپس پلیت به مدت 45 دقیقه در 37 درجه سانتیگراد انکوبه شده و بعد از این مدت وجود آگلوتیناسیون به صورت ماکروسکوپی و میکروسکوپی بررسی گردید.
آزمایش الایزا:
جهت بررسی تولید آنتیبادی از پلیتهای کوت شده با آنتیهیومن گلوبولین در آزمایشگاه مونوکلونال سازمان انتقال خون استفاده شد. 50 میکرولیتر از مایعرویی چاهکهایی که آزمایش هماگلوتیناسیون آنها مثبت شد به پلیت کوت شده با آنتیهیومن اضافه گردید. در این آزمایش چاهک Non-coated به عنوان کنترل منفی الایزا در نظر گرفته شد. پلیت به مدت 40 دقیقه در انکوباتور 37 درجه سانتیگراد انکوبه گردید.
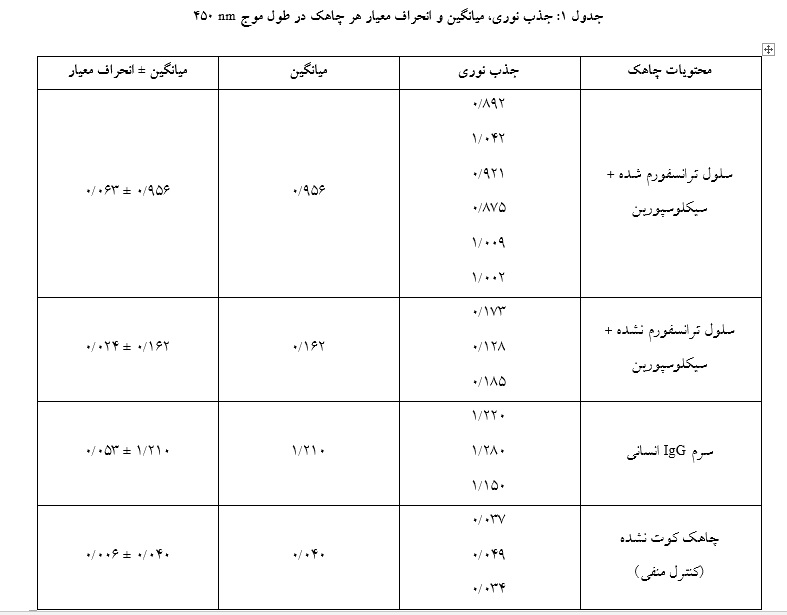
پس از سه بار شست و شو با بافر PBS-Tween ، 50 میکرولیتر از محلول کونژوگه Anti-Human HRP به هر چاهک افزوده شد و به مدت 40 دقیقه در انکوباتور 37 درجه سانتیگراد انکوبه گردید. بعد از سه بار شست و شو با بافر فسفات، به هر چاهک 50 میکرولیتر از محلول سوبسترای تترامتیل بنزیدین(TMB) افزوده شد و بعد از 20 دقیقه با افزودن 30 میکرولیتر محلول اسید واکنش متوقف شد. مقادیر جذب نوری به دسـت آمـده از نتـایج آزمـایش الایزا در جدول گردآوری شدند. سپـس محاسبه میزان میانگین و انحراف معیار و همچنین مقایسه نتایج با استفاده از R studio صورت گرفت.
یافتهها
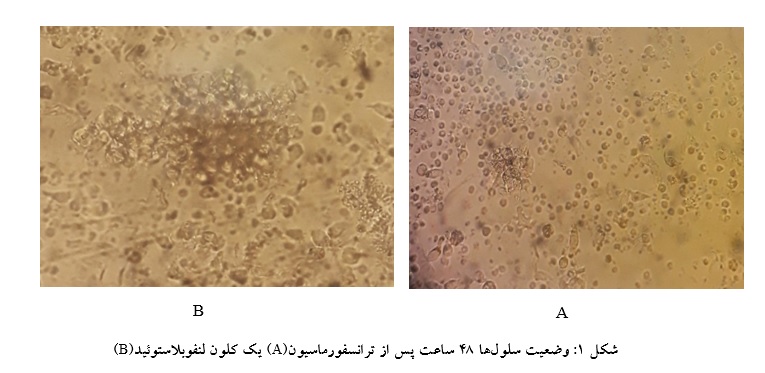
پس از مواجه سلولها با EBV ، تغییرات ظاهری در سلولها، از قبیل کشیدهتر شدن سلولها و تشکیل کلونهای کوچک پس از 48 ساعت مشاهده گردید. با گذشت زمان تعداد کلونها بیشتر شـده و افزایـش تعداد سلولها در هر
کلـون رؤیـت شـد. پـس از گـذشت 3-2 هفتــه، آزمایش هماگلوتیناسیون در پلیتهای U شکل انجام شد.
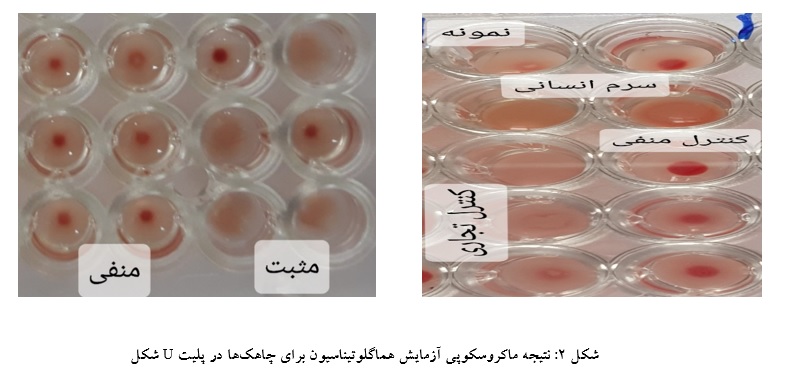
یک چاهک به عنوان کنترل منفی(سوپ رویی چاهک حاوی سلول ترانسفرم نشده) و 2 چاهک به عنوان کنترل مثبت(سرم بیماردارای Anti-E و کنترل تجاری Anti-E) در نظر گرفته شدند. 33% چاهکها دارای آزمایش هماگلوتیناسیون مثبت بودند. به عبارت دیگر آنتیبادی تولیدی توسط سلولهای موجود در چاهک توانایی هماگلوتیناسیون سوسپانسیون گلبولهای قرمز دارای آنتیژن E را داشت.
همچنین قدرت هماگلوتیناسیون آنتیبادی تولیدی برابر با قدرت هماگلوتیناسیون آنتیبادی تجاری Anti-E در رقت 10/1 بود. سوپ رویی چاهکهای مثبت در آزمایش هماگلوتیناسیون در میکروتیوبهای جداگانه جمعآوری گردید و جهت انجام آزمایش الایزا به آزمایشگاه مونوکلونال آنتیبادی سازمان انتقال خون انتقال داده شد. بعد از انجام مراحل الایزا، میزان جذب نوری چاهکها در طول موج nm 450 خوانده شد.
سلولهای ترانسفرم شده تولیدکننده آنتیبادی، در صورت عدم فیوژن با سلولهای میلومایی پس از 3 تا 4 هفته از ترانسفورماسیون به وسیله EBV ، میمیرند.
بحث
امروزه آنتیبادیهای مونوکلونال جایگاه ویژهای در علم پزشکی پیدا کردهاند و از آنها در فرآیندهای تشخیص و درمان بیماریها استفاده میشود. برای اولین بار از آنتیبادیهای مونوکلونال برای تشخیص گروههای خونی استفاده گردید و امروزه نیز یکی از کاربردهای اصلی این ترکیبات در ایمونوهماتولوژی میباشد که منجر به شناسایی و تعیین فنوتیپ گلبولهای قرمز و همچنین دریافت خون در بیماران نیازمند تزریق خون با حداکثر سازگاری میباشد.
با توجه به این که بیماران تالاسمی به دلیل تزریق خونهای مکرر عمدتاً دارای آلوآنتیبادی، به خصوص Anti-E میباشند، بنابراین سلولهای خون محیطی این افراد به طور طبیعی در محیط بدن ایمیونیزه شدهاند و نیازی به ایمیونیزاسیون این سلولها در In vitro نبوده و با نامیراسازی این سلولها به وسیله EBV و ایجاد رده سلولی لنفوبلاستوئید میتوان فرآیند تولید آنتیبادی مونوکلونال را تسریع کرد.
در این مطالعه، سلولهای تک هستهای موجود در خون محیطی بیماران تالاسمی آلوایمیون علیه آنتیژن RhE براساس گرادیان غلظتی فایکول جدا شدند و به وسیله EBV ترانسفورم گردیدند. به دلیل حضور لنفوسیتهای T سیتوتوکسیک در سلولهای جدا شده، از سیکلوسپورین به عنوان مهارکننده این سلولها استفاده شد. پس از 3-2 هفته با استفاده از آزمایش هماگلوتیناسیون حضور آنتیبادی مد نظر در چاهکها مورد ارزیابی قرار گرفت و برای چاهکهای مثبت در آزمایش هماگلوتیناسیون، جهت سنجش میزان کل آنتیبادی آزمایش الایزا صورت گرفت. میانگین جذب نوری این چاهکها (چاهکهای مثبت در آزمایش هماگلوتیناسیون) برابر با 956/0 بود که در مقایسه با میانگین جذب نوری چاهکهای کنترل(سلول ترانسفورم نشده) که 162/0 بود دارای تفاوت معنادارای بود(001/0 p<). مقایسه نتایج الایزا چاهکهای حاوی سلولهای ترانسفورم شده و ترانسفورم نشده و تشکیل کلون در چاهکهای حاوی سلولهای ترانسفورم شده، بیانگر عملکرد مناسب EBV و تولید آنتیبادی توسط سلولها بود. به نظر میرسد به دلیل استفاده از ویروسEBV در تولید این آنتیبادیها و امکان انتقال آن از راه دهان و بینی، بهتر است آنتیبادیهای تولیدی بدین روش ویروسزدایی شوند.
طوسیزاده و همکاران در سال 2017 در ایران با مطالعه و بررسی عوامل مؤثر دریافتند که در درمای 37 درجه سانتیگراد، 5%CO2 ، %20 FBS و محیط کشت RPMI ، نامیراسازی لنفوسیتها به خوبی رخ میدهد(17). این در حالی است که ما در مطالعه خود برخلاف مطالعه طوسیزاده از 10%FBS استفاده کرده و موفق به ایجاد سلولهایی نامیرا شدیم.
یوئن در سال 2011 در آمریکا، موفق به نامیراسازی لنفوسیتهای B خون محیطی با استفاده از EBV و تاکرولیموس(مهارکننده لنفوسیتهای T) گردیدند(18). ما در مطالعه خود از سیکلوسپورین به غلظت µg/mL 1/0 به عنوان جایگزین تاکرولیموس استفاده کرده و نتایجی مشابه به دست آوردیم.
فراسن و همکاران در سال 2010 سلولهای B خون محیطی را به روش FACS جدا کرده و با استفاده از EBV آنها را نامیرا ساختند؛ آنها همچنین در مطالعه خود به این نتیجه رسیدند که استفاده از PBMC در مقایسه با لنفوسیتهای B منجر به حصول نتیجه بهتری میگردد که این امر ممکن است به دلیل حضور سایر سلولها و کمک آنها به لنفوسیتهای B باشد(19). ما نیز در مطالعه خود سلولهای تک هستـهای مـوجود در خون محیطــی را جدا کرده و با استفاده از EBV موفق به ایجاد رده سلولی لنفوبلاستوئید شدیم که این یافته ما منطبق بر یافتههای فراسن و همکاران بود.
لمسکایا در سال 2017 روش نامیراسازی سلولها با EBV با کارآیی بالا را به کار بردند؛ آنها در این روش از 3 تا 5 میلیلیتر از خون محیطی به عنوان منبعی برای جداسازی لنفوسیتهای B و محیط کشت RPMI1640 بدون لایه تغذیهکننده استفاده کردند(2). ما نیز در پژوهش خود از 6-5 میلیلیتر از خون بیماران تالاسمی آلوایمیون به عنوان منبعی برای جداسازی PBMC استفاده کرده و نامیراسازی سلولها و ایجاد رده سلولی لنفوبلاستوئید را بدون استفاده از لایه تغذیهکننده انجام دادیم.
نتایج حاصل از این مطالعه بیانگر این موضوع میباشد که میتوان با استفاده از سلولهای تک هستهای خون محیطی بیماران تالاسمی آلوایمیون و EBV ، رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی ایجاد کرد.
نتیجهگیری
میتوان از حجم کمی از خون (6-5 میلیلیتر) بیماران تالاسمی آلوایمیون که لنفوسیتهای آنها به صورت طبیعی
در محیط بدن ایمیونیزه شدهاند به عنوان منبع سلولی بـرای ایجاد رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی به وسیله EBV استفاده نمود. آنتیبادی تولیدی توانایی شناسایی و آگلوتیناسیون گلبولهای قرمز را دارد.
تشکر و قدردانی
این مقاله حاصل پایاننامه دانشـجویی دوره کارشناسـی ارشد رشته هماتولوژی و طب انتقال خون در مؤسسه عالی آموزشــی و پژوهشــی طــب انتقــال خــون بــا کــد اخــلاق IR. TMI.REC.1399.016 میباشد. بودجه این مطالعه توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خـون تـأمین گردیده و همه مراحل عملی پروژه در آزمایشگاه آنتیبـادی مونوکلونال و ویروسشناسی انجام شده است.
متن کامل: (1339 مشاهده)
ایجاد رده سلولی لنفوبلاستوئید تولیدکننده Anti-RhE با استفاده از خون
بیماران تالاسمی آلوایمیون
مهدی شکفت1، سعیده میلانی2، زهره شریفی3، آرزو اودی4
چکیده
سابقه و هدف
یکی از کاربردهای ویروس اپشتاین بار در تحقیقات، نامیراسازی لنفوسیتهای B و ایجاد رده سلولی لنفوبلاستوئید میباشد. افراد مبتلا به تالاسمی معمولاً نیازمند تزریق خون هستند که عارضه اصلی آن آلوایمیونیزاسیون است. آنتیبادی علیه آنتیژن RhE سبب واکنشهای همولیتیک میگردد. هدف از این مطالعه، ایجاد رده سلولی لنفوبلاستوئید تولیدکننده آنتیE با استفاده از سلولهای تک هستهای خون محیطی بیماران تالاسمی آلوایمن علیه آنتیژن E در مواجهه با ویروس EBV بود.
مواد و روشها
در یک مطالعه تجربی، سلولهای تک هستهای 3 بیمار توسط فایکول جدا و با EBV مجاور گردید. سلولهای ترانسفرم شده در محیط کشت RPMIحاوی سیکلوسپورین کشت داده شدند. پس از 3-2 هفته، تشکیل کلون در چاهکها بررسی و آزمایش هماگلوتیناسیون برای چاهکها انجام شد؛ میزان کل آنتیبادی چاهکهای مثبت به روش الایزا اندازهگیری گردید.
یافتهها
مواجهه سلولهای تک هستهای بیماران با EBV منجر به ترانسفورم سلولها و ایجاد کلون در برخی از چاهکها گردید. نتایج هماگلوتیناسیون و الایزا نشان داد که کلونها قادر به تولید آنتیبادی ضد آنتیژن RhE هستند.
نتیجه گیری
میتوان با استفاده از سلولهای حساس شده بیماران تالاسمی علیه آنتیژن RhE و نامیراسازی آن به روش ترانسفورماسیون به کمک ویروس EBV ، رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی Anti-E ایجاد کرد.
کلمات کلیدی: آنتیبادیها، تالاسمی، آلوایمیونیزاسیون، EBV
تاریخ دریافت: 28/03/1401
تاریخ پذیرش: 05/06/1401
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: PhD زیست فناوری ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ کدپستی: 369-14665
3-PhD ویروس شناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
بیماران تالاسمی آلوایمیون
مهدی شکفت1، سعیده میلانی2، زهره شریفی3، آرزو اودی4
چکیده
سابقه و هدف
یکی از کاربردهای ویروس اپشتاین بار در تحقیقات، نامیراسازی لنفوسیتهای B و ایجاد رده سلولی لنفوبلاستوئید میباشد. افراد مبتلا به تالاسمی معمولاً نیازمند تزریق خون هستند که عارضه اصلی آن آلوایمیونیزاسیون است. آنتیبادی علیه آنتیژن RhE سبب واکنشهای همولیتیک میگردد. هدف از این مطالعه، ایجاد رده سلولی لنفوبلاستوئید تولیدکننده آنتیE با استفاده از سلولهای تک هستهای خون محیطی بیماران تالاسمی آلوایمن علیه آنتیژن E در مواجهه با ویروس EBV بود.
مواد و روشها
در یک مطالعه تجربی، سلولهای تک هستهای 3 بیمار توسط فایکول جدا و با EBV مجاور گردید. سلولهای ترانسفرم شده در محیط کشت RPMIحاوی سیکلوسپورین کشت داده شدند. پس از 3-2 هفته، تشکیل کلون در چاهکها بررسی و آزمایش هماگلوتیناسیون برای چاهکها انجام شد؛ میزان کل آنتیبادی چاهکهای مثبت به روش الایزا اندازهگیری گردید.
یافتهها
مواجهه سلولهای تک هستهای بیماران با EBV منجر به ترانسفورم سلولها و ایجاد کلون در برخی از چاهکها گردید. نتایج هماگلوتیناسیون و الایزا نشان داد که کلونها قادر به تولید آنتیبادی ضد آنتیژن RhE هستند.
نتیجه گیری
میتوان با استفاده از سلولهای حساس شده بیماران تالاسمی علیه آنتیژن RhE و نامیراسازی آن به روش ترانسفورماسیون به کمک ویروس EBV ، رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی Anti-E ایجاد کرد.
کلمات کلیدی: آنتیبادیها، تالاسمی، آلوایمیونیزاسیون، EBV
تاریخ دریافت: 28/03/1401
تاریخ پذیرش: 05/06/1401
1- کارشناس ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: PhD زیست فناوری ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ کدپستی: 369-14665
3-PhD ویروس شناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- PhD هماتولوژی و بانک خون ـ استادیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
امروزه از آنتیبادیهای مونوکلونال در تحقیقات، تشخیص و درمان بیماریها استفاده میشود. اولین گام در فرآیند تولید آنتیبادی مونوکلونال، ایمیونیزاسیون درست لنفوسیتهای B ، با آنتیژن مناسب میباشد(1). با توجه به طول عمر کوتاه و محدود لنفوسیتهای B گام بعدی نامیراسازی این سلولهای سیستم ایمنی بوده که با استفاده از روشهای مختلفی مانند استفاده از مواد شیمیایی کارسینوژن، فعالسازی تلومرازها، آلودگی سلولها با ویروسهای انکوژن مانند EBV و هیبریدیزاسیون با سلولهای سرطانی صورت میگیرد(2). EBV از خانواده هرپس ویروسها(Herpes virus) بوده و لنفوسیتهای B و سلولهای اپیتلیال را از طریق گیرنده خود که CD21 میباشد، آلوده میسازد(4، 3). در شرایط In vitro ، EBV با آلودهسازی لنفوسیتهای B ، ابتدا منجر به تغییر شکل سلولها و سپس منجر به ترانسفورماسیون، نامیرایی و تبدیل شدن آنها بهLymphoblastoid Cell Line (LCL) میگردد. در واقع LCL ها، سلولهای ترانسفرم شدهای هستند که دائماً در حال تقسیم و تولید آنتیبادی میباشند(5). به علت حضور همزمان لنفوسیتهای B و T در مرحله آلودهسازی با EBV ، لنفوسیتهای T سیتوتوکسیک نیز ایجاد شده که سبب از بین بردن لنفوسیتهای B میگردند؛ برای جلوگیری از وقوع این پدیده از سیکلوسپورین A استفاده میشود(6). تالاسمی یک بیماری ارثی هماتولوژیک ناشی از کاهش یا عدم ساخت زنجیرههای گلوبین مولکول هموگلوبین بوده که سبب عدم تعادل زنجیرههای گلوبین و در نهایت همولیز، اریتروپوئز غیر مؤثر و آنمی میگردد(7). امروزه تالاسمی به 2 گروه وابسته به تزریق خون و غیر وابسته به تزریق خون تقسیم میگردد که این تقسیمبندی مبتنی بر شدت علائم بالینی بیمار و نیازمندی آنها به تزریق خون برای بقا است(8). آلوایمیونیزاسیون طی تزریق فرآوردههای خونی و بارداری رخ میدهد و به عنوان یکی از مشکلات اصلی در بیماران نیازمند تزریق خون مداوم شناخته میشود که میتواند منجر به واکنشهای تأخیری و شدید همولیتیک ناشی از تزریق خون و همچنین بیماریهای همولیتیکی جنینی- نوزادی گردد(10، 9). سیستم گروه خونی Rh یکی از پلیمورفترین و ایمونوژنترین سیستمهای گروه خونی در انسان میباشد. 5 آنتیژن مهم در این سیستم شامل D ، C ، c ، E و e است(11). بر پایه مطالعههای انجام شده در ایران، شیوع آنتیژن E حدود 35-29 درصد میباشد(13، 12). Anti-RhE آنتیبادی، جزو شایعترین آنتیبادیها در بیماریهای همولیتیک جنینی است(14)؛ Anti-RhE آنتیبادی، شایعترین آلوآنتیبادی ناشی از تزریق خون میباشد که میتواند منجر به واکنشهای همولیتیک ناشی از تزریق خون گردد(15، 9).
با توجه به این که تزریق خونهای متعدد خطر آلوایمیونیزاسیون را افزایش میدهد، تعیین فنوتیپ گلبولهای قرمز گیرنده و دهنده خون برای یافتن خون مناسب با حداکثر سازگاری و کمترین عوارض امری ضروری میباشد که این امر اهمیت تولید مونوکلونال آنتیبادیها و استفاده از آنها را در بانک خون مشخص میکند(16). ایجاد آلوآنتیبادی ضد آنتیژن RhE که از ایمنیزایی بالایی برخوردار بوده، میتواند با بروز عوارض نامطلوب، توالی تزریق خون در بیماران را افزایش دهد. بنابراین هدف از این مطالعه، جداسازی لنفوسیتهای ایمن شده از بیماران تالاسمی آلوایمیون و ترانسفورم آنها با ویروس اپیشتاین بار جهت دستیابی به رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی ضد آنتیژن RhE بود.
مواد و روشها
مطالعه انجام شده از نوع تجربی بود.
تهیه نمونه خون:
کـار بـر روی نمونـه خـون 3 بیمار مبتلا به تالاسمی و
دارای پاسخ آلوایمن علیه آنتیژن RhE شروع گردید. تمامی نمونههای خون بیماران تالاسمی از مرکز درمان تالاسمی ظفر پس از تصویب پروژه، تایید و دریافت کد اخلاق با شماره IR.TMI.REC.1399.016 در سازمان انتقال خون و به پیوست رضایتنامهای که از بیماران جهت انجام مطالعه پژوهشی اخذ شده است، دریافت گردید.
تهیه سوپ ویروسی:
سلولهای Marmoset B95-8 (در فاز رشد نمایی) از مرکز ذخایر ژنتیک خریداری شده و در محیط کامل RPMI1640 کشت داده شدند. 5-3 روز پس از کشت و زرد کردن کامل محیط کشت، مایع رویی برداشته و به مدت 7-5 دقیقه با دور rpm 1500 سانتریفوژ گردید. مایع رویی از فیلتر 2/0 میکرون عبور داده شد و در فریزر70- درجه سانتیگراد نگهداری گردید.
جداسازی و ترانسفورماسیون سلولهای تک هستهای خون محیطی:
سلولهای تک هستهای موجود در نمونه خون دریافتی با استفاده از گرادیان غلظتی فایکول جدا شدند؛ سپس به این سلولها سوپ ویروسی اضافه گردید و به مدت 4 ساعت در انکوباتور 37 درجه سانتیگراد دارای 5 درصد CO2 انکوبه شد. هر 15 دقیقه یک بار سلولها به آرامی مخلوط گردیدند. سپس سلول ها در پلیت 96 خانهای، به میزان 100 هزار سلول در هر چاهک تقسیم شده و به چاهکها محیط کشت کامل FBS %10 + RPMI حاوی سیکلوسپورین (µg/mL 1/0) اضافه گردید(6 چاهک برای هر بیمار)؛ پلیت در انکوباتور 37 درجه سانتیگراد دارای 5 درصد CO2 انکوبه شده و پس از 24 ساعت مایع رویی هر چاهک با محیط تازه حاوی سیکلوسپورین تعویض گردید. تشکیل سلولهای لنفوبلاستوئید در فواصل زمانی مختلف بعد از ترانسفورماسیون با میکروسکوپ معکوس بررسی گردید. 3-2 هفته بعد از کشت سلولهای مجاور شده با ویروس اپشتاین بار، آزمایش میکروهماگلوتیناسیون جهت تعیین اختصاصیت آنتیبادی و آزمایش الایزا جهت تایید تولید آنتیبادی انجام شد.
هماگلوتیناسیون:
وجود آنتیبادی اختصاصی علیه آنتیژن E در مایـع رویـی هـر چاهـک بـا انجـام آزمایـش میکرو هماگلوتیناسیون تایید شد. 50 میکرولیتر از مایعرویی هر چاهک به انتهای چاهک 96 خانهای U شکل اضافه شد و 25 میکرولیتر از سوسپانسیون 2%-1% گلبولهای قرمز E مثبت تهیه شده از سلولهای غربالگر به چاهکها اضافه گردید. سپس پلیت به مدت 45 دقیقه در 37 درجه سانتیگراد انکوبه شده و بعد از این مدت وجود آگلوتیناسیون به صورت ماکروسکوپی و میکروسکوپی بررسی گردید.
آزمایش الایزا:
جهت بررسی تولید آنتیبادی از پلیتهای کوت شده با آنتیهیومن گلوبولین در آزمایشگاه مونوکلونال سازمان انتقال خون استفاده شد. 50 میکرولیتر از مایعرویی چاهکهایی که آزمایش هماگلوتیناسیون آنها مثبت شد به پلیت کوت شده با آنتیهیومن اضافه گردید. در این آزمایش چاهک Non-coated به عنوان کنترل منفی الایزا در نظر گرفته شد. پلیت به مدت 40 دقیقه در انکوباتور 37 درجه سانتیگراد انکوبه گردید.
پس از سه بار شست و شو با بافر PBS-Tween ، 50 میکرولیتر از محلول کونژوگه Anti-Human HRP به هر چاهک افزوده شد و به مدت 40 دقیقه در انکوباتور 37 درجه سانتیگراد انکوبه گردید. بعد از سه بار شست و شو با بافر فسفات، به هر چاهک 50 میکرولیتر از محلول سوبسترای تترامتیل بنزیدین(TMB) افزوده شد و بعد از 20 دقیقه با افزودن 30 میکرولیتر محلول اسید واکنش متوقف شد. مقادیر جذب نوری به دسـت آمـده از نتـایج آزمـایش الایزا در جدول گردآوری شدند. سپـس محاسبه میزان میانگین و انحراف معیار و همچنین مقایسه نتایج با استفاده از R studio صورت گرفت.
یافتهها
پس از مواجه سلولها با EBV ، تغییرات ظاهری در سلولها، از قبیل کشیدهتر شدن سلولها و تشکیل کلونهای کوچک پس از 48 ساعت مشاهده گردید. با گذشت زمان تعداد کلونها بیشتر شـده و افزایـش تعداد سلولها در هر
کلـون رؤیـت شـد. پـس از گـذشت 3-2 هفتــه، آزمایش هماگلوتیناسیون در پلیتهای U شکل انجام شد.
یک چاهک به عنوان کنترل منفی(سوپ رویی چاهک حاوی سلول ترانسفرم نشده) و 2 چاهک به عنوان کنترل مثبت(سرم بیماردارای Anti-E و کنترل تجاری Anti-E) در نظر گرفته شدند. 33% چاهکها دارای آزمایش هماگلوتیناسیون مثبت بودند. به عبارت دیگر آنتیبادی تولیدی توسط سلولهای موجود در چاهک توانایی هماگلوتیناسیون سوسپانسیون گلبولهای قرمز دارای آنتیژن E را داشت.


همچنین قدرت هماگلوتیناسیون آنتیبادی تولیدی برابر با قدرت هماگلوتیناسیون آنتیبادی تجاری Anti-E در رقت 10/1 بود. سوپ رویی چاهکهای مثبت در آزمایش هماگلوتیناسیون در میکروتیوبهای جداگانه جمعآوری گردید و جهت انجام آزمایش الایزا به آزمایشگاه مونوکلونال آنتیبادی سازمان انتقال خون انتقال داده شد. بعد از انجام مراحل الایزا، میزان جذب نوری چاهکها در طول موج nm 450 خوانده شد.
سلولهای ترانسفرم شده تولیدکننده آنتیبادی، در صورت عدم فیوژن با سلولهای میلومایی پس از 3 تا 4 هفته از ترانسفورماسیون به وسیله EBV ، میمیرند.


بحث
امروزه آنتیبادیهای مونوکلونال جایگاه ویژهای در علم پزشکی پیدا کردهاند و از آنها در فرآیندهای تشخیص و درمان بیماریها استفاده میشود. برای اولین بار از آنتیبادیهای مونوکلونال برای تشخیص گروههای خونی استفاده گردید و امروزه نیز یکی از کاربردهای اصلی این ترکیبات در ایمونوهماتولوژی میباشد که منجر به شناسایی و تعیین فنوتیپ گلبولهای قرمز و همچنین دریافت خون در بیماران نیازمند تزریق خون با حداکثر سازگاری میباشد.
با توجه به این که بیماران تالاسمی به دلیل تزریق خونهای مکرر عمدتاً دارای آلوآنتیبادی، به خصوص Anti-E میباشند، بنابراین سلولهای خون محیطی این افراد به طور طبیعی در محیط بدن ایمیونیزه شدهاند و نیازی به ایمیونیزاسیون این سلولها در In vitro نبوده و با نامیراسازی این سلولها به وسیله EBV و ایجاد رده سلولی لنفوبلاستوئید میتوان فرآیند تولید آنتیبادی مونوکلونال را تسریع کرد.
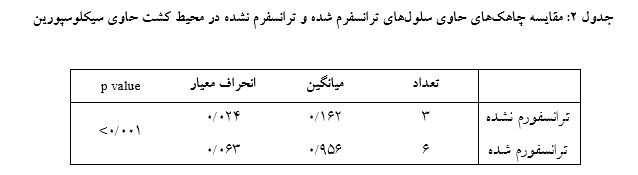
در این مطالعه، سلولهای تک هستهای موجود در خون محیطی بیماران تالاسمی آلوایمیون علیه آنتیژن RhE براساس گرادیان غلظتی فایکول جدا شدند و به وسیله EBV ترانسفورم گردیدند. به دلیل حضور لنفوسیتهای T سیتوتوکسیک در سلولهای جدا شده، از سیکلوسپورین به عنوان مهارکننده این سلولها استفاده شد. پس از 3-2 هفته با استفاده از آزمایش هماگلوتیناسیون حضور آنتیبادی مد نظر در چاهکها مورد ارزیابی قرار گرفت و برای چاهکهای مثبت در آزمایش هماگلوتیناسیون، جهت سنجش میزان کل آنتیبادی آزمایش الایزا صورت گرفت. میانگین جذب نوری این چاهکها (چاهکهای مثبت در آزمایش هماگلوتیناسیون) برابر با 956/0 بود که در مقایسه با میانگین جذب نوری چاهکهای کنترل(سلول ترانسفورم نشده) که 162/0 بود دارای تفاوت معنادارای بود(001/0 p<). مقایسه نتایج الایزا چاهکهای حاوی سلولهای ترانسفورم شده و ترانسفورم نشده و تشکیل کلون در چاهکهای حاوی سلولهای ترانسفورم شده، بیانگر عملکرد مناسب EBV و تولید آنتیبادی توسط سلولها بود. به نظر میرسد به دلیل استفاده از ویروسEBV در تولید این آنتیبادیها و امکان انتقال آن از راه دهان و بینی، بهتر است آنتیبادیهای تولیدی بدین روش ویروسزدایی شوند.
طوسیزاده و همکاران در سال 2017 در ایران با مطالعه و بررسی عوامل مؤثر دریافتند که در درمای 37 درجه سانتیگراد، 5%CO2 ، %20 FBS و محیط کشت RPMI ، نامیراسازی لنفوسیتها به خوبی رخ میدهد(17). این در حالی است که ما در مطالعه خود برخلاف مطالعه طوسیزاده از 10%FBS استفاده کرده و موفق به ایجاد سلولهایی نامیرا شدیم.
یوئن در سال 2011 در آمریکا، موفق به نامیراسازی لنفوسیتهای B خون محیطی با استفاده از EBV و تاکرولیموس(مهارکننده لنفوسیتهای T) گردیدند(18). ما در مطالعه خود از سیکلوسپورین به غلظت µg/mL 1/0 به عنوان جایگزین تاکرولیموس استفاده کرده و نتایجی مشابه به دست آوردیم.
فراسن و همکاران در سال 2010 سلولهای B خون محیطی را به روش FACS جدا کرده و با استفاده از EBV آنها را نامیرا ساختند؛ آنها همچنین در مطالعه خود به این نتیجه رسیدند که استفاده از PBMC در مقایسه با لنفوسیتهای B منجر به حصول نتیجه بهتری میگردد که این امر ممکن است به دلیل حضور سایر سلولها و کمک آنها به لنفوسیتهای B باشد(19). ما نیز در مطالعه خود سلولهای تک هستـهای مـوجود در خون محیطــی را جدا کرده و با استفاده از EBV موفق به ایجاد رده سلولی لنفوبلاستوئید شدیم که این یافته ما منطبق بر یافتههای فراسن و همکاران بود.
لمسکایا در سال 2017 روش نامیراسازی سلولها با EBV با کارآیی بالا را به کار بردند؛ آنها در این روش از 3 تا 5 میلیلیتر از خون محیطی به عنوان منبعی برای جداسازی لنفوسیتهای B و محیط کشت RPMI1640 بدون لایه تغذیهکننده استفاده کردند(2). ما نیز در پژوهش خود از 6-5 میلیلیتر از خون بیماران تالاسمی آلوایمیون به عنوان منبعی برای جداسازی PBMC استفاده کرده و نامیراسازی سلولها و ایجاد رده سلولی لنفوبلاستوئید را بدون استفاده از لایه تغذیهکننده انجام دادیم.
نتایج حاصل از این مطالعه بیانگر این موضوع میباشد که میتوان با استفاده از سلولهای تک هستهای خون محیطی بیماران تالاسمی آلوایمیون و EBV ، رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی ایجاد کرد.
نتیجهگیری
میتوان از حجم کمی از خون (6-5 میلیلیتر) بیماران تالاسمی آلوایمیون که لنفوسیتهای آنها به صورت طبیعی
در محیط بدن ایمیونیزه شدهاند به عنوان منبع سلولی بـرای ایجاد رده سلولی لنفوبلاستوئید تولیدکننده آنتیبادی به وسیله EBV استفاده نمود. آنتیبادی تولیدی توانایی شناسایی و آگلوتیناسیون گلبولهای قرمز را دارد.
تشکر و قدردانی
این مقاله حاصل پایاننامه دانشـجویی دوره کارشناسـی ارشد رشته هماتولوژی و طب انتقال خون در مؤسسه عالی آموزشــی و پژوهشــی طــب انتقــال خــون بــا کــد اخــلاق IR. TMI.REC.1399.016 میباشد. بودجه این مطالعه توسط مؤسسه عالی آموزشی و پژوهشی طب انتقال خـون تـأمین گردیده و همه مراحل عملی پروژه در آزمایشگاه آنتیبـادی مونوکلونال و ویروسشناسی انجام شده است.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |



