جلد 19، شماره 2 - ( تابستان 1401 )
جلد 19 شماره 2 صفحات 182-166 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mohammad Hoseini F, Maleknia M, Amrovani M, Jodat J, Mansourian A. Factors associated with damage caused by RBC storage and their effect on Molecular aspects of associated inflammatoryProperties with blood transfusion and anesthetic agent after cardiac surgery. bloodj 2022; 19 (2) :166-182
URL: http://bloodjournal.ir/article-1-1415-fa.html
URL: http://bloodjournal.ir/article-1-1415-fa.html
محمد حسینی فضل اله، ملک نیا محسن، امروانی مهران، جودت جواد، منصوریان افشین. فاکتورهای مرتبط با آسیب ناشی از ذخیرهسازی گلبولهای قرمز و اثر آنها بر جنبههای مولکولی التهاب القا شده به واسطه تزریق خون و مصرف عوامل بیهوشی پس از عمل جراحی قلب. فصلنامه پژوهشی خون. 1401; 19 (2) :166-182
استادیار دانشکده پزشکی دانشگاه علوم پزشکی یاسوج
متن کامل [PDF 662 kb]
(941 دریافت)
| چکیده (HTML) (1879 مشاهده)
مقدمه
اگر چه در دهههای اخیر جراحی قلب در کودکان و بزرگسالان تا حدود زیادی توانسته باعث افزایش بقای بیماران و کاهش مرگ و میر آنها گردد، با این حال بروز برخی از عوارض جانبی همچون بروز پاسخهای التهابی بعد از جراحی، میزان مرگ و میر در بیماران را به صورت قابل توجهی افزایش داده است(2، 1). تاکنون علت اصلی بروز پاسخهای التهابی شناسایی نشده است اما فاکتورهای زیادی در رابطه با تحریک سلولهای سیستم ایمنی شناسایی شده است که این فاکتورها شامل تماس خون بیماران با پمپهای خارج بدنی، تزریق خون و استفاده از برخی از داروهای بیهوشی بوده است(3). با توجه به این که نیاز بیماران به انتقال خون قبل، حین یا بعد از عمل غیر قابل انکار است، تجمع اجزای RBC در کیسههای خون میتواند منبع پاسخهای التهابی در گیرندگان باشد. به طور کلی عوامل پیش التهابی مرتبط با فرآوردههای خونی در یکی از چهار دسته ذیل قرار میگیرند. این عوامل عبارتند از: عوامل بیماریزای منتقل شده از طریق خون که باعث سپسیس باکتریایی، عفونت حاد یا مزمن ویروسی یا عفونت حاد انگلی(و اغلب همولیز) میشوند، بیماریزایی آنتیبادی نامطلوب(باعث همولیز هنگام مواجهه با آنتیژنهای هدف میشود به ویژه هنگامی که قادر به اتصال به آنتیژن مکمل خود باشد)، آسیب حاد ریه مرتبط با ترانسفوزیون(TRALI) و خروج سیتوکاینهای پیشالتهابی و کموکاینها از لکوسیتها، مواد التهابی مرتبط با پاتوفیزیولوژی پلاکتها و گلبولهای قرمز، به ویژه هنگامی که فرآوردههای سلولی خون در طول زمان ذخیره میشود و تحت اصطلاح ضایعات/آسیب ذخیرهای(storage lesion) قرار میگیرند که شامل وزیکول خارج سلولی و نیز انتشار و آزاد شدن مولکولهای متصل به غشا و محتوای درون سلولی مانند آهن آزاد(ناشی از لیز گلبول قرمز) میباشند(8-4). از طرف دیگر، عوامل بیهوشی از دیگر عواملی هستند که شرایط التهابی بیماران را تحت تأثیر قرار میدهند. عوامل بیهوشی به دو دسته تقسیم میشوند: استنشاقی و داخل عروقی. هر نوع از این عوامل پاسخ التهابی منحصر به فرد خود را تحت تاثیر قرار میدهند. بنابراین، شناسایی اثرات بیهوشی بر وضعیت التهابی بیماران، میتواند به فرآیندهای تشخیصی و پیشبرد اهداف درمانی کمک کند. درحقیقت پاتوژنز هر یک از این عوامل و نحوه فعال کردن سلولهای سیستم ایمنی توسط آنها با یکدیگر بسیار متفاوت میباشد. علاوه بر شناسایی عوامل پاتوژنز دخیل در بروز پاسخهای التهابی، تمایز پاسخهای التهابی ناشی از جراحی قلبی نسبت به التهابات ناشی از سپسیس در بیماران میتواند در به کارگیری استراتژیهای پیشگیریکننده و درمانی بسیار مهم باشد(10، 9) . از جمله پارامترها و فاکتورهای مرتبط با استراتژیهای پیشگیریکننده از بروز التهاب ناشی از ترانسفیوژن فرآوردههای خونی، میتوان به ویژگیهای مرتبط به اهداکننده به دلیل داشتن آنتیبادی نامنظم، آلوآنتیبادیها، آنتیبادیهای آلوژن و پاتوژنهای عفونی و یا مواد سمی مرتبط با آنها، پارامترهای مرتبط با فرآوری و تولید خون و فرآورده خون از نظر محتوای میکروپارتیکل و میکرووزیکول، لوکوسیتها، انواع ضایعات/آسیب ذخیرهسازی(storage lesion) و عمر فرآورده خون، پارامترهای مرتبط با گیرنده خون مانند برخی درمانهای دارویی، پارامترهای ژنتیکی مستعدکننده التهاب، وضعیت بالینی بیمار و استانداردسازی شامل مچ بودن و سازگاری گروه خونی اشاره کرد(17-11) .
از این رو در این مطالعه به بررسی مکانیسمهای مولکولی دخیل در بروز پاسخهای التهابی القا شده توسط فاکتورهای مرتبط با آسیب ناشی از ذخیرهسازی گلبول قرمز به دنبال تزریق خون، مصرف عوامل بیهوشی پس از جراحی قلبی و به کارگیری استراتژیهای پیشگیریکننده از بروز این پاسخها بر پایه همین مکانیسمهای مولکولی میپردازیم.
مواد و روشها
۱۲۶ مقاله انگلیسی زبان چاپ شده در بین سالهای ۲۰۰۱ تا ۲۰۲۱ در پایگاه Pubmed با استفاده از کلمات«جراحی توراسیک» ، «التهاب» ، «بیهوشی» و «تزریق خون» جهت نگارش این مقاله مروری جست وجو شده و مورد بررسی قرار گرفتهاند.
یافتهها
مسلماً زمانی که بیماران تحت جراحی قلب قرار میگیرند، نیاز به تزریق خون برای جلوگیری از عوارض آنمی متعاقب از دست رفتن خون میتواند استراتژی درمانی مهمی برای افزایش بقای بیماران باشد. این که تزریق خون قبل، حین و یا بعد از جراحی در بیماران صورت بگیرد، بستگی به شرایط فیزیولوژیکی و بالینی بیمار و نوع جراحی که قرار است انجام گردد، دارد(18). علاوه بر این، بر اساس این که بیمارانی که تحت عمل جراحی قرار میگیرند بزرگسال و یا کودک باشند، شدت علایم بالینی ناشی از تزریق خون در آنها متفاوت است. معمولاً عمده محصول فرآورده خونی که به بیماران تحت عمل جراحی تزریق میگردد، گلبول قرمز فشرده شده packed (RBC) است. از این رو عمده عوارض بروز یافته بعد از عمل جراحی ناشی از مشتقات RBC میباشد(19). طبق تحقیقات اخیر نشان داده شده که فرآوردههای RBC در طی مدت ذخیرهسازی دچار یک سری تغییرات ناشی از آسیبهای دوران نگهداری فرآودههای خونی میگردند و این آسیبها منجر به آزاد شدن یک سری از فاکتورها از گلبولهای قرمز میشود که آزاد شدن این فاکتورها به واسطه ایمنومدولاسیون سیستم ایمنی میتواند باعث آغاز پاسخهای التهابی پس از جراحی گردد(20، 19). از جمله ترکیبات گلبول قرمز که در اثر آسیب ناشی از ذخیرهسازی RBC تولید میشوند و میتوانند بر بروز التهاب اثرگذار باشند میتوان به هموگلوبین آزاد(Free Hemoglobin)، هم (Heme) و آمونیاک(NH3) اشاره کرد. لذا ابتدا در مورد این ترکیباب و سپس به داروهای بیهوشی پس از عمل جراحی قلب که در بروز التهاب نقش دارند با دیدگاه مولکولی پرداخته و یافتههای خود را بر پایه مکانیسمهای مولکولی التهاب القا شده توسط ترکیبات فوقالذکر و داروهای بیهوشی بیان مینماییم.
ترکیبات گلبول قرمز:
هموگلوبین آزاد(Free Hemoglobin)
یکی از فاکتورهایی که پس از ذخیرهسازی در کیسههای
packed-RBC افزایش مییابد، هموگلوبین((Hb آزاد اسـت
که ناشی از همولیز RBC میباشد(21). بسیاری از مواد بیولوژیکی فعال در کیسههای خون، مانند Hb آزاد میتوانند سلولهای اندوتلیال و ایمنی را فعال کرده و باعث التهاب شوند(22). Hb آزاد نفوذپذیری سلولهای اندوتلیال عروقی را افزایش میدهد و عملکرد اندام مربوطه را مختل میکند(23). پس از انتقال خون، سیتوکینهای التهابی مانند فاکتور نکروزدهنده تومور-آلفا (TNF-α) و اینترلوکین 1 بتا (IL-1β) معمولاً سلولهای اندوتلیال(EC) را در شرایط التهابی فعال میکنند(24). هنگامی که Hb به شکل اکسید شده تبدیل میگردد، تحت عنوان Free Hb نامیده میشود. Free Hb به واسطه تحریک IL-1β از ماکروفاژ (MQ)باعث افزایش فعال شدن(NLRP3) NLR Family Pyrin Domain Containing 3 میگردد. NLRP3 یکی از اجزای اینفلامازوم میباشد که در تحریک پاسخهای ایمنی ذاتی و پیشرفت التهاب نقش دارد(25). واسطههای التهابی و استرس اکسیداتیو میتوانند باعث آسیب سلولی در بسیاری از بافتها مانند اندوتلیال عروقی شوند(26). استرس اکسیداتیو اغلب در طی فرآیند التهاب وجود دارد. بنابرایـن، مهـار ایـن دو پارامتـر میتوانـد راهی برای محافظت از عملکرد سلول باشد(27). Hb آزاد F2-isoprostanes و isofuransرا به عنوان مارکرهای استرس اکسیداتیو افزایش میدهد؛ اکسیداسیون غیر آنزیمی اسید آراشیدونیک هر دو را تولید میکند(23). در مطالعهای که بیماران دارای مشکلات قلبی و عروقی را پس از جراحی مورد بررسی قرار داد، مایع پریکارد حاوی مقدار زیادی Hb اکسید شده آزاد بود که با سطوح بالای F2-isoprostanes همراهی داشته است(28).
علت افزایش سیتوکاینهای التهابی پس از انتقال خون ممکن است آزاد شدن مارکرهای فعال کننده اندوتلیال مانند مولکول چسبندگی سلول عروقی -1(VCAM-1) و MIF باشد که باعث تحریک سیستم ایمنی بدن میشود(29). همچنین Free Hb به واسطه بیان P- سلکتین، E- سلکتین و ICAM-1 بر روی EC باعث افزایش کموتاکسی سلولهای ایمنی و بروز پاسخهای التهابی میگردد(30). ICAM-1 و VCAM-1 با سلولهای التهابی همکاری میکنند و باعث شرایط مزمن التهاب و اختلال عملکرد اندوتلیال میشوند. Nuclear factor-κB (NF-κB) به عنوان یک القاگر التهابی، بیان VCAM-1 و ICAM-1 را در EC تنظیم میکند. مسیر سیگنالینگ AMPK / NF-κB / NLRP3 یک سیگنال مهم مرتبط با اختلال عملکرد سلولهای اندوتلیالی است؛ این مسیر التهاب و استرس اکسیداتیو را تنظیم میکند. AMPK (5-prime-Amp-Activated protein kinase) تنظیمکننده متابولیسم سلولی است که در EC ها بیان میشود و دارای اثرات ضد التهابی و آنتیاکسیدانی است. استفاده درمانی از آگونیستAMPK بر بهبود عملکرد EC تأثیر میگذارد و باعث ایجاد استرس اکسیداتیو توسط H2O2 میشود. فسفوریلاسیون و فعالسازی AMPK با فعالسازی نیتریک اکساید سنتتاز اندوتلیالی(eNOS) عملکرد EC را بهبود میبخشد. فعالسازی AMPK و سرکوب NLRP3 و NF-kB میتواند در کنترل شرایط التهابی ناشی از Free Hb سودمند باشد. علاوه بر این Free Hb میتواند به واسطه تولید واسطههای فعال اکسیژن(ROS)، باعث تبدیل LDL به ox-LDL شود. ox-LDL در واقع یکی از عوامل اصلی اختلال در عملکردEC و بروز بیماری قلبی و عروقی (CVD) میباشد(31). علیرغم این که Hb آزاد میتواند باعث بروز پاسخهای التهابی گردد، میتواند به واسطه اتصال به نیتریک اکساید(NO) و افزایش پاکسازی آن از خون باعث انقباض EC و اختلال در جریان خون شود. در حقیقت NO به عنوان یکی از عوامل گشادکننده عروق میباشد که از طریق تولید گوانوزین مونوفسفات حلقوی (cGMP) و تحریک مسیر سیگنالینگ مرتبط به آن باعث کاهش بیان ملکولهای چسبنده در سطح EC میگردد(32). ال- آرژنین((L-arginine که به عنوان سوبسترا برای تولید NO استفاده میشود، از طریق افزایش تجمع آنزیم آرژیناز در کیسههای خون باعث تجزیه آن میگردد. همچنین نشان داده شده که ال ـ آرژینین به عنوان یکی از عوامل اصلی تولید سلولهای خونی نقش دارد. بنابراین کاهش آن همراه با کاهش خونسازی و افزایش نیاز به تزریق خون در بیماران میباشد که میتواند باعث تشدید علایم بالینی بیماران شود(33). افزایش سطح Hb پس از تزریق خون باعث افزایش تولید ترومبین و فعال شدن سیستم انعقــادی
میشود(34). ترومبین، پلاکـت را فعال کرده و فیبرینولیز را
شروع میکند. همچنین باعث ترشح فعالکننده پلاسمینوژن بافتی از ECs میشود(35). در یک مطالعه، گزارش شد که فرآیند ذخیرهسازی سلول((Cell saving میتواند واسطههای التهابی مانند IL-6 را کاهش دهد و از قرار گرفتن در معرض عوارض انتقال خون در بیماران جلوگیری کند. این تئوری میتواند از اختلال عملکرد سلولهای اندوتلیال به دلیل اثر سیتوکاینهای التهابی یا افزایش پاسخ ایمنی در نتیجه فعالسازی ECs جلوگیری کند(34). به طور کلی، افزایش هموگلوبین منجر به اختلال در عملکرد ECs میشود، که نقشی حیاتی در بیماریهای قلبی دارد. تجمع Hb آزاد در کیسههای خون از طریق مکانیزمهای مختلف میتواند پاسخهای التهابی را تحریک کند. حذف Hb آزاد درون کیسههای خون میتواند از التهاب و اختلالات عروقی جلوگیری کند.
هم(Heme)
زمانی که Hb تحت تاثیر ROS اکسید میگردد، گروه هم از زنجیرههای گلوبین آن جدا شده و به صورت آزاد در گردش خون تجمع مییابد. همچنین ROS میتواند باعث تولید سیتوکاینها و مدیاتورهای التهابی شود، که ممکن است باعث آسیب به بافت گردد(36). در صورتی که هم از خون پاکسازی نگردد، همانند Hb آزاد میتواند باعث تحریک پاسخهای التهابی و ترومبوز شود. سیگنالینگ استرس اکسیداتیو از طریق NF-kB و پروتئین کینازهای فعال شده با میتوژن(MAPK) التهاب را افزایش میدهد(37). NF-κB، وارد هسته سلول میشود و ترشح سیتوکاینهای التهابی، سیکلواکسیژناز -2(COX-2) و نیتریک اکسید سنتتاز القایی (iNOS)را تنظیم میکند(38). اینترلوکین 1 بتا(IL-1b) باعث بیان iNOS در EC میشود (39). همچنین، فعالسازی فسفاتیدیل اینوزیتول 3-کیناز (PI3K)/AKT در بیان iNOS و COX-2 نقش دارد ؛ PI3K با فعال کردن AKT باعث پاسخ های التهابی میشود(40). فعالسازی مسیر سیگنالینگ MAPK باعث افزایش بیان p38 ، extracellular signal-regulated kinase (ERK)و c-Jun N-terminal kinase (JNK) میشود؛ این روند تنظیمـی

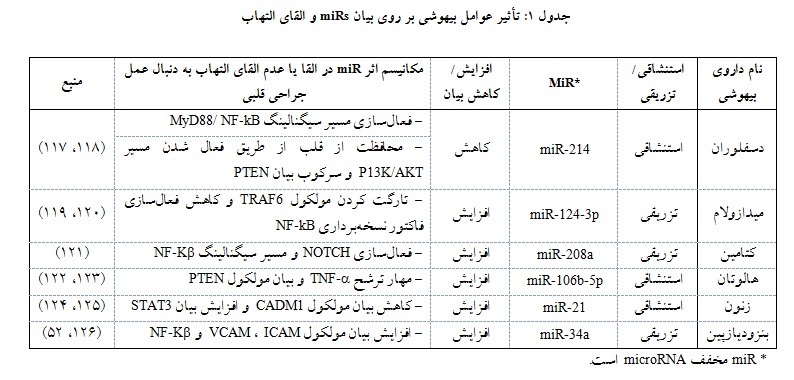
همچنین با توجه به این که این عوامل مثل یک شمشیر دو لبه عمل کرده و در مواقعی باعث التهاب و در شرایط دیگری باعث مهار التهاب میگردند و به علاوه از آن جایی که این عوامل معمولاً به واسطه یک سری فاکتورهایی همچون miRs باعث اعمال اثرات خود بر روی پاسخهای التهابی میشوند میتوان استفاده از miRs را به عنوان یک مارکر تشخیصی برای مانیتورینگ اثرات عوامل بیهوشی بر روی پاسخهای التهابی به کار گرفت(جدول ۱).
نتیجهگیری
انتقال خون در حین جراحی و نوع بیهوشی مورد استفاده در ایجاد عوارض بعد از عمل مهم و حائز اهمیت میباشد. بررسی مسیرهای سیگنالینگ القایی میتواند به
کنترل وضعیت بالینی بیمار کمک کند؛ به طوری که این مسیرها میتوانند از فعال شدن سیستم ایمنی بدن به دلیل التهاب جلوگیری کنند. در نهایت میتوان گفت، ارزیابی miRs و دیگر مسیرهای ملکولی که احتمالاً به واسطه عوامل بیهوشی و فاکتورهای آزاد شده از RBCs لیز شده در کیسه فرآوردههای خونی فعال میگردند و همچنین شناسایی مسیرهای فعال شده توسط عوامل بیهوشی که باعث مهار پاسخهای التهابی میشوند، میتواند یک استراتژی درمانی و پیشگیریکننده را برای بیماران تحت عمل جراحی قلبی ایجاد کند.
تشکر و قدردانی
از کلیه همکارانی که ما را در نگارش این مقاله یاری نمودهاند، سپاسگزاری مینماییم.
متن کامل: (1883 مشاهده)
فاکتورهای مرتبط با آسیب ناشی از ذخیرهسازی گلبولهای قرمز و اثر آنها
بر جنبههای مولکولی التهاب القا شده به واسطه تزریق خون و مصرف عوامل
بیهوشی پس از عمل جراحی قلب
فضلاله محمد حسینی1، محسن ملکنیا2، مهران امروانی3، جواد جودت2، افشین منصوریان4
چکیده
سابقه و هدف
اگر چه پیشرفتهای چشمگیری در درمان بیماران قلبی ـ عروقی رخ داده اما عوارض جانبی ناشی از درمان، مهمترین چالشهایی است که امروزه کاردیولوژیستها با آن مواجه هستند. بروز التهاب پس از عمل جراحی یکی از عوارض استفاده از مواد بیهوشی و تزریق خون در بیماران میباشد. در این مطالعه به بررسی فاکتورهای مرتبط با آسیب ذخیرهسازی گلبول قرمز و اثر آن بر جنبههای مولکولی التهاب القا شده به واسطه تزریق خون و مصرف عوامل بیهوشی پس از عمل جراحی قلب پرداخته شد تا بروز این مسأله را بتوان کاهش داد.
مواد و روشها
مقالات مرتبط برای نگارش این مقاله مروری با جستجو در پایگاه Pubmedدر میان مقالات انگلیسی زبان چاپ شده بین سالهای 2001 تا 2021 با استفاده از کلمات"جراحی توراسیک"، "التهاب"، "بیهوشی" و "تزریق خون" به دست آمد.
یافتهها
فاکتورهای مرتبط با لیز گلبولهای قرمز که در حین ذخیرهسازی فرآوردههای خونی در کیسهها تجمع مییابد و شامل هموگلوبین، هم و آمونیاک میباشد، میتوانند به واسطه مسیرهای مجزا از یکدیگر باعث بروز التهاب در بیماران پس از جراحی شوند. همچنین استفاده از مواد بیهوشی مختلف نیز میتوانند باعث تحریک پاسخهای التهابی گردند. اما نشان داده شده برخی از این مواد بیهوشی همانند شمشیر دو لبه عمل کرده و میتوانند هم باعث القای التهاب و یا باعث جلوگیری از بروز آن شوند.
نتیجه گیری
شناسایی فاکتورهایی که در اثر تحریک پاسخهای سیستم ایمنی افزایش مییابند و همچنین شناسایی مسیرهایی که باعث جلوگیری از بروز التهاب میگردند، میتوانند یک استراتژی درمانی مناسبی برای کاهش التهاب پس از عمل جراحی ایجاد کنند.
کلمات کلیدی: جراحی توراسیک، التهاب، بیهوشی، تزریق خون
تاریخ دریافت: 20/05/1400
تاریخ پذیرش: 18/10/1400
1- متخصص بیهوشی ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی یاسوج ـ یاسوج ـ ایران
2- دانشجوی کارشناسی ارشد هماتولوژی آزمایشگاهی و بانک خون ـ کمیته تحقیقات دانشجویی ـ دانشگاه علوم پزشکی جندی شاپور اهواز ـ اهواز ـ ایران
3- دانشجوی کارشناسی ارشد هماتولوژی آزمایشگاهی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تهران ـ ایران
4- مؤلف مسئول: متخصص بیهوشی ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی یاسوج ـ یاسوج ـ ایران ـ کد پستی: 7591741417
بر جنبههای مولکولی التهاب القا شده به واسطه تزریق خون و مصرف عوامل
بیهوشی پس از عمل جراحی قلب
فضلاله محمد حسینی1، محسن ملکنیا2، مهران امروانی3، جواد جودت2، افشین منصوریان4
چکیده
سابقه و هدف
اگر چه پیشرفتهای چشمگیری در درمان بیماران قلبی ـ عروقی رخ داده اما عوارض جانبی ناشی از درمان، مهمترین چالشهایی است که امروزه کاردیولوژیستها با آن مواجه هستند. بروز التهاب پس از عمل جراحی یکی از عوارض استفاده از مواد بیهوشی و تزریق خون در بیماران میباشد. در این مطالعه به بررسی فاکتورهای مرتبط با آسیب ذخیرهسازی گلبول قرمز و اثر آن بر جنبههای مولکولی التهاب القا شده به واسطه تزریق خون و مصرف عوامل بیهوشی پس از عمل جراحی قلب پرداخته شد تا بروز این مسأله را بتوان کاهش داد.
مواد و روشها
مقالات مرتبط برای نگارش این مقاله مروری با جستجو در پایگاه Pubmedدر میان مقالات انگلیسی زبان چاپ شده بین سالهای 2001 تا 2021 با استفاده از کلمات"جراحی توراسیک"، "التهاب"، "بیهوشی" و "تزریق خون" به دست آمد.
یافتهها
فاکتورهای مرتبط با لیز گلبولهای قرمز که در حین ذخیرهسازی فرآوردههای خونی در کیسهها تجمع مییابد و شامل هموگلوبین، هم و آمونیاک میباشد، میتوانند به واسطه مسیرهای مجزا از یکدیگر باعث بروز التهاب در بیماران پس از جراحی شوند. همچنین استفاده از مواد بیهوشی مختلف نیز میتوانند باعث تحریک پاسخهای التهابی گردند. اما نشان داده شده برخی از این مواد بیهوشی همانند شمشیر دو لبه عمل کرده و میتوانند هم باعث القای التهاب و یا باعث جلوگیری از بروز آن شوند.
نتیجه گیری
شناسایی فاکتورهایی که در اثر تحریک پاسخهای سیستم ایمنی افزایش مییابند و همچنین شناسایی مسیرهایی که باعث جلوگیری از بروز التهاب میگردند، میتوانند یک استراتژی درمانی مناسبی برای کاهش التهاب پس از عمل جراحی ایجاد کنند.
کلمات کلیدی: جراحی توراسیک، التهاب، بیهوشی، تزریق خون
تاریخ دریافت: 20/05/1400
تاریخ پذیرش: 18/10/1400
1- متخصص بیهوشی ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی یاسوج ـ یاسوج ـ ایران
2- دانشجوی کارشناسی ارشد هماتولوژی آزمایشگاهی و بانک خون ـ کمیته تحقیقات دانشجویی ـ دانشگاه علوم پزشکی جندی شاپور اهواز ـ اهواز ـ ایران
3- دانشجوی کارشناسی ارشد هماتولوژی آزمایشگاهی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون تهران ـ ایران
4- مؤلف مسئول: متخصص بیهوشی ـ استادیار دانشکده پزشکی دانشگاه علوم پزشکی یاسوج ـ یاسوج ـ ایران ـ کد پستی: 7591741417
مقدمه
اگر چه در دهههای اخیر جراحی قلب در کودکان و بزرگسالان تا حدود زیادی توانسته باعث افزایش بقای بیماران و کاهش مرگ و میر آنها گردد، با این حال بروز برخی از عوارض جانبی همچون بروز پاسخهای التهابی بعد از جراحی، میزان مرگ و میر در بیماران را به صورت قابل توجهی افزایش داده است(2، 1). تاکنون علت اصلی بروز پاسخهای التهابی شناسایی نشده است اما فاکتورهای زیادی در رابطه با تحریک سلولهای سیستم ایمنی شناسایی شده است که این فاکتورها شامل تماس خون بیماران با پمپهای خارج بدنی، تزریق خون و استفاده از برخی از داروهای بیهوشی بوده است(3). با توجه به این که نیاز بیماران به انتقال خون قبل، حین یا بعد از عمل غیر قابل انکار است، تجمع اجزای RBC در کیسههای خون میتواند منبع پاسخهای التهابی در گیرندگان باشد. به طور کلی عوامل پیش التهابی مرتبط با فرآوردههای خونی در یکی از چهار دسته ذیل قرار میگیرند. این عوامل عبارتند از: عوامل بیماریزای منتقل شده از طریق خون که باعث سپسیس باکتریایی، عفونت حاد یا مزمن ویروسی یا عفونت حاد انگلی(و اغلب همولیز) میشوند، بیماریزایی آنتیبادی نامطلوب(باعث همولیز هنگام مواجهه با آنتیژنهای هدف میشود به ویژه هنگامی که قادر به اتصال به آنتیژن مکمل خود باشد)، آسیب حاد ریه مرتبط با ترانسفوزیون(TRALI) و خروج سیتوکاینهای پیشالتهابی و کموکاینها از لکوسیتها، مواد التهابی مرتبط با پاتوفیزیولوژی پلاکتها و گلبولهای قرمز، به ویژه هنگامی که فرآوردههای سلولی خون در طول زمان ذخیره میشود و تحت اصطلاح ضایعات/آسیب ذخیرهای(storage lesion) قرار میگیرند که شامل وزیکول خارج سلولی و نیز انتشار و آزاد شدن مولکولهای متصل به غشا و محتوای درون سلولی مانند آهن آزاد(ناشی از لیز گلبول قرمز) میباشند(8-4). از طرف دیگر، عوامل بیهوشی از دیگر عواملی هستند که شرایط التهابی بیماران را تحت تأثیر قرار میدهند. عوامل بیهوشی به دو دسته تقسیم میشوند: استنشاقی و داخل عروقی. هر نوع از این عوامل پاسخ التهابی منحصر به فرد خود را تحت تاثیر قرار میدهند. بنابراین، شناسایی اثرات بیهوشی بر وضعیت التهابی بیماران، میتواند به فرآیندهای تشخیصی و پیشبرد اهداف درمانی کمک کند. درحقیقت پاتوژنز هر یک از این عوامل و نحوه فعال کردن سلولهای سیستم ایمنی توسط آنها با یکدیگر بسیار متفاوت میباشد. علاوه بر شناسایی عوامل پاتوژنز دخیل در بروز پاسخهای التهابی، تمایز پاسخهای التهابی ناشی از جراحی قلبی نسبت به التهابات ناشی از سپسیس در بیماران میتواند در به کارگیری استراتژیهای پیشگیریکننده و درمانی بسیار مهم باشد(10، 9) . از جمله پارامترها و فاکتورهای مرتبط با استراتژیهای پیشگیریکننده از بروز التهاب ناشی از ترانسفیوژن فرآوردههای خونی، میتوان به ویژگیهای مرتبط به اهداکننده به دلیل داشتن آنتیبادی نامنظم، آلوآنتیبادیها، آنتیبادیهای آلوژن و پاتوژنهای عفونی و یا مواد سمی مرتبط با آنها، پارامترهای مرتبط با فرآوری و تولید خون و فرآورده خون از نظر محتوای میکروپارتیکل و میکرووزیکول، لوکوسیتها، انواع ضایعات/آسیب ذخیرهسازی(storage lesion) و عمر فرآورده خون، پارامترهای مرتبط با گیرنده خون مانند برخی درمانهای دارویی، پارامترهای ژنتیکی مستعدکننده التهاب، وضعیت بالینی بیمار و استانداردسازی شامل مچ بودن و سازگاری گروه خونی اشاره کرد(17-11) .
از این رو در این مطالعه به بررسی مکانیسمهای مولکولی دخیل در بروز پاسخهای التهابی القا شده توسط فاکتورهای مرتبط با آسیب ناشی از ذخیرهسازی گلبول قرمز به دنبال تزریق خون، مصرف عوامل بیهوشی پس از جراحی قلبی و به کارگیری استراتژیهای پیشگیریکننده از بروز این پاسخها بر پایه همین مکانیسمهای مولکولی میپردازیم.
مواد و روشها
۱۲۶ مقاله انگلیسی زبان چاپ شده در بین سالهای ۲۰۰۱ تا ۲۰۲۱ در پایگاه Pubmed با استفاده از کلمات«جراحی توراسیک» ، «التهاب» ، «بیهوشی» و «تزریق خون» جهت نگارش این مقاله مروری جست وجو شده و مورد بررسی قرار گرفتهاند.
یافتهها
مسلماً زمانی که بیماران تحت جراحی قلب قرار میگیرند، نیاز به تزریق خون برای جلوگیری از عوارض آنمی متعاقب از دست رفتن خون میتواند استراتژی درمانی مهمی برای افزایش بقای بیماران باشد. این که تزریق خون قبل، حین و یا بعد از جراحی در بیماران صورت بگیرد، بستگی به شرایط فیزیولوژیکی و بالینی بیمار و نوع جراحی که قرار است انجام گردد، دارد(18). علاوه بر این، بر اساس این که بیمارانی که تحت عمل جراحی قرار میگیرند بزرگسال و یا کودک باشند، شدت علایم بالینی ناشی از تزریق خون در آنها متفاوت است. معمولاً عمده محصول فرآورده خونی که به بیماران تحت عمل جراحی تزریق میگردد، گلبول قرمز فشرده شده packed (RBC) است. از این رو عمده عوارض بروز یافته بعد از عمل جراحی ناشی از مشتقات RBC میباشد(19). طبق تحقیقات اخیر نشان داده شده که فرآوردههای RBC در طی مدت ذخیرهسازی دچار یک سری تغییرات ناشی از آسیبهای دوران نگهداری فرآودههای خونی میگردند و این آسیبها منجر به آزاد شدن یک سری از فاکتورها از گلبولهای قرمز میشود که آزاد شدن این فاکتورها به واسطه ایمنومدولاسیون سیستم ایمنی میتواند باعث آغاز پاسخهای التهابی پس از جراحی گردد(20، 19). از جمله ترکیبات گلبول قرمز که در اثر آسیب ناشی از ذخیرهسازی RBC تولید میشوند و میتوانند بر بروز التهاب اثرگذار باشند میتوان به هموگلوبین آزاد(Free Hemoglobin)، هم (Heme) و آمونیاک(NH3) اشاره کرد. لذا ابتدا در مورد این ترکیباب و سپس به داروهای بیهوشی پس از عمل جراحی قلب که در بروز التهاب نقش دارند با دیدگاه مولکولی پرداخته و یافتههای خود را بر پایه مکانیسمهای مولکولی التهاب القا شده توسط ترکیبات فوقالذکر و داروهای بیهوشی بیان مینماییم.
ترکیبات گلبول قرمز:
هموگلوبین آزاد(Free Hemoglobin)
یکی از فاکتورهایی که پس از ذخیرهسازی در کیسههای
packed-RBC افزایش مییابد، هموگلوبین((Hb آزاد اسـت
که ناشی از همولیز RBC میباشد(21). بسیاری از مواد بیولوژیکی فعال در کیسههای خون، مانند Hb آزاد میتوانند سلولهای اندوتلیال و ایمنی را فعال کرده و باعث التهاب شوند(22). Hb آزاد نفوذپذیری سلولهای اندوتلیال عروقی را افزایش میدهد و عملکرد اندام مربوطه را مختل میکند(23). پس از انتقال خون، سیتوکینهای التهابی مانند فاکتور نکروزدهنده تومور-آلفا (TNF-α) و اینترلوکین 1 بتا (IL-1β) معمولاً سلولهای اندوتلیال(EC) را در شرایط التهابی فعال میکنند(24). هنگامی که Hb به شکل اکسید شده تبدیل میگردد، تحت عنوان Free Hb نامیده میشود. Free Hb به واسطه تحریک IL-1β از ماکروفاژ (MQ)باعث افزایش فعال شدن(NLRP3) NLR Family Pyrin Domain Containing 3 میگردد. NLRP3 یکی از اجزای اینفلامازوم میباشد که در تحریک پاسخهای ایمنی ذاتی و پیشرفت التهاب نقش دارد(25). واسطههای التهابی و استرس اکسیداتیو میتوانند باعث آسیب سلولی در بسیاری از بافتها مانند اندوتلیال عروقی شوند(26). استرس اکسیداتیو اغلب در طی فرآیند التهاب وجود دارد. بنابرایـن، مهـار ایـن دو پارامتـر میتوانـد راهی برای محافظت از عملکرد سلول باشد(27). Hb آزاد F2-isoprostanes و isofuransرا به عنوان مارکرهای استرس اکسیداتیو افزایش میدهد؛ اکسیداسیون غیر آنزیمی اسید آراشیدونیک هر دو را تولید میکند(23). در مطالعهای که بیماران دارای مشکلات قلبی و عروقی را پس از جراحی مورد بررسی قرار داد، مایع پریکارد حاوی مقدار زیادی Hb اکسید شده آزاد بود که با سطوح بالای F2-isoprostanes همراهی داشته است(28).
علت افزایش سیتوکاینهای التهابی پس از انتقال خون ممکن است آزاد شدن مارکرهای فعال کننده اندوتلیال مانند مولکول چسبندگی سلول عروقی -1(VCAM-1) و MIF باشد که باعث تحریک سیستم ایمنی بدن میشود(29). همچنین Free Hb به واسطه بیان P- سلکتین، E- سلکتین و ICAM-1 بر روی EC باعث افزایش کموتاکسی سلولهای ایمنی و بروز پاسخهای التهابی میگردد(30). ICAM-1 و VCAM-1 با سلولهای التهابی همکاری میکنند و باعث شرایط مزمن التهاب و اختلال عملکرد اندوتلیال میشوند. Nuclear factor-κB (NF-κB) به عنوان یک القاگر التهابی، بیان VCAM-1 و ICAM-1 را در EC تنظیم میکند. مسیر سیگنالینگ AMPK / NF-κB / NLRP3 یک سیگنال مهم مرتبط با اختلال عملکرد سلولهای اندوتلیالی است؛ این مسیر التهاب و استرس اکسیداتیو را تنظیم میکند. AMPK (5-prime-Amp-Activated protein kinase) تنظیمکننده متابولیسم سلولی است که در EC ها بیان میشود و دارای اثرات ضد التهابی و آنتیاکسیدانی است. استفاده درمانی از آگونیستAMPK بر بهبود عملکرد EC تأثیر میگذارد و باعث ایجاد استرس اکسیداتیو توسط H2O2 میشود. فسفوریلاسیون و فعالسازی AMPK با فعالسازی نیتریک اکساید سنتتاز اندوتلیالی(eNOS) عملکرد EC را بهبود میبخشد. فعالسازی AMPK و سرکوب NLRP3 و NF-kB میتواند در کنترل شرایط التهابی ناشی از Free Hb سودمند باشد. علاوه بر این Free Hb میتواند به واسطه تولید واسطههای فعال اکسیژن(ROS)، باعث تبدیل LDL به ox-LDL شود. ox-LDL در واقع یکی از عوامل اصلی اختلال در عملکردEC و بروز بیماری قلبی و عروقی (CVD) میباشد(31). علیرغم این که Hb آزاد میتواند باعث بروز پاسخهای التهابی گردد، میتواند به واسطه اتصال به نیتریک اکساید(NO) و افزایش پاکسازی آن از خون باعث انقباض EC و اختلال در جریان خون شود. در حقیقت NO به عنوان یکی از عوامل گشادکننده عروق میباشد که از طریق تولید گوانوزین مونوفسفات حلقوی (cGMP) و تحریک مسیر سیگنالینگ مرتبط به آن باعث کاهش بیان ملکولهای چسبنده در سطح EC میگردد(32). ال- آرژنین((L-arginine که به عنوان سوبسترا برای تولید NO استفاده میشود، از طریق افزایش تجمع آنزیم آرژیناز در کیسههای خون باعث تجزیه آن میگردد. همچنین نشان داده شده که ال ـ آرژینین به عنوان یکی از عوامل اصلی تولید سلولهای خونی نقش دارد. بنابراین کاهش آن همراه با کاهش خونسازی و افزایش نیاز به تزریق خون در بیماران میباشد که میتواند باعث تشدید علایم بالینی بیماران شود(33). افزایش سطح Hb پس از تزریق خون باعث افزایش تولید ترومبین و فعال شدن سیستم انعقــادی
میشود(34). ترومبین، پلاکـت را فعال کرده و فیبرینولیز را
شروع میکند. همچنین باعث ترشح فعالکننده پلاسمینوژن بافتی از ECs میشود(35). در یک مطالعه، گزارش شد که فرآیند ذخیرهسازی سلول((Cell saving میتواند واسطههای التهابی مانند IL-6 را کاهش دهد و از قرار گرفتن در معرض عوارض انتقال خون در بیماران جلوگیری کند. این تئوری میتواند از اختلال عملکرد سلولهای اندوتلیال به دلیل اثر سیتوکاینهای التهابی یا افزایش پاسخ ایمنی در نتیجه فعالسازی ECs جلوگیری کند(34). به طور کلی، افزایش هموگلوبین منجر به اختلال در عملکرد ECs میشود، که نقشی حیاتی در بیماریهای قلبی دارد. تجمع Hb آزاد در کیسههای خون از طریق مکانیزمهای مختلف میتواند پاسخهای التهابی را تحریک کند. حذف Hb آزاد درون کیسههای خون میتواند از التهاب و اختلالات عروقی جلوگیری کند.
هم(Heme)
زمانی که Hb تحت تاثیر ROS اکسید میگردد، گروه هم از زنجیرههای گلوبین آن جدا شده و به صورت آزاد در گردش خون تجمع مییابد. همچنین ROS میتواند باعث تولید سیتوکاینها و مدیاتورهای التهابی شود، که ممکن است باعث آسیب به بافت گردد(36). در صورتی که هم از خون پاکسازی نگردد، همانند Hb آزاد میتواند باعث تحریک پاسخهای التهابی و ترومبوز شود. سیگنالینگ استرس اکسیداتیو از طریق NF-kB و پروتئین کینازهای فعال شده با میتوژن(MAPK) التهاب را افزایش میدهد(37). NF-κB، وارد هسته سلول میشود و ترشح سیتوکاینهای التهابی، سیکلواکسیژناز -2(COX-2) و نیتریک اکسید سنتتاز القایی (iNOS)را تنظیم میکند(38). اینترلوکین 1 بتا(IL-1b) باعث بیان iNOS در EC میشود (39). همچنین، فعالسازی فسفاتیدیل اینوزیتول 3-کیناز (PI3K)/AKT در بیان iNOS و COX-2 نقش دارد ؛ PI3K با فعال کردن AKT باعث پاسخ های التهابی میشود(40). فعالسازی مسیر سیگنالینگ MAPK باعث افزایش بیان p38 ، extracellular signal-regulated kinase (ERK)و c-Jun N-terminal kinase (JNK) میشود؛ این روند تنظیمـی

در فرآیند التهابی شرکت میکند(41).
با توجه به این مطلب، میتوان ادعا کرد که استفاده از مهارکنندههایNF-κB و MAPK میتواند به کنترل شرایط التهابی کمک کند. بسیاری از سلولها از طریق Anitioxidant Response Element (ARE) و transcription factor erythrocyte 2-associated factor 2 (Nrf2) به استرس اکسیداتیو پاسخ میدهند(42). سیگنالینگ Nrf2 از سلول در برابر استرس اکسیداتیو محافظت میکند. سیگنالهای محرک سلولی باعث میشود Nrf2 برخی از ژنهای محافظت از سلول مانند هم اکسیژناز -1 (HO-1) را بیان کند(43). HO-1 که توسط Nrf2 القا میشود از پاسخهای التهابی و استرس اکسیداتیو جلوگیری میکند(44). اگر چه نقش Nrf2 و HO-1 هنوز ناشناخته است، میتوان فرض کرد که فعالسازی Nrf2 میتواند از تخریب سلول جلوگیری کند. مسیر AMPK و Silent information regulator را نیز میتوان راهی برای محدود کردن التهاب دانست(45). فعالسازی Toll Like Receptor-4 (TLR4) میتواند منجر به واکنشهای التهابی شود. مولکولهای درونزا که در اثر آسیب بافتی آزاد میشوند نیز میتوانند TLR4 را فعال کنند(46). از این رو نشان داده شده که هنگامی که هم به TLR4 متصل میگردد، باعث فعال شدن NF-kB و تولید سیتوکاینهای التهابی میگردد. بنابراین، میتوان فرض کرد که استفاده از مهارکنندههای TLR4 میتواند اثرات التهابی و اکسیداتیو را بر روی گیرنده کیسه خون کاهش دهد. همچنین افزایش میزان هم آزاد میتواند باعث افزایش بیان فاکتور بافتی(TF) در سطح بسیاری از سلولها از جمله منوسیتها گردد. بیان TF نه تنها باعث بروز پاسخهای التهابی و تشکیل ترومبوز میشود بلکه باعث افزایش اتصال پلاکت به EC و بروز اختلال در عملکرد سلولهای اندوتلیالی نیز میگردد(47). هنگام اینتراکشن پلاکت با EC ، فاکتور high-mobility group box protein 1 (HMGB-1) از گرانولهای پلاکت آزاد میگردد. HMGB-1 به واسطه فعالکردن مسیر TLR4/MYD88 و همچنین مسیر BTK باعث بروز ترومبوز و التهاب میشود(48). از طرف دیگر نشان داده شده که بیان TF همراه با افزایش CXCL4 میباشد. در مطالعهها نشان داده شده که CXCL4 از بیان Hemeoxigenase-1 (HO-1) که یک پاکسازیکننده هم از جریان خون میباشد، جلوگیری میکند. همچنین بیان CD163 بر روی MQs نقش مهمی در جمعآوری Hb آزاد و هم دارد. مشخص شده که بیان CD163 باعث افزایش بیان HO-1 شده و از این طریق باعث افزایش پاکسازی هم از جریان خون میگردد. همچنین CXCL4 اثر مهاری بر روی بیان CD163دارد(50، 49)(شکل 1). بنابراین تارگت کردن مسیرهای التهابی همچون NF-kB و همچنین جلوگیری از شکلگیری آبشارهای انعقادی میتواند به واسطه مهار بیان CXCL4 باعث افزایش بیان HO-1 شده و از رخداد واکنشهای التهابی از طریق افزایش پاکسازی هم از جریان خون جلوگیری کند. هموپکسین و RBC شسته شده میتواند از مسمومیت هم جلوگیری کند. هموپکسین با اتصال به Hb ، Hb آزاد را کاهش میدهد و از عوارض التهابی جلوگیری میکند(51). در نتیجه، جلوگیری از ترشح هم یا استفاده از پاککنندههای هم از فعال شدن سیگنالهای التهابی جلوگیری میکند.
آمونیاک(NH3):
آمونیاک( (NH3در حقیقت یکی دیگر از موادی است که در طی ذخیرهسازی فرآوردههای خونی در اثر تغییر در متابولیسم RBC در کیسههای خون تجمع مییابد. به عبارت دیگر، میزان NH3 در کیسههای خون ارتباط نزدیکی با آسیبهای وارد شده به RBC در طی دوران ذخیرهسازی دارد(52). بر این اساس مطالعههای اخیر نشان
داده NH3 موجود در کیسههای خون نقش قابل توجهی در بروز التهاب پس از عمل جراحی قلب دارد(53، 52). NH3 به عنوان یونهای آمونیوم در بدن وجود دارد که باعث هایپرآمونمی و اختلال در تعادل یونی در بدن میشود؛ این اختلال سرانجام منجر به استرس اکسیداتیو میگردد(54). فزونیNH3 در کیسههای خون میتواند منجر به التهاب در گیرنده شود. NH3 به واسطه افزایش فعالیت iNOS ، تولید NO را افزایش میدهد و متعاقباً از این طریق میتواند القاگر التهاب باشد. iNOS یکی از آنزیمهایی است که از ال– آرژنین، نیتریک اکساید تولید میکند؛ بیان ژن iNOS به عوامل التهابی زیادی مانند NF-κB ،TNF-α و اینترفرون گاما(INF-γ) بستگی دارد(55). همچنین منجر به افزایش سطح mRNAمولکول NF-Kβ شده و در نتیجه ژنهای TNF-α، IL-1β و TLR-2A را فعال میکند(53). فعالیت NF-κB و افزایش TNF-α منجر به اختلال عملکرد قلب و انفارکتوس میوکارد میشود(56). NH3 میتواند از طریق ROS باعث استرس اکسیداتیو شود. افزایش مقدار ROS باعث تولید پروکسیدهای لیپیدی و پروتئینهای اکسید شده میشود که به غشای سلول آسیب میرساند و باعث آپوپتوز میشود(57). افزایش آپوپتوز میتواند منجر به اختلالات سیستم ایمنی بدن شود. در نتیجه، NH3 مکانیسم آپوپتوز را تغییر میدهد(58). NH3 با مهار فعالیت دهیدروژناز میتوکندریایی به ساختار و عملکرد میتوکندری آسیب میرساند(59). تخریب میتوکندری با انتشار سیتوکروم C و افزایش بیان کاسپاز ۳ و ۹ همراه است(60). یک مطالعه نشان داد که ژنهای مرتبط با آسیب به میتوکندری، مانند dynamin-related protein 1 (Drp1) و mitochondrial fission factor (Mff) با افزایش NH3 به طور چشمگیری افزایش مییابد(61). NH3 فعالیت برخی از آنزیمهای سرم مانند آسپارتات آمینوترانسفراز (AST)و آلانین آمینوترانسفراز(ALT) را افزایش میدهد، که به بافتها آسیب میرساند(62). در مطالعههای قبلی نشان داده شده بود که افزایش NH3 با افزایش cell free DNA (cfDNA) همراه بوده که باعث فعال کردن TLR-9 و بروز التهاب میگردد. همچنین در مطالعههای اخیر نشان داده شـده کـه افزایـش میـزان cfDNA در بیمـاران پس از عمل
جراحی قلب به علت فعالسازی TLR-9 رخ میدهد.
همچنین فعال کردن TLR-9 در بیماران تحت عمل جراحی قلب همراه با اختلال در عملکرد سلولهای اندوتلیالی میباشد(64، 63). در مطالعهای دیگر نشان داده شده است که فعالشدن ماکروفاژ Mo توسط TLR-9 همراه با افزایش تولید فاکتور بافتی(TF) میباشد که باعث فعال شدن آبشارهای انعقادی و بروز التهاب و اختلال در عملکرد سلولهای اندوتلیالی میگردد. بنابراین میتوان گفت در بیماران تحت عمل جراحی قلب بروز اختلال اندوتلیالی و همچنین افزایش cfDNA میتواند به واسطه NH3 موجود در کیسههای خون باشد که برای بیماران استفاده میگردد (65). از این رو، شناسایی cfDNA و مارکرهای مرتبط با اختلال در عملکرد سلولهای اندوتلیالی میتواند احتمال تجمع NH3 در کیسههای خون تزریقی و فعال کردن TLR-9 را نشان دهد. NH3 باعث فعال کردن مسیرهای سیگنالینگ مختلفی در ارتباط با بروز التهاب پس از عمل جراحی قلب میگردد. یکی از این مسیرها ، P38/MAPK میباشد. فعال شدن این مسیر همراه با مهار فاکتور احیاکننده Nrf2 و افزایش تولید ROS میباشد(66). در یک مطالعه نشان داده شده بود که بیان miR-26b به واسطه مهار بیان COX-2 باعث جلوگیری از فعال شدن مسیر P38/MAPK میگردد(67). همچنین افزایش بیان miR-135a به واسطه فعالکردن مسیر P38/MAPK/NF-kB باعث افزایش هیپرتروفی کاردیومیوسیتها به واسطه بروز التهاب میگردد (68)(شکل 1 ). در نهایت میتوان این طور نتیجهگیری کرد که ارزیابی miRs و سایر مارکرهای التهابی مرتبط با NH3 میتواند باعث شناسایی مارکرهای آغازکننده التهاب پس از عمل جراحی قلب و طراحی استراتژیهای درمانی مناسب برای جلوگیری از بروز التهاب و کاهش عملکرد بافت قلب گردد. NH3 میتواند فعالیت برخی از سیتوکرومها مانند CYP1C1 ، CYP2A و CYP2C8 را افزایش دهد. سیتوکرومها پروتئینهایی هستند که در تنظیم برخی از سیتوکاینها نقش دارند؛ همچنین میتوانند با تحریـک آنتـیاکسیـدانها سیتوکاینهای التهابی را نیز فعال
کنند(70، 69).
وقتی ژنهای التهابی در معرض NH3 قرار بگیرند، NF-
kB فعال شده و منجر به اختلالات سیستم ایمنی بدن میشود. NH3 میتواند با افزایش عملکرد IL4 ،IL10 و Treg و کاهش سلولهایTh1 و IFNγ پاسخهای التهابی را مختل کند(69). آکرولین با مهار IL-8 و TNF-α میتواند فعالیت NF-kB را مهار کند(71). مداخلات غیر مستقیم NH3 از طریق مکانیسمهای مختلف در اندامهای آسیب دیده و در افراد با نقایص ایمنی، اهمیت این گاز سمی را در کیسههای خون نشان میدهد؛ این امر میتواند آسیبهای جبرانناپذیری به بیماران قلبی وارد کند.
داروهای بیهوشکننده:
عوامل تزریقی:
استفاده از مواد بیهوشی قبل از عمل جراحی قلب میتواند به واسطه ایمنومدولاسیون باعث تغییر در پاسخهای التهابی پس از فرآیند جراحی گردد. همچنین نشان داده شده که استفاده از مواد بیهوشی چه به صورت تزریقی و یا استنشاقی میتواند اثرات متفاوتی بر روی سلولهای سیستم ایمنی داشته باشد. به عنوان مثال، عوامل داخل وریدی مانند پروپوفول، میدازولام، کتامین و بنزودیازپینها از طریق مکانیسمهای متفاوت تأثیرات مختلفی بر روی پاسخهای التهابی دارند(73، 72). پروپوفول(2 ، 6-دی ایزوپروپیل فنول) گیرنده گاما آمینوبوتیریک اسید نوع (GABAA) A را فعال کرده و گیرنده N-متیل-D-آسپارتات (NMDA)را مهار میکند؛ این ترکیب همچنین میتواند با کنترل این دو گیرنده شرایط التهابی را سرکوب نماید(75، 74) . به علاوه این ماده بیهوشی با مهار تمایز سلولهای Th2 نیز میتواند از بروز التهاب جلوگیری کند(76). بر اساس مطالعههای انجام شده نتایج نشان دادهاند که استفاده از پروپوفول باعث افزایش تعداد ماکروفاژهای Mo با مارکرهای CD163high وHLA-DRlow میشود که خاصیت التهابی داشته و با افزایش همولیز RBCs پس از عمل جراحی همراه میباشد(78، 77). پروپوفول باعث افزایش تولید TNF-α به واسطه فعال کردن مسیر NF-kB میگردد. همچنین مشخص شده که پروپوفـول بـاعث افزایـش COX-2 و کاهـش بیـان آنزیـم
نیتریک اکساید سنتتاز(NOS) نیز میشود. بیان COX-2 علیرغم افزایش تولید پروستاگلاندین(PGs)، با افزایش تولید سیتوکاینهای التهابی مانندIL-6 و IL-1نیز همراه میباشد(80، 79). اما در مطالعهای دیگر نشان داده شده است که پروپوفول باعث کاهش التهاب به واسطه مهار مسیر NF-kB و کاهش تولید COX-2 میگردد(81). پروپوفول با مهار miR-155 از تولید واسطههای التهابی و عملکرد نوتروفیلها جلوگیری میکند. miR-155 در رونویسی سلولهای میلوئیدی و کنترل پاسخهای التهابی نقش دارد. مسیر سیگنالینگ miR-155 در عملکرد پروپوفول مؤثر است؛ به طوری که حذف miRذکر شده اثرات ضد التهابی پروپوفول را کاهش میدهد(83، 82) . miR-155 از طریق افزایش بیان مولکول Suppressor of cytokine signaling 1 (SOCS1) میتواند اثرات ضد التهابی خود را القا کند(83). پروپوفول با فعال کردن Nrf2 و افزایش آنزیم آنتیاکسیدان HO-1میتواند استرس اکسیداتیو را کاهش دهد(84). یک مطالعه نشان داده است که پروپوفول میتواند با مکانیزم ناشناخته NADPH اکسیداز 2 (NOX2) را مهار کرده و تولید ROS را کاهش دهد(85). MAPKیک مسیر سیگنالینگ ضروری در آسیب اکسیداتیو است؛ این مسیر در آسیبهای قلبی فعال شده و منجر به اختلال در ساختار و عملکرد قلب میشود(87، 86). افزایش بیان MAPK6 باعث آپوپتوز سلولی میشود که توسط پروپوفول کاهش مییابد(88). پروپوفول با اثرات آنتیاکسیدانی بر روی قلب و بسیاری از بافتهای دیگر از القای آسیب اکسیداتیو در بافتها و ارگانهای مختلف جلوگیری میکند(89). miR-133a در میوژنز قلبی نقش دارد. طبق یک مطالعه، پروپوفول میتواند منجر به افزایش بیان miR-133a شود. افزایش بیان miR-133a میتواند با هدف قرار دادن پروتئین کیناز 2 از آپوپتوز میوسیتهای قلبی جلوگیری کند(90، 89). التهاب و آپوپتوز سلولهای اندوتلیالی به دنبال تزریق خون میتواند آسیبهای زیادی به بافت وارد کند. میتوکندری منبع اصلی ROS است. ROS بـا افزایـش نفوذپذیــری میتوکندری و خروج سیتوکرومC
باعث آپوپتوز سلولهای اندوتلیال میشود(91).
از طرف دیگر، ROSبا فعال کردن NF-kB و افزایش بیان
مولکولهای چسبندگی میتواند باعث التهاب در EC شود(92). همچنین میتواند با NO واکنش نشان دهد و اختلال عملکرد اندوتلیال را کاهش دهد(93). پروپوفول میتواند بیان پروتئین فسفاتاز 2(PP2A) را با اثر آنتیاکسیدانی کاهش داده و از سلولهای اندوتلیال در برابر ROS محافظت کند(75). PP2A یک تنظیمکننده التهاب است، که فعالسازی آن به جلوگیری از التهاب کمک میکند(94). مسیر JAK2/STAT3 در آنژیوژنز، بقای سلول و تکثیر نقش دارد. با فعالسازی این مسیر سیگنالینگ میتوان پروپوفول را به عنوان داروی محافظ ارگان در نظر گرفت(95). در مطالعههای انجام شده نشان دادهاند که پروپوفول عمدتاً به واسطه TNF-α اثر بروز التهاب و یا اثر مهاری خود را اعمال میکند. بر این اساس نشان داده شد که ترشح TNF-α باعث افزایش تولید matrix metalloproteinase 9 (MMP9) از طریق فعال کردن مسیر ca2+/CAMKII/NF-kB میگردد که استفاده از پروپوفول به واسطه مهار تولید TNF-α باعث کاهش التهاب میشود(95). همچنین در مطالعهای دیگر نشان داده شد که TLR-4 به واسطه فعال کردن مسیر CAMKII/p-TAK1/p-IRF-3 باعث تولید سیتوکاینهای التهابی میگردد اما مشخص گردید که القای بیان miR-148a میتواند به واسطه مهار CAMKII باعث کاهش پاسخهای التهابی گردد (96). پروپوفول با مهار TLR4 میتواند تولید سیتوکاینهای پیشالتهابی را کنترل کند. بنابراین میتوان گفت احتمالاً پروپوفول به واسطه القای بیان miR-148a باعث جلوگیری از تولید واسطههای التهابی میگردد. در یک مطالعه دیگر نیز نشان داده شده بود که TNF-α باعث فعال شدن مسیر HIF-1α/VEGF/VEGFR2/ERK میشود که در نهایت باعث افزایش التهاب به واسطه تولید MMPs میگردد؛ اما استفاده از پروپوفول از فعال شدن این مسیر جلوگیری میکند. بنابراین با توجه به این نکته که بیان Hypoxia-inducible factor 1 (HIF) و تولید(VEGF) vascular endothelial growth factor میتواند همراه با رگزایی باشد و از آن جایی که رگزایی باعث ترمیم کاردیومیوسیتهای آسیبدیده و بهبود نارساییهای قلبی میگردد، این مسأله را باید در نظر داشت که استفاده از پروپوفول هرچند باعث کاهش التهاب میشود اما میتواند باعث کاهش رگزایی و جلوگیری از ترمیم سلولهای قلبی نیز شود(97).
عوامل استنشاقی:
عوامل استنشاقی از جمله سووفلوران، دسفلوران، هالوتان و زنون، مانند عوامل داخل وریدی، میتوانند از طریق مکانیسمهای مختلف بر پاسخهای التهابی تأثیر بگذارند. با این حال، تأثیر عوامل استنشاق شده ممکن است متفاوت و چالش برانگیز باشد. در این راستا، سووفلوران استنشاق شده میتواند باعث التهاب شود، اما ممکن است پس از جراحی عوامل ضد التهابی مانندIL10 را نیز ایجاد کند(78، 77). همچنین نشان داده شده که سووفلوران به واسطه مهار مسیر NF-kB ، باعث کاهش التهاب شده و از این طریق باعث کاهش فاگوسیتوز میگردد. سووفلوران باعث کاهش بیان syndecan-1 نیز میشود. syndecan-1 به واسطه فعال کردن آنژیوتانسین II باعث افزایش تولید TGF-β میگردد که نقش مهاری در سیستم ایمنی دارد. در مطالعهای دیگر نشان داده شده که این دارو به واسطه مهار مسیر RhoA/FAK/p190 میتواند باعث کاهش فعال شدن NF-kB گردد. بنابراین به نظر میرسد که سووفلوران به عنوان یک شمشیر دو لبه بیشتر باعث کاهش بروز التهاب پس از عمل جراحی قلب شود(97). همچنین سووفلوران میتواند با کاهش مسیر سیگنالینگ PI3K/Akt/mTOR التهاب را آغاز کند؛PI3K / Akt/mTOR یک مسیر سیگنالینگ ضروری در تنظیم ترشح سیتوکاینهای التهابی است(98). فعالیت مولکول Mammalian target of rapamycin (mTOR) با افزایش یوبیکویتیناسیون فاکتور نسخهبرداری NF-Kβ منجر به کاهش عملکرد آن و متعاقباً کاهش التهاب میشود(99). عوامل استنشاقی مانند سووفلوران و ایزوفلوران میتوانند التهاب را در طی جراحی با افزایش تولید IL-6 و فعالسازی مسیر NF-κB راهاندازی کنند(100). دکسمدتومیدین یک آگونیست گیرندههایα2 آدرنرژیک انتخابی است و به صورت وریدی، مخاطی یا استنشاقی به منظور بیهوش کردن افراد ویا به عنوان آرامبخش استفاده میشود(101). دکسمدتومیدین با سرکوب NF-κB ، TLR4
و NLRP3 بیان سیتوکاینهای التهابی را مهار میکند(102). همچنین میتواند با افزایش فعالسازی PI3K/Akt/mTOR و مهار سووفلوران، تولید IL-6 ،IL-8 و TNF-α را مهار نماید(98). اگر چه مکانیسم عملکرد دکسمدتومیدین هنوز مشخص نیست، اما میتواند اثرات مفیدی علیه سووفلوران با عملکرد ضد التهابی داشته باشد.
بحث
آسیب ناشی از ذخیرهسازی RBC منجر به تولید ترکیباتی چون هموگلوبین، هم و آمونیاک در کیسه خون میشود و متعاقباً تزریق این خون به بیمار نیازمند به ترانسفیوژن خون در حین، قبل و بعد از عمل جراحی قلب میتواند خطر بروز التهاب و بیماریهای متعاقب آن را در این افراد افزایش دهد.
هموگلوبین آزاد میتواند به واسطه افزایش miR-144 و سرکوب مسیر سیگنالینگی mTOR القاگر التهاب باشد(103). در مطالعه پستا و همکاران نشان داده شده است که اکسیداسیون هموگلوبین آزاد میتواند به واسطه القای مسیر سیگنالینگی NLRP3/CASP1/NF-Kβ/IL-1β/TNF-α در القای التهاب در سلولهای اندوتلیالی نقش داشته و متعاقباً از طریق اختلال در عملکرد سلولهای اندوتلیالی منجر به بروز آترواسکلروزیس گردد(104) . به علاوه در مطالعه چولت و همکاران نیز این یافته حاصل شد که افزایش هموگلوبین آزاد میتواند از طریق القای فرآیند التهابی در دریافتکنندگان خون با دوز ترانسفیوژن بالا منجر به یک پیشآگهی ضعیف در بیماران دارای جراحی قلب شود(105). همچنین در مطالعه کیدو و همکاران نیز نتایج نشاندهنده این مطلب بود که غلظت هموگلوبین آزاد در بیماران همودیالیزی دارای سابقه قلبی و عروقی با وضعیت وخیم بالینی در این بیماران در ارتباط است(106). از طرف دیگر در مطالعه بوهلر و همکاران این نتیجه به دست آمد که غلظت هموگلوبین پلاسما با افزایش بیان مارکرهای استرس اکسیداتیو (malondialdehyde و 4-hydroxynonenal) و ICAM-1 (مارکر التهابی) در ارتباط بوده و از طریق فرآیند التهابی میتواند منجر به افزایش فشار خون در بیماران گردد. در این مطالعه همچنین یک راهکار پیشگیریکننده نیز ارائه گردید و آن استراتژی این بود که از طریق دریافت آنتیاکسیدانت تمپول(Tempol) میتوان اثرات التهابی و اکسیداتیو هموگلوبین آزاد را خنثی نمود و متعاقباً از این طریق فشار خون را نیز کاهش داد(107). هم(Heme) نیز میتواند از طریق القای مسیر سیگنالینگی TLR4 و فعالسازی اینفلاموزوم در پایین دست (downstream) مسیر سیگنالینگیNLRP3 منجر به تولید سیتوکاینهای پیشالتهابیTNF-α ، IL-6 و IL-1β شده و از این طریق القاگر التهاب باشد(108). در مطالعه اردی و همکاران نشان داده شده است که مولکول هم از طریق فعالسازی مسیر سیگنالینگی NLRP3 و متعاقباً فعال شدن اینفلاموزوم و تولید کاسپاز-۱ میتواند منجر به شکستن Pro-IL-18 وPro-IL-1β شده و متعاقباً با تولید این سیتوکاینها القاگر التهاب در سلولهای اندوتلیالی باشد. با القای التهاب در سلولهای اندوتلیالی اتصالات محکم بین سلولی از بین رفته و نهایتاً با اختلال در عملکرد سلولهای اندوتلیالی، خطر بروز بیماری قلبی و عروقی در فرد بالا میرود(110، 109). همچنین در مطالعه دوترا و همکاران نیز یافتهای مشابه مطالعه اردی و همکاران به دست آمد و نتیجه این مطالعه نیز نشان میداد که در بیماران مبتلا به آنمیهمولیتیک مانند تالاسمی و آنمی سلولهای داسی شکل، ترانسفیوژن مکرر خون از طریق افزایش هم میتواند به واسطه فعالسازی مسیر سیگنالینگی NLRP3 و تولید اینفلاموزوم و IL-1β منجر به القای التهاب شده و در وخیمتر شدن اوضاع بالینی بیماران مؤثر باشد(111). بنابراین این مطالب نشان میدهند که دریافت خون حاوی هم میتواند در بیماران دارای جراحی قلبی شرایط بالینی آنها را از طریق القای فرآیندهای التهابی و متعاقباً اختلال در عملکرد سلولهای اندوتلیالی تشدید کند و نه تنها بر بهبود وضعیت بالینی آنان کمککننده نباشد بلکه منجر به وخیمتر شدن اوضاع آنها نیز گردد. از طرف دیگر در مطالعه وینچی و همکاران یک استراتژی پیشگیریکننده از بروز التهاب به واسطه افزایش هم ارائه گردید. در این مطالعه مشاهده شد که استفاده از Hemopexin میتواند اثرات التهابی القا شده توسط هم را به واسطه تغییر فنوتیپی در ماکروفاژهای سیستم رتیکولواندوتلیال کاهش دهد(112). لذا میتوان از این راهکار جهت کاهش التهاب القا شده توسط هم در بیماران دریافتکننده خون تحت عمل جراحی قلب با میزان ترانسفیوژن بالا بهره جست. آمونیاک هم میتواند به واسطه مسیر سیگنالینگی miR-6615-5P/Smad7 منجر به فعالسازی فاکتور نسخهبرداری کننده التهابی NF-Kβ شده و در بروز التهاب نقش ایفا کند(113) . بدین صورت که در مطالعه هو و همکاران نتایج نشان دادهاند که میزان آمونیاک سرم میتواند با بروز التهاب و وخیمتر شدن شرایط بالینی بیماران مبتلا به اختلالات کبدی در ارتباط باشد. همچنین در این مطالعه سطح سرمی آمونیاک به عنوان یک مارکر پروگنوستیک جهت بروز Acute-on-chronic liver failure مطرح گردید(114).
به علاوه در مطالعه سیلیو و همکاران نیز یافتهها مطرحکننده این مطلب بودند که آمونیاک میتواند از طریق فعالسازی اینفلاموزوم در مسیر سیگنالینگی NLRP3 منجر به القای التهاب شود و متعاقباً با آسیب به ریه در تشدید شرایط بالینی بیمار نقش داشته باشد(115). از طرفی در مطالعه کاجی و همکاران به منظور جلوگیری از بروز التهاب به واسطه افزایش میزان آمونیاک نیز یک راهکار پیشگیرانه ارائه گردید. در این مطالعه پیشنهاد شد که میتوان التهاب ناشی از افزایش میزان آمونیاک را از طریق کاهش سطح سرمی آمونیاک با دریافت ریناکسیمین کاهش داد. این استراتژی پیشگیرانه بسیار در کاهش بروز التهاب و آنسفالوپاتی کبدی متعاقب آن در اثر افزایش سطح سرمی آمونیاک موثر بود(116) . لذا با شناسایی مسیرهای سیگنالینگی و مولکولی که توسط آن ها التهاب به واسطه فاکتورهای آسیبزا به RBC در طی ذخیرهسازی القا میشود، میتوان با ارائه تارگت تراپیهای مناسب و یا داروهای مؤثر بر این مسیرها، این نوع التهاب و عوارض ناشی از آن را کاهش داد.
در ارتباط با مصرف عوامل بیهوشکننده و التهاب القا شده توسط آنها ذکر این مطلب ضروری است که با توجه به مطالعههایی که تاکنون انجام شده، شواهد کافی و قطعی
با توجه به این مطلب، میتوان ادعا کرد که استفاده از مهارکنندههایNF-κB و MAPK میتواند به کنترل شرایط التهابی کمک کند. بسیاری از سلولها از طریق Anitioxidant Response Element (ARE) و transcription factor erythrocyte 2-associated factor 2 (Nrf2) به استرس اکسیداتیو پاسخ میدهند(42). سیگنالینگ Nrf2 از سلول در برابر استرس اکسیداتیو محافظت میکند. سیگنالهای محرک سلولی باعث میشود Nrf2 برخی از ژنهای محافظت از سلول مانند هم اکسیژناز -1 (HO-1) را بیان کند(43). HO-1 که توسط Nrf2 القا میشود از پاسخهای التهابی و استرس اکسیداتیو جلوگیری میکند(44). اگر چه نقش Nrf2 و HO-1 هنوز ناشناخته است، میتوان فرض کرد که فعالسازی Nrf2 میتواند از تخریب سلول جلوگیری کند. مسیر AMPK و Silent information regulator را نیز میتوان راهی برای محدود کردن التهاب دانست(45). فعالسازی Toll Like Receptor-4 (TLR4) میتواند منجر به واکنشهای التهابی شود. مولکولهای درونزا که در اثر آسیب بافتی آزاد میشوند نیز میتوانند TLR4 را فعال کنند(46). از این رو نشان داده شده که هنگامی که هم به TLR4 متصل میگردد، باعث فعال شدن NF-kB و تولید سیتوکاینهای التهابی میگردد. بنابراین، میتوان فرض کرد که استفاده از مهارکنندههای TLR4 میتواند اثرات التهابی و اکسیداتیو را بر روی گیرنده کیسه خون کاهش دهد. همچنین افزایش میزان هم آزاد میتواند باعث افزایش بیان فاکتور بافتی(TF) در سطح بسیاری از سلولها از جمله منوسیتها گردد. بیان TF نه تنها باعث بروز پاسخهای التهابی و تشکیل ترومبوز میشود بلکه باعث افزایش اتصال پلاکت به EC و بروز اختلال در عملکرد سلولهای اندوتلیالی نیز میگردد(47). هنگام اینتراکشن پلاکت با EC ، فاکتور high-mobility group box protein 1 (HMGB-1) از گرانولهای پلاکت آزاد میگردد. HMGB-1 به واسطه فعالکردن مسیر TLR4/MYD88 و همچنین مسیر BTK باعث بروز ترومبوز و التهاب میشود(48). از طرف دیگر نشان داده شده که بیان TF همراه با افزایش CXCL4 میباشد. در مطالعهها نشان داده شده که CXCL4 از بیان Hemeoxigenase-1 (HO-1) که یک پاکسازیکننده هم از جریان خون میباشد، جلوگیری میکند. همچنین بیان CD163 بر روی MQs نقش مهمی در جمعآوری Hb آزاد و هم دارد. مشخص شده که بیان CD163 باعث افزایش بیان HO-1 شده و از این طریق باعث افزایش پاکسازی هم از جریان خون میگردد. همچنین CXCL4 اثر مهاری بر روی بیان CD163دارد(50، 49)(شکل 1). بنابراین تارگت کردن مسیرهای التهابی همچون NF-kB و همچنین جلوگیری از شکلگیری آبشارهای انعقادی میتواند به واسطه مهار بیان CXCL4 باعث افزایش بیان HO-1 شده و از رخداد واکنشهای التهابی از طریق افزایش پاکسازی هم از جریان خون جلوگیری کند. هموپکسین و RBC شسته شده میتواند از مسمومیت هم جلوگیری کند. هموپکسین با اتصال به Hb ، Hb آزاد را کاهش میدهد و از عوارض التهابی جلوگیری میکند(51). در نتیجه، جلوگیری از ترشح هم یا استفاده از پاککنندههای هم از فعال شدن سیگنالهای التهابی جلوگیری میکند.
آمونیاک(NH3):
آمونیاک( (NH3در حقیقت یکی دیگر از موادی است که در طی ذخیرهسازی فرآوردههای خونی در اثر تغییر در متابولیسم RBC در کیسههای خون تجمع مییابد. به عبارت دیگر، میزان NH3 در کیسههای خون ارتباط نزدیکی با آسیبهای وارد شده به RBC در طی دوران ذخیرهسازی دارد(52). بر این اساس مطالعههای اخیر نشان
داده NH3 موجود در کیسههای خون نقش قابل توجهی در بروز التهاب پس از عمل جراحی قلب دارد(53، 52). NH3 به عنوان یونهای آمونیوم در بدن وجود دارد که باعث هایپرآمونمی و اختلال در تعادل یونی در بدن میشود؛ این اختلال سرانجام منجر به استرس اکسیداتیو میگردد(54). فزونیNH3 در کیسههای خون میتواند منجر به التهاب در گیرنده شود. NH3 به واسطه افزایش فعالیت iNOS ، تولید NO را افزایش میدهد و متعاقباً از این طریق میتواند القاگر التهاب باشد. iNOS یکی از آنزیمهایی است که از ال– آرژنین، نیتریک اکساید تولید میکند؛ بیان ژن iNOS به عوامل التهابی زیادی مانند NF-κB ،TNF-α و اینترفرون گاما(INF-γ) بستگی دارد(55). همچنین منجر به افزایش سطح mRNAمولکول NF-Kβ شده و در نتیجه ژنهای TNF-α، IL-1β و TLR-2A را فعال میکند(53). فعالیت NF-κB و افزایش TNF-α منجر به اختلال عملکرد قلب و انفارکتوس میوکارد میشود(56). NH3 میتواند از طریق ROS باعث استرس اکسیداتیو شود. افزایش مقدار ROS باعث تولید پروکسیدهای لیپیدی و پروتئینهای اکسید شده میشود که به غشای سلول آسیب میرساند و باعث آپوپتوز میشود(57). افزایش آپوپتوز میتواند منجر به اختلالات سیستم ایمنی بدن شود. در نتیجه، NH3 مکانیسم آپوپتوز را تغییر میدهد(58). NH3 با مهار فعالیت دهیدروژناز میتوکندریایی به ساختار و عملکرد میتوکندری آسیب میرساند(59). تخریب میتوکندری با انتشار سیتوکروم C و افزایش بیان کاسپاز ۳ و ۹ همراه است(60). یک مطالعه نشان داد که ژنهای مرتبط با آسیب به میتوکندری، مانند dynamin-related protein 1 (Drp1) و mitochondrial fission factor (Mff) با افزایش NH3 به طور چشمگیری افزایش مییابد(61). NH3 فعالیت برخی از آنزیمهای سرم مانند آسپارتات آمینوترانسفراز (AST)و آلانین آمینوترانسفراز(ALT) را افزایش میدهد، که به بافتها آسیب میرساند(62). در مطالعههای قبلی نشان داده شده بود که افزایش NH3 با افزایش cell free DNA (cfDNA) همراه بوده که باعث فعال کردن TLR-9 و بروز التهاب میگردد. همچنین در مطالعههای اخیر نشان داده شـده کـه افزایـش میـزان cfDNA در بیمـاران پس از عمل
جراحی قلب به علت فعالسازی TLR-9 رخ میدهد.
همچنین فعال کردن TLR-9 در بیماران تحت عمل جراحی قلب همراه با اختلال در عملکرد سلولهای اندوتلیالی میباشد(64، 63). در مطالعهای دیگر نشان داده شده است که فعالشدن ماکروفاژ Mo توسط TLR-9 همراه با افزایش تولید فاکتور بافتی(TF) میباشد که باعث فعال شدن آبشارهای انعقادی و بروز التهاب و اختلال در عملکرد سلولهای اندوتلیالی میگردد. بنابراین میتوان گفت در بیماران تحت عمل جراحی قلب بروز اختلال اندوتلیالی و همچنین افزایش cfDNA میتواند به واسطه NH3 موجود در کیسههای خون باشد که برای بیماران استفاده میگردد (65). از این رو، شناسایی cfDNA و مارکرهای مرتبط با اختلال در عملکرد سلولهای اندوتلیالی میتواند احتمال تجمع NH3 در کیسههای خون تزریقی و فعال کردن TLR-9 را نشان دهد. NH3 باعث فعال کردن مسیرهای سیگنالینگ مختلفی در ارتباط با بروز التهاب پس از عمل جراحی قلب میگردد. یکی از این مسیرها ، P38/MAPK میباشد. فعال شدن این مسیر همراه با مهار فاکتور احیاکننده Nrf2 و افزایش تولید ROS میباشد(66). در یک مطالعه نشان داده شده بود که بیان miR-26b به واسطه مهار بیان COX-2 باعث جلوگیری از فعال شدن مسیر P38/MAPK میگردد(67). همچنین افزایش بیان miR-135a به واسطه فعالکردن مسیر P38/MAPK/NF-kB باعث افزایش هیپرتروفی کاردیومیوسیتها به واسطه بروز التهاب میگردد (68)(شکل 1 ). در نهایت میتوان این طور نتیجهگیری کرد که ارزیابی miRs و سایر مارکرهای التهابی مرتبط با NH3 میتواند باعث شناسایی مارکرهای آغازکننده التهاب پس از عمل جراحی قلب و طراحی استراتژیهای درمانی مناسب برای جلوگیری از بروز التهاب و کاهش عملکرد بافت قلب گردد. NH3 میتواند فعالیت برخی از سیتوکرومها مانند CYP1C1 ، CYP2A و CYP2C8 را افزایش دهد. سیتوکرومها پروتئینهایی هستند که در تنظیم برخی از سیتوکاینها نقش دارند؛ همچنین میتوانند با تحریـک آنتـیاکسیـدانها سیتوکاینهای التهابی را نیز فعال
کنند(70، 69).
وقتی ژنهای التهابی در معرض NH3 قرار بگیرند، NF-
kB فعال شده و منجر به اختلالات سیستم ایمنی بدن میشود. NH3 میتواند با افزایش عملکرد IL4 ،IL10 و Treg و کاهش سلولهایTh1 و IFNγ پاسخهای التهابی را مختل کند(69). آکرولین با مهار IL-8 و TNF-α میتواند فعالیت NF-kB را مهار کند(71). مداخلات غیر مستقیم NH3 از طریق مکانیسمهای مختلف در اندامهای آسیب دیده و در افراد با نقایص ایمنی، اهمیت این گاز سمی را در کیسههای خون نشان میدهد؛ این امر میتواند آسیبهای جبرانناپذیری به بیماران قلبی وارد کند.
داروهای بیهوشکننده:
عوامل تزریقی:
استفاده از مواد بیهوشی قبل از عمل جراحی قلب میتواند به واسطه ایمنومدولاسیون باعث تغییر در پاسخهای التهابی پس از فرآیند جراحی گردد. همچنین نشان داده شده که استفاده از مواد بیهوشی چه به صورت تزریقی و یا استنشاقی میتواند اثرات متفاوتی بر روی سلولهای سیستم ایمنی داشته باشد. به عنوان مثال، عوامل داخل وریدی مانند پروپوفول، میدازولام، کتامین و بنزودیازپینها از طریق مکانیسمهای متفاوت تأثیرات مختلفی بر روی پاسخهای التهابی دارند(73، 72). پروپوفول(2 ، 6-دی ایزوپروپیل فنول) گیرنده گاما آمینوبوتیریک اسید نوع (GABAA) A را فعال کرده و گیرنده N-متیل-D-آسپارتات (NMDA)را مهار میکند؛ این ترکیب همچنین میتواند با کنترل این دو گیرنده شرایط التهابی را سرکوب نماید(75، 74) . به علاوه این ماده بیهوشی با مهار تمایز سلولهای Th2 نیز میتواند از بروز التهاب جلوگیری کند(76). بر اساس مطالعههای انجام شده نتایج نشان دادهاند که استفاده از پروپوفول باعث افزایش تعداد ماکروفاژهای Mo با مارکرهای CD163high وHLA-DRlow میشود که خاصیت التهابی داشته و با افزایش همولیز RBCs پس از عمل جراحی همراه میباشد(78، 77). پروپوفول باعث افزایش تولید TNF-α به واسطه فعال کردن مسیر NF-kB میگردد. همچنین مشخص شده که پروپوفـول بـاعث افزایـش COX-2 و کاهـش بیـان آنزیـم
نیتریک اکساید سنتتاز(NOS) نیز میشود. بیان COX-2 علیرغم افزایش تولید پروستاگلاندین(PGs)، با افزایش تولید سیتوکاینهای التهابی مانندIL-6 و IL-1نیز همراه میباشد(80، 79). اما در مطالعهای دیگر نشان داده شده است که پروپوفول باعث کاهش التهاب به واسطه مهار مسیر NF-kB و کاهش تولید COX-2 میگردد(81). پروپوفول با مهار miR-155 از تولید واسطههای التهابی و عملکرد نوتروفیلها جلوگیری میکند. miR-155 در رونویسی سلولهای میلوئیدی و کنترل پاسخهای التهابی نقش دارد. مسیر سیگنالینگ miR-155 در عملکرد پروپوفول مؤثر است؛ به طوری که حذف miRذکر شده اثرات ضد التهابی پروپوفول را کاهش میدهد(83، 82) . miR-155 از طریق افزایش بیان مولکول Suppressor of cytokine signaling 1 (SOCS1) میتواند اثرات ضد التهابی خود را القا کند(83). پروپوفول با فعال کردن Nrf2 و افزایش آنزیم آنتیاکسیدان HO-1میتواند استرس اکسیداتیو را کاهش دهد(84). یک مطالعه نشان داده است که پروپوفول میتواند با مکانیزم ناشناخته NADPH اکسیداز 2 (NOX2) را مهار کرده و تولید ROS را کاهش دهد(85). MAPKیک مسیر سیگنالینگ ضروری در آسیب اکسیداتیو است؛ این مسیر در آسیبهای قلبی فعال شده و منجر به اختلال در ساختار و عملکرد قلب میشود(87، 86). افزایش بیان MAPK6 باعث آپوپتوز سلولی میشود که توسط پروپوفول کاهش مییابد(88). پروپوفول با اثرات آنتیاکسیدانی بر روی قلب و بسیاری از بافتهای دیگر از القای آسیب اکسیداتیو در بافتها و ارگانهای مختلف جلوگیری میکند(89). miR-133a در میوژنز قلبی نقش دارد. طبق یک مطالعه، پروپوفول میتواند منجر به افزایش بیان miR-133a شود. افزایش بیان miR-133a میتواند با هدف قرار دادن پروتئین کیناز 2 از آپوپتوز میوسیتهای قلبی جلوگیری کند(90، 89). التهاب و آپوپتوز سلولهای اندوتلیالی به دنبال تزریق خون میتواند آسیبهای زیادی به بافت وارد کند. میتوکندری منبع اصلی ROS است. ROS بـا افزایـش نفوذپذیــری میتوکندری و خروج سیتوکرومC
باعث آپوپتوز سلولهای اندوتلیال میشود(91).
از طرف دیگر، ROSبا فعال کردن NF-kB و افزایش بیان
مولکولهای چسبندگی میتواند باعث التهاب در EC شود(92). همچنین میتواند با NO واکنش نشان دهد و اختلال عملکرد اندوتلیال را کاهش دهد(93). پروپوفول میتواند بیان پروتئین فسفاتاز 2(PP2A) را با اثر آنتیاکسیدانی کاهش داده و از سلولهای اندوتلیال در برابر ROS محافظت کند(75). PP2A یک تنظیمکننده التهاب است، که فعالسازی آن به جلوگیری از التهاب کمک میکند(94). مسیر JAK2/STAT3 در آنژیوژنز، بقای سلول و تکثیر نقش دارد. با فعالسازی این مسیر سیگنالینگ میتوان پروپوفول را به عنوان داروی محافظ ارگان در نظر گرفت(95). در مطالعههای انجام شده نشان دادهاند که پروپوفول عمدتاً به واسطه TNF-α اثر بروز التهاب و یا اثر مهاری خود را اعمال میکند. بر این اساس نشان داده شد که ترشح TNF-α باعث افزایش تولید matrix metalloproteinase 9 (MMP9) از طریق فعال کردن مسیر ca2+/CAMKII/NF-kB میگردد که استفاده از پروپوفول به واسطه مهار تولید TNF-α باعث کاهش التهاب میشود(95). همچنین در مطالعهای دیگر نشان داده شد که TLR-4 به واسطه فعال کردن مسیر CAMKII/p-TAK1/p-IRF-3 باعث تولید سیتوکاینهای التهابی میگردد اما مشخص گردید که القای بیان miR-148a میتواند به واسطه مهار CAMKII باعث کاهش پاسخهای التهابی گردد (96). پروپوفول با مهار TLR4 میتواند تولید سیتوکاینهای پیشالتهابی را کنترل کند. بنابراین میتوان گفت احتمالاً پروپوفول به واسطه القای بیان miR-148a باعث جلوگیری از تولید واسطههای التهابی میگردد. در یک مطالعه دیگر نیز نشان داده شده بود که TNF-α باعث فعال شدن مسیر HIF-1α/VEGF/VEGFR2/ERK میشود که در نهایت باعث افزایش التهاب به واسطه تولید MMPs میگردد؛ اما استفاده از پروپوفول از فعال شدن این مسیر جلوگیری میکند. بنابراین با توجه به این نکته که بیان Hypoxia-inducible factor 1 (HIF) و تولید(VEGF) vascular endothelial growth factor میتواند همراه با رگزایی باشد و از آن جایی که رگزایی باعث ترمیم کاردیومیوسیتهای آسیبدیده و بهبود نارساییهای قلبی میگردد، این مسأله را باید در نظر داشت که استفاده از پروپوفول هرچند باعث کاهش التهاب میشود اما میتواند باعث کاهش رگزایی و جلوگیری از ترمیم سلولهای قلبی نیز شود(97).
عوامل استنشاقی:
عوامل استنشاقی از جمله سووفلوران، دسفلوران، هالوتان و زنون، مانند عوامل داخل وریدی، میتوانند از طریق مکانیسمهای مختلف بر پاسخهای التهابی تأثیر بگذارند. با این حال، تأثیر عوامل استنشاق شده ممکن است متفاوت و چالش برانگیز باشد. در این راستا، سووفلوران استنشاق شده میتواند باعث التهاب شود، اما ممکن است پس از جراحی عوامل ضد التهابی مانندIL10 را نیز ایجاد کند(78، 77). همچنین نشان داده شده که سووفلوران به واسطه مهار مسیر NF-kB ، باعث کاهش التهاب شده و از این طریق باعث کاهش فاگوسیتوز میگردد. سووفلوران باعث کاهش بیان syndecan-1 نیز میشود. syndecan-1 به واسطه فعال کردن آنژیوتانسین II باعث افزایش تولید TGF-β میگردد که نقش مهاری در سیستم ایمنی دارد. در مطالعهای دیگر نشان داده شده که این دارو به واسطه مهار مسیر RhoA/FAK/p190 میتواند باعث کاهش فعال شدن NF-kB گردد. بنابراین به نظر میرسد که سووفلوران به عنوان یک شمشیر دو لبه بیشتر باعث کاهش بروز التهاب پس از عمل جراحی قلب شود(97). همچنین سووفلوران میتواند با کاهش مسیر سیگنالینگ PI3K/Akt/mTOR التهاب را آغاز کند؛PI3K / Akt/mTOR یک مسیر سیگنالینگ ضروری در تنظیم ترشح سیتوکاینهای التهابی است(98). فعالیت مولکول Mammalian target of rapamycin (mTOR) با افزایش یوبیکویتیناسیون فاکتور نسخهبرداری NF-Kβ منجر به کاهش عملکرد آن و متعاقباً کاهش التهاب میشود(99). عوامل استنشاقی مانند سووفلوران و ایزوفلوران میتوانند التهاب را در طی جراحی با افزایش تولید IL-6 و فعالسازی مسیر NF-κB راهاندازی کنند(100). دکسمدتومیدین یک آگونیست گیرندههایα2 آدرنرژیک انتخابی است و به صورت وریدی، مخاطی یا استنشاقی به منظور بیهوش کردن افراد ویا به عنوان آرامبخش استفاده میشود(101). دکسمدتومیدین با سرکوب NF-κB ، TLR4
و NLRP3 بیان سیتوکاینهای التهابی را مهار میکند(102). همچنین میتواند با افزایش فعالسازی PI3K/Akt/mTOR و مهار سووفلوران، تولید IL-6 ،IL-8 و TNF-α را مهار نماید(98). اگر چه مکانیسم عملکرد دکسمدتومیدین هنوز مشخص نیست، اما میتواند اثرات مفیدی علیه سووفلوران با عملکرد ضد التهابی داشته باشد.
بحث
آسیب ناشی از ذخیرهسازی RBC منجر به تولید ترکیباتی چون هموگلوبین، هم و آمونیاک در کیسه خون میشود و متعاقباً تزریق این خون به بیمار نیازمند به ترانسفیوژن خون در حین، قبل و بعد از عمل جراحی قلب میتواند خطر بروز التهاب و بیماریهای متعاقب آن را در این افراد افزایش دهد.
هموگلوبین آزاد میتواند به واسطه افزایش miR-144 و سرکوب مسیر سیگنالینگی mTOR القاگر التهاب باشد(103). در مطالعه پستا و همکاران نشان داده شده است که اکسیداسیون هموگلوبین آزاد میتواند به واسطه القای مسیر سیگنالینگی NLRP3/CASP1/NF-Kβ/IL-1β/TNF-α در القای التهاب در سلولهای اندوتلیالی نقش داشته و متعاقباً از طریق اختلال در عملکرد سلولهای اندوتلیالی منجر به بروز آترواسکلروزیس گردد(104) . به علاوه در مطالعه چولت و همکاران نیز این یافته حاصل شد که افزایش هموگلوبین آزاد میتواند از طریق القای فرآیند التهابی در دریافتکنندگان خون با دوز ترانسفیوژن بالا منجر به یک پیشآگهی ضعیف در بیماران دارای جراحی قلب شود(105). همچنین در مطالعه کیدو و همکاران نیز نتایج نشاندهنده این مطلب بود که غلظت هموگلوبین آزاد در بیماران همودیالیزی دارای سابقه قلبی و عروقی با وضعیت وخیم بالینی در این بیماران در ارتباط است(106). از طرف دیگر در مطالعه بوهلر و همکاران این نتیجه به دست آمد که غلظت هموگلوبین پلاسما با افزایش بیان مارکرهای استرس اکسیداتیو (malondialdehyde و 4-hydroxynonenal) و ICAM-1 (مارکر التهابی) در ارتباط بوده و از طریق فرآیند التهابی میتواند منجر به افزایش فشار خون در بیماران گردد. در این مطالعه همچنین یک راهکار پیشگیریکننده نیز ارائه گردید و آن استراتژی این بود که از طریق دریافت آنتیاکسیدانت تمپول(Tempol) میتوان اثرات التهابی و اکسیداتیو هموگلوبین آزاد را خنثی نمود و متعاقباً از این طریق فشار خون را نیز کاهش داد(107). هم(Heme) نیز میتواند از طریق القای مسیر سیگنالینگی TLR4 و فعالسازی اینفلاموزوم در پایین دست (downstream) مسیر سیگنالینگیNLRP3 منجر به تولید سیتوکاینهای پیشالتهابیTNF-α ، IL-6 و IL-1β شده و از این طریق القاگر التهاب باشد(108). در مطالعه اردی و همکاران نشان داده شده است که مولکول هم از طریق فعالسازی مسیر سیگنالینگی NLRP3 و متعاقباً فعال شدن اینفلاموزوم و تولید کاسپاز-۱ میتواند منجر به شکستن Pro-IL-18 وPro-IL-1β شده و متعاقباً با تولید این سیتوکاینها القاگر التهاب در سلولهای اندوتلیالی باشد. با القای التهاب در سلولهای اندوتلیالی اتصالات محکم بین سلولی از بین رفته و نهایتاً با اختلال در عملکرد سلولهای اندوتلیالی، خطر بروز بیماری قلبی و عروقی در فرد بالا میرود(110، 109). همچنین در مطالعه دوترا و همکاران نیز یافتهای مشابه مطالعه اردی و همکاران به دست آمد و نتیجه این مطالعه نیز نشان میداد که در بیماران مبتلا به آنمیهمولیتیک مانند تالاسمی و آنمی سلولهای داسی شکل، ترانسفیوژن مکرر خون از طریق افزایش هم میتواند به واسطه فعالسازی مسیر سیگنالینگی NLRP3 و تولید اینفلاموزوم و IL-1β منجر به القای التهاب شده و در وخیمتر شدن اوضاع بالینی بیماران مؤثر باشد(111). بنابراین این مطالب نشان میدهند که دریافت خون حاوی هم میتواند در بیماران دارای جراحی قلبی شرایط بالینی آنها را از طریق القای فرآیندهای التهابی و متعاقباً اختلال در عملکرد سلولهای اندوتلیالی تشدید کند و نه تنها بر بهبود وضعیت بالینی آنان کمککننده نباشد بلکه منجر به وخیمتر شدن اوضاع آنها نیز گردد. از طرف دیگر در مطالعه وینچی و همکاران یک استراتژی پیشگیریکننده از بروز التهاب به واسطه افزایش هم ارائه گردید. در این مطالعه مشاهده شد که استفاده از Hemopexin میتواند اثرات التهابی القا شده توسط هم را به واسطه تغییر فنوتیپی در ماکروفاژهای سیستم رتیکولواندوتلیال کاهش دهد(112). لذا میتوان از این راهکار جهت کاهش التهاب القا شده توسط هم در بیماران دریافتکننده خون تحت عمل جراحی قلب با میزان ترانسفیوژن بالا بهره جست. آمونیاک هم میتواند به واسطه مسیر سیگنالینگی miR-6615-5P/Smad7 منجر به فعالسازی فاکتور نسخهبرداری کننده التهابی NF-Kβ شده و در بروز التهاب نقش ایفا کند(113) . بدین صورت که در مطالعه هو و همکاران نتایج نشان دادهاند که میزان آمونیاک سرم میتواند با بروز التهاب و وخیمتر شدن شرایط بالینی بیماران مبتلا به اختلالات کبدی در ارتباط باشد. همچنین در این مطالعه سطح سرمی آمونیاک به عنوان یک مارکر پروگنوستیک جهت بروز Acute-on-chronic liver failure مطرح گردید(114).
به علاوه در مطالعه سیلیو و همکاران نیز یافتهها مطرحکننده این مطلب بودند که آمونیاک میتواند از طریق فعالسازی اینفلاموزوم در مسیر سیگنالینگی NLRP3 منجر به القای التهاب شود و متعاقباً با آسیب به ریه در تشدید شرایط بالینی بیمار نقش داشته باشد(115). از طرفی در مطالعه کاجی و همکاران به منظور جلوگیری از بروز التهاب به واسطه افزایش میزان آمونیاک نیز یک راهکار پیشگیرانه ارائه گردید. در این مطالعه پیشنهاد شد که میتوان التهاب ناشی از افزایش میزان آمونیاک را از طریق کاهش سطح سرمی آمونیاک با دریافت ریناکسیمین کاهش داد. این استراتژی پیشگیرانه بسیار در کاهش بروز التهاب و آنسفالوپاتی کبدی متعاقب آن در اثر افزایش سطح سرمی آمونیاک موثر بود(116) . لذا با شناسایی مسیرهای سیگنالینگی و مولکولی که توسط آن ها التهاب به واسطه فاکتورهای آسیبزا به RBC در طی ذخیرهسازی القا میشود، میتوان با ارائه تارگت تراپیهای مناسب و یا داروهای مؤثر بر این مسیرها، این نوع التهاب و عوارض ناشی از آن را کاهش داد.
در ارتباط با مصرف عوامل بیهوشکننده و التهاب القا شده توسط آنها ذکر این مطلب ضروری است که با توجه به مطالعههایی که تاکنون انجام شده، شواهد کافی و قطعی

در مورد این که استفاده از عوامل بیهوشی میتواند باعث بروز التهاب و یا مهار آن گردد به دست نیامده است.
همچنین با توجه به این که این عوامل مثل یک شمشیر دو لبه عمل کرده و در مواقعی باعث التهاب و در شرایط دیگری باعث مهار التهاب میگردند و به علاوه از آن جایی که این عوامل معمولاً به واسطه یک سری فاکتورهایی همچون miRs باعث اعمال اثرات خود بر روی پاسخهای التهابی میشوند میتوان استفاده از miRs را به عنوان یک مارکر تشخیصی برای مانیتورینگ اثرات عوامل بیهوشی بر روی پاسخهای التهابی به کار گرفت(جدول ۱).
نتیجهگیری
انتقال خون در حین جراحی و نوع بیهوشی مورد استفاده در ایجاد عوارض بعد از عمل مهم و حائز اهمیت میباشد. بررسی مسیرهای سیگنالینگ القایی میتواند به
کنترل وضعیت بالینی بیمار کمک کند؛ به طوری که این مسیرها میتوانند از فعال شدن سیستم ایمنی بدن به دلیل التهاب جلوگیری کنند. در نهایت میتوان گفت، ارزیابی miRs و دیگر مسیرهای ملکولی که احتمالاً به واسطه عوامل بیهوشی و فاکتورهای آزاد شده از RBCs لیز شده در کیسه فرآوردههای خونی فعال میگردند و همچنین شناسایی مسیرهای فعال شده توسط عوامل بیهوشی که باعث مهار پاسخهای التهابی میشوند، میتواند یک استراتژی درمانی و پیشگیریکننده را برای بیماران تحت عمل جراحی قلبی ایجاد کند.
تشکر و قدردانی
از کلیه همکارانی که ما را در نگارش این مقاله یاری نمودهاند، سپاسگزاری مینماییم.
نوع مطالعه: مروري |
موضوع مقاله:
ايمونوهماتولوژي
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






