جلد 18، شماره 4 - ( زمستان 1400 )
جلد 18 شماره 4 صفحات 268-255 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rahimi Mofrad M, Yari F, Nikougoftar Zarif M, Dadashi M, Aghaie A. Comparison of the effect of platelet lysate derived from umbilical cord blood and peripheral blood on the expansion and differentiation of MSCs. bloodj 2021; 18 (4) :255-268
URL: http://bloodjournal.ir/article-1-1398-fa.html
URL: http://bloodjournal.ir/article-1-1398-fa.html
رحیمی مفرد محدثه، یاری فاطمه، نیکوگفتار ظریف مهین، داداشی مریم، آقایی افسانه. مقایسه اثر لیزات پلاکتی مشتق از خون محیطی و خون بند ناف بر تکثیر و تمایز سلولهای مزانشیمال. فصلنامه پژوهشی خون. 1400; 18 (4) :255-268
دانشیار مرکز تحقیقات انتقال خون- موسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 1005 kb]
(1074 دریافت)
| چکیده (HTML) (2137 مشاهده)
مقدمه
سرم جنین گاو(FBS) معمولاً به منظور تأمین فاکتورهای رشد مورد نیاز برای تکثیر و تمایز سلول به محیط کشت سلولی اضافه میشود(2، 1). FBS همچنین به عنوان یک مکمل مورد تایید جهانی برای حمایت از گسترش و تمایز سلولهای بنیادی مزانشیمی انسان (Mesenchymal Stem Cell, MSC) استفاده شده است.
MSC یک گروه هتروژن از استمسلهای استرومال (Stromal Stem Cell) هستند. منبع اصلی این سلولها مغز استخوان است، این سلولها در دیگر بافتهای بدن مانند ماهیچه اسکلتی، بافت چربی، خون بند ناف، مایع سینوویوم، حفره دندانی، مایع آمینوتیک، کبد و ریه نیز حضور دارند(7-3). این سلولها طیفی از مارکرهای سطحی شاملCD105 ، CD73 ، CD166 ، CD29 ، CD44 ، CD90 و MHC-I را بیان میکنند و در مقایسه با هماتوپوئتیک استم سلها (Hematopoietic stem cells) برای مارکرهای CD45 ،CD34 ، CD133 و MHC-II منفی میباشند(7).
بهره بردن از FBS در محیط کشت میتواند خطر ابتلا به پریونها و/ یا عفونتهای مشترک بین انسان و دام و واکنشهای ایمنی مربوط به زنوژن را افزایش دهد. هم چنین نگرانی اصلی در مورد سلامت جنین اهداکننده در زمان گرفتن خون جنین به دلیل دستکاریهای جنینی افزایش یافته است. از این رو، سالها است که یافتن گزینه جایگزین انسانی FBS به عنوان یک موضوع تحقیقاتی مورد بررسی قرار گرفته است(8).
پلاکتها حاوی محتویات گرانولی متفاوتی هم چون گرانول a ، گرانول با هسته متراکم، لیزوزومها و پراکسیزومها هستند(1). هر پلاکت به طور تقریبی دارای 80-50 گرانول a است، که اکثر فاکتورهای رشد در این گرانولها وجود دارند(2). مطالعههای مختلف نشان داده که فاکتورهای رشد میتوانند نقش مهمی در پزشکی ترمیمی ایفا کنند، بنابراین پلاکتها به عنوان داروخانهای حامل فاکتورهای رشد به حساب میآیند(9) محصولات مشتق از پلاکت به عنوان یک ابزار مهندسی بافت به جراحان این امکان را میدهد تا با تاثیر بر محیط سلولها در خارج و داخل بدن، میزان موفقیت پیوند بافتهای نرم و سخت را افزایش دهند(10).
لیزات پلاکتی(Platelet Lysate) شامل همه فاکتورهای تشکیلدهنده پلاکتی است. لیزات را میتوان به راحتی با تخریب مکانیکی کنسانترههای پلاکتی از طریق ذوب و انجماد تهیه کرد(9). فاکتورهای رشد مشتق از لیزات پلاکت انسانی(HPL, Human Platelet Lysate) میتواند بر روی ردههای مختلف سلولی، سلولهای توموری و کندروسیتهای آرتیکولار موثر باشد. لذا استفاده از فاکتورهای مشتق از پلاکت به عنوان یک ابزار مؤثر در کشت سلول و جایگزین FBS مورد توجه قرار گرفته است(11). اخیراً منابع انسانی شامل مشتقات پلاکت و سرم انسان که از خون بند ناف، خون اتولوگ و یا آلوژن تهیه میشوند، به عنوان جایگزین FBS مورد مطالعه قرار گرفته است. استفاده از فرآوردههای انسانی به جای FBS احتمال آلودگی استمسلها با عوامل پریونی، ویروسی و بیماریهای مشترک بین انسان و دام را کاهش میدهد(12). هم چنین استفاده از HPL به عنوان ماده مغذی در کشت سلولهای مزانشیمال میتواند تأثیر مثبت داشته باشد(13). منابع انسانی اجزای خون مانند سرم انسانی یا مشتقات پلاکت اتولوگ یا آلوژنیک برای افزایش ایمنی استفاده میشود(16-14). محصولات مشتق از پلاکت اثرات متفاوتی بر میزان رشد سلولهای بنیادی مزانشیمی سلولهای مغز استخوان و بافت چربی دارند(17).
از این رو در این مطالعه، به منظور یافتن گزینههای مناسب برای FBS در محیط کشت سلولی، سلولهای بنیادی مزانشیمی از بافت جفت جدا شده و اثر لیزات پلاکت خون بند ناف و لیزات پلاکت خون محیطی بر تکثیر، گسترش و تمایز آنها به سلولهای استخوانی و سلولهای چربی مورد بررسی قرار گرفت.
مواد و روشها
نوع مطالعه در این تحقیق به صورت تجربی و روش انتخاب نمونهها تصادفی بود. سلولهای مزانشیمی از بافت جفت اهداکنندگان سالم پس از کسب رضایت تهیه شد. نمونههای پلاکت نیز از افرادی که فاقد هرگونه اختلالات کمی و کیفی پلاکتی بودند تهیه گردید. در این مطالعه 5 گروه مشتق از 3 کیسه خون بند ناف که با یکدیگر مخلوط شده بودند و هم چنین 5 گروه مشتق از 3 کیسه کنسانتره پلاکت خون محیطی مورد استفاده قرار گرفت.
تهیه لیزات پلاکتی:
ابتدا تمام خون داخل کیسه خون بند ناف و کنسانتره پلاکتی جدا شده از خون محیطی به طور جداگانه درون لولههای فالکون(Nunc ، دانمارک) ریخته شد، سپس به منظور حذف RBC و WBC به مدت 12 دقیقه،3 بار با دور g200 سانتریفیوژ(اپندورف، آلمان) گردید. سپس محلول رویی که حاوی پلاکتها بود به دقت توسط سمپلر (اپندورف، آلمان) جدا شده و به یک لوله دیگر منتقل گردید.
محلول جدا شده حاوی پلاکت به مدت 15 دقیقه با دور(RPM4400) g 1200 سانتریفیوژ گردید، محلول رویی دور ریخته شده و رسوب ته لوله که حاوی پلاکتها بود به همراه کمی از محلول باقی ماند. برای شستشو و حذف پلاسما از بافر نمکی فسفات(PBS)(سیگما، آمریکا) استفاده گردید، 12 میلیلیتر محلول PBS به سوسپانسیون پلاکتی اضافه و با دور(RPM4400) g 1200 به مدت 14 دقیقه سانتریفیوژ گردید. عمل شستشو برای هر لوله سه بار تکرار شد. پس از سه بار شستشو، محلول رویی خالی شده و 5 میلیلیتر PBS (سیگما، آمریکا) تازه به آن اضافه و از پلاکتها سوسپانسیون تهیه گردید و توسط دستگاه سل کانتر، تعداد آنها شمارش شد.
رسوب پلاکتی پس از شمارش در فریزر80- درجه سانتیگراد (Angelationi، ایتالیا) به مدت 3 ساعت قرار داده شد. پس از انجماد کامل بیرون آورده شد و در دمای محیط ذوب گردید. این مراحل برای 3 بار تکرار شد تا لیزات پلاکتی مورد نظر تهیه شود. پس از آخرین مرحله انجماد- ذوب، محلول به مدت 20 دقیقه با دور (RPM4400) g 1200 سانتریفیوژ گردید و بدین ترتیب بقایای سلولی از محیط عمل حذف شد. در نهایت غلظت پروتئینـی محلـول رویی با روش برادفورد اندازهگیری گردید.
جداسازی سلولهای بنیادی مزانشیمی از بافت جفت:
بافت جفت از مادرانی که فرم رضایتنامه کتبی را امضا کرده بودند، جمعآوری شد. به طور خلاصه، سلولهای تک هستهای آن پس از شستشو و حذف قطعات بافت جدا شدند و در فلاسک 75T (Nunc ، دانمارک) همراه محیط کشت DMEM-LG (جیبکو، آلمان) و 10%FBS (جیبکو، آلمان) کشت داه شد. پس از 24 ساعت با تعویض محیط کشت، سلولهای معلق غیر مزانشیمی از محیط برداشته شدند و سلولهای مزانشیمال با اتصال به کف فلاسک، پس از چند روز تشکیل کلنی داده و تکثیر شدند.
به مدت 14 روز، هر سه روز یک بار محیط کشت تعویض شد، پس از این مدت سلولهای مزانشیمی تکثیر یافته و تقریباً 90% کف فلاسک را پوشاندند. در این زمان سلولها پاساژ داده شد و به فلاسکهای جدید منتقل گردید.
تائید هویت سلولی، سلولهای بنیادی مزانشیمی:
به منظور تعیین هویت فنوتیپی سلولهای جدا شده از بافت جفت، سلولها پس از 5 پاساژ متوالی تریپسینه (ایده زیست نوترکیب - ایران) و از فلاسک جدا و در بافر فسفات شستشو شدند و سوسپانسیون سلولی با شمارش 1000 سلول در هر میکرولیتر تهیه شد. از سوسپانسیون مذکور مقدار 100 میکرولیتر و از آنتیبادیهای منوکلونال کنژوگه فلورسنت(داکو، دانمارک) CD44-FITC ، CD29-PE ، CD90-FITC، CD73-PE، CD105-FITC، CD166-PE، CD45-FITC و CD34-PE نیز مقدار 5 میکرولیتر به هر لوله افزوده شد. به موازات، سلولها با آنتیبادی ایزوتیپ کنترل نیز مجاور شدند. سپس لولهها 30 دقیقه در یخچال انکوبه و با افزودن 50 میکرولیتر از فیکساتیو پارافرمالدئید 1% (سیگما، آمریکا) با دستگاه فلوسیتومتری (پارتک، آلمان) تجزیه و تحلیل شدند. در هر تجزیه و تحلییل 5000 سلول بررسی گردید.
بررسی اثر لیزات پلاکتی برتکثیر سلولهای مزانشیمی:
سلولهای مزانشیمی به تعداد 104 × 5 در چاهکهای پلیت 24 خانهای(کره، SPL) کشت داده شدند. سلولهای مزانشیمی در محیط DMEM با غلظتهای متفاوت 10%، 5% و 2% از FBS به عنوان کنترل کشت داده شدند. کلیه آزمایشها به صورت دو بار تکرار(duplicate) گذاشته شد. در مورد نمونههای لیزات خون محیطی(PBL, Peripheral Blood Lysate)، غلظت پروتئین µg/mL 9000 به عنوان استاندارد در نظر گرفته شده و سپس با انجام محاسبات غلظت پروتئینی برای هر نمونه، مقدار مورد نیاز از لیزات پلاکتی که باید به محیط کشت اضافه میشد، به میزان 10% محیط کشت محاسبه گردید. هر نمونه به صورت دو بار تکرار گذاشته شد. در مورد نمونههای لیزات خون بند ناف (CBL, Cord Blood Lysate)، غلظت پروتئینی به دست آمده کمتر بود بنابراین، برای رسیدن به غلظت µg/mL 9000، محیط کشت حاوی30% لیزات به چاهکها اضافه گردید. همچنین به دو چاهک محیط حاوی 10% سرم خون AB و به دو چاهک محیط حاوی 10% سرم خون بند ناف با گروه خونی O اضافه گردید. علاوه بر این در دو چاهک محیط کشت حاوی 5% سرم AB به عنوان مکمل و 5% لیزات پلاکتی خون محیطی، و در دو چاهک محیط حاوی 5% سرم خون بند ناف به عنوان مکمل و 5% لیزات پلاکتی خون بند ناف اضافه شد. به مدت 7 روز، هر یک روز درمیان محیط کشت سلولها با همان شرایط گفته شده تعویض شد. سپس سلولها توسط تریپسین از کف چاهک جداشده و به صورت هم حجم با رنگ تریپانبلو(سیگما، آمریکا) مخلوط شده در نهایت با لام نئوبار(Marienfeld ، آلمان) شمارش شدند و درصد زنده بودن تعیین شد.
تمایز به استئوبلاست و آدیپوسیت:
به منظور بررسی اثر لیزات پلاکتی بند ناف و خون محیطی بر تمایز سلول های مزانشیمی به استئوبلاست، تعداد 104 × 5 سلول مزانشیمی در چاهکهای پلیت 24 خانهای که با محلول کلاژن 4% (Stem Cell Technologies، کانادا) آغشته شده بود کشت داده شد. به دو تا از چاهکها محیط DMEM حاوی 10%FBS و به سایر چاهکها نیز محیط حاوی لیزات خون محیطی و لیزات خون بند ناف با همان شرایط قبلی اضافه گردید. پس از این که سلولها کاملاً کف چاهکها را پوشاندند، محیط سلولها با محیط تمایز به استخوان و چربی جایگزین شد. محیط تمایز استئوسیتی (ایده زیست نوترکیب، ایران) شامل محیط DMEM-HG (Dulbecco’s Modified Eagle جیبکو، Medium-High Glucose) همراه با 10%FBS و 10 میلیمولار در لیتر دگزامتازون، 10 نانو مولار در لیتر ویتامین D3 و 50 میلیگرم در میلیلیتر اسید آسکوربیک بود. محیط تمایز آدیپوسیتی(ایده زیست نوترکیب، ایران) شامل DMEM-HG به همراه 10% FBS و 1 میکرو مولار در لیتر دگزامتازون، 10 میکرو مولار در لیتر انسولین و 200 میکرو مولار در لیتر ایندومتاسین بود. در مورد چاهکهای مربوط به لیزات به جای FBS، لیزات پلاکتی حاصل از خون بند ناف و خون محیطی اضافه شد. محیط کشت تمایزی هر 3 روز یک بار تعویض شد. در مورد محیط تمایز استئوسیتی پس از 2 هفته، و در مورد محیط تمایز آدیپوسیتی پس از 4 هفته، مرفولوژی سلولی مورد بررسی قرار گرفت. به این ترتیب جهت ارزیابی تمایز القا شده، سلولها جهت رنگآمیزی اختصاصی آماده شدند.
رنگآمیزی آلیزارین رد به منظور ارزیابی تمایز استئوسیتی:
پس از حذف محیط کشت تمایزی از چاهکها، به منظور تثبیت سلولی از 1 میلیلیتر محلول اتانول 70% (هامون طب- ایران) به مدت 10 دقیقه استفاده شد. محلول اتانول با سمپلر از چاهکها خارج شد، سپس 500 میکرولیتر بافر نمکی فسفات به چاهکها افزوده و به مدت 20 دقیقه در حرارت اتاق انکوبه شد. محلول PBS نیز به وسیله سمپلر از چاهکها خارج شد، سپس سلولها در 500 میکرولیتر محلول 60% ایزوپروپانول(سیگما، آمریکا) شستشو شد، پس از خارج کردن ایزوپروپانول از چاهک، 500 میکرولیتر محلول رنگی 2% آلیزارین رد 2% (سیگما، آمریکا) در بافر فسفات به چاهکها اضافه و پس از 10 دقیقه محلول رنگی از چاهکها خارج شد و مجدداً 500 میکرولیتر محلول PBS به هر چاهک اضافه و واکنش رنگ توسط میکروسکوپ اینورت بررسی شد.
رنگآمیزی Oil Red-O به منظور ارزیابی تمایز آدیپوسیتی:
سلولها در 1 میلیلیتر بافر نمکی فسفات شسته شدند و
به منظور تثبیت سلولی از 1 میلیلیتر محلول فرمالین 10% به مدت 30 دقیقه در دمای اتاق استفاده شد. پس از این مدت فرمالین از محیط خارج شده و سلولها دو بار با 1 میلیلیتر آب مقطر دوبار تقطیر شسته شدند، سپس به هر چاهک µL 500 محلول ایزوپروپانول60% اضافه شد و به مدت 5 دقیقه در دمای اتاق انکوبه گردید. در مرحله بعد سلولها به مدت 10 دقیقه در محلول رنگ که از ترکیب 3 حجم محلول رنگی 5/0% Oil Red-O (سیگما، آمریکا) در ایزوپروپانول 99% و 2 حجم آب مقطر به دست آمده بود، قرار گرفت. محلول رنگ به وسیله سمپلر از چاهکها خارج شد، سپس 1 میلیلیتر آب مقطر به هر چاهک اضافه شد. بعد از شستشوی سلولها با آب مقطر یک قطره رنگ هماتوکسیلین به هر چاهک اضافه شد، پس از یک دقیقه رنگ به وسیله سمپلر تخلیه و سلولها با آب مقطر شستشو و با میکروسکوپ اینورت بررسی شدند.
اندازهگیری میزان TGF- β آزاد شده از پلاکت:
بدین منظور از روش الایزا و کیت Human LAP TGF-b1 ELISA Kit (Assay Pro ، آمریکا) استفاده گردید. طبق دستورالعمل کیت، نمونههای مربوط به لیزات پلاکتی حاصل از خون بند ناف و خون محیطی بعد از این که از فریزر خارج شدند به مدت 10 دقیقه در gr 3000 سانتریفیوژ شدند. از آن جایی که غلظت پروتئین در نمونههای خون محیطی نسبت به خون بند ناف بالاتر بود، غلظت پروتئینی µg/mL2500 برای کلیه نمونهها به عنوان استاندارد انتخاب گردید و بر اساس آن محاسبات لازم برای رقیقسازی انجام گرفت. پس از تهیه محلول استاندارد بر اساس دستورالعمل کیت، مقدار µL 50 از استانداردها و نمونههای لیزات پلاکتی خون بند ناف، لیزات پلاکتی خون محیطی، سرم خون بند ناف و سرم خون محیطی به چاهکهای پلیت الایزا اضافه شد و پس از انکوباسیون 2 ساعته، چاهکها 5 مرتبه شستشو داده شدند. در مرحله دوم µL 50 آنتیبادی متصل به بیوتین به چاهکها اضافه و به مدت 2 ساعت در دمای اتاق انکوبه گردید. در مرحله بعد پس از شستشو، کونژوگه استرپتوآویدین- پراکسیداز به پلیت اضافه و پس از انکوباسیون و شستشوی مجدد، کروموژن سوبسترا به چاهکها اضافه و در تاریکی انکوبه شد. پس از پایان انکوباسیون محلول متوقفکننده به هر چاهک اضافه و بلافاصله جذب نوری نمونهها توسط دستگاهELISA Reader در طول موج 450 نانومتر اندازهگیری شد. حداقل میزان اندازهگیری این فاکتور رشد توسط کیت مورد استفاده ng/mL 03/0 بود.
آنالیز آماری:
برای آنالیز آماری از نرمافزار SPSS نسخه 22 استفاده گردید. دادهها وارد این نرمافزار شده و میانگین متغیرهای مورد نظر در نمونههای مورد آزمایش محاسبه شدند. جهت مقلیسه میانگینها از آزمونهای آماریOne- Way ANOVA استفاده گردید و مقادیر 05/0 p< از نظر آماری معنادار در نظر گرفته شد.
یافتهها
شمارش پلاکتی:
تعداد پلاکتهای حاصل از خون بند ناف و نیز خون محیطی قبل از تهیه لیزات توسط دستگاه شمارش سلولی (Cell Counter) در بخش هماتولوژی شمارش گردید. نتایج نشاندهنده حذف تقریباً کامل WBC ، RBC و تعداد مناسبی از پلاکت بود.
کشت سلولهای مزانشیمی:
یک روز پس از کشت سلولهای تک هستهای، محیط کشت فلاسکها تعویض گردید و با این کار سلولهای مرده و غیرچسبان نیز حذف شدند. دو روز پس از کشت سلولهای دوکی شکل مزانشیمی با اتصال به کف فلاسک تشکیل کلنی داده و تکثیر شدند. تعدادی سلول غیر چسبان هنوز در محیط دیده میشد که در روزهای بعدی با تعویض محیط این سلولها نیز حذف شدند. کشت اولیه در حدود 14 روز طول کشید که در نهایت، سلولها تقریباً 90% کف فلاسک را پوشانده بودند(شکل 1).
تائید هویت سلولی سلولهای بنیادی مزانشیمی:
سـلـولهـای بنیـادی مـزانشیمـی جـدا شــده از جفت
شاخصهای سطحی اختصاصی شامل CD44 ، CD73 ، CD166 ، CD105 ، CD90 و CD29 را به میزان بالایی بیان کردند. همچنین بیان مارکرهای سطحی سلولهای خونساز، CD34 و CD45 نیز بررسی شد که سلولهای مزانشیمی میزان قابل توجهی از این شاخصها را بیان نکردند. درصد
سلولهایی که شاخصهای اختصاصی سلولهای بنیادی مزانشیمی را بیان کردند به ترتیب 05/68% ، 02/96% ، 12/90% ، 44/68% ، 37/73% و 06/99% بود. در مورد CD34 و CD45 نیز به ترتیب درصدهای 3/20% و 94/7% مشاهده گردید(نمودار 1).


نمودار 2: میزان تکثیر سلول های مزانشیمی در حضور مواد مختلف به عنوان مکمل در محیط کشت
سلولهای مزانشیمی کشت داده شده در محیط کشتهای حاوی FBS ، لیزات پلاکت خون بند ناف، لیزات پلاکت خون محیطی، سرم خون بند ناف و سرم خون محیطی پس از 7 روز، توسط تریپسین از کف فلاسک جدا شده و شمارش سلولی انجام شده است.
FBS= Fetal Bovine Serum ،PBL= Peripheral Blood Lysate ،CBL= Cord Blood Lysate ،PBS= Peripheral Blood Serum، CBS= Cord Blood Serum

بررسی اثر لیزات پلاکتی برتکثیر سلولهای مزانشیمی:
سلولهای مزانشیمی کشت داده شده در محیط کشتهای حاوی FBS ، لیزات پلاکت خون بند ناف، لیزات پلاکت خون محیطی، سرم خون بند ناف و سرم خون محیطی پس از 7 روز، توسط تریپسین از کف فلاسک جدا شده و شمارش شدند، Viability سلولها در محیطهای با شرایط متفاوت، بالا 80% بود.
بررسی سلولهای مزانشیمی نشان دهنده رشد و تکثیر آنها در حضور عوامل رشد موجود در لیزات پلاکت خون بند ناف، خون محیطی، سرم خون بند ناف و سرم خون محیطی بود(نمودار 2). سلولهای مزانشیمی کشت داده شده در این محیطها از نظر مورفولوژی تغییر خاصی را نشان ندادند. میانگین و انحراف معیار(میانگین ± SD) سلولهای شمارش شده، محاسبه گردید و پس از تحلیل آماری نتایج زیر حاصل شد(جدول1):
سلولهای مزانشیمی که به مدت دو هفته در محیط تمایز به استخوان کشت داده شده بودند، تغییرات مورفولوژی نشان داده و با رنگآمیزی اختصاصی آلیزارین رد به رنگ قرمز در آمدند که حاکی از رسوب کلسیم و عناصر معدنی در سطح سلول بود(شکل 2).
ارزیابی توانایی تمایز سلولهای مزانشیمی به آدیپوسیت:
سلولهایی که در محیط تمایز آدیپوسیتی کشت داده شده بودند نیز از شکل دوکی خود خارج شده و به شکل کروی درآمده و واکوئلهای چربی در آنها ظاهر گردید. این تمایز پس از چهار هفته و در رنگآمیزی Oil Red-O به خوبی مشاهده شد(شکل 3).



اندازهگیری میزان TGF- β آزاد شده از پلاکت:
میزان فاکتور رشد TGF-β در لیزات پلاکتی تهیه شده از خون بند ناف و خون محیطی و هم چنین سرم تهیه شده از خون بند ناف و خون محیطی با روش الایزا اندازهگیری شد. دادههای به دست آمده به صورت میانگین ± SD بیان شدهاند. غلظت TGF-β در نمونههای لیزات و سرم خون محیطی و سرم خون بند ناف در حد نانوگرم در هر میلیلیتر بود و غلظت آن در نمونههای مختلف از نظر آماری تفاوت چندانی نشان نداد(نمودار 3).
بحث
بیشتر پژوهشهای انجام شده در حیطه کشت سلول، تاثیرات ژل پلاکتی تهیه شده از خون محیطی را بر تکثیر و
تمایز سلولهای بنیادی مزانشیمی جدا شده از مغز استخوان و یا بافت چربی مورد مطالعه قرار دادهاند. چند پژوهش نیز با همین موضوع در ایران انجام گرفته است. تاثیر لیزات پلاکتی بر تکثیر و تمایز سلولهای مزانشیمی کمتر مورد بررسی قرار گرفته و در کشور نیز برای اولین بار پژوهشی با این عنوان انجام گرفت. با توجه به این نکته که مطالعه حاضر برای اولین بار در ایران انجام شده است، علاوه بر بهره بردن از لیزات پلاکتی با دو منبع خون بند ناف و خون محیطی، از غلظتهای متفاوت FBS و هم چنین سرمهای مختلف انسانی در تکثیر و تمایز MSC استفاده کردهایم تا در صورت نتایج قابل قبول، به عنوان جایگزین مناسب برای FBS 10% از آن استفاده کنیم(18).
در مطالعه حاضر سلولهای بنیادی مزانشیمی جدا شده از بافت جفت دارای مارکرهای اختصاصی CD44 ،CD73 ، CD105 ،CD166 ،CD90 و CD29 بودند. لیزات پلاکتی از دو منبع خون بند ناف و خون محیطی، سرم خون AB و سرم خون بند ناف با گروه خونیO به عنوان مکمل به برخی از محیطهای کشت افزوده شد. برای جلوگیری از تداخلات مربوط به تفاوت بین کیسههای پلاکت مشتق از خون بند ناف و خون محیطی در گروههای مورد مطالعه، 3 کیسه پلاکت با هم مخلوط شدند و در یک گروه قرار گرفتند. لیزات پلاکتی به دست آمده میتواند دارای تفاوت زیادی باشد که وابسته به سن اهداکننده، شمارش سلولی اهداکننده و روش آزاد سازی فاکتورهای رشد میباشد. نتایج به دست آمده حاکی از اثر منفی سن بر غلظت محتوای فاکتورهای رشد بود(19).
سلولهای مزانشیمی کشت داده شده در سرم خون محیطی، سرم خون بند ناف، لیزات پلاکتی خون محیطی و یا لیزات پلاکتی خون بند ناف از نظر مورفولوژی شبیه به سلولهای فیبروبلاست بوده و ظاهر دوکی شکل داشتند. علاوه بر آن نتایج کشت، تکثیر و تمایز این سلولها در حضور عوامل رشد موجود در سرم و لیزات پلاکت انسانی نیز بسیار موفقیت آمیز بود و سلولها در حضور این عوامل به خوبی تکثیر یافتند و پتانسیل تمایزی آنها نیز به خوبی حفظ شد.
سلولهای مزانشیمی جدا شده از نظر مورفولوژی شبیه به سلولهای فیبروبلاست بودند و ظاهری دوکی شکل داشتند، این نتایج مشابه نتایج به دست آمده در بسیاری از پژوهشها از جمله مطالعههای آوان زینی و همکارانش در سال 2009 بود(20).
بررسی ایمونوفنوتایپـی سلولهـا بـا استفــاده از روش فلوسیتومتری نشان داد که این سلولها دارای مارکرهــای CD44 ،CD73 ،CD105 ،CD166 ،CD90 و CD29 و فاقد مارکرهای CD34 و CD45 هستند که این نتایج نیز با نتایج سایر محققین از جمله کانماتسو و همکاران مطابقت داشت. در این تحقیق که در سال 2011 به چاپ رسید، مارکرهای ذکر شده را به عنوان مارکرهای تایید شده سلولهای بنیادی مزانشیمی در نظر گرفته بود(3).
به منظور بررسی توانایی تمایز سلولهای مزانشیمی در حضور محیطهای تمایز دهنده کشت داده شدند و به سلولهای استئوبلاست و یا آدیپوسیت به طور جداگانه تمایز یافتند. به منظور تایید تمایز آنها به سلولهای استئوبلاست و آدیپوسیت، از رنگآمیزی سیتوشیمی آلیزارین رد و Oil red-O استفاده شد. در اکثر مطالعهها برای تایید تمایز به سلولهای استئوبلاست و یا آدیپوسیت از این رنگآمیزی آلیزارین رد و یا Oil red-O استفاده شده بود(21). اگر چه در برخی از موارد برای تایید تمایز به استئوبلاست علاوه بر آلیزارین رد از رنگآمیزی آلکالین فسفاتاز نیز استفاده شده بود(22). نتایج این رنگ آمیزیها تاییدی بر تمایز این سلولها بود. نتایج به دست آمده در این مطالعه شبیه نتایج مطالعه ساباپاتی و همکارانش بود(21).
در اغلب مطالعهها به منظور تکثیر و تمایز سلول های مزانشیمی از سرم حیوانی به عنوان مکمل محیط کشت استفاده میشود(24، 23، 3). در مطالعه حاضر به منظور جایگزینی سرم حیوانی به عنوان مکمل محیط کشت از لیزات پلاکتی استفاده گردید. عوامل آزاد شده از پلاکتهای لیز شده که حاوی فاکتورهای رشد متعددی میباشند، به خوبی از رشد سلولها حمایت کردند و در حضور آنها سلولهای مزانشیمی به رشد خود ادامه دادند. فاکتورهای رشد آزاد شده از پلاکت سبب رشد و تکثیر سلولهای مزانشیمی میشوند. مطالعههای متعدد نشان داده است که استفاده از پلاسمای غنی از پلاکت، پلاکتهای لیز شده و عوامل رشد آزاد شده از پلاکت، سبب حمایت از رشد و تکثیر سلولهای بنیادی مزانشیمی میشوند(25، 20، 12). در این مطالعه همانند اغلب مطالعههای انجام گرفته (مثل کرسپودیاز و همکاران در سال 2011 و بیباک و همکاران در سال 2013) برای لیز کردن پلاکت و آزادسازی عوامل رشد از روش انجماد- ذوب متوالی استفاده گردید(26، 9). اغلب پژوهشهای صورت گرفته در زمینه کشت سلول، بر روی تاثیرات ژل پلاکتی بر رشد و تکثیر سلولهای مزانشیمی و بررسی ویژگیهای این ماده، از جمله غلظت فاکتورهای رشد، بهترین روش تهیه و نگهداری و غیره متمرکز بوده است(22). در این مطالعه برای اولین بار در کشور لیزات پلاکتی مشتق از خون بند ناف و نیز خون محیطی تهیه شد و به عنوان جایگزین FBS در کشت سلولهای مزانشیمی مورد بررسی قرار گرفت. همچنین غلظت فاکتور رشد TGF-β در نمونههای مختلف مورد بررسی اندازهگیری شد. بسیاری از مطالعهها از سلولهای بنیادی مزانشیمی مغز استخوان برای کشت استفاده کرده بودند، اما در این پژوهش سلولهای بنیادی مزانشیمی از بافت جفت جدا و کشت داده شدند.
برای تهیه کنسانتره پلاکتی در اغلب مطالعهها از روش آفرزیس استفاده میشود اما در این مطالعه به علت محدودیت امکانات، کنسانترههای پلاکتی از کیسههای خون کامل تهیه گردید و به همین دلیل تعداد پلاکت در دسترس بسیار کمتر از روشهای آفرزیس بود. تحقیقات انجام شده توسط بیباک و همکارانش نشان داده است که شمارش پلاکتی کمتر از /mL 109×5/1 منجر به کاهش تاثیر لیزات پلاکتی بر تکثیر و رشد سلولهای مزانشیمی میشود(9).
علیرغم پایین بودن شمارش پلاکتی در این مطالعه، لیزات پلاکتی تهیه شده از خون بندناف و خون محیطی توانستند به خوبی از رشد و تکثیر سلولهای بنیادی مزانشیمی حمایت کنند و میزان رشد و تکثیر در آنها مشابه نتایج حاصل از کشت این سلولها در 5% FBS بوده است. استفاده همزمان سرم خون بند ناف و لیزات پلاکتی خون بند ناف در محیط کشت نیز باعث بهبود وضعیت رشد و تکثیر سلولهای مزانشیمی و رسیدن به نتایجی مشابه استفاده از 10%FBS در محیط کشت شد. کینز باخ و همکارانش در سال 2013 تاثیر سرم انسانی، لیزات پلاکتی و ترشحات پلاکتهای فعال شده به وسیله ترومبین بر تکثیر سلولهای مزانشیمی بافت چربی و استخوانی را مورد پژوهش قرار دادند و نتایج نشاندهنده تأثیر مشابه این سه ماده بر سلولهای مزانشیم بافت چربی بود. ویت زندر و همکاران هم تاثیر سرم انسانی و لیزات پلاکتی را بر فیبروبلاستهای انسانی و سلولهای مزانشیمی جداشده از بافت چربی بررسی کرده و نشان دادند که زمان دو برابر شدن جمعیت سلولی فیبروبلاستها و سلولهای مزانشیم جدا شـده از بـافت چربـی در سـرم و لیـزات نسبـت بــه
10%FBS کوتاهتر بود(24، 23).
از لیزات پلاکتی علاوه بر تکثیر سلولهای مزانشیمی میتوان در تمایز سلولهای مزانشیمی نیز استفاده کرد. در مطالعه حاضر نشان داده شد که لیزات پلاکتی خون بند ناف و خون محیطی نه تنها سبب تکثیر سلولهای مزانشیمی میشوند، بلکه در حضور این عوامل توانایی تمایز سلولهای مزانشیمی حفظ میشود و این سلولها به خوبی به سلولهای استئوبلاست و آدیپوسیت تمایز مییابند. نتایج این مطالعه با مطالعه ساباپاتی در سال 2014 مطابقت داشت(21). اگر چه تاکنون در هیج مطالعهای اثر لیزات پلاکتی خون بند ناف و خون محیطی بر تکثیر و تمایز سلولهای مزانشیمی جدا شده از بافت جفت بررسی نگردیده است، ولی نتایج حاصل از آن با نتایج سایر مطالعههای انجام شده در زمینه ژل پلاکتی و یا پلاسمای غنی از پلاکت با وجود تفاوتهای ذکر شده، مشابهت زیادی داشته است. از جمله این مطالعهها میتوان به تحقیقات سی یون بیک و همکاران درسال 2013 ، لودی کون و همکاران در سال 2014 ، بلانده و همکارانش در سال 2009 و مطالعههای بیباک اشاره نمود(22، 10، 8، 3).
در مرحله پایانی این مطالعه میزان فاکتور رشد TGF-β در لیزات پلاکتی خون بند ناف، لیزات پلاکت خون محیطی، سرم خون بند ناف و سرم خون محیطی با استفاده از روش الایزا بررسی شد. در مطالعههای مختلف که غلظت چندین فاکتور اندازهگیری شده بود، نتایج نشان داد که میزان TGF-β بالا و در حد نانوگرم در میلی لیتر است، در مطالعه حاضر نیز غلظت این فاکتور در نمونههای مختلف بالا و در حد نانوگرم در میلی لیتر مشاهده شد. البته لازم به ذکر است که نیمه عمر این فاکتورهای رشد پایین بوده و بعد از گذشت زمان ممکن است از میزان آن کاسته شود. لذا دست یابی به روش مناسب برای تهیه عوامل رشد پلاکتی، تعداد مناسب پلاکت و شرایط نگهداری مطلوب همواره مورد توجه محققین بوده است.
نتیجهگیری
در مجمـوع با در نظر گرفتن نتایج به دست آمده از این
مطالعه و مقایسه آن با سایر مطالعهها، میتوان گفت که لیزات پلاکتی تهیه شده از خون بند ناف و خون محیطی میتواند جایگزین مناسبی برای سرم حیوانی در محیط کشت سلول باشد. استفاده از لیزات پلاکتی، محیط مناسبی برای رشد و تکثیر سلولهای مزانشیمی فراهم میسازند و همچنین توانایی تمایز به استئوسیت و آدیپوسیت سلولهای مزانشیمی نیز در محیطهای حاوی این عوامل به خوبی حفظ میگردد. از معایب بهره بردن از مشتقات با منشا حیوانی به عنوان مکمل، خطر انتقال پاتوژنها و واکنشهای ایمونولوژیک میباشد. در واقع نتایج بیانگر این نکته میباشند که کشت سلولهای بنیادی مزانشیمی بدون استفاده از سرم حیوانی امکانپذیر است و در صورتی که
مطالعههای گستردهتری انجام گیرد و همچنین بررسیهای لازم کنترل کیفی، استانداردسازی لازم بر روی این محصولات و هم چنین کاهش پاتوژنها(Pathogen Reduction) انجام شود، میتوان از پلاکتها و مشتقات حاصل از آنها به عنوان مکملهای قدرتمند در چرخههای کشت سلولی استفاده نمود.
تشکر و قدردانی
این مقاله حاصل پایاننامه دانشجویی مصوب مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ایران در مقطع کارشناسی ارشد میباشد.
متن کامل: (1771 مشاهده)
مقایسه اثر لیزات پلاکتی مشتق از خون محیطی و خون بند ناف بر تکثیر
و تمایز سلولهای مزانشیمال
محدثه رحیمی مفرد1، فاطمه یاری2، مهین نیکوگفتار ظریف3، مریم داداشی4، افسانه آقایی5
چکیده
سابقه و هدف
تکثیر و تمایز سلولهای بنیادی مزانشیمی(MSC) در محیط کشت، مستلزم حضور مکملهای مغذی همانند سرم جنین گاوی(FBS) میباشد که خطر ابتلا به پریونها یا عفونتهای زئوتیک را افزایش میدهد. لیزات پلاکتی به عنوان یک منبع غنی از فاکتورهای رشد و سیتوکاینها میتواند جایگزین FBS در محیط کشت سلولی باشد. هدف مطالعه، مقایسه اثر لیزات پلاکتی خون بند ناف و خون محیطی بر تکثیر و تمایز MSCs بود.
مواد و روشها
در این مطالعه تجربی، MSCs انسانی از بافت جفت جدا و با روش فلوسیتومتری تایید هویت شدند. 3 کیسه پلاکتی جمعآوری و لیزات پلاکتی به روش تکرار انجماد/ ذوب تهیه شد. MSCs در محیطهای متفاوت کشت و برای ارزیابی ظرفیت تمایز، در محیطهای تمایز استخوانسازی و چربی کشت و با رنگآمیزی اختصاصی آلیزارین رد و Oil Red-O بررسی شدند. میزان TGF-β به روش الایزا ارزیابی شد. تحلیل آماری با استفاده از 22 SPSS و آزمون One-Way ANOVA انجام شد.
یافتهها
میزان تکثیر MSCs در محیطهای حاوی لیزات پلاکتی خون محیطی یا بند ناف تفاوت معناداری با محیط حاوی 5% FBS نداشت. میزان تکثیر در محیط حاوی CBL و سرم خون بند ناف تفاوت معناداری با محیط حاوی10% FBS نداشت و توانایی تمایز MSCs به سلولهای استخوانی و سلولهای چربی در محیطهای حاوی CBL یا PBL به خوبی حفظ شده بود.
نتیجه گیری
لیزات پلاکتی میتواند جایگزین مناسبی برای سرم حیوانی در محیط کشت سلول باشد. این عوامل علاوه بر رشد و تکثیر سلولهای مزانشیمی، توانایی تمایز به استئوسیت و آدیپوسیت را در محیطهای حاوی این عوامل به خوبی حفظ مینماید.
کلمات کلیدی: پلاکتها، خون بند ناف، مزانشیمال استم سل
تاریخ دریافت: 04/12/1399
تاریخ پذیرش: 31/05/1400
1- کارشناس ارشد خونشناسی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
و تمایز سلولهای مزانشیمال
محدثه رحیمی مفرد1، فاطمه یاری2، مهین نیکوگفتار ظریف3، مریم داداشی4، افسانه آقایی5
چکیده
سابقه و هدف
تکثیر و تمایز سلولهای بنیادی مزانشیمی(MSC) در محیط کشت، مستلزم حضور مکملهای مغذی همانند سرم جنین گاوی(FBS) میباشد که خطر ابتلا به پریونها یا عفونتهای زئوتیک را افزایش میدهد. لیزات پلاکتی به عنوان یک منبع غنی از فاکتورهای رشد و سیتوکاینها میتواند جایگزین FBS در محیط کشت سلولی باشد. هدف مطالعه، مقایسه اثر لیزات پلاکتی خون بند ناف و خون محیطی بر تکثیر و تمایز MSCs بود.
مواد و روشها
در این مطالعه تجربی، MSCs انسانی از بافت جفت جدا و با روش فلوسیتومتری تایید هویت شدند. 3 کیسه پلاکتی جمعآوری و لیزات پلاکتی به روش تکرار انجماد/ ذوب تهیه شد. MSCs در محیطهای متفاوت کشت و برای ارزیابی ظرفیت تمایز، در محیطهای تمایز استخوانسازی و چربی کشت و با رنگآمیزی اختصاصی آلیزارین رد و Oil Red-O بررسی شدند. میزان TGF-β به روش الایزا ارزیابی شد. تحلیل آماری با استفاده از 22 SPSS و آزمون One-Way ANOVA انجام شد.
یافتهها
میزان تکثیر MSCs در محیطهای حاوی لیزات پلاکتی خون محیطی یا بند ناف تفاوت معناداری با محیط حاوی 5% FBS نداشت. میزان تکثیر در محیط حاوی CBL و سرم خون بند ناف تفاوت معناداری با محیط حاوی10% FBS نداشت و توانایی تمایز MSCs به سلولهای استخوانی و سلولهای چربی در محیطهای حاوی CBL یا PBL به خوبی حفظ شده بود.
نتیجه گیری
لیزات پلاکتی میتواند جایگزین مناسبی برای سرم حیوانی در محیط کشت سلول باشد. این عوامل علاوه بر رشد و تکثیر سلولهای مزانشیمی، توانایی تمایز به استئوسیت و آدیپوسیت را در محیطهای حاوی این عوامل به خوبی حفظ مینماید.
کلمات کلیدی: پلاکتها، خون بند ناف، مزانشیمال استم سل
تاریخ دریافت: 04/12/1399
تاریخ پذیرش: 31/05/1400
1- کارشناس ارشد خونشناسی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- دکترای تخصصی ایمنیشناسی ـ استاد مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- دکترای تخصصی خونشناسی و علوم انتقال خون ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- دانشجوی دکترای تخصصی خونشناسی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- دانشجوی دکترای تخصصی خونشناسی و علوم انتقال خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
5- مؤلف مسئول: دکترای تخصصی ایمنیشناسی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
سرم جنین گاو(FBS) معمولاً به منظور تأمین فاکتورهای رشد مورد نیاز برای تکثیر و تمایز سلول به محیط کشت سلولی اضافه میشود(2، 1). FBS همچنین به عنوان یک مکمل مورد تایید جهانی برای حمایت از گسترش و تمایز سلولهای بنیادی مزانشیمی انسان (Mesenchymal Stem Cell, MSC) استفاده شده است.
MSC یک گروه هتروژن از استمسلهای استرومال (Stromal Stem Cell) هستند. منبع اصلی این سلولها مغز استخوان است، این سلولها در دیگر بافتهای بدن مانند ماهیچه اسکلتی، بافت چربی، خون بند ناف، مایع سینوویوم، حفره دندانی، مایع آمینوتیک، کبد و ریه نیز حضور دارند(7-3). این سلولها طیفی از مارکرهای سطحی شاملCD105 ، CD73 ، CD166 ، CD29 ، CD44 ، CD90 و MHC-I را بیان میکنند و در مقایسه با هماتوپوئتیک استم سلها (Hematopoietic stem cells) برای مارکرهای CD45 ،CD34 ، CD133 و MHC-II منفی میباشند(7).
بهره بردن از FBS در محیط کشت میتواند خطر ابتلا به پریونها و/ یا عفونتهای مشترک بین انسان و دام و واکنشهای ایمنی مربوط به زنوژن را افزایش دهد. هم چنین نگرانی اصلی در مورد سلامت جنین اهداکننده در زمان گرفتن خون جنین به دلیل دستکاریهای جنینی افزایش یافته است. از این رو، سالها است که یافتن گزینه جایگزین انسانی FBS به عنوان یک موضوع تحقیقاتی مورد بررسی قرار گرفته است(8).
پلاکتها حاوی محتویات گرانولی متفاوتی هم چون گرانول a ، گرانول با هسته متراکم، لیزوزومها و پراکسیزومها هستند(1). هر پلاکت به طور تقریبی دارای 80-50 گرانول a است، که اکثر فاکتورهای رشد در این گرانولها وجود دارند(2). مطالعههای مختلف نشان داده که فاکتورهای رشد میتوانند نقش مهمی در پزشکی ترمیمی ایفا کنند، بنابراین پلاکتها به عنوان داروخانهای حامل فاکتورهای رشد به حساب میآیند(9) محصولات مشتق از پلاکت به عنوان یک ابزار مهندسی بافت به جراحان این امکان را میدهد تا با تاثیر بر محیط سلولها در خارج و داخل بدن، میزان موفقیت پیوند بافتهای نرم و سخت را افزایش دهند(10).
لیزات پلاکتی(Platelet Lysate) شامل همه فاکتورهای تشکیلدهنده پلاکتی است. لیزات را میتوان به راحتی با تخریب مکانیکی کنسانترههای پلاکتی از طریق ذوب و انجماد تهیه کرد(9). فاکتورهای رشد مشتق از لیزات پلاکت انسانی(HPL, Human Platelet Lysate) میتواند بر روی ردههای مختلف سلولی، سلولهای توموری و کندروسیتهای آرتیکولار موثر باشد. لذا استفاده از فاکتورهای مشتق از پلاکت به عنوان یک ابزار مؤثر در کشت سلول و جایگزین FBS مورد توجه قرار گرفته است(11). اخیراً منابع انسانی شامل مشتقات پلاکت و سرم انسان که از خون بند ناف، خون اتولوگ و یا آلوژن تهیه میشوند، به عنوان جایگزین FBS مورد مطالعه قرار گرفته است. استفاده از فرآوردههای انسانی به جای FBS احتمال آلودگی استمسلها با عوامل پریونی، ویروسی و بیماریهای مشترک بین انسان و دام را کاهش میدهد(12). هم چنین استفاده از HPL به عنوان ماده مغذی در کشت سلولهای مزانشیمال میتواند تأثیر مثبت داشته باشد(13). منابع انسانی اجزای خون مانند سرم انسانی یا مشتقات پلاکت اتولوگ یا آلوژنیک برای افزایش ایمنی استفاده میشود(16-14). محصولات مشتق از پلاکت اثرات متفاوتی بر میزان رشد سلولهای بنیادی مزانشیمی سلولهای مغز استخوان و بافت چربی دارند(17).
از این رو در این مطالعه، به منظور یافتن گزینههای مناسب برای FBS در محیط کشت سلولی، سلولهای بنیادی مزانشیمی از بافت جفت جدا شده و اثر لیزات پلاکت خون بند ناف و لیزات پلاکت خون محیطی بر تکثیر، گسترش و تمایز آنها به سلولهای استخوانی و سلولهای چربی مورد بررسی قرار گرفت.
مواد و روشها
نوع مطالعه در این تحقیق به صورت تجربی و روش انتخاب نمونهها تصادفی بود. سلولهای مزانشیمی از بافت جفت اهداکنندگان سالم پس از کسب رضایت تهیه شد. نمونههای پلاکت نیز از افرادی که فاقد هرگونه اختلالات کمی و کیفی پلاکتی بودند تهیه گردید. در این مطالعه 5 گروه مشتق از 3 کیسه خون بند ناف که با یکدیگر مخلوط شده بودند و هم چنین 5 گروه مشتق از 3 کیسه کنسانتره پلاکت خون محیطی مورد استفاده قرار گرفت.
تهیه لیزات پلاکتی:
ابتدا تمام خون داخل کیسه خون بند ناف و کنسانتره پلاکتی جدا شده از خون محیطی به طور جداگانه درون لولههای فالکون(Nunc ، دانمارک) ریخته شد، سپس به منظور حذف RBC و WBC به مدت 12 دقیقه،3 بار با دور g200 سانتریفیوژ(اپندورف، آلمان) گردید. سپس محلول رویی که حاوی پلاکتها بود به دقت توسط سمپلر (اپندورف، آلمان) جدا شده و به یک لوله دیگر منتقل گردید.
محلول جدا شده حاوی پلاکت به مدت 15 دقیقه با دور(RPM4400) g 1200 سانتریفیوژ گردید، محلول رویی دور ریخته شده و رسوب ته لوله که حاوی پلاکتها بود به همراه کمی از محلول باقی ماند. برای شستشو و حذف پلاسما از بافر نمکی فسفات(PBS)(سیگما، آمریکا) استفاده گردید، 12 میلیلیتر محلول PBS به سوسپانسیون پلاکتی اضافه و با دور(RPM4400) g 1200 به مدت 14 دقیقه سانتریفیوژ گردید. عمل شستشو برای هر لوله سه بار تکرار شد. پس از سه بار شستشو، محلول رویی خالی شده و 5 میلیلیتر PBS (سیگما، آمریکا) تازه به آن اضافه و از پلاکتها سوسپانسیون تهیه گردید و توسط دستگاه سل کانتر، تعداد آنها شمارش شد.
رسوب پلاکتی پس از شمارش در فریزر80- درجه سانتیگراد (Angelationi، ایتالیا) به مدت 3 ساعت قرار داده شد. پس از انجماد کامل بیرون آورده شد و در دمای محیط ذوب گردید. این مراحل برای 3 بار تکرار شد تا لیزات پلاکتی مورد نظر تهیه شود. پس از آخرین مرحله انجماد- ذوب، محلول به مدت 20 دقیقه با دور (RPM4400) g 1200 سانتریفیوژ گردید و بدین ترتیب بقایای سلولی از محیط عمل حذف شد. در نهایت غلظت پروتئینـی محلـول رویی با روش برادفورد اندازهگیری گردید.
جداسازی سلولهای بنیادی مزانشیمی از بافت جفت:
بافت جفت از مادرانی که فرم رضایتنامه کتبی را امضا کرده بودند، جمعآوری شد. به طور خلاصه، سلولهای تک هستهای آن پس از شستشو و حذف قطعات بافت جدا شدند و در فلاسک 75T (Nunc ، دانمارک) همراه محیط کشت DMEM-LG (جیبکو، آلمان) و 10%FBS (جیبکو، آلمان) کشت داه شد. پس از 24 ساعت با تعویض محیط کشت، سلولهای معلق غیر مزانشیمی از محیط برداشته شدند و سلولهای مزانشیمال با اتصال به کف فلاسک، پس از چند روز تشکیل کلنی داده و تکثیر شدند.
به مدت 14 روز، هر سه روز یک بار محیط کشت تعویض شد، پس از این مدت سلولهای مزانشیمی تکثیر یافته و تقریباً 90% کف فلاسک را پوشاندند. در این زمان سلولها پاساژ داده شد و به فلاسکهای جدید منتقل گردید.
تائید هویت سلولی، سلولهای بنیادی مزانشیمی:
به منظور تعیین هویت فنوتیپی سلولهای جدا شده از بافت جفت، سلولها پس از 5 پاساژ متوالی تریپسینه (ایده زیست نوترکیب - ایران) و از فلاسک جدا و در بافر فسفات شستشو شدند و سوسپانسیون سلولی با شمارش 1000 سلول در هر میکرولیتر تهیه شد. از سوسپانسیون مذکور مقدار 100 میکرولیتر و از آنتیبادیهای منوکلونال کنژوگه فلورسنت(داکو، دانمارک) CD44-FITC ، CD29-PE ، CD90-FITC، CD73-PE، CD105-FITC، CD166-PE، CD45-FITC و CD34-PE نیز مقدار 5 میکرولیتر به هر لوله افزوده شد. به موازات، سلولها با آنتیبادی ایزوتیپ کنترل نیز مجاور شدند. سپس لولهها 30 دقیقه در یخچال انکوبه و با افزودن 50 میکرولیتر از فیکساتیو پارافرمالدئید 1% (سیگما، آمریکا) با دستگاه فلوسیتومتری (پارتک، آلمان) تجزیه و تحلیل شدند. در هر تجزیه و تحلییل 5000 سلول بررسی گردید.
بررسی اثر لیزات پلاکتی برتکثیر سلولهای مزانشیمی:
سلولهای مزانشیمی به تعداد 104 × 5 در چاهکهای پلیت 24 خانهای(کره، SPL) کشت داده شدند. سلولهای مزانشیمی در محیط DMEM با غلظتهای متفاوت 10%، 5% و 2% از FBS به عنوان کنترل کشت داده شدند. کلیه آزمایشها به صورت دو بار تکرار(duplicate) گذاشته شد. در مورد نمونههای لیزات خون محیطی(PBL, Peripheral Blood Lysate)، غلظت پروتئین µg/mL 9000 به عنوان استاندارد در نظر گرفته شده و سپس با انجام محاسبات غلظت پروتئینی برای هر نمونه، مقدار مورد نیاز از لیزات پلاکتی که باید به محیط کشت اضافه میشد، به میزان 10% محیط کشت محاسبه گردید. هر نمونه به صورت دو بار تکرار گذاشته شد. در مورد نمونههای لیزات خون بند ناف (CBL, Cord Blood Lysate)، غلظت پروتئینی به دست آمده کمتر بود بنابراین، برای رسیدن به غلظت µg/mL 9000، محیط کشت حاوی30% لیزات به چاهکها اضافه گردید. همچنین به دو چاهک محیط حاوی 10% سرم خون AB و به دو چاهک محیط حاوی 10% سرم خون بند ناف با گروه خونی O اضافه گردید. علاوه بر این در دو چاهک محیط کشت حاوی 5% سرم AB به عنوان مکمل و 5% لیزات پلاکتی خون محیطی، و در دو چاهک محیط حاوی 5% سرم خون بند ناف به عنوان مکمل و 5% لیزات پلاکتی خون بند ناف اضافه شد. به مدت 7 روز، هر یک روز درمیان محیط کشت سلولها با همان شرایط گفته شده تعویض شد. سپس سلولها توسط تریپسین از کف چاهک جداشده و به صورت هم حجم با رنگ تریپانبلو(سیگما، آمریکا) مخلوط شده در نهایت با لام نئوبار(Marienfeld ، آلمان) شمارش شدند و درصد زنده بودن تعیین شد.
تمایز به استئوبلاست و آدیپوسیت:
به منظور بررسی اثر لیزات پلاکتی بند ناف و خون محیطی بر تمایز سلول های مزانشیمی به استئوبلاست، تعداد 104 × 5 سلول مزانشیمی در چاهکهای پلیت 24 خانهای که با محلول کلاژن 4% (Stem Cell Technologies، کانادا) آغشته شده بود کشت داده شد. به دو تا از چاهکها محیط DMEM حاوی 10%FBS و به سایر چاهکها نیز محیط حاوی لیزات خون محیطی و لیزات خون بند ناف با همان شرایط قبلی اضافه گردید. پس از این که سلولها کاملاً کف چاهکها را پوشاندند، محیط سلولها با محیط تمایز به استخوان و چربی جایگزین شد. محیط تمایز استئوسیتی (ایده زیست نوترکیب، ایران) شامل محیط DMEM-HG (Dulbecco’s Modified Eagle جیبکو، Medium-High Glucose) همراه با 10%FBS و 10 میلیمولار در لیتر دگزامتازون، 10 نانو مولار در لیتر ویتامین D3 و 50 میلیگرم در میلیلیتر اسید آسکوربیک بود. محیط تمایز آدیپوسیتی(ایده زیست نوترکیب، ایران) شامل DMEM-HG به همراه 10% FBS و 1 میکرو مولار در لیتر دگزامتازون، 10 میکرو مولار در لیتر انسولین و 200 میکرو مولار در لیتر ایندومتاسین بود. در مورد چاهکهای مربوط به لیزات به جای FBS، لیزات پلاکتی حاصل از خون بند ناف و خون محیطی اضافه شد. محیط کشت تمایزی هر 3 روز یک بار تعویض شد. در مورد محیط تمایز استئوسیتی پس از 2 هفته، و در مورد محیط تمایز آدیپوسیتی پس از 4 هفته، مرفولوژی سلولی مورد بررسی قرار گرفت. به این ترتیب جهت ارزیابی تمایز القا شده، سلولها جهت رنگآمیزی اختصاصی آماده شدند.
رنگآمیزی آلیزارین رد به منظور ارزیابی تمایز استئوسیتی:
پس از حذف محیط کشت تمایزی از چاهکها، به منظور تثبیت سلولی از 1 میلیلیتر محلول اتانول 70% (هامون طب- ایران) به مدت 10 دقیقه استفاده شد. محلول اتانول با سمپلر از چاهکها خارج شد، سپس 500 میکرولیتر بافر نمکی فسفات به چاهکها افزوده و به مدت 20 دقیقه در حرارت اتاق انکوبه شد. محلول PBS نیز به وسیله سمپلر از چاهکها خارج شد، سپس سلولها در 500 میکرولیتر محلول 60% ایزوپروپانول(سیگما، آمریکا) شستشو شد، پس از خارج کردن ایزوپروپانول از چاهک، 500 میکرولیتر محلول رنگی 2% آلیزارین رد 2% (سیگما، آمریکا) در بافر فسفات به چاهکها اضافه و پس از 10 دقیقه محلول رنگی از چاهکها خارج شد و مجدداً 500 میکرولیتر محلول PBS به هر چاهک اضافه و واکنش رنگ توسط میکروسکوپ اینورت بررسی شد.
رنگآمیزی Oil Red-O به منظور ارزیابی تمایز آدیپوسیتی:
سلولها در 1 میلیلیتر بافر نمکی فسفات شسته شدند و
به منظور تثبیت سلولی از 1 میلیلیتر محلول فرمالین 10% به مدت 30 دقیقه در دمای اتاق استفاده شد. پس از این مدت فرمالین از محیط خارج شده و سلولها دو بار با 1 میلیلیتر آب مقطر دوبار تقطیر شسته شدند، سپس به هر چاهک µL 500 محلول ایزوپروپانول60% اضافه شد و به مدت 5 دقیقه در دمای اتاق انکوبه گردید. در مرحله بعد سلولها به مدت 10 دقیقه در محلول رنگ که از ترکیب 3 حجم محلول رنگی 5/0% Oil Red-O (سیگما، آمریکا) در ایزوپروپانول 99% و 2 حجم آب مقطر به دست آمده بود، قرار گرفت. محلول رنگ به وسیله سمپلر از چاهکها خارج شد، سپس 1 میلیلیتر آب مقطر به هر چاهک اضافه شد. بعد از شستشوی سلولها با آب مقطر یک قطره رنگ هماتوکسیلین به هر چاهک اضافه شد، پس از یک دقیقه رنگ به وسیله سمپلر تخلیه و سلولها با آب مقطر شستشو و با میکروسکوپ اینورت بررسی شدند.
اندازهگیری میزان TGF- β آزاد شده از پلاکت:
بدین منظور از روش الایزا و کیت Human LAP TGF-b1 ELISA Kit (Assay Pro ، آمریکا) استفاده گردید. طبق دستورالعمل کیت، نمونههای مربوط به لیزات پلاکتی حاصل از خون بند ناف و خون محیطی بعد از این که از فریزر خارج شدند به مدت 10 دقیقه در gr 3000 سانتریفیوژ شدند. از آن جایی که غلظت پروتئین در نمونههای خون محیطی نسبت به خون بند ناف بالاتر بود، غلظت پروتئینی µg/mL2500 برای کلیه نمونهها به عنوان استاندارد انتخاب گردید و بر اساس آن محاسبات لازم برای رقیقسازی انجام گرفت. پس از تهیه محلول استاندارد بر اساس دستورالعمل کیت، مقدار µL 50 از استانداردها و نمونههای لیزات پلاکتی خون بند ناف، لیزات پلاکتی خون محیطی، سرم خون بند ناف و سرم خون محیطی به چاهکهای پلیت الایزا اضافه شد و پس از انکوباسیون 2 ساعته، چاهکها 5 مرتبه شستشو داده شدند. در مرحله دوم µL 50 آنتیبادی متصل به بیوتین به چاهکها اضافه و به مدت 2 ساعت در دمای اتاق انکوبه گردید. در مرحله بعد پس از شستشو، کونژوگه استرپتوآویدین- پراکسیداز به پلیت اضافه و پس از انکوباسیون و شستشوی مجدد، کروموژن سوبسترا به چاهکها اضافه و در تاریکی انکوبه شد. پس از پایان انکوباسیون محلول متوقفکننده به هر چاهک اضافه و بلافاصله جذب نوری نمونهها توسط دستگاهELISA Reader در طول موج 450 نانومتر اندازهگیری شد. حداقل میزان اندازهگیری این فاکتور رشد توسط کیت مورد استفاده ng/mL 03/0 بود.
آنالیز آماری:
برای آنالیز آماری از نرمافزار SPSS نسخه 22 استفاده گردید. دادهها وارد این نرمافزار شده و میانگین متغیرهای مورد نظر در نمونههای مورد آزمایش محاسبه شدند. جهت مقلیسه میانگینها از آزمونهای آماریOne- Way ANOVA استفاده گردید و مقادیر 05/0 p< از نظر آماری معنادار در نظر گرفته شد.
یافتهها
شمارش پلاکتی:
تعداد پلاکتهای حاصل از خون بند ناف و نیز خون محیطی قبل از تهیه لیزات توسط دستگاه شمارش سلولی (Cell Counter) در بخش هماتولوژی شمارش گردید. نتایج نشاندهنده حذف تقریباً کامل WBC ، RBC و تعداد مناسبی از پلاکت بود.
کشت سلولهای مزانشیمی:
یک روز پس از کشت سلولهای تک هستهای، محیط کشت فلاسکها تعویض گردید و با این کار سلولهای مرده و غیرچسبان نیز حذف شدند. دو روز پس از کشت سلولهای دوکی شکل مزانشیمی با اتصال به کف فلاسک تشکیل کلنی داده و تکثیر شدند. تعدادی سلول غیر چسبان هنوز در محیط دیده میشد که در روزهای بعدی با تعویض محیط این سلولها نیز حذف شدند. کشت اولیه در حدود 14 روز طول کشید که در نهایت، سلولها تقریباً 90% کف فلاسک را پوشانده بودند(شکل 1).
تائید هویت سلولی سلولهای بنیادی مزانشیمی:
سـلـولهـای بنیـادی مـزانشیمـی جـدا شــده از جفت
شاخصهای سطحی اختصاصی شامل CD44 ، CD73 ، CD166 ، CD105 ، CD90 و CD29 را به میزان بالایی بیان کردند. همچنین بیان مارکرهای سطحی سلولهای خونساز، CD34 و CD45 نیز بررسی شد که سلولهای مزانشیمی میزان قابل توجهی از این شاخصها را بیان نکردند. درصد
سلولهایی که شاخصهای اختصاصی سلولهای بنیادی مزانشیمی را بیان کردند به ترتیب 05/68% ، 02/96% ، 12/90% ، 44/68% ، 37/73% و 06/99% بود. در مورد CD34 و CD45 نیز به ترتیب درصدهای 3/20% و 94/7% مشاهده گردید(نمودار 1).

شکل 1: سلولهای مزانشیمی در روزهای مختلف کشت (A سلولهای دوکی شکل و سلولهای غیر چسبان در محیط در روز اول کشت دیده میشوند. (B در روز پایانی سلولهای مزانشیمی رشد کردهاند و تقریباً 90% کف فلاسک را پوشاندهاند(بزرگنمایی 40×)
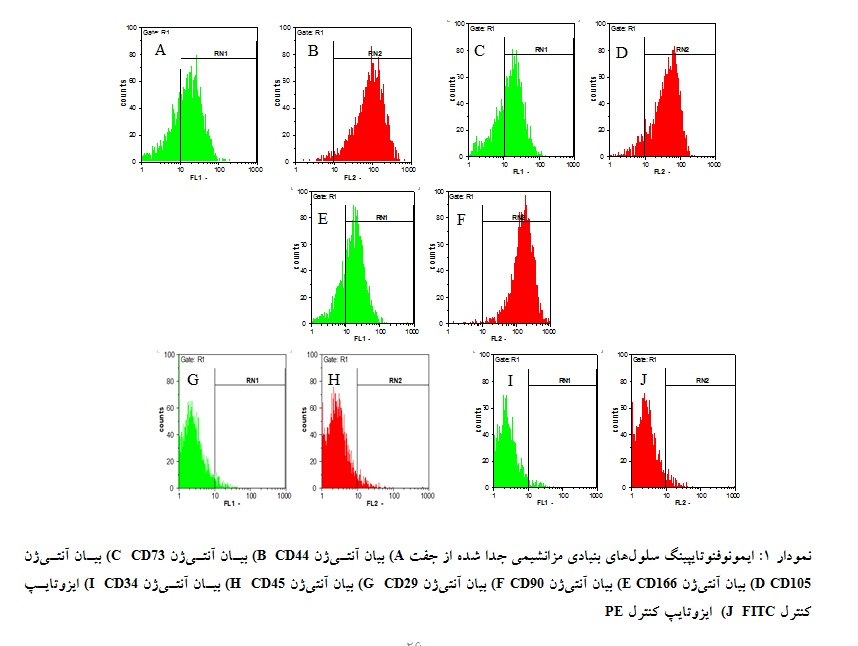
در تمامی نمودارهای بالا، محورهای افقی نمایانگر میزان رنگ کونژوگههای FITC و یا PEمتصل به آنتیبادیهای مورد نظر میباشد و محورهای عمودی تعداد سلولها را نشان میدهد. خطوط RN1, RN2 بیانگر سلولهای واجد مارکر ارزیابی است که توسط آنتیبادیهای نشاندار شده
با مواد فلورسنت شناسایی شدهاند. آنتیبادیهای CD44، CD90، CD105 و CD45 با ماده فلورسنت FITC و آنتیبادیهای CD29، CD73، CD166 و CD34 با ماده فلورسنت PE نشاندار شده است و در سطح سلولهای مزانشیمی آنتیژنهای مذکور بیان میشوند.

در تمامی نمودارهای بالا، محورهای افقی نمایانگر میزان رنگ کونژوگههای FITC و یا PEمتصل به آنتیبادیهای مورد نظر میباشد و محورهای عمودی تعداد سلولها را نشان میدهد. خطوط RN1, RN2 بیانگر سلولهای واجد مارکر ارزیابی است که توسط آنتیبادیهای نشاندار شده
با مواد فلورسنت شناسایی شدهاند. آنتیبادیهای CD44، CD90، CD105 و CD45 با ماده فلورسنت FITC و آنتیبادیهای CD29، CD73، CD166 و CD34 با ماده فلورسنت PE نشاندار شده است و در سطح سلولهای مزانشیمی آنتیژنهای مذکور بیان میشوند.

نمودار 2: میزان تکثیر سلول های مزانشیمی در حضور مواد مختلف به عنوان مکمل در محیط کشت
سلولهای مزانشیمی کشت داده شده در محیط کشتهای حاوی FBS ، لیزات پلاکت خون بند ناف، لیزات پلاکت خون محیطی، سرم خون بند ناف و سرم خون محیطی پس از 7 روز، توسط تریپسین از کف فلاسک جدا شده و شمارش سلولی انجام شده است.
FBS= Fetal Bovine Serum ،PBL= Peripheral Blood Lysate ،CBL= Cord Blood Lysate ،PBS= Peripheral Blood Serum، CBS= Cord Blood Serum

بررسی اثر لیزات پلاکتی برتکثیر سلولهای مزانشیمی:
سلولهای مزانشیمی کشت داده شده در محیط کشتهای حاوی FBS ، لیزات پلاکت خون بند ناف، لیزات پلاکت خون محیطی، سرم خون بند ناف و سرم خون محیطی پس از 7 روز، توسط تریپسین از کف فلاسک جدا شده و شمارش شدند، Viability سلولها در محیطهای با شرایط متفاوت، بالا 80% بود.
بررسی سلولهای مزانشیمی نشان دهنده رشد و تکثیر آنها در حضور عوامل رشد موجود در لیزات پلاکت خون بند ناف، خون محیطی، سرم خون بند ناف و سرم خون محیطی بود(نمودار 2). سلولهای مزانشیمی کشت داده شده در این محیطها از نظر مورفولوژی تغییر خاصی را نشان ندادند. میانگین و انحراف معیار(میانگین ± SD) سلولهای شمارش شده، محاسبه گردید و پس از تحلیل آماری نتایج زیر حاصل شد(جدول1):
- میانگین شمارش سلولهای کشت داده شده در لیزات پلاکت خون محیطی(PBL) با میانگین شمارش سلولهای کشت داده شده در 5% FBS تفاوت معنادار نداشت.
- میانگین شمارش سلولهای کشت داده شده در لیزات پلاکت خون بند ناف(CBL) با میانگین شمارش سلولهای کشت داده شده در 5% FBS تفاوت معنادار نداشت.
- میانگین شمارش سلولهای کشت داده شده در سرم خون محیطی(PBS) با میانگین شمارش
سلولهای کشت داده شده در 5% FBS تفاوت معنادار نداشت. - میانگین شمارش سلولهای کشت داده شده در سرم خون بند ناف با گروه O (CBS) با میانگین شمارش سلولهای کشت داده شده در 10% FBS تفاوت معنادار نداشت.
- میانگین شمارش سلولهای کشت داده شده در PBL+PBS با میانگین شمارش سلولهای کشت داده شده در 5% FBS تفاوت معنادار نداشت.
- میانگین شمارش سلولهای کشت داده شده در CBL+CBS با میانگین شمارش سلولهای کشت داده شده در 10% FBS تفاوت معنادار نداشت.
سلولهای مزانشیمی که به مدت دو هفته در محیط تمایز به استخوان کشت داده شده بودند، تغییرات مورفولوژی نشان داده و با رنگآمیزی اختصاصی آلیزارین رد به رنگ قرمز در آمدند که حاکی از رسوب کلسیم و عناصر معدنی در سطح سلول بود(شکل 2).
ارزیابی توانایی تمایز سلولهای مزانشیمی به آدیپوسیت:
سلولهایی که در محیط تمایز آدیپوسیتی کشت داده شده بودند نیز از شکل دوکی خود خارج شده و به شکل کروی درآمده و واکوئلهای چربی در آنها ظاهر گردید. این تمایز پس از چهار هفته و در رنگآمیزی Oil Red-O به خوبی مشاهده شد(شکل 3).



اندازهگیری میزان TGF- β آزاد شده از پلاکت:
بحث
بیشتر پژوهشهای انجام شده در حیطه کشت سلول، تاثیرات ژل پلاکتی تهیه شده از خون محیطی را بر تکثیر و
تمایز سلولهای بنیادی مزانشیمی جدا شده از مغز استخوان و یا بافت چربی مورد مطالعه قرار دادهاند. چند پژوهش نیز با همین موضوع در ایران انجام گرفته است. تاثیر لیزات پلاکتی بر تکثیر و تمایز سلولهای مزانشیمی کمتر مورد بررسی قرار گرفته و در کشور نیز برای اولین بار پژوهشی با این عنوان انجام گرفت. با توجه به این نکته که مطالعه حاضر برای اولین بار در ایران انجام شده است، علاوه بر بهره بردن از لیزات پلاکتی با دو منبع خون بند ناف و خون محیطی، از غلظتهای متفاوت FBS و هم چنین سرمهای مختلف انسانی در تکثیر و تمایز MSC استفاده کردهایم تا در صورت نتایج قابل قبول، به عنوان جایگزین مناسب برای FBS 10% از آن استفاده کنیم(18).
در مطالعه حاضر سلولهای بنیادی مزانشیمی جدا شده از بافت جفت دارای مارکرهای اختصاصی CD44 ،CD73 ، CD105 ،CD166 ،CD90 و CD29 بودند. لیزات پلاکتی از دو منبع خون بند ناف و خون محیطی، سرم خون AB و سرم خون بند ناف با گروه خونیO به عنوان مکمل به برخی از محیطهای کشت افزوده شد. برای جلوگیری از تداخلات مربوط به تفاوت بین کیسههای پلاکت مشتق از خون بند ناف و خون محیطی در گروههای مورد مطالعه، 3 کیسه پلاکت با هم مخلوط شدند و در یک گروه قرار گرفتند. لیزات پلاکتی به دست آمده میتواند دارای تفاوت زیادی باشد که وابسته به سن اهداکننده، شمارش سلولی اهداکننده و روش آزاد سازی فاکتورهای رشد میباشد. نتایج به دست آمده حاکی از اثر منفی سن بر غلظت محتوای فاکتورهای رشد بود(19).
سلولهای مزانشیمی کشت داده شده در سرم خون محیطی، سرم خون بند ناف، لیزات پلاکتی خون محیطی و یا لیزات پلاکتی خون بند ناف از نظر مورفولوژی شبیه به سلولهای فیبروبلاست بوده و ظاهر دوکی شکل داشتند. علاوه بر آن نتایج کشت، تکثیر و تمایز این سلولها در حضور عوامل رشد موجود در سرم و لیزات پلاکت انسانی نیز بسیار موفقیت آمیز بود و سلولها در حضور این عوامل به خوبی تکثیر یافتند و پتانسیل تمایزی آنها نیز به خوبی حفظ شد.
سلولهای مزانشیمی جدا شده از نظر مورفولوژی شبیه به سلولهای فیبروبلاست بودند و ظاهری دوکی شکل داشتند، این نتایج مشابه نتایج به دست آمده در بسیاری از پژوهشها از جمله مطالعههای آوان زینی و همکارانش در سال 2009 بود(20).
بررسی ایمونوفنوتایپـی سلولهـا بـا استفــاده از روش فلوسیتومتری نشان داد که این سلولها دارای مارکرهــای CD44 ،CD73 ،CD105 ،CD166 ،CD90 و CD29 و فاقد مارکرهای CD34 و CD45 هستند که این نتایج نیز با نتایج سایر محققین از جمله کانماتسو و همکاران مطابقت داشت. در این تحقیق که در سال 2011 به چاپ رسید، مارکرهای ذکر شده را به عنوان مارکرهای تایید شده سلولهای بنیادی مزانشیمی در نظر گرفته بود(3).
به منظور بررسی توانایی تمایز سلولهای مزانشیمی در حضور محیطهای تمایز دهنده کشت داده شدند و به سلولهای استئوبلاست و یا آدیپوسیت به طور جداگانه تمایز یافتند. به منظور تایید تمایز آنها به سلولهای استئوبلاست و آدیپوسیت، از رنگآمیزی سیتوشیمی آلیزارین رد و Oil red-O استفاده شد. در اکثر مطالعهها برای تایید تمایز به سلولهای استئوبلاست و یا آدیپوسیت از این رنگآمیزی آلیزارین رد و یا Oil red-O استفاده شده بود(21). اگر چه در برخی از موارد برای تایید تمایز به استئوبلاست علاوه بر آلیزارین رد از رنگآمیزی آلکالین فسفاتاز نیز استفاده شده بود(22). نتایج این رنگ آمیزیها تاییدی بر تمایز این سلولها بود. نتایج به دست آمده در این مطالعه شبیه نتایج مطالعه ساباپاتی و همکارانش بود(21).
در اغلب مطالعهها به منظور تکثیر و تمایز سلول های مزانشیمی از سرم حیوانی به عنوان مکمل محیط کشت استفاده میشود(24، 23، 3). در مطالعه حاضر به منظور جایگزینی سرم حیوانی به عنوان مکمل محیط کشت از لیزات پلاکتی استفاده گردید. عوامل آزاد شده از پلاکتهای لیز شده که حاوی فاکتورهای رشد متعددی میباشند، به خوبی از رشد سلولها حمایت کردند و در حضور آنها سلولهای مزانشیمی به رشد خود ادامه دادند. فاکتورهای رشد آزاد شده از پلاکت سبب رشد و تکثیر سلولهای مزانشیمی میشوند. مطالعههای متعدد نشان داده است که استفاده از پلاسمای غنی از پلاکت، پلاکتهای لیز شده و عوامل رشد آزاد شده از پلاکت، سبب حمایت از رشد و تکثیر سلولهای بنیادی مزانشیمی میشوند(25، 20، 12). در این مطالعه همانند اغلب مطالعههای انجام گرفته (مثل کرسپودیاز و همکاران در سال 2011 و بیباک و همکاران در سال 2013) برای لیز کردن پلاکت و آزادسازی عوامل رشد از روش انجماد- ذوب متوالی استفاده گردید(26، 9). اغلب پژوهشهای صورت گرفته در زمینه کشت سلول، بر روی تاثیرات ژل پلاکتی بر رشد و تکثیر سلولهای مزانشیمی و بررسی ویژگیهای این ماده، از جمله غلظت فاکتورهای رشد، بهترین روش تهیه و نگهداری و غیره متمرکز بوده است(22). در این مطالعه برای اولین بار در کشور لیزات پلاکتی مشتق از خون بند ناف و نیز خون محیطی تهیه شد و به عنوان جایگزین FBS در کشت سلولهای مزانشیمی مورد بررسی قرار گرفت. همچنین غلظت فاکتور رشد TGF-β در نمونههای مختلف مورد بررسی اندازهگیری شد. بسیاری از مطالعهها از سلولهای بنیادی مزانشیمی مغز استخوان برای کشت استفاده کرده بودند، اما در این پژوهش سلولهای بنیادی مزانشیمی از بافت جفت جدا و کشت داده شدند.
برای تهیه کنسانتره پلاکتی در اغلب مطالعهها از روش آفرزیس استفاده میشود اما در این مطالعه به علت محدودیت امکانات، کنسانترههای پلاکتی از کیسههای خون کامل تهیه گردید و به همین دلیل تعداد پلاکت در دسترس بسیار کمتر از روشهای آفرزیس بود. تحقیقات انجام شده توسط بیباک و همکارانش نشان داده است که شمارش پلاکتی کمتر از /mL 109×5/1 منجر به کاهش تاثیر لیزات پلاکتی بر تکثیر و رشد سلولهای مزانشیمی میشود(9).
علیرغم پایین بودن شمارش پلاکتی در این مطالعه، لیزات پلاکتی تهیه شده از خون بندناف و خون محیطی توانستند به خوبی از رشد و تکثیر سلولهای بنیادی مزانشیمی حمایت کنند و میزان رشد و تکثیر در آنها مشابه نتایج حاصل از کشت این سلولها در 5% FBS بوده است. استفاده همزمان سرم خون بند ناف و لیزات پلاکتی خون بند ناف در محیط کشت نیز باعث بهبود وضعیت رشد و تکثیر سلولهای مزانشیمی و رسیدن به نتایجی مشابه استفاده از 10%FBS در محیط کشت شد. کینز باخ و همکارانش در سال 2013 تاثیر سرم انسانی، لیزات پلاکتی و ترشحات پلاکتهای فعال شده به وسیله ترومبین بر تکثیر سلولهای مزانشیمی بافت چربی و استخوانی را مورد پژوهش قرار دادند و نتایج نشاندهنده تأثیر مشابه این سه ماده بر سلولهای مزانشیم بافت چربی بود. ویت زندر و همکاران هم تاثیر سرم انسانی و لیزات پلاکتی را بر فیبروبلاستهای انسانی و سلولهای مزانشیمی جداشده از بافت چربی بررسی کرده و نشان دادند که زمان دو برابر شدن جمعیت سلولی فیبروبلاستها و سلولهای مزانشیم جدا شـده از بـافت چربـی در سـرم و لیـزات نسبـت بــه
10%FBS کوتاهتر بود(24، 23).
از لیزات پلاکتی علاوه بر تکثیر سلولهای مزانشیمی میتوان در تمایز سلولهای مزانشیمی نیز استفاده کرد. در مطالعه حاضر نشان داده شد که لیزات پلاکتی خون بند ناف و خون محیطی نه تنها سبب تکثیر سلولهای مزانشیمی میشوند، بلکه در حضور این عوامل توانایی تمایز سلولهای مزانشیمی حفظ میشود و این سلولها به خوبی به سلولهای استئوبلاست و آدیپوسیت تمایز مییابند. نتایج این مطالعه با مطالعه ساباپاتی در سال 2014 مطابقت داشت(21). اگر چه تاکنون در هیج مطالعهای اثر لیزات پلاکتی خون بند ناف و خون محیطی بر تکثیر و تمایز سلولهای مزانشیمی جدا شده از بافت جفت بررسی نگردیده است، ولی نتایج حاصل از آن با نتایج سایر مطالعههای انجام شده در زمینه ژل پلاکتی و یا پلاسمای غنی از پلاکت با وجود تفاوتهای ذکر شده، مشابهت زیادی داشته است. از جمله این مطالعهها میتوان به تحقیقات سی یون بیک و همکاران درسال 2013 ، لودی کون و همکاران در سال 2014 ، بلانده و همکارانش در سال 2009 و مطالعههای بیباک اشاره نمود(22، 10، 8، 3).
در مرحله پایانی این مطالعه میزان فاکتور رشد TGF-β در لیزات پلاکتی خون بند ناف، لیزات پلاکت خون محیطی، سرم خون بند ناف و سرم خون محیطی با استفاده از روش الایزا بررسی شد. در مطالعههای مختلف که غلظت چندین فاکتور اندازهگیری شده بود، نتایج نشان داد که میزان TGF-β بالا و در حد نانوگرم در میلی لیتر است، در مطالعه حاضر نیز غلظت این فاکتور در نمونههای مختلف بالا و در حد نانوگرم در میلی لیتر مشاهده شد. البته لازم به ذکر است که نیمه عمر این فاکتورهای رشد پایین بوده و بعد از گذشت زمان ممکن است از میزان آن کاسته شود. لذا دست یابی به روش مناسب برای تهیه عوامل رشد پلاکتی، تعداد مناسب پلاکت و شرایط نگهداری مطلوب همواره مورد توجه محققین بوده است.
نتیجهگیری
در مجمـوع با در نظر گرفتن نتایج به دست آمده از این
مطالعه و مقایسه آن با سایر مطالعهها، میتوان گفت که لیزات پلاکتی تهیه شده از خون بند ناف و خون محیطی میتواند جایگزین مناسبی برای سرم حیوانی در محیط کشت سلول باشد. استفاده از لیزات پلاکتی، محیط مناسبی برای رشد و تکثیر سلولهای مزانشیمی فراهم میسازند و همچنین توانایی تمایز به استئوسیت و آدیپوسیت سلولهای مزانشیمی نیز در محیطهای حاوی این عوامل به خوبی حفظ میگردد. از معایب بهره بردن از مشتقات با منشا حیوانی به عنوان مکمل، خطر انتقال پاتوژنها و واکنشهای ایمونولوژیک میباشد. در واقع نتایج بیانگر این نکته میباشند که کشت سلولهای بنیادی مزانشیمی بدون استفاده از سرم حیوانی امکانپذیر است و در صورتی که
مطالعههای گستردهتری انجام گیرد و همچنین بررسیهای لازم کنترل کیفی، استانداردسازی لازم بر روی این محصولات و هم چنین کاهش پاتوژنها(Pathogen Reduction) انجام شود، میتوان از پلاکتها و مشتقات حاصل از آنها به عنوان مکملهای قدرتمند در چرخههای کشت سلولی استفاده نمود.
تشکر و قدردانی
این مقاله حاصل پایاننامه دانشجویی مصوب مرکز تحقیقات انتقال خون، مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ایران در مقطع کارشناسی ارشد میباشد.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






