جلد 18، شماره 2 - ( تابستان 1400 )
جلد 18 شماره 2 صفحات 126-117 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hashemi Tayer A, Kamravan M. Evaluation of platelet growth factors in platelet gel prepared from umbilical cord blood and peripheral blood. bloodj 2021; 18 (2) :117-126
URL: http://bloodjournal.ir/article-1-1394-fa.html
URL: http://bloodjournal.ir/article-1-1394-fa.html
هاشمی طیر اکبر، کامروان مریم. ارزیابی سطح فاکتورهای رشد پلاکتی در فرآورده ژل پلاکتی حاصل از خون بند ناف و خون محیطی. فصلنامه پژوهشی خون. 1400; 18 (2) :117-126
استادیار مرکز تحقیقات بیماری های غیر واگیر ـ دانشگاه علوم پزشکی جهرم
متن کامل [PDF 554 kb]
(1071 دریافت)
| چکیده (HTML) (2295 مشاهده)
مقدمه
ژل پلاکتی(Platelet Gel; PG) در اصل کنسانتره پلاکتی است که با مخلوط نمودن پلاسمای غنی از پلاکت (Platelet Rich Plasma; PRP) با معرف ترومبین و یون کلسیم تهیه میشود(۱). ترومبین به عنوان فعالکننده پلاکتی، سبب تحریک تجمع پلاکتها شده و در نهایت منبعی از فاکتورهای رشد اگزوژن شامل فاکتور رشد مشتق از پلاکت(PDGF)، فاکتور رشد اپیدرمال(EGF)، فاکتور رشد ترانسفورمینگ(TGF-b)، فاکتور رشد فیبروبلاستی(FGF) و فاکتور رشد اندوتلیال عروقی (VEGF) را فراهم میکند که چرخه ترمیم زخم را واسطهگری مینمایند(۲). PDGF اولین فاکتور رشدی است که در محل زخم یافت میشود و سبب تولید کلاژن، تکثیر و فراخوانی فیبروبلاستها، نوتروفیلها، ماکروفاژها و سلولهای بنیادی مزانشیمی به محل آسیب دیده میگردد(3، 2). EGF با تحریک ساخت سلولهای اپیتلیال و ترشح کلاژناز توسط سلولهای فیبروبلاستی، در فاز بازسازی زخم نقش مهمی ایفا میکند(۴). TGF-β در طول فرایند بهبود زخم افزایش یافته و اهمیت اصلی این فاکتور در فراخوانی پریاستئوبلاستها، شکلگیری استخوان و تولید ماتریکس خارج سلولی میباشد(5، 3). اهمیت فاکتور VEGF در فرآیند رگزایی، فراخوانی استئوبلاستها، تولید استخوان و ترمیم زخم میباشد(6، 3). FGF نیز نقش مهمی در رگزایی، تحریک ساخت سلولهای اپیتلیالی و اندوتلیالی، تولید کلاژن و تحریک انقباض زخم دارد(۷). گرانولهای پلاکتی نه تنها حاوی فاکتورهای رشد هستند بلکه مواد فعال بیولوژیک دیگر نظیر سروتونین، کاتکول آمینها و پروتئینهای ضد باکتریایی نیز در آنها وجود دارد(۸).
بعد از افزودن ترومبین و کلسیم به پلاسمای سرشار از پلاکت، ژل چسبنده و ضخیمی شکل میگیرد که غلظت بالایی از فاکتورهای رشد پلاکتی دخیل در مراحل اولیه ترمیم زخم را نسبت به حالت فیزیولوژیک فراهم میسازد (2، 1). PG به لحاظ داشتن ماهیت ترمیمی و تاثیر ضد باکتریایی، کاربرد گستردهای در درمان زخمهای ناشی از ترومای حاد دارد(۹). همچنین در ترمیم و بازسازی استخوان، ترمیم زخم پای دیابتی، ترمیم زخمهای پوستی و همچنین به عنوان یک عامل پیشگیریکننده از عفونتهای استخوانی در بالین استفاده شده است(15-10). پس از به کار بردن PG ، ژل در بدن جذب میشود و به همین دلیل کاربرد آن سبب ایجاد واکنشهای التهابی، نکروز بافتی و فیبروز وسیع نمیشود(۱۶).
امروزه PG مشتق شده از خون محیطی به عنوان یک ماده بیولوژیک که حاوی غلظت بالایی از فاکتورهای رشد ترمیمی میباشد، به طورگستردهای در بسیاری از زمینههای جراحی کاربرد دارد(۲). در مورد ماهیت ترمیمی PG مشتق شده از خون بند ناف و میزان فاکتورهای رشد موجود در آن، تحقیقات کمی صورت گرفته است و با توجه به این که امروزه خونهای بند ناف بدون هیچ کاربردی دور ریخته میشوند، در صورتی که مشخص گردد PG حاصل از خون بند ناف حاوی غلظت مناسبی از فاکتورهای رشد میباشد، میتوان از آن به عنوان منبعی از فاکتورهای رشد برای تهیه فرآوردههای بیولوژیک با ماهیت ترمیمی استفاده نمود (18، 17). در مطالعه حاضر، نمونه خون بند ناف و خون محیطی از اهداکنندگان داوطلب جمعآوری و پس از تهیه PG ، میزان فاکتورهای رشد پلاکتی مورد ارزیابی قرار گرفتند.
مواد و روشها
انتخاب اهداکننده:
در این مطالعه مورد - شاهدی، بعد از کسب رضایتنامه کتبی از مادران باردار بستری در مرکز آموزشی درمانی شهید مطهری جهرم و اهداکنندگان خون مراجعهکننده به پایگاه انتقال خون جهرم، ۳۰ نمونه خون بند ناف(حجم خون بند ناف بین ۸۰ تا ۲۰۰ میلیلیتر) و ۳۰ نمونه خون محیطی در کیسههای سهتایی(هامبورگ، آلمان، Fresenius Kabi) با ضد انعقاد سیترات(نسبت خون به ضد انعقاد، ۷ به ۱) جمعآوری گردید. در هر دو گروه، عدم وجود اختلالات زمینهای و انعقادی و همچنین عدم مصرف داروهای ضد انعقادی و فیبرینولیتیک، از شرایط ورود به مطالعه و در گروه مادران باردار نیز ناکافی بودن حجم نمونه بند ناف (کمتر از ۵۰ میلیلیتر) و تأخیر در جمعآوری نمونه خون بند ناف از شرایط خروج از مطالعه در نظر گرفته شدند.
جمعآوری خون بند ناف:
در این مطالعه برای جمعآوری نمونه خون بند ناف به این صورت اقدام شد که پس از بریدن و گره زدن بنـد نـاف، یـک کیسـه مخصـوص بـا بارکـد مشـخص جهـت جمعآوری انتخاب گردید. سـوزن متصـل بـه کیسـه بـا رعایت شرایط استریل وارد ورید بند ناف شده و کیسـه در سطح پایینتری قرار داده شد تا خون موجود در وریـد بنـد ناف به سـرعت و بـه طـور کامـل وارد کیسـه جمـعآوری استریل دارای ماده ضد انعقاد شود. پس از جمعآوری، خون بند نـاف برچسـبگـذاری شده، وزن شده و حجم آن ثبت گردید. قبل از تهیه فرآورده، کیسههای خون از نظر حضور لخته یا همولیز به صورت چشمی بررسی شدند.
جمعآوری خون محیطی:
از اهداکنندگان داوطلب، مقدار۴۵۰ میلیلیتر خون کامل در کیسههای سه تایی حاوی ۶۳ میلیلیتر ماده ضد انعقاد سیترات- فسفات- دکستروز(CPD) و از ناحیه پیش بازوی اهدا کننده خونگیری شد. جهت تهیه فرآورده گلبول قرمز، کیسههای خون به مدت ۲۰ دقیقه با سرعت ۲۴۰۰ دور در دقیقه در دمای ۴ درجه سانتیگراد سانتریفیوژ شده و پلاسمای خون توسط اکستراکتور به کیسه جانبی منتقل گردید و گلبولهای قرمز تنها در حجم کمی از پلاسما شناور شدند. بعد از تهیه فرآوردهها، ۲۰۰ میلیلیتر آن که شامل فرآورده گلبول قرمز میباشد، در زنجیره انتقال خون مورد استفاده بیماران نیازمند خون قرار گرفت و تنها از ۲۵۰ میلیلیتر باقیمانده که پلاسمای حاوی پلاکت میباشد، فرآورده ژل پلاکتی تهیه گردید.
در هر دو نوع نمونه گرفته شده(خون بند ناف و خون اهدا کننده داوطلب)، با استفاده از روش سانتریفیوژ و پس از جداسازی PRP از خون، طی مراحلی PG غنی از فاکتورهای رشد که ترکیبی از ترومبین و PRP میباشد، بـه
صورت استریل تهیه گردید.
تهیه پلاسمای غنی از پلاکتPRP)):
نمونههای خون بند ناف و خون محیطی با سرعت ۱۲۰۰ دور در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ شدند. سپس محلول رویی برداشته و به لوله دیگری منتقل گردید و مجدداً با دور ۱۲۰۰ در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ شدند. به منظور تغلیظ پلاکتها، نیمی از پلاسمای رویی به عنوان پلاسمای فاقد پلاکت(Platelet Poor Plasma; PPP) جهت تهیه ترومبین به لوله دیگری منتقل گردید و رسوب پلاکتی تشکیل شده در پلاسمای رویی باقیمانده شناور شده و به عنوان PRP قابل استفاده میباشد(۲). تعداد پلاکتها در PRP با استفاده از لام هموسیتومتر شمارش شده و جهت همسانسازی، تعداد پلاکتها در PRP نمونههای مختلف، در محدوده 106×۲ در هر میکرولیتر پلاسما تنظیم گردید.
تهیه ترومبین از پلاسمای فاقد پلاکت(PPP):
برای تهیه ترومبین، ۵ میلیلیتر PPP با ۱ میلیلیتر کلسیم گلوکونات تزریقی(مینو، ایران) مخلوط شده و به مدت ۳۰ دقیقه در دمای اتاق انکوبه شدند. پس از تشکیل لخته، نمونه با دور ۳۰۰۰ در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ شد و محلول رویی که حاوی ترومبین میباشد در لوله جداگانه جمعآوری گردید(۲).
تهیه ژل پلاکتی:
به منظور تهیه ۱۰ میلیلیتر PG ، ۶ میلیلیتر PRP با ۲ میلیلیتر ترومبین و ۲ میلیلیتر کلسیم گلوکونات تزریقی مخلوط شدند. مخلوط تهیه شده به عنوان PG بلافاصله به ۵ الیکوت تقسیم شده و در زمانهای مختلف(زمان صفر، ۳۰ دقیقه، ۱، ۶ و ۲۴ساعت) در دمای ۳۷ درجه سانتیگراد انکوبه شدند. بعد از گذشت زمانهای فوق، نمونهها با سرعت ۳۰۰۰ دور در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ و سپس محلول رویی(حاوی فاکتورهای رشد پلاکتی) جدا شده و به لوله دیگری منتقل گردید. فاکتورهای تهیه شده تا زمان آنالیز در دمای ۷۰- درجه سانتیگراد نگهداری شدند(۲).
اندازهگیری فاکتورهای رشد آزاد شده از پلاکت:
غلظت مهمترین فاکتورهای رشد پلاکتی شامل PDGF (آلمان، DRG ، Human/Mouse PDGF-AB ELISA kit)، EGF (آلمان، DRG ، Human/Mouse EGF ELISA kit)، VEGF (آلمان، DRG ، Human/Mouse VEGF ELISA kit) و TGFb (آلمان، DRG ، Human/Mouse TGFb ELISA kit) در محلول رویی PG تهیه شده از خون بند ناف و خون محیطی و هم چنین در پلاسمای فاقد پلاکت PPP در زمانهای مختلف انکوباسیون با روش الایزا و طبق دستورالعمل سازنده اندازهگیری شد(2).
تجزیه و تحلیل دادهها:
جهت آنالیز توصیفی دادهها از شاخصهای میانگین و انحراف معیار و برای آنالیز تحلیلی دادهها جهت متغیرهای کمی از تجزیه و تحلیل واریانس(ANOVA) با دادههای تکراری استفاده شد. جهت مقایسه دادهها بین بازههای زمانی مختلف از آزمون Paired t test استفاده شد. برای تمام آنالیزهای آماری از نرمافزار STATA ورژن 13 (آمریکا، TX ، College Station ، Stata Crop) استفاده و ۰۵/۰p < به عنوان سطح آماری معنادار در نظر گرفته شد.
یافتهها
اهداکننده خون بند ناف:
در این مطالعه، ۳۰ نمونه خون بند ناف جمعآوری گردید که ۱۷ نمونه از بند ناف نوزادانی به دست آمد که به روش زایمان طبیعی به دنیا آمده بودند و ۱۳ نمونه نیز از بند ناف نوزادان به روش سزارین جمعآوری گردید. متوسط سن مادران انتخاب شده در روش زایمان طبیعی 5/5 ± 6/24 سال و در روش سزارین 1/6 ± 8/25 سال بود. همچنین میانگین تعداد هفتههای بارداری در روش زایمان طبیعی 97/0 ± 4/39 هفته و در روش سزارین 38/1 ± 6/38 هفته بود. نتایج آزمایشهای غربالگری انعقادی PT و PTT مادران نیز در محدوده طبیعی تعیین مقدار شد.
در این مطالعه، متوسط حجم خون گرفته شده از بند ناف نوزادن به روش سزارین و زایمان طبیعی به ترتیب 8/29 ± 95 میلیلیتر و 2/24 ± ۸۶ میلیلیتر بود و به طور میانگین حجم PPP و PRP به دست آمده از هر دو روش به ترتیب 9/7 ± 5/34 میلیلیتر و 2/5 ± 3/10 میلیلیتر تعیین مقدار شد. همچنین میانگین تعداد پلاکتها در خون بند ناف 103 × 7/45 ± 199 در هر میکرولیتر خون تعیین مقدار شد.
اهداکننده خون محیطی:
در این مطالعه متوسط سن اهداکنندگان داوطلب 8/11 ± ۱/۳۷ سال بود. حداقل سنی ۱۹ و حداکثر سنی ۵۸ سال بود. از تعداد ۳۰ داوطلب، ۲۸ نفر مرد و تنها 2 نفر زن بودند. نتایج آزمایشهای غربالگری انعقادی افراد داوطلب در محدوده طبیعی تعیین مقدار شد. در این مطالعه، متوسط حجم خون کامل، PPP و PRP گرفته شده از اهداکنندگان به ترتیب 2/10± 8/499 میلی لیتر، ۹/۸ ±۱۸۰ میلیلیتر و ۸/۹ ± ۶/۵۱ میلیلیتر تعیین مقدار شد. میانگین تعداد پلاکتها در خون محیطی به دست آمده از اهداکنندگان 103×3/43±189 در هر میکرولیتر خون تعیین مقدار شد.
تهیه ژل پلاکتی:
در این مطالعه، PG با اضافه نمودن ترومبین و کلسیم گلوکونات به PRP به دست آمد(شکل ۱).
شکل 1: PG تهیه شده از خون بند ناف
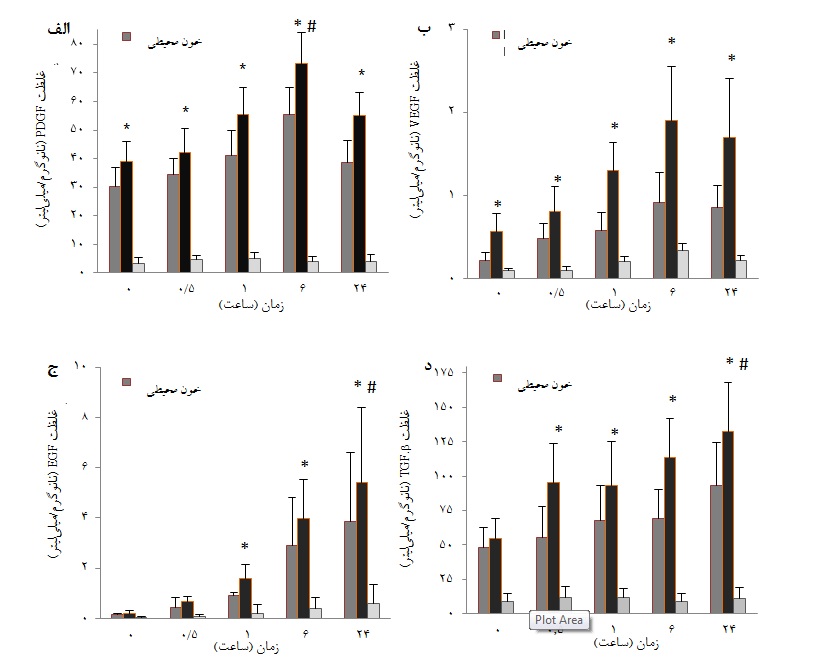
نمودار ۱: میزان فاکتورهای رشد در محلول رویی PG حاصل از خون بند ناف و خون محیطی و PPP در زمانهای مختلف انکوباسیون. در طول زمان انکوباسیون، غلظت فاکتور PDGF(نمودار ۱ الف) و فاکتور VEGF (نمودار ۱ ب) در نمونه PG خون بند ناف و خون محیطی با طولانیتر شدن زمان انکوباسیون تا ۶ ساعت افزایش معناداری پیدا کرد(ANOVA ,۰۱/۰p< #;). میزان فاکتورهای رشد EGF (نمودار ۱ج) و TGF-β (نمودار ۱د) به تدریج در طول ۲۴ ساعت انکوباسیون افزایش معناداری داشتند(ANOVA ,۰۱/۰p< #;). همچنین غلظت فاکتورها بین نمونههای PG حاصل از خون بند ناف در مقایسه با خون محیطی و پلاسمای PPP تفاوت قابل توجه آماری داشت( paired t-test ,۰۰۱/۰p< *;).
سنجش سطح فاکتورهای رشد آزاد شده از پلاکتهای فعالشده:
سطح فاکتورهای رشد پلاکتی در PG تهیه شده از نمونههای خون بند ناف و خون محیطی و همچنین در PPP در زمانهای مختلف انکوباسیون با روش الایزا اندازهگیری شد. نتایج نشان دادند که بیشترین غلظت فاکتور رشد آزاد شده PDGF-AB و VEGF در PG تهیه شده از خون بند ناف و خون محیطی مربوط به ۶ ساعت اول پس از انکوباسیون PG بود که از نظر آماری به طور معناداری نسبت به زمانهای دیگر مورد مطالعه بیشتر بود. بعد از تحریک پلاکتی با ترومبین و کلسیم گلوکونات، میزان این فاکتورها افزایش یافته و ۶ ساعت بعد از انکوباسیون، بیشترین میزان فاکتور اندازهگیری شد(نمودار 1، الف و ب). تفاوت میزان فاکتورها در این زمان نسبت به سایر زمانها از لحاظ آماری معنادار بود(۰۱/۰p<). بعد از مدت ۶ ساعت، سطح فاکتور به آرامی و آهسته در طول انکوباسیون شروع به کاهش یافت. در بررسی بین نمونههای مختلف مورد آزمایش، قابل توجه است که در تمام زمانها، سطح فاکتور PDGF و VEGF در PG خون بند ناف بیشتر از خون محیطی و PPP اندازهگیری شد(۰۱/۰p<). این تفاوت از نظر آماری معنادار بود(۰۰۱/۰p<). همچنین سطح فاکتور PDGF و VEGF در PG خون محیطی در تمامی زمانهای مورد آزمایش بیشتر از سطح فاکتور در PPP اندازهگیری شد و این تفاوت نیـز از نظر آماری معنادار بود(۰۰۱/۰p<).
همچنین یافتههای الایزا نشان دادند که در طول دوره انکوباسیون تا ۲۴ساعت، میزان فاکتورهای رشد EGF و TGF-β به تدریج افزایش مییابد، به طوری که بیشترین غلظت TGF-β و EGF در پایان ۲۴ ساعت انکوباسیون به ترتیب به میزان ۲/۳۶ ± ۲/۱۳۲ نانوگرم در میلی لیتر و ۹/۲ ± ۴/۵ پیکوگرم در میلیلیتر در PG حاصل از خون بند ناف افزایش یافت(نمودار 1، ج و د). در مجموع میزان TGF-β و EGF در این زمان، نسبت به سایر زمانهای انکوباسیون هم در محلول رویی PG (خون بند ناف و خون محیطی) و هم در PPP به طور معناداری بیشتر بود(۰۱/۰p<). قابل توجه است که بر خلاف میزان بالای فاکتورهای PDGF ، VEGF و TGF-β، میزان فاکتور EGF در محلول رویی PG و هم در PPP پائین و در حدود پیکوگرم در میلیلیتر است. تغییر آماری معناداری در غلظت فاکتور TGF در پلاسمای PPP در طول زمان انکوباسیون وجود نداشت.
در بررسی بین نمونههای مختلف مورد آزمایش نیز، قابل توجه است که در تمام زمانهای مورد آزمایش سطح فاکتورهای رشد TGF-β و EGF اندازهگیری شده در PG خون بند ناف بیشتر از خون محیطی(به استثنای زمان صفر) و PPP اندازهگیری شد(۰۰۱/۰p<). همچنین سطح فاکتور TGF-β و EGF در PG خون محیطی در تمامی زمانهای مورد آزمایش بیشتر از سطح فاکتور در PPP اندازهگیری شد و این تفاوت از نظر آماری معنادار بود(۰۰۱/۰p<).
بحث
هدف اصلی از انجام مطالعه حاضر، تهیه و تعیین خصوصیات PG تهیه شده از خون بند ناف در مقایسه با خون محیطی با تمرکز بر ارزیابی سطح فاکتورهای رشد پلاکتی آزاد شده میباشد. یافتههای ما نشان داد که به دنبال
تهیه PG و انکوباسیون آن در طول مدت ۲۴ ساعت، سطح
فاکتورهای رشد پلاکتی به طور قابل توجهی با گذشت زمان انکوباسیون افزایش یافت. بیشترین غلظت فاکتور رشد آزاد شده PDGF و VEGF در PG تهیه شده از خون بند ناف و خون محیطی مربوط به ۶ ساعت اول پس از انکوباسیون PG بود که از نظر آماری به طور معناداری نسبت به زمانهای دیگر بیشتر بود.
در مورد فاکتورهای رشد EGF و TGF-β نیز بیشترین غلظت فاکتور رشد آزاد شده در PG تهیه شده از خون بند ناف و خون محیطی مربوط به زمان انکوباسیون ۲۴ ساعت بود که از نظر آماری به طور معناداری نسبت به زمانهای دیگر بیشتر بود. در بررسی بین نمونههای مختلف مورد آزمایش نیز، قابل توجه است که در تمام زمانهای انکوباسیون مورد آزمایش، سطح تمام فاکتورهای رشد مورد مطالعه در PG تهیه شده از خون بند ناف بیشتر از PG حاصل از خون محیطی و پلاسمای PPP اندازهگیری شد و این تفاوت از نظر آماری معنادار بود.
در این مطالعه نیز همانند مطالعه مارتینو، میزان فاکتورهای رشد TGF و PDGF در پلاسما و محلول رویی PG بالا بود. در مطالعه هاشمی و همکاران در سال ۲۰۱۲، خصوصیات آزمایشگاهی PG اتولوگ تهیه شده از خون محیطی و میزان آزادسازی فاکتورهای رشد پلاکتی به دنبال ۷۲ ساعت انکوباسیون و در ۶ نقطه زمانی(۰، ۵/۰، ۶، ۲۴، ۴۸ و ۷۲ ساعت) مورد بررسی قرار گرفت و نشان داده شد که غلظت فاکتورهای رشد PDGF و TGF-β در PG تهیه شده از خون محیطی بالا بود، در مقابل غلظت فاکتورهای EGF و FGF پایین بود. همچنین نشان داده شد که حداکثر غلظت PDGF در مدت زمان ۳۰ دقیقه و در مورد سایر فاکتورها نیز به دنبال ۲۴ ساعت انکوباسیون از پلاکتها آزاد میگردند که با یافتههای مطالعه حاضر همخوانی دارد (۲).
در مطالعه حاضر، افزایش سطح فاکتورهای رشد پلاکتی در PG تهیه شده از خون بند ناف با مطالعه پرازی و همکارانش مطابقت داشت(17). مطالعه پرازی و همکارانش با هدف ارزیابی تعدادی از فاکتورهای رشد پلاکتی در PG حاصل از خون بند ناف، نشان داد که غلظت فاکتورهای رشد پلاکتی PDGF-ββ ، VEGF ، FGF و به مقدار کمتری سطح PDGF-AB در ژل پلاکتی خون بند ناف بیشتر از پلاسمای PPP بود و پیشنهاد کردند که در مصارف بالینی نظیر مهندسی بافت که سطح بالاتری از فاکتورهای رشد پلاکتی مورد نیاز میباشد، استفاده از PG خون بند ناف میتواند سودمند باشد. از طرف دیگر آنها نشان دادند که سطح فاکتور TGF-βدر PG خون بند ناف کمتر از خون محیطی میباشد که در تناقض با نتایج این مطالعه است. TGF-β به عنوان پروتئین تنظیمی چند عملکردی است که به واسطه افزایش تولید کلاژن در القای پاسخهای ترمیمی نقش مهمی ایفا میکند(۱۷).
در مطالعه سو و همکاران، در بررسی ۸ نمونه ریلیزات پلاکتی با هدف ارزیابی فاکتورهای رشد پلاکتی به دنبال ۵ ساعت انکوباسیون، نشان داده شد که سطح اکثر فاکتورهای رشد پلاکتی به استثنای فاکتور رشد شبه انسولین(IGF)، به طور قابل ملاحظهای به دنبال تهیه PG خون محیطی افزایش پیدا میکند که با یافتههای مطالعه حاضر مطابقت دارد(19). همچنین در مطالعه دیگری از سو و همکاران اشاره شده است که تنها ۳۵% PDGF و۵۰% TGF-β پلاکتی در عرض ۱ الی ۵ ساعت از تهیه PG خون محیطی آزاد میشوند(۲۰). در مطالعه حاضر، میزان آزادسازی فاکتور EGF در ابتدای دوره انکوباسیون PG کم بود که در نهایت بعد از ۲۴ ساعت انکوباسیون به حداکثر میزان خود رسید. در مطالعههایی نشان داده شد، هنگامی که از غلظت بالاتر ترومبین برای دگرانولاسیون پلاکتی استفاده شود، آزادسازی EGFسریعاً آغاز میشود ولی هنگامی که از غلظتهای کمتر ترومبین و کلسیم استفاده شود، آزادسازی این فاکتور به تأخیر میافتد(21، 2). در این مطالعه، تأخیر در آزادسازی فاکتور EGF احتمالاً به دلیل پایین بودن میزان فعالیت ترومبین میباشد.
روشهای متعددی برای تهیه PG و آزادسازی فاکتورهای رشد پلاکتی گزارش شده است که عامل مشترک در تمام روشهای مختلف تهیه PG، استفاده از فعالکنندههای مختلف پلاکتی(گلوکونات کلسیم، ترومبین، و باتروکسوبین) و استراتژی سانتریفیوژ میباشد. افزودن ترومبین و کلسیم به پلاسمای غنی از پلاکت، سبب تحریک پلاکتها و دگرانولاسیون آنها میشود که در نهایت فاکتورهای رشد موجود در گرانولهای آلفای پلاکتی آزاد میشود(۱۶). در اکثر مطالعهها برای تهیه ژل پلاکتی، از ترومبین تجاری با میزان فعالیت بالا استفاده شده است. اما در برخی مطالعهها نشان داده شده است که استفاده از ترومبین تهیه شده از پلاسمای انسانی علیرغم فعالیت اندازهگیری شده پایینتر، فعالیت مناسبتری داشته و به طور مؤثرتری باعث آزادسازی عوامل رشد پلاکتی میگردد(۲). در مطالعه پرازی و همکارانش، جهت فعال سازی پلاکتها و تهیه PG از خون بند ناف از کلسیم گلوکونات و باتروکسوبین به عنوان فعالکننده قوی پلاکتی استفاده شده است(۱۷). فاکتورهای رشد پلاکتی با داشتن ماهیتهای میتوژنیک و کموتاکتیک میتوانند عملکردهای سلولی درگیر در چرخه ترمیم بافت و تکثیر سلولی را افزایش دهند. با توجه به ماهیتهای پلاکتی اشاره شده، در مطالعههای بالینی مختلف به گزارشهایی مبنی بر تسریع ترمیم زخم به دنبال درمان با PG و فاکتورهای رشد پلاکتی اشاره شده است(۲۴-۲۲). با توجه به نتایج مطالعه حاضر مبنی بر بالاتر بودن غلظت PDGF و VEGF در PG خون بند ناف نسبت به خون محیطی، میتوان در بسیاری از موارد بالینی نظیر زخم پای دیابتی، از PG خون بند ناف استفاده نمود. تصور بر این است که در بیماران دیابتی، کاهش تولید VEGF و رگزایی عامل اختلال در ترمیم بافت باشند. نشان داده شده است که زخمهای درمان شده با VEGF میزان بالاتری از اپیتلیزاسیون، تولید ماتریکس خارج سلولی و تکثیر سلولی بیشتر را نشان میدهند(۲۵).
در سالهای اخیر، نقش تکثیری فاکتورهای رشد حاصل از خون بند ناف، مورد بررسی قرار گرفته است و نشان داده شد که استفاده از PG خون بند ناف در مقایسه با خون محیطی میتواند متعهد شدن سلول بنیادی مزانشیمی را به طور متفاوتی تحت تأثیر قرار دهد و پیشنهاد کردند که PG خون بند ناف علاوه بر داشتن خصوصیت ویژه رگزایی، میتواند خصوصیات بسیار عالی تکثیری را به عنوان مکمل کشت سلولی نشان دهد(۲۶). در بررسی کاربردهای بالینی و ترمیمی PG ، کارآیی PG به واسطه آزادسازی فاکتورهای رشد میباشد که میتوانند از طریق اثرات پاراکرینی، میانجی ترمیم بافت باشند. در حال حاضر با توجه به استفاده از رویکردهای مختلف در تهیه PG و آزادسازی فاکتورهای رشد، قیاس کردن نتایج به دست آمده در این مطالعه با مطالعههای مشابه دیگر شاید کمی مشکل باشد. قابل توجه است که فاکتورهای رشد تحت تاثیر تعداد پلاکتها و لوکوسیتها نیز قرار دارند و باید از روشهای استاندارد تولید کنسانتره پلاکتی استفاده شود(۲۷).
نتیجهگیری
در این مطالعه به روشی آسان، ساده و در دسترس برای تهیه PG و آزادسازی فاکتورهای رشد از منبع خون بند ناف اشاره شد. با توجه به بالاتر بودن غلظت فاکتورهای
رشد پلاکتی در PG تهیه شده از خون بند ناف در مقایسه با خون محیطی، استفاده از فرآورده خون بند ناف در انواع درمانهای ترمیمی میتواند سودمند باشد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه دکترای حرفهای بوده که در کمیتـه اخـلاق پزشـکی دانشگاه علوم پزشکی جهرم با کد IR.JUMS.REC.1397.031 مورد تصویب قرار گرفته است. بدینوسیله نویسندگان مقاله برخود لازم میدانند تا از همکاری معاونت محترم پژوهشی دانشگاه علوم پزشکی جهرم به دلیل تأمین مالی این پروژه و همچنین از همکاری صمیمانه اهداکنندگان خون بند ناف سپاسگزاری نمایند.
متن کامل: (2216 مشاهده)
ارزیابی سطح فاکتورهای رشد پلاکتی در فرآورده ژل پلاکتی حاصل از
خون بند ناف و خون محیطی
اکبر هاشمی طیر1، مریم کامروان2
چکیده
سابقه و هدف
ژل پلاکتی، غنی از فاکتورهای رشد نظیر فاکتور رشد مشتق از پلاکت، فاکتور رشد ترانسفورمینگ، فاکتور رشد اندوتلیال عروقی، فاکتور رشد اپیدرمال و فاکتور رشد فیبروبلاستی میباشد که ماهیتهای ترمیمی دارند. در این مطالعه، فاکتورهای رشد در ژل پلاکتی تهیه شده از خون بند ناف و خون محیطی بررسی شدند.
مواد و روشها
در این مطالعه مورد - شاهدی، نمونه خون ۳۰ اهداکننده خون بند ناف و ۳۰ اهداکننده خون محیطی مورد ارزیابی قرار گرفت. از نمونههای جمعآوری شده، ژل پلاکتی(فاکتور رشد پلاکتی) تهیه گردید. سطح فاکتورهای رشد در محلول رویی فاکتور رشد پلاکتی در زمانهای مختلف انکوباسیون(۰، ۵/۰، ۱، ۶ و ۲۴ ساعت) در دمای 37 درجه سانتیگراد با استفاده از الایزا اندازهگیری شد.
یافتهها
ارزیابی الایزا نشان داد که غلظت فاکتورهای رشد مشتق از پلاکت و رشد اندوتلیال عروقی، در محلول رویی ژل پلاکتی خون بند ناف بعد از ۶ ساعت انکوباسیون به طور قابل توجهی افزایش یافت(۰۱/۰p<). غلظت فاکتور رشد مشتق از پلاکت در ژل پلاکتی خون بند ناف در زمان صفر و ۶ ساعت انکوباسیون به ترتیب ۱/۷ ± ۹۰/۳۸ و ۹/۱۰±۲۰/۷۳ نانوگرم در میلیلیتر تعیین شد. همچنین سطح فاکتورهای رشد ترانسفورمینگ و فاکتور رشد اپیدرمال به دنبال ۲۴ ساعت انکوباسیون ژل پلاکتی به طور معناداری افزایش داشتند (۰۱/۰p<). در تمام زمانهای مورد مطالعه، سطح فاکتورهای رشد اندازهگیری شده در ژل پلاکتی خون بند ناف بیشتر از ژل پلاکتی خون محیطی تعیین شد.
نتیجه گیری
مقدار قابل توجهی از فاکتورهای رشد در ژل پلاکتی خون بند ناف آزاد میشوند که میتوانند پروسه ترمیم را واسطهگری کنند.
کلمات کلیدی: خون بند ناف، پلاکتها، فاکتور رشد
تاریخ دریافت: 21/11/99
تاریخ پذیرش: 26/02/1400
1- مؤلف مسئول: دکترای تخصصی هماتولوژی ـ استادیار مرکز تحقیقات بیماریهای غیر واگیر ـ دانشگاه علوم پزشکی جهرم ـ جهرم ـ ایران ـ کدپستی: 74148046199
2- کارشناس پرستاری ـ دانشگاه علوم پزشکی جهرم ـ جهرم ـ ایران
خون بند ناف و خون محیطی
اکبر هاشمی طیر1، مریم کامروان2
چکیده
سابقه و هدف
ژل پلاکتی، غنی از فاکتورهای رشد نظیر فاکتور رشد مشتق از پلاکت، فاکتور رشد ترانسفورمینگ، فاکتور رشد اندوتلیال عروقی، فاکتور رشد اپیدرمال و فاکتور رشد فیبروبلاستی میباشد که ماهیتهای ترمیمی دارند. در این مطالعه، فاکتورهای رشد در ژل پلاکتی تهیه شده از خون بند ناف و خون محیطی بررسی شدند.
مواد و روشها
در این مطالعه مورد - شاهدی، نمونه خون ۳۰ اهداکننده خون بند ناف و ۳۰ اهداکننده خون محیطی مورد ارزیابی قرار گرفت. از نمونههای جمعآوری شده، ژل پلاکتی(فاکتور رشد پلاکتی) تهیه گردید. سطح فاکتورهای رشد در محلول رویی فاکتور رشد پلاکتی در زمانهای مختلف انکوباسیون(۰، ۵/۰، ۱، ۶ و ۲۴ ساعت) در دمای 37 درجه سانتیگراد با استفاده از الایزا اندازهگیری شد.
یافتهها
ارزیابی الایزا نشان داد که غلظت فاکتورهای رشد مشتق از پلاکت و رشد اندوتلیال عروقی، در محلول رویی ژل پلاکتی خون بند ناف بعد از ۶ ساعت انکوباسیون به طور قابل توجهی افزایش یافت(۰۱/۰p<). غلظت فاکتور رشد مشتق از پلاکت در ژل پلاکتی خون بند ناف در زمان صفر و ۶ ساعت انکوباسیون به ترتیب ۱/۷ ± ۹۰/۳۸ و ۹/۱۰±۲۰/۷۳ نانوگرم در میلیلیتر تعیین شد. همچنین سطح فاکتورهای رشد ترانسفورمینگ و فاکتور رشد اپیدرمال به دنبال ۲۴ ساعت انکوباسیون ژل پلاکتی به طور معناداری افزایش داشتند (۰۱/۰p<). در تمام زمانهای مورد مطالعه، سطح فاکتورهای رشد اندازهگیری شده در ژل پلاکتی خون بند ناف بیشتر از ژل پلاکتی خون محیطی تعیین شد.
نتیجه گیری
مقدار قابل توجهی از فاکتورهای رشد در ژل پلاکتی خون بند ناف آزاد میشوند که میتوانند پروسه ترمیم را واسطهگری کنند.
کلمات کلیدی: خون بند ناف، پلاکتها، فاکتور رشد
تاریخ دریافت: 21/11/99
تاریخ پذیرش: 26/02/1400
1- مؤلف مسئول: دکترای تخصصی هماتولوژی ـ استادیار مرکز تحقیقات بیماریهای غیر واگیر ـ دانشگاه علوم پزشکی جهرم ـ جهرم ـ ایران ـ کدپستی: 74148046199
2- کارشناس پرستاری ـ دانشگاه علوم پزشکی جهرم ـ جهرم ـ ایران
مقدمه
ژل پلاکتی(Platelet Gel; PG) در اصل کنسانتره پلاکتی است که با مخلوط نمودن پلاسمای غنی از پلاکت (Platelet Rich Plasma; PRP) با معرف ترومبین و یون کلسیم تهیه میشود(۱). ترومبین به عنوان فعالکننده پلاکتی، سبب تحریک تجمع پلاکتها شده و در نهایت منبعی از فاکتورهای رشد اگزوژن شامل فاکتور رشد مشتق از پلاکت(PDGF)، فاکتور رشد اپیدرمال(EGF)، فاکتور رشد ترانسفورمینگ(TGF-b)، فاکتور رشد فیبروبلاستی(FGF) و فاکتور رشد اندوتلیال عروقی (VEGF) را فراهم میکند که چرخه ترمیم زخم را واسطهگری مینمایند(۲). PDGF اولین فاکتور رشدی است که در محل زخم یافت میشود و سبب تولید کلاژن، تکثیر و فراخوانی فیبروبلاستها، نوتروفیلها، ماکروفاژها و سلولهای بنیادی مزانشیمی به محل آسیب دیده میگردد(3، 2). EGF با تحریک ساخت سلولهای اپیتلیال و ترشح کلاژناز توسط سلولهای فیبروبلاستی، در فاز بازسازی زخم نقش مهمی ایفا میکند(۴). TGF-β در طول فرایند بهبود زخم افزایش یافته و اهمیت اصلی این فاکتور در فراخوانی پریاستئوبلاستها، شکلگیری استخوان و تولید ماتریکس خارج سلولی میباشد(5، 3). اهمیت فاکتور VEGF در فرآیند رگزایی، فراخوانی استئوبلاستها، تولید استخوان و ترمیم زخم میباشد(6، 3). FGF نیز نقش مهمی در رگزایی، تحریک ساخت سلولهای اپیتلیالی و اندوتلیالی، تولید کلاژن و تحریک انقباض زخم دارد(۷). گرانولهای پلاکتی نه تنها حاوی فاکتورهای رشد هستند بلکه مواد فعال بیولوژیک دیگر نظیر سروتونین، کاتکول آمینها و پروتئینهای ضد باکتریایی نیز در آنها وجود دارد(۸).
بعد از افزودن ترومبین و کلسیم به پلاسمای سرشار از پلاکت، ژل چسبنده و ضخیمی شکل میگیرد که غلظت بالایی از فاکتورهای رشد پلاکتی دخیل در مراحل اولیه ترمیم زخم را نسبت به حالت فیزیولوژیک فراهم میسازد (2، 1). PG به لحاظ داشتن ماهیت ترمیمی و تاثیر ضد باکتریایی، کاربرد گستردهای در درمان زخمهای ناشی از ترومای حاد دارد(۹). همچنین در ترمیم و بازسازی استخوان، ترمیم زخم پای دیابتی، ترمیم زخمهای پوستی و همچنین به عنوان یک عامل پیشگیریکننده از عفونتهای استخوانی در بالین استفاده شده است(15-10). پس از به کار بردن PG ، ژل در بدن جذب میشود و به همین دلیل کاربرد آن سبب ایجاد واکنشهای التهابی، نکروز بافتی و فیبروز وسیع نمیشود(۱۶).
امروزه PG مشتق شده از خون محیطی به عنوان یک ماده بیولوژیک که حاوی غلظت بالایی از فاکتورهای رشد ترمیمی میباشد، به طورگستردهای در بسیاری از زمینههای جراحی کاربرد دارد(۲). در مورد ماهیت ترمیمی PG مشتق شده از خون بند ناف و میزان فاکتورهای رشد موجود در آن، تحقیقات کمی صورت گرفته است و با توجه به این که امروزه خونهای بند ناف بدون هیچ کاربردی دور ریخته میشوند، در صورتی که مشخص گردد PG حاصل از خون بند ناف حاوی غلظت مناسبی از فاکتورهای رشد میباشد، میتوان از آن به عنوان منبعی از فاکتورهای رشد برای تهیه فرآوردههای بیولوژیک با ماهیت ترمیمی استفاده نمود (18، 17). در مطالعه حاضر، نمونه خون بند ناف و خون محیطی از اهداکنندگان داوطلب جمعآوری و پس از تهیه PG ، میزان فاکتورهای رشد پلاکتی مورد ارزیابی قرار گرفتند.
مواد و روشها
انتخاب اهداکننده:
در این مطالعه مورد - شاهدی، بعد از کسب رضایتنامه کتبی از مادران باردار بستری در مرکز آموزشی درمانی شهید مطهری جهرم و اهداکنندگان خون مراجعهکننده به پایگاه انتقال خون جهرم، ۳۰ نمونه خون بند ناف(حجم خون بند ناف بین ۸۰ تا ۲۰۰ میلیلیتر) و ۳۰ نمونه خون محیطی در کیسههای سهتایی(هامبورگ، آلمان، Fresenius Kabi) با ضد انعقاد سیترات(نسبت خون به ضد انعقاد، ۷ به ۱) جمعآوری گردید. در هر دو گروه، عدم وجود اختلالات زمینهای و انعقادی و همچنین عدم مصرف داروهای ضد انعقادی و فیبرینولیتیک، از شرایط ورود به مطالعه و در گروه مادران باردار نیز ناکافی بودن حجم نمونه بند ناف (کمتر از ۵۰ میلیلیتر) و تأخیر در جمعآوری نمونه خون بند ناف از شرایط خروج از مطالعه در نظر گرفته شدند.
جمعآوری خون بند ناف:
در این مطالعه برای جمعآوری نمونه خون بند ناف به این صورت اقدام شد که پس از بریدن و گره زدن بنـد نـاف، یـک کیسـه مخصـوص بـا بارکـد مشـخص جهـت جمعآوری انتخاب گردید. سـوزن متصـل بـه کیسـه بـا رعایت شرایط استریل وارد ورید بند ناف شده و کیسـه در سطح پایینتری قرار داده شد تا خون موجود در وریـد بنـد ناف به سـرعت و بـه طـور کامـل وارد کیسـه جمـعآوری استریل دارای ماده ضد انعقاد شود. پس از جمعآوری، خون بند نـاف برچسـبگـذاری شده، وزن شده و حجم آن ثبت گردید. قبل از تهیه فرآورده، کیسههای خون از نظر حضور لخته یا همولیز به صورت چشمی بررسی شدند.
جمعآوری خون محیطی:
از اهداکنندگان داوطلب، مقدار۴۵۰ میلیلیتر خون کامل در کیسههای سه تایی حاوی ۶۳ میلیلیتر ماده ضد انعقاد سیترات- فسفات- دکستروز(CPD) و از ناحیه پیش بازوی اهدا کننده خونگیری شد. جهت تهیه فرآورده گلبول قرمز، کیسههای خون به مدت ۲۰ دقیقه با سرعت ۲۴۰۰ دور در دقیقه در دمای ۴ درجه سانتیگراد سانتریفیوژ شده و پلاسمای خون توسط اکستراکتور به کیسه جانبی منتقل گردید و گلبولهای قرمز تنها در حجم کمی از پلاسما شناور شدند. بعد از تهیه فرآوردهها، ۲۰۰ میلیلیتر آن که شامل فرآورده گلبول قرمز میباشد، در زنجیره انتقال خون مورد استفاده بیماران نیازمند خون قرار گرفت و تنها از ۲۵۰ میلیلیتر باقیمانده که پلاسمای حاوی پلاکت میباشد، فرآورده ژل پلاکتی تهیه گردید.
در هر دو نوع نمونه گرفته شده(خون بند ناف و خون اهدا کننده داوطلب)، با استفاده از روش سانتریفیوژ و پس از جداسازی PRP از خون، طی مراحلی PG غنی از فاکتورهای رشد که ترکیبی از ترومبین و PRP میباشد، بـه
صورت استریل تهیه گردید.
تهیه پلاسمای غنی از پلاکتPRP)):
نمونههای خون بند ناف و خون محیطی با سرعت ۱۲۰۰ دور در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ شدند. سپس محلول رویی برداشته و به لوله دیگری منتقل گردید و مجدداً با دور ۱۲۰۰ در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ شدند. به منظور تغلیظ پلاکتها، نیمی از پلاسمای رویی به عنوان پلاسمای فاقد پلاکت(Platelet Poor Plasma; PPP) جهت تهیه ترومبین به لوله دیگری منتقل گردید و رسوب پلاکتی تشکیل شده در پلاسمای رویی باقیمانده شناور شده و به عنوان PRP قابل استفاده میباشد(۲). تعداد پلاکتها در PRP با استفاده از لام هموسیتومتر شمارش شده و جهت همسانسازی، تعداد پلاکتها در PRP نمونههای مختلف، در محدوده 106×۲ در هر میکرولیتر پلاسما تنظیم گردید.
تهیه ترومبین از پلاسمای فاقد پلاکت(PPP):
برای تهیه ترومبین، ۵ میلیلیتر PPP با ۱ میلیلیتر کلسیم گلوکونات تزریقی(مینو، ایران) مخلوط شده و به مدت ۳۰ دقیقه در دمای اتاق انکوبه شدند. پس از تشکیل لخته، نمونه با دور ۳۰۰۰ در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ شد و محلول رویی که حاوی ترومبین میباشد در لوله جداگانه جمعآوری گردید(۲).
تهیه ژل پلاکتی:
به منظور تهیه ۱۰ میلیلیتر PG ، ۶ میلیلیتر PRP با ۲ میلیلیتر ترومبین و ۲ میلیلیتر کلسیم گلوکونات تزریقی مخلوط شدند. مخلوط تهیه شده به عنوان PG بلافاصله به ۵ الیکوت تقسیم شده و در زمانهای مختلف(زمان صفر، ۳۰ دقیقه، ۱، ۶ و ۲۴ساعت) در دمای ۳۷ درجه سانتیگراد انکوبه شدند. بعد از گذشت زمانهای فوق، نمونهها با سرعت ۳۰۰۰ دور در دقیقه به مدت ۱۰ دقیقه سانتریفیوژ و سپس محلول رویی(حاوی فاکتورهای رشد پلاکتی) جدا شده و به لوله دیگری منتقل گردید. فاکتورهای تهیه شده تا زمان آنالیز در دمای ۷۰- درجه سانتیگراد نگهداری شدند(۲).
اندازهگیری فاکتورهای رشد آزاد شده از پلاکت:
غلظت مهمترین فاکتورهای رشد پلاکتی شامل PDGF (آلمان، DRG ، Human/Mouse PDGF-AB ELISA kit)، EGF (آلمان، DRG ، Human/Mouse EGF ELISA kit)، VEGF (آلمان، DRG ، Human/Mouse VEGF ELISA kit) و TGFb (آلمان، DRG ، Human/Mouse TGFb ELISA kit) در محلول رویی PG تهیه شده از خون بند ناف و خون محیطی و هم چنین در پلاسمای فاقد پلاکت PPP در زمانهای مختلف انکوباسیون با روش الایزا و طبق دستورالعمل سازنده اندازهگیری شد(2).
تجزیه و تحلیل دادهها:
جهت آنالیز توصیفی دادهها از شاخصهای میانگین و انحراف معیار و برای آنالیز تحلیلی دادهها جهت متغیرهای کمی از تجزیه و تحلیل واریانس(ANOVA) با دادههای تکراری استفاده شد. جهت مقایسه دادهها بین بازههای زمانی مختلف از آزمون Paired t test استفاده شد. برای تمام آنالیزهای آماری از نرمافزار STATA ورژن 13 (آمریکا، TX ، College Station ، Stata Crop) استفاده و ۰۵/۰p < به عنوان سطح آماری معنادار در نظر گرفته شد.
یافتهها
اهداکننده خون بند ناف:
در این مطالعه، ۳۰ نمونه خون بند ناف جمعآوری گردید که ۱۷ نمونه از بند ناف نوزادانی به دست آمد که به روش زایمان طبیعی به دنیا آمده بودند و ۱۳ نمونه نیز از بند ناف نوزادان به روش سزارین جمعآوری گردید. متوسط سن مادران انتخاب شده در روش زایمان طبیعی 5/5 ± 6/24 سال و در روش سزارین 1/6 ± 8/25 سال بود. همچنین میانگین تعداد هفتههای بارداری در روش زایمان طبیعی 97/0 ± 4/39 هفته و در روش سزارین 38/1 ± 6/38 هفته بود. نتایج آزمایشهای غربالگری انعقادی PT و PTT مادران نیز در محدوده طبیعی تعیین مقدار شد.
در این مطالعه، متوسط حجم خون گرفته شده از بند ناف نوزادن به روش سزارین و زایمان طبیعی به ترتیب 8/29 ± 95 میلیلیتر و 2/24 ± ۸۶ میلیلیتر بود و به طور میانگین حجم PPP و PRP به دست آمده از هر دو روش به ترتیب 9/7 ± 5/34 میلیلیتر و 2/5 ± 3/10 میلیلیتر تعیین مقدار شد. همچنین میانگین تعداد پلاکتها در خون بند ناف 103 × 7/45 ± 199 در هر میکرولیتر خون تعیین مقدار شد.
اهداکننده خون محیطی:
در این مطالعه متوسط سن اهداکنندگان داوطلب 8/11 ± ۱/۳۷ سال بود. حداقل سنی ۱۹ و حداکثر سنی ۵۸ سال بود. از تعداد ۳۰ داوطلب، ۲۸ نفر مرد و تنها 2 نفر زن بودند. نتایج آزمایشهای غربالگری انعقادی افراد داوطلب در محدوده طبیعی تعیین مقدار شد. در این مطالعه، متوسط حجم خون کامل، PPP و PRP گرفته شده از اهداکنندگان به ترتیب 2/10± 8/499 میلی لیتر، ۹/۸ ±۱۸۰ میلیلیتر و ۸/۹ ± ۶/۵۱ میلیلیتر تعیین مقدار شد. میانگین تعداد پلاکتها در خون محیطی به دست آمده از اهداکنندگان 103×3/43±189 در هر میکرولیتر خون تعیین مقدار شد.
تهیه ژل پلاکتی:
در این مطالعه، PG با اضافه نمودن ترومبین و کلسیم گلوکونات به PRP به دست آمد(شکل ۱).

شکل 1: PG تهیه شده از خون بند ناف

نمودار ۱: میزان فاکتورهای رشد در محلول رویی PG حاصل از خون بند ناف و خون محیطی و PPP در زمانهای مختلف انکوباسیون. در طول زمان انکوباسیون، غلظت فاکتور PDGF(نمودار ۱ الف) و فاکتور VEGF (نمودار ۱ ب) در نمونه PG خون بند ناف و خون محیطی با طولانیتر شدن زمان انکوباسیون تا ۶ ساعت افزایش معناداری پیدا کرد(ANOVA ,۰۱/۰p< #;). میزان فاکتورهای رشد EGF (نمودار ۱ج) و TGF-β (نمودار ۱د) به تدریج در طول ۲۴ ساعت انکوباسیون افزایش معناداری داشتند(ANOVA ,۰۱/۰p< #;). همچنین غلظت فاکتورها بین نمونههای PG حاصل از خون بند ناف در مقایسه با خون محیطی و پلاسمای PPP تفاوت قابل توجه آماری داشت( paired t-test ,۰۰۱/۰p< *;).
سنجش سطح فاکتورهای رشد آزاد شده از پلاکتهای فعالشده:
سطح فاکتورهای رشد پلاکتی در PG تهیه شده از نمونههای خون بند ناف و خون محیطی و همچنین در PPP در زمانهای مختلف انکوباسیون با روش الایزا اندازهگیری شد. نتایج نشان دادند که بیشترین غلظت فاکتور رشد آزاد شده PDGF-AB و VEGF در PG تهیه شده از خون بند ناف و خون محیطی مربوط به ۶ ساعت اول پس از انکوباسیون PG بود که از نظر آماری به طور معناداری نسبت به زمانهای دیگر مورد مطالعه بیشتر بود. بعد از تحریک پلاکتی با ترومبین و کلسیم گلوکونات، میزان این فاکتورها افزایش یافته و ۶ ساعت بعد از انکوباسیون، بیشترین میزان فاکتور اندازهگیری شد(نمودار 1، الف و ب). تفاوت میزان فاکتورها در این زمان نسبت به سایر زمانها از لحاظ آماری معنادار بود(۰۱/۰p<). بعد از مدت ۶ ساعت، سطح فاکتور به آرامی و آهسته در طول انکوباسیون شروع به کاهش یافت. در بررسی بین نمونههای مختلف مورد آزمایش، قابل توجه است که در تمام زمانها، سطح فاکتور PDGF و VEGF در PG خون بند ناف بیشتر از خون محیطی و PPP اندازهگیری شد(۰۱/۰p<). این تفاوت از نظر آماری معنادار بود(۰۰۱/۰p<). همچنین سطح فاکتور PDGF و VEGF در PG خون محیطی در تمامی زمانهای مورد آزمایش بیشتر از سطح فاکتور در PPP اندازهگیری شد و این تفاوت نیـز از نظر آماری معنادار بود(۰۰۱/۰p<).
همچنین یافتههای الایزا نشان دادند که در طول دوره انکوباسیون تا ۲۴ساعت، میزان فاکتورهای رشد EGF و TGF-β به تدریج افزایش مییابد، به طوری که بیشترین غلظت TGF-β و EGF در پایان ۲۴ ساعت انکوباسیون به ترتیب به میزان ۲/۳۶ ± ۲/۱۳۲ نانوگرم در میلی لیتر و ۹/۲ ± ۴/۵ پیکوگرم در میلیلیتر در PG حاصل از خون بند ناف افزایش یافت(نمودار 1، ج و د). در مجموع میزان TGF-β و EGF در این زمان، نسبت به سایر زمانهای انکوباسیون هم در محلول رویی PG (خون بند ناف و خون محیطی) و هم در PPP به طور معناداری بیشتر بود(۰۱/۰p<). قابل توجه است که بر خلاف میزان بالای فاکتورهای PDGF ، VEGF و TGF-β، میزان فاکتور EGF در محلول رویی PG و هم در PPP پائین و در حدود پیکوگرم در میلیلیتر است. تغییر آماری معناداری در غلظت فاکتور TGF در پلاسمای PPP در طول زمان انکوباسیون وجود نداشت.
در بررسی بین نمونههای مختلف مورد آزمایش نیز، قابل توجه است که در تمام زمانهای مورد آزمایش سطح فاکتورهای رشد TGF-β و EGF اندازهگیری شده در PG خون بند ناف بیشتر از خون محیطی(به استثنای زمان صفر) و PPP اندازهگیری شد(۰۰۱/۰p<). همچنین سطح فاکتور TGF-β و EGF در PG خون محیطی در تمامی زمانهای مورد آزمایش بیشتر از سطح فاکتور در PPP اندازهگیری شد و این تفاوت از نظر آماری معنادار بود(۰۰۱/۰p<).
بحث
هدف اصلی از انجام مطالعه حاضر، تهیه و تعیین خصوصیات PG تهیه شده از خون بند ناف در مقایسه با خون محیطی با تمرکز بر ارزیابی سطح فاکتورهای رشد پلاکتی آزاد شده میباشد. یافتههای ما نشان داد که به دنبال
تهیه PG و انکوباسیون آن در طول مدت ۲۴ ساعت، سطح
فاکتورهای رشد پلاکتی به طور قابل توجهی با گذشت زمان انکوباسیون افزایش یافت. بیشترین غلظت فاکتور رشد آزاد شده PDGF و VEGF در PG تهیه شده از خون بند ناف و خون محیطی مربوط به ۶ ساعت اول پس از انکوباسیون PG بود که از نظر آماری به طور معناداری نسبت به زمانهای دیگر بیشتر بود.
در مورد فاکتورهای رشد EGF و TGF-β نیز بیشترین غلظت فاکتور رشد آزاد شده در PG تهیه شده از خون بند ناف و خون محیطی مربوط به زمان انکوباسیون ۲۴ ساعت بود که از نظر آماری به طور معناداری نسبت به زمانهای دیگر بیشتر بود. در بررسی بین نمونههای مختلف مورد آزمایش نیز، قابل توجه است که در تمام زمانهای انکوباسیون مورد آزمایش، سطح تمام فاکتورهای رشد مورد مطالعه در PG تهیه شده از خون بند ناف بیشتر از PG حاصل از خون محیطی و پلاسمای PPP اندازهگیری شد و این تفاوت از نظر آماری معنادار بود.
در این مطالعه نیز همانند مطالعه مارتینو، میزان فاکتورهای رشد TGF و PDGF در پلاسما و محلول رویی PG بالا بود. در مطالعه هاشمی و همکاران در سال ۲۰۱۲، خصوصیات آزمایشگاهی PG اتولوگ تهیه شده از خون محیطی و میزان آزادسازی فاکتورهای رشد پلاکتی به دنبال ۷۲ ساعت انکوباسیون و در ۶ نقطه زمانی(۰، ۵/۰، ۶، ۲۴، ۴۸ و ۷۲ ساعت) مورد بررسی قرار گرفت و نشان داده شد که غلظت فاکتورهای رشد PDGF و TGF-β در PG تهیه شده از خون محیطی بالا بود، در مقابل غلظت فاکتورهای EGF و FGF پایین بود. همچنین نشان داده شد که حداکثر غلظت PDGF در مدت زمان ۳۰ دقیقه و در مورد سایر فاکتورها نیز به دنبال ۲۴ ساعت انکوباسیون از پلاکتها آزاد میگردند که با یافتههای مطالعه حاضر همخوانی دارد (۲).
در مطالعه حاضر، افزایش سطح فاکتورهای رشد پلاکتی در PG تهیه شده از خون بند ناف با مطالعه پرازی و همکارانش مطابقت داشت(17). مطالعه پرازی و همکارانش با هدف ارزیابی تعدادی از فاکتورهای رشد پلاکتی در PG حاصل از خون بند ناف، نشان داد که غلظت فاکتورهای رشد پلاکتی PDGF-ββ ، VEGF ، FGF و به مقدار کمتری سطح PDGF-AB در ژل پلاکتی خون بند ناف بیشتر از پلاسمای PPP بود و پیشنهاد کردند که در مصارف بالینی نظیر مهندسی بافت که سطح بالاتری از فاکتورهای رشد پلاکتی مورد نیاز میباشد، استفاده از PG خون بند ناف میتواند سودمند باشد. از طرف دیگر آنها نشان دادند که سطح فاکتور TGF-βدر PG خون بند ناف کمتر از خون محیطی میباشد که در تناقض با نتایج این مطالعه است. TGF-β به عنوان پروتئین تنظیمی چند عملکردی است که به واسطه افزایش تولید کلاژن در القای پاسخهای ترمیمی نقش مهمی ایفا میکند(۱۷).
در مطالعه سو و همکاران، در بررسی ۸ نمونه ریلیزات پلاکتی با هدف ارزیابی فاکتورهای رشد پلاکتی به دنبال ۵ ساعت انکوباسیون، نشان داده شد که سطح اکثر فاکتورهای رشد پلاکتی به استثنای فاکتور رشد شبه انسولین(IGF)، به طور قابل ملاحظهای به دنبال تهیه PG خون محیطی افزایش پیدا میکند که با یافتههای مطالعه حاضر مطابقت دارد(19). همچنین در مطالعه دیگری از سو و همکاران اشاره شده است که تنها ۳۵% PDGF و۵۰% TGF-β پلاکتی در عرض ۱ الی ۵ ساعت از تهیه PG خون محیطی آزاد میشوند(۲۰). در مطالعه حاضر، میزان آزادسازی فاکتور EGF در ابتدای دوره انکوباسیون PG کم بود که در نهایت بعد از ۲۴ ساعت انکوباسیون به حداکثر میزان خود رسید. در مطالعههایی نشان داده شد، هنگامی که از غلظت بالاتر ترومبین برای دگرانولاسیون پلاکتی استفاده شود، آزادسازی EGFسریعاً آغاز میشود ولی هنگامی که از غلظتهای کمتر ترومبین و کلسیم استفاده شود، آزادسازی این فاکتور به تأخیر میافتد(21، 2). در این مطالعه، تأخیر در آزادسازی فاکتور EGF احتمالاً به دلیل پایین بودن میزان فعالیت ترومبین میباشد.
روشهای متعددی برای تهیه PG و آزادسازی فاکتورهای رشد پلاکتی گزارش شده است که عامل مشترک در تمام روشهای مختلف تهیه PG، استفاده از فعالکنندههای مختلف پلاکتی(گلوکونات کلسیم، ترومبین، و باتروکسوبین) و استراتژی سانتریفیوژ میباشد. افزودن ترومبین و کلسیم به پلاسمای غنی از پلاکت، سبب تحریک پلاکتها و دگرانولاسیون آنها میشود که در نهایت فاکتورهای رشد موجود در گرانولهای آلفای پلاکتی آزاد میشود(۱۶). در اکثر مطالعهها برای تهیه ژل پلاکتی، از ترومبین تجاری با میزان فعالیت بالا استفاده شده است. اما در برخی مطالعهها نشان داده شده است که استفاده از ترومبین تهیه شده از پلاسمای انسانی علیرغم فعالیت اندازهگیری شده پایینتر، فعالیت مناسبتری داشته و به طور مؤثرتری باعث آزادسازی عوامل رشد پلاکتی میگردد(۲). در مطالعه پرازی و همکارانش، جهت فعال سازی پلاکتها و تهیه PG از خون بند ناف از کلسیم گلوکونات و باتروکسوبین به عنوان فعالکننده قوی پلاکتی استفاده شده است(۱۷). فاکتورهای رشد پلاکتی با داشتن ماهیتهای میتوژنیک و کموتاکتیک میتوانند عملکردهای سلولی درگیر در چرخه ترمیم بافت و تکثیر سلولی را افزایش دهند. با توجه به ماهیتهای پلاکتی اشاره شده، در مطالعههای بالینی مختلف به گزارشهایی مبنی بر تسریع ترمیم زخم به دنبال درمان با PG و فاکتورهای رشد پلاکتی اشاره شده است(۲۴-۲۲). با توجه به نتایج مطالعه حاضر مبنی بر بالاتر بودن غلظت PDGF و VEGF در PG خون بند ناف نسبت به خون محیطی، میتوان در بسیاری از موارد بالینی نظیر زخم پای دیابتی، از PG خون بند ناف استفاده نمود. تصور بر این است که در بیماران دیابتی، کاهش تولید VEGF و رگزایی عامل اختلال در ترمیم بافت باشند. نشان داده شده است که زخمهای درمان شده با VEGF میزان بالاتری از اپیتلیزاسیون، تولید ماتریکس خارج سلولی و تکثیر سلولی بیشتر را نشان میدهند(۲۵).
در سالهای اخیر، نقش تکثیری فاکتورهای رشد حاصل از خون بند ناف، مورد بررسی قرار گرفته است و نشان داده شد که استفاده از PG خون بند ناف در مقایسه با خون محیطی میتواند متعهد شدن سلول بنیادی مزانشیمی را به طور متفاوتی تحت تأثیر قرار دهد و پیشنهاد کردند که PG خون بند ناف علاوه بر داشتن خصوصیت ویژه رگزایی، میتواند خصوصیات بسیار عالی تکثیری را به عنوان مکمل کشت سلولی نشان دهد(۲۶). در بررسی کاربردهای بالینی و ترمیمی PG ، کارآیی PG به واسطه آزادسازی فاکتورهای رشد میباشد که میتوانند از طریق اثرات پاراکرینی، میانجی ترمیم بافت باشند. در حال حاضر با توجه به استفاده از رویکردهای مختلف در تهیه PG و آزادسازی فاکتورهای رشد، قیاس کردن نتایج به دست آمده در این مطالعه با مطالعههای مشابه دیگر شاید کمی مشکل باشد. قابل توجه است که فاکتورهای رشد تحت تاثیر تعداد پلاکتها و لوکوسیتها نیز قرار دارند و باید از روشهای استاندارد تولید کنسانتره پلاکتی استفاده شود(۲۷).
نتیجهگیری
در این مطالعه به روشی آسان، ساده و در دسترس برای تهیه PG و آزادسازی فاکتورهای رشد از منبع خون بند ناف اشاره شد. با توجه به بالاتر بودن غلظت فاکتورهای
رشد پلاکتی در PG تهیه شده از خون بند ناف در مقایسه با خون محیطی، استفاده از فرآورده خون بند ناف در انواع درمانهای ترمیمی میتواند سودمند باشد.
تشکر و قدردانی
این تحقیق حاصل پایاننامه دکترای حرفهای بوده که در کمیتـه اخـلاق پزشـکی دانشگاه علوم پزشکی جهرم با کد IR.JUMS.REC.1397.031 مورد تصویب قرار گرفته است. بدینوسیله نویسندگان مقاله برخود لازم میدانند تا از همکاری معاونت محترم پژوهشی دانشگاه علوم پزشکی جهرم به دلیل تأمین مالی این پروژه و همچنین از همکاری صمیمانه اهداکنندگان خون بند ناف سپاسگزاری نمایند.
نوع مطالعه: پژوهشي |
موضوع مقاله:
انتقال خون
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






