جلد 18، شماره 2 - ( تابستان 1400 )
جلد 18 شماره 2 صفحات 78-71 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Abedini M, Motamedi Z, Soleimany Ferizhandy A, Amini Kafi-Abad S. Evaluation and analysis of quality control results of Fresh Frozen Plasma units in Iranian blood transfusion centers during 1397-1398. bloodj 2021; 18 (2) :71-78
URL: http://bloodjournal.ir/article-1-1384-fa.html
URL: http://bloodjournal.ir/article-1-1384-fa.html
عابدینی مریم، معنمدی زهرا، سلیمانی فریزهندی علی، امینی کافی آباد صدیقه. ارزیابی و تحلیل نتایج کنترل کیفی واحدهای پلاسمای تازه منجمد در مراکز انتقال خون ایران 1398-1397. فصلنامه پژوهشی خون. 1400; 18 (2) :71-78
دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 397 kb]
(1104 دریافت)
| چکیده (HTML) (2780 مشاهده)
مقدمه
پلاسمای تازه منجمد(FFP)، پلاسمایی است که تحت فرآیند انجماد به دمایی که فعالیت پروتئینهای ناپایدار آن حفظ شود رسیده است. پلاسما باید در 6 تا 8 ساعت اول پس از اهدا، از خون کامل جداسازی و منجمد گردد. این محصول از فرآوری واحد خون کامل و یا به روش فرزیس تهیه میشود(1). FFP جهت تصحیح فاکتورهای انعقادی در ناهنجاریهای انعقادی که کمبود فاکتور آن هنوز مشخص نشده باشد یا مرتبط با چند فاکتور باشد و یا در صورتی که فاکتور اختصاصی آن در دسترس نباشد، کاربرد دارد(2). این محصول در صنعت پلاسما جهت تهیه داروهای مشتق از پلاسما مانند انواع فاکتورهای انعقادی، ایمونوگلوبولین و آلبومین استفاده میشود. کیفیت محصول نهایی بستگی به کیفیت فرآیند جمعآوری خون کامل، تولید، حمل و ذخیرهسازی دارد.
یک درصد فرآورده FFP تولید شده در ماه، از نظر پارامترهای کیفی حجم، تعداد گلبول سفید، تعداد گلبول قرمز، تعداد پلاکت و میزان پروتئین بررسی میشود. واحدهای مذکور به صورت تصادفی انتخاب میگردند(3). پارامتر پروتئین نیز طبق فارماکوپه انگلستان و آمریکا و اروپا بررسی میشود(4). طبق استاندارد اروپا، بررسی میزان فاکتور VIII هر سه ماه یک بار انجام میشود، تعداد 10 کیسه FFP به صورت تصادفی در روزهای مختلف اولین ماه خونگیری انتخاب و در پایان ماه سوم نگهداری مورد سنجش فعالیت FVIII قرار میگیرد(5). سایر پارامترها قبل از انجماد پلاسما ارزیابی میشوند. پارامتر میزان فعالیت FVIII مهمترین پارامتر در ارزیابی کیفی فرآورده FFP است. عوامل مختلفی در کیفیت آن دخیل میباشند. کنترل زنجیره سرد در طی مراحل تولید اهمیت ویژه دارد. مدت زمان خونگیری، دمای نگهداری خون قبل از فرآوری، فاصله زمان خونگیری تا جداسازی پلاسما، فاصله زمان بین خونگیری تا انجماد و فاصله زمان جداسازی پلاسما تا فرآیند انجماد، مدت زمان فرآیند انجماد و معتبر بودن تجهیز مورد استفاده جهت انجماد پلاسما اهمیت دارد(9-6). عوامل دیگری مانند استریلیتی صحیح بازو در زمان خونگیری، نحوه ورود سوزن در هنگام جمعآوری خون و میزان آسیب بافتی، عدم حرکت سوزن حین خونگیری و مخلوط شدن یکنواخت خون با ماده ضد انعقاد موجود در کیسه در حین خونگیری، در میزان و حفظ FVIII فرآورده FFP تاثیر دارند(10). عواملی مانند نوع گروه خون اهداکننده و نوع ماده ضد انعقاد نیز ممکن است در کیفیت FVIII محصول FFP مؤثر باشد(11). پارامترهای شمارش سلولی به دلیل آن که میتوانند منجر به ایجاد واکنش در گیرنده و ایجاد آلوآنتیبادیها شوند و در فرآیند تولید داروهای مشتق از پلاسما نیز مؤثر هستند، اهمیت دارند(12). گلبول سفید ممکن است منجر به انتقال ویروسهای داخل سلولی مثل سایتومگالو ویروس گردد(13). در طول نگهداریFFP، گلبولهای سفید با ترشح آنزیمهای پروتئولیز میتوانند منجر به کاهش عملکرد FVIII شوند(15، 14).گلبول قرمز ممکن است باعث انتقال باکتریهایی همچون یرسینیا به گیرنده شود(16). تعداد سلولها در FFP تحت تاثیر عوامل مختلفی از جمله سانتریفیوژ صحیح، معتبر بودن سانتریفیوژ جهت انجام فرآیند، روش جداسازی پلاسما از بخش سلولی خون، کالیبره بودن اکستراکتورهای خودکار میباشد مهارت کارشناس تولید فرآوردههای خون در استفاده از اکستراکتورهای دستی، در تعداد سلولهای فرآورده FFP نقش به سزایی دارد. علاوه بر این، تعداد گلبول سفید در FFP تهیه شده از کیسههای فیلتردار میتواند تحت تاثیر عواملی مانند دمای خون قبل از فیلتراسیون، نوع فیلتر مورد استفاده در فیلتراسیون خون کامل و فرآیند صحیح فیلتراسیون باشد(18، 17). حجم واحدهای FFP بسته به حجم خون کامل دریافتی، میزان Hb اهداکننده و این که در مراحل تولید، فرآورده پلاکت کنسانتره نیز استحصال شود، متفاوت میباشد(19).
هدف از این مطالعه، بررسی کیفیت و درصد انطباق هر یک از پارامترهای کیفی فرآورده FFP با استانداردهای تدوین شده در سازمان انتقال خون ایران در طول سالهای 1397 و 1398 بود.
مواد و روشها
ایـن مطالعـه توصیفی- مقطعی بود. در طـول سالهـای
1398-1397، تعداد 3669556 واحد FFP تولید و یک درصد تولیدات ارزیابی کیفی شدند. پارامتر حجم با روش ترازوی وزنی و اندازهگیری FVIII به روش لخته با استفاده از کیت استاگو(Stago) کمپانی دیاگنوستیکا ساخت کشور فرانسه، بررسی تعداد گلبول سفید، تعداد گلبول قرمز و تعداد پلاکت با روش شمارش سلولی به وسیله لام نجت و بررسی میزان پروتئین با استفاده از کیتهای مورد تائید اداره کل تجهیزات و ملزومات پزشکی انجام شد. گزارشهای کنترل کیفی فرآورده FFP در مراکز انتقال خون در فرمهای مصوب ثبت میشود، در این فرمها نام پایگاه، شماره واحد اهدایی، تاریخ خونگیری، تاریخ انقضای فرآورده، تاریخ انجام کنترل کیفی، تعداد تولید فرآورده FFP و تعداد محصول کنترل کیفی شده ثبت شده، اطلاعات کد تجهیزات مورد استفاده در فرآیند کنترل کیفی فرآورده و نتایج کنترل کیفی پارامترهای حجم، FVIII ، تعداد گلبول سفید، تعداد گلبول قرمز، تعداد پلاکت و میزان پروتئین ذکر میشود. نتایج به دست آمده با نتایج مرجع مقایسه میگردد.
طبق مراجع معتبر بینالمللی و استانداردهای ملی انتقال خون ایران و دستورالعملهای سازمان انتقال خون ایران، استاندارد پارامترهای کنترل کیفی فرآورده FFP مطابق جدول میباشد(جدول 1)(20، 1).
نتایج کنترل کیفی فرآورده FFP به صورت ماهانه در واحد کنترل کیفی مراکز استانها آنالیز شده، با نتایج ماه قبل بررسی و تعداد موارد نامنطبق و درصد موارد منطبق بر روی منحنیها رسم میشود. در صورتی که تعداد موارد نامنطبق بیش از مقادیر تعریف شده در دستورالعملهای تدوین شده باشد و یا نسبت به ماه قبل افزایش داشته باشد، علل ریشهای بررسی و اقدام اصلاحی مناسب صورت گرفته و در ماههای آینده اثر بخشی اقدامات صورت گرفته کنترل میگردد.
آنالیزهای آماری:
گزارشهای کنترل کیفی فرآورده FFP پایگاههای سراسر کشور در نرمافزار 2019 Microsoft Excel جمعآوری گردید. تمام نتایج با مقادیر استاندارد تدوین شده در سازمان انتقال خون ایران مقایسه شد. تعداد واحدهای خارج از محدوده مجاز هریک از پارامترهای کیفی فرآورده FFP در سالهای 1397 و 1398 بررسی شد و درصد انطباق هر پارامتر کیفی محاسبه گردید. سپس، نتایج کمی پارامترهای حجم، FVIII ، تعداد گلبول سفید، تعداد گلبول قرمز، تعداد پلاکت و میزان پروتئین به صورت mean ± 1SD در سال 1397و 1398 محاسبه گردید. با استفاده از نرمافزار Med Calc Statistical Software Version 19.2.6 ، نسبت انطباق هر یک از پارامترها به تعداد کل پارامتر ارزیابی شده در سالهای 1397 و 1398 با استفاده از روش آماری chi squared بررسی شد. همچنین، میانگین و انحراف استاندارد هر پـارامتر در سـال 1397 در مقایسـه با سال 1398 با روش t-test بررسی شد. 05/0 p≤ معنادار در نظر گرفته شد.
یافتهها
در ارزیابی به عمل آمده مشخص گردید، در سال 1397 تعداد 1874376 واحد FFP تولید، 3479 واحد برای FVIII و 18744 واحد از جهت سایر پارامترهای کیفی ارزیابی شدهاند.
در سال 1398 تعداد 1795180 واحد FFP تولید، 3464 واحد از نظر پارامتر کیفی FVIII و 18282 واحد از نظر سایر پارامترها مطابق با دستورالعملهای مصوب در سازمان انتقال خون ایران ارزیابی شدهاند. میزان استاندارد پارامترهای کیفی فرآورده FFP و تعداد و درصد انطباق هر یک از پارامترهای کیفی فرآورده FFP در جدول آمده است(جداول 1 و 2).
درصد انطباق هر یک از پارامترهای کیفی فرآورده FFP، در سال 1398 نسبت به سال 1397 افزایش یافته است، همچنین با توجه بهp value ، اختلاف درصد انطباق پارامترهای FVIII ، تعداد گلبول قرمز و میزان پروتئین بین سال 1397 و 1398 معنادار میباشد(05/0 p≤).
میانگین ± انحراف معیار پارامترهای کیفی ارزیابی شده فرآورده FFP در سازمان انتقال خون ایران در سالهای 1398- 1397 بررسی شد(جدول 3).
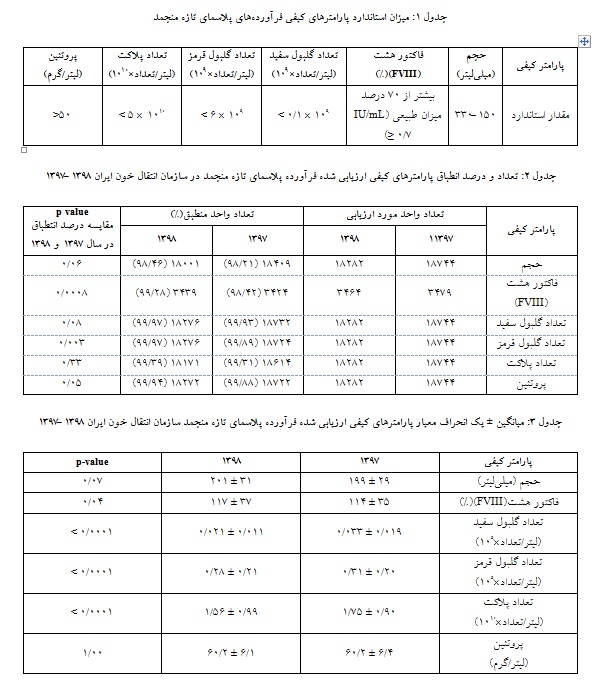
میانگین نتایج کمی هر یک از پارامترهای کیفی ارزیابی شده، در محدوده استانداردهای تدوین شده در سازمان انتقال خون بوده است. مقایسه نتایج پارامترهای حجم و میزان پروتئین در سال 1398 با 1397 تغییر محسوسی نداشته و این اختلاف معنادار نبوده است. در حالی که، میانگین درصد فعالیت FVIII در سال 1398 افزایش معنادار
نسبت به سال 1397 داشتـه اسـت (05/0 p≤).
تعـداد گلبـول سفیـد، گلبول قرمز و پلاکت در فرآورده
FFP درسال 1398 نسبت به سال1397 کاهش داشته و بهبود یافته است و این اختلاف معنادار بوده است(05/0 p≤). در بررسی اقدامات اصلاحی صورت گرفته از سوی مراکز، مشخص گردید بیشترین علل ریشهای مطرح شده درخصوص عدم انطباق FVIII مربوط به عدم کنترل زنجیره سرما در فرآیند تولید بوده است.
بحث
نتایج به دست آمده در این مطالعه نشان میدهد که پارامترهای کیفی فرآورده FFP شامل فعالیت FVIII ، حجم، تعداد گلبول قرمز، تعداد گلبول سفید، تعداد پلاکت و مقدار پروتئین در طول سالهای 1398-1397 با توجه به دستورالعملهای مدون در سازمان انتقال خون، مطلوب بوده است. درسال 1398 میزان درصد انطباق در تمام پارامترهای کیفی نسبت به سال 1397 افزایش داشته، افزایش درصد انطباق در پارامترهای FVIII، تعداد گلبول قرمز و میزان پروتئین معنادار بوده است(05/0 p≤). افزایش درصد انطباق پارامترهای کیفی فرآورده FFP، نشانگر آن است که اقدامات اصلاحی صورت گرفته از سوی مراکز تولید در خصوص ارزیابی کیفی فرآورده FFP اثربخش بوده است.
مهمترین پارامتری که در ارزیابی کیفیت فرآورده FFP مورد بررسی قرار میگیرد، میزان فعالیت FVIII میباشد. مقدار استاندارد این پارامتر مطابق راهنمای تهیه، استفاده و تضمین کیفیت فرآوردههای خون کمیته اروپا و استانداردهای ملی انتقال خون ایران و دستورالعملهای مصوب در سازمان انتقال خون ایران، بیش از70% طبیعی است(20، 1). همانطور که در نتایج جدول3 مشاهده میگردد، در محصولات ارزیابی شده در طول سالهای 1398-1397، میانگین میزان فعالیت FVIII بسیار بیشتر از حداقل استاندارد تعریف شده بوده است. همچنین میانگین درصد فعالیت FVIII افزایش معناداری در سال 1398 نسبت به سال 1397داشته است. در طول سال 1398، میزان فعالیت FVIII در72/0% واحدهای ارزیابی شده (25 واحد FFP) کمتر از70% طبیعی بوده است. تمام واحدهایی که میزان فعالیت FVIII در آنها، کمتر از 70% طبیعی بوده، در محدوده 70%-60% طبیعی بودهاند. با توجه به اهمیت حفظ فعالیت FVIII در فرآورده FFP ، کنترل و بهینهسازی کلیه مراحل تولید، نگهداری و ذخیرهسازی اهمیت ویژهای دارد. بیشترین علل ریشهای مربوط به عدم انطباق در نتایج ارزیابی پارامتر FVIII ، عدم کنترل زنجیره سرما بود. رعایت زنجیره سرما در زمان حمل، تولید و ذخیرهسازی اهمیت ویژهای دارد. در این خصوص تجهیزات و اقدامات اصلاحی مؤثری در قالب فرآیندهای آموزشی، معتبرسازی و بازنگری دستورالعملها مطابق آخرین مراجع علمی صورت گرفته است. در خصوص اسناد معتبرسازی علاوه بر این که حمل و نقل باید مطابق سند معتبرسازی انجام شود، پایش دما در حین حمل با استفاده از دیتا لاگر کالیبره اهمیت دارد. لاگ بوک تجهیزات از جمله هموشیکرها، اکستراکتورها و سانتریفیوژها باید تحت کنترل باشد و عملکرد صحیح آنها تضمین شده باشد.
میانگین پارامترهای تعداد گلبول قرمز، تعداد گلبول سفید و تعداد پلاکت در فرآورده FFP تولید شده در سال 1398 نسبت به سال 1397 کاهشی معنادار داشته است که نشاندهنده بهبود روند تولید فرآورده FFP در زمان جداسازی پلاسما میباشد.
در مطالعهای که توسط سلطان و همکارانش صورت گرفته است، سطح FVIII در 100 واحد فرآورده FFP بررسی و میزان FVIII بر اساس بررسی لخته با استفاده ازSysmex® CA-1500-automated coagulation analyzer معادل 01/15% ± 24/84% بوده و 95% منطبق با استانداردها و 5% عدم انطباق مشاهده شده است. درصد عدم انطباق پارامتر FVIII در این مطالعه در سال 1397 58/1% بود که در سال 1398 به 72/0% رسیده و روند بهبود مناسبی را نشان میدهد(21).
در مطالعهای که، توسط آمش و همکارانش انجام شده است، سطحFVIII در تقریباً 97% موارد بالای70% میزان طبیعی بوده همچنین حجم فرآورده FFP برابر 17 ± 211 میلیلیتر بوده است(22). با توجه به تعداد نمونه بررسی شده و مراکز تولید متعدد در این مطالعه، میزان انحراف از استاندارد پارامتر حجم در این مطالعه بیشتر میباشد ولی حد بالای پارامتر حجم در هر دو مطالعه یکسان و معادل 228 میلیلیتر بوده است. در مطالعهای که، توسط بالا و همکارانش بر روی 3476 واحد FFP انجام شده است، سطح FVIII ، در 5/97% واحدها منطبق با استاندارد بوده و میزان آن IU/mL 086/0 ± 8/0 میباشد و همچنین میانگین حجم FFP معادل 58/9 ± 217 میلیلیتر بوده است(23). با توجه به تعدد مراکز تولید، میزان انحراف از استاندارد پارامتر حجم در این مطالعه در مقایسه با مطالعه بالا بیشتر بوده است. در مطالعه دوگرا و همکارانش در بررسی 100 واحد FFP ، میزان FVIII با روش Sysmex CA-50 coagulometer معادل 01/29 ± 205/117 بوده است(24). میزان FVIII در این مطالعه تقریباً با مطالعه صورت گرفته توسط دوگرا برابر میباشد و اختلاف معناداری ندارد. در مطالعه گرجیسویک و همکارانش، میزان حجم فرآورده FFP برابر 234-178 میلیلیتر و در 90% واحدها، میزان پروتئین در حد قابل قبول بوده است(25). میزان حجم در این مطالعه تقریباً با مطالعه صورت گرفته توسط گرجیسویک برابر است و درصد واحدهای منطبق با استاندارد پارامتر پروتئین در این مطالعه بالاتر میباشد. در مطالعه نوال و همکارانش، میزان فعالیت FVIII در90% واحدهای بررسی شده بیش از 50% بوده است(26). در این مطالعه در تمام واحدهایی که میزان فعالیت FVIII کمتر از 70% طبیعی بوده، این مقدار در محدوده70%-60% طبیعی بوده است و فعالیت FVIII کمتر از60% نبوده است. در مطالعه جیولیانو و همکارانش، در بررسی 1485 واحد FFP، میانگین میزان فعالیت FVIII، 99% بوده است و در 1/83% واحدهای ارزیابی شده، میزان فعالیت FVIII بیش از70% بوده است(27). در این مطالعه میانگین فعالیت FVIII بیشتر بوده و در 28/99% واحدهای FFP بررسی شده، میزان FVIII بالاتر از 70% بوده است.
در مطالعهای که توسط سواپنیل و همکارانش صورت گرفته است، در طی سالهای 2014-2013 ، 47/16% واحدهـای FFP دارای عـدم انطباق در یکی از پارامترهای کیفی فرآورده FFP بوده است، میزان درصد عدم انطباق در
پارامترهای کیفی فرآورده FFP در این مطالعه کمتر بوده است. در مطالعه سواپنیل، 43% علت عدم انطباق فرآورده FFP مربوط به پارامتر حجم، 33% مربوط به سطح فیبرینوژن و24% مربوط به میزان فعالیت FVIII بوده است(28). در این مطالعه نیز بیشترین درصد عدم انطباق فرآورده FFP به دلیل عدم انطباق در پارامتر حجم و سپس FVIII بوده است.
نتیجهگیری
این مطالعه نشان داد که بیش از% 99 واحدهای FFP مورد ارزیابی در طول سالهای 1398-1397 با نتایج تعیین شده در مراجع معتبر علمی و دستورالعملهای سازمان انتقال خون ایران مطابق بوده است. افزایش درصد انطباق تمام پارامترهای کیفی فرآورده FFP همچنین، افزایش میانگین درصد فعالیت FVIII و کاهش میانگین تعداد گلبول سفید، گلبول قرمز و پلاکت در محصول نهایی FFP، نشاندهنده ارتقای فرآیند تولید میباشد و اقدامات صورت گرفته جهت بهبود حفظ زنجیره سرما، در افزایش کیفیت FVIII اثربخش بوده است.
استقرار سیستم مدیریت کیفیت و بررسی علل ریشهای عدم انطباقها، اقدامات اصلاحی و پیگیری اثر بخشی اقدامات انجام شده، پایش مستمر نتایج کنترل کیفی محصولات و بررسی تغییرات کیفی محصولات تولید شده و ارزیابی خطر هر یک از تغییرات قبل از بهرهبرداری، منجر به بهبود و اطمینان از ثبات کیفیت محصول میگردد.
تشکر و قدردانی
این مقاله منتج از نتایج کنترل کیفی فرآوردهها در واحد کنترل کیفی ادارات کل سازمان انتقال خون ایران میباشد. بدین وسیله از خانم دکتر فائزه قاسمی عضو هیئت علمی مؤسسه طب انتقال خون، کلیه همکاران در واحد کنترل کیفی ادارات کل انتقال خون و آقای صدری مهر تشکر به عمل میآید.
متن کامل: (2568 مشاهده)
ارزیابی و تحلیل نتایج کنترل کیفی واحدهای پلاسمای تازه منجمد در مراکز
انتقال خون ایران 1398-1397
مریم عابدینی1، زهرا معتمدی1، علی سلیمانی فریزهندی2، صدیقه امینی کافیآباد3
چکیده
سابقه و هدف
پلاسمای تازه منجمد، پلاسمایی است که تحت فرآیند انجماد به دمایی که فعالیت پروتئینهای ناپایدار آن حفظ شود رسیده است. هدف از مطالعه، بررسی کیفیت فرآورده FFP در طول سالهای 1397 و 1398 بوده است.
مواد و روشها
در یک مطالعه توصیفی ـ مقطعی، نتایج کنترل کیفی پارامترهای FFP ادارات کل انتقال خون در EXCEL 2019 جمعآوری شد. با استفاده از MedCalc Statistical Software Version 19.2.6 و روش آماری کایدو، انطباق پارامترهای کیفی به تعداد کل واحدهای مورد ارزیابی بررسی شد. با روش t-test ، مقدارmean ±1 SD پارامترهای حجم،FVIII ، تعداد گلبول سفید، گلبول قرمز، پلاکت و پروتئین در سال 1397 و 1398 مقایسه شد.
یافتهها
در سال 1397 ، تعداد 18744 و در سال 1398 تعداد18282 واحد FFP از نظر کیفی ارزیابی شدهاند. درصد انطباق پارامترهای کیفی FFP ، در سال 1398 نسبت به 1397 افزایش یافته و برای پارامترهایFVIII ، تعداد گلبول قرمز و پروتئین معنادار است(05/0 p≤). میانگین میزان FVIII ، افزایش معنادار و تعداد گلبول قرمز، گلبول سفید و پلاکت فرآورده FFP در سال 1398 نسبت به سال 1397 کاهشی معنادار داشت(05/0 p≤).
نتیجه گیری
این مطالعه نشان داد که بیش از 99% واحدهای FFP ارزیابی شده در طول سالهای 1398-1397 منطبق با استانداردهای سازمان انتقال خون ایران بوده است. افزایش درصد انطباق پارامترهای کیفی در سال 1398، افزایش میانگین فعالیت FVIII و کاهش معنادار تعداد گلبول قرمز، گلبول سفید و پلاکت فرآورده FFP در سال 1398 به 1397 بیانگر ارتقای فرآیند تولید است.
کلمات کلیدی: پلاسمای تازه منجمد، گلبول سفید، گلبول قرمز
تاریخ دریافت: 05 /12/99
تاریخ پذیرش: 14/ 01/1400
1- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- مؤلف مسئول: متخصص آسیبشناسی تشریحی و بالینی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
انتقال خون ایران 1398-1397
مریم عابدینی1، زهرا معتمدی1، علی سلیمانی فریزهندی2، صدیقه امینی کافیآباد3
چکیده
سابقه و هدف
پلاسمای تازه منجمد، پلاسمایی است که تحت فرآیند انجماد به دمایی که فعالیت پروتئینهای ناپایدار آن حفظ شود رسیده است. هدف از مطالعه، بررسی کیفیت فرآورده FFP در طول سالهای 1397 و 1398 بوده است.
مواد و روشها
در یک مطالعه توصیفی ـ مقطعی، نتایج کنترل کیفی پارامترهای FFP ادارات کل انتقال خون در EXCEL 2019 جمعآوری شد. با استفاده از MedCalc Statistical Software Version 19.2.6 و روش آماری کایدو، انطباق پارامترهای کیفی به تعداد کل واحدهای مورد ارزیابی بررسی شد. با روش t-test ، مقدارmean ±1 SD پارامترهای حجم،FVIII ، تعداد گلبول سفید، گلبول قرمز، پلاکت و پروتئین در سال 1397 و 1398 مقایسه شد.
یافتهها
در سال 1397 ، تعداد 18744 و در سال 1398 تعداد18282 واحد FFP از نظر کیفی ارزیابی شدهاند. درصد انطباق پارامترهای کیفی FFP ، در سال 1398 نسبت به 1397 افزایش یافته و برای پارامترهایFVIII ، تعداد گلبول قرمز و پروتئین معنادار است(05/0 p≤). میانگین میزان FVIII ، افزایش معنادار و تعداد گلبول قرمز، گلبول سفید و پلاکت فرآورده FFP در سال 1398 نسبت به سال 1397 کاهشی معنادار داشت(05/0 p≤).
نتیجه گیری
این مطالعه نشان داد که بیش از 99% واحدهای FFP ارزیابی شده در طول سالهای 1398-1397 منطبق با استانداردهای سازمان انتقال خون ایران بوده است. افزایش درصد انطباق پارامترهای کیفی در سال 1398، افزایش میانگین فعالیت FVIII و کاهش معنادار تعداد گلبول قرمز، گلبول سفید و پلاکت فرآورده FFP در سال 1398 به 1397 بیانگر ارتقای فرآیند تولید است.
کلمات کلیدی: پلاسمای تازه منجمد، گلبول سفید، گلبول قرمز
تاریخ دریافت: 05 /12/99
تاریخ پذیرش: 14/ 01/1400
1- کارشناس علوم آزمایشگاهی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- کارشناس ارشد هماتولوژی ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
3- مؤلف مسئول: متخصص آسیبشناسی تشریحی و بالینی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
مقدمه
پلاسمای تازه منجمد(FFP)، پلاسمایی است که تحت فرآیند انجماد به دمایی که فعالیت پروتئینهای ناپایدار آن حفظ شود رسیده است. پلاسما باید در 6 تا 8 ساعت اول پس از اهدا، از خون کامل جداسازی و منجمد گردد. این محصول از فرآوری واحد خون کامل و یا به روش فرزیس تهیه میشود(1). FFP جهت تصحیح فاکتورهای انعقادی در ناهنجاریهای انعقادی که کمبود فاکتور آن هنوز مشخص نشده باشد یا مرتبط با چند فاکتور باشد و یا در صورتی که فاکتور اختصاصی آن در دسترس نباشد، کاربرد دارد(2). این محصول در صنعت پلاسما جهت تهیه داروهای مشتق از پلاسما مانند انواع فاکتورهای انعقادی، ایمونوگلوبولین و آلبومین استفاده میشود. کیفیت محصول نهایی بستگی به کیفیت فرآیند جمعآوری خون کامل، تولید، حمل و ذخیرهسازی دارد.
یک درصد فرآورده FFP تولید شده در ماه، از نظر پارامترهای کیفی حجم، تعداد گلبول سفید، تعداد گلبول قرمز، تعداد پلاکت و میزان پروتئین بررسی میشود. واحدهای مذکور به صورت تصادفی انتخاب میگردند(3). پارامتر پروتئین نیز طبق فارماکوپه انگلستان و آمریکا و اروپا بررسی میشود(4). طبق استاندارد اروپا، بررسی میزان فاکتور VIII هر سه ماه یک بار انجام میشود، تعداد 10 کیسه FFP به صورت تصادفی در روزهای مختلف اولین ماه خونگیری انتخاب و در پایان ماه سوم نگهداری مورد سنجش فعالیت FVIII قرار میگیرد(5). سایر پارامترها قبل از انجماد پلاسما ارزیابی میشوند. پارامتر میزان فعالیت FVIII مهمترین پارامتر در ارزیابی کیفی فرآورده FFP است. عوامل مختلفی در کیفیت آن دخیل میباشند. کنترل زنجیره سرد در طی مراحل تولید اهمیت ویژه دارد. مدت زمان خونگیری، دمای نگهداری خون قبل از فرآوری، فاصله زمان خونگیری تا جداسازی پلاسما، فاصله زمان بین خونگیری تا انجماد و فاصله زمان جداسازی پلاسما تا فرآیند انجماد، مدت زمان فرآیند انجماد و معتبر بودن تجهیز مورد استفاده جهت انجماد پلاسما اهمیت دارد(9-6). عوامل دیگری مانند استریلیتی صحیح بازو در زمان خونگیری، نحوه ورود سوزن در هنگام جمعآوری خون و میزان آسیب بافتی، عدم حرکت سوزن حین خونگیری و مخلوط شدن یکنواخت خون با ماده ضد انعقاد موجود در کیسه در حین خونگیری، در میزان و حفظ FVIII فرآورده FFP تاثیر دارند(10). عواملی مانند نوع گروه خون اهداکننده و نوع ماده ضد انعقاد نیز ممکن است در کیفیت FVIII محصول FFP مؤثر باشد(11). پارامترهای شمارش سلولی به دلیل آن که میتوانند منجر به ایجاد واکنش در گیرنده و ایجاد آلوآنتیبادیها شوند و در فرآیند تولید داروهای مشتق از پلاسما نیز مؤثر هستند، اهمیت دارند(12). گلبول سفید ممکن است منجر به انتقال ویروسهای داخل سلولی مثل سایتومگالو ویروس گردد(13). در طول نگهداریFFP، گلبولهای سفید با ترشح آنزیمهای پروتئولیز میتوانند منجر به کاهش عملکرد FVIII شوند(15، 14).گلبول قرمز ممکن است باعث انتقال باکتریهایی همچون یرسینیا به گیرنده شود(16). تعداد سلولها در FFP تحت تاثیر عوامل مختلفی از جمله سانتریفیوژ صحیح، معتبر بودن سانتریفیوژ جهت انجام فرآیند، روش جداسازی پلاسما از بخش سلولی خون، کالیبره بودن اکستراکتورهای خودکار میباشد مهارت کارشناس تولید فرآوردههای خون در استفاده از اکستراکتورهای دستی، در تعداد سلولهای فرآورده FFP نقش به سزایی دارد. علاوه بر این، تعداد گلبول سفید در FFP تهیه شده از کیسههای فیلتردار میتواند تحت تاثیر عواملی مانند دمای خون قبل از فیلتراسیون، نوع فیلتر مورد استفاده در فیلتراسیون خون کامل و فرآیند صحیح فیلتراسیون باشد(18، 17). حجم واحدهای FFP بسته به حجم خون کامل دریافتی، میزان Hb اهداکننده و این که در مراحل تولید، فرآورده پلاکت کنسانتره نیز استحصال شود، متفاوت میباشد(19).
هدف از این مطالعه، بررسی کیفیت و درصد انطباق هر یک از پارامترهای کیفی فرآورده FFP با استانداردهای تدوین شده در سازمان انتقال خون ایران در طول سالهای 1397 و 1398 بود.
مواد و روشها
ایـن مطالعـه توصیفی- مقطعی بود. در طـول سالهـای
1398-1397، تعداد 3669556 واحد FFP تولید و یک درصد تولیدات ارزیابی کیفی شدند. پارامتر حجم با روش ترازوی وزنی و اندازهگیری FVIII به روش لخته با استفاده از کیت استاگو(Stago) کمپانی دیاگنوستیکا ساخت کشور فرانسه، بررسی تعداد گلبول سفید، تعداد گلبول قرمز و تعداد پلاکت با روش شمارش سلولی به وسیله لام نجت و بررسی میزان پروتئین با استفاده از کیتهای مورد تائید اداره کل تجهیزات و ملزومات پزشکی انجام شد. گزارشهای کنترل کیفی فرآورده FFP در مراکز انتقال خون در فرمهای مصوب ثبت میشود، در این فرمها نام پایگاه، شماره واحد اهدایی، تاریخ خونگیری، تاریخ انقضای فرآورده، تاریخ انجام کنترل کیفی، تعداد تولید فرآورده FFP و تعداد محصول کنترل کیفی شده ثبت شده، اطلاعات کد تجهیزات مورد استفاده در فرآیند کنترل کیفی فرآورده و نتایج کنترل کیفی پارامترهای حجم، FVIII ، تعداد گلبول سفید، تعداد گلبول قرمز، تعداد پلاکت و میزان پروتئین ذکر میشود. نتایج به دست آمده با نتایج مرجع مقایسه میگردد.
طبق مراجع معتبر بینالمللی و استانداردهای ملی انتقال خون ایران و دستورالعملهای سازمان انتقال خون ایران، استاندارد پارامترهای کنترل کیفی فرآورده FFP مطابق جدول میباشد(جدول 1)(20، 1).
نتایج کنترل کیفی فرآورده FFP به صورت ماهانه در واحد کنترل کیفی مراکز استانها آنالیز شده، با نتایج ماه قبل بررسی و تعداد موارد نامنطبق و درصد موارد منطبق بر روی منحنیها رسم میشود. در صورتی که تعداد موارد نامنطبق بیش از مقادیر تعریف شده در دستورالعملهای تدوین شده باشد و یا نسبت به ماه قبل افزایش داشته باشد، علل ریشهای بررسی و اقدام اصلاحی مناسب صورت گرفته و در ماههای آینده اثر بخشی اقدامات صورت گرفته کنترل میگردد.
آنالیزهای آماری:
گزارشهای کنترل کیفی فرآورده FFP پایگاههای سراسر کشور در نرمافزار 2019 Microsoft Excel جمعآوری گردید. تمام نتایج با مقادیر استاندارد تدوین شده در سازمان انتقال خون ایران مقایسه شد. تعداد واحدهای خارج از محدوده مجاز هریک از پارامترهای کیفی فرآورده FFP در سالهای 1397 و 1398 بررسی شد و درصد انطباق هر پارامتر کیفی محاسبه گردید. سپس، نتایج کمی پارامترهای حجم، FVIII ، تعداد گلبول سفید، تعداد گلبول قرمز، تعداد پلاکت و میزان پروتئین به صورت mean ± 1SD در سال 1397و 1398 محاسبه گردید. با استفاده از نرمافزار Med Calc Statistical Software Version 19.2.6 ، نسبت انطباق هر یک از پارامترها به تعداد کل پارامتر ارزیابی شده در سالهای 1397 و 1398 با استفاده از روش آماری chi squared بررسی شد. همچنین، میانگین و انحراف استاندارد هر پـارامتر در سـال 1397 در مقایسـه با سال 1398 با روش t-test بررسی شد. 05/0 p≤ معنادار در نظر گرفته شد.
یافتهها
در ارزیابی به عمل آمده مشخص گردید، در سال 1397 تعداد 1874376 واحد FFP تولید، 3479 واحد برای FVIII و 18744 واحد از جهت سایر پارامترهای کیفی ارزیابی شدهاند.
در سال 1398 تعداد 1795180 واحد FFP تولید، 3464 واحد از نظر پارامتر کیفی FVIII و 18282 واحد از نظر سایر پارامترها مطابق با دستورالعملهای مصوب در سازمان انتقال خون ایران ارزیابی شدهاند. میزان استاندارد پارامترهای کیفی فرآورده FFP و تعداد و درصد انطباق هر یک از پارامترهای کیفی فرآورده FFP در جدول آمده است(جداول 1 و 2).
درصد انطباق هر یک از پارامترهای کیفی فرآورده FFP، در سال 1398 نسبت به سال 1397 افزایش یافته است، همچنین با توجه بهp value ، اختلاف درصد انطباق پارامترهای FVIII ، تعداد گلبول قرمز و میزان پروتئین بین سال 1397 و 1398 معنادار میباشد(05/0 p≤).
میانگین ± انحراف معیار پارامترهای کیفی ارزیابی شده فرآورده FFP در سازمان انتقال خون ایران در سالهای 1398- 1397 بررسی شد(جدول 3).

میانگین نتایج کمی هر یک از پارامترهای کیفی ارزیابی شده، در محدوده استانداردهای تدوین شده در سازمان انتقال خون بوده است. مقایسه نتایج پارامترهای حجم و میزان پروتئین در سال 1398 با 1397 تغییر محسوسی نداشته و این اختلاف معنادار نبوده است. در حالی که، میانگین درصد فعالیت FVIII در سال 1398 افزایش معنادار
نسبت به سال 1397 داشتـه اسـت (05/0 p≤).
تعـداد گلبـول سفیـد، گلبول قرمز و پلاکت در فرآورده
FFP درسال 1398 نسبت به سال1397 کاهش داشته و بهبود یافته است و این اختلاف معنادار بوده است(05/0 p≤). در بررسی اقدامات اصلاحی صورت گرفته از سوی مراکز، مشخص گردید بیشترین علل ریشهای مطرح شده درخصوص عدم انطباق FVIII مربوط به عدم کنترل زنجیره سرما در فرآیند تولید بوده است.
بحث
نتایج به دست آمده در این مطالعه نشان میدهد که پارامترهای کیفی فرآورده FFP شامل فعالیت FVIII ، حجم، تعداد گلبول قرمز، تعداد گلبول سفید، تعداد پلاکت و مقدار پروتئین در طول سالهای 1398-1397 با توجه به دستورالعملهای مدون در سازمان انتقال خون، مطلوب بوده است. درسال 1398 میزان درصد انطباق در تمام پارامترهای کیفی نسبت به سال 1397 افزایش داشته، افزایش درصد انطباق در پارامترهای FVIII، تعداد گلبول قرمز و میزان پروتئین معنادار بوده است(05/0 p≤). افزایش درصد انطباق پارامترهای کیفی فرآورده FFP، نشانگر آن است که اقدامات اصلاحی صورت گرفته از سوی مراکز تولید در خصوص ارزیابی کیفی فرآورده FFP اثربخش بوده است.
مهمترین پارامتری که در ارزیابی کیفیت فرآورده FFP مورد بررسی قرار میگیرد، میزان فعالیت FVIII میباشد. مقدار استاندارد این پارامتر مطابق راهنمای تهیه، استفاده و تضمین کیفیت فرآوردههای خون کمیته اروپا و استانداردهای ملی انتقال خون ایران و دستورالعملهای مصوب در سازمان انتقال خون ایران، بیش از70% طبیعی است(20، 1). همانطور که در نتایج جدول3 مشاهده میگردد، در محصولات ارزیابی شده در طول سالهای 1398-1397، میانگین میزان فعالیت FVIII بسیار بیشتر از حداقل استاندارد تعریف شده بوده است. همچنین میانگین درصد فعالیت FVIII افزایش معناداری در سال 1398 نسبت به سال 1397داشته است. در طول سال 1398، میزان فعالیت FVIII در72/0% واحدهای ارزیابی شده (25 واحد FFP) کمتر از70% طبیعی بوده است. تمام واحدهایی که میزان فعالیت FVIII در آنها، کمتر از 70% طبیعی بوده، در محدوده 70%-60% طبیعی بودهاند. با توجه به اهمیت حفظ فعالیت FVIII در فرآورده FFP ، کنترل و بهینهسازی کلیه مراحل تولید، نگهداری و ذخیرهسازی اهمیت ویژهای دارد. بیشترین علل ریشهای مربوط به عدم انطباق در نتایج ارزیابی پارامتر FVIII ، عدم کنترل زنجیره سرما بود. رعایت زنجیره سرما در زمان حمل، تولید و ذخیرهسازی اهمیت ویژهای دارد. در این خصوص تجهیزات و اقدامات اصلاحی مؤثری در قالب فرآیندهای آموزشی، معتبرسازی و بازنگری دستورالعملها مطابق آخرین مراجع علمی صورت گرفته است. در خصوص اسناد معتبرسازی علاوه بر این که حمل و نقل باید مطابق سند معتبرسازی انجام شود، پایش دما در حین حمل با استفاده از دیتا لاگر کالیبره اهمیت دارد. لاگ بوک تجهیزات از جمله هموشیکرها، اکستراکتورها و سانتریفیوژها باید تحت کنترل باشد و عملکرد صحیح آنها تضمین شده باشد.
میانگین پارامترهای تعداد گلبول قرمز، تعداد گلبول سفید و تعداد پلاکت در فرآورده FFP تولید شده در سال 1398 نسبت به سال 1397 کاهشی معنادار داشته است که نشاندهنده بهبود روند تولید فرآورده FFP در زمان جداسازی پلاسما میباشد.
در مطالعهای که توسط سلطان و همکارانش صورت گرفته است، سطح FVIII در 100 واحد فرآورده FFP بررسی و میزان FVIII بر اساس بررسی لخته با استفاده ازSysmex® CA-1500-automated coagulation analyzer معادل 01/15% ± 24/84% بوده و 95% منطبق با استانداردها و 5% عدم انطباق مشاهده شده است. درصد عدم انطباق پارامتر FVIII در این مطالعه در سال 1397 58/1% بود که در سال 1398 به 72/0% رسیده و روند بهبود مناسبی را نشان میدهد(21).
در مطالعهای که، توسط آمش و همکارانش انجام شده است، سطحFVIII در تقریباً 97% موارد بالای70% میزان طبیعی بوده همچنین حجم فرآورده FFP برابر 17 ± 211 میلیلیتر بوده است(22). با توجه به تعداد نمونه بررسی شده و مراکز تولید متعدد در این مطالعه، میزان انحراف از استاندارد پارامتر حجم در این مطالعه بیشتر میباشد ولی حد بالای پارامتر حجم در هر دو مطالعه یکسان و معادل 228 میلیلیتر بوده است. در مطالعهای که، توسط بالا و همکارانش بر روی 3476 واحد FFP انجام شده است، سطح FVIII ، در 5/97% واحدها منطبق با استاندارد بوده و میزان آن IU/mL 086/0 ± 8/0 میباشد و همچنین میانگین حجم FFP معادل 58/9 ± 217 میلیلیتر بوده است(23). با توجه به تعدد مراکز تولید، میزان انحراف از استاندارد پارامتر حجم در این مطالعه در مقایسه با مطالعه بالا بیشتر بوده است. در مطالعه دوگرا و همکارانش در بررسی 100 واحد FFP ، میزان FVIII با روش Sysmex CA-50 coagulometer معادل 01/29 ± 205/117 بوده است(24). میزان FVIII در این مطالعه تقریباً با مطالعه صورت گرفته توسط دوگرا برابر میباشد و اختلاف معناداری ندارد. در مطالعه گرجیسویک و همکارانش، میزان حجم فرآورده FFP برابر 234-178 میلیلیتر و در 90% واحدها، میزان پروتئین در حد قابل قبول بوده است(25). میزان حجم در این مطالعه تقریباً با مطالعه صورت گرفته توسط گرجیسویک برابر است و درصد واحدهای منطبق با استاندارد پارامتر پروتئین در این مطالعه بالاتر میباشد. در مطالعه نوال و همکارانش، میزان فعالیت FVIII در90% واحدهای بررسی شده بیش از 50% بوده است(26). در این مطالعه در تمام واحدهایی که میزان فعالیت FVIII کمتر از 70% طبیعی بوده، این مقدار در محدوده70%-60% طبیعی بوده است و فعالیت FVIII کمتر از60% نبوده است. در مطالعه جیولیانو و همکارانش، در بررسی 1485 واحد FFP، میانگین میزان فعالیت FVIII، 99% بوده است و در 1/83% واحدهای ارزیابی شده، میزان فعالیت FVIII بیش از70% بوده است(27). در این مطالعه میانگین فعالیت FVIII بیشتر بوده و در 28/99% واحدهای FFP بررسی شده، میزان FVIII بالاتر از 70% بوده است.
در مطالعهای که توسط سواپنیل و همکارانش صورت گرفته است، در طی سالهای 2014-2013 ، 47/16% واحدهـای FFP دارای عـدم انطباق در یکی از پارامترهای کیفی فرآورده FFP بوده است، میزان درصد عدم انطباق در
پارامترهای کیفی فرآورده FFP در این مطالعه کمتر بوده است. در مطالعه سواپنیل، 43% علت عدم انطباق فرآورده FFP مربوط به پارامتر حجم، 33% مربوط به سطح فیبرینوژن و24% مربوط به میزان فعالیت FVIII بوده است(28). در این مطالعه نیز بیشترین درصد عدم انطباق فرآورده FFP به دلیل عدم انطباق در پارامتر حجم و سپس FVIII بوده است.
نتیجهگیری
این مطالعه نشان داد که بیش از% 99 واحدهای FFP مورد ارزیابی در طول سالهای 1398-1397 با نتایج تعیین شده در مراجع معتبر علمی و دستورالعملهای سازمان انتقال خون ایران مطابق بوده است. افزایش درصد انطباق تمام پارامترهای کیفی فرآورده FFP همچنین، افزایش میانگین درصد فعالیت FVIII و کاهش میانگین تعداد گلبول سفید، گلبول قرمز و پلاکت در محصول نهایی FFP، نشاندهنده ارتقای فرآیند تولید میباشد و اقدامات صورت گرفته جهت بهبود حفظ زنجیره سرما، در افزایش کیفیت FVIII اثربخش بوده است.
استقرار سیستم مدیریت کیفیت و بررسی علل ریشهای عدم انطباقها، اقدامات اصلاحی و پیگیری اثر بخشی اقدامات انجام شده، پایش مستمر نتایج کنترل کیفی محصولات و بررسی تغییرات کیفی محصولات تولید شده و ارزیابی خطر هر یک از تغییرات قبل از بهرهبرداری، منجر به بهبود و اطمینان از ثبات کیفیت محصول میگردد.
تشکر و قدردانی
این مقاله منتج از نتایج کنترل کیفی فرآوردهها در واحد کنترل کیفی ادارات کل سازمان انتقال خون ایران میباشد. بدین وسیله از خانم دکتر فائزه قاسمی عضو هیئت علمی مؤسسه طب انتقال خون، کلیه همکاران در واحد کنترل کیفی ادارات کل انتقال خون و آقای صدری مهر تشکر به عمل میآید.
نوع مطالعه: پژوهشي |
موضوع مقاله:
انتقال خون
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






