جلد 18، شماره 4 - ( زمستان 1400 )
جلد 18 شماره 4 صفحات 312-291 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ansari A, Khosronezhad F, Shallageh Y, Zare A, Afaghi saray S, Hasanzadeh M. A Review of Hemostatic Agents and Products. bloodj 2021; 18 (4) :291-312
URL: http://bloodjournal.ir/article-1-1373-fa.html
URL: http://bloodjournal.ir/article-1-1373-fa.html
انصاری علی، خسرونژاد فاطمه، شلاگه یوسف، زارع ابوالفضل، آفاقی شبنم، حسن زاده مهدی. مروری بر انواع مواد و محصولات مؤثر بر تسریع انعقاد خون. فصلنامه پژوهشی خون. 1400; 18 (4) :291-312
استادیار دانشکده مهندسی نساجی ـ دانشگاه یزد
متن کامل [PDF 739 kb]
(3051 دریافت)
| چکیده (HTML) (3263 مشاهده)
مقدمه
توقف سریع خونریزی در جراحات عمیق، مسأله مهمی در حفظ حیات فرد آسیبدیده است؛ به طوری که از دست رفتن شدید خون ممکن است حتی منجر به مرگ افراد شود. خونریزیهای کنترل نشده یکی از مهمترین عوامل مرگ و میر در اثر آسیبهای جنگی و غیر جنگی به شمار میرود. 50 درصد از افرادی که در اثر صدمه دیدن پیش از رسیدن به بیمارستان میمیرند، به دلیل خونریزیهای شدید جان خود را از دست میدهند(2، 1). در میان مصدومان تصادفات جادهای نیز 80 درصد قربانیان به دلیل خونریزی جانشان را از دست میدهند(3). همچنین، دومین دلیل اصلی مرگ و میر در بیمارستانها، خونریزی در بیماران است(4). نکته قابل توجه این است که بسیاری از این مرگها، با روشهای سادهای مانند پوشاندن زخم و جلوگیری از خونریزی قابل پیشگیری هستند.
از گذشته تاکنون از مواد مختلفی به منظور پوشاندن زخم استفاده شده است که از آن جمله میتوان به مواد طبیعی نظیر کتان، کنف، پشم، چربیهای حیوانی، عسل، موم زنبور و چای سبز اشاره کرد(7-5). اکثر این زخم پوشها به دلیل جذب ترشحات زخم و چسبیدن به محل زخم، سبب التهاب و عفونت و درنتیجه کندشدن روند ترمیم زخم میشوند(10-8). همچنین روشهای قدیمی کنترل خونریزی که مبتنی بر اعمال فشار بر روی زخم هستند مانند استفاده از تورنیکه یا زخمبند(تسمه یا نواری که دور عضوی بسته میشود تا مانع عبور خون گردد)، پانسمان فشاری و بخیهزدن، در مواقعی که زخم سطحی وسیع بوده و فشار آوردن به تنهایی نتواند خونریزی را متوقف کند، کاربرد چندانی نخواهند داشت. امروزه با توسعه پلیمرهای زیستی جدید و توسعه روشهای ساخت پانسمانهای جدید، امکان بهبود سریعتر و کاهش احتمال عفونت زخم فراهم شده است(11، 10). با این وجود محدودیت اصلی این پانسمانها، عدم توانایی آنها برای جلوگیری از خونریزی در زمان کوتاه و شرایط بحرانی میباشد. به منظور رفع این مشکلات، محققان از مواد مختلفی مانند کیتوسان، ژلاتین، کراتین، کتیرا و پلی وینیل الکل (PolyVinyl Alcohol, PVA) کـه از طریـق تأثیـر بــر
مراحل مختلفی از انعقاد خون، توانایی تسریع در فرآیند انعقاد خون را دارند استفاده کردهاند(15-9). این مواد انعقادی تاکنون در کاربردهای مختلفی از جمله اورژانسهای تروما، جراحیها و نیز در کاربردهای نظامی به طور گسترده و پیشرو در حال تکامل و استفاده بودهاند(21-16). شناخت مبانی فیزیولوژی انعقاد خون در بدن انسان میتواند در جهت شناخت مکانیسم دقیق عملکرد این مواد و یافتن انواع دیگری از این مواد منعقدکننده خون کمککننده باشد.
به طور کلی دو نوع ماده اصلی در فرآیند انعقاد خون نقش دارند. دسته اول پروکوآگولانتها(ProCoagulants) هستند که سبب پیشبرد فرآیند انعقاد خون میشوند و دسته دوم موادی که سبب مهار انعقاد خون میگردند و ضد انعقاد(AntiCoagulants) نام دارند. تعادل بین این دو دسته مواد در حالت طبیعی در خون به گونهای است که غلظت مواد آنتیکوآگولانت بر غلظت مواد پروکوآگولانت غالب است. میزان پروکوآگولانتها معمولاً به دنبال آسیب بافتی زیاد میشود و با به هم خوردن تعادل طبیعی، فرآیند تشکیل لخته(هموستاز) آغاز میگردد(22). هرگاه یک رگ خونی در محل آسیب بافتی، دچار آسیب یا پارگی شود، هموستاز با چند مکانیسم عمده به ترتیب زیر صورت میگیرد: 1- انقباض رگ، 2- تشکیل میخ پلاکتی، 3- تشکیل لخته خونی و در نتیجه انعقاد خون و 4- استحکام لخته خون و مهار جریان خونریزی(22، 16). در واقع به دنبال آسیب عروقی و شروع خونریزی، به ترتیب مراحل انقباض دیواره عروق جهت کاهش جریان خون در محل، چسبندگی(Adhesion) پلاکتها به دیواره آسیبدیده عروق، فعال شدن پلاکتها و تجمع(Aggregation) آنها در کنار هم اتفاق میافتد و به تشکیل میخ پلاکتی(Platelet Plug) اولیه منجر میشود(23). این میخ پلاکتی استحکام کافی جهت مهار جریان خونریزی را ندارد. بنابراین شبکهای تور مانند از رشتههای پروتئین فیبرین در اطراف پلاکتها تشکیل شده و لختهای مستحکم ایجاد میشود. در واقع به دنبال آسیب عروقی و آزاد شدن برخی مواد شیمیایی، آبشاری از فاکتورهای انعقادی در قالب دو مسیر داخلی و خارجی انعقاد به دنبال یکدیگر فعال شده و در نهایت از طریق مسیر مشترک به تشکیل شبکه فیبرینی منجر میشود(24، 16). مانند کیتوسان و ژلاتین که بر فرآیند انعقاد خون مؤثرند و در قالب زخمپوشها و مواد منعقدکننده موضعی خون قابل استفاده هستند. معیارهای انتخاب مواد منعقدکننده خون شامل: 1- شروع اثر فوری برای مهار انواع خونریزی شریانی ویا وریدی (در کم تر از 2 دقیقه)، 2- زیستسازگاری (عدم سمیت و حساسیتزایی موضعی ویا سیستمیک)، 3- عدم ایجاد درد یا آسیب حرارتی در موضع، 4- قابلیت قراردادن و برداشتن آسان در محل زخم، 5- اثر انعقادی قوی بر زخمهایی که حتی اثر فشاری تورنیکه نیز بر آنها موثر نیست، 6- پایداری و امکان نگهداری طولانی، 7- صرفهی اقتصادی و 8- زیستتخریبپذیری میباشد(26، 25)؛ بنابراین شناخت دقیق خصوصیات هریک از مواد در جهت انتخاب به عنوان منعقدکننده خون بر طبق معیارهای مطرح شده ضروری و مورد نیاز است.
در مطالعه پیش رو، انواع مواد دارای قابلیت انعقاد خون که تاکنون معرفی و استفاده شدهاند، مورد بررسی قرار میگیرند تا با شناخت مزایا و معایب هر یک، دید بهتری برای انتخاب مواد انعقادی و معرفی مواد جدید برطبق معیارهای مطرح شده به مخاطب ارائه شود.
مواد و روشها
در این مطالعه مروری، جستجوی دادهها در پایگاههای معتبر علمی PubMed، Scopus، Sience Direct، SID، Magiran و IranMedex بدون محدودیت تاریخ انتشار و نوع مطالعه با ترکیب کلمات کلیدی مرتبط با موضوع مواد و محصولات منعقد کننده خون انجام شد. کلمات کلیدی مورد جستجو شامل: مواد منعقدکننده خون، خونریزی، زخمپوش، زخم، پانسمان، تروما، ترومای جنگی و ترومای غیر جنگی بودند. همچنین جستجوی مطالعهها با کلید واژه نامهای اختصاصی مواد و محصولات هموستاتیک از جمله CombatGauze، Celox، HemCon، Chitosan، ترومبین، فیبرین و غیره انجام شد. از مقالات معتبر رفرانس داده شده در مقالات اصیل یافت شده نیز استفاده شد. مطالعههای مرتبط با بررسی چکیده مقالات توسط دو پژوهشگر به صورت مستقل انتخاب شدند. مطالعههای انتخاب شده در هر دو حوزه مطالعههای انسانی و مطالعه مدلهای حیوانی بود. بیشتر مقالات مرور شده به زبان انگلیسی بوده و از تعدادی از مطالعههای فارسی مرتبط با این حوزه نیز استفاده شد. در نهایت از میان بیش از 360 مقاله اولیه مورد بررسی، 110 مقاله انتخاب شده و مورد مرور نتایج قرار گرفتند.
یافتهها
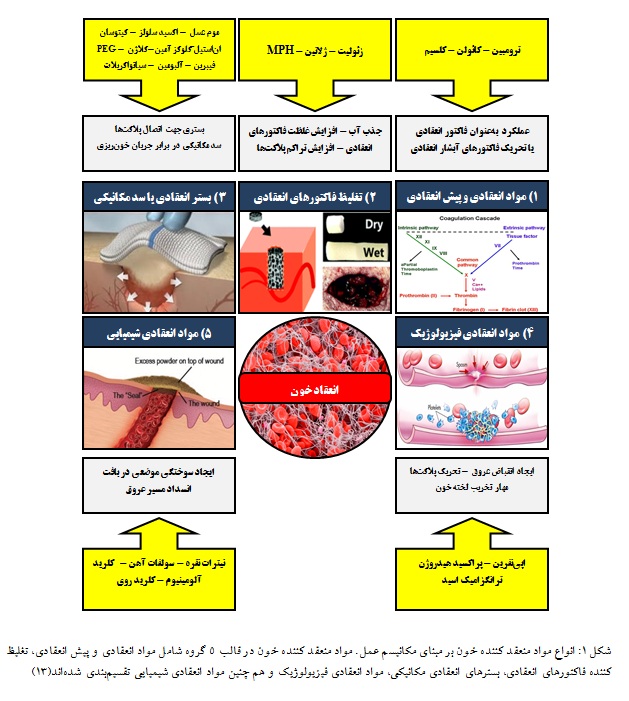
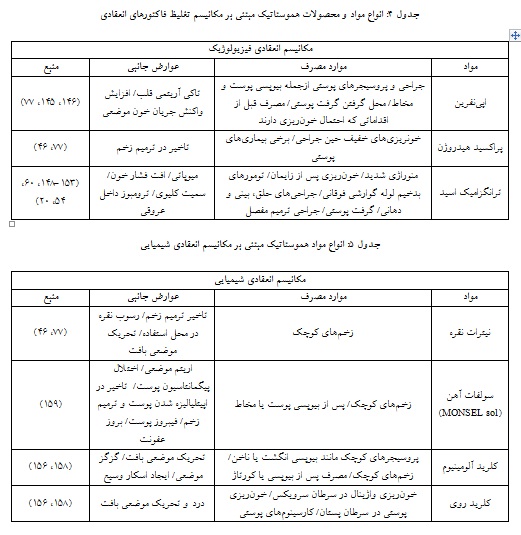
با توجه به مبانی انعقاد خون، مواد مختلفی که به طور مستقیم یا غیر مستقیم بتوانند بر یک یا چند مرحله از مراحل انعقاد خون تاثیر مثبت بگذارند، قابلیت استفاده به عنوان منعقد کننده خون را دارند. این مواد به طور کلی بر مبنای نحوه عملکرد و تاثیر بر مراحل هموستاز به 5 دسته تقسیم میشوند: 1- عوامل انعقادی و پیش انعقادی، 2- مواد تغلیظکننده فاکتورهای انعقادی، 3- مواد ایجاد کننده سد مکانیکی در برابر جریان خون 4- مواد انعقادی فیزیولوژیک 5- سایر مواد شیمیایی انعقادی(شکل 1 و جداول 5-1). در ادامه به تشریح هر یک از پنج دسته مواد انعقادی و ارائه مثالهای مرتبط پرداخته میشود.
عوامل انعقادی و پیشانعقادی:
این دسته از مواد، یا با تأثیر مستقیم بر فاکتورهای آبشار انعقادی بدن فرد آسیب دیده و فعالسازی این فاکتورها عمل کرده(عوامل پیشانعقادی) و یا خود به عنوان فاکتور انعقادی در مسیرهای آبشار انعقادی ایفای نقش میکنند(عوامل انعقادی)(27). از جمله عوامل پیشانعقادی که تاکنون برای بندآوردن خونریزی استفاده شدهاند میتوان به کائولن اشاره کرد. کائولن، سیلیکات آلومینیومی است که با تأثیر قوی بر فعالسازی مسیر داخلی آبشار انعقادی (خصوصاً از طریق فعالسازی فاکتور 12) باعث تسریع روند انعقاد خون در زخم میشود. برای مثال، محصولی به نام QuickClot Combat Gauze از زخم پوش پلیاستری حاوی کائولن ساخته شده است که حدود سه دقیقه پس از قرار دادن آن بر روی زخـم به همراه اعمال فشار مستقیم با دست میتواند موجب بند آمدن خونریزی شود(30-26).
این محصول در سال 2008 توسط کمیته مراقبت از تلفات مبارزه تاکتیکی CoTCCC (Committee on Tactical Combat Casualty Care) به عنوان خط اول درمان خونریزیهای شدیدی که به بستن تورنیکه پاسخ نمیدهند، انتخاب شد و همچنان به عنوان یکی از زخمپوشهای منعقدکننده خون توسط ارتش امریکا مورد استفاده است (32، 31، 28). در مطالعهای توسط آرنود و همکارانش در سال 2009 در مقایسه 10 نوع ماده منعقدکننده خون، QuickClot جزو 4 محصول برتر از نظر کاهش حجم خونریزی و افزایش بقای جاندار نشـان داده
شد(33).
در مطالعـه دیگـری کـه توسط خیرآبادی و همکارانش
در سال 2009 ، درباره مقایسه عملکرد 4 نوع زخمپوش منعقدکننده خون شامل HemCon، Celox، TraumaStat، QuickClot و گـاز معمولـی بـر روی مـدل خوکی خونریزی شریانی انجام شد، نتایج نشان داد که زخمپوش QuickClot بهترین کارآیی را از نظر کاهش حجم خون از دست رفته، افزایش میزان بقای جاندار و حفظ میانگین فشار خون پس از جراحت در جاندار، در میان این 4 محصول داشت(34). مشاهده شده است که تأثیر Combat Gauze در مهار خونریزی اندامها و سر و گردن بیشتر از خونریزیهای تنهای است(35). در بـرخی افـراد کـه دچـار بیمـاریهای انعقادی دائمی هستند و یا در برخی شرایطگذرا از جمله اختلال انعقادی ناشی از تروما (Trauma Induced Coagulopathy, TIC)، خونریزی شدید و از دست دادن پلاکتها و فاکتورهای انعقادی، هیپوترمی(کاهش دمای مرکزی بدن به کمتر از °C 35)، اسیدوز، افزایش تخریب لخته خونی (هیپرفیبرینولیز) و اختلال الکترولیتی، سیستم انعقادی بدن دچار اختلال شده و استفاده از مواد پیشانعقادی ممکن است تاثیر مطلوب بر روند انعقاد خون نداشته باشد(37، 36). زیرا سیستم انعقادی خود فرد دچار اختلال گشته و فاکتورهای انعقادی قابلیت فعالسازی توسط مواد پیشانعقادی را ندارند(38). در چنین شرایطی لازم است از مواد انعقادی بهجای مواد پیشانعقادی استفاده گردد. در این میان میتوان محصولات هموستاتیک حاوی موادی مانند ترومبین، فیبرینوژن، فاکتور 7، 8 و یا کلسیم را نام برد (38). نشان داده شده است که QuickClot در این شرایط از جمله هیپوترمی مؤثرتر از پانسمان گاز معمولی بوده است؛ ولی تاثیر کمتری نسبت به محصولات مبتنی بر عوامل انعقادی ازجمله ترومبین و فیبرینوژن داشته است (42-39). از جمله عوامل انعقادی مؤثر بر بند آوردن خونریزی، ترومبین میباشد. ترومبین از طریق مکانیسمهای انعقادی مختلفی از جمله تبدیل فیبرینوژن به فیبرین، فعالسازی فاکتور 5، 8 و 11 و همچنین تحریک چسبندگی و تجمع پلاکتها بهسرعت موجب انعقاد خون میشود(45-43). ترومبین به دلیل عملکرد در مرحله آخر آبشار انعقادی(تبدیل فیبرینوژن به فیبرین) و عدم وابستگی به مراحل قبلی آبشار، در بیمارانی که به دلیل مصرف داروهای ضد انعقادی و یا بیماری انعقادی دچار اختلال عملکرد فاکتورهای انعقادی هستند نیز کاربرد دارد(46).
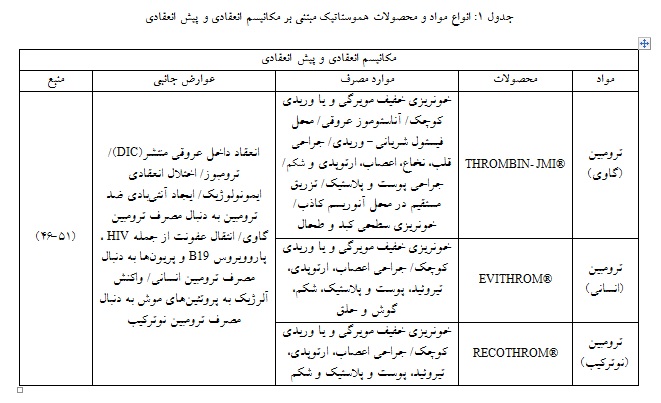
ترومبین جهت استفاده در محصولات منعقدکننده خون از منشا حیوانی یا انسانی و یا ترومبین نوترکیب استحصال میشود. ترومبین گاوی از حدود 60 سال پیش به عنوان ماده هموستاتیک موضعی استفاده میشده است اما به علت حساسیتزایی و تحریک سیستم ایمنی انسان و عوارض ناشی از آن، هشدار خطر در مورد عوارض مصرف آن توسط سازمان غذا و دارو ارائه شده است(50-46).
سپس استفاده از ترومبین انسانی مطرح شد که احتمال انتقال برخی از بیماریهای ویروسی از فرد دهنده به گیرنده را به دنبال دارد. ترومبین نوترکیب عوارض کمتری نسبت به انواع حیوانی و انسانی دارد(51).
از جمله محصولات مبتنی بر ترومبین میتوان به THROMBIN-JMI (ترومبین گاوی)، EVITHROM (ترومبین انسانی) و RECOTHROM (ترومبین نوترکیب) اشاره کرد(48). ازجمله محدودیتهای ترومبین، پایداری نسبتاً کم در دمای محیط و دماهای بالاتر است. برای مثال، EVITHROM حداکثر به مدت 1 ساعت در دمای اتاق و حداکثر 10 دقیقه در دمای37 درجه سانتیگراد پایدار است و بنابراین باید در فریزر نگهداری شود(48).
در مطالعههای اخیر، اثر بخشی ترکیبی از ترومبین و نوعی فاکتور بافتی نوترکیب(TT-173) در مهار خونریزی جراحی تعویض کامل مفصل زانو در مدل حیوانی گوسفند و همچنین مهار خونریزی کبدی در مدل حیوانی خوکی بیشتر از اثر انعقادی ترومبین به تنهایی گزارش شده است(53، 52). در مطالعه منتشر شده در سال 2021، تاثیر ترومبین موضعی در مهار خونریزی طی جراحی آرتروپلاستی کامل مفصل شانه برابر با تاثیر هموستاتیک ترانگزامیک اسید وریدی گزارش شده و در نتیجه ترومبین موضعی بهعنوان جایگزینی برای ترانگزامیکاسید در موارد منع مصرف ترانگزامیک اسید پیشنهاد شده است(54).
مواد تغلیظکننده فاکتورهای انعقادی:
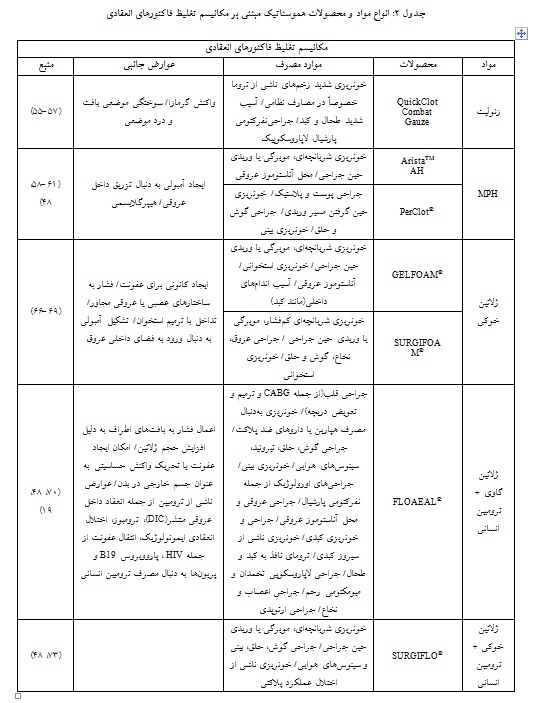
این دسته از مواد از طریق جذب سریع محتوای آب موجود در خون و درنتیجه افزایش غلظت فاکتورهای انعقادی موجود در خون فرد و افزایش تراکم پلاکتها، موجب تسریع روند انعقاد خون میشوند(جدول 2). از جمله مواد مبتنی بر این مکانیسم میتوان زئولیتها و ساختارهای پلیساکاریدی میکرو متخلخل حاصل از نشاسته گیاهی (MPH: Microporous Polysaccharide Hemospheres) را بیان کرد. برای مثال محصول QuickClot Combat Gauze (Z-Medica) از گرانولهای زئولیتی ساخته شده و در سال 2002 تاییدیه FDA را دریافت کرد(55). زئولیتها طی واکنشی گرامازا، آب را جذب میکنند. از آنجایی که گرمای تولید شده میتواند موجب آسیب بافتی موضعی و حتی ترومبوز عروقی گردد، این محصول در سال 2008 توسط CoTCCC کنار گذاشته شد(57، 56). برخلاف این محصول، ساختارهای میکرومتخلخل نشاسته میتوانند بدون تولید گرما، آب محیط را جذب کنند و بدون آسیب حرارتی به بافت، موجب تغلیظ فاکتورهای انعقادی، افزایش تراکم سلولهای انعقادی و همچنین ایجاد بستری ژل مانند جهت تشکیل شبکه فیبرینی شوند(60-58). بنابراین از طریق دو مکانیسم تغلیظ فاکتورها و ایجاد بستر مکانیکی عمل میکنند. از دیگر مزایای این مواد، زیستسازگاری، عدم سمیت و عدم حساسیتزایی است(48). این مواد در بدن پس از حدود 48 ساعت، جذب شده و یا با آنزیم آمیلاز و پیراز موجود در سرم تجزیه میشوند(61).
از محصولات مبتنی بر MPH میتوان به PerClot به صورت اپلیکاتور از پیش آماده، PerClot Laparoscopic به صورت اپلیکاتور دارای کاتتر بلند و نازک(قطر مقطع mm 5) برای استفاده در جراحیهای لاپاروسکوپیک و همچنین EndoClot PHS به صورت اپلیکاتور حاوی کاتتر جهت استفاده در حین اندوسکوپی برای مهار خونریزیهای لوله گوارشی اشاره کرد(48). در مطالعه آلام و همکارانش (2003)، در مقایسه اثر هموستاتیک QuickClot، TraumaDEX (محصول مبتنی بر MPH) و گاز معمولی، در مدل خوکی خونریزی شدید شریان و ورید فمورال، TraumaDEX اثر کمتری نسبت به QuickClot و اثر بیشتری نسبت به گاز معمولی داشت(62).
در مطالعه دیگری بر مقایسه اثر هموستاتیک TraumaDEX و Celox در مدل خوکی خونریزی شدید شریان و ورید فمورال، حجم خونریزی به دنبال مصرف هر یک از دو نوع ماده منعقدکننده خون کاهش یافت، اما تفاوت معناداری بین میزان اثر TraumaDEX و Celox مشاهده نشد(63). البته این مطالعهها به صورت محدود و با حجم نمونه کم انجام شدهاند و برای اظهار نظر دقیقتر در مورد مقایسه اثر انعقادی این محصولات به مطالعات بیشتر در سطوح شواهد بالاتر نیاز است. انواعی دیگر از محصولات مبتنی بر ژلاتین ساخته شدهاند که بیشتر از طریق مکانیسم جذب آب و تغلیظ سلولهای خونی و فاکتورهای انعقادی عمل میکنند(65، 64، 46). هر چند که معمولاً مواد انعقادی و پیش انعقادی از جمله ترومبین نیز در ترکیب با ژلاتین قرار داده میشود تا از ترکیبی از مکانیسمهای انعقادی برای تسریع روند انعقاد خون استفاده شود(66، 46). اسفنج ژلاتینی قابلیت جذب آب معادل 35 تا 45 برابر وزن خود را دارد که همین امر علاوه بر تغلیظ فاکتورهای انعقادی، موجب افزایش حجم ژلاتین و ایجاد فشار و مانع مکانیکی موضعی در برابر جریان خونریزی میشود. ژلاتین ترکیبی آبدوست، غیرمحرک، غیرسمی و غیرحساسیتزا بوده و پس از استفاده معمولاً طی 4 تا 6 هفته قابل جذب است (67، 46). محصول GELFOAM در سال 1945 و محصول SURGIFOAM در سال 1983 با ترکیب ژلاتین حاصل از پوست خوک ساخته شدند(68، 66). همچنین محصول GELFOAM PLUS ، شامل پودر ترومبین انسانی جهت ترکیب با آب و آغشته کردن GELFOAM به آن است تا عملکرد انعقادی ترومبین نیز به عملکرد ژلاتین افزوده گردد(69). محصولاتی نیز به صورت سیال از جمله FLOSEAL و SURGIFLO از ترکیب ژلاتین و ترومبین جهت تسریع انعقاد خون ساخته و به بازار عرضه شدهاند(71، 70، 48). کاربرد FLOSEAL در جراحی اندومتریوما موجب بهبود کنترل خونریزی حسن جراحی و نیز بازگشت عملکرد تخمدان پس از جراحی شده است (72، 18). در مطالعههای جدیدتر، ترکیبی از ژلاتین و ترانسگلوتامیناز میکروبی با قابلیت ایجاد اتصالات عرضی بیشتر و مستحکمتر بین اجزای ژلاتینی در مقایسه با SURGIFLO معرفی شده است(73). باید توجه داشت که میزان جذب آب و افزایش حجم ژلاتین در مقایسه با کیتوسان و سلولز بیشتر است که از یک طرف موجب افزایش اثر هموستاتیک مکانیکی شده و از طرف دیگر عوارض فشاری بر بافتهای اطراف را نیز به دنبال دارد (74).
مواد ایجاد کننده بستر انعقادی و یا سد مکانیکی در برابر جریان خون:
این دسته از مواد با چسبیدن به بافتهای اطراف محل خونریزی و ایجاد یک سد مکانیکی در برابر جریان خون، موجب مهار جریان خون به سمت خارج از عروق میشوند(69)؛ بنابراین انعقاد خون به دنبال استفاده از این مواد، مستلزم عملکرد کامل سیستم انعقادی بدن فرد شامل اتصال و تجمع پلاکتها و آبشار انعقادی نیز میباشد(75، 45، 43). به طور کلی استفاده از این گروه از مواد و محصولات هموستاتیک، راحتتر و ارزانتر از سایر گروههـا و معمـولاً نیازمنـد فشار موضعی با دست میباشد
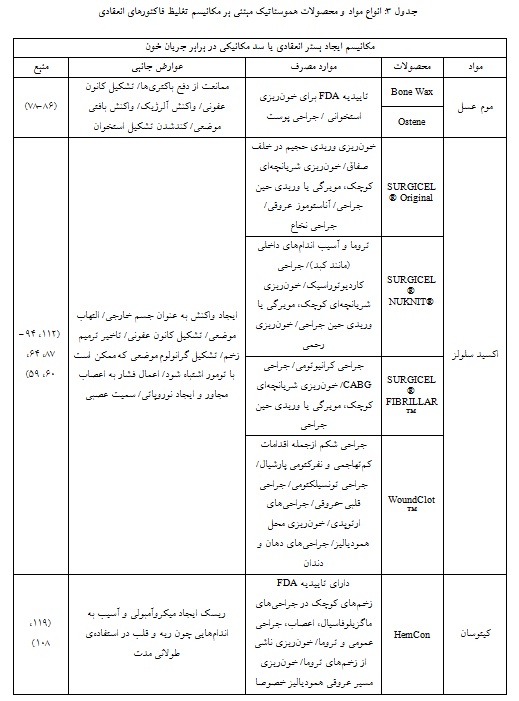
(46). در سال 1886، برای اولین بار از ترکیب موم عسل، سالیسیلیک اسید و روغن بادام برای مهار خونریزی از جمجمه سگ استفاده شد(76، 67). سپس ترکیبات جدیدتری مبتنی بر موم عسل و با تفاوت در چربی اضافه شده به آن(پارافین، ایزوپروپیل پالمیتات و غیره) نیز مورد استفاده قرار گرفتند. این ترکیبات اغلب برای مهار خونریزی استخوانی استفاده میشوند که از طریق انسداد مکانیکی کانالهای استخوانی و انسداد مسیر خونریزی عمل میکنند(77، 46). برای مثال میتوان محصولی به نام Bone Wax که دارای تاییدیه FDA برای مهار خونریزیهای استخوانی و جراحیهای پوست میباشد، را نام برد. این محصول، نامحلول بوده و به مدت طولانی در محل مورد استفاده در جراحی باقی میماند و موجب تحریک دستگاه ایمنی ذاتی و فعال شدن فاگوسیتها و به دنبال آن ایجاد عوارض خفیف تا شدیدی(بسته به محل و نوع جراحی) از جمله اختلال در تولید و ترمیم استخوان و همچنین تشکیل گرانولوما در محل استفاده میشود(83-78).
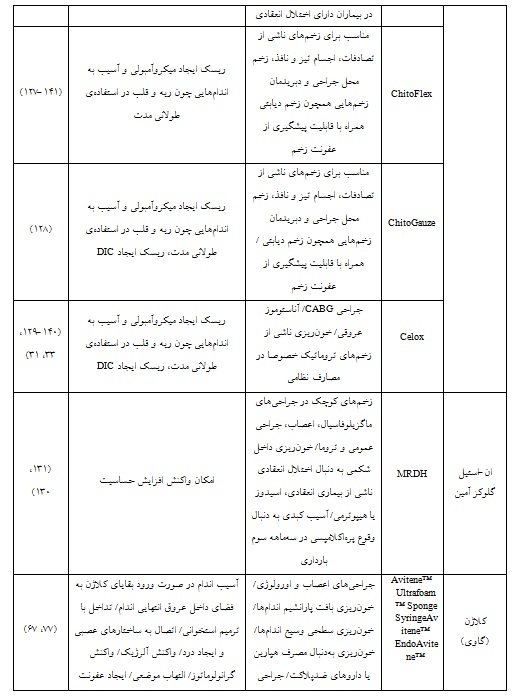
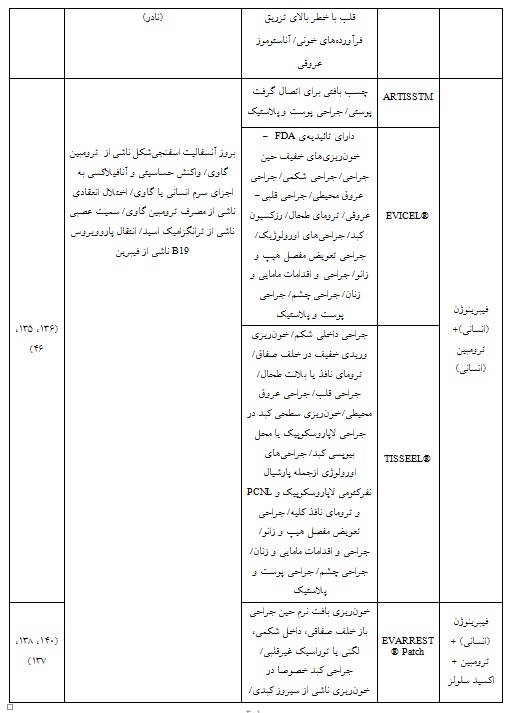
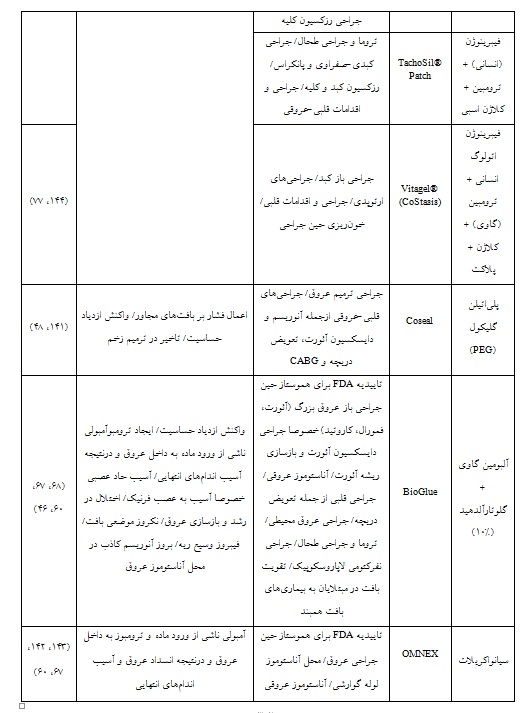
 بسیاری دیگر از محصولات مبتنی بر این مکانیسم، حاوی کیتوسان هستند. کیتوسان پلیساکاریدی حاصل از فرآیند استیلزدایی(Deacetylation) کیتین موجود در اسکلت خارجی سختپوستان(مانند خرچنگ) است و بعد از سلولز، به عنوان فراوانترین پلیساکارید موجود در طبیعت شناخته میشود(96). کیتوسان ترکیبی زیست سازگار، زیست تخریبپذیر، ضدباکتری و ضد قارچ، ضد سرطان، مؤثر در تسریع فرآیند انعقاد خون، ترمیم زخم(111، 110، 106) و بازسازی بافتها، آنتیاکسیدان و همچنین دارای خاصیت ضددردی موضعی است(شکل 2)(118-97).
بسیاری دیگر از محصولات مبتنی بر این مکانیسم، حاوی کیتوسان هستند. کیتوسان پلیساکاریدی حاصل از فرآیند استیلزدایی(Deacetylation) کیتین موجود در اسکلت خارجی سختپوستان(مانند خرچنگ) است و بعد از سلولز، به عنوان فراوانترین پلیساکارید موجود در طبیعت شناخته میشود(96). کیتوسان ترکیبی زیست سازگار، زیست تخریبپذیر، ضدباکتری و ضد قارچ، ضد سرطان، مؤثر در تسریع فرآیند انعقاد خون، ترمیم زخم(111، 110، 106) و بازسازی بافتها، آنتیاکسیدان و همچنین دارای خاصیت ضددردی موضعی است(شکل 2)(118-97).
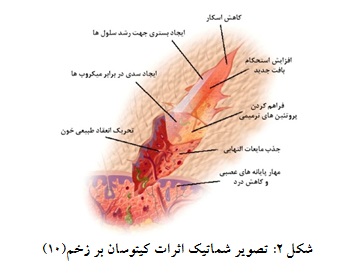
شکل 2: تصویر شماتیک اثرات کیتوسان بر زخم(10)
این ویژگیها وابسته به درجه داستیلاسیون و وزن مولکولی کیتوسان متغیر است(96). کیتوسان اثر انعقادی مستقیم بر مراحل انعقاد خون ندارد؛ بلکه در اثر ایجاد پیوند الکترواستاتیکی بین بارهای مثبت زنجیرههای پلیمری کیتوسان و بار منفی سطح غشای گلبولهای قرمز و پلاکتهای خون، موجب ایجاد یک سد مکانیکی ژل مانند در برابر جریان خون میشود(121-96). اتصال کیتوسان به سطوح مخاطی نیز بر همین اساس است؛ به طوریکه پیوند الکترواستاتیک بین بارهای مثبت کیتوسان و بارهای منفی گلیکوپروتئین موسین موجود در سطوح مخاطی صورت میگیرد(122، 96). به دلیل همین مکانیسم مستقل از مسیرهای انعقادی بدن، مشاهده شده است که کیتوسان بر تسریع فرآیند انعقاد خون در مدلهای موشی دارای اختلال انعقادی از جمله در مهار خونریزی شریانی موشهای هیپوترم دریافتکننده وارفارین و همچنین مهار خونریزی کبدی موشهای دریافتکننده هپارین سیستمیک مؤثر است(124، 123). در مطالعه بر روی یکی از اولین زخمپوشهای مبتنی بر کیتوسان به نام HemCon، نشان داده شد که این محصول موجب کاهش خونریزی در مدل خوکی خونریزی وریدی و کبدی میشود؛ اما اثرگذاری کمتری بر مهار خونریزیهای شریانی دیده شد(108). نسل دوم محصولات مبتنی بر کیتوسان، زخمپوش ChitoFlex است که موجب تسریع انعقاد خون میگردد؛ اما در زمان معرفی این محصول، برتری خاصی در نتیجه آزمایشهای انجامشده نسبت به سایر محصولات هموستاتیک موجود در بازار مشاهده نشد(127-33). سپس زخمپوشی به نام ChitoGauze به عنوان نسل سوم محصولات منعقدکننده مبتنی بر کیتوسان ارائه شد که اثرگذاری بالایی مشابه Combat Gauze داشت؛ البته ChitoGauze به علت زمان کمتری که برای انعقاد خون نیاز دارد و همچنین به دلیل حجم خونریزی کمتر با مصرف زخمپوش در مقایسه با Combat Gauze، بیشتر مورد استقبال قرار گرفت(128). محصول دیگری که مبتنی بر کیتوسان در سال 2006 ارائه شد، Celox نام داشت. Celox به دو شکل گرانول و گاز زخمپوش به بازار ارائه شد و در مطالعههای مختلف، اثر انعقادی آن تایید شده است(129-32). فرم گرانول این محصول به علت دشواری استفاده بر روی زخم در زیر باران، در باد شدید یا نور کم، امکان استفاده از آن را در شرایط اورژانسی یا جنگی سخت کرده است و زخمپوش گازیشکل این محصول (Celox Gauze) امکان کاربرد راحتتری دارد؛ بهطوری که بهعنوان زخمپوش منعقدکننده خون در نیروهای نظامی بریتانیا مورد استفاده قرار گرفته است(31).
بحث
خونریزیهای شدید میتوانند تهدیدکننده حیات انسان باشند و انسانها همواره به دنبال روشهایی برای بند آوردن خونریزی و حفظ جان خود در شرایط اورژانسی انواع تروما از جمله جراحات نظامی، تصادفات جادهای و عملهای جراحی بودهاند. این روشها به طور کلی شامل پوشاندن زخم و اعمال فشار بر آن بوده است؛ اما با توجه به عدم کارآیی این روشها در خونریزیهای شدید، تلاشها به سمت یافتن موادی جهت کمک به انعقاد سریعتر خون معطوف شد(7، 6). شروع استفاده از این مواد را میتوان از دهه 1880 میلادی با کاربرد موم عسل جهت پوشاندن زخمهای خونریزی دهنده دانست(76، 67). سپس انواع مواد منعقدکننده خون در قالب محصولات متنوعی معرفی و روانه بازار شدند. هر یک از این محصولات بر یک یا چند مرحله از مراحل سهگانه انعقاد خون(انقباض عروق، تشکیل میخ پلاکتی و ایجاد لخته فیبرینی محکم) اثر تحریکی دارند.
در این مطالعه، با مروری بر مطالعههای قبلی در حوزه انواع مواد و محصولات منعقدکننده خون، این مواد و محصولات با توجه به نحوه عملکرد و تاثیر آنها بر مراحل انعقاد خون در قالب 5 گروه اصلی شامل مواد انعقادی و پیش انعقادی، تغلیظکنندههای فاکتورهای انعقادی، بسترهای انعقادی و سدهای مکانیکی، مواد انعقادی فیزیولوژیک و مواد انعقادی شیمیایی دستهبندی شدهاند. هر یک از این مواد با توجه به کاربرد مورد نظر، مزایا و معایبی دارند که از نظر موارد مصرف و منع مصرف، عوارض جانبی و امکان استفاده راحت مقایسه شدهاند.
در مقایسه راحتی کاربرد بالینی این محصولات، به طور
کلی استفاده از مواد و محصولات گروه بسترهای انعقادی و سدهای مکانیکی در وهله اول و هم چنین گروه تغلیظکنندههای فاکتورهای انعقادی در وهله دوم، راحتتر و ارزانتر از سایر گروهها بوده و بنابراین در موارد استفاده انبوه از جمله کاربردهای نظامی و اورژانس حوادث بیشتر مورد استقبال بودهاند. در مقایسه مواد و محصولات از نظر قابلیت آن ها در کنترل خونریزیهای شدید، اغلب گروه مواد انعقادی و پیش انعقادی در صدر جدول قرار میگیرند. بنابراین در برخی خونریزی های شدید و یا شرایط اختلال انعقادی در بیماران، از محصولات انعقادی مؤثرتر به ویژه گروه مواد انعقادی و پیش انعقادی استفاده میشود که البته قیمت بالاتر و اغلب شرایط نگهداری سختتری دارند.
گروه مواد انعقادی فیزیولوژیک نیز اغلب به علت کاربرد سیستمیک در موارد کاربرد موضعی، اثرات سیستمیک بر تمام بدن داشته و در موارد جراحات موضعی کاربرد گستردهای ندارد و صرفاً در موارد سیستمیک استفاده میشوند. در طرف مقابل، گروه مواد انعقادی شیمیایی به علت ایجاد سوختگی بافتی، صرفاً در موارد موضعی و به صورت محدود کاربرد داشته و در کاربردهای سیستمیک استفاده نمیشوند.
در دهههای گذشته، توجه محققان بیشتر به سمت یافتن مواد انعقادی جدید در هر یک از این پنج گروه بوده است و محصولات انعقادی اغلب بر مبنای یک گروه از این مواد ساخته و به بازار عرضه میشدند. اما در سالهای اخیر، تمایل و توجه بیشتری به محصولات مبتنی بر ترکیب مواد انعقادی از چند گروه مختلف معطوف شده و کارآیی بیشتری از این محصولات ترکیبی گزارش شده است. از جمله این محصولات ترکیبی میتوان به Floseal، Surgiflo، Evarrest ، TachoSil و Vitagel اشاره کرد که در جداول 2 و 3 به ارائه جزئیاتی از مزایا و معایب آنها از نظر کاربرد بالینی و عوارض جانبی پرداخته شده است(16).
در سالهای اخیر تلاش محققان و شرکتها بر آن بوده که هر یک از محصولات انعقادی به فرمهای مختلف برای کاربردهای متنوع از جمله فرم زخم پوش برای جراحات سطحی، فرم گرانوله و سیال برای زخمهای عمقی یا جراحیهای داخلی و در قالب اپلیکاتور برای جراحیهای لاپاراسکوپیک به بازار عرضه شوند. در سالهای اخیر، نگاه ویژهای توسط شرکتها برای تولید مواد انعقادی شناخته شده در قالب فرمهای جدید و اختصاصی برای کاربردهای ویژه وجود داشته است.
از طرف دیگر با پیشرفتهای حوزه فناوری نانو در سالهای اخیر، استفاده از ظرفیتهای فناوری نانو از جمله ساخت نانو الیاف با تخلخل بالا به عنوان بستر مواد انعقادی زخم پوش موجب بهبود عملکرد زخمپوشها و دستیابی به روشهایی ارزان و در دسترس از جمله الکتروریسی برای ساخت این زخمپوشها شده است(163، 162، 16).
اخیراً در حوزه پژوهشی، ایالات متحده آمریکا در رده اول و چین در رده دوم از نظر تعداد مقالات چاپ شده در زمینه مواد منعقد کننده خون بودهاند. به طور کلی روند پژوهش و چاپ مقالات در این زمینه طی 20 سال گذشته روند صعودی داشته و پیشبینی میشود که پژوهشهای آینده بیشتر به بررسی کارآیی ترکیب چند ماه هموستاتیک، بررسی کارآیی فرمهای مختلف از یک ماده هموستاتیک و هم چنین انجام کارآزماییهای بالینی معتبر جهت تائید عملکردهای قبلی مواد هموستاتیک باشد.
نتیجهگیری
هر یک از مواد و محصولات منعقدکننده خون میتوانند با توجه به مکانیسم اثر خود فرآیند انعقاد خون و اثر بخشی خود در کنترل خونریزی در شرایطی ویژه از جمله تروماهای جنگی و غیرجنگی، جراحیها و سایر موارد اورژانس مؤثر باشند و شناخت خصوصیات هر ماده میتواند در کاربرد بالینی بهینه و کاهش عوارض جانبی مؤثر باشد. از طرفی در حوزه پژوهشی، ارائه دستهبندی جامعی از مواد هموستاتیک با تکیه بر فیزیولوژی انعقاد خون میتواند به شناخت کاملتر و دستهبندی ذهنی منظمتری از انواع مواد هموستاتیک جهت ادامه تحقیقات و پرکردن خلاهای علمی موجود، منجر شود.
تشکر و قدردانی
نویسندگان از همکاری و حمایتهای مادی و معنوی ستاد ویژه توسعه فناوری نانو کمال تقدیر و تشکر را دارند.
متن کامل: (20291 مشاهده)
مروری بر انواع مواد و محصولات مؤثر بر تسریع انعقاد خون
علی انصاری1، فاطمه خسرونژاد2، یوسف شلاگه3، ابوالفضل زارع4، شبنم افاقی5، مهدی حسنزاده6
چکیده
سابقه و هدف
خونریزی شدید، عامل بسیاری از مرگ و میرهای ناشی از تروماهای جنگی و غیر جنگی است؛ به طوری که حدود نیمی از موارد مرگ و میر ناشی از تصادفات به علت خونریزی شدید پیش از رسیدن به بیمارستان اتفاق میافتد. مهار خونریزی در موارد شدید، مستلزم استفاده از مواد مؤثر بر تسریع انعقاد خون(مواد هموستاتیک) است. هدف از این مطالعه، آشنایی با انواع مواد و محصولات منعقد کننده خون در مراحل تحقیقاتی تا تجاری و دستهبندی آنها از نظر مبانی فیزیولوژی انعقاد خون بود. بررسی و مقایسه هر یک از گروههای محصولات میتواند در جهت کاربرد بالینی بهینه این محصولات و نیز در انجام پژوهشهای اصیل در ادامه مطالعههای پیشین در این حوزه کمککننده باشد.
مواد و روشها
در این مطالعه مروری، جستجوی دادهها در پایگاههای معتبر علمی PubMed ، Scopus ، Sience Direct ، SID، Magiran و IranMedex بدون محدودیت تاریخ انتشار با ترکیب کلمات کلیدی مرتبط از جمله مواد منعقدکننده خون، خونریزی، زخم پوش و تروما انجام شد. مطالعههای مرتبط با بررسی چکیده مقالات توسط دو پژوهشگر به صورت مستقل انتخاب شدند.
یافتهها
در این مطالعه، با توجه به مبانی انعقاد خون، مواد و محصولات منعقدکننده خون بر مبنای مکانیسم عمل در قالب پنج گروه شامل(1) مواد انعقادی و پیشانعقادی، (2) تغلیظکنندههای فاکتورهای انعقادی، (3) بسترهای انعقادی مکانیکی، (4) مواد انعقادی فیزیولوژیک و (5) مواد انعقادی شیمیایی دستهبندی و مقایسه شدند.
نتیجه گیری
هر یک از محصولات منعقدکننده خون میتوانند با توجه به مکانیسم عمل و اثربخشی خود در کنترل خونریزی در شرایطی ویژه از جمله تروماهای جنگی و غیرجنگی و جراحیها مؤثر باشند.
کلمات کلیدی: مواد انعقادی، فاکتورهای انعقاد خون، زخمپوش، تروما
تاریخ دریافت: 25/09/1399
تاریخ پذیرش: 14/07/1400
1- دانشجوی دکترای عمومی پزشکی ـ دانشکده پزشکی دانشگاه علوم پزشکی شهید بهشتی و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
2- دانشجوی کارشناسی ارشد گرایش انتخاب و شناسایی مواد ـ دانشکده مهندسی و علم مواد دانشگاه صنعتی شریف و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
3- دانشجوی دکترای عمومی پزشکی ـ دانشکده پزشکی دانشگاه علوم پزشکی شهید بهشتی و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
4- دانشجوی کارشناسی ارشد گرایش استخراج فلزات ـ دانشکده مهندسی و علم مواد ـ دانشگاه تهران و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
5- دانشجوی کارشناسی مهندسی پزشکی ـ دانشکده مهندسی پزشکی دانشگاه صنعتی امیر کبیر و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
6- مؤلف مسئول: دکترای تخصصی مهندسی نساجی ـ استادیار دانشکده مهندسی نساجی ـ دانشگاه یزد ـ یزد ـ ایران ـ کدپستی: 8915818411
علی انصاری1، فاطمه خسرونژاد2، یوسف شلاگه3، ابوالفضل زارع4، شبنم افاقی5، مهدی حسنزاده6
چکیده
سابقه و هدف
خونریزی شدید، عامل بسیاری از مرگ و میرهای ناشی از تروماهای جنگی و غیر جنگی است؛ به طوری که حدود نیمی از موارد مرگ و میر ناشی از تصادفات به علت خونریزی شدید پیش از رسیدن به بیمارستان اتفاق میافتد. مهار خونریزی در موارد شدید، مستلزم استفاده از مواد مؤثر بر تسریع انعقاد خون(مواد هموستاتیک) است. هدف از این مطالعه، آشنایی با انواع مواد و محصولات منعقد کننده خون در مراحل تحقیقاتی تا تجاری و دستهبندی آنها از نظر مبانی فیزیولوژی انعقاد خون بود. بررسی و مقایسه هر یک از گروههای محصولات میتواند در جهت کاربرد بالینی بهینه این محصولات و نیز در انجام پژوهشهای اصیل در ادامه مطالعههای پیشین در این حوزه کمککننده باشد.
مواد و روشها
در این مطالعه مروری، جستجوی دادهها در پایگاههای معتبر علمی PubMed ، Scopus ، Sience Direct ، SID، Magiran و IranMedex بدون محدودیت تاریخ انتشار با ترکیب کلمات کلیدی مرتبط از جمله مواد منعقدکننده خون، خونریزی، زخم پوش و تروما انجام شد. مطالعههای مرتبط با بررسی چکیده مقالات توسط دو پژوهشگر به صورت مستقل انتخاب شدند.
یافتهها
در این مطالعه، با توجه به مبانی انعقاد خون، مواد و محصولات منعقدکننده خون بر مبنای مکانیسم عمل در قالب پنج گروه شامل(1) مواد انعقادی و پیشانعقادی، (2) تغلیظکنندههای فاکتورهای انعقادی، (3) بسترهای انعقادی مکانیکی، (4) مواد انعقادی فیزیولوژیک و (5) مواد انعقادی شیمیایی دستهبندی و مقایسه شدند.
نتیجه گیری
هر یک از محصولات منعقدکننده خون میتوانند با توجه به مکانیسم عمل و اثربخشی خود در کنترل خونریزی در شرایطی ویژه از جمله تروماهای جنگی و غیرجنگی و جراحیها مؤثر باشند.
کلمات کلیدی: مواد انعقادی، فاکتورهای انعقاد خون، زخمپوش، تروما
تاریخ دریافت: 25/09/1399
تاریخ پذیرش: 14/07/1400
1- دانشجوی دکترای عمومی پزشکی ـ دانشکده پزشکی دانشگاه علوم پزشکی شهید بهشتی و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
2- دانشجوی کارشناسی ارشد گرایش انتخاب و شناسایی مواد ـ دانشکده مهندسی و علم مواد دانشگاه صنعتی شریف و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
3- دانشجوی دکترای عمومی پزشکی ـ دانشکده پزشکی دانشگاه علوم پزشکی شهید بهشتی و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
4- دانشجوی کارشناسی ارشد گرایش استخراج فلزات ـ دانشکده مهندسی و علم مواد ـ دانشگاه تهران و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
5- دانشجوی کارشناسی مهندسی پزشکی ـ دانشکده مهندسی پزشکی دانشگاه صنعتی امیر کبیر و کانون برگزیدگان باشگاه نانو ـ تهران ـ ایران
6- مؤلف مسئول: دکترای تخصصی مهندسی نساجی ـ استادیار دانشکده مهندسی نساجی ـ دانشگاه یزد ـ یزد ـ ایران ـ کدپستی: 8915818411
مقدمه
توقف سریع خونریزی در جراحات عمیق، مسأله مهمی در حفظ حیات فرد آسیبدیده است؛ به طوری که از دست رفتن شدید خون ممکن است حتی منجر به مرگ افراد شود. خونریزیهای کنترل نشده یکی از مهمترین عوامل مرگ و میر در اثر آسیبهای جنگی و غیر جنگی به شمار میرود. 50 درصد از افرادی که در اثر صدمه دیدن پیش از رسیدن به بیمارستان میمیرند، به دلیل خونریزیهای شدید جان خود را از دست میدهند(2، 1). در میان مصدومان تصادفات جادهای نیز 80 درصد قربانیان به دلیل خونریزی جانشان را از دست میدهند(3). همچنین، دومین دلیل اصلی مرگ و میر در بیمارستانها، خونریزی در بیماران است(4). نکته قابل توجه این است که بسیاری از این مرگها، با روشهای سادهای مانند پوشاندن زخم و جلوگیری از خونریزی قابل پیشگیری هستند.
از گذشته تاکنون از مواد مختلفی به منظور پوشاندن زخم استفاده شده است که از آن جمله میتوان به مواد طبیعی نظیر کتان، کنف، پشم، چربیهای حیوانی، عسل، موم زنبور و چای سبز اشاره کرد(7-5). اکثر این زخم پوشها به دلیل جذب ترشحات زخم و چسبیدن به محل زخم، سبب التهاب و عفونت و درنتیجه کندشدن روند ترمیم زخم میشوند(10-8). همچنین روشهای قدیمی کنترل خونریزی که مبتنی بر اعمال فشار بر روی زخم هستند مانند استفاده از تورنیکه یا زخمبند(تسمه یا نواری که دور عضوی بسته میشود تا مانع عبور خون گردد)، پانسمان فشاری و بخیهزدن، در مواقعی که زخم سطحی وسیع بوده و فشار آوردن به تنهایی نتواند خونریزی را متوقف کند، کاربرد چندانی نخواهند داشت. امروزه با توسعه پلیمرهای زیستی جدید و توسعه روشهای ساخت پانسمانهای جدید، امکان بهبود سریعتر و کاهش احتمال عفونت زخم فراهم شده است(11، 10). با این وجود محدودیت اصلی این پانسمانها، عدم توانایی آنها برای جلوگیری از خونریزی در زمان کوتاه و شرایط بحرانی میباشد. به منظور رفع این مشکلات، محققان از مواد مختلفی مانند کیتوسان، ژلاتین، کراتین، کتیرا و پلی وینیل الکل (PolyVinyl Alcohol, PVA) کـه از طریـق تأثیـر بــر
مراحل مختلفی از انعقاد خون، توانایی تسریع در فرآیند انعقاد خون را دارند استفاده کردهاند(15-9). این مواد انعقادی تاکنون در کاربردهای مختلفی از جمله اورژانسهای تروما، جراحیها و نیز در کاربردهای نظامی به طور گسترده و پیشرو در حال تکامل و استفاده بودهاند(21-16). شناخت مبانی فیزیولوژی انعقاد خون در بدن انسان میتواند در جهت شناخت مکانیسم دقیق عملکرد این مواد و یافتن انواع دیگری از این مواد منعقدکننده خون کمککننده باشد.
به طور کلی دو نوع ماده اصلی در فرآیند انعقاد خون نقش دارند. دسته اول پروکوآگولانتها(ProCoagulants) هستند که سبب پیشبرد فرآیند انعقاد خون میشوند و دسته دوم موادی که سبب مهار انعقاد خون میگردند و ضد انعقاد(AntiCoagulants) نام دارند. تعادل بین این دو دسته مواد در حالت طبیعی در خون به گونهای است که غلظت مواد آنتیکوآگولانت بر غلظت مواد پروکوآگولانت غالب است. میزان پروکوآگولانتها معمولاً به دنبال آسیب بافتی زیاد میشود و با به هم خوردن تعادل طبیعی، فرآیند تشکیل لخته(هموستاز) آغاز میگردد(22). هرگاه یک رگ خونی در محل آسیب بافتی، دچار آسیب یا پارگی شود، هموستاز با چند مکانیسم عمده به ترتیب زیر صورت میگیرد: 1- انقباض رگ، 2- تشکیل میخ پلاکتی، 3- تشکیل لخته خونی و در نتیجه انعقاد خون و 4- استحکام لخته خون و مهار جریان خونریزی(22، 16). در واقع به دنبال آسیب عروقی و شروع خونریزی، به ترتیب مراحل انقباض دیواره عروق جهت کاهش جریان خون در محل، چسبندگی(Adhesion) پلاکتها به دیواره آسیبدیده عروق، فعال شدن پلاکتها و تجمع(Aggregation) آنها در کنار هم اتفاق میافتد و به تشکیل میخ پلاکتی(Platelet Plug) اولیه منجر میشود(23). این میخ پلاکتی استحکام کافی جهت مهار جریان خونریزی را ندارد. بنابراین شبکهای تور مانند از رشتههای پروتئین فیبرین در اطراف پلاکتها تشکیل شده و لختهای مستحکم ایجاد میشود. در واقع به دنبال آسیب عروقی و آزاد شدن برخی مواد شیمیایی، آبشاری از فاکتورهای انعقادی در قالب دو مسیر داخلی و خارجی انعقاد به دنبال یکدیگر فعال شده و در نهایت از طریق مسیر مشترک به تشکیل شبکه فیبرینی منجر میشود(24، 16). مانند کیتوسان و ژلاتین که بر فرآیند انعقاد خون مؤثرند و در قالب زخمپوشها و مواد منعقدکننده موضعی خون قابل استفاده هستند. معیارهای انتخاب مواد منعقدکننده خون شامل: 1- شروع اثر فوری برای مهار انواع خونریزی شریانی ویا وریدی (در کم تر از 2 دقیقه)، 2- زیستسازگاری (عدم سمیت و حساسیتزایی موضعی ویا سیستمیک)، 3- عدم ایجاد درد یا آسیب حرارتی در موضع، 4- قابلیت قراردادن و برداشتن آسان در محل زخم، 5- اثر انعقادی قوی بر زخمهایی که حتی اثر فشاری تورنیکه نیز بر آنها موثر نیست، 6- پایداری و امکان نگهداری طولانی، 7- صرفهی اقتصادی و 8- زیستتخریبپذیری میباشد(26، 25)؛ بنابراین شناخت دقیق خصوصیات هریک از مواد در جهت انتخاب به عنوان منعقدکننده خون بر طبق معیارهای مطرح شده ضروری و مورد نیاز است.
در مطالعه پیش رو، انواع مواد دارای قابلیت انعقاد خون که تاکنون معرفی و استفاده شدهاند، مورد بررسی قرار میگیرند تا با شناخت مزایا و معایب هر یک، دید بهتری برای انتخاب مواد انعقادی و معرفی مواد جدید برطبق معیارهای مطرح شده به مخاطب ارائه شود.
مواد و روشها
در این مطالعه مروری، جستجوی دادهها در پایگاههای معتبر علمی PubMed، Scopus، Sience Direct، SID، Magiran و IranMedex بدون محدودیت تاریخ انتشار و نوع مطالعه با ترکیب کلمات کلیدی مرتبط با موضوع مواد و محصولات منعقد کننده خون انجام شد. کلمات کلیدی مورد جستجو شامل: مواد منعقدکننده خون، خونریزی، زخمپوش، زخم، پانسمان، تروما، ترومای جنگی و ترومای غیر جنگی بودند. همچنین جستجوی مطالعهها با کلید واژه نامهای اختصاصی مواد و محصولات هموستاتیک از جمله CombatGauze، Celox، HemCon، Chitosan، ترومبین، فیبرین و غیره انجام شد. از مقالات معتبر رفرانس داده شده در مقالات اصیل یافت شده نیز استفاده شد. مطالعههای مرتبط با بررسی چکیده مقالات توسط دو پژوهشگر به صورت مستقل انتخاب شدند. مطالعههای انتخاب شده در هر دو حوزه مطالعههای انسانی و مطالعه مدلهای حیوانی بود. بیشتر مقالات مرور شده به زبان انگلیسی بوده و از تعدادی از مطالعههای فارسی مرتبط با این حوزه نیز استفاده شد. در نهایت از میان بیش از 360 مقاله اولیه مورد بررسی، 110 مقاله انتخاب شده و مورد مرور نتایج قرار گرفتند.
یافتهها
با توجه به مبانی انعقاد خون، مواد مختلفی که به طور مستقیم یا غیر مستقیم بتوانند بر یک یا چند مرحله از مراحل انعقاد خون تاثیر مثبت بگذارند، قابلیت استفاده به عنوان منعقد کننده خون را دارند. این مواد به طور کلی بر مبنای نحوه عملکرد و تاثیر بر مراحل هموستاز به 5 دسته تقسیم میشوند: 1- عوامل انعقادی و پیش انعقادی، 2- مواد تغلیظکننده فاکتورهای انعقادی، 3- مواد ایجاد کننده سد مکانیکی در برابر جریان خون 4- مواد انعقادی فیزیولوژیک 5- سایر مواد شیمیایی انعقادی(شکل 1 و جداول 5-1). در ادامه به تشریح هر یک از پنج دسته مواد انعقادی و ارائه مثالهای مرتبط پرداخته میشود.
عوامل انعقادی و پیشانعقادی:
این دسته از مواد، یا با تأثیر مستقیم بر فاکتورهای آبشار انعقادی بدن فرد آسیب دیده و فعالسازی این فاکتورها عمل کرده(عوامل پیشانعقادی) و یا خود به عنوان فاکتور انعقادی در مسیرهای آبشار انعقادی ایفای نقش میکنند(عوامل انعقادی)(27). از جمله عوامل پیشانعقادی که تاکنون برای بندآوردن خونریزی استفاده شدهاند میتوان به کائولن اشاره کرد. کائولن، سیلیکات آلومینیومی است که با تأثیر قوی بر فعالسازی مسیر داخلی آبشار انعقادی (خصوصاً از طریق فعالسازی فاکتور 12) باعث تسریع روند انعقاد خون در زخم میشود. برای مثال، محصولی به نام QuickClot Combat Gauze از زخم پوش پلیاستری حاوی کائولن ساخته شده است که حدود سه دقیقه پس از قرار دادن آن بر روی زخـم به همراه اعمال فشار مستقیم با دست میتواند موجب بند آمدن خونریزی شود(30-26).

این محصول در سال 2008 توسط کمیته مراقبت از تلفات مبارزه تاکتیکی CoTCCC (Committee on Tactical Combat Casualty Care) به عنوان خط اول درمان خونریزیهای شدیدی که به بستن تورنیکه پاسخ نمیدهند، انتخاب شد و همچنان به عنوان یکی از زخمپوشهای منعقدکننده خون توسط ارتش امریکا مورد استفاده است (32، 31، 28). در مطالعهای توسط آرنود و همکارانش در سال 2009 در مقایسه 10 نوع ماده منعقدکننده خون، QuickClot جزو 4 محصول برتر از نظر کاهش حجم خونریزی و افزایش بقای جاندار نشـان داده
شد(33).
در مطالعـه دیگـری کـه توسط خیرآبادی و همکارانش
در سال 2009 ، درباره مقایسه عملکرد 4 نوع زخمپوش منعقدکننده خون شامل HemCon، Celox، TraumaStat، QuickClot و گـاز معمولـی بـر روی مـدل خوکی خونریزی شریانی انجام شد، نتایج نشان داد که زخمپوش QuickClot بهترین کارآیی را از نظر کاهش حجم خون از دست رفته، افزایش میزان بقای جاندار و حفظ میانگین فشار خون پس از جراحت در جاندار، در میان این 4 محصول داشت(34). مشاهده شده است که تأثیر Combat Gauze در مهار خونریزی اندامها و سر و گردن بیشتر از خونریزیهای تنهای است(35). در بـرخی افـراد کـه دچـار بیمـاریهای انعقادی دائمی هستند و یا در برخی شرایطگذرا از جمله اختلال انعقادی ناشی از تروما (Trauma Induced Coagulopathy, TIC)، خونریزی شدید و از دست دادن پلاکتها و فاکتورهای انعقادی، هیپوترمی(کاهش دمای مرکزی بدن به کمتر از °C 35)، اسیدوز، افزایش تخریب لخته خونی (هیپرفیبرینولیز) و اختلال الکترولیتی، سیستم انعقادی بدن دچار اختلال شده و استفاده از مواد پیشانعقادی ممکن است تاثیر مطلوب بر روند انعقاد خون نداشته باشد(37، 36). زیرا سیستم انعقادی خود فرد دچار اختلال گشته و فاکتورهای انعقادی قابلیت فعالسازی توسط مواد پیشانعقادی را ندارند(38). در چنین شرایطی لازم است از مواد انعقادی بهجای مواد پیشانعقادی استفاده گردد. در این میان میتوان محصولات هموستاتیک حاوی موادی مانند ترومبین، فیبرینوژن، فاکتور 7، 8 و یا کلسیم را نام برد (38). نشان داده شده است که QuickClot در این شرایط از جمله هیپوترمی مؤثرتر از پانسمان گاز معمولی بوده است؛ ولی تاثیر کمتری نسبت به محصولات مبتنی بر عوامل انعقادی ازجمله ترومبین و فیبرینوژن داشته است (42-39). از جمله عوامل انعقادی مؤثر بر بند آوردن خونریزی، ترومبین میباشد. ترومبین از طریق مکانیسمهای انعقادی مختلفی از جمله تبدیل فیبرینوژن به فیبرین، فعالسازی فاکتور 5، 8 و 11 و همچنین تحریک چسبندگی و تجمع پلاکتها بهسرعت موجب انعقاد خون میشود(45-43). ترومبین به دلیل عملکرد در مرحله آخر آبشار انعقادی(تبدیل فیبرینوژن به فیبرین) و عدم وابستگی به مراحل قبلی آبشار، در بیمارانی که به دلیل مصرف داروهای ضد انعقادی و یا بیماری انعقادی دچار اختلال عملکرد فاکتورهای انعقادی هستند نیز کاربرد دارد(46).
ترومبین جهت استفاده در محصولات منعقدکننده خون از منشا حیوانی یا انسانی و یا ترومبین نوترکیب استحصال میشود. ترومبین گاوی از حدود 60 سال پیش به عنوان ماده هموستاتیک موضعی استفاده میشده است اما به علت حساسیتزایی و تحریک سیستم ایمنی انسان و عوارض ناشی از آن، هشدار خطر در مورد عوارض مصرف آن توسط سازمان غذا و دارو ارائه شده است(50-46).
سپس استفاده از ترومبین انسانی مطرح شد که احتمال انتقال برخی از بیماریهای ویروسی از فرد دهنده به گیرنده را به دنبال دارد. ترومبین نوترکیب عوارض کمتری نسبت به انواع حیوانی و انسانی دارد(51).
از جمله محصولات مبتنی بر ترومبین میتوان به THROMBIN-JMI (ترومبین گاوی)، EVITHROM (ترومبین انسانی) و RECOTHROM (ترومبین نوترکیب) اشاره کرد(48). ازجمله محدودیتهای ترومبین، پایداری نسبتاً کم در دمای محیط و دماهای بالاتر است. برای مثال، EVITHROM حداکثر به مدت 1 ساعت در دمای اتاق و حداکثر 10 دقیقه در دمای37 درجه سانتیگراد پایدار است و بنابراین باید در فریزر نگهداری شود(48).
در مطالعههای اخیر، اثر بخشی ترکیبی از ترومبین و نوعی فاکتور بافتی نوترکیب(TT-173) در مهار خونریزی جراحی تعویض کامل مفصل زانو در مدل حیوانی گوسفند و همچنین مهار خونریزی کبدی در مدل حیوانی خوکی بیشتر از اثر انعقادی ترومبین به تنهایی گزارش شده است(53، 52). در مطالعه منتشر شده در سال 2021، تاثیر ترومبین موضعی در مهار خونریزی طی جراحی آرتروپلاستی کامل مفصل شانه برابر با تاثیر هموستاتیک ترانگزامیک اسید وریدی گزارش شده و در نتیجه ترومبین موضعی بهعنوان جایگزینی برای ترانگزامیکاسید در موارد منع مصرف ترانگزامیک اسید پیشنهاد شده است(54).

مواد تغلیظکننده فاکتورهای انعقادی:
این دسته از مواد از طریق جذب سریع محتوای آب موجود در خون و درنتیجه افزایش غلظت فاکتورهای انعقادی موجود در خون فرد و افزایش تراکم پلاکتها، موجب تسریع روند انعقاد خون میشوند(جدول 2). از جمله مواد مبتنی بر این مکانیسم میتوان زئولیتها و ساختارهای پلیساکاریدی میکرو متخلخل حاصل از نشاسته گیاهی (MPH: Microporous Polysaccharide Hemospheres) را بیان کرد. برای مثال محصول QuickClot Combat Gauze (Z-Medica) از گرانولهای زئولیتی ساخته شده و در سال 2002 تاییدیه FDA را دریافت کرد(55). زئولیتها طی واکنشی گرامازا، آب را جذب میکنند. از آنجایی که گرمای تولید شده میتواند موجب آسیب بافتی موضعی و حتی ترومبوز عروقی گردد، این محصول در سال 2008 توسط CoTCCC کنار گذاشته شد(57، 56). برخلاف این محصول، ساختارهای میکرومتخلخل نشاسته میتوانند بدون تولید گرما، آب محیط را جذب کنند و بدون آسیب حرارتی به بافت، موجب تغلیظ فاکتورهای انعقادی، افزایش تراکم سلولهای انعقادی و همچنین ایجاد بستری ژل مانند جهت تشکیل شبکه فیبرینی شوند(60-58). بنابراین از طریق دو مکانیسم تغلیظ فاکتورها و ایجاد بستر مکانیکی عمل میکنند. از دیگر مزایای این مواد، زیستسازگاری، عدم سمیت و عدم حساسیتزایی است(48). این مواد در بدن پس از حدود 48 ساعت، جذب شده و یا با آنزیم آمیلاز و پیراز موجود در سرم تجزیه میشوند(61).
از محصولات مبتنی بر MPH میتوان به PerClot به صورت اپلیکاتور از پیش آماده، PerClot Laparoscopic به صورت اپلیکاتور دارای کاتتر بلند و نازک(قطر مقطع mm 5) برای استفاده در جراحیهای لاپاروسکوپیک و همچنین EndoClot PHS به صورت اپلیکاتور حاوی کاتتر جهت استفاده در حین اندوسکوپی برای مهار خونریزیهای لوله گوارشی اشاره کرد(48). در مطالعه آلام و همکارانش (2003)، در مقایسه اثر هموستاتیک QuickClot، TraumaDEX (محصول مبتنی بر MPH) و گاز معمولی، در مدل خوکی خونریزی شدید شریان و ورید فمورال، TraumaDEX اثر کمتری نسبت به QuickClot و اثر بیشتری نسبت به گاز معمولی داشت(62).

در مطالعه دیگری بر مقایسه اثر هموستاتیک TraumaDEX و Celox در مدل خوکی خونریزی شدید شریان و ورید فمورال، حجم خونریزی به دنبال مصرف هر یک از دو نوع ماده منعقدکننده خون کاهش یافت، اما تفاوت معناداری بین میزان اثر TraumaDEX و Celox مشاهده نشد(63). البته این مطالعهها به صورت محدود و با حجم نمونه کم انجام شدهاند و برای اظهار نظر دقیقتر در مورد مقایسه اثر انعقادی این محصولات به مطالعات بیشتر در سطوح شواهد بالاتر نیاز است. انواعی دیگر از محصولات مبتنی بر ژلاتین ساخته شدهاند که بیشتر از طریق مکانیسم جذب آب و تغلیظ سلولهای خونی و فاکتورهای انعقادی عمل میکنند(65، 64، 46). هر چند که معمولاً مواد انعقادی و پیش انعقادی از جمله ترومبین نیز در ترکیب با ژلاتین قرار داده میشود تا از ترکیبی از مکانیسمهای انعقادی برای تسریع روند انعقاد خون استفاده شود(66، 46). اسفنج ژلاتینی قابلیت جذب آب معادل 35 تا 45 برابر وزن خود را دارد که همین امر علاوه بر تغلیظ فاکتورهای انعقادی، موجب افزایش حجم ژلاتین و ایجاد فشار و مانع مکانیکی موضعی در برابر جریان خونریزی میشود. ژلاتین ترکیبی آبدوست، غیرمحرک، غیرسمی و غیرحساسیتزا بوده و پس از استفاده معمولاً طی 4 تا 6 هفته قابل جذب است (67، 46). محصول GELFOAM در سال 1945 و محصول SURGIFOAM در سال 1983 با ترکیب ژلاتین حاصل از پوست خوک ساخته شدند(68، 66). همچنین محصول GELFOAM PLUS ، شامل پودر ترومبین انسانی جهت ترکیب با آب و آغشته کردن GELFOAM به آن است تا عملکرد انعقادی ترومبین نیز به عملکرد ژلاتین افزوده گردد(69). محصولاتی نیز به صورت سیال از جمله FLOSEAL و SURGIFLO از ترکیب ژلاتین و ترومبین جهت تسریع انعقاد خون ساخته و به بازار عرضه شدهاند(71، 70، 48). کاربرد FLOSEAL در جراحی اندومتریوما موجب بهبود کنترل خونریزی حسن جراحی و نیز بازگشت عملکرد تخمدان پس از جراحی شده است (72، 18). در مطالعههای جدیدتر، ترکیبی از ژلاتین و ترانسگلوتامیناز میکروبی با قابلیت ایجاد اتصالات عرضی بیشتر و مستحکمتر بین اجزای ژلاتینی در مقایسه با SURGIFLO معرفی شده است(73). باید توجه داشت که میزان جذب آب و افزایش حجم ژلاتین در مقایسه با کیتوسان و سلولز بیشتر است که از یک طرف موجب افزایش اثر هموستاتیک مکانیکی شده و از طرف دیگر عوارض فشاری بر بافتهای اطراف را نیز به دنبال دارد (74).
مواد ایجاد کننده بستر انعقادی و یا سد مکانیکی در برابر جریان خون:
این دسته از مواد با چسبیدن به بافتهای اطراف محل خونریزی و ایجاد یک سد مکانیکی در برابر جریان خون، موجب مهار جریان خون به سمت خارج از عروق میشوند(69)؛ بنابراین انعقاد خون به دنبال استفاده از این مواد، مستلزم عملکرد کامل سیستم انعقادی بدن فرد شامل اتصال و تجمع پلاکتها و آبشار انعقادی نیز میباشد(75، 45، 43). به طور کلی استفاده از این گروه از مواد و محصولات هموستاتیک، راحتتر و ارزانتر از سایر گروههـا و معمـولاً نیازمنـد فشار موضعی با دست میباشد
(46). در سال 1886، برای اولین بار از ترکیب موم عسل، سالیسیلیک اسید و روغن بادام برای مهار خونریزی از جمجمه سگ استفاده شد(76، 67). سپس ترکیبات جدیدتری مبتنی بر موم عسل و با تفاوت در چربی اضافه شده به آن(پارافین، ایزوپروپیل پالمیتات و غیره) نیز مورد استفاده قرار گرفتند. این ترکیبات اغلب برای مهار خونریزی استخوانی استفاده میشوند که از طریق انسداد مکانیکی کانالهای استخوانی و انسداد مسیر خونریزی عمل میکنند(77، 46). برای مثال میتوان محصولی به نام Bone Wax که دارای تاییدیه FDA برای مهار خونریزیهای استخوانی و جراحیهای پوست میباشد، را نام برد. این محصول، نامحلول بوده و به مدت طولانی در محل مورد استفاده در جراحی باقی میماند و موجب تحریک دستگاه ایمنی ذاتی و فعال شدن فاگوسیتها و به دنبال آن ایجاد عوارض خفیف تا شدیدی(بسته به محل و نوع جراحی) از جمله اختلال در تولید و ترمیم استخوان و همچنین تشکیل گرانولوما در محل استفاده میشود(83-78).





به همین دلیل، در سال 2001، محصول جدیدتری به نام Ostene که حاوی کوپلیمر آلکیلناکسید بود به بازار معرفی شد(84). این ترکیب محلول در آب، قابل جذب و قابل دفع از طریق ادرار بوده و عوارض Bone Wax را به دنبال نداشت(86، 85، 67).
اکسید سلولز در سال 1942 برای اولین بار به عنوان ماده منعقد کننده خون معرفی شد(87). الیاف اکسید سلولز به عنوان بستری برای شروع فرآیند انعقاد و همچنین به صورت یک سد مکانیکی عمل میکنند(64، 60). همچنین pH اسیدی اکسید سلولز از طرفی موجب اثرات سوزاننده موضعی و نکروز انعقادی و در نتیجه کمک به مهار خونریزی میشود و از طرف دیگر باعث غیر فعال شدن برخی از فاکتورهای انعقادی بدن و تضعیف سیستم انعقادی میگردد(77، 69). اسیدیته اکسید سلولز همچنین با اثر باکتریوستاتیک موضعی از رشد انواعی از باکتریهای گرم مثبت و گرم منفی جلوگیری میکند(89، 88، 60). اکسید سلولز پس از استفاده در موضع معمولاً پس از 2 تا 6 هفته به طور کامل جذب میشود(90- 59). معایب محصولات مبتنی بر اکسید سلولز نیز به دلیل جذب ناکامل از موضع، سوختگی موضعی، التهاب و تشکیل گرانولوما میباشد (94-91). محصولات مختلفی از جمله SURGICEL، SURGICEL NUKNIT، SURGICEL FIBRILLAR و SURGICEL SNOW برمبنای اکسید سلولز ساخته و عرضه شدهاند(95). محصول WoundClot نیز حاوی الیاف سلولز اکسید نشده درون ژلاتین است و از مکانیسم جذب آب ژلاتین به میزان 25 برابر وزن آن و در نتیجه تغلیظ فاکتورهای انعقادی استفاده میکند(61). در مطالعهای، در مقایسه اثر محصولات هموستاتیک موضعی شامل فرم پودر و اسفنج Cutanoplast (مبتنی بر ژلاتین) و فرم زخمپوش Emoist (مبتنی بر اکسید سلولز)، نشان داده شد که هر دو این محصولات در کنترل خونریزیهای احشای داخلی بدن مؤثر هستند (64).  بسیاری دیگر از محصولات مبتنی بر این مکانیسم، حاوی کیتوسان هستند. کیتوسان پلیساکاریدی حاصل از فرآیند استیلزدایی(Deacetylation) کیتین موجود در اسکلت خارجی سختپوستان(مانند خرچنگ) است و بعد از سلولز، به عنوان فراوانترین پلیساکارید موجود در طبیعت شناخته میشود(96). کیتوسان ترکیبی زیست سازگار، زیست تخریبپذیر، ضدباکتری و ضد قارچ، ضد سرطان، مؤثر در تسریع فرآیند انعقاد خون، ترمیم زخم(111، 110، 106) و بازسازی بافتها، آنتیاکسیدان و همچنین دارای خاصیت ضددردی موضعی است(شکل 2)(118-97).
بسیاری دیگر از محصولات مبتنی بر این مکانیسم، حاوی کیتوسان هستند. کیتوسان پلیساکاریدی حاصل از فرآیند استیلزدایی(Deacetylation) کیتین موجود در اسکلت خارجی سختپوستان(مانند خرچنگ) است و بعد از سلولز، به عنوان فراوانترین پلیساکارید موجود در طبیعت شناخته میشود(96). کیتوسان ترکیبی زیست سازگار، زیست تخریبپذیر، ضدباکتری و ضد قارچ، ضد سرطان، مؤثر در تسریع فرآیند انعقاد خون، ترمیم زخم(111، 110، 106) و بازسازی بافتها، آنتیاکسیدان و همچنین دارای خاصیت ضددردی موضعی است(شکل 2)(118-97).
شکل 2: تصویر شماتیک اثرات کیتوسان بر زخم(10)
این ویژگیها وابسته به درجه داستیلاسیون و وزن مولکولی کیتوسان متغیر است(96). کیتوسان اثر انعقادی مستقیم بر مراحل انعقاد خون ندارد؛ بلکه در اثر ایجاد پیوند الکترواستاتیکی بین بارهای مثبت زنجیرههای پلیمری کیتوسان و بار منفی سطح غشای گلبولهای قرمز و پلاکتهای خون، موجب ایجاد یک سد مکانیکی ژل مانند در برابر جریان خون میشود(121-96). اتصال کیتوسان به سطوح مخاطی نیز بر همین اساس است؛ به طوریکه پیوند الکترواستاتیک بین بارهای مثبت کیتوسان و بارهای منفی گلیکوپروتئین موسین موجود در سطوح مخاطی صورت میگیرد(122، 96). به دلیل همین مکانیسم مستقل از مسیرهای انعقادی بدن، مشاهده شده است که کیتوسان بر تسریع فرآیند انعقاد خون در مدلهای موشی دارای اختلال انعقادی از جمله در مهار خونریزی شریانی موشهای هیپوترم دریافتکننده وارفارین و همچنین مهار خونریزی کبدی موشهای دریافتکننده هپارین سیستمیک مؤثر است(124، 123). در مطالعه بر روی یکی از اولین زخمپوشهای مبتنی بر کیتوسان به نام HemCon، نشان داده شد که این محصول موجب کاهش خونریزی در مدل خوکی خونریزی وریدی و کبدی میشود؛ اما اثرگذاری کمتری بر مهار خونریزیهای شریانی دیده شد(108). نسل دوم محصولات مبتنی بر کیتوسان، زخمپوش ChitoFlex است که موجب تسریع انعقاد خون میگردد؛ اما در زمان معرفی این محصول، برتری خاصی در نتیجه آزمایشهای انجامشده نسبت به سایر محصولات هموستاتیک موجود در بازار مشاهده نشد(127-33). سپس زخمپوشی به نام ChitoGauze به عنوان نسل سوم محصولات منعقدکننده مبتنی بر کیتوسان ارائه شد که اثرگذاری بالایی مشابه Combat Gauze داشت؛ البته ChitoGauze به علت زمان کمتری که برای انعقاد خون نیاز دارد و همچنین به دلیل حجم خونریزی کمتر با مصرف زخمپوش در مقایسه با Combat Gauze، بیشتر مورد استقبال قرار گرفت(128). محصول دیگری که مبتنی بر کیتوسان در سال 2006 ارائه شد، Celox نام داشت. Celox به دو شکل گرانول و گاز زخمپوش به بازار ارائه شد و در مطالعههای مختلف، اثر انعقادی آن تایید شده است(129-32). فرم گرانول این محصول به علت دشواری استفاده بر روی زخم در زیر باران، در باد شدید یا نور کم، امکان استفاده از آن را در شرایط اورژانسی یا جنگی سخت کرده است و زخمپوش گازیشکل این محصول (Celox Gauze) امکان کاربرد راحتتری دارد؛ بهطوری که بهعنوان زخمپوش منعقدکننده خون در نیروهای نظامی بریتانیا مورد استفاده قرار گرفته است(31).
بحث
خونریزیهای شدید میتوانند تهدیدکننده حیات انسان باشند و انسانها همواره به دنبال روشهایی برای بند آوردن خونریزی و حفظ جان خود در شرایط اورژانسی انواع تروما از جمله جراحات نظامی، تصادفات جادهای و عملهای جراحی بودهاند. این روشها به طور کلی شامل پوشاندن زخم و اعمال فشار بر آن بوده است؛ اما با توجه به عدم کارآیی این روشها در خونریزیهای شدید، تلاشها به سمت یافتن موادی جهت کمک به انعقاد سریعتر خون معطوف شد(7، 6). شروع استفاده از این مواد را میتوان از دهه 1880 میلادی با کاربرد موم عسل جهت پوشاندن زخمهای خونریزی دهنده دانست(76، 67). سپس انواع مواد منعقدکننده خون در قالب محصولات متنوعی معرفی و روانه بازار شدند. هر یک از این محصولات بر یک یا چند مرحله از مراحل سهگانه انعقاد خون(انقباض عروق، تشکیل میخ پلاکتی و ایجاد لخته فیبرینی محکم) اثر تحریکی دارند.
در این مطالعه، با مروری بر مطالعههای قبلی در حوزه انواع مواد و محصولات منعقدکننده خون، این مواد و محصولات با توجه به نحوه عملکرد و تاثیر آنها بر مراحل انعقاد خون در قالب 5 گروه اصلی شامل مواد انعقادی و پیش انعقادی، تغلیظکنندههای فاکتورهای انعقادی، بسترهای انعقادی و سدهای مکانیکی، مواد انعقادی فیزیولوژیک و مواد انعقادی شیمیایی دستهبندی شدهاند. هر یک از این مواد با توجه به کاربرد مورد نظر، مزایا و معایبی دارند که از نظر موارد مصرف و منع مصرف، عوارض جانبی و امکان استفاده راحت مقایسه شدهاند.
در مقایسه راحتی کاربرد بالینی این محصولات، به طور
کلی استفاده از مواد و محصولات گروه بسترهای انعقادی و سدهای مکانیکی در وهله اول و هم چنین گروه تغلیظکنندههای فاکتورهای انعقادی در وهله دوم، راحتتر و ارزانتر از سایر گروهها بوده و بنابراین در موارد استفاده انبوه از جمله کاربردهای نظامی و اورژانس حوادث بیشتر مورد استقبال بودهاند. در مقایسه مواد و محصولات از نظر قابلیت آن ها در کنترل خونریزیهای شدید، اغلب گروه مواد انعقادی و پیش انعقادی در صدر جدول قرار میگیرند. بنابراین در برخی خونریزی های شدید و یا شرایط اختلال انعقادی در بیماران، از محصولات انعقادی مؤثرتر به ویژه گروه مواد انعقادی و پیش انعقادی استفاده میشود که البته قیمت بالاتر و اغلب شرایط نگهداری سختتری دارند.
گروه مواد انعقادی فیزیولوژیک نیز اغلب به علت کاربرد سیستمیک در موارد کاربرد موضعی، اثرات سیستمیک بر تمام بدن داشته و در موارد جراحات موضعی کاربرد گستردهای ندارد و صرفاً در موارد سیستمیک استفاده میشوند. در طرف مقابل، گروه مواد انعقادی شیمیایی به علت ایجاد سوختگی بافتی، صرفاً در موارد موضعی و به صورت محدود کاربرد داشته و در کاربردهای سیستمیک استفاده نمیشوند.
در دهههای گذشته، توجه محققان بیشتر به سمت یافتن مواد انعقادی جدید در هر یک از این پنج گروه بوده است و محصولات انعقادی اغلب بر مبنای یک گروه از این مواد ساخته و به بازار عرضه میشدند. اما در سالهای اخیر، تمایل و توجه بیشتری به محصولات مبتنی بر ترکیب مواد انعقادی از چند گروه مختلف معطوف شده و کارآیی بیشتری از این محصولات ترکیبی گزارش شده است. از جمله این محصولات ترکیبی میتوان به Floseal، Surgiflo، Evarrest ، TachoSil و Vitagel اشاره کرد که در جداول 2 و 3 به ارائه جزئیاتی از مزایا و معایب آنها از نظر کاربرد بالینی و عوارض جانبی پرداخته شده است(16).
در سالهای اخیر تلاش محققان و شرکتها بر آن بوده که هر یک از محصولات انعقادی به فرمهای مختلف برای کاربردهای متنوع از جمله فرم زخم پوش برای جراحات سطحی، فرم گرانوله و سیال برای زخمهای عمقی یا جراحیهای داخلی و در قالب اپلیکاتور برای جراحیهای لاپاراسکوپیک به بازار عرضه شوند. در سالهای اخیر، نگاه ویژهای توسط شرکتها برای تولید مواد انعقادی شناخته شده در قالب فرمهای جدید و اختصاصی برای کاربردهای ویژه وجود داشته است.
از طرف دیگر با پیشرفتهای حوزه فناوری نانو در سالهای اخیر، استفاده از ظرفیتهای فناوری نانو از جمله ساخت نانو الیاف با تخلخل بالا به عنوان بستر مواد انعقادی زخم پوش موجب بهبود عملکرد زخمپوشها و دستیابی به روشهایی ارزان و در دسترس از جمله الکتروریسی برای ساخت این زخمپوشها شده است(163، 162، 16).
اخیراً در حوزه پژوهشی، ایالات متحده آمریکا در رده اول و چین در رده دوم از نظر تعداد مقالات چاپ شده در زمینه مواد منعقد کننده خون بودهاند. به طور کلی روند پژوهش و چاپ مقالات در این زمینه طی 20 سال گذشته روند صعودی داشته و پیشبینی میشود که پژوهشهای آینده بیشتر به بررسی کارآیی ترکیب چند ماه هموستاتیک، بررسی کارآیی فرمهای مختلف از یک ماده هموستاتیک و هم چنین انجام کارآزماییهای بالینی معتبر جهت تائید عملکردهای قبلی مواد هموستاتیک باشد.
نتیجهگیری
هر یک از مواد و محصولات منعقدکننده خون میتوانند با توجه به مکانیسم اثر خود فرآیند انعقاد خون و اثر بخشی خود در کنترل خونریزی در شرایطی ویژه از جمله تروماهای جنگی و غیرجنگی، جراحیها و سایر موارد اورژانس مؤثر باشند و شناخت خصوصیات هر ماده میتواند در کاربرد بالینی بهینه و کاهش عوارض جانبی مؤثر باشد. از طرفی در حوزه پژوهشی، ارائه دستهبندی جامعی از مواد هموستاتیک با تکیه بر فیزیولوژی انعقاد خون میتواند به شناخت کاملتر و دستهبندی ذهنی منظمتری از انواع مواد هموستاتیک جهت ادامه تحقیقات و پرکردن خلاهای علمی موجود، منجر شود.
تشکر و قدردانی
نویسندگان از همکاری و حمایتهای مادی و معنوی ستاد ویژه توسعه فناوری نانو کمال تقدیر و تشکر را دارند.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






