جلد 18، شماره 1 - ( بهار 1400 )
جلد 18 شماره 1 صفحات 35-27 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Vakili L, Chegini A, Samiee S, Shaiegan M. Evaluation of mitochondrial DNA during platelet storage prepared by platelet rich plasma. Sci J Iran Blood Transfus Organ 2021; 18 (1) :27-35
URL: http://bloodjournal.ir/article-1-1334-fa.html
URL: http://bloodjournal.ir/article-1-1334-fa.html
وکیلی لیلا، چگینی آزیتا، سمیعی شهرام، شایگان مژگان. تغییرات میتوکندریال DNA ، طی نگهداری فرآوردههای پلاکتی تهیه شده به روش پلاسمای غنی از پلاکت. فصلنامه پژوهشی خون. 1400; 18 (1) :27-35
مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون
متن کامل [PDF 451 kb]
(911 دریافت)
| چکیده (HTML) (2077 مشاهده)
مقدمه
پلاکت یکی از پر مصرفترین فرآوردههای انتقال خون است که علاوه بر موارد درمانی مانند استفاده برای افراد دچار ترومبوسیتوپنی، در برخی موارد نیز جهت پیشگیری از خونریزی، در درمان بیماران مبتلا به ترومبوسیتوپنی بستری در بخش مراقبتهای ویژه، تحت شیمیدرمانی و غیره کاربرد دارد(2، 1). برای حصول نتیجه مطلوب در تزریق پلاکت، کیفیت این محصول از اهمیت بهسزایی برخوردار است چرا که در این گونه افراد تزریق مکرر، میتواند مشکلات عدیدهای مانند ایمیونیزاسیون و مقاومت پلاکتی برای بیمار ایجاد کند و سبب بروز عوارض انتقال خون مانند آسیب حاد ریوی ناشی از انتقال خون (TRALI)، واکنشهای غیر همولیتیک ناشی از انتقال خون (NHTRs) و سندرم زجر تنفسی حاد(ARDS) نیز شود(6-3، 1).
پلاکتهای پستانداران فاقد هسته بوده و با توجه به عدم وجود هسته، سلامت پلاکتها تا حد زیادی توسط سلامت میتوکندری آنها تعیین میشود(7). پلاکتها منبع مهمی برای میتوکندری هستند و میتوکندریها نیز میتوانند به علت ترشح عواملی موجب تحریک پاسخهای التهابی شوند. در نتیجه میتوکندریها میتوانند در ارتباط با کیفیت محصولات خونی مطرح باشند. از عواملی که توسط میتوکندریها ترشح میشوند، میتوان به الگوهای مولکولی مرتبط با آسیب DAMPs (Damage associated molecular patterns) اشاره نمود که میتوانند در سلولها تحت شرایط استرس، القا و تولید شوند. این مولکولها علاوه بر نقشهای فیزیولوژیک در داخل سلول، زمانی که در محیط خارج سلولی قرار گیرند نقشهای متفاوتی از جمله آماده نگهداشتن بدن در مقابل خطر، تحریک پاسخ التهابی و تحریک فرآیند بازسازی بافت آسیبدیده کسب میکنند. در ضمن بعضی از سلولهایی که در معرض استرس تهدید
کننده حیات قرار میگیرند نیز قادر به ترشخ DAMPs میباشند(8). DAMPs به طور کامل شامل نوع میتوکندریایی و DNA سلولی و سیتوزولیک و پروتئینهای هستهای هستند که خارج از سلول آزاد شدهاند و به عنوان واسطههای ایمنی مرتبط با التهاب و آسیب مطرح میباشند. گلبولهای سفید و پلاکتها از منابع مهم DAMPs میتوکندریایی هستند(1). یکی از مهمترین انواع DAMPs که تاکنون مطرح شده است، میتوکندریال DNA (mtDNA ؛ mitochondrial ) است. به دلیل این که پلاکتها به میزان زیادی میتوکندری دارند، mtDNA های مشتق از پلاکت میتوانند به عنوان فاکتورهای خطرساز برای آغاز واکنشهای غیر همولیتیک ناشی از انتقال خون از جمله ARDS و TRALI محسوب شوند که از عوارض تهدید کننده حیات میباشند(8، 5، 4). بدینترتیب mtDNA که بالاترین سطح آن در کنسانترههای پلاکتی یا PCs گزارش شده است، موجب واکنشهای ناشی از انتقال خون میشود(9، 4). به علاوه mtDNA که به عنوان فعالکننده نوتروفیلهای پلیمورفونوکلئر شناخته شده است، به سلولهای اندوتلیال قابلیت نفوذ و تراوایی را القا کرده و منجر به پاسخهای التهابی در داخل بدن زنده (in vivo) نیز میشود. میزان mtDNA در PCs به طور قابل توجهی با میزان عوارض جانبی تزریق خون در ارتباط است(10). علاوه بر افزایش میزان mtDNA در فرآوردههای پلاکتی، فعالیت بیولوژیک آن نیز برای ایجاد واکنشهای بعد از انتقال خون مهم است. مجاورسازی پلاسمای جدا شده از فرآوردههای پلاکتی با نوتروفیلها و پلاکتها، یکی از راههای ارزیابی فعالیت بیولوژیک آن میباشد. غلظتهای پائینتر mtDNA ، هنگامی که با formyl-l-methionyl-l-leucyl-l-phenylalanin (fmlp) و هم چنین با آنتیبادیهای HLA همراه میشوند، قادر به فعالسازی سلولهای ایمنی ذاتی(نوتروفیلها، مونوسیتها و بازوفیلها) هستند. این نتایج بیان میکند که آنها در فرآوردههای خونی دارای عملکردی به عنوان BRMs (Biological response modifiers) پاسخ اصلاح شده بیولوژیک هستند در صورتی که در آن فرآورده، سایر محرکها از قبیل آنتیبادیهای HLA حضور داشته باشند. اما در غیاب فاکتورهای(هم افزایی) سینرژیک، جهت فعالسازی گلبولهای سفید WBC ، به غلظتهای بالایی از آنها برای وقوع NHTR پس از تزریق پلاکت نیاز داریم در نتیجه آنها به تنهایی نمیتوانند موجب القای فعالشدن در گلبولهای سفید شوند اما در همراهی با فاکتورهای سینرژیک این امکان به وجود میآید. پارتیکلهای حاوی mtDNA در پلاسما در اندازههای مختلف وجود دارد با این حال هنوز ماهیت این ذرات مشخص نیست و منشاء آن میتواند از میتوکندریهای با قطر 5/5 تا 1 میکرومتر و طول 5 تا 15 میکرومتر و یا پلاکتها(هر پلاکت شامل متوسط 4 کپی از ژنوم میتوکندریال است) و یا از قطعات سلولی باشد(11).
البته در دنیا مطالعههای انگشت شماری، به خود مولکول mtDNA به عنوان یک DAMPs در فرآوردههای خونی پرداختهاند، بدین جهت ما هم بر آن شدیم به جهت یافتن روشهای نوین در بهبود کیفی هر چه بیشتر محصولات پلاکتی و تزریق محصولات با کیفیتتر و با حداقل عوارض، برای اولین بار در ایران مطالعهای بر روی mtDNA محصولات پلاکتی انجام دهیم. هدف تحقیق حاضر، بررسی mtDNA بر روی محصول پلاکتی PRP و مقایسه میزان mtDNA در طول زمان نگهداری(روزهای 1، 3 و 5) بود.
مواد و روشها
در این مطالعه تجربی، 22 نمونه پلاکت PRP تهیه شده از اهداکنندگان مرد داوطلب، در مرکز نوآوری سازمان انتقال خون ایران پس از اخذ رضایتنامه آگاهانه جهت شرکت در مطالعه گرفته شد(کد اخلاق: IR.TMI.REC.1397.011). حجم نمونه با توجه به مقالات باکور و همکاران انتخاب شد(12). طبق مطالعه آنها، تعداد نمونهها در هر روش 15-6 عدد بود. ماده ضد انعقاده/نگهدارنده تمامی کیسهها CPDA بود. هیچ انتخابی در مورد شرکت سازنده کیسه خون، گروه خون و یا مشخصات اهداکننده وجود نداشت. کیسههای پلاکتی پس از دریافت، به مرکز تحقیقات سازمان انتقال خون ایران منتقل و به آژیتاتور پلاکتی انتقال داده شد و در دمای 22 ± 2 درجه سانتیگراد نگهداری گردید. درجه حرارت و زمان نگهداری در آژیتاتور پلاکتی روزانه چک شد و مطالعه بر روی کیسههای دارای رنگ و swirling مناسب صورت گرفت.
مطابق با استانداردهای سازمان انتقال خون، پلاکت کنسانتره از طریق سانتریفیوژ کردن خون کامل وبا حجم 70- 60 میلیلیتر در هر کیسه تهیه شد(کیسههای شرکت ماکوفارمای کشورفرانسه).
فرآوردههای تهیه شده را تا 5 روز پس از تولید، در آژیتاتور پلاکتی ذخیره کردیم. قبل از شروع نمونهگیری و انجام هر آزمایش، شماره و برچسبی خاص بر روی کیسههای پلاکت کنسانتره تهیه و چسبانیده شدند. هم چنین تاریخ تحویل و تهیه فرآورده در چک لیستهای مخصوص ثبت گردید. در واقع به هر کیسه، کد شناسه مخصوص این مطالعه اختصاص داده شد. نمونهگیری از تمامی کیسهها به صورت یکسان و در سیستم بسته صورت گرفت.
برای به دست آوردن سوپرناتانت پلاکتی، ابتدا فرآوردهها با استفاده از سانتریفیوژ یخچالدار در دمای 20 الی 24درجه سانتیگراد با دور 3000 G به مدت 5 دقیقه و در مرحله بعد محلول رویی حاصل از آن با دور 10000G به مدت 30 دقیقه سانتریفیوژ و از سوپرناتانت حاصل از آن جهت استخراج mtDNA پلاکتی استفاده نمودیم. استخراج mtDNA پلاکتی با استفاده از QIAamp DNA Mini Kit (کارخانه کیناژن ساخت کشور آلمان) صورت گرفت. تغییرات mtDNAموجود در محلول رویی یا سوپرناتانت این فرآوردهها در روزهای 1 ، 3 و 5 ذخیرهسازی توسط روش Real time PCR با روش سایبرگرین اندازهگیری شد. به عنوان ژن هدف، از آغازگر ژن COX3 و جهت کنترل داخلی از GAPDH استفاده شد.
همچنین جهت کنترل مثبت از نمونه رسوب پلاکتی تیمار شده با پراکسید هیدورژن و کنترل منفی از آب مقطر استفاده نمودیم. آزمایشها با استفاده از دستگاه روتوژن انجام شد و پس از نرمالیزاسیون و محاسبه میزان تغییرات یا fold change در روزهای ذخیرهسازی نسبت به یکدیگر با استفاده از نرمافزار 2009 REST ، با استفاده از نتایج حاصل از آن، نمودار مربوطه به کمک نرمافزار 8 prism ترسیم گردید.
پس از انجام آزمایشها به صورت دوپلیکیت از Ct هر یک از نمونهها میانگین گرفته و دادههای حاصل را در نرمافزار 2009 REST وارد و میزان fold change را در روزهای مختلف 1 و 3 و 5 محاسبه کردیم تا میزان fold change در روزهای مختلف ذخیره فرآورده به دست آمده و مقایسه شود. میزان P کمتر از 0 معنادار در نظر گرفته شد.
سپس اطلاعات موجود در چک لیست و نتایج آزمایش با روش t-test توسط نرمافزار 2009 REST آنالیز شده، نمودارهای مربوطه با استفاده از نرمافزار 8 Graphpad prism رسم گردید.
یافتهها
با توجه به آن که این مطالعه برای اولین بار در ایران صورت گرفت، در مرحله اول راهاندازی آزمایش، از آغازگر ND6 به عنوان آغازگر اصلی و همچنین از آغازگر GAPDH به عنوان کنترل داخلی در هر دوره کاری استفاده شد. بـه عنـوان کنتـرل مثبـت از نمونههـای رسوب پلاکتی، پس از سانتریفیوژ در دور g 3000 اسفاده شد. با پراکسید هیدروژن (H2O2)با رقت 3/1 که در بن ماری در دمای 50 درجه به مدت 2 ساعت جهت آزادسازی هر چه بیشتر mtDNA تیمار شده بود، استفاده شد. از آب مقطر اتوکلاو شده نیز به عنوان NTC استفاده گردید.
پیک نمودار ذوب ، هم برای نمونهها و هم برای کنترل مثبت و منفی توسط آغازگر ND6 چه قبل و چه بعد از تیمار کردن با H2O2 روی هم منطبق و از هم قابل افتراق نبود. این بدان علت است که دمای ذوب بهینه برای این آغازگر مشابه دمای ذوب نمونه NTC است. بدین جهت از آغازگر دیگری یعنی آغازگر ژن COX3 جهت ادامه این مطالعه استفاده نمودیم. جهت تعیین میزان کارآیی آغازگرها نیز از رقتهای مختلفH2O2 استفاده شد و طبق یافتههای حاصل کارایی آغازگرها جهت ادامه مطالعه صد در صد در نظر گرفته شد. در هر ران کاری مربوط به نمونههایPRP ، علاوه بر ژن COX3 ، ژن GAPDH و NTC به تفکیک استفاده شد که نمودارهای Ct(Cycle Threshold) مربوط به هر یک و نتایج مربوط به نمودارهای دمای ذوب مربوط به نمونههای PRP نمایش داده شده است (نمودارهای 1 و 2).

نمودار 1: نمودارهای Cycle Threshold مربوط به ژن COX3 ، ژن GAPDH و NTC

نمودار 2: نمودار دمای ذوب نمونههای PRP
جدول 1: نتیجه تغییرات mtDNA روز 3 به 1 در نمونههای PRP
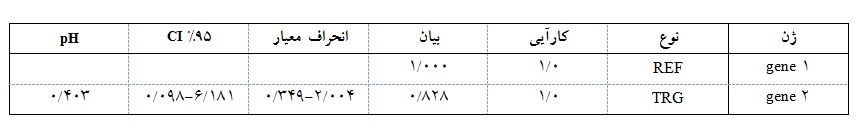
جدول 2: نتیجه تغییرات mtDNA روز 1 به 5 در نمونههای PRP

پس از انجام آزمایشها به صورت دو پلیکیت، از Ct هر یک از نمونهها میانگین گرفته و دادههای حاصل را در نرمافزار 2009 REST وارد و میزان تغییرات(fold change) را در روزهای مختلف محاسبه نمودیم که مطابق نتایج حاصل، میزان تغییرات در mtDNA مایع رویی فرآوردههای پلاکتی تهیه شده به روش PRP در روز اول افزایش داشت و به تدریج روز 3 به 1 ، 8/0 برابر، در روز 3 به 5 ، 6/0 برابر و در روز 5 به 1 ، 49/0 برابر تغییر یافته و کاهش را شاهد بودیم که این تغییرات در روزهای 3 به 1 به صورت غیر معنادار و و در روزهای 5 به 1 به صورت معنادار میباشد(003/0 p=). در تمام نمونههای PRP ، mtDNA به میزان متفاوت حضور داشت و میزان آن در روزهای مختلف با یکدیگر متفاوت بود(جداول 1 و 2).
بحث
پلاکتها میتوانند به عنوان واسطههای التهابی مداخلهکننده در تزریق خون باشند و محصولات پلاکتی که در ارتباط با عوارض ناخواسته انتقال خون هستند، حاوی میزان بیشتری mtDNA نسبت به محصولات فاقد عارضهاند(9). طبق یافتههای حاصل از مطالعه حاضر، تغییرات mtDNA در فرآوردههای پلاکتی تهیه شده به روش PRP در طـی روزهـای 1، 3 و 5 در فرآورده پلاکت
کنسانتـره(PC) بـدیـن صـورت بـود کـه در روز 1 و 3،
همچنین در روزهای 3 و 5 ، 1 و 5 کاهش میزان آن در زمان نگهداری مشاهده شد که این تغییر در روزهای 3 به 1 به صورت غیر معنادار و در روز 5 به 1 ، 5 به 3 به صورت معنادار بود. تمام نمونههای این مطالعه از اهداکنندگان سالم به دست آمد. در مطالعه دیگری میزان mtDNA را در افراد با نقص ایمنی و یا دارای التهاب یا عفونت بررسی نمودند و نتیجه گرفتند که میزان آن نسبت به افراد طبیعی، متفاوت میباشد(14، 13).
در مطالعه سیمون و همکارانش، mtDNA در فرآوردههای FFP زنان در مقایسه با سایر فرآوردههای تهیه شده از زنان و مردان، به میزان بالاتری موجود بود. آنها بیان کردند که بین جنسیت و افزایش پاسخهای التهابی ارتباط وجود دارد. mtDNA میتواند با افزایش پاسخهای التهابی مرتبط باشد(5). به همین جهت مطالعه ما تنها روی نمونههای مردان صورت گرفت تا اثر جنسیت در این مطالعه از بین رود و تنها بر روی یک نوع فرآورده پلاکت تهیه شده از مردان مقایسه صورت گیرد. آنها در این مطالعه، مایعرویی نمونههای پلاکتی از نوع PRP را پس از دو مرحله سانتریفیوژ سبک و سنگین در دورهای g3000 به مدت 5 دقیقه و دور g 10000 به مدت نیم ساعت جداسازی کردند. میتوان انتظار داشت در این نوع جداسازی هر دو نوع mtDNA آزاد و پارتیکلی در مایعرویی پلاسما وجود داشته است و اندازهگیری هر دو نوع صورت گرفته است در حالی که در مطالعه ما از روش فیلتراسیون و اولتراسانتریفیوژ استفاده نشد.
در مطالعههایی که به دنبال یافتن mtDNA هستیم، برای پیشگیری از بروز خطا، باید از اختصاصیت این امر که حتماً mtDNA اندازهگیری شده، اطمینان حاصل شود. در مطالعه ما جهت کنترل اختصاصیت از پراکسید هیدروژن برای آزادسازی mtDNA از رسوب پلاکتها و ایجاد نمونهای به عنوان کنترل مثبت استفاده کردیم. لازم به ذکر است که پس از هر بار سانتریفیوژ تعداد سلولهای موجود در مایعرویی پلاسما در نمونهها اندازهگیری شد که این میزان برابر صفر بود البته با توجه به دور بالای سانتریفـیوژ،
عملاً هیچ سلول هستهداری در نمونه باقی نخواهد ماند.
علاوه بر این در مطالعههای بیوانفورماتیک نسبت به اختصاصیت آغازگر انتخاب شده توجه کافی صورت گرفته است. لی و همکاران دریافتند mtDNA در فرآوردههای تزریقی همانند پلاکتها وجود دارد و بدین جهت ممکن است این محصولات خونی نقش مهمی را در آغاز TRALI داشته باشند. آنها mtDNA موجود در فرآوردههای مختلف را مورد ارزیابی کمی قرار دادند که در نتیجه آن توانستند mtDNA را در تمام این محصولات از جمله پلاکتها شناسایی کنند(15).
به علاوه یاسویی و همکارانش دریافتند که در محصولات خونی گزارش شده از عارضه NHTRs غلظت متوسط mtDNA در کنسانترههای پلاکتی در مقایسه با FFP و RBC بالاست، همچنین DAMPs موجود در کنسانترههای پلاکتی عامل NHTRs ، برای فعال کردن نوتروفیلها، منوسیتها و بازوفیلها به اندازه کافی، زیاد میباشد در نتیجه از نظر آنها mtDNA مشتق از پلاکت، جزو کاندیداهای ایجاد NHTRs است(1). در مطالعه دیگری نیز عنوان شد مهمترین مشخصه در مورد پلاکتهایی که در ارتباط با NHTR هستند، زمان ذخیره و نگهداری آنها نیست بلکه میزان پلاکت در هر تزریق است(16).
باکور و همکارانش بیان کردند تغییرات زیادی که در میزان mtDNA حتی با بیش از 100 fold در بین روشهای مختلف تولید فرآوردههای گلبول قرمز وجود دارد، احتمالاً میتوانند منعکسکننده میزان آسیب سلولی که در روشهای مختلف ایجاد شده است، باشد. mtDNA افزایش یافته به علت ذخیرهسازی، احتمالاً میتواند وابسته به حضور باقیمانده گلبولهای سفید و پلاکتهای باقیمانده در این واحدها باشد. علاوه بر روشهای تولید، محصولهای افزاینده، ستهای جمعآوری و فیلترهای کم لکوسیت مورد استفاده نیز میتواند روی میزان mtDNA مؤثر باشند بنابراین، پارامتر mtDNA میتواند به عنوان یک مارکر بیانکننده کیفیت محصول نیز در نظر گرفته شود. همچنین در این مطالعه روند نوسانی از افزایش و کاهش mtDNA در هر یک از انواع محصولات گلبول قرمز در روزهای 1 تا 42 ذخیرهسازی وجود داشت که این روند نامنظم و متفاوت از افزایش و کاهش در میزان mtDNA ، طی روزهای مختلف ذخیرهسازی، در هر یک از محصولات، هم به طور مجزا طی روزهای ذخیره و هم در مقایسه با بقیه محصولات از همان نوع دیده شد(12).
در مطالعه حاضر، تغییرات mtDNA در فرآوردههای پلاکتی تهیه شده به روش PRP را در طی روزهای 1، 3 و 5 در مایع رویی فرآوردههای پلاکت، بررسی کردیم و تغییرات را در روزهای ذخیرهسازی و نگهداری فرآورده مشاهده نمودیم به طوری که در روز اول افزایش و در روزهای 1 به 3 همچنین در روزهای 5 به 3 و 5 به 1 کاهش میزان mtDNA دیده شد که این تغییر در روزهای 1 به 3 به صورت غیر معنادار و در روز 5 به 1 و 5 به 3 به صورت معنادار بود.
در حالی که بودرو و همکارانش بیان نمودند که میزان mtDNA در فرآورده پلاکتی بالاست اما تغییرات آن را هنگام نگهداری بررسی نکردند(9). در چند مطالعه نشان داده شده، ذخیرهسازی طولانی مدت کنسانتره پلاکتی (طولانیتر از 4 روز)، سبب خطر بیشتر بروز عوارض جانبی در بیماران میشود(19-17).
در مطالعه دیگری که توسط کوگناس و همکارانش صورت گرفت، از فرآوردههای پلاکتی آفرزیس استفاده کردند و مشاهده نمودند که سطح mtDNA در فرآورده تزریقی به بیماران دچار عارضه(ng/L 64/52 ± 55/122) در روز 4 در مقایسه با روز 1 تا 3 افزایش و سپس کاهش یافته و به میزان روز اول میرسد(ng/L 93/8 ± 8). البته آنها در گروه پلاکتهایی که ایجاد عارضه شده بود، افزایش mtDNA را در روز سوم مشاهده نموده بودند. آنها در این مطالعه گزارش نمودند که mtDNA در روزهای اول ذخیرهسازی آزاد میشود و در هر دو گروه کنترل و بیماران تجمع یافته و سپس کاهش مییابد تا به حد غیر قابل اندازهگیری میرسد. اما در بیماران دچار عارضه میزان mtDNA در روز چهارم افزایش یافته و سپس کاهش پیدا میکند تا به میزان اولیه آن میرسد(20). در این مطالعه نیز آزادسازی و افزایش mtDNA را در روز اول و بعد کاهش آن را در روزهای ذخیرهسازی کیسههای پلاکتی مشاهده نمودیم. گرچه مطالعه کوگناس بر روی کیسههای آفرزیس صورت گرفته بود که عنوان شده شاید فرآیند آفرزیس سبب آزادسازی mtDNA گردیده است. البته با توجه به آن که بررسی آنها در دو گروه بیماران و کنترل بود، میزان IL-13, sCD40L را نیز اندازهگیری نمودند و متوجه ارتباط بین mtDNA و BRMs (پاسخ اصلاح شده بیولوژیک) شدند(20).
در مطالعه ما نیز نه تنها وجود mtDNA بلکه تغییرات آن در طی زمان، مورد بررسی قرار گرفت. با توجه به آن که اکثر مطالعهها بر روی بیماران و نتیجه تزریق فرآوردههای خون و عوارضی همانند TRALI و NHTR بوده، میتوان گفت که یکی از محدودیتهای مطالعه ما شاید عدم بررسی فرآوردههای تزریقی در بیماران دچار عارضه بوده است. اگر چه در ابتدا با توجه به محدودیتهای موجود هدف تنها بررسی mtDNA در فرآورده پلاکت بود.
نتیجهگیری
میزان mtDNA در روز اول افزایش و طی روزهای نگهداری فرآوردههای PRP تغییر یافت و در روزهای مختلف 1، 3 و 5 این تغییرات به صورت کاهشی مشاهده گردید ولی در کل میتوان گفت در حال حاضر مکانیسم مشخصی برای افزایش یا کاهش در میزان mtDNA در محصولات خونی مطرح نشده است و به مطالعههای بیشتری در این باره نیاز است. این مطالعه اولین مطالعه راجع به mtDNA در محصولات خونی است که در ایران انجام شده است و با توجه به اهمیت این موضوع، نیاز به مطالعههای بیشتر روی سایر فرآورده ها و همچنین روی محصولاتی که تزریق آنها با واکنشهای انتقال خونی همراه بوده، میباشد.
تشکر و قدردانی
این مقاله حاصل پایاننامه دانشجویی دوره کارشناسی ارشـد رشتـه خونشناسـی مـــرکز تحقیقات مؤسسه عالـی
آموزشی و پژوهشی طب انتقال خون با کد اخلاق(IR.TMI.REC.1397.011) میباشد. بودجه این مطالعه توسط مؤسسه آموزشی و پژوهشی طب انتقال خون تأمین گردیده و تهیه فرآورده توسط بخش نوآوری سازمان و همه مراحل عملی پروژه در مرکز تحقیقات سازمان انتقال خون انجام شده است.
متن کامل: (1640 مشاهده)
تغییرات میتوکندریال DNA ، طی نگهداری فرآوردههای پلاکتی
تهیه شده به روش پلاسمای غنی از پلاکت
لیلا وکیلی1، آزیتا چگینی2، شهرام سمیعی3، مژگان شایگان4
چکیده
سابقه و هدف
فعال شدن پلاکت، به دلایل متعدد از لحظه نمونهگیری تا قبل از تزریق فرآورده رخ میدهد. پلاکتهای فعال شده، میتوکندریهای فعال را به سمت غشا تغییر مکان داده، آنها از غشاء جوانه زده و میتوانند به صورت آزاد ریزش کرده و منجر به آزادشدن واسطههای پیش التهابی و میتوکندریال DNA گردند. بدین جهت، میزان میتوکندریال DNA را به عنوان یکی از پارامترهای فعالیت پلاکتی در نظرگرفتهاند. هدف از این مطالعه، مقایسه میزان میتوکندریال DNA در طول زمان نگهداری بود.
مواد و روشها
در این مطالعه تجربی، 22 فرآورده پلاکتی PRP ، پس از اخذ رضایتنامه از اهداکنندگان مرد مراجعهکننده به مرکز نوآوری سازمان انتقال خون ایران به دست آمد. از این کیسهها در روزهای 1، 3 و 5 نمونهگیری شد تا میزان تغییرات میتوکندریالDNA در این فرآوردهها توسط روش Real time PCR بررسی شود. نتایج با آزمون آماری paired t-test تجزیه و تحلیل شده ومیزان p کمتر از 05/0 معنادار در نظرگرفته شد.
یافتهها
میزان میتوکندریالDNA در روز اول افزایش و به تدریج روز 3 به 1، 8/0 برابر و در روز 5 به 3 ، 6/0 برابر و در روز 5 به 1 ، 49/0 برابر تغییر یافته و کاهش را نشان داد. این تغییرات در روزهای 3 به 1 به صورت غیر معنادار و در روزهای 5 به 1 به صورت معنادار بود(003/0 P=).
نتیجه گیری
میزان میتوکندریال DNA در فرآوردههای تولید شده به روش PRP ، در روز اول افزایش و طی روزهای ذخیرهسازی تغییر کرده وکاهش یافت.
کلمات کلیدی: Real-Time Polymerase Chain Reaction ، DNA ، میتوکندری، پلاسمای غنی از پلاکت
تاریخ دریافت: 13/3 /99
تاریخ پذیرش: 21/11/99
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: متخصص بیهوشی ـ استادیار مرکز تحقیقات انقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- کارشناس ارشد بیوشیمی بالینی ـ مربی مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- دکترای ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
تهیه شده به روش پلاسمای غنی از پلاکت
لیلا وکیلی1، آزیتا چگینی2، شهرام سمیعی3، مژگان شایگان4
چکیده
سابقه و هدف
فعال شدن پلاکت، به دلایل متعدد از لحظه نمونهگیری تا قبل از تزریق فرآورده رخ میدهد. پلاکتهای فعال شده، میتوکندریهای فعال را به سمت غشا تغییر مکان داده، آنها از غشاء جوانه زده و میتوانند به صورت آزاد ریزش کرده و منجر به آزادشدن واسطههای پیش التهابی و میتوکندریال DNA گردند. بدین جهت، میزان میتوکندریال DNA را به عنوان یکی از پارامترهای فعالیت پلاکتی در نظرگرفتهاند. هدف از این مطالعه، مقایسه میزان میتوکندریال DNA در طول زمان نگهداری بود.
مواد و روشها
در این مطالعه تجربی، 22 فرآورده پلاکتی PRP ، پس از اخذ رضایتنامه از اهداکنندگان مرد مراجعهکننده به مرکز نوآوری سازمان انتقال خون ایران به دست آمد. از این کیسهها در روزهای 1، 3 و 5 نمونهگیری شد تا میزان تغییرات میتوکندریالDNA در این فرآوردهها توسط روش Real time PCR بررسی شود. نتایج با آزمون آماری paired t-test تجزیه و تحلیل شده ومیزان p کمتر از 05/0 معنادار در نظرگرفته شد.
یافتهها
میزان میتوکندریالDNA در روز اول افزایش و به تدریج روز 3 به 1، 8/0 برابر و در روز 5 به 3 ، 6/0 برابر و در روز 5 به 1 ، 49/0 برابر تغییر یافته و کاهش را نشان داد. این تغییرات در روزهای 3 به 1 به صورت غیر معنادار و در روزهای 5 به 1 به صورت معنادار بود(003/0 P=).
نتیجه گیری
میزان میتوکندریال DNA در فرآوردههای تولید شده به روش PRP ، در روز اول افزایش و طی روزهای ذخیرهسازی تغییر کرده وکاهش یافت.
کلمات کلیدی: Real-Time Polymerase Chain Reaction ، DNA ، میتوکندری، پلاسمای غنی از پلاکت
تاریخ دریافت: 13/3 /99
تاریخ پذیرش: 21/11/99
1- دانشجوی کارشناسی ارشد هماتولوژی و بانک خون ـ مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
2- مؤلف مسئول: متخصص بیهوشی ـ استادیار مرکز تحقیقات انقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران ـ صندوق پستی: 1157-14665
3- کارشناس ارشد بیوشیمی بالینی ـ مربی مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
4- دکترای ایمونولوژی ـ دانشیار مرکز تحقیقات انتقال خون ـ مؤسسه عالی آموزشی و پژوهشی طب انتقال خون ـ تهران ـ ایران
مقدمه
پلاکت یکی از پر مصرفترین فرآوردههای انتقال خون است که علاوه بر موارد درمانی مانند استفاده برای افراد دچار ترومبوسیتوپنی، در برخی موارد نیز جهت پیشگیری از خونریزی، در درمان بیماران مبتلا به ترومبوسیتوپنی بستری در بخش مراقبتهای ویژه، تحت شیمیدرمانی و غیره کاربرد دارد(2، 1). برای حصول نتیجه مطلوب در تزریق پلاکت، کیفیت این محصول از اهمیت بهسزایی برخوردار است چرا که در این گونه افراد تزریق مکرر، میتواند مشکلات عدیدهای مانند ایمیونیزاسیون و مقاومت پلاکتی برای بیمار ایجاد کند و سبب بروز عوارض انتقال خون مانند آسیب حاد ریوی ناشی از انتقال خون (TRALI)، واکنشهای غیر همولیتیک ناشی از انتقال خون (NHTRs) و سندرم زجر تنفسی حاد(ARDS) نیز شود(6-3، 1).
پلاکتهای پستانداران فاقد هسته بوده و با توجه به عدم وجود هسته، سلامت پلاکتها تا حد زیادی توسط سلامت میتوکندری آنها تعیین میشود(7). پلاکتها منبع مهمی برای میتوکندری هستند و میتوکندریها نیز میتوانند به علت ترشح عواملی موجب تحریک پاسخهای التهابی شوند. در نتیجه میتوکندریها میتوانند در ارتباط با کیفیت محصولات خونی مطرح باشند. از عواملی که توسط میتوکندریها ترشح میشوند، میتوان به الگوهای مولکولی مرتبط با آسیب DAMPs (Damage associated molecular patterns) اشاره نمود که میتوانند در سلولها تحت شرایط استرس، القا و تولید شوند. این مولکولها علاوه بر نقشهای فیزیولوژیک در داخل سلول، زمانی که در محیط خارج سلولی قرار گیرند نقشهای متفاوتی از جمله آماده نگهداشتن بدن در مقابل خطر، تحریک پاسخ التهابی و تحریک فرآیند بازسازی بافت آسیبدیده کسب میکنند. در ضمن بعضی از سلولهایی که در معرض استرس تهدید
کننده حیات قرار میگیرند نیز قادر به ترشخ DAMPs میباشند(8). DAMPs به طور کامل شامل نوع میتوکندریایی و DNA سلولی و سیتوزولیک و پروتئینهای هستهای هستند که خارج از سلول آزاد شدهاند و به عنوان واسطههای ایمنی مرتبط با التهاب و آسیب مطرح میباشند. گلبولهای سفید و پلاکتها از منابع مهم DAMPs میتوکندریایی هستند(1). یکی از مهمترین انواع DAMPs که تاکنون مطرح شده است، میتوکندریال DNA (mtDNA ؛ mitochondrial ) است. به دلیل این که پلاکتها به میزان زیادی میتوکندری دارند، mtDNA های مشتق از پلاکت میتوانند به عنوان فاکتورهای خطرساز برای آغاز واکنشهای غیر همولیتیک ناشی از انتقال خون از جمله ARDS و TRALI محسوب شوند که از عوارض تهدید کننده حیات میباشند(8، 5، 4). بدینترتیب mtDNA که بالاترین سطح آن در کنسانترههای پلاکتی یا PCs گزارش شده است، موجب واکنشهای ناشی از انتقال خون میشود(9، 4). به علاوه mtDNA که به عنوان فعالکننده نوتروفیلهای پلیمورفونوکلئر شناخته شده است، به سلولهای اندوتلیال قابلیت نفوذ و تراوایی را القا کرده و منجر به پاسخهای التهابی در داخل بدن زنده (in vivo) نیز میشود. میزان mtDNA در PCs به طور قابل توجهی با میزان عوارض جانبی تزریق خون در ارتباط است(10). علاوه بر افزایش میزان mtDNA در فرآوردههای پلاکتی، فعالیت بیولوژیک آن نیز برای ایجاد واکنشهای بعد از انتقال خون مهم است. مجاورسازی پلاسمای جدا شده از فرآوردههای پلاکتی با نوتروفیلها و پلاکتها، یکی از راههای ارزیابی فعالیت بیولوژیک آن میباشد. غلظتهای پائینتر mtDNA ، هنگامی که با formyl-l-methionyl-l-leucyl-l-phenylalanin (fmlp) و هم چنین با آنتیبادیهای HLA همراه میشوند، قادر به فعالسازی سلولهای ایمنی ذاتی(نوتروفیلها، مونوسیتها و بازوفیلها) هستند. این نتایج بیان میکند که آنها در فرآوردههای خونی دارای عملکردی به عنوان BRMs (Biological response modifiers) پاسخ اصلاح شده بیولوژیک هستند در صورتی که در آن فرآورده، سایر محرکها از قبیل آنتیبادیهای HLA حضور داشته باشند. اما در غیاب فاکتورهای(هم افزایی) سینرژیک، جهت فعالسازی گلبولهای سفید WBC ، به غلظتهای بالایی از آنها برای وقوع NHTR پس از تزریق پلاکت نیاز داریم در نتیجه آنها به تنهایی نمیتوانند موجب القای فعالشدن در گلبولهای سفید شوند اما در همراهی با فاکتورهای سینرژیک این امکان به وجود میآید. پارتیکلهای حاوی mtDNA در پلاسما در اندازههای مختلف وجود دارد با این حال هنوز ماهیت این ذرات مشخص نیست و منشاء آن میتواند از میتوکندریهای با قطر 5/5 تا 1 میکرومتر و طول 5 تا 15 میکرومتر و یا پلاکتها(هر پلاکت شامل متوسط 4 کپی از ژنوم میتوکندریال است) و یا از قطعات سلولی باشد(11).
البته در دنیا مطالعههای انگشت شماری، به خود مولکول mtDNA به عنوان یک DAMPs در فرآوردههای خونی پرداختهاند، بدین جهت ما هم بر آن شدیم به جهت یافتن روشهای نوین در بهبود کیفی هر چه بیشتر محصولات پلاکتی و تزریق محصولات با کیفیتتر و با حداقل عوارض، برای اولین بار در ایران مطالعهای بر روی mtDNA محصولات پلاکتی انجام دهیم. هدف تحقیق حاضر، بررسی mtDNA بر روی محصول پلاکتی PRP و مقایسه میزان mtDNA در طول زمان نگهداری(روزهای 1، 3 و 5) بود.
مواد و روشها
در این مطالعه تجربی، 22 نمونه پلاکت PRP تهیه شده از اهداکنندگان مرد داوطلب، در مرکز نوآوری سازمان انتقال خون ایران پس از اخذ رضایتنامه آگاهانه جهت شرکت در مطالعه گرفته شد(کد اخلاق: IR.TMI.REC.1397.011). حجم نمونه با توجه به مقالات باکور و همکاران انتخاب شد(12). طبق مطالعه آنها، تعداد نمونهها در هر روش 15-6 عدد بود. ماده ضد انعقاده/نگهدارنده تمامی کیسهها CPDA بود. هیچ انتخابی در مورد شرکت سازنده کیسه خون، گروه خون و یا مشخصات اهداکننده وجود نداشت. کیسههای پلاکتی پس از دریافت، به مرکز تحقیقات سازمان انتقال خون ایران منتقل و به آژیتاتور پلاکتی انتقال داده شد و در دمای 22 ± 2 درجه سانتیگراد نگهداری گردید. درجه حرارت و زمان نگهداری در آژیتاتور پلاکتی روزانه چک شد و مطالعه بر روی کیسههای دارای رنگ و swirling مناسب صورت گرفت.
مطابق با استانداردهای سازمان انتقال خون، پلاکت کنسانتره از طریق سانتریفیوژ کردن خون کامل وبا حجم 70- 60 میلیلیتر در هر کیسه تهیه شد(کیسههای شرکت ماکوفارمای کشورفرانسه).
فرآوردههای تهیه شده را تا 5 روز پس از تولید، در آژیتاتور پلاکتی ذخیره کردیم. قبل از شروع نمونهگیری و انجام هر آزمایش، شماره و برچسبی خاص بر روی کیسههای پلاکت کنسانتره تهیه و چسبانیده شدند. هم چنین تاریخ تحویل و تهیه فرآورده در چک لیستهای مخصوص ثبت گردید. در واقع به هر کیسه، کد شناسه مخصوص این مطالعه اختصاص داده شد. نمونهگیری از تمامی کیسهها به صورت یکسان و در سیستم بسته صورت گرفت.
برای به دست آوردن سوپرناتانت پلاکتی، ابتدا فرآوردهها با استفاده از سانتریفیوژ یخچالدار در دمای 20 الی 24درجه سانتیگراد با دور 3000 G به مدت 5 دقیقه و در مرحله بعد محلول رویی حاصل از آن با دور 10000G به مدت 30 دقیقه سانتریفیوژ و از سوپرناتانت حاصل از آن جهت استخراج mtDNA پلاکتی استفاده نمودیم. استخراج mtDNA پلاکتی با استفاده از QIAamp DNA Mini Kit (کارخانه کیناژن ساخت کشور آلمان) صورت گرفت. تغییرات mtDNAموجود در محلول رویی یا سوپرناتانت این فرآوردهها در روزهای 1 ، 3 و 5 ذخیرهسازی توسط روش Real time PCR با روش سایبرگرین اندازهگیری شد. به عنوان ژن هدف، از آغازگر ژن COX3 و جهت کنترل داخلی از GAPDH استفاده شد.
همچنین جهت کنترل مثبت از نمونه رسوب پلاکتی تیمار شده با پراکسید هیدورژن و کنترل منفی از آب مقطر استفاده نمودیم. آزمایشها با استفاده از دستگاه روتوژن انجام شد و پس از نرمالیزاسیون و محاسبه میزان تغییرات یا fold change در روزهای ذخیرهسازی نسبت به یکدیگر با استفاده از نرمافزار 2009 REST ، با استفاده از نتایج حاصل از آن، نمودار مربوطه به کمک نرمافزار 8 prism ترسیم گردید.
پس از انجام آزمایشها به صورت دوپلیکیت از Ct هر یک از نمونهها میانگین گرفته و دادههای حاصل را در نرمافزار 2009 REST وارد و میزان fold change را در روزهای مختلف 1 و 3 و 5 محاسبه کردیم تا میزان fold change در روزهای مختلف ذخیره فرآورده به دست آمده و مقایسه شود. میزان P کمتر از 0 معنادار در نظر گرفته شد.
سپس اطلاعات موجود در چک لیست و نتایج آزمایش با روش t-test توسط نرمافزار 2009 REST آنالیز شده، نمودارهای مربوطه با استفاده از نرمافزار 8 Graphpad prism رسم گردید.
یافتهها
با توجه به آن که این مطالعه برای اولین بار در ایران صورت گرفت، در مرحله اول راهاندازی آزمایش، از آغازگر ND6 به عنوان آغازگر اصلی و همچنین از آغازگر GAPDH به عنوان کنترل داخلی در هر دوره کاری استفاده شد. بـه عنـوان کنتـرل مثبـت از نمونههـای رسوب پلاکتی، پس از سانتریفیوژ در دور g 3000 اسفاده شد. با پراکسید هیدروژن (H2O2)با رقت 3/1 که در بن ماری در دمای 50 درجه به مدت 2 ساعت جهت آزادسازی هر چه بیشتر mtDNA تیمار شده بود، استفاده شد. از آب مقطر اتوکلاو شده نیز به عنوان NTC استفاده گردید.
پیک نمودار ذوب ، هم برای نمونهها و هم برای کنترل مثبت و منفی توسط آغازگر ND6 چه قبل و چه بعد از تیمار کردن با H2O2 روی هم منطبق و از هم قابل افتراق نبود. این بدان علت است که دمای ذوب بهینه برای این آغازگر مشابه دمای ذوب نمونه NTC است. بدین جهت از آغازگر دیگری یعنی آغازگر ژن COX3 جهت ادامه این مطالعه استفاده نمودیم. جهت تعیین میزان کارآیی آغازگرها نیز از رقتهای مختلفH2O2 استفاده شد و طبق یافتههای حاصل کارایی آغازگرها جهت ادامه مطالعه صد در صد در نظر گرفته شد. در هر ران کاری مربوط به نمونههایPRP ، علاوه بر ژن COX3 ، ژن GAPDH و NTC به تفکیک استفاده شد که نمودارهای Ct(Cycle Threshold) مربوط به هر یک و نتایج مربوط به نمودارهای دمای ذوب مربوط به نمونههای PRP نمایش داده شده است (نمودارهای 1 و 2).

نمودار 1: نمودارهای Cycle Threshold مربوط به ژن COX3 ، ژن GAPDH و NTC

نمودار 2: نمودار دمای ذوب نمونههای PRP
جدول 1: نتیجه تغییرات mtDNA روز 3 به 1 در نمونههای PRP

جدول 2: نتیجه تغییرات mtDNA روز 1 به 5 در نمونههای PRP

پس از انجام آزمایشها به صورت دو پلیکیت، از Ct هر یک از نمونهها میانگین گرفته و دادههای حاصل را در نرمافزار 2009 REST وارد و میزان تغییرات(fold change) را در روزهای مختلف محاسبه نمودیم که مطابق نتایج حاصل، میزان تغییرات در mtDNA مایع رویی فرآوردههای پلاکتی تهیه شده به روش PRP در روز اول افزایش داشت و به تدریج روز 3 به 1 ، 8/0 برابر، در روز 3 به 5 ، 6/0 برابر و در روز 5 به 1 ، 49/0 برابر تغییر یافته و کاهش را شاهد بودیم که این تغییرات در روزهای 3 به 1 به صورت غیر معنادار و و در روزهای 5 به 1 به صورت معنادار میباشد(003/0 p=). در تمام نمونههای PRP ، mtDNA به میزان متفاوت حضور داشت و میزان آن در روزهای مختلف با یکدیگر متفاوت بود(جداول 1 و 2).
بحث
پلاکتها میتوانند به عنوان واسطههای التهابی مداخلهکننده در تزریق خون باشند و محصولات پلاکتی که در ارتباط با عوارض ناخواسته انتقال خون هستند، حاوی میزان بیشتری mtDNA نسبت به محصولات فاقد عارضهاند(9). طبق یافتههای حاصل از مطالعه حاضر، تغییرات mtDNA در فرآوردههای پلاکتی تهیه شده به روش PRP در طـی روزهـای 1، 3 و 5 در فرآورده پلاکت
کنسانتـره(PC) بـدیـن صـورت بـود کـه در روز 1 و 3،
همچنین در روزهای 3 و 5 ، 1 و 5 کاهش میزان آن در زمان نگهداری مشاهده شد که این تغییر در روزهای 3 به 1 به صورت غیر معنادار و در روز 5 به 1 ، 5 به 3 به صورت معنادار بود. تمام نمونههای این مطالعه از اهداکنندگان سالم به دست آمد. در مطالعه دیگری میزان mtDNA را در افراد با نقص ایمنی و یا دارای التهاب یا عفونت بررسی نمودند و نتیجه گرفتند که میزان آن نسبت به افراد طبیعی، متفاوت میباشد(14، 13).
در مطالعه سیمون و همکارانش، mtDNA در فرآوردههای FFP زنان در مقایسه با سایر فرآوردههای تهیه شده از زنان و مردان، به میزان بالاتری موجود بود. آنها بیان کردند که بین جنسیت و افزایش پاسخهای التهابی ارتباط وجود دارد. mtDNA میتواند با افزایش پاسخهای التهابی مرتبط باشد(5). به همین جهت مطالعه ما تنها روی نمونههای مردان صورت گرفت تا اثر جنسیت در این مطالعه از بین رود و تنها بر روی یک نوع فرآورده پلاکت تهیه شده از مردان مقایسه صورت گیرد. آنها در این مطالعه، مایعرویی نمونههای پلاکتی از نوع PRP را پس از دو مرحله سانتریفیوژ سبک و سنگین در دورهای g3000 به مدت 5 دقیقه و دور g 10000 به مدت نیم ساعت جداسازی کردند. میتوان انتظار داشت در این نوع جداسازی هر دو نوع mtDNA آزاد و پارتیکلی در مایعرویی پلاسما وجود داشته است و اندازهگیری هر دو نوع صورت گرفته است در حالی که در مطالعه ما از روش فیلتراسیون و اولتراسانتریفیوژ استفاده نشد.
در مطالعههایی که به دنبال یافتن mtDNA هستیم، برای پیشگیری از بروز خطا، باید از اختصاصیت این امر که حتماً mtDNA اندازهگیری شده، اطمینان حاصل شود. در مطالعه ما جهت کنترل اختصاصیت از پراکسید هیدروژن برای آزادسازی mtDNA از رسوب پلاکتها و ایجاد نمونهای به عنوان کنترل مثبت استفاده کردیم. لازم به ذکر است که پس از هر بار سانتریفیوژ تعداد سلولهای موجود در مایعرویی پلاسما در نمونهها اندازهگیری شد که این میزان برابر صفر بود البته با توجه به دور بالای سانتریفـیوژ،
عملاً هیچ سلول هستهداری در نمونه باقی نخواهد ماند.
علاوه بر این در مطالعههای بیوانفورماتیک نسبت به اختصاصیت آغازگر انتخاب شده توجه کافی صورت گرفته است. لی و همکاران دریافتند mtDNA در فرآوردههای تزریقی همانند پلاکتها وجود دارد و بدین جهت ممکن است این محصولات خونی نقش مهمی را در آغاز TRALI داشته باشند. آنها mtDNA موجود در فرآوردههای مختلف را مورد ارزیابی کمی قرار دادند که در نتیجه آن توانستند mtDNA را در تمام این محصولات از جمله پلاکتها شناسایی کنند(15).
به علاوه یاسویی و همکارانش دریافتند که در محصولات خونی گزارش شده از عارضه NHTRs غلظت متوسط mtDNA در کنسانترههای پلاکتی در مقایسه با FFP و RBC بالاست، همچنین DAMPs موجود در کنسانترههای پلاکتی عامل NHTRs ، برای فعال کردن نوتروفیلها، منوسیتها و بازوفیلها به اندازه کافی، زیاد میباشد در نتیجه از نظر آنها mtDNA مشتق از پلاکت، جزو کاندیداهای ایجاد NHTRs است(1). در مطالعه دیگری نیز عنوان شد مهمترین مشخصه در مورد پلاکتهایی که در ارتباط با NHTR هستند، زمان ذخیره و نگهداری آنها نیست بلکه میزان پلاکت در هر تزریق است(16).
باکور و همکارانش بیان کردند تغییرات زیادی که در میزان mtDNA حتی با بیش از 100 fold در بین روشهای مختلف تولید فرآوردههای گلبول قرمز وجود دارد، احتمالاً میتوانند منعکسکننده میزان آسیب سلولی که در روشهای مختلف ایجاد شده است، باشد. mtDNA افزایش یافته به علت ذخیرهسازی، احتمالاً میتواند وابسته به حضور باقیمانده گلبولهای سفید و پلاکتهای باقیمانده در این واحدها باشد. علاوه بر روشهای تولید، محصولهای افزاینده، ستهای جمعآوری و فیلترهای کم لکوسیت مورد استفاده نیز میتواند روی میزان mtDNA مؤثر باشند بنابراین، پارامتر mtDNA میتواند به عنوان یک مارکر بیانکننده کیفیت محصول نیز در نظر گرفته شود. همچنین در این مطالعه روند نوسانی از افزایش و کاهش mtDNA در هر یک از انواع محصولات گلبول قرمز در روزهای 1 تا 42 ذخیرهسازی وجود داشت که این روند نامنظم و متفاوت از افزایش و کاهش در میزان mtDNA ، طی روزهای مختلف ذخیرهسازی، در هر یک از محصولات، هم به طور مجزا طی روزهای ذخیره و هم در مقایسه با بقیه محصولات از همان نوع دیده شد(12).
در مطالعه حاضر، تغییرات mtDNA در فرآوردههای پلاکتی تهیه شده به روش PRP را در طی روزهای 1، 3 و 5 در مایع رویی فرآوردههای پلاکت، بررسی کردیم و تغییرات را در روزهای ذخیرهسازی و نگهداری فرآورده مشاهده نمودیم به طوری که در روز اول افزایش و در روزهای 1 به 3 همچنین در روزهای 5 به 3 و 5 به 1 کاهش میزان mtDNA دیده شد که این تغییر در روزهای 1 به 3 به صورت غیر معنادار و در روز 5 به 1 و 5 به 3 به صورت معنادار بود.
در حالی که بودرو و همکارانش بیان نمودند که میزان mtDNA در فرآورده پلاکتی بالاست اما تغییرات آن را هنگام نگهداری بررسی نکردند(9). در چند مطالعه نشان داده شده، ذخیرهسازی طولانی مدت کنسانتره پلاکتی (طولانیتر از 4 روز)، سبب خطر بیشتر بروز عوارض جانبی در بیماران میشود(19-17).
در مطالعه دیگری که توسط کوگناس و همکارانش صورت گرفت، از فرآوردههای پلاکتی آفرزیس استفاده کردند و مشاهده نمودند که سطح mtDNA در فرآورده تزریقی به بیماران دچار عارضه(ng/L 64/52 ± 55/122) در روز 4 در مقایسه با روز 1 تا 3 افزایش و سپس کاهش یافته و به میزان روز اول میرسد(ng/L 93/8 ± 8). البته آنها در گروه پلاکتهایی که ایجاد عارضه شده بود، افزایش mtDNA را در روز سوم مشاهده نموده بودند. آنها در این مطالعه گزارش نمودند که mtDNA در روزهای اول ذخیرهسازی آزاد میشود و در هر دو گروه کنترل و بیماران تجمع یافته و سپس کاهش مییابد تا به حد غیر قابل اندازهگیری میرسد. اما در بیماران دچار عارضه میزان mtDNA در روز چهارم افزایش یافته و سپس کاهش پیدا میکند تا به میزان اولیه آن میرسد(20). در این مطالعه نیز آزادسازی و افزایش mtDNA را در روز اول و بعد کاهش آن را در روزهای ذخیرهسازی کیسههای پلاکتی مشاهده نمودیم. گرچه مطالعه کوگناس بر روی کیسههای آفرزیس صورت گرفته بود که عنوان شده شاید فرآیند آفرزیس سبب آزادسازی mtDNA گردیده است. البته با توجه به آن که بررسی آنها در دو گروه بیماران و کنترل بود، میزان IL-13, sCD40L را نیز اندازهگیری نمودند و متوجه ارتباط بین mtDNA و BRMs (پاسخ اصلاح شده بیولوژیک) شدند(20).
در مطالعه ما نیز نه تنها وجود mtDNA بلکه تغییرات آن در طی زمان، مورد بررسی قرار گرفت. با توجه به آن که اکثر مطالعهها بر روی بیماران و نتیجه تزریق فرآوردههای خون و عوارضی همانند TRALI و NHTR بوده، میتوان گفت که یکی از محدودیتهای مطالعه ما شاید عدم بررسی فرآوردههای تزریقی در بیماران دچار عارضه بوده است. اگر چه در ابتدا با توجه به محدودیتهای موجود هدف تنها بررسی mtDNA در فرآورده پلاکت بود.
نتیجهگیری
میزان mtDNA در روز اول افزایش و طی روزهای نگهداری فرآوردههای PRP تغییر یافت و در روزهای مختلف 1، 3 و 5 این تغییرات به صورت کاهشی مشاهده گردید ولی در کل میتوان گفت در حال حاضر مکانیسم مشخصی برای افزایش یا کاهش در میزان mtDNA در محصولات خونی مطرح نشده است و به مطالعههای بیشتری در این باره نیاز است. این مطالعه اولین مطالعه راجع به mtDNA در محصولات خونی است که در ایران انجام شده است و با توجه به اهمیت این موضوع، نیاز به مطالعههای بیشتر روی سایر فرآورده ها و همچنین روی محصولاتی که تزریق آنها با واکنشهای انتقال خونی همراه بوده، میباشد.
تشکر و قدردانی
این مقاله حاصل پایاننامه دانشجویی دوره کارشناسی ارشـد رشتـه خونشناسـی مـــرکز تحقیقات مؤسسه عالـی
آموزشی و پژوهشی طب انتقال خون با کد اخلاق(IR.TMI.REC.1397.011) میباشد. بودجه این مطالعه توسط مؤسسه آموزشی و پژوهشی طب انتقال خون تأمین گردیده و تهیه فرآورده توسط بخش نوآوری سازمان و همه مراحل عملی پروژه در مرکز تحقیقات سازمان انتقال خون انجام شده است.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |






